Изобретение относится к интегральному анализу биологических тканей и выделений организма человека с использованием метода хромато-масс-спектрометрии (ГХ/МС). Способ может быть использован в медицине, биологии, экспертно-криминалистической, судебной и оперативно-розыскной деятельности при установлении факта наличия спиртов в биологических тканях и выделениях человека, наличия и степени алкогольного опьянения проверяемых лиц, установлении фактических данных об отравлении фальсифицированным алкоголем и т.п.
В качестве исследуемых образцов биологических тканей и выделений организма человека могут использоваться следующие объекты: водные экстракты выдыхаемого воздуха, кровь, слюна, моча, водные экстракты дезинтегрированных органов и тканей.
Известен метод выявления неизвестных веществ в биологических жидкостях пациентов, принимавших наркотические или психотропные вещества, заключающийся в том, что готовят три пробы исследуемого образца биологической жидкости: первую - путем экстракции с перерастворением, вторую - путем кислотного гидролиза и третью - путем ферментативного гидролиза. Причем, первую пробу подвергают ГХ/МС анализу в режиме градиента температуры 15°С/мин и данные анализируют путем сравнения с базой данных, по которой выявляют признаки неизвестного вещества (НВ), а именно - спектры с m/z, совпадающими с базовыми ионами наркотического, или психотропного вещества, или метаболитов, и содержание (НВ) в пробе. Вторую пробу подвергают ГХ/МС анализу в режиме градиента температуры 25°С/мин и третью пробу подвергают ГХ/МС анализу в режиме градиента температуры 15°С/мин. При увеличении содержания НВ в последних двух пробах по сравнению с первой подвергают ГХ/МС анализу, также в режиме градиента температуры 15°С/мин, базовое наркотическое или психотропное вещество на присутствие в нем НВ и при его отсутствии в базовом веществе проверяют присутствие НВ в интактной биологической жидкости, для чего пробу ее готовят путем кислотного гидролиза и подвергают ГХ/МС анализу в режимах градиента температуры 15°С/мин и 25°С/мин. В случае обнаружения НВ в интактной биологической жидкости его квалифицируют как эндогенное, а при отсутствии признаков аликвоту первой пробы смешивают с пробой интактной биологической жидкости. При этом готовят пробу путем кислотного гидролиза смеси, подвергают пробу ГХ/МС анализу в режимах градиента температуры 15°С/мин и 25°С/мин. Далее определяют содержание НВ по результатам обоих режимов анализа и сравнивают его с содержанием НВ в первой пробе. При совпадающих значениях содержания НВ в указанных трех пробах квалифицируют НВ как новый, ранее неизвестный продукт метаболизма базового наркотического или психотропного вещества - патент RU 2419788, G01N 30/02, 2009 г.
Исследование, проводимое известным методом, является сложным и трудоемким. Кроме того, метод является разрушающим, то есть после проведенного анализа объект не может быть использован для каких-либо иных дополнительных исследований, например ДНК, одорологических, запаховых исследований и др.
Прототипом изобретения является нитритный метод определения спиртов, заключающийся в превращении спиртов в более летучие, чем исходные спирты, алкилнитриты путем взаимодействия их с нитритом натрия в среде трихлоруксусной кислоты, и в дальнейшем - хроматографировании алкилнитритов. Разделенные на хроматографической колонке компоненты смеси последовательно поступают в детектор по теплопроводности - катарометр, сигналы которого регистрируются в виде ряда хроматографических пиков на хроматограмме. Идентификация веществ производится по времени их удержания, которое исчисляется от момента введения анализируемого вещества в колонку до появления максимума пика. Чувствительность для этилового спирта составляет - 0,01%, объемн. Расчет концентрации этилового алкоголя производят по интенсивностям пиков на хроматограмме после калибровки по методу внутреннего стандарта. Внутренним стандартом служит изопропиловый спирт (источник: «Медицинское освидетельствование для установления факта употребления алкоголя и состояния опьянения». Указание Министерства Здравоохранения СССР от 02 сентября 1988 г. №06-14/33-14. - М., Минздрав СССР, 1988 г., стр.57-59, стр.65-71 (копия прилагается), размещено в Интернете).
Недостатки способа-прототипа:
- низкая чувствительность: для этилового спирта - 0,01% объемн.;
- идентификация спиртов производится только по времени выхода на хроматограмме, что может приводить к возможности ошибки при их идентификации (например, при табакокурении или пероральном употреблении спиртосодержащих лекарственных препаратов проверяемыми лицами, наличии следов ацетона или углеводородов в окружающем воздухе и т.п.);
- способ является разрушающим, то есть после проведенного анализа объект не может быть использован для каких-либо иных исследований, например ДНК, одорологических или запаховых исследований, дополнительных исследований на наличие в них наркотических, сильнодействующих и психотропных веществ и др.
Техническая задача, решаемая изобретением, заключается в повышении чувствительности, точности и надежности идентификации и количественного исследования, а также в сохранении используемого объекта для возможных повторных или дополнительных исследований, т.е. его неразрушении.
Эта задача решена способом определения спиртов в биологических тканях и выделениях организма человека, при котором исследуемый образец помещают в герметичную емкость из инертного материала, термостатируют до температуры выше 25°С, но ниже температуры разрушения исследуемого биологического объекта, из термостатированного образца осуществляют отбор пробы парогазовой фазы, которую исследуют хромато-масс-спектрометрически путем разделения на хроматографической колонке, после чего компоненты смеси парогазовой фазы регистрируют в виде ряда хроматографических пиков на хроматограмме и идентифицируют по времени их выхода на хроматограмме и масс-спектру, а расчет концентрации спиртов производят в соответствии с полученной хроматограммой по соответствующим площадям пиков компонентов смеси парогазовой фазы.
Рассмотрим технологию способа.
В качестве образцов биологических тканей и выделений организма человека могут использоваться следующие объекты: водные экстракты выдыхаемого воздуха, кровь, слюна, моча, водные экстракты дезинтегрированных органов и тканей.
Следует отметить, что данные объекты могут изыматься как в присутствии проверяемого лица, например при установлении факта наличия и степени алкогольного опьянения проверяемых лиц, когда отбор проб не представляет каких-либо технических затруднений, так и при отсутствии проверяемого лица - по следам (микроколичествам) биологических объектов в случае обнаружения их на месте происшествия, например при бегстве лица с места дорожно-транспортного происшествия, нахождении лица в беспомощном (бессознательном) состоянии и т.д,, и т.п.
Так как общеизвестно, что все эти вышеуказанные объекты представляют собой гомогенные или гетерогенные системы, в значительных количествах содержащие воду, то в качестве модельных систем в эксперименте использовали растворы этилового спирта в дистиллированной воде с различной объемной концентрацией.
Температура термостатирования исследуемого образца зависит от температуры его разрушения (непригодности его для возможных повторных или дополнительных исследований) и при исследовании образцов разного вида, например мочи и крови, будет различаться и зависеть от свойств самого объекта исследования. Например, при исследовании крови коагуляция белков может начинаться при температуре 43-46°С, а полная коагуляция наступает в результате длительного нагревания крови до температуры 70-80°С.
С учетом указанного выше общеизвестного факта растворы этилового спирта в воде нагревали (термостатировали) до двух значений температуры: 25°С и 40°С соответственно.
Именно такой температурный диапазон позволяет сохранить исследуемый образец крови для использования его при каких-либо иных исследованиях, например ДНК, одорологических или запаховых исследованиях, дополнительных исследованиях на наличие в них наркотических, сильнодействующих и психотропных веществ и др.
Также, зная возможные границы концентраций эндогенного алкоголя, вырабатываемого в организме некоторых людей и алкогольного опьянения организма человека: от десятых-сотых долей промиле до 4-10 промиле, то есть от 0,01% объемн. до 1% объемн. этанола в крови, для проверки работоспособности предлагаемого способа растворы этанола в дистиллированной воде готовили в тех же концентрациях.
На практике экспериментально осуществляли это нижеследующим образом.
В стандартные стеклянные хроматографические виалы объемом 5 мл заливали растворы этанола трех концентраций: 1% объемн. 0,1% объемн. и 0,1% объемн., что соответствует концентрациям этанола в крови: 10, 1 и 0,1 промиле соответственно. Всего - 6 проб (по три - для каждой температуры). В каждом случае объем жидкой фазы составлял - 2 мл, а объем парогазовой фазы над ней - 3 мл соответственно. После этого каждую из виал сразу закрывали резиновой прокладкой-пробкой, на которую надевали специальный алюминиевый колпачок и запечатывали герметически путем его обжатия.
После этого первые три виалы термостатировали (нагревали) путем погружения их в воду с температурой 25°С на время около 15 минут, а вторые три виалы - термостатировали в аналогичных условиях до температуры 40°С.
Пробы из каждой из виал отбирали стандартным хроматографическим шприцем, объемом 10 мкл, который перед отбором проб также термостатировали до температур 25°С и 40°С соответственно, путем нагрева потоком теплого воздуха такой же температуры в сушильном шкафу в течение 15 минут. Это производилось для того, чтобы избежать потерь этанола за счет конденсации его паров из отбираемой пробы на поверхностях шприца (игла, поршень и т.д.) за счет разностей температур. Во всех случаях отбор парогазовой фазы осуществляли из свободного объема виал путем прокалывания резиновой пробки. Объем отбираемой пробы парогазовой фазы во всех случаях составлял - 10 мкл (10-6 л).
После отбора проб их раздельно сразу исследовали методом хромато-масс-спектрометрии.
Выбор метода хромато-масс-спектрометрии обусловлен следующими факторами:
- идентификация вещества в пробе парогазовой фазы одновременно по двум критериям: времени выхода на хроматограмме и его масс-спектру, что позволяет обеспечить 100% надежность идентификации спиртов на хроматограмме, даже при наличии каких-либо загрязняющих или затрудняющих идентификацию посторонних веществ в парогазовой и жидкой фазе исследуемого объекта;
- кроме этого в зависимости от условий и свойств анализируемых веществ метод хромато-масс-спектрометрии обладает высокой чувствительностью: десятые доли нг (не ниже 10-9-10-10 г) вещества в пробе.
Для получения количественных характеристик обнаруживаемого этанола в пробах парогазовой фазы предварительно определяли время выхода его на хроматограмме, характерные особенности его масс-спектра, а также зависимость его концентрации от площади пика на хроматограмме путем непосредственного исследования проб как парогазовой, так и жидкой фазы этилового спирта известной концентрации в полностью тех же условиях хроматографирования.
Исследование методом хромато-масс-спектрометрии проводилось в следующих условиях:
Хроматограф: модель «Trace GC Ultra», фирмы «Thermo Finnigan», США.
Колонка - кварцевая, капиллярная стандартная модель «ВРХ-5»:
- внутренний диаметр: 0,25 мм;
- длина: 30 м.
Неподвижная жидкая фаза:
- толщина пленки: 0,25 мкм.
Температурный режим колонки - программирование:
- начальная температура: 50°С,
- скорость подъема температуры: 10°С/мин,
- конечная температура: 300°С, выдержка - 15 мин.
Испаритель: - «splitless» (1:1); температура: 250°С.
Газ-носитель: - гелий; расход через колонку: 1 мл/мин.
Температура интерфейса: 250°С.
Объем вводимой парогазовой пробы: 10,0 мкл.
Масс-спектрометр: модель «PolarisQ», фирмы «Thermo Finnigan», США.
Тип ионизации: электронный удар (70 эВ).
Детектирование: - «по полному ионному току» (SCAN-mode).
Температура ионизационной камеры: 200°С.
Диапазон масс: 32-450 а.е.м.
Система обработки данных: «Xcalibur», версия 1.4 SR1.
Расшифровка масс-спектров производилась путем сравнения как с калибровочным масс-спектром этанола, так и путем сравнения с библиотечными масс-спектрами.
При этом в обоих случаях на масс-спектрах этанола по полному ионному току (SCAN-mode) выявлены следующие основные ионы с характеристическими отношениями масса к заряду m/z (а.е.м.): 347%, 372%, 412%, 427%, 4314%, 45100%, 465%, 472% соответственно.
Способ проиллюстрирован фиг.1-8 и таблицей 1.
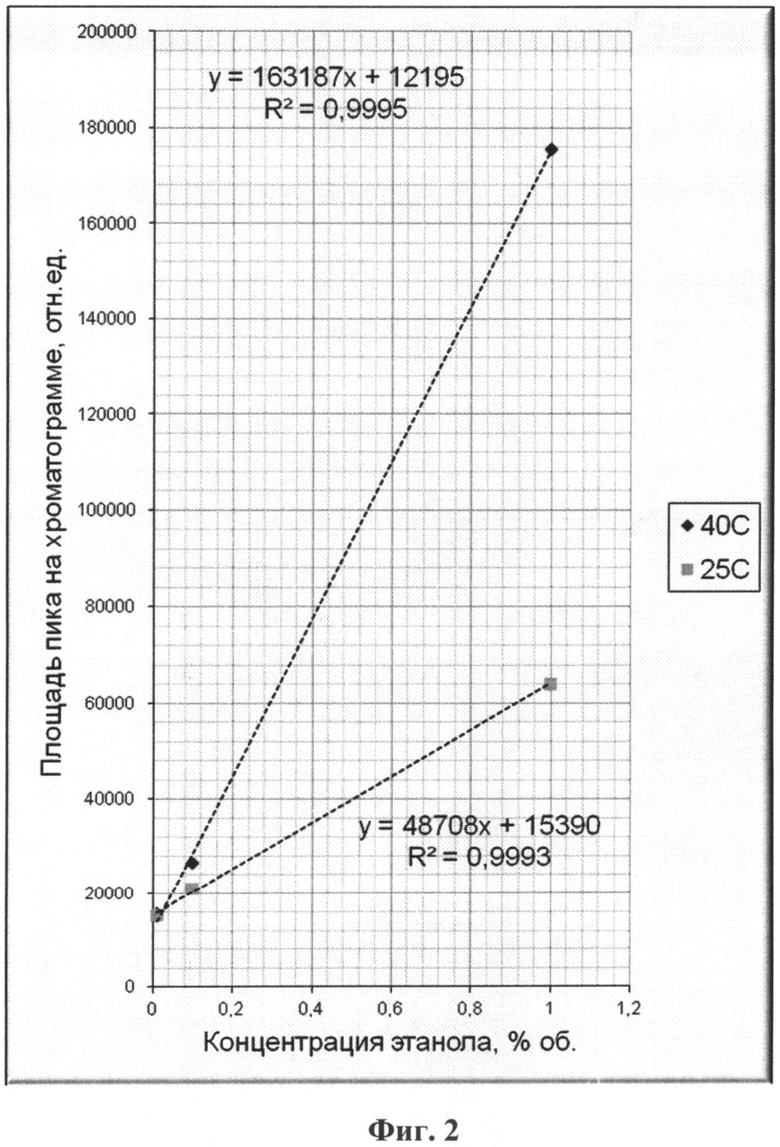
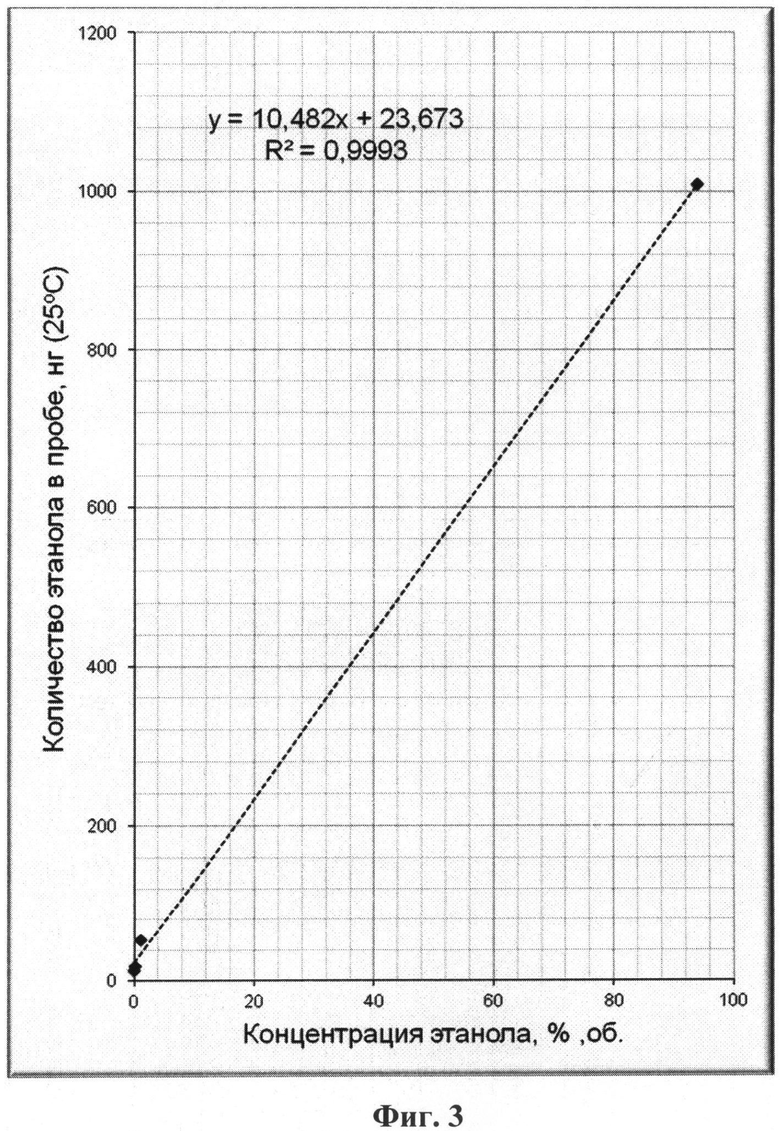
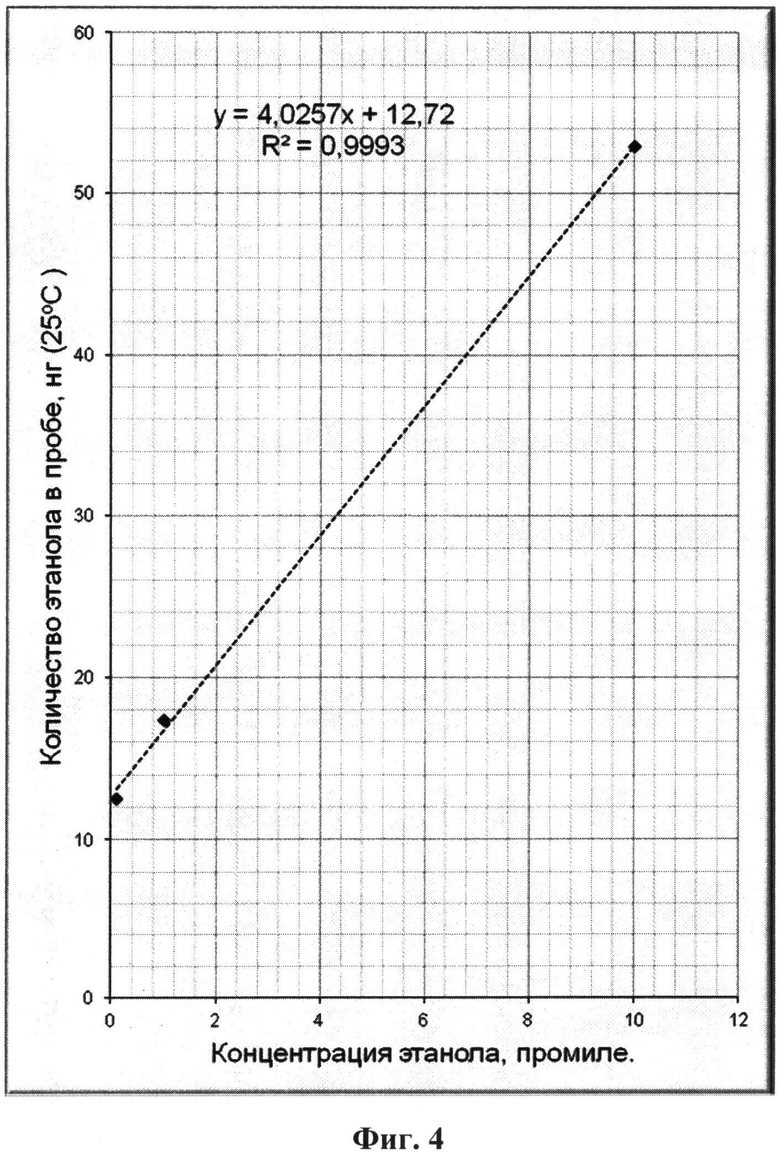
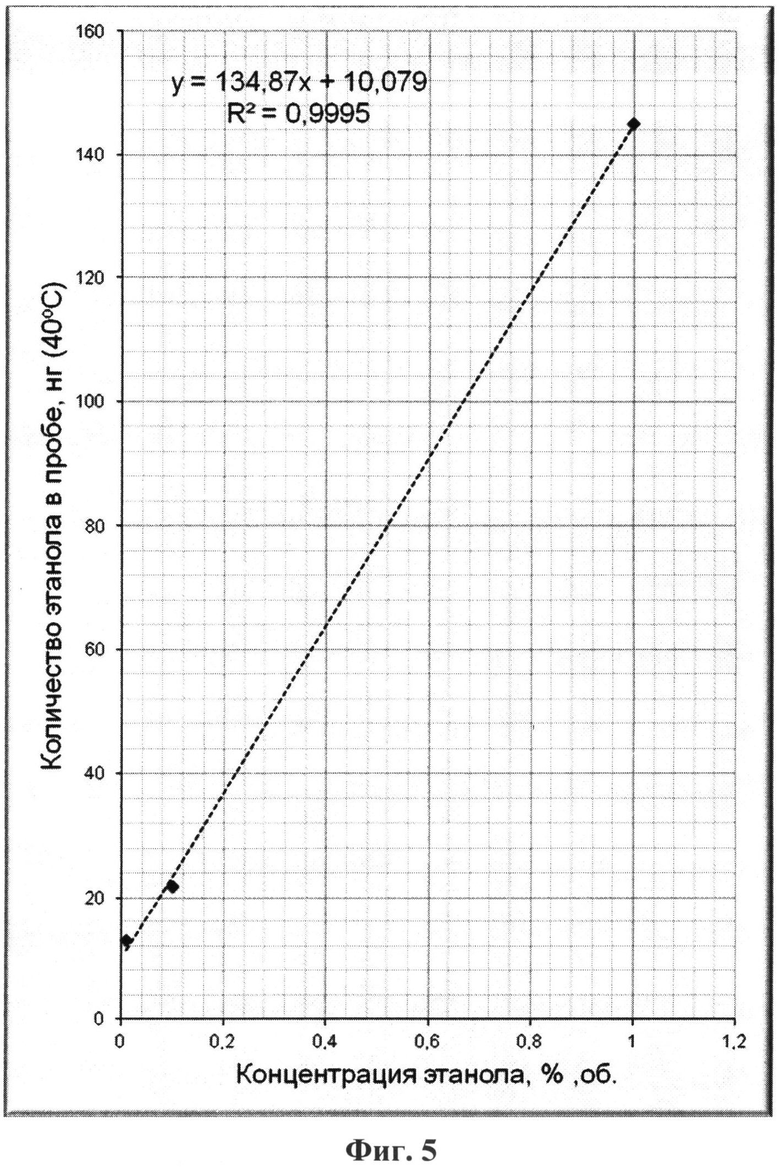
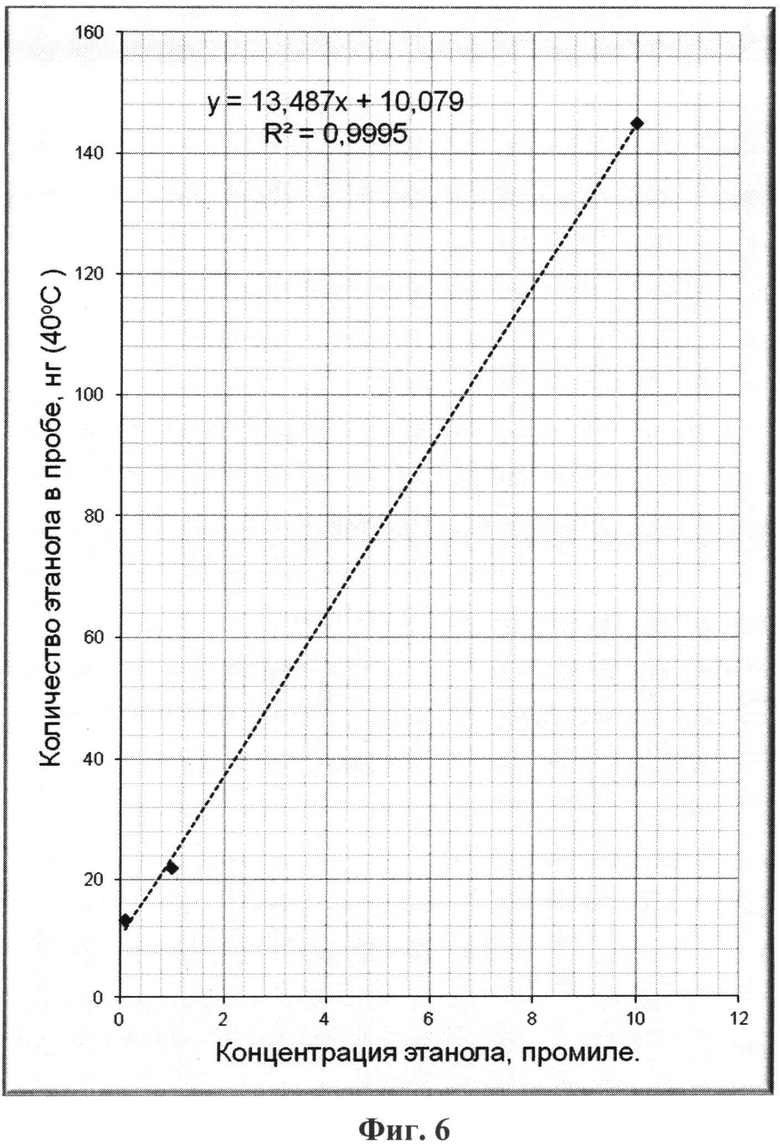
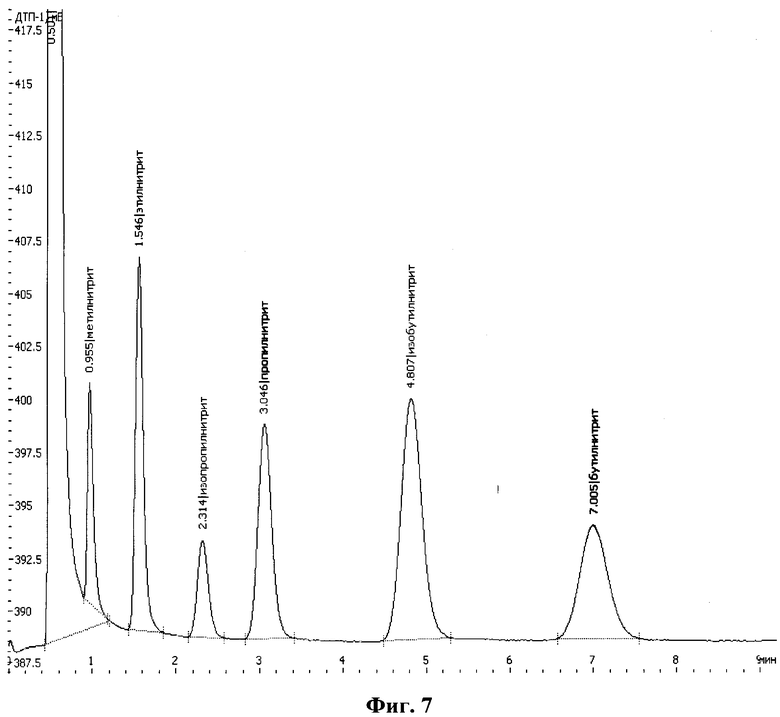
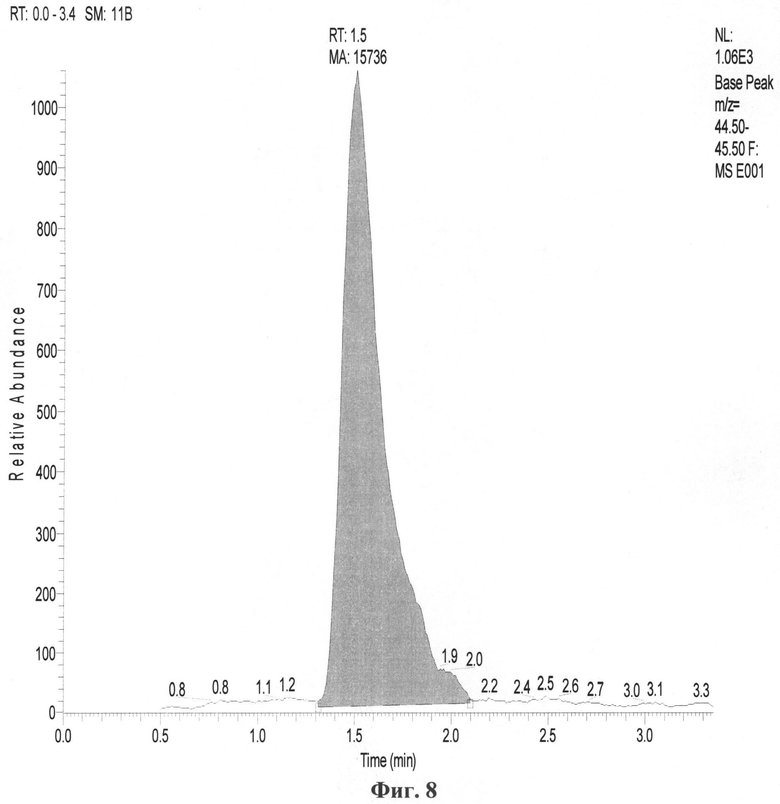
На фиг.1 приведен характерный вид хроматограммы и масс-спектра этанола в пробе; на фиг.2-6 - результаты хроматографирования нескольких проб при различных концентрациях этанола в парогазовой фазе; на фиг.7, 8 приведены хроматограммы, полученные по методике-прототипу и предлагаемому способу соответственно.
В результате хроматографирования проб парогазовой фазы, а также идентификации пиков этанола по времени выхода - около 1,5 минут и масс-спектрам определялись количества этанола в каждой пробе (в расчете на 10 мкл парогазовой фазы) в зависимости от температуры термостатирования и концентрации этилового спирта в водном растворе - фиг.1.
Для каждого из пиков этанола на хроматограммах рассчитывали количество этанола в пробе (нг), при этом для повышения точности и надежности результатов расчет производился не по интенсивностям (высотам) пиков, а по их площадям, как общеизвестно, прямо пропорциональным концентрации вещества в пробе.
Результаты хроматографирования всех проб и расчетов концентрации этанола в пробах парогазовой фазы для них приведены в таблице 1 и на фиг.2-6.
Непосредственно из приведенных в таблице 1 и на фиг.2-6 результатов исследования методом хромато-масс-спектрометрии можно сделать следующие выводы:
- количество этанола в пробах парогазовой фазы прямо пропорционально его концентрации в жидкой фазе (на фиг.2-6 для удобства приведены соответствующие уравнения прямых Y=kX+b, а также значения коэффициентов корреляции R2 (все коэффициенты корреляции близки к единице), полученные непосредственной обработкой данных по методу наименьших квадратов - МНК);
- обнаруживаемые количества этанола в пробах парогазовой фазы позволяют надежно количественно определять его в пробах биологических тканей и выделений организма человека при концентрациях значительно ниже 0,01% объемн. (менее 0,1 промиле);
- при термостатировании пробы от 25°С до 40°С количество этанола в парогазовой фазе возрастает в несколько раз, что повышает чувствительность данного способа, при отсутствии какого-либо разрушения белковых веществ в жидкой фазе проб биологических тканей и выделений организма человека.
Для иллюстрации большей чувствительности предлагаемого способа по сравнению с прототипом на фиг.7-8 приведены хроматограммы, полученные на газовом хроматографе с детектором по теплопроводности (ДТП) по методике-прототипу (фиг.7) и по предлагаемому способу (фиг.8) на оборудовании и при условиях, описанных выше, для растворов этилового спирта одной и той же концентрации - 0,01% объемн.
При сравнении интенсивности пика этилнитрита (производного этанола), обнаруженного в парогазовой пробе (на хроматограмме фиг.7 - пик со временем выхода около 1,546 мин, интенсивность 407 отн. ед.), и интенсивности и площади пика этанола в пробе парогазовой фазы (на хроматограмме фиг.8 - интенсивность около 1060 отн. ед., площадь - 15736 отн. ед.), отобранной при 40°С, которые в обоих случаях прямо пропорциональны концентрациям веществ в парогазовой фазе над растворами этанола одинаковых концентраций, можно сделать вывод о том, что предлагаемый способ определения наличия спиртов в пробах биологических тканей и выделений организма человека превосходит методику-прототип по чувствительности не менее чем в 10-20 раз.
Также необходимо отметить, что при использовании в качестве аналитической системы ГХ-МС иного оборудования, например хроматографа типа Agilent-6890 (производство фирмы «Agilent», США), с более селективной (чем использованная) по отношению к спиртам хроматографической колонкой и хромато-масс-спектрометром с квадрупольным анализатором типа Agilent-5973N, позволяющим в режиме детектирования по выбранным ионам (SIMM-mode) повысить чувствительность обнаружения спиртов еще примерно в 10 раз (в нашем случае использовался масс-детектор с конструкцией типа «ионная ловушка», не дающий практического повышения чувствительности в SIMM-mode по сравнению со SCAN-mode), чувствительность предлагаемого способа может быть выше, по сравнению с протитипом, в 10-100 раз и более.
Таким образом, предлагаемый способ определения спиртов в биологических тканях и выделениях организма человека превосходит известную методику-протитип по чувствительности, позволяет исключить возможную ошибку при идентификации спиртов и является неразрушающим, то есть после проведенного анализа объект может быть использован для каких-либо иных повторных или дополнительных исследований.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ идентификации этилглюкуронида в крови | 2020 |
|
RU2750408C1 |
| Способ идентификации этилглюкуронида в сухих пятнах крови | 2020 |
|
RU2740269C1 |
| Способ идентификации наркотических и психоактивных веществ в биосубстрате человека | 2019 |
|
RU2723907C1 |
| Способ идентификации наркотических и психоактивных веществ в сложных биологических матрицах организма человека | 2019 |
|
RU2705932C1 |
| СПОСОБ КАЛИБРОВКИ СИСТЕМЫ ГАЗОВОЙ ХРОМАТОГРАФИИ - МАСС СПЕКТРОМЕТРИИ (ГХ-МС), ОСНАЩЕННОЙ СПЕЦИАЛЬНЫМ ПО, ДЛЯ ОПРЕДЕЛЕНИЯ МАРКЕРОВ МИКРООРГАНИЗМОВ В ИССЛЕДУЕМОЙ ПРОБЕ МАТЕРИАЛА БИОЛОГИЧЕСКОГО ПРОИСХОЖДЕНИЯ | 2012 |
|
RU2501011C2 |
| СПОСОБ ВЫЯВЛЕНИЯ НЕИЗВЕСТНЫХ ВЕЩЕСТВ В БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ ПАЦИЕНТОВ, ПРИНИМАВШИХ НАРКОТИЧЕСКИЕ ИЛИ ПСИХОАКТИВНЫЕ ВЕЩЕСТВА | 2009 |
|
RU2419788C2 |
| СПОСОБ ВЫЯВЛЕНИЯ ВОЗБУДИТЕЛЯ ИНФЕКЦИОННОГО ПРОЦЕССА В СТЕРИЛЬНЫХ БИОЛОГИЧЕСКИХ СРЕДАХ МАКРООРГАНИЗМА | 1997 |
|
RU2146368C1 |
| СПОСОБ ВЫЯВЛЕНИЯ И ОПРЕДЕЛЕНИЯ ПРОИСХОЖДЕНИЯ НЕИЗВЕСТНЫХ ВЕЩЕСТВ В СПИРТНЫХ НАПИТКАХ | 2009 |
|
RU2392616C1 |
| Способ одновременного количественного определения стойких хлорорганических пестицидов в шерсти животных методом газовой хромато-масс-спектрометрии | 2022 |
|
RU2806370C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ РОДОВОГО (ВИДОВОГО) СОСТАВА АССОЦИАЦИИ МИКРООРГАНИЗМОВ | 1993 |
|
RU2086642C1 |
Изобретение относится к интегральному анализу биологических тканей и выделений организма человека с использованием метода хромато-масс-спектрометрии (ГХ/МС). Способ может быть использован в медицине, биологии, экспертно-криминалистической, судебной и оперативно-розыскной деятельности. Заявленный способ заключается в том, что исследуемый образец помещают в герметичную емкость из инертного материала, термостатируют до температуры выше 25°С, но ниже температуры разрушения исследуемого биологического объекта. Из термостатированного образца осуществляют отбор пробы парогазовой фазы, которую исследуют хромато-масс-спектрометрически путем разделения на хроматографической колонке. Затем компоненты смеси парогазовой фазы регистрируют в виде ряда хроматографических пиков на хроматограмме и идентифицируют по времени их выхода на хроматограмме и масс-спектру. Расчет концентрации спиртов производят в соответствии с полученной хроматограммой по соответствующим площадям пиков компонентов смеси парогазовой фазы. Техническим результатом является повышение чувствительности, точности и надежности идентификации и количественного исследования, а также сохранение используемого объекта для возможных повторных или дополнительных исследований. 1 табл., 8 ил.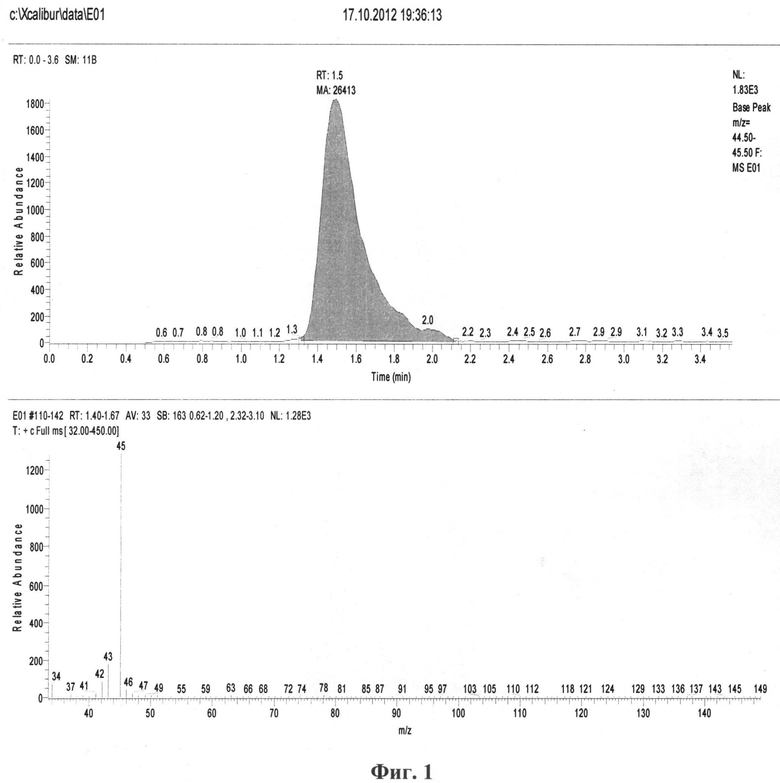
Способ определения спиртов в биологических тканях и выделениях организма человека, при котором исследуемый образец помещают в герметичную емкость из инертного материала, термостатируют до температуры выше 25°С, но ниже температуры разрушения исследуемого биологического образца, из термостатированного образца осуществляют отбор пробы парогазовой фазы, которую исследуют хромато-масс-спектрометрически путем разделения на хроматографической колонке, после чего компоненты смеси парогазовой фазы регистрируют в виде ряда хроматографических пиков на хроматограмме и идентифицируют по времени их выхода на хроматограмме и масс-спектру, а расчет концентрации спиртов производят в соответствии с полученной хроматограммой по соответствующим площадям пиков компонентов смеси парогазовой фазы.
| С.А.Савчуком и др., Пособие для врачей клинической лабораторной диагностики, Обнаружение и количественное определение летучих токсичных веществ и гликолей в биологических объектах методами газовой хроматографии и хромато-масс-спектрометрии, ММА им | |||
| Сеченова Минздрава РФ, М., 2003 | |||
| Медицинское освидетельствование для установления факта употребления |
Авторы
Даты
2014-05-20—Публикация
2012-12-03—Подача