Настоящее изобретение относится к новым замещенным 2-метилтиоэтилом гетероциклам и их производным, а также к их получению и к их применению в качестве добавок к кормам, прежде всего для питания пользовательных животных, таких, например, как куры, свиньи, жвачные, а также рыб и ракообразных (морских животных).
Уровень техники
Незаменимые аминокислоты, такие как метионин, лизин или треонин, являются в качестве добавок к кормам важным компонентом питания животных. Их добавление к кормам, во-первых, ускоряет рост животных, а во-вторых, повышает эффективность усвоения корма. В этом состоит очевидное экономическое преимущество. Рынки кормовых добавок имеют большое промышленное и хозяйственное значение. Помимо этого спрос на кормовые добавки постоянно повышается и на развивающихся рынках, что не в последнюю очередь объясняется возрастающей ролью в мире таких стран, как, например, Китай и Индия.
Из WO 2004/008874 известно, в частности, что для животных многих видов метионин (2-амино-4-метилтиомасляная кислота) представляет собой первую незаменимую аминокислоту. Так, например, эффективность лактации у молочных коров касательно количества и качества молока в значительной степени зависит от поступления метионина в организм животных в достаточных количествах. При этом потребность высокопродуктивных молочных коров в метионине не может покрываться за счет белка, вырабатываемого микробами в рубце, соответственно за счет не разлагающегося в рубце белка, содержащегося в корме (Graulet и др., Journ. Animal and Feed Sciences, 2004, с.269). По этим причинам метионин целесообразно добавлять в корм для повышения тем самым экономической эффективности производства молока и улучшения его качества.
D,L-Meтионин и его гидроксианалог (ГАМ), которым называют также D,L-2-гидрокси-4-метилтиомасляную кислоту (ГММК), обычно используют в качестве добавки к кормам для животных с однокамерным желудком, таких, например, как птица и свиньи. Благодаря этому в организме таких животных повышается доступное количество L-метионина, которое в этом случае может способствовать стимуляции роста животного.
В отличие от этого добавление метионина к кормам для жвачных оказывается неэффективным, поскольку основное его количество разлагается в рубце животных под действием микробов. В результате такого разложения метионина лишь небольшая часть от всего его добавленного к корму количества попадает в тонкий кишечник животного, где обычно происходит всасывание метионина в кровь.
В WO 99/04647 описано применение ГАМ в качестве добавки к кормам для жвачных. В этой публикации утверждается, что ГАМ лишь частично разлагается в рубце и поэтому по меньшей мере 20-40% от всего его добавленного к корму количества может после всасывания в тонком кишечнике участвовать в процессе обмена веществ. В целом же ряде других публикаций говорится об ином механизме поступления ГАМ в организм жвачных. Так, например, в WO 2000/28835 говорится, что ГАМ может успешно проходить через рубец и в конечном итоге попадать в тонкий кишечник и всасываться в нем лишь при условии его ежесуточного потребления животным в очень больших количествах, составляющих от 60 до 120 г. Однако при столь высоком расходе метионина его применение становится экономически невыгодным.
Для высокоэффективного обеспечения организма жвачных метиониновыми продуктами, такими как D,L-метионин, соответственно рац-ГАМ, их необходимо применять в форме, защищенной от разложения в рубце. Необходимое условие при этом состоит в том, чтобы найти метиониновый продукт, придающий метионину максимально возможную стойкость при его нахождении в рубце и вместе с тем обеспечивающий его высокоэффективное всасывание в тонком кишечнике. В этом отношении существует несколько рассмотренных ниже возможностей по приданию подобных свойств D,L-метионину или рац-ГАМ.
а) Физическая защита
Высокую стойкость метионину при его нахождении в рубце можно придать нанесением приемлемого защитного слоя на метионин, соответственно его распределением в защитной матрице. Благодаря этому метионин может практически без потерь проходить через рубец. В дальнейшем защитный слой вскрывается или удаляется, например, в сычуге в результате кислотного гидролиза, а высвобождающийся при этом метионин может затем всасываться в тонком кишечнике животного. Защитный слой, соответственно защитная матрица, может состоять из комбинации нескольких веществ, таких, например, как липиды, неорганические материалы и углеводы. В качестве примера имеющихся на рынке продуктов подобного типа можно назвать следующие.
I) Продукт Met-PlusTM: выпускается фирмой Nisso America и представляет собой защищенный липидом метионин с содержанием D,L-метионина 65%. Защитная матрица образована кальциевыми солями жирных кислот с длинной цепью, таких, например, как лауриновая кислота. Консервантом при этом служит бутилированный гидрокситолуол.
II) Продукт Mepron® M85: выпускается фирмой Degussa AG и представляет собой защищенный углеводами метионин с сердцевиной из D,L-метионина, крахмала и стеариновой кислоты. В качестве защитного слоя используется этилцеллюлоза. Содержание D,L-метионина в подобном продукте составляет 85%.
III) Продукт SmartamineTM M: выпускается фирмой Adisseo и представляет собой защищенный полимером метионин. Наряду со стеариновой кислотой пеллеты (гранулы сферической формы) содержат D,L-метионин в количестве по меньшей мере 70%. Защитный слой образован сополимером винилпиридина со стиролом.
Физическая защита, хотя она и препятствует разложению метионина в рубце под действием микробов, повышая тем самым его поступление в организм животного и полноту его усвоения животным, обладает целым рядом существенных недостатков.
Получение метионина, соответственно нанесение на него покрытия, в большинстве случаев является технически сложным и связанным поэтому с высокими затратами процессом. Помимо этого нанесенное на поверхность готовых гранул покрытие может легко повреждаться от механической нагрузки и истирания при переработке кормов, что может привести к снижению эффективности защиты или даже полной ее утрате. Поэтому защищенные метиониновые гранулы невозможно повторно гранулировать для их переработки в более крупные комбикормовые гранулы, поскольку при такой переработке также произошло бы разрушение защитного слоя под действием механических нагрузок. Этот фактор существенно ограничивает применение подобных продуктов, поскольку приготовление комбикормовых гранул является широко распространенным методом переработки кормов.
б) Химическая защита
Наряду с возможностями чисто физической защиты метионина его стойкость при нахождении в рубце можно также повысить путем модифицирования химической структуры, например, путем этерификации карбоксильной группы. В настоящее время на рынке имеются или в литературе описаны следующие продукты.
I) Эфиры метионина, такие, например, как D,L-трет-бутилметионин: по результатам проведенных исследований было установлено, что подобные эфиры проявляют лишь умеренную стойкость при нахождении в рубце (Loerch и Oke, "Rumen Protected Amino Acids in Ruminant Nutrition" в "Absorption and Utilization of Amino Acids", т. 3, изд-во CRC Press Boca Raton, Florida, 1989, cc. 187-200). В публикации же WO 00/28835 биологическая доступность D,L-трет-бутилметионина оценивается в 80%.
II) Продукт MetasmartТМ: выпускается фирмой Adisseo и представляет собой рацемический изопропиловый эфир гидроксианалога метионина (HMBi). Это соединение поставляется также на рынок под торговым наименованием "Sequent" американской фирмой Novus. Согласно WO 00/28835 биологическая доступность HMBi для жвачных составляет не менее 50%. Решающую роль при этом играет неожиданно быстрое всасывание гидрофобного HMBi через стенку рубца. Затем этот сложный эфир может гидролизоваться в крови до ГАМ и после окисления и дальнейшего переаминирования может превращаться в L-метионин. В ЕР 1358805 указывается сравнимая биологическая доступность HMBi. В этих исследованиях HMBi использовали в нанесенном на пористый носитель виде. В еще одной публикации, изданной Европейской Комиссией, говорится, что примерно 50% HMBi всасывается через стенку рубца (European Comission: Report of the Scientific Committee on Animal Nutrition on the Use of HMBi, 25 апреля 2003 г.). В статье Graulet и др., опубликованной в Journal of Animal and Feed Science (269) в 2004 г., говорится, что благодаря липофильным свойствам изопропильной группы HMBi улучшается его диффузия через стенку рубца.
HMBi можно получать двумя разными опубликованными в литературе способами. Так, в частности, HMBi можно получать непосредственно в одну стадию из соответствующего циангидрина (WO 00/59877). Этерификация с образованием изопропилового эфира происходит при этом in situ без необходимости предшествующего выделения ГАМ. При получении же HMBi другим способом чистый ГАМ этерифицируют взаимодействием с изопропанолом (WO 01/58864 и WO 01/56980). В обоих случаях для синтеза используют синильную кислоту, которая не только обладает высокой стоимостью, но и потенциально является высокоопасным веществом.
В последние годы возросло также значение такой области, как аквакультура (Food and Agriculture Organization of the United Nation (PAO) Fisheries Department, "State of World Aquaculture 2006", 2006, Рим; International Pood Policy Research Institute (IFPRI), "Fish 2020: Supply and Demand in Changing Markets", 2003, Вашингтон, округ Колумбия). Разведение и выращивание пригодных для употребления в пищу пресноводных и морских животных, прежде всего рыб и ракообразных, также требуют выпуска продуктов в особых формах для снабжения организма таких животных метионином.
Метионин для снабжения им организма рыб и ракообразных, разводимых в коммерческих целях в аквакультурных хозяйствах, требует его выпуска в соответствующим образом защищенной форме, с тем чтобы, во-первых, продукт оставался достаточно стойким в водной среде в процессе кормления животных и чтобы, во-вторых, в конечном итоге обеспечивалась возможность оптимального усвоения метионинового продукта, потребленного животным, его организмом.
Задача изобретения
В основу настоящего изобретения была положена задача, в первую очередь, предложить кормовое средство, соответственно кормовую добавку для животных на основе новых заменителей метионина.
С учетом описанных выше недостатков, присущих уровню техники, задача изобретения заключалась прежде всего в разработке химически защищенного метионинового продукта для пользовательных животных. Такой продукт должен предназначаться, в первую очередь, для жвачных, главным образом для молочных коров, и прежде всего должен обладать стойкостью при нахождении в их рубце. Вместе с тем подобный продукт должен быть максимально пригоден и для применения в рационе питания рыб и ракообразных в аквакультурных хозяйствах. Таким путем для животных наряду с D,L-метионином и ГАМ должно обеспечиваться наличие еще одного эффективного источника метионина, каковой источник метионина не обладал бы вовсе или обладал бы лишь в гораздо меньшей степени недостатками известных продуктов.
Еще одна задача изобретения заключалась в разработке кормового средства, соответственно кормовой добавки, которое/которая помимо исключительно высокой биологической ценности и биологической доступности было/была бы простым/простой в обращении с ним/ней и обладало/обладала бы высокой сохраняемостью, а также стойкостью в обычных условиях производства комбикормов, прежде всего при гранулировании. Такой продукт при его применении в рационе питания жвачных обладал бы преимуществом, заключающимся в значительном упрощении и в возможности стандартизации переработки и приготовлении комбикормов, что в свою очередь позволило бы существенно повысить экономическую эффективность, равно как и качество производства молока.
Описание изобретения
Эти, а также другие, конкретно не указанные задачи, которые, однако, со всей очевидностью вытекают из контекста настоящего описания, решаются с помощью предлагаемых в изобретении гетероциклических соединений и их производных формулы I, соответственно формулы II, прежде всего благодаря их применению в качестве кормового средства, предпочтительно для кур, свиней, жвачных, рыб и ракообразных.
Объектом настоящего изобретения в соответствии с этим является соединение общей формулы (I) или (II)
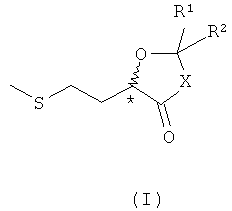
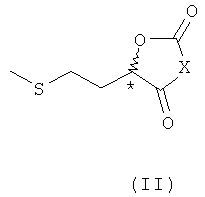
в которой Х представляет собой О или NR, где R представляет собой Н, необязательно разветвленный С1-С6алкил, С3-С6циклоалкил, арил, прежде всего фенил, или аралкил, прежде всего бензил, а R1 и R2 имеют одинаковые или разные значения и независимо друг от друга представляют собой Н, необязательно разветвленный C1-С6алкил, С2-С6циклоалкил, аллил, арил, прежде всего фенил, или аралкил, прежде всего бензил, или R1 и R2 совместно обозначают необязательно замещенную C1-С6алкилом С2-С6алкиленовую группу.
Преимущества соединений формулы I заключаются, например, в том, что они, когда каждый из R1 и R2 обозначает Н, соответственно (низш.)алкильный остаток, такой как метил, этил, н-пропил, представляют собой жидкие, абсолютно прозрачные, бесцветные соединения. В то же время соединения формулы I не содержат никаких димерных и олигомерных побочных продуктов полностью в отличие от имеющейся в продаже 2-гидрокси-4-метилтиоэтилмасляной кислоты (ГАМ-мономер). Последняя находится в равновесии с ее димерными и высшими олигомерными эфирами (продукты конденсации), которые обладают гораздо более низкой биологической доступностью по сравнению с самим ГАМ-мономером или D,L-метионином. Поэтому ГАМ для смещения равновесия в сторону требуемого мономера так же, как и аналогичную молочную кислоту, поставляют на рынок в виде 88%-ного водного раствора.
Предлагаемые же в изобретении соединения не требуется разбавлять водой, благодаря чему обеспечивается наличие биологически активного вещества в чистом виде. Помимо этого предлагаемые в изобретении соединения легко поддаются дистилляции, прежде всего в тех случаях, когда каждый из R1 и R2 обозначает Н, метил, этил или н-пропил, что позволяет технически простым путем достичь почти 100%-ной чистоты этих новых веществ, в чем состоит исключительное технологическое, а тем самым и экономическое преимущество.
Жидкие соединения формулы I, соответственно формулы II, где Х представляет собой О, можно непосредственно применять в виде жидкой кормовой добавки, с чем в определенных прикладных областях связан целый ряд преимуществ, прежде всего в том случае, когда на комбикормовых заводах уже имеются системы дозирования жидкостей, добавляемых в виде так называемых микрокомпонентов. Вместе с тем такие соединения при необходимости можно также наносить на твердые носители, которые могут быть неорганическими или органическими и должны быть пригодны для применения в кормопроизводстве, что позволяет простым путем получить твердую кормовую добавку, с которой столь же легко работать, как и, например, с D,L-метионином, являющимся классической твердой добавкой к кормам, в тех местах, где имеются только системы дозирования твердых веществ.
Неорганическими носителями могут служить кремниевые кислоты, такие, например, как продукт Sipernat, выпускаемый фирмой Evonik-Degussa, или силикаты, а также оксиды алюминия или цеолиты, например, силикат кальция, силикат натрия или алюмосиликат натрия, либо карбонаты металлов, такие как карбонат магния, кальция или натрия, при этом подобные носители можно использовать индивидуально либо в виде смеси двух или более из них.
Органическими носителями могут служить, например, альгинаты, стеараты, крахмалы и камеди. Предпочтительны альгинат кальция, натрия или алюминия, стеарат кальция или натрия, кукурузный крахмал либо гуммиарабик, при этом подобные носители можно использовать индивидуально либо в виде смеси двух или более из них.
Использование носителей позволяет также при необходимости целенаправленно снижать концентрацию предлагаемых в изобретении соединений до значений менее 100%.
Предпочтительны соединения формулы I, в которых Х обозначает О, поскольку такие соединения представляют собой ацетали и сложные эфиры, при гидролизе которых в организме непосредственно образуется мономерный ГАМ, который затем может метаболизироваться. При этом одновременно происходит высвобождение соответствующего карбонильного соединения R1R2С=O.
Предпочтительны в данном случае соединения формулы I, в которых каждый из R1 и R2 представляет собой необязательно разветвленный C1-С6алкил. По физиологическим причинам особенно предпочтительно в данном случае соединение 4, где R1 и R2 обозначают СН3, поскольку при высвобождении ГАМ образуется лишь физиологически безвредный ацетон. Благодаря низкой концентрации метионинового эквивалента в комбикорме, составляющей обычно от 0,1 до 0,5 мас.%, допустимо также наличие других остатков R1, R2, соответственно карбонильных соединений, которые соответственно высвобождаются при гидролизе до ГАМ.
К предпочтительным поэтому относятся также соединение 2 (см. примеры), где R1, R2 обозначают Н, и соединение 6, где R1 представляет собой Н, а R2 представляет собой трет-бутил. Предпочтительно в данном случае и соединение формулы I, где Х обозначает О, R1 представляет собой Н, а R2 представляет собой фенил; поскольку при гидролизе такого соединения образуется бензальдегид, который встречается также в растительных продуктах, таких как горький миндаль. В качестве карбонильного соединения при гидролизе соединения 2 образуется формальдегид, легко окисляющийся далее до формиата, который как таковой имеет немаловажное значение в качестве компонента кормов.
Предпочтительно также соединение 7 общей формулы I, в котором R1 и R2 совместно представляют собой (CH2)5 и в результате гидролиза которого происходит высвобождение циклогексанона.
К предпочтительным согласно изобретению, однако, относятся также соединения формулы I, в которых Х представляет собой NH. При их гидролизе наряду с соответствующим карбонильным соединением R1R2C=O одновременно высвобождается аммиак. Такой аммиак представляет собой точно молярный NН3-эквивалент, который расходуется в организме на метаболизм предлагаемого в изобретении соединения формулы II с образованием аминокислоты - метионина.
Предпочтительно при этом соединение формулы I, в котором Х представляет собой NH, а R1 и R2 обозначают Н. В качестве карбонильного соединения при гидролизе такого соединения образуется формальдегид, легко окисляющийся далее до формиата, который как таковой имеет немаловажное значение в качестве компонента кормов.
Предпочтительно также соединение 12, в котором R1 представляет собой Н, а R2 представляет собой фенил. В качестве карбонильного соединения при гидролизе такого соединения образуется бензальдегид, являющийся природным компонентом горького миндаля.
Предпочтительны далее соединения формулы I, в которых Х представляет собой NH и которые отличаются тем, что каждый из R1 и R2 обозначает необязательно разветвленный C1-С6алкил.
Особенно предпочтительно при этом соединение 10, в котором R1 и R2 обозначают СН3 и в результате гидролиза которого высвобождаются только NН3 и ацетон.
Однако интерес в качестве компонентов кормов представляют также соединение 13, где R1 обозначает СН3, а R2 обозначает С2Н5, и соединение 14, где R1 и R2 совместно обозначают (СН2)5.
Помимо этого при создании изобретения было синтезировано соединение 8 формулы II, в котором Х представляет собой О. При комнатной температуре такое вещество представляет собой жидкость. В результате его гидролиза непосредственно образуется мономерный ГАМ, а в качестве побочного продукта образуется только СО2, который в любом случае участвует в естественном метаболизме в живых организмах и поэтому абсолютно безвреден. Данный фактор обладает исключительно важным преимуществом для питания животных.
Равным образом интерес представляет соединение 15 формулы II, в котором Х обозначает NH и которое представляет собой бесцветное твердое вещество и поэтому является своего рода противоположностью вышеуказанного соединения. В результате гидролиза подобного соединения также непосредственно образуется ГАМ-мономер (2-гидрокси-4-метилтиоэтилмасляная кислота), а наряду с СО2 в качестве еще одного побочного продукта образуется NН3, который также участвует в естественном метаболизме в живых организмах, соответственно который в свою очередь служит в качестве NH3-эквивалента для образования аминокислоты из гидроксикислоты и поэтому даже может обеспечивать дополнительные преимущества.
Все предлагаемые в изобретении соединения общих формул I и II в принципе пригодны для применения в кормлении пользовательных животных, поскольку все они содержат основной элемент гидроксианалога метионина, высвобождающийся в процессе физиологического метаболизма таких соединений в виде 2-гидрокси-4-метилтиобутирата и превращающийся в конечном итоге в метионин. Другие преимущества подобных химически защищенных аналогов метионина указывались в начале описания, соответственно рассмотрены выше. Подобные химически защищенные продуктовые формы, во-первых, обладают достаточной стойкостью во время кормления животных, в том числе и в водной среде, а во-вторых, хорошо усваиваются организмом животных. Предпочтение тому или иному соединению следует отдавать в зависимости от вида животного и матрицы кормового средства, соответственно от условий кормления.
Подобные соединения могут прежде всего найти применение для кормления птицы, свиней, жвачных, равно как и для кормления рыб или ракообразных. Объектами настоящего изобретения являются также кормовые смеси для кормления пользовательных животных, содержащие по меньшей мере одно из соединений общей формулы I или II, равно как и соответствующее применение этих соединений для приготовления кормовых смесей, предназначенных для кормления пользовательных животных.
Объектом настоящего изобретения является также соответствующий способ получения соединений общей формулы I или II.
Исходным соединением при осуществлении такого способа является соединение общей формулы III
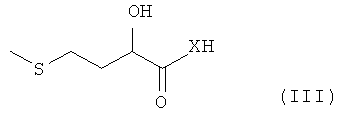
где каждый из X, R1 и R2 имеет указанные выше значения. Соединение формулы III, в котором Х обозначает О, представляет собой 2-гидрокси-4-метилтиомасляную кислоту (соединение 3, ГАМ-мономер), которую можно также получать in situ из одной из ее солей, предпочтительно кальциевой соли (соединение 1, см. пример 1), взаимодействием с кислотой. Соединение формулы III, в котором Х обозначает NH, представляет собой амид 2-гидрокси-4-метилтиомасляной кислоты (соединение 9, ГАМ-амид), который можно получать из нитрила 2-гидрокси-4-метилтиомасляной кислоты известными методами гидролиза, например взаимодействием с 55-70%-ной серной кислотой.
Объектом изобретения в соответствии с этим является способ получения соединений формулы I, отличающийся тем, что соединение общей формулы III подвергают, необязательно в присутствии растворителя, взаимодействию с карбонильным соединением R1R2С=O в свободном или ацетализированном виде. К пригодным для применения при такой реакции растворителям относятся, например, толуол или хлороформ, каждый из которых одновременно может служить азеотропообразователем, а также тетрагидрофуран, диоксан, метиленхлорид и диметилформамид. Особенно предпочтительно, однако, одновременно применять в качестве растворителя используемое карбонильное соединение, прежде всего в тех случаях, когда речь идет о кетоне, таком, например, как ацетон или метилэтилкетон. Избыток карбонильного соединения можно по завершении реакции легко регенерировать обычным путем и непосредственно, а при необходимости также после дальнейшей очистки можно использовать повторно.
Подобный способ предпочтительно осуществлять при кислотном катализе. В качестве катализаторов используют пригодные для этого кислоты Льюиса или кислоты Бренстеда.
К предпочтительным катализаторам относятся кислоты Бренстеда из числа НСl, H2SO4, паратолуолсульфокислоты и СF3SO3Н, а также кислоты Льюиса из числа ZnCl2 CuSO4, FеСl3, АlСl3, MgCl2 и MgBr2. По завершении реакции катализаторы можно регенерировать обычным путем и непосредственно, а при необходимости также после дальнейшей очистки можно использовать повторно.
Вместо карбонильного соединения R1R2C=O можно также использовать его диметил- либо диэтилацеталь. Выделяющийся при этом метанол или этанол можно регенерировать из реакционной смеси, предпочтительно путем перегонки.
Предпочтительно также удалять из реакционной смеси образующуюся при непосредственном применении карбонильного соединения R1R2С=O в ходе реакции конденсации воду. Удаление образующейся воды, соответственно образующегося спирта из реакционной смеси позволяет повысить степень превращения и селективность образования требуемого продукта конденсации. Для удаления воды/спирта дополнительно можно также использовать азеотропообразователь, такой, например, как толуол, что позволяет путем перегонки удалять воду, соответственно спирты в виде азеотропов.
Объектом настоящего изобретения является также способ получения соединений формулы II, отличающийся тем, что соединение общей формулы III

подвергают взаимодействию с производным угольной кислоты XlX2C=O, где X1 и Х2 имеют одинаковые или разные значения и независимо друг от друга могут представлять собой хлор, ОССl3, ОСН3, ОСН2СН3 или связанный через азот имидазолил, соответственно триазолил.
Поскольку применение фосгена (Х1, X2 представляют собой Сl) в качестве реагента связано с определенными проблемами, в качестве реакционноспособного эквивалента угольной кислоты предпочтительно использовать простой в обращении с ним дифосген (X1 представляет собой Сl, Х представляет собой ОССl3). Вместе с тем пригодны и простые в обращении с ними диметилкарбонат или диэтилкарбонат и указанные N-содержащие эквиваленты угольной кислоты, такие, например, как карбонилдиимидазол.
Подобную реакцию можно эффективно проводить и при кислотном, и при основном катализе. Кислотными катализаторами могут служить указанные выше кислоты Бренстеда или Льюиса. Для применения в качестве основных катализаторов пригодны прежде всего алкоголяты щелочных металлов, образованные С1-С4спиртами, такие, например, как метоксид либо этоксид натрия или же трет-бутилат калия.
Еще один возможный вариант способа получения соединений формулы I, где Х представляет собой NH, отличается тем, что нитрил 2-гидрокси-4-метилтиомасляной кислоты формулы IV
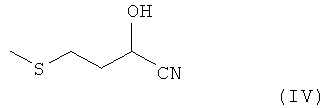
подвергают в присутствии кислоты и ангидрида карбоновой кислоты взаимодействию с карбонильным соединением R1R2С=O, где R1 и R2 имеют указанные выше значения. Преимущество этого варианта состоит в возможности избежать необходимости в образовании предшественника амида 2-гидрокси-4-метилтиомасляной кислоты (ГАМ-амида).
В подобном варианте осуществления предлагаемого в изобретении способа в качестве кислоты предпочтительно использовать серную кислоту и/или уксусную кислоту, а в качестве ангидрида карбоновой кислоты - уксусный ангидрид.
Преимущество всех рассмотренных выше вариантов осуществления предлагаемого в изобретении способа состоит в возможности их проведения простым путем и в возможности получения целевых продуктов с выходом отчасти от высокого до очень высокого.
Ниже изобретение более подробно поясняется на примерах, не ограничивающих его объем.
Примеры
Пример 1: Получение 5-(2-(метилтио)этил)-1,3-диоксолан-4-она (соединение 2) из кальциевой соли 2-гидрокси-4-(метилтио)бутановой кислоты (соединение 1) и раствора формалина при катализе кислотой Бренстеда в двухфазной смеси
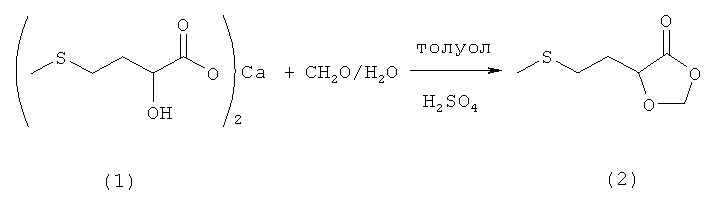
В 500-миллилитровой трехгорлой круглодонной колбе 10,0 г (29,5 ммоля) кальциевой соли 2-гидрокси-4-(метилтио)бутановой кислоты (соединение 1) добавляли в 150 мл воды и 150 мл толуола и смешивали с 3,5 г (34,6 ммоля) 97%-ной серной кислоты. После добавления 50 г (0,58 моля, 19,6 экв.) 37%-ного раствора формалина смесь нагревали до температуры кипения и перемешивали в течение 16 ч при этой температуре. После охлаждения фазы разделяли и водную фазу дважды промывали толуолом порциями по 50 мл. Объединенные органические фазы однократно промывали 50 мл раствора NaCl, сушили над MgSO4 и концентрировали на роторном испарителе. Затем полученный сырой продукт подвергали перегонке (tкип 125°C при давлении 1,5 мбар). Таким путем получили 7,7 г (47,6 ммоля, выход 81%) 5-(2-(метилтио)этил)-1,3-диоксолан-4-она (соединение 2) в виде бесцветной жидкости.
1Н-ЯМР 5-(2-(метилтио)этил)-1,3-диоксолан-4-она (соединение 2) (500 МГц, CDCl3): δ=2,02-2,21 (m, 2H, CH2); 2,12 (s, 3H, SСН3); 2,62-2,72 (m, 2H, SCH2); 4,39-4,41 (m, 1H, CH); 5,44 (s, 1H, CH); 5,55 (s, 1H, CH).
13С-ЯМР 5-(2-(метилтио)этил)-1,3-диоксолан-4-она (соединение 2) (125 МГц, CDCl3): δ=15,29 (SСН3); 29,38 (SCH2); 29,74 (СН2); 71,49 (CH); 94,26 (ОСН2О); 172,80 (С=O).
Элементный анализ для С6Н10О3S (M=162,21 г/моль): рассчитано: С 44,43, Н 6,21, S 19,77; обнаружено: С 44,22, Н 6,36, S 19,69.
Пример 2: Получение 5-(2-(метилтио)этил)-1,3-диоксолан-4-она (соединение 2) из 2-гидрокси-4-(метилтио)бутановой кислоты (соединение 3) и триоксана или параформальдегида при катализе кислотой Бренстеда
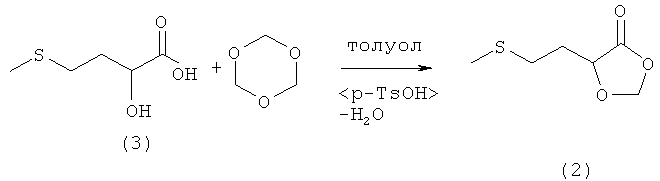
В 100-миллилитровой трехгорлой круглодонной колбе 5,0 г (33,3 ммоля) 2-гидрокси-4-(метилтио)бутановой кислоты (соединение 3) и 5,0 г (55,5 ммоля, 1,67 экв.) 1,3,5-триоксана (в другом варианте 5,0 г параформальдегида) добавляли в 50 мл толуола, смешивали со взятой на кончике шпателя паратолуолсульфокислотой и нагревали до кипения. Через 12 ч растворитель отгоняли на роторном испарителе и полученный сырой продукт перегоняли в вакууме. Таким путем получили 4,6 г (28,5 ммоля, выход 86%) 5-(2-(метилтио)этил)-1,3-диоксолан-4-она (соединение 2) в виде бесцветной жидкости. Данные ЯМР-анализа совпадали с таковыми из примера 1.
Пример 3: Получение 2,2-диметил-5-(2-(метилтио)этил)-1,3-диоксолан-4-она (соединение 4) из 2-гидрокси-4-(метилтио)бутановой кислоты (соединение 3) и ацетона при катализе кислотой Бренстеда
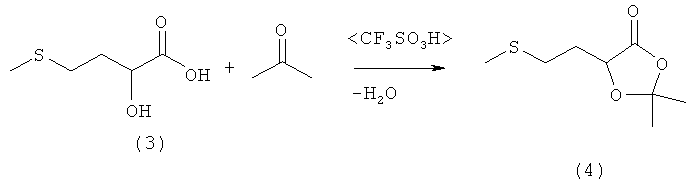
В 250-миллилитровой трехгорлой круглодонной колбе 5,0 г (33,3 ммоля) 2-гидрокси-4-(метилтио)бутановой кислоты (соединение 3) добавляли в 100 мл ацетона, смешивали с несколькими каплями трифторметансульфокислоты или серной кислоты и перемешивали в течение 16 ч при комнатной температуре. Затем реакционную смесь концентрировали на роторном испарителе, остаток растворяли в 100 мл диэтилового эфира и дважды экстрагировали насыщенным раствором NaCl порциями по 25 мл. Далее эфирную фазу сушили над MgSO4 и концентрировали на роторном испарителе, после чего полученный сырой продукт перегоняли в вакууме на колонке Вигре (tкип 122°С при давлении 1 мбар). Таким путем получили 5,2 г (27,4 ммоля, выход 82%) 2,2-диметил-5-(2-(метилтио)этил)-1,3-диоксолан-4-она (соединение 4) в виде бесцветного масла.
1Н-ЯМР 2,2-диметил-5-(2-(метилтио)этил)-1,3-диоксолан-4-она (соединение 4) (500 МГц, СDCl3): δ=1,55 (s, 3Н, СН3); 1,61 (s, 3H, СН3); 1,95-2,20 (m, 2H, CH2); 2,11 (s, 3Н, SСН3); 2,62-2,66 (m, 2H, SCH2); 4,55 (dd, 3J=7,5 Гц, 2J=4,4 Гц, 1Н, СН).
13С-ЯМР 2,2-диметил-5-(2-(метилтио)этил)-1,3-диоксолан-4-она (соединение 4) (125 МГц, CDCl3): δ=14,96 (SCH3); 25,46 (СН3); 26,92 (СН3); 29,04 (CH2); 30,73 (CH2); 72,18 (СН); 110,37 (С); 172,68 (С=O).
Элементный анализ для С8Н14О3S (M=190,26 г/моль): рассчитано: С 50,50, Н 7,42, S 16,85; обнаружено: С 50,28, Н 7,63, S 16,88.
Пример 4: Получение 2,2-диметил-5-(2-(метилтио)этил)-1,3-диоксолан-4-она (соединение 4) из 2-гидрокси-4-(метилтио)бутановой кислоты (соединение 3) и ацетона при катализе кислотой Льюиса
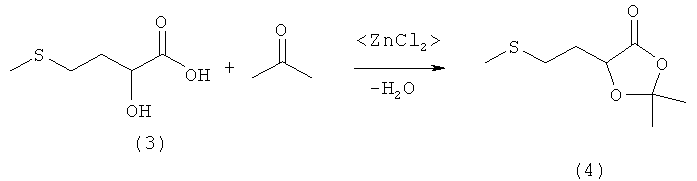
В 100-миллилитровой трехгорлой круглодонной колбе 5,0 г (33,3 ммоля) 2-гидрокси-4-(метилтио)бутановой кислоты (соединение 3) добавляли в 20 мл ацетона, смешивали с 1,0 экв. кислоты Льюиса (893 мг ZnCl2, в других вариантах 1,69 г MgBr2·2Et2O или 1,38 г ВF3·2Н2O) и перемешивали в течение 16 ч при комнатной температуре. Затем реакционную смесь концентрировали на роторном испарителе, остаток растворяли в 100 мл диэтилового эфира и промывали 50 мл воды и дважды насыщенным раствором порциями по 25 мл. Далее эфирную фазу сушили над MgSO4 и концентрировали на роторном испарителе, после чего полученный сырой продукт перегоняли в вакууме в трубке с шаровым расширением. Таким путем получили 1.1 г (5,8 ммоля, выход 87%) 2,2-диметил-5-(2-(метилтио)этил)-1,3-диоксолан-4-она (соединение 4) в виде бесцветного масла. Данные ЯМР-анализа совпадают с таковыми из примера 3.
Пример 5: Получение 2,2-диметил-5-(2-(метилтио)этил)-1,3-диоксолан-4-она (соединение 4) из 2-гидрокси-4-(метилтио)бутановой кислоты (соединение 3) и ацетона путем перекетализации
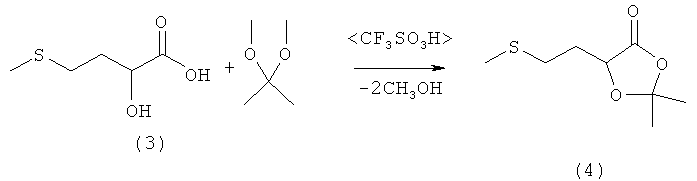
В 100-миллилитровой трехгорлой круглодонной колбе 5,0 г (33,3 ммоля) 2-гидрокси-4-(метилтио)бутановой кислоты (соединение 3) и 5,0 г (48,0 ммолей, 1,44 экв.) 2,2-диметоксипропана добавляли в 50 мл тетрагидрофурана и нагревали до кипения. Через 3 ч растворитель отгоняли на роторном испарителе, после чего полученный сырой продукт перегоняли в вакууме. Таким путем получили 5,6 г (29,7 ммоля, выход 89%) 2,2-диметил-5-(2-(метилтио)этил)-1,3-диоксолан-4-она (соединение 4) в виде бесцветного масла. Данные ЯМР-анализа совпадают с таковыми из примера 3.
Пример 6: Получение 2-этил-2-метил-5-(2-(метилтио)этил)-1,3-диоксолан-4-она (соединение 5) из 2-гидрокси-4-(метилтио)бутановой кислоты (соединение 3) и этилметилкетона
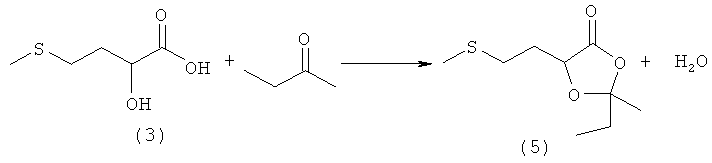
35,0 г (205 ммолей) 88%-ной 2-гидрокси-4-(метилтио)бутановой кислоты (соединение 3) добавляли в 350 мл этилметилкетона и выдерживали при кипячении с обратным холодильником в течение 5 ч. После охлаждения растворитель вместе с образовавшейся водой отгоняли на роторном испарителе и остаток перегоняли в вакууме (tкип 103°С при давлении 0,4 мбара). Таким путем получили 26,5 г (выход 56%) 2-этил-2-метил-5-(2-(метилтио)этил)-1,3-диоксолан-4-она (соединение 5) в виде бесцветной жидкости. Отогнанный этилметилкетон сушили над MgSO4, после чего его можно было повторно использовать в последующей реакции.
1H-ЯМР 2-этил-2-метил-5-(2-(метилтио)этил)-1,3-диоксолан-4-она (соединение 5) (смесь диастереомеров в соотношении 63:37) (500 МГц, CDCl3): δ=0,96-1,00 (m, 3Н, СН3); 1,52, 1,56 (s, 3H, СН3); 1,80-1,88 (m, 2H, CH2); 1,97-2,18 (m, 2H, СН2); 2,11 (s, 3Н, SСН3); 2,63-2,67 (m, 2H, СH2); 4,54-4,58 (m, 1H, CH).
13С-ЯМР 2-этил-2-метил-5-(2-(метилтио)этил)-1,3-диоксолан-4-она (соединение 5) (смесь диастереомеров в соотношении 63:37) (125,8 МГц, СDСl3): δ=7,23, 7,87 (СН3); 15,24 (SСН3); 23,86. 25,09 (СН2); 29,34, 29,51, 30,97, 31,54, 32,42, 32,60 (СН3, 2×СН2); 72,25, 73,00 (CH); 112,29, 112,83 (С); 173,04, 173,09 (С=O).
Элементный анализ для С9Н16О3S (M=204,29 г/моль): рассчитано: С 52,91, Н 7,89, S 15,70; обнаружено: С 53,04, Н 8,02, S 15,46.
Пример 7: Получение 2-трет-бутил-5-(2-(метилтио)этил)-1,3-диоксолан-4-она (соединение 6) из кальциевой соли 2-гидрокси-4-(метилтио)бутановой кислоты (соединение 1) и пивалинового альдегида при катализе кислотой Бренстеда
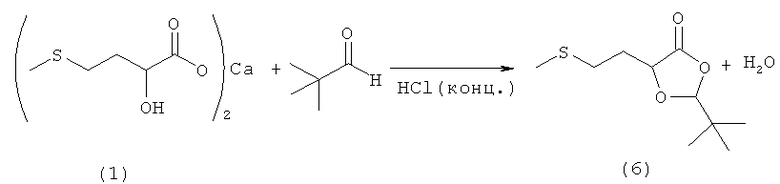
6,77 г (20 ммолей) кальциевой соли 2-гидрокси-4-(метилтио)бутановой кислоты (соединение 1) при перемешивании и охлаждении льдом медленно смешивали с 13,8 г концентрированной соляной кислоты. При этом образовывался прозрачный раствор. Затем к этому раствору в атмосфере защитного газа добавляли 15 мл толуола и 3,45 г (40 ммолей) свежеперегнанного пивалинового альдегида и нагревали до 75°С, при этом двухфазная смесь становилась прозрачной. Далее смесь в течение 7 ч перемешивали при указанной температуре. После охлаждения образовывались две фазы. Органическую толуольную фазу отделяли, а водную фазу дважды промывали толуолом порциями по 10 мл. Объединенные органические фазы трижды промывали водой порциями по 15 мл, сушили над Na2SO4 и после фильтрации концентрировали на роторном испарителе. В завершение из полученного сырого продукта в высоком вакууме удаляли последние остатки растворителя. Таким путем получили 2,62 г (12,0 ммолей, выход 30%) 2-трет-бутил-5-(2-(метилтио)этил)-1,3-диоксолан-4-она (соединение 6) в виде слегка желтоватого масла.
lH-ЯMP 2-трет-бутил-5-(2-(метилтио)этил)-1,3-диоксолан-4-она (соединение 6) (смесь диастереомеров) (500 МГц, СDСl3): δ=0,96, 0,98 (s, 9H, СН3); 1,99-2,22 (m, 2H, CH2); 2,09 (s, 3H, SCH3); 2,64-2,69 (m, 2H. CH2); 4,43-4,46, 4,51-4,54 (m, 1H, CH); 5,15, 5,28 (s, 1H, CH).
13С-ЯМР 2-трет-бутил-5-(2-(метилтио)этил)-1,3-диоксолан-4-она (соединение 6) (смесь диастереомеров) (125,8 МГц, СDСl3): δ=15,21, 15,25 (SCH3); 23,24, 23,44 (СН3); 29,37, 29,39, 30,22, 30,33, 34,24, 35,74 (С, 2×СН2); 73,15, 73,42 (CH); 109,43, 110.46 (CH); 173,17, 173,27 (С=O).
Элементный анализ для С10Н18О3S (M=218,31 г/моль): рассчитано: С 55,01, Н 8,33, S 14,69; обнаружено: С 55,36, Н 8.52, S 14,23.
Пример 8: Получение 3-(2-(метилтио)этил)-1,4-диоксаспиро[4.5]декан-2-она (соединение 7) из 2-гидрокси-4-(метилтио)бутановой кислоты (соединение 3) и циклогексанона
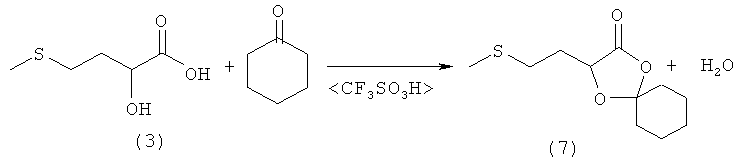
В 250-миллилитровой трехгорлой круглодонной колбе 10,0 г (66,6 ммоля) 2-гидрокси-4-(метилтио)бутановой кислоты (соединение 3) и 13,1 г (133,2 ммоля, 2,0 экв.) циклогексанона добавляли в 100 мл ТГФ, смешивали с несколькими каплями трифторметансульфокислоты и перемешивали в течение 16 ч при комнатной температуре. Затем реакционную смесь концентрировали на роторном испарителе. Полученный остаток растворяли в 100 мл смеси из 10 мл дихлорметана и 90 мл н-гексана и промывали дважды водой порциями по 50 мл и однократно насыщенным раствором NaCl порцией 50 мл. Органическую фазу затем сушили над MgSO4 и концентрировали на роторном испарителе. Далее полученный сырой продукт хроматографировали на силикагелевой колонке, используя смесь н-гексан/этилацетат в соотношении 15:1. После концентрирования на роторном испарителе под высоким вакуумом удаляли последние остатки растворителя. Таким путем получили 11,2 г (48,6 ммоля, выход 73%) 3-(2-(метилтио)этил)-1,4-диоксаспиро[4.5]декан-2-она (соединение 7) в виде бесцветной жидкости.
1Н-ЯМР 3-(2-(метилтио)этил)-1,4-диоксаспиро[4.5]декан-2-она (соединение 7) (500 МГц, CDCl3): δ=1,38-1,88 (m, 10Н, 5×CH2); 1,96-2,20 (m, 2H, CH2); 2,11 (s, 3Н, SСН3); 2,65 (t, 3J=7,4 Гц, 2H, SСH2; 4,55 (dd, 3J=7,6, 2J=4,5 Гц, 1Н, CH).
13С-ЯМР 3-(2-(метилтио)этил)-1,4-диоксаспиро[4.5]декан-2-она (соединение 7) (125,8 МГц, CDCl3): δ=22,86 (SCH3); 23,00 (СH2); 24,50 (CH2); 29,38 (SCH2); 31,13 (CH2); 35,24 (СH2); 36,77 (СН2); 72,25 (CH); 111,49 (С); 173,07 (С=O).
Пример 9: Получение 5-(2-(метилтио)этил)-1,3-диоксолан-2,4-диона (соединение 8) из 2-гидрокси-4-(метилтио)бутановой кислоты (соединение 3) и дифосгена
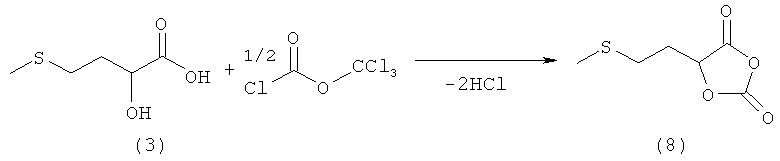
В 50-миллилитровой колбе Шленка 1,5 г (10,0 ммолей) 2-гидрокси-4-(метилтио)бутановой кислоты (соединение 3) добавляли в 10 мл сухого ТГФ и к полученной смеси в атмосфере аргона в течение 15 мин добавляли 1,5 мл (12,0 ммолей) дифосгена. После добавления 30 мг активированного угля реакционную смесь перемешивали в течение 12 ч при комнатной температуре. Затем реакционный раствор фильтровали через слой целита, концентрировали при комнатной температуре на роторном испарителе и в течение 4 ч сушили под высоким вакуумом. Таким путем получили 1,1 г (9,7 ммоля, выход 97%) 5-(2-(метилтио)этил)-1,3-диоксолан-2,4-диона (соединение 8) в виде желтоватого масла.
1H-ЯМР 5-(2-(метилтио)этил)-1,3-диоксолан-2,4-диона (соединение 8) (500 МГц CDCl3): δ=2,10 (s, 3Н, SСН3); 2,20-2,40 (m, 2Н, СН2); 2,60-2,80 (m, 2H, SCH2); 5.20-5,30 (m, 1H, CH).
Пример 10: Получение 2,2-диметил-5-(2-(метилтио)этил)оксазолидин-4-она (соединение 10) из амида 2-гидрокси-4-(метилтио)бутановой кислоты (соединение 9) и ацетона при катализе кислотой Бренстеда
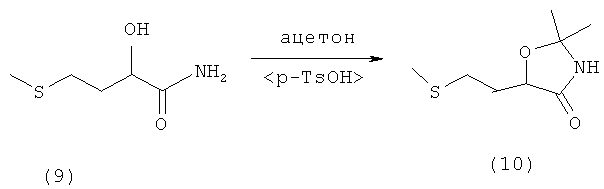
В 250-миллилитровой трехгорлой колбе с водоотделителем и обратным холодильником 14,9 г (0,1 моля) амида 2-гидрокси-4-(метилтио)бутановой кислоты (соединение 9) добавляли в 150 мл толуола, смешивали с 11,6 г ацетона (0,2 моля) и 0,8 г паратолуолсульфокислоты и при перемешивании медленно нагревали до температуры кипения. При этом мутная суспензия становилась прозрачной при 90°С. Весь раствор в течение 14 ч кипятили с обратным холодильником. При этом толуольную фазу, которую в общей сложности дважды подвергали перегонке, спускали и затем дважды дополняли ацетоном порциями по 11,6 г. После охлаждения мутный реакционный раствор фильтровали и фильтрат промывали однократно разбавленным раствором NаНСО3 порцией 100 мл, дважды Н2О порциями по 100 мл и в завершение однократно насыщенным раствором хлорида натрия порцией 100 мл. Далее толуольную фазу сушили над Na2SO4. После фильтрации растворитель отгоняли под вакуумом на роторном испарителе. Таким путем получили 13,2 г оранжево-коричневого масла, которое медленно кристаллизовалось. Для перекристаллизации добавляли 30 мл н-гексана, кратковременно нагревали до температуры кипения, после чего охлаждали до комнатной температуры и оставляли стоять на ночь. На следующий день выкристаллизовавшееся твердое вещество отфильтровывали и сушили под высоким вакуумом. Таким путем получили 11,5 г (0,06 моля, М=189,28 г/моль, выход 60%) 2,2-диметил-5-(2-(метилтио)этил)оксазолидин-4-она (соединение 10) в виде слегка желтоватого твердого вещества (tпл 84°С).
1H-ЯМР 2,2-диметил-5-(2-(метилтио)этил)оксазолидин-4-она (соединение 10) (500 МГц, ДМСО-d6): δ=1,34 (s, 3Н, СН3); 1.36 (s, 3Н, СН3); 1,73-1,78 (m, 1Н, СН); 1,87-1,92 (m, 1H, CH); 2,04 (s, 3Н, SСН3); 2,48-2,56 (m, 2H, CH2); 4,23-4,28 (m, 1H, CH); 8,83 (шир. s, 1H, NH).
13С-ЯМР 2,2-диметил-5-(2-(метилтио)этил)оксазолидин-4-она (соединение 10) (125,8 МГц, ДМСО-d6): δ=14,50 (SCH3); 28.07, 28,70, 29,10, 31,66 (2×СН2, 2×СН3); 74,53 (CH); 89,60 (С); 171,94 (С=O).
Элементный анализ для C8H15NO2S (M=189,28 г/моль): рассчитано: С 50,76, Н 7,99, N 7,40, S 16,94; обнаружено: С 50,90, Н 8,11, N 7,31, S 16,90.
Пример 11: Получение 2,2-диметил-5-(2-(метилтио)этил)оксазолидин-4-она (соединение 10) из амида 2-гидрокси-4-(метилтио)бутановой кислоты (соединение 9) путем перекетализации
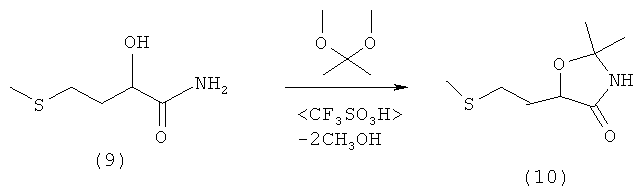
В 250-миллилитровой трехгорлой колбе 10,0 г (67,0 ммолей) амида 2-гидрокси-4-(метилтио)бутановой кислоты (соединение 9) суспендировали в 70 мл сухого тетрагидрофурана и смешивали с 13,96 г (134,0 ммоля, 2,0 экв.) диметоксипропана. После добавления нескольких капель трифторметансульфокислоты реакционную смесь в течение 16 ч перемешивали при комнатной температуре. Затем растворитель удаляли на роторном испарителе при давлении 100 мбар и температуре 30°С. Маслянистый остаток растворяли в 100 мл диэтилового эфира и дважды промывали водой порциями по 50 мл. Эфирную фазу сушили над MgSO4 и концентрировали на роторном испарителе. Полученное твердое вещество затем перекристаллизовывали из 100 мл н-гексана, отфильтровывали и под высоким вакуумом удаляли последние остатки растворителя. Таким путем получили 11,8 г (62 ммоля, выход 93%) 2,2-диметил-5-(2-(метилтио)этил)оксазолидин-4-она (соединение 10) в виде бесцветного твердого вещества. Данные ЯМР-анализа совпадают с таковыми из примера 10.
Элементный анализ для C8H15NO2S (M=189,28 г/моль): рассчитано: С 50,76, Н 7,99, N 7,40, S 16,94; обнаружено: С 50,96, Н 8,14, N 7,31, S 16,88.
Пример 12: Получение 2,2-диметил-5-(2-(метилтио)этил)оксазолидин-4-она (соединение 10) из 1-гидрокси-3-(метилтио)пропанкарбонитрила (соединение 11)
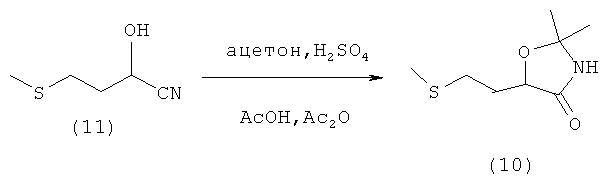
В 100-миллилитровой трехгорлой колбе 13,1 г 96%-ного 1-гидрокси-3-(метилтио)пропанкарбонитрила (соединение 11) (0,1 моля) и 7,0 г ацетона (0,12 моля) при 10°С растворяли в 30 мл ледяной уксусной кислоты. Затем к раствору медленно по каплям добавляли 5 мл ацетангидрида (0,05 моля). После этого при 0°С медленно добавляли смесь из 10 мл концентрированной серной кислоты и 10 мл ледяной уксусной кислоты. При этом необходимо было следить за тем, чтобы температура всего реакционного раствора не поднималась выше 0°С. Таким путем получили вязкую желтоватую суспензию, практически не поддающуюся перемешиванию. По завершении добавления смесь перемешивали сначала в течение 1 ч при 10°С, а затем в течение 15 мин при комнатной температуре. Далее реакционный раствор сливали на лед (примерно 150 г), после чего трижды экстрагировали диэтиловым эфиром порциями по 100 мл. Эфирную фазу однократно промывали насыщенным раствором гидрокарбоната натрия, а затем насыщенным раствором поваренной соли и сушили над сульфатом натрия. Na2SO4 отфильтровывали и диэтиловый эфир отгоняли под вакуумом. Таким путем получили 4,5 г оранжево-коричневого масла, которое перекристаллизовывали из н-гексана. После фильтрации и удаления под высоким вакуумом последних остатков растворителя удалось выделить 2,8 г (14,8 ммоля, М=189,28 г/моль, выход 15%) 2,2-диметил-5-(2-(метилтио)этил)оксазолидин-4-она (соединение 10) в виде слегка желтоватого твердого вещества. Данные ЯМР-анализа совпадают с таковыми из примера 10.
Пример 13: Получение 5-(2-(метилтио)этил)-2-фенилоксазолидин-4-она (соединение 12) из амида 2-гидрокси-4-(метилтио)бутановой кислоты (соединение 9) при кислотном катализе кислотой Бренстеда
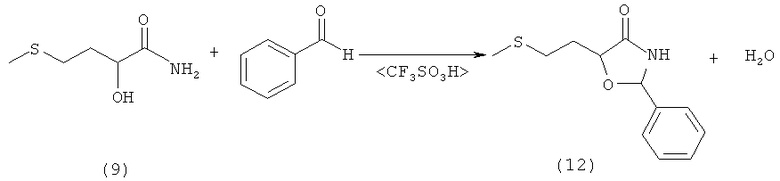
В 100-миллилитровой трехгорлой колбе 5,0 г (33,5 ммоля) амида 2-гидрокси-4-(метилтио)бутановой кислоты (соединение 9) суспендировали в 35 мл сухого тетрагидрофурана и смешивали с 7,1 г (67 ммолей, 2,0 экв.) свежеперегнанного бензальдегида. После добавления нескольких капель трифторметансульфокислоты реакционную смесь в течение 16 ч перемешивали при комнатной температуре. Затем прозрачный раствор концентрировали на роторном испарителе и полученный остаток растворяли в 100 мл диэтилового эфира. Затем промывали трижды водой порциями по 30 мл и однократно насыщенным раствором NaCl порцией 30 мл. Эфирную фазу сушили над MgSO4 и концентрировали на роторном испарителе. Полученную смесь продуктов затем разделяли путем фракционной кристаллизации. Из 100 мл смеси дихлорметан/диэтиловый эфир в соотношении 1:1 в общей сложности выделили 2,8 г твердого вещества, которое затем перекристаллизовывали из диэтилового эфира. Таким путем получили 2,1 г (8,8 ммоля, выход 26%) 5-(2-(метилтио)этил)-2-фенилоксазолидин-4-она (соединение 12) в виде бесцветного твердого вещества (tпл 130°C).
1Н-ЯМР 5-(2-(метилтио)этил)-2-фенилоксазолидин-4-она (соединение 12) (500 МГц, CDCl3): δ=2,00-2,30 (m, 2H, СH2); 2,11 (s, 3H, SСН3); 2,63-2,75 (m, 2H, SCH2); 4,49-4,53 (m, 1H, CH); 6,03-6,05 (m, 1H, CH); 6,24 (шир. s, 1H, NH); 7,40-7,50 (m, 5H, Нфенил).
13С-ЯМР 5-(2-(метилтио)этил)-2-фенилоксазолидин-4-она (соединение 12) (125,8 МГц, CDCl3): δ=19,67 (SCH3); 29,93 (SCH2); 31,74 (CH2); 76,68 (CH); 87,33 (CH); 127,23, 129,28, 130,49, 138,12 (Сфенил); 175,25 (С=O).
Элементный анализ для C12H15NO2S (M=237,32 г/моль): рассчитано: С 60,73, Н 6,37, N 5,90, S 13,51; обнаружено: С 60,61, Н 6,27, N 5,66, S 13,49.
Пример 14: Получение 2-этил-2-метил-5-(2-(метилтио)этил)оксазолидин-4-она (соединение 13) из амида 2-гидрокси-4-(метилтио)бутановой кислоты (соединение 9) при катализе кислотой Бренстеда
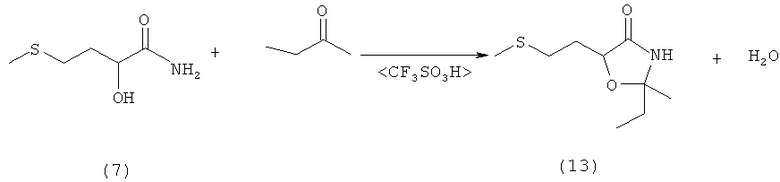
В 100-миллилитровой трехгорлой колбе 5,0 г (33,5 ммоля) амида 2-гидрокси-4-(метилтио)бутановой кислоты (соединение 9) суспендировали в 35 мл сухого тетрагидрофурана и смешивали с 4,8 г (67 ммолей, 2,0 экв.) этилметилкетона. После добавления нескольких капель трифторметансульфокислоты реакционную смесь в течение 5 дней перемешивали при комнатной температуре. Затем прозрачный реакционный раствор концентрировали на роторном испарителе, образовавшийся остаток растворяли в 100 мл диэтилового эфира и промывали трижды водой порциями по 30 мл и однократно насыщенным раствором NaCl порцией 30 мл. Объединенные эфирные фазы сушили над MgSO4, концентрировали на роторном испарителе и остаток дважды перекристаллизовывали из смеси диэтиловый эфир/н-гексан. Таким путем получили 5,1 г (24,9 ммоля, выход 74%) 2-этил-2-метил-5-(2-(метилтио)этил)оксазолидин-4-она (соединение 13) в виде бесцветного твердого вещества (tпл 62°С).
1Н-ЯМР 2-этил-2-метил-5-(2-(метилтио)этил)оксазолидин-4-она (соединение 13) (500 МГц, CDCl3): δ=0,95 (t, 3J=7,4 Гц, 3Н, СН3); 1,44-1,46 (pd, 3Н, СН3); 1,62-1,80 (m, 2Н, CH2); 1,90-2,16 (m, 2H, CH2); 2,12 (s, 3Н, SCH3); 2,60-2,70 (m, 2H, SCH2); 4,42-4,48 (m, 1H, CH); 6,60-6,80 (шир. d, 1H. NH).
13С-ЯМР 2-этил-2-метил-5-(2-(метилтио)этил)оксазолидин-4-она (соединение 13) (125,8 МГц, CDCl3): δ=7,82, 7,97 (СН3); 15,36, 15,37 (SСН3); 26,55, 27,62, 29,55, 29,78, 31,79, 32,42, 34,09, 34,51 (3×СН2, 1×СН3); 75,18, 76,27 (СН); 92,56, 92,81 (С); 174,13, 174,19 (С=O).
Элементный анализ для C9H17NO2S (M=203,30 г/моль): рассчитано: С 53,17, Н 8,43, N 6,89, S 15,77; обнаружено: С 52,46, Н 8,27, N 6,49, S 15,71.
Пример 15: Получение 2-(2-(метилтио)этил)-1-окса-4-азаспиро[4.5] декан-3-она (соединение 14) из амида 2-гидрокси-4-(метилтио)бутановой кислоты (соединение 9) при катализе кислотой Бренстеда
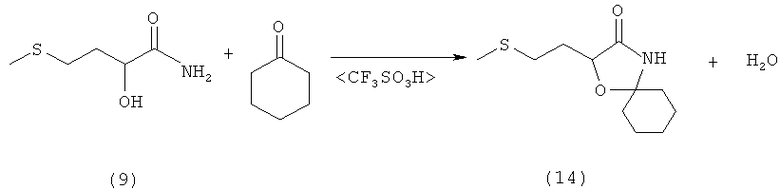
В 250-миллилитровой трехгорлой колбе 10,0 г (67,0 ммолей) амида 1-гидрокси-3-(метилмеркапто)бутановой кислоты (соединение 9) суспендировали в 150 мл сухого толуола и смешивали с 32,9 г (336 ммолей, 5,0 экв.) циклогексанона. После добавления нескольких капель трифторметансульфокислоты реакционную смесь нагревали до кипения и в течение 1 ч перемешивали при этой температуре. Затем реакционный раствор охлаждали и дважды экстрагировали водой порциями по 50 мл. Органическую фазу сушили над MgSO4 и концентрировали на роторном испарителе при давлении 70 мбар и температуре 40°С. Полученное твердое вещество перекристаллизовывали из смеси н-гексан/ЕtOАс, отфильтровывали, сушили и под высоким вакуумом удаляли последние остатки растворителя. Таким путем получили 12,4 г (54 ммоля, выход 80%) 2-(2-(метилтио)этил)-1-окса-4-азаспиро[4.5]декан-3-она (соединение 14) в виде бесцветного твердого вещества (tпл 109°С).
1Н-ЯМР 2-(2-(метилтио)этил)-1-окса-4-азаспиро[4.5]декан-3-она (соединение 14) (500 МГц, CDCl3): δ=1,38-1,80 (m, 10Н, 5×CH2); 1,90-2,18 (m, 2H, СН2); 2,12 (s, 3H, SCH3); 2,64 (t, 3J=7,6 Гц, 2Н, СH2); 4,44 (dd, 3J=7,6 Гц. 2J=2,1 Гц, 1Н, СН); 8,41 (шир. s, 1H, NH).
13С-ЯМР 2-(2-(метилтио)этил)-1-окса-4-азаспиро[4.5]декан-3-она (соединение 14) (125,8 МГц, CDCl3): δ=15,42 (SСН3); 23,02, 23,12, 24,68 (3×СН2); 29,52 (SCH2); 32,30 (СН2); 37,85, 38,93 (2×СН2); 75,33 (СН); 91,98 (С); 174,54 (С=O).
Элементный анализ для C11H19NO2S (M=229,34 г/моль): рассчитано: С 57,61, Н 8,35, N 6,11, S 13,98; обнаружено: С 57,72, Н 8,46, N 5,98, S 13,99.
Пример 16: Получение 5-(2-(метилтио)этил)оксазолидин-2,4-диона (соединение 15) из амида 2-гидрокси-4-(метилтио)бутановой кислоты (соединение 9)
В 250-миллилитровой трехгорлой колбе 5,0 г (33,5 ммоля) амида 1-гидрокси-3-(метилмеркапто)бутановой кислоты (соединение 9) суспендировали в 50 мл метанола, добавляли 10 мл диметилкарбоната и затем смешивали с 9,05 г (168 ммолей, 5,0 экв.) метилата натрия. После этого реакционную смесь нагревали до кипения и в течение 24 ч перемешивали при этой температуре и при нагревании с обратным холодильником. Затем реакционный раствор охлаждали, дважды смешивали со 100 мл холодной воды и трижды экстрагировали трет-бутилметиловым эфиром порциями по 50 мл. Объединенные органические фазы сушили над MgSO4 и концентрировали на роторном испарителе при давлении 15 мбар и температуре 40°С, после чего в течение ночи хранили в холодильнике. Образовавшееся кристаллическое твердое вещество несколько раз перекристаллизовывали из смеси н-гексан/EtOAc. После фильтрации и сушки под высоким вакуумом удаляли последние остатки растворителя. Таким путем получили 2,8 г (12,2 ммоля, выход 36,4%) 5-(2-(метилтио)этил)оксазолидин-2,4-диона (соединение 15) в виде бесцветного твердого вещества.
1Н-ЯМР 5-(2-(метилтио)этил)оксазолидин-2,4-диона (соединение 15) (500 МГц, СDСl3): δ=2,10 (s, 3H, SCH3); 2,20-2,40 (m, 2H, CH2); 2,60-2,80 (m, 2H, SCH2); 5,0-5,2 (m, 1H, СН); 9,1 (шир. s, 1H, NH).
| название | год | авторы | номер документа |
|---|---|---|---|
| КЕТОМЕТИОНИНКЕТАЛИ И ИХ ПРОИЗВОДНЫЕ | 2007 |
|
RU2483062C2 |
| ДИПЕПТИДЫ В КАЧЕСТВЕ КОРМОВЫХ ДОБАВОК | 2010 |
|
RU2536467C2 |
| ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ МЕТИОНИЛМЕТИОНИНА В КАЧЕСТВЕ ДОБАВКИ К КОРМАМ ДЛЯ РЫБ И РАКООБРАЗНЫХ | 2009 |
|
RU2599783C2 |
| СПОСОБ ПОЛУЧЕНИЯ КЕТОКИСЛОТ И ИХ ПРОИЗВОДНЫХ | 2008 |
|
RU2536046C2 |
| ИНГИБИТОРЫ ПРЕНИЛТРАНСФЕРАЗ | 1997 |
|
RU2186776C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЦИКЛИЧЕСКИХ ДИКЕТОНОВ | 2003 |
|
RU2316544C2 |
| НОВЫЕ ТРИАРИЛИМИДАЗОЛЫ | 2004 |
|
RU2372346C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДИСКОДЕРМОЛИДА И ЕГО АНАЛОГОВ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 2001 |
|
RU2283309C2 |
| СОЕДИНЕНИЯ 6-АМИНО-1Н-ИНДАЗОЛА И 4-АМИНОБЕНЗОФУРАНА В КАЧЕСТВЕ ИНГИБИТОРОВ ФОСФОДИЭСТЕРАЗЫ 4 | 2003 |
|
RU2354648C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2'-ФТОР-2'-АЛКИЛЗАМЕЩЕННЫХ ИЛИ ДРУГИХ ЗАМЕЩЕННЫХ РИБОФУРАНОЗИЛПИРИМИДИНОВ И ПУРИНОВ И ИХ ПРОИЗВОДНЫХ | 2005 |
|
RU2433124C2 |
Данное изобретение относится к новому соединению общей формулы (I)

в которой Х представляет собой О или NR, где R обозначает Н, а R1 и R2 имеют одинаковые или разные значения и независимо друг от друга представляют собой Н, необязательно разветвленный C1-С6алкил, С3-С6циклоалкил, фенил, или R1 и R2 оба вместе представляют собой необязательно замещенную C1-С6алкилом С2-С6алкиленовую группу, а также к способам получения этого соединения, кормовым смесям на основе этих соединений для кормления пользовательных животных и применению их для кормления птицы, свиней, жвачных, рыб или ракообразных. 6 н. и 19 з.п. ф-лы, 16 пр.
1. Химическое соединение общей формулы I
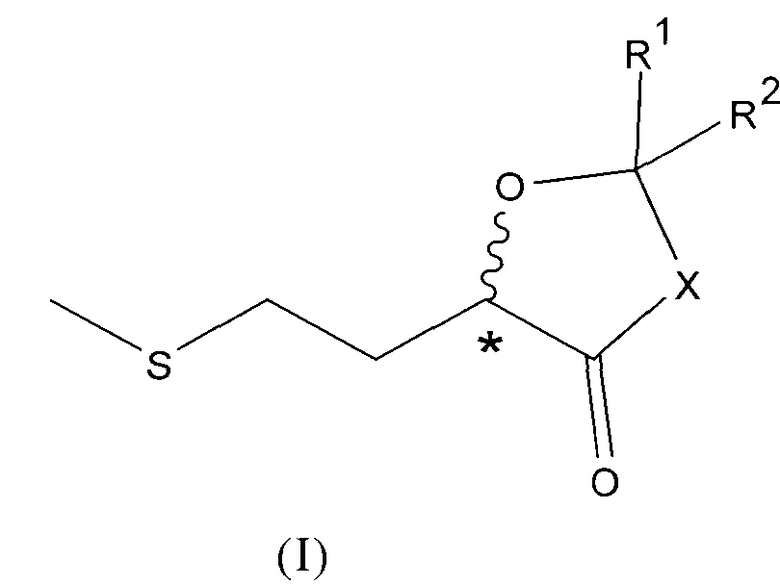
в которой
Х представляет собой О или NR, где R представляет собой Н, а
R1 и R2 имеют одинаковые или разные значения и независимо друг от друга представляют собой Н, необязательно разветвленный C1-C6алкил,
C3-C6циклоалкил, фенил, или R1 и R2 совместно обозначают C2-C6алкиленовую группу.
2. Соединение формулы I по п.1, отличающееся тем, что Х представляет собой О.
3. Соединение по п.2, отличающееся тем, что R1 и R2 обозначают Н.
4. Соединение по п.2, отличающееся тем, что R1 обозначает Н, а R2 обозначает трет-бутил.
5. Соединение по п.2, отличающееся тем, что R1 обозначает Н, а R2 обозначает фенил.
6. Соединение по п.2, отличающееся тем, что каждый из R1 и R2 обозначает необязательно разветвленный C1-C6алкил.
7. Соединение по п.6, отличающееся тем, что R1 и R2 обозначают CH3.
8. Соединение по п.2, отличающееся тем, что R1 и R2 совместно обозначают (CH2)5.
9. Соединение формулы I по п.1, отличающееся тем, что Х представляет собой NH.
10. Соединение по п.9, отличающееся тем, что R1 и R2 обозначают Н.
11. Соединение по п.9, отличающееся тем, что R1 обозначает Н, а R2 обозначает фенил.
12. Соединение по п.9, отличающееся тем, что каждый из R1 и R2 обозначает необязательно разветвленный C1-C6алкил.
13. Соединение по п.12, отличающееся тем, что R1 и R2 обозначают CH3.
14. Соединение по п.12, отличающееся тем, что R1 обозначает CH3, а R2 обозначает С2Н5.
15. Соединение по п.2, отличающееся тем, что R1 и R2 совместно обозначают (CH2)5.
16. Применение соединений по одному из пп.1-15 для кормления птицы, свиней, жвачных, рыб или ракообразных.
17. Кормовые смеси для кормления пользовательных животных по п.16, содержащие по меньшей мере одно соединение по одному из пп.1-15.
18. Применение соединений по одному из пп.1-15 для получения кормовых смесей, предназначенных для кормления пользовательных животных по п.16.
19. Способ получения соединений формулы I по п.1, отличающийся тем, что соединение общей формулы III
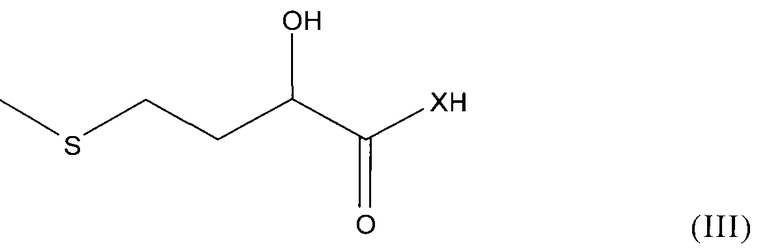
подвергают, необязательно в присутствии растворителя, взаимодействию с карбонильным соединением R1R2C=O в свободном или ацетализированном виде, при этом каждый из X, R1 и R2 имеет указанные в п.1 значения.
20. Способ по п.19, отличающийся тем, что в качестве катализатора используют кислоту Льюиса или кислоту Бренстеда.
21. Способ по п.20, отличающийся тем, что в качестве катализатора используют HCl, H2SO4, паратолуолсульфокислоту, CF3SO3H, ZnCl2, CuSO4, FeCl3, AlCl3, MgCl2 или MgBr2.
22. Способ по одному из пп.19-21, отличающийся тем, что применяют диметил- или диэтилацеталь соединения R1R2C=O.
23. Способ по одному из пп.19-22, отличающийся тем, что образующуюся в ходе реакции воду или образующийся в ходе реакции спирт удаляют.
24. Способ получения соединений формулы I по п.1, где Х представляет собой NH, отличающийся тем, что гидроксинитрил формулы IV
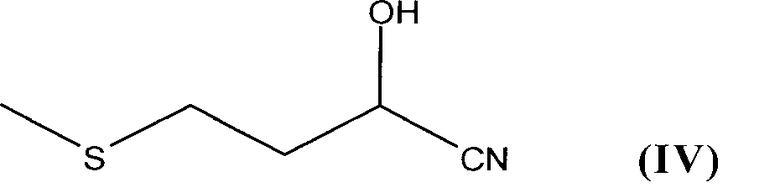
подвергают в присутствии кислоты или ангидрида карбоновой кислоты взаимодействию с карбонильным соединением R1R2C=O, где R1 и R2 имеют указанные в п.1 значения.
25. Способ по п.24, отличающийся тем, что в качестве кислоты используют серную кислоту и/или уксусную кислоту, а в качестве ангидрида карбоновой кислоты используют уксусный ангидрид.
| Устройство бункерного силоса с механизированной выгрузкой загружаемого материала | 1932 |
|
SU28835A1 |
| Hidetoshi Tokuyama et al, Synthesis, 2002,Bd.8,p.1121-1123 | |||
| Способ получения 2-окси-4-(метилтио)-масляной кислоты | 1984 |
|
SU1428193A3 |
| Способ откорма сельскохозяйственной птицы | 1985 |
|
SU1313410A1 |
| 0 |
|
SU402176A1 | |
Авторы
Даты
2014-05-20—Публикация
2008-12-01—Подача