Настоящее изобретение относится к новым способам химического синтеза метионилметионина, который является дипептидом метионина, и к его особому применению в качестве кормовой добавки индивидуально или в смеси с метионином для кормления рыб и ракообразных.
Уровень техники
Незаменимые аминокислоты, такие как метионин, лизин или треонин, являются в качестве кормовых добавок важным компонентом питания животных и играют решающую роль при промышленном выращивании пользовательных животных, таких, например, как куры, свиньи и жвачные. Дополнение природных источников белка, таких, например, как соя, кукуруза и пшеница, подобными незаменимыми аминокислотами позволяет, во-первых, ускорить рост животных, соответственно повысить лактацию у высокопродуктивных молочных коров, а во-вторых, повысить эффективность усвоения корма. В этом состоит значительное экономическое преимущество. Рынки кормовых добавок имеют большое промышленное и хозяйственное значение. Помимо этого спрос на кормовые добавки постоянно повышается и на развивающихся рынках, что не в последнюю очередь объясняется возрастающей ролью в мире таких стран, как, например, Китай и Индия.
L-Метионин ((S)-2-амино-4-метилтиомасляная кислота) является для многих видов животных, таких как куры, утки, индейки, а также для многих видов рыб, моллюсков и ракообразных, первой лимитирующей аминокислотой и поэтому играет исключительно важную роль в рационе питания животных и в качестве кормовой добавки (Rosenberg и др., J. Agr. Food Chem., 5, 1957, сс.694-700, и, Lovell T.R., J.Anim. Sci., 69, 1991, cc.4193-4200). Однако при классическом химическом синтезе метионин образуется в виде рацемата, представляющего собой смесь из D- и L-метионинов в соотношении 50:50. Такой рацемический DL-метионин, однако, можно использовать непосредственно в качестве кормовой добавки, поскольку у животных некоторых видов в условиях in vivo существует механизм превращения неприродного D-энантиомера метионина в его природный L-энантиомер. При этом сначала происходит дезаминирование D-метионина под действием неспецифической D-оксидазы в α-кетометионин, который затем под действием L-трансаминазы превращается в L-метионин (Baker D.H., "Amino acids in farm animal nutrition", под ред. D'Mello J.P.F., Wallingford (UK), CAB International, 1994, cc.37-61). Таким путем в организме повышается доступное количество L-метионина, который затем может использоваться в организме животного для его роста. Ферментативное превращение D-метионина в L-метионин было обнаружено у кур, свиней и коров, но прежде всего и у плотоядных и всеядных рыб, а также у морских и пресноводных креветок. Так, например, по результатам исследований Sveier и др. (Aquacult. Nutr., 7 (3), 2001, cc.169-181) и Kim и др. (Aquaculture, 101 (1-2), 1992, cc.95-103) было установлено, что превращение D-метионина в L-метионин возможно у плотоядных атлантических лососей и радужных форелей. То же самое удалось обнаружить Robinson и др. (J. Nutr., 108 (12), 1978, сс.1932-1936) и Schwarz и др. (Aquaculture, 161, 1998, сс.121-129) у всеядных видов рыб, таких, например, как сомообразные и карповые. Помимо этого Forster и Dominy (J.World Aquacult. Soc, 37 (4), 2006, cc.474-480) в экспериментах с кормлением всеядных морских креветок вида Litopenaeus vannamei установили, что DL-метионин обладает такой же эффективностью, что и L-метионин.
В 2007 г. во всем мире было произведено свыше 700000 тонн кристаллического DL-метионина, соответственно рацемического жидкого гидроксианалога метионина (ГАМ, рац-2-гидрокси-4-(метилтио)масляная кислота (ГМБ)) и твердого ГАМ в виде его кальциевой соли и успешно использовалось непосредственно в качестве кормовой добавки при разведении животных с однокамерным желудком, таких, например, как сельскохозяйственная птица и свиньи. В результате стремительного экономического развития рыбоводства и разведения ракообразных в высокиндустриальных аквакультурах в последние годы постоянно возрастает значение той роли, которую именно в этой области играет возможность оптимального, экономичного и эффективного дополнения рациона питания животных метионином (Food and Agriculture Organization of the United Nation (FAO) Fisheries Department, "State of World Aquaculture 2006", 2006, Рим; International Food Policy Research Institute (IFPRI), "Fish 2020: Supply and Demand in Changing Markets", 2003, Вашингтон, округ Колумбия). При этом, однако, в отличие от сельскохозяйственной птицы и свиней при применении метионина, ГАМ или Са-ГАМ в качестве добавки к кормам для определенных видов рыб и ракообразных можно столкнуться с различными проблемами. Так, в частности, в публикации Rumsey и Ketola (J.Fish. Res. Bd. Can., 32, 1975, cc.422-426) говорится, что применение соевой муки в сочетании с индивидуально добавленными, кристаллическими аминокислотами не приводило к усилению роста радужных форелей. По результатам исследований, проведенных Murai и др. (Bull. Japan. Soc. Sci. Fish., 50 (11), 1984, с.1957), удалось установить, что ежедневное кормление карповых кормами с высокой долей добавленных к ним кристаллических аминокислот приводило к выведению более 40% свободных аминокислот из организма через жабры и почки. В связи с быстрым всасыванием добавленных аминокислот вскоре после поедания корма происходит очень быстрое повышение концентрации аминокислот в плазме крови рыб ("быстрая реакция"). Однако другие аминокислоты из природных источников белка, таких, например, как соевая мука, к этому моменту еще не находятся в плазме крови, что может привести к асинхронности в одновременной усвояемости всех важных аминокислот. Вследствие этого часть высококонцентрированных аминокислот быстро выводится из организма, соответственно быстро метаболизируется в нем и используется, например, в качестве исключительно источника энергии. В результате этого у карповых при применении кристаллических аминокислот в качестве кормовых добавок происходит лишь незначительное усиление роста, соответственно не происходит никакого усиления роста (Аое и др., Bull. Jap. Soc. Sci. Fish., 36, 1970, cc.407-413). В случае же ракообразных дополнение их корма кристаллическими аминокислотами может привести к возникновению еще и других проблем. В связи с медленным поеданием корма определенными ракообразными, такими, например, как креветки вида Litopenaeus Vannamei, по причине длительного пребывания корма в воде добавленные к нему водорастворимые аминокислоты удаляются из него в результате их растворения (вымывания), что приводит к эвтрофикации водоема, а не к усилению роста животных (Alam и др., Aquaculture, 248, 2005, сс.13-16).
Тем самым метионин для эффективного снабжения им организма рыб и ракообразных, разводимых в аквакультурных хозяйствах, требует для определенных видов животных и определенных условий применения его выпуска в специальной форме, например, в соответствующим образом химически или физически защищенной форме. Преследуемая при этом цель состоит, во-первых, в том, чтобы продукт оставался достаточно стойким в водной среде в процессе кормления животных и не удалялся из корма в результате растворения. Во-вторых, в конечном итоге должна обеспечиваться возможность оптимального и высокоэффективного усвоения метионинового продукта, потребленного животным, его организмом.
Ранее уже предпринимались многочисленные усилия по разработке добавок к кормам для рыб и ракообразных, особенно кормовых добавок на основе метионина. Так, например, в WO 89/06497 описано применение ди- и трипептидов в качестве добавки к кормам для рыб и ракообразных. Такие кормовые добавки должны способствовать росту животных. При этом, однако, использовали преимущественно ди- и трипептиды из заменимых и поэтому также не лимитирующих аминокислот, таких, например, как глицин, аланин и серии. В качестве метионинсодержащих дипептидов в указанной публикации описаны только DL-аланил-DL-метионин и DL-метионил-DL-глицин. Однако по этой причине эффективное содержание действующего вещества в дипептиде составляет лишь 50% (моль/моль), что с экономической точки зрения следует классифицировать как серьезный недостаток. В WO 02/088667 описаны энантиоселективный синтез и применение олигомеров из ГАМ и аминокислот, таких, например, как метионин, в качестве добавок к кормам, в том числе, в частности, и добавок к кормам для рыб и ракообразных. Применение таких кормовых добавок должно обеспечивать возможность ускоренного роста животных. Описанные в указанной публикации олигомеры образуют путем протекающей при ферментативном катализе реакции, получаемые в результате которой индивидуальные олигомеры обладают исключительно широким молекулярно-массовым распределением (полидисперсностью). По указанным причинам подобный способ неизбирателен, дорог и сложен в осуществлении и связан с дорогостоящей и трудоемкой очисткой получаемых им продуктов. У Dabrowski и др. в US 2003/0099689 описано применение синтетических пептидов в качестве кормовых добавок для стимулирования роста водных животных. При этом на массовую долю пептидов может приходиться от 6 до 50% от всей массы кормовой смеси. Такие синтетические пептиды состоят преимущественно из незаменимых и лимитирующих аминокислот. Однако синтез подобных синтетических олиго- и полипептидов исключительно сложен и дорог, а возможность его реализации в промышленном масштабе связана со значительными трудностями. Помимо этого эффективность полипептидов отдельной аминокислоты является спорной, поскольку они часто лишь очень медленно превращаются или вовсе не превращаются в физиологических условиях в свободные аминокислоты. Так, например, у Baker и др. (J. Nutr., 112, 1982, сс.1130-1132) говорится, что поли-L-метионин по причине его полной нерастворимости в воде не обладает никакой биологической ценностью в отношении кур, поскольку его всасывание в их организм невозможно.
Наряду с применением новых химических производных метионина, таких, например, как метионинсодержащие пептиды и олигомеры, исследовались также различные возможности по физической защите метионина, такие, например, как нанесение покрытия на эту аминокислоту, соответственно ее включение в защитную матрицу. Так, например, Alam и др. (Aquacult. Nutr., 10, 2004, сс.309-316, и Aquaculture, 248, 2005, сс.13-19) установили, что снабженные покрытием метионин и лизин в отличие от таковых без покрытия оказывают исключительно положительное влияние на рост молодых креветок курума (Marsupenaeus japonicus). Хотя применение специального покрытия и позволило предотвратить вымывание метионина и лизина из кормовых гранул, тем не менее подобному подходу присущи некоторые серьезные недостатки. Получение метионина, соответственно нанесение на него покрытия в большинстве случаев является технически сложным и трудоемким процессом и поэтому связано с высокими затратами. Помимо этого покрытие, нанесенное на окончательно снабженный им метионин, может легко повреждаться от механической нагрузки и истирания при переработке кормов, что может привести к снижению эффективности физической защиты метионина или даже к полной ее утрате. К этому же следует добавить, что покрытие или применение матрицы снижает содержание метионина и поэтому часто является неэкономичным.
Наряду с предлагаемым в изобретении применением DL-метионил-DL-метионина по новому назначению в качестве кормовой добавки с низкой вымываемостью из кормовых гранул и экструдатов, а также наряду с оптимальным поступлением метионина в организм благодаря медленному высвобождению метионина в результате расщепления метионилметионина удалось также разработать новые способы его получения, которые обладают многими преимуществами перед описанными в литературе способами. Большинством известных из литературы методов синтеза дипептидов предусмотрено применение дорогих защитных групп, таких, например, как Вос-(трет-бутоксикарбонильная) или Z-(бензилоксикарбонильная) защитные группы, которые перед собственно синтезом дипептидов вводят в молекулу соответствующей аминокислоты и которые затем требуется вновь отщеплять. Помимо этого в большинстве случаев необходимо активирование подвергаемых сочетанию аминокислот. Так, в частности, получение метионилметионина возможно путем сочетания N-Boc-метионина с метиловым эфиром метионина с помощью дициклогексилкарбодиимида (ДЦК). Существенные недостатки подобного способа получения метионилметионина состоят в применении дорогих защитных групп, в высоких затратах на синтез и в использовании не утилизируемых и дорогих агентов сочетания, таких, например, как ДЦК. Другой альтернативный подход к техническому синтезу метионилметионина описан в DE 2261926. Путем нагревания изопропилового эфира метионина на первой стадии получают 3,6-бис-[2-(метилтио)этил]-2,5-пиперазиндион (метиониндикетопиперазин, ДКП), который затем можно омылять до метионилметионина. При этом на стадии омыления удавалось достичь лишь удовлетворительного выхода продукта порядка 62-65%. Помимо этого применение изопропилового эфира метионина в качестве исходного материала связано с высокими затратами из-за его высокой стоимости и поэтому нерентабельно.
Задача изобретения
В основу настоящего изобретения была положена задача в первую очередь предложить кормовое средство, соответственно кормовую добавку для применения в рационе питания животных на основе нового заменителя метионина, которое, соответственно которую можно было использовать индивидуально или в виде смеси с метионином особенно в области промышленного разведения рыб и ракообразных в аквакультурах. Одновременно с этим требовалось разработать простой и экономичный способ химического синтеза такого нового заменителя метионина.
С учетом описанных выше недостатков, присущих уровню техники, задача изобретения заключалась прежде всего в разработке химически защищенного метионинового продукта для применения в рационе питания различных видов всеядных, растительноядных и плотоядных рыб и ракообразных, обитающих в морской или пресной воде. Такой продукт должен в первую очередь характеризоваться низкой растворимостью (вымываемостью) в воде во избежание его удаления из всей кормовой гранулы, соответственно всего кормового экструдата и обладать механизмом медленного высвобождения, т.е. медленным и непрерывным высвобождением свободного метионина в физиологических условиях. Помимо этого подобный новый метиониновый продукт должен также допускать возможность его эффективного применения в виде смеси с DL-метионином.
Еще одна задача изобретения заключалась в том, чтобы предложить заменитель метионина в качестве кормового средства, соответственно кормовой добавки, который помимо исключительно высокой биологической ценности и биологической доступности был бы простым в обращении с ним и обладал бы высокой сохраняемостью, а также стойкостью в обычных условиях производства комбикормов, прежде всего при гранулировании и экструзии.
Таким путем для рыб и ракообразных наряду с кристаллическим DL-метионином должно обеспечиваться наличие еще одного эффективного источника метионина, у какового источника полностью бы отсутствовали недостатки известных продуктов или такие недостатки присутствовали бы лишь в меньшем объеме.
Помимо этого задача изобретения состояла в разработке нового, гибкого способа синтеза метионилметионина DL-метионил-DL-метионина), который позволял бы в качестве исходного материала использовать типичные исходные, промежуточные и побочные продукты промышленного процесса получения DL-метионина. Кроме того, необходимо было разработать способ, пригодный для разделения пар диастереомеров, а именно: DD/LL- и DL/LD-метионилметионина, обеспечив тем самым для применения в особых случаях возможность также оптимального и эффективного использования только одной пары диастереомеров (DD/LL-I или DL/LD-I).
Описание изобретения
Указанная задача решается благодаря применению DL-метионил-DL-метионина и его солей в качестве кормовой добавки в кормовых смесях для животных, разводимых и выращиваемых в аквакультурных хозяйствах.
В предпочтительном варианте кормовая смесь содержит DL-метионил-DL-метионин в количестве от 0,01 до 5 мас.%, предпочтительно от 0,05 до 0,5 мас.%.
Применение DL-метионил-DL-метионина зарекомендовало себя при этом в качестве наиболее предпочтительного, поскольку такое соединение благодаря низкой растворимости смеси в виде DD/LL/DL/LD-метионилметионина, соответственно пары диастереомеров в виде DL/LD-метионилметионина (0,4 г/л) обладает исключительно высокой стойкостью к вымыванию.
Помимо этого такое соединение проявляет хорошую стойкость к гранулированию и экструзии при производстве кормов. DL-Метионил-DL-метионин стабилен в смесях с обычными компонентами и кормовыми средствами, такими, например, как зерновые (в частности кукуруза, пшеница, тритикале, ячмень, просо и другие), белковый корм растительного или животного происхождения (в частности соевые бобы и рапс, а также продукты их дальнейшей переработки, бобовые (например, горох, фасоль, люпин и т.д.), рыбная мука и другие), а также в комбинации с добавленными незаменимыми аминокислотами, протеинами, пептидами, углеводами, витаминами, минеральными веществами, жирами и маслами.
Еще одно преимущество состоит в том, что благодаря высокому относительному содержанию действующего вещества - метионилметионина - на кг вещества по сравнению с DL-метионином на моль метионилметионина экономится моль воды.
В одном из предпочтительных вариантов предлагаемого в изобретении применения кормовая смесь содержит протеины и углеводы, предпочтительно на основе рыбной, соевой или кукурузной муки, и может быть дополнена незаменимыми аминокислотами, протеинами, пептидами, витаминами, минеральными веществами, углеводами, жирами и маслами.
В особенно предпочтительном варианте DL-метионил-DL-метионин присутствует в кормовой смеси индивидуально в виде DD/LL/LD/DL-смеси, в виде DL/LD-смеси или в виде DD/LL-смеси, предпочтительно в каждом случае дополнительно в смеси с DL-метионином, на долю которого в предпочтительном варианте приходится от 0,01 до 20 мас.%, наиболее предпочтительно от 1 до 10 мас.%.
В одном из особенно предпочтительных вариантов предлагаемого в изобретении применения DL-метионил-DL-метионин представлен в виде пары энантиомеров, представляющей собой DL/LD-метионилметионин.
В еще одном предпочтительном варианте предлагаемого в изобретении применения животными, разводимыми и выращиваемыми в аквакультурных хозяйствах, являются пресноводные и морские рыбы и ракообразные, выбранные из группы, включающей карповых, форелей, лососевых, сомовых, окуневых, камбаловых, осетровых, тунцовых, угревых, лещей, тресковых, морских креветок, криль и пресноводных креветок, особенно предпочтительно из группы, включающей белого толстолобика (Hypophthalmichthys molitrix), белого амура (Ctenopharyngodon idella), сазана (Cyprinus carpio), пестрого толстолобика (Aristichthys nobilis), золотого карася (Carassius carassius), катлю (Carta Carta), лабео poxa (Labeo rohita), тихоокеанского и атлантического лососей (Salmon salar и Oncorhynchus kisutch), радужную форель (Oncorhynchus mykiss), канального сомика (Ictalurus punctatus), африканского сома (Clarias gariepinus), пангасиуса (Pangasius bocourti и Pangasius hypothalamus), нильскую тиляпию (Oreochromis niloticus), ханоса (Chanos chanos), кобию (Rachycentron canadum), белую тихоокеанскую креветку (Litopenaeus vannamei), черную тигровую креветку (Penaeus monodon) и гигантскую пресноводную креветку (Macrobrachium rosenbergii).
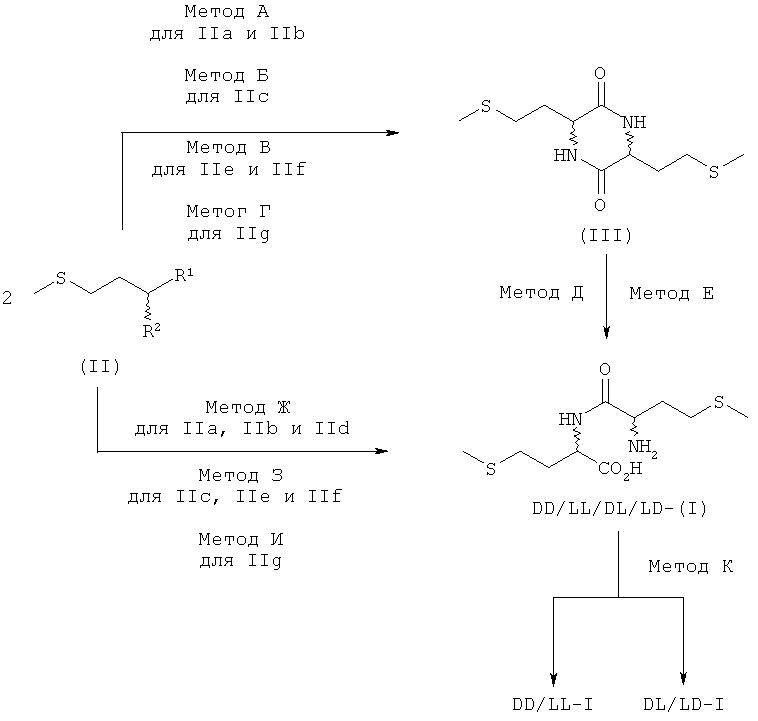
Согласно изобретению Dl-метионил-DL-метионин (I) (кратко называемый также метионилметионином или Met-Met) или его соли с щелочными и щелочноземельными металлами, такие, например, как труднорастворимая кальциевая или цинковая соль, применяют в виде смеси DD/LL/DL/LD-, DD/LL-или DL/LD-диастереомеров индивидуально или в смеси с DL-метионином в качестве добавки в кормовых смесях, предпочтительно в качестве добавки к кормам для рыб и ракообразных:
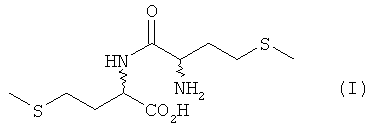
Дипептид DL-метионил-DL-метионин (I) существует в виде четырех разных стереоизомеров (диастереомеров) DD-, LL-, DL- и LD-I, из которых природным является только L-метионил-L-метионин (LL-I), а все три других дипептида - L-метионил-D-метионин (LD-I), D-метионил-L-метионин (DL-I) и D-метионил-D-метионин (DD-I) - являются неприродными (см. схему 1).
Схема 1
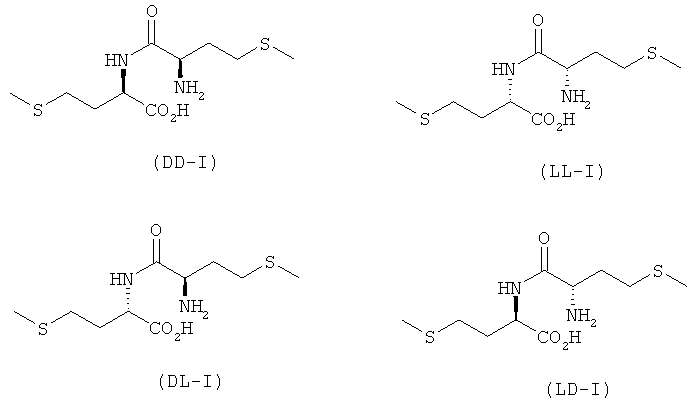
При этом изомеры DD-I и LL-I являются зеркальными отражениями друг друга, т.е. они представляют собой энантиомеры и тем самым обладают также одинаковыми физическими свойствами. То же самое относится и к паре изомеров DL-I и LD-I.
Обе же пары изомеров DD/LL-I и DL/LD-I являются диастереомерными друг по отношению к другу, т.е. обладают разными физическими характеристиками. Так, например, пара диастереомеров DD/LL-I имеет при комнатной температуре растворимость в воде 21,0 г/л, тогда как растворимость пары диастереомеров DL/LD-I составляет 0,4 г/л.
Наряду с разработкой новых методов синтеза метионилметионина объектом настоящего изобретения является также применение DL-метионил-DL-метионина в виде смеси DD/LL/DL/LD-, DD/LL- или DL/LD-диастереомеров в качестве ростостимулирующего кормового средства для всеядных, плотоядных и растительноядных рыб и ракообразных в аквакультурных хозяйствах. Так, в частности, согласно изобретению было установлено, что DL-метионил-DL-метионин (I) может в физиологических условиях ферментативно расщепляться в организме рыб и ракообразных на свободный D-, соответственно L-метионин (схема 2) (см. также примеры 22-24). Для этого из карпа (всеядная рыба), форели (плотоядная рыба) и белой тихоокеанской креветки (всеядная креветка) выделяли соответствующие пищеварительные ферменты, которые в оптимизированных опытах in vitro подвергали в условиях, сравнимых с физиологическими, взаимодействию с DL-метионил-DL-метионином. Согласно изобретению особенность расщепления DL-метионил-DL-метионина (I) заключается в том, что все четыре возможных диастереомера, т.е. природный LL-I, а также три неприродных диастереомера DD-, DL- и LD-I, могут расщепляться в физиологических условиях. Сказанное относится и к применению общей смеси всех диастереомеров (DD/LL/DL/LD-I), и к каждой из обеих пар диастереомеров DD/LL-I, соответственно DL/LD-I (см. фиг.1).
Схема 2
Однако расщепление индивидуальных диастереомеров метионилметионина протекает с разной скоростью. Сказанное поясняется на фиг.2 схематичным представлением ферментативного расщепления индивидуальных диастереомеров метионилметионина пищеварительными ферментами рыб и ракообразных. По причине замедленного расщепления высвобождение D- и L-метионина также происходит с задержкой (см. фиг.3). В этом состоит значительное преимущество, заключающееся в отсутствии возможности быстрого всасывания свободного D-, соответственно L-метионина в пищеварительном тракте (в отсутствии "быстрой реакции") и тем самым также в отсутствии возможности повышения концентрации свободного метионина в плазме крови до пиковых значений.
Преимущество, связанное с применением метионилметионина в качестве кормовой добавки и источника метионина, состоит в том, что высвобождение D-, соответственно L-метионина в организме может происходить на протяжении всего времени переваривания пищи и тем самым может протекать синхронно с высвобождением других аминокислот из природных источников белка (механизм "замедленного высвобождения") (см. фиг.3). Вследствие подобного особого эффекта в плазме крови обеспечивается одновременная доступность всех важных и незаменимых аминокислот в идеальной пропорции между ними, что является абсолютно необходимым условием для оптимального роста организма.
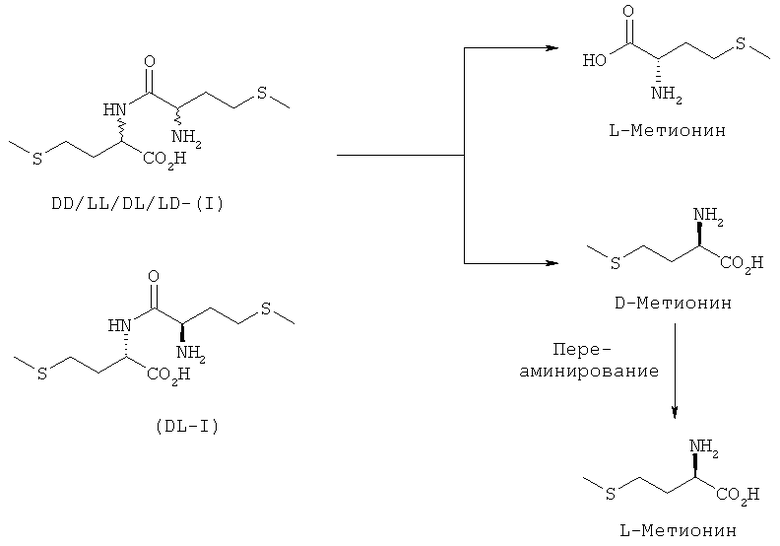
При ферментативном расщеплении дипептида - DL-метионил-DL-метионина (I) - наряду с природным L-метионином высвобождается также неприродный D-метионин (см. схему 2). Он может ферментативно переаминироваться до природного L-метионина в организме плотоядных, всеядных и растительноядных морских, соответственно пресноводных рыб и ракообразных. Сказанное проиллюстрировано в примере 25 на примере карповых. С использованием ферментного коктейля из пищеварительных и печеночных ферментов, выделенных из карповых, удалось превратить D- в L-метионин в условиях, соответствующих физиологическим (см. фиг.4). Тем самым при применении DL-метионил-DL-метионина (I) обеспечивается оптимальное снабжение организма природным L-метионином.
Результаты опытов с гранулированием и экструзией различных смесей из DL-метионил-DL-метионина (I) и природных источников белка и углеводов, таких, например, как рыбная, кукурузная и соевая мука, а также в виде смесей с другими незаменимыми аминокислотами, протеинами, пептидами, витаминами, минеральными веществами, жирами и маслами, свидетельствуют о том, что DL-метионил-DL-метионин (I) остается абсолютно стабильным в ходе и после производственного процесса и не подвергается распаду или разложению (см. пример 26).
Для исследования стойкости диастереомеров метионилметионина (I) к вымыванию из комбикормовых гранул в воде определяли временную зависимость растворения метионилметионина (см. пример 26). В сравнительных целях исследовали стойкость DL-метионина, ГАМ и кальциевой соли ГАМ (ГАМ-Са) к вымыванию в тех же условиях. При этом было установлено, что общая смесь всех диастереомеров (DD/LL/DL/LD-I), равно как и пары диастереомеров DD/LL-I и DL/LD-I проявляют явно меньшую склонность к вымыванию, чем DL-метионин, ГАМ и кальциевая соль ГАМ (ГАМ-Са) (см. фиг.5). Тем самым с течением времени метионилметионин удаляется из кормовых гранул в результате своего растворения в гораздо меньшем количестве по сравнению со всеми другими производными метионина. Особо низкие показатели вымывания обнаруживает пара диастереомеров DL/LD-I, которая даже по истечении 200-минутного пребывания кормовых гранул в воде удаляется из них в результате своего растворения в количестве лишь максимум 5% от своего исходного количества (см. фиг.5).
Положенная в основу изобретения задача решается далее с помощью способа получения DL-метионил-DL-метионина (I) формулы

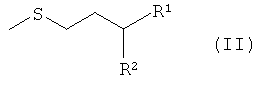
путем превращения производного мочевины общей формулы II
 ,
,
где остатки R1 и R2 в производных мочевины IIa, IIb, IIc, IId, IIe, IIf и IIg имеют следующие значения:
в соединении IIa R1 обозначает СООН, a R2 обозначает NHCONH2,
в соединении IIb R1 обозначает CONH2, a R2 обозначает NHCONH2,
в соединении IIc R1 обозначает CONH2, a R2 обозначает NH2,
в соединении IId R1-R2 обозначают -CONHCONH-,
в соединении IIe R1 обозначает CN, a R2 обозначает ОН,
в соединении IIf R1 обозначает CN, a R2 обозначает NH2,
в соединении IIg R1 обозначает =O, a R2 обозначает Н,
в DL-метионил-DL-метионин (I).
В одном из вариантов осуществления предлагаемого в изобретении способа при этом предпочтительно использовать в качестве исходного продукта метионингидантоин (IId) либо промежуточно образовывать его в качестве промежуточного продукта. В этом варианте осуществления предлагаемого в изобретении способа DL-метионил-DL-метионин синтезируют непосредственно из метионингидантоина, и в этом случае данный вариант охватывает представленные на схеме 3 методы Ж, З и И.
Схема 3
При этом предпочтительно подвергать раствор, содержащий метионингидантоин и воду, взаимодействию с метионином в основных условиях. Предпочтительно далее устанавливать значение рН раствора, содержащего производное мочевины, на 8-14, более предпочтительно на 10-13.
В предпочтительном варианте реакцию проводят при температуре от 50 до 200°С, более предпочтительно от 80 до 170°С, особенно предпочтительно от 130 до 160°С.
Помимо этого реакцию предпочтительно проводить под давлением, предпочтительно под давлением в пределах от 3 до 20 бар, особенно предпочтительно от 6 до 15 бар.
В следующем предпочтительном варианте осуществления предлагаемого в изобретении способа раствор, содержащий метионингидантоин и воду, предварительно образован из одного или нескольких соединений IIa, IIb, IIc, IId, IIe, IIf и IIg.
В следующем предпочтительном варианте осуществления предлагаемого в изобретении способа метионингидантоин получают взаимодействием соединения IIe или IIf с азотсодержащим основанием, NH4HCO3, (NH4)2СО3, смесью NH4OH/CO2 или карбаматными солями.
Реакцию с участием соединения Не предпочтительно проводить при температуре от 0 до 150°С, более предпочтительно от 0 до 100°С, особенно предпочтительно от 10 до 70°С.
В следующем предпочтительном варианте осуществления предлагаемого в изобретении способа метионингидантоин получают взаимодействием соединения IIf с СО2. Такую реакцию предпочтительно при этом проводить в присутствии основания, предпочтительно выбираемого из группы, включающей KHCO3, K2CO3, третичные амины и их соли и основания щелочных и щелочноземельных металлов.
В следующем предпочтительном варианте осуществления предлагаемого в изобретении способа метионингидантоин получают взаимодействием соединения IIg с источником цианид-ионов и основанием, выбираемым из группы, включающей азотсодержащие основания, аммониевые соли в присутствии CO2, NH4HCO3, (NH4)2CO3, смесь NH4OH/CO2 и карбаматные соли. Такую реакцию предпочтительно при этом проводить при температуре от -20 до 150°С, более предпочтительно от -10 до 100°С, особенно предпочтительно от 0 до 70°С.
Альтернативный вариант осуществления предлагаемого в изобретении способа предусматривает выполнение следующих стадий:
а) превращение производного мочевины формул IIa, IIb, IIc, IId, IIe, IIf и IIg в дикетопиперазин формулы
б) превращение указанного дикетопиперазина в DL-метионил-DL-метионин.
В этом варианте предлагаемый в изобретении способ охватывает представленные на схеме 3 методы А, Б, В и Г. При осуществлении этих методов дикетопиперазин (III) образуется в качестве промежуточного продукта.
Реакцию по превращению производного мочевины в дикетопиперазин предпочтительно при этом проводить при температуре от 50 до 200°С, более предпочтительно от 100 до 180°С, особенно предпочтительно от 140 до 170°С.
В одном из предпочтительных вариантов осуществления предлагаемого в изобретении способа реакцию по превращению производного мочевины в дикетопиперазин проводят под давлением, предпочтительно под давлением в пределах от 3 до 20 бар, особенно предпочтительно от 6 до 15 бар.
Реакцию по превращению производного мочевины в дикетопиперазин предпочтительно далее проводить в присутствии основания. Такое основание предпочтительно при этом выбирать из группы, включающей азотсодержащие основания, NH4HCO3, (NH4)2CO3, KHCO3, K2CO3, смесь NH4OH/CO2, карбаматные соли и основания щелочных и щелочноземельных металлов.
В следующем предпочтительном варианте осуществления предлагаемого в изобретении способа производное мочевины превращают в дикетопиперазин реакцией с метионином. Производное мочевины и метионин предпочтительно при этом использовать в соотношении между ними от 1:100 до 1:0,5.
В следующем предпочтительном варианте осуществления предлагаемого в изобретении способа дикетопиперазин превращают в DL-метионил-DL-метионин путем кислотного гидролиза. Кислотный гидролиз проводят при этом в присутствии кислоты, предпочтительно выбираемой из группы, включающей минеральные кислоты, HCl, H2CO3, CO2/H2O, H2SO4, фосфорные кислоты, карбоновые кислоты и гидроксикарбоновые кислоты.
В другом варианте осуществления предлагаемого в изобретении способа дикетопиперазин превращают в DL-метионил-DL-метионин путем основного гидролиза. Основный гидролиз для получения DL-метионил-DL-метионина предпочтительно при этом проводить при значении рН в пределах от 7 до 14, более предпочтительно от 9 до 12, особенно предпочтительно от 10 до 11. Основные условия можно при этом создавать с использованием вещества, предпочтительно выбираемого из группы, включающей азотсодержащие основания, NH4HCO3, (NH4)2C03, смесь NH4OH/CO2, карбаматные соли, KHCO3, K2CO3, карбонаты и основания щелочных и щелочноземельных металлов.
Кислотный, соответственно основный гидролиз предпочтительно проводить при температуре от 50 до 200°С, более предпочтительно от 80 до 180°С, особенно предпочтительно от 90 до 160°С.
В еще одном варианте превращение дикетопиперазина в DL-метионил-DL-метионин проводят путем введения CO2 в основный раствор, предпочтительно в основный раствор гидроксида аммония, калия или натрия.
В одном из предпочтительных вариантов осуществления предлагаемого в изобретении способа дикетопиперазин выделяют перед гидролизом. Дикетопиперазин предпочтительно при этом выделять из реакционного раствора путем кристаллизации, предпочтительно при температуре от -30 до 120°С, особенно предпочтительно от 10 до 70°С.
Для выделения смеси диастереомеров в виде DD/LL/DL/LD-метионилметионина из основных реакционных растворов их подкисляют и получают метионилметионин путем кристаллизации, соответственно осаждения. Предпочтительно при этом устанавливать значение рН на величину в пределах от 5 до 9, более предпочтительно от 5 до 7, особенно предпочтительно на величину около 5,6. Для подкисления при этом можно использовать кислоты, предпочтительно выбираемые из группы, включающей минеральные кислоты, HCl, H2CO3, CO2/H2O, H2SO4, фосфорные кислоты, карбоновые кислоты и гидроксикарбоновые кислоты.
Для выделения смеси диастереомеров в виде DD/LL/DL/LD-метионилметионина из кислых реакционных растворов их нейтрализуют добавлением оснований и получают метионилметионин путем кристаллизации, соответственно осаждения. Предпочтительно при этом устанавливать значение рН на величину в пределах от 5 до 9, более предпочтительно от 5 до 7, особенно предпочтительно на величину около 5,6. Для нейтрализации при этом используют основания, предпочтительно выбираемые из группы, включающей NH4HCO3, (NH4)2CO3, азотсодержащие основания, NH4OH, карбаматные соли, KHCO3, K2CO3, карбонаты и основания щелочных и щелочноземельных металлов.
В изобретении предлагается далее способ разделения смеси диастереомеров в виде DD/LL/DL/LD-метионилметионина путем фракционной кристаллизации с получением обеих пар энантиомеров - DD/LL-метионилметионина и DL/LD-метионилметионина.
В одном из предпочтительных вариантов осуществления такого способа фракционной кристаллизации путем подкисления работают следующим образом:
а) путем подкисления содержащей DD/LL/DL/LD-метионилметионин суспензии до образования прозрачного раствора и путем последующего постепенного смешивания полученного кислого раствора с основанием до выпадения осадка в виде него получают DL/LD-метионилметионин,
б) из полученного на стадии а) маточного раствора выделяют DD/LL-метионилметионин.
При этом особенно предпочтительно использовать для подкисления на стадии а) кислоту и устанавливать значение рН на величину в пределах от 0,1 до 1,0, предпочтительно на величину около 0,6, а значение рН полученного прозрачного раствора устанавливать затем добавлением основания на величину в пределах от 5 до 6, предпочтительно на величину около 5,6. В качестве кислоты можно при этом использовать минеральные кислоты, предпочтительно фосфорную кислоту, серную кислоту, соляную кислоту или угольную кислоту, соответственно диоксид углерода, и/или карбоновые кислоты, прежде всего такие карбоновые кислоты с C1-C4, как муравьиная кислота, уксусная кислота, пропионовая кислота, масляная кислота или изомасляная кислота. Особенно предпочтительно использовать угольную кислоту, соответственно диоксид углерода. При этом угольную кислоту, соответственно диоксид углерода можно вводить в реакционную смесь под нормальным либо повышенным давлением.
Для создания основных условий на стадии а) предпочтительно использовать основание, выбираемое из группы, включающей NH4HCO3, (NH4)2CO3, азотсодержащие основания, NH4OH, карбаматные соли, KHCO3, K2CO3, карбонаты, основания щелочных металлов и основания щелочноземельных металлов.
В еще одном предпочтительном варианте осуществления способа фракционной кристаллизации путем подщелачивания работают следующим образом:
а) путем подщелачивания содержащей DD/LL/DL/LD-метионилметионин суспензии до образования прозрачного раствора и путем последующего постепенного смешивания полученного основного раствора с кислотой до выпадения осадка в виде него получают DL/LD-метионилметионин,
б) из полученного на стадии а) маточного раствора затем выделяют DD/LL-метионилметионин.
При этом особенно предпочтительно использовать для подщелачивания на стадии а) основание и устанавливать значение рН на величину в пределах от 7,5 до 14, предпочтительно на величину от примерно 9 до 13, а значение рН полученного прозрачного раствора устанавливать затем добавлением кислоты на величину в пределах от 5 до 6, предпочтительно на величину около 5,6. В качестве оснований при этом предпочтительно использовать основания, выбираемые из группы, включающей NH4HCO3, (NH4)2CO3, азотсодержащие основания, NH4OH, карбаматные соли, KHCO3, K2CO3, карбонаты и основания щелочных и щелочноземельных металлов.
Для создания кислых условий на стадии а) предпочтительно использовать кислоту, выбираемую из группы минеральных кислот, предпочтительно фосфорную кислоту, серную кислоту, соляную кислоту или угольную кислоту, соответственно диоксид углерода, и/или из группы карбоновых кислот, прежде всего из группы карбоновых кислот с С1-С4, включающей муравьиную кислоту, уксусную кислоту, пропионовую кислоту, масляную кислоту и изомасляную кислоту. Особенно предпочтительно использовать угольную кислоту, соответственно диоксид углерода.
В одном из предпочтительных вариантов осуществления способа фракционной кристаллизации ее проводят при температуре от 0 до 100°С, предпочтительно от 5 до 60°С, особенно предпочтительно от 10 до 40°С.
Полученный DD/LL-метионилметионин можно при этом рацемизировать и подавать на разделение описанным выше способом, которым обе пары энантиомеров - DD/LL-метионилметионин и DL/LD-метионилметионин - отделяют друг от друга.
Все описанные выше предлагаемые в изобретении способы предпочтительно проводить в водной среде.
Помимо этого предлагаемые в изобретении способы можно проводить в известном специалистам периодическом или непрерывном режиме.
Графические материалы
На фиг.1 схематично в графическом виде представлено ферментативное расщепление смесей диастереомеров метионилметионина DD/LL-I, DL/LD-I и DD/LL/DL/LD-I.
На фиг.2 схематично в графическом виде представлено ферментативное расщепление четырех диастереомеров метионилметионина DD-I, LL-I, DL-I и LD-I, происходящее с разной скоростью.
На фиг.3 схематично в графическом виде представлено ферментативное высвобождение метионина (совместно D- и L-Met) из четырех диастереомеров метионилметионина DD-I, LL-I, DL-I и LD-I.
На фиг.4 в графическом виде представлена биологическая трансформация D-метионина в L-метионин при использовании ферментного коктейля, содержащего соответствующие ферменты, выделенные из зеркального карпа.
На фиг.5 в графическом виде представлена стойкость смесей диастереомеров метионилметионина DD/LL-I, DL/LD-I и LL/DD/LD/DL-I к вымыванию в сравнении с метионином, ГАМ и ГАМ-Са.
На фиг.6 в графическом виде представлены результаты опытов in vitro с перевариванием четырех различных диастереомеров метионилметионина LL-I, LD-I, DL-I и DD-I под действием пищеварительных ферментов, выделенных из зеркального карпа.
На фиг.7 в графическом виде представлены результаты опытов in vitro с перевариванием различных смесей диастереомеров метионилметионина LL/DD-I, DL/LD-I и LL/DD/LD/DL-I под действием пищеварительных ферментов, выделенных из зеркального карпа.
На фиг.8 в графическом виде представлены результаты опытов in vitro с перевариванием четырех различных диастереомеров метионилметионина LL-I, LD-I, DL-I и DD-I под действием пищеварительных ферментов, выделенных из радужной форели.
На фиг.9 в графическом виде представлены результаты опытов in vitro с перевариванием смесей диастереомеров метионилметионина LL/DD-I, DL/LD-I и LL/DD/LD/DL-I под действием пищеварительных ферментов, выделенных из радужной форели.
На фиг.10 в графическом виде представлены результаты опытов in vitro с перевариванием четырех различных диастереомеров метионилметионина LL-I, LD-I, DL-I и DD-I под действием пищеварительных ферментов, выделенных из белой тихоокеанской креветки.
На фиг.11 в графическом виде представлены результаты опытов in vitro с перевариванием различных смесей диастереомеров метионилметионина LL/DD-I, DL/LD-I и LL/DD/LD/DL-I под действием пищеварительных ферментов, выделенных из белой тихоокеанской креветки.
Примеры
А) Обзор отдельных стадий предлагаемого в изобретении способа и используемых при его осуществлении методов
Предлагаемый в изобретении способ получения DL-uemounn-DL-метионина (I) и разделение пар диастереомеров DD/LL-I и DL/LD-I более подробно рассмотрены ниже.
При получении ОЕ-метионил-ОЕ-метионина (I) предлагаемым в изобретении способом при этом исходят из соединения общей формулы II
 ,
,
где
в соединении IIa R1 обозначает СООН, a R2 обозначает NHCONH2
в соединении IIb R1 обозначает CONH2, a R2 обозначает NHCONH2,
в соединении IIc R1 обозначает CONH2, a R2 обозначает NH2,
в соединении IId R1-R2 обозначают -CONHCONH-,
в соединении IIe R1 обозначает CN, a R2 обозначает OH,
в соединении IIf R1 обозначает CN, a R2 обозначает NH2,
в соединении IIg R1 обозначает =O, a R2 обозначает Н.
Указанное соединение различными методами синтеза (А, Б, В, Г, Д, Е, Ж, З и И) превращают в DL-метионил-DL-метионин (I) (см. схему 3). При этом при синтезе методами А, Б, В и Г образуется соответствующий дикетопиперазин (III) в качестве промежуточного продукта. При синтезе методами Ж, З и И образуется метионингидантоин в качестве промежуточного продукта, который превращают непосредственно в DL-метионил-DL-метионин (I). После этого можно методом К путем фракционной кристаллизации разделять обе пары диастереомеров DD/LL-I и DL/LD-I (см. схему 3).
Схема 3

Б) Примеры синтеза
Пример 1: Синтез 3,6-бис[2-(метилтио)этил]-2,5-пиперазиндиона (III) (метиониндикетопиперазина, ДКП из N-карбамоилметионина (IIa) по методу А
17,5 г (90,0 ммолей, чистота: 99%) N-карбамоилметионина (IIa) растворяли в 150 мл воды и в течение 6 ч перемешивали при 160°С в 200-миллилитровом стальном автоклаве фирмы Roth, оборудованном магнитной мешалкой. При этом давление возрастало. Из автоклава периодически стравливали газ до тех пор, пока давление не достигало 7 бар. По завершении реакции автоклав охлаждали в ледяной бане. Полученную суспензию затем фильтровали, отфильтрованное твердое вещество многократно промывали водой и сушили в сушильном шкафу под вакуумом при 50°С. Таким путем с выходом 8,1 г (30,9 ммоля) (69%) выделили бис-[2-(метилтио)этил]-2,5-пиперазиндион (III) в виде бледно-желтых кристаллов с чистотой >98% (ЖХВР) и температурой плавления 234-236°С.
1Н-ЯМР-спектр 3,6-бис-[2-(метилтио)этил]-2,5-пиперазиндиона (III) (500 МГц, D6-ДМСО): δ=1,85-2,05 (m, 4Н, 2×SCH2CH2); 2,049 (s, 6Н, 2×SCH3); 2,46-2,60 (m, 4Н, 2×SCH2); 3,92-3,99 (m, 2Н, 2×СН); 8,213 (s, 2Н, 2×NH).
13С-ЯМР-спектр 3,6-бис-[2-(метилтио)этил]-2,5-пиперазиндиона (III) (125,8 МГц, D6-ДМСО): δ=14,35 (CH3); 14,38 (CH3); 28,50 (CH2S); 28,68 (CH2S); 31,92 (CH2CH2S); 32,33 (CH2CH2S); 52,92 (CH); 52,96 (CH); 167,69 (С=O); 167,71 (С=O).
Элементный анализ для C10H18N2O2S2 (М=262,39 г/моль):
рассчитано: С 45,77; Н 6,91; N 10,68; S 24,44
обнаружено: С 45,94; Н 6,96; N 10,64; S 24,38
Пример 2: Синтез 3,6-бис-[2-(метилтио)этил]-2,5-пиперазиндиона (III) (метиониндикетопиперазина, ДКП) из амида 2-[(аминокарбонил)амино]-4-(метилтио)масляной кислоты (N-карбамоилметионинамида) (IIb) по методу А
17,4 г (90 ммоля, чистота: 98,5%) амида 2-[(аминокарбонил)амино]-4-(метилтио)масляной кислоты (IIb) растворяли в 150 мл воды и в течение 7 ч перемешивали при 160°С в 200-миллилитровом стальном автоклаве фирмы Roth, оборудованном магнитной мешалкой. При этом давление возрастало. Из автоклава периодически стравливали газ до тех пор, пока давление не достигало 7 бар. По завершении реакции автоклав охлаждали в ледяной бане. Полученную суспензию затем фильтровали, отфильтрованное твердое вещество многократно промывали водой и сушили в сушильном шкафу под вакуумом при 50°С. Таким путем с выходом 9,2 г (35,1 ммоля) (78%) выделили быс-[2-(метилтио)этил]-2,5-пиперазиндион (III) в виде бледно-желтых кристаллов с чистотой >98% (ЖХВР).
Температура плавления и данные ЯМР-спектра совпадали с таковыми из примера 1.
Пример 3: Синтез 3,6-бис-[2-(метилтио)этил]-2,5-пиперазиндиона (III) (метиониндикетопиперазина, ДКП) из 5-[2-(метилтио)этил]-2,4-имидазолидиндиона (IId) (метионингидантоина) по методу А с последующим повторным применением маточного раствора (каскадная реакция)
Первая реакция
Суспензию из 13,4 г (0,09 моля) метионина, 17,2 г (0,09 моля, чистота: 91%) метионингидантоина (IId) и 150 г воды помещали в 200-миллилитровый стальной автоклав фирмы Roth, оборудованный магнитной мешалкой, и перемешивали в течение 6 ч при 160°С, при этом давление возрастало до 15 бар. Из автоклава периодически сбрасывали давление до тех пор, пока оно не стабилизировалось на постоянном уровне в 10 бар. После этого автоклав охлаждали в ледяной бане, полученную суспензию фильтровали и твердое вещество промывали 75 мл воды. В завершение твердое вещество оставляли сушиться на ночь в вакуумном сушильном шкафу при 50°С. Таким путем выделили био[2-(метилтио)этил]-2,5-пиперазиндион (III) в виде бледно-желтых кристаллов.
Последующие реакции
Промывочную воду и маточный раствор из предыдущей реакции объединяли и сгущали на роторном испарителе при 50°С до объема 90 мл. В концентрированном маточном растворе растворяли 17,2 г (0,09 моля, чистота: 91% метионингидантоина (IId) и добавлением воды массу раствора доводили до 150 г.Полученный раствор помещали в 200-миллилитровый стальной автоклав фирмы Roth, оборудованный магнитной мешалкой, и перемешивали в течение 6 ч при 160°С, при этом давление возрастало до 15 бар. Из автоклава периодически сбрасывали давление до тех пор, пока оно не стало постоянным и равным 10 барам. Последующую переработку выполняли аналогично первой реакции.
Пример 4: Синтез 3,6-бис-[2-(метилтио)этил]-2,5-пиперазиндиона (III) (метиониндикетопиперазина, ДКП) из амида 2-амино-4-(метилтио)масляной кислоты (метионинамида) (IIc) по методу Б
16,6 г (0,09 моля) гидрохлорида амида 2-амино-4-(метилтио)масляной кислоты (Не) и 8,7 г (0,09 моля) (NH4)2CO3 растворяли в 150 г воды и в течение 6 ч перемешивали при 160°С в 200-миллилитровом стальном автоклаве фирмы Roth, оборудованном магнитной мешалкой. После этого автоклав охлаждали в ледяной бане. Полученную суспензию затем фильтровали, отфильтрованное твердое вещество многократно промывали водой и сушили в сушильном шкафу под вакуумом при 50°С. Таким путем с выходом 6,5 г (24,8 ммоля) (55%) выделили бис-[2-(метилтио)этил]-2,5-пиперазиндион (III) в виде бледно-желтых кристаллов с чистотой >98% (ЖХВР).
Температура плавления и данные ЯМР-спектра совпадали с таковыми из примера 1.
Пример 5: Синтез 3,6-бис-[2-(метилтио)этил]-2,5-пиперазиндиона (III) (метиониндикетопиперазина, ДКП) из 2-гидрокси-4-(метилтио)бутаннитрила (циангидрина 3-(метилмеркапто)пропионового альдегида, ММП-ЦГ) (IIe) по методу В
Раствор 30,5 г (0,232 моля) 2-гидрокси-4-(метилтио)бутаннитрила (IIe) и 360 г воды при комнатной температуре медленно добавляли по каплям к суспензии 22,4 г (0,283 моля = 1,22 экв.) NH4HCO3 в 20 г воды и перемешивали в течение 2 ч. NH4HCO3 переходил при этом в раствор. После этого полученный раствор в течение 7 ч перемешивали при 50°С, а затем оставляли перемешиваться на ночь при комнатной температуре. Далее реакционную смесь переносили в 500-миллилитровый стальной автоклав, нагревали до 160°С и в течение 6 ч перемешивали при этой температуре. Затем автоклав охлаждали в ледяной бане, полученную суспензию фильтровали и твердое вещество промывали 50 мл воды. В завершение светлое твердое вещество оставляли сушиться на ночь в вакуумном сушильном шкафу при 50°С. Таким путем с выходом 17,8 г (67,8 ммоля) (58%) выделили бис-[2-(метилтио)этил]-2,5-пиперазиндион (III) в виде бледно-желтых кристаллов с чистотой >98% (ЖХВР).
Температура плавления и данные ЯМР-спектра совпадали с таковыми из примера 1.
Пример 6: Синтез 3,6-бис-[2-(метилтио)этил]-2,5-пиперазиндиона (III) (метиониндикетопиперазина, ДКП) из 2-амино-4-(метилтио)бутаннитрила (метиониннитрила) (IIf) по методу В
В раствор 26,2 г (0,201 моля) 2-амино-4-(метилтио)бутаннитрила (IIf) в 330 г воды в течение 3 ч вводили умеренный поток CO2, при этом температура повышалась до 45°С, а значение рН стабилизировалось на 8. После этого смесь оставляли перемешиваться на ночь при комнатной температуре. На следующее утро реакционную смесь переносили в 500-миллилитровый стальной автоклав, нагревали до 160°С и в течение 6 ч перемешивали при этой температуре. После этого автоклав охлаждали в ледяной бане, полученную суспензию фильтровали, твердое вещество промывали 50 мл воды и оставляли сушиться на ночь в вакуумном сушильном шкафу при 50°С. Таким путем с выходом 15,7 г (59,7 ммоля) (59%) выделили бис-[2-(метилтио)этил]-2,5-пиперазиндион (III) в виде бледно-желтых кристаллов с чистотой >98% (ЖХВР).
Температура плавления и данные ЯМР-спектра совпадали с таковыми из примера 1.
Пример 7: Синтез 3,6-бис-[2-(метилтио)этил]-2,5-пиперазиндиона (III) (метиониндикетопиперазина, ДКП) из 3-(метилтио)пропионового альдегида (3-(метилмеркапто)пропионового альдегида, ММП) (IIg) по методу Г
66,0 г (0,68 моля) (NH4)2CO3 добавляли в 100 г воды и охлаждали в ледяной бане до 5°С. После этого в течение 25 мин по каплям добавляли 16,6 г (0,61 моля) свежеперегнанной синильной кислоты, поддерживая при этом температуру суспензии в пределах от 5 до 10°С. После добавления 860 г воды затем при 10°С в течение 80 мин по каплям добавляли 60,3 г (0,58 моля) 3-(метилтио)пропионового альдегида (IIg). Значение рН оставалось при этом постоянным в пределах от 8,5 до 9. Затем реакционную смесь нагревали до 50°С и в течение 7 ч перемешивали при этой температуре. По завершении реакции реакционную смесь охлаждали в ледяной бане до 5°С и оставляли на ночь в холодильнике. На следующее утро смесь переносили в 2-литровый стальной автоклав, нагревали до 160°С и в течение 6 ч перемешивали при этой температуре. После этого автоклав охлаждали в ледяной бане, полученную суспензию фильтровали, промывали 150 мл воды и твердое вещество оставляли сушиться на ночь в вакуумном сушильном шкафу при 50°С. Таким путем с выходом 48,6 г (185,2 ммоля) (64%) выделили бис-[2-(метилтио)этил]-2,5-пиперазиндион (III) в виде бледно-желтых кристаллов с чистотой >98% (ЖХВР).
Температура плавления и данные ЯМР-спектра совпадали с таковыми из примера 1.
Пример 8: Синтез DD/LL/DL/LD-метионилметионина (I) из 3,6-бис-[2-(метилтио)этил]-2,5-пиперазиндиона (III) (метиониндикетопиперазина, ДКП) с использованием концентрированной соляной кислоты по методу Д
655,9 г (2,50 моля) 3,6-бис-[2-(метилтио)этил]-2,5-пиперазиндиона (III) (ДКП) суспендировали в 1661 г воды. Далее при перемешивании очень медленно по каплям добавляли 271,0 г концентрированной соляной кислоты, после чего осторожно при высокоинтенсивном перемешивании нагревали до температуры перегонки. При этом возможно интенсивное пенообразование. Реакционную смесь в течение 5,5 ч нагревали с обратным холодильником, в результате чего все твердое вещество переходило в раствор. В процессе последующего охлаждения в осадок выпадал непрореагировавший ДКП (III), который отфильтровывали. Этот ДКП можно вновь использовать для дальнейшего омыления в последующих реакциях. Затем значение рН фильтрата в химическом стакане с охлаждением ледяной баней устанавливали на 6 добавлением 32%-ной аммиачной воды. При этом в осадок выпадал DD/LL/DL/LD-метионилметионин (I) в виде смеси обеих пар диастереомеров в соотношении 50:50 (DL/LD-Met-Met) (DL/DL-I), соответственно (DD/LL-Met-Met) (DD/LL-I) с образованием густой кашеобразной смеси выпавших кристаллов и маточного раствора. В завершение продукт сушили в сушильном шкафу под вакуумом при 60°С. Выход: 601,0 г (2,14 моля) (85,7%) DD/LL/DL/LD-метионилметионина (I) в виде слегка желтоватого твердого вещества с чистотой 98% (ЖХВР).
1H-ЯМР-спектр DD/LL/DL/LD-метионилметионина (I) (500 МГц, D6-ДМСО+HCl): δ=1,86-2,16 (m, 4Н, 2×SCH2CH2); 2,050 (s, 3Н, SCH3); 2,060 (s, 3H, SCH3); 2,44-2,64 (m, 4H, 2×SCH2); 2,90-4,00 (m, 1H, CH); 4,32-4,42 (m, 1H, CH); 8,45 (шир. s, 3H, NH3 +); 8,98-9,08 (m, 1H, 2×NH).
13С-ЯМР-спектр DD/LL/DL/LD-метионилметионина (I) (125,8 МГц, D6-ДМСО+НС1): δ=14,33 (CH3); 14,38 (CH3); 27,74; 27,94; 29,51; 30,04; 30,13; 30,89; 30,95; 51,00; 51,29; 51,54 (CH, CH2); 168,05 (CONH); 168,19 (CONH); 172,55 (COOH); 172,62 (COOH).
Элементный анализ для C10H20N2O3S2 (M=280,41 г/моль):
рассчитано: С 42,83; Н 7,19; N 9,99; S 22,87
обнаружено: С 42,61; Н 7,19; N 10,06; S 22,72
Пример 9: Технический синтез DD/LL/DL/LD-метионилметионина (I) из 3,6-бис-[2-(метилтио)этил]-2,5-пиперазиндиона (III) (метиониндикетопиперазина. ДКП) с использованием концентрированной соляной кислоты по методу Д
В 500-литровый эмалированный бак с мешалкой заливали 500 л воды, после чего добавляли 32 л концентрированной соляной кислоты, а также 78,6 кг 3,6-быс-[2-(метилтио)этил]-2,5-пиперазиндиона (III) (ДКП) и аппарат герметично закрывали. Далее содержимое аппарата при перемешивании нагревали до 110°С с выдержкой при этой температуре в течение 2 ч, при этом давление возрастало до 2,5 бара, а ДКП (III) практически полностью переходил в раствор. По завершении реакции смесь охлаждали до 20°С и непрореагировавший ДКП отделяли на центрифуге. Твердое вещество затем промывали 10 л воды. После этого фильтрат и промывочную воду собирали в 800-литровую емкость и затем вновь подавали в 500-литровый бак с мешалкой. После добавления 2 кг активированного угля смесь перемешивали в течение 30 мин при 20°С. Затем суспензию фильтровали на фильтр-прессе с подачей фильтрата в другой 500-литровый бак с мешалкой. Далее добавлением примерно 28 л концентрированного раствора аммиака при рН 6 осаждали DD/LL/DL/LD-метионилметионин (I). При этом в осадок сначала преимущественно выпадала труднорастворимая рацемическая пара диастереомеров в виде DL/LD-метионилметионина (DL/LD-I). Его отделяли центрифугированием и маточный раствор совместно с промывочной водой при внутренней температуре максимум 40°С концентрировали в вакууме, создаваемом пароструйным насосом, до четверти от первоначального объема. При этом выкристаллизовывалась легче растворимая рацемическая пара диастереомеров в виде DD/LL-метионилметионина (DD/LL-I) совместно с малыми количествами труднорастворимой пары диастереомеров DL/LD-I. По завершении дистилляции смесь охлаждали до 20°С и центрифугировали. Отделенный маточный раствор и промывочную воду отбрасывали. Обе фракции сушили под вакуумом при 70°С. Таким путем удалось получить в целом 64,2 кг (78%) DD/LL/DL/LD-метионилметионина (I) в виде смеси диастереомеров с чистотой >98% (ЖХВР).
Температура плавления и данные ЯМР-спектра совпадали с таковыми из примера 8.
Пример 10: Синтез DD/LL/DL/LD-метионилметионина (I) из 3,6-бис-[2-(метилтио)этил]-2,5-пиперазиндиона (III) (метиониндикетопиперазина, ДКП) в основных условиях, например, с использованием аммиака, по методу Е
65,6 г (0,25 моля) 3,6-бис-[2-(метилтио)этил]-2,5-пиперазиндиона (III) (ДКП), 70 мл 25%-ного раствора аммиака и 500 мл воды нагревали в автоклаве до 150°С с выдержкой при этой температуре в течение 2 ч. После охлаждения смеси непрореагировавший ДКП (III) (16,0 г=24,4%) отделяли вакуум-фильтрацией. Его можно вновь использовать в следующей реакции. Фильтрат концентрировали на роторном испарителе при температуре воды в пределах от 80 до 90°С до тех пор, пока не начали выпадать первые кристаллы. После охлаждения и выдержки в течение ночи удалось после фильтрации и сушки выделить в общей сложности 49,3 г (70,3%) DD/LL/DL/LD-метионилметионина (I), представлявшего собой смесь обеих пар диастереомеров DL/DL-I, соответственно DD/LL-I в соотношении 50:50, в виде белого твердого вещества с чистотой 98% (ЖХВР).
Температура плавления и данные ЯМР-спектра совпадали с таковыми из примера 8.
Пример 11: Очистка DD/LL/DL/LD-метионилметионина (I)
500 г DD/LL/DL/LD-метионилметионина (I) суспендировали в 7800 г полностью обессоленной воды (рН 5,3). Далее при 26°С значение рН добавлением 346,6 г 50%-ной по массе серной кислоты устанавливали на 1,0. При этом метионилметионин полностью растворялся. Для осветления желтоватого, мутного раствора к нему добавляли 18 г активированного угля и перемешивали в течение 60 мин. После этого активированный уголь отфильтровывали и значение рН абсолютно прозрачного, бесцветного раствора добавлением 228 г 32%-ного по массе раствора аммиака устанавливали на 5,6. Этот раствор оставляли стоять на ночь. После этого выпавшее в осадок белое твердое вещество отделяли вакуум-фильтрацией и сушили в сушильном шкафу под вакуумом при 50°С. Выход: 460,5 г (92%) DD/LL/DL/LD-метионилметионина (I) в виде ярко-белого твердого вещества с чистотой >99% (ЖХВР).
Данные ЯМР-спектра совпадали с таковыми из примера 8.
Пример 12: Синтез DD/LL/DL/LD-метионилметионина (I) из N-карбамоилметионина (IIa) и DL-метионина с использованием KOH по методу Ж
13,4 г (0,09 моля) DL-метионина, 17,5 г (0,09 моля, чистота: 99%) N-карбамоилметионина (IIa) и 11,9 г (0,18 моля) 85%-ного KOH растворяли в 150 мл воды и в течение 5 ч перемешивали при 150°С в 200-миллилитровом стальном автоклаве фирмы Roth, оборудованном магнитной мешалкой, при этом давление возрастало до 6 бар. По завершении реакции автоклав охлаждали, выпавший в осадок 3,6-бис-[2-(метилтио)этил]-2,5-пиперазиндион (III) (метиониндикетопиперазин, ДКП) отфильтровывали и промывали небольшим количеством воды. Промывочную воду и маточный раствор объединяли и концентрировали на роторном испарителе при 40°С до объема 130 мл. В полученный раствор затем вводили умеренный поток CO2 до достижения значения рН, равного 6,4, и выпадения в осадок белого твердого вещества. Его отфильтровывали, промывали небольшим количеством холодной воды и оставляли сушиться на ночь в вакуумном сушильном шкафу при 50°С. Таким путем с выходом 11,4 г (40,6 ммоля) (45%) выделили DD/LL/DL/LD-метионилметионин (I) в виде белого твердого вещества с чистотой >98% (ЖХВР).
Данные ЯМР-спектра совпадали с таковыми из примера 8.
Пример 13: Синтез DD/LL/DL/LD-метионилметионина (I) из 5-[2-(метилтио)этил]-2,4-имидазолидиндиона (IId) (метионингидантоина) и DL-метионина с использованием KOH по методу Ж
13,4 г (0,09 моля) DL-метионина, 17,2 г (0,09 моля, чистота: 91%) метионингидантоина (IId) и 8,9 г (0,135 моля) 85%-ного KOH растворяли в 150 мл воды и в течение 5 ч перемешивали при 150°С в 200-миллилитровом стальном автоклаве фирмы Roth, оборудованном магнитной мешалкой, при этом давление возрастало до 8 бар. По завершении реакции автоклав охлаждали, полученную суспензию фильтровали и выпавший в осадок 3,6-бис-[2-(метилтио)этил]-2,5-пиперазиндион (III) (метиониндикетопиперазин, ДКП) многократно промывали водой небольшими порциями. Маточный раствор и промывочную воду объединяли и полученный раствор концентрировали на роторном испарителе при 40°С до объема 125 мл. Концентрат осторожно нейтрализовали концентрированной соляной кислотой. Смесь при значении рН, равном 5,8, оставляли перемешиваться при комнатной температуре на ночь, в течение которой в осадок выпадало белое твердое вещество. Его отфильтровывали, промывали небольшим количеством холодной воды и оставляли сушиться на ночь в вакуумном сушильном шкафу при 50°С. Таким путем с выходом 17,5 г (62,4 ммоля) (69%) выделили DD/LL/DL/LD-метионилметионин (I) в виде белого твердого вещества с чистотой >98% (ЖХВР).
Данные ЯМР-спектра совпадали с таковыми из примера 8.
Пример 14: Синтез DD/LL/DL/LD-метионилметионина (I) из 5-[2-(метилтио)этил]-2,4-имидазолидиндиона (IId) (метионингидантоина) и DL-метионина с использованием K2CO3 по методу Ж
13,4 г (0,09 моля) DL-метионина, 17,2 г (0,09 моля, чистота: 91%) метионингидантоина (IId) и 12,4 г (0,09 моля) K2CO3 растворяли в 150 мл воды и в течение 5 ч перемешивали при 150°С в 200-миллилитровом стальном автоклаве фирмы Roth, оборудованном магнитной мешалкой, при этом давление возрастало до 12 бар. По завершении реакции автоклав охлаждали, выпавший в осадок 3,6-бис-[2-(метилтио)этил]-2,5-пиперазиндион (III) (метиониндикетопиперазин, ДКП) отфильтровывали и промывали небольшим количеством воды. Промывочную воду и маточный раствор объединяли и концентрировали на роторном испарителе при 40°С до объема 135 мл. В полученный раствор затем вводили умеренный поток CO2 до достижения значения рН, равного 6,8, и выпадения в осадок белого твердого вещества. Его отфильтровывали, промывали небольшим количеством холодной воды и оставляли сушиться на ночь в вакуумном сушильном шкафу при 50°С. Выход: 14,3 г (60,0 ммоля) (57%) DD/LL/DL/LD-метионилметионина (I) в виде белого твердого вещества с чистотой >99% (ЖХВР).
Данные ЯМР-спектра совпадали с таковыми из примера 8.
Пример 15: Синтез DD/LL/DL/LD-метионилметионина (I) из 5-[2-(метилтио)этил]-2,4-имидазолидиндиона (IId) (метионингидантоина) и DL-метионина с использованием KHCO3 по методу Ж
13,4 г (0,09 моля) DL-метионина, 17,2 г (0,09 моля, чистота: 91%) метионингидантоина (Hd) и 9,1 г (0,09 моля) KHCO3 растворяли в 150 мл воды и в течение 5 ч перемешивали при 150°С в 200-миллилитровом стальном автоклаве фирмы Roth, оборудованном магнитной мешалкой, при этом давление возрастало до 12 бар. По завершении реакции автоклав охлаждали, выпавший в осадок 3,6-бис-[2-(метилтио)этил]-2,5-пиперазиндион (III) (метиониндикетопиперазин, ДКП) отфильтровывали и промывали небольшим количеством воды. Промывочную воду и маточный раствор объединяли и концентрировали на роторном испарителе при 40°С до объема 120 мл. В полученный раствор затем вводили умеренный поток СО2 до достижения значения рН, равного 6,3, и выпадения в осадок белого твердого вещества. Его отфильтровывали, промывали небольшим количеством холодной воды и оставляли сушиться на ночь в вакуумном сушильном шкафу при 50°С. Выход: 16,0 г (57,1 ммоля) (63%) DD/LL/DL/LD-метионилметионина (I) в виде белого твердого вещества с чистотой >99% (ЖХВР).
Данные ЯМР-спектра совпадали с таковыми из примера 8.
Пример 16: Синтез DD/LL/DL/LD-метионилметионина (I) из амида 2-амино-4-(метилтио)масляной кислоты (IIc) (метионинамида) и DL-метионина с использованием (NH4)2CO3 по методу З
8,3 г (0,045 моля) гидрохлорида амида 2-амино-4-(метилтио)масляной кислоты (IIc), 6,7 г (0,045 моля) метионина, 4,3 г (0,045 моля) (NH4)2CO3 и 3,0 г (0,045 моля) 85%-ного KOH растворяли в 75 г воды и в течение 6 ч перемешивали при 160°С в 200-миллилитровом стальном автоклаве фирмы Roth, оборудованном магнитной мешалкой. После этого автоклав охлаждали в ледяной бане, полученную суспензию фильтровали и выпавший в осадок 3,6-бис-[2-(метилтио)этил]-2,5-пиперазиндион (III) (метиониндикетопиперазин, ДКП) промывали небольшим количеством воды. Промывочную воду и маточный раствор объединяли и концентрировали на роторном испарителе при 40°С до объема 70 мл. В полученный раствор затем вводили умеренный поток CO2 до достижения значения рН, равного 6,3, и выпадения в осадок белого твердого вещества. Его отфильтровывали, промывали небольшим количеством холодной воды и оставляли сушиться на ночь в вакуумном сушильном шкафу при 50°С. Выход: 7,8 г (27,8 ммоля) (62%) DD/LL/DL/LD-метионилметионина (I) в виде белого твердого вещества с чистотой >98% (ЖХВР).
Данные ЯМР-спектра совпадали с таковыми из примера 8.
Пример 17: Синтез DD/LL/DL/LD-метионилметионина (I) из 2-гидрокси-4-(метилтио)бутаннитрила (IIe) (циангидрина 3-(метилмеркапто)пропионового альдегида, ММП-ЦГ) и DL-метионина с использованием NH4HCO3 по методу З
15,2 г (0,116 моля) 2-гидрокси-4-(метилтио)бутаннитрила (IIe) при комнатной температуре медленно добавляли по каплям к суспензии 11,1 г (0,141 моля = 1,22 экв.) NH4HCO3 в 10 г воды и перемешивали в течение 2 ч. NH4HCO3 переходил при этом в раствор. После этого добавляли 180 г воды и полученный раствор в течение 7 ч перемешивали при 50°С, а затем оставляли перемешиваться на ночь при комнатной температуре. На следующее утро добавляли 17,3 г (0,116 моля) метионина, 7,7 г (0,116 моля) 85%-ного KOH, а также еще 180 г воды, реакционную смесь переносили в 1-литровый стальной автоклав, нагревали до 160°С и в течение 6 ч перемешивали при этой температуре. После этого автоклав охлаждали в ледяной бане, полученную суспензию фильтровали и выпавший в осадок 3,6-бис-[2-(метилтио)этил]-2,5-пиперазиндион (III) (метиониндикетопиперазин, ДКП) промывали 100 мл воды. Маточный раствор и промывочную воду объединяли и полученный раствор концентрировали на роторном испарителе при 40°С до объема 160 мл. Концентрат осторожно нейтрализовали 50%-ной серной кислотой. Смесь при значении рН, равном 5,4, оставляли перемешиваться при комнатной температуре на ночь, в течение которой в осадок выпадало белое твердое вещество. Его отфильтровывали, промывали небольшим количеством холодной воды и оставляли сушиться на ночь в вакуумном сушильном шкафу при 50°С. Выход: 15,2 г (54,2 ммоля) (47%) DD/LL/DL/LD-метионилметионина (I) в виде белого твердого вещества с чистотой >99% (ЖХВР).
Данные ЯМР-спектра совпадали с таковыми из примера 8.
Пример 18: Синтез DD/LL/DL/LD-метионилметионина (I) из 2-амино-4-(метилтио)бутаннитрила (IIf) (метиониннитрила) с использованием CO2 и DL-метионина по методу 3
В раствор 26,2 г (0,201 моля) 2-амино-4-(метилтио)бутаннитрила (IIf) в 330 г воды в течение 3 ч вводили умеренный поток CO2, при этом температура повышалась до 45°С, а значение рН стабилизировалось на 8. После этого смесь оставляли перемешиваться на ночь при комнатной температуре. На следующее утро реакционную смесь смешивали с 30,0 г (0,201 моля) метионина и 13,3 г (0,201 моля) 85%-ного KOH, переносили в 1-литровый стальной автоклав, нагревали до 160°С и в течение 6 ч перемешивали при этой температуре. После этого автоклав охлаждали в ледяной бане, полученную суспензию фильтровали и выпавший в осадок 3,6-бис-[2-(метилтио)этил]-2,5-пиперазиндион (III) (метиониндикетопиперазин, ДКП) промывали небольшим количеством воды. Промывочную воду и маточный раствор объединяли и концентрировали на роторном испарителе при 40°С до объема 280 мл. В полученный раствор затем вводили умеренный поток CO2 до достижения значения рН, равного 6,0, и выпадения в осадок белого твердого вещества. Его отфильтровывали, промывали небольшим количеством холодной воды и оставляли сушиться на ночь в вакуумном сушильном шкафу при 50°С. Выход: 32,7 г (116,6 ммоля) (58%) DD/LL/DL/LD-метионилметионина (I) в виде белого твердого вещества с чистотой >98% (ЖХВР).
Данные ЯМР-спектра совпадали с таковыми из примера 8.
Пример 19: Синтез DD/LL/DL/LD-метионилметионина (I) из 3-(метилтио)пропионового альдегида (IIg) (ММП) с использованием синильной кислоты, карбоната аммония и DL-метионина по методу И
66,0 г (0,68 моля) (NH4)2CO3 добавляли в 100 г воды и охлаждали в ледяной бане до 5°С. Затем в течение 25 мин по каплям добавляли 16,55 г (0,612 моля) свежеперегнанной синильной кислоты, поддерживая при этом температуру суспензии в пределах от 5 до 10°С. После добавления 500 г воды затем в течение 80 мин при 10°С по каплям добавляли 60,3 г (0,58 моля) 3-(метилтио)пропионового альдегида (IIg). Значение рН оставалось при этом постоянным в пределах от 8,5 до 9. Затем реакционную смесь нагревали до 50°С и в течение 7 ч перемешивали при этой температуре. По завершении реакции реакционную смесь охлаждали в ледяной бане до 5°С и оставляли на ночь в холодильнике. На следующее утро добавляли 86,5 г (0,58 моля) 2-амино-4-(метилтио)масляной кислоты (метионина), 38,3 г (0,58 моля) 85%-ного KOH (0,58 моля), а также еще 530 г воды. Затем смесь переносили в 2-литровый стальной автоклав, нагревали до 160°С и в течение 6 ч перемешивали при этой температуре. После этого автоклав охлаждали в ледяной бане, полученную суспензию фильтровали и выпавший в осадок 3,6-бис-[2-(метилтио)этил]-2,5-пиперазиндион (III) (метиониндикетопиперазин, ДКП) промывали небольшим количеством воды. Промывочную воду и маточный раствор объединяли и концентрировали на роторном испарителе при 40°С до объема 800 мл. В полученный раствор затем вводили умеренный поток CO2 до достижения значения рН, равного 6,0, и выпадения в осадок белого твердого вещества. Его отфильтровывали, промывали небольшим количеством холодной воды и оставляли сушиться на ночь в вакуумном сушильном шкафу при 50°С. Выход: 85,1 г (0,30 моля) (52%) DD/LL/DL/LD-метионилметионина (I) в виде белого твердого вещества с чистотой >98% (ЖХВР).
Данные ЯМР-спектра совпадали с таковыми из примера 8.
Пример 20: Разделение обеих пар диастереомеров в виде DD/LL-метионилметионина (DD/LL-I) и DL/LD-метионилметионина (DL/LD-I) путем фракционной кристаллизации из DD/LL/DL/LD-метионилметионина (I) по методу К
а) DL/LD-Метионилметионин (DL/LD-I)
290,4 г DD/LL/DL/LD-метионилметионина (I) (смесь из DD/LL-I и DL/LD-I в соотношении 50:50) суспендировали в 2614 г полностью обессоленной воды и значение рН добавлением 381,7 г 50%-ной по массе серной кислоты устанавливали на 0,6. Значение рН прозрачного, бесцветного раствора добавлением 265,9 г 32%-ного по массе раствора аммиака устанавливали на 5,6 и образовавшийся белый осадок отделяли вакуум-фильтрацией (580,9 г во влажном состоянии). В завершение твердое вещество сушили в сушильном шкафу под вакуумом при 50°С. Выход составил 126,2 г (86,9%) DL/LD-метионилметионина (DL/LD-I) в виде белого твердого вещества с чистотой >98% (ЖХВР) и с температурой плавления в пределах от 232 до 233°С (разлож.).
1Н-ЯМР-спектр DL/LD-метионилметионина (DL/LD-I) (500 МГц, D6-ДМСО+HCl): 1,88-2,12 (m, 4Н, 2×SCH2CH2); 2,031 (s, 3Н, СН3); 2,041 (s, 3Н, СН3); 2,48-2,56 (m, 4Н, 2×SCH2); 3,87-3,95 (m, 1H, СН); 4,30-4,38 (m, 1Н, СН); 8,429 (d, 3Н, V=4,4 Гц, NH3 +); 9,034 (d, 1Н, 3J=8,0 Гц, NH).
13С-ЯМР-спектр DL/LD-метионилметионина (DL/LD-I) (125,8 МГц, D6-ДМСО+HCl): 14,57 (СН3); 14,62 (СН3); 28,19; 29,75; 30,28; 31,19; 51,25 (СН); 51,79 (СН); 168,29 (CONH); 172,80 (COOH).
Растворимость (вода, 20°С): 0,4 г/л.
б) DD/LL-Метионилметионин (DD/LL-I)
Бесцветный маточный раствор со стадии а) концентрировали на роторном испарителе при 35°С под вакуумом, создаваемым водяным насосом. Таким путем получили белую суспензию. Белую твердую фазу, состоящую из сульфата аммония, из остатков DL/LD-I и из целевого соединения, затем отделяли вакуум-фильтрацией и сушили под вакуумом при 50°С. Для разделения трех твердых веществ смесь суспендировали в полностью обессоленной воде и разделяли путем перемешивания. Нерастворившийся DL/LD-I отделяли вакуум-фильтрацией и маточный раствор концентрировали на роторном испарителе при 50°С под вакуумом, создаваемым водяным насосом, до примерно пятой части от первоначального объема. После продолжительного стояния выкристаллизовывался DD/LL-метионилметионин (DD/LL-I) в виде белого твердого вещества. В завершение его отделяли вакуум-фильтрацией и сушили в вакуумном сушильном шкафу при 50°С. Выход составил 78,2 г (53,9%) в пересчете на DD/LL-метионилметионин (DD/LL-I) в виде белого твердого вещества с чистотой >96% (ЖХВР) и с температурой плавления в пределах от 226 до 227°С (разложение).
1Н-ЯМР-спектр DD/LL-метионилметионина (DD/LL-I) (500 МГц, D6-ДМСО+HCl): 1,84-2,12 (m, 4Н, 2×SCH2CH2); 2,044 (s, 3Н, СН3); 2,046 (s, 3Н, СН3); 2,48-2,62 (m, 4Н, 2×SCH2); 3,89-3,97 (m, 1Н, CH); 4,33-4,40 (m, 1H, СН); 8,422 (d, 3Н, 3J=4,0 Гц, NH3 +); 9,065 (d, 1H, 3J=7,5 Гц, NH).
13С-ЯМР-спектр DD/LL-метионилметионина (DD/LL-I) (125,8 МГц, D6-ДМСО+HCl): 14,56 (CH3); 14,57 (CH3); 27,97; 29,73; 30,35; 31,11; 51,22 (CH); 51,50 (CH); 168,41 (CONH); 172,83 (COOH).
Растворимость (вода, 20°С): 21,0 г/л.
Пример 21: Рацемизация обеих пар диастереомеров в виде DD/LL-метионилметионина (DD/LL-I) и DL/LD-метионилметионина (DL/LD-D в основных условиях
а) Рацемизация DL/LD-метионилметионина (DL/LD-I)
12,6 г (45,0 ммолей) пары диастереомеров в виде DL/LD-метионилметионина (DL/LD-I) совместно с 3,1 г (22,5 ммоля) K2CO3 в 200-миллилитровом лабораторном реакторе фирмы Roth растворяли в 75 мл воды и при перемешивании нагревали до 160°С. Давление при этом возрастало до 7 бар. После 6-часовой выдержки при этой температуре автоклав охлаждали в ледяной бане. Полученную суспензию затем фильтровали, отфильтрованное твердое вещество многократно промывали водой и сушили в сушильном шкафу под вакуумом при 50°С. Таким путем с выходом 6,5 г (24,8 ммоля) (55%) выделили бис-[2-(метилтио)этил]-2,5-пиперазиндион (III) в виде бледно-желтых кристаллов с чистотой >98% и температурой плавления 234-236°С при соотношении между диастереомерами 52:48 (DD/LL-III:мезо-III). Промывочную воду и маточный раствор объединяли и концентрировали на роторном испарителе при 40°С до объема 25 мл. В полученный раствор затем вводили умеренный поток CO2 до достижения значения рН, равного 6,0, и выпадения в осадок белого твердого вещества. Его отфильтровывали, промывали небольшим количеством холодной воды и оставляли сушиться на ночь в вакуумном сушильном шкафу при 50°С. Таким путем с выходом 5,7 г (20,3 ммоля) (45%) выделили DD/LL/DL/LD-метионилметионин (I) в виде белого твердого вещества с чистотой >98% (ЖХВР).
Данные ЯМР-спектра совпадали с таковыми из примера 8.
б) Рацемизация DL/LD-метионилметионина (DD/LL-I)
12,6 г (45,0 ммолей) DD/LL-метионилметионина (DD/LL-I) совместно с 4,5 г (45,0 ммолей) КНСОз в 200-миллилитровом лабораторном реакторе фирмы Roth растворяли в 75 мл воды и при перемешивании нагревали до 160°С. Давление при этом возрастало до 7. После 6-часовой выдержки при этой температуре автоклав охлаждали в ледяной бане. Полученную суспензию затем фильтровали, отфильтрованное твердое вещество многократно промывали водой и сушили в сушильном шкафу под вакуумом при 50°С. Таким путем с выходом 6,0 г (22,9 ммоля) (51%) выделили быс-[2-(метилтио)этил]-2,5-пиперазиндион (III) в виде бледно-желтых кристаллов с чистотой>98% (ЖХВР) и температурой плавления 233-236°С при соотношении между диастереомерами 54:46 (DD/LL-III:мезо-III). Промывочную воду и маточный раствор объединяли и концентрировали на роторном испарителе при 40°С до объема 25 мл. В полученный раствор затем вводили умеренный поток CO2 до достижения значения рН, равного 6,0, и выпадения в осадок белого твердого вещества. Его отфильтровывали, промывали небольшим количеством холодной воды и оставляли сушиться на ночь в вакуумном сушильном шкафу при 50°С. Таким путем с выходом 5,5 г (19,6 ммоля) (44%) выделили DD/LL/DL/LD-метионилметионин (I) в виде белого твердого вещества с чистотой >98% (ЖХВР).
Данные ЯМР-спектра совпадали с таковыми из примера 8.
Пример 22: Опыты in vitro с перевариванием DL-метионил-DL-метионина (I) под действием пищеварительных ферментов, выделенных из всеядных карповых
а) Выделение пищеварительных ферментов из зеркального карпа (Cyprinus carpio morpha noblis)
Пищеварительные ферменты выделяли в соответствии с методом, описанным у EIP и MATTY (Aquaculture, 79, 1989, сс.111-119). Для этого у пяти однолетних зеркальных карпов (Cyprinus carpio morpha noblis) извлекали кишечник, промывали его водой, разрезали вдоль и с кишечника соскабливали слизистую оболочку. Ее совместно с колотым льдом измельчали в миксере. Полученную суспензию обрабатывали ультразвуковым стержнем с целью разрушения еще целых клеток. Для отделения клеточных компонентов и жира суспензию в течение 30 мин центрифугировали при 4°С, гомогенат отделяли декантированием и стерилизовали его полоской тимеросала. Из 5 зеркальных карпов получили 260,7 мл раствора ферментов слизистой оболочки кишечника и этот раствор хранили в темноте при 4°С.
б) Проведение опытов in vitro с перевариванием
DL-метионил-DL-метионин (I) или соответствующие пары диастереомеров PP/LL-I и PL/LP-I растворяли в буферном растворе mpuc/UCl и смешивали с раствором ферментов. Для сравнения и для оценки скорости исключительно химического расщепления в каждом случае проводили по "холостому" опыту без раствора ферментов. Периодически отбирали пробу и количественно оценивали ее состав путем ее анализа на калиброванном ЖХВР-хроматографе. Степень превращения определяли как частное от деления площади под кривой, полученной для метионина, на площадь под кривой, полученной для метионилметионина (I) (см. фиг.6 и 7).
Пример 23: Опыты in vitro с перевариванием DL-метионил-DL-метионина (I) под действием пищеварительных ферментов, выделенных из плотоядных форелей
а) Выделение пищеварительных ферментов из радужных форелей (Oncorhynchus mykiss)
Пищеварительные ферменты выделяли в соответствии с методом, описанным у EIP и MATTY (Aquaculture, 79, 1989, сс.111-119). Для этого у шести однолетних радужных форелей (Oncorhynchus mykiss) извлекали кишечник и перерабатывали его описанным в примере 22 способом.
б) Проведение опытов in vitro с перевариванием
Опыты in vitro с перевариванием проводили аналогично примеру 22 (см. фиг.8 и 9).
Пример 24: Опыты in vitro с перевариванием РЬ-метионил-РЬ-метионина (I) под действием пищеварительных ферментов, выделенных из всеядных морских креветок
а) Выделение пищеварительных ферментов из белых тихоокеанских креветок (Litopenaeus Vannamei)
Пищеварительные ферменты выделяли в соответствии с методом, описанным у Ezquerra и Garcia-Carreno (J. Food Biochem., 23, 1999, cc. 59-74). Для этого из пяти килограмм белых тихоокеанских креветок (Litopenaeus Vannamei) удаляли гепатопанкреас и совместно с колотым льдом измельчали в миксере. Дальнейшую переработку выполняли аналогично примеру 22.
б) Проведение опытов in vitro с перевариванием
Опыты in vitro с перевариванием проводили аналогично примеру 22 (см. фиг.10 и 11).
Пример 25: Биологическая трансформация D-метионина в L-метионин под действием ферментов кишечника, печени и поджелудочной железы, выделенных из зеркального карпа
а) Выделение пищеварительных ферментов из зеркального карпа (Cyprinus carpio morpha noblis)
Пищеварительные ферменты выделяли в соответствии с методом, описанным у EIP и MATTY (Aquaculture, 79, 1989, сс.111-119). Для этого у пяти однолетних зеркальных карпов (Cyprinus carpio morpha noblis) извлекали кишечник и перерабатывали его описанным в примере 22 способом. Для выделения печеночных ферментов у рыб извлекали печень, гомогенизировали и обрабатывали аналогично способу переработки ферментов кишечника в примере 22. Аналогичным путем выделяли также ферменты из поджелудочной железы.
б) Проведение биологической трансформации D-метионина в L-метионин in vitro
D-Метионин растворяли в буферном растворе и смешивали с раствором ферментов. Для сравнения и для оценки скорости исключительно химического превращения в каждом случае проводили по "холостому" опыту без раствора ферментов. Через 24 ч отбирали пробу и количественно оценивали ее состав путем ее анализа на калиброванном ЖХВР-хроматографе. Степень превращения определяли как частное от деления площади под кривой, полученной для L-метионина, на площадь под кривой, полученной для D-метионина (см. фиг.4).
Буферные растворы
Цитратный буфер: рН 5, рН 6 и рН 7
Фосфатный буфер: рН 8
трис/HCl-буфер: рН 9
Ферментный коктейль из ферментов кишечника, печени и поджелудочной железы (соответствует 5%-ному раствору ферментов, выделенных из карпов) 2,6 мл раствора ферментов из слизистой оболочки кишечника
3.5 мл раствора ферментов из печени
5.6 мл раствора ферментов из поджелудочной железы
Пример 26: Стойкость смесей диастереомеров метионилметионина LL/DD/LD/DL-I, DD/LL-I, соответственно DL/LD-I к вымыванию из кормовых гранул в сравнении с DL-метионином, ГАМ и кальциевой солью ГАМ
Кормовая смесь
В качестве основы (матрицы) кормового средства использовали бедную метионином кормовую смесь из традиционных компонентов, таких, например, как соевый шрот, соевое масло, кукурузный крахмал, пшеничная мука, рыбная мука, целлюлоза, кристаллические незаменимые аминокислоты, минеральные вещества и витамины, в виде премиксов. Эту смесь затем порциями по 20 кг дополняли указанными в таблице 5 производными метионина в количестве 0,25%) (в пересчете на серные эквиваленты), гомогенизировали и после этого гранулировали при обработке паром. Для сравнения с метионилметионином (I) проводили по одному опыту с гранулированием смеси, дополненной DL-метионином, ГАМ (гидроксианалогом метионина), соответственно кальциевой солью ГАМ. В качестве контрольного опыта проводили, кроме того, гранулирование смеси без добавки производного метионина (см. таблицу 5).
В ходе всего процесса гранулирования и обработки паром все диастереомеры метионилметионина (I) оставались стабильными (см. таблицу 6).
(Ex: растворимые компоненты)
Аминокислоты определяли при этом в соответствии с методом, утвержденным Директивной ЕС 98/64/ЕС. После экстракции свободных аминокислот и метионилметионина (I) их затем определяли с помощью анализатора аминокислот путем послеколоночной дериватизации нингидрином (см. таблицу 6).
После этого определяли стойкость диастереомеров метионилметионина (I) к вымыванию из кормовых гранул в воде. При этом вымывание метионилметионина в воде определяли в функции времени, температуры, состава воды (морская или пресная). Для этого 20,0 г кормовых гранул помещали в мелкоячеистый сетчатый мешок и полностью погружали в 200 г воды в колбе Эрленмейера. После этого всю колбу Эрленмейера при постоянной температуре в 20°С приводили в непрерывное движение с помощью лабораторного встряхивателя. Затем через определенные временные интервалы отбирали по пробе воды и путем ЖХВР-анализа определяли содержание в ней индивидуальных пар диастереомеров метионилметионина (см. таблицу 7).
В сравнительных целях в каждом случае в тех же условиях исследовали кормовые гранулы, дополненные DL-метионином, ГАМ, соответственно кальциевой солью ГАМ, и тем самым в соответствующих условиях определяли стойкость к вымыванию из них добавленного компонента в воде (см. фиг.5 и таблицу 7).
| название | год | авторы | номер документа |
|---|---|---|---|
| ДИПЕПТИДЫ В КАЧЕСТВЕ КОРМОВЫХ ДОБАВОК | 2010 |
|
RU2536467C2 |
| ЗАМЕЩЕННЫЕ 2-МЕТИЛТИОЭТИЛОМ ГЕТЕРОЦИКЛЫ В КАЧЕСТВЕ ДОБАВОК К КОРМАМ | 2008 |
|
RU2516833C2 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТИОНИНА ИЗ ГОМОСЕРИНА | 2007 |
|
RU2472778C2 |
| КЕТОМЕТИОНИНКЕТАЛИ И ИХ ПРОИЗВОДНЫЕ | 2007 |
|
RU2483062C2 |
| СПОСОБ ПОЛУЧЕНИЯ КЕТОКИСЛОТ И ИХ ПРОИЗВОДНЫХ | 2008 |
|
RU2536046C2 |
| СПОСОБ ПОЛУЧЕНИЯ АММОНИЕВОЙ СОЛИ 2-ГИДРОКСИ-4-МЕТИЛТИОМАСЛЯНОЙ КИСЛОТЫ | 2004 |
|
RU2355678C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3-(МЕТИЛТИО)ПРОПАНАЛЯ И 2-ГИДРОКСИ-4(МЕТИЛТИО)БУТАННИТРИЛА | 2005 |
|
RU2383531C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3-(АЛКИЛТИО)ПРОПАНАЛЯ | 2006 |
|
RU2367652C2 |
| УСТОЙЧИВЫЕ К ЦИАНИДАМ НИТРИЛГИДРАТАЗЫ | 2005 |
|
RU2385876C2 |
| НОВЫЙ СПОСОБ ПОЛУЧЕНИЯ 4,4-(1-МЕТИЛ-1,2-ЭТАНДИИЛ)-бис-(2,6,-ПИПЕРАЗИНДИОНА) | 2007 |
|
RU2487869C2 |
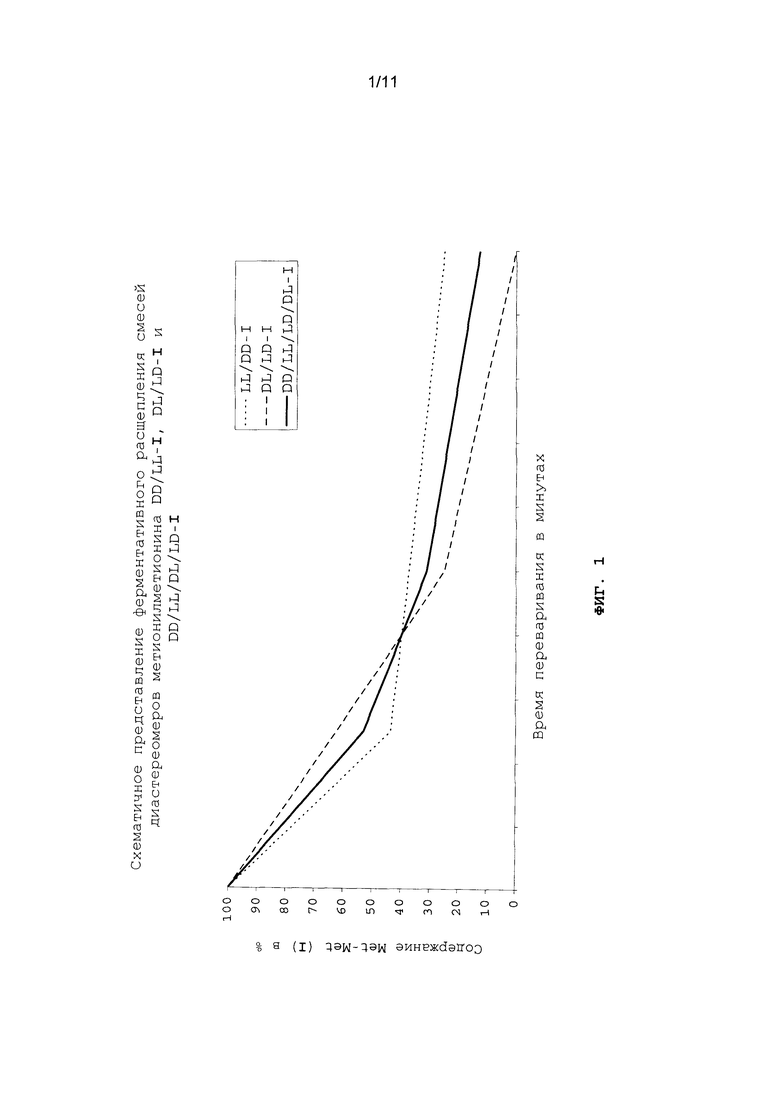
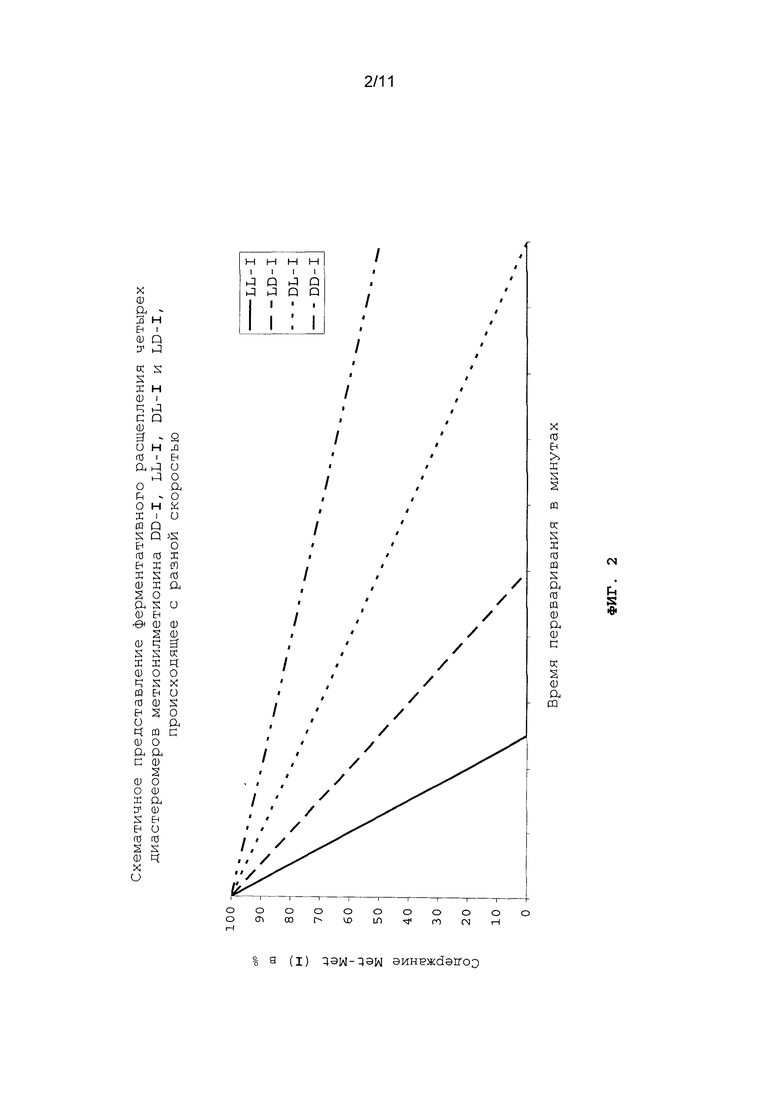
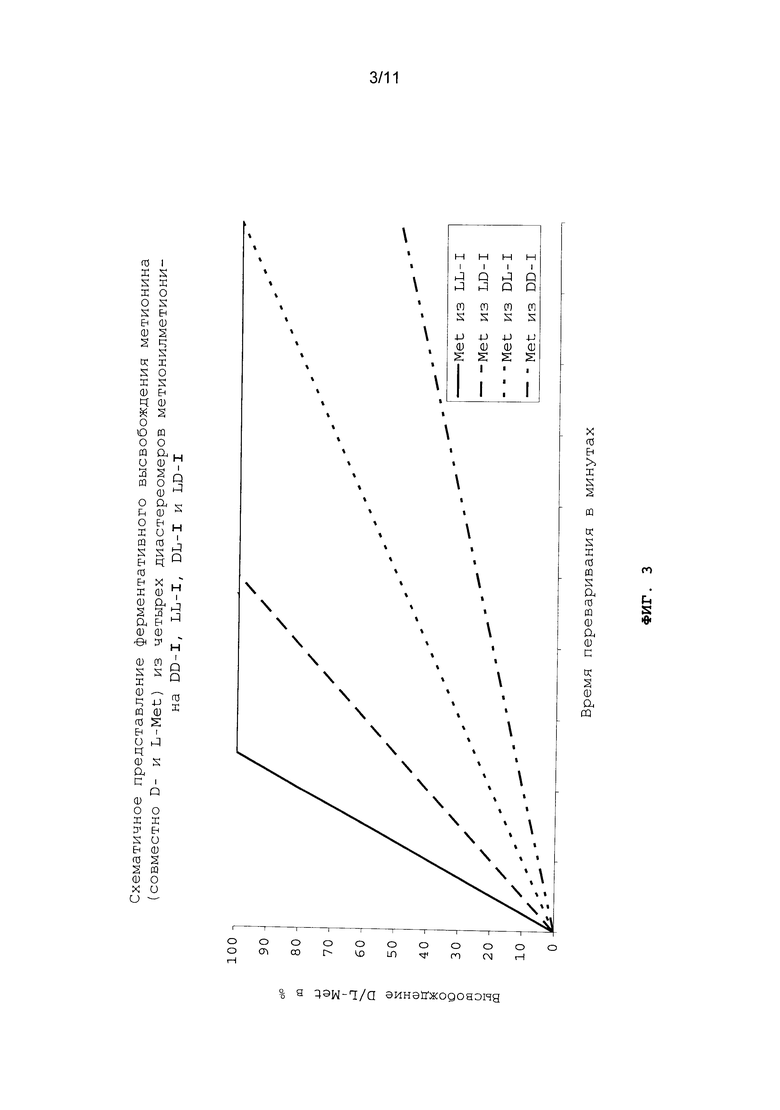
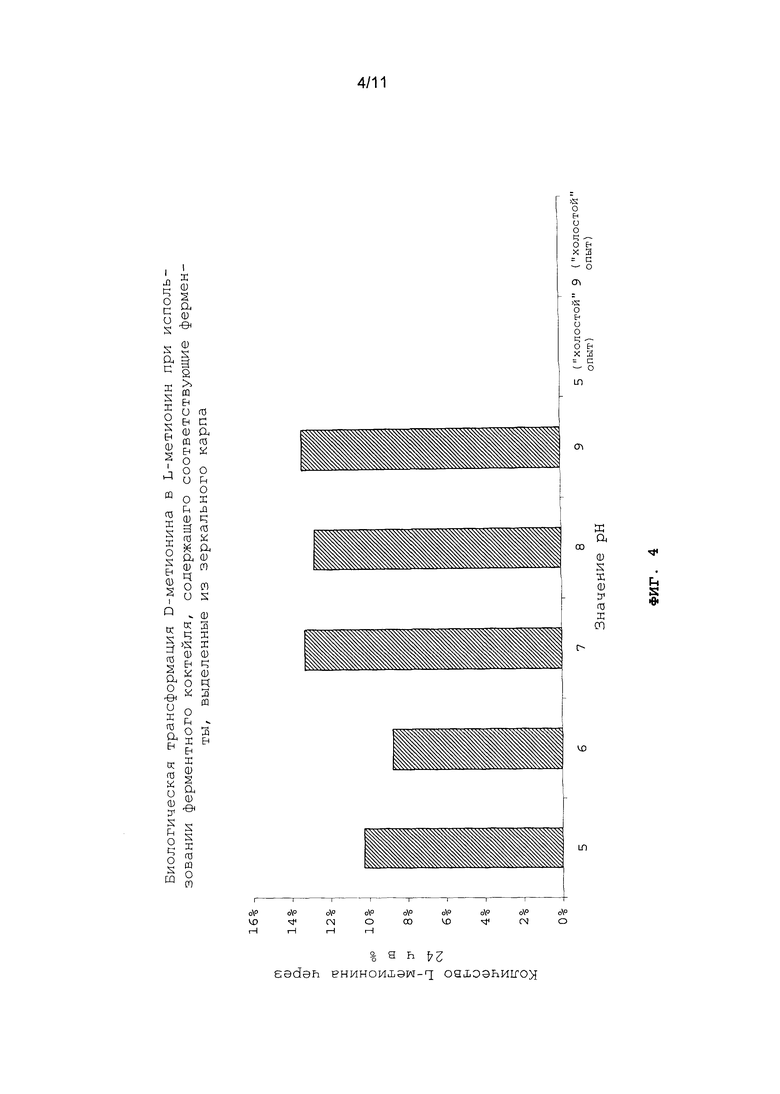
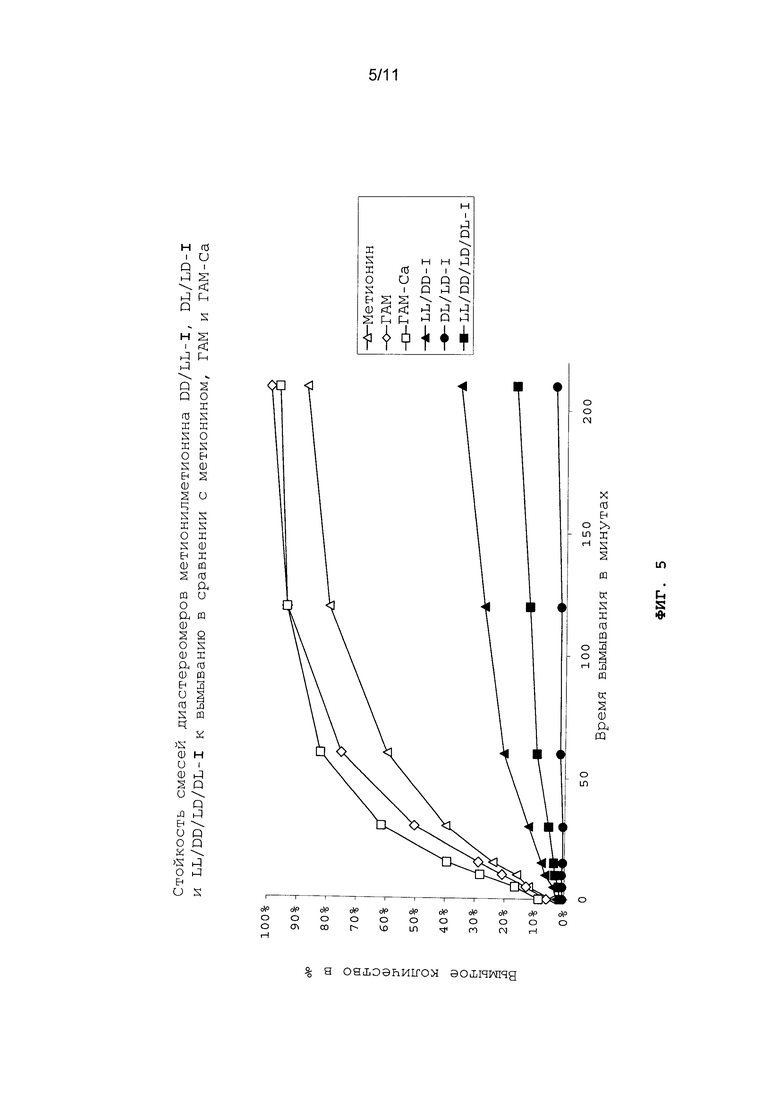
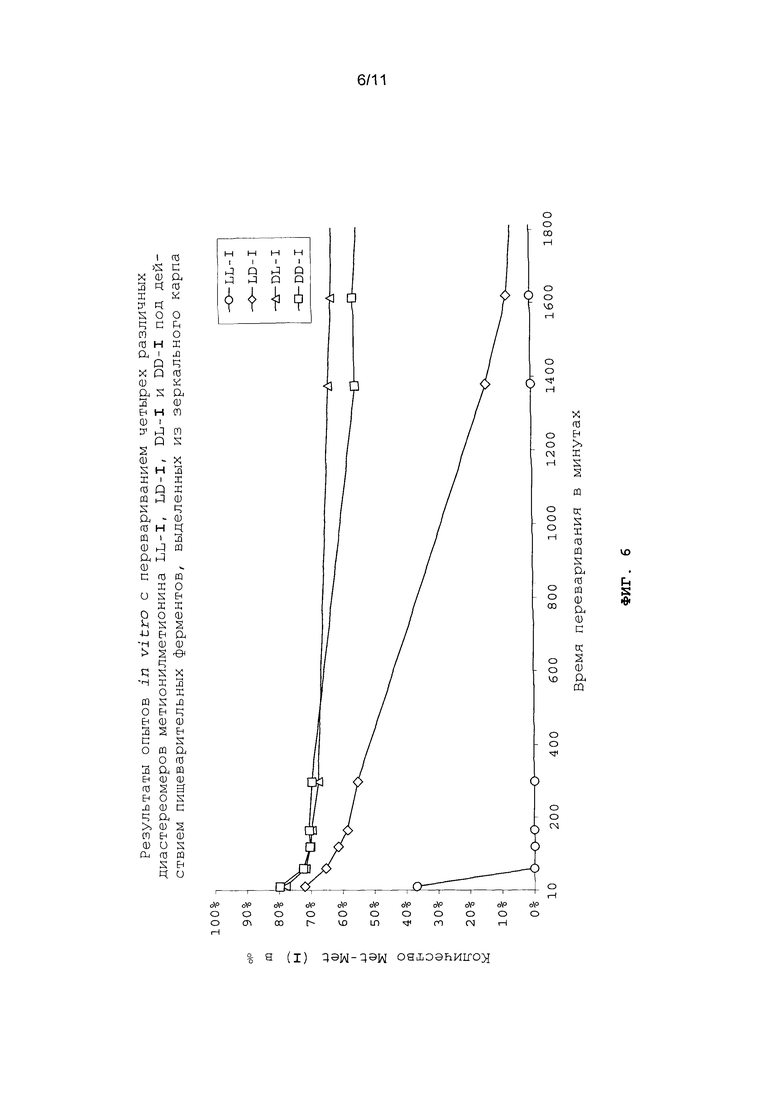
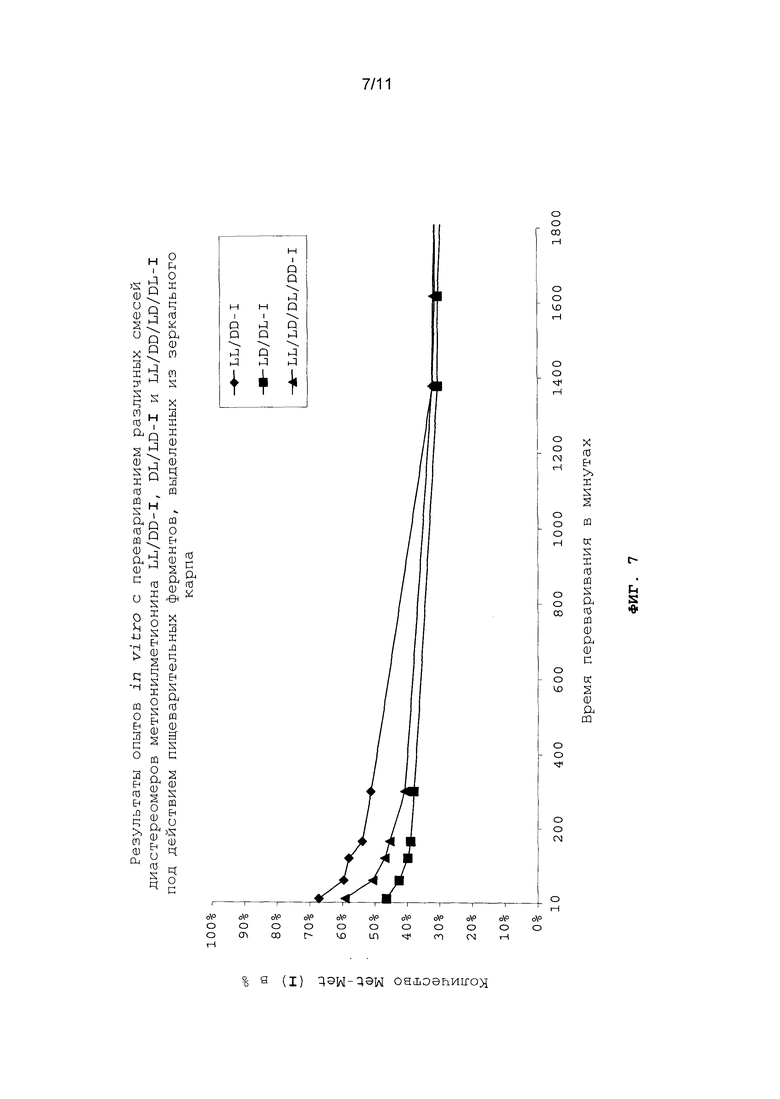
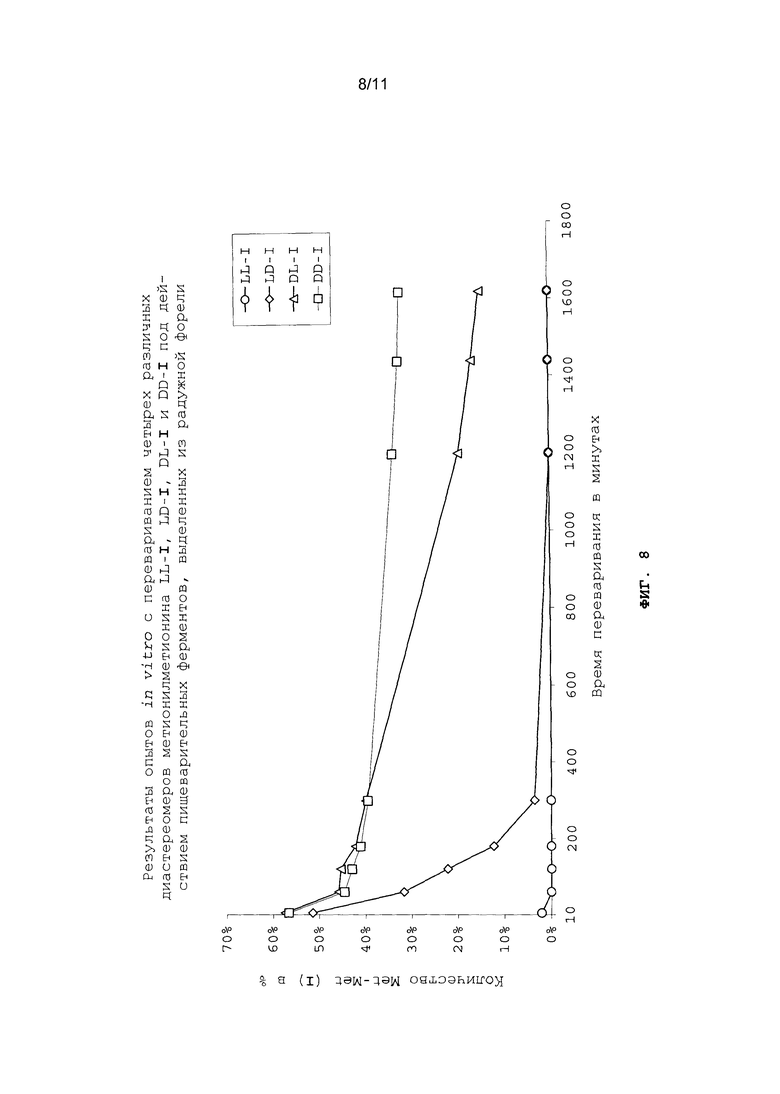
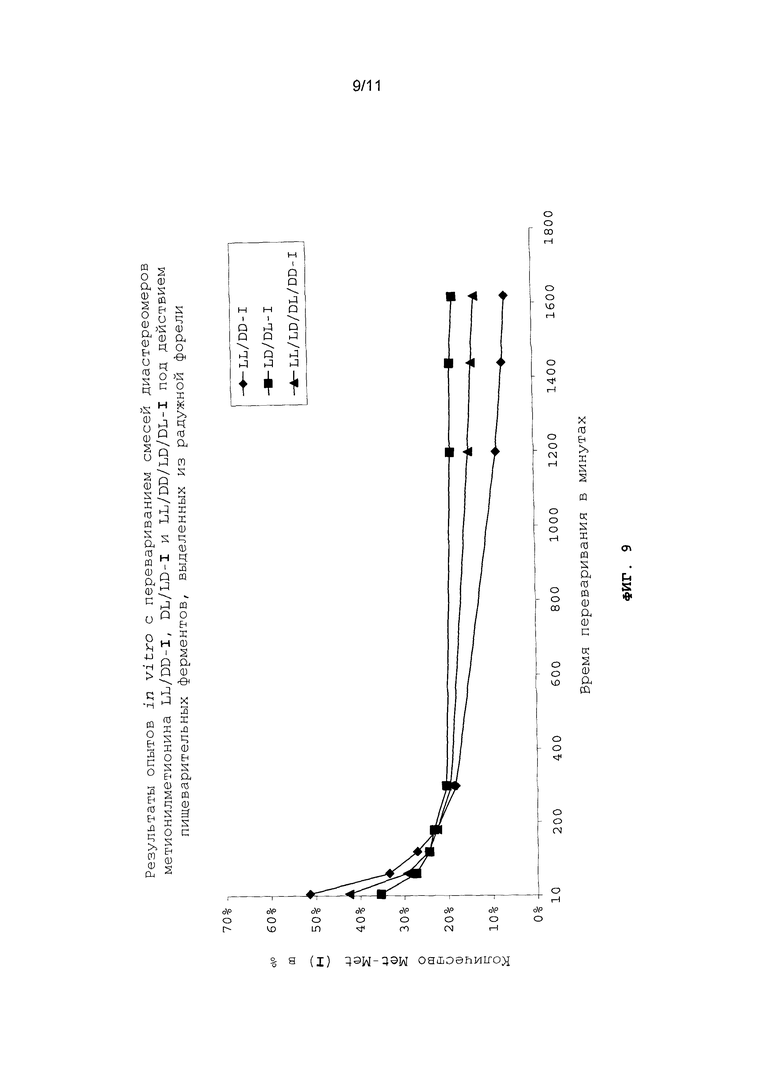
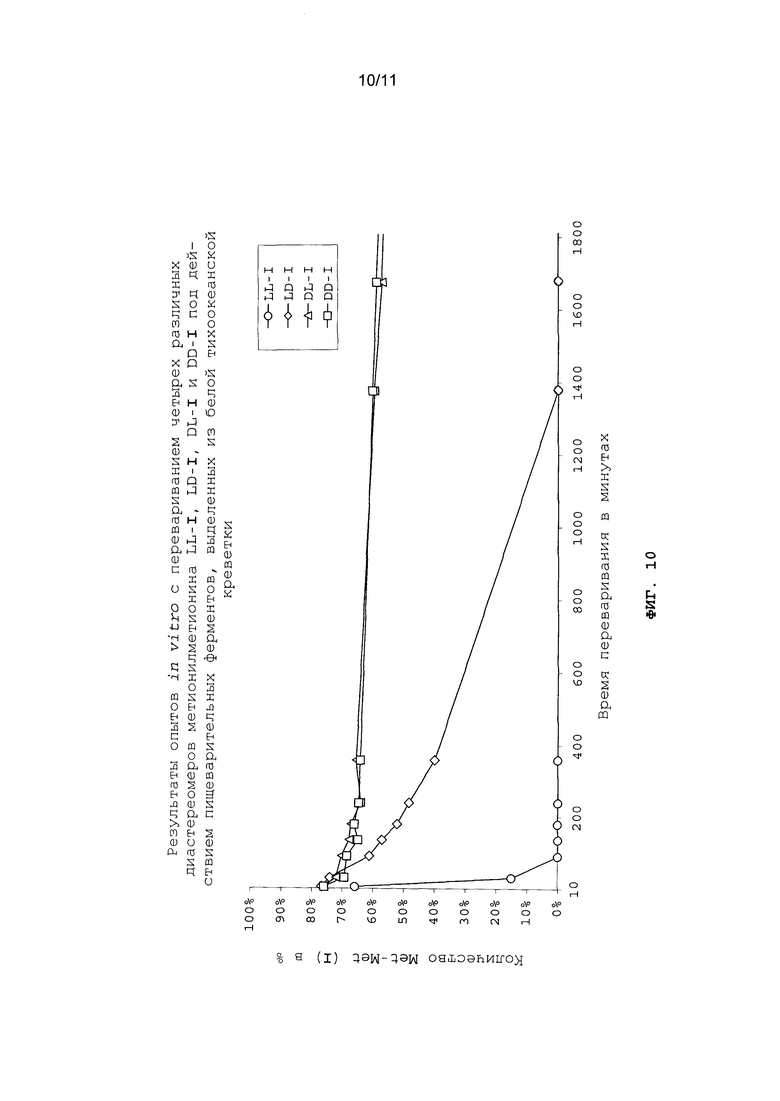
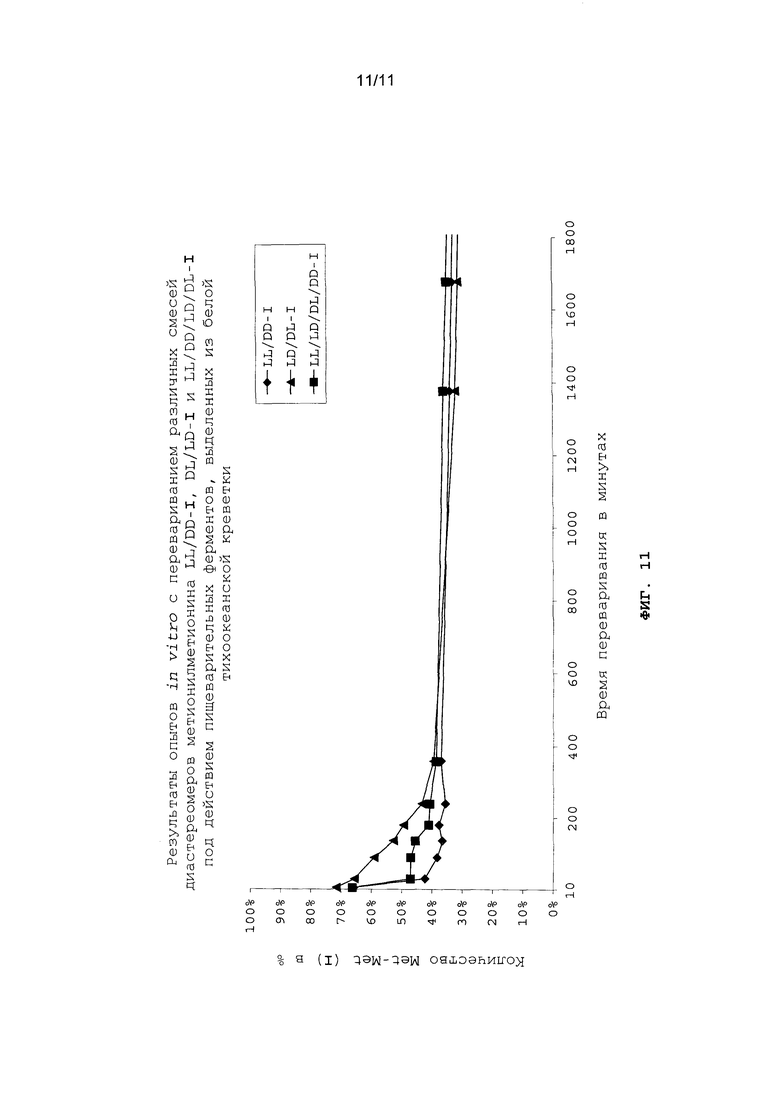
Изобретение относится к применению DL-метионил-DL-метионина и его солей в качестве кормовой добавки в кормовых смесях для животных, разводимых и выращиваемых в аквакультурных хозяйствах. Также изобретение относится к способу получения DL-метионил-DL-метионина формулы (I), где остатки R1 и R2 в производных мочевины IIa, IIb, IIc, IIe и IIf имеют следующие значения: в соединении IIa R1 обозначает СООН, a R2 обозначает NHCONH2, в соединении IIb R1 обозначает CONH2, a R2 обозначает NHCONH2, в соединении IIc R1 обозначает CONH2, a R2 обозначает NH2, в соединении IIe R1 обозначает CN, a R2 обозначает ОН, в соединении IIf R1 обозначает CN, a R2 обозначает NH2, в DL-метионил-DL-метионин (I), путем превращения производного мочевины общей формулы (II), при осуществлении которого значение рН раствора, содержащего производное мочевины, устанавливают на величину в пределах от 8 до 14, и реакцию проводят при температуре от 50 до 200°С. Технический результат: разработан новый способ получения DL-метионил-DL-метионина, который полезен в качестве кормовой добавки в кормовых смесях для животных, разводимых и выращиваемых в аквакультурных хозяйствах. 2 н. и 24 з.п. ф-лы, 11 ил., 7 табл., 26 пр.


1. Применение DL-метионил-DL-метионина и его солей в качестве кормовой добавки в кормовых смесях для животных, разводимых и выращиваемых в аквакультурных хозяйствах.
2. Применение по п.1 в виде соли, предпочтительно содержащей катионы из группы, включающей щелочные и щелочноземельные металлы, а также аммоний, Cu2+, Zn2+ и Со2+.
3. Применение по п.1 или 2, при этом кормовая смесь содержит DL-метионил-DL-метионин в количестве от 0,01 до 5 мас. %, предпочтительно от 0,05 до 0,5 мас. %.
4. Применение по п.1 или 2, при этом кормовая смесь содержит белок и углеводы, предпочтительно на основе рыбной, соевой или кукурузной муки, и может быть дополнена незаменимыми аминокислотами, протеинами, пептидами, витаминами, минеральными веществами, углеводами, жирами и маслами.
5. Применение по п.1 или 2, при этом DL-метионил-DL-метионин индивидуально либо в виде соли присутствует в виде DD/LL/LD/DL-смеси, в виде DL/LD-смеси или в виде DD/LL-смеси, предпочтительно в каждом случае дополнительно в смеси с DL-метионином, на долю которого предпочтительно приходится от 0,01 до 20 мас. %, наиболее предпочтительно от 1 до 10 мас. %.
6. Применение по п.1 или 2, при этом DL-метионил-DL-метионин присутствует в виде пары энантиомеров, представляющей собой DL/LD-метионилметионин.
7. Применение по п.1 или 2, при этом животными, разводимыми и выращиваемыми в аквакультурных хозяйствах, являются пресноводные и морские рыбы и ракообразные, предпочтительно выбранные из группы, включающей карповых, форелей, лососевых, сомовых, окуневых, камбаловых, осетровых, тунцовых, угревых, лещей, тресковых, морских креветок, криль и пресноводных креветок, особенно предпочтительно из группы, включающей белого толстолобика (Hypophthalmichthys molitrix), белого амура (Ctenopharyngodon idella), сазана (Cyprinus carpio), пестрого толстолобика (Aristichthys nobilis), золотого карася (Carassius carassius), катлю (Catla Catla), лабео poxa (Labeo rohita), тихоокеанского и атлантического лососей (Salmon salar и Oncorhynchus kisutch), радужную форель (Oncorhynchus mykiss), канального сомика (Ictalurus punctatus), африканского сома (Clarias gariepinus), пангасиуса (Pangasius bocourti и Pangasius hypothalamus), нильскую тиляпию (Oreochromis niloticus), ханоса (Chanos chanos), кобию (Rachycentron canadum), белую тихоокеанскую креветку (Litopenaeus vannamei), черную тигровую креветку (Penaeus monodon) и гигантскую пресноводную креветку (Macrobrachium rosenbergii).
8. Способ получения DL-метионил-DL-метионина формулы (I)
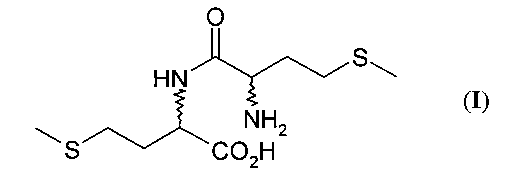
путем превращения производного мочевины общей формулы II
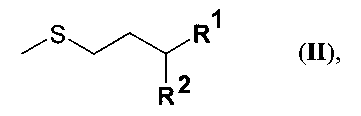
где остатки R1 и R2 в производных мочевины IIa, IIb, IIc, IIe и IIf имеют следующие значения:
в соединении IIa R1 обозначает СООН, a R2 обозначает NHCONH2,
в соединении IIb R1 обозначает CONH2, a R2 обозначает NHCONH2,
в соединении IIc R1 обозначает CONH2, a R2 обозначает NH2,
в соединении IIe R1 обозначает CN, a R2 обозначает ОН,
в соединении IIf R1 обозначает CN, a R2 обозначает NH2,
в DL-метионил-DL-метионин (I), при осуществлении которого значение рН раствора, содержащего производное мочевины, устанавливают на величину в пределах от 8 до 14 и реакцию проводят при температуре от 50 до 200°С.
9. Способ по п.8, при осуществлении которого значение рН раствора, содержащего производное мочевины, устанавливают на величину в пределах от 10 до 13.
10. Способ по одному из пп.8-9, при осуществлении которого реакцию проводят при температуре от 80 до 170°С, предпочтительно от 130 до 160°С.
11. Способ по одному из пп.8-9, при осуществлении которого реакцию проводят под давлением, предпочтительно под давлением в пределах от 3 до 20 бар, особенно предпочтительно от 6 до 15 бар.
12. Способ по п.8, предусматривающий выполнение следующих стадий:
а) превращение производного мочевины формул IIa, IIb, IIc, IIe и IIf в дикетопиперазин (III) формулы
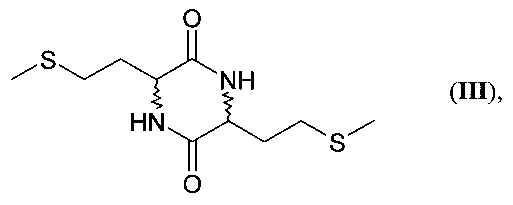
б) превращение указанного дикетопиперазина (III) в DL-метионил-DL-метионин (I), при осуществлении которого реакцию по превращению производного мочевины в дикетопиперазин проводят при температуре от 50 до 200°С.
13. Способ по п.12, при осуществлении которого реакцию по превращению производного мочевины в дикетопиперазин проводят при температуре от 100 до 180°С, предпочтительно от 140 до 170°С.
14. Способ по п.12, при осуществлении которого реакцию по превращению производного мочевины в дикетопиперазин проводят под давлением, предпочтительно под давлением в пределах от 3 до 20 бар, особенно предпочтительно от 6 до 15 бар.
15. Способ по одному из пп.12-14, при осуществлении которого реакцию по превращению производного мочевины в дикетопиперазин проводят в присутствии основания.
16. Способ по п.15, при осуществлении которого основание выбирают из группы, включающей азотсодержащие основания, NH4HCO3, (NH4)2СО3, KHCO3, K2CO3, смесь NH4OH/CO2, карбаматные соли и основания щелочных и щелочноземельных металлов.
17. Способ по одному из пп.12-14, при осуществлении которого производное мочевины превращают в дикетопиперазин реакцией с метионином.
18. Способ по одному из пп.12-14, при осуществлении которого дикетопиперазин превращают в DL-метионил-DL-метионин путем кислотного гидролиза.
19. Способ по п.18, при осуществлении которого кислотный гидролиз проводят в присутствии кислоты, выбираемой из группы, включающей минеральные кислоты, HCl, Н2СО3, СО2/Н2О, H2SO4, фосфорные кислоты, карбоновые кислоты и гидроксикарбоновые кислоты.
20. Способ по п.12, при осуществлении которого дикетопиперазин превращают в DL-метионил-DL-метионин путем основного гидролиза.
21. Способ по п.20, при осуществлении которого основный гидролиз для получения DL-метионил-DL-метионина проводят при значении рН в пределах от 7 до 14, более предпочтительно от 9 до 12, особенно предпочтительно от 10 до 11.
22. Способ по п.21, при осуществлении которого основные условия создают с использованием вещества, выбираемого из группы, включающей азотсодержащие основания, NH4HCO3, (NH4)2СО3, смесь NH4OH/CO2, карбаматные соли, KHCO3, K2CO3, карбонаты, основания щелочных металлов и основания щелочноземельных металлов.
23. Способ по п.18, при осуществлении которого реакцию проводят при температуре от 50 до 200°С, предпочтительно от 80 до 180°С, особенно предпочтительно от 90 до 160°С.
24. Способ по п.12, при осуществлении которого превращение дикетопиперазина в DL-метионил-DL-метионин проводят путем введения СО2 в основный раствор, предпочтительно в основный раствор гидроксида аммония, калия или натрия.
25. Способ по одному из пп.12-14, при осуществлении которого дикетопиперазин выделяют перед гидролизом.
26. Способ по п.25, при осуществлении которого дикетопиперазин выделяют из реакционного раствора путем кристаллизации, предпочтительно при температуре от -30 до 120°С, особенно предпочтительно от 10 до 70°С.
| Наддолотный стабилизатор | 1989 |
|
SU1760074A2 |
| US 3980653 А, 14.09.1976 | |||
| BAKER D.H | |||
| ET AL, Journal of Nutrition, 114(2), 1984, стр | |||
| ПРИСПОСОБЛЕНИЕ ДЛЯ УСТРАНЕНИЯ СКОЛЬЖЕНИЯ КОЛЕС АВТОМОБИЛЕЙ | 1920 |
|
SU292A1 |
| US 4056658 А, 01.11.1977 | |||
| RU 2005103732 A, 20.07.2006. | |||
Авторы
Даты
2016-10-20—Публикация
2009-10-09—Подача