Настоящее изобретение относится к новым связанным с метионином искусственным и природным дипептидам незаменимых, лимитирующих аминокислот, таких, например, как лизин, треонин и триптофан, серусодержащих аминокислот - цистеина и цистина, а также к их синтезу и применению в качестве кормовых добавок для кормления пользовательных животных, таких как куры, свиньи и жвачные, но прежде всего также для кормления рыб и ракообразных, разводимых в аквакультурах.
Уровень техники
Незаменимые аминокислоты (сокращенно "ЕАА", от англ. "essential ammo acids"), к которым относятся метионин, лизин, треонин, триптофан, гистидин, валин, лейцин, изолейцин, фенилаланин и аргинин, а также обе серусодержащие аминокислоты - цистеин и цистин - являются важными компонентами кормов и играют важную роль при промышленном выращивании пользовательных животных, таких, например, как куры, свиньи и жвачные. При этом решающее значение имеет прежде всего оптимальное распределение незаменимых аминокислот и достаточное снабжение ими организма животных. Поскольку в корме на основе природных источников белка, таких, например, как соя, кукуруза и пшеница, определенные незаменимые аминокислоты часто содержатся в недостаточном количестве, целенаправленное дополнение такого корма синтетическими незаменимыми аминокислотами, такими, например, как DL-метионин, L-лизин, L-треонин или L-триптофан, позволяет, во-первых, ускорить рост животных, соответственно повысить лактацию у высокопродуктивных молочных коров, а во-вторых, повысить также эффективность усвоения корма. В этом состоит значительное экономическое преимущество. Рынки кормовых добавок имеют большое промышленное и хозяйственное значение. Помимо этого спрос на кормовые добавки постоянно повышается и на развивающихся рынках, что не в последнюю очередь объясняется возрастающей ролью в мире таких стран, как, например, Китай и Индия.
L-Метионин ((S)-2-амино-4-метилтиомасляная кислота) является для животных многих видов первой лимитирующей аминокислотой среди всех незаменимых аминокислот и поэтому играет одну из важнейших ролей в рационе питания животных и в качестве кормовой добавки (Rosenberg и др., J. Agr. Food Chem., 5, 1957, сс.694-700). Однако при классическом химическом синтезе метионин образуется в виде рацемата, представляющего собой смесь из D- и L-метионинов в соотношении 50:50. Такой рацемический DL-метионин, однако, можно использовать непосредственно в качестве кормовой добавки, поскольку у животных некоторых видов в условиях in vivo существует механизм превращения неприродного D-энантиомера метионина в его природный L-энантиомер. При этом сначала происходит дезаминирование D-метионина под действием неспецифической D-оксидазы в α-кетометионин, который затем под действием L-трансаминазы превращается в L-метионин (Baker D.H., "Amino acids in farm animal nutrition", под ред. D'Mello J.P.F., Wallingford (UK), CAB International, 1994, cc.37-61). Таким путем в организме повышается доступное количество L-метионина, который затем может использоваться в организме животного для его роста. Ферментативное превращение D-метионина в L-метионин было обнаружено у кур, свиней и коров, но прежде всего и у рыб, морских креветок и пресноводных креветок. Так, например, по результатам исследований Sveier и др. (Aquacult. Nutr., 7(3), 2001, cc.169-181) и Kim и др. (Aquaculture, 101(1-2), 1992, сс.95-103) было установлено, что превращение D-метионина в L-метионин возможно у плотоядных атлантических лососей и радужных форелей. То же самое удалось обнаружить Robinson и др. (J. Nutr., 108(12), 1978, сс.1932-1936) и Schwarz и др. (Aquaculture, 161, 1998, сс.121-129) у всеядных видов рыб, таких, например, как сомообразные и карповые. Помимо этого Forster и Dominy (J. World Aquacult. Soc., 37(4), 2006, сс.474-480) в экспериментах с кормлением всеядных морских креветок вида Litopenaeus vannamei установили, что DL-метионин обладает такой же эффективностью, что и L-метионин. В 2007 г. во всем мире было произведено свыше 700000 тонн кристаллического DL-метионина, соответственно рацемического жидкого гидроксианалога метионина (ГАМ, рац-2-гидрокси-4-(метилтио)масляная кислота (ГММ)) и твердого ГАМ в виде его кальциевой соли и успешно использовалось непосредственно в качестве кормовой добавки при разведении животных с однокамерным желудком, таких, например, как сельскохозяйственная птица и свиньи.
В отличие от метионина лизин, треонин и триптофан можно использовать в качестве кормовых добавок только в виде L-энантиомеров каждого из них, поскольку D-энантиомеры каждой из трех этих незаменимых и лимитирующих аминокислот не могут превращаться организмом в физиологических условиях в соответствующие L-энантиомеры. Так, в частности, мировой сбыт одного только L-лизина, представляющего собой первую лимитирующую аминокислоту у свиней, составил в 2007 г. более одного миллиона тонн. Мировой же сбыт двух других лимитирующих незаменимых аминокислот - L-треонина и L-триптофана - составил в 2007 г. лишь более 100000 т, соответственно чуть меньше 3000 т.
DL-Метионин, ГАМ, а также L-лизин, L-треонин и L-триптофан обычно непосредственно используют в качестве добавки к кормам для животных с однокамерным желудком, таких, например, как сельскохозяйственная птица и свиньи. В отличие от этого добавление таких незаменимых аминокислот, как метионин, лизин, треонин или же ГАМ, к кормам для жвачных оказывается неэффективным, поскольку основное его количество разлагается в рубце жвачных под действием микробов. В результате такого разложения незаменимых аминокислот лишь незначительная часть от всего их добавленного к корму количества попадает в тонкий кишечник животного, где обычно происходит их всасывание в кровь. Среди незаменимых аминокислот в первую очередь метионин, потребляемый жвачными, играет решающую роль, поскольку только при оптимальном снабжении их организма этой аминокислотой обеспечивается высокая лактация. Для возможности высокоэффективного обеспечения организма жвачных метионином его требуется применять в форме, защищенной от разложения в рубце. В этом отношении существует несколько возможностей по приданию D,L-метионину, соответственно рац-ГАМ подобных свойств. Одна из таких возможностей по приданию метионину высокой стойкости к разложению в рубце состоит в нанесении на метионин соответствующего защитного слоя, соответственно в его распределении в пригодной для применения в этих целях защитной матрице. Благодаря этому метионин может практически без потерь проходить через рубец. В дальнейшем защитный слой удаляется, например, в сычуге в результате кислотного гидролиза, а высвобождающийся при этом метионин может затем всасываться в тонком кишечнике жвачного. Для применения в подобных целях пригодны имеющиеся в продаже продукты, например продукт Mepron® фирмы Evonik Degussa и продукт Smartamine™ фирмы Adisseo. Получение метионина, соответственно нанесение на него покрытия в большинстве случаев является технически сложным и трудоемким процессом и поэтому связано с высокими затратами. Помимо этого нанесенное на поверхность готовых гранул покрытие может легко повреждаться от механической нагрузки и истирания при переработке кормов, что может привести в конечном итоге к снижению эффективности защиты или даже к ее полной утрате. Поэтому защищенные метиониновые гранулы невозможно перерабатывать в более крупные комбикормовые гранулы, поскольку при такой переработке также произошло бы разрушение защитного слоя под действием механических нагрузок. Этот фактор существенно ограничивает применение подобных продуктов. Еще одна возможность по повышению стойкости метионина к разложению в рубце состоит в химическом образовании производных метионина, соответственно ГАМ. При этом функциональные группы молекулы защищают приемлемыми защитными группами. Так, например, карбоксильную функциональную группу можно в этих целях этерифицировать спиртами. Таким путем удается уменьшить разложение в рубце под действием микроорганизмов. В качестве примера имеющегося в продаже продукта с химической защитой можно назвать продукт Metasmart™, представляющий собой рацемический изопропиловый эфир гидроксианалога метионина (HMBi). Согласно WO 00/28835 биологическая доступность HMBi для жвачных составляет по меньшей мере 50%. Недостаток химического образования производных метионина, соответственно ГАМ часто состоит в их худшей биодоступности и сравнительно низком содержании собственно действующего вещества.
Наряду с проблемой разложения добавляемых к корму незаменимых аминокислот, таких как метионин, лизин или треонин, в рубце жвачных с различными проблемами можно также столкнуться при добавлении незаменимых аминокислот к корму для рыб и ракообразных. В результате стремительного экономического развития рыбоводства и разведения ракообразных в высокоиндустриальных аквакультурах в последние годы постоянно возрастает значение той роли, которую именно в этой области играет возможность оптимального, экономичного и эффективного дополнения рациона питания животных незаменимыми и лимитирующими аминокислотами (Food and Agriculture Organization of the United Nation (FAO) Fisheries Department, "State of World Aquaculture 2006", 2006, Рим; International Food Policy Research Institute (IFPRI), "Fish 2020: Supply and Demand in Changing Markets", 2003, Вашингтон, округ Колумбия). При этом, однако, в отличие от сельскохозяйственной птицы и свиней при применении кристаллических незаменимых аминокислот в качестве добавки к кормам для определенных видов рыб и ракообразных можно столкнуться с различными проблемами. Так, в частности, в публикации Rumsey и Ketola (J. Fish. Res. Bd. Can., 32, 1975, сс.422-426) говорится, что применение соевой муки в сочетании с индивидуально добавленными кристаллическими аминокислотами не приводило к усилению роста радужных форелей. По результатам исследований, проведенных Murai и др. (Bull. Japan. Soc. Sci. Fish., 50(11), 1984, с.1957), удалось установить, что ежедневное кормление карповых кормами с высокой долей добавленных к ним кристаллических аминокислот приводило к выведению более 40% свободных аминокислот из организма через жабры и почки. В связи с быстрым всасыванием добавленных аминокислот вскоре после поедания корма происходит очень быстрое повышение концентрации аминокислот в плазме крови рыб ("быстрая реакция"). Однако другие аминокислоты из природных источников белка, таких, например, как соевая мука, к этому моменту еще не находятся в плазме крови, что может привести к асинхронности в одновременной усвояемости всех важных аминокислот. Вследствие этого часть высококонцентрированных аминокислот быстро выводится из организма, соответственно быстро метаболизируется в нем и используется, например, в качестве исключительно источника энергии. В результате этого у карповых при применении кристаллических аминокислот в качестве кормовых добавок происходит лишь незначительное усиление роста, соответственно не происходит никакого усиления роста (Аое и др., Bull. Jap. Soc. Sci. Fish., 36, 1970, сс.407-413). В случае же ракообразных дополнение их корма кристаллическими незаменимыми аминокислотами может привести к возникновению еще и других проблем. В связи с медленным поеданием корма определенными ракообразными, такими, например, как креветки вида Litopenaeus Vannamei, по причине длительного пребывания корма в воде добавленные к нему водорастворимые аминокислоты удаляются из него в результате их растворения (вымывания), что приводит к эвтрофикации водоема, а не к усилению роста животных (Alam и др., Aquaculture, 248, 2005, сс.13-16). Тем самым незаменимые аминокислоты для эффективного снабжения ими организма рыб и ракообразных, разводимых в аквакультурных хозяйствах, требуют для определенных видов животных и определенных условий применения их выпуска в специальной форме, например в соответствующим образом химически или физически защищенной форме. Преследуемая при этом цель состоит, во-первых, в том, чтобы продукт оставался достаточно стойким в водной среде в процессе кормления животных и не удалялся из корма в результате растворения. Во-вторых, в конечном итоге должна обеспечиваться возможность оптимального и высокоэффективного усвоения аминокислотного продукта, потребленного животным, его организмом.
Ранее уже предпринимались многочисленные усилия по разработке приемлемых добавок к кормам для рыб и ракообразных, особенно кормовых добавок на основе незаменимых аминокислот - метионина и лизина. Так, например, в WO 89/06497 описано применение ди- и трипептидов в качестве добавки к кормам для рыб и ракообразных. Такие кормовые добавки должны способствовать росту животных. При этом, однако, использовали преимущественно ди- и трипептиды из заменимых, а также нелимитирующих аминокислот, таких, например, как глицин, аланин и серии, содержащихся во многих растительных источниках белков в более чем достаточных количествах.
В качестве метионинсодержащих дипептидов в указанной публикации описаны только DL-аланил-DL-метионин и DL-метионил-DL-глицин. Однако по этой причине эффективное содержание действующего вещества в дипептиде составляет лишь 50% (моль/моль), что с экономической точки зрения следует классифицировать как серьезный недостаток. В WO 02/088667 описаны энантиоселективный синтез и применение олигомеров из ГАМ и аминокислот, таких, например, как метионин, в качестве добавок к кормам, в том числе, в частности, и добавок к кормам для рыб и ракообразных. Применение таких кормовых добавок должно обеспечивать возможность ускоренного роста животных. Описанные в указанной публикации олигомеры образуют путем протекающей при ферментативном катализе реакции, получаемые в результате которой индивидуальные олигомеры обладают исключительно широким молекулярно-массовым распределением (полидисперсностью). По указанным причинам подобный способ неизбирателен, дорог и сложен в осуществлении и связан с дорогостоящей и трудоемкой очисткой получаемых им продуктов. У Dabrowski и др. в US 2003/0099689 описано применение синтетических пептидов в качестве кормовых добавок для стимулирования роста водных животных. При этом на массовую долю пептидов может приходиться от 6 до 50% от всей массы кормовой смеси. Такие синтетические пептиды состоят преимущественно из незаменимых аминокислот. Однако энантиоселективный синтез подобных синтетических олиго- и полипептидов исключительно сложен и дорог, а возможность его реализации в промышленном масштабе связана со значительными трудностями. Помимо этого эффективность полипептидов отдельной аминокислоты является спорной, поскольку они часто лишь очень медленно превращаются или вовсе не превращаются в физиологических условиях в свободные аминокислоты. Так, например, у Baker и др. (J. Nutr., 112, 1982, сс.1130-1132) говорится, что поли-L-метионин по причине его полной нерастворимости в воде не обладает никакой биологической ценностью в отношении кур, поскольку его всасывание в их организм невозможно.
Наряду с применением новых химических производных незаменимых аминокислот, таких, например, как метионинсодержащие пептиды и олигомеры, исследовались также различные возможности по физической защите незаменимых аминокислот, такие, например, как нанесение покрытия на незаменимую аминокислоту, соответственно ее включение в защитную матрицу.
Так, например, Alam и др. (Aquacult. Nutr., 10, 2004, сс.309-316, и Aquacultwe, 248, 2005, сс.13-19) установили, что снабженные покрытием метионин и лизин в отличие от таковых без покрытия оказывают исключительно положительное влияние на рост молодых креветок курума (Marsupenaeus japonicus). Хотя применение специального покрытия и позволило предотвратить вымывание метионина и лизина из кормовых гранул, тем не менее подобному подходу присущи некоторые серьезные недостатки. Получение аминокислот, соответственно нанесение на них покрытия в большинстве случаев является технически сложным и трудоемким процессом и поэтому связано с высокими затратами. Помимо этого покрытие, нанесенное на окончательно снабженную им аминокислоту, может легко повреждаться от механической нагрузки и истирания при переработке кормов, что может привести к снижению эффективности физической защиты аминокислоты или даже к полной утрате такой физической защиты. К этому же следует добавить, что покрытие или применение матрицы снижает содержание аминокислоты и поэтому часто является неэкономичным.
Задача изобретения
В основу настоящего изобретения была положена задача в первую очередь предложить кормовое средство, соответственно кормовую добавку для применения в рационе питания животных на основе нового метионинсодержащего заменителя, в котором метионин ковалентно связан с незаменимой и лимитирующей аминокислотой, такой, например, как L-лизин, L-треонин и L-триптофан, и который можно было бы использовать в качестве кормовой добавки для кормления пользовательных животных, таких как куры, свиньи и жвачные, но прежде всего также для кормления рыб и ракообразных, разводимых в аквакультурах.
С учетом описанных выше недостатков, присущих уровню техники, задача изобретения заключалась прежде всего в разработке химически защищенного продукта на основе комбинации из ковалентно связанных между собой DL-метионина и незаменимой аминокислоты, такой, например, как L-лизин, L-треонин или L-триптофан, для применения в рационе питания различных пользовательных животных, таких как куры, свиньи и жвачные, а также в рационе питания многих видов всеядных, растительноядных и плотоядных рыб и ракообразных, обитающих в морской или пресной воде. Подобный продукт наряду с функцией источника метионина должен также выполнять функцию источника всех других незаменимых аминокислот. Такой продукт должен в первую очередь обладать механизмом замедленного высвобождения, т.е. медленным и непрерывным высвобождением свободного метионина и незаменимой аминокислоты в физиологических условиях. Помимо этого такой продукт в химически защищенной форме, состоящий из метионина и незаменимой аминокислоты, должен обладать стойкостью к разложению в рубце и быть тем самым пригодным для применения в рационе питания всех жвачных. Для применения в качестве добавки к кормам для рыб и ракообразных такой продукт, представленный в указанной выше форме, должен характеризоваться низкой растворимостью (вымываемостью) в воде во избежание его удаления из всей кормовой гранулы, соответственно всего кормового экструдата.
Еще одна задача изобретения заключалась в том, чтобы предложить заменитель кристаллических незаменимых аминокислот в качестве кормового средства, соответственно кормовой добавки, который помимо исключительно высокой биологической ценности и биологической доступности был бы простым в обращении с ним и обладал бы высокой сохраняемостью, а также стойкостью в обычных условиях производства комбикормов, прежде всего при гранулировании и экструзии.
Таким путем, например, для кур, свиней, жвачных, рыб и ракообразных наряду с кристаллическими незаменимыми аминокислотами должно обеспечиваться наличие дополнительных эффективных источников незаменимых аминокислот, у каковых источников полностью бы отсутствовали недостатки известных продуктов или такие недостатки присутствовали бы лишь в меньшем объеме.
Помимо этого задача изобретения состояла в разработке различных новых, гибких способов синтеза дипептидов, содержащих только один метиониновый остаток, прежде всего синтеза L-EAA-DL-метионина (I) и DL-метионил-L-EAA (II). Один из таких способов синтеза должен допускать возможность использовать в качестве исходного материала типичные исходные, промежуточные и побочные продукты промышленного процесса получения DL-метионина.
Описание изобретения
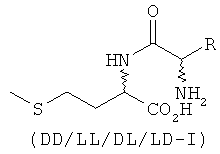
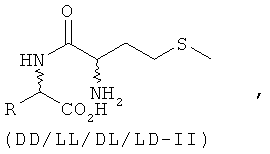
Указанная задача решается с помощью кормовых добавок, содержащих дипептиды или их соли, при этом один аминокислотный остаток дипептида представляет собой DL-метионильный остаток, а другой аминокислотный остаток дипептида представляет собой аминокислоту в L-конфигурации, выбранную из группы, включающей лизин, треонин, триптофан, гистидин, валин, лейцин, изолейцин, фенилаланин, аргинин, цистеин и цистин.
В предпочтительном варианте кормовая добавка содержит дипептиды общей формулы DL-метионил-L-ЕАА (соответствует смеси из D-метионил-L-ЕАА и L-метионил-L-ЕАА) и/или L-EAA-DL-метионин (соответствует смеси из L-EAA-D-метионина и L-EAA-L-метионина), где L-EAA представляет собой аминокислоту в L-конфигурации, выбранную из группы, включающей лизин, треонин, триптофан, гистидин, валин, лейцин, изолейцин, фенилаланин, аргинин, цистеин и цистин.
Объектом изобретения является далее кормовая смесь, содержащая указанную выше кормовую добавку.
Кормовая добавка, содержащая L-EAA-DL-метионин и/или DL-метионил-L-ЕАА и их соли, пригодна для применения в качестве кормовой добавки в кормовых смесях для кормления сельскохозяйственной птицы, свиней и жвачных, но прежде всего также для кормления рыб и ракообразных, разводимых в аквакультурах.
В предпочтительном варианте кормовая смесь содержит L-EAA-DL-метионин и DL-метионил-L-ЕАА в количестве от 0,01 до 5 мас.%, предпочтительно от 0,05 до 0,5 мас.%.
Применение L-EAA-DL-метионина и DL-метионил-L-ЕАА зарекомендовало себя при этом в качестве наиболее предпочтительного, поскольку эти дипептиды благодаря своей низкой растворимости обладают исключительно высокой стойкостью к вымыванию.
Помимо этого такое соединение проявляет хорошую стойкость к гранулированию и экструзии при производстве кормов. Дипептиды L-EAA-DL-метионин и DL-метионил-L-ЕАА стабильны в смесях с обычными компонентами и кормовыми средствами, такими, например, как зерновые (в частности, кукуруза, пшеница, тритикале, ячмень, просо и другие), белковый корм растительного или животного происхождения (в частности, соевые бобы и рапс, a также продукты их дальнейшей переработки, бобовые (например, горох, фасоль, люпин и т.д.), рыбная мука и другие), а также в комбинации с добавленными незаменимыми аминокислотами, протеинами, пептидами, углеводами, витаминами, минеральными веществами, жирами и маслами.
Еще одно преимущество состоит в том, что благодаря высокому относительному содержанию действующих веществ - L-EAA-DL-метионина и DL-метионил-L-ЕАА - на кг вещества по сравнению с DL-метионином и L-EAA на моль L-EAA-DL-метионина, соответственно DL-метионил-L-ЕАА экономится моль воды.
В одном из предпочтительных вариантов предлагаемого в изобретении применения кормовая смесь содержит протеины и углеводы, предпочтительно на основе рыбной, соевой или кукурузной муки, и может быть дополнена незаменимыми аминокислотами, протеинами, пептидами, витаминами, минеральными веществами, углеводами, жирами и маслами.
В особенно предпочтительном варианте DL-метионил-L-ЕАА и L-EAA-DL-метионин присутствуют в кормовой смеси индивидуально в виде D-метионил-L-ЕАА, L-метионил-L-ЕАА, L-EAA-D-метионина или L-EAA-L-метионина, в виде смеси между собой, соответственно также в виде смеси с D-метионил-D-ЕАА, L-метионил-D-EAA, D-EAA-D-метионином или D-EAA-L-метионином, предпочтительно в каждом случае дополнительно в смеси с DL-метионином, на долю которого в предпочтительном варианте приходится от 0,01 до 90 мас.%, более предпочтительно от 0,1 до 50 мас.%, особенно предпочтительно от 1 до 30 мас.%, и предпочтительно в каждом случае дополнительно в смеси с L-EAA, такой, например, как L-лизин, на долю которой в предпочтительном варианте приходится от 0,01 до 90 мас.%, более предпочтительно от 0,1 до 50 мас.%, особенно предпочтительно от 1 до 30 мас.%.
В еще одном предпочтительном варианте предлагаемого в изобретении применения животными, разводимыми и выращиваемыми в аквакультурных хозяйствах, являются пресноводные и морские рыбы и ракообразные, выбранные из группы, включающей карповых, форелей, лососевых, сомовых, окуневых, камбаловых, осетровых, тунцовых, угревых, лещей, тресковых, морских креветок, криль и пресноводных креветок, особенно предпочтительно из группы, включающей белого толстолобика (Hypophthalmichthys molitrix), белого амура (Ctenopharyngodon idelld), сазана (Cyprinus carpio), пестрого толстолобика (Aristichthys nobilis), золотого карася (Carassius carassius), катлю (Catia Catid), лабео роха (Labeo rohita), тихоокеанского и атлантического лососей (Salmon salar и Oncorhynchus kisutch), радужную форель (Oncorhynchus mykiss), канального сомика (Ictalurus punctatus), африканского сома (Glorias gariepinus), пангасиуса (Pangasius bocourti и Pangasius hypothalamus), нильскую тиляпию (Oreochromis niloticus), ханоса (Chanos chanos), кобию (Rachycentron canadum), белую тихоокеанскую креветку (Litopenaeus vannarnei), черную тигровую креветку (Penaeus monodon) и гигантскую пресноводную креветку (Macrobrachium rosenbergii).
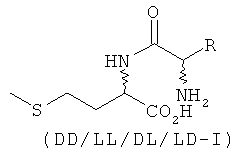
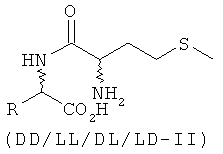
Согласно изобретению L-EAA-DL-метионин (L-EAA-DL-Met) (I) и DL-метионил-L-EAA (DL-Met-L-EAA) (II) или их соли с щелочными и щелочноземельными металлами, такие, например, как труднорастворимая кальциевая или цинковая соль, применяют в виде D-метионил-L-ЕАА, L-метионил-L-EAA, L-EAA-D-метионина или L-EAA-L-метионина либо в виде соответствующих смесей диастереомеров индивидуально или в смеси с DL-метионином, индивидуально или в смеси с L-EAA в качестве добавки в кормовых смесях, предпочтительно в качестве добавки к кормам для сельскохозяйственной птицы, свиней и жвачных, особенно предпочтительно для рыб и ракообразных:
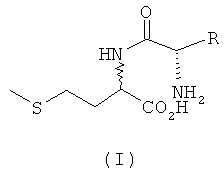
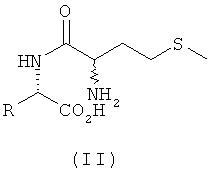
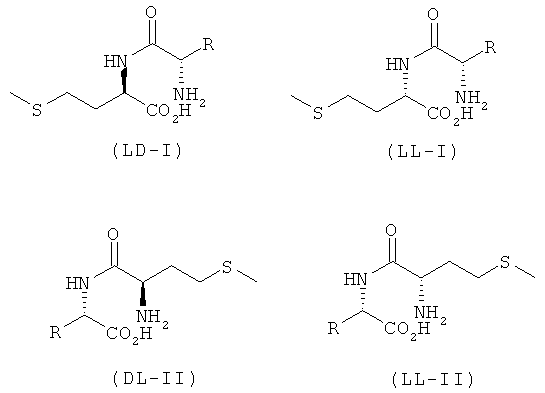
L-EAA-DL-метионин (I) существует в виде обоих диастереомеров L-EAA-D-Met (LD-I) и L-EAA-L-Met (LL-I). Равным образом и дипептид DL-метионил-L-EAA (II) существует в виде двух разных стереоизомеров D-Met-L-EAA (DL-II) и L-Met-L-EAA (LL-II). При этом только оба диастереомера L-EAA-L-Met (LL-I) и L-Met-L-EAA (LL-II) являются природными, тогда как оба других диастереомера L-EAA-D-Met (LD-I) и D-Met-L-EAA (DL-II) являются неприродными (см. схему 1).
Схема 1
Остаток R в ЕАА имеет при этом следующие значения:
в формуле Ia, соотв. IIa R обозначает 1-метилэтил- (валин)
в формуле Ib, соотв. IIb R обозначает 2-метилпропил- (лейцин)
в формуле Ic, соотв. IIc R обозначает (1S)-1-метилпропил- (изолейцин)
в формуле Id, соотв. IId R обозначает (1R)-1-гидроксиэтил- (треонин)
в формуле Ie, соотв. IIe R обозначает 4-аминобутил- (лизин)
в формуле If, соотв. IIf R обозначает 3-[(аминоиминометил)- (аргинин)
амино]пропил-
в формуле Ig, соотв. IIg R обозначает бензил- (фенилаланин)
в формуле Ih, соотв. IIh R обозначает (1H-имидазол-4-ил)метил- (гистидин)
в формуле Ij, соотв. IIj R обозначает (1H-индол-3-ил)метил- (триптофан)
При этом стереоизомеры L-EAA-D-метионин (LD-I), L-EAA-L-метионин (LL-I), D-метионил-L-ЕАА (DL-II) и L-метионил-L-ЕАА (LL-II) можно использовать индивидуально или в виде смесей между собой в качестве кормовой добавки, предпочтительно в качестве добавки к кормам для сельскохозяйственной птицы, свиней, жвачных, рыб, ракообразных, а также домашних животных.
Наряду с разработкой нового способа синтеза L-EAA-DL-метионина (I) и DL-метионил-L-ЕАА (II) одним из основных объектов настоящего изобретения является также применение соединений формул I и II в виде смеси диастереомеров, представляющей собой смесь из D-метионил-L-ЕАА (DL-II) и L-метионил-L-ЕАА (LL-II), соответственно смесь из L-EAA-D-метионина (LD-I) и L-EAA-L-метионина (LL-I), или в виде индивидуального диастереомера, представляющего собой D-метионил-L-ЕАА (DL-II), L-метионил-L-ЕАА (LL-II), L-EAA-D-метионин (LD-I), соответственно L-EAA-L-метионин (LL-I), в качестве ростостимулирующего кормового средства для сельскохозяйственной птицы, свиней и жвачных, а также для всеядных, плотоядных и растительноядных рыб и ракообразных в аквакультурных хозяйствах. Помимо этого применение L-EAA-DL-метионина (I), соответственно DL-метионил-L-EAA (II) в качестве кормовой добавки позволяет повысить лактацию у высокопродуктивных молочных коров.
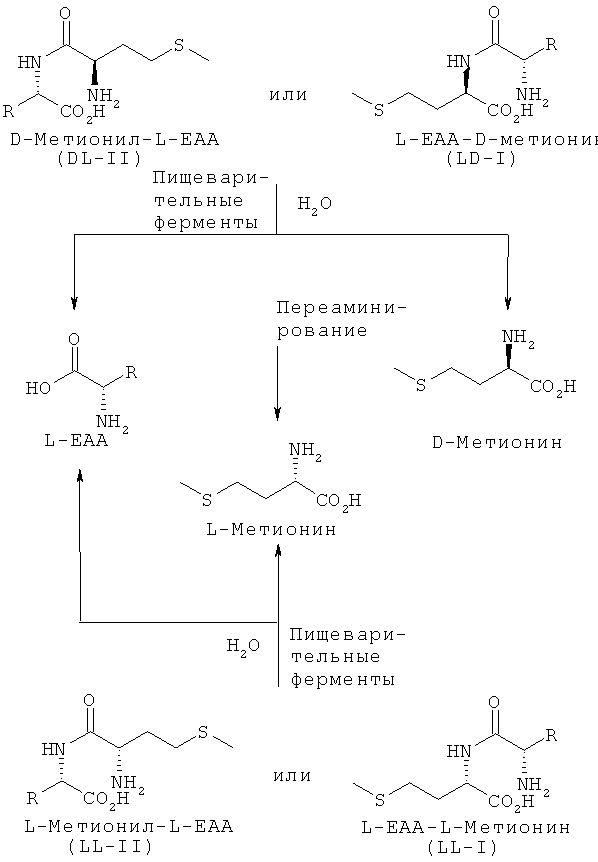
Так, в частности, согласно изобретению было установлено, что L-EAA-DL-метионин (I), соответственно DL-метионил-L-EAA (II) в виде смеси диастереомеров, представляющей собой смесь из L-EAA-D-метионина (LD-I) и L-EAA-L-метионина (LL-I) в соотношении 50:50, соответственно смесь из D-метионил-L-EAA (DL-II) и L-метионил-L-EAA (LL-II) в соотношении 50:50, либо в виде соответствующего индивидуального диастереомера может в физиологических условиях ферментативно расщепляться в организме кур, свиней, коров, рыб, таких, например, как карпы и форели, а также ракообразных, таких, например, как Litopenaeus Vannamei (белая тихоокеанская креветка) и Macrobrachium Rosenbergii (гигантская пресноводная креветка), на свободный D-, соответственно L-метионин и соответственно на L-EAA (см. схему 2).
Для этого, например, из кур, всеядных карпов, плотоядных форелей и всеядных белых тихоокеанских креветок (Litopenaeus Vannamei) выделяли соответствующие пищеварительные ферменты, которые в оптимизированных опытах in vitro подвергали в условиях, сравнимых с физиологическими, взаимодействию с DL-метионил-L-EAA (II) в виде смеси диастереомеров, представляющей собой смесь из D-метионил-L-EAA (DL-II) и L-метионил-L-ЕАА (LL-II) в соотношении 50:50, соответственно с L-EAA-DL-метионином (I), представляющим собой смесь из L-EAA-D-метионина (LD-I) и L-EAA-L-метионина (LL-I) в соотношении 50:50, либо с каждым из соответствующих индивидуальных диастереомеров, представляющим собой D-метионил-L-EAA (DL-II), L-метионил-L-EAA (LL-II), L-EAA-D-метионин (LD-I) или L-EAA-L-метионин (LL-I). Согласно изобретению особенность расщепления L-EAA-DL-метионина (I), соответственно DL-метионил-L-EAA (II) заключается в том, что наряду с двумя природными диастереомерами - L-EAA-L-метионином (LL-I) и L-метионил-L-ЕАА (LL-II) - в физиологических условиях могут расщепляться также два неприродных диастереомера - L-EAA-D-метионин (LD-I) и D-метионил-L-EAA (DL-II) (см. фиг.1-17). Сказанное относится и к применению смеси D-метионил-L-ЕАА (DL-II) и L-метионил-L-ЕАА (LL-II), смеси D-метионил-L-EAA (DL-II) и L-EAA-D-метионина (LD-I) (см. фиг.12), соответственно смеси L-метионил-L-EAA (LL-II) и L-EAA-D-метионина (LD-I) (см. фиг.12), и к применению общей смеси всех диастереомеров, и к применению каждого из индивидуальных диастереомеров (см. фиг.1-11 и 13-17).
Схема 2
Природные дипептиды L-EAA-L-Met (LL-I) и L-Met-L-EAA (LL-II) расщепляли действием пищеварительных ферментов, выделенных из плотоядных радужных форелей, всеядных зеркальных карпов, всеядных белых тихоокеанских креветок и кур (см. таблицу 1).
Дипептид
Для этого из пищеварительных трактов рыб и морских креветок выделяли ферменты. Затем полученными растворами ферментов расщепляли дипептиды L-EAA-L-Met (LL-I) и L-Met-L-EAA (LL-II). Для лучшей сопоставимости перевариваемости дипептидов ферментами, выделенными из различных видов животных, использовали такие же условия, что и в опытах по перевариванию in vitro (37°C, pH 9).
Все природные дипептиды расщеплялись под действием пищеварительных ферментов, выделенных из плотоядной радужной форели (см. фиг.3 и 4), всеядного зеркального карпа (см. фиг.1 и 2), всеядной белой тихоокеанской креветки (см. фиг.5 и 6) и курицы (см. фиг.16). Процессы расщепления L-Met-L-EAA (LL-II) обычно протекают несколько быстрее, чем процессы расщепления аналогичных дипептидов L-EAA-L-Met (LL-I).
С целью максимально наглядно продемонстрировать ферментативное расщепление неприродных дипептидов - L-EAA-D-Met (LD-I) и D-Met-L-EAA (DL-II) - под действием пищеварительных ферментов, выделенных из рыб различных видов, исследования проводили в соответствии с приведенной ниже экспериментальной матрицей (см. таблицу 2).
Вид
Для этого из пищеварительных трактов рыб и морских креветок выделяли ферменты. Затем полученными растворами ферментов расщепляли химически синтезированные дипептиды L-EAA-D-Met (LD-I) и D-Met-L-EAA (DL-II). Для лучшей сопоставимости перевариваемости дипептидов ферментами, выделенными из различных видов животных, использовали такие же условия, что и в опытах по перевариванию in vitro (37°C, pH 9).
Все неприродные дипептиды L-EAA-D-Met (LD-I) и D-Met-L-EAA (DL-II) расщепляются под действием пищеварительных ферментов, выделенных из всеядного зеркального карпа (см. фиг.7), растительноядного белого амура (см. фиг.8), плотоядной радужной форели (см. фиг.11), всеядной белой тихоокеанской креветки (см. фиг.10) и курицы (см. фиг.17). Процессы расщепления D-Met-L-EAA (DL-II) протекают несколько медленнее, чем процессы расщепления аналогичных дипептидов L-EAA-D-Met (LD-I). Под действием же пищеварительных ферментов, выделенных из тиляпии (см. фиг.9), расщепление D-Met-L-EAA (DL-II) происходило быстрее, чем расщепление дипептидов L-EAA-D-Met (LD-I). Наиболее быстро перевариваются дипептиды D-Met-L-Lys (DL-IIe) и L-Lys-D-Met (LD-Ie). Преобладающая часть лизинсодержащих дипептидов в условиях реакции in vitro расщеплялась под действием всех использовавшихся пищеварительных ферментов уже по истечении 5 ч.
Полученные результаты свидетельствуют о том, что каждый использовавшийся неприродный дипептид (см. фиг.7-11 и 17) может расщепляться под действием пищеварительных ферментов рыб различных видов, морских креветок и кур. При этом применение ферментов, выделенных из плотоядных радужных форелей, всеядных зеркальных карпов, тиляпий, белых тихоокеанских креветок, растительноядных белых амуров, а также кур позволило экспериментально подтвердить, что неприродные дипептиды L-EAA-D-Met (LD-I) и D-Met-L-EAA (DL-II) могут расщепляться in vitro животными всех видов несмотря на явные различия в их пищеварительных системах. Добавление дипептидов L-EAA-D-Met (LD-I) и/или D-Met-L-EAA (DL-II) к корму позволяет, таким образом, целенаправленно дозировать присутствующие в нем в недостатке незаменимые аминокислоты (DL-Met и L-EAA).
На примере дипептидов на основе аминокислот - L-триптофана и DL-метионина - исследовали расщепление смесей природных и неприродных дипептидов. Смесь диастереомеров, состоящая из обоих неприродных дипептидов L-Trp-D-Met (LD-Ij) и D-Met-L-Trp (DL-IIj), расщеплялась полностью, равно как и смесь из природного дипептида L-Met-L-Trp (LL-IIj) и неприродного дипептида L-Trp-D-Met (LD-Ij). Эффект "замедленного высвобождения" выражен у смеси LD-Ij/DL-IIj гораздо более явно, чем у смеси LD-Ij'/LL-IIj, т.е. аминокислоты триптофан и метионин высвобождаются при ферментативном переваривании дипептидов медленнее друг по отношению к другу и в течение более продолжительного периода времени.
Положенная в основу изобретения задача решается также с помощью дипептида или его соли общей формулы DL-метионил-DL-EAA или DL-EAA-DL-метионин, где ЕАА обозначает аминокислоту, предпочтительно в L-конфигурации, выбранную из группы, включающей лизин, треонин, триптофан, гистидин, валин, лейцин, изолейцин, фенилаланин, аргинин, цистеин и цистин. При этом равным образом предпочтителен метионильный остаток в D-, соответственно L-конфигурации. К подобным дипептидам относятся Met-Lys, Met-Thr, Met-Trp, Met-His, Met-Val, Met-Leu, Met-Ile, Met-Phe, Met-Arg, Met-Cys и Met-цистин, в каждом случае в конфигурациях DD, LD, DL и LL, а также Lys- Met, Thr-Met, Trp-Met, His-Met, Val-Met, Leu-Met, He-Met, Phe-Met, Arg-Met, Cys-Met и цистин-Met, в каждом случае в конфигурациях DD, LD, DL и LL.
Положенная в основу изобретения задача решается далее с помощью способа получения дипептида, содержащего только один метионильный остаток, формулы DD/LL/DL/LD-I или DD/LL/DL/LD-II:
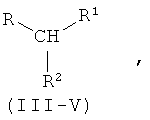
путем взаимодействия аминокислоты с производным мочевины одной из общих формул III-V
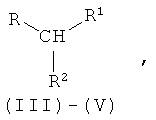
где R имеет следующие значения:
в формулах Ia-Va R обозначает 1-метилэтил- (валин)
в формулах Ib-Vb R обозначает 2-метилпропил- (лейцин)
в формулах Ic-Vc R обозначает (1S)-1-метилпропил- (изолейцин)
в формулах Id-Vd R обозначает (1R)-1-гидроксиэтил- (треонин)
в формулах Ie-Ve R обозначает 4-аминобутил- (лизин)
в формулах If-Vf R обозначает 3-[(аминоиминометил)- (аргинин)
амино]пропил-
в формулах Ig-Vg R обозначает бензил- (фенилаланин)
в формулах Ih-Vh R обозначает (1H-имидазол-4-ил)метил- (гистидин)
в формулах Ij-Vj R обозначает (1H-индол-3-ил)метил- (триптофан)
в формулах Ik-Vk R обозначает -CH2-SH (цистеин)
в формулах Im-Vm R обозначает -CH2-S-S-CH2-CNH2-COOH (цистин)
в формулах IIIn-Vn R обозначает -СН2-СН2-3-СН3 (метионин)
остатки R и R в производных мочевины формул III, IV и V имеют следующие значения:
в формулах IIIa-IIIn R1 обозначает СООН, а R2 обозначает NHCONH2,
в формулах IVa-IVn R1 обозначает CONH2, а R2 обозначает NHCONH2,
в формулах Va-Vn R1-R2 обозначают -CONHCONH-,
при этом либо R представляет собой метионильный остаток, а добавленная аминокислота выбрана из группы, включающей лизин, треонин, триптофан, гистидин, валин, лейцин, изолейцин, фенилаланин, аргинин, цистеин и цистин, либо добавленная аминокислота представляет собой метионин, а R представляет собой аминокислотный остаток, выбранный из группы, включающей лизин, треонин, триптофан, гистидин, валин, лейцин, изолейцин, фенилаланин, аргинин, цистеин и цистин.
В одном из предпочтительных вариантов в качестве исходного продукта используют или в качестве промежуточного продукта образуют метионингидантоин или гидантоин аминокислоты, выбранной из группы, включающей лизин, треонин, триптофан, гистидин, валин, лейцин, изолейцин, фенилаланин, аргинин, цистеин и цистин.
В одном из вариантов осуществления предлагаемого в изобретении способа предпочтительно подвергать раствор, содержащий метионингидантоин (Vn) и воду, взаимодействию с аминокислотой в основных условиях либо подвергать раствор, содержащий гидантоин аминокислоты, выбранной из группы, включающей лизин, треонин, триптофан, гистидин, валин, лейцин, изолейцин, фенилаланин, аргинин, цистеин и цистин, и воду, взаимодействию с метионином в основных условиях.
В еще одном варианте осуществления предлагаемого в изобретении способа при этом предпочтительно использовать в качестве исходного продукта метионингидантоин (Vn) либо промежуточно образовывать его в качестве промежуточного продукта. Ниже на схеме 3 проиллюстрирован предпочтительный вариант с получением DL-метионил-L-ЕАА (II) непосредственно из метионингидантоина (Vn) и N-карбамоилметионина (IIIn), соответственно амида N-карбамоилметионина (IVn) в соответствии с методом А.
Схема 3
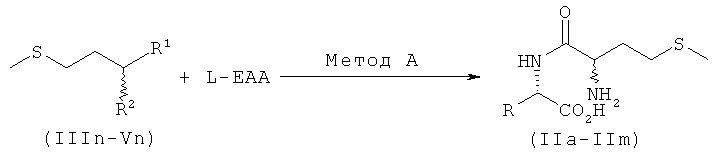
Предпочтительно далее устанавливать значение pH раствора, содержащего производное мочевины, на 7-14, более предпочтительно на 8-13, особенно предпочтительно на 9-12.
В предпочтительном варианте реакцию проводят при температуре от 30 до 200°С, более предпочтительно от 80 до 170°С, особенно предпочтительно от 120 до 160°С.
Помимо этого реакцию предпочтительно проводить под давлением, предпочтительно под давлением в пределах от 2 до 100 бар, более предпочтительно от 4 до 60 бар, особенно предпочтительно от 8 до 40 бар.
В еще одном предпочтительном варианте раствор, содержащий метионингидантоин и воду, или раствор, содержащий гидантоин аминокислоты, выбранной из группы, включающей лизин, треонин, триптофан, гистидин, валин, лейцин, изолейцин, фенилаланин, аргинин, цистеин и цистин, и воду, предварительно образован из одного или нескольких соединений IIIa-IIIn, IVa-IVn и Va-Vn. В другом варианте можно также в качестве предшественников гидантоина использовать соответствующий аминонитрил, циангидрин или смесь из соответствующего альдегида, синильной кислоты и аммиака, соответственно также смесь из соответствующего альдегида и аммониевых и цианидных солей.
В еще одном предпочтительном варианте осуществления предлагаемого в изобретении способа предусмотрено выполнение следующих стадий:
а) взаимодействие производного мочевины формулы IIIa-IIIn, IVa-IVn или Va-Vn с аминокислотой с получением дикетопиперазина формулы VIa-VIm
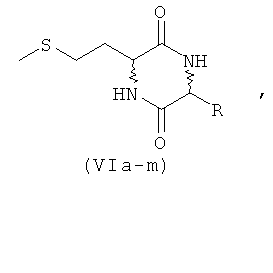 где R имеет указанные выше значения,
где R имеет указанные выше значения,
б) взаимодействие дикетопиперазина формулы VI с получением смеси из дипептидов формул DD/LL/DL/LD-I и DD/LL/DL/LD-II
где R имеет указанные выше значения.
Реакция по превращению производного мочевины формул IIIn, IVn и Vn в дикетопиперазин формулы VIa-VIm и последующая реакция по превращению этого дикетопиперазина с получением смеси диастереомеров, содержащей предпочтительные дипептиды L-EAA-DL-метионин (I) и DL-метионил-L-EAA (II), проиллюстрированы на схеме 4.
Схема 4
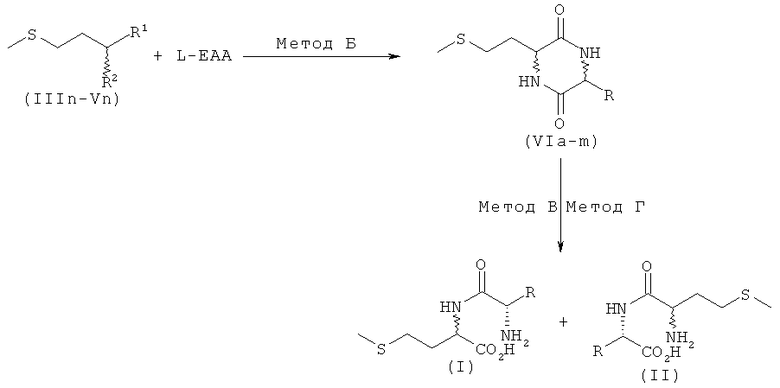
На приведенной выше схеме представлена реакция по превращению дикетопиперазина VIa-VIm в смесь из предпочтительных дипептидов - L-EAA-DL-метионина (I) и DL-метионил-L-EAA (II). Этот вариант осуществления предлагаемого в изобретении способа охватывает представленные на схеме 4 методы Б, В и Г. В этих вариантах дикетопиперазин VIa-VIm в каждом случае образуется в качестве промежуточного продукта.
Взаимодействие производного мочевины с аминокислотой с получением дикетопиперазина предпочтительно проводить при температуре в пределах от 20 до 200°С, более предпочтительно от 40 до 180°С, особенно предпочтительно от 100 до 170°С.
В одном из предпочтительных вариантов осуществления описанного выше способа взаимодействие производного мочевины с аминокислотой с получением дикетопиперазина проводят под давлением, предпочтительно под давлением в пределах от 2 до 90 бар, более предпочтительно от 4 до 70 бар, особенно предпочтительно от 5 до 50 бар.
Взаимодействие производного мочевины с аминокислотой с получением дикетопиперазина предпочтительно далее проводить в присутствии основания. Такое основание предпочтительно при этом выбирать из группы, включающей азотсодержащие основания, NH4HCO3, (NH4)2СО3, KНСО3, K2СО3, смесь NH4OH/СО2, карбаматные соли, а также основания щелочных и щелочноземельных металлов.
В еще одном предпочтительном варианте осуществления предлагаемого в изобретении способа реакцию по получению дикетопиперазина проводят, либо подвергая производное мочевины формулы
где R обозначает метионильный остаток, взаимодействию с аминокислотой, выбранной из группы, включающей лизин, треонин, триптофан, гистидин, валин, лейцин, изолейцин, фенилаланин, аргинин, цистеин и цистин, либо подвергая производное мочевины формулы

где R представляет собой аминокислотный остаток, выбранный из группы, включающей лизин, треонин, триптофан, гистидин, валин, лейцин, изолейцин, фенилаланин, аргинин, цистеин и цистин, взаимодействию с аминокислотой - метионином.
В одном из предпочтительных вариантов осуществления предлагаемого в изобретении способа, предусматривающего превращение производного мочевины в дикетопиперазин взаимодействием с метионином, производное мочевины и метионин особенно предпочтительно использовать в соотношении между ними от 1:100 до 1:0,5.
В еще одном предпочтительном варианте осуществления предлагаемого в изобретении способа дикетопиперазин превращают в смесь из дипептидов формул I и II путем кислотного гидролиза. Путем такого кислотного гидролиза предпочтительно при этом превращать дикетопиперазин в смесь из L-EAA-DL-метионина (I) и DL-метионил-L-EAA (II).
Кислотный гидролиз проводят при этом в присутствии кислоты, предпочтительно выбираемой из группы, включающей минеральные кислоты, HCl, Н2СО3, СО2/Н2О, H2SO4, фосфорные кислоты, карбоновые кислоты и гидроксикарбоновые кислоты.
В другом предпочтительном варианте осуществления предлагаемого в изобретении способа дикетопиперазин превращают в смесь из дипептидов (I) и (II) путем основного гидролиза. Путем такого основного гидролиза предпочтительно при этом превращать дикетопиперазин в смесь из L-EAA-DL-метионина (I) и DL-метионил-L-EAA (II).
Основный гидролиз предпочтительно при этом проводить при значении pH в пределах от 7 до 14, более предпочтительно от 8 до 13, особенно предпочтительно от 9 до 12. При этом может происходить полная рацемизация. Основные условия можно создавать с использованием вещества, предпочтительно выбираемого из группы, включающей азотсодержащие основания, NH4HCO3, (NH4)2СО3, смесь NH4OH/CO2, карбаматные соли, KНСО3, K2СО3, карбонаты, а также основания щелочных и щелочноземельных металлов.
Кислотный, соответственно основный гидролиз предпочтительно проводить при температуре в пределах от 50 до 200°С, более предпочтительно от 80 до 180°С, особенно предпочтительно от 90 до 160°С.
В одном из предпочтительных вариантов аминокислотный остаток в производном мочевины формул III-V представлен в D- или L-конфигурации либо в смеси из D- и L-конфигураций, предпочтительно в смеси из D- и L-конфигураций, когда производное мочевины образовано из метионина.
В еще одном предпочтительном варианте аминокислотный остаток в производном мочевины формул III-V представлен в D- или L-конфигурации либо в смеси из D- и L-конфигураций, предпочтительно в L-конфигурации, когда производное мочевины образовано из аминокислоты, выбранной из группы, включающей лизин, треонин, триптофан, гистидин, валин, лейцин, изолейцин, фенилаланин, аргинин, цистеин и цистин.
В следующем предпочтительном варианте осуществления предлагаемого в изобретении способа им получают дипептиды, которые представлены в виде смеси из LL, DL, LD и DD, предпочтительно в виде смеси из LL, LD, DL.
В одном из предпочтительных вариантов осуществления предлагаемого в изобретении способа дикетопиперазин выделяют перед гидролизом. Дикетопиперазин предпочтительно при этом выделять из реакционного раствора путем кристаллизации, предпочтительно при температуре в пределах от -30 до 120°С, особенно предпочтительно от 10 до 70°С.
Для выделения смеси диастереомеров в виде дипептидов формулы DD/LL/DL/LD-(I) и DD/LL/DL/LD-(II), предпочтительно смеси диастереомеров в виде смеси из L-EAA-DL-метионина (I) и DL-метионил-L-EAA (II), из основных реакционных растворов их подкисляют и получают продукт путем кристаллизации, соответственно осаждения. Предпочтительно при этом устанавливать значение pH на величину в пределах от 2 до 10, более предпочтительно от 3 до 9, особенно предпочтительно на соответствующую изоэлектрическую точку конкретного дипептида формул I и II. Для подкисления при этом можно использовать кислоты, предпочтительно выбираемые из группы, включающей минеральные кислоты, HCl, Н2СО3, СО2/Н2О, H2SO4, фосфорные кислоты, карбоновые кислоты и гидроксикарбоновые кислоты.
Для выделения смеси диастереомеров в виде дипептидов формул DD/LL/DL/LD-(I) и DD/LL/DL/LD-(II), предпочтительно смеси диастереомеров в виде смеси из L-EAA-DL-метионина (I) и DL-метионил-L-EAA (II), из кислых реакционных растворов их нейтрализуют добавлением оснований и получают продукт путем кристаллизации, соответственно осаждения. Предпочтительно при этом устанавливать значение pH на величину в пределах от 2 до 10, более предпочтительно от 3 до 9, особенно предпочтительно на соответствующую изоэлектрическую точку конкретного дипептида формул I и II. Для нейтрализации при этом используют основания, предпочтительно выбираемые из группы, включающей NH4HCO3, (NH4)2СО3, азотсодержащие основания, NH4OH, карбаматные соли, KНСО3, K2СО3, карбонаты, а также основания щелочных и щелочноземельных металлов.
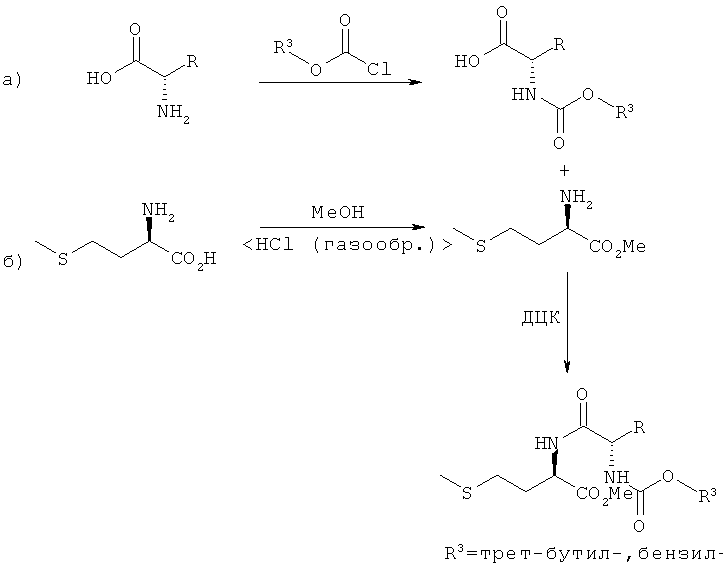
Еще один альтернативный вариант осуществления предлагаемого в изобретении способа предусматривает синтез неприродных дипептидов - L-EAA-D-метионина Ia-Ij, соответственно D-метионил-L-EAA IIa-IIj - с применением техники защитных групп. Так, в частности, для синтеза дипептидов типа L-EAA-D-метионина (LD-I) сначала аминогруппу свободной L-EAA защищали защитной ВОС-группой (трет-бутоксикарбонилом-). В другом варианте можно также успешно использовать защитную Z-группу (бензоксикарбонил-). D-Метионин этерифицировали метанолом, защищая таким путем кислотную функциональную группу. После этого защищенную ВОС-, соответственно Z-группой аминокислоту L-EAA подвергали реакции сочетания с метиловым эфиром D-метионина с применением дициклогексилкарбодиимида (ДЦК) (см. схему 5).
Схема 5
После очистки BOC-L-EAA-D-метионин-ОМе, соответственно Z-L-EAA-D-метионин-ОМе сначала в мягких основных условиях расщепляли метиловый эфир. Затем в кислых условиях взаимодействием с HBr в ледяной уксусной кислоте отщепляли защитную ВОС-, соответственно Z-группу и свободный дипептид - L-EAA-D-метионин (LD-I) - очищали путем переосаждения и перекристаллизации (см. схему 6).
Схема 6
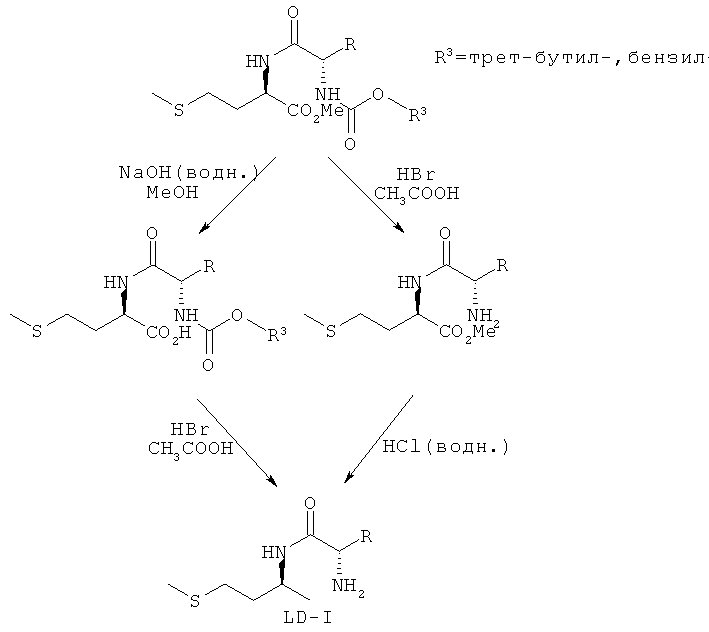
В другом варианте можно также сначала подвергать защищенный ВОС-группой метиловый эфир дипептида - BOC-L-EAA-D-метионин-ОМе - взаимодействию с HBr в ледяной уксусной кислоте для удаления тем самым защитной ВОС-группы. После упаривания затем можно расщеплять метиловый эфир добавлением разбавленного раствора соляной кислоты. Затем свободный дипептид - L-EAA-D-метионин (LD-I) - можно и в этом случае очищать путем переосаждения и перекристаллизации (см. схему 6).
Весь описанный выше процесс можно также использовать применительно к дипептидам в виде L-EAA-D-метионина формул Ia-Ij. При этом использовали метиловые эфиры L-EAA и защищенного ВОС-, соответственно Z-группой D-метионина.
Все описанные выше варианты осуществления предлагаемого в изобретении способа предпочтительно проводить в водной среде.
Помимо этого описанные выше варианты осуществления предлагаемого в изобретении способа можно проводить в известном специалистам периодическом или непрерывном режиме.
Графические материалы
На фиг.1 в графическом виде представлено расщепление дипептидов L-EAA-L-Met (LL-I) под действием ферментов, выделенных из зеркального карпа.
На фиг.2 в графическом виде представлено расщепление дипептидов L-Met-L-EAA (LL-II) под действием ферментов, выделенных из зеркального карпа.
На фиг.3 в графическом виде представлено расщепление дипептидов L-EAA-L-Met (LL-I) под действием ферментов, выделенных из радужной форели.
На фиг.4 в графическом виде представлено расщепление дипептидов L-Met-L-EAA (LL-II) под действием ферментов, выделенных из радужной форели.
На фиг.5 в графическом виде представлено расщепление дипептидов L-EAA-L-Met (LL-I) под действием ферментов, выделенных из белой тихоокеанской креветки.
На фиг.6 в графическом виде представлено расщепление дипептидов L-Met-L-EAA (LL-II) под действием ферментов, выделенных из белой тихоокеанской креветки.
На фиг.7 в графическом виде представлено расщепление дипептидов L-EAA-D-Met (LD-I) и D-Met-L-EAA (DL-II) под действием ферментов, выделенных из зеркального карпа.
На фиг.8 в графическом виде представлено расщепление дипептидов L-EAA-D-Met (LD-I) и D-Met-L-EAA (DL-II) под действием ферментов, выделенных из белого амура.
На фиг.9 в графическом виде представлено расщепление дипептидов L-EAA-D-Met (LD-I) и D-Met-L-EAA (DL-II) под действием ферментов, выделенных из тиляпии.
На фиг.10 в графическом виде представлено расщепление дипептидов L-EAA-D-Met (LD-I) и D-Met-L-EAA (DL-II) под действием ферментов, выделенных из белой тихоокеанской креветки.
На фиг.11 в графическом виде представлено расщепление дипептидов L-EAA-D-Met (LD-I) и D-Met-L-EAA (DL-II) под действием ферментов, выделенных из радужной форели.
На фиг.12 в графическом виде представлено расщепление смесей из L-Trp-D-Met/D-Met-L-Trp (LD-Ij/DL-IIj) и L-Trp-D-Met/L-Met-L-Trp (LD-Ij/LL-IIj) под действием ферментов, выделенных из зеркального карпа.
На фиг.13 в графическом виде представлены результаты опытов in vitro по расщеплению природных дипептидов L-Ile-L-Met (LL-Ic), соответственно L-Met-L-Ile (LL-IIc) под действием 1%-ного раствора ферментов, выделенных из зеркального карпа, и неприродных дипептидов L-Ile-D-Met (LD-Ic), соответственно D-Met-L-Ile (DL-IIc) под действием 10%-ного раствора ферментов, выделенных из зеркального карпа.
На фиг.14 в графическом виде представлены результаты опытов in vitro по расщеплению природных дипептидов L-Thr-L-Met (LL-Id), соответственно L-Met-L-Thr (LL-IId) под действием 1%-ного раствора ферментов, выделенных из зеркального карпа, и неприродных дипептидов L-Thr-D-Met (LD-Id), соответственно D-Met-L-Thr (DL-IId) под действием 10%-ного раствора ферментов, выделенных из зеркального карпа.
На фиг.15 в графическом виде представлены результаты опытов in vitro по расщеплению природных дипептидов L-Lys-L-Met (LL-Ie), соответственно L-Met-L-Lys (LL-IIe) под действием 1%-ного раствора ферментов, выделенных из зеркального карпа, и неприродных дипептидов L-Lys-D-Met (LD-Ie), соответственно D-Met-L-Lys (DL-IIe) под действием 10%-ного раствора ферментов, выделенных из зеркального карпа.
На фиг.16 в графическом виде представлено расщепление дипептидов L-Met-L-EAA (LL-II) под действием ферментов, выделенных из курицы.
На фиг.17 в графическом виде представлено расщепление дипептидов L-EAA-D-Met (LD-I) и D-Met-L-EAA (DL-II) под действием ферментов, выделенных из курицы.
Примеры
Пример 1: Общая методика синтеза неприродных дипептидов - L-EAA-D-метионина Ia-Ii, соответственно D-метионил-L-EAA IIa-IIj - с применением техники защитных групп
Для синтеза дипептидов типа L-EAA-D-метионина (LD-I) сначала аминогруппу свободной L-EAA защищали защитной ВОС-группой (трет-бутоксикарбонилом-). В другом варианте можно также успешно использовать защитную Z-группу (бензоксикарбонил-). D-Метионин этерифицировали метанолом, защищая таким путем кислотную функциональную группу. После этого защищенную ВОС-, соответственно Z-группой аминокислоту L-EAA подвергали реакции сочетания с метиловым эфиром D-метионина с применением дициклогексилкарбодиимида (ДЦК) (см. схему 5).
Схема 5

После очистки BOC-L-EAA-D-метионин-ОМе, соответственно Z-L-EAA-D-метионин-ОМе сначала в мягких основных условиях расщепляли метиловый эфир. Затем в кислых условиях взаимодействием с HBr в ледяной уксусной кислоте отщепляли защитную ВОС-, соответственно Z-группу и свободный дипептид - L-EAA-D-метионин (LD-I) - очищали путем переосаждения и перекристаллизации (см. схему 6).
Схема 6

В другом варианте можно также сначала подвергать защищенный ВОС-группой метиловый эфир дипептида - BOC-L-EAA-D-метионин-ОМе - взаимодействию с HBr в ледяной уксусной кислоте для удаления тем самым защитной ВОС-группы. После упаривания затем можно расщеплять метиловый эфир добавлением разбавленного раствора соляной кислоты. Затем свободный дипептид - L-EAA-D-метионин (LD-I) - можно и в этом случае очищать путем переосаждения и перекристаллизации (см. схему 6).
Весь описанный выше процесс можно также использовать применительно к дипептидам в виде L-EAA-D-метионина формул Ia-Ij. При этом использовали метиловые эфиры L-EAA и защищенного ВОС-, соответственно Z-группой D-метионина.
Пример 2
а) Методика синтеза Z-D-Met
30,0 г (0,201 моля) D-метионина и 42,4 г (0,4 моля) Na2CO3 добавляли в 200 мл воды и охлаждали в ледяной бане до 0°С. После этого медленно добавляли 51,2 г (0,3 моля) карбоксибензилоксихлорида (Cbz-Cl) и реакционную смесь в течение 3 ч перемешивали при комнатной температуре. Затем подкисляли разбавленной соляной кислотой и реакционный раствор трижды экстрагировали метил-трет-бутиловым эфиром (МТБЭ) порциями по 50 мл. Объединенные органические фазы сушили над MgSO4 и концентрировали на ротационном испарителе. Полученный остаток перекристаллизовывали из смеси диэтилового эфира с этилацетатом и сушили в вакууме при 30°С. Таким путем выделили 36,4 г (64%) карбоксибензилокси-D-метионина (Z-D-Met) в виде белого кристаллического твердого вещества.
б) Общая методика синтеза Z-L-EAA
50 ммолей L-EAA и 10,6 г (100 ммолей) Na2CO3 добавляли в 50 мл воды и охлаждали в ледяной бане до 0°С. После этого медленно добавляли 12,8 г (75 ммолей) карбоксибензилоксихлорида (Cbz-Cl) и реакционную смесь в течение 3 ч перемешивали при комнатной температуре. Затем подкисляли разбавленной соляной кислотой и реакционный раствор трижды экстрагировали МТБЭ порциями по 25 мл. Объединенные органические фазы сушили над MgSO4 и концентрировали на ротационном испарителе. Полученный остаток перекристаллизовывали и сушили в вакууме при 30°С.
Пример 3: Методика синтеза D-Met-OMe·HCl
50,0 г (0,335 моля) D-метионина суспендировали в 500 мл метанола и суспензию барботировали газообразным HCl с умеренной скоростью до насыщения. При этом метионин растворялся, а раствор нагревался до 55°С. После этого реакционную смесь оставляли перемешиваться на ночь при комнатной температуре. На следующее утро смесь досуха концентрировали на ротационном испарителе при 40°С и полученный остаток дважды перекристаллизовывали из диэтилового эфира. Таким путем выделили 47,1 г (86%) гидрохлорида метилового эфира D-метионина в виде белого кристаллического твердого вещества.
Пример 4: Общая методика синтеза L-EAA-OMe·HCl
0,3 моля L-EAA суспендировали в 500 мл метанола и суспензию барботировали газообразным HCl с умеренной скоростью до насыщения. При этом аминокислота растворялась, а раствор нагревался до 50-60°С. После этого реакционную смесь оставляли перемешиваться на ночь при комнатной температуре. На следующее утро смесь досуха концентрировали на ротационном испарителе при 40°С и полученный остаток дважды перекристаллизовывали из диэтилового эфира или смеси диэтилового эфира с метанолом.
Пример 5: Общая методика синтеза соединений группы PG-D-Met-L-EAA-ОМе (PG-DL-II-ОМе) (реакция сочетания)
20,0 ммолей гидрохлорида L-EAA-OMe суспендировали в смеси из 30 мл хлороформа и 5 мл метанола, смешивали с 4,15 г (30 ммолей) K2СО3 и перемешивали в течение 1 ч при комнатной температуре. После этого соль отфильтровывали и промывали небольшим количеством хлороформа. После концентрирования фильтрата полученный остаток растворяли в 50 мл тетрагидрофурана, смешивали с 4,37 г (21,0 ммоль, 1,05 экв.) ДЦК и 5,66 г (20,0 ммолей) Z-D-метионина и перемешивали в течение 16 ч при комнатной температуре. После этого реакционную смесь смешивали с 3 мл ледяной уксусной кислоты, перемешивали в течение 30 мин и выпавшее в осадок белое твердое вещество (Н,N'-дициклогексилмочевину) отфильтровывали. Фильтрат концентрировали на ротационном испарителе и возможно выпавшую в осадок N,N'-дициклогексилмочевину отфильтровывали. Маслянистый остаток затем дважды перекристаллизовывали из смеси хлороформа с н-гексаном и сушили в вакууме, создаваемом масляным насосом.
Сокращение "PG" обозначает защитную группу (защитную Z- или ВОС-группу).
5а) Z-D-Met-L-Val-OMe (Z-DL-IIa-OMe)
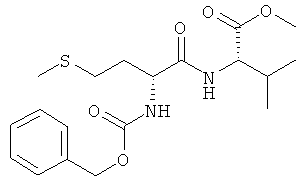
Суммарная формула: C19H28N2O5S (396,50 г/моль), выход: 4,60 г (58%), чистота: 97%, белое твердое вещество.
1Н-ЯМР-спектр соединения Z-D-Met-L-Val-OMe (Z-DL-IIa-OMe) (500 МГц, CDCl3):δ=0,88(d, 3J=6,8 Гц, 3Н, СН3); 0,93 (d,3J=6,8 Гц, 3Н, СН3); 1,90-2,20 (m, 3Н, SCH2CH2, СН(СН3)2); 2,10 (s, 3Н, SCH3); 2,50-2,64 (m, 2H, SCH2); 3,73 (s, 3Н, ОСН3); 4,38-4,44 (m, 1H, CH); 4,48-4,54 (m, 1H, CH); 5,08-5,18 (m, 2H, OCH2); 5,49 (шир. s, 1H, NH); 6,58 (шир. s, 1H, NH); 7,24-7,38 (m, 5H, Ph)
13С-ЯМР-спектр соединения Z-D-Met-L-Val-OMe (Z-DL-IIa-OMe) (125 МГц, CDCl3):δ=15,26; 17,74; 19,01; 30,13; 31,16; 31,67; 52,21; 57,24; 67,22; 128,16; 128,27; 128,58; 136,16; 156,13; 171,01; 171,95
5б) Z-D-Met-L-Leu-OMe (Z-DL-IIb-OMe)
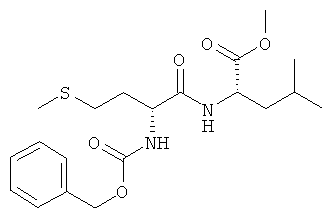
Суммарная формула: C20H30N2O5S (410,53 г/моль), выход: 5,40 г (66%), чистота: 97%, белое твердое вещество.
1Н-ЯМР-спектр соединения Z-D-Met-L-Leu-OMe (Z-DL-IIb-OMe) (500 МГц, D6-ДМСО):δ=0,90-0,95 (m, 6H, СН(СН3)2); 1,50-1,72 (m, 3Н, CH2CH(СН3)2);
1,90-2,15 (m, 2H, SCH2CH2); 2,09 (s, 3H, SCH3); 2,48-2,64 (m, 2H, SCH2); 3,71 (s, 3Н, ОСН3); 4,36-4,44 (m, 1Н, CH); 4,56-4,62 (m, 1H, CH); 5,12 (s, 2H, ОСН2); 5,56 (d, 3J=7,6 Гц, 1H, OC(=O)NH); 6,59 (шир. s, 1H, NH); 7,26-7,36 (m, 5H, Ph)
13С-ЯМР-спектр соединения Z-D-Met-L-Leu-OMe (Z-DL-IIb-OMe) (125 МГц, D6-ДМСО):δ=15,27; 21,86; 22,78; 24,95; 30,11; 31,62; 33,96; 41,35; 50,86; 52,33; 67,20; 128,09; 128,25; 128,57; 156,97; 170,95; 173,01
5в) Z-D-Met-L-Ile-OMe (Z-DL-IIc-OMe)
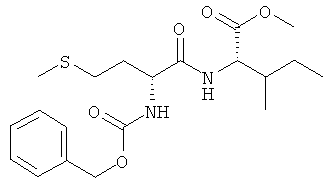
Суммарная формула: C20H30N2O5S (410,53 г/моль), выход: 5,09 г (62%), чистота: 97%, белое твердое вещество.
1Н-ЯМР-спектр соединения Z-D-Met-L-Ile-OMe (Z-DL-IIc-OMe) (500 МГц, CDCl3):δ=0,86-0,94 (m, 6H, СН(СН3)СН2СН3); 1,10-1,45 (m, 2H, СН2СН3); 1,84-1,94 (m, 1H, СН(СН3); 1,94-2,16 (m, 2H, SCH2CH2); 2,10 (s, 3H, SCH3); 2,49-2,64 (m, 2H, SCH2); 3,72 (s, 3Н, ОСН3); 4,36-4,44 (m, 1H, CH); 4,52-4,58 (m, 1H, CH); 5,08-5,18 (m, 2H, OCH2); 5,46 (шир. s, 1H, NH); 6,58 (шир. s, 1H, NH); 7,28-7,38 (m, 5H, Ph)
13С-ЯМР-спектр соединения Z-D-Met-L-Ile-OMe (Z-DL-IIc-OMe) (125 МГц, CDCl3):δ=11,55; 15,26; 15,54; 25,19; 30,12; 31,70; 33,96; 37,79; 52,15; 45,07; 56,55; 67,18; 128,12; 128,24; 128,56; 156,13; 170,92; 171,96
5г) Z-D-Met-L-Thr-OMe (Z-DL-IId-OMe)
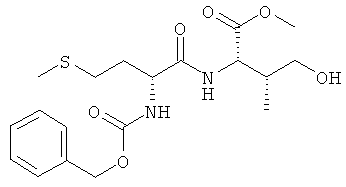
Суммарная формула: C18H26N2O6S (398,47 г/моль), выход: 2,14 г (36%), чистота: 95%, бледно-желтое твердое вещество.
1Н-ЯМР-спектр соединения Z-D-Met-L-Thr-OMe (Z-DL-IId-OMe) (500 МГц, CDCl3):δ=1,10-1,25 (m, 3H, СНСН3); 1,95-2,20 (m, 2H, SCH2CH2); 2,09 (s, 3H, SCH3); 2,49 (шир. s, 1Н, ОН); 2,52-2,62 (m, 2H, SCH2); 3,74 (s, 3H, ОСН3); 4,30-4,56 (m, 3H, 3×СН); 5,12 (s, 2H, ОСН2); 5,70-5,78 (m, 1Н, NH); 7,03 (d, 3J=8,9 Гц, 1Н, NH); 7,28-7,38 (m, 5H, Ph)
13С-ЯМР-спектр соединения Z-D-Met-L-Thr-OMe (Z-DL-IId-OMe) (125 МГц, CDCl3):δ=15,15; 20,05; 30,10; 31,91; 52,66; 54,37; 57,44; 67,23; 67,82; 128,17; 128,26; 128,57; 136,16; 156,18; 171,25; 171,87
5д) Z-D-Met-L-Lys(ВОС)-OMe (Z-DL-IIe(BOC)-OMe)
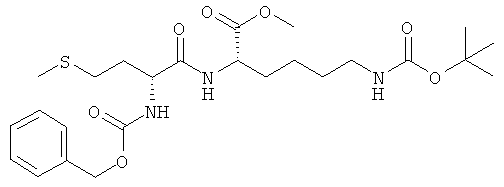
Суммарная формула: C25H39N3O7S (525,66 г/моль), выход: 10,86 г (33%), чистота: 95%, бледно-желтое твердое вещество.
1Н-ЯМР-спектр соединения Z-D-Met-L-Lys(BOC)-OMe (Z-DL-IIe(BOC)-ОМе) (500 МГц, CDCl3):δ=1,25-1,90 (m, 6H, 3×CH2(Lys)); 1,43 (s, 9H, С(СН3)3); 1,92-2,16 (m, 2H, SCH2CH2); 2,09 (s, 3H, SCH3); 2,48-2,62 (m, 2H, SCH2); 3,02- 3,12 (m, 2H, NCH2); 3,72 (s, 3H, ОСН3); 4,35-4,65 (m, 3H, 2×CH, NH); 5,13 (s, 2H, ОСН2); 5,58 (d, 3J=7,5 Гц, 1Н, NH); 6,75 (шир. s, 1H, NH); 7,28-7,36 (m, 5H, Ph)
13С-ЯМР-спектр соединения Z-D-Met-L-Lys(BOC)-OMe (Z-DL-IIe(BOC)-OMe) (125 МГц, CDCl3):δ=15,31; 22,44; 28,45; 29,47; 30,12; 31,82; 52,08; 52,45; 67,20; 79,15; 128,08; 128,25; 128,34; 128,57; 156,07; 170,97; 172,38
5e) Z-D-Met-L-Phe-OMe (Z-DL-IIg-OMe)
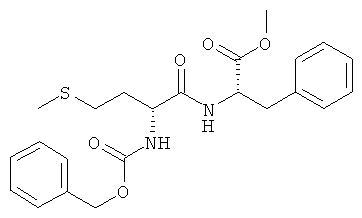
Суммарная формула: C23H28N2O5S (444,54 г/моль), выход: 3,73 г (42%), чистота: 95% (жидкостная хроматография высокого разрешения (ЖХВР)), белое твердое вещество.
1Н-ЯМР-спектр соединения Z-D-Met-L-Phe-OMe (Z-DL-IIg-OMe) (500 МГц, D6-ДМСО/CDCl3):δ=1,72-1,94 (m, 2H, SCH2CH2); 2,01 (s, 3H, SCH3); 2,30-2,38 (m, 2H, SCH2); 2,94-3,14 (m, 2H, CH2Ph); 3,70 (s, 3H, ОСН3); 4,25-4,32 (m, 1H, CHCH2CH2S); 4,70-4,78 (m, 1H, CHCH2Ph); 5,00-5,10 (шир. s, 2H, OCH2Ph); 6,60-6,70 (m, 1H, NH); 7,10-7,35 (m, 10H, 2×Ph); 7,75-7,80 (шир. s, 1H, NH)
5ж) Z-D-Met-L-His-OMe (Z-DL-IIh-OMe)
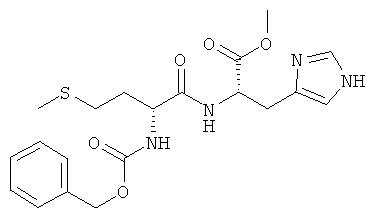
Суммарная формула: C20H26N4O5S (434,51 г/моль), выход: 2,35 г (27%), чистота: 95% (ЖХВР), бледно-желтое твердое вещество.
1H-ЯМР-спектр соединения Z-D-Met-L-His-OMe (Z-DL-IIh-OMe) (500 МГц, CDCl3):δ=1,88-2,14 (m, 2H, SCH2CH2); 2,05 (s, 3Н, SCH3); 2,44-2,56 (m, 2H, SCH2); 3,06-3,14 (m, 2H, СН2-имидазолил); 3,68 (s, 3Н, ОСН3); 4,20-4,40 (m, 2H, NH, CH); 4,70-4,76 (m, 1H, CH); 5,11 (s, 2H, OCH2); 5,91 (d,3J=7,6 Гц, 1Н, NH); 6,76 (шир. s, 1H, СН(имидазолил); 7,26-7,45 (m, 5H, Ph); 7,73 (шир. s, 1H, СН(имидазолил)); 9,30 (шир. s, 1H, NH)
13С-ЯМР-спектр соединения Z-D-Met-L-His-OMe (Z-DL-IIh-OMe) (125 МГц, CDCl3):δ=15,27; 29,94; 31,81; 33,92; 52,46; 67,14; 116,88; 128,02; 128,12; 128,23; 128,49; 128,58; 133,23; 135,20; 136,21; 156,97; 171,17; 171,57
5з) Z-D-Met-L-Trp-OMe (Z-DL-IIj-ОМе)
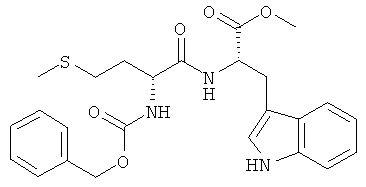
Суммарная формула: C25H29N3O5S (483,58 г/моль), выход: 5,71 г (59%), чистота: 98% (ЖХВР), бледно-желтое твердое вещество.
1Н-ЯМР-спектр соединения Z-D-Met-L-Trp-OMe (Z-DL-IIj-OMe) (500 МГц, D6-ДМСО):δ=1,60-1,80 (m, 2H, SCH2CH2); 1,95 (s, 1H, SCH3); 2,25-2,35 (m, 2H, SCH2); 3,02-3,20 (m, 2H, СН2-индолил); 3,60 (s, 3Н, ОСН3); 4,10-4,16 (m, 1H, CH); 4,50-4,60 (m, 1H, CH); 4,98-5,08 (m, 2H, OCH2); 6,94-7,50 (m, 12H, индолил, Ph, OC(=O)NH); 8,25 (d, 3J=8,6 Гц, 1H, CONH-Trp)
13С-ЯМР-спектр соединения Z-D-Met-L-Trp-OMe (Z-DL-IIj-OMe) (125 МГц, D6-ДМСО):δ=14,42; 27,01; 29,40; 31,59; 51,75; 52,78; 53,60; 65,36; 109,16; 111,31; 117,84; 118,31; 120,86; 123,60; 126,90; 127,59; 127,68; 128,21; 136,02; 136,89; 155,81; 171,32; 172,06
Пример 6: Общая методика синтеза соединений группы PG-L-EAA-D-Met-ОМе (PG-LD-1-OMe) (реакция сочетания)
3,99 г (20,0 ммолей) гидрохлорида метилового эфира D-метионина суспендировали в смеси из 30 мл хлороформа и 5 мл метанола, смешивали с 4,15 г (30 ммолей) K2СО3 и перемешивали в течение 1 ч при комнатной температуре. После этого соль отфильтровывали и промывали небольшим количеством хлороформа. После концентрирования фильтрата полученный остаток растворяли в 50 мл тетрагидрофурана, смешивали с 4,37 г (21,0 ммоль, 1,05 экв.) ДЦК и 20,0 ммолями соответствующей PG-L-EAA (PG-L-аминокислоты) и перемешивали в течение 16 ч при комнатной температуре. После этого реакционную смесь смешивали с 3 мл ледяной уксусной кислоты, перемешивали в течение 30 мин и выпавшее в осадок белое твердое вещество (N,N'-дициклогексилмочевину) отфильтровывали. Фильтрат концентрировали на ротационном испарителе и возможно выпавшую в осадок N,N'-дициклогексилмочевину отфильтровывали. Маслянистый остаток затем дважды перекристаллизовывали из смеси хлороформа с н-гексаном и сушили в вакууме, создаваемом масляным насосом.
Сокращение "PG" обозначает защитную группу (защитную Z- или ВОС-группу).
6а) Z-L-Val-D-Met-OMe (Z-LD-Ia-OMe)
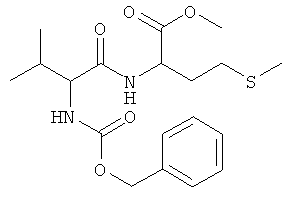
Суммарная формула: C19H28N2O5S (396,50 г/моль), выход: 3,01 г (38%), чистота: 95% (ЖХВР), белое твердое вещество.
1Н-ЯМР-спектр соединения Z-L-Val-D-Met-OMe (Z-LD-Ia-OMe) (500 МГц, CDCl3):δ=0,92 (d, 3J=6,9 Гц, 3Н, СН3); 0,99 (d,3J=6,9 Гц, 3Н, СН3); 1,90-2,25 (m, 3Н, SCH2CH2, СН(СН3)2); 2,07 (s, 3Н, SCH3); 2,44-2,54 (m, 2H, SCH2); 3,74 (s, 3Н, ОСН3); 4,04-4,10 (m, 1Н, CH); 4,67-4,74 (m, 1H, CH); 5,12 (s, 2H, ОСН2); 5,28 (шир. s, 1H, NH); 6,65 (d, 3J=7,5 Гц, 1H, NH); 7,28-7,38 (m, 5H, Ph)
13С-ЯМР-спектр соединения Z-L-Val-D-Met-OMe (Z-LD-Ia-OMe) (125 МГц, CDCl3):δ=15,45; 17,46; 19,30; 29,96; 30,87; 31,40; 51,57; 52,55; 60,37; 67,18; 128,08; 128,24; 128,57; 136,19; 156,38; 171,04; 172,04
6б) Z-L-Leu-D-Met-OMe (Z-LD-Ib-OMe)
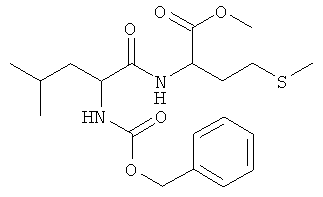
Суммарная формула: C20H30N2O5S (410,53 г/моль), выход: 4,48 г (55%), чистота: 96% (ЖХВР), белое твердое вещество.
1H-ЯМР-спектр соединения Z-L-Leu-D-Met-OMe (Z-LD-Ib-OMe) (500 МГц, CDCl3):δ=0,94 (d, 3J=6,3 Гц, 6Н, СН(СН3)2); 1,48-1,72 (m, 3Н, СН2СН(СН3)2); 1,90-2,20 (m, 2H, SCH2CH2); 2,07 (s, 3h, SCH3); 2,42-2,52 (m, 2H, SCH2); 3,73 (s, 3Н, ОСН3); 4,20-4,30 (m, 1H, CH); 4,64-4,72 (m, 1H, CH); 5,12 (s, 2H, OCH2); 5,23 (d, 3J=7,9 Гц, 1H, NH); 6,84 (d, 3J=7,2 Гц, 1H, NH); 7,28-7,38 (m, 5H, Ph)
13С-ЯМР-спектр соединения Z-L-Leu-D-Met-OMe (Z-LD-Ib-OMe) (125 МГц, CDCl3):δ=15,47; 22,97; 24,81; 29,97; 31,46; 51,58; 52,55; 67,23; 128,09; 128,26; 128,58; 136,16; 156,23; 172,02; 172,09
6в) Z-L-Ile-D-Met-OMe (Z-LD-Ic-OMe)
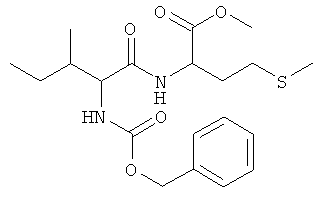
Суммарная формула: C20H30N2O5S (410,53 г/моль), выход: 3,89 г (47%), чистота: 97% (ЖХВР), белое твердое вещество.
1Н-ЯМР-спектр соединения Z-L-Ile-D-Met-OMe (Z-LD-Ic-OMe) (500 МГц, CDCl3):δ=0,91 (t, 3J=7,1 Гц, 3Н, CH2CH3); 0,96 (d, 3J=7,1 Гц; 3Н, СН(СН3); 1,08-1,16 (m, 1H, СН'Н''СН3); 1,46-1,54 (m, 1H, СН'Н''СН3); 1,88-2,20 (m, 3Н, СН(СН3), SCH2CH2); 2,07 (s, 3Н, SCH3); 2,44-2,52 (m, 2H, SCH2); 3,73 (s, 3Н, ОСН3); 4,08-4,16 (m, 1H, CH); 4,66-4,74 (m, 1H, CH); 5,11 (s, 2H, OCH2); 5,34 (d, 3J=7,6 Гц, 1H; NH); 6,74 (d, 3J=8,0 Гц, 1H, NH); 7,28-7,38 (m, 5H, Ph)
13С-ЯМР-спектр соединения Z-L-Ile-D-Met-OMe (Z-LD-Ic-OMe) (125 МГц, CDCl3):δ=11,54; 15,46; 15,68; 24,66; 29,96; 31,42; 37,36; 51,59; 52,57; 59,83; 67,19; 128,10; 128,25; 128,58; 136,20; 156,34; 170,99; 172,03
6г) Z-L-Thr-D-Met-OMe (Z-LD-Id-OMe)
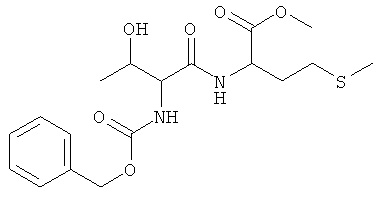
Суммарная формула: C18H26N2O6S (398,47 г/моль), выход: 2,47 г (31%), чистота: 99% (ЖХВР), бледно-желтое твердое вещество.
1Н-ЯМР-спектр соединения Z-L-Thr-D-Met-OMe (Z-LD-Id-OMe) (500 МГц, CDCl3):δ=1,19 (d, 3J=6,4 Гц, 3Н, СН3); 1,94-2,20 (m, 2H, SCH2CH2); 2,06 (s, 3Н, SCH3); 2,45-2,55 (m, 2H, SCH2); 3,73 (s, 3Н, ОСН3); 4,18 (шир. s, 1H, CH); 4,39 (шир. s, 1H; CH); 4,66-4,74 (m, 1H, CH); 5,10-5,18 (m, 2H, OCH2); 5,85 (шир. s, 1H, OC(=O)NH); 7,21 (шир. s, 1H, NH); 7,28-7,38 (m, 5H, Ph)
13С-ЯМР-спектр соединения Z-L-Thr-D-Met-OMe (Z-LD-Id-OMe) (125 МГц, CDCl3):δ=15,43; 18,48; 30,10; 30,91; 51,80; 52,66; 59,16; 66,99; 67,36; 128,04; 128,29; 128,59; 136,08; 156,94; 171,27; 172,25
6д) BOC-L-Lys(ВОС)-D-Met-OMe (BOC-LD-Ie(BOC)-OMe)
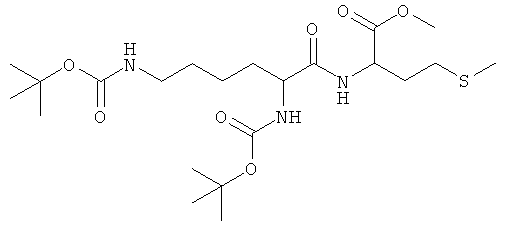
Суммарная формула: C22H41N3O7S (491,64 г/моль), выход: 5,22 г (53,1%), чистота: 97% (ЖХВР), белое аморфное твердое вещество.
1Н-ЯМР-спектр соединения BOC-L-Lys(BOC)-D-Met-OMe (BOC-LD-Ie(BOC)-OMe) (500 МГц, CDCl3):δ=1,32-1,42 (m, 2H, CH2(Lys)); 1,44 (s, 9H, С(СН3)3); 1,45 (s, 9H, С(СН3)3); 1,46-1,56 (m, 2H, CH2(Lys)); 1,60-1,72 (m, 1H, CHCH'H''(Lys)); 1,82-1,92 (m, 1H, CHCH'CH''(Lys); 1,92-2,03 (m, 1H, SCH2CHH'H''); 2,09 (s, 3Н, SCH3); 2,12-2,22 (m, 1H, SCH2CH'H''); 2,51 (t, 3J=7,4 Гц, 2H, SCH2); 3,08-3,16 (m, 2H, NCH2); 3,75 (s, 3Н, ОСН3); 4,02-4,12 (m, 1H, CH); 4,54-4,62 (m, 1H, NH); 4,66-4,74 (m, 1H, CH): 5,06-4,14 (m, 1H, NH); 6,81 (d, 3J=7,4 Гц, 1H,NH)
6e) Z-L-Phe-D-Met-OMe (Z-LD-Ig-OMe)
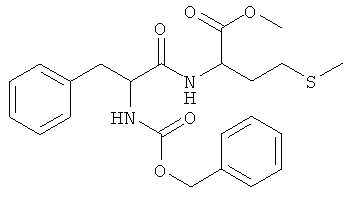
Суммарная формула: C23H28N2O5S (444,54 г/моль), выход: 3,51 г (40%), чистота: 99% (ЖХВР), белое твердое вещество.
1Н-ЯМР-спектр соединения Z-L-Phe-D-Met-OMe (Z-LD-Ig-OMe) (500 МГц, CDCl3):δ=1,78-2,04 (m, 2H, SCH2CH2); 2,02 (s, 3Н, SCH3); 2,20-2,30 (m, 2H, SCH2); 3,02-3,14 (m, 2H, CH2Ph); 3,71 (s, 3Н, ОСН3); 4,40-4,50 (m, 1H, CH); 4,60-4,66 (m, 1H, CH); 5,09 (s, 2H, ОСН2); 5,31 (шир. s, 1H, OC(=O)NH); 6,42 (d, 3J=7,6 Гц, 1H, NH); 7,16-7,36 (m, 10Н, 2×Ph)
13С-ЯМР-спектр соединения Z-L-Phe-D-Met-OMe (Z-LD-Ig-OMe) (125 МГц, CDCl3):δ=15,37; 29,67; 31,35; 38,63; 51,52; 52,53; 56,36; 67,15; 127,18; 128,06; 128,24; 128,57; 128,83; 129,26; 136,13; 136,30; 155,90; 170,63; 171,88
6ж) BOC-L-Phe-D-Met-OMe (BOC-LD-Ig-OMe)
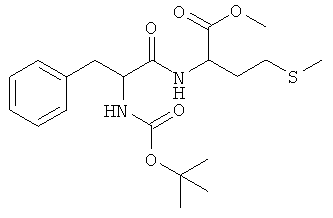
Суммарная формула: C20H30N2O5S (410,53 г/моль), выход: 4,03 г (49%), чистота: 98% (ЖХВР), белое твердое вещество.
1H-ЯМР-спектр соединения BOC-L-Phe-D-Met-OMe (BOC-LD-Ig-OMe) (500 МГц, CDCl3):δ=1,42 (s, 9H, С(СН3)3); 1,80-2,08 (m, 2H, SCH2CH2); 2,04 (s, 3Н, SCH3); 2,24-2,34 (m, 2H, SCH2); 3,07 (d, 3J=7,2 Гц, 2H, CH2Ph); 3,73 (s, 3Н, ОСН3); 4,30-4,42 (m, 1H, CH); 4,60-4,68 (m, 1H, CH); 4,90-5,02 (шир. s, 1H, NH); 6,44 (d, 3J=7,9 Гц, 1H, NH); 7,18-7,34 (m, 5H, Ph)
13С-ЯМР-спектр соединения BOC-L-Phe-D-Met-OMe (BOC-LD-Ig-OMe) (125 МГц, CDCl3):δ=15,39; 28,29; 29,67; 31,51; 38,42; 51,47; 52,50; 56,00; 80,38; 127,07; 128,79; 129,27; 136,60; 156,42; 171,00; 171,94
6з) Z-L-His-D-Met-OMe (Z-LD-Ih-OMe)
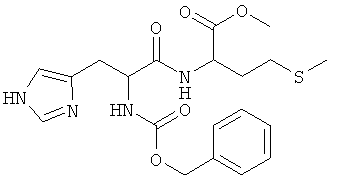
Суммарная формула: C20H26N4O5S (434,51 г/моль), выход: 1,65 г (19%), чистота: 95% (ЖХВР), бледно-желтое твердое вещество.
1Н-ЯМР-спектр соединения Z-L-His-D-Met-OMe (Z-LD-Ih-OMe) (500 МГц, D6-ДМСО/CDCl3):δ=1,82-1,98 (m, 2H, SCH2CH2); 2,01 (s, 3H, SCH3); 2,30-2,44 (m, 2H, SCH2); 2,76-2,94 (m, 2H, СН2-имидазолил); 3,63 (s, 3H, ОСН3); 4,28-4,42 (m, 2H, 2×CH); 5,01 (s, 2H, OCH2); 6,78 (шир. s, 1Н, СН(имидазолил)); 7,25-7,37 (m, 6H, Ph, NH); 7,50 (шир. s, 1Н, СН(имидазолил)); 8,27 (шир. s, 1Н, NH); 11,76 (шир. s, 1Н, NH(имидазолил))
13С-ЯМР-спектр соединения Z-L-His-D-Met-OMe (Z-LD-Ih-OMe) (125 МГц, D6-ДМСО/CDCl3):δ=14,54; 29,40; 30,52; 50,78; 51,79; 54,61; 65,35; 127,47; 127,61; 128,20; 134,53; 136,92; 155,57; 171,39; 171,94
6и) Z-L-Trp-D-Met-OMe (Z-LD-Ii-OMe)
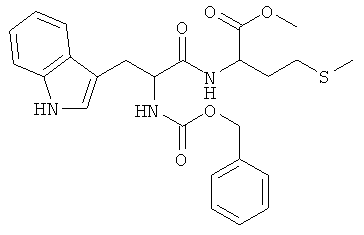
Суммарная формула: C25H29N3O5S (483,58 г/моль), выход: 5,50 г (57%), чистота: 99% (ЖХВР), бледно-желтое твердое вещество.
1Н-ЯМР-спектр соединения Z-L-Trp-D-Met-OMe (Z-LD-Ij-OMe) (500 МГц, CDCl3):δ=1,68-1,92 (m, 2H, SCH2CH2); 1,97 (s, 3H, SCH3); 2,08-2,14 (m, 2H, SCH2); 3,14-3,34 (m, 2H, СН2-индолил); 3,64 (s, 3H, ОСН3); 4,50-4,62 (m, 2H, 2×CH); 5,10 (s, 2H, ОСН2); 5,44 (шир. s, 1H, NH); 6,32 (шир. s, 1H, NH); 7,00-7,38, 10Н; ароматич.); 8,17 (шир. s, 1H, NH)
13С-ЯМР-спектр соединения Z-L-Trp-D-Met-OMe (Z-LD-Ij-OMe) (125 МГц, CDCl3):δ=15,31; 29,48; 31,26; 33,97; 51,48; 52,45; 55,65; 67,10; 1101,37; 111,34; 118,77; 119,94; 122,44; 123,14; 127,32; 128,09; 128,22; 128,56; 136,20; 136,28; 155,99; 171,15; 171,80
6к) BOC-L-Trp-D-Met-OMe (BOC-LD-Ii-OMe)
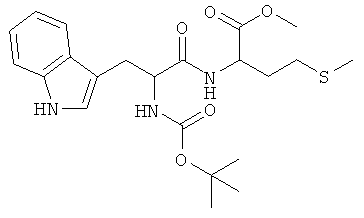
Суммарная формула: C22H31N3O5S (449,56 г/моль), выход: 5,91 г (66%), чистота: 99% (ЖХВР), белое твердое вещество.
1H-ЯМР-спектр соединения BOC-L-Trp-D-Met-OMe (BOC-LD-Ij-OMe) (500 МГц, CDCl3):δ=1,42 (s, 8H, С(СН3)3); 1,70-1,98 (m, 2H, SCH2CH2); 1,99 (s, 3H, SCH3); 2,10-2,20 (m, 2H, SCH2); 3,14-3,34 (m, 2H, СН2-индолил); 3,66 (s, 3H, ОСН3); 4,44-4,52 (m, 1H, CH); 4,56-4,62 (m, 1H, CH); 5,12 (шир. s, 1H, NH); 6,39 (d, 3J=8,0 Гц, 1H, NH); 7,04-7,38 (m, 5H, индолил-СН); 8,17 (d, 3J=7,9 Гц, 1H, NH)
13С-ЯМР-спектр соединения BOC-L-Trp-D-Met-OMe (BOC-LD-Ij-OMe) (125 МГц, CDCl3):δ=15,28; 28,27; 29,43; 31,36; 33,93; 52,38; 55,25; 80,19; 110,54; 111,25; 118,78; 119,80; 122,31; 123,06; 127,40; 136,25; 155,40; 171,53; 171,85
Пример 7: Общая методика синтеза соединений группы PG-L-EAA-D-Met (PG-LD-I) и PG-D-Met-L-EAA (PG-DL-II) (расщепление метилового эфира)
10,0 ммолей PG-L-EAA-D-Met-OMe (PG-LD-1-OMe) или PG-D-Met-L-EAA-OMe (PG-DL-11-OMe) суспендировали в 15 мл воды и 200 мл метанола и смешивали с 1,2 экв. (12,0 ммолей) NaOH (12,0 мл 1н. NaOH). После двухчасового перемешивания гомогенный реакционный раствор подкисляли разбавленной соляной кислотой и метанол отгоняли на ротационном испарителе. Выкристаллизовавшееся при этом белое твердое вещество отфильтровывали, промывали 20 мл воды и перекристаллизовывали.
Сокращение "PG" обозначает защитную группу (защитную Z- или ВОС-группу).
Пример 8: Общая методика синтеза соединений группы L-EAA-D-Met (LD-I) и D-Met-L-EAA (PL-11) (отщепление N-концевой защитной Z-группы)
5,0 ммолей Z-L-EAA-D-Met (Z-LD-I) или Z-D-Met-L-EAA (Z-LD-II) растворяли в 50 мл ледяной уксусной кислоты и смешивали с 18,5 мл (15,6 г, 250 ммолей, 50 экв.) диметилсульфида и 5,0 г (3,6 мл) 33%-ной HBr в уксусной кислоте (1,65 г, 4,0 экв.). По завершении реакции реакционный раствор концентрировали на ротационном испарителе. Остаток растворяли в примерно 50 мл метанола и смешивали с 3,5 г (50 ммолей, 10 экв.) метантиолата натрия. После 20-минутного перемешивания при комнатной температуре раствор нейтрализовали концентрированной соляной кислотой и затем его концентрировали на ротационном испарителе. Остаток растворяли в 40 мл воды и трижды экстрагировали диэтиловым эфиром порциями по 40 мл. Водную фазу концентрировали на ротационном испарителе, что сопровождалось выпадением в осадок белого рыхлого твердого вещества. Полученный дипептид отделяли вакуум-фильтрацией, промывали небольшим количеством воды и сушили в вакууме.
Пример 9: Общая методика синтеза соединений группы L-EAA-D-Met (LD-I) и D-Met-L-EAA (DL-II) (отщепление N-концевой защитной ВОС-группы)
5,0 ммолей BOC-L-EAA-D-Met (BOC-LD-I) или BOC-D-Met-L-EAA (ВОС-DL-II) растворяли в 50 мл ледяной уксусной кислоты и смешивали с 5,0 г (3,6 мл) 33%-ной HBr в уксусной кислоте (1,65 г (4,0 экв.)). По завершении реакции реакционный раствор концентрировали на ротационном испарителе. Остаток растворяли в 40 мл воды и трижды экстрагировали диэтиловым эфиром порциями по 40 мл. Водную фазу при постоянном охлаждении в ледяной бане медленно нейтрализовали 20%-ным раствором NaOH. Далее раствор трижды промывали диэтиловым эфиром порциями по 40 мл и водную фазу концентрировали на ротационном испарителе, что сопровождалось выпадением в осадок белого рыхлого твердого вещества. Полученный дипептид отделяли вакуум-фильтрацией, промывали небольшим количеством воды и сушили в вакууме.
9а) D-Met-L-Leu (DL-IIb)
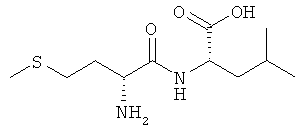
Выход: 860 мг (66%), чистота: 98% (ЖХВР), белое рыхлое твердое вещество.
1Н-ЯМР-спектр соединения H-D-Met-L-Leu (DL-IIb) (500 МГц, D6-ДМСО+HCl):δ=0,85 (d, 3J=6,3 Гц, 3Н, СН3); 0,90 (d, 3J=6,3 Гц, 3Н, СН3); 1,50-1,70 (m, 3Н, SCH2CH2, СН(СН3)2); 2,00-2,10 (m, 5H, SCH3, CH2CH); 2,45-2,55 (m, 2Н, SCH2); 3,88-3,94 (m, 1H, CH); 4,22-4,30 (m, 1H, CH); 8,40-8,60 (m, 3Н, 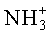
13С-ЯМР-спектр соединения D-Met-L-Leu (DL-IIb) (500 МГц, D6-ДМСО+HCl):δ=14,56; 21,16; 22,95; 24,50; 28,21; 31,22; 50,66; 51,77; 168,16; 173,50
Масс-спектрометрия высокого разрешения (МСВР) (pESI) для C11H23N2O3S (МН+):
рассчитано: 263,14294
обнаружено: 263,14224
9б) D-Met-L-Ile (DL-IIc)
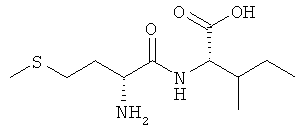
Выход: 900 мг (69%), чистота: 99% (ЖХВР), белое рыхлое твердое вещество.
1Н-ЯМР-спектр соединения D-Met-L-Ile (DL-IIc) (500 МГц, D6-ДМСО+HCl):δ=0,82-0,90 (m, 6H, 2×СН3); 1,16-1,44 (m, 2H, SCH2CH3); 1,80-1,90 (m, 1H, CH); 2,00-2,10 (m, 2H, СН2); 2,05 (s, 3H, SCH3); 2,46-2,54 (m, 2H, SCH2); 3,96-4,02 (m, 1H, CH); 4,24-4,30 (m, 1H, CH); 8.36-8,44 (m, 3H, 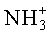
13С-ЯМР-спектр соединения D-Met-L-Ile (DL-IIc) (500 МГц, D6-ДМСО+HCl):δ=11,44; 14,86; 15,96; 24,95; 28,58; 31,71; 36,75; 52,00; 56,82; 168,64; 172,74
МСВР (pESI) для C11H23H2O3S (МН+):
рассчитано: 263,14294
обнаружено: 263,14215
9в) D-Met-L-Thr (DL-IId)
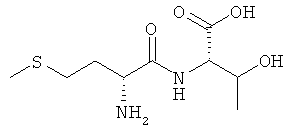
Выход: 640 мг (51%), чистота: 98% (ЖХВР), белое рыхлое твердое вещество.
1Н-ЯМР-спектр соединения D-Met-L-Thr (DL-IId) (500 МГц, D6-ДМСО+HCl):δ=1,10 (d, 3J=6,2 Гц, 3H, СНСН3); 2,06 (s, 3H, SCH3); 2,06-2,14 (m, 2H, SCH2CH2); 2,48-2,60 (m, 2H, SCH2); 4,00-4,28 (m, 4H, 2×CH, CHOH); 8,40-8,46 (m, 3H, 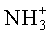
13С-ЯМР-спектр соединения D-Met-L-Thr (DL-IId) (500 МГц, D6-ДМСО+HCl):δ=15,14; 20,94; 28,74; 31,94; 52,44; 58,81; 66,97; 169,22; 172,20
МСВР (pESI) для C9H19N2O4S (MH+):
рассчитано: 251,10655
обнаружено: 251,10583
9г) D-Met-L-Lys·2HCl (DL-IIe-2HCl)
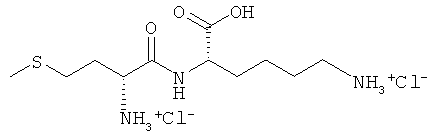
Выход: 613 мг (49%), чистота: 97% (ЖХВР), желтоватое твердое вещество.
1Н-ЯМР-спектр соединения D-Met-L-Lys·2HCl (DL-IIe-2HCl) (500 МГц, ДМСО):δ=1,32-1,42 (m, 2H, CH2(Lys); 1,52-1,62 (m, 2H, CH2(Lys); 1,64-1,80 (m, 2H, CH2(Lys); 2,00-2,10 (m, 5H, SCH2CH2, SCH3); 2,46-2,56 (m, 2H, SCH2); 2,70-2,82 (m, 2H, NCH2); 3,92-4,00 (m, 1H, CH); 4,16-4,24 (m, 1H, CH); 7,9 (шир. s, 3H, 
MCBP (pESI) для C11H24O3S (МН+):
рассчитано: 278,15384
обнаружено: 278,15288
9д) D-Met-L-Phe (DL-IIg)
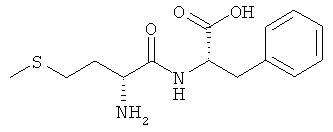
Выход: 930 мг (63%), чистота: 98% (ЖХВР), белое рыхлое твердое вещество.
1H-ЯМР-спектр соединения D-Met-L-Phe (DL-IIg) (500 МГц, D6-ДМСО+HCl):δ=1,64-1,82 (m, 2H, SCH2CH2); 1,95 (s, 3H, SCH3); 2,10-2,26 (m, 2H, SCH2); 2,80-3,20 (m, 2H, CH2Ph); 3,70 (t, 3J=6,1 Гц, 1H, CHCH2Ph); 4,42-4,50 (m, 1H, CHCH2CH2S); 7,16-7,28 (m, 5H, Ph); 8,50-8,60 (шир. s, 1H, NH)
13С-ЯМР-спектр соединения D-Met-L-Phe (DL-IIg) (500 МГц, D6-ДМСО+HCl):δ=14,28; 28,08; 31,63; 37,03; 51,84; 53,78; 126,28; 127,97; 129,08; 137,69; 168,90; 172,65
MCBP (pESI) для C14H21N2O3S (MH+):
рассчитано: 297,12729
обнаружено: 297,12643
9е) D-Met-L-Trp (DL-IIj)
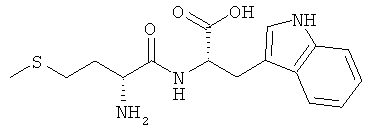
Выход: 1,38 г (82%), чистота: 98% (ЖХВР), белое рыхлое твердое вещество.
1H-ЯМР-спектр соединения D-Met-L-Trp (DL-IIj) (500 МГц, D6-ДМСО+HCl):δ=1,50-1,80 (m, 2H, SCH2CH2); 1,93 (s, 3H, SCH3); 2,30-2,40 (m, 2Н, SCH2); 3,02-3,22 (m, 2H, СН2); 3,34-3,40 (m, 1H, SCH2CH2CH); 4,38-4,40 (m, 1H, CH); 6,90-7,60 (m, 5H, индолил); 8,05-8,15 (шир. s, 1H, CONH); 10,80 (шир. s, 1H, NH)
13С-ЯМР-спектр соединения D-Met-L-Trp (DL-IIj) (500 МГц, D6-ДМСО+HCl):δ=14,37; 27,38; 29,12; 33,28; 53,00; 53,49; 110,26; 111,17; 118,07; 118,26; 120,64; 123,36; 127,52; 135,98; 171,87; 173,53
MCBP (pESI) для C16H22H3O3S (МН+):
рассчитано: 336,13819
обнаружено: 336,13718
9ж) L-Leu-D-Met (LD-Ib)
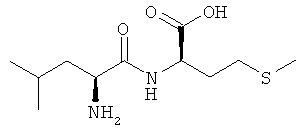
Выход: 710 мг (54%), чистота: 99% (ЖХВР), белое рыхлое твердое вещество.
1Н-ЯМР-спектр соединения H-L-Leu-D-Met (LD-Ib) (500 МГц, D6-ДМСО+HCl):δ=0,91 (t, 3J=5,4 Гц, 6Н, 2×СН3); 1,62 (t, 3J=6,8 Гц, 2H, СН2СН(СН3)2); 1,60-1,75 (m, 1H, СН(СН3)2); 1,88-2,04 (m, 2H, SCH2CH2); 2,04 (s, 3H, SCH3); 2,40-2,54 (m, 2H, SCH2); 3,78-3,86 (m, 1H, CH); 4,32-4,40 (m, 1H, CH); 8,36 (d, 3J=4,0 Гц, 3H, 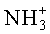
13С-ЯМР-спектр соединения H-L-Leu-D-Met (LD-Ib) (500 МГц, D6-ДМСО+HCl):δ=14,56; 22,78; 23,33; 23,93; 29,89; 30,58; 41,03; 51,40; 51,56; 169,41; 173,03
MCBP (pESI) для C11H23N2O3S (MH+):
рассчитано: 263,14294
обнаружено: 263,14218
9з) L-Ile-D-Met (LD-Ic)
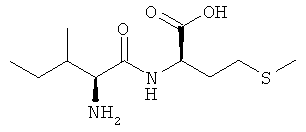
Выход: 790 мг (59%), чистота: 97% (ЖХВР), белое рыхлое твердое вещество.
1Н-ЯМР-спектр соединения L-Ile-D-Met (LD-Ic) (500 МГц, D6-ДМСО):δ=0,82 (t, 3J=7,4 Гц, 3H, СН3СН2); 0,86 (2, 3J=6,6 Гц, 3H, СН3СН); 1,02-1,12 (m, 1H, СН3СН'Н''); 1,36-1,46 (m, 1H, СН3СН'Н''); 1,64-1,72 (m, 1H, СН3СН); 1,80-1,98 (m, 2H, SCH2CH2); 2,00 (s, 3H, SCH3); 2,36-2,44 (m, 2H, SCH2); 3,27 (d, 3J=5,1 Гц, 1H, CH); 3,99 (t, 3J=5,3 Гц; 1H, CH); 7,92 (шир. s, 1H, NH)
13С-ЯМР-спектр соединения L-Ile-D-Met (LD-Ic) (500 МГц, D6-ДМСО):δ=11,57; 14,54; 15,60; 23,58; 29,69; 32,42; 37,90; 53,06; 58,79; 172,09; 173,37
MCBP (pESI) для C11H23N2O3S (MH+):
рассчитано: 263,14294
обнаружено: 263,14224
9и) L-Thr-D-Met (LD-Id)
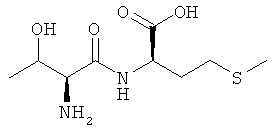
Выход: 690 мг (55%), чистота: 99% (ЖХВР), белое рыхлое твердое вещество.
1H-ЯМР-спектр соединения L-Thr-D-Met (LD-Id) (500 МГц, D6-ДМСО+CDCl3):δ=1,08 (d, 3J=6,6 Гц, 3Н, СН3); 1,82-2,08 (m, 2H, SCH2CH2), 2,02 (s, 3Н, SCH3); 2,38-2,50 (m, 2H, SCH2); 3,06 (d, 3J=4,2 Гц, 1Н, СН); 3,88-3,94 (m, 1Н, СН); 3,98-4,04 (m, 1Н, СН); 7,91 (d, 3J=7,3 Гц, 1Н, NH)
13С-ЯМР-спектр соединения L-Thr-D-Met (LD-Id) (500 МГц, D6-ДМСО+CDCl3):δ=14,75; 19,70; 30,07; 32,45; 53,71; 60,22; 67,45; 172,58; 174,24
МСВР (pESI) для C9H19N2O4S (MH+):
рассчитано: 251,10655
обнаружено: 251,10586
9к) L-Lys-D-Met·2HCl (LD-Ie-2HCl)
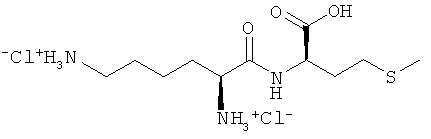
Выход: 676 мг (54%), чистота: 96% (ЖХВР), бесцветные кристаллы.
1H-ЯМР-спектр соединения L-Lys-D-Met·2HCl (LD-Ie-2HCl) (500 МГц, D6-ДМСО):δ=1,30-1,44 (m, 2H, CH2(Lys)); 1,54-1,64 (m, 2H, CH2(Lys)); 1,72-1,84 (m, 1Н, CH2(Lys)); 1,90-2,04 (m, 2H, SCH2CH2); 2,05 (s, 3Н, SCH3); 2,44-2,58 (m, 2H, SCH2); 2,70-2,80 (m, 2H, NCH2); 3,82-3,90 (m, 1Н, СН); 4,34-4,42 (m, 1Н, СН); 7,9 (шир. s, 3Н, 
МСВР (pESI) для C11H24O3S (МН+):
рассчитано: 278,15384
обнаружено: 278,15290
9л) L-Phe-D-Met (LD-Ig)
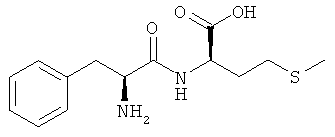
Выход: 880 мг (59%), чистота: 98% (ЖХВР), белое рыхлое твердое вещество.
1H-ЯМР-спектр соединения L-Phe-D-Met (LD-Ig) (500 МГц, D6-ДМСО+D2O):δ=1,60-2,02 (m, 4H, SCH2CH2); 2,05 (s, 3H, SCH3); 3,08-3,32 (m, 2Н, PhCH2); 4,12-4,16 (m, 1H, CH); 4,20-4,26 (m, 1H, CH); 7,30-7,50 (m, 5H, Ph)
13С-ЯМР-спектр соединения L-Phe-D-Met (LD-Ig) (500 МГц, D6-ДМСО+D2O):δ=15,37; 30,72; 32,10; 38,09; 55,40; 55,96; 129,24; 130,50; 130,71; 136,55; 169,47; 178,42
МСВР (pESI) для C14H21N2O3S (MH+):
рассчитано: 297,12729
обнаружено: 297,12646
9м) L-Trp-D-Met (LD-Ij)
Выход: 1,40 г (83%), чистота: 98% (ЖХВР), белое рыхлое твердое вещество.
1H-ЯМР-спектр соединения L-Trp-D-Met (LD-Ij) (500 МГц, D6-MCO):δ=1,68-1,88 (m, 2Н, SCH2CH2); 1,94 (s, 3H, SCH3); 2,24 (d, 3J=7,9 Гц, 2Н, SCH2); 2,80-2,88 (m, 1H, CH); 3,10-3,16 (m, 1H, CH); 3,70-3,76 (m, 1H, CH); 4,00-4,06 (m, 1H, CH); 6,90-7,60 (m, 5H, индолил); 8,10 (шир. s, 1H, NH); 10,90 (шир. s, 1H, NH)
13С-ЯМР-спектр соединения L-Trp-D-Met (LD-Ij) (500 МГц, D6-ДМСО):δ=14,51; 29,56; 29,90; 32,09; 52,78; 54,59; 109,82; 111,26; 118,15; 118,30; 120,80; 123,82; 127,20; 136,16; 172,03; 173,02
МСВР (pESI) для C16H22N3O3S (MH+):
рассчитано: 336,13819
обнаружено: 336,13724
Пример 10: Химический синтез смеси диастереомеров Met-Ile (IIc) из 5-[2-(метилтио)этил]-2,4-имидазолидиндиона (метионингидантоина) (Vn) и L-изолейцина с использованием KОН
11,8 г (0,09 моля) L-изолейцина, 17,2 г (0,09 моля, чистота: 91%) 5-[2-(метилтио)этил]-2,4-имидазолидиндиона (Vn) и 11,9 г (0,8 моля) 85%-ного KОН растворяли в 150 мл воды и в течение 5 ч перемешивали при 150°С в 200-миллилитровом стальном автоклаве фирмы Roth, оборудованном магнитной мешалкой, в ходе чего давление возрастало до 8 бар. По завершении реакции автоклав охлаждали, выпавшее в осадок твердое вещество отфильтровывали и промывали его небольшим количеством воды. Фильтрат барботировали СО2, который подавали с умеренным расходом. Выпавшее при этом в осадок твердое вещество вновь отделяли вакуум-фильтрацией, промывали его небольшим количеством холодной воды и в течение нескольких часов сушили при 30°С в вакууме, создаваемом масляным насосом. Выход: 7,3 г (31% от теории) белого твердого вещества. 1Н-ЯМР-спектр совпадал с наложенными 1Н-ЯМР-спектрами соединений L-Met-L-Ile (LL-IIc) и D-Met-L-Ile (DL-IIc) (см. пример 9б).
Пример 11: Химический синтез смеси диастереомеров Met-Ile (IIc) из N-карбамоилметионина (IIIn) и L-изолейцина с использованием KОН
11,8 г (0,09 моля) L-изолейцина, 17,5 г (0,09 моля, чистота: 99%) N-карбамоилметионина (IIIn) и 11,9 г (0,18 моля) 85%-ного KОН растворяли в 150 мл воды и в течение 5 ч перемешивали при 150°С в 200-миллилитровом стальном автоклаве фирмы Roth, оборудованном магнитной мешалкой, в ходе чего давление возрастало до 7 бар. По завершении реакции автоклав охлаждали, выпавшее в осадок твердое вещество отфильтровывали и промывали его небольшим количеством воды. Фильтрат нейтрализовали 10%-ной серной кислотой, выпавшее при этом в осадок твердое вещество отделяли вакуум-фильтраций, промывали его небольшим количеством холодной воды и в течение нескольких часов сушили при 30°С в вакууме, создаваемом масляным насосом. Выход: 6,4 г (27% от теории) белого твердого вещества. 1Н-ЯМР совпадал с наложенными 1Н-ЯМР-спектрами соединений L-Met-L-Ile (LL-IIc) и D-Met-L-Ile (DL-IIc) (см. пример 9б).
Пример 12: Химический синтез смеси диастереомеров Met-Ile (IIc) из амида 2-[(аминокарбонил)амино]-4-(метилтио)масляной кислоты (амида N-карбамоилметионина) (IVn) и L-изолейцина с использованием КОН
11,8 г (0,09 моля) L-изолейцина, 17,4 г (90 ммолей, чистота: 98,5%) амида 2-[(аминокарбонил)амино]-4-(метилтио)масляной кислоты (IVn) и 11,9 г (0,8 моля) 85%-ного K ОН растворяли в 150 мл воды и в течение 5 ч перемешивали при 150°С в 200-миллилитровом стальном автоклаве фирмы Roth, оборудованном магнитной мешалкой, в ходе чего давление возрастало до 7 бар. По завершении реакции автоклав охлаждали, выпавшее в осадок твердое вещество отфильтровывали и промывали его небольшим количеством воды. Фильтрат нейтрализовали полуконцентрированной соляной кислотой, выпавшее при этом в осадок твердое вещество отделяли вакуум-фильтраций, промывали его небольшим количеством холодной воды и в течение нескольких часов сушили при 30°С в вакууме, создаваемом масляным насосом. Выход: 8,0 г (34% от теории) белого твердого вещества. 1Н-ЯМР совпадал с наложенными 1Н-ЯМР-спектрами соединений L-Met-L-Ile (LL-IIc) и D-Met-L-Ile (DL-IIc) (см. пример 9б).
Пример 13: Химический синтез 3-[2-(метилтио)этил]-6-(1-(метил)пропил)-2,5-пиперазиндиона (VIc) из 5-[2-(метилтио)этил]-2,4-имидазолидиндиона (метионингидантоина) (Vn) и L-изолейцина
11,8 г (0,09 моля) L-изолейцина, 17,2 г (0,09 моля, чистота: 91%) 5-[2-(метилтио)этил]-2,4-имидазолидиндиона (Vn) и 7,1 г (0,9 моля) (NH4)HCO3 растворяли в 150 мл воды и в течение 5 ч перемешивали при 150°С в 200-миллилитровом стальном автоклаве фирмы Roth, оборудованном магнитной мешалкой, что сопровождалось возрастанием давления. Путем периодического стравливания газа давление поддерживали постоянным на уровне 8 бар. По завершении реакции автоклав охлаждали в ледяной бане. Полученную суспензию затем фильтровали, отфильтрованное твердое вещество многократно промывали водой и в течение нескольких часов сушили его при 30°С в вакууме, создаваемом масляным насосом. Выход: 9,9 г (45% от теории) соединения VIc в виде белого твердого вещества.
1Н-ЯМР-спектр 3-[2-(метилтио)этил]-6-(1-(метил)пропил)-2,5-пиперазиндиона (VIc) (500 МГц, D6-ДМСО):δ=0,85 (t, 3J=7,4 Гц, 3Н, СН2СН3); 0,90 (d, 3J=7,4 Гц, 3Н, СНСН3); 1,10-1,50 (m, 2H, SCH2CH2); 1,80-1,90 (m, 1H, CH); 1,90-2,00 (m, 2H, CH2); 2,04 (s, 3Н, SCH3); 2,42-2,58 (m, 2H, SCH2); 3,64-3,68 (m, 1H, CH); 3,94-3,98 (m, 1H, CH); 8.08-8,16 (m, 2H, 2×NH)
13С-ЯМР-спектр 3-[2-(метилтио)этил]-6-(1-(метил)пропил)-2,5-пиперазиндиона (VIc) (500 МГц, D6-ДМСО+HCl):δ=12,02; 14,85; 15,27; 24,61; 28,74; 32,15; 39,90; 52,92; 59,34; 167,90; 168,10
Пример 14: Химический синтез 3-[2-(метилтио)этил]-6-(1-метил)пропил)-2,5-пиперазиндиона (VIc) из N-карбамоилметионина (IIIn) и L-изолейцина
11,8 г (0,09 моля) L-изолейцина, 17,5 г (0,09 моля, чистота: 99%) N-карбамоилметионина (IIIn) и 7,1 г (0,9 моля) (NH4)HCO3 растворяли в 150 мл воды и в течение 5 ч перемешивали при 150°С в 200-миллилитровом стальном автоклаве фирмы Roth, оборудованном магнитной мешалкой, что сопровождалось возрастанием давления. Путем периодического стравливания газа давление поддерживали постоянным на уровне 8 бар. По завершении реакции автоклав охлаждали в ледяной бане. Полученную суспензию затем фильтровали, отфильтрованное твердое вещество многократно промывали водой и в течение нескольких часов сушили при 30°С в вакууме, создаваемом масляным насосом. Выход: 9,1 г (41,3% от теории) соединения VIc в виде белого твердого вещества. ЯМР-спектр совпадал с ЯМР-спектром из примера 13.
Пример 15: Химический синтез 3-[2-(метилтио)этил]-6-(1-метил)пропил)-2,5-пиперазиндиона (VIc) из амида 2-[(аминокарбонил)амино]-4-(метилтио)масляной кислоты (амида N-карбамоилметионина) (IVn) и L-изолейцина
11,8 г (0,09 моля) L-изолейцина, 17,4 г (90 ммолей, чистота: 98,5%) амида 2-[(аминокарбонил)амино]-4-(метилтио)масляной кислоты (IVn) и 7,1 г (0,9 моля) (NH4)HCO3 растворяли в 150 мл воды и в течение 5 ч перемешивали при 150°С в 200-миллилитровом стальном автоклаве фирмы Roth, оборудованном магнитной мешалкой, что сопровождалось возрастанием давления. Путем периодического стравливания газа давление поддерживали постоянным на уровне 8 бар. По завершении реакции автоклав охлаждали в ледяной бане. Полученную суспензию затем фильтровали, отфильтрованное твердое вещество многократно промывали водой и в течение нескольких часов сушили при 30°С в вакууме, создаваемом масляным насосом. Выход: 10,3 г (47% от теории) белого твердого вещества IVc. ЯМР-спектр совпадал с ЯМР-спектром из примера 13.
Пример 16: Синтез смеси диастереомеров Ile-Met (Ic) и Met-Ile (IIc) из 3-[2-(метилтио)этил]-6-(1-метил)пропил)-2,5-пиперазиндиона (VIc) с использованием концентрированной соляной кислоты
24,4 г (100 ммолей) 3-[2-(метилтио)этил]-6-(1-метил)пропил)-2,5-пиперазиндиона (VIc) суспендировали в 66 г воды. Далее при перемешивании медленно по каплям добавляли 11 г концентрированной соляной кислоты и затем осторожно при очень интенсивном перемешивании нагревали до температуры перегонки. После этого реакционную смесь в течение 8 ч кипятили с обратным холодильником, в ходе чего все твердое вещество переходило в раствор. В ходе последующего охлаждения в осадок выпадало небольшое количество непрореагировавшего дикетопиперазина, который отфильтровывали. Затем в химическом стакане с ледяной баней значение pH фильтрата устанавливали на 5-6 добавлением 32%-ной аммиачной воды. При этом в осадок выпадала смесь DL-Met-DL-Ile (смесь диастереомеров соединения IIc) и DL-Ile-DL-Met (смесь диастереомеров соединения Ic) в виде белого рыхлого твердого вещества. Это твердое вещество сушили в сушильном шкафу при 40°С в вакууме, создаваемом водоструйным насосом. Выход: 21,5 г (82,0%).
Пример 17: Синтез смеси диастереомеров Ile-Met (Ic) и Met-Ile (IIc) из 3-[2-(метилтио)этил]-6-(1-метил)пропил)-2,5-пиперазиндиона (VIc) в щелочных условиях с использованием аммиака
19,6 г (0,8 моля) 3-[2-(метилтио)этил]-6-(1-метил)пропил)-2,5-пиперазиндиона (VIc), 22,4 мл 25%-ного раствора аммиака и 160 мл воды нагревали в автоклаве до 150°С с выдержкой при этой температуре в течение 2 ч. После охлаждения непрореагировавший дикетопиперазин отделяли вакуум-фильтраций. Его можно вновь использовать в следующей реакционной смеси. Фильтрат концентрировали на ротационном испарителе при температуре воды 80°С до выпадения в осадок первых кристаллов. После охлаждения смеси ее оставляли стоять на ночь, после чего путем фильтрации и сушки удалось выделить смесь DL-Met-DL-Ile (смесь диастереомеров соединения IIc) и DL-Ile-DL-Met (смесь диастереомеров соединения Ic) в виде белого рыхлого твердого вещества. Выход: 12,2 г (58%).
Пример 18: Опыты in vitro с перевариванием L-EAA-L-Met (LL-I), соответственно L-Met-L-EAA (LL-II) под действием пищеварительных ферментов, выделенных из всеядных карповых
а) Выделение пищеварительных ферментов из зеркального карпа (Cyprinus carpio morpha noblis)
Пищеварительные ферменты выделяли в соответствии с методом, описанным у EID и MATTY (Aquaculture, 79, 1989, сс.111-119). Для этого у пяти однолетних зеркальных карпов (Cyprinus carpio morpha noblis) извлекали кишечник, промывали его водой, разрезали вдоль и с кишечника соскабливали слизистую оболочку. Ее совместно с колотым льдом измельчали в миксере. Полученную суспензию обрабатывали ультразвуковым стержнем с целью разрушения еще целых клеток. Для отделения клеточных компонентов и жира суспензию в течение 30 мин центрифугировали при 4°С, гомогенат отделяли декантированием и стерилизовали его полоской тимеросала. Из 5 зеркальных карпов получили 296,3 мл раствора ферментов слизистой оболочки кишечника и этот раствор хранили в темноте при 4°С.
б) Проведение опытов in vitro с перевариванием
L-Met-L-EAA (LL-II), соответственно L-EAA-L-Met (LL-I) растворяли в буферном растворе трис/HCl и смешивали с раствором ферментов. Для сравнения и для оценки скорости исключительно химического расщепления в каждом случае проводили по "холостому" опыту без раствора ферментов (см. таблицу 3). Периодически отбирали пробу и количественно оценивали ее состав путем ее анализа на калиброванном ЖХВР-хроматографе. Степень превращения определяли как частное от деления содержания метионина на содержание L-Met-L-EAA (LL-II), соответственно L-EAA-L-Met (LL-I) (см. фиг.1 и 2).
Пример 19: Опыты in vitro с перевариванием L-EAA-D-Met (LD-I). соответственно D-Met-L-EAA (DL-II) под действием пищеварительных ферментов, выделенных из всеядных карповых
а) Выделение пищеварительных ферментов из зеркального карпа (Cyprinus carpio morpha noblis)
Пищеварительные ферменты выделяли в соответствии с методом, описанным у EID и MATTY (Aquaculture, 79, 1989, сс.111-119). Для этого у пяти однолетних зеркальных карпов (Cyprinus carpio morpha noblis) извлекали кишечник и перерабатывали его описанным в примере 18 способом.
б) Проведение опытов in vitro с перевариванием
D-Met-L-EAA (DL-II), соответственно L-EAA-D-Met (LD-I) растворяли в буферном растворе трис/HCl и смешивали с раствором ферментов. Для сравнения и для оценки скорости исключительно химического расщепления в каждом случае проводили по "холостому" опыту без раствора ферментов (см. таблицу 4). Периодически отбирали пробу и количественно оценивали ее состав путем ее анализа на калиброванном ЖХВР-хроматографе. Степень превращения определяли как частное от деления площади под кривой, полученной для метионина, на площадь под кривой, полученной для D-Met-L-EAA (DL-II), соответственно L-EAA-D-Met (LD-I) (см. фиг.7).
Пример 20: Опыты in vitro с перевариванием L-EAA-L-Met (LL-I). соответственно L-Met-L-EAA (LL-II) под действием пищеварительных ферментов, выделенных из плотоядных форелей
а) Выделение пищеварительных ферментов из радужных форелей (Oncorhynchus mykiss)
Пищеварительные ферменты выделяли в соответствии с методом, описанным у EID и MATTY (Aquaculture, 79, 1989, сс.111-119). Для этого у шести однолетних радужных форелей (Oncorhynchus mykiss) извлекали кишечник и перерабатывали его описанным в примере 18 способом.
б) Проведение опытов in vitro с перевариванием
Опыты in vitro с перевариванием проводили аналогично примеру 18 (см. таблицу 5, фиг.3 и 4).
Пример 21: Опыты in vitro с перевариванием L-EAA-D-Met (LD-I), соответственно D-Met-L-EAA (DL-II) под действием пищеварительных ферментов, выделенных из плотоядных форелей
а) Выделение пищеварительных ферментов из радужных форелей (Oncorhynchus mykiss)
Пищеварительные ферменты выделяли в соответствии с методом, описанным у EID и MATTY (Aquaculture, 79, 1989, сс.111-119). Для этого у шести однолетних радужных форелей (Oncorhynchus mykiss) извлекали кишечник и перерабатывали его описанным в примере 18 способом.
б) Проведение опытов in vitro с перевариванием
Опыты in vitro с перевариванием проводили аналогично примеру 19 (см. таблицу 6, фиг.11).
Пример 22: Опыты in vitro с перевариванием L-EAA-L-Met (LL-I), соответственно L-Met-L-EAA (LL-II) под действием пищеварительных ферментов, выделенных из всеядных морских креветок
а) Выделение пищеварительных ферментов из белых тихоокеанских креветок (Litopenaeus Vannamei)
Пищеварительные ферменты выделяли в соответствии с методом, описанным у Ezquerra и Garcia-Carreno (J. Food Biochem., 23, 1999, cc.59-74). Для этого из пяти килограмм белых тихоокеанских креветок (Litopenaeus Vannamei) удаляли гепатопанкреас и совместно с колотым льдом измельчали в миксере. Дальнейшую переработку выполняли аналогично примеру 18.
б) Проведение опытов in vitro с перевариванием
Опыты in vitro с перевариванием проводили аналогично примеру 18 (см. таблицу 7, фиг.5 и 6).
Пример 23: Опыты in vitro с перевариванием L-EAA-D-Met (LD-I), соответственно D-Met-L-EAA (DL-II) под действием пищеварительных ферментов, выделенных из всеядных морских креветок
а) Выделение пищеварительных ферментов из белых тихоокеанских креветок (Litopenaeus Vannamei)
Пищеварительные ферменты выделяли в соответствии с методом, описанным у Ezquerra и Garcia-Carreno (J. Food Biochem., 23, 1999, cc.59-74). Для этого из пяти килограмм белых тихоокеанских креветок (Litopenaeus Vannamei) удаляли гепатопанкреас и совместно с колотым льдом измельчали в миксере. Дальнейшую переработку выполняли аналогично примеру 18.
б) Проведение опытов in vitro с перевариванием
Опыты in vitro с перевариванием проводили аналогично примеру 19 (см. таблицу 8, фиг.10).
Пример 24: Опыты in vitro с перевариванием L-EAA-L-Met (LL-I). соответственно L-Met-L-EAA (LL-II) под действием пищеварительных ферментов, выделенных из кур
а) Выделение пищеварительных ферментов из кур
Пищеварительные ферменты выделяли в соответствии с методом, описанным у EID и MATTY (Aquaculture, 79, 1989, cc.111-119). Для этого у одной курицы извлекали кишечник, промывали его водой, разрезали вдоль и с кишечника соскабливали слизистую оболочку. Ее совместно с колотым льдом измельчали в миксере. Полученную суспензию обрабатывали ультразвуковым стержнем с целью разрушения еще целых клеток. Для отделения клеточных компонентов и жира суспензию в течение 30 мин центрифугировали при 4°С, гомогенат отделяли декантированием и стерилизовали его полоской тимеросала. Из одной курицы получили 118,9 мл раствора ферментов слизистой оболочки кишечника и этот раствор хранили в темноте при 4°С.
б) Проведение опытов in vitro с перевариванием
L-Met-L-EAA (LL-II), соответственно L-EAA-L-Met (LL-I), растворяли в буферном растворе трис/HCl и смешивали с раствором ферментов. Для сравнения и для оценки скорости исключительно химического расщепления в каждом случае проводили по "холостому" опыту без раствора ферментов. Периодически отбирали пробу и количественно оценивали ее состав путем ее анализа на калиброванном ЖХВР-хроматографе. Степень превращения определяли как частное от деления содержания метионина на содержание L-Met-L-EAA (LL-II), соответственно L-EAA-L-Met (LL-I) (см. таблицу 9, фиг.16).
Пример 25: Опыты in vitro с перевариванием L-EAA-D-Met (LD-I), соответственно D-Met-L-EAA (DL-II), под действием пищеварительных ферментов, выделенных из кур
а) Выделение пищеварительных ферментов из кур
Пищеварительные ферменты выделяли в соответствии с методом, описанным у EID и MATTY (Aquaculture, 79, 1989, cc.111-119). Для этого у одной курицы извлекали кишечник и перерабатывали его описанным в примере 24 способом.
б) Проведение опытов in vitro с перевариванием
D-Met-L-EAA (DL-II), соответственно L-EAA-D-Met (LD-I), растворяли в буферном растворе трис/HCl и смешивали с раствором ферментов. Для сравнения и для оценки скорости исключительно химического расщепления в каждом случае проводили по "холостому" опыту без раствора ферментов. Периодически отбирали пробу и количественно оценивали ее состав путем ее анализа на калиброванном ЖХВР-хроматографе. Степень превращения определяли как частное от деления площади под кривой, полученной для метионина, на площадь под кривой, полученной для D-Met-L-EAA (DL-II), соответственно L-EAA-D-Met (LD-I), (см. таблицу 10, фиг.17).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ МЕТИОНИЛМЕТИОНИНА В КАЧЕСТВЕ ДОБАВКИ К КОРМАМ ДЛЯ РЫБ И РАКООБРАЗНЫХ | 2009 |
|
RU2599783C2 |
| ЗАМЕЩЕННЫЕ 2-МЕТИЛТИОЭТИЛОМ ГЕТЕРОЦИКЛЫ В КАЧЕСТВЕ ДОБАВОК К КОРМАМ | 2008 |
|
RU2516833C2 |
| ПИРАЗОЛ-ЗАМЕЩЕННЫЕ ПИРИДИНЫ С ПРОТИВОРАКОВОЙ АКТИВНОСТЬЮ, ИХ ПРИМЕНЕНИЕ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2022 |
|
RU2823567C2 |
| СПОСОБ ПОЛУЧЕНИЯ КЕТОКИСЛОТ И ИХ ПРОИЗВОДНЫХ | 2008 |
|
RU2536046C2 |
| КЕТОМЕТИОНИНКЕТАЛИ И ИХ ПРОИЗВОДНЫЕ | 2007 |
|
RU2483062C2 |
| ВОДОРАСТВОРИМЫЕ АНАЛОГИ СС-1065 И ИХ КОНЪЮГАТЫ | 2007 |
|
RU2489423C2 |
| ПЕПТИДНЫЕ ПРОИЗВОДНЫЕ, ИХ СТЕРЕОИЗОМЕРЫ ИЛИ ФИЗИОЛОГИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ОБЛАДАЮЩИЕ ПРОТИВОТРОМБОЗНОЙ, ПРОТИВОСВЕРТЫВАЮЩЕЙ ИЛИ ПРОТИВОВОСПАЛИТЕЛЬНОЙ АКТИВНОСТЬЮ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ПОДАВЛЕНИЯ ТРОМБИНА, СПОСОБ ПОДАВЛЕНИЯ КИНИНОГЕНАЗ, ПРИМЕНЕНИЕ СОЕДИНЕНИЙ В КАЧЕСТВЕ ИСХОДНЫХ В СИНТЕЗЕ ИНГИБИТОРА ТРОМБИНА | 1994 |
|
RU2142469C1 |
| N-(1,2,5-ОКСАДИАЗОЛ-3-ИЛ)БЕНЗАМИДЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ГЕРБИЦИДОВ | 2010 |
|
RU2554349C9 |
| НОВЫЙ СПОСОБ СИНТЕЗА АМАНИТИНОВ | 2018 |
|
RU2792210C2 |
| ПРОИЗВОДНЫЕ ЛАНТИОНИНА | 2010 |
|
RU2518890C2 |
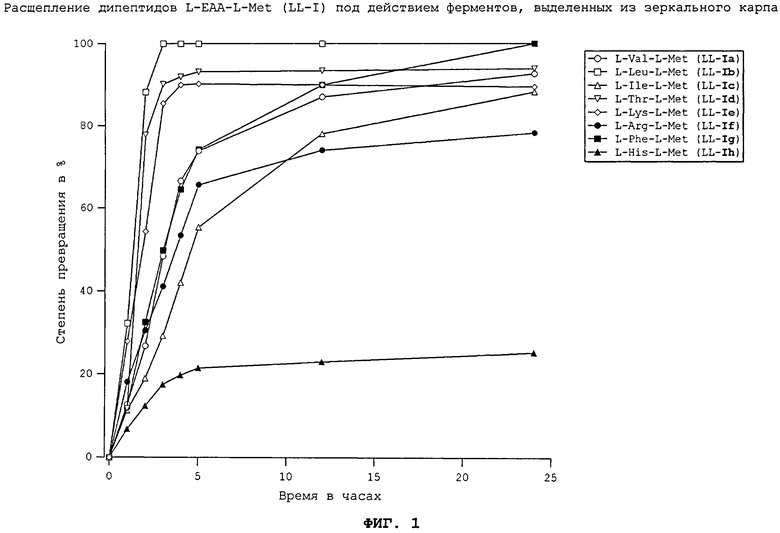
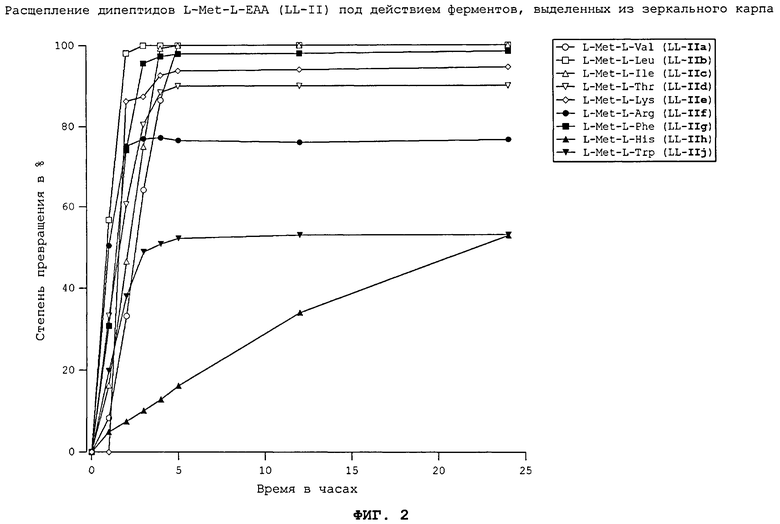
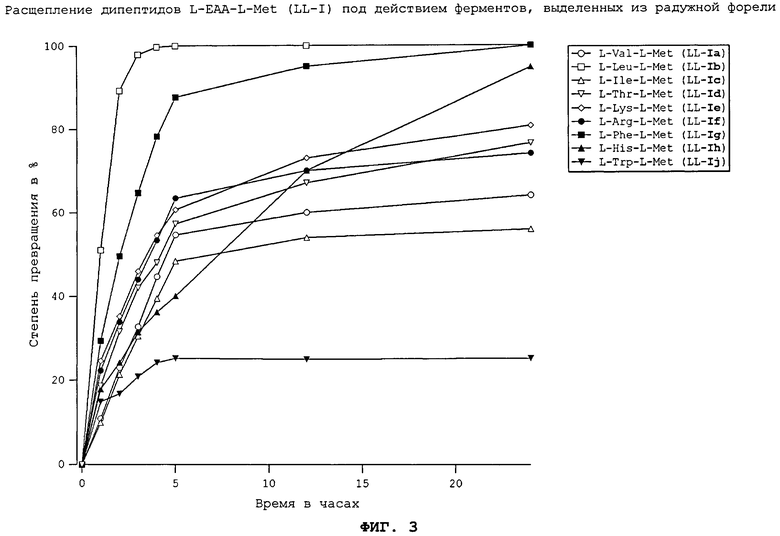
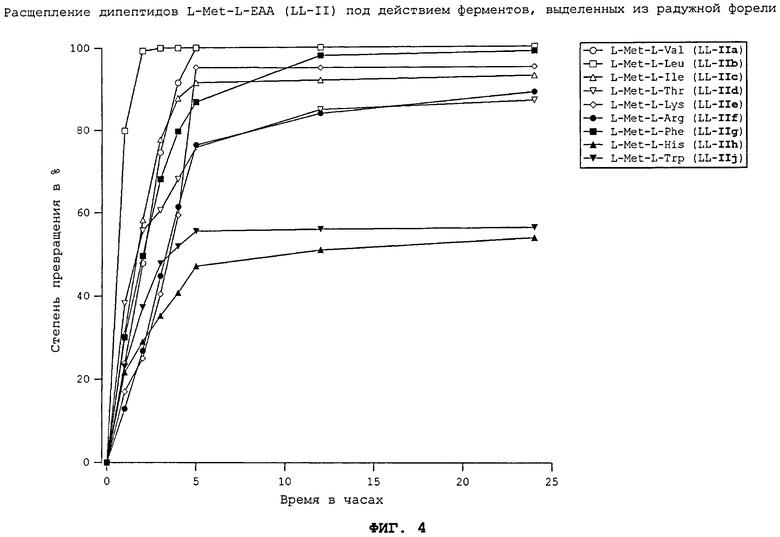
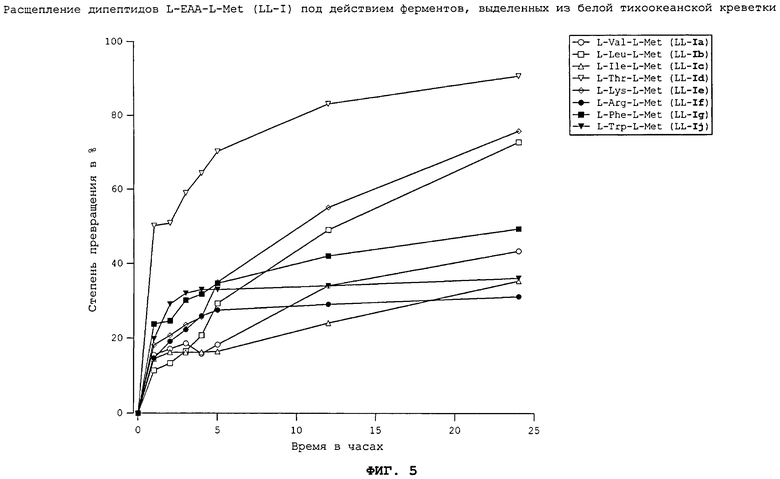
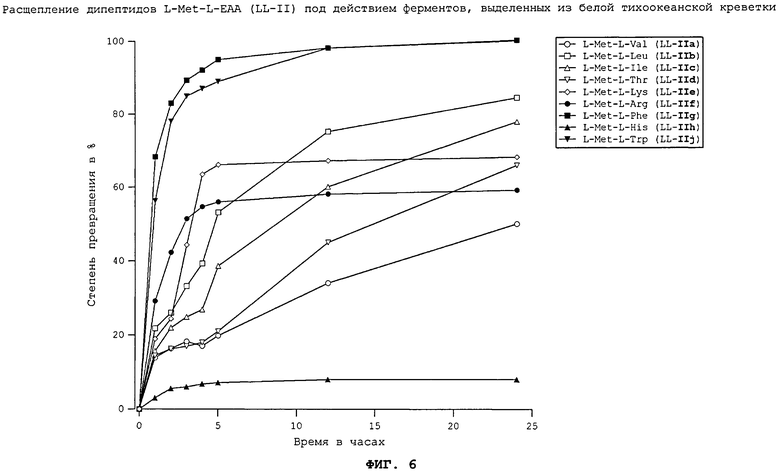
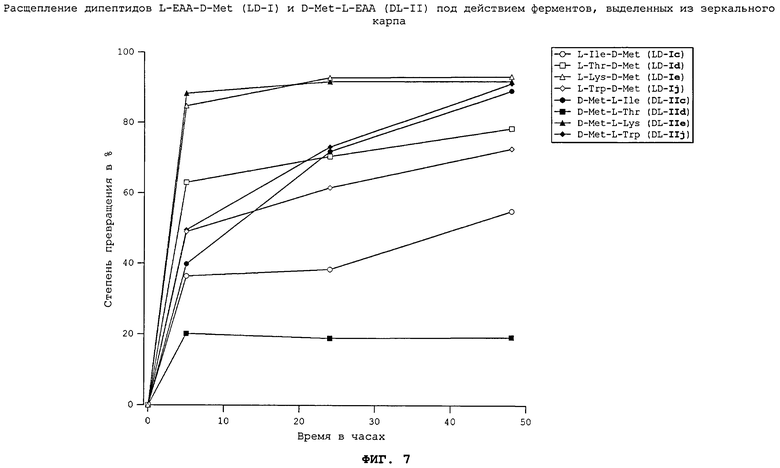
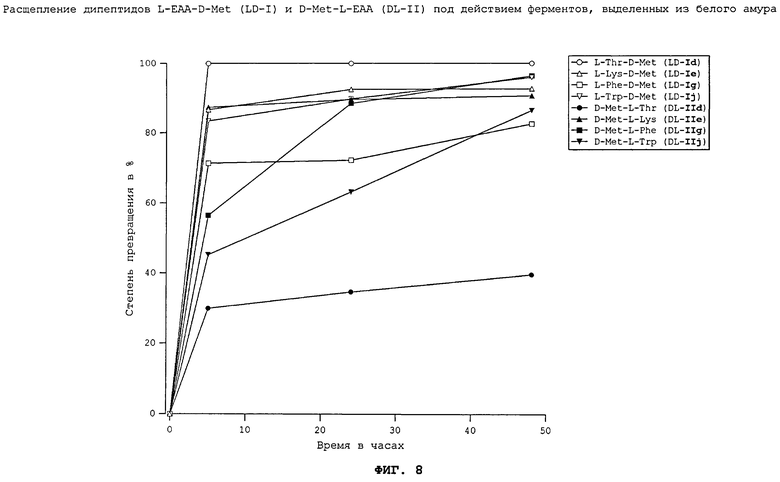
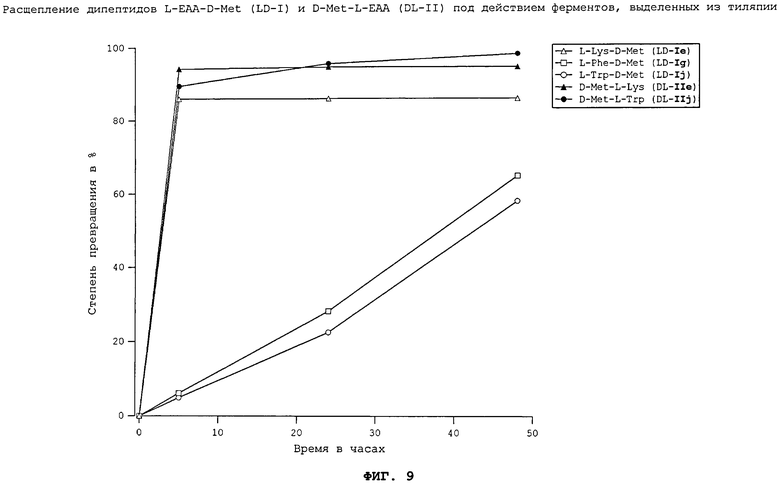
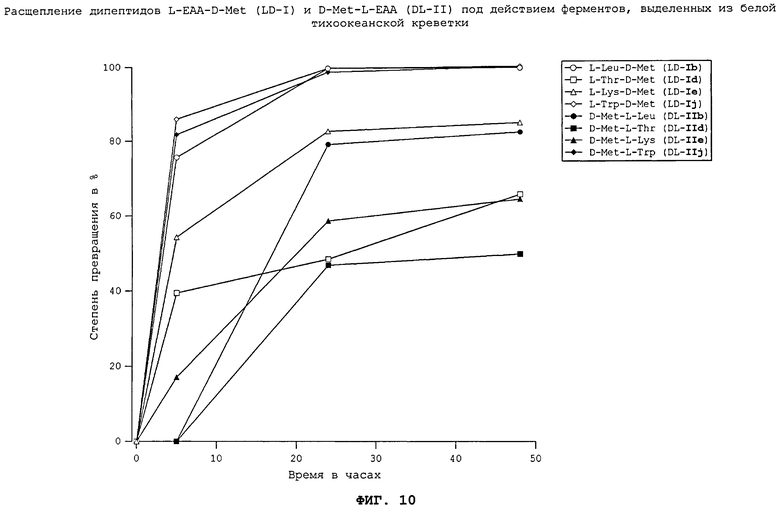
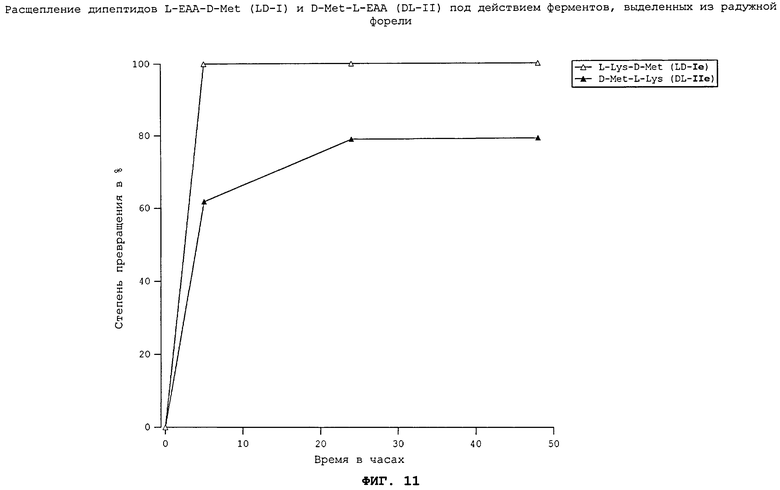
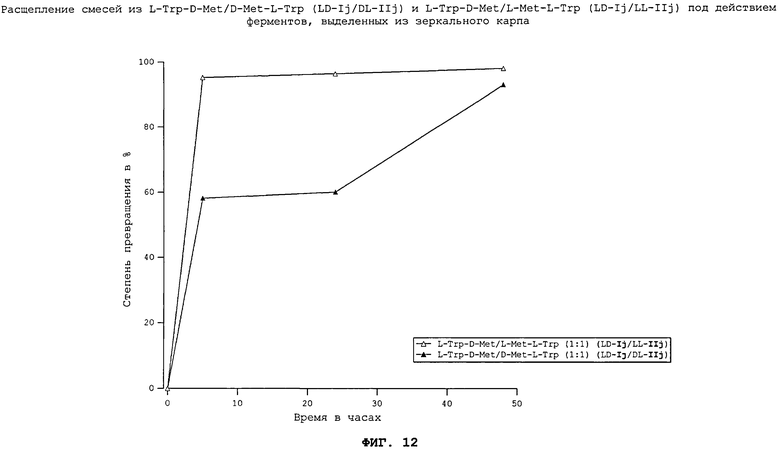
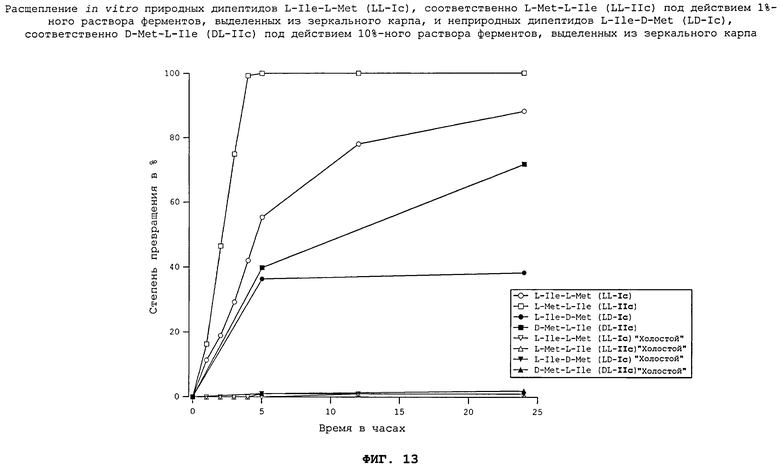
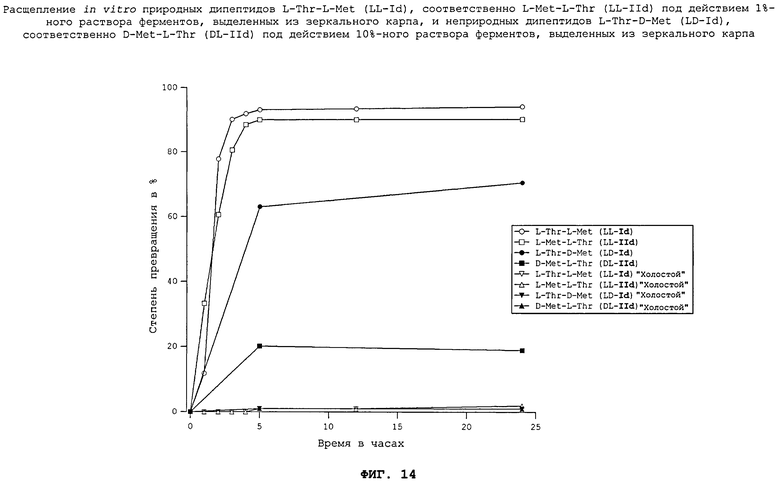
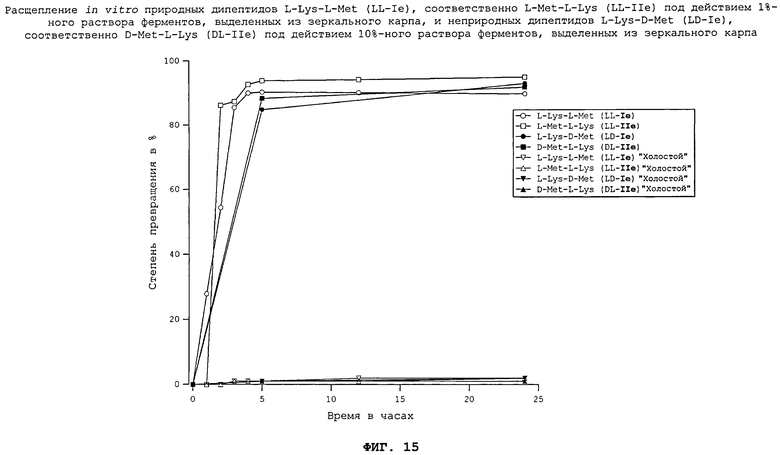
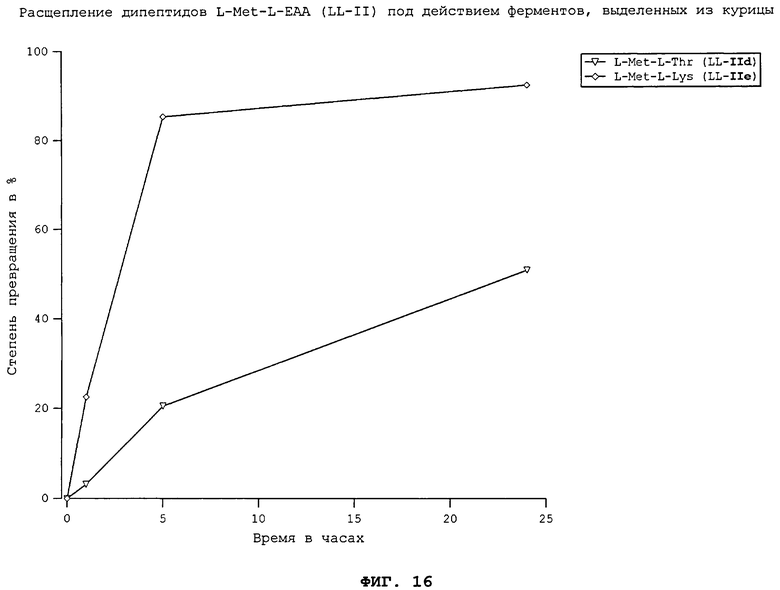
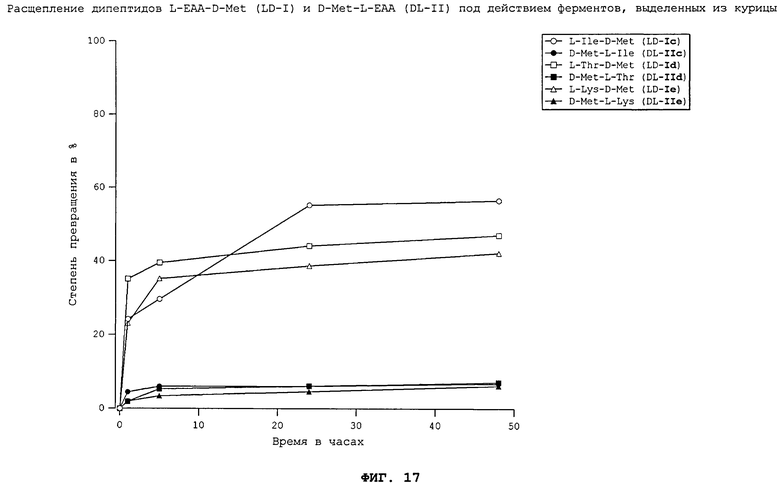
Изобретение относится к кормовым добавкам, содержащим дипептиды или их соли, при этом один аминокислотный остаток дипептида представляет собой DL-метионильный остаток, а другой аминокислотный остаток дипептида представляет собой аминокислоту в L-конфигурации, выбранную из группы, включающей лизин, треонин, триптофан, гистидин, валин, лейцин, изолейцин, фенилаланин, аргинин, цистеин и цистин. Также описаны кормовые смеси, содержащие такие добавки, и способ получения указанных дипептидов. 7 н. и 24 з.п. ф-лы, 17 ил., 10 табл., 25 пр.
1. Кормовая добавка, содержащая дипептиды или их соли, при этом один аминокислотный остаток дипептида представляет собой DL-метионильный остаток, а другой аминокислотный остаток дипептида представляет собой аминокислоту в L-конфигурации, выбранную из группы, включающей лизин, треонин, триптофан, гистидин, валин, лейцин, изолейцин, фенилаланин, аргинин, цистеин и цистин.
2. Кормовая добавка по п.1, содержащая дипептиды общей формулы DL-метионил-L-EAA и/или L-EAA-DL-метионин, где L-EAA представляет собой аминокислоту в L-конфигурации, выбранную из группы, включающей лизин, треонин, триптофан, гистидин, валин, лейцин, изолейцин, фенилаланин, аргинин, цистеин и цистин.
3. Кормовая смесь, содержащая кормовую добавку по п.1 или 2.
4. Кормовая смесь по п.3, содержащая DL-метионил-L-ЕАА и/или L-EAA-DL-метионин индивидуально в виде D-метионил-L-ЕАА, L-метионил-L-EAA, L-EAA-D-метионина или L-EAA-L-метионина, в виде смеси между собой, соответственно также в виде смеси с D-метионил-D-ЕАА, L-метионил-D-ЕАА, D-EAA-D-метионином или D-EAA-L-метионином.
5. Кормовая смесь по п.4, дополнительно содержащаяся в смеси с метионином.
6. Кормовая смесь по п.5, содержащаяся в смеси с D,L-метионином с его содержанием в пределах от 0,01 до 90 мас.%.
7. Кормовая смесь по п.6, содержащаяся в смеси с D,L-метионином с его содержанием от 0,1 до 50 мас.%.
8. Кормовая смесь по п.7, содержащаяся в смеси с D,L-метионином с его содержанием от 1 до 30 мас.%.
9. Кормовая смесь по п.4, дополнительно содержащаяся в смеси с L-EAA.
10. Кормовая смесь по п.9, где L-EAA - это L-лизин.
11. Кормовая смесь по п.9, где L-EAA содержится в пределах от 0,01 до 90 мас.%.
12. Кормовая смесь по п.11, где L-EAA содержится в пределах от 0,1 до 50 мас.%.
13. Кормовая смесь по п.12, где L-EAA содержится в пределах от 1 до 30 мас.%.
14. Дипептид или его соль общей формулы DL-метионил-DL-EAA или DL-EAA-DL-метионин, где ЕАА представляет собой аминокислоту, выбранную из группы, включающей лизин, треонин, триптофан, гистидин, валин, лейцин, изолейцин, фенилаланин, аргинин, цистеин и цистин.
15. Способ получения дипептида, содержащего только один метионильный остаток, формулы DD/LL/DL/LD-I и/или DD/LL/DL/LD-II:
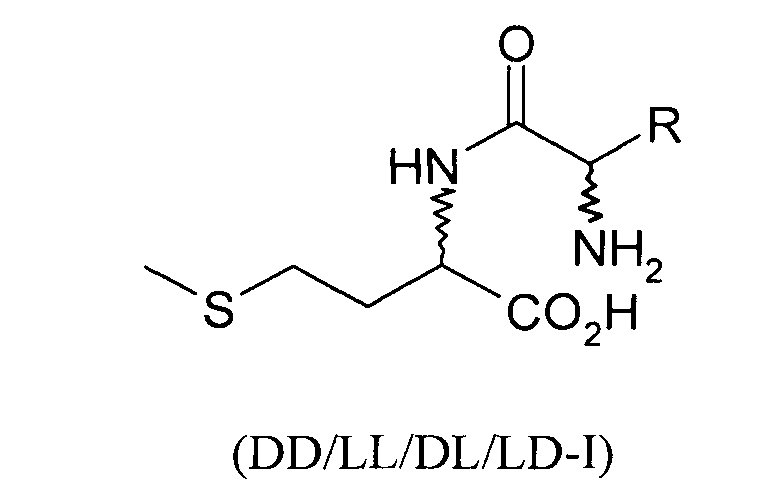
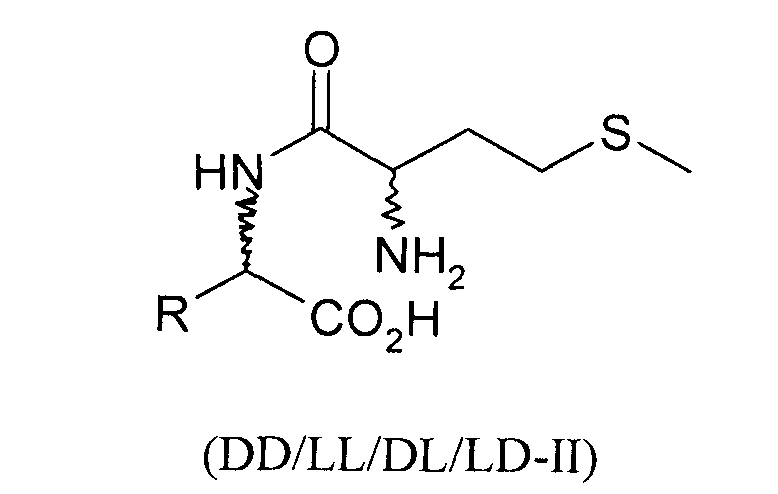
путем взаимодействия аминокислоты с производным мочевины одной из общих формул III-V
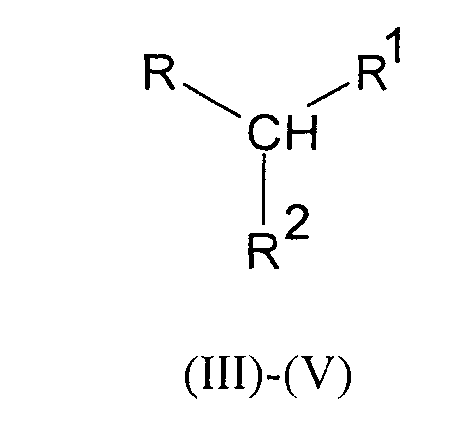 ,
,
где
R имеет следующие значения:
остатки R1 и R2 в производных мочевины формул III, IV и V имеют следующие значения:
в формулах IIIa-IIIn R1 обозначает СООН, a R2 обозначает NHCONH2,
в формулах IVa-IVn R1 обозначает CONH2, a R2 обозначает NHCONH2,
в формулах Va-Vn R1-R2 обозначают -CONHCONH-,
при этом либо R представляет собой метионильный остаток, а добавленная аминокислота выбрана из группы, включающей лизин, треонин, триптофан, гистидин, валин, лейцин, изолейцин, фенилаланин, аргинин, цистеин и цистин, либо добавленная аминокислота представляет собой метионин, a R представляет собой аминокислотный остаток, выбранный из группы, включающей лизин, треонин, триптофан, гистидин, валин, лейцин, изолейцин, фенилаланин, аргинин, цистеин и цистин.
16. Способ по п.15, при осуществлении которого в качестве исходного продукта используют либо в качестве промежуточного продукта образуют метионингидантоин или гидантоин аминокислоты, выбранный из группы, включающей лизин, треонин, триптофан, гистидин, валин, лейцин, изолейцин, фенилаланин, аргинин, цистеин и цистин.
17. Способ по п.15 или 16, при осуществлении которого раствор, содержащий метионингидантоин и воду, подвергают взаимодействию с аминокислотой в основных условиях либо раствор, содержащий гидантоин аминокислоты, выбранной из группы, включающей лизин, треонин, триптофан, гистидин, валин, лейцин, изолейцин, фенилаланин, аргинин, цистеин и цистин, и воду, подвергают взаимодействию с метионином в основных условиях.
18. Способ по п.15 или 16, при осуществлении которого значение рН раствора, содержащего производное мочевины, устанавливают на величину в пределах от 7 до 14 и/или реакцию проводят при температуре в пределах от 30 до 200°C и/или реакцию проводят под давлением в пределах от 2 до 100 бар.
19. Способ по любому из пп.15-16, при осуществлении которого раствор, содержащий метионингидантоин и воду, или раствор, содержащий гидантоин аминокислоты, выбранной из группы, включающей лизин, треонин, триптофан, гистидин, валин, лейцин, изолейцин, фенилаланин, аргинин, цистеин и цистин, и воду, предварительно образован из одного или нескольких соединений III, IV и V.
20. Способ по п.15, предусматривающий выполнение следующих стадий:
а) взаимодействие производного мочевины формулы III, IV или V с аминокислотой с получением дикетопиперазина формулы VI
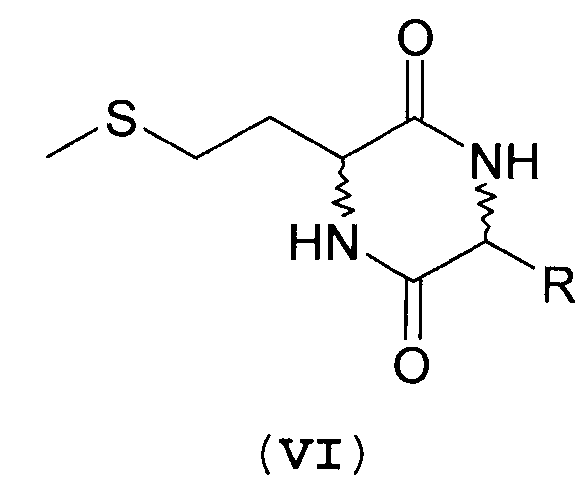 ,
,
где R имеет указанные в п.15 значения,
б) взаимодействие дикетопиперазина формулы VI с получением смеси из дипептидов формул DD/LL/DL/LD-I и DD/LL/DL/LD-II
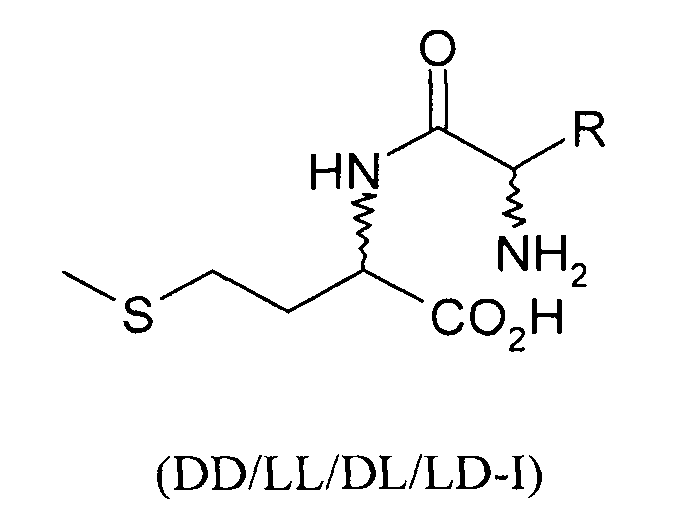
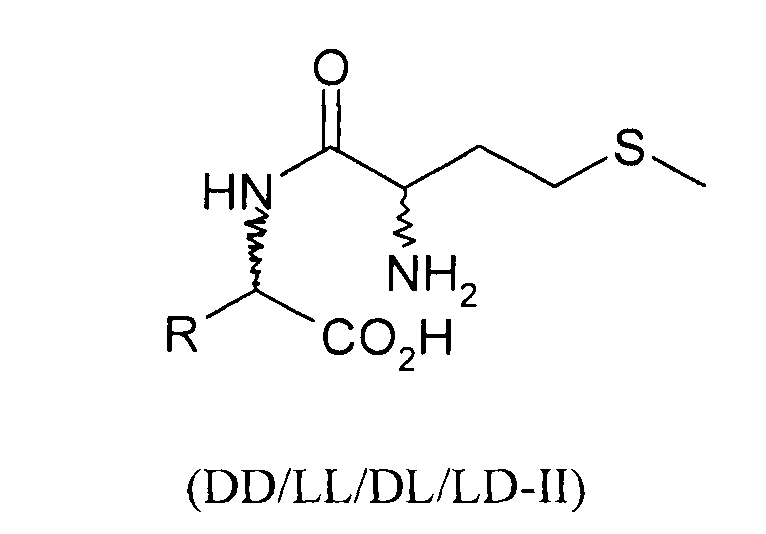 ,
,
где R имеет указанные в п.15 значения.
21. Способ по п.20, при осуществлении которого взаимодействие производного мочевины с аминокислотой с получением дикетопиперазина проводят при температуре в пределах от 20 до 200°C и/или под давлением, предпочтительно под давлением в пределах от 2 до 90 бар.
22. Способ по п.20 или 21, при осуществлении которого взаимодействие производного мочевины с аминокислотой с получением дикетопиперазина проводят в присутствии основания, предпочтительно в присутствии основания, выбранного из группы, включающей азотсодержащие основания, NH4HCO3, (NH4)2CO3, KНСО3, K2СО3, смесь NH4OH/CO2, карбаматные соли, а также основания щелочных и щелочноземельных металлов.
23. Способ по п.20 или 21, при осуществлении которого реакцию по получению дикетопиперазина проводят, либо подвергая производное мочевины формулы
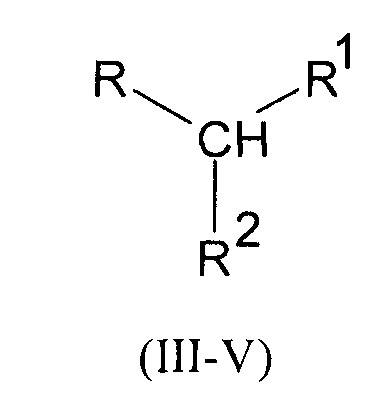 ,
,
где R обозначает метионильный остаток, взаимодействию с аминокислотой, выбранной из группы, включающей лизин, треонин, триптофан, гистидин, валин, лейцин, изолейцин, фенилаланин, аргинин, цистеин и цистин, либо подвергая производное мочевины формулы
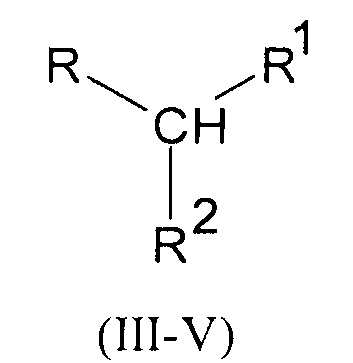 ,
,
где R представляет собой аминокислотный остаток, выбранный из группы, включающей лизин, треонин, триптофан, гистидин, валин, лейцин, изолейцин, фенилаланин, аргинин, цистеин и цистин, взаимодействию с аминокислотой - метионином.
24. Способ по п.20 или 21, при осуществлении которого дикетопиперазин превращают в смесь из дипептидов формул I и II путем кислотного гидролиза, предпочтительно в присутствии кислоты, выбранной из группы, включающей минеральные кислоты, HCl, Н2СО3, CO2/Н2О, H2SO4, фосфорные кислоты, карбоновые кислоты и гидроксикарбоновые кислоты.
25. Способ по п.20 или 21, при осуществлении которого дикетопиперазин превращают в смесь из дипептидов формул I и II путем основного гидролиза, предпочтительно при значении pH в пределах от 7 до 14, предпочтительно с использованием основания, выбираемого из группы, включающей азотсодержащие основания, NH4HCO3, (NH4)2CO3, смесь NH4OH/CO2, карбаматные соли, KНСО3, K2CO3, карбонаты, а также основания щелочных и щелочноземельных металлов.
26. Способ по п.15 или 16, при осуществлении которого производное мочевины III-V представлено в D-конфигурации, L-конфигурации или в смеси из D- и L-конфигураций, предпочтительно в смеси из D- и L-конфигураций, когда производное мочевины образовано из метионина (IIIn-Vn), либо производное мочевины III-V представлено в D-конфигурации, L-конфигурации или в смеси из D- и L-конфигураций, предпочтительно в L-конфигурации, когда производное мочевины III-V образовано из аминокислоты, выбранной из группы, включающей лизин, треонин, триптофан, гистидин, валин, лейцин, изолейцин, фенилаланин, аргинин, цистеин и цистин.
27. Способ выделения смеси диастереомеров дипептидов формул I и II путем кристаллизации из основных реакционных растворов, полученных при осуществлении способа по п.16, предпочтительно путем установления значения pH раствора на величину в пределах от 2 до 10, предпочтительно от 3 до 9, особенно предпочтительно на соответствующую изоэлектрическую точку конкретного дипептида формул I и II, добавлением кислоты, предпочтительно выбираемой из группы, включающей минеральные кислоты, HCl, Н2СО3, СО2/Н2О, H2SO4, фосфорные кислоты, карбоновые кислоты и гидроксикарбоновые кислоты.
28. Способ выделения смеси диастереомеров дипептидов формул I и II путем кристаллизации из кислотных реакционных растворов, полученных при осуществлении способа по п.24, путем установления значения pH раствора на величину в пределах от 2 до 10, добавлением основания, выбираемого из группы, включающей NH4HCO3, (NH4)2CO3, азотсодержащие основания, NH4OH, карбаматные соли, KНСО3, K2СО3, карбонаты, а также основания щелочных и щелочноземельных металлов.
29. Способ по п.28, где указанный pH раствора составляет величину от 3 до 9.
30. Способ по п.29, где указанная величина соответствует изоэлектрической точке конкретного дипептида формулы I, соответственно II.
31. Применение соединений формул I и/или II по п.15 в качестве кормовой добавки для кормления преимущественно домашней птицы, свиней, жвачных, пресноводных или морских рыб, ракообразных или домашних животных.
| НОВЫЙ ФЕРМЕНТ, ОБРАЗУЮЩИЙ ПЕПТИД, МИКРООРГАНИЗМ, ПРОДУЦИРУЮЩИЙ ДАННЫЙ ФЕРМЕНТ, И СПОСОБ СИНТЕЗА ДИПЕПТИДА С ИХ ПРИМЕНЕНИЕМ | 2003 |
|
RU2300565C2 |
| US 0004056658 A1, 01.11.1977 | |||
| Способ размножения копий рисунков, текста и т.п. | 1921 |
|
SU89A1 |
| US 20030099689 A1, 29.05.2003 | |||
| US 0005525350 A1, 11.06.1996 | |||
| US 0005167957 A1, 01.12.1992 | |||
| US 3980653 A1, 14.09.1976 | |||
| H | |||
| Gaertner et.al."HYDROLYSIS OF ISOPEPTIDE BOND OF e-N-L-METHIONYL-L-LYSINE BY INTESTINAL AMINOPEPTIDASE", FEBS LETTERS, v.133, n.1, p.135-138 | |||
Авторы
Даты
2014-12-27—Публикация
2010-03-22—Подача