Изобретение относится к аллергологии и иммунологии, в частности к моделированию гиперчувствительности замедленного типа (ГЗТ) на микобактерии в организме морских свинок. Предлагаемый способ может быть использован при оценке влияния иммунобиологических препаратов на кожную реакцию ГЗТ; изучении механизмов развития реакций ГЗТ; оценке противотуберкулезных препаратов.
Известен способ моделирования гиперчувствительности замедленного типа у морских свинок [OIE Manual of Diagnostic Test and Vaccines for Terrestrial Animals - 6-th ed. - 2008. - Vol.l. -P. 693], который заключается в том, что животным внутримышечно вводят патогенные микобактерии на физиологическом растворе в минимальной инфицирующей дозе, что приводит к медленному прогрессированию инфекционного процесса.
Недостатком этого способа является эпидемиологическая опасность для персонала, вероятность рассеивания микобактерий в окружающей среде, трудность в подборе минимальной дозы микобактерий, не приводящей к гибели животных ранее чем предполагается проведение основного этапа исследования.
Известен способ моделирования гиперчувствительности замедленного типа у морских свинок [Комитет экспертов ВОЗ по стандартизации биологических препаратов. 36-й доклад. Серия технических докладов 745. ВОЗ. Женева. 1988 г. С.43], который заключается в том, что животным внутримышечно вводят инактивированные микобактерии в адъюванте.
Недостатком данного способа являет развитие ГЗТ на измененные микобактериальные антигены, что снижает специфичность моделирования ГЗТ.
Известен способ моделирования гиперчувствительности замедленного типа у морских свинок, который был выбран за прототип [HBASAC- BCG combined vaccine for intracutaneous injection and preparation method and thereof, №US 7,579,003 B2, Aug. 25, 2009]. Сущность способа заключается во внутрикожном введении авирулентных микобактерии М. bovis штамм BCG на физиологическом растворе. В данном случае антигенный состав используемых аттенуированных микобактерий является близким по отношению к патогенным микобактериям, что обуславливает моделирование ГЗТ, адекватной инфекционному процессу.
Недостатком данного способа является широкая вариабельность кожных реакций ГЗТ в ответ на ППД для млекопитающих. Так, в экспериментальных группах рандинбредных морских свинок вариабельность кожных реакций ГЗТ колеблется: от 12,70% до 26,98%, (диапазон от средних Gv=11-25% до значительных Gv>25% значений), что не учитывается как значимый фактор, который может привести к получению недостоверных результатов, при реализации заявленных задач, а также необходимости перестановки эксперимента. В свою очередь, показатель коэффициент вариации характеризует воспроизводимость результатов эксперимента, в обратной зависимости: чем ниже коэффициент вариации, тем выше воспроизводимость результатов исследования [Г.Ф.Лакин. Биометрия. - М., Высшая школа, 1990. с 50-51].
Технической задачей является повышение воспроизводимости получаемых результатов при моделировании гиперчувствительности замедленного типа у морских свинок на микобактерии М. bovis штамм BCG.
Техническая задача достигается способом моделирования гиперчувствительности замедленного типа у морских свинок на микобактерии, включающим внутрикожное введение альбиносам самкам морских свинок, полученных близкородственным скрещиванием брат х сестра (F2) авирулентных микобактерий М. bovis штамм BCG с последующем, формированием групп(-ы) животных по размеру воспалительной реакции в ответ на внутрикожное введение микобактерии М. bovis штамм BCG, через 30-35 дней.
Основанием предлагаемого способа являются исследования, проведенные на детях, вакцинированных авирулентными микобактериями М. bovis штамм BCG (вакцина BCG), у которых была показана корреляционная зависимость между интенсивностью кожной реакции ГЗТ, развивающейся в ответ на введение туберкулина, и размером поствакцинального рубчика на месте введения микобактерий М. bovis штамм BCG [Клименко Л.И., Полякова Т.С., Бучковская И.Ю./ Оценка качества вакцинации БЦЖ по развитию поствакцинального знака / Запорожский медицинский журнал №1 (70). 2012. С.86-88]. При этом корреляционная зависимость, полученная на детях, предполагает подобную зависимость у лабораторных животных - альбиносов самок морских свинок, полученных близкородственным скрещиванием брат х сестра (F2). Так, проведенные исследования продемонстрировали, что между размером воспалительной реакции, в ответ на внутрикожное введение микобактерий М. bovis штамм BCG, и воспалительной реакцией на внутрикожное введение ППД для млекопитающих имеется положительная корреляционная зависимость, соответствующая 0,85 (р>0,01). В свою очередь, высокий показатель коэффициента корреляции позволяет получать группы животных с близкими значениями воспалительной реакции, в ответ на внутрикожное введение ППД для млекопитающих, при использовании интервальных оценок.
Заявленное изобретение отличается от прототипа тем, что для сенсибилизации количество животных определяют по таблице 1 с учетом частоты (интервала) и после развития состояния ГЗТ, перед проведением исследования осуществляют подбор животных, полученных близкородственным скрещиванием брат х сестра (F2) в группы(-у) по размеру воспалительной реакции на месте введения микобактерий М. bovis штамм BCG, согласно таблице 1.
Реализация предлагаемого способа возможна в двух вариантах.
При реализации первого варианта предполагается использовать количество животных для сенсибилизации не менее 15 голов с использованием 3 номера интервала воспалительной реакции на введение М. bovis штамм BCG и наибольшей частотой интервала - (0,4).
При осуществлении второго варианта предполагается использование всех номеров интервалов, поэтому для сенсибилизации животных используется не менее 100 голов, что обеспечит распределение по всем интервалам воспалительной реакции на введение М. bovis штамм BCG и количество животных не менее 10 голов.
Способ осуществляется следующим образом. Определяют количество животных (альбиносов, самок морских свинок, полученных близкородственным скрещиванием брат x сестра (F2), массой 500-600 г), необходимое для осуществления исследования (при этом n≥6; при n=6, количество животных необходимое для сенсибилизации будет соответствовать 15), по формуле (I):
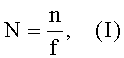
где:
N - количество животных, необходимое для сенсибилизации;
n - количество животных, необходимое для постановки эксперимента;
f - частота интервала (табличное значение).
Приготавливают суспензию с содержанием количеств мг микобактерий в физиологическом растворе, соответствующем 0,2 мг/ 0,1 см3, рассчитывая количество биомассы микобактерий М. bovis штамм BCG и объем физиологического раствора, необходимые для приготовления требуемого количества суспензии.
Количество биомассы микобактерий М. bovis штамм BCG, необходимое для сенсибилизации морских свинок, рассчитывается по формуле (II).
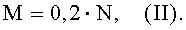
где:
M - биомасса микобактерии (мг) М. bovis штамм BCG
0,2 - доза микобактерии (мг), необходимая для сенсибилизации одного животного;
N - количество животных, необходимое для сенсибилизации;
Объем физиологического раствора, необходимый для приготовления суспензии, рассчитывается по формуле (III).
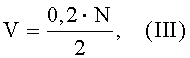
где:
V - объем физиологического раствора (см3), необходимый для приготовления суспензии;
0,2 - доза микобактерии (мг), необходимая для сенсибилизации одного животного;
N - количество животных, необходимое для сенсибилизации;
2 - коэффициент перевода расчетной массы микобактерий М. bovis штамм BCG в объем суспензии.
Далее животных внутрикожно в депелированный участок на брюшной стенке сенсибилизируют микобактериями М. bovis штамм BCG. Через 30-35 дней животных нумеруют и на месте введения микобактерии М. bovis штамм BCG, определяют линейные размеры воспалительной реакции, (сумма продольного и поперечного диаметров, деленная на 2), результаты протоколируются и согласно таблице 1 (графа интервалы воспалительных реакций на введение М. bovis штамм BCG) формируется группа(-ы). Данных животных используют для проведения исследования.
Пример выполнения предлагаемого способа.
Пример 1. В работе предполагается проведение исследования на одной группе животных в количестве 10 голов. Расчеты предполагается осуществлять с использованием номера интервала 3.
По таблице 1 (графа частота интервала - f) рассчитывается общее количество животных, необходимое для сенсибилизации. Так, для получения 10 животных, подставляем значение 10 в формулу I, и получаем расчетное значение 25 голов.
Пример 2. Приготавливается суспензия микобактерий М. bovis штамм BCG на физиологическом растворе. Для этого определяют количество мг микобактерий, необходимое для сенсибилизации группы животных (N=25), по формуле (II), в результате получают значение 5 мг. После этого определяют объем физиологического раствора, на котором приготавливается суспензия, по формуле (III), и получают значение 2,5 см3.
Пример 3. Осуществляют внутрикожную сенсибилизацию 25 голов альбиносов самок морских свинок, полученных близкородственным скрещиванием брат х сестра (F2), массой 500-600 гр, в дозе 0,1 см3, в депилированный участок кожи на брюшной стенке.
Пример 4. Через 30-35 дней после сенсибилизации формируют группу животных согласно таблице 1, с значениями воспалительной реакций на введение М. bovis штамм BCG, входящими в интервал 13,0-13,5 мм.
Пример 5. На сформированной группе осуществляется постановка эксперимента.
В таблице 2 приведены результаты вариации аллергических реакций ГЗТ прототипа и предлагаемого способа: группа 1 сформирована случайным образом, без подборки по воспалительной реакции на месте введения микобактерий М. bovis BCG; группа 2 сформирована по размеру воспалительной реакции на внутрикожное введение микобактерий М. bovis BCG.
Из полученных данных видно, что значение коэффициента вариации на дозы ППД для млекопитающих значимо ниже в группе животных, сформированной в соответствии с предлагаемым способом, в сравнении с группой, сформированной по способу-прототипа (р>0,05).
В зависимости от планируемого эксперимента предлагаемый способ предполагает следующие варианты использования.
1. При проведении единичных сравнительных исследований целесообразно использование небольшого количества животных центрального номера интервала 3, обеспечивающего частоту интервала, равную 0,4.
2. При проведении масштабных, в том числе фундаментальных исследований, сравнительных исследований, целесообразным является сенсибилизация не менее 100 голов животных, что обеспечит получение в группах количества животных от 10 и более и все номера интервалов.
Результатом предлагаемого способа является повышение воспроизводимости результатов исследований при оценке влияния иммунобиологических препаратов на кожную реакцию ГЗТ, изучении механизмов развития реакций ГЗТ и оценке противотуберкулезных препаратов.
ного
Примечание: Gv- коэффициент вариации
Сумм, р-я - суммарная реакция
Изобретение относится к области аллергологии и иммунологии и предназначено для оценки влияния иммунобиологических препаратов на кожную реакцию гиперчувствительности замедленного типа (ГЗТ). Предложен способ моделирования ГЗТ у морских свинок на микобактерии М. bovis. Осуществляют внутрикожное введение альбиносам самкам морских свинок, полученных близкородственным скрещиванием брат х сестра (F2), авирулентных микобактерий М. bovis штамм BCG с последующим формированием групп(-ы) животных по размеру воспалительной реакции в ответ на внутрикожное введение микобактерий М. bovis штамм BCG через 30-35 дней. Предлагаемый способ эффективен в изучении механизмов развития ГЗТ и оценке противотуберкулезных препаратов. 2 табл., 5 пр.
Способ моделирования гиперчувствительности замедленного типа у морских свинок на микобактерии М. bovis, включающий внутрикожное введение альбиносам самкам морских свинок, полученных близкородственным скрещиванием брат x сестра (F2), авирулентных микобактерий М. bovis штамм BCG, отличающийся тем, что из совокупности сенсибилизированных животных формируют группу(-ы) животных по размеру воспалительной реакции в ответ на внутрикожное введение микобактерий М. bovis штамм BCG через 30-35 дней.
| US 7579003 B2, 25.08.2009 | |||
| BOVINE TUBERCULOSIS | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| OIE Terrestrial Manual | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| СПОСОБ ДИАГНОСТИКИ ТУБЕРКУЛЕЗНОЙ ИНФЕКЦИИ, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК, КОДИРУЮЩАЯ СИНТЕЗ ГИБРИДНОГО БЕЛКА CFP10-ESAT6 ИЗ MYCOBACTERIUM TUBERCULOSIS, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ГИБРИДНЫЙ БЕЛОК CFP10-ESAT6 И ЕГО ПРИМЕНЕНИЕ | 2003 |
|
RU2277540C2 |
| ИММУНОГЕННАЯ КОМПОЗИЦИЯ (ВАРИАНТЫ) НА ОСНОВЕ РЕКОМБИНАНТНОГО ВНУТРИКЛЕТОЧНОГО ПАТОГЕНА | 2003 |
|
RU2337707C2 |
Авторы
Даты
2014-05-27—Публикация
2012-10-25—Подача