Изобретение относится к аллергологии и иммунологии, в частности к способам усиления и оценки сенсибилизирующих свойств различных видов микобактерий и может быть использовано в ветеринарной и медицинской практиках при изучении сенсибилизирующих свойств микобактерий.
Паратуберкулез - хроническая инфекционная болезнь, в основном жвачных животных, чаще всего протекающая латентно, характеризующаяся поражением кишечника и мезентериальных лимфатических узлов и как следствие - сопровождающаяся расстройством работы желудочно-кишечного тракта (диареей), потерей продуктивности, прогрессирующим истощением - вплоть до летального исхода.
Паратуберкулез был и остается одной из недостаточно изученных, сложно контролируемых инфекций. Инкубационный период длится от 6 месяцев до 15 лет, возможны случаи самоизлечения, т.е. клиническая картина может не проявиться в течение всей жизни животного. При этом латентно больные животные могут стать носителями микобактерий, и периодически выделяя возбудителя во внешнюю среду, создавать условия для распространения паратуберкулеза в стаде.
Некоторые авторы сравнивают проблему паратуберкулеза с «верхушкой айсберга» (айсберг-эффект), когда на один клинический случай приходятся десятки случаев инфицированных животных в латентной форме [Н.П. Овдиенко и соавт., 2007; А.И. Завгородный и соавт. 2010; А.Х. Найманов и соавт., 2020, 2022].
В 1912 году T.W. Twort, Y.Z. Ingram выделили возбудителя из подвздошной кишки больной коровы и назвали его Mycobacterium enteridis chronicae bovis. В дальнейшем возбудитель заболевания был квалифицирован как Mycobacterium paratuberculosis, а болезнь названа паратуберкулезом. После исследований с применением молекулярно-генетических методов было установлено, что гены М. avium и М. paratuberculosis на 99% гомологичны. Впоследствии, по предложению M.F. Thorel et al. (1990), возбудитель паратуберкулеза стали считать подвидом микобактерий птичьего вида - Mycobacterium avium subspecies paratuberculosis (MAP).
Микобактерий паратуберкулеза «вездесущи» в окружающей внешней среде, их обнаруживают в кишечнике, фекалиях, молоке, крови крупного рогатого скота. Тем не менее выявить эти микобактерий у животных и во внешней среде достаточно сложно, так как они не могут быть идентифицированы при бактериоскопии, а только молекулярно-генетическими методами [A. W iczniewska et.al., 2002; R. Greenstein, 2003; В.И. Литвинов и соавт., 2008].
При паратуберкулезе нет высокоэффективных методов диагностики, лечения и вакцинопрофилактики. Большим препятствием в разработке эффективных методов диагностики является отсутствие биологической модели для воспроизведения болезни. Многочисленные попытки воспроизвести паратуберкулез у лабораторных животных не увенчались успехом.
По мнению многих исследователей ни один из существующих методов диагностики паратуберкулеза не обладает 100% эффективностью, поэтому рекомендуется применять комплексный подход к диагностике паратуберкулеза крупного рогатого скота [J. Larson, 2002].
В соответствии 28 издания «Кодекса здоровья наземных животных МЭБ» от 2019 года при паратуберкулезе нет рекомендуемых тестов, а в качестве альтернативных тестов предлагается внутрикожная туберкулиновая проба и иммуноферментный анализ.
В «скрытости» инфекции, низкой чувствительности и специфичности методов диагностики, сложности выделения, культивирования и идентификации возбудителя в отсутствии возможности воспроизведения болезни на лабораторных животных - заключаются основные сложности в установлении диагноза на паратуберкулез.
Паратуберкулез крупного рогатого скота регистрируют во многих странах мира. По данным ООН, болезнь признана серьезной проблемой современности со значительными экономическими последствиями. Экономический ущерб слагается из снижения продукции животноводства, потери молочной продуктивности, истощения, бесплодия, выбраковки или гибели больных животных.
В настоящее время паратуберкулез остается менее изученной инфекцией, чем другие хронические инфекционные болезни животных.
Уровень техники
Известен способ изучения сенсибилизирующих свойств атипичных микобактерий, когда для подтверждения причины реакций на туберкулин в благополучных по туберкулезу хозяйствах изучают сенсибилизирующие свойства атипичных микобактерий, выделенных из послеубойного материала крупного рогатого скота. Этот способ является наиболее близким прототипом предлагаемого нами способа. Культуру атипичных микобактерий вводят подкожно двум морским свинкам в дозе 1 мг/мл. Спустя 21-30 дней после введения культуры микобактерий морских свинок исследуют симультанной аллергической пробой с ППД-туберкулином для млекопитающих и КАМ. ППД-туберкулин для млекопитающих вводят в дозе 25 ТЕ (что соответствует дозе, выраженной в эквивалентных единицах активности международного стандарта, используемого в настоящее время - 5 ME), КАМ (комплексный аллерген из атипичных микобактерий) вводят в дозе 10 ЕД и в объеме 0,1 мл физиологического раствора или растворителя микобактериальных аллергенов.
Указанные разведения аллергенов вводят внутрикожно с левой и правой стороны в депилированные участки кожи на боках животного. Реакцию учитывают через 24-48 часов. Положительная реакция проявляется гиперемией кожи и образованием припухлости диаметром 5 мм или более, иногда с некрозом в центре. Обнаружение реакции на один или оба препарата свидетельствует о сенсибилизирующих свойствах изучаемой культуры атипичных микобактерий [Наставление по диагностике туберкулеза животных. Утверждено Департаментом ветеринарии МСХ РФ, 2002 г. стр. 60-61].
Недостатком этого способа сенсибилизации является низкая сенсибилизирующая способность нетуберкулезных непатогенных микобактерий для морских свинок (кроме микобактерий, относящихся к патогенным видам М. bovis и М. tuberculosis).
Технической проблемой является необходимость создания способа усиления сенсибилизации морских свинок различными видами микобактерий с целью повышения информативности и точности способа оценки сенсибилизирующих свойств микобактерий паратуберкулеза, расширение арсенала способов усиления сенсибилизации морских свинок
Раскрытие сущности изобретения
Техническим результатом является усиление сенсибилизации морских свинок различными видами микобактерий, повышение сенсибилизирующей роли различных видов микобактерий для последующий оценки уровня сенсибилизации разными видами микобактериальных аллергенов, расширение арсенала способов усиления сенсибилизации морских свинок.
Основной задачей при разработке заявленного способа являлся подбор оптимальной дозы, места введения различных видов микобактерий, адъюванта и микобактериальных аллергенов, позволяющих по интенсивности проявления кожной реакции ГЗТ оценить аллергическую реактивность морских свинок, сенсибилизированных микобактериями с низкой сенсибилизирующей способностью.
Способ усиления сенсибилизации морских свинок различными видами микобактерий в адъюванте для оценки сенсибилизирующих свойств различных видов микобактерий включает в себя подкожное ведение различных видов микобактерий морским свинкам, оценку сенсибилизирующих свойств микобактерий через 30 суток методом симультанной пробы с ППД-туберкулином для млекопитающих, инъецируемых внутрикожно в боковую поверхность справа и ППД-туберкулин для птиц слева, с определением через 24 часа интенсивности аллергических реакций и сравнением значений интенсивности этих реакций на оба аллергена.
Подкожное введение морским свинкам осуществляют на расстоянии 3-5 см в четыре места в области спины - холки и крестца. Изучаемые виды микобактерий вводятся морским свинкам в дозе 5 мг в составе адъюванта, включающего 15 частей ланолина и 85 частей вазелинового масла на одно животное.
Аллергические исследования зараженных (сенсибилизированных) морских свинок проводят через 30 суток, методом внутрикожного введения в область боковой поверхности брюшка с правой и левой стороны (в депилированные от шерсти участки кожи) ППД-туберкулина для млекопитающих и ППД-туберкулина для птиц. Учет и оценку аллергических реакций определяют по проявлению и интенсивности проявления реакции гиперчувствительности замедленного типа (ГЗТ) через 24 часа после внутрикожного введения аллергенов.
Для усиления сенсибилизирующих свойств различных видов микобактерий используют культуры микобактерий в количестве 5 мг, в составе адъюванта, включающего 15 частей ланолина, 85 частей минерального масла в соотношении 15:85-0,5 мл.
Увеличение дозы культур микобактерий до 5 мг, подкожное введение в 4 места позволяет значительно усилить сенсибилизирующие свойства микобактерий и усиливает сенсибилизацию организма морских свинок. Использование адъюванта позволяет пролонгировать сенсибилизацию животных и усилить иммунный ответ на подкожное введение различных видов микобактерий.
В связи с тем, что в диагностике микобактериальных инфекций симультанной аллергической пробой основное значение имеет не количество реагирующих животных на тот или другой аллерген, а интенсивность проявления реакций (минимальный размер аллергической реакции 5 мм.) на введение этих аллергенов, то проявление кожной реакции ГЗТ на микобактериальные аллергены свидетельствует о сенсибилизирующих свойствах изучаемой культуры.
Осуществление изобретения
Пример 1. Исследование сенсибилизированных различными видами микобактерий морских свинок
В лаборатории хронических инфекций на среде Левенштейна-Йенсена были выращены 8 культур микобактерий: М. bovis БЦЖ, М. avium, М. fortuitum, М. scrofulaceum, М. phlei, М. itracellularae, М. smegmatis и М. avium subsp.paratuberulosis, в течение 35 суток, при температуре 37°С. По истечении указанного времени с поверхности питательной среды культуры микобактерий в количестве по 5 мг (3-х недельная культура) из расчета на одну морскую свинку внесли в отдельные стерильные пластиковые пробирки В пробирки добавили адъювант (15 частей ланолина и 85 частей минерального масла) из расчета 0,5 см3 адьюванта на 5 мг микобактерий. Каждый полученный вариант культуры микобактерий и адъюванта гомогенизировали и инъецировали подкожно на расстояние 3-5 см в четыре места в области спины (2 в область холки и 2 в области крестца) морским свинкам, массой 300-350 гр.
Через 30 суток после введения микобактерий в составе адъюванта морским свинкам на боковых поверхностях брюшка справа и слева депилировали шерсть размером 90 х 40 мм и внутрикожно инъецировали справа - ППД для млекопитающих, слева - комплексный аллерген из атипичных микобактерий (КАМ) в установленных дозах. Результаты исследования через 24 часа после введения аллергенов указаны в таблицах 1-2.
Исследования были осуществлены в четырех сериях опытов. В первой серии опытов (результаты представлены в таблице 1) в пяти группах морских свинок, сенсибилизированных микобактериями различных видов с адъювантом. Оценку иммунологической реактивности морских свинок осуществляли, используя ППД для млекопитающих и КАМ. Во второй серии опытов (результаты исследования представлены в таблице 2) в пяти группах морских свинок, сенсибилизированные различными микобактериями с адъювантом, оценку иммунологической реактивности морских свинок осуществляли, используя ППД для млекопитающих и ППД для птиц. Для этого через 30 суток после введения микобактерий морским свинкам на боковых поверхностях брюшка справа и слева депилировали шерсть и внутрикожно инъецировали микобактериальные аллергены. 5 группе морских свинок, сенсибилизированных М. avium, М. bovis БЦЖ, М. avium subsp.paratuberulosis, М. scrofulaceum и М. intracellularae, оценку сенсибилизации проводили с ППД для млекопитающих и ППД для птиц. 6 группе морских свинок, сенсибилизированных М. avium, М. bovis БЦЖ, М. avium subsp.paratuberulosis, М. scrofulaceum, М. phlei и М. smegmatis, оценку сенсибилизации проводили с ППД для млекопитающих и КАМ.
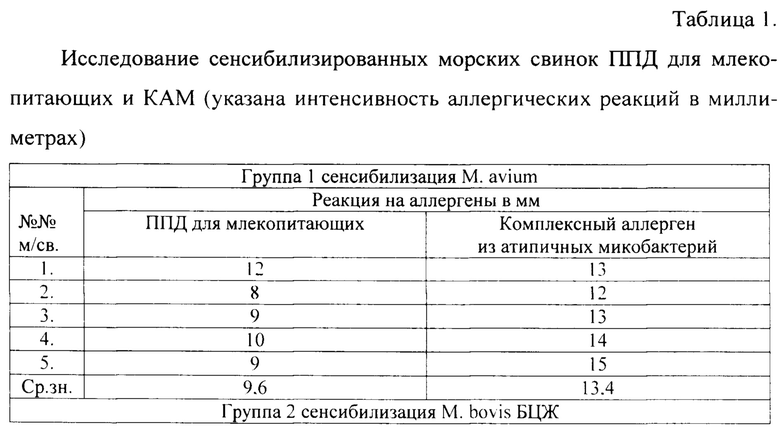
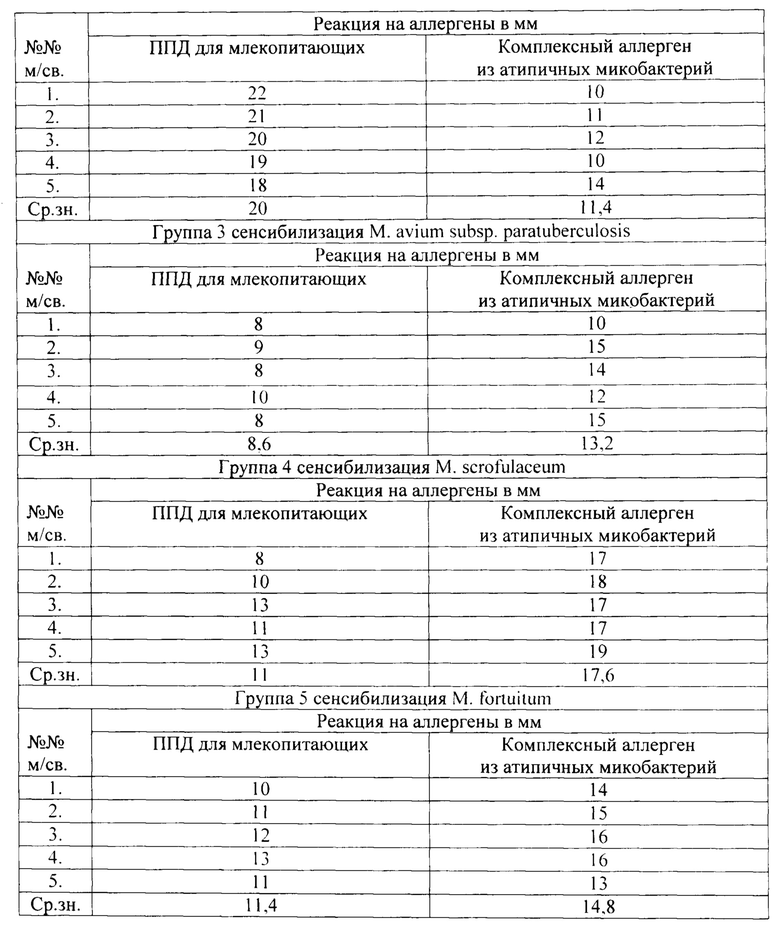
Из данных таблицы видно, что в первой группе морских свинок, которым инъецировали микобактерий М. avium, максимальная интенсивность кожной реакции ГЗТ у животных выявлена на КАМ, чем на ППД для млекопитающих.
Во второй группе морских свинок, которым инъецировали микобактерий М. bovis БЦЖ, максимальная интенсивность кожной реакции ГЗТ у животных выявлена на ППД для млекопитающих, чем на КАМ.
В третьей группе морских свинок, которым вводили М. avium subsp.paratuberculosis, большая интенсивность аллергических реакций ГЗТ выявлена у животных на КАМ, чем на ППД для млекопитающих.
В четвертой группе морских свинок, которым вводили М. scrofulaceum, и в пятой группе морских свинок, которым вводили М. fortuitum, большая интенсивность аллергических реакций ГЗТ выявлена также на КАМ, чем на ППД для млекопитающих.
Полученные результаты исследований показывают, что при подкожном методе сенсибилизации морских свинок различными культурами микобактерий в адъюванте усиливается интенсивность проявления аллергических реакций на внутрикожное введение аллергенов.
Ответная реакция ГЗТ строго специфична, так как зараженные М. bovis животные реагируют с большей интенсивностью реакций ГЗТ на ППД для млекопитающих, а сенсибилизированные непатогенными для морских свинок микобактериями реагируют с большей интенсивностью аллергических реакций на комплексный аллерген из атипичных микобактерий.
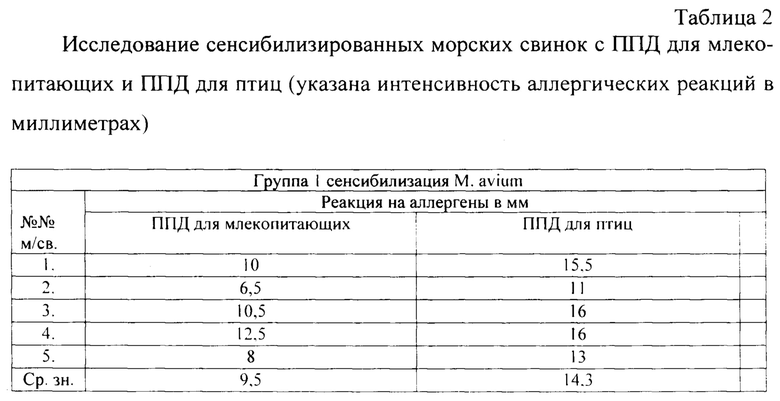
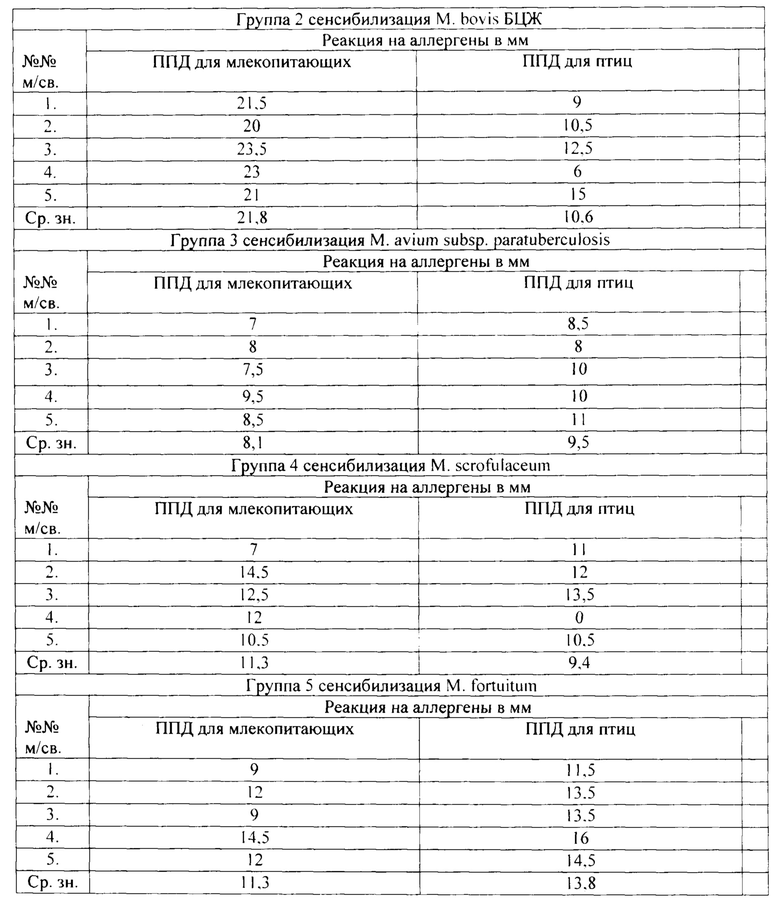
Из данных таблицы видно, что в первой группе морских свинок, которые были сенсибилизированы М. avium, максимальная интенсивность кожной реакции ГЗТ у животных выявлена на ППД туберкулин для птиц, что свидетельствует о большей сенсибилизации М. avium и специфичности ППД для птиц.
Во второй группе морских свинок, которым инъецировали М. bovis БЦЖ, максимальная интенсивность кожной реакции ГЗТ у животных выявлена на ППД туберкулин для млекопитающих, что свидетельствует о большей сенсибилизации М. bovis и специфичности ППД для млекопитающих.
В третьей группе морских свинок, которым инъецировали М. paratuberculosis, максимальная интенсивность кожной реакции ГЗТ у животных выявлена на ППД для птиц, что свидетельствует о близком родстве М. avium и М. avium subsp.paratuberculosis.
В четвертой и пятой группах морских свинок, которым подкожно вводили атипичные микобактерий М. scrofulaceum и М. fortuitum, максимальная интенсивность кожной реакции ГЗТ не выявлена ни на один аллерген, что свидетельствует о гетерологичности используемых аллергенов в отношении исследуемых культур микобактерий. Так, интенсивность аллергических реакций составила в среднем: на ППД для млекопитающих 11,3 мм, на ППД для птиц 9,4-13,8 мм. Тем не менее, проявление интенсивности реакций у сенсибилизированных атипичными микобактериями животных было выше на ППД для птиц.
Проявление кожной реакции ГЗТ на микобактериальные аллергены свидетельствует о сенсибилизирующих свойствах изучаемых культур и принадлежности их к роду микобактерий.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ дифференциации M. avium subsp. paratuberculosis от других видов микобактерий на сенсибилизированных этими видами микобактерий морских свинках | 2022 |
|
RU2800320C1 |
| Комплексный аллерген для диагностики паратуберкулеза | 2021 |
|
RU2771778C1 |
| Способ оценки сенсибилизирующих свойств микобактерий и микобактериальных антигенов | 2018 |
|
RU2691398C1 |
| Способ оценки сенсибилизирующих свойств атипичных микобактерий | 2019 |
|
RU2715220C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ АЛЛЕРГЕНА ДЛЯ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ПАРААЛЛЕРГИЧЕСКИХ РЕАКЦИЙ У КРУПНОГО РОГАТОГО СКОТА НА ППД ТУБЕРКУЛИН ДЛЯ МЛЕКОПИТАЮЩИХ | 2010 |
|
RU2443428C1 |
| КОМПЛЕКСНЫЙ АЛЛЕРГЕН ДЛЯ ДИФФЕРЕНЦИАЦИИ АЛЛЕРГИЧЕСКИХ РЕАКЦИЙ У КРУПНОГО РОГАТОГО СКОТА НА ППД-ТУБЕРКУЛИН ДЛЯ МЛЕКОПИТАЮЩИХ | 2002 |
|
RU2217165C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ГИПЕРЧУВСТВИТЕЛЬНОСТИ ЗАМЕДЛЕННОГО ТИПА У МОРСКИХ СВИНОК НА МИКОБАКТЕРИИ M.BOVIS | 2012 |
|
RU2517218C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЛЕРГЕНА ДЛЯ ДИФФЕРЕНЦИАЦИИ НЕСПЕЦИФИЧЕСКИХ РЕАКЦИЙ НА ППД ТУБЕРКУЛИН ДЛЯ МЛЕКОПИТАЮЩИХ | 2015 |
|
RU2605633C1 |
| Способ внутрикожного введения ППД-туберкулина для птиц при аллергической диагностике паратуберкулеза крупного и мелкого рогатого скота | 2022 |
|
RU2806215C2 |
| КОМПЛЕКСНЫЙ АЛЛЕРГЕН ДЛЯ ДИФФЕРЕНЦИАЦИИ АЛЛЕРГИЧЕСКИХ РЕАКЦИЙ НА ППД-ТУБЕРКУЛИН ДЛЯ МЛЕКОПИТАЮЩИХ | 2009 |
|
RU2409387C2 |
Изобретение относится к аллергологии и иммунологии, в частности к способу сенсибилизации морских свинок микобактериями в адъюванте для оценки сенсибилизирующих свойств микобактерий. Для этого подкожно вводят микобактерии морским свинкам в четыре точки на расстоянии 3-5 см друг от друга в области спины - холки и крестца - в дозе 5 мг в составе адъюванта, включающего 15 частей ланолина и 85 частей вазелинового масла, в объеме 0.5 см3 на одно животное. Изобретение обеспечивает повышение сенсибилизирующей роли различных видов микобактерий для последующей оценки уровня сенсибилизации разными видами микобактериальных аллергенов, расширение арсенала способов сенсибилизации морских свинок. 1 пр., 2 табл.
Способ сенсибилизации морских свинок микобактериями в адъюванте для оценки сенсибилизирующих свойств микобактерий, включающий подкожное введение микобактерий морским свинкам, отличающийся тем, что подкожное введение микобактерий осуществляют в четыре точки на расстоянии 3-5 см друг от друга в области спины - холки и крестца - в дозе 5 мг в составе адъюванта, включающего 15 частей ланолина и 85 частей вазелинового масла, в объеме 0.5 см3 на одно животное.
| Способ оценки сенсибилизирующих свойств атипичных микобактерий | 2019 |
|
RU2715220C1 |
| Способ оценки сенсибилизирующих свойств микобактерий и микобактериальных антигенов | 2018 |
|
RU2691398C1 |
| КАРГОПОЛЬЦЕВА Д.Р | |||
| и др | |||
| Опыт применения теста максимизации Магнуссона и Клигмана на морских свинках при оценке сенсибилизирующего потенциала химических веществ / Лабораторные животные для научных исследований, 2018, N 4, стр | |||
| Приспособление в центрифугах для регулирования количества жидкости или газа, оставляемых в обрабатываемом в формах материале, в особенности при пробеливании рафинада | 0 |
|
SU74A1 |
| MYASOEDOV Y.M | |||
| THE STUDY OF THE SENSITIZING PROPERTIES OF | |||
Авторы
Даты
2024-04-11—Публикация
2023-03-17—Подача