ИНФОРМАЦИЯ, КАСАЮЩАЯСЯ ПРАВИТЕЛЬСТВА
Настоящее изобретение было сделано в рамках гранта № AI31338, финансируемого Правительством и выданного Министерством здравоохранения и социального обеспечения. Правительство имеет определенные права на это изобретение.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение в основном относится к иммуногенным композициям, полученным из рекомбинантных аттенюированных внутриклеточных патогенных бактерий. Более конкретно, настоящее изобретение относится к иммуногенным композициям, содержащим рекомбинантные аттенюированные Mycobacteria, которые сверхэкспрессируют и секретируют основные внеклеточные белки. Кроме того, иммуногенные композиции по настоящему изобретению также содержат рекомбинантные аттенюированные Mycobacteria, включая ауксотрофные штаммы. Иммуногенные композиции по настоящему изобретению могут использоваться для индукции иммунных ответов в организм хозяина.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Давно известно, что паразитирующие микроорганизмы обладают способностью инфицировать животных, вызывая болезни и часто смерть. Патогены являются основной причиной смерти на протяжении всей истории человечества и продолжают причинять огромные страдания. Несмотря на то что за последние сто лет были достигнуты значительные успехи в профилактике и лечении многих инфекционных заболеваний, до сих пор не существует универсального эффективного подхода для лечения из-за сложных взаимоотношений "хозяин-паразит". Трудности в противодействии сложным механизмам инвазии, наблюдаемым у многих патогенных микроорганизмов, подтверждаются возрождением различных заболеваний, таких как туберкулез, а также возникновением большого числа резистентных штаммов бактерий и вирусов.
К числу эпидемиологически важных патогенов относятся внутриклеточные бактерии, которые имеют доказанную устойчивость при лечении или профилактических мероприятиях. Внутриклеточные бактерии, включая род Mycobacterium, весь или часть своего жизненного цикла находятся в клетках инфицированного организма хозяна, а не во внеклеточной среде. Внутриклеточные бактерии вызывают бесчетное множество болезней во всем мире и миллионы смертей ежегодно. Туберкулез является главной причиной смерти от одного возбудителя во всем мире, при этом ежегодно насчитывается 10 миллионов новых случаев и 2,9 миллиона смертельных исходов. Кроме того, внутриклеточные бактерии являются причиной возникновения миллионов случаев лепры. Другие истощающие заболевания, вызываемые внутриклеточными агентами, включают кожный и висцеральный лейшманиоз, американский трипанозомоз (болезнь Шагаса), листериоз, токсоплазмоз, гистоплазмоз, трахому, пситтакоз, лихородку Ку и легионеллез.
В настоящее время считается, что примерно одна треть населения земного шара инфицирована M. tuberculosis, что влечет за собой возникновение миллионов случаев легочной формы туберкулеза ежегодно. Более конкретно, легочная форма туберкулеза человека, вызываемая M. tuberculosis, является основной причиной смерти в развивающихся странах. Способный выживать внутри макрофагов и моноцитов, M. tuberculosis может вызывать хроническую внутриклеточную инфекцию. M. tuberculosis относительно успешно обходит нормальные защитные механизмы организма хозяина, скрываясь внутри клеток, в первую очередь ответственных за обнаружение чужеродных элементов и последующую активацию иммунной системы. Более того, многие химиотерапевтические средства первой линии, используемые для лечения туберкулеза, обладают относительно низкой активностью против внутриклеточных организмов по сравнению с внеклеточными формами. Такие свойства патогенных бактерий до сих пор ограничивали эффективность иммунотерапевтических средств или иммуногенных композиций против туберкулезных инфекций.
В последнее время о резистентности возбудителей туберкулеза к одному или нескольким лекарственным средствам сообщалось в 36 из 50 штатов США. В Нью-Йорке одна треть всех исследованных случаев были резистентны к одному или нескольким основным лекарственным средствам, применяемым для лечения туберкулеза. Несмотря на то что нерезистентный туберкулез может быт излечен после длительного курса антибиотиками, перспективы в отношении штаммов, резистентных к лекарственным препаратам, довольно печальны. У пациентов, которые инфицированны штаммами, резистентными к двум или более основным антибиотикам, уровень смертности составляет около 50%. Соответственно, существует острая необходимость в безопасных и эффективных иммуногенных композициях против разнообразных видов M. tuberculosis.
Первичная инфекция M. tuberculosis почти всегда возникает при вдыхании распыленных в воздухе частиц, поскольку патоген может оставаться жизнеспособным в течение ряда недель или месяцев во влажной или сухой мокроте. Несмотря на то что первичным сайтом инфекции являются легкие, патоген может также вызвать инфекцию почти любого органа, включая, но этим не ограничиваясь, кости, селезенку, почку, оболочки мозга и кожу. В зависимости от вирулентности конкретного штамма и устойчивости организма-хозяина инфекция и соответствующее поражение ткани может быть небольшим или обширным. У большенства людей, подвергающихся воздействию вирулентных штаммов бактерий, первичная инфекция находится под контролем. Развитие приобретенного иммунитета после первичного стимула снижает пролиферацию бактерий, что позволяет излечить патологические нарушения и обеспечивает практически бессимптомное проявление заболевания у субъекта.
Если M. tuberculosis не контролируется инфицированным субъектом, то такая ситуация часто приводит к обширному поражению легочной ткани. У восприимчивых индивидуумов поражение обычно формируется в легких, так как бациллы туберкулеза размножаются в альвеолярных или легочных макрофагах. Поскольку организмы размножаются, они могут распространяться по лимфатической системе до удаленных лимфатических узлов и через кровоток к апикальным частям легкого, костному мозгу, почкам и оболочкам мозга. Первоначально, в результате клеточных реакций гиперчувствительности, образуются характерные грануломатозные поражения или туберкулы, в зависимости от тяжести инфекции. Указанные поражения в основном состоят из эпителиоидных клеток, окруженных моноцитами, лимфоцитами и фибробластами. В большинстве случаев поражение или туберкулы постепенно некротизируются и подвергаются казеозу (преобразованию пораженных тканей в размягченную творожистую субстанцию).
Несмотря на то что M. tuberculosis является важнейшим патогеном, другие виды рода Mycobacterium также вызывают заболевание у животных, включая человека, и они также входят в область настоящего изобретения. Например, M. bovis очень сходен с M. tuberculosis и ответственен за туберкулезные инфекции домашних животных, таких как крупный рогатый скот, свиньи, овцы, лошади, собаки и кошки. Кроме того, M. bovis может инфицировать людей через желудочно-кишечный тракт, обычно при употреблении сырого молока. Локализованная кишечная инфекция постепенно переходит в дыхательные пути и затем приобретает классические симптомы туберкулеза. Другим важным патогенным переносчиком рода Mycobacterium является M. leprae, которая вызывает миллионы случаев древнего заболевания лепры. Другие виды этого рода, которые вызывают заболевание у животных и человека, включают M. kansasii, M. avium intracellulare, M. fortuitum, M. marinum, M. chelonei и M. scrofulaceum. Патогенные виды микобактерий зачастую обладают высокой степенью гомологии последовательностей соответствующих ДНК и соответствующих белков, а некоторые виды, такие как M. tuberculosis и M. bovis, являются очень сходными.
По очевидным практическим и моральным соображениям начальные исследования на людях для определения эффективности экспериментальных композиций в отношении таких поражений недопустимы. Соответственно, на ранних стадиях разработки любого лекарственного препарата или иммуногенной композиции стандартной процедурой является использование соответствующей модели животного, с учетом аспектов безопасности и затрат. Успех внедрения в лабораторную практику моделей животных основан на понимании того, что иммуногенные эпитопы зачастую активны в организмах различных видов. Таким образом, иммуногенная детерминанта одного вида, например грызуна или морской свинки, будет, по существу, иммунореактивной у других видов, например у человека. Только после соответствующего изучения на моделях животных проводятся клинические испытания на людях для дальнейшей проверки безопасности и эффективности иммуногенной композиции для человека.
В отношении альвеолярной или легочной формы инфекций, вызываемых M. tuberculosis, модель на морской свинке во многих отношениях наиболее сходна с патологией данного заболевания у человека. Соответственно, специалистам в данной области будет понятно, что модель данного заболевания на морской свинке подходит для экстраполяции на человека и других млекопитающих. Как и человек, морские свинки восприимчивы к туберкулезной инфекции при низких дозах распыленного патогена M. tuberculosis человека. В отличие от человека, у которого первичная инфекция обычно находится под контролем, у морских свинок при воздействии аэролизованного патогена всегда развивается диссеминированное заболевание, что облегчает последующий анализ. Кроме того, как у морских свинок, так и у человек проявляются кожные реакции гиперчувствительности замедленного типа, характеризующиеся развитием плотного мононуклеарного уплотнения, или ригидной области на месте кожного теста. И наконец, характерные туберкулезные поражения человека и морских свинок имеют близкую морфологию, включая наличие гигантских клеток Лангханса. Поскольку морские свинки более восприимчивы к первичной инфекции и у них быстрее развивается заболевание, чем у человек, любая защита, создаваемая в экспериментах с использованием этой животной модели, является убедительным показателем, что такой же защитный иммунитет может возникать у человека или другого менее восприимчивого млекопитающего. Соответственно, исключительно с целью объяснения, а не для ограничения, настоящее изобретение в основном будет продемонстрировано на примерах с морскими свинками в качестве организма-хозяина млекопитающего. Для специалистов в данной области очевидно, что настоящее изобретение может быть осуществлено и на других организмах-хозяевах млекопитающих, включая человека и домашних животных.
Попытки борьбы с туберкулезом, используя иммуногенные композиции, начались с 1921 года после того, как Кальметт и Герен успешно получили аттенюированный вирулентный штамм M. bovis в Институте Пастера в Лилле, Франция (Institut Pasteur in Lille, France). Аттенюированный M. bovis стал известен как бацилла Кальметта-Герена или сокращенно БЦЖ. Почти восемдесят лет после этого иммуногенные композиции, полученные из БЦЖ, остаются единственным профилактическим средством для борьбы с туберкулезом в настоящее время. Фактически, иммуногенные композиции на основе БЦЖ, доступные сегодня, получают из исходного штамма M. bovis, разработанного Кальметтом и Героном в институте Пастера.
Всемирная Организация Здравоохранения рассматривает иммуногенные композиции на основе БЦЖ как незаменимый фактор снижения заболеваемости туберкулезом в мире, особенно в развивающихся странах. Теоретически, иммуногенная композиция на основе БЦЖ вызывает клеточный иммунитет против аттенюированной бактерии, которая иммунологически близка к M. tuberculosis. Полученный иммунный ответ должен ингибировать развитие первичного туберкулеза. Таким образом, если первичный туберкулез ингибируется, то не могут возникать латентные инфекции и предотвращается реактивация заболевания.
Используемые в настоящее время иммуногенные композиции на основе БЦЖ доступны в виде лиофилизированных культур, которые восстанавливают стерильным разбавителем непосредственно перед введением. В странах, где используется вакцинация БЦЖ, включая развивающиеся и развитые страны, иммуногенную композицию на основе БЦЖ вводят при рождении, на первом году жизни и в раннем детстве. Взрослые люди, посещающие эпидемически неблагополучные районы, где они могут подвергаться воздействию высоких доз микобактерий, в качестве профилактики могут быть вакцинированы БЦЖ, при условии отсутствия реакции на кожный тест. Побочные реакции на иммуногенную композицию редки, и в основном они ограничиваются кожными раздражителями и лимфаденитом вблизи места инъекции. Однако, в отличие от редких побочных реакций на иммунологическую композицию, иммуногенные композиции на основе БЦЖ характеризуются беспрецендентной безопасностью на примере трех миллиардов доз, введенных во всем мире, начиная с 1930 года.
Однако к такой беспрецендентной безопасности традиционных иммуногенных композиций на основе БЦЖ относятся с возрастающей критикой, и она является парадоксом для практической медицины. Оказалось, что той категорией населения, которая наиболее восприимчива к микобактериальной инфекции, являются больные с иммуносупрессией. Лица с ранней или поздней стадией ВИЧ-инфекции особенно восприимчивы к туберкулезной инфекции. К сожалению, большое число людей на ранней стадии ВИЧ-инфекции не знают о своем иммунном статусе. Вполне вероятно, что такие больные могут быть добровольно иммунизированы живой аттенюированной иммуногенной композицией, такой как БЦЖ, без предупреждения о существующем для них риске. Кроме того, другие индивидуумы с незначительной иммуносупрессией также могут быть по незнанию иммунизированы БЦЖ в надежде избежать микобактериального заболевания. В связи с этим желательны более безопасные, более эффективные БЦЖ или БЦЖ-подобные иммуногенные композиции.
В последнее время уделяется большое внимание применению трансформированных штаммов БЦЖ для получения иммуногенных композиций, которые экспрессируют различные клеточные антигены. Например, C.K. Stover et. al. сообщали о получении иммуногенной композиции против болезни Лайма с использованием рекомбинантной БЦЖ (рБЦЖ), которая экспрессирует мембранный липопротеин OspA Borrellia burgdorferi. Аналогично, теми же авторами была получена иммуногенная композиция на основе рБЦЖ, которая экспрессирует пневмококковый поверхностный белок (PsPA) Streptococcus pneumoniae (Stover, C.K., G.P. Bansal, S. Langerman, and M.S. Hanson. 1994. Protective Immunity Elicited by rBCG Immunogenic compositions. In: Brown F. (ed.): Recombinant Vectors in Immunogenic composition Development. Dev Biol Stand. Dasel, Karger, Vol. 82, 163-170).
В патенте США (USPN) 5504005 ("патент '005") и в патенте США USPN 5854055 ("патент '055"), опубликованных B.R. Bloom et al., описываются теоретические векторы рБЦЖ, экспрессирующие широкий спектр клеточных белков слияния различных видов микроорганизмов. Теоретические векторы, описанные в этих патентах, относятся или к клеточным белкам слияния, в противоположность внеклеточным неслитым белковым антигенам, и/или рБЦЖ является предположительно вектором, экспрессирующим белки слияния отдаленных видов. Более того, экспрессируемые в данных моделях белки слияния рекомбинантных клеток кодируются ДНК, которая интегрирована в геном хозяина под контролем промоторов белков теплового шока. Следовательно, экспрессированные антигены являются белками слияния и экспрессия ограничивается уровнями, примерно равными или меньшими, чем векторы нативных белков.
Кроме того, ни в патенте '005, ни в патенте '055 не описывается тестирование безопасности на моделях животных, возникновение иммунного ответа или защитного иммунитета в такой системе животного, которая полностью имитирует заболевание человека. Кроме того, только теоретические векторы рБЦЖ, экспрессирующие белки слияния M. tuberculosis, в патентах '005 и '055 описаны, но не дано описание фактических иммуногенных композиций. Описанные в этих патентах модели иммуногенных композиций в отношении M. tuberculosis относятся к клеткам со слитыми белками теплового шока, а не к внеклеточным неслитым белкам.
В патенте США номер 5830475 ("патент '475") также теоретически описываются микобактериальные иммуногенные композиции, используемые для экспрессии белков слияния. ДНК, кодирующая указанные белки слияния, находится во внехромосомных плазмидах под контролем микобактериальных промоторов белков теплового шока и промоторов стрессовых белков. Описанные иммуногенные композиции предназначены для вызывания иммунных ответов у животных, отличных от человека, для продукции антител и не указывается на то, что они препятствуют развитию заболеваний, вызванных внутриклеточными патогенами, у млекопитающих. Кроме того, в патенте '475 не описаны рекомбинантные иммуногенные композиции, в которых используются белок-специфичные промоторы для экспрессии внеклеточных неслитых белков.
В патенте США номер 6467967, опубликованном теми же изобретателями, заявляются иммуногенные композиции, содержащие рекомбинантную БЦЖ, с внехромосомной последовательностью нуклеиновой кислоты, содержащей ген, кодирующий крупный внеклеточный белок M. tuberculosis размером 30 кДа, где указанный крупный внеклеточный белок M. tuberculosis размером 30 кДа сверхэкспрессируется и секретируется. Кроме того, авторы настоящего изобретения подали частично продолженную заявку (заявка на патент США, серийный номер 10/261981, подана 30 сентября 2002 года), заявляющую дополнительную рекомбинантную БЦЖ, которая сверхэкспрессирует другие крупные внеклеточные белки M. tuberculosis.
Следовательно, до сих пор существует необходимость в рекомбинантных иммуногенных композициях против внутриклеточного патогена, которые экспрессируют крупные внеклеточные неслитые белки внутриклеточных патогенов и которые тесно связаны с иммуногенной композицией. Кроме того, существует необходимость в рекомбинантных иммуногенных композициях против внутриклеточного патогена, которые способны к сверхэкспрессии рекомбинантных внеклеточных неслитых белков благодаря внехромосомной ДНК, содержащей промоторы гена белков, отличных от белков теплового шока, или промоторы гена белков, отличных от стрессовых белков.
Конкретно, все еще есть острая необходимость в создании иммуногенных композиций против внутриклеточного патогена, которые обеспечивают реципиентам защиту от заболеваний и которые дают бóльшую защиту, чем защита у реципиентов при использовании иммуногенной композиции на основе БЦЖ. Кроме того, как в развитых, так и неразвитых странах существует острая необходимость в недорогом иммунотерапевтическом и профилактическом способе лечения туберкулеза и других заболеваний, вызываемых внутриклеточными патогенами.
Кроме того, существует необходимость в иммуногенных композициях против внутриклеточного патогена, которые могли бы безопасно вводиться индивидуумам с иммуносупрессией или с частичной иммуносупрессией.
Следовательно, целью настоящего изобретения является разработка иммуногенных композиций для диагностики, лечения, профилактики, ингибирования или ослабления заболевания, вызванного внутриклеточными патогенами.
Другой целью настоящего изобретения является разработка иммуногенных композиций для диагностики, лечения, профилактики, ингибирования или ослабления заболевания, вызванного внутриклеточными патогенами, используя внутриклеточные патогены, которые трансформированы для экспрессии крупных рекомбинантных иммуногенных антигенов того же внутриклеточного патогена, другого внутриклеточного патогена или их обоих.
Еще одной целью настоящего изобретения является разработка иммуногенных композиций для диагностики, лечения, профилактики, ингибирования или ослабления микобактериальных заболеваний, используя рекомбинантные БЦЖ, которые экспрессируют внеклеточный(ые) белок(и) патогенной микобактерии.
Еще одной целью настоящего изобретения является разработка иммуногенных композиций для диагностики, лечения, профилактики, ингибирования или ослабления туберкулеза, используя рекомбинантные штаммы БЦЖ, которые экспрессируют и секретируют один или более крупных внеклеточных белков Mycobacterium tuberculosis.
Еще одной целью настоящего изобретения является разработка указанных выше иммуногенных композиций в такой форме, которая может безопасно вводиться индивидуумам с иммуносупрессией или с частичной иммуносупрессией.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение достигает указанных выше и других целей за счет нового класса иммуногенных композиций и иммунотерапевтических средств, а также методов диагностики, лечения, профилактики, ингибирования или ослабления заболеваний, вызываемых внутриклеточными патогенами, у млекопитающих. Исторически иммуногенные композиции и иммунотерапевтические средства против внутриклеточного патогена получали из самого внутриклеточного патогена или близкородственных ему видов. Эти старые модели иммуногенных композиций полностью состояли из микроорганизма или его субъединиц. Например, первая и в настоящее время единственная доступная иммуногенная композиция для Mycobacterium tuberculosis представляет собой аттенюированную живую иммуногенную композицию, полученную из близкородственного внутриклеточного патогена M. bovis. Недавно авторами настоящего изобретения было обнаружено, что специфические внеклеточные продукты внутриклеточных патогенов, которые секретируются в среду для роста, могут использоваться как в виде индивидуальных субъединиц, так и в виде сочетаний субъединиц, для стимулирования сильных иммунных ответов у млекопитающих. Однако отсутствовали доказательства того, что указанные субъединичные иммуногенные композиции превосходят по своим свойствам исходную аттенюированную иммуногенную композицию, полученную из M. bovis.
В настоящем изобретении подробно описываются иммуногенные композиции и иммунотерапевтические средства, состоящие из рекомбинантных аттенюированных внутриклеточных патогенов, которые трансформированы и экспрессируют внеклеточный(ые) белок(и) (рекомбинантных иммуногенных антигенов) другого или того же самого внутриклеточного патогена. В одном из вариантов иммуногенные композиции по настоящему изобретению получают с использованием рекомбинантных штаммов бациллы Кальметта-Герена или БЦЖ. В этом варианте рекомбинантная БЦЖ экспрессирует крупные внеклеточные белки патогенных микобактерий, включая, но не ограничиваясь ими, M. tuberculosis, M. leprae и M. bovis, если назвать лишь некоторые из них.
Крупные внеклеточные белки, экспрессируемые рекомбинантной БЦЖ, включают, но не ограничиваются ими, белки размером 12 кДа, 14 кДа, 16 кДа, 23 кДа, 23,5 кДа, 30 кДа, 32А кДа, 32В кДа, 45 кДа, 58 кДа, 71 кДа, 80 кДа и 110 кДа Mycobacterium sp. и соответствующие аналоги, гомологи и их субъединицы, включая рекомбинантные неслитые белки, белки слияния и их производные. Специалистам в данной области очевидно, что величина молекулярной массы, используемая для идентификации крупных внеклеточных белков микобактерий и других внутриклеточных патогенов, является лишь приблизительной. Специалистам в области рекомбинантной технологии и молекулярной биологии понятно, что возможно осуществлять одновременную экспрессию (совместную трансляцию) указанных белков с дополнительными аминокислотами, полипептидами и белками, также возможно экспрессировать эти белки в укороченных формах. Полученные модифицированные белки, рассматриваемые в контексте настоящего изобретения, включают нативные белки, неслитые белки, белки слияния, гибридные белки или химерные белки. Для целей настоящего изобретения белки слияния определяются как включающие, но не ограничиваясь этим, продукты двух или более кодирующих последовательностей из разных генов, которые могут быть клонированы вместе и которые после трансляции образуют одну полипептидную последовательность.
В настоящем изобретении также описываются рекомбинантные аттенюированные иммуногенные композиции на основе внутриклеточного патогена, которые сверхэкспресситуют неслитые белки по меньшей мере из одного другого внутриклеточного патогена. Указанная цель достигается использованием внехромосомных нуклеиновых кислот для экспрессии по меньшей мере одного рекомбинантного гена иммуногенного антигена и при введении указанного(ых) гена(ов) под контроль промоторов гена белка, не относящегося к белкам теплового шока, или промоторов гена белка, не относящегося к стрессовым белкам, предпочтительно под контроль промоторных последовательностей специфичного белка. Следовательно, получают иммуногенные композиции, включающие неслитые рекомбинантные иммуногенные антигены, экспрессированные в бóльших количествах, чем это возможно в том случае, когда гены, кодирующие рекомбинантные иммуногенные композиции, стабильно интегрированы в геномную ДНК иммуногенной композиции. В результате получают иммуногенные композиции на основе внутриклеточного патогена, которые неожиданно обладают повышенной специфичностью и эффективностью, чем существующие субъединичные или аттенюированные иммуногенные композиции на основе внутриклеточного патогена.
Кроме того, в настоящем изобретении описываются способы лечения и профилактики заболеваний у млекопитающих, вызываемых внутриклеточными патогенами, в которых используют иммуногенные композиции по настоящему изобретению. Частичный перечень большого числа внутриклеточных патогенов, которые могут использоваться в качестве аттенюированного организма и/или источника рекомбинантных иммуногенных антигенов, включает, но им не ограничивается, Mycobacterium bovis, M. tuberculosis, M. leprae, M. kansasii, M. avium, Mycobacterium sp., Legionella pneumophila, L. longbeachae, L. bozemanii, Legionella sp., Rickettsia rickettsii, Rickettsia typhi, Rickettsia sp., Ehrlichia chaffeensis, Ehrlichia phagocytophila geno group, Ehrlichia sp., Coxiella burnetii, Leishmania sp., Toxoplasma gondii, Trypanosoma cruzi, Chlamydia pneumoniae, Chlamydia sp., Listeria monocytogenes, Listeria sp. и Histoplasma sp.
Понятно, что иммуногенные композиции по настоящему изобретению могут вводиться любым способом, при котором возникает иммунный ответ и который включает, но ими не ограничивается, внутрикожный, подкожный, внутримышечный, интраназальный, внутрибрюшинный, пероральный путь или ингаляцию. По прошествии соответствующего периода после прививки млекопитающих стимулируют воздействием инфицирующего аэрозоля, содержащего M. tuberculosis. У млекопитающих, получавших иммуногенную композицию по настоящему изобретению, абсолютно не обнаруживали заболевания по сравнению с млекопитающими, получавшими только одну БЦЖ, только один крупный внеклеточный белок или любое их сочетание.
В одном из вариантов осуществления настоящего изобретения иммуногенная композиция, содержащая рекомбинантную БЦЖ с последовательностью внехромосомной нуклеиновой кислоты и ген, кодирующий по меньшей мере один внеклеточный белок микобактерии, где указанный крупный внеклеточный белок микобактерий сверхэкспрессируется и секретируется, индуцируя иммунный ответ у животного.
В другом варианте осуществления настоящего изобретения иммуногенная композиция содержит рекомбинантную БЦЖ с последовательностью внехромосомной нуклеиновой кислоты, которая содержит ген, кодирующий крупный внеклеточный неслитый белок Mycobacterium tuberculosis с массой 23,5 кДа, под контролем промотора, где указанный промотор не является промотором белка теплового шока или промотором стрессового белка и где крупный внеклеточный неслитый белок с массой 23,5 кДа сверхэкспрессируется и секретируется, индуцируя иммунный ответ у животного.
В еще одном из вариантов осуществления настоящего изобретения иммуногенная композиция содержит рекомбинантную БЦЖ с последовательностью внехромосомной нуклеиновой кислоты, которая содержит ген, кодирующий крупный внеклеточный неслитый белок Mycobacteriumtuberculosis 32А кДа под контролем промотора, где указанный промотор не является промотором белка теплового шока или промотором стрессового белка и где крупный внеклеточный неслитый белок 32А кДа сверхэкспрессируется и секретируется, индуцируя иммунный ответ у животного.
В другом варианте осуществления настоящего изобретения иммуногенная композиция содержит рекомбинантную БЦЖ с последовательностью внехромосомной нуклеиновой кислоты, которая содержит генетическую конструкцию с, по меньшей мере, одним геном, кодирующим крупный внеклеточный Mycobacterium tuberculosis (Mtb) размером 30 кДа и крупный внеклеточный неслитый белок Mtb размером 23,5 кДа, где крупный внеклеточный белок Mtb 30 кДа и крупный внеклеточный неслитый белок размером 23,5 кДа сверхэкспрессируются и секретируются, индуцируя иммунный ответ у животного.
В другом иллюстративном варианте осуществления настоящего изобретения иммуногенная композиция включает в себя рекомбинантную БЦЖ с последовательностью внехромосомной нуклеиновой кислоты, которая содержит ген, кодирующий крупный внеклеточный неслитый белок Mycobacterium bovis размером 30 кДа под контролем промотора, где указанный промотор не является промотором белка теплового шока или промотором стрессового белка и где крупный внеклеточный неслитый белок Mycobacterium bovis размером 32 кДа сверхэкспрессируется и секретируется из указанной рекомбинантной БЦЖ, индуцируя гуморальный и клеточный иммунный ответ у животного.
Еще в одном из вариантов осуществления настоящего изобретения иммуногенная композиция включает в себя рекомбинантную БЦЖ с последовательностью внехромосомной нуклеиновой кислоты, которая содержит ген, кодирующий крупный внеклеточный неслитый белок Mycobacterium leprae размером 30 кДа под контролем промотора, где указанный промотор не является промотором белка теплового шока или промотором стрессового белка и где крупный внеклеточный неслитый белок Mycobacterium leprae размером 30 кДа сверхэкспрессируется и секретируется из рекомбинантной БЦЖ, индуцируя гуморальный и клеточный иммунный ответ у животного.
Другие варианты осуществления настоящего изобретения включают в себя иммуногенные композиции, где аттенюированный внутриклеточный патоген (например, рекомбинантная БЦЖ) представляет собой ауксотрофный организм с регулируемым ростом. В контексте настоящего описания термин "регулируемый рост" относится к ауксотрофному организму, который растет при наличии определенного питательного вещества. Такое определенное питательное вещество либо вводят совместно с иммуногенной композицией, либо вводят после введения иммуногенной композиции реципиенту.
В одном из вариантов ауксотрофный организм с регулируемым ростом представляет собой рекомбинантную БЦЖ, которая трансформирована и сверхэкспрессирует и секретирует по меньшей мере один крупный внеклеточный белок M. tuberculosis.
В другом варианте осуществления настоящего изобретения таким определенным питательным веществом, требуемым для регулирования роста ауксотрофного организма с регулируемым ростом, является аминокислота.
Другой вариант осуществления настоящего изобретения включает в себя аттенюированную рекомбинантную БЦЖ (штамм Tice), в которой альфа-субъединицу нитратредуктазы (ген narG) разрушают путем аллельного обмена. Затем эту высокоаттенюированную narG БЦЖ трансформируют, используя по меньшей мере одну гетерологичную нуклеиновую кислоту, кодирующую по меньшей мере один крупный внеклеточный белок Mtb. Полученный высокоаттенюированный narG-мутированный трансформант используют в качестве иммуногенной композиции у млекопитающих с иммуносупрессией.
Другие объекты, особенности и преимущества настоящего изобретения будут очевидны специалистам в данной области при рассмотрении приведенного ниже подробного описания предпочтительных иллюстративных вариантов осуществления изобретения в сочетании с чертежами, которые кратко описываются ниже.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 показаны гели, окрашенные красителем кумасси синим (Coomassie blue), помеченные как 1а и 1b, которые иллюстрируют секрецию рекомбинантного белка Mycobacterium tuberculosis размером 30 кДа трансформированными штаммами БЦЖ из культуральных фильтратов.
На фиг.2 графически показаны результаты двух экспериментов, помеченных как 2а и 2b, проведенных для сравнения результатов кожных тестов у морских свинок, которым прививали рекомбинантную иммуногенную композицию БЦЖ, экспрессирующую крупный внеклеточный белок M. tuberculosis размером 30 кДа, только БЦЖ, только рекомбинантный белок размером 30 кДа или ложную иммуногенную композицию.
На фиг.3 графически показано изменение массы тела морских свинок, помеченных как 3а и 3b, после стимуляции M. tuberculosis после иммунизации.
На фиг.4а графически показано количество колониеобразующих единиц (КОЕ) инфекционного M. tuberculosis, выделенных из легких морских свинок после стимуляции M. tuberculosis после иммунизации.
На фиг.4b графически показано количество колониеобразующих единиц (КОЕ) инфекционного M. tuberculosis, выделенных из селезенки морских свинок после стимуляции M. tuberculosis после иммунизации.
На фиг.5 графически показана реакция на кожную пробу у морских свинок в ответ на ложную иммунизацию иммуногенной композицией, на введение БЦЖ и БЦЖ в сочетании с рекомбинантным белком M. tuberculosis размером 30 кДа.
На фиг.6 графически показаны титры антител на очищенный рекомбинантный крупный внеклеточный белок M. tuberculosis 30 кДа (р30), крупный внеклеточный белок 32А кДа (р32A) и крупный внеклеточный белок размером 23,5 кДа (р23,5).
КРАТКОЕ ОПРЕДЕЛЕНИЕ ТЕРМИНОВ
Для облегчения понимания приведенного ниже подробного описания примеров и приведенной формулы изобретения может быть полезно дать некоторые определения. Указанные определения по своему характеру являются неограничивающими и приводятся лишь для удобства читателя.
Ауксотроф или ауксотрофный: В контексте настоящего описания термин "ауксотроф" относится к микроорганизму, имеющему спецефические потребности в питании, которые не требуются организму дикого типа. В отсутствие требуемого питательного вещества ауксотроф не растет, тогда как организм дикого типа растет.
Ген: Термин "ген" в контексте настоящего описания относится по меньшей мере к части генетической конструкции, содержащей промотор и/или другие регуляторные последовательности, необходимые для экспрессии или для модификации экспрессии генетической конструкции.
Генетическая конструкция: Термин "генетическая конструкция" в контексте настоящего описания обозначает последовательность нуклеиновой кислоты, кодирующей по меньшей мере один крупный внеклеточный белок по меньшей мере одного внеклеточного патогена. В одном из вариантов осуществления настоящего изобретения генетическая конструкция представляет собой внехромосомную ДНК.
Регулируемый рост: В контексте настоящего описания термин "регулируемый рост" относится к ауксотрофной форме иммуногенных композиций по настоящему изобретению. Рост регулируется введением питательного вещества, необходимого для роста ауксотрофа, в концентрации, достаточной для индукции роста.
Хозяин: В контексте настоящего описания термин "хозяин" относится к реципиенту иммуногенных композиций по настоящему изобретению. Примерами организмов-хозяев являются млекопитающие, включающие, но не ограничиваясь, приматов, грызунов, коров, лошадей, собак, кошек, овец, коз и свиней. В одном из вариантов осуществления настоящего изобретения указанным организмом-хозяином является человек.
Иммуноген: В контексте настоящего описания термин "иммуноген" обозначает любой субстрат, который вызывает иммунный ответ в организме хозяина. Иммуногены по настоящему изобретению включают, но ими не ограничиваясь, крупные внеклеточные белки и их рекомбинантные формы, полученные из внутриклеточных патогенов, таких как, не ограничиваясь ими, представители рода Mycobacterium.
Иммуногенная композиция: В контексте настоящего описания термин "иммуногенная композиция" включает рекомбинантный вектор, вместе или без адъюванта, такой как внутриклеточный патоген, который экспрессирует и/или секретирует иммуноген in vivo, где указанный иммуноген вызывает иммунную реакцию в организме-хозяине. Иммуногенные композиции по настоящему изобретению могут включать или могут не включать в себя ауксотрофный организм в виде трансформанта.
Последовательность нуклеиновой кислоты: В контексте настоящего описания термин "последовательность нуклеиновой кислоты" обозначает любую непрерывную последовательность нуклеиновых кислот.
Трансформант: В контексте настоящего описания термин "трансформант" относится к микроорганизму, который трансформирован по меньшей мере одной гетерологичной нуклеиновой кислотой, кодирующей полипептид, который экспрессируется и/или секретируется. В одном из вариантов осуществления настоящего изобретения указанный трансформант представляет собой БЦЖ.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится в основном к иммуногенным композициям, содержащим аттенюированные или невирулентные рекомбинантные внутриклеточные патогены, которые экспрессируют и/или секретируют рекомбинантные иммуногенные антигены того же или другого вида. В другом варианте осуществления настоящего изобретения аттенюированный внутриклеточный патоген представляет собой ауксотроф с регулируемым ростом. В еще одном варианте осуществления настоящего изобретения аттенюированный внутриклеточный патоген аттенюируют посредством аллельного обмена. Иллюстративные варианты осуществления настоящего изобретения основаны на аттенюированной или невирулентной рекомбинантной БЦЖ. Однако настоящее изобретение не ограничивается рекомбинантной БЦЖ.
Иммуногенные композиции вводят одним или несколькими путями, которые включают, но не ограничиваются ими, подкожный, внутримышечный, интраназальный, внутрибрюшинный, внутрикожный, пероральный путь введения или ингаляцию. Иммуногенные композиции по настоящему изобретению сохранятся внутри организма-хозяина, экспрессирующего и секретирующего иммуноген(ы) in situ. Если используется ауксотрофный штамм, то иммуногенная композиция остается по существу иммунологически инертной до поступления достаточного количества соответствующего питательного вещества в организм-хозяин. Как только поступает необходимый питательный компонент, ауксотрофная иммуногенная композиция начинает экспрессировать и секретировать иммуноген. Позже, если желательно, при удалении необходимого питательного компонента можно остановить рост ауксотрофа и экспрессию антигена in situ.
Если в иммуногенных композициях по настоящему изобретению используется ауксотрофный трансформант, экспрессирующий иммуноген, необходимый питательный компонент, требуемый для инициации роста ауксотрофа в организме-хозяине, может вводиться либо непосредственно до, либо одновременно, либо сразу после введения иммуногенной композиции. К области настоящего изобретения также относится вариант задержки введения необходимых питательных компонентов на несколько дней или даже недель после введения иммуногенной композиции. Кроме того, необходимый питательный компонент может удаляться из организма-хозяина в любой момент времени после введения иммуногенной композиции для остановки пролиферации ауксотрофного трансформанта.
Настоящее изобретение может использоваться для получения иммуногенных композиций против разнообразных внутриклеточных патогенов, включая, но ими не ограничиваясь, штаммы БЦЖ, сверхэкспрессирующие крупные внеклеточные неслитые белки M. tuberculosis, M. bovis или M. leprae. Иммуногенные композиции, полученные согласно подходам настоящего изобретения, используются для проявления иммунных ответов у организмов-хозяев. Индуцированные иммунные ответы могут быть гуморальными (антитела) или клеточными и могут использоваться для диагностики, профилактики или облегчения.
Каждая иммуногенная композиция по настоящему изобретению может экспрессировать по меньшей мере один иммуноген различной молекулярной массы данного внутриклеточного патогена. Например, авторами настоящего изобретения ранее были идентифицированы иммуногены M. tuberculosis, которые могут включть в себя, но ими не ограничиваясь, крупные внеклеточные белки размером 12 кДа, 14 кДа, 16 кДа, 23 кДа, 23,5 кДа, 30 кДа, 32А кДа, 32В кДа, 45 кДа, 58 кДа, 71 кДа, 80 кДа, 110 кДа и их соответствующие аналоги, гомологи, субъединицы и вырожденные варианты, включая рекомбинантные неслитые белки, белки слияния и их производные (смотрите находящиеся на рассмотрении патентные заявки США с серийными номерами 08/156358, 09/157689, 09/175598, 09/226539 и 09/322116, полное содержание которых включено в настоящее описание в качестве ссылки). Специалистам в данной области очевидно, что значения молекулярной массы, используемые для идентификации крупных внеклеточных белков микобактерий и других внутриклеточных патогенов, являются лишь приблизительными. Для специалистов в области рекомбинантной технологии и молекулярной биологии понятно, что можно одновременно экспрессировать (одновременно транслировать) эти белки с дополнительными аминокислотами, полипептидами и белками, а также возможно экспрессировать эти белки в усеченных формах. Полученные модифицированные белки также входят в область настоящего изобретения, независимо от того, как они обозначены: нативные, неслитые белки, белки слияния, гибридные белки или химерные белки. Для целей настоящего изобретения белки слияния определяются как включающие, но не ограничиваясь ими, продукты двух или нескольких кодирующих последовательностей разных генов, которые клонированы вместе и которые, после трансляции, образуют одну полипептидную последовательность.
Экспрессия антигена, включая внеклеточные белки, в основном увеличивается, когда гены, кодирующие рекомбинантные неслитые белки, расположены и находятся под контролем одной или нескольких плазмид (внехромосомной ДНК), а не интегрированы в геном организма-хозяина. Однако экспрессия белков, осуществляемая под контролем промоторных последовательностей конкретного белка, обеспечивает повышенный уровень экспрессии, улучшенную упаковку и процессинг неслитых белковых антигенов. В этой связи настоящее изобретение относится к рекомбинантным внеклеточным неслитым белкам, кодируемым внехромосомной ДНК, контролируемым генными промоторами, не относящимися к белкам теплового шока, или генными промоторами, не относящимся к стрессовым белкам, предпочтительно промоторными последовательностями специфичных белков.
Настоящее изобретение относится к рекомбинантным аттенюированным иммуногенным композициям на основе внутриклеточного патогена, таким как рБЦЖ, которые экспрессируют свои собственные эндогенные внеклеточные белки, а также рекомбинантные внеклеточные неслитые белки, близкородственных и/или других внутриклеточных патогенов. Однако за 80 лет исследований было показано, что эндогенные внеклеточные белки БЦЖ сами по себе не обеспечивают полной защиты у всех реципиентов. Более того, как далее будет пояснено более подробно, авторы настоящего изобретения также показали, что совместное введение внеклеточных белков M. tuberculosis и обычной вакцины БЦЖ не приводит к получению иммуногенных композиций, обладающих улучшенными показателями по сравнению с введением только одной БЦЖ.
В одном из вариантов осуществления настоящего изобретения иммуногенная композиция содержит рекомбинантную иммуногенную композицию БЦЖ, экспрессирующую только один иммуноген, например, но не ограничиваясь, крупные внеклеточные белки M. tuberculosis размером 23,5 кДа, 30 кДа или 32 кДа. В другом варианте осуществления настоящего изобретения рекомбинантная БЦЖ может экспрессировать два или более иммуногенов, например крупные внеклеточные белки M. tuberculosis размером 23,5 кДа и 30 кДа. Последний вариант может быть особенно эффективным в качестве иммуногенной композиции для профилактики заболеваний у млекопитающих. Авторы настоящего изобретения предложили неограничивающую теорию, согласно которой одновременная сверхэкспрессия крупных внеклеточных белков M. tuberculosis размером 23,5 кДа и 30 кДа рекомбинантной БЦЖ может оказывать синергический эффект, усиливая иммунный ответ млекопитающих против внутриклеточных патогенов по настоящему изобретению. Эта теория частично основана на том наблюдении, что БЦЖ дикого типа и рекомбинантная БЦЖ являются делеционными мутантами M. bovis, которая в природе не экспрессирует свой собственный крупный внеклеточный белок размером 23,5 кДа.
Однако иммуногенные композиции, в которых используется БЦЖ как трансформант, могут вызывать диссеминированное заболевание у пациентов с нарушениями иммунитета, такими как СПИД. В редких случаях диссеминированные заболевания могут быть летальными. Следовательно, в другом варианте настоящее изобретение относится к созданию рекомбинантных штаммов БЦЖ, используя БЦЖ Tice в качестве исходного штамма дикого типа, который, как ожидается, будет безопасным для индукции иммунного ответа в организме-хозяине с нарушениями иммунитета. Четыре указанных штамма являются ауксотрофами, и в этой связи они размножаются только в присутствии избыточных количеств аминокислоты, в отношении которой они ауксотрофаны. В одном из вариантов осуществления настоящего изобретения неограничивающие иллюстративные примеры включают БЦЖ, ауксотрофные по триптофану или глутамину. По этой причине их рост регулируется в организме-хозяине по описанной ниже схеме. Два дополнительных штамма БЦЖ, которые могут использоваться у млекопитающих с иммуносупрессией или с частичной иммуносупрессией, не являются ауксотрофами, и в этой связи их рост не регулируется. Указанные неауксотрофные штаммы БЦЖ являются мутантами, получаемыми на основе аллельного обмена, и предполагается, что они будут аттенюированными в организме-хозяине с нарушениями иммунитета.
Однако, как указывалось ранее, настоящее изобретение не ограничивается ауксотрофными штаммами трансформанта. Авторы настоящего изобретения предполагают, что ауксотрофы могут быть неприемлемы для использования во всех тех случаях, когда желательными являются иммуногенные композиции по настоящему изобретению. Например, в том случае, когда ауксотрофы используют для регулирования роста трансформантов in vivo, требуется своевременное и последовательное введение второй композиции для обеспечения индукции иммунного ответа в организме-хозяине. Такой подход требует особого внимания как со стороны того, кто осуществляет введение, так и со стороны реципиента и попечителя/родителя. Следовательно, если риск диссеминированного заболевания, связанного с иммуногенной композицией, минимален, то более желательно вводить неауксотрофный трансформант. Следовательно, ниже приведено описание, которое относится к различным вариантам осуществления настоящего изобретения, включая генетические конструкции, плазмиды и фармацевтические композиции, применимые в равной степени как к ауксотрофным, так и к неауксотрофным трансформантам.
Для специалистов в области микробиологии понятно, что приведенные ниже условия роста, состав сред, температурные условия, временные параметры культивирования и т.д. являются в основном одинаковыми для ауксотрофов и неауксотрофов, за исключением того, что для роста ауксотрофов требуется добавление необходимого питательного компонента. Кроме того, специалистам со знаниями иммунологии будет понятно, что процедура введения иммуногенных композиций в организм-хозяин будет одинаковой и для ауксотрофных, и для неауксотрофных композиций.
В одном из иллюстративных вариантах осуществления настоящего изобретения рекомбинантные иммуногенные композиции БЦЖ экспрессируют крупные внеклеточные белки M. tuberculosis, используя плазмиды pNBV1 и промотор перед участком, примыкающим к гену глутаминсинтетазы (glnA1). В другом иллюстративном варианте осуществления настоящего изобретения рекомбинантные иммуногенные композиции БЦЖ экспрессируют крупные внеклеточные белки M. tuberculosis, используя плазмиду pNBV1 и промотор, расположенный непосредственно перед участком, примыкающим к гену, кодирующему внеклеточный белок. В еще одном иллюстративном варианте осуществления настоящего изобретения рекомбинантные иммуногенные композиции БЦЖ экспрессируют крупный внеклеточный белок M. bovis размером 30 кДа, используя плазмиду pNBV1 и промотор, расположенный непосредственно перед участком, примыкающим к гену, кодирующему внеклеточный белок размером 30 кДа. В другом иллюстративном варианте осуществления настоящего изобретения рекомбинантные иммуногенные композиции БЦЖ экспрессируют крупный внеклеточный белок M. leprae размером 30 кДа, используя плазмиду pNBV1 и промотор, расположенный непосредственно перед участком, примыкающим к гену, кодирующему внеклеточный белок размером 30 кДа.
Для простоты, в связи с чрезвычайной сложностью предстоящего описания, но не ограничивая настоящее изобретение, будет более подробно описано использование рекомбинантной БЦЖ (рБЦЖ) как агента для вакцинации и внеклеточных неслитых белков M. tuberculosis, M. bovis и M. leprae, особенно крупных внеклеточных неслитых белков M. tuberculosis размером 23,5 кДа, 30 кДа и 32А кДа и крупных внеклеточных неслитых белков M. bovis и M. leprae размером 30 кДа, в качестве показательных вариантов осуществления настоящего изобретения. Кроме того, в качестве примера сверхэкспрессии и секреции множественного гетерологичного антигена будет описана одновременная экспрессия и секреция из рБЦЖ крупных внеклеточных неслитых белков M. tuberculosis размером 23,5 кДа и 30 кДа.
Следует понимать, что любой рекомбинантный иммуногенный антиген может экспрессироваться любым рекомбинантным аттенюированным внутриклеточным патогеном. Кроме того, иммуногенные композиции по настоящему изобретению не ограничиваются рБЦЖ в качестве иммуногенной композиции. Более того, иммуногены не ограничиваются крупными внеклеточными неслитыми белками M. tuberculosis, M. bovis и M. leprae.
Для того, чтобы определить эффекты иммуногенных композиций различных штаммов, использовали различные штаммы БЦЖ для получения разных вариантов по настоящему изобретению: БЦЖ Tice и БЦЖ Connaught. Штамм дикого типа M. bovis БЦЖ Tice приобретали от компании Organon и штамм дикого типа M. bovis БЦЖ Connaught получали от компании Connaught Laboratories, Toronto, Canada. Штаммы поддерживали в среде 7Н9, pH 6,7 (Difco) при температуре 37°С в атмосфере с 5% содержанием СО2 и 95% содержанием воздуха без встряхивания. Культуры обрабатывали ультразвуком один или два раза в неделю в течение 5 минут на ультразвуковой водяной бане для снижения образования сгустков бактерий.
ИММУНОГЕННЫЕ КОМПОЗИЦИИ, ПОДХОДЯЩИЕ ДЛЯ ИСПОЛЬЗОВАНИЯ В СЛУЧАЕ РЕЦИПИЕНТОВ С НАРУШЕННЫМ ИММУНИТЕТОМ
А. Рекомбинантная БЦЖ Tice (рБЦЖ30 Tice)
Рекомбинантную БЦЖ Tice (рБЦЖ30 Tice), экспрессирующую крупный внеклеточный неслитый белок M. tuberculosis размером 30 кДа, получают следующим образом. Плазмиду pMTB30, рекомбинантную конструкцию «челночной»-плазмиды pSMT3 на основе E. coli/микобактерий, получают по методике, описанной ранее авторами настоящего изобретения (Harth, G., B.-Y. Lee and Horwitz. 1997. High-level heterologous expression and secretion in rapidly growing nonpathogenic mycobacteria of four major Mycobacterium tuberculosis extracellular proteins considered to be leading immunogenic composition candidates and drug targets. Infect. Immun. 65:2321-2328, полное описание данной работы приведено в настоящей заявке в качестве ссылки).
B. Рекомбинантная БЦЖ30 Tice II (pNBV1-pglnA-MTB30)
Рекомбинантную БЦЖ30 Tice II (pNBV1-pglnA-MTB30), которая срерхэкспрессирует внеклеточный неслитый белок M. tuberculosis размером 30 кДа, получают следующим образом. Плазмиду pNBV1-pglnA-MTB30 конструируют амплификацией кодирующей области гена M. tuberculosis для белка размером 30 кДа (включая сайт рестрикции Ndel на старт-кодоне и сайт рестрикции HindIII непосредственно перед стоп-кодоном) и клонированием ПЦР-продукта после промотора glnA1 M. tuberculosis в сайтах Ndel→indIII в pNBV1-BFRB (Tullius, M., G. Harth, and M.A. Horwitz. 2001. The high extracellular levels of Mycobacterium tuberculosis glutamine synthetase and superoxide dismutase are primarily due to high expression and extracellular stability rather than to a protein specific export mechanism. Infect. Immun. 69: 6348-6363). После подтверждения методом рестрикционного анализа того, что была получена нужная плазмида, данную плазмиду подвергают электропорации в M. bovis БЦЖ Tice и отбирают трансформанты на 7Н11 агаре, содержащем 50 мкг/мл гигромицина. Несколько отдельных гигромицин-устойчивых клонов отбирают случайным образом и культивируют в среде 7Н9, содержащей 50 мкг/мл гигромицина. Экспрессию и выход рекомбинантного белка M. tuberculosis размером 30 кДа подтверждают электрофорезом в полиакриламидном геле и методом иммуноблоттинга с поливалентным высокоспецифичным иммуноглобулином кролика против белка размером 30 кДа. Было показано, что рБЦЖ30 Tice II продуцирует в 24 раза больше антигена размером 30 кДа на мл культуры, чем БЦЖ Tice, содержащая только вектор (pNBV1).
С. Рекомбинантная БЦЖ23,5 Tice I (pNBV1-pglnA-MTB23,5)
Рекомбинантную БЦЖ23,5 Tice I (pNBV1-pglnA-MTB23,5), которая срерхэкспрессирует внеклеточный неслитый белок M. tuberculosis размером 23,5 кДа, получают следующим образом. Плазмиду pNBV1-pglnA-MTB23,5 конструируют амплификацией кодирующей области гена M. tuberculosis размером 23,5 кДа (включая сайт рестрикции Ndel на старт-кодоне и сайты рестрикции BamHI и HindIII непосредственно после стоп-кодона) и клонированием данного ПЦР-продукта после промотора glnA1 M. tuberculosis в сайтах Ndel→indIII в pNBV1-BFRB (Tullius, M., G. Harth, and M.A. Horwitz. 2001. The high extracellular levels of Mycobacterium tuberculosis glutamine synthetase and superoxide dismutase are primarily due to high expression and extracellular stability rather than to a protein specific export mechanism. Infect. Immun. 69: 6348-6363). После подтверждения методом рестрикционного анализа того, что была получена нужная плазмида, плазмиду подвергают электропорации в M. bovis БЦЖ Tice и трансформанты отбирают на 7Н11 агаре, содержащем 50 мкг/мл гигромицина. Случайным образом отбирают несколько отдельных гигромицин-устойчивых клонов и культивируют в среде 7Н9, содержащей 50 мкг/мл гигромицина. Экспрессию и выход рекомбинантного белка M. tuberculosis размером 23,5 кДа подтверждают электрофорезом в полиакриламидном геле и методом иммуноблоттинга с поливалентным высокоспецифичным иммуноглобулином кролика против белка размером 23,5 кДа. рБЦЖ23,5 Tice I продуцирует белок размером 23,5 кДа на высоком уровне, что эквивалентно или несколько превышает количество рекомбинантного белка размером 30 кДа, продуцируемого рБЦЖ30 Tice II. Поскольку БЦЖ не содержит гена, кодирующего белок размером 23,5 кДа, невозможно провести сравнение с исходным штаммом, как это было сделано в случае белка размером 30 кДа. (БЦЖ Tice не экспрессирует белок размером 23,5 кДа из-за геномной делеции RD2 размером ˜11,5 т.н., которая содержит соответствующие гены M. tuberculosis Rv1978-Rv1988 [ген белка размером 23,5 кДа = Rv 1980]; делеция возникла при создании штаммов БЦЖ из дикого типа M. bovis до 1931 года.)
D. Рекомбинантная БЦЖ30/23,5 Tice I (pNBV1-pglnA-MTB30/23,5)
Рекомбинантную БЦЖ30/23,5 Tice I (pNBV1-pglnA-MTB30/23,5), которая срерхэкспрессирует внеклеточный неслитый белок M. tuberculosis размером 30 кДа и 23,5 кДа, получают следующим образом. Плазмиду pNBV1-pglnA1-MTB30/23,5 конструируют клонированием BamHI фрагмента размером 1 т.н. из pNBV1-pglnA1-MTB/23,5 (которая содержит промотор glnA1 M. tuberculosis и всю кодирующую область белка размером 23,5 кДа) в уникальный сайт BamHII в pNBV1-pglnA1-MTB30. Гены, кодирующие два белка, ориентированы в одном направлении на плазмиде с геном, кодирующим белок размером 23,5 кДа, перед геном, кодирующим белок размером 30 кДа. После подтверждения методом рестрикционного анализа, что была получена нужная плазмида, данную плазмиду подвергают электропорации в M. bovis БЦЖ Tice и трансформанты отбирают на агаре 7Н11, содержащем 50 мкг/мл гигромицина. Случайным образом отбирают несколько отдельных гигромицин-устойчивых клонов и культивируют в среде 7Н9, содержащей 50 мкг/мл гигромицина. Экспрессию и выход рекомбинантных белков M. tuberculosis размером 30 кДа и 23,5 кДа подтверждают электрофорезом в полиакриламидном геле и методом иммуноблоттинга с поливалентным высокоспецифичным иммуноглобулином кролика против белка размером 30 кДа и против белка размером 23,5 кДа. Было показано, что рБЦЖ30/23,5 Tice I продуцирует в 24 раза больше антигена размером 30 кДа в расчете на мл культуры, чем БЦЖ Tice, содержащая только вектор (pNBV1). Данный штамм также в больших количествах продуцирует белок размером 23,5 кДа, который несколько превышает количество рекомбинантного белка 30 кДа. Поскольку БЦЖ не содержит гена, кодирующего белок размером 23,5 кДа, нельзя провести сравнение с исходным штаммом, как это было сделано в случае белка размером 30 кДа.
Е. Рекомбинантная БЦЖ30 Tice III (pNBV-1-MTB30)
Рекомбинантную БЦЖ30 Tice III (pNBV-1-MTB30), которая срерхэкспрессирует крупный внеклеточный белок M. tuberculosis размером 30 кДа, получают следующим образом. Данный рекомбинантный штамм получают электропорацией рекомбинантной плазмиды pNBV1, состоящей из векторного скелета и участка размером ˜1,5 т.н. из ДНК M. tuberculosis Erdman, фланкированного сайтами рестрикции Clal и BamHI и содержащего кодирующий участок крупного внеклеточного белка размером 30 кДа и промоторный участок, непосредственно перед кодирующим участком в БЦЖ Tice (образец № 2). Данный штамм стабильно поддерживает рекомбинантную плазмиду, и уровень экспрессии рекомбинантного белка размером 30 кДа остается практически постоянным в течение 12 месяцев в отсутствие антибиотиков, что подтверждается результатами иммуноблоттинга с антисывороткой, специфичной к белку размером 30 кДа (14,4-кратное превышение над фоновым уровнем в БЦЖ Tice дикого типа в начале анализа и 11,5-кратное превышение в конце анализа). Вариант для хранения (образец № 1) устанавливают в 10% глицерине при концентрации 2,5×108 частиц/мл и хранят при температуре -80°С.
F. Рекомбинантная БЦЖ23,5 Tice II (pNBV-1-MTB23,5)
Рекомбинантную БЦЖ23,5 Tice II (pNBV-1-MTB23,5), которая срерхэкспрессирует крупный внеклеточный белок из M. tuberculosis размером 30 кДа, получают следующим образом. Данный рекомбинантный штамм получают электропорацией рекомбинантной плазмиды pNBV1, состоящей из векторного скелета и участка размером примерно 1,4 т.н. из ДНК M. tuberculosis Erdman, фланкированного сайтами рестрикции Pstl и BamHI и содержащего кодирующий участок крупного внеклеточного белка размером 23,5 кДа и промоторный участок непосредственно перед кодирующим участком, в бактерии БЦЖ Tice (образец № 2). Данный штамм стабильно поддерживает рекомбинантную плазмиду, и уровень экспрессии рекомбинантного белка размером 23,5 кДа остается практически постоянным в течение 12 месяцев в отсутствие антибиотиков, что подтверждается результатами иммуноблоттинга с использованием специфичной антисыворотки против белка размером 23,5 кДа (16,2 мг/л в начале анализа и 15,1 мг/л в конце анализа). Поскольку БЦЖ не содержит ген, кодирующий белок размером 23,5 кДа, нет возможности провести сравнение с исходным штаммом, как было сделано в случае белка размером 30 кДа. Вариант для хранения (образец № 1) был установлен 24.08.2001 в 10% глицерине концентрации 3×108 частиц/мл и хранится при температуре -80°С.
G. Рекомбинантная БЦЖ30/23,5 Tice IIA (pNBV1-MTB30/23,5↑↑)
Рекомбинантная БЦЖ30/23,5 Tice IIA (pNBV1-MTB30/23,5↑↑) (в настоящем описании после символа "↑↑" идет указание генетической конструкции, кодирующей множественные крупные внеклеточные белки, причем последовательности нуклеиновых кислот, кодирующих каждый белок [гены], ориентированы в одном и том же направлении относительно 5'-конца генетической конструкции) срерхэкспрессирует крупные внеклеточные белки из M. tuberculosis размером 30 кДа и размером 23,5 кДа. Гены, кодирующие оба белка, ориентированы в одном и том же направлении. Рекомбинантный штамм получают электропорацией рекомбинантной плазмиды pNBV1, состоящей из векторного скелета и двух участков ДНК M. tuberculosis Erdman размерами ˜1,5 и 1,4 т.н., фланкированных сайтами рестрикции Clal и Ndel (ген и промотор для белка размером 30 кДа) и Ndel и Ndel-BamHI (ген и промотор для белка размером 23,5 кДа), и содержащей кодирующие и промоторные участки непосредственно перед каждым из двух кодирующих участков крупных внеклеточных белков размером 30 и 23,5 кДа, в бактерии БЦЖ Tice (образец № 2). Данный штамм стабильно поддерживает рекомбинантную плазмиду, и уровень экспрессии рекомбинантных белков размером 30 кДа и 23,5 кДа остается практически постоянным в течение 12 месяцев в отсутствие антибиотиков, что подтверждается результатами иммуноблоттинга с использованием антисыворотки, специфичной для белка размером 30 кДа и 23,5 кДа (в случае белка размером 30 кДа экспрессия в 23,3 раза превышает фоновый уровень, характерный для БЦЖ Tice дикого типа в начале анализа, и в 16,5 раз превышает фоновый уровень в БЦЖ Tice дикого типа в конце анализа; для белка размером 23,5 кДа экспрессия составляет 18,7 мг/л в начале анализа и 12,2 мг/л в конце анализа). Как указывалось выше, экспрессию рекомбинантного белка размером 23,5 кДа измеряют в абсолютных величинах, поскольку БЦЖ Tice не экспрессирует белок размером 23,5 кДа. Вариант для хранения (образец № 1) устанавливают в 10% глицерине в концентрации 3×108 частиц/мл и хранят при температуре -80°С.
H. Рекомбинантная БЦЖ30/23,5 Tice IIB (pNBV1-MTB30/23,5↑↓)
Рекомбинантная БЦЖ30/23,5 Tice IIB (pNBV-1-MTB30/23,5↑↓) (в настоящем описании после символа "↑↓" идет указание генетической конструкции, кодирующей множественные крупные внеклеточные белки, причем последовательности нуклеиновых кислот, кодирующих каждый белок [гены], ориентированы в противоположном направлении относительно 5'-конца генетической конструкции) срерхэкспрессирует оба крупных внеклеточных белка и белок из M. tuberculosis размером 30 кДа и 23,5 кДа. Гены, кодирующие оба белка, ориентированы в противоположных направлениях на плазмиде. Рекомбинантный штамм получают электропорацией рекомбинантной плазмиды pNBV1, состоящей из векторного скелета и двух участков ДНК M. tuberculosis Erdman размерами ˜1,5 и 1,4 т.н., фланкированных сайтами рестрикции Clal и Ndel (ген и промотор для белка размером 30 кДа) и Ndel и Ndel-BamHI (ген и промотор для белка размером 23,5 кДа), и содержащей кодирующий и промоторный участки непосредственно перед кодирующими участками крупных внеклеточных белков размером 30 и 23,5 кДа, в бактерии БЦЖ Tice (образец № 2). В отличие от описанного выше штамма (рБЦЖ30/23,5 Tice IIA), ориентация рестрикционного фрагмента Ndel, содержащего кодирующий и промоторный участок белка размером 23,5 кДа, является инвертированной. Штамм стабильно поддерживает рекомбинантную плазмиду, и уровень экспрессии рекомбинантного белка размером 30 и 23,5 кДа остается практически постоянным в течение 12 месяцев в отсутствие антибиотиков, что подтверждается результатами иммуноблоттинга с использованием антисыворотки, специфичной для белка размером 30 кДа и 23,5 кДа. (Для белка размером 30 кДа экспрессия в 25,7 раз превышает фоновый уровень, характерный для БЦЖ Tice дикого типа в начале анализа, и в 21,1 раз превышает фоновый уровень в БЦЖ Tice дикого типа в конце анализа; для белка размером 23,5 кДа экспрессия составляет 16,6 мг/л в начале анализа и 12,8 мг/л в конце анализа.) Как указывалось выше, экспрессию рекомбинантного белка размером 23,5 кДа измеряют в абсолютных величинах, поскольку БЦЖ Tice не экспрессирует белок размером 23,5 кДа. Вариант для хранения (образец № 1) устанавливают в 10% глицерине в концентрации 3×108 частиц/мл и хранят при температуре -80°С.
I. Рекомбинантная БЦЖ32A Tice I (pNBV1-MTB32A)
Рекомбинантную БЦЖ32A Tice I (pNBV1-MTB32A), которая срерхэкспрессирует крупный внеклеточный белок M. tuberculosis размером 32А кДа (также известный как антиген 85А), получают следующим образом. Данный рекомбинантный штамм получают электропорацией рекомбинантной плазмиды pNBV1, состоящей из векторного скелета и участка ДНК M. tuberculosis размером ˜1,5 т.н., фланкированного сайтами рестрикции Clal и BamHI, и содержащей кодирующий участок крупного внеклеточного белка размером 32А кДа и промоторный участок непосредственно перед кодирующим участком, в бактерии БЦЖ Tice (образец № 2). Данный штамм стабильно поддерживает рекомбинантную плазмиду, и уровень экспрессии рекомбинантного белка размером 32А кДа остается практически постоянным в течение 12 месяцев в отсутствие антибиотиков, что подтверждается результатами иммуноблоттинга с антисывороткой, специфичной к белку размером 32А кДа (достигается превышение в 10,5 раза фонового уровня, характерного для БЦЖ Tice дикого типа, в начале анализа и в 8,1 раза - в конце анализа). Препарат для хранения (образец № 1) устанавливают в 10% глицерине в концентрации 3×108 частиц/мл и хранят при температуре -80°С.
J. Рекомбинантная БЦЖ(MB)30 Tice (pNBV1-MB30)
Рекомбинантную БЦЖ(MB)30 Tice (pNBV1-MB30), которая срерхэкспрессирует крупный внеклеточный белок из M. bovis, размером 30 кДа получают следующим образом. Данный рекомбинантный штамм получают электропорацией рекомбинантной плазмиды pNBV1, состоящей из векторного скелета и участка размером ˜1,5 т.н., из ДНК M. bovis дикого типа (ATCC#19210), фланкированного сайтами рестрикции Clal и BamHI, и содержащей кодирующий участок крупного внеклеточного белка размером 30 кДа и промоторный участок непосредственно перед кодирующим участком, в бактерии БЦЖ Tice (образец № 2). Данный штамм стабильно поддерживает рекомбинантную плазмиду, и уровень экспрессии рекомбинантного белка размером 30 кДа остается практически постоянным в течение 12 месяцев в отсутствие антибиотиков, что подтверждается результатами иммуноблоттинга с использованием антисыворотки, специфичной к белку размером 30 кДа (достигается превышение в 9,7 раза фонового уровня, характерного для БЦЖ Tice дикого типа, в начале анализа и в 7,8 раза - в конце анализа). Препарат для хранения (образец № 2) устанавливают в 10% глицерине в концентрации 2,5×108 частиц/мл и хранят при температуре -80°С.
K. Рекомбинантная БЦЖ(ML)30 Tice (pNBV1-ML30)
Рекомбинантную БЦЖ(ML)30 Tice (pNBV1-ML30), которая срерхэкспрессирует крупный внеклеточный белок из M. leprae размером 30 кДа, получают следующим образом. Указанный рекомбинантный штамм получают электропорацией рекомбинантной плазмиды pNBV1, состоящей из векторного скелета и участка ДНК M. leprae размером ˜1,3 т.н., фланкированного сайтами рестрикции Clal и BamHI, и содержащей кодирующий участок крупного внеклеточного белка размером 30 кДа и промоторный участок непосредственно перед кодирующим участком, в бактерии БЦЖ Tice (образец № 2). Данный штамм стабильно поддерживает рекомбинантную плазмиду, и уровень экспрессии рекомбинантного белка размером 30 кДа остается практически постоянным в течение 12 месяцев в отсутствие антибиотиков, что подтверждается результатами иммуноблоттинга с использованием антисыворотки, специфичной к белку размером 30 кДа (достигается превышение в 9,7 раза фонового уровня, характерного для БЦЖ Tice дикого типа, в начале анализа и в 9,3 раза - в конце анализа). Препарат для хранения (образец № 1) устанавливают в 10% глицерине в концентрации 3×108 частиц/мл и хранят при температуре -80°С.
ИММУНОГЕННЫЕ КОМПОЗИЦИИ, ПРИГОДНЫЕ ДЛЯ ИСПОЛЬЗОВАНИЯ В ОРГАНИЗМЕ-ХОЗЯИНЕ С ОСЛАБЛЕННЫМ ИММУНИТЕТОМ
I. Разработка БЦЖ с регулируемым ростом (ауксотрофы)
А. БЦЖ Tice glnA1
Ген glnA1 в БЦЖ Tice разрушают путем аллельного обмена с использованием плазмиды pEX1-Mtb-glnA1::Kmr, которую ранее использовали для получения мутанта M. tuberculosis glnA1 (M. V., G. Harth, and M. A. Horwitz. 2003. Glutamine Synthetase (GlnA1) is essential for growth of Mycobacterium tuberculosis in human macrophages in guinea pigs. Infect. Immun. Vol. 71:7). pEX1-Mtb-glnA1::Kmr, полученный на основе температурочувствительного sacB-вектора pPR27, содержит ген hygr и фрагмент размером 1,8 т.н., содержащий локус glnA1 из M. tuberculosis с кассетой Kmr, встроенной в уникальный сайт, расположенный в центральной части кодирующей области glnA1 (Pelicic, V., M. Jackson, J.M. Reyrat, W.R. Jacobs, Jr., B. Gicquel, and C. Guilhot. 1997. Efficient allelic exchange and transposon mutagenesis in Mycobacterium tuberculosis. Proc. Natl. Acad. Sci. USA 94: 10955-10960). pEX1-Mtb-glnA1::Kmr вводятэлектропорацией в БЦЖ Tice и трансформанты отбирают на среде 7H11, содержащей 50 мкг/мл гигромицина. Чашки вначале выдерживают при рекомендованной температуре (32°С) в течение 6 дней и затем инкубируют в ограничительных условиях (39°С) в течение 46 дней. Единственный трансформант растят в культуральном бульоне 7Н9-10% OADC-0,05% Твин-80 с добавкой 50 мкг/мл канамицина и 20 мМ L-глутамина при рестриктивной температуре в течение примерно 25 генераций и затем вносят на чашки со средой 7Н11, содержащей 2% (вес/объем) сахарозы, 20 мМ L-глутамина и 50 мкг/мл канамицина, для отбора клонов, которые подверглись второму процессу гомологичной рекомбинации. Было показано, что двенадцать из 35 случайно отобранных клонов Kmr имеют нужный фенотип (то есть Hygs и глутаминовый ауксотроф). Для подтверждения чистоты культуры авторы вносят в чашки один из двенадцати клонов при низкой плотности и изолируют единичную колонию. Исходные препараты для хранения штаммов при замораживании получают из повторно изолированного клона. Соответствующий генотип мутанта подтверждают анализом по методу саузерн-блоттинга.
Штамм БЦЖ Tice glnA1 представляет собой глутаминовый ауксотроф. На чашках со средой 7Н11 не отмечается его рост без добавления L-глутамина. Кроме того, мутант glnA1 демонстрирует небольшой или вообще отсутствие внутриклеточного роста в человеческих макрофагах в случае культивирования макрофагов в среде культуры ткани, содержащей 0,2 мМ L-глутамина (условия, при которых штамм дикого типа растет нормально). Однако внутриклеточный рост, аналогичный росту штамма дикого типа, достигается при добавлении большого избытка L-глутамина (10 мМ) к среде для культуры ткани. Анализ методом комплементации проводят при трансформации БЦЖ Tice glnA1 плазмидами, содержащими ген glnA1 из M. tuberculosis (pNBV1-MtbGS) или ген glnA из S. typhimurium (pNBV1-StGS). Обе плазмиды приводят к восстановлению мутанта до ростового фенотипа дикого типа.
Ожидается, что потребность в L-глутамине данного ауксоторофа БЦЖ glnA1 будет аналогичной таковой для штамма glnA1 M. tuberculosis, которую авторы настоящего изобретения ранее охарактеризовали достаточно детально (Tullius, M.V., G. Harth, and M.A. Horwitz. 2003. Glutamine Synthetase (GlnA1) is essential for growth of Mycobacterium tuberculosis in human macrophages and in guinea pigs. Infect. Immun. Vol. 71:7). В случае штамма M. tuberculosis glnA1 требуется высокий уровень L-гутамина (10-20 мМ) для нормального роста мутанта в твердой среде. В жидкой среде мутант M. tuberculosis glnA1 растет с нормальной скоростью при наличии ≥1 мМ L-глутамина. Хотя исходный рост является нормальным при содержании 1-2 мМ L-гутамина, данные культуры не достигают такой высокой плотности, как культуры, содержащие 5 мМ и 20 мМ L-глутамина, и демонстрируют резкое падение жизнеспособности сразу после логарифмической фазы. Штамм M. tuberculosis glnA1 быстро теряет жизнеспособность после разбавления средой, не содержащей L-гутамин. Не отмечается роста мутанта M. tuberculosis glnA1 в человеческих макрофагах, если макрофаги культивируют в присутствии 0,2 мМ L-глутамина, то есть в условиях, при которых штамм дикого типа растет нормально. Отмечается лишь слабый рост мутанта M. tuberculosis glnA1 в человеческих макрофагах в случае культивирования макрофагов в стандартной среде для культуры ткани, содержащей 2 мМ L-глутамина. Однако достигается внутриклеточный рост, аналогичный росту штамма дикого типа, если макрофаги культивируют при большом избытке L-глутамина (10 мМ). Мутант M. tuberculosis glnA1 представляет собой в высокой степени аттенюированный штамм, используемый на модели легочного туберкулеза с использованием морских свинок.
B. БЦЖ Tice trpD
Ген trpD в БЦЖ Tice разрушают путем аллельного обмена. Субстрат для аллельного обмена получают по методике ПЦР, в результате которой создают локус trpD в БЦЖ Tice с делецией размером 588 н.п. и вставляют кассету Kmr в сайт делеции. Данную мутированную аллель клонируют в векторе pEX2, полученном путем аллельного обмена (производное pEX1, в котором ген gfpuv, кодирующий зеленый флуоресцентный белок, замещен опероном E. coli codBA, кодирующим цитозиндезаминазу), с образованием pEX2 ▵trpD::Kmr (Tullius, M.V., G. Harth, and M.A. Horwitz. 2003. Glutamine Synthetase (GlnA1) is essential for growth of Mycobacterium tuberculosis in human macrophages and in guinea pigs. Infect. Immun. Vol. 71:7).
pEX2 ▵trpD::Kmr подвергают электропорациивБЦЖ Tice и трансформанты отбирают на среде 7Н11, содержащей 50 мкг/мл гигромицина, при рекомендованной температуре (32°С). Объединенные трансформанты растят в культуральном бульоне 7H9-10% OADC-0,05% Твин-80 с добавкой 10 мкг/мл канамицина и 50 мкг/мл L-триптофана при рекомендованной температуре в течение примерно 10 генераций и затем вносят на чашки со средой 7Н10, содержащей 2% (вес/объем) сахарозы, 50 мкг/мл канамицина и 50 мкг/мл L-триптофана, при ограничительной температуре (39°С) для отбора клонов, которые подверглись гомологичной рекомбинации. Было показано, что четыре из 10 отобранных клонов Kmr содержат нужный фенотип (то есть Hygs и триптофановый ауксотроф). Для гарантии чистоты культуры один из четырех клонов вносят на чашку при низкой плотности и изолируют одну колонию. Исходные препараты для хранения данного штамма при замораживании получают из указанного повторно изолированного клона. Соответствующий генотип мутанта подтверждают анализом по методу саузерн-блоттинга.
Штамм БЦЖ Tice trpD представляет собой триптофановый ауксотроф. Не отмечается его рост на чашках со средой 7Н11 без добавления L-триптофана. В культуральном бульоне штамм БЦЖ Tice trpD растет со скоростью, аналогичной скорости роста штамма дикого типа, в присутствии ≤10 мкг/мл L-триптофана. Рост замедляется примерно в два раза при концентрации 3 мкг/мл L-типтофана и штамм теряет жизнеспособность при разбавлении средой, не содержащей L-триптофан. Мутант trpD демонстрирует небольшое или отсутствие внутриклеточного роста в человеческих макрофагах при культивировании макрофагов в стандартной среде для культуры ткани, содержащей 5 мкг/мл (условия, при которых штамм дикого типа растет нормально). Однако при добавлении к среде для культуры ткани дополнительно 100 мкг/мл L-триптофана достигается внутриклеточный рост, аналогичный росту штамма дикого типа. Анализ методом комплементации проводят при трансформации БЦЖ Tice trpD плазмидой, содержащей ген trpD БЦЖ Tice (pNBV1-trpD). Данная плазмида приводят к восстановлению мутанта до ростового фенотипа дикого типа.
II. БЦЖ с регулируемым ростом, осуществляющая сверхэкспрессию крупного секретируемого белка M. tuberculosis размером 30 кДа (ауксотрофы)
А. БЦЖ Tice glnA1 pSMT3-MTB30
Плазмиду pSMT3-MTB30 подвергают электропорации в БЦЖ Tice glnA1 и трансформанты отбирают на агаре 7Н11 с добавкой 50 мкг/мл гигромицина, 50 мкг/мл канамицина и 20 мМ L-глутамина. Отбирают случайным образом два отдельных клона, устойчивых к канамицину и гигромицину, и культивируют их в среде 7Н9, содержащей 50 мкг/мл гигромицина, 50 мкг/мл канамицина и 20 мМ L-глутамина. Наличие экспрессии и выход рекомбинантного белка M. tuberculosis размером 30 кДа подтверждают электрофорезом в полиакриламидном геле и методом иммуноблоттинга с использованием поливалентного высокоспецифичного иммуноглобулина кролика против белка размером 30 кДа. Было показано, что БЦЖ Tice glnA1 pSMT3-MTB30 образует приблизительно в 10-20 раз больше антигена размером 30 кДа на мл культуры, чем БЦЖ Tice glnA1. БЦЖ Tice glnA1 pSMT3-MTB30, как и исходный штамм БЦЖ Tice glnA1, является глутаминовым ауксотрофом.
B. БЦЖ Tice trpD pSMT3-MTB30
Плазмиду pSMT3-MTB30 подвергают электропорации в БЦЖ Tice trpD и трансформанты отбирают на агаре 7Н11 с добавкой 50 мкг/мл гигромицина, 50 мкг/мл канамицина и 50 мкг/мл L-триптофана. Отбирают случайным образом десять отдельных клонов, устойчивых к канамицину и гигромицину, и культивируют их в бульоне 7Н9-10% OADC-0,05% Твин-80, содержащем 50 мкг/мл гигромицина, 50 мкг/мл канамицина и 50 мкг/мл L-триптофана. Экспрессию рекомбинантного белка M. tuberculosis размером 30 кДа подтверждают электрофорезом в полиакриламидном геле и методом иммуноблоттинга с использованием поливалентного высокоспецифичного иммуноглобулина кролика против белка размером 30 кДа. Было показано, что БЦЖ Tice trpD pSMT3-MTB30 образует приблизительно в 10-20 раз больше антигена размером 30 кДа на мл культуры, чем контрольный штамм БЦЖ Tice.
III. Аттенюированная БЦЖ: (не ауксотрофная) БЦЖ Tice narG
Ген БЦЖ Tice narG (кодирующий альфа-субъединицу нитратредуктазы) разрушают путем аллельного обмена. Субстрат для аллельного обмена получают по методике ПЦР, в результате которой создают локус narG в БЦЖ Tice с делецией 2952 н.п. и встраивают кассету Kmr в сайт делеции. Данную мутированную аллель клонируют в векторе pEX2, полученном путем аллельного обмена (производное pEX1, в котором ген gfpuv замещен опероном E. coli codBA), с образованием pEX2 ▵rG::Kmr (Tullius, M.V., G. Harth, and M.A. Horwitz. 2003. Glutamine Synthetase (GlnA1) is essential for growth of Mycobacterium tuberculosis in human macrophages and in guinea pigs. Infect. Immun. Vol. 71:7).
pEX2 ▵rG::Kmr подвергают электропорации вБЦЖ Tice (12-13-2001) и трансформанты отбирают на агаровой среде 7Н11, содержащей 50 мкг/мл гигромицина и 50 мкг/мл канамицина, при рекомендованной температуре (32°С). Объединенные трансформанты растят в культуральном бульоне 7H9-10% OADC-0,05% Твин-80 с добавкой 10 мкг/мл канамицина при рекомендованной температуре в течение примерно 30 генераций и затем вносят на чашки с агаровой средой 7Н10, содержащей 2% (все/объем) сахарозы и 10 мкг/мл канамицина, при ограничительной температуре (39°С), для отбора клонов, которые подверглись гомологичной рекомбинации. Было показано, что восемь из 8 отобранных клонов Kmr содержат нужный фенотип (то есть Hygs). Для подтверждения чистоты культуры один из восьми клонов вносят на чашку при низкой плотности и повторно изолируют единичную колонию. Соответствующий генотип мутанта подтверждают анализом по методу саузерн-блоттинга, результат которого указывает на отсутствие у мутанта narG полной длины.
Мутант narG растет нормально на чашках в культуральном бульоне и внутриклеточно в макрофагах. Относительно полученного БЦЖ narG мутанта в литературе имеются данные о том, что он является высокоаттенюированным, в сравнении с исходным штаммом БЦЖ, на модели иммунодефицитных мышей SCID (Weber, I., Fritz, C., Ruttkowski, S., Kreft, A., and F.C. Band. 2000. Anaerobic nitrate reductase (narGHJI) activity of Mycobacterium bovis BCG in vitro and its contribution to virulence in immunodeficient mice. Mol. Microbiol. 35(5): 1017-1025). В этой связи ожидалось, что мутантный штамм narG будет в аналогичной мере аттенюированным для мышей SCID и вдобавок будет обладать ослабленными свойствами для пациентов с ослабленным иммунитетом.
IV. Аттенюированная БЦЖ, осуществляющая сверхэкспрессию крупного секретируемого белка M. tuberculosis размером 30 кДа (не ауксотроф)
БЦЖ Tice narG pSMT3-MTB30
Плазмиду pSMT3-MTB30 подвергают электропорации в БЦЖ Tice narG и трансформанты отбирают на агаровой среде 7Н11, содержащей 50 мкг/мл гигромицина и 10 мкг/мл канамицина. Отбирают случайным образом пять отдельных клонов, устойчивых к гигромицину и канамицину, и культивируют в бульоне 7H9-10% OADC-0,05% Твин-80, содержащем 50 мкг гигромицина.
Экспрессию рекомбинантного белка M. tuberculosis размером 30 кДа подтверждают электрофорезом в полиакриламидном геле и методом иммуноблоттинга с использованием поливалентного высокоспецифичного иммуноглобулина кролика против белка размером 30 кДа. Было показано, что БЦЖ Tice narG pSMT3-MTB30 продуцирует приблизительно в 10-20 раз больше антигена размером 30 кДа на мл культуры, чем контрольный штамм БЦЖ Tice.
Следует понимать, что при использовании описанных выше способов, в сочетании с методами, известными специалистам в области технологии рекомбинантной ДНК, могут быть получены рекомбинантные штаммы БЦЖ (как ауксотрофные, так и неауксотрофные), экспрессирующие крупный внеклеточный неслитый белок M. tuberculosis размером 32(А) кДа, крупный внеклеточный неслитый белок размером 16 кДа, крупный внеклеточный неслитый белок размером 23,5 кДа и другие крупные внеклеточные неслитые белки M. tuberculosis. Кроме того, могут быть использованы аналогичные методики для получения рекомбинантных штаммов БЦЖ, экспрессирующих крупные внеклеточные неслитые белки M. leprae, которые включают, но не ограничиваясь, крупный внеклеточный неслитый белок M. leprae, представляющий собой гомолог крупного внеклеточного неслитого белка M. tuberculosis размером 30 кДа (известный также как антиген 85В), крупный внеклеточный неслитый белок M. leprae размером 32(А) кДа, представляющий собой гомолог крупного внеклеточного неслитого белка M. tuberculosis размером 32(А) кДа (известный также как антиген 85А) и другие крупные внеклеточные неслитые белки M. leprae. Дополнительно могут быть использованы аналогичные методики для получения рекомбинантной БЦЖ по типу M. bovis, экспрессирующей крупный внеклеточный неслитый белок M. bovis размером 30 кДа, представляющий собой гомолог крупного внеклеточного неслитого белка M. tuberculosis размером 30 кДа (известный также как антиген 85В), крупный внеклеточный неслитый белок M. bovis размером 32(А) кДа, представляющий собой гомолог крупного внеклеточного неслитого белка M. tuberculosis размером 32(А) кДа (известный также как антиген 85А) и другие крупные внеклеточные белки M. bovis.
ХАРАКТЕРНЫЕ СПОСОБЫ ПОЛУЧЕНИЯ ПЛАЗМИДЫ И ТРАНСФОРМАНТА
В общих чертах получение плазмиды pMTB30 генноинженерными методами для экспрессии крупного внеклеточного неслитого белка M. tuberculosis Erdman размером 30 кДа на основе ее собственного промотора (или любого другого промотора гена, не связанного с белками теплового шока и стрессовыми белками) осуществляют путем встраивания крупного фрагмента, полученного при рестрикции геномной ДНК, содержащего ген для неслитого белка размером 30 кДа плюс обширные фланкирующие последовательности ДНК, в плазмидный сайт множественного клонирования с использованием методик, известных специалистам в области технологии рекомбинантной ДНК. Вначале плазмиду вводят в E. coli DH5α с получением больших количеств рекомбинантной плазмиды. Рекомбинантный штамм Е. coli, который не способен экспрессировать неслитый белок M. tuberculosis размером 30 кДа, растят в присутствии 250 мкг/мл гигромицина, и наличие вставки последовательности плазмидной ДНК определяют по ее полному действию. Плазмиду вводят в M. smegmatis путем электропорации с использованием следующих условий: 6,25 кВ/см, 25 мкФ и 1000 mΩ, которые приводят к получению наибольшего числа положительных трансформантов. Авторы настоящего изобретения подтвердили наличие рекомбинантной плазмиды по росту в присутствии 50 мкг/мл гигромицина и конститутивной экспрессии и выходу рекомбинантного неслитого белка размером 30 кДа, путем электрофореза в полиакриламидном геле и иммуноблоттинга с использованием поливалентного высокоспецифичного иммуноглобулина кролика против неслитого белка размером 30 кДа с использованием методик, известных специалистам в области технологии рекомбинантной ДНК. Дополнительно авторы настоящего изобретения подтвердили правильность экспрессии и процессинга рекомбинантного неслитого белка M. tuberculosis размером 30 кДа, который был неотличим от нативного варианта по результатам секвенирования по N-концевой аминокислоте.
Далее рекомбинантную pSMT3 плазмиду pMTB30 вводят в M. bovis БЦЖ Tice с использованием условий, включающих 6,25 кВ/см, 25 мкФ и 200 mΩ в качестве оптимальных условий для электропорации. Трансформанты инкубируют в среде 7Н9 с добавкой 2% глюкозы в течение 4 часов при 37°С на качалке в условиях окружающей среды и затем помещают на чашки с агаровой средой 7Н11 с добавкой 20 мкг/мл гигромицина. Постепенно концентрацию гигромицина повышают до 50 мкг/мл при добавлении новой ростовой среды для субъкультивирования трансформантов. Рекомбинантные культуры БЦЖ Tice поддерживают в тех же условиях, что и штамм дикого типа, за исключением того, что среда 7Н9 содержит 50 мкг/мл гигромицина.
Экспрессию и выход рекомбинантного неслитого белка M. tuberculosis размером 30 кДа подтверждают электрофорезом в полиакриламидном геле и иммуноблотттингом с использованием поливалентного высокоспецифичного иммуноглобулина кролика против неслитого белка размером 30 кДа. В типичном случае 1 из 10 трансформантов экспрессируют и экспортируют значительно большие количества рекомбинантного неслитого белка, чем другие трансформанты; отбирают 2 таких трансформанта и получают большое количество препарата указанных трансформантов, которые замораживают при -70°С в среде 7Н9, содержащей 10% глицерина. Данные трансформанты используют для исследования эффективности иммуногенной композиции на морских свинках. На фиг.1а показана экспрессия крупного внеклеточного неслитого белка M. tuberculosis размером 30 кДа рекомбинантной БЦЖ Tice, как следует из результатов электрофореза в SDS-PAGE и анализа методом иммуноблоттинга. Рекомбинантный штамм экспрессирует значительно больше крупного внеклеточного неслитого белка M. tuberculosis размером 30 кДа, чем штамм дикого типа, что следует как из данных, полученных при окрашивании гелей красителем кумасси синим, так и по результатам оценки иммуноблоттов.
Другой рекомбинантный штамм M. bovis БЦЖ Connaught (рБЦЖ30 Conn), экспрессирующий крупный внеклеточный неслитый белок M. tuberculosis размером 30 кДа, получают по методике, аналогичной методике получения рекомбинантной БЦЖ Tice (рБЦЖ30 Tice), с использованием указанной выше плазмиды pMTB30. Данный штамм поддерживают в среде, содержащей гигромицин в концентрации 50 мкг/мл, в тех же условиях, что были описаны для рекомбинантного штамма БЦЖ Tice. На фиг.1b показана экспрессия крупного внеклеточного неслитого белка M. tuberculosis размером 30 кДа рекомбинантной БЦЖ Connaught, выявляемая по данным электрофореза в SDS-PAGE и анализа методом иммуноблоттинга. Рекомбинантный штамм экспрессирует значительно больше крупного внеклеточного неслитого белка M. tuberculosis размером 30 кДа, чем штамм дикого типа, что следует как по результатам окрашивания гелей красителем кумасси синим, так и по оценке иммуноблоттов.
Дополнительно проводят сравнение относительной экспрессии крупных внеклеточных неслитых белков в штаммах рБЦЖ с использованием плазмиды pNBV1 и промотора, расположенного на участке непосредственно перед геном глутаминсинтетазы glnA1 или геном, кодирующим внеклеточный белок, с исходным штаммом БЦЖ. Иммуноблотты каждого рекомбинантного белка переводят в цифровую форму для компьютерного анализа с использованием сканера CreoScitex EverSmart Jazz и полосы белков анализируют методом денситометрии при измерении площади с использованием программы NIH image 1.62. Уровни экспрессии для каждого рекомбинантного белка приведены в таблице 8.
Стабильность плазмиды в рекомбинантных штаммах БЦЖ оценивают биохимически. Биохимический анализ показывает, что в присутствии гигромицина обе культуры рекомбинантных штаммов БЦЖ поддерживают стойкий уровень экспрессии рекомбинантного неслитого белка в течение 3-месячного периода. В отсутствие гигромицина те же культуры демонстрируют лишь слабое снижение экспрессии неслитого белка (в пересчете на клетку), что указывает на стабильность поддержания рекомбинантной плазмиды и очень постепенную потерю ее в бактериях, растущих без селективного давления (фиг.1а и фиг.1b, линия 3).
Была исследована стабильность различных рекомбинантных штаммов БЦЖ по настоящему изобретению, экспрессирующих крупные внеклеточные неслитые белки M. tuberculosis в варианте использования плазмиды pNBV1 и промотора, расположенного на участке непосредственно перед геном glnA1 глутаминсинтетазы. Экспрессия белков размером 30 кДа и/или 23,5 кДа в рБЦЖ30 Tice II, рБЦЖ23,5 Tice I и рБЦЖ30/23,5 Tice I была стабильной по меньшей мере в течение 3 месяцев непрерывного культивирования (примерно 30 генераций) в среде, содержащей гигромицин для отбора положительных плазмид. Кроме того, культивирование штаммов в течение одного месяца (примерно 10 генераций) в среде, не содержащей гигромицин, не приводит к снижению уровня экспрессии. Однако после 6 месяцев непрерывного культивирования в отсутствие гигромицина (примерно 60 генераций) экспрессия белка размером 30 кДа в рБЦЖ30 Tice II значительно снижается и экспрессия белков размером 30 кДа и 23,5 кДа в рБЦЖ30/23,5 Tice I значительно снижается до необнаруживаемых уровней. Остается высокой только экспрессия белка размером 23,5 кДа в рБЦЖ23,5 Tice I. Было подтверждено, что падение экспрессии у двух штаммов связано с потерей плазмиды большим процентом клеток в культуре (что было определено при посеве штаммов на чашки со средой 7Н11 при наличии и без гигромицина). У рБЦЖ23,5 Tice I не выявлено потери плазмиды (примерно 100% клеток были гигромицин-устойчивыми), что согласуется с высокой экспрессией, поддерживаемой даже после 6 месяцев культивирования в отсутствие гигромицина.
Дополнительно была также исследована стабильность новых рекомбинантных стабильных штаммов БЦЖ, экспрессирующих крупные внеклеточные белки M. tuberculosis, M. bovis и M. leprae с использованием плазмиды pNBV1 и промотора, расположенного непосредственно перед геном, кодирующим внеклеточный белок. Экспрессия рекомбинантных белков, например крупных внеклеточных белков M. tuberculosis размером 30, 23,5 и 32А кДа и крупного внеклеточного белка M. bovis и M. leprae размером 30 кДа, была стабильной в течение по меньшей мере 12 месяцев непрерывного культивирования (˜120 генераций) в среде, содержащей или не содержащей гигромицин в качестве положительного селективного маркера плазмиды pNBV1. Не обнаруживается утраты плазмиды.
Приведенные эксперименты показывают, что различные рекомбинантные штаммы демонстрируют широкий спектр стабильности в том, что касается уровня экспрессии рекомбинантных белков. В целом, плазмиды, содержащие кодирующие последовательности ДНК для рекомбинантных белков, слитые с их эндогенными промоторными участками, достаточно стабильно экспрессируют рекомбинантные белки в течение по меньшей мере 12 месяцев, хотя уровни в обычном случае несколько падают с течением времени, что связано, вероятнее всего, с необходимостью достижения баланса между экспрессией и секрецией рекомбинантных белков и метаболическим состоянием бактериальной клетки и экспрессией соответствующих эндогенных белков. И наоборот, штаммы, содержащие плазмиды, в которых экспрессию рекомбинантных белков осуществляет гетерологичный промотор glnA1, демонстрируют высокую вариабельность в стабильности экспрессии с течением времени. Следует отметить, что рекомбинантные белки были идентичны тем белкам, которые экспрессировались указанными выше сочетаниями. В этой связи вариабельность в экспрессии является явной функцией промоторной последовательности.
ХАРАКТЕРНЫЕ СПОСОБЫ ОЦЕНКИ БЕЗОПАСНОСТИ И ЭФФЕКТИВНОСТИ ИММУНОГЕННЫХ КОМПОЗИЦИЙ ПО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ
Иммуногенные композиции по настоящему изобретению после их успешного получения подвергают анализу на безопасность и эффективность с использованием моделей на животных. В исследованиях используют морских свинок, поскольку модель на морских свинках особенно показательна для туберкулеза человека по клиническим, иммунологическим и патологическим характеристикам. В отличие от мыши и крысы, но сходно с человеком, морская свинка: а) чувствительна к низким дозам распыленного M. tuberculosis; b) демонстрирует выраженную реакцию на кожный тест на туберкулин и с) демонстрирует наличие гигантских клеток Ланганса и казеолиза легочных поражений. Однако в то время как лишь у 10% иммунокомпетентных людей, которые инфицированы M. tuberculosis, развивается активное заболевание в течение жизни (у одной половины сразу после воздействия, а у другой половины после латентного периода), у инфицированных морских свинок всегда развивается раннее активное заболевание. В то время как морские свинки отличаются от людей по данному аспекту, сходство развития активного заболевания после инфекции M. tuberculosis с человеком является преимуществом, используемым в испытании эффективности иммуногенных композиций.
Прививочный материал для иммунизации в соответствии с настоящим изобретением получают из аликвот, выделенных из культур («бактерий») БЦЖ дикого типа или рекомбинантных БЦЖ в логарифмической фазе роста. Каждую аликвоту бактерий подвергают центрифугированию при 3500×g в течение 15 минут и затем промывают 1×фосфатно-буферным раствором (1×PBS, 50 мМ фосфата натрия, рН 7, 150 мМ хлорида натрия). Прививочный материал для иммунизации затем ресуспендируют до конечной концентрации 1×104 колониеобразующих единиц на мл в 1×PBS с содержанием 1000 жизнеспособных бактерий на 100 мкл.
Самцов морских свинок штамма Хартли (Hartley) весом 250-300 г, не содержащих специфических патогенов, выращенных по методу аутбридинга (полученные от Charles River Breeding Laboratories), в группах по 9 животных внутрикожно иммунизируют одним из следующих препаратов: 1) один раз БЦЖ Connaught [103 колониеобразующих единиц (КОЕ)] (время 0 недель); 2) один раз рБЦЖ30 Connaught (103 КОЕ) (время 0 недель); 3) очищенный рекомбинантный крупный внеклеточный неслитый белок M. tuberculosis размером 30 кДа (р30), 100 мкг в 100 мкл композиции адъюванта Synex (SAF), три раза с интервалом по три недели (время 0, 3 и 6 недель), SAF, состоящий из Плуроника L121 (Pluronic L121), сквалана и Твин-80, и в случае первой иммунизации аланилмурамилового дипептида и 4) только SAF (100 мкл) (ложная иммунизация), три раза с интервалами по три недели (время 0, 3 и 6 недель). Дополнительную группу из трех животных подвергают ложной иммунизации с использованием только SAF (100 мкл), и эта группа служит контролем кожного теста. Указанные и от трех до шести других животных, подвергнутых ложной иммунизации, служат в качестве неинфицированных контролей в экспериментах по контрольному заражению.
Через девять недель после единственной иммунизации (группы БЦЖ и рБЦЖ30) или первой иммунизации (группа р30 и группа животных с ложной иммунизацией на кожный тест) у морских свинок выбривают спину и проводят внутрикожную инъекцию 10 мкг очищенного рекомбинантного крупного внеклеточного неслитого белка M. tuberculosis размером 30 кДа (р30) в 100 мкл фосфатно-буферного раствора. Через двадцать четыре часа измеряют диаметр эритемы и уплотнения. (Отдельную группу животных с ложной иммунизацией используют в исследованиях на контрольное заражение для кожного теста. Животных после ложной иммунизации, использованных для контрольного заражения, не подвергают кожному тесту для устранения возможности того, что кожный тест сам по себе может повлиять на результат исследования.)
Через девять недель после первой или единственной иммунизации и сразу после кожного теста животных подвергают контрольному заражению аэрозолем, полученным из 10 мл суспензии, образованной из единичных клеток, содержащей 1×105 колониеобразующих единиц (КОЕ) M. tuberculosis. Штамм Mycobacterium tuberculosis Erdman (ATCC 35801) пассируют на морских свинках, выращенных по методу аутбридинга, для поддержания вирулентности, культивируют на агаре 7Н11, подвергают осторожной обработке ультразвуком с получением суспензии единичных клеток и замораживают при температуре -70°С для последующего использования в экспериментах по контрольному заражению на животных. Используемая для контрольного заражения аэрозольная доза доставляет ˜40 живых бацилл в легкие каждого животного. Используют воздушно-капельный тип инфекции, поскольку он представляет собой естественный способ инфекции для легочного туберкулеза. Используют большую дозу для индукции клинически выраженного заболевания у 100% контрольных животных в течение относительно короткого периода времени (10 недель). После этого морских свинок помещают по одному в клетки из нержавеющей стали, находящиеся в ламинарном боксе, закрытом от биологического заражения, и позволяют свободный доступ к стандартной лабораторной пище и воде. Животных осматривают на наличие признаков заболевания и взвешивают еженедельно в течение 10 недель и затем подвергают эвтаназии. Удаляют правое легкое и селезенку каждого животного и культивируют для выявления КОЕ M. tuberculosis.
В каждом из двух экспериментов животные, подвергнутые ложной иммунизации, и животные, иммунизированные с использованием БЦЖ дикого типа, демонстрируют небольшую или вовсе отсутствие эритемы и уплотнения при тестировании с использованием крупного внеклеточного неслитого белка M. tuberculosis размером 30 кДа (р30). И наоборот, животные, иммунизированные р30 или рБЦЖ30, демонстрируют выраженную эритему и уплотнение, которые значительно превосходят по выраженности соответствующие признаки у животных, подвергнутых ложной иммунизации или иммунизированных БЦЖ дикого типа (таблица 1 и фиг.2).
В каждом из двух экспериментов неинфицированные животные контрольной группы нормально набирают вес после стимуляции, как и животные, иммунизированные рБЦЖ30 или БЦЖ дикого типа (фиг.3). Фактически не отмечается существенных различий по прибавке веса между указанными тремя группами. И наоборот, животные, подвергнутые ложной иммунизации, и в меньшей степени животные, иммунизированные р30, демонстрируют сниженную прибавку в весе в течение всего эксперимента (таблица 2 и фиг.3). Следовательно, после контрольного заражения M. tuberculosis и БЦЖ, и рБЦЖ30 полностью защищают животных от потери веса, что представляет собой основной физический признак развития туберкулеза у человека, а также является показателем туберкулеза на модели данного хронического инфекционного заболевания с использованием морских свинок.
В каждом из двух экспериментов к концу 10 недели наблюдения морских свинок подвергают эвтаназии, у каждого животного асептически удаляют правое легкое и селезенку и исследуют уровень КОЕ M. tuberculosis. У животных, подвергнутых ложной иммунизации, отмечается наибольшее количество бактерий в легких и селезенке (таблица 3 и фиг.4а и фиг.4b). Животные, иммунизированные р30, характеризуются меньшим числом микроорганизмов в легких и селезенке, чем животные, подвергнутые ложной иммунизации; животные, иммунизированные БЦЖ, характеризуются меньшим числом микроорганизмов, чем животные, иммунизированные р30; и, что особенно примечательно, животные, иммунизированные рБЦЖ30, характеризуются меньшим числом микроорганизмов, чем животные, подвергнутые иммунизации с использованием БЦЖ. В статистических тестах с использованием двунаправленного факторного анализа по методу вариантов для сравнения средних значений показано, что средние значения для четырех групп "лечения" (ложная иммунизация, введение р30, БЦЖ и рБЦЖ30) в эксперименте 1 значительно не отличались от средних значений для четырех групп «лечения» в эксперименте 2 и что в этой связи можно объединить данные, полученные в обоих экспериментах. Объединенные данные приведены в таблице 4 и фиг.3. Наибольший интерес и важность представляет тот факт, что животные, иммунизированные рБЦЖ30, имеют на 0,5 log меньше микроорганизмов в легких и примерно на 1 log меньше микроорганизмов в селезенке, чем животные, иммунизированные БЦЖ. При статистической обработке по методу анализа вариантов для сравнения средних значений и с использованием критерия наименьшего значимого различия (Tukey-Fisher; LSD) для оценки статистического различия было показано, что среднее значение данного показателя и в легких, и в селезенке для каждой из четырех групп значительно отличается от среднего значения по каждому из других вариантов (таблица 4). Различия между животными, иммунизированными рБЦЖ30 и БЦЖ, по данному показателю в легких было значимым при p=0,02 и в селезенках при p=0,001. Параллельно выявлению различий по уровню КОЕ в легких при макроскопическом исследовании было показано, что легкие животных, иммунизированных рБЦЖ30, характеризуются меньшей деструкцией ткани легкого, чем животные, иммунизированные БЦЖ (20±4% против 35±5%, среднее значение ±СКО).
Таким образом, введение рекомбинантной БЦЖ, экспрессирующей крупный внеклеточный неслитый белок M. tuberculosis размером 30 кДа, создает высокий уровень защиты против аэрозольной стимуляции M. tuberculosis с использованием высокочувствительной модели морских свинок на легочный туберкулез. И, наоборот, как будет описано в примерах ниже, введение того же внеклеточного неслитого белка микобактерий (крупного внеклеточного неслитого белка рекомбинантной M. tuberculosis размером 30 кДа) в адъюванте в сочетании с БЦЖ не индуцирует высокого уровня защиты против аэрозольной провокации M. tuberculosis; указанный вывод равным образом относится и к введению рекомбинантной M. smegmatis, экспрессирующей крупный внеклеточный неслитый белок M. tuberculosis размером 30 кДа, а также к введению крупного внеклеточного неслитого белка M. tuberculosis размером 30 кДа в микросферах, которые имеют примерно тот же размер, что и БЦЖ, и как и БЦЖ, медленно высвобождают белки в течение 60-90 дней; а также к введению крупного внеклеточного неслитого белка M. tuberculosis размером 30 кДа, инкупсулированного в липосомы.
Весьма неожиданный аспект настоящего изобретения заключается в том, что штамм рБЦЖ30 индуцирует защиту, более высокую, чем БЦЖ дикого типа, даже несмотря на то, что штамм дикого типа экспрессирует и секретирует эндогенный, высокогомологичный крупный внеклеточный белок размером 30 кДа (смотрите фиг.1). Ген, кодирующий белок размером 30 кДа, из подштамма БЦЖ Connaught не был секвенирован. Однако, как было показано, последовательность белка размером 30 кДа из двух других подштаммов БЦЖ, рассчитанная на основании последовательности клонированного гена указанных подштаммов, отличается от белка M. tuberculosis только по одной аминокислоте (BCG Paris 1173 P2) или по 5 аминокислотам, включая две дополнительные аминокислоты (BCG Tokyo). (Смотрите страницы 3041-3042 из Harth, G., B.-Y. Lee, J. Wang, D.L. Clemens, and M.A. Horwitz. 1996. Novel insights into the genetics, biochemystry, and immunocytochemistry of the 30-kilodalton major extracellular protein of Mycobacterium tuberculosis. Infect. Immun. 64: 3038-3047, полное содержание данной работы приведено в настоящем описании в качестве ссылки.) В этой связи маловероятно, что улучшенная защита в случае использования рекомбинантного штамма связана с небольшими различиями в аминокислотах между рекомбинантным и эндогенным белками. Более вероятно, это связано с повышенным уровнем экспрессии рекомбинантного неслитого белка в сравнении с эндогенным белком. Если так, то высокая экспрессия, достигаемая при использовании высококопийной плазмиды, будет, скорее всего, важным фактором, способствующим получению рекомбинантной иммуногенной композиции.
В третьем эксперименте самцов морских свинок линии Hartley весом 250-300 граммов, не содержащих специфических патогенов, которые были выращены по методу аутбридинга и получены от компании Charles River Breeding Laboratories, в группах по 9 животных, подвергают внутрикожной иммунизации с использованием 103 КОЕ одним из указанных ниже штаммов:
Группа А: БЦЖ Tice, исходный контрольный вариант.
Группа B: рБЦЖ30 Tice I (pSMT3-MTB30).
Группа C: рБЦЖ30 Tice II (pNBV1-pglnA1-MTB30).
Группа D: рБЦЖ23,5 Tice I (pNBV1-pglnA1-MTB23,5).
Группа E: рБЦЖ30/23,5 Tice I (pNBV1-pglnA1-MTB30/23,5).
Группа F: рБЦЖ30 Tice II (pNBV1-pglnA1-MTB30).
и рБЦЖ23,5 Tice I (pNBV1-pglnA1-MTB23,5)
(используют по 5×102 каждого штамма).
Кроме того, 18 животных подвергают ложной иммунизации буфером по одному из приведенных вариантов: группа G: 12 животных, подвергнутых ложной иммунизации (только для последующего контрольного заражения), и группа Н: 6 животных, подвергнутых ложной иммунизации (только для кожного теста).
Через девять недель после иммунизации у 9 морских свинок в каждой из указанных выше групп A-F и у 6 животных из группы Н, подвергнутых ложной иммунизации, сбривают шерсть на спине и инъецируют внутрикожно 10 мкг очищенного крупного внеклеточного неслитого белка рекомбинантной M. tuberculosis размером 30 кДа (р30) в 100 мкл фосфатно-буферного раствора. Животных, иммунизированных штаммом, экспрессирующим р23,5 (группы A, D, E, F), и 6 животных, подвергнутых ложной иммунизации в группе Н, дополнительно подвергают кожному тесту с использованием 10 мкг очищенного крупного внеклеточного белка рекомбинантной M. tuberculosis размером 23,5 кДа в 100 мкл фосфатно-буферного раствора. Через 24 часа измеряют диаметр эритемы и уплотнения. (Отдельную группу животных из числа подвергнутых ложной иммунизации, которые были использованы в исследовании на контрольное заражение, также используют для кожного теста. Животных после ложной иммунизации, которые были использованы в исследовании на контрольное заражение, не подвергают кожному тесту для устранения возможности того, что сам по себе кожный тест может повлиять на результат.)
Результаты, приведенные в таблице 9, показывают, что животные, иммунизированные исходным штаммом БЦЖ Tice (группа А), и животные, подвергнутые ложной иммунизации (группа Н), демонстрируют небольшую или вовсе отсутствие эритемы и уплотнения при тестировании с использованием р30 или р23,5. И, наоборот, животные, иммунизированные рекомбинантным штаммом БЦЖ, экспрессирующим р30, имеют выраженные эритему и уплотнение в ответ на введение р30, что значительно выше, чем у животных, иммунизированных с использованием БЦЖ Tice, или животных, подвергнутых ложной иммунизации. Аналогично, животные, иммунизированные рекомбинантным штаммом БЦЖ, экспрессирующим р23,5, имеют выраженные эритему и уплотнение в ответ на введение р23,5 что значительно выше, чем у животных, иммунизированных с использованием БЦЖ Tice, или животных, подвергнутых ложной иммунизации. Кроме того, животные, иммунизированные рекомбинантным штаммом БЦЖ, экспрессирующим и р30, и р23,5, имеют выраженные эритему и уплотнение в ответ на введение указанных белков, что значительно выше, чем у животных, иммунизированных с использованием БЦЖ Tice, или животных, подвергнутых ложной иммунизации. И, наконец, животные, иммунизированные двумя разными штаммами рекомбинантной БЦЖ в одно и то же время, где один штамм экспрессирует р30, а другой экспрессирует р23,5, имеют выраженные эритему и уплотнение в ответ на введение обоих указанных белков, что значительно выше, чем в случае животных, иммунизированных с использованием БЦЖ Tice, или животных, подвергнутых ложной иммунизации.
Интересно, что животные, иммунизированные новыми рекомбинантными штаммами БЦЖ (группы C, D, E и F), каждое из которых экспрессирует рекомбинантные белки с использованием промотора, полученного из участка, расположенного перед геном glnA1 M. tuberculosis, не демонстрируют более выраженную степень эритемы и уплотнения в ответ на введение р30, чем животные, иммунизированные штаммом рБЦЖ30 Tice I, который экспрессирует р30 с использованием промотора, полученного из участка, расположенного перед геном M. tuberculosis, кодирующим крупный внеклеточный белок размером 30 кДа.
Через девять недель после иммунизации и сразу после кожного теста всех животных в группах A-G подвергают контрольному заражению аэрозолем с использованием 10 мл суспензии из единичных клеток, содержащей 5×104 колониеобразующих единиц (КОЕ) M. tuberculosis. (Перед проведением контрольного заражения провоцирующий штамм M. tuberculosis Erdman [ATCC 35801] пассируют на морских свинках, выращенных по методу аутбридинга, для поддержания вирулентности, культивируют на агаре 7Н11, осторожно обрабатывают ультразвуком с получением суспензии единичных клеток и замораживают при температуре -70°С.) Указанная доза аэрозоля доставляет ˜20 живых бацилл в легкие каждого животного. Используют воздушно-капельный способ инфекции, поскольку он представляет собой естественный способ инфекции для легочного туберкулеза. Используют большую дозу с тем, чтобы вызвать заметные клинические признаки заболевания у 100% контрольных животных в течение относительно короткого периода времени (10 недель). После этого морских свинок помещают по одному в клетки из нержавеющей стали, содержащиеся в ламинарном боксе, закрытом от биологического заражения, и позволяют свободный доступ к стандартной лабораторной пище и воде. Животных осматривают на наличие признаков заболевания и взвешивают еженедельно в течение 10 недель и затем подвергают эвтаназии. Удаляют правое легкое и селезенку каждого животного и культивируют для выявления уровня КОЕ M. tuberculosis на агаре Middlebrook 7H11 в течение двух недель при температуре 37°С в атмосфере с содержанием 5% СО2-95% воздуха.
Результаты оценки уровня КОЕ в легких и селезенке показаны в таблице 10. Приведенные результаты показывают, что животные, иммунизированные БЦЖ или любым рекомбинантным штаммом БЦЖ, имеют гораздо меньший уровень КОЕ в легких и селезенках, чем животные, подвергнутые ложной иммунизации. Важно отметить, что животные, иммунизированные любым рекомбинантным штаммом БЦЖ, имеют более низкий уровень КОЕ в легких и селезенках, чем животные, иммунизированные исходным штаммом БЦЖ Tice. Однако ни для одного из исследованных в данном эксперименте рекомбинантных штаммов не было выявлено улучшенных свойств в сравнении с рБЦЖ30 Tice I.
В четвертом эксперименте самцов морских свинок линии Хартли (Hartley) весом 250-300 граммов, не содержащих специфических патогенов, которые были выращены по методу аутбридинга и получены от компании Charles River Breeding Laboratories, в группах по 6 животных подвергают внутрикожной иммунизации с содержанием 103 КОЕ одного из указанных ниже штаммов:
Группа I: БЦЖ Tice, исходный контрольный вариант.
Группа J: рБЦЖ30 Tice I (pSMT3-MTB30).
Группа K: рБЦЖ30 Tice III (pNBV1-MTB30).
Группа L: рБЦЖ23,5 Tice II (pNBV1-MTB23,5).
Группа M: рБЦЖ30/23,5 Tice IIA (pNBV1-MTB30/23,5↑↑).
Группа N: рБЦЖ30/23,5 Tice IIB (pNBV1-MTB30/23,5↑↓).
Группа O: рБЦЖ32A Tice I (pNBV1-MTB32A).
Группа P: ложная иммунизация только буфером (шесть животных).
Через девять недель после иммунизации у морских свинок в указанных выше группах I-P выбривают спину. Животным, иммунизированным штаммом, экспрессирующим р30 (группы I, J, K, M и N), и 6 животным в группе Р с ложной иммунизацией подкожно вводят инъекцию 10 мкг очищенного рекомбинантного крупного внеклеточного белка M. tuberculosis размером 30 кДа (р30) в 100 мкл фосфатно-буферного раствора. Животных, иммунизированных штаммом, экспрессирующим р23,5 (группы L, M, N), и 6 животных, подвергнутых ложной иммунизации в группе Р, дополнительно подвергают кожному тесту с использованием 10 мкг очищенного рекомбинантного крупного внеклеточного белка M. tuberculosis размером 23,5 кДа в 100 мкл фосфатно-буферного раствора. Животным путем инъекции вводят штамм, экспрессирующий р32A (группа О), и 6 животных, подвергнутых ложной иммунизации в группе Р, подвергают кожному тесту, с использованием 10 мкг очищенного рекомбинантного крупного внеклеточного белка M. tuberculosis размером 32А кДа в 100 мкл фосфатно-буферного раствора. Через 24 часа измеряют диаметр эритемы и уплотнения.
Результаты, приведенные в таблице 11, показывают, что животные, иммунизированные исходным штаммом БЦЖ Tice (группа А), не демонстрируют признаков эритемы и уплотнения при тестировании с использованием р30, тогда как животные (группы J, K, M, N), иммунизированные штаммами, экспрессирующими рекомбинантный белок размером 30 кДа, имеют выраженную эритему и уплотнение. Кроме того, животные (группы K, M и N), иммунизированные штаммами, экспрессирующими р30 в большем количестве, чем рБЦЖ30 Tice I и с использованием промотора, полученного из участка, расположенного перед геном белка размером 30 кДа, демонстрируют более выраженное уплотнение, что является более надежным индикатором кожной гиперчувствительности замедленного типа, чем эритема, в сравнении с животными, имунизированными рБЦЖ30 Tice I. Животные (группы L, M и N), иммунизированные рекомбинантным штаммом БЦЖ, экспрессирующим р23,5, белок, который отсутствует в исходном штамме БЦЖ, демонстрируют выраженные проявления эритемы и уплотнения в ответ на введение р23,5, тогда как животные с ложной иммунизацией характеризуются небольшой эритемой и отсутствием уплотнения при введении р23,5. Животные (группа О), иммунизированные рекомбинантным штаммом БЦЖ, осуществляющим сверхэкспрессию р32А, имеют более выраженные проявления эритемы и уплотнения в ответ на введение белка 32А кДа, чем животные, подвергнутые ложной иммунизации.
Дополнительно, через десять недель после иммунизации у нескольких морских свинок в группах I-P берут образцы крови и определяют в сыворотке титры антител на очищенный рекомбинантный крупный внеклеточный белок M. tuberculosis размером 30 кДа (р30), на крупный внеклеточный белок 32А кДа (р32А) и крупный внеклеточный белок размером 23,5 кДа (р23,5). Титры антител определяют методом ELISA и вычисляют величины, обратные показателю титра антител, для каждого животного. На фиг.6 графически изображены полученные результаты.
В пятом эксперименте, разработанном для демонстрации наличия защиты от инфекции у иммунизированных млекопитающих, морские свинки линии Хартли (Hartley), не содержащие конкретного патогена, весом 250-300 г, которые были выращены по методу аутбридинга и получены от компании Charles River Breeding Laboratories, в группах по 6 животных подвергают внутрикожной иммунизации с содержанием по 103 КОЕ одного из указанных ниже штаммов:
Группа I: БЦЖ Tice, исходный контрольный вариант.
Группа J: рБЦЖ30 Tice I (pSMT3-MTB30).
Группа K: рБЦЖ30 Tice III (pNBV1-MTB30).
Группа L: рБЦЖ23,5 Tice II (pNBV1-рMTB23,5).
Группа M: рБЦЖ30/23,5 Tice IIA (pNBV1-MTB30/23,5↑↑).
Группа N: рБЦЖ30/23,5 Tice IIB (pNBV1-MTB30/23,5↑↓).
Группа O: рБЦЖ32A Tice I (pNBV1-MTB32A).
Группа P: 12 животных, подвергнутых ложной иммунизации буфером, не содержащим антиген.
Через девять недель после иммунизации и сразу после кожного теста всех животных в группах I-P подвергают контрольному заражению аэрозолем с использованием 10 мл суспензии из единичных клеток, содержащей 5×104 колониеобразующих единиц (КОЕ) M. tuberculosis. (Перед проведением контрольного заражения провоцирующий штамм M. tuberculosis Erdman [ATCC 35801] пассируют на морских свинках, выращенных по методу аутбридинга, для поддержания вирулентности, культивируют на агаре 7Н11, осторожно обрабатывают ультразвуком с получением суспензии единичных клеток и замораживают при температуре -70°С.) Данная доза аэрозоля доставляет ˜20 живых бацилл в легкие каждого животного. Используют воздушно-капельный способ инфекции, поскольку он представляет собой естественный способ инфекции для легочного туберкулеза. Используют большую дозу с тем, чтобы вызвать клинически выраженные признаки заболевания у 100% контрольных животных в течение относительно короткого периода времени (10 недель). После этого морских свинок помещают по одному в клетки из нержавеющей стали, находящиеся в ламинарном боксе, закрытом от биологического заражения, и позволяют свободный доступ к стандартной лабораторной пище и воде. Животных осматривают на наличие признаков заболевания и взвешивают еженедельно в течение 10 недель и затем подвергают эвтаназии. У каждого животного удаляют правое легкое и селезенку и культивируют для определения уровня КОЕ M. tuberculosis. Полученные результаты приведены в таблице 12 ниже.
(средний диаметр ±СКО) (мм)
(средний диаметр ±СКО) (мм)
Результирующая прибавка веса после контрольного заражения аэрозольной формой вирулентного штамма M. tuberculosis Erdman
(средний вес ±СКО) (г)
(средний вес ±СКО) (г)
неделя 0-10
(среднее значение ± СКО)
Число колониеобразующих единиц (КОЕ) M. tuberculosis в легких и селезенках животных, подвергнутых контрольному заражению аэрозолем с использованием штамма M. tuberculosis Erdman
Объединенные результаты экспериментов 1 и 2
(среднее значение ±СКО)
(среднее значение ±СКО)
Результаты статистического анализа (ANOVA)
Уровень КОЕ в легких и селезенке
Объединенные результаты экспериментов 1 и 2
Число колониеобразующих единиц (КОЕ) M. tuberculosis в легком и селезенке животных, подвергнутых контрольному заражению аэрозолем с использованием штамма M. tuberculosis Erdman:
Животных иммунизируют БЦЖ, или БЦЖ + рекомбинантный белок М. tuberculosis размером 30 кДа в адъюванте, или подвергают ложной иммунизации
(среднее значение ±СКО)
(среднее значение ±СКО)
Число колониеобразующих единиц (КОЕ) M. tuberculosis в легком и селезенке животных, подвергнутых контрольному заражению аэрозолем с использованием штамма M. tuberculosis Erdman:
Животных иммунизируют живыми рекомбинантными клетками М. smegmatis, экспрессирующими крупный внеклеточный белок М. tuberculosis размером 30 кДа (рM. smegmatis30)
(среднее значение ±СКО)
(среднее значение ±СКО)
Число колониеобразующих единиц (КОЕ) M. tuberculosis в легком и селезенке животных, подвергнутых контрольному заражению аэрозолем с использованием штамма M. tuberculosis Erdman:
Животных иммунизируют микросферами, которые имеют примерно тот же размер, что и БЦЖ, и которые, как и БЦЖ, медленно высвобождают крупный внеклеточный белок М. tuberculosis размером 30 кДа (р30)
Животных иммунизируют липосомами, которые содержат крупный внеклеточный белок М. tuberculosis размером 30 кДа (р30)
(среднее значение ±СКО)
(среднее значение ±СКО)
(10 мг Ч1)
(3,3 мг Ч3)
Экспрессия рекомбинантных белков рекомбинантными штаммами БЦЖ Tice
Кожная реакция гиперчувствительности замедленного типа (DTH) на очищенный рекомбинантный крупный внеклеточный белок M. tuberculosis размером 30 кДа (р30) и крупный внеклеточный белок размером 23,5 кДа (р23,5)
(мм±СКО)
р23,5
0±0
0±0
р23,5
10,3±2,9
7,3±2,8
р23,5
7,6±2,2
5,6±2,2
р23,5
0±0
0±0
Защитный иммунитет в отношении контрольного заражения аэрозолем:
число КОЕ в легком и селезенке
Кожная реакция гиперчувствительности замедленного типа (DTH) на очищенный рекомбинантный крупный внеклеточный белок M. tuberculosis размером 30 кДа (р30) и крупный внеклеточный белок размером 23,5 (р23,5)
(мм±СКО)
р23,5
9,3±1,9
8,6±1,9
р23,5
9,0±2,3
9,0±2,3
р23,5
р32А
2,8±1,3
0,8±0,5
0±0
0±0
Защитный иммунитет в отношении контрольного заражения аэрозолем:
число КОЕ в легких и селезенках
Приведенные ниже примеры иллюстртруют новый аспект настоящего изобретения. Каждый пример иллюстрирует способ доставки иммуногенов по настоящему изобретению с использованием подхода, близкого, но отличающегося от подхода по настоящему изобретению, с использованием иммуногенной композиции. А именно: в примере 1 показано, что в случае введения иммуногенов по настоящему изобретению вместе с БЦЖ, но без достижения in vivo экспрессии БЦЖ, высокий уровень защитного иммунитета не создается.
В примере 2 показано, что экспрессия in vivo иммуногенов по настоящему изобретения с использованием Mycobacterium sp., близких к БЦЖ, но не способных реплицироваться в организме-хозяине млекопитающего, не индуцирует значительных уровней защиты против контрольного заражения M. tuberculosis. Результаты примеров 3 и 4 показывают, что медленное высвобождение иммуногенов по настоящему изобретению синтетической иммуногенной композиции с микроносителями также не может индуцировать значительных уровней защиты против контрольного заражения M. tuberculosis.
В примере 5 описан репрезентативный способ введения ауксотрофных вариантов по настоящему изобретению. Аналогично, в примере 6 подробно описывается использование неауксотрофных аттенюированных штаммов по настоящему изобретению.
ПРИМЕРЫ
Таким образом, приведенные ниже примеры служат для пояснения тех совершенно неожиданных и замечательных преимуществ, существенных для области иммунологии инфекционных заболеваний, которыми обладают иммуногенные композиции на основе внутриклеточного патогена по настоящему изобретению. Указанные примеры даны лишь с иллюстративной целью и не предназначены для ограничения настоящего изобретения.
ПРИМЕР 1
Иммунизация морских свинок БЦЖ плюс рекомбинантный крупный внеклеточный белок M. tuberculosis размером 30 кДа (р30) индуцирует высокий уровень защиты против контрольного заражения M. tuberculosis
Авторы предварительно иммунизируют морских свинок, используя БЦЖ плюс р30 в мощном адъюванте (SAF, Syntex Adjuvant Formulation). Белок р30 (100 мкг на иммунизацию) вводят внутрикожно три раза. При этом в ответ на р30 индуцируется сильная реакция гиперчувствительности замедленного типа на коже (C-DTH) (фиг.5). Фактически, реакция C-DTH сравнима с реакцией, индуцированной рекомбинантной БЦЖ, которая экспрессирует р30. Тем не менее, иммунизация с использованием и БЦЖ, и р30 не индуцирует высокого уровня защиты против контрольного заражения с использованием M. tuberculosis (таблица 5). Животные, иммунизированные с использованием и БЦЖ, и р30, не имеют сниженного числа КОЕ в легких и селезенке, по сравнению с животными, иммунизированными одной только БЦЖ. Данный результат полностью противоположен результату, описанному выше, в котором животные, иммунизированные рекомбинантной БЦЖ, экспрессирующей р30, демонстрируют высокий уровень защиты при проведении контрольного заражения M. tuberculosis.
ПРИМЕР 2
Иммунизация морских свинок рекомбинантной M. smegmatis, экспрессирующей крупный внеклеточный белок M. tuberculosis размером 30 кДа (р30) в форме, неотличимой от нативной формы, не индуцирует высокого уровня защиты против контрольного заражения с использованием M. tuberculosis
В одном из тех экспериментов, в которых авторы иммунизировали животных БЦЖ, иммунизацию морских свинок проводили живыми рекомбинантными клетками M. smegmatis, экспрессирующими крупный внеклеточный белок M. tuberculosis размером 30 кДа (р30) в форме, неотличимой от нативной формы. Экспрессия и секреция крупного внеклеточного белка M. tuberculosis размером 30 кДа (р30) клетками M. smegmatis была равной или превышала соответствующие показатели у рекомбинантного штамма БЦЖ, экспрессирующего и секретирующего крупный внеклеточный белок M. tuberculosis размером 30 кДа. Кроме того, доза рекомбинантной M. smegmatis, 109 бактерий, была очень высокой, в один миллион раз превышавшей дозу рекомбинантной БЦЖ (103 бактерий), взятой для того, чтобы наверняка компенсировать слабое размножение M. smegmatis в организме-хозяине животного. С целью дополнительной компенсации рекомбинантную M. smegmatis вводят три раза внутрикожно, тогда как рекомбинантную БЦЖ вводят всего один раз внутрикожно. Иммунизация рекомбинантной M. smegmatis, экспрессирующей белок р30, вызывает сильную реакцию гиперчувствительности замедленного типа на коже (C-DTH) в ответ на р30. Фактически, реакция C-DTH была сравнима или превосходила реакцию, индуцированную рекомбинантной БЦЖ, экспрессирующей р30. Тем не менее, живые рекомбинантные клетки M. smegmatis, экспрессирующие крупный внеклеточный белок M. tuberculosis размером 30 кДа, не индуцируют высокого уровня защиты против контрольного заражения M. tuberculosis (таблица 6). Животные, иммунизированные живыми рекомбинантными клетками M. smegmatis, экспрессирующими крупный внеклеточный белок M. tuberculosis размером 30 кДа, не имеют меньшего числа КОЕ в легких и селезенке, чем животные, иммунизированные только одной БЦЖ. Данный результат полностью противоположен результату, описанному выше, в котором животные, иммунизированные рекомбинантной БЦЖ, экспрессирующей р30, демонстрируют высокий уровень защиты при контрольном заражении с использованием M. tuberculosis.
ПРИМЕР 3
Иммунизация морских свинок микросферами, которые имеют примерно тот же размер, что и БЦЖ, и которые, как и БЦЖ, медленно высвобождают крупный внеклеточный белок M. tuberculosis размером 30 кДа (р30) в течение 60-90 дней, не индуцирует высокий уровень защиты от контрольного заражения с использованием M. tuberculosis
В одном из тех экспериментов, в которых авторы проводили иммунизацию животных с использованием рБЦЖ30 и БЦЖ, для иммунизации морских свинок использовали микросферы, которые имеют примерно тот же размер, что и БЦЖ, и которые, как и БЦЖ, медленно высвобождают крупный внеклеточный белок M. tuberculosis размером 30 кДа (р30) в течение 60-90 дней. Одну группу животных подвергают однократной иммунизации микросферами, содержащими 10 мг р30. Другую группу животных подвергают иммунизации три раза с использованием микросфер, содержащих 3,3 мг р30. По расчетам данное количество существенно превышает количество белка р30, экспрессируемого рекомбинантным штаммом БЦЖ. Иммунизация при любом режиме введения микросфер индуцирует сильную кожную реакцию гиперчувствительности замедленного типа (C-DTH) в ответ на введение р30. Фактически, реакция C-DTH была сравнима с реакцией, индуцированной рекомбинантной БЦЖ, экспрессирующей р30. Тем не менее, иммунизация микросферами, которые имеют примерно тот же размер, что и БЦЖ, и которые, как и БЦЖ, медленно высвобождают крупный внеклеточный белок М. tuberculosis размером 30 кДа, не индуцирует высокий уровень защиты против контрольного заражения с использованием M. tuberculosis (таблица 7). Животные, иммунизированные микросферами, не имеют меньшего числа КОЕ в легких и селезенке, чем животные, иммунизированные только одной БЦЖ. Данный результат полностью противоположен результату, описанному выше, в котором животные, иммунизированные рекомбинантной БЦЖ, экспрессирующей р30, демонстрируют высокий уровень защиты при контрольном заражении M. tuberculosis.
ПРИМЕР 4
Иммунизация морских свинок липосомами, содержащими крупный внеклеточный белок M. tuberculosis размером 30 кДа, не индуцирует высокого уровня защиты против контрольного заражения M. tuberculosis
В рамках такого же эксперимента, который был описан в примере 3, авторы иммунизировали морских свинок с использованием липосом, содержащих крупный внеклеточный белок M. tuberculosis размером 30 кДа. Животных иммунизируют три раза с использованием липосом, содержащих 50 мкг р30. При этом, в ответ на введение р30, индуцируется умеренная кожная реакция гиперчувствительности замедленного типа (C-DTH). Реакция по типу C-DTH была более выраженной, чем реакция, индуцированная БЦЖ и контрольными липосомами, и была меньше, чем в случае индукции рекомбинантной БЦЖ, экспрессирующей р30. Тем не менее, иммунизация липосомами, содержащими крупный внеклеточный белок M. tuberculosis размером 30 кДа, не индуцирует высокого уровня защиты при контрольном заражении M. tuberculosis (таблица 7). Животные, иммунизированные с использованием липосом, содержащих крупный внеклеточный белок M. tuberculosis размером 30 кДа, не имеют меньшего числа КОЕ в легких и селезенке, чем животные, иммунизированные одной только БЦЖ. Данный результат полностью противоположен результату, описанному выше, в котором животные, иммунизированные рекомбинантной БЦЖ, экспрессирующей р30, демонстрируют высокий уровень защиты при контрольном заражении M. tuberculosis.
ПРИМЕР 5
Использование ауксотрофных штаммов с регулируемым ростом
Вакцины ауксотрофных штаммов с регулируемым ростом используют следующим образом. Индивидуумов с ослабленным иммунитетом иммунизируют вакцинами, например штаммом БЦЖ, ауксотрофным по триптофану. Затем, сразу после введения такой индивидуум начинает вводить в в свое питание достаточное количество триптофана так, чтобы уровни размножения ауксотрофа были нормальными и чтобы осуществлялся высокий уровень индукции защитного иммунитета от туберкулеза. У большинства людей размножение рекомбинантной БЦЖ не вызывает проблем со здоровьем. Организм размножается в тканях до умеренных уровней и затем очищается иммунной системой. Однако у некоторых людей с ослабленным иммунитетом могут развиться диссеминированные заболевания или другие проблемы, связанные с размножением бактерий. В этом случае таким индивидуумам необходимо сразу прекратить прием пищевой добавки. В отсутствие пищевой добавки ауксотроф быстро погибает, и устраняются вызванные им проблемы со здоровьем.
Данный подход является особенно привлекательным для развивающихся стран, где медицинская помощь может быть не всегда доступна. Если индивидуум имеет неблагоприятные последствия иммунизации, у него нет необходимости обращаться за квалифицированной медицинской помощью или принимать антибиотики, что может быть дорогостоящим или не всегда доступным. Такой индивидуум всего лишь прекращает прием пищевой добавки, что представляет собой пассивное, а не активное действие.
ПРИМЕР 6
Использование неауксотрофных аттенюированных штаммов
Указанные штаммы вводят лицам с ослабленным иммунитетом обычным способом, как и вакцину БЦЖ, то есть без каких-либо пищевых добавок.
Иммуногенные композиции по настоящему изобретению представляют совершенно новый подход к индукции иммунных ответов против внутриклеточных патогенов. С помощью серии хорошо разработанных экспериментов и продуманных анализов авторы настоящего изобретения всесторонне продемонстрировали, что защитный иммунитет достигается лишь в том случае, когда точно отобранный внутриклеточный патоген или близко родственный ему вид трансформируют для экспрессии рекомбинантных внеклеточных белков того же или другого внутриклеточного патогена, в соответствии с подходом настоящего изобретения.
Настоящее изобретение может также использоваться для диагностики, достижения профилактического и терапевтического эффекта одновременно против множества имеющихся внутриклеточных патогенов. Например, может быть разработана рекомбинантная аттенюированная внутриклеточная иммуногенная композиция типа M. bovis для экспрессии защитных иммуногенов против M. tuberculosis и Legionella sp. одновременно. Следовательно, при введении таких иммуногенных композиций может быть достигнута значительная эффективность. Неограничивающие примеры рекомбинантной БЦЖ, экспрессирующей крупные внеклеточные белки M. tuberculosis, являются не только полноценной иллюстрацией настоящего изобретения, но отражают значительный прогресс в медицине и вклад для человечества в целом.
Если не указано иного, то следует понимать, что все цифры, отражающие количество ингредиентов, свойства, такие как молекулярная масса, условия реакции и тому подобное, используемые в описании и в формуле изобретения, могут быть изменены во всех тех случаях, которые обозначены термином "примерно". Соответственно, если не указано иного, то цифровые параметры, приведенные в описании и в формуле изобретения, являются приблизительными величинами, которые можно изменять в зависимости от тех свойств, которые желательно достичь при осуществлении настоящего изобретения. В качестве очень приблизительной оценки, но не с целью ограничения применения принципа эквивалентов к области данного изобретения, следует отметить, что каждый приведенный числовой параметр следует интерпретировать по меньшей мере как в виде указанных значимых цифр, так и в округленном виде, получаемом при применении обычной методики округления. Независимо от того, что цифровые диапазоны и параметры, определяющие широкую область настоящего изобретения, являются приблизительными, численные значения, указанные в конкретных примерах, даются с наибольшей возможной точностью. Однако любое численное значение содержит определенную долю ошибки, обязательно возникающую из-за существования стандартного отклонения, свойственного соответствующим методам измерения.
Указанные перед терминами определенные и неопределенные артикли, а также аналогичные символы, используемые в контексте описания настоящего изобретения (особенно в контексте прилагаемой ниже формулы изобретения), приведены таким образом, чтобы охватить как вариант единственного объекта, так и множественных объектов, если особо не оговорено иное, или по контексту явно не следует иного. В данном случае указание диапазонов значений служит для упрощения способа отсылки к каждому отдельному значению в данном диапазоне. Если не указано иного, то каждое отдельное значение включается в описание, как если бы оно было отдельно указано в нем. Все способы, раскрытые в настоящем описании, могут быть осуществлены в любом подходящем порядке, если не указано иного или неясно из контекста. Использование в настоящем описании любого и всех примеров или конкретного языкового стиля (например, термина "такой как") служит лишь для лучшей иллюстрации изобретения и не налагает каких-либо ограничений на область заявленного изобретения. Никакие элементы языкового стиля в настоящем описании не должны рассматриваться как указывающие на какой-либо незаявляемый элемент, существенный для практики осуществления настоящего изобретения.
Объединение в группы альтернативных элементов или вариантов изобретения, раскрытого в настоящем описании, не должно рассматриваться как ограничивающее. Каждый член группы может рассматриваться и заявляться как отдельно, так и в любом сочетании с другими имеющимися в ней элементами. Предполагается, что один или более представителей данной группы могут быть включены или исключены из нее с точки зрения удобства и/или патентоспособности. В случае, если происходит такое включение или исключение, то описание будет содержать данную группу в модифицированном виде, который будет соответствовать приведенному описанию всех групп Маркуши, использованных в прилагаемой формуле изобретения.
В описании заявки приводятся предпочтительные варианты настоящего изобретения, включая наилучший способ, известный авторам, для осуществления настоящего изобретения. Разумеется, специалисты в настоящей области могут, на основе приведенного описания, внести другие изменения в показанные предпочтительные варианты. Авторы полагаются на практические навыки специалистов, достаточные для внесения такого рода изменений в соответствующем виде, и считают, что данное изобретение может быть осуществлено иначе, чем конкретно раскрыто в настоящем описании. Соответственно, настоящее изобретение включает все варианты и эквиваленты объекта, перечисленные в прилагаемой формуле изобретения в рамках, допустимых применяемым законодательством. Кроме того, любое сочетание указанных выше элементов во всех возможных вариациях охватывается настоящим изобретением, если особо не указано иное или из контекста явно не следует противоположное.
Кроме того, на протяжении всего описания даются цифровые ссылки на патенты и опубликованные материалы. Каждая из указанных выше ссылок и печатных публикаций включена в настоящее описание в качестве ссылки в полном объеме.
В заключение, должно быть понятно, что варианты осуществления настоящего изобретения, раскрытые в приведенном описании, являются иллюстративными примерами принципов настоящего изобретения. Другие варианты, которые могут быть использованы, также входят в область настоящего изобретения. Таким образом, к примеру, но не для ограничения, следует отметить, что в соответствии с приведенным описанием могут быть использованы альтернативные формы представления настоящего изобретения. Соответственно, настоящее изобретение не ограничивается тем, что в нем точно показано и описано.
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ, ВКЛЮЧЕННЫЕ В НАСТОЯЩЕЕ ОПИСАНИЕ В КАЧЕСТВЕ ССЫЛОК
1. Fine, P.E.M. 1989. The BCG story: Lessons from the past and implications for the future. Rev. Infect. Dis. 11 (Suppl. 2): S353-S359.
2. Colditz, G.A. T.F. Brewer, C.S. Berkey, M.E. Wilson, E. Burdick, H.V. Fineberg, and Mosteller. 1994. Effecacy of BCG vaccine in the prevention of tuberculosis. Meta-analysis of the published literature. JAMA 271: 698-702.
3. Horwitz, M.A., G. Harth, B.J. Dillon, and S. Malese-Galic. 2000. Recombinant BCG vaccines expressing the Mycobacterium tuberculosis 30 kDa major secretory protein induce greater protective immunity against tuberculosis than conventional BCG vaccines in a highly susceptible animal model. Proc. Natl. Acad. Sci. (USA) 97: 13853-13858.
4. Horwitz, M.A., B.-W.E. Lee, B.J. Dillon, and G. Harth. 1995. Protective immunity against tuberculosis induce by vaccination with major extracellular proteins of Mycobacterium tuberculosis. Proc. Natl. Acad. Sci. (USA) 92: 1530-1534.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИНЫ РЕКОМБИНАНТНЫХ ВНУТРИКЛЕТОЧНЫХ ПАТОГЕНОВ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2001 |
|
RU2266132C2 |
| Рекомбинантный штамм Mycobacterium bovis rBCG-1 на основе вакцинного штамма Mycobacterium bovis BCG strain Russia 368 | 2022 |
|
RU2807732C1 |
| Рекомбинантный штамм вируса гриппа A/PR8-NS124-TB10.4-2A-HspX и способ специфической профилактики туберкулеза легких с использованием вакцины мукозального применения на его основе | 2019 |
|
RU2726106C1 |
| ПОЛИАНТИГЕННАЯ ВАКЦИНА ДЛЯ ПРОФИЛАКТИКИ И ВСПОМОГАТЕЛЬНОГО ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА | 2019 |
|
RU2724896C1 |
| ВАКЦИНА И СПОСОБЫ ОБНАРУЖЕНИЯ И ПРОФИЛАКТИКИ ФИЛЯРИОЗА | 2021 |
|
RU2832185C1 |
| КОМПОЗИЦИЯ РЕКОМБИНАНТНЫХ БЕЛКОВ, СПОСОБ ПОЛУЧЕНИЯ ТАКОЙ КОМПОЗИЦИИ, ФАРМАЦЕВТИЧЕСКИЙ НАБОР РЕАГЕНТОВ ДЛЯ ИММУНОТЕРАПИИ И ПРОФИЛАКТИЧЕСКОЙ ВАКЦИНАЦИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ АНОГЕНИТАЛЬНОЙ СФЕРЫ, СПОСОБ ИММУНОТЕРАПИИ И ПРОФИЛАКТИЧЕСКОЙ ВАКЦИНАЦИИ НА ЕГО ОСНОВЕ | 2002 |
|
RU2229307C1 |
| ФЛАВИВИРУС С ДВУХКОМПОНЕНТНЫМ ГЕНОМОМ И ЕГО ИСПОЛЬЗОВАНИЕ | 2008 |
|
RU2527891C2 |
| ПРОТИВОЧУМНАЯ ВАКЦИНА | 1996 |
|
RU2197988C2 |
| ЭКСПРЕССИРУЮЩАЯ СИСТЕМА | 2001 |
|
RU2385348C2 |
| ВАКЦИННАЯ КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ТУБЕРКУЛЕЗНОЙ ИНФЕКЦИИ И ГЕНЕТИЧЕСКИЕ КОНСТРУКЦИИ ДЛЯ ПОЛУЧЕНИЯ ДЕЙСТВУЮЩИХ КОМПОНЕНТОВ ЭТОЙ КОМПОЗИЦИИ | 2003 |
|
RU2262351C1 |
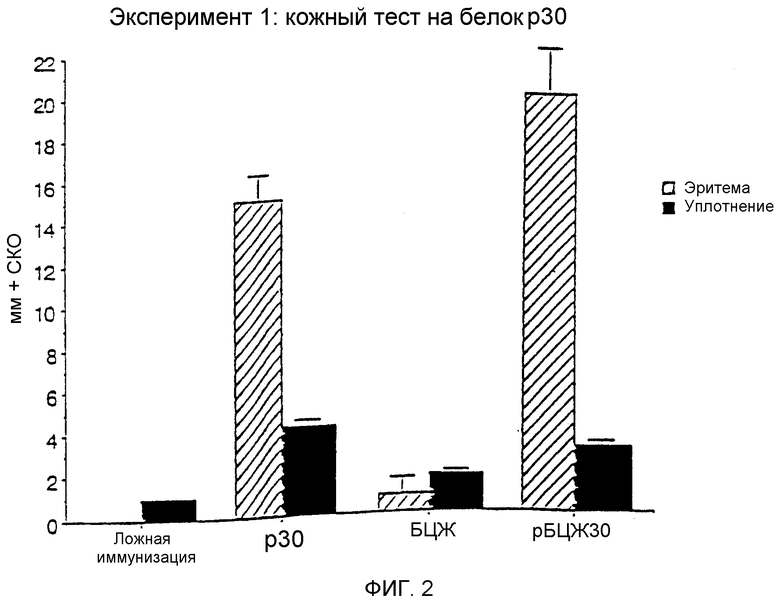
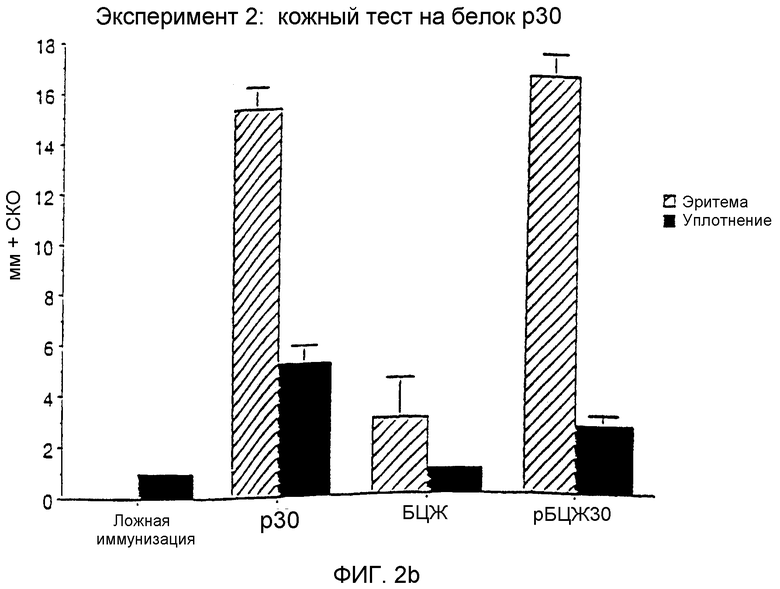
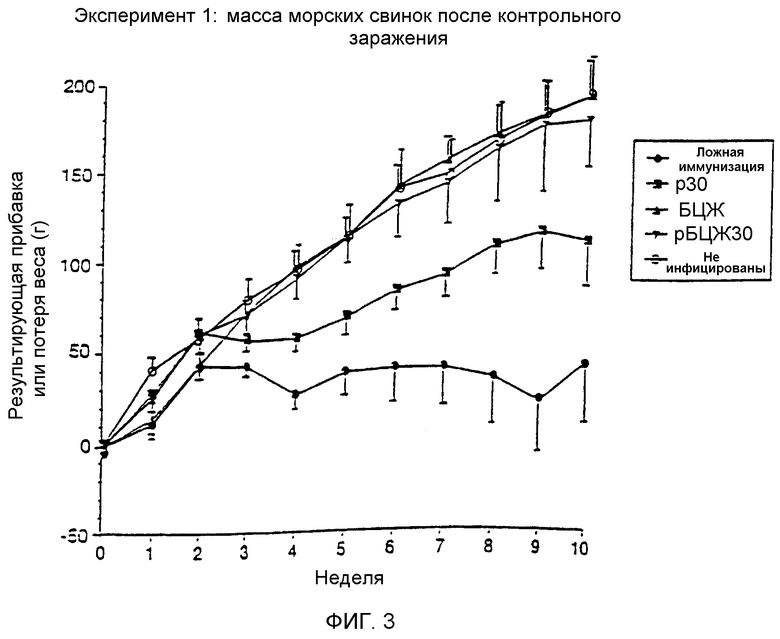
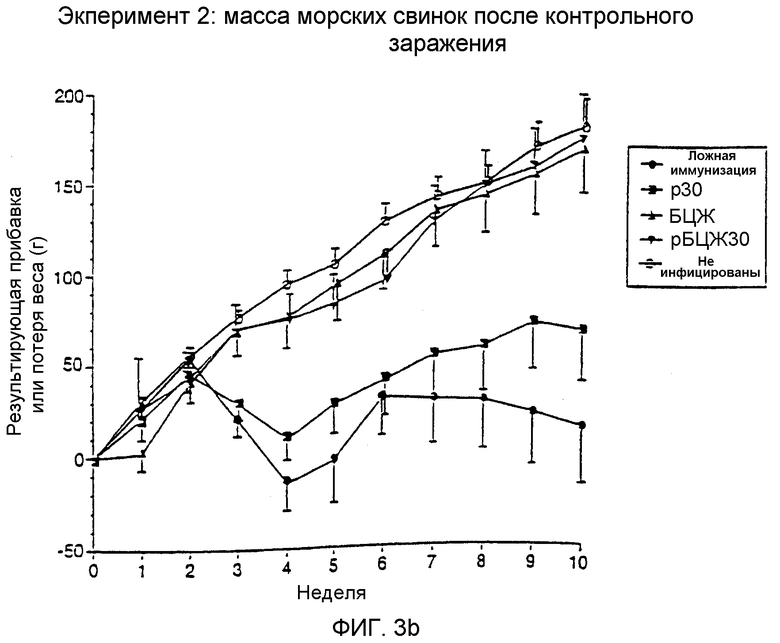
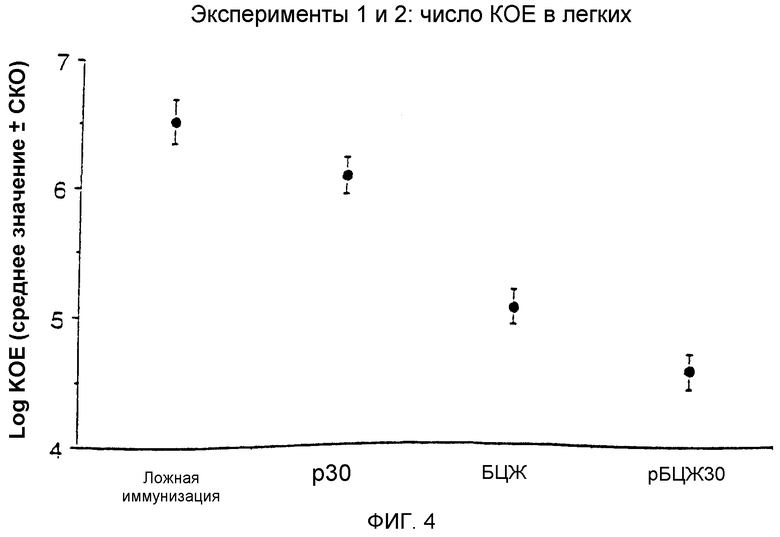
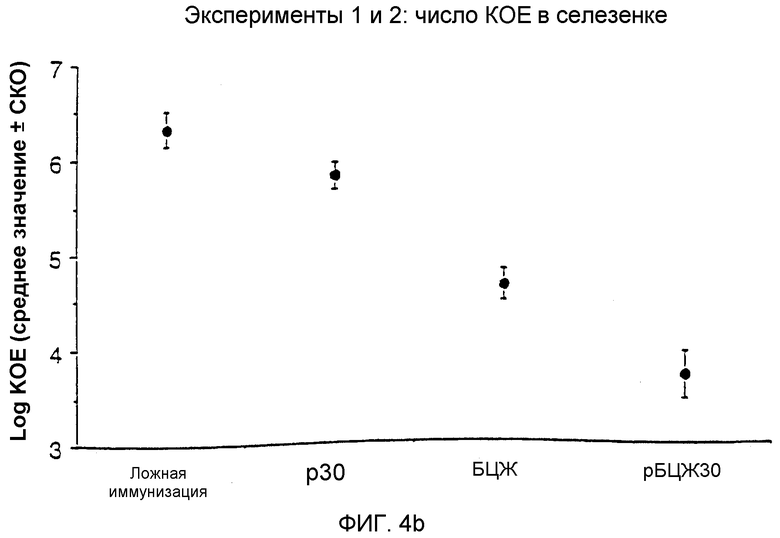
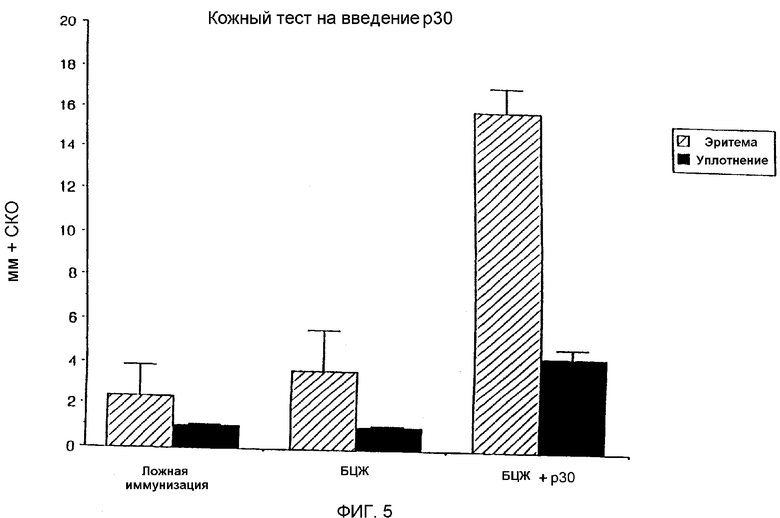
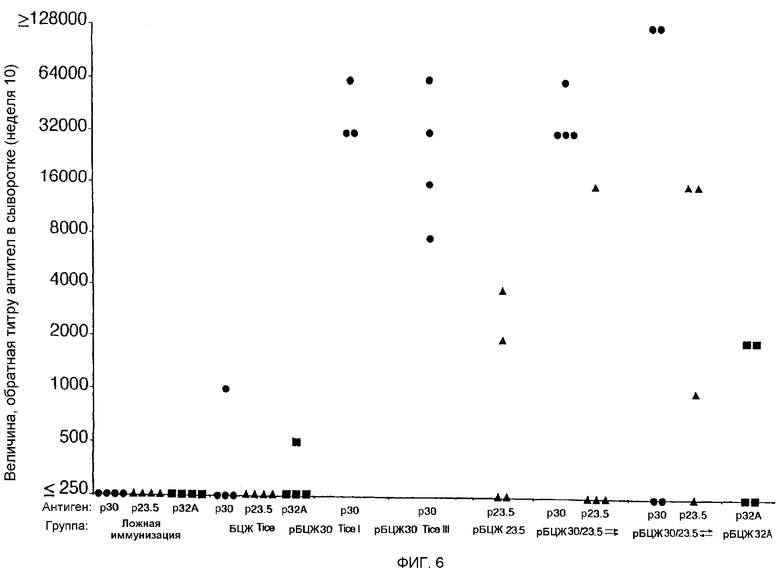
Представлены иммуногенные композиции, включающие рекомбинантные аттенюированные внутриклеточные патогены, например бациллу Кальмета-Герена (БЦЖ). Иммуногенная композиция включает, в частности, БЦЖ, содержащую последовательность внехромосомной нуклеиновой кислоты, которая включает ген, кодирующий крупный внеклеточный белок микобактерий размером 23,5, 30 и/или 32 кДа, при этом крупный внеклеточный неслитый белок микобактерий сверхэкспрессируется и секретируется. Вариантом иммуногенной композиции является композиция, содержащая рекомбинантную БЦЖ с регулируемым ростом. При введении иммуногенных композиций в организм млекопитающего указанные белки сверхэкспрессируются и секретируются, вызывая иммунную ответную реакцию организма на введенный антиген. Представленные в изобретении иммуногенные композиции обеспечивают надежный и безопасный защитный иммунитет. 2 н. и 8 з.п. ф-лы, 6 ил., 12 табл.
рекомбинантную бациллу Кальметта-Герена (БЦЖ), содержащую последовательность внехромосомной нуклеиновой кислоты, которая включает ген, кодирующий крупный внеклеточный белок микобактерий, выбранный из группы, состоящей из белков размером 23,5 кДа, 30 кДа, 32 кДа и их сочетаний, где указанный крупный внеклеточный белок микобактерий сверхэкспрессируется и секретируется.
| US 5854055 A, 29.12.1998 | |||
| US 5504005 A, 02.04.1996 | |||
| RU 96119399 A, 20.12.1998 | |||
| ИММУНОМОДУЛИРУЮЩЕЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1996 |
|
RU2112543C1 |
Авторы
Даты
2008-11-10—Публикация
2003-09-30—Подача