Предлагаемое изобретение относится к области аналитической химии и может быть использовано в медицинских, ветеринарных и других исследованиях для качественного и количественного определения гидроксиметилхиноксилиндиоксида и его примесей.
В настоящее время к лекарственным субстанциям и препаратам предъявляются три требования: эффективность, безопасность, качество. Качество лекарственной субстанции и лекарственного препарата определяется установлением его подлинности, определением его чистоты и количественным содержанием чистого вещества в препарате. Присутствие в лекарственных субстанциях примесей может не только снижать терапевтический эффект, но и вызывать нежелательное побочное действие лекарственного препарата, включающего такую субстанцию.
Проблема определения примеси в лекарственной субстанции гидроксиметилхиноксилиндиоксида связана с проблемами разделения активного вещества и примесей. Решить данную проблему можно с помощью метода высокоэффективной жидкостной хроматографии (ВЭЖХ).
Известен способ определения гидроксиметилхиноксилиндиоксида в водном растворе методом ВЭЖХ в изократическом режиме с использованием хроматографической колонки размером 300×4,0 мм, заполненной сорбентом µ Bondapak CN, в качестве подвижной фазы используют смесь 0,05 М фосфатно-аммиачный буфер (рН 2,5) с ацетонитрилом, минимальная определяемая концентрация 0,05 мг/л (ГОСТ Р ИСО 10993.13-99* Оценка биологического действия медицинских изделий).
Известен способ определения гидроксиметилхиноксилиндиоксида в крови и моче с помощью ВЭЖХ. Определение проводят на хроматографической колонке размером 600×2,0 мм, заполненной носителем марки Bio-SilA с размером частиц 25-35 мкм, в качестве подвижной фазы используют дистиллированную воду в изократическом режиме, минимальная определяемая концентрация 0,15 мкг/мл при пробе 20 мкл («Метод количественного определения диоксидина (гидроксиметилхиноксилиндиоксида) в крови и моче с помощью высокоэффективной жидкостной хроматографии». Химико-фармацевтический журнал, 1977, №9).
Известен способ определения гидроксиметилхиноксилиндиоксида в тканях рыб с помощью ВЭЖХ. Определение проводят на хроматографической колонке размером 2,1×50 мм, заполненной сорбентом BEN С18 с размером частиц 1,7 мкм, в качестве подвижной фазы используют смесь метанола (А) с 0,3% водным раствором муравьиной кислоты (В), в градиентном режиме: 0-2 мин, 10-63% А; 2-3 мин, 63% А, при температуре 40°С, для детектирования используют тройной квадрупольный масс-спектрометр (Journal of Separation Science, 2011, №34, p.469-474).
Известен способ определения примесей в гидроксиметилхиноксилиндиоксиде методом ТСХ. Определение проводят на хроматографических пластинках Силуфол УФ 254 или Кизельгель 60 F 254, используя в качестве подвижной фазы смесь хлороформа с этанолом 96% в соотношении 19:1 (ФСП 42-0144717605).
Известные способы хорошо себя зарекомендовали и пригодны для качественного и количественного определения или гидроксиметилхиноксилиндиоксида, или его примесей, однако ни один из известных способов не позволяет одновременно и за короткий промежуток времени определить гидроксиметилхиноксилиндиоксид и его примеси в лекарственной субстанции или лекарственном препарате.
В гидроксиметилхиноксилиндиоксиде присутствует как идентифицированная примесь хиноксидин, так и неидентифицированные примеси. Количественный контроль идентифицированной и неидентифицированных примесей является важным для определения качества лекарственной субстанции или лекарственного препарата.
Задачей предлагаемого изобретения является разработка способа одновременного определения за короткий промежуток времени содержания гидроксиметилхиноксилиндиоксида (ГХМД) и его примесей в субстанции ГХМД методом ВЭЖХ.
Поставленная задача решается предлагаемым способом определения содержания ГХМД и его примесей в субстанции ГХМД, включающим приготовление испытуемого раствора субстанции; приготовление стандартных растворов ГМХД и примесей; хроматографирование приготовленных растворов методом высокоэффективной жидкостной хроматографии с разделением на колонке С18 размером 50×3,0 мм, заполненной носителем с зернением 3,0 мкм, или размером 150×4,6 мм, заполненной носителем с зернением 5,0 мкм, с использованием в качестве подвижной фазы смеси воды с ацетонитрилом в соотношении от 90:10 до 95:5 или смеси 0,3% раствора муравьиной кислоты с ацетонитрилом в соотношении от 90:10 до 95:5 и ацетонитрила в режиме линейного градиента на хроматографе с использованием ультрафиолетового детектора; идентификацию ГХМД и его примесей на полученных хроматограммах по временам удерживания; расчет содержания ГХМД и его примесей в лекарственной субстанции ГХМД на основании расчетных формул.
Предпочтительно, чтобы ацетонитрил представлял собой ацетонитрил для хроматографии.
Предпочтительно, что носитель представляет собой обращенно-фазовый носитель.
Предпочтительно, что определение содержания ГХМД и его примесей проводят в лекарственной субстанции и лекарственном препарате.
Технический результат от использования предлагаемого изобретения заключается в создании эффективного способа, позволяющего с высокой точностью одновременно определить содержание ГХМД и его примесей в субстанции ГХМД. Кроме того, данный способ прост в исполнении и экономичен.
Предлагаемый способ осуществляется следующим образом:
готовят раствор испытуемого препарата и раствор стандартного образца (СО), последовательно хроматографируют на жидкостном хроматографе фирмы Waters, США с УФ-детектором при длине волны 260 нм и 240 нм с использованием хроматографической колонки С18 размером 50×3,0 мм, заполненной обращенно-фазным носителем с зернением 3,0 мкм, или размером 150×4,6 мм, заполненной обращенно-фазным носителем зернением 5,0 мкм, в режиме линейного градиента с использованием в качестве подвижной фазы (ПФ):
- смеси воды с ацетонитрилом для хроматографии в соотношении от 90:10 до 95:5 или смеси 0,3% раствора муравьиной кислоты с ацетонитрилом для хроматографии в соотношении от 90:10 до 95:5 - фаза А;
- ацетонитрила для хроматографии - фаза В, получая не менее трех хроматограмм каждого раствора. Находят площади пиков определяемых веществ на хроматограммах испытуемого и стандартного растворов и по формуле рассчитывают их содержание в анализируемой лекарственной субстанции.
Примеры конкретного применения предлагаемого способа
Способ определения содержания ГХМД и его примесей в лекарственной субстанции
Пример 1
Для приготовления испытуемого раствора образца лекарственной субстанции берут около 50 мг (точная навеска) ГХМД, растворяют в 50 мл воды в мерной колбе вместимостью 100 мл, доводят объем раствора водой до метки и перемешивают. 2 мл полученного раствора помещают в мерную колбу вместимостью 25 мл, доводят объем раствора смесью воды с ацетонитрилом (90:10) до метки, перемешивают и фильтруют через мембранный фильтр, отбрасывая первые порции фильтрата.
Для приготовления раствора стандартного образца (СО) ГХМД берут около 50 мг (точная навеска) его СО, растворяют в 50 мл воды в мерной колбе вместимостью 100 мл, доводят объем раствора водой до метки и перемешивают. 2 мл полученного раствора помещают в мерную колбу вместимостью 25 мл, доводят объем раствора смесью воды с ацетонитрилом (90:10) до метки, перемешивают и фильтруют через мембранный фильтр, отбрасывая первые порции фильтрата (раствор А).
1,0 мл раствора А помещают в мерную колбу вместимостью 10 мл, доводят объем раствора смесью воды с ацетонитрилом (90:10) до метки и перемешивают (раствор Б).
Для приготовления раствора стандартного образца (СО) идентифицированной примеси хиноксидина берут около 4 мг (точная навеска) его СО, помещают в мерную колбу вместимостью 200 мл, растворяют в 50 мл метанола, затем доводят объем раствора водой до метки и перемешивают (раствор 1).
2,5 мл раствора 1 СО хиноксидина помещают в мерную колбу вместимостью 25 мл, доводят объем раствора смесью воды с ацетонитрилом (90:10) до метки и перемешивают (раствор 2).
Для приготовления раствора стандартного образца (СО) ГХМД и хиноксидина берут 1,0 мл раствора Б и 2 мл раствора 2, помещают в мерную колбу вместимостью 10 мл, доводят объем раствора смесью воды с ацетонитрилом (90:10) до метки, перемешивают и фильтруют через мембранный фильтр, отбрасывая первые порции фильтрата.
По 20 мкл испытуемого раствора лекарственной субстанции ГХМД, раствора А СО ГХМД и раствора СО ГХМД и хиноксидина последовательно хроматографируют при температуре 25°С на жидкостном хроматографе с УФ-детектором и колонкой размером 150×4,6 мм с обращенно-фазным носителем YMC-Triart С18 с размером частиц 5,0 мкм в режиме линейного градиента с использованием в качестве подвижной фазы смеси воды с ацетонитрилом для хроматографии (90:10) и ацетонитрила для хроматографии. Получают не менее 3-х хроматограмм каждого раствора.
Состав подвижной фазы в течение анализа изменяется по следующей схеме:
Скорость потока подвижной фазы 1,0 мл/мин. Длина волны УФ-детектора 260 нм и 240 нм.
Рассчитывают площади пиков ГХМД и находят его количество в анализируемой субстанции ГХМД по формуле, %:
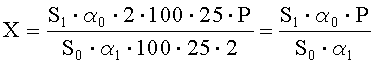
где S1 - среднее значение площади пика ГХМД на хроматограммах испытуемого раствора;
S0 - среднее значение площади пика ГХМД на хроматограммах раствора А СО;
α1 - навеска субстанции ГХМД в миллиграммах;
α0 - навеска СО ГХМД в миллиграммах;
Р - содержание активного вещества в СО ГХМД в процентах.
Рассчитывают площади пиков идентифицированной примеси хиноксидина и находят ее количество в анализируемой субстанции ГХМД по формуле, %:
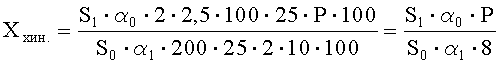
где S1 - среднее значение площади пика примеси хиноксидина на хроматограммах испытуемого раствора;
S0 - среднее значение площади пика хиноксидина на хроматограммах растворов СО ГХМД и хиноксидина;
α1 - навеска субстанции ГХМД в миллиграммах;
α0 - навеска СО хиноксидина в миллиграммах;
Р - содержание активного вещества в СО хиноксидина в процентах.
Рассчитывают площади пиков неидентифицированных примесей и находят их количество в анализируемой субстанции ГХМД по формуле, %:
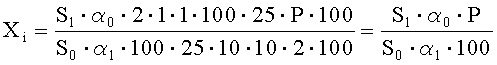
где S1 - среднее значение площади пика неидентифицированной примеси на хроматограммах испытуемого раствора;
S0 - среднее значение площади пика ГХМД на хроматограммах растворов СО ГХМД и хиноксидина;
α1 - навеска субстанции ГХМД в миллиграммах;
α0 - навеска СО ГХМД в миллиграммах;
Р - содержание активного вещества в СО ГХМД в процентах.
Хроматограммы испытуемого раствора лекарственной субстанции ГХМД, раствора А СО ГХМД и раствора СО ГХМД и хиноксидина, полученные с использованием колонки размером 150×4,6 мм с обращенно-фазным носителем YMC-Triart С18 с размером частиц 5,0 мкм, представлены на фиг.1, 2, 3.
Пример 2
Для приготовления испытуемого раствора образца лекарственной субстанции берут около 50 мг (точная навеска) ГХМД, растворяют в 50 мл воды в мерной колбе вместимостью 100 мл, доводят объем раствора водой до метки и перемешивают. 1 мл полученного раствора помещают в мерную колбу вместимостью 25 мл, доводят объем раствора смесью воды с ацетонитрилом (95:5) до метки, перемешивают и фильтруют через мембранный фильтр, отбрасывая первые порции фильтрата.
Для приготовления раствора стандартного образца (СО) ГХМД берут около 50 мг (точная навеска) его СО, растворяют в 50 мл воды в мерной колбе вместимостью 100 мл, доводят объем раствора водой до метки и перемешивают. 2 мл полученного раствора помещают в мерную колбу вместимостью 25 мл, доводят объем раствора смесью воды с ацетонитрилом (95:5) до метки, перемешивают и фильтруют через мембранный фильтр, отбрасывая первые порции фильтрата (раствор А).
1,0 мл раствора А помещают в мерную колбу вместимостью 10 мл, доводят объем раствора смесью воды с ацетонитрилом (95:5) до метки и перемешивают (раствор Б).
Для приготовления раствора стандартного образца (СО) хиноксидина берут 4 мг (точная навеска) его СО, помещают в мерную колбу вместимостью 200 мл, растворяют в 50 мл метанола, затем доводят объем раствора водой до метки и перемешивают (раствор 1).
2,5 мл раствора 1 СО хиноксидина помещают в мерную колбу вместимостью 25 мл, доводят объем раствора смесью воды с ацетонитрилом (95:5) до метки и перемешивают (раствор 2).
Для приготовления раствора стандартного образца (СО) ГХМД и хиноксидина берут 1,0 мл раствора Б и 1 мл раствора 2, помещают в мерную колбу вместимостью 10 мл, доводят объем раствора смесью воды с ацетонитрилом (95:5) до метки, перемешивают и фильтруют через мембранный фильтр, отбрасывая первые порции фильтрата.
По 10 мкл испытуемого раствора лекарственной субстанции ГХМД, раствора А СО ГХМД и раствора СО ГХМД и хиноксидина последовательно хроматографируют при температуре 25°С на жидкостном хроматографе с УФ-детектором и колонкой размером 50×3,0 мм с обращенно-фазным носителем YMC-Triart С18 с размером частиц 3,0 мкм в режиме линейного градиента с использованием в качестве подвижной фазы смеси воды с ацетонитрилом для хроматографии (95:5) и ацетонитрила для хроматографии. Получают не менее 3-х хроматограмм каждого раствора.
Состав подвижной фазы в течение анализа изменяется по следующей схеме:
Скорость потока подвижной фазы 0,6 мл/мин. Длина волны УФ-детектора 260 нм и 240 нм.
Рассчитывают площади пиков ГХМД и находят его количество в анализируемой субстанции ГХМД по формуле, %:
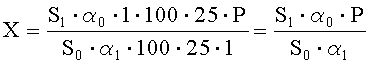
где S1 - среднее значение площади пика ГХМД на хроматограммах испытуемого раствора;
S0 - среднее значение площади пика ГХМД на хроматограммах раствора А СО;
α1 - навеска субстанции ГХМД в миллиграммах;
α0 - навеска СО ГХМД в миллиграммах;
Р - содержание активного вещества в СО ГХМД в процентах.
Рассчитывают площади пиков примеси хиноксидина и находят его количество в анализируемой субстанции ГХМД по формуле, %:
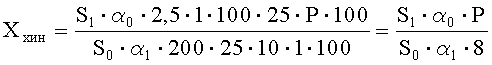
где S1 - среднее значение площади пика примеси хиноксидина на хроматограммах испытуемого раствора;
S0 - среднее значение площади пика хиноксидина на хроматограммах растворов СО ГХМД и хиноксидина;
α1 - навеска субстанции ГХМД в миллиграммах;
α2 - навеска СО хиноксидина в миллиграммах;
Р - содержание активного вещества в СО хиноксидина в процентах.
Рассчитывают площади пиков неидентифицированных примесей и находят их количество в анализируемой субстанции ГХМД по формуле, %:
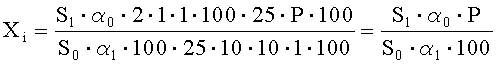
где S1 - среднее значение площади пика неидентифицированной примеси на хроматограммах испытуемого раствора;
S0 - среднее значение площади пика ГХМД на хроматограммах растворов СО ГХМД и хиноксидина;
α1 - навеска субстанции ГХМД в миллиграммах;
α2 - навеска СО ГХМД в миллиграммах;
Р - содержание активного вещества в СО ГХМД в процентах.
Хроматограммы испытуемого раствора лекарственной субстанции ГХМД, раствора А СО ГХМД и раствора СО ГХМД и хиноксидина, полученные с использованием колонки размером 50×3,0 мм с обращенно-фазным носителем YMC-Triart С18 с размером частиц 3,0 мкм, представлены на фиг.4, 5, 6.
Способ определения содержания ГХМД и его примесей в мази
Пример 3
Для приготовления испытуемого раствора навеску мази массой около 1 г (точная навеска) помещают в коническую колбу вместимостью 100 мл, прибавляют 50 мл воды, перемешивают до полного распределения препарата и фильтруют в мерную колбу вместимостью 100 мл. Коническую колбу и воронку с ватой обмывают 40 мл воды, собирая промывные воды в той же мерной колбе, затем доводят объем раствора водой до метки, перемешивают и центрифугируют не менее 15 мин при 8000 мин-1. 2 мл полученного раствора помещают в мерную колбу вместимостью 25 мл, доводят объем раствора смесью воды с ацетонитрилом (90:10) до метки, перемешивают и фильтруют через мембранный фильтр, отбрасывая первые порции фильтрата.
Для приготовления раствора стандартного образца (СО) ГХМД берут около 50 мг (точная навеска) его СО, растворяют в 50 мл воды в мерной колбе вместимостью 100 мл, доводят объем раствора водой до метки и перемешивают. 2 мл полученного раствора помещают в мерную колбу вместимостью 25 мл, доводят объем раствора смесью воды с ацетонитрилом (90:10) до метки, перемешивают и фильтруют через мембранный фильтр, отбрасывая первые порции фильтрата (раствор А).
1,0 мл раствора А помещают в мерную колбу вместимостью 10 мл, доводят объем раствора смесью воды с ацетонитрилом (90:10) до метки и перемешивают (раствор Б).
Для приготовления раствора стандартного образца (СО) хиноксидина берут около 4 мг (точная навеска) его СО, помещают в мерную колбу вместимостью 200 мл, растворяют в 50 мл метанола, затем доводят объем раствора водой до метки и перемешивают (раствор 1).
2,5 мл раствора 1 СО хиноксидина помещают в мерную колбу вместимостью 25 мл, доводят объем раствора смесью воды с ацетонитрилом (90:10) до метки и перемешивают (раствор 2).
Для приготовления раствора стандартного образца (СО) ГХМД и хиноксидина берут 1,0 мл раствора Б и 2 мл раствора 2, помещают в мерную колбу вместимостью 10 мл, доводят объем раствора смесью воды с ацетонитрилом (90:10) до метки, перемешивают и фильтруют через мембранный фильтр, отбрасывая первые порции фильтрата.
По 20 мкл испытуемого раствора мази ГХМД, раствора А СО ГХМД и раствора СО ГХМД и хиноксидина последовательно хроматографируют при температуре 25°С на жидкостном хроматографе с УФ-детектором и колонкой размером 150×4,6 мм с обращенно-фазным носителем YMC-Triart С18 с размером частиц 5,0 мкм в режиме линейного градиента с использованием в качестве подвижной фазы смеси воды с ацетонитрилом для хроматографии (90:10) и ацетонитрила для хроматографии. Получают не менее 3-х хроматограмм каждого раствора.
Состав подвижной фазы в течение анализа изменяется по следующей схеме:
Скорость потока подвижной фазы 1,0 мл/мин. Длина волны УФ-детектора 260 нм и 240 нм.
Рассчитывают площади пиков ГХМД и находят его количество в анализируемой мази по формуле, %:
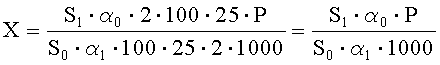
где S1 - среднее значение площади пика ГХМД на хроматограммах испытуемого раствора;
S2 - среднее значение площади пика ГХМД на хроматограммах раствора А СО;
α1 - навеска мази ГХМД в граммах;
α0 - навеска СО ГХМД в миллиграммах;
Р - содержание активного вещества в СО ГХМД в процентах.
Рассчитывают площади пиков примеси хиноксидина и находят его количество в анализируемой субстанции ГХМД по формуле, %:
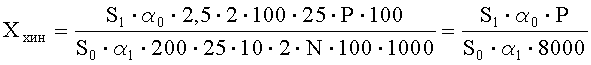
где S1 - среднее значение площади пика примеси хиноксидина на хроматограммах испытуемого раствора;
S0 - среднее значение площади пика хиноксидина на хроматограммах растворов СО ГХМД и хиноксидина;
α1 - навеска мази в граммах;
α0 - навеска СО хиноксидина в миллиграммах;
N - содержание ГХМД в граммах в 1 г препарата;
Р - содержание активного вещества в СО хиноксидина в процентах.
Рассчитывают площади пиков неидентифицированных примесей и находят их количество в анализируемой мази ГХМД по формуле, %:
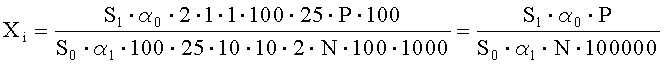
где S1 - среднее значение площади пика неидентифицированной примеси на хроматограммах испытуемого раствора;
S0 - среднее значение площади пика ГХМД на хроматограммах растворов СО ГХМД и хиноксидина;
α1 - навеска мази в граммах;
α0 - навеска СО ГХМД в миллиграммах;
N - содержание ГХМД в граммах в 1 г препарата;
Р - содержание активного вещества в СО ГХМД в процентах.
Хроматограмма испытуемого раствора мази, полученная с использованием колонки размером 150×4,6 мм с обращенно-фазным носителем YMC-Triart С18 с размером частиц 5,0 мкм, представлена на фиг.7.
Пример 4
Для приготовления испытуемого раствора навеску мази массой около 1 г (точная навеска) помещают в коническую колбу вместимостью 100 мл, прибавляют 50 мл воды, перемешивают до полного распределения препарата и фильтруют через вату в мерную колбу вместимостью 100 мл. Коническую колбу и воронку с ватой обмывают 40 мл воды, собирая промывные воды в той же мерной колбе, затем доводят объем раствора водой до метки, перемешивают и центрифугируют не менее 15 мин при 8000 мин-1. 1 мл полученного раствора помещают в мерную колбу вместимостью 25 мл, доводят объем раствора смесью воды с ацетонитрилом (95:5) до метки, перемешивают и фильтруют через мембранный фильтр.
Для приготовления раствора стандартного образца (СО) ГХМД берут около 50 мг (точная навеска) его СО, растворяют в 50 мл воды в мерной колбе вместимостью 100 мл, доводят объем раствора водой до метки и перемешивают. 1 мл полученного раствора помещают в мерную колбу вместимостью 25 мл, доводят объем раствора смесью воды с ацетонитрилом (95:5) до метки, перемешивают и фильтруют через мембранный фильтр (раствор А).
1,0 мл раствора А помещают в мерную колбу вместимостью 10 мл, доводят объем раствора смесью воды с ацетонитрилом (95:5) до метки и перемешивают (раствор Б).
Для приготовления раствора стандартного образца (СО) хиноксидина берут около 4 мг (точная навеска) его СО, помещают в мерную колбу вместимостью 200 мл, растворяют в 50 мл метанола, затем доводят объем раствора водой до метки и перемешивают (раствор 1).
2,5 мл раствора 1 СО хиноксидина помещают в мерную колбу вместимостью 25 мл, доводят объем раствора смесью воды с ацетонитрилом (95:5) до метки и перемешивают (раствор 2).
Для приготовления раствора стандартного образца (СО) ГХМД и хиноксидина берут 1,0 мл раствора Б и 1 мл раствора 2, помещают в мерную колбу вместимостью 10 мл, доводят объем раствора смесью воды с ацетонитрилом (95:5) до метки, перемешивают и фильтруют через мембранный фильтр, отбрасывая первые порции фильтрата.
По 20 мкл испытуемого раствора А лекарственной субстанции ГХМД и раствора СО гидроксиметилхиноксилиндиоксида и хиноксидина последовательно хроматографируют при температуре 25°С на жидкостном хроматографе с УФ-детектором и колонкой размером 50×3,0 мм с обращенно-фазным носителем YMC-Triart С18 с размером частиц 3,0 мкм в режиме линейного градиента с использованием в качестве подвижной фазы смеси воды с ацетонитрилом для хроматографии (95:5) и ацетонитрила для хроматографии, дегазированный. Получают не менее 3-х хроматограмм каждого раствора.
Состав подвижной фазы в течение анализа изменяется по следующей схеме:
Скорость потока подвижной фазы 1,0 мл/мин. Длина волны УФ-детектора 260 нм и 240 нм.
Рассчитывают площади пиков гидроксиметилхиноксилиндиоксида и находят его количество в анализируемой мази по формуле, %:
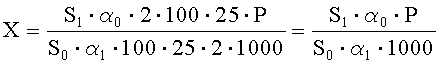
где S1 - среднее значение площади пика ГХМД на хроматограммах испытуемого раствора;
S0 - среднее значение площади пика ГХМД на хроматограммах раствора А СО;
α1 - навеска мази ГХМД в граммах;
α0 - навеска СО ГХМД в миллиграммах;
Р - содержание активного вещества в СО ГХМД в процентах.
Рассчитывают площади пиков примеси хиноксидина и находят его количество в анализируемом лекарственном препарате ГХМД по формуле, %:
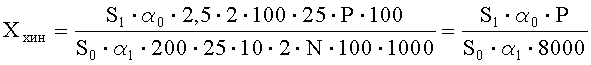
где S1 - среднее значение площади пика примеси хиноксидина на хроматограммах испытуемого раствора;
S0 - среднее значение площади пика хиноксидина на хроматограммах растворов СО ГХМД и хиноксидина;
α1 - навеска мази в граммах;
α0 - навеска СО хиноксидина в миллиграммах;
N - содержание ГХМД в граммах в 1 г препарата;
Р - содержание активного вещества в СО хиноксидина в процентах.
Рассчитывают площади пиков неидентифицированных примесей и находят их количество в анализируемом лекарственном препарате ГХМД по формуле, %:
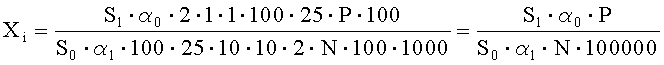
где S1 - среднее значение площади пика неидентифицированной примеси на хроматограммах испытуемого раствора;
S0 - среднее значение площади пика гидроксиметилхиноксилиндиоксида на хроматограммах растворов СО гидроксиметилхиноксилиндиоксида и хиноксидина;
α1 - навеска мази в граммах;
α0 - навеска СО гидроксиметилхиноксилиндиоксида в миллиграммах;
N - содержание гидроксиметилхиноксилиндиоксида в граммах в 1 г препарата;
Р - содержание активного вещества в СО гидроксиметилхиноксилиндиоксида в процентах.
Хроматограмма испытуемого раствора мази, полученная с использованием колонки размером 50×3,0 мм с обращенно-фазным носителем YMC-Triart С18 с размером частиц 3,0 мкм, представлена на фиг.8.
Статистическую обработку результатов, полученных при использовании предлагаемого способа, проводили в соответствии с требованиями Государственной фармакопеи СССР, XI изд.
Как видно из полученных результатов, предлагаемый способ позволяет с высокой точностью определить содержание примесей в субстанции ГХМД и в лекарственном препарате, его содержащем.
Предлагаемое изобретение относится к области аналитической химии и может быть использовано в медицинских, ветеринарных и других исследованиях для определения в лекарственной субстанции гидроксиметилхиноксилиндиоксида количества активного компонента - гидроксиметилхиноксилиндиоксида (ГМХД) и примесей. Для этого определения проводят методом ВЭЖХ на колонке С18 размером 50×3,0 мм, заполненной носителем с зернением 3,0 мкм, или размером 150×4,6 мм, заполненной носителем с зернением 5,0 мкм, с использованием в качестве подвижной фазы смеси воды с ацетонитрилом в соотношении от 90:10 до 95:5 или смеси 0,3% раствора муравьиной кислоты с ацетонитрилом в соотношении от 90:10 до 95:5 и ацетонитрила в режиме линейного градиента на хроматографе с использованием ультрафиолетового детектора. Техническим результатом является повышение точности определения содержания гидроксиметилхиноксилиндиоксида и его примесей как в субстанции, так и в лекарственном препарате, его содержащем. 2 з.п. ф-лы, 8 ил., 4 табл.
1. Способ определения в лекарственной субстанции гидроксиметилхиноксилиндиоксида количества активного компонента - гидроксиметилхиноксилиндиоксида (ГМХД) и примесей, включающий приготовление испытуемого раствора субстанции; приготовление стандартных растворов ГМХД и примеси; хроматографирование приготовленных растворов методом высокоэффективной жидкостной хроматографии с разделением на колонке С18 размером 50×3,0 мм, заполненной носителем с зернением 3,0 мкм, или размером 150×4,6 мм, заполненной носителем с зернением 5,0 мкм, с использованием в качестве подвижной фазы смеси воды с ацетонитрилом в соотношении от 90:10 до 95:5 или смеси 0,3% раствора муравьиной кислоты с ацетонитрилом в соотношении от 90:10 до 95:5 и ацетонитрила в режиме линейного градиента на хроматографе с использованием ультрафиолетового детектора; идентификацию ГХМД и его примеси на полученных хроматограммах по временам удерживания; расчет содержания ГХМД и его примесей в лекарственной субстанции ГХМД на основании расчетных формул.
2. Способ по п.1, где ацетонитрил представляет собой ацетонитрил для хроматографии.
3. Способ по п.1, где носитель представляет собой обращенно-фазный носитель.
4. Способ по п.1, где определение содержания ГХМД и его примесей проводят в лекарственном препарате.
| Zhang, Xiaojun et al, Determination of marker residue of Olaquindox in fish tissue by ultra performance liquid chromatography–tandem mass spectrometry, Journal of Separation Science, Volume 34, issue 4 (February 2011), p | |||
| Прибор для раскрывания парашюта на желаемом расстоянии от места спуска | 1922 |
|
SU469A1 |
| Барам Г.И и др., ВЫСОКОЭФФЕКТИВНАЯ ЖИДКОСТНАЯ ХРОМАТОГРАФИЯ | |||
| В КОНТРОЛЕ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ, | |||
Авторы
Даты
2014-05-27—Публикация
2012-11-08—Подача