Область изобретения
Настоящее изобретение относится к способу получения титана, в частности, но, не исключительно, из руды, содержащей диоксид титана и по меньшей мере 1,0 вес.% примесей, включая оксид кальция и оксид железа.
Уровень техники
Титан является металлом с замечательными свойствами, но его применение ограничено из-за высокой стоимости его добычи и переработки. Применение процессов Кролла или Хантера требует высокочистого тетрахлорида титана, который восстанавливают либо магнием (процесс Кролла) [W.J. Kroll, Trans. Electrochem. Soc, 78 (1940) 35-57], либо натрием (процесс Хантера) [M.A. Hunter, J. Am. Chem. Soc, 32 (1910) 330-336]. Высокочистый тетрахлорид титана получают карбохлорированием неочищенного диоксида титана, и когда все оксиды будут хлорированы, примеси удаляют путем избирательной дистилляции хлоридов. Другим путем получения высокочистого диоксида титана, обычно для пигментной промышленности, является сульфатный способ, в котором неочищенный диоксид титана растворяют в серной кислоте, и железо, являющееся главной примесью, осаждают в виде оксида железа. Однако имеется несколько источников оксида титана, которые содержат примеси или являются слишком мелкозернистыми, что делает обычные способы экономически нецелесообразными. Например, титановые руды, содержащие значительные количества оксида кальция, в процессе карбохлорирования образуют хлорид кальция, который плавится ниже температуры в реакторе с псевдоожиженным слоем. Эта жидкая фаза деожижает слой. Размер частиц некоторых других рудных тел слишком мал, чтобы оставаться в псевдоожиженном слое, и они просто уносятся. Способ с применением серной кислоты приводит к образованию стабильного сульфата кальция, когда содержащие оксид кальция руды выщелачивают. Было бы выгодным, если эти материалы можно было бы просто превращать в высокочистый титан.
Как отмечено выше, существует два промышленных способа, Кролла и Хантера, получения титана с использованием высокочистого хлорида титана, причем подавляющую часть титана получают с помощью процесса Кролла. Чтобы снизить расходы на производство титана, были исследованы другие способы, обычно начинающиеся с высокочистого оксида. В лабораторных экспериментах и экспериментах в масштабе опытных установок диоксид титана восстанавливали, используя кальций, растворенный в хлориде кальция (процесс OS) [R.O. Suzuki, "Ti-2003 science and technology". Eds G. Lutjering, J. Albrecht, (2004, Wiley-VCH, Weinheim) 245-252], или электрохимически, путем электровосстановления в расплавленном хлориде кальция (процесс FFC Cambridge) [G.Z. Chen, DJ. Fray, T.W. Farthing, Nature 407 (2000) 361-364]. В последнем процессе оксид титана делают катодом в ванне хлорида кальция, и было найдено, что катодная реакция представляет собой не осаждение кальция из расплава, а ионизацию кислорода в диоксиде титана, который диффундирует к аноду и разряжается. В обоих этих процессах могут быть обработаны руды, содержащие оксид кальция, так как оксид кальция просто растворялся бы в соли. Однако в этом случае не было бы селективного удаления других элементов, так что конечный продукт был бы отражением примесей в исходном сырье. Все другие процессы, такие как процесс Армстронга - "Summary of emerging titanium cost reductions", EHK Technologies, Report prepared for US Department of Energy and Oak Ridge National Laboratory, subcontract 4000023694 (2003), являющийся производным процесса Хантера, требуют в качестве сырья высокочистый тетрахлорид титана.
Другим интересным процессом является запатентованный Вейнером (Wainer) в 1950-е годы [US 2722509], который описывает процесс, где эквимолярные количества тонко диспергированного, химически чистого карбида титана и тонко диспергированного, химически чистого моноксида титана тщательно смешивали и нагревали в атмосфере аргона, образуя анод из TiC·TiO - взаимного твердого раствора карбида титана и моноксида титана, в котором мольное отношение карбида к моноксиду не превышает 1. В качестве электролита использовали расплав хлоридной соли электроположительного элемента, и когда прикладывается напряжение, протекают анодные реакции следующего типа:
TiCO=Ti2++CO+xCO+2e- .
Ионы титана растворяются в электролите и восстанавливаются на катоде:
Ti2++2e=Ti.
Уизерс (Withers) и сотрудники исследовали также термический и электрохимический процессы получения титана, смотри WO 2005/019501 и WO 2007/097823. Этот процесс включает в себя образование композита оксид титана-углерод путем смешивания оксида титана с источником углерода и нагрева в отсутствие воздуха до температуры, достаточной для восстановления титана в TiO2 до более низкой валентности и образования композитного электрода из субоксида титана/углерода. В процессе образования композитного электрода из субоксида титана/углерода любой оксид железа восстанавливался до железа и удалялся выщелачиванием или путем образования комплексов железа в водном растворе при температуре окружающей среды. WO 2005/019501 предлагает, что, вводя в анод другие оксиды, можно будет восстановить заодно эти другие оксиды и осадить катионы одновременно на катоде, получая сплав, который отражает состав исходного анода. В этом же документе описан способ получения высокочистого титана, который использует такие же условия, как в предшествующих экспериментах. Эти два результата совершенно несовместимы.
Настоящий заявитель стремился предоставить способ рафинирования титана из руды, содержащей диоксид титана и относительно высокие уровни (например, по меньшей мере 1,0 вес.%) примесей, включая оксид кальция и оксид железа.
Сущность изобретения
Согласно широкому аспекту настоящее изобретение предусматривает электрорафинирование анода, состоящего из оксикарбида, с получением чистого металлического материала на катоде.
В соответствии с другим аспектом настоящего изобретения предусмотрен способ получения титана, содержащий: обеспечение оксида титана с уровнем примесей по меньшей мере 1,0 вес.%; реагирование оксида титана с образованием оксикарбида титана; проведение электролиза оксикарбида титана в электролите, причем оксикарбид титана выполнен как анод; и извлечение рафинированного металлического титана из катода в электролите.
Настоящий заявитель неожиданно обнаружил, что при проведении электролиза оксикарбида титана на катоде осаждается металлический титан с относительно высокой чистотой по сравнению с уровнями примесей в оксиде титана. Рафинированный металлический титан может иметь уровень примесей менее 0,5 вес.%, т.е. иметь чистоту по меньшей мере 99,5% по весу, и даже может иметь чистоту по меньшей мере 99,8% по весу. Настоящий заявитель обнаружил, что изначально присутствующие в оксиде титана примеси, которые, как можно было бы ожидать, будут осаждаться на катоде вместе с титаном, удерживаются в электролите.
Оксид титана может быть рудой или рудным концентратом. Оксид титана может содержать примеси, выбранные из группы, состоящей из оксидов кремния, алюминия, железа, кальция, хрома и ванадия. В одном варианте оксид титана содержит примеси, включающие оксиды железа и/или кальция. Наличие таких примесей мешает извлечению титана с использованием обычных методов, особенно если оксиды кальция и/или железа присутствуют в значительных количествах. Например, присутствие более чем примерно 0,15-0,2 вес.% оксида кальция может препятствовать переработке в реакторе с псевдоожиженным слоем из-за расплавления хлорида кальция, получающегося на более ранней стадии карбохлорирования. Следовательно, руда, содержащая диоксид титана и значительные уровни оксида кальция и оксида железа, имеет значительно меньшую ценность, чем другие руды с всего лишь минимальными или следовыми уровнями оксида кальция и/или оксида железа.
Оксид титана может иметь уровень примесей по меньшей мере 2,0 вес.%, возможно даже по меньшей мере 2,5 вес.%. Оксид титана может включать по меньшей мере 0,1 вес.% оксида кальция, возможно даже по меньшей мере 0,5 вес.% оксида кальция. Дополнительно или альтернативно, оксид титана может включать по меньшей мере 0,1 вес.% оксида железа, возможно по меньшей мере 0,5 вес.% оксида железа и возможно даже по меньшей мере 5 вес.% оксида железа. Рафинированный металлический титан может иметь более низкий уровень кальция и/или железа, чем оксид титана.
Оксид титана может содержать по существу диоксид титана. Например, оксид титана может содержать по меньшей мере 90 вес.% диоксида титана, возможно даже по меньшей мере 95 вес.% диоксида титана. Оксикарбид титана может быть образован при реагировании оксида титана с карбидом титана в таких относительных количествах, чтобы образовать твердый раствор Ti-C-O. Например, порошки оксида титана и карбида титана могут быть смешаны и спечены с образованием твердого раствора Ti-C-O. Если оксид титана содержит по существу диоксид титана, его можно смешать с карбидом титана в таких относительных количествах, чтобы добиться стехиометрической реакции, заданной как 4TiC+2TiO2=3Ti2CO+CO(г).
Электролит может быть солевым расплавом и может содержать хлорид щелочного или щелочноземельного металла. Солевой расплав может быть выбран из группы, состоящей из хлорида лития, хлорида натрия, хлорида калия, хлорида магния и их смесей. Солевой расплав может содержать эвтектику хлорид натрия - хлорид калия или эвтектику хлорид лития - хлорид натрия - хлорид калия. Альтернативно, солевой расплав может представлять собой хлорид магния. Такая соль кипит при 1412°C и отгоняется из катодного продукта; другие соли могут быть удалены только растворением в воде, что вызывает окисление титана. Солевой расплав может дополнительно содержать хлорид титана(II) (TiCl2) и/или хлорид титана(III) (TiCl3). Присутствие хлорида титана (возможно несколько весовых процентов) может помочь перемещению ионов титана через соль.
Способ может дополнительно содержать удаление примесей из электролита путем обработки расплавленного электролита титаном, например, при температуре 700°C.
В соответствии с другим аспектом настоящего изобретения предусмотрен способ рафинирования титана, содержащий: обеспечение титановой руды или рудного концентрата, содержащей(го) диоксид титана; реагирование титановой руды или рудного концентрата с образованием оксикарбида титана; проведение электролиза оксикарбида титана в электролите, причем оксикарбид титана выполнен как анод; и извлечение титана из катода в электролите.
Титановая руда или рудный концентрат может содержать примеси (как определено в предыдущем аспекте). Образование оксикарбида титана может включать в себя реагирование диоксида титана с карбидом титана (как определено в предыдущем аспекте). Извлеченный титан может иметь более высокую чистоту (более низкий уровень примесей в относительных единицах), причем уровень титана повышается от менее 98% по весу в руде или рудном концентрате до по меньшей мере 99,5% по весу в извлеченном титане и возможно даже по меньшей мере 99,8% по весу.
Краткое описание чертежей
Далее будет подробно описан вариант воплощения изобретения в качестве примера и с обращением к приложенным чертежам, на которых:
фигура 1 является блок-схемой, иллюстрирующей способ, воплощающий настоящее изобретение;
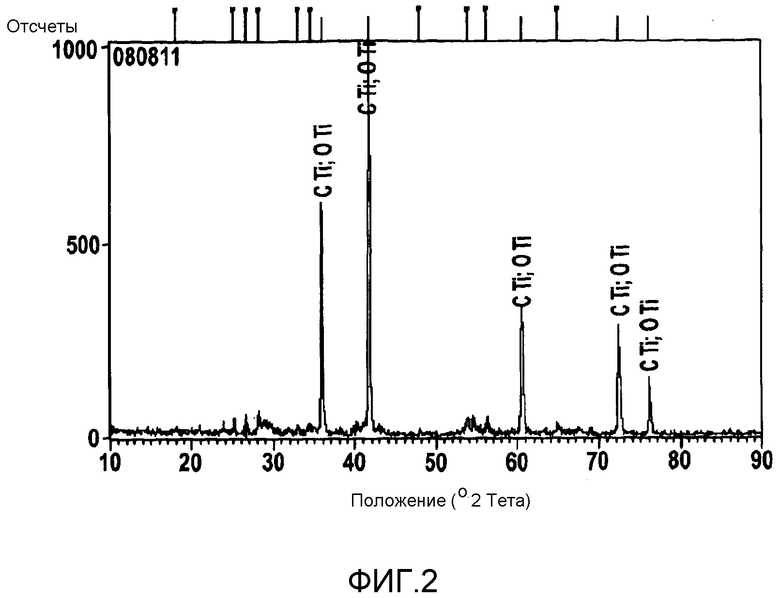
фигура 2 является рентгенодифрактограммой твердого раствора Ti-C-O, полученного в соответствии с одним этапом настоящего изобретения;
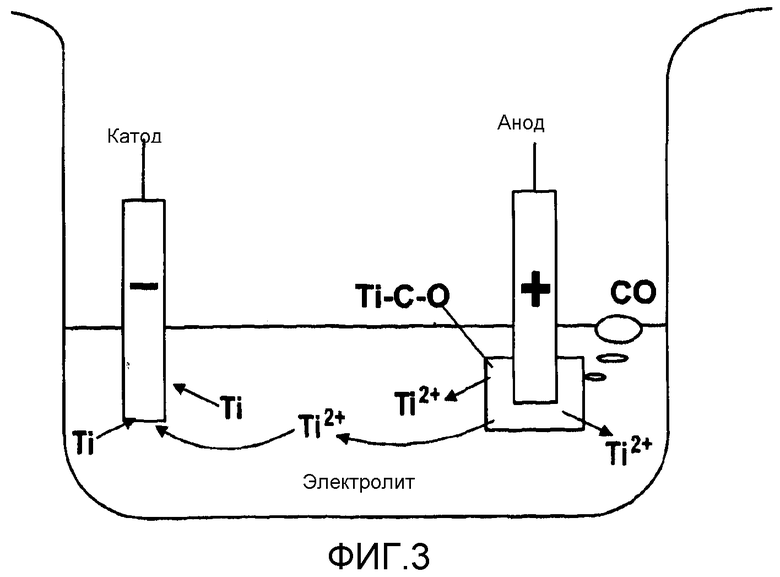
фигура 3 является схематическим изображением ячейки электрорафинирования в соответствии с другим этапом настоящего изобретения;
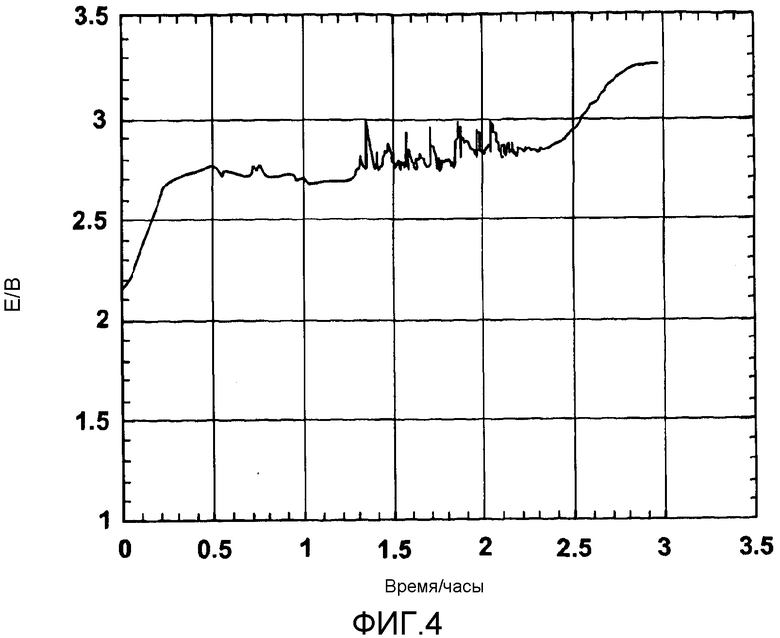
фигура 4 показывает профиль потенциала при анодном растворении Ti-O-C;
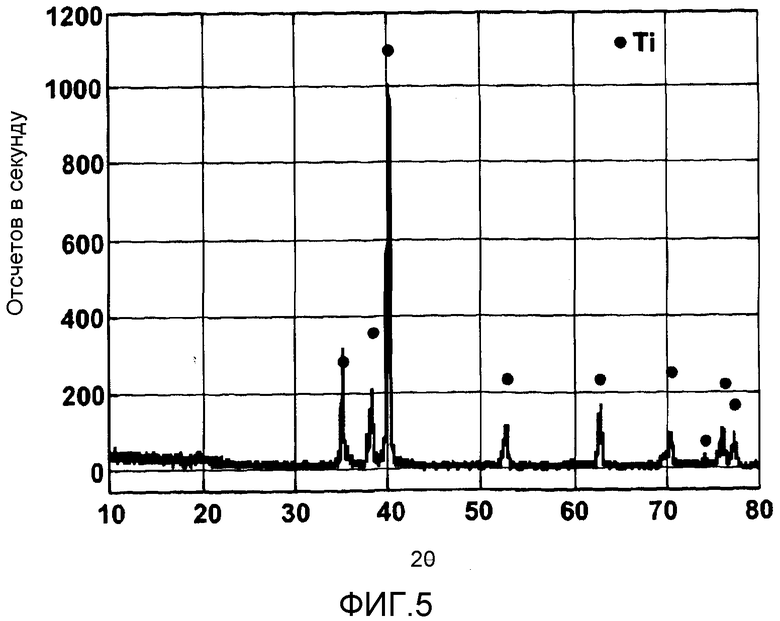
фигура 5 показывает рентгеновские спектры рафинированного металлического титана, извлеченного на катоде;
фигуры 6a и 6b являются СЭМ-микроснимками рафинированного металлического титана, извлеченного на катоде; и
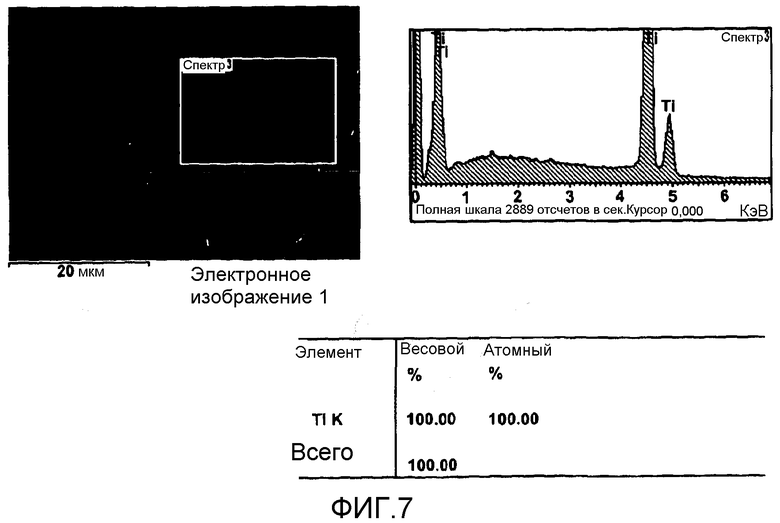
фигура 7 показывает энергодисперсионный спектр рафинированного металлического титана, извлеченного на катоде.
Частичное описание воплощения изобретения
Электрорафинирование в расплавах солей применяется в промышленности для получения высокочистого расплавленного алюминия путем растворения алюминия в медно-алюминиевом сплаве. Его делают анодом, и алюминий, являясь наиболее химически активным элементом, ионизируется в соли и осаждается на катоде, а примеси остаются в аноде. Потенциалы ионизации чистых элементов для хлоридного расплава по отношению к Na/Na+, при 1173 K, равны:
Марганец должен ионизироваться первым, за ним следуют Al, Fe и Si, но, так как количество марганца обычно очень мало, первым ионизируется алюминий.
Этот же принцип может применяться к рафинированию титана, но в данном изобретении реакциями являются не рафинирование металлического титана, а рафинирование (выделение) металла из оксидов металлов. Типичный состав руды приведен в таблице 1.
Анализ типичного коммерческого концентрата рутила
Если этот материал прореагировал с C с образованием TiCxOy и других оксикарбидов, реакции в таблице 2 будут протекать, если материал сделать анодом.
Потенциалы относительно Na=Na++e
Порядок ионизации должен быть следующим: кальций, железо, магний, хром, титан и затем кремний, т.е. кальций должен удаляться в виде ионов кальция, затем следует Fe в виде Fe2+ и т.д. Однако это относится к чистым оксидам металлов, тогда как в руде вероятно, что оксиды образуют твердый раствор, и их активности, за исключением TiO, будут значительно снижены. Активность 2×10-5 изменит потенциал на 0,5 В, так что единственным надежным выводом является то, что первым будет ионизироваться кальций, а за ним - другие элементы. При нахождении в электролите потенциалы осаждения должны быть заданы таблицей 3, и порядок осаждения следующий: хром, железо, титан, магний и, наконец, кальций.
Потенциалы относительно Na++e=Na
Опять же на эти потенциалы осаждения будут влиять активности или концентрации ионов в соли, так что, если концентрация вещества низкая, будет труднее осадить металл из этого вещества.
Общим выводом из этих расчетов является то, что очень вероятно, что кальций, будучи сильно электроположительным, будет удерживаться электролитом. Неожиданно было обнаружено, что при электрорафинировании оксикарбида, полученного из руды с составом, указанным в таблице 1, на катоде осаждался титан с очень низким содержанием примесей других элементов.
ПРИМЕР
Широкий по смыслу способ получения титана из руды (такой как руда, состав которой дается в таблице 1) проиллюстрирован на фигуре 1. Обеспечив руду на этапе 10, на этапе 12 образуют оксикарбид титана. Оксикарбид титана подвергают электролизу на этапе 14 и рафинированный металлический титан извлекают на катоде на этапе 16.
Оксикарбид приготовили (этап 12) смешением руды состава, приведенного в таблице 1, в соответствии со стехиометрией, заданной уравнением:
4TiC+2TiO2=3Ti2CO+CO(г).
Порошки прессовали в таблетки диаметром 2 мм и толщиной 2 мм, используя одноосное давление 2,65 тонны·см-2. Таблетки спекали в вакуумной печи при 1373 K в вакууме 10-2 торр. После спекания таблетки были однородно черными, и рентгенограмма (фигура 2) показывает, что таблетка состояла из твердого раствора Ti-C-O.
Схема ячейки электрорафинирования показана на фигуре 3. Оксикарбид титана (Ti-C-O) выполняли как анод и подвергали электролизу в электролите (этап 14). Использованными электролитами были либо эвтектика NaCl-KCl, либо эвтектика LiCl-NaCl-KCl, содержащие некоторую долю TiCl2 и TiCl3. Осуществили ряд гальваностатических электролизов в диапазоне плотности тока от 50 до 100 мА∙см-2.
Из фигуры 4 можно видеть, что потенциал является по существу постоянным, но повышается до потенциала разложения объемной соли, когда анод был израсходован и в качестве анода стал действовать токоподводящий провод.
Рассчитали анодный и катодный выходы по току в предположении, что валентность иона титана в растворе была 2,5. Предполагали, что во время электрорафинирования имели место следующие электрохимические реакции:
Анод: Ti=Ti3++3e и Ti=Ti2++2e,
Катод: Ti3++e=Ti2+ и Ti2++2e=Ti.
*Анодный и катодный выходы по току в предположении, что электролит содержит смесь 50/50 Ti3+ и Ti2+
(отн. Ti2,5+)*
(отн. Ti2,5+)*
Из таблицы 3 ясно, что большая часть титана и некоторые из примесей растворялись в соли. Однако высокая концентрация Ti3+ снижала выход по току на катоде.
Металл, осажденный на катоде во время электролиза (этап 16), собирали. Этот металл физически разламывали и промывали, и фигура 5 показывает рентгеновские спектры, фигура 6 - микроструктуру, а фигура 7 - энергодисперсионный спектр. Это окончательно доказывает, что на катоде был осажден относительно чистый титан.
Примеси в катодном продукте анализировали с помощью индуктивно связанной плазмы. Электрорафинированный продукт, как описано выше, приготовили из рудного концентрата, представленного в таблице 1. Как можно видеть (смотри таблицу 4), по сравнению с их содержанием в рудном концентрате, содержание основных элементов - металлов было снижено до очень низкого уровня (типично примерно на один порядок величины или более), за исключением железа. Относительно высокое содержание железа в катодном продукте частично могло быть вызвано тем, что в качестве катода использовали стальной стержень, который загрязнял катодный продукт при его физическом удалении с электрода.
Состав примесей в исходных и конечных продуктах
Как можно видеть, имелось снижение по значительному числу элементов, так что качество титана повысилось с 96,44% (в концентрате) до 99,73%, что является существенным повышением.
Для анализа примесей в солевом расплаве после экспериментов использовали установку с индукционно-связанной плазмой (ICP). Ячейка содержала 260 г электролита NaCl-KCl, и для каждого электролиза использовали около 0,326 г анода из Ti-C-O, а электролиз проводили при напряжении на ячейке 0,6 В. После электролиза из объема электролита отбирали около 1 г соли и растворяли в высокочистой воде. Концентрацию примесей анализировали с помощью ICP, и результаты показаны в таблице 5.
Состав примесей в соли после электролиза (электролит использовали четыре раза)
Можно видеть, что большая часть примесей была анодно растворена в солевой расплав, где они и остались. Вообще говоря, количество примесей повышается по мере использования электролита, но эти повышения не являются однородными. Это может быть связано с гетерогенностью в составе таблеток. Элементы Ca, Cr, Fe и Si накапливаются в виде ионов в соли, тогда как Al теряется из расплава в виде хлорида алюминия, который имеет очень высокое давление паров. Кальций имеет слишком высокий потенциал осаждения, чтобы осаждаться, тогда как титан осаждается, а для других элементов можно предположить, что их очень низкие концентрации ведут к низким градиентам концентрации и, следовательно, к низкому массопереносу в расплаве. Cr, Fe и Si можно удалить, обрабатывая расплав титаном, при этом будет идти следующая реакция:
MCl2+Ti=TiCl2+M,
где M означает любой из Cr, Fe или Si или часть удаленного и неучитываемого электролита.
Обработка электролита титаном при 700°C удаляет многие примеси до очень низких уровней, например, Cr до 0,003 вес.%, Fe до 4×10-6 вес.%, Si до 6×10-9 вес.%, что даст титановый продукт с еще более низким уровнем примесей.


Изобретение относится к способу получения титана. Способ включает наличие оксида титана с уровнем примесей по меньшей мере 1,0 вес.%, взятого в виде руды или рудного концентрата. Затем проводят реагирование оксида титана с образованием оксикарбида титана. Далее осуществляют проведение электролиза оксикарбида титана в электролите, причем оксикарбид титана выполнен как анод. Затем проводят извлечение рафинированного металлического титана с катода в электролите, имеющего уровень примесей 0,5 вес.%. Технический результат - осуществление способа рафинирования титана из руды. 11 з.п. ф-лы, 7 ил., 5 табл., 1 пр.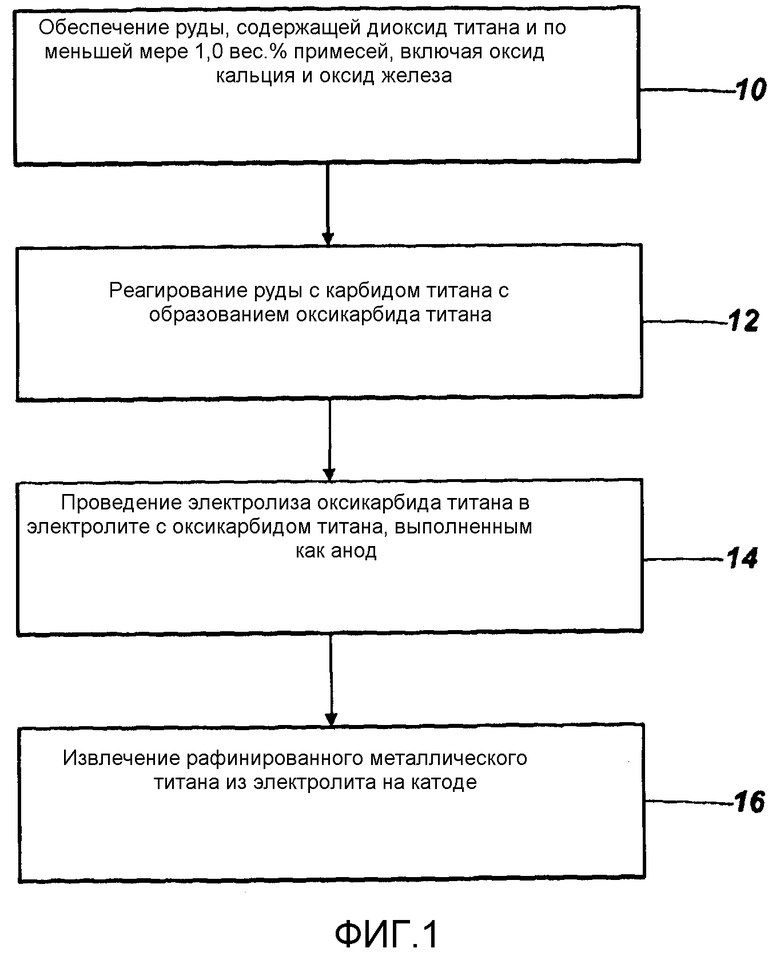
1. Способ получения титана, включающий
обеспечение оксида титана в виде руды или рудного концентрата с уровнем примесей по меньшей мере 1,0 вес.%, включая по меньшей мере 0,1 вес.% оксида кальция и/или по меньшей мере 0,1 вес.% оксида железа,
образование из оксида титана оксикарбида титана,
проведение электролиза в электролите с оксикарбидом титана в виде анода и
извлечение с катода в электролите рафинированного металлического титана, имеющего уровень примесей менее 0,5 вес.%.
2. Способ по п.1, в котором рафинированный металлический титан имеет чистоту по меньшей мере 99,8% по весу.
3. Способ по п.1 или 2, в котором оксид титана имеет уровень примесей по меньшей мере 2,0 вес.%.
4. Способ по п.1, в котором оксид титана содержит примеси, выбранные из группы, состоящей из оксидов кремния, алюминия, железа, кальция, хрома и ванадия.
5. Способ по п.1, в котором оксид титана включает по меньшей мере 0,5 вес.% оксида кальция и/или по меньшей мере 0,5 вес.% оксида железа.
6. Способ по п.1, в котором оксид титана содержит по существу диоксид титана.
7. Способ по п.6, в котором оксикарбид титана образуют при реагировании оксида титана с карбидом титана.
8. Способ по п.7, в котором осуществляют реагирование карбида титана с диоксидом титана в соответствии со стехиометрией, заданной как: 4TiC+2TiO2=3Ti2CO+CO(г).
9. Способ по п.1, в котором электролит представляет собой солевой расплав.
10. Способ по п.9, в котором солевой расплав содержит хлорид щелочного или щелочноземельного металла.
11. Способ по п.10, в котором солевой расплав выбран из группы, состоящей из хлорида лития, хлорида натрия, хлорида калия, хлорида магния и любых их смесей.
12. Способ по п.11, в котором солевой расплав представляет собой одну из эвтектики хлорид натрия - хлорид калия и эвтектики хлорид лития - хлорид натрия - хлорид калия.
| US 2009152507 A1,18.06.2009 | |||
| WO 9964638 А1, 16.12.1999 | |||
| Способ получения металлов | 1981 |
|
SU1416060A3 |
| СПОСОБ ПОЛУЧЕНИЯ ТУГОПЛАВКИХ МЕТАЛЛОВ ИЗ РУДНЫХ КОНЦЕНТРАТОВ | 1994 |
|
RU2103391C1 |
| JP 57116791 А, 20.07.1982 | |||
| WO 9849357 А1, 05.11.1998 | |||
| JP 62086188 А, 20.04.1987 | |||
| WO 2007097823 A2, 30.08.2007 | |||
Авторы
Даты
2014-06-10—Публикация
2010-07-28—Подача