2420-173326RU/071
САМОИНАКТИВИРУЮЩИЕСЯ АДЕНОВИРУСЫ-ПОМОЩНИКИ ДЛЯ ПОЛУЧЕНИЯ РЕКОМБИНАНТНЫХ АДЕНОВИРУСОВ С ВЫСОКОЙ ЕМКОСТЬЮ
Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБЕРТЕНИЕ
Изобретение относится к области аденовирусных векторов и, более конкретно, к области получения систем третьего поколения или аденовирусных векторов, лишенных вирусных кодирующих областей («лишенных существенного внутреннего содержимого» - «gutless»), с помощью применения самоинактивирующихся аденовирусов-помощников, которые позволяют создавать в клетках рекомбинантные аденовирусы с минимальным загрязнением аденовируса с высокой емкостью аденовирусами-помощниками.
Аденовирусы с высокой емкостью (НС-Ad), также известные как аденовирусы, «лишенные существенного внутреннего содержимого», или зависимые от помощников аденовирусы, очень привлекательны в качестве векторов для генной терапии, так как могут поддерживать высокую эффективность трансдукции и тропизм других аденовирусных векторов, как у грызунов, так и у приматов, но они предотвращают иммуногенность, ассоциированную с экспрессией вирусных белков в инфицированных клетках. Кроме того, такие вирусные векторы обладают высокой емкостью для встраивания представляющего интерес трансгена (примерно до 36 т.п.н.), намного большей, чем емкость других вирусных векторов.
Аденовирусные векторы с высокой емкостью основаны на аденовирусах, которые «очищены» от всех вирусных кодирующих последовательностей. Такие векторы имеют в качестве минимальных требований концевые области аденовирусного генома (ITR, инвертированные концевые повторы), которые необходимы для репликации вируса, и сигнал упаковки (Ψ), который также действует в цис-положении.
В связи с тем, что у аденовирусов с высокой емкостью отсутствуют все вирусные кодирующие области, для его размножения требуется присутствие вирус-помощника с делецией в области E1, который обеспечивает вирусные белки в транс-положении. Размножение осуществляют с помощью котрансфекции или совместно инфекции линий клеток 293, в которые была интегрирована делетированная область E1 вируса-помощника.
Однако при такой системе размножения также образуются нежелательные вирусные частицы, которые заключают в капсид геномы вирусов-помощников и загрязняют конечные препараты аденовирусов с высокой емкостью. Накопление вирусов-помощников довольно изменчиво, но иногда оно может быть таким значительным, что они вытесняют вирус с высокой емкостью, что является одной из причин, по которой современные способы получения являются недостаточно надежными для клинического применения. Эффективность является другим ограничивающим фактором, также отчасти связанным с проблемой появления вирусов-помощников. До настоящего времени разработаны и описаны несколько разных систем уменьшения эффективности упаковки вируса-помощника. Такие системы обычно основаны на введении мутаций в сигнал упаковки вируса-помощника, на увеличенном размере его генома и особенно на специфичном удалении сигнала упаковки в процессе продуцирования вирусов.
Parks с соавторами (Proc. Natl. Acad. Sci. USA 1996; 93: 13565-13570) описали способы удаления сигнала упаковки Ψ вируса-помощника с помощью системы рекомбинации Cre-loxP, в которой сигнал Ψ указанного вируса фланкирован сайтами loxP. Если размножение осуществляют в клетках 293, экспрессирующих рекомбиназу Cre, то рекомбиназа вырезает сигнал Ψ вируса-помощника, предотвращая его от возможности упаковки, но так, чтобы он сохранял кодирующие последовательности, необходимые для упаковки аденовируса с высокой емкостью. Альтернативно в US 7045347 и в публикации Ng с соавторами (Mol. Ther. 2001; 3: 809-815) описаны системы инактивации вируса-помощника, основанные на вирусах-помощниках, последовательность упаковки которых фланкирована сайтами узнавания frt для рекомбиназы FLP, так что размножение вируса-помощника в клетках 293, экспрессирующих рекомбиназу FLP дрожжей, приводит к вырезанию последовательности упаковки.
Такие системы имеют недостаток, который заключается в том, что реакция, катализируемая рекомбиназой, является двунаправленной, в силу чего последовательность упаковки может быть снова повторно введена в геном вируса-помощника. Чтобы предотвратить такую проблему Groth с соавторами (Proc. Natl. Acad. Sci. USA 2000; 97: 5995-6000) предложили применение однонаправленной рекомбиназы, в частности, рекомбиназы PhiC31, с использованием специфичных последовательностей узнавания attB/attP для того, чтобы фланкировать сигнал Ψ. Когда рекомбиназа PhiC31 вырезает последовательность, фланкированную сайтами attB/attP, она модифицирует последовательности узнавания и превращает их в последовательности attR/attL, предотвращая возможность узнавания их снова (с повторным введением сигнала Ψ).
Однако в случае всех способов сталкиваются с проблемой, что удаление последовательностей упаковки вируса-помощника требует экспрессии рекомбиназы с кодирующей ее последовательности, локализованной в геноме клетки-хозяина. Указанный процесс происходит в момент вирусного цикла, когда экспрессия клеточных белков частично ингибирована вследствие цитопатических эффектов, ассоциированных с инфекцией аденовирусами, поэтому вероятно, что не достигаются достаточно высокие внутриклеточные уровни рекомбиназы, чтобы удалить все копии аденовируса-помощника.
Поэтому были предложены альтернативные способы, чтобы предотвратить образование аденовирусов-помощников, способных упаковываться, или, по меньшей мере, задержать их образование относительно образования векторов, лишенных существенного внутреннего содержимого. В патентном документе WO2007125146 соответственно описан вариант описанного ранее способа, в котором аденовирусные векторы-помощники содержат последовательность attB фага ФС31 между последовательностью упаковки и ITR, ближайшей к указанной последовательности упаковки. Добавление указанного сайта attB приводит даже в отсутствие рекомбиназы ФС31 к задержке упаковки аденовируса-помощника относительно аденовируса, лишенного существенного внутреннего содержимого, что вызывает уменьшение количества загрязняющих аденовирусов-помощников в препарате вирусов, лишенных существенного внутреннего содержимого. Однако такой способ приводит только к задержке образования аденовирусов-помощников, но не предотвращает образование аденовирусов-помощников, обладающих способностью к упаковке.
Указанную проблему решали с помощью аденовирусной системы, описанной в DE 10159167. В данной системе рекомбиназа кодируется аденовирусом, лишенным существенного внутреннего содержимого, а аденовирус-помощник содержит сайты-мишени, узнаваемые рекомбиназой, которые определяют границы области, содержащей сигнал упаковки, и удаление которой приводит к тому, что аденовирусный ген E1, присутствующий в аденовирусе-помощнике в 3'-направлении по отношению к сайленсеру экспрессии, оказывается вблизи промотора транскрипции p5 AAV. Поэтому в присутствии аденовируса, лишенного существенного внутреннего содержимого, рекомбиназа удаляет область упаковки генома аденовируса-помощника, в то же самое время обеспечивая экспрессию гена E1, который необходим для упаковки аденовируса, лишенный существенного внутреннего содержимого. Однако в такую аденовирусную систему включен вирус-помощник, экспрессирующий E1, поэтому он является реплицируемым вирусом и, следовательно, более опасным, чем обычный вирус-помощник. Кроме того, вирус, лишенный существенного внутреннего содержимого, экспрессирует рекомбиназу, которая нежелательна в терапевтическом векторе с потенциальным клиническим применением.
Другим альтернативным решением для предотвращения зависимости рекомбиназы от пакующей клетки является использованием рекомбиназы, кодируемой самим вирусом-помощником. В патентном документе US 20020072120 описаны аденовирусные векторы-помощники, кодирующие слитый белок, образованный рекомбиназой Cre, и связывающим лиганд доменом рецептора эстрогена, при этом указанный слитый белок кодируется последовательностью, которая находится под оперативным контролем конститутивного промотора. Слитый белок Cre-ER перемешается в ядро и проявляет свою рекомбиназную активность только в присутствии эстрогена или аналога, тем самым исключая необходимость в использовании клетки, экспрессирующей рекомбиназу, и в то же самое время предотвращая токсичный эффект рекомбиназы в связи с тем, что ее активность можно регулировать с помощью добавления эстрогенов в культуральную среду.
Таким образом, в данной области существует необходимость в системах упаковки аденовирусных векторов, которая устраняет недостатки систем, известных до настоящего времени, в частности в способах, при которых образование аденовирусов-помощников во время размножения аденовируса, лишенного существенного внутреннего содержимого, максимально снижено.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В первом аспекте изобретение относится к полинуклеотиду, содержащему:
(a) область, кодирующую сайт-специфичную рекомбиназу, при этом указанная область находится под оперативным контролем индуцируемого промотора, и
(b) область, необходимую для репликации и/или упаковки аденовирусного генома, фланкированную последовательностями узнавания, специфичными для рекомбиназы, кодируемой последовательностью по п. (a), при этом указанные последовательности узнавания ориентированы так, чтобы вырезание указанной необходимой области происходило в присутствии указанной рекомбиназы.
Во втором аспекте изобретение относится к экспрессирующему вектору, содержащему полинуклеотид согласно изобретению.
В третьем аспекте изобретение относится к аденовирусной частице, содержащей последовательность полинуклеотида согласно изобретению.
В другом аспекте изобретение относится к системе репликации и упаковки самоинактивирующегося аденовируса-помощника, включающей в себя:
(a) полинуклеотид, экспрессирующий вектор или аденовирусную частицу согласно изобретению; и
(b) эукариотическую клетку.
В другом аспекте изобретение относится к способу получения самоинактивирующегося аденовируса-помощника, включающему в себя:
i) осуществление контакта клетки с полинуклеотидом, экспрессирующим вектором или аденовирусной частицей согласно изобретению и необязательно с одним или несколькими полинуклеотидами, кодирующими аденовирусные белки, необходимые для упаковки и репликации аденовируса в клетке в подходящих условиях, так чтобы происходило проникновение в клетку аденовирусного генома или полинуклеотида,
(ii) содержание клетки в условиях подходящих для того, чтобы обеспечить возможность упаковки и репликации аденовируса в клетки и предотвратить экспрессию сайт-специфичной рекомбиназы, и
(iii) извлечение аденовирусов из среды.
В другом аспекте изобретение относится к аденовирусу-помощнику, полученному согласно способу, описанному в предыдущем абзаце.
В другом аспекте изобретение относится к применению полинуклеотида, вектора иди аденовирусной частицы согласно изобретению для продуцирования и упаковки аденовирусов с высокой емкостью.
В другом аспекте изобретение относится к системе для получения рекомбинантного аденовируса с высокой емкостью, включающей в себя:
(a) полинуклеотид, экспрессирующий вектор или аденовирусную частицу согласно изобретению;
(b) аденовирус, геном которого содержит представляющий интерес ген, и в котором отсутствует последовательность, кодирующая, по меньшей мере, один из белков, необходимых для репликации, или последовательность, кодирующая, по меньшей мере, один из белков, необходимых для упаковки указанного аденовируса, или полинуклеотид, содержащий геном указанного аденовируса, и
(c) эукариотическую клетку.
В другом аспекте изобретение относится к способу создания аденовируса с высокой емкостью, экспрессирующего представляющий интерес ген, включающему в себя стадии:
(i) осуществления контакта клетки с аденовирусом в подходящих условиях так, чтобы происходило проникновение в клетку генома указанного аденовируса или полинуклеотида, содержащего указанный геном,
(ii) осуществления контакта указанной клетки со вторым компонентом, выбранным из группы, состоящей из:
(a) полинуклеотида, содержащего:
1) область, кодирующую сайт-специфичную рекомбиназу, при этом указанная область находится под оперативным контролем индуцируемого промотора, и
2) сигнал упаковки аденовируса Ψ, фланкированный последовательностями узнавания, специфичными для рекомбиназы, кодируемой последовательностью по п. (a), при этом указанные последовательности узнавания ориентированы так, чтобы вырезание сигнала упаковки Ψ происходило в присутствии указанной рекомбиназы,
(b) аденовирусного вектора, содержащего полинуклеотид по п. (a); и
(c) аденовирусной частицы, содержащей полинуклеотид по п. (a),
в условиях, подходящих для того, чтобы происходило проникновение в клетку указанного полинуклеотида, указанного аденовирусного вектора или генома указанной аденовирусной частицы,
(iii) поддерживание клетки в условиях, подходящих для экспрессии белков, кодируемых геномами обоих аденовирусов, для репликации геномов обоих аденовирусов и для экспрессии рекомбиназы, кодируемой полинуклеотидом, вектором или аденовирусом, используемым на стадии (ii), и
(iv) извлечение аденовируса с высокой емкостью из культуры клеток.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигуре 1 показана оперативная схема самоинактивирующегося аденовируса-помощника. На панели A показан классический способ, основанный на продукции Cre пакующей клеткой. В условиях интенсивной репликации вирусов экспрессия Cre может быть недостаточной для вырезания последовательности упаковки из некоторого количества вирусных геномов, количество которых возрастает экспоненциально. На панели В показано, как каждый самоинактивирующийся вирус-помощник является носителем гена Cre, так что способность к экспрессии Cre возрастает параллельно в увеличением количества вирусных геномов.
На фигуре 2 показана оперативная схема индуцируемой системы для экспрессии Cre. Конститутивный промотор (PGK) управляет экспрессией трансактивирующего белка rtTA-M2. В присутствии индуктора (доксициклина), rtTA-M2 димеризуется и активирует индуцируемый промотор (tetO-pA1b), контролирующий экспрессию рекомбиназы Cre. pA, последовательность полиаденилирования.
На фигуре 3 показана оперативная схема белка tTS. В отсутствие доксициклина tTS связывается с индуцируемым промотором и ингибирует экспрессию Cre. Когда добавляют доксициклин, tTS теряет аффинность к промотору, останавливает ингибирование экспрессии Cre и обеспечивает возможность для опосредованной димером активации трансактивирующего белка.
На фигуре 4 показана стабильная экспрессия tTS в клетках 293. ДНК разных клонов клеток 293, трансфицированных плазмидой, экспрессирующей tTS, очищали и осуществляли ОТ-ПЦР, чтобы выявить продукцию мРНК tTS. Плазмиды, содержащие кДНК, включали в качестве контроля. MW, маркер размера.
На фигуре 5 показан контроль экспрессии Cre в индуцируемых плазмидах. Клетки 293 трансфицировали указанными плазмидами: pBS185 экспрессирует Cre под контролем конститутивного промотора CMV; palbCre содержит индуцируемый промотор для контроля экспрессии Cre; pGKrtTA экспрессирует трансактиватор под контролем промотора PGK; prtTACre содержит кассеты экспрессии Cre и трансактиватора в одной и той же плазмиде. В случае A все клетки поддерживали в присутствии доксициклина. В случае B их сравнивали в присутствии или в отсутствие доксициклина. Экспрессию Cre выявляли с помощью Вестерн-блота.
На фигуре 6 в виде диаграммы представлен вирус AdTetCre и его функционирование. Сигнал упаковки (Ψ) фланкирован сайтами LoxP в такой же ориентации. Трансактиватор rtTA-M2 находится под контролем конститутивного промотора гена PGK мыши, а белок MerCreMer находится под контролем своего индуцируемого промотора TetO-palb. В присутствии доксициклина трансактиватор rtTA-M2 димеризуется и связывается с промотором TetO-palb. Это активирует экспрессию белка MerCreMer, который будет активным в присутствии тамоксифена, узнавая сайты LoxP и удаляя сигнал упаковки, предотвращая при этом капсидирование вируса-помощника. ITR, инвертированный концевой повтор.
На фигуре 7 показана рекомбинация между плазмидами pAdLoxPMerCre и pShutMer с образованием генома вируса AdTetCre. В клетки 293tTs совместно трансфицировали две плазмиды pShutMer и pAdLoxPMerCre, расщепленные ферментом рестрикции Рас I. Между гомологичными областями обеих плазмид происходила рекомбинация, при этом геном инфекционного аденовируса восстанавливался с полной кассетой экспрессии для MerCreMer и сигналом упаковки, фланкированным сайтами LoxP.
На фигуре 8 показана регуляция экспрессии белка MerCreMer вируса AdTetCre. Клетки 293tTs инфицировали вирусом AdTetCre, используя MOI 2 вируса/клетку, в течение 48 часов в присутствии (дорожки 7-9) или в отсутствие (дорожки 4-6) обработки тамоксифеном и доксициклином. Экстракт клеток 293 загружали на дорожку 2, чтобы подтвердить выявление рекомбиназы дикого типа с помощью антитела. Клетки 293tTs на дорожке 3 трансфицированы плазмидой pANMerCreMer. Дорожка 1 соответствует нетрансфицированным клеткам 293 в качестве негативного контроля. Экспрессию Cre и MerCreMer регистрировали с помощью иммуноблоттинга.
На фигуре 9 показана регуляция продукции вируса AdTetCre. Клетки 293tTs, 293 and 293Cre4 инфицировали, используя MOI 2 вируса/клетку, вирусом AdTetCre в течение 48 часов, и количественно оценивали продукцию инфекционного вируса в клеточных экстрактах. Клетки получали предварительную 24-часовую обработку доксициклином (Dox), тамоксифеном (Tam), обоими средствами одновременно (T/D) или оставались необработанными в течение данного периода (контроль), как указано. Обработки продолжали во время инфекции.
На фигуре 10 показана регуляция продукции вируса AdTetCre по сравнению со стандартным аденовирусом-помощником. Клетки 293tTs, 293 и 293Cre4 инфицировали, используя MOI 2 вируса/клетку, вирусом AdTetCre или AdLC8cluc. Клетки получали предварительную 24-часовую обработку доксициклином и тамоксифеном (T/D) или оставались необработанными в течение данного периода (контроль), как указано. Обработки продолжали во время инфекции. В конце 48-часового периода количественно оценивали продукцию инфекционного вируса в клеточных экстрактах.
На фигуре 11 показано вырезание сигнала упаковки вируса AdTetCre и AdLC8cluc. (A) Клетки 293 инфицировали, используя MOI 2 вируса/клетку, вирусом AdTetCre в течение 48 часов. Клетки получали предварительную 24-часовую обработку доксициклином и тамоксифеном (дорожка 4) или оставались необработанными в течение данного периода времени (дорожка 3), как указано. Обработки продолжали во время инфекции, после указанного периода времени ДНК инфицированных клеток экстрагировали, и область, соответствующую началу вирусного генома, амплифицировали в ПЦР. ПЦР-продукт при использовании плазмиды pShutMer в качестве матрицы, при этом такая плазмида содержит ту же самую область генома (дорожка 2), или очищенного вируса AdTetCre, полученного в клетках 293tTs (дорожка 1), показан в качестве контроля. (B) Клетки 293Cre4 (дорожка 2) инфицировали, используя MOI 2 вируса/клетку, вирусом AdLC8cluc, и спустя 48 часов экстрагировали ДНК. ПЦР-анализ осуществляли, как описано в предыдущем разделе. ДНК очищенного вируса AdLC8cluc, полученного в клетках 293 (дорожка 1), использовали в качестве контроля. Размер, соответствующий фрагменту с интактным или вырезанным сигналом упаковки, показан черной или белой стрелкой, соответственно.
На фигуре 12 показано применение вируса AdTetCre для получения НС-Ad. (A) Клетки 293Cre4 трансфицировали плазмидой, содержащей геном НС-Ad KCZ, и спустя 6 часов инфицировали, используя MOI 1, вирусом-помощником AdTetCre. Клетки собирали через 48 часов (пассаж 0). Лизат предыдущего пассажа использовали в последующих пассажах, чтобы инфицировать больше клеток 293Cre4 с использованием MOI 1 вируса AdTetCre. Пассажи 0-3 осуществляли на чашках диаметром 60 мм. Пассаж 4 соответствует 2 чашкам диаметром 150 мм, пассаж 5-8 чашкам диаметром 150 мм и пассаж 6 эквивалентен 30 чашкам диаметром 150 мм. Количество вирусов KCZ и AdTetCre оценивали в каждом пассаже с помощью иммуноцитохимии. Во всех случаях клетки обрабатывали доксициклином и тамоксифеном. (B) Такой же протокол использовали в случае клеток 293 вплоть до пассажа 4. (C) Такому же протоколу следовали в случае клеток 293Cre4, используя вирус-помощник AdLC8cluc без обработки доксициклином и тамоксифеном.
На фигуре 13 показана кинетика экспрессии белка MerCreMer вируса AdTetCre. Клетки 293 подвергали 24-часовой предварительной обработке тамоксифеном и доксициклином, после которой их инфицировали вирусом AdTetCre, используя MOI 2 вируса/клетку. Через 6, 12, 36 и 48 часов клетки собирали и анализировали экспрессию MerCreMer с помощью иммуноблоттинга. Экстракт неинфицированных клеток 293 загружали на контрольную дорожку.
На фигуре 14 показано применение вируса AdTetCre для получения HC-Ad, несущего терапевтический трансген. (A) Были инфицированы клетки Huh-7 (полученные из гепатокарциномы человека) с разным количеством вектора HC-Ad, экспрессирующего мышиный IL-12 (GL-Ad/RUmIL-12), в присутствии индуктора Мифепристон. (B) Вектор HC-Ad, экспрессирующий мышиный IL-12 (GL-Ad/RUmIL-12), вводили внутривенно мышам и после внутрибрюшинного введения индуктора Мифепристон измеряли количество MIL-12, присутствующее в сыворотке (RU486). Индукцию и измерение mIL-12 осуществляли на 7, 48 и 62 сутки после инъекции вектора и проверяли, что мыши стабильно экспрессировали высокие количества трансгена. Индукцию измеряли MIL-12 через 7, 48 и 62 суток после инъекции вектора, и было обнаружено, что мыши стабильно экспрессируют высокие количества трансгена.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы изобретения показали, что аденовирусные векторы-помощники, в которых последовательность упаковки фланкирована сайтами-мишенями узнавания рекомбиназой, и которые дополнительно содержат последовательность, кодирующую рекомбиназу, при этом указанная последовательность оперативно связана с индуцируемым промотором, неожиданно обеспечивает возможность образования аденовируса, лишенного существенного внутреннего содержимого, с низкой степенью загрязнения вирусами-помощниками. Не связывая изобретение с какой-либо теорией, считают, что включение колирующей последовательности в существующий аденовирус-помощник позволяет увеличить экспрессию рекомбиназы параллельно с увеличением копий существующего вируса, так что всегда имеется достаточное количество рекомбиназы, чтобы вырезать последовательность упаковки из всех копий генома аденовируса-помощника, и она всегда нечувствительна к ингибированию экспрессии клеточных белков, вызванному существующим вирусом. На фигуре 1 показаны сравнительные схемы способов упаковки обычного аденовируса, при которых рекомбиназа экспрессируется клеткой, в которой осуществляется указанная упаковка (левая панель), или способа согласно изобретению, при котором рекомбиназа экспрессируется геномом существующего вируса-помощника (правая панель). В экспериментальной части иллюстративным образом (смотри пример 3) описано, что аденовирусы, имеющие характерные признаки согласно изобретению, экспрессируют рекомбиназу, зависимую от присутствия доксициклина в среде.
Полинуклеотид согласно изобретению
Таким образом, в первом аспекте изобретение относится к полинуклеотиду, содержащему:
(a) область, кодирующую сайт-специфичную рекомбиназу, при этом указанная область находится под оперативным контролем индуцируемого промотора, и
(b) область, необходимую для репликации и/или упаковки аденовирусного генома, фланкированную последовательностями узнавания, специфичными для рекомбиназы, кодируемой последовательностью по п. (a), при этом указанные последовательности узнавания ориентированы так, чтобы вырезание указанной необходимой области происходило в присутствии указанной рекомбиназы.
Согласно изобретению подразумевают, что сайт-специфичная рекомбиназа представляет собой белок, который способен стимулировать сайт-специфичную рекомбинацию между сайтами-мишенями для указанной рекомбиназы. Рекомбиназы, подходящие для использования в изобертении, включают рекомбиназу Cre фага P1 (LoxP), рекомбиназу FLP S. cerevisiae (Frt), интегразу из фага ФС31 Streptomyces (attB, attP), рекомбиназу TP901-1, рекомбиназу R4 или интегразу лямбда. В предпочтительном варианте, рекомбиназой, кодируемой полинуклеотидом согласно изобретению, является рекомбиназа Cre, которая включает как рекомбиназу Cre фага P1, которая исходно описана Abreinski и Hoess (J. Biol. Chem. 1984, 259: 1509-1514), а также слитые белки, содержащие последовательность рекомбиназы и второй полипептид, регулирующий активность рекомбиназы. Рекомбиназа Cre, как при использовании как таковой, так и при использовании в форме слитого белка, может быть модифицирована так, чтобы она обладала более широкой специфичностью по отношению к последовательностям-мишеням, как описано в WO2000060091.
В том случае, когда полинуклеотид согласно изобретению содержит последовательность, кодирующую слитый белок, включающий в себя рекомбиназу, возможно использование полипептидов, действующих как активируемые последовательности ядерной локализации, т.е., они действуют по существу только в присутствии определенного лиганда. Таким образом можно легко регулировать активность рекомбиназы, так чтобы она перемещалась в ядро и проявляла свою активность только в присутствии указанного лиганд. В предпочтительном варианте источником активируемой последовательности ядерной локализации является ядерный рецептор. Последовательностями ядерной локализации, подходящими для применения в изобретении, являются последовательность локализации, полученная из PPAR (рецепторы, активируемые пролифератором пероксисом), которая перемещается в ядро в присутствии 15-дезокси-[дельта]-простагландина J2, из рецепторов ретиноевой кислоты, которая перемещается в ядро в присутствии альфа-, бета- или гамма-изомеров 9-цис-ретиноевой кислоты, из X-рецепторов фарнезоидов, активируемых ретиноевой кислотой и TTNPB, из X-рецепторов печени, активируемых 24-гидроксихолестерином, X-рецепторов бензоатов, активируемых 4-аминобутилбензоатом, из конститутивного рецептора андростана, рецепторов прегнана, индуцируемых прегнолон-16-карбонтрила из рецепторов стероидов и ксенобиотиков, индуцируемых рифампицином, из рецепторов прогестерона, индуцируемых медроксипрогестероном, а также агонистами и антагонистами мифепристона и производными 19-норэтистерона, из рецепторов глюкокортикоидов, активируемых глюкокортикоидами, из рецепторов тиреоидных гормонов, активируемых T3 и/или T4, и из рецепторов эстрогенов, активируемых эстрогенами и их производными, такими как 17-бета-эстрадиол и эстрадиол. Альтернативно можно использовать слитый белок, который инактивируется посредством его связывания с другим белком, и который в присутствии лиганда в результате диссоциации отщепляется от указанного дополнительного белка, таким образом приводя к индуцируемой активации слитого белка.
Активируемая последовательность ядерной локализации предпочтительно соответствует домену связывания лиганда рецептора эстрогена, который описан в WO0228175. В контексте изобретения термин «домен связывания лиганда» означает последовательность домена связывания эстрогена рецептора эстрогена и предпочтительно его вариантов, содержащих одну или несколько мутаций, возникающих в результате инсерции, делеции и/или замены одной или несколько аминокислот, но который сохраняет по существу интактную способность к транслокации в ядро в присутствии определенного лиганда, хотя предпочтительные лиганды таких вариантов могут варьировать по сравнению с лигандами рецептора дикого типа. Таким образом, изобретение включает в себя применение последовательностей ядерной локализации предпочтительно отвечающих на природные лиганды рецепторов эстрогена (эстрадиол, эстриол или эстрон) или на их различные агонисты и антагонисты, такие как тамоксифен, ICI 164384, RU 54876, диэтилстилбестрол, ралоксифен, зукломифен и торемифен.
Рекомбиназа и последовательность ядерной локализации могут встречаться в любом положении относительно другого элемента слитого белка. Следовательно, изобретение охватывает полинуклеотиды, кодирующие слитые белки, в которых C-концевая область последовательности ядерной локализации связана с N-концевой областью рекомбиназы, полинуклеотиды, кодирующие слитые белки, в которых C-концевая область рекомбиназы связана с N-концевой областью последовательности ядерной локализации, и предпочтительно полинуклеотиды, кодирующие слитые белки, образованные рекомбиназой, фланкированной двумя последовательностями ядерной локализации, которые могут быть идентичными или разными, хотя предпочтительно они являются идентичными. Кроме того, изобретение охватывает применение вариантов последовательности ядерной локализации, которая проявляет аффинность по отношению к лигандам, отличающуюся от аффинности, проявляемой последовательностью ядерной локализации рецептора дикого типа. Таким образом, изобретение охватывает применение последовательности связывающего лиганд домена рецептора эстрогена, содержащего мутацию G512R (пронумеровано в соответствии с нумерацией рецептора эстрогена человека). Такая мутация приводит к получению аффинности связывающего лиганд домена с природным лигандом, которая в 1000 раз меньше, чем аффинность, проявляемая связывающим лиганд доменом рецептора дикого типа, но она, однако, не влияет на его аффинность по отношению к 4-гидрокситамоксифену. Таким образом, можно стимулировать транслокацию слияния с белком, обладающим активностью рекомбиназы, используя 4-гидрокситамоксифен, не влияя на возможный ответ пакующей клетки на эстрогены. Альтернативно связывающий лиганд домен рецептора эстрогена может содержать мутации G400V/M543A/L544A, которые приводят получению связывающего лиганд домена, который в 10 раз более чувствителен, транслокация которого в ядро может быть активирована с использованием дозы, которая в 4 раза ниже, чем доза, необходимая для активации ядерной транслокации мутанта G512R. Альтернативно связывающий лиганд домен может содержать мутации M543 и L544A, приводящие к образованию молекулы, проявляющей чувствительность к тамоксифену и 4-гидрокситамоксифену, которая в 10 раз выше чувствительности, проявляемой мутантом G400V/M543A/L544A. В предпочтительном варианте активируемой последовательностью ядерной локализации является связывающий лиганд домен рецептора эстрогена человека (Metger et al., 1995, Proc. Natl. Acad. Sci USA, 92: 6991-6995) или вариант G521R такого домена, который описан Feil et al. (Proc. Natl. Acad. Sci. USA, 1996, 93: 10887-10890). В другом предпочтительном варианте рекомбиназа содержит вариант G525R последовательности ядерной локализации, активируемой эстрогенами, полученной из рецептора эстрогена мыши (аминокислот 281-599 указанного рецептора), на каждом конце белка, как, например, белок MerCreMer, подробно описанный Verrou с соавторами (Biol. Chem., 1999, 380: 1435-1438) и Tannour-Louet M. с соавторами (Hepatology, 2002; 35: 1072-1081), при этом содержание указанных публикации включено в настоящее описание в виде ссылки.
Полинуклеотид согласно изобретению содержит последовательность, кодирующую рекомбиназу, которая находится под оперативным контролем индуцируемого промотора. В контексте изобретения индуцируемый промотор понимают как любую последовательность ДНК, которая способна стимулировать транскрипцию полинуклеотида, расположенного в 3'-направлении, в присутствии соединения или в определенных условиях. Предпочтительно индуцируемыми промоторами, которые можно использовать в контексте изобретения, являются промоторы, отвечающие на индуцирующий агент, которые дают нулевую или незначительную базовую экспрессию в отсутствие индуцирующего агента и которые способны стимулировать активацию гена, локализованного в 3'-положении. В зависимости от типа индуцирующего агента индуцируемые промоторы классифицируют как включаемые/выключаемые Tet-промоторы (Gossen, M. and H. Bujard (1992) Proc. Natl. Acad. Sci. USA, 89: 5547-5551; Gossen, M. et al., 1995, Science 268: 1766-1769; Rossi, F.M.V. and H.M. Blau, 1998, Curr. Opin. Biotechnol. 9: 451-456); включаемые/выключаемые Pip-промоторы (US 6287813); зависимые от антипрогестина промоторы (US 2004132086), зависимые от экдизона промоторы (Christopherson et al., 1992, Proc. Natl. Acad. Sci. USA, 89: 6314-6318; No et al., 1996, Proc. Natl. Acad. Sci. USA, 93: 3346-3351, Suhr et al., 1998, Proc. Natl. Acad. Sci. USA, 95: 7999-8004 и WO9738117), зависимый от металлотионеина промотор (WO8604920) и зависимые от рапамицина промоторы (Rivera et al., 1996, Nat. Med. 2: 1028-32).
В предпочтительном варианте индуцируемый промотор представляет собой зависимую от тетрациклина систему. Такая система позволяет получать высокие уровни экспрессии, регулируемой тетрациклином или его производными, такими как доксициклин. В такой системе экспрессия гена активируется в присутствии доксициклина и инактивируется в отсутствие доксициклина. Такая система основана на двух регуляторных элементах, встречающихся в опероне резистентности к тетрациклину E. coli, в частности, последовательности тетрациклинового оператора, с которой связывается тетрациклиновый репрессор. Представляющий интерес ген клонируют в 3'-направлении относительно промотора, содержащего несколько элементов ответа на тетрациклин. Вторая плазмида содержит последовательность, кодирующую регуляторный элемент, который называют регулируемым тетрациклином трансактиватором, который состоит из транскрипционного фактора VP16 вируса простого герпеса и тетрациклинового репрессора дикого типа (rtTA-M2, описанного в Zabala с соавторами в Cancer Res., 64: 2799-2804). Следовательно, в присутствии доксициклина слитый белок, образованный тетрациклиновым репрессором и VP16, взаимодействует с индуцируемым промотором, стимулируя транскрипцию гена, расположенного в 3'-напралвении по отношению к промотору. Указанный индуцируемый промотор предпочтительно образован несколькими копиями Tet-оператора (TetO), слитыми с минимальным промотором, таким как, например, минимальный промотор CMV, промотор из 29 пар нуклеотидов центрального белка вируса гепатита В человека или промоторы из 5'-области гена альбумина мыши из 196 или 84 пар нуклеотидов или промотор альбумина (Zabala et al., 2004, выше).
Специалисту в данной области будет понятно, что трансактиватор ответа на тетрациклин может кодироваться геномом клетки, используемой для упаковки, имеющимся полинуклеотидом, содержащим последовательность, кодирующую рекомбиназу, под контролем промотора, чувствительного к тетрациклину, или в предпочтительном варианте и геномом и полинуклеотидом. Количество продуцируемого трансактиватора, таким образом, будет зависеть от количества копий аденовирусного генома в клетке, что в свою очередь позволит адаптировать количество трансактиватора к количеству промоторов, присутствующих в клетке. Последовательность, кодирующая трансактиватор, регулируется конститутивным промотором. Конститутивными промоторами, подходящими для регуляции зависимого от лиганда трансактиватора наряду с другими являются промотор CMV, промотор SV40, промотор DHFR, промотор вируса опухоли молочной железы мышей (MMTV), промотор фактора элонгации 1a (EF1a), промотор альбумина, промотор ApoA1, промотор кератина, промотор CD3, промотор тяжелой или легкой цепи иммуноглобулина, промотор нейрофиламентов, промотор специфичной для нейронов енолазы, промотор L7, промотор CD2, промотор киназы легкой цепи миозина, промотор гена HOX, промотор тимидинкиназы, промотор РНК-полимеразы II, промотор гена MyoD, промотор гена фосфоглицерокиназы (PGK), промотор липопротеида низкой плотности (LDL), промотор гена актина. В предпочтительном варианте промотором, регулирующим экспрессию трансактиватора, является промотор гена PGK.
Полинуклеотид согласно изобретению также содержит область, необходимую для репликации и/или для упаковки аденовируса, которая фланкирована сайтами-мишенями рекомбиназы, которая кодируется указанным полинуклеотидом. Области аденовирусного генома, необходимые для репликации и/или для упаковки указанного генома, включают в себя инвертированные концевые повторы (ITR) и аденовирусную последовательность упаковки Ψ.
Согласно изобретению термин «инвертированный концевой повтор» или «ITR» понимают как последовательности длиной примерно 100 пар нуклеотидов, которые находятся с обеих сторон от линейного генома аденовируса и которые необходимы для репликации аденовирусного генома (Stow, N.D., 1982, Nucl. Acid. Res, 10: 5105-5109).
Согласно изобретению термин «аденовирусный сигнал упаковки Ψ» понимают как последовательность длиной примерно 160 пар нуклеотидов, которая в случае аденовируса серотипов 2 и 5 находится между положениями 190 и 350 генома. Удаление последовательности генома аденовируса предотвращает эффективное включение молекул ДНК, которые образуются во время размножения вируса, в недавно образованные капсиды (Hearing, P. et al., 1987, J. Virol., 61: 2555-2558), но не предотвращает репликацию указанного генома в пакующей клетке, в отличие от удаления ITR.
В предпочтительном варианте область аденовирусного генома, образующая часть полинуклеотида согласно изобретению, представляет собой аденовирусный сигнал упаковки. Очевидно, что соответствующие сайты-мишени, фланкирующие аденовирусный сигнал упаковки, должны быть выбраны на основе рекомбиназы, которая кодируется полинуклеотидом согласно изобретению. Следовательно, если рекомбиназа, кодируемая полинуклеотидом, представляет собой рекомбиназу Cre, последовательность упаковки должна быть фланкирована сайтами LoxP. Если рекомбиназа, кодируемая полинуклеотидом, представляет собой рекомбиназу FLP, последовательность упаковки должна быть фланкирована сайтами FRT. В предпочтительном варианте рекомбиназа, кодируемая полинуклеотидом согласно изобретению, представляет собой рекомбиназу Cre, и сайты-мишени указанной рекомбиназы (сайты LoxP) фланкируют последовательность упаковки Ψ в одном и том же направлении, так что происходит вырезание последовательности, находящейся между ними.
Сайты LoxP образованы последовательностью из 34 пар нуклеотидов, которые в свою очередь образованы двумя инвертированными повторами из 13 пар нуклеотидов, фланкирующими центральную область из 8 пар нуклеотидов. Изобретение также охватывает применение вариантов последовательности LoxP дикого типа, которые неспособны подвергаться рекомбинации с последовательностями LoxP, но которые могут рекомбинировать только с идентичными вариантами LoxP, такими как варианты, описанные в WO199925851 и WO2007085906. Такие варианты последовательности LoxP особенно применимы, когда клетка, которую намереваются использовать для упаковки аденовируса, содержит области с своем геноме, фланкированные последовательностями LoxP дикого типа. Вариантами последовательности LoxP, применимыми в контексте изобретения, являются последовательности loxP, 1охР2, 1охР511, loxP514, loxB, loxC2, loxL, loxR, 1охА86, 1охА117, 1охРЗ и loxP23.
Аденовирусный вектор-помощник согласно изобретению
Описанные ранее полинуклеотиды согласно изобретению могут образовывать часть экспрессирующего вектора или могут быть применимы для конструирования экспрессирующего вектора, включающего в себя последовательности, необходимые для его функционирования в качестве аденовирусного вектора. Следовательно, в другом аспекте изобретение относится к экспрессирующему вектору, содержащему полинуклеотид согласно изобретению. В предпочтительном варианте вектором, содержащим полинуклеотид согласно изобретению, является аденовирусный вектор-помощник.
В контексте изобретения «вектор-помощник» понимают как вектор, способный частично или полностью транс-комплементировать рекомбинантный вирусный вектор, который не способен к репликации. Поэтому он представляет собой вектор, который рано или поздно способен продуцировать, по меньшей мере, один полипептид, который рекомбинантный вектор не способен продуцировать, и который необходим для образования вирусной частицы. Векторы-помощники могут полностью комплементировать аденовирусный вектор, т.е. вектор-помощник способен продуцировать все компоненты аденовируса, необходимые для репликации, которые отсутствуют у аденовирусного вектора, или он может только частично комплементировать аденовирусный вектор, т.е. способен комплементировать только часть функций, которых лишен аденовирусный вектор.
Специалисту в данной области будет понятно, что последовательность аденовирусного вектора-помощника будет зависеть от аденовирусного вектора, который используют, с учетом того, что в зависимости от количества кодирующих последовательностей аденовирусного генома, которые отсутствуют в аденовирусном векторе, вектор-помощник должен включать в себя большее или меньшее количество последовательностей, чтобы обеспечить репликацию и упаковку указанного аденовирусного вектора. В том случае, когда аденовирусный вектор представляет собой вектор, лишенный существенного внутреннего содержимого (также известный аденовирусный вектор с высокой емкостью или зависимый от помощника вектор), вектор-помощник согласно изобретению должен включать в себя фактически все ранние и поздние области транскрипции аденовируса, за исключением ранней области E3, которая не является обязательной для вирусной репликации in vitro, и предпочтительно также области E1, которую может обеспечить пакующая клетка. В предпочтительном варианте вектор-помощник согласно изобретению содержит геном аденовирусного вектора первого поколения, отличающийся тем, что он не содержит кодирующих последовательностей белков E1 и E3, и в котором ген, кодирующий рекомбиназу встроен вместо области, кодирующей белок E1. Таким образом, аденовирусный вектор-помощник согласно изобретению содержит следующие элементы:
- инвертированный 5'-концевой повтор,
- последовательность упаковки Ψ, фланкированная сайтами-мишенями узнавания рекомбиназой,
- последовательность рекомбиназы под контролем индуцируемого промотора,
- аденовирусные кодирующие последовательности, за исключением областей E1 и E3,
- инвертированный 3'-концевой повтор.
В предпочтительном варианте геном вируса-помощника кодирует трансактиватор, который способен стимулировать экспрессию рекомбиназы в присутствии лиганда. В еще более предпочтительном трансактиватором является трансактиватор rtTA-M2, образованный тетрациклиновым репрессором, связанным с белком VP16 вируса простого герпеса, и в таком случае стадию (iii) способа осуществляют в присутствии аналога тетрациклина, предпочтительно доксициклина.
На фигуре 2 представлена диаграмма аденовирусного вектора согласно изобретению, включающего в себя последовательность, кодирующую транскрипционный трансактиватор под контролем промотора гена PGK, в котором рекомбиназа находится под контролем промотора, образованного несколькими повторами tet-оператора, связанными с минимальным промотором гена альбумина.
Последовательность упаковки Ψ предпочтительно фланкирована сайтами LoxP. В еще более предпочтительном варианте рекомбиназа представляет собой рекомбиназу Cre или рекомбиназу MerCreMer, которые могут быть под контролем промотора, образованного серией повторов оператора TetO и минимальным промотором, таким как, например, промотор альбумина. Также можно использовать ослабленные последовательности упаковки, также фланкированные сайтами-мишенями рекомбиназы. Такие сигналы проявляют более низкую способность к капсидированию и могут быть получены, например, посредством делеции области упаковки, как описано в WO9428152.
Также можно повысить безопасность вектора-помощника с помощью использования пары сайтов-мишеней узнавания дополнительными рекомбиназами, фланкирующих другую существенную область генома указанного аденовируса, такую как, например, области ITR, так чтобы присутствие рекомбиназы вызывало удаление более одной области генома аденовируса, которые являются обязательными для его репликации или капсидирования.
Специалисту в данной области будет понятно, что вектор-помощник может представлять собой реплицируемый вирус, т.е. он имеет все гены, необходимые для его репликации и упаковки, или он может представлять собой дефектный аденовирус по одному или нескольким генам, в целях предотвращения возможного размножения аденовирусного вектора в окружающей области. В связи с тем, что такие белки необходимы для размножения аденовируса, они должны быть представлены в транс-положении, предпочтительно клетками, используемыми для упаковки. Линиями клеток, подходящими для такой цели, являются клетки линии 293 (Graham et al., 1977, J. Gene. Virol. 36, 59-72), полученные из клеток эмбриональной почки человека и способные комплементировать функцию E1, при условии, что они содержат 5'-конец аденовируса типа-5, интегрированные в их геном, клетки линии W162, которые способны комплементировать функции E1 и/или E4 аденовируса (Weinberg et al., Proc. Natl. Acad. Sci. USA, 1983, 80: 53 83-5386), клеточные линии, способные комплементировать полный геном аденовируса типа-5 или функции E1 и E4 (WO9428152), линия N52, линия Perc и тому подобные.
Аденовирусный вектор-помощник согласно изобретению может находиться в виде полинуклеотида, содержащего все ранее описанные функции, или альтернативно, если полинуклеотид был создан и/или амплифицирован с помощью его трансфекции в пермиссивные клетки, он будет приводить к образованию целых аденовирусных частиц, которые могут быть извлечены из пакующих клеток и использованы в качестве векторов-помощников вместо полинуклеотида. Таким образом, в другом аспекте изобретение относится к аденовирусной частице, содержащей последовательность полинуклеотида согласно изобретению. В контексте настоящего изобретения подразумевают, что аденовирусная частица представляет собой частицу, образованную двунитевой молекулой ДНК, образующей аденовирусный геном, как описано, например, Shenk, T. (Adenoviridae: The viruses and their replication, 1996, In Fields Virology. B.N. Fields, D.M. Knipe, and P.M. Howley, eds. (Lippincott-Raven, Philadelphia, PA) pp. 2111-2147).
Системы и способы размножения аденовирусов-помощников согласно изобретению
Векторы-помощники согласно изобретению можно амплифицировать с помощью последовательных циклов репликации в пермиссивных эукариотических клетках. Поэтому в другом аспекте изобретение относится к системе для репликации и упаковки рекомбинантного аденовируса, включающей в себя:
a) полинуклеотид согласно изобретению, экспрессирующий вектор согласно изобретению или аденовирусную частицу согласно изобретению, и
b) эукариотическую клетку.
Специалисту в данной области будет понятно, что для репликации аденовируса в эукариотической клетке требуется, чтобы экспрессия рекомбиназы, кодируемой полинуклеотидом согласно изобретению, не происходила, в связи с тем, что если рекомбиназа экспрессируется, она может вызывать вырезание области аденовирусного генома, которая фланкирована сайтами-мишенями указанной рекомбиназы, что может предотвращать размножение новых вирусов-помощников. В том случае, когда последовательность, кодирующая рекомбиназу, находится под контролем тетрациклинового оператора, последний имеет низкий базальный уровень экспрессия. Однако такая базальная экспрессия может быть еще больше снижена, если клетки, в которых происходит размножение аденовируса-помощника, экспрессируют зависимый от тетрациклина репрессор, который способен предотвращать транскрипцию генов, расположенных в 3'-направлении по отношению к тетрациклиновым операторам, в отсутствие доксициклина. Таким образом, в предпочтительном варианте клетка, составляющая компонент (b) системы для репликации аденовируса согласно изобретению содержит специфичный для промотора транскрипционный репрессор, регулирующий экспрессию сайт-специфичной рекомбиназы. В предпочтительном варианте, если промотором, регулирующим экспрессию рекомбиназы, является промотор, активируемый тетрациклином или его аналогом (доксициклином), репрессор, экспрессируемый пакующей клеткой, представляет собой репрессор, который активируется в отсутствие указанного лиганда. Следовательно, в предпочтительном варианте пакующие клетки согласно изобретению содержат полинуклеотид, экспрессирующий зависимый от тетрациклина репрессор, который в отсутствие тетрациклина или доксициклина связывается с Tet-операторами, блокируя транскрипцию. Специфичным для tet-оператора репрессором предпочтительно является репрессор rtTS. В еще более предпочтительном варианте репрессор rtTS находится под оперативным контролем конститутивного промотора. Промотором, регулирующим экспрессию rtTS, предпочтительно является промотор эукариотического фактора элонгации EF1a.
На левой панели на фигуре 3 показан механизм, обеспечивающий репрессию экспрессии гена, кодирующего рекомбиназу, в отсутствие доксициклина.
Кроме того, в том случае, когда рекомбиназа содержит активируемую последовательность ядерной локализации, размножение аденовируса-помощника должно осуществлять в отсутствие лиганда, способного активировать указанную последовательность ядерной локализации, так что даже если имеется минимальное количество рекомбиназы вследствие базальной транскрипции указанного гена, она остается в цитоплазме и не способна проявлять свою рекомбиназную активность по отношению к аденовирусному геному.
Векторы-помощники согласно изобретению и системы для их упаковки можно использовать для амплификации указанных векторов. Таким образом, в другом аспекте изобретение относится к способу (далее первому способу согласно изобретению) получения рекомбинантного аденовируса-помощника, включающему в себя:
(i) осуществлении контакта клетки с полинуклеотидом согласно изобретению, с экспрессирующим вектором согласно изобретению или аденовирусной частицей согласно изобретению и, необязательно, с одним или несколькими полинуклеотидами, кодирующими аденовирусные белки, необходимые для упаковки и репликации аденовируса в клетке, в подходящих условиях, так чтобы происходило проникновение в клетку аденовирусного генома или полинуклеотида, содержащего указанный геном,
(ii) поддерживание клетки в подходящих условиях, чтобы обеспечить возможность упаковки и репликации аденовируса в клетке и предотвратить экспрессию сайт-специфичной рекомбиназы, и
(iii) извлечение аденовирусов из среды.
Стадия (i) первого способа согласно изобретению включает в себя введение генома указанного аденовируса в клетку. Специалисту в данной области будет понятно, что стадию (i) осуществляют по-разному, в зависимости от формы, в которой находится указанный аденовирусный геном. В том случае, когда указанны геном находится в виде полинуклеотида, стадия (i) включает в себя приведение указанного полинуклеотида в контакт с клеткой в условиях, которые обеспечивают его проникновение в клетку. Трансфекция может быть осуществлена с помощью микроинъекции композиции, содержащей полинуклеотид, или альтернативно с помощью копреципитации в присутствии фосфата кальция или хлорида кальция, с помощью трансфекции, опосредованной DEAE-декстраном, липофекции, электропорации, а также с использованием ряда коммерчески доступных наборов для трансфекции, на основе упомянутых способов. Эффективность трансфекции будет зависеть от ряда факторов, включая тип клетки, количество пассажей, состояния слияния клеток в монослой, а также условия трансфекции (время, форму приготовления липосом или преципитатов и т.д.). Все такие параметры могут быть определены и скорректированы с помощью обычного экспериментирования.
В том случае, когда аденовирусный вектор представляет собой аденовирусную частицу согласно изобретению, достаточно привести аденовирус в контакт с клеткой, так чтобы аденовирус инфицировал клетку естественным образом. Вирус предпочтительно приводят в контакт с клетками, используя отношение количества вирусных частиц к клетке (множественность инфекции или MOI), составляющее, по меньшей мере, примерно 1, 2, 10, 20, 30, 50, 100, 200, 2000 или любое другое подходящее значение MOI, так чтобы, по существу все клетки в культуре были инфицированы.
В том случае, когда в аденовирусном векторе-помощнике отсутствуют любые последовательности, кодирующие компоненты, необходимые для его репликации и/или упаковки, необходимо обеспечить указанные компоненты в транс-положении. Компоненты предпочтительно обеспечивают благодаря экспрессии полинуклеотидов, составляющих часть генома клеток, которые используют в качестве пакующих клеток. Следовательно, в случае аденовирусных векторов, в геномах которых отсутствуют области E1 и/или E4, клетками, которые используют на стадии (i) способа согласно изобретению, наряжу с другими, являются клетки, относящиеся к клеточным линиям 293 (Graham et al., 1977, J. Gene. Virol. 36: 59-72) и W162 (Weinberg et al., Proc. Natl. Acad. Sci. USA, 1983, 80: 5383-5386) и клеточным линиям, описанным в WO9428152, которые указаны выше.
На стадии (ii) первый способ согласно изобретению включает в себя поддерживание клеток, в которые был включен аденовирусный геном на стадии (i), в подходящих условиях, чтобы обеспечить упаковку и репликацию аденовируса в клетке и предотвратить экспрессию сайт-специфичной рекомбиназы. В связи с тем, что рекомбиназа находится под оперативным контролем индуцируемого промотора, в идеальных условиях указанный промотор не должен активировать транскрипцию, пока он не будет находится в присутствии активирующего агента. Однако все индуцируемые промоторы обладают некоторой базальной активностью, которая при наличии векторов-помощников может привести к удалению важной последовательности (предпочтительно последовательности упаковки Ψ) и тем самым привести к тому, что аденовирусные геномы становятся неспособными к капсидированию, и следовательно к уменьшению выхода процесса. Поэтому в предпочтительном варианте процесс капсидирования осуществляется в клетках, экспрессирующих репрессор транскрипции, который связывается с сайтом связывания промотора, регулирующего экспрессию рекомбиназы посредством блокирования транскрипции на основе такого связывания. Указанный репрессор транскрипции предпочтительно является активным в отсутствие лиганда, который активирует указанный транскрипционный промотор. В конкретном случае, когда используют промотор, активируемый зависимым от тетрациклина активатором rtTA, репрессор транскрипции специфично связывается с тетрациклиновыми операторами в отсутствие доксициклина, таким образом блокируя экспрессию гена рекомбиназы.
Стадию (ii) осуществляют в течение необходимого времени, так чтобы концентрация вирусных частиц была достаточно высокой, и такую концентрацию определяют стандартными способами, такими как способ Resource Q, основанный на ВЭЖХ, который описан Shabram с соавторами (Hum. Gene Ther. 1997, 8: 453-465), или опосредованно в результате визуального наблюдения цитопатического эффекта в клетках. Культивирование клеток необязательно может включать в себя добавление свежей культуральной среды.
На третьей стадии аденовирусы, образованные на стадии (ii), извлекают из культуры клеток. С этой целью понадобится отделение клеток от культуральной среды любым способом, известным специалисту в данной области (трипсинизация или механическое соскабливание и центрифугирование или фильтрация), разрушение клеток в инертном растворе (циклы замораживания/оттаивания, гомогенизация, обработка ультразвуком, кавитация, использование детергентов и тому подобное) и очистка аденовирусных частиц известными способами, такими как ультрацентрифугирование в градиенте CsCl или использование различных типов хроматографии, например сочетания ионообменной хроматографии и аффинной хроматографии с хелатами металлов (Huyghe et al., 1996, Human Gene Therapy, 6: 1403-1416), сочетания ионообменной хроматографии и фракционной хроматографии в геле (WO07059473), хроматографии на диэтиламиноэтил-(DEAE)-целлюлозе (Haruna et al., 1961, Virology 13, 264-267), хроматографии на гидроксилапатите (US2002/0064860) и хроматографии на других смолах, таких как мягкие гели (агароза), макропористые полимеры, основанные на синтетических полимерах, включая проникающую хроматографию (фрактогель) и использование материалов на основе мягкого геля в твердой капсуле (например, Ceramica HyperD® F) (Rodrigues, 1997, J. Chromatogr. В Biomed. Sci. Appl. 699: 47-61).
В другом аспекте изобретение охватывает аденовирусы-помощники, полученные первым способом согласно изобретению.
Системы и способы размножения аденовируса, содержащего представляющий интерес ген, с использованием аденовирусов-помощников согласно изобретению.
Аденовирусы-помощники, являющиеся предметом изобретения, могут быть использованы в системах для репликации и упаковки аденовирусов с высокой емкостью, содержащих представляющий интерес ген. Таким образом, в одном аспекте изобретение относится к применению полинуклеотида согласно изобретению или вектора согласно изобретению или аденовирусной частицы согласно изобретению для получения и упаковки аденовирусов с высокой емкостью.
В другом аспекте изобретение относится к системе получения рекомбинантных аденовирусов с высокой емкостью, включающей в себя:
(a) полинуклеотид согласно изобретению, экспрессирующий вектор согласно изобретению или аденовирусную частицу согласно изобретению;
(b) аденовирус, геном которого содержит представляющий интерес ген, и в котором отсутствует последовательность, кодирующая, по меньшей мере, один из белков, необходимых для репликации, или, по меньшей мере, один из белков, необходимых для упаковки указанного аденовируса, или полинуклеотид, содержащий геном указанного аденовируса, и
(c) эукариотическую клетку.
В указанной системе первый компонент по существу представляет собой компонент, описанный для систем амплификации аденовирусов-помощников, и состоит из полинуклеотида, содержащего, по меньшей мере, часть генома аденовируса-помощника, либо полностью, либо частично обеспечивающего компоненты, необходимые для репликации и упаковки аденовируса с высокой емкостью.
Второй компонент содержит аденовирусы с высокой емкостью или полинуклеотиды, содержащие геном указанного вируса, при этом в указанном геноме отсутствует последовательность, кодирующая, по меньшей мере, один из белков, необходимых для репликации, или, по меньшей мере, один из белков, необходимых для упаковки указанного аденовируса, и который необходимо амплифицировать с использованием системы согласно изобретению. Согласно изобретению, подразумевают, что термин «аденовирусы с высокой емкостью» означает рекомбинантные аденовирусы такого типа, который называют зависимыми от помощника аденовирусами или аденовирусами, лишенными существенного внутреннего содержимого, отличающимися тем, что все гены аденовирусного генома были удалены, за исключением областей 5'- и 3'-ITR и области упаковки Ψ, которые описаны, например, Alba с соавторами (Gene Therapy, 2005, 12: S18-S27). Такие аденовирусы принимают гетерологичные последовательности до 36 кД, в связи с тем, что в них отсутствуют характерные последовательности аденовирусного генома.
Гетерологичными генами, которые могут быть в ведены в вектор, лишенный существенного внутреннего содержимого способами согласно изобретению, являются гены, кодирующие эритропоэтин (EPO), лептины, кортикотропин-высвобождающий гормон (CRH), соматотропин-высвобождающий гормон (GHRH), гонадотропин-высвобождающий гормон (GnRH), тиреотропин-высвобождающий гормон (TRH), пролактин-высвобождающий гормон (PRH), мелатонин-высвобождающий гормон (MRH), пролактин-ингибирующий гормон (PIH), соматостатин, адренокортикотропный гормон (ACTH), соматотропин или гормон роста (GH), лютеинизирующий гормон (LH), фолликулостимулирующий гормон (FSH), тиреотропин (TSH или тиреостимулирующий гормон), пролактин, окситоцин, антидиуретический гормон (ADH или вазопрессин), мелатонин, мюллеров ингибирующий фактор, кальцитонин, паратиреоидный гормон, гастрин, холецистокинин (CCK), секретин, инсулиноподобный фактор роста типа I (IGF-I), инсулиноподобный фактор роста типа II (IGF-II), атриальный натрийуретический пептид (ANP), хорионический гонадотропин человека (hCG), инсулин, глюкагон, соматостатин, панкреатический полипептид (PP), лептин, нейропептид Y, ренин, ангиотензин I, ангиотензин II, фактор VIII, фактор IX, тканевой фактор, фактор VII, фактор X, тромбин, фактор V, фактор XI, фактор XIII, интерлейкин 1 (IL-1), интерлейкин 2 (IL-2), фактор некроза опухолей-alpha (TNF-a), интерлейкин 6 (IL-6), интерлейкин 8 (IL-8 и хемокины), интерлейкин 12 (IL-12), интерлейкин 16 (IL-16), интерлейкин 15 (IL-15), интерлейкин 24 (IL-24), интерфероны альфа, бета, гамма, CD3, ICAM-1, LFA-1, LFA-3, хемокины, включая RANTES 1α, MIP-1α, MIP-1β, фактор роста нейронов (NGF), полученный из тромбоцитов фаткор роста (PDGF), трансформирующий фактор роста-бета (TGF-бета), костные морфогенные белки (BMP), факторы роста фибробластов (FGF и KGF), эпидермальный фактор роста (EGF и тому подобные), васкулярный эпителиальный фактор роста (VEGF), колониестимулирующий фактор гранулоцитов (G-CSF), глиальный фактор роста, фактор роста кератиноцитов, эндотелиальный фактор роста, антитрипсин альфа-1, фактор некроза опухолей, колониестимулирующий фактор гранулоцитов и макрофагов (GM-CSF), кардиотропин 1 (CT-1), онкостатин M (OSM), амфирегулин (AR), циклоспорин, фибриноген, лактоферрин, активатор плазминогена тканевого типа (tPA), химотрипсин, иммуноглобулины, гирудин, супероксиддисмутазу, имиглюцеразу, β-глюкоцереброзидазу, α-L-гликозидазу-α, α-L-идуронидазу, идуронат-2-сульфатазу, галсульфазу, α-галактозидазу A человека, ингибитор протеиназы α-1, лактазу, ферменты поджелудочной железы (липазу, амилазу, протеазу), аденозиндезаминазу, иммуноглобулины, альбумин, ботулинические токсины типа A и В, коллагеназу, дезоксирибонуклеазу I человека, гиалуронидазу, папаин, L-аспарагиназу, лепирудин, стрептокиназу, трансформирующий фактор бета-клеток (TGF-P), ингибирующие пептиды, такие как пептиды, описанные в публикациях WO0331155, WO200519244 и WO0393293, содержание которых включено в настоящее описание в виде ссылки, кассеты экспрессии, подходящие для транскрипции молекул интерферирующих РНК (кшРНК, миРНК, микроРНК, модифицированных рибонуклеопротеидных РНК U1).
Кроме указанных гетерологичных генов лишенные существенного внутреннего содержимого аденовирусы, используемые в изобретении, могут содержать вставочные области, такие как вставочные последовательности, полученные из генома фага лямбда, описанные Parks с соавторами (J. Virol., 1999, 73: 8027-8034) или вставочная ДНК, присутствующая в pSTK120, как описано Sandig с соавторами (Proc. Natl. Acad. Sci. USA, 97: 1002-7). Такие области обычно содержат последовательности, присутствующие в геноме человека и способные увеличивать экспрессию гетерологичных генов по сравнению с контрольными аденовирусами, которые вместо указанной вставочной ДНК человека содержат фрагмент длиной 22 т.п.н. фага лямбда, описанный Parks с соавторами (J. Virol., 1999, 73: 8027-8034).
Общая длина вставочной ДНК человека может варьировать, но находится в диапазоне от 20 до 30 т.п.н., предпочтительно от 20 до 25 т.п.н. или еще более предпочтительно от 21 до 23 т.п.н., например, 22 т.п.н.. Количество последовательностей, действующих в цис-положении в указанной вставочной ДНК, может варьировать и составляет 2, 3 или 4 или больше, и такие последовательности включают без ограничения домен альфоидных повторов длиной 16,2 т.п.н. (описанный в Smith J.G. et al., 1995, Mol. Cell. Biol., 15: 5165-72); области прикрепления к матриксу (MAR), такие как, например, фрагмент длиной 4,2 т.п.н., содержащий левый конец аденовируса типа 6 или две копии области прикрепления к матриксу иммуноглобулина κ (которые описаны в Betz A.G. et al., 1994, Cell, 77: 239-248); регуляторную область гепатоцитов (HCR), такую как фрагмент длиной 1,2 т.п.н., содержащий указанную HCR (который описан в Miao et al., Molecular Therapy, 1: 522-32); или другую область прикрепления к матриксу, такую как область длиной 2,8 т.п.н. лизоцима цыпленка (которая описана Phi-Van L. et al., 1990, Mol. Cell. Biol. 10: 2302-2307), область прикрепления к матриксу 5'-области интерферона β (которая описана в Bode J. et al. 1992, Science, 10: 195-197) или другие некодирующие последовательности человека, такие как теломерные или центромерные последовательности.
Наконец, система для получения рекомбинантного аденовируса с высокой емкостью согласно изобретению дополнительно включает в себя эукариотическую клетку, в которой осуществляется процесс амплификации указанных аденовирусов. Эукариотические клетки, подходящие для применения в указанной системе, включают все такие клеточные линии, которые могут быть спонтанно инфицированы аденовирусом (если аденовирусы являются компонентами (a) и (b) системы), или клеточные линии, чувствительные к трансфекции полинуклеотидами, содержащими геномы аденовирусов с высокой емкостью и аденовирусов-помощников. Кроме того, если геном аденовируса-помощника не содержит последовательности, кодирующей трансактиватор, способный активировать экспрессию рекомбиназы, клетки, составляющие компонент (c), должны экспрессировать указанный трансактиватор, предпочтительно стабильно и предпочтительно под контролем конститутивного промотора. Это может быть полезным для ускорения кинетики экспрессии рекомбиназы, входящей в состав аденовируса-помощника, и, следовательно, для облегчения вырезания его последовательности упаковки. В предпочтительном варианте можно использовать клетки, экспрессирующие рекомбиназу, сайты-мишени которой фланкируют важную область генома аденовируса-помощника, так чтобы в дополнение к рекомбиназе, продуцируемой действующим аденовирусом-помощником, имелось дополнительно количество рекомбиназы, продуцируемой данной клеткой, с тем, чтобы получить более высокую эффективность удаления всех реплицируемых геномов аденовирусов-помощников. Изобретение предпочтительно охватывает применение постоянных клеточных линий, стабильно экспрессирующих рекомбиназу Cre, таких как линия 293Cre (Parks с соавторами, выше). Рекомбиназа, экспрессируемая клеткой, может быть под контролем конститутивного промотора или может быть под контролем индуцируемого промотора, который может быть таким же или другим, отличным от промотора, используемого для регуляции экспрессии рекомбиназы, кодируемой аденовирусом-помощником. Конститутивными и индуцируемыми промоторами, которые можно использовать для регуляции экспрессии рекомбиназы, кодируемой клеткой, являются такими же, как промоторы, описанные выше.
В другом аспекте изобретение относится к способу (далее второй способ согласно изобретению) создания аденовирусного вектора с высокой емкостью, экспрессирующего представляющий интерес ген, включающему в себя следующие стадии:
(i) осуществление контакта клетки с аденовирусом, геном которого содержит представляющий интерес ген, и в котором отсутствует последовательность, кодирующая, по меньшей мере, один из белков, необходимых для репликации или для упаковки указанного аденовируса, или с полинуклеотидом, содержащим геном указанного аденовируса в подходящих условиях, так чтобы происходило проникновение в клетку генома указанного аденовируса или полинуклеотида, содержащего указанный геном,
(ii) осуществление контакта указанной клетки со вторым компонентом, выбранным из группы, состоящей из:
(a) полинуклеотида, содержащего:
1) область, кодирующую сайт-специфичную рекомбиназу, при этом указанная область находится под оперативным контролем индуцируемого промотора, и
2) аденовирусный сигнал упаковки Ψ, фланкированный последовательностями узнавания, специфичными для рекомбиназы, кодируемой последовательностью по п. (a), при этом указанные последовательности узнавания ориентированы таким образом, что в присутствии указанной рекомбиназы происходит вырезание сигнала упаковки Ψ,
(b) аденовирусного вектора, содержащего полинуклеотид по п. (a),
(c) аденовирусной частицы, содержащей полинуклеотид по п. (a),
в подходящих условиях для того, чтобы происходило проникновение в клетку указанного полинуклеотида, указанного аденовирусного вектора или генома указанной аденовирусной частицы,
(iii) поддерживание клетки в условиях, подходящих для экспрессии белков, кодируемых геномами обоих аденовирусов, и для экспрессии рекомбиназы, кодируемой полинуклеотидом, вектором или аденовирусом, используемым на стадии (ii), и
(iv) извлечение аденовируса с высокой емкостью из культуры клеток.
Стадия (i) второго способа согласно изобретению сходна с первой стадией первого способа согласно изобретению, в связи с тем, что она включает в себя приведение клетки в контакт с аденовирусный геномом, при этом указанный аденовирусный геном может быть в форме «голого» полинуклеотида или составлять часть аденовирусной частицы. В первом случае стадия (i) данного способа заключается в применении известных способов для того, чтобы полинуклеотид имел доступ внутрь клетки, которые были описаны ранее. Во втором случае достаточно привести аденовирусную частицу в контакт с клеткой, и если она экспрессирует поверхностные молекулы, действующие в качестве рецепторов для аденовирусов, последние будут спонтанно включать свой геном в клетку. В предпочтительном варианте аденовирусом, который используют на стадии (i), является аденовирусом с высокой емкостью или аденовирусом, лишенным существенного внутреннего содержимого.
Стадия (ii) второго способа согласно изобретению может быть осуществлена одновременно, до или после стадии (i), хотя ее следует осуществлять после стадии (i), чтобы предотвратить цитопатическое действие, вызванное экспрессией структурных и регуляторных белков аденовируса, в результате предотвращения эффективной репликации генома аденовируса, содержащего представляющий интерес ген. Проникновение в клетку генома аденовируса-помощника происходит либо благодаря использованию известных способов трансфекции, если указанный геном находится в виде «голого» полинуклеотида, либо путем естественной инфекции аденовирусом, если указанный геном представлен в форме аденовирусной частицы.
Стадия (iii) второго способа согласно изобретению включает в себя поддерживание клеток в подходящих условиях, чтобы обеспечить возможность экспрессии посредством клеточного аппарата транскрипции/трансляции структурных белков, кодируемых геномом аденовируса-помощника, который был введен на стадии (ii), и чтобы обеспечить репликацию генома аденовируса, содержащего представляющий интерес ген. На этой стадии необходимо обеспечить экспрессию и активность в клетке рекомбиназы, кодируемой геномом аденовируса-помощника, для того, чтобы происходило вырезание области указанного генома, необходимой для его репликации и/или капсидирования, и образование аденовирусных частиц, содержащих геном аденовируса-помощника, было максимально снижено. В предпочтительном варианте стадию (iii) осуществляют в присутствии специфичного трансактиватора, индуцирующего промотор, регулирующий экспрессию сайт-специфичной рекомбиназы. Указанный трансактиватор может быть предоставлен рассматриваемой клеткой, в которой осуществляется процесс упаковки, если полинуклеотид, который его кодирует, стабильно интегрирован в геном указанной клетки, или альтернативно в предпочтительном варианте имеющийся геном аденовируса-помощника кодирует указанный трансактиватор. В еще более предпочтительном варианте трансактиватор экспрессируется с генома аденовируса-помощника и пакующей клетки. В еще более предпочтительном варианте указанный трансактиватор требует присутствия лиганда для проявления его трансактивирующей активности, и в таком случае стадию (iii) данного способа осуществляют в присутствии указанного лиганда, чтобы обеспечить максимальную экспрессию рекомбиназы. В еще более предпочтительном варианте трансактиватором является трансактиватор rtTA-M2, образованный тетрациклиновым репрессором, связанным с белком VP16 вируса простого герпеса, и в таком случае стадию (iii) данного способа осуществляют в присутствии аналога тетрациклина, предпочтительно доксициклина.
На правой панели на фигуре 3 показан механизм, посредством которого происходит активация экспрессии рекомбиназы в присутствии доксициклина.
Как описано ранее, по существу любая рекомбиназа является подходящей для удаления сигнала упаковки вируса-помощника, при условии, что указанный сигнал упаковки фланкирован сайтами-мишенями указанной рекомбиназы в подходящей ориентации, чтобы вызвать вырезание последовательности, находящейся между обоими сигналами. В предпочтительном варианте рекомбиназой, кодируемой аденовирусом-помощником, является рекомбиназа Cre или слитый белок, содержащий указанную рекомбиназу. Дополнительным путем для обеспечения того, чтобы рекомбиназа была неактивной, когда она не используется в процессе упаковки представляющего интерес аденовируса, является использование рекомбиназы, транслокация которой в ядро зависит от присутствия лиганда, который может быть добавлен экзогенно и который связывается с клеточными белками, предотвращающими ее функционирование в отсутствие специфичного лиганда. Таким образом, в предпочтительном варианте изобретение охватывает применение слитого белка, образованного рекомбиназой Cre и, по меньшей мере, одной связывающей лиганд областью рецептора эстрогена. Такие типы слитых белков по умолчанию расположены в цитоплазме и связаны с некоторыми клеточными белками и, следовательно, не способны проявлять свою рекомбиназную функцию. Однако в присутствии эстрогена или производного (например, тамоксифена), слитый белок освобождается от связи с указанными клеточными белками и перемещается в ядро, где проявляет свою рекомбиназную функцию. В еще более предпочтительном варианте рекомбиназой, кодируемой геномом рекомбинантного аденовируса, является рекомбиназа MerCreMer, образованная рекомбиназой Cre с мутантной областью связывания лиганда рецептора эстрогена в N-концевом положении и в C-концевом положении.
На фигуре 6 в виде диаграммы показан механизм, посредством которого осуществляется экспрессия и активация рекомбиназы в присутствии доксициклина и тамоксифена.
Стадия (iv) второго способа согласно изобретению включает в себя очистку аденовирусов, лишенных существенного внутреннего содержимого, образованных на стадии (iii), и указанную стадию осуществляют по существу таким же образом, каким осуществляют очистку аденовирусов-помощников на стадии (iii) первого способа согласно изобретению, которая подробно описана выше.
Специалисту в данной области будет понятно, что аденовирусы, содержащие представляющий интерес ген, очищенные вторым способом согласно изобретению, можно применять в последующих раундах размножения, снова приводя указанный аденовирус в контакт с клеткой с последующим приведением указанной клетки в контакт с другой дозой аденовирусов-помощников, полученных первым способом согласно изобретению. Таким образом, способ согласно изобретению можно повторять поочередно несколько раз, получая большее количество аденовирусных частиц в каждом цикле.
Ниже изобретение проиллюстрировано на основе следующих примеров, представленных в иллюстративной форме и не ограничивающих объем изобретения.
ПРИМЕРЫ
ПРИМЕР 1
Конструирование вируса AdTetCre
Конструирование индуцируемой кассеты экспрессии MerCreMer.
Индуцируемая система состоит из двух независимых транскрипционных единиц. Одна из них кодирует рекомбиназу под контролем индуцируемого промотора, а другая кодирует трансактиватор под контролем конститутивного промотора (промотор гена PGK мыши). Чтобы получить первую единицу, описанную ранее плазмиду pO7Pal-luc (Zabala et al., 2004, Cancer Res. 64: 2799-2804) использовали в качестве исходной плазмиды. Указанная плазмида содержит 7 связывающих сайтов для трансактиватора и область длиной 196 п.н. 5'-конца промотора альбумина мыши, контролирующего экспрессию гена люциферазы, и сигнал полиаденилирования вируса SV40. В указанную плазмиду вводили кодирующую последовательность слитого белка MerCreMer из плазмиды pANMerCreMer (Dr. M. Reth, Max-Planck Institute for Immunobiology, Freiburg, Germany) (Verrou et al., 1999, Biol Chem. 380: 1435-8). Клонирование осуществляли, используя сайты рестрикции HindIII плазмиды pANMerCreMer и сайты HindIII и XbaI плазмиды pO7Pal-luc, получая плазмиду palbMerCreMer. Использовали промотор гена фосфоглицераткиназы (PGK) мыши, чтобы получить вторую единицу, регулирующую экспрессию трансактиватора rtTA2S-M2 (Zabala et al., 2004, выше), и синтетический сигнал полиаденилирования на основе гена бета-глобина мыши (Levitt et al., 1989, Genes Dev. 3: 1019-25). Полученная плазмида названа pGKrtTA. Обе транскрипционные единицы сливали в одной плазмиде, названной prtTAMerCre, посредством субклонирования XhoI-SalI-фрагмента плазмиды palbMerCreMer в плазмиде pGKrtTA.
Конструирование генома вектора AdTetCre.
Сначала с помощью ПЦР получали последовательность, содержащую ITR левого конца аденовируса и сигнал упаковки, фланкированный сайтами LoxP. В качестве матрицы для этой цели использовали плазмиду pGS102, содержащую геном аденовируса-помощника (E. Ayuso, Doctoral Thesis, School of Veterinary Medicine. Universidad Autonoma de Barcelona. CBATEG. 2006). Использовали следующие олигонуклеотиды:

Полученный фрагмент вводили в плазмиду pShuttle (He et al., 1998), получая плазмиду pShut-VH. Затем ориентацию бактериальных последовательностей, включенных в плазмиду (резистентность к канамицину и начало репликации) изменяли, используя расщепление ферментом PacI и повторное лигирование фрагментов. Полученная плазмида названа pShutLoxP. Затем вводили один сайт рестрикции для фермента SwaI между положениями NotI и SalI в плазмиде. С этой целью конструировали кассету посредством гибридизации олигонуклеотидов

ее расщепляли ферментами NotI и SalI и лигировали в плазмиду pShutLoxP. Полученная плазмида названа pShutSwa. Затем указанную плазмиду использовали в качестве матрицы для амплификации фрагмента, содержащего левую часть аденовирусного генома (включая последовательность капсидирования, фланкированную сайтами LoxP, и сайт узнавания SwaI). Использовали следующие олигонуклеотиды:

Полученный фрагмент вводили в ClaI-сайт плазмиды pAdEasyl (He et al., 1998, Proc. Natl. Acad. Sci. USA, 95: 2509-14). Таким образом получали плазмиду pAdLoxP2, содержащую геном аденовирусного вектора первого поколения (с делецией областей E1 и E3), в которой сигнал капсидирования фланкирован сайтами LoxP. В полученную плазмиду вводили индуцируемую кассету экспрессии белка MerCreMer из плазмиды prtTAMerCre, используя только сайт SwaI. Такая новая плазмида (pAdLoxPMerCre) должна содержать последовательность нового самоинактивирующегося аденовируса-помощника, но обнаружили, что последовательность капсидирования спонтанно вырезалась в ходе процесса амплификации такой плазмиды в E. coli, вероятно за счет экспрессии рекомбиназы MerCreMer. Чтобы решить такую проблему использовали методику, основанную на гомологичной рекомбинации в клетках млекопитающих. С этой целью фрагмент SnaBI-SapI плазмиды prtTAMerCre, содержащей индуцируемую кассету экспрессии, но с укороченной кодирующей последовательностью MerCreMer вводили в плазмиду pShutSwa. Таким образом предотвращали одновременное наличие сайтов LoxP и способности экспрессировать рекомбиназную активность в одной и той же плазмиде. Полученная плазмида названа pShutMer. Чтобы получить новый вирус-помощник, плазмиды pAdLoxPMerCre и pShutMer котрансфицировали в клетки 293tTS. Такие плазмиды имели достаточные области гомологии, способствующие рекомбинации, которая может приводить к образованию функционального вирусного генома (фигура 7). В том случае, когда в культурах клеток наблюдали явное цитопатическое действие (примерно через 10-15 дней после трансфекции), клетки лизировали и подтверждали структуру вируса с помощью ПЦР и секвенирования большинства важных областей. Отдельные клоны получали путем лимитирующего разведения в клетках 293tTS. Новый самоинактивирующийся аденовирус-помощник назван AdTetCre.
Амплификация, очистка и количественная оценка вируса
Вирус AdTetCre амплифицировали в клетках 293tTS. После того, как в большинстве клеток наблюдали цитопатический эффект, их собирали вместе с культуральной средой и центрифугировали. Надосадок отбрасывали, а клетки снова ресуспендировали в небольшом объеме 10 мМ трис, pH 8,1. Затем клетки лизировали с помощью 3 циклов замораживания и размораживания и высвобождаемый вирус очищали, используя двойной градиент хлорида цезия. Полосу, соответствующую вирусу, собирали, и соль удаляли хроматографией на колонке для эксклюзионной хроматографии по размеру (сефадекс). Определение количества вируса в инфекционных единицах осуществляли с использованием коммерческого набора для быстрого титрования AdenoX (BD Biosciences), согласно инструкциям производителя.
Экспрессия белка MerCreMer
Клетки 293tTS высевали в 6-луночном планшете (7,5×105 клеток/лунку). Через 24 часов их предварительно обрабатывали тамоксифеном (0,8 мкМ) и доксициклином (100 нг/мл) или оставляли необработанными. Во временной точке 48 часов клетки инфицировали вирусом AdTetCre, используя MOI 2 вируса/клетку, продолжая обработку тамоксифеном и доксициклином во время инфекции. Клетки собирали спустя 48 часов. В случае контроля клеток 293 такие клетки культивировали в 6-луночном планшете и собирали в тот же момент времени, что и упомянутые инфицированные клетки. Так же поступали в случае контроля клеток 293Cre4. Чтобы исследовать кинетику экспрессии белка MerCreMer, клетки обрабатывали таким же образом и собирали в разное время (6 час, 12 час, 36 час и 48 час). Для получения позитивного контроля белка MerCreMer клетки 293tTS трансфицировали плазмидой pANMerCreMer. Трансфекцию осуществляли, используя 20 мкл липофектамина 2000 и 15 мкг нерасщепленной плазмиды. Клетки собирали через 48 часов. Во всех случаях клетки лизировали раствором, приготовленным из буфера TNE (50 мМ трис pH 7,5, 5 мМ EDTA, 100 мМ NaCl) с добавлением 1% игепала и смеси ингибиторов протеаз (таблетки полной смеси, Roche), в течение 15 минут на льду и затем обрабатывали ультразвуком и центрифугировали при 15000 g в течение 45 минут при 4°C. Количество белка определяли способом Бредфорда и затем осуществляли электрофоретическое разделение белков в 8% SDS-ПААГ, на который наносили по 20 мкг белка в каждом образце. Белок Cre или MerCreMer выявляли с помощью Вестерн-блоттинга, используя разведение 1:10000 первого антитела, специфичного для Cre (Novagen) и разведение 1:5000 второго антитела козы против Ig кролика, связанного с пероксидазой (BioRad). Проявление осуществляли с использованием хемилюминесцентного реагента Western Lightning (Perkin Elmer).
Контроль продуцирования вирусов с помощью доксициклина и тамоксифена
Разные клетки (293, 293tTS или 293Cre4) высевали в 12-луночные планшеты по 4×104 клеток на лунку и поддерживали в культуральной среде DMEM с добавлением 10% FBS, глутамина, пенициллина и стрептомицина. Через 24 часа клетки обрабатывали доксициклином (100 нг/мл), тамоксифеном (0,8 мкМ) или одновременно обоими агентами, или клетки оставляли необработанными. Инфекцию осуществляли спустя 24 часа, используя MOI 2 вируса/клетку, вирусом-помощником AdTetCre или AdLC8cluc, и спустя 48 часов клетки собирали. Оценку количества инфекционных вирусов осуществляли с использованием набора для быстрого титрования AdenoX (BD Biosciences), согласно инструкциям производителя
Протокол получения НС-Ad
Плазмиду pKCZ, содержащую геном НС-Ad KCZ, расщепляли ферментом рестрикции PmeI, чтобы линеаризовать плазмиду и исключить резистентность к антибиотику. Затем плазмиду преципитировали добавлением ацетата натрия (300 мМ) и 2,5 объемов абсолютного этанола. Образец хранили при -20°C в течение, по меньшей мере, 1 часа и затем центрифугировали при 11000 g в течение 30 минут при 4°C. Преципитат промывали 70% этанолом и сушили на воздухе. Затем его ресуспендировали в воде и 15 мкг использовали для трансфекции 1×106 клеток 293Cre4 в чашке диаметром 60 мм, которые были предварительно обработаны в течение 24 часов тамоксифеном и доксициклином. Трансфекцию осуществляли с использованием 20 мкл липофектамина 2000 (Invitrogen). Среду сменяли через 6 часов, добавляя среду DMEN с 2% FBS и вирус AdTetCre при MOI 1 вирус/клетку. Такое значение MOI определи в предварительном эксперименте, в котором анализировали количество вируса, необходимое для получения 90% цитопатического эффекта в случае инфекции в течение 48 часов. Инфекции давали возможно протекать в течение 48 часов и затем клетки собирали в 200 мкл 10 мМ трис, pH 8,1. Указанная стадия трансфекции названа пассажем 0. Вирус, полученный в такой фазе высвобождали из клеток, используя 3 цикла замораживания/размораживания, и 150 мкл лизата использовали для инфицирования новой чашки с клетками 293Cre4 вместе с MOI 1 вируса-помощника AdTetCre. Как и в предыдущем случае клетки предварительно обрабатывали в течение 24 часов доксициклином и тамоксифеном. Таким образом осуществляли так называемые пассажи 1-3. В случае пассажа 4 в двух чашках диаметром 150 мм осуществляли инфекцию, используя по 1×107 клеток 293Cre4 в каждой чашке, в случае пассажа 5 использовали 8 чашек диаметром 150 мм, и в случае конечного пассажа при получении в среднем масштабе использовали 30 чашек диаметром 150 мм. Полученный вирус очищали, используя двойной градиент хлорида цезия, и соль удаляли из препарата, используя эксклюзионную колонку (сефадекс). Количество AdTetCre оценивали при каждом пассаже с помощью коммерческого набора для быстрого титрования AdenoX (BD Biosciences), согласно инструкциям производителя. НС-Ad KCZ количественно оценивали путем окрашивания X-Gal.
Получение в клетках 293 осуществляли таким же образом, доводя до 4 пассажа. Получение вируса-помощника AdLC8cluc осуществляли в клетках 293Cre4, не обработанных доксициклином и тамоксифеном, доводя до 6 пассажа.
ПРИМЕР 2
Конструирование плазмидной системы, обеспечивающей экспрессию Cre регулируемым доксициклином и тамоксифеном образом
Чтобы добиться регуляции экспрессии Cre, использовали индуцируемую систему типа «tet-on», которая была оптимизирована ранее (Zabala et al., 2004, выше). Система основана на конститутивной экспрессии трансактивирующего белка (rtTA-M2), который димеризуется в присутствии экзогенно добавленного доксициклина, принимая активную конформацию, способную связываться с промоторами, содержащими последовательности связывания «tet» (фигура 2). Таким образом достигается такой результат, что ген, который находится под контролем индуцируемого промотора (с сайтами «tet»), экспрессируется только в присутствии доксициклина зависимым от дозы образом. В данном случае была сконструирована плазмида, в которой трансактиватор rtTA-M2 находится под контролем конститутивного промотора (фосфоглицераткиназы, PGK), чтобы гарантировать, что он может быть активным в любой клетке, пакующей НС-Ad. Кроме того, Cre находится под контролем индуцируемого промотора, образованного несколькими «tet»-сайтами, связанными с минимальным промотором (в данном случае с промотором альбумина). Затем обе конструкции сливали, получая плазмиду с полной системой индуцируемой экспрессии Cre (фигура 2).
Чтобы гарантировать, что базальная экспрессия Cre не будет предотвращать продуцирование нового вируса-помощника, осуществляли две дополнительных методики.
С одной стороны, создавали клетки, конститутивно экспрессирующие репрессор tTS. Белок tTS способен связываться с индуцируемым промотором в отсутствие доксициклина и блокировать транскрипцию. Когда добавляют индуктор доксициклин, tTS изменяет конформацию и оказывается больше не связанным с промотором, оставляя открытый путь для трансактиватора rtTA-M2, чтобы последний связался и активировал экспрессию Cre (фигура 3). Следовательно, способ основан на двух типах пакующих клеток: 293, экспрессирующих tTS, для получения аденовируса-помощника и клетках 293 (имеющих или не имеющих конститутивной экспрессии Cre и/или rtTA-M2) для получения НС-Ad. Получали коммерческую плазмиду, в которой ген кодирующий tTS, экспрессируется под контролем вирусного промотора CMV. В связи с тем, что указанный промотор может подвергаться долговременному сайленсингу, его заменяли промотором EF1a, дающим более устойчивую экспрессию в стабильных линиях. На фигуре 4 показан результат ОТ-ПЦР для проверки экспрессии введенного гена после селекции клонов в клетках 293.
Кроме того, получали последовательность, кодирующую слитый белок, состоящий из рекомбиназы Cre, связанной на своем карбоксильном и амино-конце с соответствующими мутантными рецепторами эстрогена. Было описано, что такой белок (названный MerCreMer) проявляет рекомбиназную активность, характерную для Cre, только в присутствии тамоксифена (Verrou et al., 1999, Biol Chem. 380: 1435-8). Таким образом, в случае, когда индуцируемая система tet-on не может обеспечивать эффективный контроль экспрессии Cre в отсутствие доксициклина, фермент будет неактивным и позволит продуцировать вирус-помощник. Напротив, при получении НС-Ad тамоксифен будет добавлен к клеткам без tTS, обработанным доксициклином, так что активация системы будет максимальной.
После завершения конструирования плазмид, интегрирующих систему регуляции рекомбиназ Cre или MerCreMer подтверждали работу индуцируемой системы. На фигуре 5 в качестве примера показана регуляция экспрессии Cre в клетках 293. Когда совместно трансфицируют отдельные плазмиды, кодирующие трансактиватор и Cre с использованием индуцируемого промотора, получают экспрессию рекомбиназы в присутствии доксициклина, тогда как по отдельности обе плазмиды не экспрессируются. Плазмида, содержащая полную систему, также продуцирует Cre, хотя в меньшей степени. На фигуре 5B показано, как последняя плазмида экспрессирует значительные количества Cre только когда клетки обрабатывают доксициклином.
ПРИМЕР 3
Аденовирусные векторы-помощники, осуществляющие экспрессиию Cre, регулируемую доксициклином и тамоксифеном.
Затем начали конструирование самоинактивирующегося вектора - носителя рекомбиназы MerCreMer, посредством введения различных элементов в плазмиду, содержащую геном аденовирусного вектора первого поколения. Геномная структура такого вектора показана на фигуре 6, наряду с предполагаемым механизмом работы. Однако полная система не может быть получена в одной плазмиде, так как наблюдается вырезание последовательности упаковки, фланкированной сайтами LoxP, в ходе амплификации плазмид в E. coli. Поэтому конечная стадия получения нового вектора заключалась в котрансфекции клеток 293tTS двумя плазмидами, которые реконструируют целый геном после осуществления гомологичной рекомбинации в клетках (фигура 7). Вирус амплифицировали в клетках 293tTS и очищали таким же способом, как и любой другой аденовирусный вектор первого поколения.
После получения вируса его проверяли с помощью Вестерн-блота, чтобы показать, что он способен к экспрессии белка MerCreMer, индуцируемой доксициклином (фигура 8). Затем исследовали его поведение в присутствии доксициклина и тамоксифена в разных типах клеток. С этой целью инфицировали клетки 293, 293tTS или 293, конститутивно экспрессирующие рекомбиназу Cre (293Cre4) (Parks et al., 1996, Proc. Natl. Acad. Sci. USA, 93: 13565-70), в присутствии или в отсутствие указанных обработок. После 48 часов инфекции в каждом случае оценивали количество продуцируемого инфекционного вируса. Как можно видеть на фигуре 9, количество вирусного продукта сильно снижалось в клетках 293tTS только в присутствии доксициклина и тамоксифена, что согласуется с ожидаемым ингибированием капсидирования вируса вследствие вырезания последовательности капсидирования. В клетках 293, в которых уровень базальной экспрессии MerCreMer может быть более высоким, независимое добавление доксициклина или тамоксифена вызывало относительное снижение продукции вируса, хотя комбинированная обработка вновь позволяла достигать более заметного уменьшения. Когда использовали клетки 293Cre4, как и предполагалось, продуцирование вирусов было низким, независимо от активации индуцируемой системы. Чтобы показать специфичность системы, проводили сходное исследование, на сей раз сравнивая вирус AdTetCre со стандартным вирусом-помощником (AdLC8cluc), который имеет сигнал капсидирования, фланкированный сайтами LoxP, но не экспрессирует никакой рекомбиназы (Parks et al., 1996, выше). Как видно на фигуре 10, обработка тамоксифеном и доксициклином не вызывала значимого изменения уровней продуцирования вируса. Упаковка вируса снижается только в случае использования клеток 293Cre4. Напротив, сильное снижение подтверждено в случае AdTetCre, при этом уровни были даже ниже, чем уровни, наблюдаемые в случае AdLC8cluc в клетках 293Cre4. Чтобы показать, что такое снижение является следствием вырезания последовательности упаковки, начальную область вирусов AdTetCre, присутствующих в клетках 293, обработанных доксициклином и тамоксифеном, амплифицировали, используя ПЦР. Как видно на фигуре 11A, амплифицированный фрагмент меньше, чем фрагмент, соответствующий немодифицированному геному, и размер совместим с размером при полном отсутствии последовательности упаковки. Дополнительное подтверждение получили с помощью секвенирования. На фигуре 11B показано, что последовательность упаковки утрачивается в случае стандартного вируса-помощника (AdLC8cluc), когда он инфицирует клетки 293Cre4. Кроме того, можно видеть, что такое вырезание, по-видимому, неполное, в отличие от вируса AdTetCre.
ПРИМЕР 4
Получение аденовируса, лишенного существенного внутреннего содержимого, с помощью применения самоинактивирующегося вируса-помощника
После проверки того, что вирус AdTetCre инактивируется индуцируемым образом (самоинактивация), исследовали его способность функционировать в качестве вируса-помощника в способе получения НС-Ad. С этой целью использовали стандартный протокол трансфекции плазмидой, кодирующей НС-Ad (в данном случае KCZ, экспрессирующей ген LacZ), и последующей инфекции вирусом-помощником. Затем осуществляли последовательные стадии амплификации, на которых НС-Ad, полученный на предыдущей стадии, использовали для инфекции клеток на новой чашке вместе с добавлением нового вируса-помощника. Размер и количество чашек прогрессивно увеличивали. Такой способ осуществляли с использованием клеток 293 и клеток 293Cre4 и вируса AdTetCre в качестве помощника. Чтобы сравнить со стандартным способом таким же образом использовали вирус-помощник AdLC8cLuc в клетках 293Cre4. Количество инфекционных единиц, соответствующих HC-Ad и вирусу-помощнику, количественно оценивали на каждой стадии. Как показано на фигуре 12A, продуцирование HC-Ad с использованием вируса AdTetCre, прогрессивно возрастало на следующих друг за другом стадиях, осуществляемых в клетках 293Cre4, при этом загрязнение аденовирусом-помощником всегда хорошо поддерживалось на более низком уровне. В последнем пассаже, осуществляемом в данном примере (пассаж 6), количество аденовируса с высокой емкостью составляло 1,2×1011 суммарных единиц IU, при этом загрязнение аденовирусом-помощником составляет меньше 0,05%. Такой выход и чистота считаются приемлемыми для получения HC-Ad в среднем масштабе. Напротив, когда использовали вирус AdLC8cluc, степень загрязнения таким вирусом, возрастала от стадии к стадии, в конечном итоге превышая количество вектора с высокой емкостью (фигура 12C). Хотя в других случаях такое загрязнение меньше, и можно использовать стандартный способ получения HC-Ad, часто описывали избыточное накопление вируса-помощника, что свидетельствует об отсутствии устойчивости такого способа. Что касается получения в клетках 293 с использованием вируса AdTetCre, то степень загрязнения была также слишком высокой (фигура 12B). Полученные данные свидетельствуют о том, что рекомбиназа Cre, экспресируемая пакующими клетками, работает совместно с рекомбиназой MerCreMer, экспрессируемой вирусом, достигая оптимального эффекта. Вероятно, что такая конститутивная экспрессия важна для обеспечения присутствия рекомбиназы в начальные моменты после инфекции вирусом-помощником. В нескольких последующих экспериментах, которые были осуществлены до настоящего времени, количество вируса AdTetCre всегда оставалось ниже количества вируса с высокой емкостью при использовании клеток 293Cre4, что свидетельствует о более высокой надежности данного способа получения по сравнению с методикой, основанной на обычных аденовирусах-помощниках.
ПРИМЕР 5
Получение аденовируса, лишенного существенного внутреннего содержимого, несущего терапевтический трансген, посредством использования самоинактивирующегося аденовируса-помощника.
После проверки того, что вирус AdTetCre может быть инактивирован индуцируемым образом (самоинактивация) и обладает способностью функционировать в качестве вируса-помощника в способе получения HC-Ad, исследовали его способность продуцировать HC-Ad, несущий терапевтический ген. Например, вирус GL-Ad/RUmIL-12 (также называемый HC-Ad-mIL-12) экспрессирует мышиный цитокин интерлейкин 12 (mIL-12) под контролем активируемого мифепристоном специфичного для печени индуцируемого промотора. Такой вектор оказывал противоопухолево действие в нескольких животных моделях рака печени (Wang et al., Gastroenterology 2004, 126: 278-289). Плазмиду pGLAd-RUmIL-12, содержащую геном GL-Ad/RUmIL-12, получали, как описано ранее (Wang, L., et al., 2004 Gastroenterology 126: 278-89), ее расщепляли ферментом рестрикции PmeI, чтобы линеаризовать и удалить резистентность к антибиотику. Затем ее преципитировали добавлением ацетата натрия (300 мМ) и 2,5 объемов абсолютного этанола. Образец хранили при -20°C в течение, по меньшей мере, 1 часа и затем центрифугировали при 11000 g в течение 30 минут при 4°C, осадок промывали 70% этанолом и сушили на воздухе. Затем его ресуспендировали в воде и использовали 15 мкг для трансфекции 1×106 клеток 293Cre4 на чашке диаметром 60 мм, которую ранее обработали в течение 24 часов тамоксифеном и доксициклином. Трансфекцию осуществляли, используя 20 мкл липофектамина 2000 (Invitrogen). Среду заменяли через 6 часов, добавляя среду DMEN с 2% FBS и вирус AdTetCre вирус при значении MOI 1 вирус/клетку. Указанное значение MOI определяли в предварительном эксперименте, в котором анализировали количество вируса, необходимое для получения 90% цитопатического эффекта после 48 часов инфекции. Инфекцию давали возможность прогрессировать в течение 48 часов и затем клетки собирали в 200 мкл 10 мМ трис, pH 8,1. Такая стадия трансфекции-инфекции названа пассажем 0. Вирус, полученный в такой фазе, высвобождали из клеток с помощью 3 циклов замораживания/размораживания и 150 мкл лизата использовали для инфекции клеток 293Cre4 на новой чашке вместе с MOI 1 вируса-помощника AdTetCre. Как и в предыдущем случае, клетки предварительно обрабатывали в течение 24 часов доксициклином и тамоксифеном. Пассажи, названные пассажами 1-3, осуществляли таким же образом. В случае пассажа 4 инфицировали две чашки диаметром 150 мм с 1×107 клеток 293Cre4 в каждой, в случае пассажа 5 было двадцать чашек диаметром 150 мм, и в конечном пассаже при получении в среднем масштабе использовали тридцать чашек диаметром 150 мм, при этом лизат был эквивалентен четырем чашкам диаметром 150 мм. Полученный вирус очищали в двойном градиенте хлорида цезия и соль удаляли из препарата с помощью колонки для экслюзионной хроматографии по размеру (сефадекс). Количество AdTetCre оценивали в каждом пассаже, используя коммерческий набор для быстрого титрования AdenoX (BD Biosciences) согласно инструкциям производителя. Продуцирование GL-Ad/RumIL-12 достигало 1,5×1012 вирусных частиц (vp), при этом загрязнение аденовирусом-помощником AdTetCre было меньше 2,6×106 IU.
Учитывая, что такой вектор не экспрессирует никакого репортерного гена, его функцию подтверждали посредством определения продуцирования трансгена (mIL-12) в инфицированных клетках. На фигуре 14A показаны уровни mIL-12, полученные после инфекции клеток HuH-7 (полученных из гепатокарциномы человека) разными количествами аденовирусного вектора с высокой емкостью GL-Ad/RUmIL-12 в присутствии индуктора мифепристона. Затем подтверждали функционирование вектора in vivo. С этой целью вектор эндогенно инъецировали мышам и измеряли количество mIL-12, присутствующего в сыворотке после внутрибрюшинного введения индуктора мифепристона. Индукцию и измерение mIL-12 осуществляли на 7, 48 и 62 дни после инъекции вектора, и проверяли, что мыши стабильно экспрессировали высокие количества трансгена (фигура 14B). Полученные данные показывают, что новый способ является эффективным для получения векторов, представляющих клинический интерес.


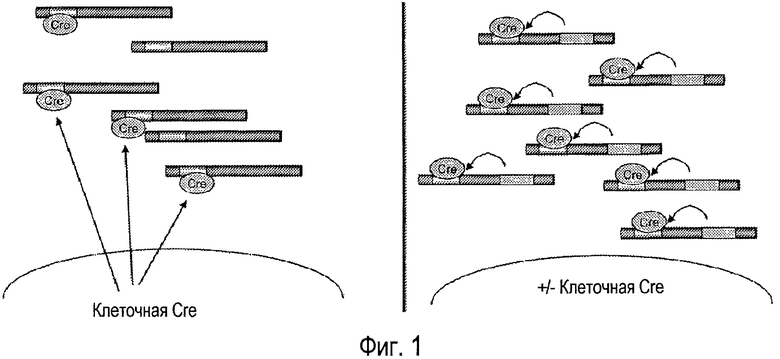
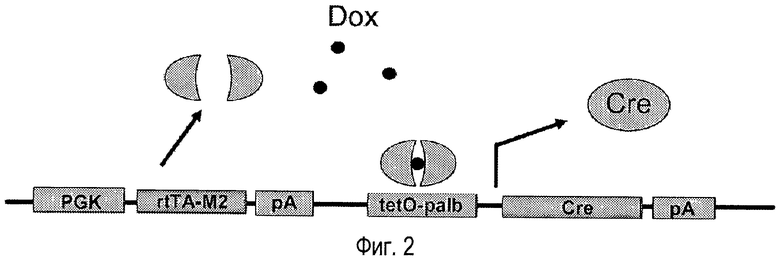
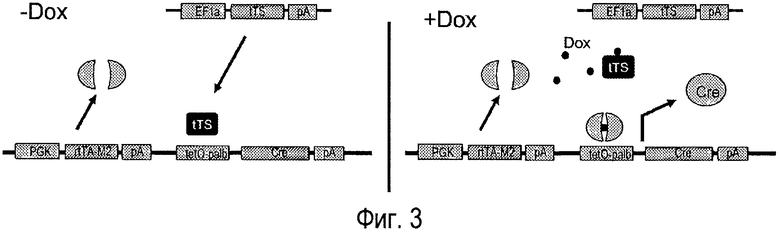

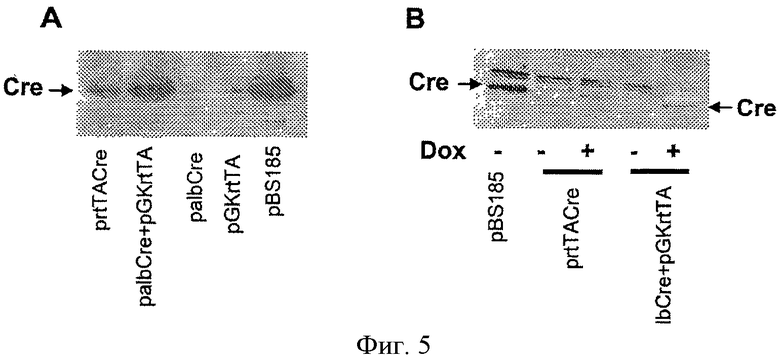
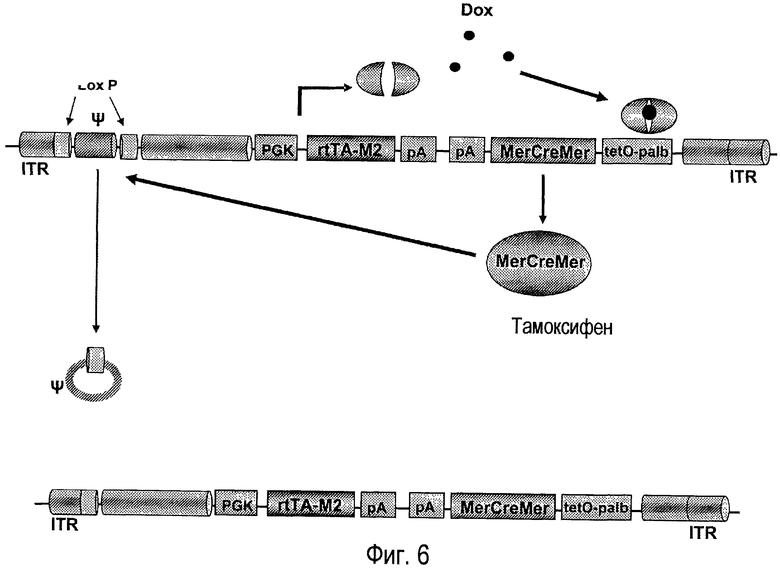

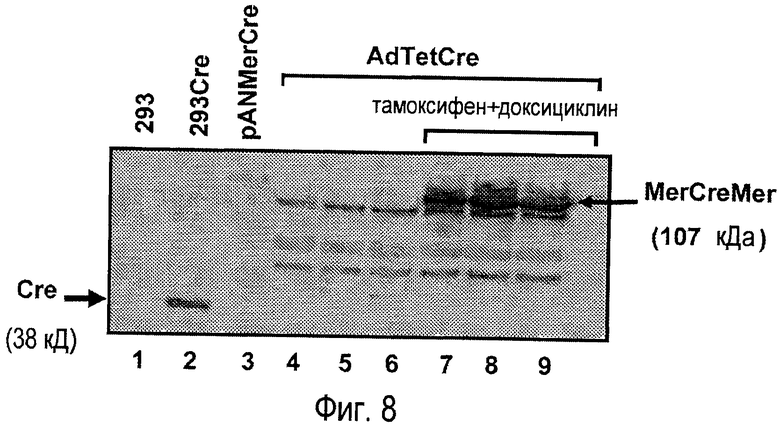
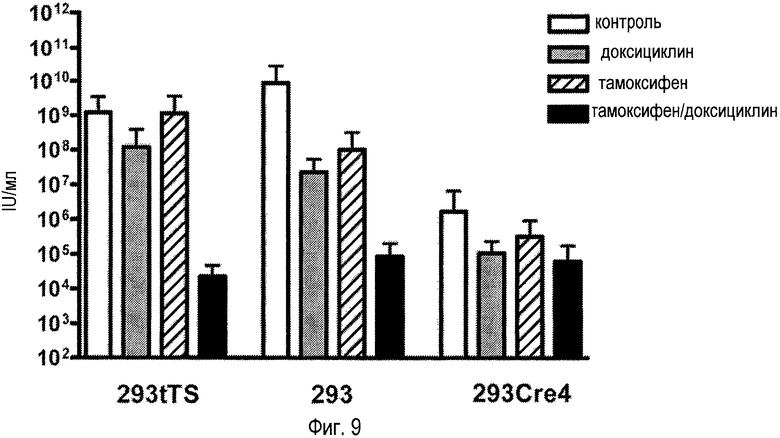
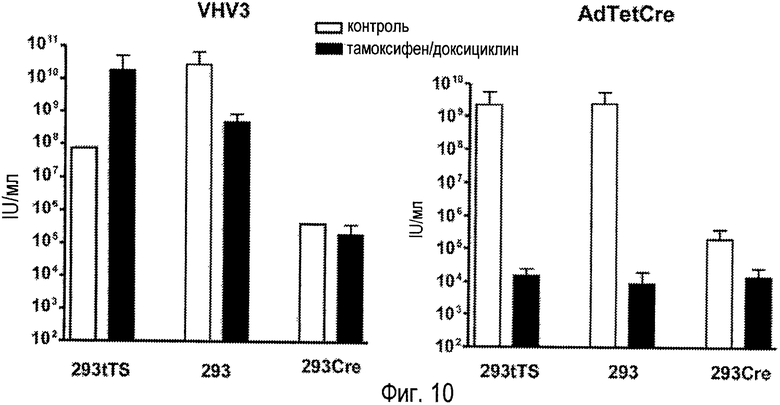
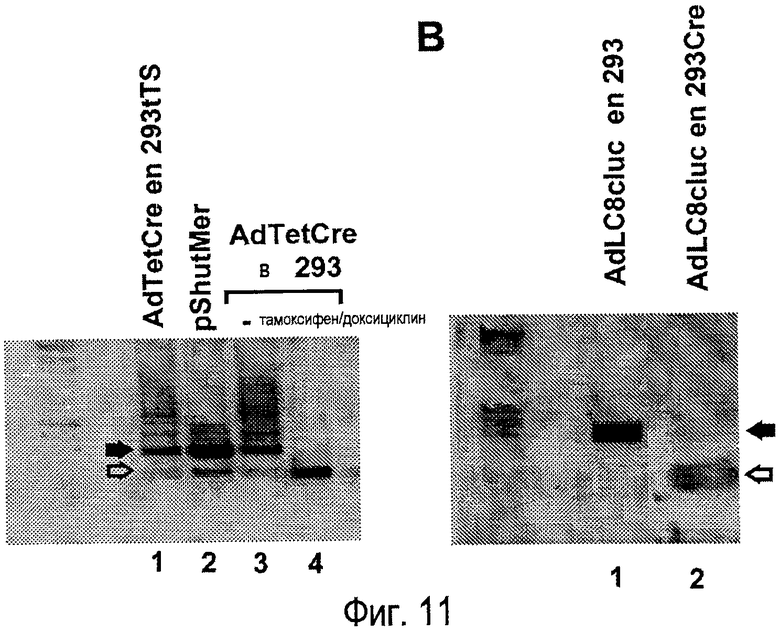
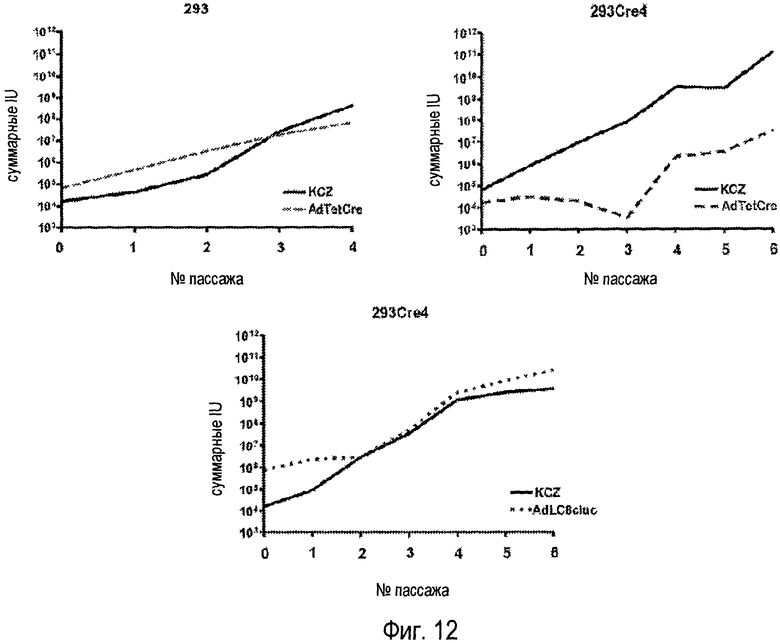
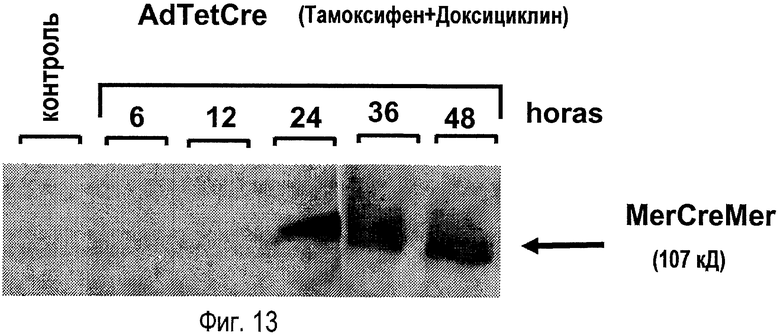
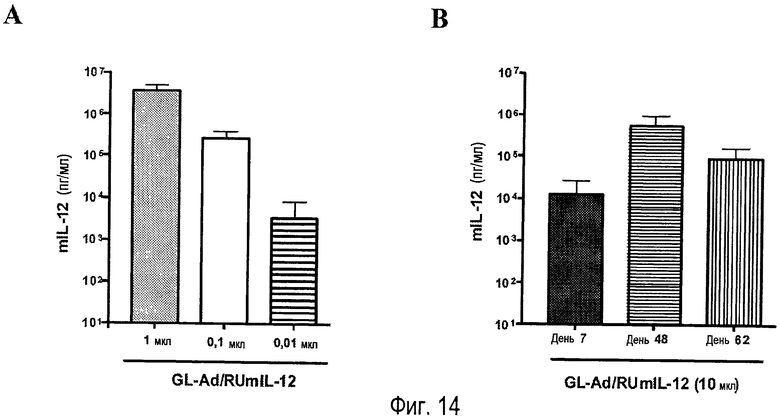
Изобретение относится к области биотехнологии. Предложен аденовирусный вектор-помощник для получения рекомбинантного аденовируса с высокой емкостью. Указанные вектора позволяют разрабатывать системы для создания в клетках рекомбинантных аденовирусов с высокой емкостью, и которые оптимально уменьшают загрязнение указанных аденовирусов с высокой емкостью аденовирусами-помощниками. Изобретение может быть использовано в клеточной технологии. 8 н. и 20 з.п.ф-лы, 14 ил., 5 пр.
1. Аденовирусный вектор-помощник для получения рекомбинантного аденовируса с высокой емкостью, содержащий:
a) инвертированный 5'-концевой повтор;
b) область, кодирующую слитый белок, содержащий первый полипептид и второй полипептид, где первый полипептид представляет собой сайт-специфичную рекомбиназу, где второй полипептид регулирует активность указанной рекомбиназы, и где указанная область находится под оперативным контролем индуцируемого промотора, который активируется специфичным трансактиватором;
c) область, необходимую для репликации и/или для упаковки аденовирусного генома, фланкированную последовательностями узнавания, специфичными для рекомбиназы, кодируемой последовательностью b), в которой областью c), необходимой для упаковки или репликации аденовирусного генома, является сигнал упаковки Ψ, где последовательности узнавания, специфичные к рекомбиназе, кодируемой последовательностью b), представляют собой сайты LoxP, где указанные последовательности узнавания ориентированы так, чтобы вырезание указанной необходимой области происходило в присутствии указанной рекомбиназы,
d) аденовирусные кодирующие последовательности, за исключением областей E1 и E3, и
e) инвертированный 3'-концевой повтор.
2. Аденовирусный вектор-помощник по п.1, дополнительно содержащий последовательность, кодирующую активатор транскрипции, который способен специфично активировать промотор, регулирующий экспрессию рекомбиназы, кодируемой последовательностью (a), в присутствии лиганда указанного активатора транскрипции.
3. Аденовирусный вектор-помощник по п.2, где указанным активатором транскрипции является трансактиватор, зависимый от аналога тетрациклина.
4. Аденовирусный вектор-помощник по п.3, где активатором транскрипции является трансактиватор rtTA-M2.
5. Аденовирусный вектор-помощник по п.1, где рекомбиназой является рекомбиназа Cre или слитый белок, содержащий последовательность рекомбиназы Cre.
6. Аденовирусный вектор-помощник по п.5, где рекомбиназа дополнительно содержит связывающий гормон домен или активируемую последовательность ядерной локализации, предпочтительно связывающий гормон домен рецептора эстрогена.
7. Аденовирусный вектор-помощник по п.6, в котором рекомбиназой является рекомбиназа merCremer.
8. Аденовирусная частица, содержащая последовательность аденовирусного вектора-помощника по любому из п.п.1-7 для получения рекомбинантного аденовируса с высокой емкостью.
9. Система для репликации и упаковки самоинактивирующегося аденовируса-помощника, включающая:
(a) аденовирусный вектор по любому из п.п.1-7 или аденовирусную частицу по п.8; и
(b) эукариотическую клетку.
10. Система по п.9, где клетка, составляющая компонент (b), содержит специфичный для промотора репрессор транскрипции, регулирующий экспрессию сайт-специфичной рекомбиназы.
11. Система по п.10, где репрессор транскрипции является активным в отсутствие лиганда, который способен стимулировать экспрессию сайт-специфичной рекомбиназы.
12. Способ получения самоинактивирующегося аденовируса-помощника, включающий:
i) осуществление контакта клетки с аденовирусным вектором-помощником по любому из п.п.1-7 или аденовирусной частицей по п.8 и, необязательно, с одним или несколькими полинуклеотидами, кодирующими аденовирусные белки, необходимые для упаковки и репликации аденовируса в клетке, в подходящих условиях, так чтобы происходило проникновение в клетку аденовирусного генома или полинуклеотида, содержащего указанный геном,
(ii) поддерживание клетки в условиях подходящих для того, чтобы обеспечить возможность упаковки и репликации аденовируса в клетке и предотвратить экспрессию сайт-специфичной рекомбиназы, и
(iii) извлечение аденовирусов из среды.
13. Способ по п.12, где клетка содержит специфичный для промотора репрессор транскрипции, регулирующий экспрессию сайт-специфичной рекомбиназы, где указанный репрессор является активным в отсутствие аналога лиганда, способного активировать промотор, регулирующий экспрессию сайт-специфичной рекомбиназы.
14. Способ по п.13, где указанным репрессором транскрипции является зависимый от доксициклина репрессор tTS.
15. Аденовирус-помощник для получения рекомбинантного аденовируса с высокой емкостью, полученный согласно способу по любому из п.п.12-14.
16. Применение аденовирусного вектора-помощника по любому из п.п.1-7 или аденовирусной частицы по п.8, содержащей указанный полинуклеотид, для получения и упаковки аденовируса с высокой емкостью.
17. Система для получения рекомбинантного аденовируса с высокой емкостью, включающая в себя:
(a) аденовирусный вектор по любому из п.п.1-7 или аденовирусную частицу по п.8;
(b) аденовирус, геном которого содержит представляющий интерес ген и в котором отсутствует последовательность, кодирующая, по меньшей мере, один из белков, необходимых для репликации, или, по меньшей мере, один из белков, необходимых для упаковки указанного аденовируса, или полинуклеотид, содержащий геном указанного аденовируса, и
(c) эукариотическую клетку.
18. Система по п.17, где эукариотическая клетка содержит полинуклеотид, экспрессирующий сайт-специфичную рекомбиназу, которая кодируется компонентом (a) системы.
19. Система по п.18, где область, кодирующая сайт-специфичную рекомбиназу под оперативным контролем индуцируемого промотора.
20. Способ создания аденовируса с высокой емкостью, экспрессирующего представляющий интерес ген, включающий в себя стадии:
(i) осуществления контакта клетки с аденовирусом в подходящих условиях так, чтобы происходило проникновение в клетку генома указанного аденовируса или полинуклеотида, содержащего указанный геном,
(ii) осуществления контакта указанной клетки со вторым компонентом, выбранным из группы, состоящей из:
(a) аденовирусного вектора по п.1;
(b) аденовирусной частицы, содержащей полинуклеотид согласно (a);
в условиях, подходящих для того, чтобы происходило проникновение в клетку указанного аденовирусного вектора или генома указанной аденовирусной частицы,
(iii) поддерживания клетки в условиях, подходящих для экспрессии белков, кодируемых геномами обоих вирусов, для репликации геномов обоих аденовирусов и для экспрессии рекомбиназы, кодируемой вектором или аденовирусом, используемым на стадии (ii), и
(iv) извлечения аденовируса с высокой емкостью из культуры клеток.
21. Способ по п.20, где аденовирусный вектор согласно (а) и/или клетка дополнительно содержит последовательность, кодирующую специфичный трансактиватор промотора, регулирующего экспрессию сайт-специфичной рекомбиназы.
22. Способ по п.21, где стадии (i) и/или (ii) осуществляют в присутствии лиганда, который способен связываться и активировать специфичный трансактиватор промотора, регулирующего экспрессию сайт-специфичной рекомбиназы.
23. Способ по п.22, где указанным трансактиватором является rtTA-M2, где указанным лигандом является доксициклин.
24. Способ по любому из п.п.20-23, где клетка содержит последовательность, кодирующую сайт-специфичную рекомбиназу, где указанная рекомбиназа является такой же, как рекомбиназа, кодируемая полинуклеотидом согласно (a).
25. Способ по любому из п.п.20-24, где сайт-специфичной рекомбиназой является рекомбиназа Cre или слитый белок, содержащий последовательность рекомбиназы Cre.
26. Способ по п.25, где рекомбиназой является рекомбиназа merCremer.
27. Способ по п.26, где стадию (i) и/или (ii) осуществляют в присутствии тамоксифена.
28. Способ по любому из п.п.20-27, включающий в себя повторение, по меньшей мере, один раз стадий (i)-(iv) с использованием на стадии (i) каждого цикла аденовируса, извлеченного на стадии (iv) предыдущего цикла, и, необязательно, с добавлением новой дозы аденовируса-помощника на стадиях (i) каждого цикла.
| КЕРАМИЧЕСКИЙ МАТЕРИАЛ ДЛЯ ИЗГОТОВЛЕНИЯ ДУГОГАСИТЕЛЬНЫХ КАМЕР | 0 |
|
SU220814A1 |
| US 2002072120 A1 (LUSKY MONIKA, ; MEHTALI MAJID), 13.06.2002 | |||
| US 20070249043 A1 (MAYALL TIMOTHY P), 25.10.2007 | |||
| RU 2004138095 A (ХОЛЬМ ПЕР СОННЕ), 27.10.2005 | |||
Авторы
Даты
2014-06-27—Публикация
2009-05-13—Подача