Изобретение относится к биотехнологии, в частности к генетической инженерии, и представляет собой рекомбинантную плазмидную ДНК, обусловливающую синтез и секрецию эпидермального фактора роста человека (hEGF) в клетках бактерий в виде гибридного белка с глутатион-S-трансферазой. Изобретение может найти применение в микробиологической промышленности и медицине, в частности, для создания новых противоожоговых и ранозаживляющих средств, для диагностики злокачественных заболеваний, ассоциированных с гиперпродукцией рецептора hEGF, а также в создании новых методов адресной доставки тех или иных терапевтических средств в клетки-мишени, специфически экспрессирующие рецептор hEGF.
Уровень техники
hEGF - гормон пептидной природы, продуцируемый разнообразными тканями и содержащийся практически во всех биологических жидкостях организма человека. hEGF синтезируется в виде предшественника длиной 1217 аминокислот и подвергается дальнейшему протеолитическому процессингу с образованием зрелого белка с характерным размером в 53 и с тремя внутренними дисульфидными связями [1]. hEGF действует на ткани, содержащие соответствующий рецептор на своей поверхности, и стимулирует их рост и деление. Наиболее мощным митогеном in vivo и in vitro hEGF является для эпителиальных и соединительно-тканных клеток. Детальное изучение спектра влияний указывает на возможные пути его биотехнологического применения в качестве ранозаживляющего, цитопротективного, противоязвенного препарата и др. [2-7].
К настоящему времени известны рекомбинантные плазмидные ДНК, обеспечивающие экспрессию hEGF в секретируемом виде в клетках бактерий Escherichia coli, B.subtilis и дрожжей S.cerevisiae и Pichiapastoris [8-11]. Несмотря на известные преимущества такого подхода, а именно правильное созревание и сворачивание рекомбинантного в процессе секреции, защита от внутриклеточных протеаз и простота и доступность для дальнейших методов очистки, такой подход не лишен недостатков, основным является невысокий выход целевого продукта. В связи с этим усовершенствование известных методов получения рекомбинантного hEGF представляет несомненный практический интерес.
Одним из наиболее эффективных способов очистки целевого белка является аффинная хроматография [12]. В последние годы получили широкое распространение методы экспрессии рекомбинантных белков в форме гибридов, содержащих вспомогательный полипептид, специфически связывающийся с соединением, которое применяется в качестве лиганда при последующей очистке белка аффинной хроматографией.
Одним из наиболее популярных аффинных доменов, широко используемых для иммобилизации и очистки гибридных белков, является глутатион-S-трансфераза (GST). Помимо своей высокой стабильности и высокой специфичности по отношению к различным сорбентам на основе глутатиона GST также является солюбилизирющим доменом. Сочетание этих характеристик делают GST весьма привлекательным для самых различных биотехнологических применений.
Из уровня техники известны способы получения биологически активного EGF мыши [13] и человека [14] в виде их гибридов с полипептидом GST, обычно используемым исключительно с целью усовершенствования процедуры очистки получаемого продукта. При этом обе генетические конструкции, как и рекомбинантная ДНК по изобретению, построены с учетом возможности последующего отщепления являющегося в данном случае вспомогательным полипептида GST с помощью последующей обработки протеазой, сайт которой введен между двумя сливаемыми последовательностями (GST и EGF) и которая в обоих известных аналогах представлена тромбином. Принимая во внимание то, что в работе [14], как и в настоящем изобретении, используется последовательность, кодирующая EGF человека (hEGF), она представляется предпочтительной для рассмотрения в качестве ближайшего аналога (прототипа) изобретения.
Отличительными признаками заявляемой рекомбинантной ДНК от предлагаемой в прототипе является наличие в ее структуре другого сайта протеазного расщепления (сайта расщепления энтерокиназой вместо сайта расщепления тромбином), а также новая нуклеотидная последовательность SEQ ID N0:1, кодирующая «гибрид» и являющаяся результатом разработки заявителем конкретного дизайна, которая проведена с учетом применения оптимальных для E.coli кодонов, особенностей структуры объединяемых генов и их транскриптов, а также необходимых условий адаптации результирующей последовательности к используемому вектору-носителю. Соответственно, предлагаемую плазмиду pAS007 от плазмидной конструкции, раскрытой в прототипе, отличают оба ее основных элемента: другой фрагмент, относящийся к вектору-носителю и другой фрагмент с кодирующей последовательностью (SEQ ID N0:1). Основным недостатком предлагаемого в прототипе гибридного белка (и, соответственно, кодирующей его последовательности) является использование сайта расщепления тромбином, который не отличается достаточным уровнем специфичности, что, соответственно, приводит к потерям материала (гибридного белка) при получении из него hEGF в силу появления «побочных» продуктов неспецифического гидролиза [15]. В отличие от этого, энтерокиназа применительно к данной гибридной последовательности оказалась высокоспецифичной в отношении введенного в конструкцию сайта расщепления.
Недостатком предлагаемой в прототипе плазмидной конструкции в целом является низкий выход обеспечиваемого экспрессионной системой целевого продукта, составляющий не более 63 мг/л, что с высокой степенью вероятности является результатом использования слабого промотора tac, а также отсутствия надлежащей оптимизации и адаптации к системе встраиваемой кодирующей последовательности.
В настоящей работе была поставлена задача получения нового синтетического гена гибридного белка GST-hEGF (рекомбинантной ДНК) и плазмидной ДНК с его использованием, которые были бы лишены указанных недостатков и обеспечивали более высокий выход белка (технический результат), а также возможность более эффективного (без потерь, связанных с неспецифическим гидролизом) использования данного белка для последующего получения hEGF (дополнительный результат).
Раскрытие изобретения
Решение поставленной задачи включало следующие этапы:
а) дизайн конструкции гена гибридного белка, предполагающий оптимальную комбинацию его элементов с точки зрения экспрессии, очистки и последующего энзиматического расщепления гибрида, а также оптимизацию объединяемых последовательностей; б) получение и объединение нуклеотидных последовательностей, кодирующих компоненты гибридного белка; в) создание векторной конструкции для экспрессии гибридного белка; г) оптимизацию условий продукции и очистки гибридного белка.
Дизайн, определяющий нуклеотидную последовательность гибридного гена, был разработан с учетом предпочтительных для Е.сoli кодонов, особенностей структуры объединяемых генов и их транскриптов, а также необходимых условий адаптации результирующих последовательностей к их объединению и включению в плазмидную конструкцию.
Нуклеотидную последовательность, кодирующую оптимизированный вариант гена hEGF с дополнительным «спейсером» из 13-ти аминокислотных остатков, включающих сайт расщепления энтерокиназой, получали методом олигонуклеотидного синтеза.
Для создания вектора экспрессии, направляющего в клетках E.coli синтез гибридного белка, состоящего из GST, слитой с hEGF, был использован вектор рЕТМ-41 [16]. Данный вектор содержит ген GST под контролем сильного промотора гена 10 фага Т7, обеспечивающего высокоэффективную экспрессию чужеродных генов в штаммах E.coli, экспрессирующих РНК-полимеразу фага Т7 [16].
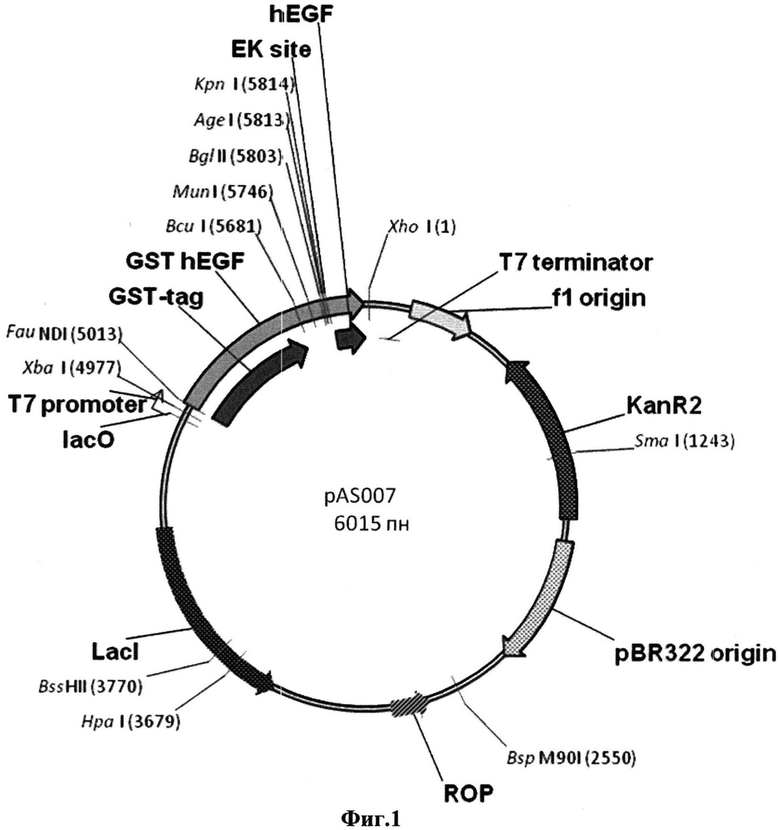
Экспрессирующая рекомбинантная плазмида pAS007 сконструирована путем субклонирования полученного ранее оптимизированного варианта гена hEGF в вектор рЕТМ-41 по сайтам рестрикции KpnI/Xho1 (фиг.1).
Путем трансформации клеток штамма Escherichia coli BL21(DE3) сконструированной плазмидой pAS007, отбора и культивирования клонов трансформантов с высоким уровнем синтеза гибридного белка получен рекомбинантный штамм Escherichia coli BL21(DE3)/pAS007 - продуцент гибридного белка GST-hEGF по изобретению. Синтез GST-hEGF в полученном рекомбинантном штамме осуществляется при культивировании на обычных селективных средах с добавлением индуктора изопропил-D-тиогалактозида (ИПТГ) или лактозы и обеспечивает выход целевого белка 200 мг/л культуры.
Таким образом, настоящее изобретение включает 2 объекта:
Первый объект - рекомбинантная ДНК, которая кодирует гибридный белок GST-hEGF, состоящий из глутатион-S-трансферазы и hEGF, разделенных сайтом расщепления энтерокиназой, и характеризуется нуклеотидной последовательностью SEQID №1.
Второй объект - рекомбинантная плазмида pAS007, обеспечивающая синтез гибридного белка GST-hEGF в клетках Escherichia coli и состоящая из фрагмента ДНК с последовательностью SEQID №1, кодирующего названный гибридный белок, и KpnI/XhoI фрагмента плазмиды рЕТМ-41, объединенных между собой согласно Фиг.1.
Краткое описание фигур.
Фиг.1 - Физическая и генетическая карты вектора pAS007.
Обозначено положение гена GST-hEGF, сайта энтерокиназы ЕК, других элементов вектора, уникальных сайтов рестрикции.
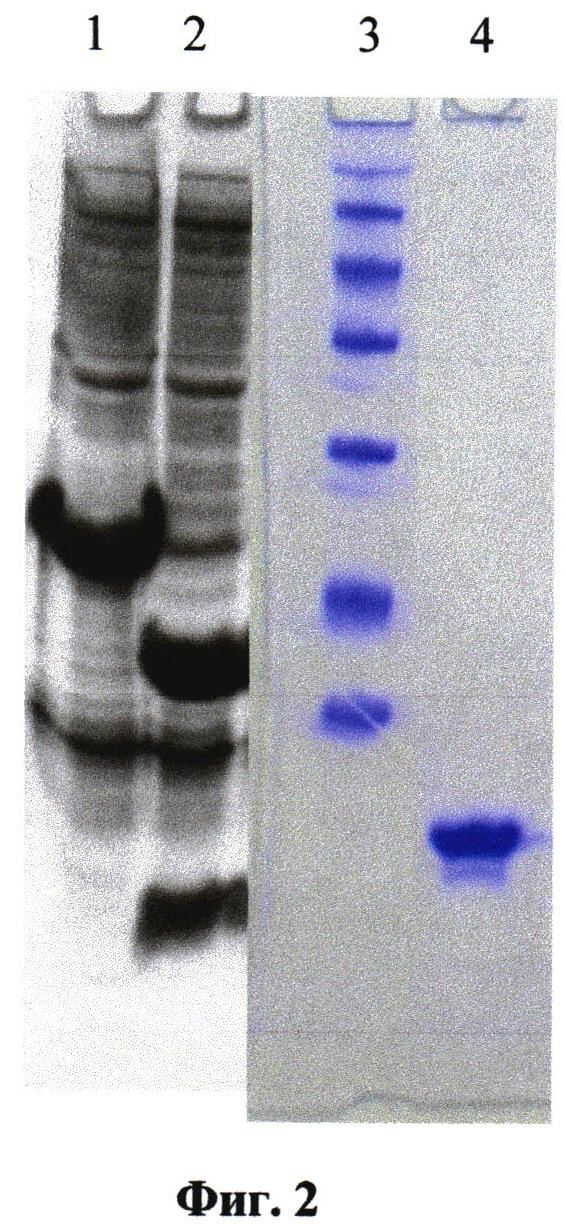
Фиг.2 - Анализ экспрессии и специфического гидролиза GST-hEGF при помощи электрофореза.
Дорожка 1 - GST-hEGF до специфического гидролиза, дорожка 2 - GST и hEGF после гидролиза специфичной протеиназой энтерокиназой, дорожка 3 - маркер молекулярных масс №26610 (ThermoSci., США) (сверху вниз - 116 кДа, 66.2, 45, 35, 25, 18.4, 14.4), дорожка 4 - hEGF после стадии очистки.
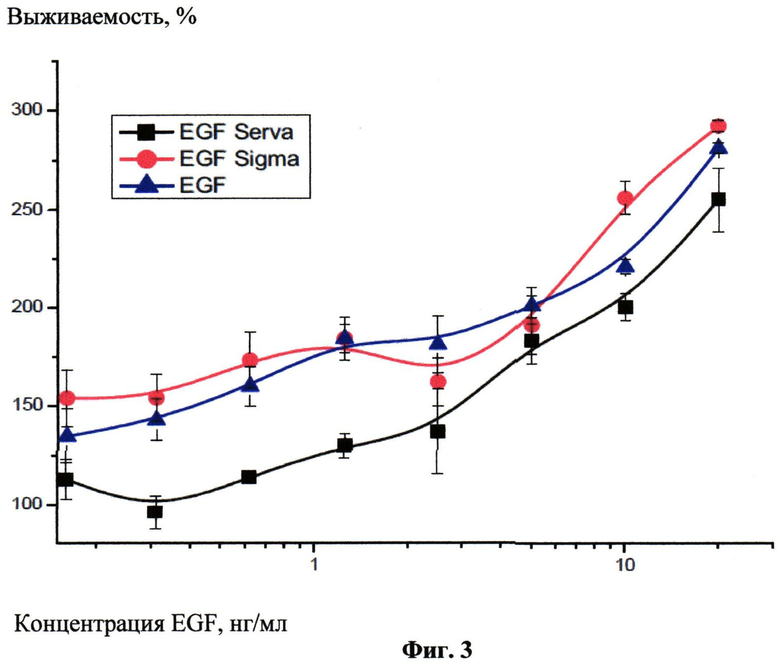
Фиг.3 - Стимуляция пролиферации эмбриональных фибробластов мыши линии NIH3T3.
Оценка по увеличению количества клеток после 5 сут. инкубации с EGF в среде DMEM, содержащей 1% FBS. Исходная концентрация клеток 4×103/лунку. Высаживание проводили на 1% FBS за сутки до добавления EGF (SRB-тест). По оси абсцисс - концентрация EGF, нг/мл, по оси ординат - выживаемость, % от контроля без добавления EGF.
Осуществление изобретения.
При осуществлении изобретения, помимо методов, подробно раскрытых в нижеследующих примерах, использовали хорошо известные специалистам методики, описанные в руководствах по молекулярной биологии и генетической инженерии [17].
Пример 1. Дизайн и конструирование гена hEGF.
Дизайн варианта синтетического гена hEGF, кодирующего зрелый полипептид размером 53 а.к.о., слитый с 13 аминокислотной «спейсерной» последовательностью, включающей природный сайт энтерокиназы, проводили при помощи программы GeneDesigner [18]. Данная программа позволяет на основании аминокислотной последовательности белка подобрать соответствующую кодирующую последовательность, оптимизированную для экспрессии в выбранном организме-хозяине с учетом характерной частоты встречаемости кодонов и другими характеристиками, способствующими эффективной гетерологичной экспрессии выбранного полипептида. Отобранную таким образом нуклеотидную последовательность гена hEGF разбивали на олигонуклеотиды длиной 40 пн с помощью программы DNAworks [19] для последующей сборки гена методом рекомбинатной ПЦР. При дизайне фланкирующих праймеров к их 5-последовательностям добавляли последовательности, содержащие сайты рестриктаз KpnI и XhoI для последующего создания экспрессионной конструкции.
Сборку синтетического гена осуществляли в две стадии с использованием оптимизированного ПЦР метода получения синтетических генов [20] с использованием олигонуклеотидов, перечисленных в таблице 1.
На первой стадии по 5 мкл каждого из 10-олигонуклеотидов и проводят 1 стадию ПЦР с использованием Taq полимеразы в следующих условиях.
Смесь для ПЦР (100 мкл):
10 мкл 10-кратного ПЦР-буфера («Fermentas");
5 мкл 1 мкМ праймеров №№1-10
10 мкл 2,0 мМ dNTP каждого вида;
30 мкл деионизованной воды;
1 мкл ДНК полимеразы («Fermentas").
Условия проведения ПЦР: 94°, 5′ (денатурация), 94°, 30′′; 50°, 30′′; 72°, 10′′ (амплификация).
1 мкл полученной смеси используют для проведения повторной ПЦР с праймерами №1 и №10 в тех же условиях
После повторной амплификации ПЦР смесь анализируют электрофорезом в 2% агарозном геле и выявляют гомогенный фрагмент размером около 0,15 тпн. Фрагмент выделяют из геля с помощью набора http://WizardPCRPrepsK.it (Promega, США) в соответствии с инструкцией производителя.
Пример 2. Конструирование вектора экспрессии pAS007
Полученный ПЦР фрагмент с геном hEGF встраивают в состав вектора рЕТ41, содержащего промотор фага Т7, обеспечивающий высокую экспрессию гетерологичных генов в штаммах E.coli, синтезирующих Т7 полимеразу [21], и модифицированный ген GST. Для этого 100 нг ПЦР фрагмента, полученного, как описано в примере 1, гидролизуют совместно рестриктазами KpnI/XhoI и встраивают с помощью Т4 ДНК лигазы в KpnI/XhoI вектор рЕТ41.
Полученной лигазной смесью трансформируют компетентные клетки штамма Escherichia coli XL1-Blue recA1 endA1 gyrA96 thi-1 hsdR17 supE44 relA1 lac [F′proAB lacIqZ□M15 Tn10 (Tetr)] (Stratagene, США), и полученные канамицин-устойчивые трансформанты анализируют методом ПЦР-скрининга с праймерами №1 и №10 (Таблица 1) и отбирают «положительные» клоны, образующие ПЦР фрагменты размером 180 п.н. Несколько «положительных» клонов проверяют секвенированием с использованием этих же праймеров Т7 и отбирают клон с геном GST-hEGF без неспецифических ПЦР-мутаций, который обозначают как pAS007.
Пример 3. Получение рекомбинантного штамма Е.coli - продуцента GST-hEGF.
Полученной рекомбинантной плазмидой pAS007 трансформируют штамм E.coli BL21 (DE3) [21] [F-, ompT, hsdSB (rB-, mB-), dcm, gal, Δ (DE3)]. Выбор данного штамма в качестве реципиента для продукции GSТ-hЕGF обусловлен тем, что он синтезирует РНК - полимеразу фага Т7, а также обладает сниженной протеазной активностью, что способствует повышению выхода целевых белков.
Для селекции наиболее активного продуцента белка GST-hEGF и подбора условий культивирования отдельные клоны трансформантов выращивают в 50 мл среды LB при температуре от 20°C до 37°C до А600 ~1,0 ОЕ, после чего вносят индуктор ИПТГ до конечной концентрации 0.2 мМ и продолжают инкубацию в течение 22 часов. Периодически отбирают аликвоты суспензии клеток выросших индивидуальных трансформантов и используют их для определения параметров роста культуры и уровня продукции GST-hEGFв бактериальных клетках. Для получения грубого экстракта осадок клетки разрушают ультразвуком с периодическим охлаждением во льду (4·30 сек с интервалом 1 мин). Клеточный дебрис удаляют центрифугированием (13000 об/мин, 10 мин), 50 мкл полученного осветленного лизата используют для определения уровня продукции GST-hEGF методом электрофореза в ДСН-ПААГ.
Определенный уровень продукции гибридного белка GST-hEGF в полученом штамме E.coli BL21(DE3)/pAS0007 составляет примерно 200 мг белка на литр культуры продуцента, что более чем в три раза превышает выход белка согласно прототипу [14]. Полученный гибридный белок обладает присущей EGFспецифической митогенной активностью, хотя и в существенно меньшей степени, чем сам EGF.
Пример 4. Специфический гидролиз GST-hEGF
Специфический гидролиз гибридного белка GST-hEGF осуществляли путем внесения в рефолдирующий раствор специальной гидролазы - легкой цепи энтерокиназы человека [22]. Инкубирование в присутствии гидролазы продолжали в течение 2 часов. В последовательности аминокислотных остатков hEGF отсутствуют сайты неспецифического гидролиза энтерокиназы, поэтому полипептидная цепь hEGF в процессе гидролиза не подвергалась воздействию энтерокиназы. На Фиг.2. показано, что гидролиз гибридного белка осуществляется практически полностью и приводит к получению продуктов реакции - GST и hEGF. При дальнейшей очистке hEGF получается продукт практически без видимых примесей, что говорит о высокой специфичности гидролиза и является подтверждением того, что полипептидная цепь hEGF в процессе гидролиза не подвергалась воздействию энтерокиназы. Аналогичная высокая специфичность легкой цепи энтерокиназы человека продемонстрирована ранее при специфическом гидролизе гибридного белка Trx-hEGF [22], где также не обнаруживается продуктов неспецифического гидролиза hEGF.
Пример 5. Биологическая активность hEGF
Для тестирования биологической активности hEGF эмбриональные фибробласты мыши линии NIH3T3 культивировали в пластиковых культуральных флаконах в среде DMEM, содержащей 10% FBS и 50 мкг/мл гентамицина в CO2-инкубаторе при 37°C в увлажненной атмосфере, содержащей 5% CO2. Клетки рассевали дважды в неделю с помощью раствора 0.05% трипсина 0.02% EDTA.
За сутки до внесения hEGF фибробласты высевали в 96-луночные планшеты с плотностью 4×103 клеток/лунку. На следующий день клетки промывали средой DMEM, не содержащей сыворотки, добавляли свежую среду DMEM, содержащую 1% FBS, вносили rEGF и для сравнения коммерчески-доступные препараты EGF мыши (производства Sigma, США; Serva, ФРГ) в диапазоне концентраций 0.16-20 нг/мл с шагом 1:2 в трех параллельных лунках для каждой концентрации и инкубировали в стандартных условиях в течение 5 суток. После окончания инкубации количество клеток в лунках определяли с помощью SRB (sul-forhodamine В) [23]. Среду из лунок удаляли с помощью водоструйного насоса, клетки фиксировали 10% ТХУ (2 ч, +4°C), высушивали на воздухе, добавляли в каждую лунку по 50 мкл 0.4% раствора SRB в 1% уксусной кислоте и инкубировали 30 минут при комнатной температуре при перемешивании на шейкере. Не связавшийся с белками клеток краситель удаляли путем четырехкратной промывки 1% раствором уксусной кислоты, связавшийся с клетками краситель после высушивания экстрагировали 100 мкл 10 mM раствора незабуференного TRIS. Интенсивность окраски измеряли по поглощению при 540 нм на планшетном спектрофотометре. Выживаемость клеток для каждой концентрации оценивали в процентах от необработанного контроля. На основе полученных данных строили кривые выживаемости. Статистическую обработку проводили при помощи той же программы. Результаты представлены на Фиг.3.
Из Фиг.2 можно сделать вывод, что рекомбинантный EGF обладает такой же биологической активностью, что и коммерческие аналоги. Причем его активность выше чем у EGF производства Serva, ФРГ, и совпадает с активностью EGF производства Sigma, США, в широком диапазоне концентраций 0.16-20 нг/мл.
Список цитированных источников
1. Scott J, Patterson S, Rail L, Bell GI, Crawford R, Penschow J, Niall H, Coghlan J The structure and biosynthesis of epidermal growth factor precursor. J Cell Sci Suppl 1985; 3: 19-28.
2. Schultz G, Khaw PT, Oxford K, MaCauley S, Van Setten G, Chegini N Growth factors and ocular wound healing. Eye 1994; 8 (Pt 2): 184-187.
3. Greenhalgh DG. The role of growth factors in wound healing. J Trauma. 1996 Jul 1; 41 (1): 159-167.
4. Schultz G, et al. EGF and TGF-alpha in wound healing and repair. J Cell Biochem. 1991 Apr 1; 45 (4): 346-352.
5. Cristiano RJ, et al. Epidermal growth factor mediated DNA delivery into lung cancer cells via the epidermal growth factor receptor. Cancer Gene Ther. 1996 Jan 1; 3 (1): 4-10.
6. Jinno H, et al. Epidermal growth factor receptor-dependent cytotoxic effect by an EGF-ribonuclease conjugate on human cancer cell lines-a trial for less immunogenic chimeric toxin. Cancer Chemother Pharmacol. 1996 Jan 1; 38 (4): 303-308.
7. Ohno K, et al. Multi-drug delivery system using streptavidin-transforming growth factoralpha chimeric protein. DNA Cell Biol. 1996 May 1; 15 (5): 401-406.
8. Morioka-Fujimoto K, et al. Modified enterotoxin signal sequences increase secretion level of the recombinant human epidermal growth factor in Escherichia coli. J Biol Chem. 1991 Jan 25; 266 (3): 1728-1732.
9. Yamagata H, Nakahama K., Suzuki Y, Kakinuma A, Tsukagoshi N, Udaka S Use of Bacillus brevis for efficient synthesis and secretion of human epidermal growth factor. Proc Natl Acad Sci USA 1989 May; 86 (10): 3589-3593.
10. Urdea MS, Merryweather JP, Mullenbach GT, Coit D, Heberlein U, Valenzuela P, Barr PJ Chemical synthesis of a gene for human epidermal growth factor urogastrone and its expression in yeast. Proc Natl Acad Sci USA 1983 Dec; 80 (24): 7461-7465.
11. Clare JJ, Romanes MA, Payment FB, Rowedder JE, Smith MA, Payne MM. Sreekrishna K, Henwood CA Production of mouse epidermal growth factor in yeast: high-level secretion using Pichia pastoris strains containing multiple gene copies. Gene 1991 Sep 15; 105 (2): 205-212.
12. Sassenfeld HM. (1990) Engineering proteins for purification. Trends Biotechnol., 8 (4): 88-93.
13. Li Wenqing, Xu Bainian, Zhu Jian, Luo Jinxian (1998). Expression of GST-EGF fusion protein in E.coli and its purification. Acta Scientiarum Naturalium Universitatis Sunyatseni, 37, 13-16.
14. ZHI Qing-Wen, LI Qian, WANG Shu-Hao, WANG Yu-Xia, LI Shi-Gui, SUN Man-Ji (2005). Expression of gene of GST-hEGF fusion protein and bioactivity of its product. Chin J Pharmacol Toxicol, 19, 113-117.
15. Davie EW, Kulman JD (2006). An overview of the structure and function of thrombin. Semin Thromb Hemost. 32, : 3-15.
16. Novagen, TB239.
17. Ausubel F.M., Brent R.G., Kingston R.E., Moore D.D., Seidman J.G., Smith J.A., Struhl K.A. Current Protocols in Molecular Biology. Massachusets General Hospital and Harvard Medical School, John Willey & Sons Inc., 1994.
18. Villalobos A, Ness JE, Gustafsson C, Minshull J, Govindarajan S. (2006) Gene Designer: a synthetic biology tool for constructing artificial DNA segments. BMC Bioinformatics. 2006 Jun 6; 7: 285.
19. Hoover DM, Lubkowski J (2002). DNA Works: an automated method for designing oligonucleotides for PCR-based gene synthesis. Nucleic Acids Res. 30(10):43.
20. Dong В, Mao R, Li B, Liu Q, Xu P, Li G. (2007) An improved method of gene synthesis based on DNA works software and overlap extension PCR. Mol Biotechnol. 37 (3): 195.
21. Studier, F.W. and Moffatt, B.A. (1986). Use of bacteriophage T7 RNA poymerase to direct selective high-level expression of cloned genes. J. Mol. Biol. 189, 113-130.
22. Gasparian M.E., Ostapchenko V.G., Schulga A.A., Dolgikh D.A., Kirpichnikov M.P. Expression, purification, and characterization of human enteropeptidase catalytic subunit in Escherichia coli. Protein Expression and Purification. Pages 133-139. Volume 31, Issue 1, September 2003.
23. Skehan H, Storeng R, Scudiero D. New colorimetric cytotoxicity assay for anticancer-drug screening. J Natl Cancer Inst. N 82 (13) P.1107-1112. 1990.




Изобретение относится к биотехнологии, в частности к генно-инженерному получению белков человека, и может быть использовано для получения эпидермального фактора роста человека (чЭФР) в клетках бактерий в виде гибридного белка с глутатион-3-трансферазой. Конструируют рекомбинантную ДНК, кодирующую гибридный белок GST-hEGF, который состоит из аминокислотной последовательности глутатион-S-трансферазы и аминокислотной последовательности эпидермального фактора роста человека, разделенных сайтом расщепления энтерокиназой, и характеризующуюся нуклеотидной последовательностью SEQ ID NO:1. На основе KpnI/XhoI-фрагмента вектора рЕТ41 и указанной рекомбинантной ДНК создают рекомбинантную плазмиду рАS007 для экспрессии гибридного белка GST-hEGF в клетках E.coli. Изобретение позволяет достичь высоких уровней экспрессии GST-hEGF в клетках E.coli. 2 н.п. ф-лы, 3 ил., 1 табл., 5 пр.
1. Рекомбинантная ДНК, кодирующая гибридный белок GST-hEGF, который состоит из аминокислотной последовательности глутатион-S-трансферазы и аминокислотной последовательности эпидермального фактора роста человека, разделенных сайтом расщепления энтерокиназой, и характеризующаяся нуклеотидной последовательностью SEQ ID NO:1.
2. Рекомбинантная плазмида рАS007 для экспрессии гибридного белка GST-hEGF в клетках E.coli, состоящая из KpnI/XhoI-фрагмента вектора рЕТ41 и рекомбинантной ДНК по п.1, объединенных между собой так, как это показано на фиг.1.
| ZHI QING-WEN et al., Expression of gene of GST-hEGF fusion protein and bioactivity of its product, Chin J | |||
| Pharmacol Toxicol, 2005, v.19, n.2, p.113-117 | |||
| LI WENQING et al., Expression of GST-EGF fusion protein in E | |||
| coli and its purification, Acta Scientiarum Naturalium Universitatis Sunyatseni, 1998, v | |||
| Пишущая машина | 1922 |
|
SU37A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Насос | 1917 |
|
SU13A1 |
| CN 101857865 A, | |||
Авторы
Даты
2014-06-27—Публикация
2011-03-02—Подача