Изобретение относится к способу синтеза азотсодержащих гетероциклических соединений, в частности к получению 7-R-пиридо[1,2-а]бензимидазолов общей формулы
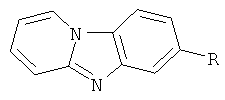
, где R=a) CF3, б) CN, в) СООН, г) C(O)NH2, д) СООСН3, е) СOOC2H5 , которые могут быть использованы в качестве полупродуктов для синтеза биологически активных веществ (Пат. 04297475 Япония (1992); E-S. A.M.Badawey, Y.M.Gohar. IL Farmaco., 47, 489 (1992); Пат. 2.394.824 РФ (2010)), флюоресцентных красителей (U.V.Gokhale, S.Seshadri. // Dyes Pigm., 8, 157 (1987)), интеркалирующих агентов для проведения генетического анализа (О.А.Rachinskaya, K.V.Popov, G.A.Ryzvanovich, N.L.Bol'sheva, R.S.Begunov, O.Yu.Yurkevich, A.V.Zelenin, O.V.Muravenko // Russian Journal of Genetics, 48, 1055-1062 (2012)), в качестве лекарственных средств против туберкулеза (М.Pieroni, S.K.Tipparaju, S.Lun, Y.Song, A.W.Sturm, W.R.Bishai, A.P.Kozikowski // Chem. Med. Chem., 6, 334-342 (2011)), противовирусных (C.K.Котовская, З.М.Баскакова, B.H.Чарушин, О.Н.Чупахин, Е.Ф.Беланов, Н.И.Бормотов, С.М.Балахнин, О.А. Серова // Хим.-фарм. журн., 39, 12-16 (2005)), противоопухолевых препаратов (Н.М. Refaat // Med. Chem. Res., 21, 1253-1260 (2012)), психотропных лекарственных средств (A.D.Jordan, А.Н.Vaidya, D.I.Rosenthal, В.Dubinsky, C.P.Kordik, P.J.Sanfilippo, Wu-Nan Wu and A.B.Reitz // Bioorg. Med. Chem. Lett., 12, 2381-2386 (2002)).
Наиболее близким по содержанию является способ получения 7-R-пиридо[1,2-а]бензимидазолов, основанный на восстановлении хлоридов N-(2-нитро-4-R-фенил)пиридиния хлоридом олова (II) в кислой водно-спиртовой среде при температуре 20°С в течение 0,12 ч, с последующим выделением конечных продуктов экстракцией хлороформом, после обработки реакционной массы аммиаком. Выход целевых продуктов после отгонки хлороформа 90-98% (Пат. №2241710 РФ (2004)).
Недостатками известного способа синтеза 7-R-пиридо[1,2-а]бензимидазолов являются: использование дорогостоящего хлорида олова (II), необходимость регенерации образовавшегося Sn(OH)4 и сложность выделения целевых продуктов.
Цель изобретения - создание безреагентного способа получения 7-R-пиридо[1,2-а]бензимидазолов, позволяющего снизить стоимость синтеза и упростить выделение целевых продуктов.
Поставленная цель достигается тем, что в качестве источника электронов для восстановления хлоридов N-(2-нитро-4-11-фенил)пиридиния используется электрический ток. Применение электрического тока позволяет отказаться от применения дорогостоящих реагентов, в данном случае хлорида олова (II). В результате также отпадает необходимость в разделении твердых неорганических и органических веществ экстракцией хлороформом и отгонке последнего с целью выделения целевых продуктов в кристаллическом виде. Причем восстановление проводят в диафрагменной ячейке в гальваностатическом режиме на свинцовом катоде, сила тока 0.6 А. Анолитом служит 15%-ный раствор серной кислоты, анодом - платина. Субстрат растворяют в смеси спирта и 4%-ной соляной кислоты, взятых в соотношении 1:1. Электролиз ведут при перемешивании при температуре 40-45°С, пропуская через электролитическую ячейку заряд в 4 Ф в течение 0,5 ч. Целевые продукты выделяются фильтрованием выпавшего осадка после обработки реакционной смеси гидроксидом аммония.
Реализация предложенного метода синтеза 7-R-пиридо[1,2-а]бензимидазолов позволяет сократить общее операционное время процесса с 2,5 ч до 0,75 ч и получать целевые продукты с выходом 88-96%.
Строение и чистоту промежуточных соединений и целевых продуктов пиридо[1,2-α]бензимидазолов анализировали методом ЯМР 1Н- и масс-спектроскопии, определением температуры плавления и элементного состава.
Изобретение иллюстрируется следующими примерами.
Пример 1. 7-(Трифторметил)пиридо[1,2-α]бензимидазол (а). Электрохимический синтез проводили в ячейке с диафрагмой в гальваностатическом режиме на свинцовом катоде площадью 85 см2, ток 0.6 А, плотность тока 7.06 мА/см2. Анолит - 15%-ная серная кислота, анод - платина. 1 г (3.34 ммоль) субстрата растворяли в 20 мл спирта и добавляли 20 мл 4% соляной кислоты. Электролиз вели при перемешивании при температуре 40-45°С. Пропустив через электролитическую ячейку заряд в 4 Ф в течение 0,5 ч, электролиз останавливали, католит подщелачивали 25%-ным раствором аммиака до рН 7-8 и отфильтровывали выпавший осадок, получая 0.74 г (96% от теории) 7-(трифторметил)пиридо[1,2-α]бензимидазола. Т. пл. 233-235° С.
Спектр ЯМР 1Н (ДМСО-d6) δ, мд: 7.09 т (1H, Н2, J 7.0 Гц), 7.66 т (1H, Н3, J 8.0 Гц), 7.68 д (1Н, Н9, J 8.0 Гц), 7.75 д (1H, Н4, J 9.0 Гц), 8.16 д (1H, Н6, J 1.5 Гц), 8.53 дд (1H, Н8, J 2 Гц, J 8 Гц), 9.15 д (1Н, Н1, J 7.5 Гц).
MS, m/z: 236 (100) [М]+, 217 (20), 186 (12), 167 (4), 118 (5), 69 (5), 63 (11), 51 (17), 39
Найдено, %: С 60.79; Н 2.96; N 12.01.
Вычислено, %: С 61.02; Н 2.97; N 11.86. C12H7N2
Примеры 2-7. Другие замещенные пиридо[1,2-α]бензимидазолы получают аналогично примеру 1.
Пиридо[1,2-α]бензимидазол-7-карбонитрил (б). Выход 0.59 г (93%). Т.пл. 242-244° С.
Спектр ЯМР 1Н (ДМСО-d6) δ, мд: 7.10 т (1H, Н2, J 6.5 Гц), 7.67 т (1H, Н3, J 7 Гц), 7.74 д (1H, Н4, J 9.5 Гц), 7.75 д (1Н, Н9, J 8.5 Гц), 8.35 д (1H, Н6, J 1.5 Гц), 8.51 дд (1H, Н8, J 2.0 Гц, J 8.5 Гц), 9.15 д (1H, Н1, J 6.5 Гц).
MS, m/z: 193 (100) [М]+, 167 (6), 165 (4), 154 (4), 139 (9), 97 (9), 78 (8), 63 (7), 51 (12), 39 (15).
Найдено, %: С 74.64; Н 3.60; N 21.87.
Вычислено, %: С 74.61; Н 3.63; N 21.76. C12H7N3.
Пиридо[1,2-α]бензимидазол-7-карбоновая кислота (в). Выход 0.62 г (88%). Т. пл.>300°С.
Спектр ЯМР 1Н (ДМСО-d6) δ, мд: 7.05 м (1H, Н2), 7.60 т (1H, Н3, J 8.5 Гц), 7.70 д (1H, Н4, J 9.0 Гц), 7.95 дд (1H, H8, J 2.0 Гц, J 8.0 Гц), 8.35 д (1H, Н9, J 8.0 Гц), 8.40 д (1H, Н6, J 1.0 Гц), 9.10 д (1H, Н1, J 7.5), 12.85 с (1H, СООН).
MS, m/z: 212 (100) [М]+, 167 (38), 140 (15), 78 (10), 51 (6).
Найдено, %: С 68.21; Н 3.72; N 13.24.
Вычислено, %: С 67.92; Н 3.77; N 13.21. C12H8N2.
Пиридо[1,2-α]бензимидазол-7-карбоксамид (г). Выход 0.63 г (91%). Т. пл.>300°С.
Спектр ЯМР 1Н (ДМСО-d6) δ, мд: 7.01 т (1H, Н2, J 9.0 Гц), 7.30 с (1H, CONH2), 7.56 т (1H, H3, J 10.0 Гц), 7.66 д (1H, Н9 J 9.5 Гц), 7.88 д (1H, H4, J 9.5 Гц), 8.06 с (1H, CONH2), 8.32 д (1H, H8, J 10.0 Гц), 8.38 д (1H, Н6, J 1.0 Гц), 9.08 д (1H, Н1, J 8.5 Гц).
MS, m/z: 211 (100) [М]+, 167 (94), 140 (30), 78 (40), 63 (37), 51 (33), 39 (24).
Найдено, %: С 68.19; Н 4.21; N 20.02.
Вычислено, %: С 68.25; Н 4.27; N 19.91. C12H9N3.
Метил пиридо[1,2-α]бензимидазол-7-карбоксилат (д). Выход 0.70 г (94%). Т. пл. 226-228°С.
Спектр ЯМР 1Н (ДМСО-d6) δ, мд: 3.9 с (3 Н, СН3), 7.03 т (1H, Н2, J 7.5 Гц), 7.55 т (1H, Н3, J 8.5 Гц), 7.68 д (1H, Н4, J 8.0 Гц), 7.94 дд (1H, Н8, J 1.5, J 7.5 Гц), 8.37 д (1H, Н9, J 8.0 Гц), 8.39 (1H, Н6, J 1.0 Гц), 9.08 д (1H, Н1, J 7.5 Гц).
MS, m/z: 226 (100) [М]+, 195 (86), 167 (74), 140 (31), 78 (34), 63 (29), 51 (37), 39 (22).
Найдено, %: С 68.97; Н 4.34; N 12.42.
Вычислено, %: С 69.02; Н 4.42; N 12.39. C13H10N4O2.
Этил пиридо[1,2-α]бензимидазол-7-карбоксилат (е). Выход 0.71 г (91%). Т. пл. 179-182°С.
Спектр ЯМР 1Н (ДМСО-d6) δ, мд: 1.38 м (3Н, СН3), 4.35 м (2Н, СН2), 7.02 т (1H, Н2, J 7.5 Гц), 7.57 т (1H, Н3, J 8.5 Гц), 7.67 д (1H, Н4, J 8.5 Гц), 7.95 дд (1H, Н8, J 1.5, J 8.0 Гц), 8.35 д (1H, Н9, J 8.0 Гц), 8.38 (1H, Н6, J 1.0 Гц), 9.07 (1H, Н1, J 8.0 Гц).
MS, m/z: 240 (100) [М]+, 195 (58), 167 (56), 140 (26), 78 (41), 63 (32), 51 (34), 39 (26).
Найдено, %: С 69.85; Н 4.98; N 11.72.
Вычислено, %: С 70.00; Н 5.00; N 11.67. C14H12N2O2.
| название | год | авторы | номер документа |
|---|---|---|---|
| БЕЗДИАФРАГМЕННЫЙ ЭЛЕКТРОСИНТЕЗ ЗАМЕЩЕННЫХ ПИРИДО[1,2-а]БЕНЗИМИДАЗОЛОВ | 2014 |
|
RU2556001C1 |
| Периленилтриазолы - ингибиторы репродукции вируса клещевого энцефалита | 2017 |
|
RU2650880C1 |
| Способ получения дигалогенпроизводного 1,2,3,4-тетрагидропиридо- или пиридо[1,2-а]бензимидазол-6,9-диона | 2023 |
|
RU2828349C1 |
| Способ получения монотерпеновых сульфокислот | 2016 |
|
RU2651791C2 |
| Способ синтеза пиридо[1,2-а]имидазо[4,5-f]бензимидазола и его производных | 2017 |
|
RU2645917C1 |
| Способ получения пуриновых нуклеозидов ряда β-D-арабинофуранозы | 2015 |
|
RU2624023C2 |
| ФЕНОЛОРГАНОСИЛОКСАНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2487901C1 |
| ПРОИЗВОДНЫЕ МУТИЛИНОВ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТИБАКТЕРИАЛЬНЫХ СРЕДСТВ | 2000 |
|
RU2276135C2 |
| Способ получения N-арилзамещенных 3H-имидазо[4,5-b]пиридинов | 2016 |
|
RU2642456C2 |
| СПОСОБ ПОЛУЧЕНИЯ НАФТО[1,2,3-cd]ИНДОЛ-6(2Н)-ОНОВ | 2013 |
|
RU2552416C2 |
Настоящее изобретение относится к способу получения 7-R-пиридо[1,2-а]бензимидазолов общей формулы  , где R=a) CF3, б) CN, в) СООН, г) C(O)NH2, д) СООСН3, е) СООС2Н5, заключающемуся в том, что восстановление хлоридов N-(2-нитро-4-R-фенил)пиридиния проводят в смеси спирта и 4%-ной соляной кислоты, взятых в соотношении 1:1, с помощью электрического тока в диафрагменной ячейке в гальваностатическом режиме при температуре 40-45°С на свинцовом катоде, при пропускании через электролитическую ячейку заряда в 4 Ф в течение 0,5 ч, силой тока 0.6 А, в качестве анолита используется 15%-ный раствор серной кислоты, в качестве анода - платина, целевые продукты выделяются фильтрованием выпавшего осадка после обработки реакционной смеси гидроксидом аммония. Технический результат: разработан новый безреагентный способ получения 7-R-пиридо[1,2-а]бензимидазолов, позволяющий снизить стоимость синтеза и упростить процесс выделения целевых продуктов. 7 пр.
, где R=a) CF3, б) CN, в) СООН, г) C(O)NH2, д) СООСН3, е) СООС2Н5, заключающемуся в том, что восстановление хлоридов N-(2-нитро-4-R-фенил)пиридиния проводят в смеси спирта и 4%-ной соляной кислоты, взятых в соотношении 1:1, с помощью электрического тока в диафрагменной ячейке в гальваностатическом режиме при температуре 40-45°С на свинцовом катоде, при пропускании через электролитическую ячейку заряда в 4 Ф в течение 0,5 ч, силой тока 0.6 А, в качестве анолита используется 15%-ный раствор серной кислоты, в качестве анода - платина, целевые продукты выделяются фильтрованием выпавшего осадка после обработки реакционной смеси гидроксидом аммония. Технический результат: разработан новый безреагентный способ получения 7-R-пиридо[1,2-а]бензимидазолов, позволяющий снизить стоимость синтеза и упростить процесс выделения целевых продуктов. 7 пр.
Способ получения 7-R-пиридо[1,2-а]бензимидазолов общей формулы
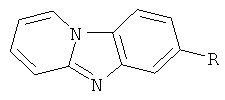
где R=a) CF3, б) CN, в) СООН, г) C(O)NH2, д) СООСН3, е) СООС2Н5, заключающийся в том, что восстановление хлоридов N-(2-нитро-4-R-фенил)пиридиния проводят в смеси спирта и 4%-ной соляной кислоты, взятых в соотношении 1:1, с помощью электрического тока в диафрагменной ячейке в гальваностатическом режиме при температуре 40-45°С на свинцовом катоде, при пропускании через электролитическую ячейку заряда в 4 Ф в течение 0,5 ч, силой тока 0.6 А, в качестве анолита используется 15%-ный раствор серной кислоты, в качестве анода - платина, целевые продукты выделяются фильтрованием выпавшего осадка после обработки реакционной смеси гидроксидом аммония.
| Sokolov A.A | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Ryzvanovich G.A | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Begunov | |||
Авторы
Даты
2014-07-20—Публикация
2012-12-25—Подача