Изобретение относится к области молекулярной биологии, микробиологии и медицины, а именно к применению новых противовирусных производных широкого спектра действия на основе периленилтриазолов. Более конкретно, изобретение относится к области биологически активных соединений и касается разработки новых 1-замещенных 4-(перилен-2-ил)-1,2,3-триазолов и 4-(перилен-3-ил)-1,2,3-триазолов, являющихся эффективными ингибиторами репродукции оболочечных вирусов.
В последние десятилетия по всему миру резко возросло количество заболеваний вызванных вирусными инфекциями, что создает угрозу сотням тысяч человеческих жизней. Более того, текущие прогнозы по изменению глобального климата к концу этого столетия повышают вероятность расширения ареала обитания насекомых, являющихся основными переносчиками патогенов. Таким образом, вероятно, вирусные лихорадки в двадцать первом веке будут представлять собой наибольшую опасность для миллионов людей на планете.
Считается, что профилактика и терапия вызванных вирусами заболеваний чрезвычайно сложна, так как возбудители сохраняются и мутируют в природе в организмах промежуточных хозяев, тогда как сама инфекция является острой, с крайне малым инкубационным периодом - все это способствует быстрым вспышкам эпидемий различной степени опасности, вплоть до катастрофических пандемий.
Несмотря на прикладываемые во всем мире усилия, в настоящее время для многих вирусных заболеваний отсутствует клинически одобренная терапия, при наличии только лечения симптомов у пациентов и поддерживающей терапии в условиях стационара. Таким образом, глобальное социально-экономическое воздействие вирусных возбудителей требует обнаружения и валидирования вирусных мишеней и рациональной разработки новых противовирусных соединений.
Уровень техники
К началу 90-х гг. прошлого века было синтезировано несколько десятков различных 5-замещенных 2'-дезоксиуридинов и их аналогов с другими нуклеозидами, а также исследована их способность ингибировать репликацию вирусов (далее - противовирусная активность) [De Clercq Е. Antiviral and antitumor activities of 5-substituted 2'-deoxyuridines // Methods and findings in experimental and clinical pharmacology. - 1980. - T. 2. - №. 5. - C. 253.; Herdewijn P. 5-Substituted-2'-deoxyuridines as anti-HSV-1 agents: synthesis and structure activity relationship // Antiviral Chemistry and Chemotherapy. - 1994. - T. 5. - №. 3. - C. 131-146.].
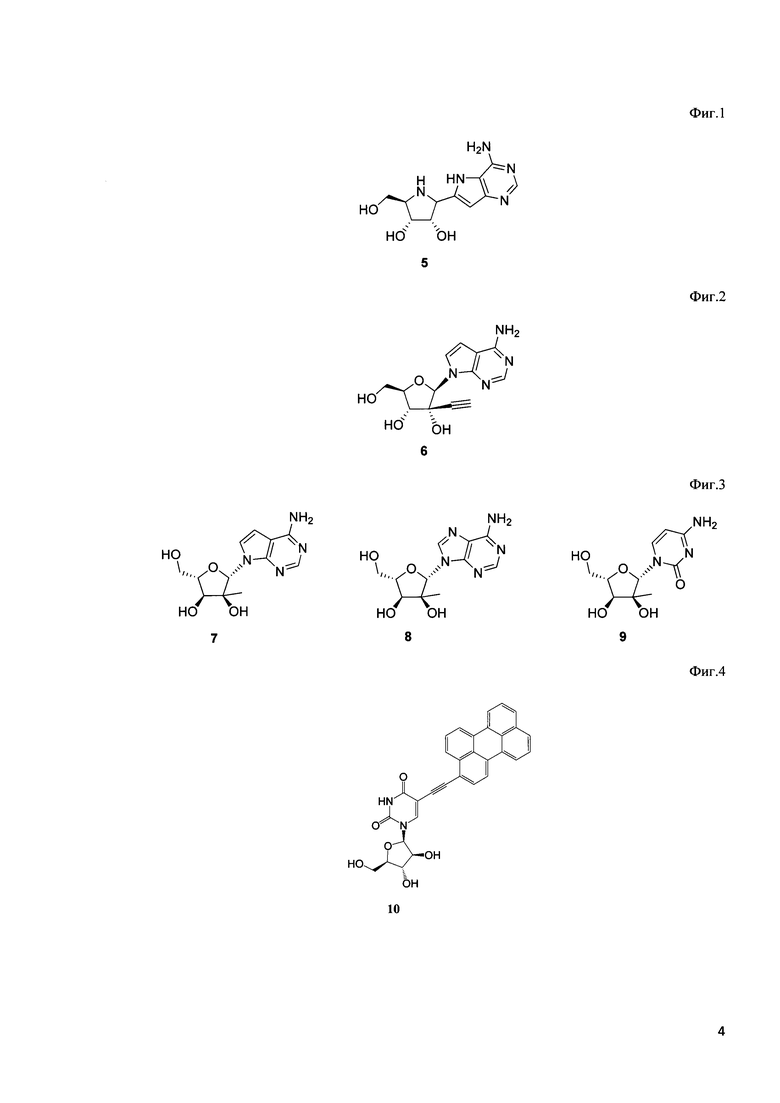
Известен модифицированный нуклеозид - BCX4430 (5, Фиг. 1), который демонстрирует высокую активность по отношению к таким семействам оболочечных вирусов, как Filoviridae, Bunyaviridae, Arenaviridae, Picornaviriae, Orthomyxoviridae, Paramyxoviridae, и Coronaviridae [Warren Т.K. et al. Protection against filovirus diseases by a novel broad-spectrum nucleoside analogue BCX4430 // Nature. - 2014. - T. 508. - №. 7496. - C. 402.].
BCX4430 полностью ингибирует репликацию вируса клещевого энцефалита (TBEV) на клетках почки эмбриона свиньи при концентрации 25 μМ и при 50 μM в форме гидрохлоридной соли. Однако цитотоксичность этого вещества показала снижение жизнеспособности клеток на 10-20% уже при концентрации 75 μМ [Eyer L. et al. Antiviral activity of the adenosine analogue BCX4430 against West Nile virus and tick-borne flaviviruses // Antiviral research. - 2017. - T. 142. - C. 63-67.].
Известен нуклеозид - NITD008 (6, Фиг. 2), который имеет концентрацию полуингибирования TBEV в 0,9 μМ на клеточной линии А549. Тем не менее, считается, что данный препарат не войдет в клиническую практику. [Lo М.K. et al. In vitro antiviral activity of adenosine analog NITD008 against tick-borne flaviviruses // Antiviral research. - 2016. - T. 130. - C. 46-49.].
Известны 7-диазо-2'-С-метиладенозин (7, Фиг. 3), 2'-С-метиладенозин (8, Фиг. 4) и 2'-С-метилцитидин (9, Фиг. 5), которые показывают антивирусную активность против TBEV (7-диазо-2'-С-метиладенозин: ЕС50=5.1±0.4 μМ, 2'-С-метиладенозин: ЕС50=7.1±1.2 μМ, 2'-С-метилцитидин: ЕС50=14.2±1.9 μМ). Однако 2'-С-метилцитидин достаточно цитотоксичен для клеток почки эмбриона свиньи (СС50=~50 μМ), а 2'-С-метиладенозин показывает значительный спад антивирусной активности на 3-й день. Высокая противовирусная активность и низкая цитотоксичность 7-диазо-2'-С-метиладенозина делают его потенциальным кандидатом для лечения TBEV. [Eyer L. et al. Nucleoside inhibitors of tick-borne encephalitis virus // Antimicrobial agents and chemotherapy. - 2015. - T. 59. - №. 9. - C. 5483-5493.].
Наиболее близким к заявляемому техническому результату является нуклеозид, модифицированный объемным ароматическим заместителем, 5-(3-периленилэтинил)-2'-арабиноуридин (10, Фиг. 6), демонстрирующий активность в отношении ряда оболочечных вирусов. Он имеет концентрацию полуингибирования (IC50) 131 и 31 nM относительно вируса простого герпеса типов 1 и 2, соответственно, 187 nM для вируса гепатита С, 5 nM для вируса Варицелла-Зостер, 78-283 nM для различных штаммов вируса гриппа A [Colpitts С.С., Ustinov A.V. et al. 5-(Perylen-3-yl)ethynyl-arabino-uridine (aUY11), an arabino-based rigid amphipathic fusion inhibitor, targets virion envelope lipids to inhibit fusion of influenza virus, hepatitis С virus, and other enveloped viruses. J. Virol., 2013, 87:3640-3654.] и 18 nМ для вируса клещевого энцефалита [Orlov A.A. et al. Rigid amphipathic nucleosides suppress reproduction of the tick-borne encephalitis virus // MedChemComm. - 2016. - T. 7. - №. 3. - C. 495-499.].
Раскрытие изобретения
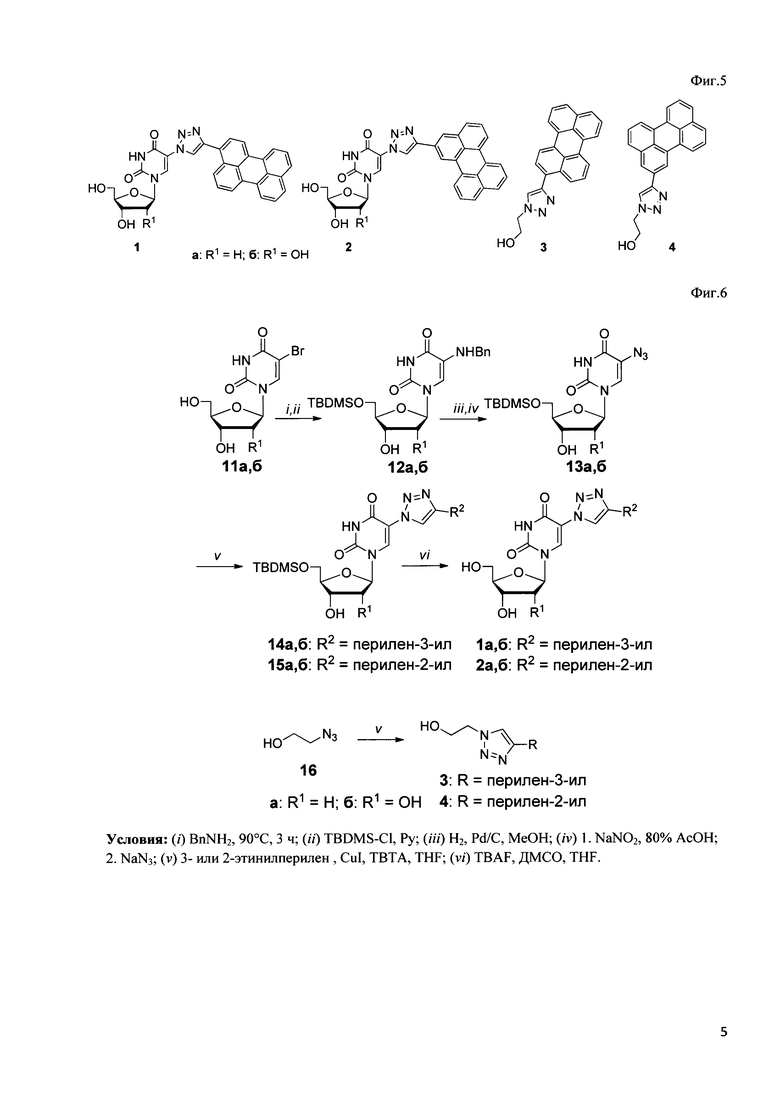
В задачу настоящего изобретения входит расширение арсенала антивирусных лекарственных средств. В процессе создания настоящего изобретения установлено, что новые соединения, представляющие собой 4-(перилен-2-ил)-1,2,3-триазольные и 4-(перилен-3-ил)-1,2,3-триазольные производные 2'-дезоксиуридина и уридина, а также этанола, обладающие способностью ингибировать репликацию вируса клещевого энцефалита и имеющие формулы 1, 2, 3 и 4. Данное изобретение иллюстрируют следующие графические материалы: Фиг. 6 и Таблица.
4-(Перилен-2-ил)-1,2,3-триазольные и 4-(перилен-3-ил)-1,2,3-триазольные производные 2'-дезоксиуридина и уридина, а также этанола, были получены в соответствии с Фиг. 6.
Исходные 5-азидо-5'-O-ТВDМS-2'-дезоксиуридин (13а) и 5-азидо-5'-O-ТВDМS-уридин (13b) синтезируют аминированием 5-бром-2'-дезоксиуридина (11а) и 5-бромуридина (11b) бензиламином, с последующим введением 5'-O-трет-бутилдиметилсилильной защитной группы, восстановлением бензильной группы и диазотированием/азидированием [Gourdain S. et al. Highly efficient and facile synthesis of 5-azido-2'-deoxyuridine // Nucleosides, Nucleotides and Nucleic Acids. - 2010. - T. 29. - №. 7. - C. 542-546.]. Реакция 1,3-диполярного циклоприсоединения между азидом 13а и 3- или 2-этинилпериленом [Chistov A.A. et al. 2-Ethynylperylene and improved synthesis of 3-ethynylperylene // Tetrahedron letters. - 2016. - T. 57. - №. 9. - C. 1003-1005.] в присутствии CuI в ДМСО и последующее деблокирование 5'-гидроксильной группой обработкой фторидом н-тетрабутиламмония (TBAF) в ДМСО дает производные 1а и 2а, соответственно. Аналогично, реакция между азидом 13b и 3- или 2-этинилпериленом приводит к производным 1b и 2b, соответственно. Наконец, реакция 1,3-диполярного циклоприсоединения между 2-азидоэтанолом 16 и 3- или 2-этинилпериленом в присутствии CuI в ДМСО приводит к соединениям 3 и 4, соответственно.
Предлагаемое изобретение иллюстрируют следующие графические материалы:
На Фиг. 1 изображена структура нуклеозида ВСХ4430.
На Фиг. 2 изображена структура нуклеозида NITD008.
На Фиг. 3 изображены структуры 7-диазо-2'-С-метиладенозина, 2'-С-метиладенозина и 2'-С-метилцитидина соответственно.
На Фиг. 4 изображена структура 5-(3-периленилэтинил)-2'-арабиноуридина.
На Фиг. 5 изображены структуры заявляемых соединений.
На Фиг. 6 изображена схема химического синтеза заявляемых соединений.
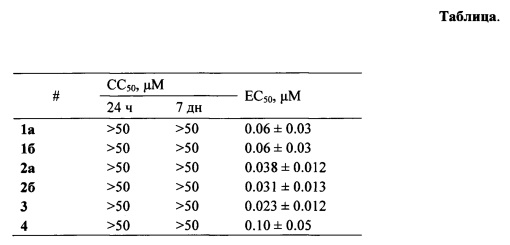
Таблица.
Изображена цитотоксичность (СС50) и противовирусная активность (ЕС50) заявляемых соединений (1, 2, 3, 4 а, б) против-TBEV на клеточной линии PEK.
Изобретение иллюстрируют следующие примеры.
Пример 1. 5'-O-трет-бутилдиметилсилил-5-бензиламино-2'-дезоксиуридин (12а).
5-Бром-2'-дезоксиуридин (11а) (3.07 г, 10.0 ммоль) растворяют в бензиламине (20 мл), раствор нагревают до 90°С и перемешивают в течение 3 ч. После охлаждения до комнатной температуры, реакционную смесь переупаривают с толуолом (2×20 мл). Сухой остаток растворяют в СН2Сl2 (250 мл) и экстрагируют водой (3×250 мл). Водный экстракт концентрируют и сушат в вакууме. Высушенный остаток растворяют в безводном пиридине (50 мл) и добавляют трет-бутилдиметилсилилхлорид (1.51 г, 11.0 ммоль, 1.1 экв.). Смесь оставляют при комнатной температуре на ночь и выливают в водный NaHCO3 (100 мл). Продукт экстрагируют CH2Cl2 (2×100 мл), объединенные органические фракции концентрируют и переупаривают с толуолом (2×50 мл). Продукт очищают колоночной хроматографией на силикагеле (0→2% МеОН в СН2Сl2). Выход 3.63 г, 81% в виде белой пены. 1Н ЯМР (500 МГц, ДМСО-d6): δ 11.44 (уш. с, 1H, Н3), 7.34-7.21 (м, 5Н, Ph), 6.17-6.12 (м, 2Н, Н6, H1'), 5.25 (д, J=4.3 Гц, 1Н, 3'-ОН), 5.20 (т, J=6.0 Гц, 1Н, NHBn), 4.17-1.07 (м, 2Н, CH2Ph), 4.01-3.96 (м, 1Н, Н3'), 3.68-3.63 (м, 1Н, Н4'), 3.55 (дд, J=11.0, 5.0 Гц, 1H, Н5'а), 3.43 (дд, J=11.0, 5.4 Гц, 1Н, Н5'b), 2.00-1.94 (м, 1H, Н2'а), 1.93-1.86 (м, 1H, Н2'b), 0.87 (с, 9Н, С(СН3)3), 0.04 (с, 3Н, SiCH3), 0.04 (с, 3Н, SiCH3). 13С ЯМР (126 МГц, ДМСО-d6): δ 160.22 (С4), 148.29 (С2), 138.85 (С6), 128.32 (2С), 127.12 (2С), 126.90, 124.27 (Ph), 110.53 (С5), 86.19, 83.44, 70.36, 63.49 (С1', С4', С3', С5'), 46.92 (NCH2), 37.96 (С2'), 25.81 (3С, С(СН3)3), 18.02 (С(СН3)3), -5.34, -5.38 (2С, SiCH3). МАЛДИ m/z: рассчитано для C22H34N3O5Si+ [М+Н]+: 448.2; найдено 448.3. HRMS (ESI) m/z: рассчитано для C22H32N3O5Si- [М-Н]-: 446.2117; найдено 446.2103.
Пример 2. 5'-O-трет-бутилдиметилсилил-5-бензиламино-уридин (12б).
Вещество получено по описанному выше (пример 1) методу из 5-бром-уридина (11б) (3.23 г, 10.0 ммоль). Выход 2.96 г, 64%). 1Н ЯМР (500 МГц, ДМСО-d6): δ 11.43 (уш. с, 1Н, Н3), 7.34-7.22 (м, 5Н, Ph), 6.16 (с, 1H, Н6), 5.76 (д, J=5.8 Гц, 1Н, Н1'), 5.24 (д, J=6.0 Гц, 1Н, 3'-ОН), 5.10 (т, J=6.2 Гц, 1Н, NHBn), 5.03 (д, J=4.6 Гц, 1Н, 2'-ОН), 4.11 (д, J=6.2 Гц, 2Н, CH2Ph), 3.90-3.85 (м, 1Н, Н4'), 3.75-3.70 (м, 2Н, Н2', Н3'), 3.64 (дд, J=11.3, 3.5 Гц, 1Н, Н5'а), 3.50 (дд, J=11.3, 4.6 Гц, 1Н, H5'b), 0.87 (с, 9H, С(СН3)3), 0.06 (с, 6Н, SiCH3). 13С ЯМР (126 МГц, ДМСО-d6): δ 160.18 (С4), 148.68 (С2), 138.77 (С6), 128.26 (2С), 127.16 (2С), 126.88, 124.26 (Ph), 111.05 (С5), 87.53 (С1'), 83.73 (С4'), 72.02 (С2'), 69.91 (С3'), 63.46 (С5'), 46.93 (NCH2), 25.77 (3С, С(СН3)3), 17.98 (С(СН3)3), -5.40, -5.43 (2С, SiCH3). МАЛДИ m/z: рассчитано для C22H34N3O6Si+ [М+Н]+: 464.2; найдено 464.2. HRMS (ESI) m/z: рассчитано для C22H32N3O6Si- [М-Н]-: 462.2066; найдено 462.2052.
Пример 3. 5'-O-трет-бутилдиметилсилил-5-азидо-2'-дезоксиуридин (13а).
К раствору 12а (3.58 г, 8.0 ммоль) в метаноле (100 мл) добавляют 10% Pd/C (250 мг), суспензию перемешивают в атмосфере водорода 3 часа. Катализатор фильтруют, фильтрат упаривают в вакууме досуха. Полученный промежуточный амин представляет собой желтоватую пену, выход количественный. Затем амин растворяют в 80% уксусной кислоте (20 мл), охлаждают до 0°С, к нему добавляют NaNO2 (0.61 г; 8.8 ммоль). Через 5 мин, добавляют NaN3 (0.58 г, 8.8 ммоль), смесь перемешивают при 0°С в течение 1 ч в темноте, после чего разбавляют водой (60 мл). Выпавший осадок фильтруют, продукт промывают водой и сушат в высоком вакууме. Выход 1.93 г, (63%). 1Н ЯМР (500 МГц, CDCl3): δ 8.98 (уш. с, 1Н, Н3), 8.20 (с, 1Н, Н6), 6.16 (т, J=6.4 Гц, 1Н, H1'), 4.51-1.46 (м, 1H, Н3'), 3.99-3.93 (м, 2Н, Н5'), 3.82-3.76 (м, Н4'), 2.31-2.25 (м, 2Н, Н2'), 0.89 (с, 9Н, C(CH3)3), 0.09 (с, 6Н, SiCH3). 13С NMR (126 МГц, CDCl3): δ 160.00 (С4), 149.88 (С2), 145.80 (С6), 87.81, 86.86, 71.35, 67.98, 61.74 (С5, С1', С4', С3', С5'), 41.32 (С2'), 25.69 (3С, С(СН3)3), 17.92 (С(СН3)3), -4.70, -4.87 (2С, SiCH3). HRMS (ESI) m/z: рассчитано для C15H24N5O5Si- [М-Н]-: 382.1552; найдено 382.1542.
Пример 4. 5'-O-трет-бутилдиметилсилил-5-азидо-уридин (13б).
Вещество получено по описанному выше (пример 3) методу из 5'-O-трет-бутилдиметилсилил-5-бензиламино-уридина (12б) (3.70 г, 8.0 ммоль). Выход 1.47 г, 46%. 1Н ЯМР (600 МГц, ДМСО-d6): δ 11.80 (уш. с, 1Н, Н3), 7.53 (с, 1Н, Н6), 5.75 (д, 1Н, J=4.8 Гц, H1'), 5.41 (уш. с, 1Н, 3'-ОН), 5.07 (уш. с, 1Н, 2'-ОН), 4.00-3.96 (м, 1Н, Н4'), 3.94-3.91 (м, 1Н, Н3'), 3.91-3.88 (м, 1Н, Н2'), 3.84 (дд, J=11.7, 2.6 Гц, 1Н, Н5'а), 3.73 (дд, J=11.7, 2.4 Гц, 1Н, Н5'b), 0.91 (с, 9Н, С(СН3)3), 0.12 (с, 3Н, SiCH3), 0.11 (с, 3Н, SiCH3). 13С ЯМР (151 МГц, ДМСО-d6): δ 159.81 (С4), 149.20 (С2), 127.64 (С6), 113.43 (С5), 88.04 (С1'), 84.29 (С4'), 73.76 (С2'), 69.52 (С3'), 62.58 (С5'), 25.81 (3С, С(СН3)3), 18.08 (С(СН3)3), -5.51, -5.58 (2С, SiCH3). HRMS (ESI) m/z: рассчитано для C15H24N5O6Si- [М-Н]-: 398.1501; найдено 398.1483.
Пример 5. Общая методика получения триазолов.
Азид (1 экв.), алкин (1.1 экв.), CuI (0.05 экв.) и трис(бензилтриазолил)амин (ТВТА) (0.05 экв.) добавляют в сухой тетрагидрофуран (5 мл), смесь перемешивают при 50°С в атмосфере аргона. Полученную смесь упаривают на вакууме, сухой остаток очищают колоночной хроматографией на силикагеле, используя СН2Сl2/ЕtOАс (20%→100%) градиент. Собранные фракции, содержащие продукт, упаривают на вакууме.
Пример 6. 5'-O-трет-бутилдиметилсилил-5-[4-(перилен-3-ил)-1,2,3-триазол-1-ил]-2'-дезоксиуридин (14а).
Вещество получено по описанному выше (пример 5) методу из 5'-O-трет-бутилдиметилсилил-5-азидо-2'-дезоксиуридина (13а) (119 мг, 0.31 ммоль). Выход 103 мг (50%). 1Н ЯМР (500 МГц, ДМСО-d6): δ 12.16 (уш с, 1Н, Н3), 8.81 (с, 1Н, Н6), 8.49-8.36 (м, 6Н, H1, 4, 6, 7, 12 - перилен, Н5 - триазол), 7.85-7.80 (м, 2Н), 7.79-7.75 (м, 1H) (Н2, 9, 10 - перилен), 7.63-7.55 (м, 3Н, Н5, 8, 11 - перилен), 6.23 (т, J=6.7 Гц, 1H, H1'), 5.34 (д, 1Н, J=4.3 Гц, 3'-ОН), 4.25-1.20 (м, 1H, Н3'), 3.95-3.91 (м, 1Н, Н4'), 3.86-3.81 (м, 1H, Н5'а), 3.77-3.72 (м, 1H, Н5'b), 2.31-2.26 (м, 1Н, Н2'а), 2.20-2.15 (м, 1Н, Н2'b), 0.72 (с, 9Н, С(СН3)3), -0.04 (с, 3Н, SiCH3), -0.08 (с, 3Н, SiCH3). 13С ЯМР (126 МГц, ДМСО-d6): δ 158.60 (С4), 149.21 (С2), 145.61 (С4 - триазол), 136.63 (С6), 134.16, 131.58, 130.88, 130.81, 130.40, 130.10, 129.35, 128.65, 128.39, 128.02, 127.84, 127.65, 127.24, 127.05, 126.94, 126.91, 126.05, 125.55, 121.48, 121.03, 120.48 (перилен, С5 - триазол), 113.23 (С5), 87.40, 85.37, 70.25, 63.00 (С1, С4', С3', С5'), 40.50 (С2'), 25.62 (3С, С(СН3)3), 17.85 (С(СН3)3), -5.70, -5.86 (2С, SiCH3). HRMS (ESI) m/z: рассчитано для C37H36N5O5Si- [М-Н]- 658.2491; найдено 658.2477.
Пример 7. 5'-О-трет-бутилдиметилсилил-5-[4-(перилен-3-ил)-1,2,3-триазол-1-ил]-уридин (14б).
Вещество получено по описанному выше (пример 5) методу из 5'-О-трет-бутилдиметилсилил-5-азидо-уридина (13б) (190 мг, 0.48 ммоль). Выход 187 мг (58%). 1Н ЯМР (500 МГц, ДМСО-d6): δ 12.20 (уш. с, 1Н, Н3), 8.81 (с, 1Н, Н6), 8.44-8.37 (м, 6Н, H1, 4, 6, 7, 12 - перилен, Н5 - триазол), 7.83-7.72 (м, 3Н, Н2, 9, 10 - перилен), 7.60-7.51 (м, 3Н, Н5, 8, 11 - перилен), 5.90 (д, 1H, J=3.3 Гц, H1'), 5.61 (д, 1Н, J=4.1 Гц, 2'-ОН), 5.22-5.17 (м, 1H, 3'-ОН), 4.17-4.10 (м, 1Н, Н2'), 4.03-3.95 (м, 2Н, Н3', Н4'), 3.89-3.83 (м, 1H, Н5'а) 3.78-3.71 (м, 1Н, Н5'b), 0.71 (с, 9Н, С(СН3)3), -0.06 (с, 3Н, SiCH3), -0.09 (с, 3Н, SiCH3). 13С ЯМР (151 МГц, ДМСО-d6): δ 158.69 (С4), 149.57 (С2), 145.73 (С4 - триазол), 136.85 (С6), 134.18, 131.58, 130.91, 130.83, 130.42, 130.11, 128.85, 128.41, 128.15, 128.05, 127.86, 127.66, 127.25, 126.96, 126.93, 126.33, 125.35, 121.05 (3С), 120.51 (перилен, С5 - триазол), 113.45 (С5), 88.44 (С1'), 84.62 (С4'), 74.23 (С2'), 69.62 (С3'), 62.61 (С5'), 25.69 (3С, С(СН3)3), 17.98 (С(СН3)3), -5.69, -5.87 (2С, SiCH3). HRMS (ESI) m/z: рассчитано для C37H36N5O6Si- [М-Н]- 674.2440; найдено 674.2419.
Пример 8. 5'-O-трет-бутилдиметилсилил-5-[4-(перилен-2-ил)-1,2,3-триазол-1-ил]-2'-дезоксиуридин (15а).
Вещество получено по описанному выше (пример 5) методу из 5'-О-трет-бутилдиметилсилил-5-азидо-2'-дезоксиуридина (13а) (99 мг, 0.25 ммоль). Выход 131 мг (69%). 1Н ЯМР (500 МГц, ДМСО-d6): δ 12.18 (уш. с, 1H, Н3), 9.15 (с, 1H, Н5 - триазол), 8.79 (с, 1Н, H1 - перилен), 8.55-8.53 (м, 1Н), 8.39-8.28 (м, 4Н) (Н6, Н3, 6, 7, 12 - перилен), 7.88-7.76 (м, 3Н, Н4, 9, 10 - перилен), 7.57-7.50 (м, 3Н, Н5, 8, 11), 6.23 (т, J=6.4 Гц, 1Н, Н1'), 5.34 (д, 1Н, J=4.3 Гц, 3'-ОН), 4.24-1.20 (м, 1H, Н3'), 3.95-3.91 (м, 1Н, Н4'), 3.81 (дд, 1Н, J=11.6, 3.5 Гц, Н5'а) 3.72 (дд, 1Н, J=11.6, 3.4 Гц, Н5'b), 2.32-2.28 (м, 1Н, Н2'а), 2.21-2.17 (м, 1Н, Н2'b), 0.68 (с, 9Н, С(СН3)3), -0.06 (с, 3Н, SiCH3), -0.11 (с, 3Н, SiCH3). 13С ЯМР (126 МГц, ДМСО-d6): 158.61 (С4), 149.22 (С2), 146.31 (С4 - триазол), 136.60 (С6), 134.65, 134.27, 131.43, 130.49, 130.19, 130.13, 128.56, 128.33, 128.19, 128.08, 127.91, 127.57, 127.44, 126.83, 126.77, 124.12, 123.50, 121.21, 120.84, 120.74, 117.99 (перилен, С5 - триазол), 113.19 (С5), 87.46, 85.52, 70.33, 63.05 (С1', С4', С3', С5'), 40.45 (С2'), 25.60 (3С, С(СН3)3), 17.85 (С(СН3)3), -5.70, -5.84 (2С, SiCH3). HRMS (ESI) m/z: рассчитано для С37Н36N5O5Si- [М-Н]- 658.2491; найдено 658.2476.
Пример 9. 5'-O-трет-бутилдиметилсилил-5-[4-(перилен-2-ил)-1,2,3-триазол-1-ил]-уридин (15б).
Вещество получено по описанному выше (пример 5) методу из 5'-О-трет-бутилдиметилсилил-5-азидо-уридина (13б) (104 мг, 0.26 ммоль). Выход 156 мг (88%). 1Н ЯМР (500 МГц, ДМСО-d6): δ 12.22 (уш. с, 1Н, Н3), 9.15 (с, 1Н, Н5 - триазол), 8.78 (с, 1Н, H1 - перилен), 8.51 (д, 1Н, J=7.3 Гц), 8.38-8.35 (м, 2Н), 8.37-8.35 (м, 2Н), 8.31-8.26 (м, 2Н) (Н6, Н3, 6, 7, 12 - перилен), 7.86-7.75 (м, 3Н, Н4, 9, 10 - перилен), 7.56-7.48 (м, 3Н, Н5, 8, 11 - перилен), 5.90 (д, 1Н, J=4.9 Гц, H1'), 5.60 (т, 1Н, J=5.5 Гц, 2'-ОН), 5.17 (д, 1H, J=4.9 Гц, 3'-ОН), 4.18-4.13 (м, 1Н, Н2'), 4.00-4.96 (м, 2Н, Н3', Н4'), 3.87-3.83 (м, 1Н, Н5'а) 3.75-3.70 (м, 1Н, Н5'b), 0.68 (с, 9Н, С(СН3)3), -0.08 (с, 3Н, SiCH3), -0.12 (с, 3Н, SiCH3). 13С ЯМР (126 МГц, ДМСО-d6): 158.66 (С4), 149.56 (С2), 146.40 (С4 - триазол), 136.83 (С6), 134.66, 134.28, 131.44, 130.50, 130.19, 130.13, 128.55, 128.34, 128.19, 128.09, 127.92, 127.58, 127.44, 126.83, 126.76, 124.33, 123.52, 121.19, 120.84, 120.74, 117.99 (перилен, С5 - триазол), 113.43 (С5), 88.58 (С1'), 84.62 (С4'), 74.08 (С2'), 69.63 (С3'), 62.67 (С5'), 25.65 (3С, С(СН3)3), 17.94 (С(СН3)3), -5.71, -5.86 (2С, SiCH3). HRMS (ESI) m/z: рассчитано для C37H36N5O6Si- [М-Н]-: 674.2440; найдено 674.2419.
Пример 10. Общая методика десилилирования.
К раствору нуклеозидов 14-15 (1 экв.) в безводном ДМСО (10 мл/ммоль) добавляют TBAF (1 экв.). Смесь перемешивают ночь, затем разбавляют водой (50 мл/ммоль). Выпавший продукт фильтруют, промывают водой (50 мл/ммоль), и диэтиловым эфиром (10 мл/ммоль), высушивают в вакууме, и повторно промывают диэтиловым эфиром (50 мл/ммоль), затем гексаном (50 мл/ммоль). Полученный порошок сушат в вакууме.
Пример 11. 5-[4-(Перилен-3-ил)-1,2,3-триазол-1-ил]-2'-дезоксиуридин (1а).
Вещество получено по описанному выше (пример 10) методу из 5'-О-трет-бутилдиметилсилил-5-[4-(перилен-3-ил)-1,2,3-триазол-1-ил]-2'-дексиуридина (14а) (62 мг, 0.09 ммоль). Выход 40 мг (78%). 1Н ЯМР (500 МГц, ДМСО-d6): δ 12.07 (уш. с, 1Н, Н3), 8.81 (с, 1Н, Н6), 8.77 (с, 1Н, Н5 - триазол), 8.43-8.35 (м, 5Н, H1, 4, 6, 7, 12 - перилен), 7.83-7.78 (м, 3Н, Н2, 9, 10 - перилен), 7.59-7.54 (м, 1H), 7.53-7.47 (м, 2Н) (Н5, 8, 11 - перилен), 6.20 (т, 1Н, J=6.6 Гц, H1'), 5.35-5.30 (м, 1Н, 3'-ОН), 5.14-5.06 (м, 1Н, 5'-ОН), 4.30-4.24 (м, 1Н, Н3'), 3.86-3.80 (м, 1H, Н4'), 3.64-3.51 (м, 2Н, Н5'), 2.26-2.19 (м, 2Н, Н2'). 13С ЯМР (151 МГц, ДМСО-d6): δ 158.65 (С4), 149.38 (С2), 145.41 (С4 - триазол), 137.36 (С6), 134.20, 131.55, 130.85, 130.83, 130.47, 130.16, 128.43, 128.21, 128.05, 127.87, 127.68, 127.42, 127.05, 126.99, 126.96, 125.94, 125.42, 121.09, 121.06 (2С), 120.53 (перилен, С5 - триазол), 113.19 (С5), 87.81, 85.22, 70.02, 60.85 (С1', С4', С3', С5'), 40.41 (С2'). HRMS (ESI) m/z: рассчитано для C31H22N5O5- [М-Н]-: 544.1626; найдено 544.1611.
Пример 12. 5-[4-(Перилен-3-ил)-1,2,3-триазол-1-ил]-уридин (1б).
Вещество получено по описанному выше (пример 10) методу из 5'-О-трет-бутилдиметилсилил-5-[4-(перилен-3-ил)-1,2,3-триазол-1-ил]-уридина (14б) (100 мг, 0.15 ммоль). Выход 70 мг (84%). 1Н ЯМР (400 МГц, ДМСО-d6): δ 12.16 (уш. с, 1H, Н3), 8.86 (с, 1Н, Н6), 8.82 (с, 1H, Н5 - триазол), 8.47-8.39 (м, 5Н, H1, 4, 6, 7, 12 - перилен), 7.84-7.80 (м, 3Н, Н2, 9, 10 - перилен), 7.63 (т, 1Н, J=8.0 Гц), 7.57 (т, 2Н, J=7.7 Гц) (Н5, 8, 11 - перилен), 5.87 (д, 1Н, J=4.5 Гц, H1'), 5.52 (д, 1Н, J=5.7 Гц, 2'-ОН), 5.21 (т, 1Н, J=4.8 Гц, 5'-ОН), 5.16 (д, 1Н, J=5.1 Гц, 3'-ОН), 4.20-4.16 (м, 1Н, Н2'), 4.08-1.04 (м, 1Н, Н3'), 3.94-3.91 (м, 1Н, Н4'), 3.71-3.66 (м, 1H, Н5'а), 3.60-3.55 (м, 1H, Н5'b). 13С ЯМР (101 МГц, ДМСО-d6): δ 158.61 (С4), 149.58 (С2), 145.35 (С4 - триазол), 137.55 (С6), 134.21, 131.56, 130.86, 130.83, 130.48, 130.16, 128.44, 128.23, 128.06, 127.88, 127.69, 127.45, 127.06, 127.01, 126.98, 126.02, 125.44, 121.11, 121.08 (2С), 120.56 (перилен, С5 - триазол), 113.24 (С5), 104.85, 88.76 (С1'), 84.91 (С4'), 74.06 (С2'), 69.33 (С3'), 60.20 (С5'). HRMS (ESI) m/z: рассчитано для С31H22N5О6- [М-Н]-: 560.1576; найдено 560.1561.
Пример 13. 5-[4-(Перилен-2-ил)-1,2,3-триазол-1-ил]-2'-дезоксиуридин (2а).
Вещество получено по описанному выше (пример 10) методу из 5'-O-трет-бутилдиметилсилил-5-[4-(перилен-2-ил)-1,2,3-триазол-1-ил]-2'-дезоксиуридина (15а) (95 мг, 0.14 ммоль). Выход 47 мг (60%). 1Н ЯМР (500 МГц, ДМСО-d6): δ 12.15 (уш. с, 1H, Н3), 9.14 (с, 1H, Н5 - триазол), 8.80 (с, 1Н, H1 - перилен), 8.77 (с, 1Н, Н6), 8.53 (д, 1Н, J=7.4 Гц), 8.40-8.26 (м, 3Н) (Н3, 6, 7, 12 - перилен), 7.89-7.75 (м, 3Н, Н4, 9, 10 - перилен), 7.60-7.48 (м, 3Н, Н5, 8, 11 - перилен), 6.24 (т, 1Н, J=6.0 Гц, НГ), 5.35-5.28 (м, 1Н, 3'-ОН), 5.15-5.08 (м, 1Н, 5'-ОН), 4.33-4.27 (м, 1H, Н3'), 3.89-3.83 (м, 1Н, Н4'), 3.68-3.54 (м, 2Н, Н5'), 2.31-2.22 (м, 2Н, Н2'). 13С ЯМР (126 МГц, ДМСО-d6): δ 158.63 (С4), 149.36 (С2), 146.12 (С4 - триазол), 137.38 (С6), 134.67, 134.29, 131.45, 130.51, 130.21, 130.16, 128.56, 128.35, 128.22, 128.12, 127.93, 127.58, 127.46, 126.85, 126.82, 124.05, 123.52, 121.27, 120.88, 120.77, 117.99 (перилен, С5 - триазол), 113.16 (С5), 87.77, 85.26, 70.01, 60.84, 40.34 (С2'). HRMS (ESI) m/z: рассчитано для C31H22N5O5- [М-Н]-: 544.1626; найдено 544.1614.
Пример 14. 5-[4-(Перилен-2-ил)-1,2,3-триазол-1-ил]-уридин (2б).
Вещество получено по описанному выше (пример 10) методу из 5'-О-трет-бутилдиметилсилил-5-[4-(перилен-2-ил)-1,2,3-триазол-1-ил]-уридина (15б) (148 мг, 0.22 ммоль). Выход 80 мг (65%). 1Н ЯМР (400 МГц, ДМСО-d6): δ 12.20 (уш. с, 1H, Н3), 9.14 (с, 1Н, Н5 - триазол), 8.84 (с, 1H, H1 - перилен), 8.80 (с, 1H, Н6), 8.53 (д, 1H, J=7.4 Гц), 8.37-8.30 (м, 3Н) (Н3, 6, 7, 12 - перилен), 7.86-7.78 (м, 3Н, Н4, 9, 10 - перилен), 7.60-7.53 (м, 3Н, Н5, 8, 11 - перилен), 5.87 (д, 1Н, J = 3.8 Гц, НГ), 5.50 (уш. с, 1Н, 2'-ОН), 5.11 (уш. с, 1Н, 3'-ОН), 4.20-4.14 (м, 1Н, Н2'), 4.07-1.01 (м, 1Н, Н3'), 3.95-3.89 (м, 1Н, Н4'), 3.72-3.65 (м, 1H, Н5'а), 3.63-3.53 (м, 1H, Н5'b). 13С ЯМР (101 МГц, ДМСО-d6): 8 159.03 (С4), 149.95 (С2), 146.09 (С4 - триазол), 137.44 (С6), 134.68, 134.30, 131.45, 130.52, 130.22, 130.16, 128.59, 128.36, 128.23, 128.13, 127.94, 127.58, 127.47, 126.88, 126.84, 124.09, 123.52, 121.28, 120.89, 120.78, 117.99 (перилен, С5 - триазол), 113.27 (С5), 88.83 (С1'), 84.82 (С4'), 74.16 (С2'), 69.35 (С3'), 60.20 (С5'). HRMS (ESI) m/z: рассчитано для C31H22N5O6- [М-Н]-: 560.1576; найдено 560.1559.
Пример 15. Общая методика получения триазолов (3-4).
К раствору соответствующего этинилперилена (91 мг, 0.25 ммоль) в ДМСО (2.5 мл) добавляют 2-азидоэтанол (44 мг, 0.5 ммоль), CuI (2.5 мг, 0.013 ммоль) и ТВТА (6.9 мг, 0.013 ммоль). Смесь перемешивают в атмосфере аргона ночь при комнатной температуре. Затем раствор разбавляют водой (12 мл), образовавшийся осадок фильтруют, сушат в токе водоструйного насоса, затем промывают диэтиловым эфиром (2×10 мл) и CH2Cl2 (2×10 мл) и сушат в вакууме.
Пример 16. 2-[4-(Перилен-3-ил)-1Н-1,2,3-триазол-1-ил]этанол (3).
Вещество получено по описанному выше (пример 15) методу. Выход 74 мг (81%). 1Н ЯМР (500 МГц, ДМСО-d6): δ 8.57 (с, 1Н, Н5 - триазол), 8.46-8.43 (м, 5Н, H1, 4, 6, 7, 12 - перилен), 7.82-7.77 (м, 3Н, Н2, 9, 10 - перилен), 7.62-7.53 (м, 3Н, Н5, 8, 11 - перилен), 5.11 (т, 1Н, J=5.5 Гц, ОН), 4.53 (т, 2Н, J=5.5 Гц, CH2N), 3.91 (q, 2Н, J=5.5 Гц, СН2O). 13С ЯМР (125.8 МГц, ДМСО-d6): δ 145.23 (С4 - триазол), 134.18, 131.54, 130.70, 130.50, 130.44, 130.21, 128.39, 128.03, 127.93, 127.86, 127.66, 127.54, 127.20, 126.93, 126.90, 125.65, 124.53, 120.97, 120.92, 120.86, 120.49 (перилен, С5 - триазол), 59.80, 52.40 (СН2СН2). HRMS (ESI) m/z: рассчитано для C24H16N3O- [М-Н]-: 362.1299; найдено 362.1345.
Пример 17. 2-[4-(Перилен-2-ил)-1Н-1,2,3-триазол-1-ил]этанол (4).
Вещество получено по описанному выше (пример 15) методу. Выход 78 мг (86%). 1Н ЯМР (600 МГц, ДМСО-d6): δ 8.86 (с, 1Н, Н5 - триазол), 8.77 (с, 1Н, H1 - перилен), 8.54-8.51 (м, 1H), 8.38-8.30 (м, 3Н) (Н3, 6, 7, 12 - перилен), 7.87-7.79 (м, 3Н, Н4, 9, 10 - перилен), 7.61-7.53 (м, 3Н, Н5, 8, 11 - перилен), 5.13 (т, 1H, J=5.5 Гц, ОН), 4.51 (т, 2Н, J=5.5 Гц, CH2N), 3.89 (q, 2Н, J=5.5 Гц, СН2O). 13С ЯМР (151 МГц, ДМСО-d6): δ 145.83 (С4 - триазол), 134.67, 134.29, 131.24, 130.45, 130.23, 130.18, 129.21, 128.26, 128.12, 128.07, 127.91, 127.39 (2С), 126.86, 126.81, 123.24, 122.61, 121.08, 120.83, 120.60, 117.98 (перилен, С5 - триазол), 59.82, 52.56 (СН2СН2). HRMS (ESI) m/z: рассчитано для C24H16N3O- [М-Н]-: 362.1299; найдено 362.1353.
Микробиологические исследования заявляемых соединений (1а, б, 2а, б, 3, 4).
Пример 18. Анализ клеточной цитотоксичности.
В работе использовали клеточную линию почек эмбриона свиньи (PEK), которую поддерживали в среде 199 (ФГУП IPVE, Россия) 37°С с 5% фетальной бычьей сывороткой (Gibco); вирус клещевого энцефалита штамм Абсеттаров (код доступа в GenBank AF091005) из лабораторного собрания Института полиомиелита и вирусных энцефалитов им. М.П. Чумакова.
Клетки PEK были засеивают и инкубируют в течении 72 ч при 37°С. Стоковые растворы соединений концентрацией 5 ммоль были готовят в ДМСО (Sigma). Двукратные разведения изучаемых соединений со стартовой концентрацией 50 мкМ готовят в среде 199 (на растворе Эрла) в 96-луночной панели. Одинаковые объемы полученных растворов добавляют к монослою клеток в 8 повторах. Для контрольного теста к монослою добавляют объем раствора ДМСО, равный объему добавленных растворов образцов. Инкубируют панели в СO2-инкубаторе при 37°С 24 часа для определения острой цитотоксичности и 7 дней для определения хронической цитотоксичности. Значения СС50 были рассчитывают по методу Кербера [Hamilton М.A., Russo R.С., Thurston R.V. Trimmed Spearman-Karber method for estimating median lethal concentrations in toxicity bioassays // Environmental Science & Technology. - 1977. - T. 11. - №. 7. - C. 714-719.]. (Результаты представлены в Таблице)
Пример 19. Анализ противовирусной активности.
Клетки РЕК были засеивают и инкубируют в течении 72 ч при 37°С. Стоковые растворы соединений концентрацией 5 ммоль были готовят в ДМСО (Sigma). Для определения значений полуингибиторной концентрации ЕС50 из стоковых растворах готовят растворы с концентрациями 100 или 10 мкмоль. Четырехкратные разведения изучаемых соединений со стартовой концентрацией 2 или 0,2 мкМ делают в среде 199 (на растворе Эрла) в 96 луночной панели. В лунки с веществами вносят равный по объему раствор вируса (40-80 БОЕ/120 мкл) в среде 199 (на растворе Эрла). Приготовленные растворы веществ с вирусом вносят в 24-х луночную панель (4 ряда лунок на одно соединение). Инкубируют 1 час при 37°С в СO2-инкубаторе, после чего добавляют покрытие - 1 мл 1,26% метилцеллюлозы, содержащей 2% FBS. Пластины инкубируют 6 дней при 37°С в СO2-инкубаторе. На 6 день клетки фиксируют спиртом и красились 0,4% раствором генцианвиолета. Значения EC50_BKЭ определяют по методу Рида-Менча. Значения ЕС50 были посчитаны в соответствии с методом Reed и Muench [Reed L.J., Muench, Н. A simple method of estimating fifty percent endpoints. // American journal of epidemiology. - 1938. - T. 27. - №. 3. - C. 493-497.]. (Результаты представлены в Таблице).
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ совместного получения 1-(2-амино-4-R-фенил)- и 2-(2-амино-4-R-фенил)бензотриазолов | 2023 |
|
RU2825731C1 |
| Адамантилсодержащие производные 1,2,4-триазола и 1,3,4-тиадиазола, имеющие монотерпеноидные фрагменты, используемые в качестве ингибиторов фермента тирозил-ДНК-фосфодиэстеразы 1 | 2020 |
|
RU2761880C1 |
| МОНОЦИКЛИЧЕСКИЕ L-НУКЛЕОЗИДЫ, ИХ АНАЛОГИ И ПРИМЕНЕНИЯ | 1997 |
|
RU2188828C2 |
| Способ получения пуриновых нуклеозидов ряда β-D-арабинофуранозы | 2015 |
|
RU2624023C2 |
| Способ получения N-замещенных 5-бензоил-2-имино-4-тиазолинов | 2024 |
|
RU2823709C1 |
| ЛИГАНДЫ, ТРОПНЫЕ К ПРОСТАТИЧЕСКОМУ СПЕЦИФИЧЕСКОМУ МЕМБРАННОМУ АНТИГЕНУ И ИХ ПРИМЕНЕНИЕ ДЛЯ ПОЛУЧЕНИЯ ДВОЙНЫХ КОНЪЮГАТОВ С ТЕРАПЕВТИЧЕСКИМИ АГЕНТАМИ НА ИХ ОСНОВЕ ДЛЯ КОМБИНИРОВАННОЙ ТЕРАПИИ ПСМА ЭКСПРЕССИРУЮЩИХ ОПУХОЛЕЙ | 2023 |
|
RU2841078C1 |
| (E)-2-(4-{[3-(2,4-ДИМЕТОКСИФЕНИЛ)АКРИЛАМИДО]МЕТИЛ}-1H-1,2,3-ТРИАЗОЛ-1-ИЛ)-2-ИЗОПРОПИЛ-9-(4-МЕТИЛПИПЕРАЗИН-1-ИЛ)-3,7-ДИОКСО-3,7-ДИГИДРО-2H-ФУРО[3,2-g]ХРОМЕН, ОБЛАДАЮЩИЙ АНАЛЬГЕТИЧЕСКОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2549574C1 |
| Производное 1'-бромо-2',3',4'-триметоксибензо[5',6':4,5]-(aR, 1S)-1-ацетамидо-6,7-дигидроциклогепта-[3,4-f]-1Н-индола и его применение | 2016 |
|
RU2630303C1 |
| ГИДРОКСАМОВЫЕ КИСЛОТЫ, СОДЕРЖАЩИЕ ЯДРА 1,2,4- И 1,3,4-ОКСАДИАЗОЛА В КАЧЕСТВЕ ПОТЕНЦИАТОРОВ ДЕЙСТВИЯ АНТИБИОТИКОВ | 2023 |
|
RU2830361C1 |
| МЕТАЛЛООРГАНИЧЕСКОЕ СОЕДИНЕНИЕ, ПРИГОДНОЕ В КАЧЕСТВЕ СОКАТАЛИЗАТОРА ДЛЯ ПОЛИМЕРИЗАЦИИ ОЛЕФИНОВ | 2001 |
|
RU2248980C2 |
Изобретение относится к периленилтриазолам общей формулы
в которой
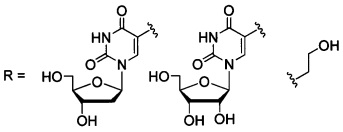
в качестве ингибиторов репродукции вируса клещевого энцефалита. Технический результат: получены новые периленилтриазолы, ингибирующие репродукцию вируса клещевого энцефалита. 1 табл., 6 ил., 19 пр.
Периленилтриазолы общей формулы:

где
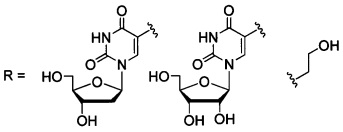
- ингибиторы репродукции вируса клещевого энцефалита.
| Сапожникова К | |||
| А | |||
| и др | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Che C | |||
| Colpitts et al | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| A | |||
| A | |||
| Orlov et al | |||
| "Rigid amphipathic nucleosides suppress reproduction of the tick-borne encephalitis virus" Medicinal Chemistry Communication, vol.7, N3, 2016, 495-499 | |||
| T | |||
| Ogoshi et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2018-04-18—Публикация
2017-11-30—Подача