Изобретение относится к способу синтеза азотсодержащих гетероциклических соединений, в частности к получению замещенных пиридо[1,2-а]бензимидазолов общей формулы
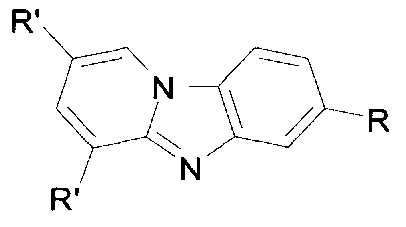
где а) R=CF3, R′=H; б) R=CN, R′=H; в) R=СООН, R′=H; г) R=СООСН3, R′=H; д) R=СООС2Н5, R′=H; е) R=COOPh, R′=H; ж) R=CF3, R′=CH3; з) R=CN, R′=CH3, которые могут быть использованы в качестве полупродуктов для синтеза биологически активных веществ, проявляющих антиоксидантную активность [Н.G. Kathrotiya, Μ.P. Patel // J. Chem. Sci, 125, 5, 993-1001 (2013), в качестве лекарственных средств против малярии [A.J. Ndakala, R.K. Gessner, P.W. Gitari, N. October, K.L. White, A. Hudson, F. Fakorede, D.M. Shackleford, M. Kaiser, C. Yeates, S.A. Charman, K. Chibale // J Med Chem, 54, 4581-4589 (2011)], антибактериальных препаратов [B.S. Chetan, H.J. Hardik, P.P. Manish, G.P. Ranjan // Med Chem Res, 22, 3035-3047 (2013)], противогрибковых средств [Η. Takeshita, J. Watanabe, Y. Kimura, K. Kawakami, H. Takahashi, M. Takemura, A. Kitamura, K. Someya, R. Nakajima // Bioorg. Med. Chem. Lett, 20, 3893-3896 (2010)] ингибиторов перфоринов [D.M. Lyons, K.M. Huttunen, K.A. Browne, et al // Bioorg. Med. Chem., 19, 4091-4100 (2011)]. Помимо этого пиридо[1,2-α]бензимидазолы обладают флуоресцентными свойствами [X. Chen, Η. Yang, Υ. Ge, L. Feng, J. Jia, J. Wang // Luminescence, 27, 382-389 (2012)], что находит применение в области оптоэлектроники, например в нелинейной оптике.
Наиболее близким по содержанию является способ получения замещенных пиридо[1,2-а]бензимидазолов, основанный на восстановлении хлоридов N-(2-нитро-4-R-фенил)пиридиния в диафрагменной ячейке в гальваностатическом режиме на свинцовом катоде, при силе тока 0.6 А. Анолитом служит 15%-ный раствор серной кислоты, анодом - платина. Субстрат растворяют в смеси спирта и 4%-ной соляной кислоты, взятых в соотношении 1:1. Электролиз ведут при перемешивании при температуре 40-45°C, пропуская через электролитическую ячейку заряд в 4 Φ в течение 0,5 ч. Выход целевых продуктов 88-96% (Пат. №2522549 РФ (2014)).
Недостатками известного способа синтеза замещенных пиридо[1,2-а]бензимидазолов являются использования диафрагмы для разделения катодного и анодного пространств при электролизе, что приводит к увеличению сопротивления переноса заряда и как следствие увеличению рабочего напряжения на электроде и росту потребляемой электроэнергии, а так же снижению скорости конверсии субстрата и выходов целевых продуктов. К тому же применение диафрагмы, которая изготавливается из механически прочного химически инертного электрического изолятора, обладающего при этом малым сопротивлением, значительно усложняет конструкцию и стоимость электролизера.
Цель изобретения - создание бездиафрагменного электрохимического способа получения замещенных пиридо[1,2-а]бензимидазолов, позволяющего снизить стоимость синтеза и увеличить выход целевых продуктов.
Поставленная цель достигается тем, что для электровосстановления хлоридов 1-(2-нитро-4-R-фенил)-3,5-R′-пиридиния используется электролизер без диафрагмы. Это позволяет уменьшить силу тока с 0,6 А до 0,4 А при тех же температуре и времени процесса, как в приведенном выше способе. В результате также отпадает необходимость применения серной кислоты, выступающей в качестве анолита в ходе диафрагменного электросинтеза, что способствует увеличению срока службы оборудования, ввиду отсутствия коррозии, и уменьшению количества вредных отходов. Причем восстановление проводят в гальваностатическом режиме на свинцовом катоде при силе тока 0.4 А, используя анод из платины. Субстрат растворяют в смеси спирта и 4%-ной соляной кислоты, взятых в соотношении 1:1. Электролиз ведут при перемешивании при температуре 40°С, пропуская через электролитическую ячейку заряд в 4 Ф в течение 0,5 ч. Целевые продукты выделяются фильтрованием выпавшего осадка после обработки реакционной смеси гидроксидом аммония.
Реализация предложенного метода синтеза замещенных пиридо[1,2-а]бензимидазолов позволяет уменьшить силу тока с 0,6 А до 0,4 А, упростить конструкцию электролизера и получать целевые продукты с выходом 91-98%.
Строение и чистоту промежуточных соединений и целевых продуктов пиридо[1,2-а]бензимидазолов анализировали методом ЯМР 1Н-спектроскопии и масс-спектрометрии, масс-спектрометрии высокого разрешения, определением температуры плавления и элементного состава.
Изобретение иллюстрируется следующими примерами.
Пример 1. 7-(Трифторметил)пиридо[1,2-а]бензимидазол (а). Электрохимический синтез проводили в бездиафрагменной ячейке в гальваностатическом режиме на свинцовом катоде площадью 85 см2, ток 0.4 А, плотность тока 4.71 мА/см2. Анод - платина. 1 г (3.34 ммоль) хлорида 1-(2-нитро-4-(трифторметил)фенил)пиридиния растворяли в 20 мл спирта и добавляли 20 мл 4% соляной кислоты. Электролиз вели при перемешивании при температуре 40°C. Пропустив через электролитическую ячейку заряд в 4 Φ в течение 0,5 ч, электролиз останавливали, электролит подщелачивали 25%-ным раствором аммиака до pH=7-8 и отфильтровывали выпавший осадок, получая 0.74 г (96% от теории) 7-(трифторметил)пиридо[1,2-а]бензимидазола. Т. пл. 233-235°C.
Спектр ЯМР 1H (ДМСО-d6) δ, мд: 7.09 т (1Н, Н2, J 7.0 Гц), 7.66 т (1Н, Н3, J 8.0 Гц), 7.68 д (1Н, Н9, J 8.0 Гц), 7.75 д (1Н, Н4, J 9.0 Гц), 8.16 д (1Н, H6, J 1.5 Гц), 8.53 дд (1H, Н8, J 2 Гц, J 8 Гц), 9.15 д (1Н, Н1, J 7.5 Гц).
MS, m/z: 236 (100) [М]+, 217 (20), 186 (12), 167 (4), 118 (5), 69 (5), 63 (11), 51 (17), 39 (20).
Найдено, %: С 60.79; Η 2.96; N 12.01.
Вычислено, %: С 61.02; Η 2.97; Ν 11.86. C12H7N2
Примеры 2-8. Другие замещенные пиридо[1,2-а]бензимидазолы получают аналогично примеру 1.
Пиридо[1,2-а]бензимидазол-7-карбонитрил (б). Выход 0.69 г (94%). Т. пл. 242-244°С.
Спектр ЯМР 1H (ДМСО-d6) δ, мд: 7.10 т (1Н, Н2, J 6.5 Гц), 7.67 т (1Н, Н3, J 7 Гц), 7.74 д (1Н, Н4, J 9.5 Гц), 7.75 д (1H, Н9, J 8.5 Гц), 8.35 д (1Н, Н6, J 1.5 Гц), 8.51 дд (1H, Н8, J 2.0 Гц, J 8.5 Гц), 9.15 д (1H, Н1, J 6.5 Гц).
MS, m/z: 193 (100) [М]+, 167 (6), 165 (4), 154 (4), 139 (9), 97 (9), 78 (8), 63 (7), 51 (12), 39 (15).
Найдено, %: С 74.64; Η 3.60; N 21.87.
Вычислено, %: С 74.61; Η 3.63; N 21.76. C12H7N3.
Пиридо[1,2-а]бензимидазол-7-карбоновая кислота (в). Выход 0.69 г (91%). Т. пл. >300°C.
Спектр ЯМР 1H (ДМСО-d6) δ, мд: 7.05 м (1H, Н2), 7.60 т (1Н, Н3, J 8.5 Гц), 7.70 д (1Н, Н4, J 9.0 Гц), 7.95 дд (1Н, Н8, J 2.0 Гц, J 8.0 Гц), 8.35 д (1Н, Н9, J 8.0 Гц), 8.40 д (1Н, Н6 J 1.0 Гц), 9.10 д (1H, H1, J 7.5), 12.85 с (1Н, СООН).
MS, m/z: 212 (100) [М]+, 167 (38), 140 (15), 78 (10), 51 (6).
Найдено, %: С 68.21; Η 3.72; N 13.24.
Вычислено, %: С 67.92; Η 3.77; N 13.21. C12H8N2.
Метил пиридо[1,2-а]бензимидазол-7-карбоксилат (г). Выход 0.71 г (92%). Т. пл. 226-228°С.
Спектр ЯМР 1H (ДМСО-d6) δ, мд: 3.9 с (3Н, СН3), 7.03 т (1Н, Н2, J 7.5 Гц), 7.55 т (1Н, Н3, J 8.5 Гц), 7.68 д (1Н, Н4, J 8.0 Гц), 7.94 дд (1Н, Н8, J 1.5, J 7.5 Гц), 8.37 д (1H, Н9, J 8.0 Гц), 8.39 (1Н, Н6, J 1.0 Гц), 9.08 д (1Н, Н1, J 7.5 Гц).
MS, m/z: 226 (100) [M]+, 195 (86), 167 (74), 140 (31), 78 (34), 63 (29), 51 (37), 39 (22).
Найдено, %: С 68.97; Η 4.34; Ν 12.42.
Вычислено, %: С 69.02; Η 4.42; Ν 12.39. C13H10N4O2.
Этил пиридо[1,2-а]бензимидазол-7-карбоксилат (д). Выход 0.71 г (91%). Т. пл. 179-182°С.
Спектр ЯМР 1H (ДМСО-d6) δ, мд: 1.38 м (3Н, СН3), 4.35 м (2Н, СН2), 7.02 т (1Н, Н2, J 7.5 Гц), 7.57 т (1Н, Н3, J 8.5 Гц), 7.67 д (1Н, Н4, J 8.5 Гц), 7.95 дд (1Н, Н8, J 1.5, J 8.0 Гц), 8.35 д (1Н, Н9, J 8.0 Гц), 8.38 (1Н, Н6, J 1.0 Гц), 9.07 (1Н, Н1, J 8.0 Гц).
MS, m/z: 240 (100) [М]+, 195 (58), 167 (56), 140 (26), 78 (41), 63 (32), 51 (34), 39 (26).
Найдено, %: С 69.85; Η 4.98; Ν 11.72.
Вычислено, %: С 70.00; Η 5.00; Ν 11.67. C14H12N2O2.
Фенил пиридо[1,2-а]бензимидазол-7-карбоксилат (е). Выход 0.74 г (91%).Т. пл. 257-260°С.
Спектр HRMS, найдено: m/z 289.0963 [М+Н]+; C18H13N2O2 +; вычислено: М=289.0972.
Спектр ЯМР 1H (ДМСО-d6, δ, м.д., J/Гц): 7.08 (т, 1Η, Н(4′), J=8); 7.34 (м, 3Н, Н(2), Η(2′), Н(6′)); 7.48 (т, 2Н, Н(3), Н(5′)); 7.64 (т, 1Н, Н(3)); 7.75 (д, 1Н, Н(4)); 8.12 (д, 1Н, Н(9), J=8.5); 8.48 (д.д, 1Н, Н(8), J=2.0, J=8.5); 8.60 (д, 1Η, Н(6), J=1.5); 9.12 (д, 1Η, H(1), J=8.5).
2,4-Диметил-7-(трифторметил)пиридо[1,2-а]бензимидазол (ж). Выход 0.78 г (98%). Т. пл. 125-128°С.
Спектр HRMS, найдено: m/z 265.0952 [М+Н]+; C14H12N2F3 +; вычислено: М=265.0947.
Спектр ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 2.32 (с, 3Н, 2СН3); 2.53 (с, 3Н, 4СН3); 7.29 (с, 1Н, Н(3), J=0.5); 7.60 (д.д, 1Н, Н(8), J=1.5, J=8); 8.13 (с, 1Η, Н(6),J=1.5); 8.38 (д, 1Н, Н(9), J=8.5); 8.77 (с, 1Н, H(1), J=0.5)
2,4-Диметилпиридо[1,2-а]бензимидазол-7-карбонитрил (з). Выход 0.69 г (90%). Т. пл. 216-219°С.
Спектр HRMS, найдено: m/z 222.1037 [М+Н]+; C14H12N3 +; вычислено: М=222.1026.
Спектр ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 2.32 (с, 3Н, 2СН3); 2.53 (с, 3Н, 4СН3); 7.32 (д, 1Н, Н(3), J=0.5); 7.64 (д.д, 1Н, Н(8), J=1.5, J=8); 8.24 (д, 1Η, Н(6), J=1.5); 8.38 (д, 1Η, Н(9), J=8.5); 8.77 (д, 1Η, H(1), J=0.5).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 7-R-ПИРИДО[1,2-а]БЕНЗИМИДАЗОЛОВ | 2012 |
|
RU2522549C1 |
| ГИДРОГАЛОГЕНИДЫ 11-[(4-ТРЕТ-БУТИЛФЕНОКСИ)ЭТИЛ]- И 11-БЕНЗИЛЗАМЕЩЁННЫХ 2,3,4,5-ТЕТРАГИДРО[1,3]ДИАЗЕПИНО[1,2-A]БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЕ АЛЬФА-ГЛЮКОЗИДАЗА ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ | 2015 |
|
RU2602504C1 |
| Способ получения N-[2-амино-4-(трифторметил)фенил]-N-фенил-4-(трифторметил)бензол-1,2-диамина и его производных | 2016 |
|
RU2645922C2 |
| Способ получения N-арилзамещенных 3H-имидазо[4,5-b]пиридинов | 2016 |
|
RU2642456C2 |
| ПРОИЗВОДНЫЕ ФЕНИЛ-3-АМИНОМЕТИЛ-ХИНОЛОНА-2 В КАЧЕСТВЕ ИНГИБИТОРОВ NO-СИНТЕТАЗЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, БИОЛОГИЧЕСКИ АКТИВНЫЕ СОЕДИНЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2003 |
|
RU2284325C2 |
| Способ получения 1,2,3,4-тетрагидропиридо[1,2-a]бензимидазолов | 2020 |
|
RU2751058C1 |
| ДИАЛКИЛ(АРИЛ)-ЦИС-2-(2-ГИДРОКСИАРИЛ)-2-АЛКИЛ(АРИЛ)ЭТЕНИЛФОСФИНОКСИДЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2007 |
|
RU2329271C1 |
| АНТАГОНИСТЫ TLR7/8 И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2833035C2 |
| Способ получения дигалогенпроизводного 1,2,3,4-тетрагидропиридо- или пиридо[1,2-а]бензимидазол-6,9-диона | 2023 |
|
RU2828349C1 |
| ПРОИЗВОДНЫЕ 3-АМИНОМЕТИЛХИНОЛОНА-2 В КАЧЕСТВЕ ИНГИБИТОРОВ NO-СИНТЕТАЗЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ, БИОЛОГИЧЕСКИ АКТИВНЫЕ СОЕДИНЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2003 |
|
RU2267485C2 |
Изобретение относится к области органической химии, а именно к способу получения 7-R-пиридо[1,2-а]бензимидазолов общей формулы,  , где a) R=CF3, R′=H; б) R=CN, R′=H; в) R=COOH, R′=H; г) R=COOCH3, R′=H; д) R=COOC2H5, R′=H; e) R=COOPh, R′=H; ж) R=CF3, R′=CH3; з) R=CN, R′=CH3, заключающемуся в том, что восстановление хлоридов N-(2-нитpo-4-R-фенил)-3,5-R′-пиридиния проводят в смеси спирта и 4%-ной соляной кислоты, взятых в соотношении 1:1, с помощью электрического тока в электролизере без диафрагмы в гальваностатическом режиме при температуре 40°С на свинцовом катоде, при пропускании через электролитическую ячейку заряда в 4 Φ в течение 0,5 ч, силой тока 0,4 А, используя анод из платины, целевые продукты выделяются фильтрованием выпавшего осадка после обработки реакционной смеси гидроксидом аммония. Технический результат: разработан способ получения производных пиридо[1,2-а]бензимидазолов, которые могут быть использованы в качестве полупродуктов для синтеза биологически активных веществ, проявляющих антиоксидантную активность, что находит применение в области оптоэлектроники, например в нелинейной оптике. 8 пр.
, где a) R=CF3, R′=H; б) R=CN, R′=H; в) R=COOH, R′=H; г) R=COOCH3, R′=H; д) R=COOC2H5, R′=H; e) R=COOPh, R′=H; ж) R=CF3, R′=CH3; з) R=CN, R′=CH3, заключающемуся в том, что восстановление хлоридов N-(2-нитpo-4-R-фенил)-3,5-R′-пиридиния проводят в смеси спирта и 4%-ной соляной кислоты, взятых в соотношении 1:1, с помощью электрического тока в электролизере без диафрагмы в гальваностатическом режиме при температуре 40°С на свинцовом катоде, при пропускании через электролитическую ячейку заряда в 4 Φ в течение 0,5 ч, силой тока 0,4 А, используя анод из платины, целевые продукты выделяются фильтрованием выпавшего осадка после обработки реакционной смеси гидроксидом аммония. Технический результат: разработан способ получения производных пиридо[1,2-а]бензимидазолов, которые могут быть использованы в качестве полупродуктов для синтеза биологически активных веществ, проявляющих антиоксидантную активность, что находит применение в области оптоэлектроники, например в нелинейной оптике. 8 пр.
Способ получения замещенных пиридо[1,2-а]бензимидазолов общей формулы
 ,
,
где a) R=CF3, R′=H; б) R=CN, R′=H; в) R=COOH, R′=H; г) R=COOCH3, R′=H; д) R=COOC2H5, R′=H; e) R=COOPh, R′=H; ж) R=CF3, R′=CH3; з) R=CN, R′=CH3,
заключающийся в том, что восстановление хлоридов N-(2-нитpo-4-R-фенил)-3,5-R′-пиридиния проводят в смеси спирта и 4%-ной соляной кислоты, взятых в соотношении 1:1, с помощью электрического тока в электролизере без диафрагмы в гальваностатическом режиме при температуре 40°С на свинцовом катоде, при пропускании через электролитическую ячейку заряда в 4 Φ в течение 0,5 ч, силой тока 0,4 А, используя анод из платины, целевые продукты выделяются фильтрованием выпавшего осадка после обработки реакционной смеси гидроксидом аммония.
| СПОСОБ ПОЛУЧЕНИЯ 7-R-ПИРИДО[1,2-а]БЕНЗИМИДАЗОЛОВ | 2012 |
|
RU2522549C1 |
| US 20130053363 A1, 28.02.2013 | |||
Авторы
Даты
2015-07-10—Публикация
2014-07-23—Подача