Изобретение относится к микробиологии и генной инженерии и может быть использовано при создании аттенуированной вакцины против Mycobacterium tuberculosis в медицине.
Проблема борьбы с туберкулезом, опережающим по уровню смертности другие инфекции и уносящим около 2 миллионов человеческих жизней ежегодно, существенно осложняется тем, что МТВ (Mycobacterium tuberculosis) - возбудители этой болезни - способны выживать в латентном (покоящемся) состоянии. По данным ВОЗ каждый третий житель Земли является носителем латентного туберкулеза, потенциально способного перейти в острую форму. Вакцинирование живой вакциной (BCG) также приводит к образованию латентных форм BCG, которые при ослаблении иммунитета способны реактивироваться и вызывать BCG-инфекции. Актуально получение живых вакцинных препаратов, не способных к переходу в латентное состояние. В переходе бактерий в покоящееся состояние участвуют бактериальные токсины, компоненты ТА систем (Gerdes K, Christensen SK, Lobner-Olesen A, Nat Rev Microbiol. (2005) May; 3(5):371-82). ТА система является двухкомпонентной, токсины нарушают такие важнейшие клеточные функции, как трансляция, репликация, синтез компонентов клеточной стенки, антитоксины контролируют активность токсинов, связывая его в комплексы (Makarova Kira S, Wolf Yuri I and Koonin Eugene V Biol Direc (2009)).
Наиболее распространены ТА семейства VapBC. Мишенью токсина VapC является тРНК (Winther KS, Gerdes K. Proc Natl Acad Sci USA (2011) 108(18):7403-7). Антитоксин VapB является ингибитором токсина VapC.
Задачей изобретения является рекомбинантная плазмидная ДНК pMind-vapB, представляющая фрагмент ДНК с геном vapB (MSMEG_1283), обеспечивающая гиперэкспрессию гена vapB в М. tuberculosis. Рекомбинантная плазмида pMind получена и описана ранее (Blokpoel MC, Murphy HN, O'Toole R, Wiles S, Runn ES, Stewart GR, Young DB, Robertson BD, Nucleic Acids Res. 2005 Feb 1;33(2):e22). Рекомбинантный штамм Mycobacterium tuberculosis-VapB, полученный путем введения в штамм М. tuberculosis Rv37 рекомбинантной плазмидной ДНК pMind-VapB, утрачивает способность образовывать латентные формы, что позволит обезопасить применение аттенуированных противотуберкулезных вакцин.
Получение рекомбинантной плазмидной ДНК pMind-vapB, содержащей ген антитоксина VapB
pMind-vapB плазмида была получена на основе вектора pMind, позволяющего осуществлять контролируемую, индуцированную экспрессию под контролем тетрациклин-зависимого промотора. Клонированный ген vapB кодирует антитоксин VapB Mycobacterium smegmatis. Клонирование vapB осуществлено следующим образом: Выделенная с помощью Genomic DNA Purification Kit (Fermentas) ДНК М. smegmatis использовалась в качестве матрицы для амплификации гена vapB. ПЦР проводилась с использованием праймеров (рис.1). В праймеры были введены сайты рестрикции BamHI и SpeI. Сайты выделены подчеркиванием. Амплификация проводилась в следующем режиме: шаг 1. 94°С - 5 минут, шаг 2. 94°С - 30 секунд, шаг 3. - 56°С - 30 секунд, шаг 4. - 72°С 60 секунд; далее цикл шаг 2, шаг 3, шаг 4 - 25 раз, далее 72°С - 5 минут. Продукт амплификации выделялся согласно протоколу с помощью Gel and PCR Clean-up System (Promega) и клонировался в вектор pGEM-T (Promega) с помощью Т4 ligase (Promega). Трижды отмытые стерильным 10% С3Н8О3 в деионизованной Н2О клетки E.coli (штамм BMHI) были трансформированы лигазной смесью методом электропорации согласно протоколу Bio-Rad. Трансформированные клетки высевались на селективную агаризованную среду NB (Nutrient broth) (Himedia), содержащую 50 мкг/мл ампициллина, 0,2 mM IPTG, 0,004% X-Gal. Через 20 часов отбирались белые колонии и анализировались вышеописанным методом ПЦР. ПЦР-позитивные колонии инокулировали в 4 мл NB среды, содержащей 50 мкг/мл ампициллина. Вектор pGEM-vapBC выделяли согласно протоколу с помощью DNA Purification Kit (Promega). Вектор pGEM-vapBC был гидролизован по сайту рестрикции BsaBI, в 1% агарозе электрофоретически была отделена часть, соответствующая гену vapC, вектор pGEM-vapB с удаленной большей частью гена vapC был выделен с помощью Gel and PCR Clean-up System (Promega), затем лигирован и трансформирован в, как описано выше, E.coli (штамм ВМHI). Трансформированные клетки высевались на селективную агаризованную среду NB, содержащую 50 мкг/мл ампициллина, колонии отбирались так же, как описано выше, по размеру амплифицированного фрагмента. Выделение вектора pGEM-vapB из ПЦР-позитивных колоний проводили так же, как описано выше. Выделенный вектор гидролизовали по сайтам рестрикции BamHI и SpeI, вектор pMind гидролизовали по тем же сайтам. Продукты гидролиза разделяли электрофоретически в 1% агарозе, нужные фрагменты выделяли с помощью Gel and PCR Clean-up System. После чего фрагмент гена VapB лигировали в вектор pMind. Лигазную смесь трансформировали, как описано выше, в E.coli штамм (BMHI). Полученные колонии анализировались вышеописанным методом ПЦР. Выделение вектора pMind-vapB из ПЦР-позитивных колоний проводили так же, как описано выше. Полученный вектор при введении в М. tuberculosis обеспечивал гиперпродукцию антитоксина VapB указанными бактериями.
Клонированная в pMind VapB последовательность 636 пар оснований - рис.2.
Аминокислотная последовательность клонированного в pMind белка VapB (92 аминокислоты) - рис.3.
Трансформация штамма М. tuberculosis рекомбинантной плазмидной ДНК pMind-vapB
Трансформация штамма М. tuberculosis (MTB) генетической конструкцией pMind-vapB проводилась согласно протоколу (Parish Tanya and Stoker Neil G Human press, Totowa, New Jersey. (1998)). Рекомбинантная плазмидная ДНК pMind-vapB позволяет осуществлять гиперэкспрессию антитоксина VapB в штаммах Mycobacterium tuberculosis.
Описание гиперэкспрессии VapB М. tuberculosis
Полученный М. tuberculosis-vapB штамм был протестирован на способность образовывать покоящиеся формы в условиях культивирования при низких значениях рН (Shleeva МО, Kudykina YK, Vostroknutova GN, Suzina NE, Mulyukin AL, Tuberculosis. 2011 Mar;91(2):146-54). Полученный штамм потерял способность образовывать покоящиеся формы (Рис.4). Разность между количеством клеток, подсчитанных после реактивации бактерий методом предельных разведении (МПР), и количеством колониеобразующих единиц (КОЕ) демонстрирует образование покоящихся форм М. tuberculosis.
Штамм М. tuberculosis-vapB с введенной плазмидой pMind-vapB неспособен образовывать дормантные формы.
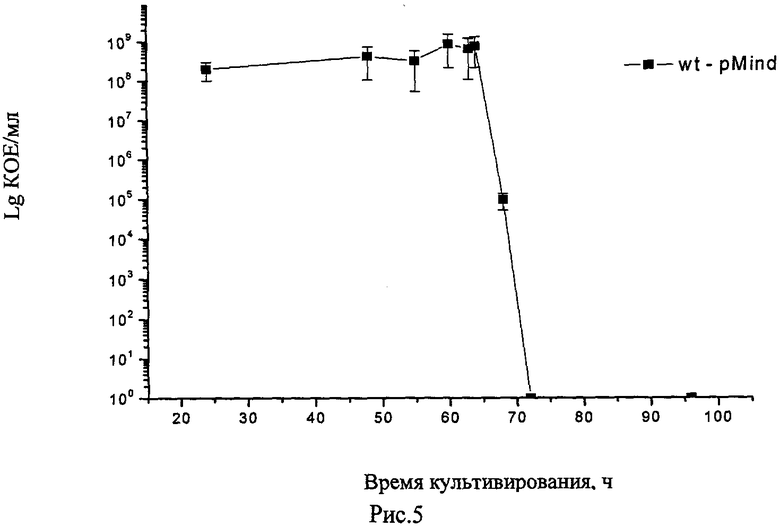
Существуют модели получения покоящихся форм M. smegmatis. В одной из моделей при культивировании на модифицированной питательной среде клетки M. smegmatis теряли способность культивироваться на твердых средах и переходили в состояние покоя (Рис. 5) (Shleeva M, Mukamolova GV, Young M, Williams HD, Kaprelyants AS Microbiology (2004) 150(Pt 6):1687-97).
Трансформация штамма M. smegmatis генетической конструкцией pMmd-vapB проводилась согласно протоколу (Parish Tanya and Stoker Neil G Human press, Totowa, New Jersey. (1998)). В результате введения вектора pMind-vapB, позволяющего осуществить гиперэкспрессию антитоксина VapB в M. smegmatis, получен штамм M. smegmatis - vapB, гиперэкспрессирующий антитоксин VapB. Было обнаружено, что гиперэкспрессия антитоксина VapB приводит к полной потере способности клетками штамма M. smegmatis - vapB образовывать покоящиеся некультивируемые формы (рис.6). Полученный результат свидетельствуют об отсутствие видовой специфичности действия антитоксина VapB для видов Smegmatis и Tuberculosis, и позволяет считать, что гиперэкспрессия антитоксина VapB в различных штаммах МТБ будет приводить к утрате способности образовывать дормантные формы.
Краткое описание рисунков:
На рис.1 приведены последовательности праймеров, которые использовались для проведения ПЦР. В праймеры были введены сайты рестрикции BamHI и SpeI. Сайты выделены подчеркиванием.
На рис.2 приведена клонированная в вектор pMind VapB последовательность 636 пар оснований.
На рис.3 приведена аминокислотная последовательность клонированного в вектор pMind белка VapB (92 аминокислоты).
На рис.4 показана способность штаммов M. tuberculosis и M. tuberculosis-vapB к образованию дормантных форм. КОЕ (колония образующая единица) отражает количество активных клеток в ростовой среде, НВЧ (наиболее вероятное число) отражает реактивацию дормантных клеток + количество активных клеток. Математическая разность между КОЕ и НВЧ - количество дормантных клеток в культуре.
На рис.5 показана динамика роста и образования покоящихся некультивированных форм клетками контрольного рекомбинантного штамма Wt - pMind M. smegmatis.
На рис.6 показана динамика роста клеток рекомбинантных штаммов Wt - pMind и Wt - pMind-vapB M. smegmatis. ( ) - динамика образования некультивируемых покоящихся форм рекомбинантным штаммом Wt - pMind; (
) - динамика образования некультивируемых покоящихся форм рекомбинантным штаммом Wt - pMind; ( ) - динамика роста клеток рекомбинантного штамма Wt - pMind-vapB.
) - динамика роста клеток рекомбинантного штамма Wt - pMind-vapB.
| название | год | авторы | номер документа |
|---|---|---|---|
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pMind-vapC, СОДЕРЖАЩАЯ НУКЛЕОТИДНУЮ ПОСЛЕДОВАТЕЛЬНОСТЬ, КОДИРУЮЩУЮ ГЕН vapC MSMEG_1284 | 2012 |
|
RU2524143C2 |
| Фрагмент ДНК, содержащий нуклеотидную последовательность с инвертированными повторами MITEKpnl у колистин-резистентных штаммов Klebsiella pneumoniae | 2020 |
|
RU2736114C1 |
| ТЕСТ-СИСТЕМА Mycobacterium smegmatis aphVIII+ ДЛЯ СКРИНИНГА ИНГИБИТОРОВ СЕРИН-ТРЕОНИНОВЫХ ПРОТЕИНКИНАЗ ЭУКАРИОТИЧЕСКОГО ТИПА | 2014 |
|
RU2566998C1 |
| Способ моделирования дормантного состояния Mycobacterium tuberculosis in vitro | 2018 |
|
RU2707941C1 |
| СПОСОБ СОЗДАНИЯ РЕКОМБИНАНТНОГО АДЕНОВИРУСА ПТИЦ ДЛЯ ВАКЦИНАЦИИ И ГЕННОЙ ТЕРАПИИ | 2007 |
|
RU2326942C1 |
| НОВАЯ ЭФФЕКТИВНАЯ ЛЕКАРСТВЕННАЯ МИШЕНЬ ДЛЯ ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА | 2008 |
|
RU2474621C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЭКСПРЕССИОННОГО ПЛАЗМИДНОГО ВЕКТОРА, ОБЛАДАЮЩЕГО ПОВЫШЕННОЙ СТАБИЛЬНОСТЬЮ НАСЛЕДОВАНИЯ В КЛЕТКАХ Escherichia coli | 2008 |
|
RU2422504C2 |
| Аллерген, содержащий комбинацию последовательностей белков, кодируемых генами EsxA, EsxB, EspJ, EspK M.tuberculosis complex, и способ его применения для диагностики инфекции M.tuberculosis complex | 2017 |
|
RU2636490C1 |
| ВАКЦИНЫ РЕКОМБИНАНТНЫХ ВНУТРИКЛЕТОЧНЫХ ПАТОГЕНОВ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2001 |
|
RU2266132C2 |
| СПОСОБ ВНЕСЕНИЯ НЕМАРКИРОВАННЫХ ТОЧЕЧНЫХ ЗАМЕН В ХРОМОСОМУ МИКРОБАКТЕРИЙ | 2020 |
|
RU2763746C1 |

Изобретение относится к микробиологии и генной инженерии и представляет собой рекомбинантную плазмидную ДНК pMind-vapB, представляющую собой плазмиду pMind, в которую клонирована последовательность, представленная на рис.2. Рекомбинантная плазмидная ДНК pMind-vapB позволяет осуществлять гиперэкспрессию антитоксина VapB в штаммах Mycobacterium tuberculosis. 6 ил.
Рекомбинантная плазмидная ДНК pMind-vapB, обеспечивающая гиперэкспрессию гена vapB в клетках M.tuberculosis, представляющая собой плазмиду pMind, в которую клонирована нуклеотидная последовательность

Авторы
Даты
2014-07-27—Публикация
2012-10-23—Подача