Изобретение относится к молекулярной биологии, биотехнологии, генной инженерии вирусов и касается оригинального способа создания рекомбинантного аденовируса птиц CELO, содержащего целевой ген или гены под контролем экзогенного промотора, как минимум один целевой ген под контролем собственного промотора вируса CELO, в результате экспрессии которых в организме птиц, млекопитающих животных и человека возникает иммунитет к заболеванию или заболеваниям, либо достигается необходимый генно-терапевтический эффект, что может быть использовано для создания генно-инженерных рекомбинантных вакцин нового поколения и препаратов для генной терапии.
Для создания иммунитета к какому-либо заболеванию в организм вводят вакцины - препараты из микроорганизмов или вирусов для стимуляции выработки у организма соответствующих собственных антител. Более современный способ вакцинации - это использование созданных генно-инженерными методами инфекционных агентов с необходимым набором антигенов. Новые виды вакцин для птиц, млекопитающих животных, а также человека должны быть эффективными по своему целевому назначению, безопасными для организма и дешевыми.
Генная терапия - это современное направление лечения многих наследственных и приобретенных заболеваний путем введения фрагмента ДНК в клетки больного человека с целью замещения функции мутантного гена и лечения наследственных болезней. В этих целях, как и в случае создания нового поколения вакцин, используют геномы вирусов, в которые встраивают необходимые целевые гены. Основываясь на свойстве вирусов доставлять генетический материал в клетки организма, их применяют в качестве векторов. Таким образом, в настоящее время с успехом применяют ретровирусы, лентивирусы, аденоассоциированный вирус, герпесвирусы, поксвирусы и аденовирусы.
Аденовирусы (adenovirus) составляют группу ДНК-вирусов и вызывают острые респираторные заболевания, пневмонии, эпидемиологические кератоконьюктивиты, инфекционные болезни желудочно-кишечного тракта и мочевого пузыря. Аденовирусные векторы являются широко используемым инструментом для доставки генов в клетки млекопитающих. Рекомбинантные аденовирусы по сравнению с другими векторными системами отличаются высокой эффективностью экспрессии целевого трансгена в различных типах клеток, безопасностью вектора для человека и животных, накоплением рекомбинантных вирусов в клетках-продуцентах в высоком титре, индукцией как гуморального, так и клеточного иммунного ответа на трансгенный продукт в организме человека и животных, большой пакующей емкостью вектора и т.д. В настоящее время известны способы получения рекомбинантных вакцин на основе аденовирусов человека и животных (Hum Gene Ther. 2005, V.16, p.157-168; Proc. Natl. Acad. Sci. USA 2004, V.101, p.14567-14571).
Известно, что наиболее часто на практике используют аденовирус человека 5-го серотипа. Так был получен рекомбинантный аденовирус человека 5-го серотипа (Ad5), содержащий нуклеотидную последовательность гемагглютинина вируса гриппа человека, для дальнейшего использования в качестве вакцины для человека и животных против патогенного штамма вируса гриппа (Vaccine. 2005, V 23, р.1029-1036). Ген гемагглютинина вируса гриппа птиц H5N1 клонировали в аденовирус человека 5-го серотипа также с целью использования полученного рекомбинантного вируса как вакцины для человека, млекопитающих животных и птиц (Vaccine 2006, J. of Virology, 2006, V. 80, №4, p.1959-1964). Также данный аденовирус использовали для генной терапии опухолей в случае, когда в него был клонирован ген опухолевого супрессора р53 (US 7033750). Все вышеназванные гены были клонированы под контролем промотора цитомегаловируса CMV.
Однако аденовирусы имеют собственный промотор - главный поздний промотор (major late promoter - MLP), который является более эффективным по сравнению с экзогенными промоторами, например вышеназванным CMV. При этом промотор MLP способен функционировать только в пермиссивной (подходящей для размножения вируса) системе и только находясь в составе репликативно-компетентного аденовируса. Это обусловлено тем, что транскрипция генов, находящихся под его контролем, начинается после прохождения процесса репликации вирусного генома. В последнее время все большее применение находят векторы на основе репликативно-компетентных аденовирусов, в связи с чем становится актуальным использование главного позднего промотора. Известно, что в геном аденовируса человека 5-го серотипа под контроль главного позднего промотора MLP был встроен ген капсидного антигена папиломавируса собаки (PNAS 2005, V.102, №12, р.4590-4595). Для клонирования гена использовали сайт, расположенный в позднем регионе генома L5, после последовательности, кодирующей ген фибера.
Таким образом, известно использование рекомбинантных аденовирусов только с одной экспрессирующей кассетой, несущей один или два целевых гена, рамки считывания которых имеют небольшой размер (до 1000 нуклеотидов для каждого из двух генов), хотя аденовирусная система потенциально может содержать не менее двух кассет, в составе которых могут находиться один или несколько целевых гена, белковые продукты которых могут относиться к различным функциональным группам: цитокинам, онкосупрессорам, факторам роста, антигенам патогенных организмов.
Наряду с аденовирусами человека для создания векторных систем используют аденовирус птиц CELO chicken embryo lethal orphan (аденовирус птиц 1 серотипа FAV-1). Вирус CELO является инфекционным агентом, но при этом вызываемая им инфекция не несет значительных экономических последствий или угрозы здоровью птицы. Данный вирус может быть выделен от здоровых цыплят и не вызывает заболевания в результате экспериментального заражения цыплят. Рекомбинантные аденовирусы птиц CELO, экспрессирующие гены протективных антигенов различных патогенов, обладают выраженным тропизмом по отношению к эпителиальным тканям птиц. Это позволяет осуществлять эффективную и пролонгированную экспрессию целевого гена в организме иммунизированных птиц, что в свою очередь приводит к формированию у них мощного специфического гуморального и цитотоксического иммунного ответа против патогена. Дополнительным преимуществом рекомбинантных аденовирусов птиц CELO является низкая себестоимость получения препаративных количеств вируса в аллантоисе куриного эмбриона - безопасной и высокотехнологичной системе, традиционно использующейся для производства вакцин. В связи с этим рекомбинантный вирус CELO был использован для клонирования гена VP2 вируса инфекционного бурсита птиц (IBDV) (Vaccine 2004, V.22, р.2351-2360) и гена гликопротеина G вируса бешенства (Микробиология, 2006, т.4, с.69-71). Полученные рекомбинантные аденовирусы CELO были использованы для вакцинации млекопитающих животных и птиц, в результате чего были получена их защищенность от патогенных штаммов вирусов.
Известно, что для получения рекомбинантных аденовирусов используют несколько способов. Первый включает направленное лигирование целевого гена с фрагментами аденовирусного генома (Маниатис Т. и др. Молекулярное клонирование. М.: Мир, 1984). Так как геном аденовирусов имеет большой размер порядка 35000-45000 н.п. и содержит незначительное число уникальных сайтов рестрикции, этот способ технически сложен и нерезультативен, тем более в случае введения нескольких целевых генов.
Второй известный способ основан на использовании фага лямбда, который также ограничивает возможности при получении рекомбинантных аденовирусов, так как эта технология требует дорогостоящих материалов и процесс получения рекомбинантного вируса проходит многостадийно (J.Virology, 2001, V.75, N 11, p.5288-5301).
Известен также третий способ, основанный на клонировании целевого гена в «shuttle»-векторе, который содержит участки, гомологичные концевым фрагментам генома аденовируса, с последующей гомологичной рекомбинацией, в результате которой происходит перенос целевого гена в геномную ДНК аденовируса.
Известно, что для получения рекомбинантного вируса CELO с помощью гомологичной рекомбинации используют полную геномную ДНК вируса CELO или плазмиду, содержащую полную геномную ДНК вируса CELO, а также плазмидную конструкцию, одновременно содержащую правый и левый участки генома CELO и одну экспрессирующую кассету из целевого гена под контролем эукариотического промотора и сигнала полиаденилирования. Экспрессирующая кассета содержится либо в левом участке генома CELO, либо в правом его участке. В правом участке генома CELO из плазмидной конструкции осуществляют два вида делеций, либо в области 40065-43684 н.п., либо в области 41731-43684 н.п. в связи с ограничением пакующей емкости вирусной частицы (US, 6841158, 2005). При этом в область делеций 41731-43684 н.п. клонируют экспрессирующую кассету с одним целевым геном в связи с ограничением пакующей емкости вирусной частицы, позволяющей в данном случае встроить ген, размер которого не превышает 2153 н.п.
За счет гомологичных участков плазмидной конструкции с экспрессирующей кассетой и полной геномной ДНК вируса CELO в клетках Е. coli проводят гомологичную рекомбинацию, результатом которой является получение плазмиды с полным геномом CELO и включенной экспрессирующей кассетой. Полученную плазмиду путем трансфекции вводят в пермиссивную для вируса CELO линию клеток гепатомы петуха леггорн LMH (leggom male hepatoma), где происходит сборка и размножение рекомбинантного аденовируса (J. Virology 1999, V.73, №2, p.1399-1410).
Данный способ имеет ограничения в использовании, поскольку из-за большого размера генома CELO (около 44000 н.п.) целевые вставки должны быть ограниченного размера, то есть имеется возможность клонирования только одного целевого гена. Получение рекомбинантного аденовируса через стадии рекомбинации в клетках Е. coli размножения в клетках LMH приводит к увеличению затрат на получение вакцины или генно-терапевтического препарата. Также не задействован главный поздний промотор аденовируса MLP, который является эффективным для экспрессии целевых генов в клетках птиц.
Задачей изобретения является создание нового способа получения рекомбинантного аденовируса птиц CELO с использованием двух плазмидных конструкций, созданных на основе генома аденовируса птиц CELO и содержащих его участки, с целью увеличения емкости рекомбинантного аденовируса для клонирования целевых генов под контролем экзогенного промотора и создания дополнительной экспрессионной кассеты под контролем собственного эффективного промотора аденовируса для клонирования целевых генов, а также для их комбинирования с генами под контролем экзогенного промотора, экспрессия которых приводит к иммунизации организма птиц, млекопитающих животных и человека, а также проведению генной терапии.
Поставленная задача решается тем, что в способе создания рекомбинантного аденовируса птиц для вакцинации и генной терапии берут геномную ДНК аденовируса птиц CELO, которая включает собственный главный поздний промотор MLP аденовируса, и на основе ее левого фрагмента (1-20028 н.п.) конструируют первую плазмиду, содержащую встроенные сайт сплайсинга и как минимум один целевой ген под контролем промотора MLP. Также на основе правого фрагмента генома CELO (17390-43804) конструируют вторую плазмиду, в которой присутствует зона, гомологичная зоне первой конструкции для проведения рекомбинации, при этом в нуклеотидной последовательности плазмиды образуют делецию в 3787 н.п. для увеличения пакующей емкости аденовируса CELO, в области которой затем клонируют как минимум одну экспрессирующую кассету, состоящую из экзогенного промотора, обеспечивающего высокий уровень экспрессии в эукариотических клетках, из как минимум одного целевого гена и сигнала полиаденилирования. Гомологичную рекомбинацию проводят в культуре клеток гепатомы петуха леггорн (LMH), обеспечивая получение рекомбинантного аденовируса, состоящего из геномной ДНК аденовируса птиц CELO с экспрессирующей кассетой, включающей сайт сплайсинга, как минимум один целевой ген под контролем промотора аденовируса MLP и сигнал полиаденилирования из генома аденовируса птиц CELO, а также с еще одной экспрессирующей кассетой, состоящей из как минимум одного целевого гена под контролем экзогенного промотора для экспрессии в клетках эукариот и сигнала полиаденилирования. В культуре клеток LMH происходит сборка и размножение рекомбинантного аденовируса птиц CELO для последующего использования в качестве вакцины или генно-терапевтического препарата. В качестве целевых генов в составе экспрессирующих кассет используют гены: цитокинов (γ-интерферона птиц, α16-интерферона человека, α-интерферона α-2а человека, β-интерферона человека, γ-интерферона человека, гранулоцитарно-макрофагального колониестимулирующего фактора GMCSF человека, интерлейкина- 2 человека), факторов роста (инсулиноподобного фактора роста IGF1 человека, фактора роста эндотелия сосудов VEGF человека, нейротрофического фактора глиальных клеток GDNF человека), онкосупрессоров (тимидинкиназы HSV1 вируса герпеса I типа человека, р53 человека), а также антигенов (протективных антигенов микобактерии М. tuberculosis Ag85A, Ag85B, ESAT6, антигенов гексона вируса птиц ССЯ-76 и отростка пентона (фибера) вируса птиц ССЯ-76). Гены птиц клонируют под контролем аденовирусного промотора MLP, гены микроорганизмов и человека - под экзогенным промотором. Клонирование проводят либо одиночными генами, либо несколькими генами в определенной комбинации: ген цитокина птиц под контролем промотора MLP или экзогенного промотора, ген цитокина птиц под контролем промотора MLP и ген цитокина птиц под контролем экзогенного промотора, ген цитокина человека под контролем экзогенного промотора, ген фактора роста человека под контролем экзогенного промотора, ген онкосупрессора человека под контролем экзогенного промотора, ген протективного антигена микобактерии под контролем экзогенного промотора, два гена протективных антигенов микобактерии под контролем экзогенного промотора, ген антигена птиц под контролем промотора MLP или экзогенного промотора, ген антигена птиц под контролем промотора MLP и ген антигена птиц под контролем экзогенного промотора, ген цитокина под контролем промотора MLP в сочетании с геном антигена под контролем экзогенного промотора.
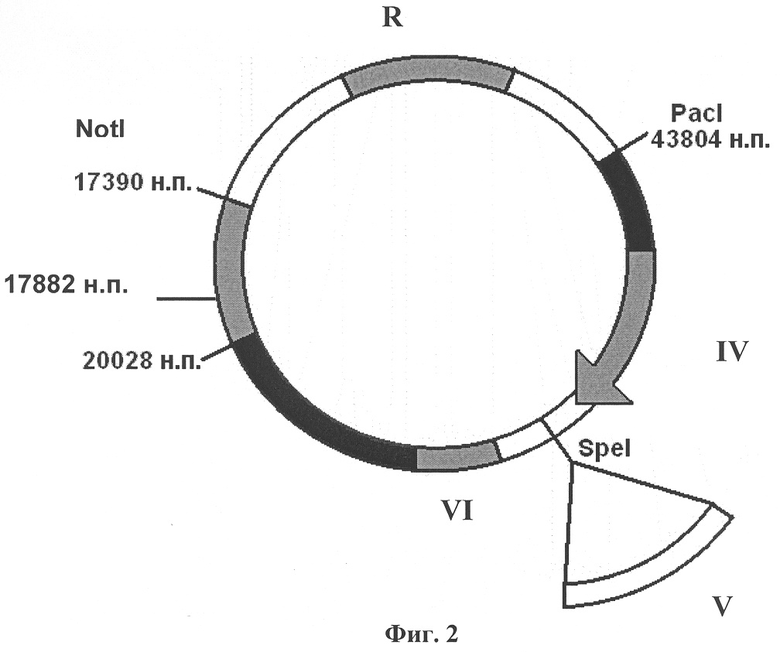
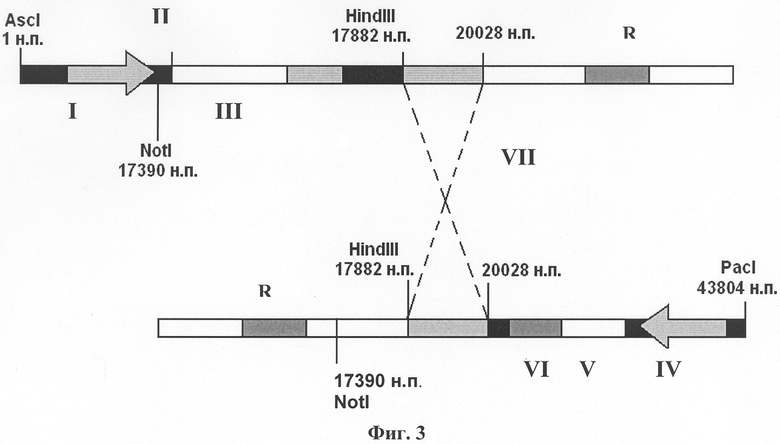
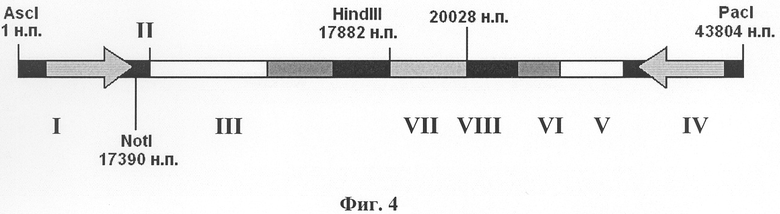
Изобретение поясняется чертежами, где на фиг.1 изображена плазмидная конструкция, несущая в своем составе фрагмент генома вируса CELO от 1 н.п. по 20028 н.п., в котором находится экспрессирующая кассета, состоящая из собственного MLP промотора (I) аденовируса CELO, сайта сплайсинга (II), полилинкера с уникальным сайтом рестрикции SpeI для клонирования целевых (репортерных) генов (III). На фиг.2 изображена плазмидная конструкция, несущая в своем составе фрагмент генома вируса CELO от 17390 н.п. по 43804 н.п. с делецией в 3787 н.п., в области которой находится экспрессирующая кассета, состоящая из промотора цитомегаловируса человека CMV (IV) для эффективной экспрессии эукариотических генов, полилинкера с уникальным сайтом рестрикции SpeI для клонирования целевых (репортерных) генов (V) и сигнала полиаденилирования (VI). На фиг.3 показана схема гомологичной рекомбинации в области 17882-20028 н.п. (VII) в клетках линии LMH между линеаризованными плазмидными конструкциями, изображенными на фиг.1 и на фиг.2. На фиг.4 показан полноразмерный геном рекомбинантного аденовируса CELO, полученного в результате гомологичной рекомбинации, содержащего экспрессирующую кассету из собственного промотора MLP (I) аденовируса CELO, сайта сплайсинга (II), как минимум одного целевого (репортерного) гена (III) и сигнала полиаденилирования аденовируса (VIII), а также экспрессирующую кассету из промотора цитомегаловируса человека CMV (IV), как минимум одного целевого (репортерного) гена (V) и сигнала полиаденилирования (VI), например, гена бычьего гормона роста BGH p(A).
Способ создания рекомбинантного аденовируса птиц CELO для вакцинации и генной терапии основан на гомологичной рекомбинации между двумя плазмидными конструкциями, специально созданными на основе полноразмерного генома аденовируса птиц CELO.
Первая плазмидная конструкция, которая показана на фиг.1, содержит в своем составе левый фрагмент генома вируса CELO от 1 н.п. до 20028 н.п. и экспрессирующую кассету, состоящую из промотора MLP (I) аденовируса CELO, обеспечивающего достаточный для иммунизации уровень экспрессии репортерных генов в клетках птиц, из специально встроенного сайта сплайсинга (II), из целевого гена (III), клонирование которого проводят по уникальному сайту рестрикции SpeI. Главный поздний промотор MLP контролирует транскрипцию на достаточно большом участке вирусного генома, для вируса CELO - с 12193 нуклеотида по 39751 нуклеотид (+) цепи ДНК. Для проведения клонирования целевых генов под его контролем был выбран участок (17501-17502 н.п.), находящийся между сигналом полиаденилирования поздней рамки считывания L2 и ATG кодона белка pVI, в котором не происходит перекрывания рамок считывания поздних и ранних генов. При клонировании по данному сайту репортерного гена он будет функционировать как еще одна рамка считывания в составе поздней рамки считывания L1 при условии наличия на его 3'-конце сайта сплайсинга, который необходимо встроить. При этом сигналом полиаденилирования для встроенного по сайту репортерного гена будет служить собственный polyA аденовируса (VIII), который показан на фиг.4.
Вторая плазмидная конструкция, которая показана на фиг.2, содержит правый фрагмент генома CELO от сайта узнавания рестриктазой NotI (17390 н.п.) до правого инвертированного повтора (последнего нуклеотида генома вируса CELO - 43804 н.п.). Данный фрагмент имеет делегированную область в 3787 н.п. для увеличения пакующей емкости вируса CELO, в которой клонируют, как минимум, одну экспрессирующую кассету, состоящую из экзогенного промотора CMV (IV), обеспечивающего высокий уровень экспрессии в эукариотических клетках, из целевого гена (генов) (V) и из сигнала полиаденилирования гена бычьего гормона роста BGH p(A)(VI).
Обе созданные плазмидные конструкции имеют гены, отвечающие за резистентность к антибиотику (R), а также - гомологичный участок для рекомбинации 17390-2002 8 н.п. (VII), составляющий 2638 н.п. генома вируса CELO. Гомологичную рекомбинацию, которая показана на фиг.3, проводят непосредственно в пермиссивной для CELO культуре клеток гепатомы петуха леггорна (LMH).
В результате чего получают рекомбинантный аденовирус (показан на фиг.4) с увеличенной емкостью, состоящий из полноразмерной геномной ДНК аденовируса птиц CELO, включающей две экспрессирующие кассеты, в составе которых клонированы целевые гены для экспрессии в клетках птиц, млекопитающих животных и человека. В культуре клеток LMH происходят сборка и размножение рекомбинантного аденовируса CELO.
С помощью данного способа возможно получение рекомбинантных аденовирусов CELO: - несущих репортерный ген (гены) в области делеции на правом конце генома в экспрессирующей кассете под контролем экзогенного промотора CMV;
- несущих как минимум один репортерный ген под контролем собственного промотора аденовируса MLP,
- несущих два репортерных гена, один из которых находится в области делеции на правом конце генома в экспрессирующей кассете под контролем экзогенного промотора CMV, а второй - под контролем собственного промотора MLP.
В качестве целевых (репортерных) генов в составе экспрессирующих кассет используют гены, необходимые для достижения высокого иммунного эффекта и необходимого генно-терапевтического эффекта. Данные гены относятся к различным функциональным группам: цитокинам, онкосупрессорам, факторам роста и антигенам патогенных организмов.
Цитокины - это белки межклеточных взаимодействий. К ним принадлежат интерфероны, интерлейкины, GM-CSF и другие белки.
Интерферон α и интерферон β, имеющие общий клеточный рецептор, называют интерферонами I типа. Интерферон α кодируют примерно 20 сходных генов, a интерферон β - два гена. Интерфероны I типа обладают иммунорегуляторной и антипролиферативной активностью (Int J Oncol., 2006, V 29, №6, p.1405-1412, Nat Clin Pract Oncol. 2006, V 3, №11, p.633-639). Рекомбинантный интерферон разрешен к применению при хроническом миелолейкозе, волосатоклеточном лейкозе, эпидемической форме саркомы Капоши. Интерферон у, продуцируемый лимфоцитами, относят к интерферонам II типа. Он имеет другие иммунорегуляторные свойства, обладает меньшей противоопухолевой активностью и его используют для лечения хронической гранулематозной болезни (Hematol Oncol., 2006, V 24, №3, p.151-158).
GM-CSF - гранулоцитарно-макрофагальный колониестимулирующий фактор. Показано, что GM-CSF стимулирует стволовые клетки костного мозга к образованию в агаре смешанных колоний, состоящих из гранулоцитов и макрофагов (Nimmer S. et al., 1988, Int. J.Oncol. 2006, V.28, №4, p.947-953).
Интерлейкины - это цитокины, опосредующие взаимодействия между лейкоцитами. Обнаружено по крайней мере 17 интерлейкинов. Интерлейкин 2, известный раньше как фактор роста Т-лимфоцитов, считается основным регулятором клеточного иммунитета. Он стимулирует пролиферацию и цитотоксическую активность Т- и NK-лимфоцитов.
Нейротрофические факторы роста (нейротрофины) играют важную роль в процессах развития и функционирования нервной системы, а также, что особо важно для практической медицины, в регенерации поврежденных нейрональных структур (Lindsay ea 1996, Lindsay ea 1996, Cuello ea 1997, Ebadi ea 1997). Недостаточная экспрессия нейротрофических факторов роста является причиной многих заболеваний нервной системы. Например, дегенерация аксонов нервных клеток связана с изменением экспрессии таких факторов, как инсулиноподобного фактора роста - insulin like grouth factor (IGF1IGF2), нейротрофического фактора глиальных клеток - glial derived neurotrophic factor (GDNF) и др.
VEGF - (Vascular endothelial growth factor) - фактор роста сосудистого эндотелия гликопротеин, связывающийся только с эндотелиальными клетками и стимулирующий их пролиферацию. Этот фактор усиленно продуцируется клетками некоторых опухолей человека, в частности рака яичника, способствуя неоваскуляризации опухоли и, возможно, связанной с этим ранней ее диссеминации. Помимо ангиогенного действия VEGF значительно усиливает проницаемость сосудов; с этим его свойством связывают локальную экстравазацию, наблюдаемую в ряде опухолей, например образование асцита при раке яичника (Karp, J.E., and Broder, S. 1995).
В генной терапии для лечения злокачественных опухолей используют гены онкосупрессоров. В частности, применяют целенаправленное введение в опухолевые ткани «генов-самоубийц», продукция которых обладает цитотоксическим эффектом. Наиболее перспективными в этом плане считаются так называемые условно-летальные гены, кодирующие белки, которые сами по себе не являются токсичными для клеток, но при взаимодействии с каким-либо веществом могут вызывать их разрушение. К таким генам относят ген тимидинкиназы вируса герпеса HSV1. Его введение в опухолевые клетки пациента приведет к тому, что генетически модифицированные этим геном опухолевые клетки больного будут разрушены (Cancer Gene Ther., 2005, V.12, №7, p.617-626).
Белок р53 является ключевым элементом контроля клеточного ответа на различные виды стресса: его активация в ответ на стресс приводит к остановке пролиферации или апоптозу (клеточной смерти). Инактивация р53, наблюдаемая в большинстве опухолей, свидетельствует в пользу его противоопухолевой активности (Cancer Gene Ther., 2004, V.11, №1, p.79-84.).
Еще одной актуальной группой генов для клонирования в рекомбинантном аденовирусе CELO являются нуклеотидные последовательности, кодирующие антигены. Гены Ag85A, Ag85B, ESAT6 кодируют основные защитные антигены возбудителя туберкулеза Mycobacterium tuberculosis, которые используют для создания генно-инженерных вакцин на базе плазмидных и вирусных векторов, в частности на основе генома аденовируса человека 5-го серотипа (J. Immunol., 2004, Nov 15, V.173, №10, p.6357-6365). Гексон и фибер являются поверхностными антигенами вируса ССЯ-76 (синдром снижения яйценоскости-76), вызывающего болезнь кур-несушек, которая характеризуется размягчением, отсутствием или депигментацией скорлупы яиц и сопровождается значительным снижением яйценоскости. Для профилактики заболевания ССЯ-76 в настоящее время используются малоэффективные инактивированные вакцины. Генетических вакцин, содержащих гены гексона и фибера вируса ССЯ-76, до настоящего времени не разработано. Поэтому клонирование в рекомбинантном аденовирусе CELO генов гексона и отростка пентона (фибера) вируса птиц ССЯ-76 может быть использовано для эффективной борьбы с синдромом снижения яйценоскости у кур.
Основной характеристикой, отличающей новый способ получения рекомбинантного аденовируса птиц для вакцинации и генной терапии от описанного аналога, является использование для получения рекомбинантного аденовируса CELO двух плазмидных конструкций, которые созданы на основе генома CELO, при этом одна из которых содержит концевой фрагмент генома CELO с экспрессирующей кассетой в области делеции, а другая начальный фрагмент генома CELO с экспрессирующей кассетой, в состав которой входит собственный промотор аденовируса. Полученный рекомбинантный аденовирус CELO содержит две экспрессионные кассеты, причем в составе каждой может находится один и более целевых генов. Также полученный рекомбинантный аденовирус CELO способен к репликации и упаковке при увеличенном размере (за счет нескольких вставок чужеродной ДНК в его геном) непосредственно в культуре клеток LMH, минуя стадию с использованием клеток Е. coli.
Получение рекомбинантного аденовируса, который содержит одновременно несколько одинаковых / разных генов под контролем экзогенного и собственного промотора MLP, актуально, поскольку:
1) позволяет обеспечить экспрессию нескольких разных генов в одной и той же клетке, вероятность чего сильно снижается при инфекции двумя отдельными рекомбинантными аденовирусами, несущими те же гены;
2) служит для увеличения уровня экспрессии генов (по крайней мере, в два раза) за счет увеличения количества копий гена в дозе вируса (в случае одного и того же гена);
3) экономически более выгодно получение одного рекомбинантного вируса, чем двух;
4) может обеспечивать усиление клеточного иммунного ответа, особенно эффективен случай, когда цитокин находится в сочетании с антигеном.
Изобретение иллюстрируют следующие примеры.
Пример 1. Создание первой плазмидной конструкции, содержащей левый фрагмент генома вируса CELO с сайтом клонирования целевого гена под контролем собственного промотора аденовируса MLP к п.1 формулы изобретения.
Для получения конструкции используют следующие олигонуклеотиды: NotI-F 5'-cctatcattgcggccgctatcg-3'и Not-R 5'-cagcatcactttttgtcccc-g-3', содержащие в своем составе сайт для эндонуклеазы рестрикции NotI; HindIII-F 5'-actggacgcactaaaaggccc-3'; HindIII-R 5'-cccaaagctttacgccgcagc-3', содержащие в своем составе сайт для эндонуклеазы рестрикции HindIII. Проводят полимеразную цепную реакцию (ПЦР) в 25 мкл реакционной смеси, содержащей 2 мкг ДНК вируса CELO в качестве матрицы, 10 пкМ каждого праймера HindIII-R и HindIII-F, 67 мМ трис-HCl (рН 8,8 при 25°С), 15 мМ сульфата аммония, 2,5 мМ хлористого магния, 0,01% Твин-20, смесь дезоксинуклеотидтрифосфатов (дАТФ, дЦТФ, дТТФ и дГТФ, по 2,5 мМ) и 1 ед. Taq-ДНК-полимеразы под вазелиновым маслом при следующих условиях: 94°С - 5 мин; 5 циклов: 58°С - 2 мин, 72°С - 20 с и 94°С - 30 с; 20 циклов: 58°С - 30 с, 72°С - 20 с и 94°С - 30 с; затем 58°С - 5 мин и 72°С - 10 мин. Продукт амплификации обрабатывают хлороформом, переосаждают этиловым спиртом и растворяют в бидистиллированной воде. Затем полученную конструкцию, состоящую из участка генома CELO 17502-17882 н.п., а также содержащую единичный сайт SpeI, клонируют в плазмидном векторе pGEM-T Easy («Promega» №А1360). Клонирование проводят согласно протоколу, приложенному к набору для клонирования ПЦР-продуктов pGEM-Т Easy.
В результате следующей ПЦР на матрице генома CELO с праймерами NotI-F и Not-R при условиях 94°С - 5 мин; 5 циклов: 58°С - 2 мин, 72°С - 20 с и 94°С - 30 с; 20 циклов: 58°С - 30 с, 72°С - 20 с и 94°С - 30 с; затем 58°С - 5 мин и 72°С - 10 мин получают конструкцию, состоящую из участка генома CELO 17390-17501 н.п. Полученную промежуточную конструкцию для дальнейшего получения первой конструкции клонируют в коммерческом векторе pGEM-T Easy («Promega» №А 1360) согласно прилагаемому протоколу. Таким образом, получают плазмиды pGEM-Hind и pGEM-Not.
Для включения полученных конструкций в состав генома CELO необходимо создать плазмидный вектор, где вышеописанные конструкции были бы фланкированы участками ДНК, гомологичными вирусным, что обеспечит дальнейшее получение полного генома рекомбинантного аденовируса CELO. С этой целью участок ДНК аденовируса с 12657 н.п. (сайт для рестриктазы NdeI) по 19960 н.п. (сайт для рестриктазы BamHI) клонируют в плазмиду pShuttle-CMV («Invitrogen», USA), обработанную эндонуклеазами рестрикции NdeI и DraIII («Fermentas», Латвия) (Т.Маниатис и др. Методы генетической инженерии. Молекулярное клонирование. М.: Мир, 1984). В полученной плазмиде pCELO12-19 проводят клонирование сначала первой части конструкции из плазмиды pGEM-Hind по сайтам NotI и HindIII, а затем второй части конструкции из pGEM-Not по двум сайтам для NotI и таким образом получают плазмиду pCELOHindNot.
Для получения полноразмерного генома рекомбинантного аденовируса необходимо увеличить левое и правое гомологичные плечи минимум до 2000 нуклеотидов. Однако левое плечо необходимо продлить полностью до 1 нуклеотида генома CELO для того, чтобы при гомологичной рекомбинации избежать получения продукта без чужеродной вставки. С этой целью проводят увеличение правого участка гомологии путем клонирования последовательности генома CELO от 19146 до 22653 (сайты для рестриктазы SphI) в плазмиду pCELO-HindNot, обработанные SphI («Fermentas», Латвия). В результате получают плазмидную конструкциию pCELOHNS.
Далее фрагмент конструкции pCELOHNS, содержащий конструкцию в составе участка генома CELO 12657-22653 н.п., после обработки рестриктазами Ndel и Bstll07I клонируют в плазмидном векторе pCDNA 3.1.Zeo+ («Invitrogen», USA), обработанном рестриктазами NdeI и EcoRV («Fermentas», Латвия). В результате получают конструкцию р31N.
Для создания плазмидной конструкции, содержащей уникальный сайт AscI, фланкирующий первый нуклеотид генома CELO, синтезируют олигонуклеотиды, первый из которых 5'-attggcgcgccgatgatgtat-3' кодирует на 5'-конце сайт для узнавания AscI, фланкирующий первый нуклеотид CELO. Обратный праймер 5'-ctacagcacccatacctgtg-3' комплементарен последовательности генома CELO 1260-1280 н.п. В результате ПЦР на матрице ДНК CELO при условиях 94°С - 5 мин; 5 циклов: 58°С - 2 мин, 72°С - 20 с и 94°С - 30 с; 20 циклов: 58°С - 30 с, 72°С - 20 с и 94°С - 30 с; затем 58°С - 5 мин и 72°С - 10 мин, с последующим клонированием продукта в вектор pGEM-T Easy получают конструкцию pGEM1280, которая содержит уникальный сайт AscI, фланкирующий участок генома CELO от 1 до 1280 н.п.
Далее в плазмиде pGEM1280, обработанной рестриктазой MunI (736 н.п. генома CELO), клонируют фрагмент генома CELO MunI (736 н.п.)-MunI (14631 н.п.). В результате получают конструкцию pGEM014, содержащую уникальный сайт AscI, фланкирующий участок генома CELO от 1 до 14631 п.о. Затем фрагмент полученной плазмиды, полученный при ее гидролизе по сайтам для NotI и XhoI, субклонируют в коммерческом векторе pBlueScript KS(II)+(«Invitrogen», USA), обработанном по сайтам для тех же рестриктаз. Таким образом, получают плазмидную конструкцию pBS014, содержащую уникальный сайт AscI, фланкирующий участок генома CELO от 1 до 14631 п.о.
На последнем этапе фрагмент конструкции p31N, содержащий конструкцию в составе участка генома CELO 12657-20028 н.п., полученного после обработки данной плазмиды по двум сайтам для рестриктазы XhoI, клонируют в полученной на предыдущем этапе конструкции pBS014, обработанной по сайтам для той же рестриктазы. В результате получают конструкцию pCELO20HN, содержащую конструкцию в составе участка генома CELO 1-20028 н.п., где первый нуклеотид генома CELO фланкирован уникальным сайтом для узнавания рестриктазой AscI, но без вставки репортерного гена по уникальному сайту SpeI (показана на фиг.1).
Пример 2. Создание второй плазмидной конструкции, содержащей правый фрагмент генома CELO от сайта узнавания рестриктазой NotI (17390 н.п.) до правого инвертированного повтора (последнего нуклеотида генома аденовируса - 43804 н.п.), в котором по месту делеции клонирована экспрессирующая кассета к п.1 формулы изобретения.
Фрагмент генома аденовируса CELO от 36278 н.п. до 40065 н.п. получают путем гидролиза ДНК вируса CELO по сайтам для рестриктаз ClaI и KpnI (№ER0141, ER0521 «Fermentas», Латвия). Клонирование полученного фрагмента проводят в плазмидном векторе pBluescript II KS(+) («Invitrogen», USA) по сайтам для рестриктаз ClaI и KpnI (№ER0141, ER0521 «Fermentas», Латвия) (Т.Маниатис и др. Методы генетической инженерии. Молекулярное клонирование. М.: Мир, 1984). Наличие вставки подтверждают с помощью рестрикционного анализа, используя рестриктазы XhoI и XbaI. Из полученного плазмидного вектора pBS-CELO-R указанный фрагмент аденовирусного генома субклонируют в плазмиде pCBEdlRV (Мол. Генетика, микробиология и вирусология, 2002, №2, стр.30-35), несущей фрагмент генома аденовируса CELO 43685-43804 н.п. по сайтам для рестриктаз KpnI и Есо321. Рестрикционный анализ проводят по сайтам XhoI, XbaI и Есо321. В полученный плазмидный вектор pCBEdlRVnew, который содержит правый фрагмент генома вируса CELO с делецией размером 3787 н.п., по сайту EcoRV клонируют экспрессирующую кассету из плазмиды pcDNA 3.1.Zeo+(Invitrogen, США), гидролизованной по сайтам BglII и PvuII (№ER0081, ER0631 «Fermentas», Латвия) и обработанной фрагментом Кленова (Klenow fragment №ЕР0051 «Fermentas», Латвия). Рестрикционный анализ полученной плазмидной конструкции проводят по сайтам EcoRV и XbaI. Новая плазмидная конструкция pCBEdl3kb содержит экспрессирующую кассету с промотором области Е1 цитомегаловируса человека CMV, полилинкером для клонирования целевых генов (с уникальной рестриктазой SpeI) и сигналом полиаденилирования гена бычьего гормона роста BGH p(A), а также участки генома вируса CELO 36248-40065 н.п. и 43685-43804 н.п., с увеличенным объемом вставки чужеродной ДНК до 3787 н.п.
Данной плазмидой трансфецируют клетки линии LMH совместно с ДНК вируса CELO, гидролизованной рестриктазой Swa I. В результате гомологичной рекомбинации получают рекомбинантный аденовирус птиц CELO-d13 с делецией фрагмента генома размером 3787 н.п. (таким образом, емкость вектора увеличивают до 5100 н.п.).
Плазмиду pCELO, содержащую полноразмерный геном аденовируса птиц CELO, фланкированный сайтами для эндонуклеазы рестрикции Pacl, гидролизуют по сайту NotI и частично гидролизуют по сайту Pacl, затем проводят лигирование. В результате получают плазмиду pCELO-Not-43804, содержащую геном вируса CELO от 17390 н.п. (сайт для NotI) до 43804 н.п. Методом гомологичной рекомбинации в Е. coli между плазмидой pCELO-Not-43804, линеаризованной по сайту для ApaLI, и геномной ДНК вируса CELO-dl3, гидролизованной по сайту для Ndd, получают плазмидную конструкцию pCELOdl3right. Данная конструкция изображена на фиг.2, содержит фрагмент генома вируса CELO от сайта NotI до 43804 н.п., причем правый инвертированный повтор фланкирован единичной рестриктазой Pacl. Также данная плазмида содержит экспрессирующую кассету в области делеции генома CELO с уникальной рестриктазой Spel. (показана на фиг.2).
Пример 3. Получение рекомбинантного аденовируса птиц CELO, содержащего две экспрессирующие кассеты - с промотором аденовируса MLP и с экзогенным промотором к п.1 формулы изобретения.
Плазмидную конструкцию pCELO20HN по примеру 1, содержащую участок генома вируса CELO от 1 до 20028 н.п.и единичный сайт для эндонуклеазы рестрикции AscI, гидролизуют с помощью рестриктазы AscI, а плазмидную конструкцию pCELOdl3right по примеру 2 гидролизуют с помощью рестриктазы Pacl («Fermentas», Латвия). Затем обе конструкции котрансфицируют в клетки гепатомы петуха леггорн LMH методом кальциево-фосфатной преципитации (J. Gen. Virol., 1977). В результате гомологичной рекомбинации, которая показана на фиг.3, между фрагментом вирусного генома CELO 17882-20028 н.п.из первой конструкции и аналогичным фрагментом из другой конструкции в клетках LMH получают полный рекомбинантный аденовирус CELO (фиг.4), рекомбинантность которого подтверждают с помощью метода ПЦР.
Пример 4. Конструирование рекомбинантных аденовирусов CELON-chIFNγ/dl3 и CELONdl3-chIFN, несущих ген γ-интерферона птиц, и исследование противовирусной активности in vitro к пп.2-3 формулы изобретения.
Ген γ-интерферона птиц получают в результате ПЦР на матрице ДНК генома курицы. Для синтеза кДНК используют пару праймеров IFN-F 5'-catgaaggacagcactaagg-3' и IFN-R 5'-aatagttagtcttctattag-3', подобранных на концы гена согласно последовательности GENE-Bank №АН009942 (Gallus gallus interferon gamma, complete cds). В результате ПЦР при условиях 94°С - 5 мин; 5 циклов: 58°С - 2 мин, 72°С - 20 с и 94°С - 30 с; 20 циклов: 58°С - 30 с, 72°С - 20 с и 94°С - 30 с; затем 58°С - 5 мин и 72°С - 10 мин получают кДНК гена γ-интерферона, которую затем клонируют в вектор pGEM-T Easy («Promega», Cat. No A1360). Таким образом, получают плазмиду pGEM-γIFN. Химический синтез олигодезоксирибонуклеотидов проводят твердофазным аминофосфитным методом с помощью синтезатора АСМ 100-2 (Новосибирск). Очистку проводят электрофорезом в 12%-ном ПААГ.
На следующем этапе из полученной плазмиды pGEM-γIFN, обработанной эндонуклеазой рестрикции NotI (№ER0592 «Fermentas», Латвия) и фрагментом Кленова (№ЕР0052 «Fermentas», Латвия), проводят клонирование гена γIFN в плазмидной конструкции pCELOdl3right по примеру 2, гидролизованной по сайту SpeI (№ER1251 «Fermentas», Латвия) и обработанной фрагментом Кленова. В результате получают плазмидную конструкцию pCELOdl3-chIFNγ, несущую фрагмент генома вируса птиц CELO, где в области делеции генома содержится экспрессирующая кассета с геном γ-интерферона птиц. Далее, данной плазмидой, обработанной рестиктазой Pacl (№K0547R «New England BioLabs», США), и плазмидой pCELO20HN, обработанной рестиктазой AscI (№R0558S «New England BioLabs», США), котрансфецируют клетки линии LMH. Таким образом, в результате гомологичной рекомбинации в клетках линии LMH получают рекомбинантный аденовирус птиц CELONdl3-chIFN, несущий ген γ-интерферона птиц под контролем промотора CMV.
Также из полученной плазмиды pGEM-γIFN, обработанной эндонуклеазой рестрикции NotI (№ER0592 «Fermentas», Латвия) и фрагментом Кленова (№ЕР0052 «Fermentas», Латвия), ген γ-интерферона γIFN клонируют в плазмидной конструкции pCELO20HN по примеру 1, гидролизованной по сайту SpeI (№ER1251 «Fermentas», Латвия) и обработанной фрагментом Кленова. В результате получают плазмидную конструкцию pCELO20HN-chIFNγ, несущую фрагмент генома вируса птиц CELO и ген IFNγ птиц под контролем промотора MLP. Далее, данной плазмидой, обработанной рестиктазой AscI, и плазмидой pCELOdl3right, обработанной рестиктазой PacI, котрансфецируют клетки линии LMH. В результате гомологичной рекомбинации в клетках линии LMH получают рекомбинантный аденовирус птиц CELON-chIFNγ/dl3, несущий ген γ-интерферона птиц под контролем промотора MLP.
На следующем этапе проводят исследование противовирусной активности препаратов культуральной жидкости, содержащей alFNγ. Для этого вирусами CELON-chIFNγ/d13, CELONd13-chIFN и CELO дикого типа (в качестве отрицательного контроля) инфицируют клетки линии LMH в дозе 5 БОЕ/кл. Через 72 часа после инфекции отбирают культуральную среду. Исследование противовирусной активности препаратов проводят по стандартной методике титрования интерферона на культуре клеток птицы. В качестве индикаторного тест-вируса используют вирус энцефаломиокардита мышей. В результате анализа выявлено, что культуральная среда клеток, инфицированных вирусом CELO дикого типа, не обладает противовирусной активностью. Противовирусная активность опытных образцов - культуральной среды клеток, инфицированных вирусом CELON-chIFNγ/dl3 и CELONdl3-chIFN, составляет 1·104 МЕ/мл и 1,2·104 МЕ/мл.
Пример 5. Конструирование рекомбинантного аденовируа, несущего гены γ-интерферона птиц одновременно под контролем собственного промотора аденовируса и под контролем экзогенного промотора, и исследование противовирусной активности к пп.4-5 формулы изобретения.
Плазмидой, pCELOdl3-chIFNγ, несущей фрагмент генома вируса птиц CELO, где в области делеции генома содержится экспрессирующая кассета с геном γ-интерферона птиц, обработанной рестиктазой PacI (№R0547S «New England BioLabs», США), и плазмидой pCELO20HN-chIFNγ по примеру 4, несущей фрагмент генома вируса птиц CELO и ген IFNγ птиц под контролем промотора MLP, обработанной рестиктазой AscI (№R0558S «New England BioLabs», США), котрансфецируют клетки линии LMH. Таким образом, в результате гомологичной рекомбинации в клетках линии LMH получают рекомбинантный аденовирус птиц CELON-chIFN/dl3-chIFN, несущий ген γ-интерферона птиц под контролем промотора CMV и под контролем промотора MLP.
На следующем этапе проводят исследование противовирусной активности препаратов культуральной жидкости, содержащей aIFNγ. Для этого вирусами CELON-chIFN/d13-chIFN и CELO дикого типа (в качестве отрицательного контроля) инфицируют клетки линии LMH в дозе 5 БОЕ/кл. Через 72 часа после инфекции отбирают культуральную среду. Исследование противовирусной активности препаратов проводят по стандартной методике титрования интерферона на культуре клеток птицы. В качестве индикаторного тест-вируса используют вирус энцефаломиокардита мышей. В результате анализа выявлено, что культуральная среда клеток, инфицированных вирусом CELO дикого типа, не обладает противовирусной активностью. Противовирусная активность опытного образца - культуральной среды клеток, инфицированных вирусом CELON-chIFN/dl3-chIFN, составляет 2,8·104 МЕ/мл.
Пример 6. Конструирование рекомбинантного аденовируса CELONd13-IFNα16, несущего ген α16-интерферона человека под контролем экзогенного промотора к пп.6, 7 формулы изобретения.
Ген α16-интерферона человека получают методом ПЦР на матрице ДНК генома человека. Для синтеза кДНК используют пару праймеров, подобранных на концы гена согласно последовательности GENE-Bank №NM002173 (Homo sapiens interferon, alpha 16 (IFNA16), mRNA). Полученную кДНК гена α16-интерферона клонируют в плазмидном векторе pGEM-T Easy («Promega», Cat. No A1360). На следующем этапе из полученной плазмиды pGEM-α16IFN, обработанной эндонуклеазой рестрикции NotI (№ER0592 «Fermentas», Латвия) и фрагментом Кленова (№ЕР0052 «Fermentas», Латвия), ген α16IFN клонируют в плазмидной конструкции pCELOd13right по примеру 2, гидролизованной по сайту Spel (№ER1251 «Fermentas», Латвия) и обработанной фрагментом Кленова. В результате получают плазмидную конструкцию pCELOd13-IFNα16 с фрагментом генома вируса птиц CELO, где в области делеции генома содержится экспрессирующая кассета с геном IFNα16 человека.
Данной плазмидой, обработанной рестиктазой PacI (№R0547S «New England BioLabs», США), и плазмидой pCELO20HN, обработанной рестиктазой AscI (№R0558S «New England BioLabs», США), котрансфецируют клетки линии LMH. Таким образом, в результате гомологичной рекомбинации в клетках линии LMH, получают рекомбинантный аденовирус птиц CELONdB-IFNα16, несущий ген α16-интерферона человека под контролем экзогенного промотора CMV.
Пример 7. Конструирование рекомбинантного аденовируса CELONd13-IFNα-2α, несущего ген α-интерферона α-2а человека под контролем экзогенного промотора к пп.6, 8 формулы изобретения.
Ген α-интерферона α-2а клонируют из плазмиды pORF-hIFN-α («Invivogen», Cat. code porf-hifna), гидролизованной по сайтам для эндонуклеаз рестрикции NcoI (№ER0571 «Fermentas», Латвия) и NheI (№ER0971 «Fermentas», Латвия), с последующей обработкой фрагментом Кленова (№ЕР0052 «Fermentas», Латвия), в плазмидной конструкции pCELOdl3right по примеру 2, гидролизованной по сайту SpeI (№ER1251 «Fermentas», Латвия) и обработанной фрагментом Кленова. В результате получают плазмидную конструкцию pCELOdl3-IFNα-2a с фрагментом генома вируса птиц CELO, где в области делеции генома содержится экспрессирующая кассета с геном IFNα-2a.
Данной плазмидой, обработанной рестиктазой PacI (№R0547S «New England BioLabs», США), и плазмидой pCELO20HN по примеру 1, обработанной рестиктазой AscI (№R0558S «New England BioLabs», США), котрансфецируют клетки линии LMH. В результате гомологичной рекомбинации в клетках линии LMH получают рекомбинантный аденовирус птиц CELONdl3-IFNα-2a, несущий ген α-интерферона α-2а человека под контролем экзогенного промотора.
Пример 8. Конструирование рекомбинантного аденовируса CELONd13-IFNβ, несущего ген β-интерферона человека под контролем экзогенного промотора, к пп.6, 9 формулы изобретения.
Ген β-интерферона клонируют из плазмиды pORF-hINF-β («Invivogen», Cat. code porf-hifnb), гидролизованной по сайтам для эндонуклеаз рестрикции AgeI (№ER1461 «Fermentas», Латвия) и NheI (№ER0971 «Fermentas», Латвия), с последующей обработкой фрагментом Кленова (№ЕР0052 «Fermentas», Латвия), в плазмидной конструкции pCELOdl3right по примеру 2, гидролизованной по сайту SpeI (№ER1251 «Fermentas», Латвия) и обработанной фрагментом Кленова. В результате получают плазмидную конструкцию pCELOdl3-IFNβ с фрагментом генома вируса птиц CELO, где в области делеции генома содержится экспрессирующая кассета с геном IFN β.
Далее, данной плазмидой, обработанной рестиктазой PacI (№R0547S «New England BioLabs», США), и плазмидой pCELO20HN по примеру 1, обработанной рестиктазой AscI (№R0558S «New England BioLabs», США), котрансфецируют клетки линии LMH. В результате гомологичной рекомбинации в клетках линии LMH получают рекомбинантный аденовирус птиц CELONdl3-IFNβ, несущий ген β-интерферона человека.
Пример 9. Конструирование рекомбинантного аденовируса CELONdl3-IFNγ, несущего ген γ-интерферона человека, к пп.6, 10 формулы изобретения.
Ген γ-интерферона человека клонируют из плазмиды pORF-hINF-γ («Invivogen», Cat. code porf-hifng), гидролизованной по сайтам для эндонуклеаз рестрикции SgrAI (№R0603S «New England BioLabs», США) и NheI (№ER0971 «Fermentas», Латвия), с последующей обработкой фрагментом Кленова (№ЕР0052 «Fermentas», Латвия), в плазмидной конструкции pCELOdl3right по примеру 2, гидролизованной по сайту SpeI (№ER1251 «Fermentas», Латвия) и обработанной фрагментом Кленова. В результате получают плазмидную конструкцию pCELOdl3-IFNγ, несущую фрагмент генома вируса птиц CELO, где в области делеции генома содержится экспрессирующая кассета с геном IFNγ.
Данной плазмидой, обработанной рестиктазой PacI (№R0547S «New England BioLabs», США), и плазмидой pCELO20HN по примеру 1, обработанной рестиктазой AscI (№R0558S «New England BioLabs», США), котрансфецируют клетки линии LMH. В результате гомологичной рекомбинации в клетках линии LMH получают рекомбинантный аденовирус птиц CELONdl3-IFNγ, несущий ген γ-интерферона человека под контролем экзогенного промотора.
Пример 10. Конструирование рекомбинантного аденовируса CELONdl3-GMCSF, несущего ген гранулоцитарно-макрофагального колониестимулирующего фактора GMCSF человека под контролем экзогенного промотора, к пп.6, 11 формулы изобретения.
Ген GMCSF клонируют из плазмиды pORF-hGMCSF («Invivogen», Cat. code porf-hgmcsf), гидролизованной по сайтам для эндонуклеаз рестрикции SgrAI (№R0603S «New England BioLabs», США) и NheI (№ER0971 «Fermentas», Латвия), с последующей обработкой фрагментом Кленова (№ЕР0052 «Fermentas», Латвия), в плазмидной конструкции pCELOdl3right по примеру 2, гидролизованной по сайту SpeI (№ER1251 «Fermentas», Латвия) и обработанной фрагментом Кленова. В результате получают плазмидную конструкцию pCELOd13-GMCSF, несущую фрагмент генома вируса птиц CELO, где в области делеции генома содержится экспрессирующая кассета с геном GMCSF.
Данной плазмидой, обработанной рестиктазой PacI (№R0547S «New England BioLabs», США), и плазмидой pCELO20HN, обработанной рестиктазой AscI (№R0558S «New England BioLabs», США), котрансфецируют клетки линии LMH. В результате гомологичной рекомбинации в клетках линии LMH получают рекомбинантный аденовирус птиц CELONd13-GMCSF, несущий ген гранулоцитарно-макрофагального колониестимулирующего фактора GMCSF человека под контролем экзогенного промотора.
Пример 11. Конструирование рекомбинантного аденовируса CELONdl3-IL-2, несущего ген интерлейкина-2 человека под контролем экзогенного промотора, к пп.6, 12 формулы изобретения.
Ген интерлейкина-2 человека клонируют из плазмиды pORF-hIL-2 («Invivogen», Cat. code porf-hiI2), гидролизованной по сайтам для эндонуклеаз рестрикции SgrAI (№ R0603S «New England BioLabs», США) и NheI (№ ER0971 «Fermentas», Латвия), с последующей обработкой фрагментом Кленова (№ ЕР0052 «Fermentas», Латвия), в плазмидной конструкции pCELOd13right, гидролизованной по сайту SpeI (№ ER1251 «Fermentas», Латвия) и обработанной фрагментом Кленова. В результате получают плазмидную конструкцию pCELOdl3-IL-2, несущую фрагмент генома вируса птиц CELO, где в области делеции генома содержится экспрессирующая кассета с геном IL-2 человека.
Данной плазмидой, обработанной рестиктазой PacI (№R05478 «New England BioLabs», США), и плазмидой pCELO20HN, обработанной рестиктазой AscI (№ R0558S «New England BioLabs», США), котрансфецируют клетки линии LMH. В результате гомологичной рекомбинации в клетках линии LMH получают рекомбинантный аденовирус птиц CELONdl3-IL-2, несущий ген интерлейкина-2 человека под контролем экзогенного промотора.
Пример 12. Конструирование рекомбинантного аденовируса CELONdl3-IGF1, несущего ген инсулиноподобного фактора роста IGF1 человека, к пп.13, 14 формулы изобретения.
Ген инсулиноподобного фактора роста 1, IGF1 клонируют из плазмиды pBLAST49-hIGF1A («Invivogen», Cat. code pbla-higfa), гидролизованной по сайтам для эндонуклеаз рестрикции NcoI (№ ER0571 «Fermentas», Латвия) и NheI (№ ER0971 «Fermentas», Латвия), с последующей обработкой фрагментом Кленова (№ ЕР0052 «Fermentas», Латвия), в плазмидной конструкции pCELOdl3right, гидролизованной по сайту SpeI (№ ER1251 «Fermentas», Латвия) и обработанной фрагментом Кленова. В результате получают плазмидную конструкцию pCELOdl3-IGF1, несущую фрагмент генома вируса птиц CELO, где в области делеции генома содержится экспрессирующая кассета с геном IGF1.
Данной плазмидой, обработанной рестиктазой PacI (№ K0547S «New England BioLabs», США), и плазмидой pCELO20HN, обработанной рестиктазой AscI (№ R0558S «New England BioLabs», США), котрансфецируют клетки линии LMH. В результате гомологичной рекомбинации в клетках линии LMH получают рекомбинантный аденовирус птиц CELONd13-IGF1, несущий ген инсулиноподобного фактора роста 1, IGF1 человека.
Пример 13. Конструирование рекомбинантного аденовируса CELONdl3-VEGF, несущего ген фактора роста эндотелия сосудов VEGF человека под контролем экзогенного промотора, к пп.13, 15 формулы изобретения.
Ген фактора роста эндотелия сосудов VEGF клонируют из плазмиды pBLAST49-hVEGF («Invivogen», Cat. code pbla-hvegf), гидролизованной по сайтам для эндонуклеаз рестрикции AgeI (№ ER1461 «Fermentas», Латвия) и NheI (№ ER0971 «Fermentas», Латвия), с последующей обработкой фрагментом Кленова (№ ЕР0052 «Fermentas», Латвия), в плазмидной конструкции pCELOdl3right, гидролизованной по сайту SpeI (№ ER1251 «Fermentas», Латвия) и обработанной фрагментом Кленова. В результате получают плазмидную конструкцию pCELOdl3-VEGF, несущую фрагмент генома вируса птиц CELO, где в области делеции генома содержится экспрессирующая кассета с геном VEGF.
Данной плазмидой, обработанной рестиктазой PacI (№ R0547S «New England BioLabs», США), и плазмидой pCELO20HN, обработанной рестиктазой AscI (№ R0558S «New England BioLabs», США), котрансфецируют клетки линии LMH. В результате гомологичной рекомбинации в клетках линии LMH получают рекомбинантный аденовирус птиц CELONdl3-VEGF, несущий ген фактора роста эндотелия сосудов VEGF человека под контролем экзогенного промотора.
Пример 14. Конструирование рекомбинантного аденовируса CELONdl3-GDNF, несущего ген нейротрофического фактора глиальных клеток GDNF человека под контролем экзогенного промотора, к пп.13, 16 формулы изобретения.
Ген нейротрофического фактора глиальных клеток GDNF клонируют из плазмиды pBLAST49-hGDNFa («Invivogen», Cat. code pbla-hgdfna), гидролизованной по сайтам для эндонуклеаз рестрикции BspHI (№ ER1281 «Fermentas», Латвия) и NheI (№ ER0971 «Fermentas», Латвия), с последующей обработкой фрагментом Кленова (№ ЕР0052 «Fermentas», Латвия), в плазмидной конструкции pCELOdl3right, гидролизованной по сайту SpeI (№ER1251 «Fermentas», Латвия) и обработанной фрагментом Кленова. В результате получают плазмидную конструкцию pCELOd13-GDNF, несущую фрагмент генома вируса птиц CELO, где в области делеции генома содержится экспрессирующая кассета с геном GDNF.
Данной плазмидой, обработанной рестиктазой PacI (№ R0547S «New England BioLabs», США), и плазмидой pCELO20HN, обработанной рестиктазой AscI (№ R0558S «New England BioLabs», США), котрансфецируют клетки линии LMH. В результате гомологичной рекомбинации в клетках линии LMH получают рекомбинантный аденовирус птиц CELONdI3-GDNF, несущий ген нейротрофического фактора глиальных клеток GDNF человека под контролем экзогенного промотора.
Пример 15. Конструирование рекомбинантного аденовируса CELONd13-ТК, несущего ген тимидинкиназы вируса HSV1 под контролем экзогенного промотора, к пп.17, 18 формулы изобретения.
Ген тимидинкиназы вируса HSV1 клонируют из плазмиды pORF-HSVltk («Invivogen», Cat. code pmod-tk), гидролизованной по сайтам для эндонуклеаз рестрикции NcoI (№ER 0571 «Fermentas», Латвия) и NheI (№ ER0971 «Fermentas», Латвия), с последующей обработкой фрагментом Кленова (№ ЕР0052 «Fermentas», Латвия), в плазмидной конструкции pCELOd13 right, гидролизованной по сайту SpeI (№ ER 1251 «Fermentas», Латвия) и обработанной фрагментом Кленова. В результате получают плазмидную конструкцию pCELOd13-TK, несущую фрагмент генома вируса птиц CELO, где в области делеции генома содержится экспрессирующая кассета с геном тимидинкиназы вируса HSV1.
Данной плазмидой, обработанной рестиктазой PacI (№ R0547S «New England BioLabs», США), и плазмидой pCELO20HN, обработанной рестиктазой AscI (№ R0558S «New England BioLabs», США), котрансфецируют клетки линии LMH. В результате гомологичной рекомбинации в клетках линии LMH получают рекомбинантный аденовирус птиц CELONd13-ТК, несущий ген тимидинкиназы вируса HSV1 под контролем экзогенного промотора.
Пример 16. Конструирование рекомбинантного аденовируса CELONdl3-p53, несущего ген р53 человека под контролем экзогенного промотора, и определение его противоопухолевой активности к пп.17, 19 формулы изобретения.
Ген р53 человека клонируют из плазмиды pORF-hp53 («Invivogen», Cat. code porf-hp53), гидролизованной по сайтам для эндонуклеаз рестрикции AgeI (№ ER1461 «Fermentas», Латвия) и NheI (№ ER0971 «Fermentas», Латвия), с последующей обработкой фрагментом Кленова, в плазмидной конструкции pCELOd13right, гидролизованной по сайту SpeI (№ ER1251 «Fermentas», Латвия) и обработанной фрагментом Кленова (№ ЕР0052 «Fermentas», Латвия). Полученная плазмидная конструкция pCELOdl3-p53 содержит фрагмент генома вируса птиц CELO, где в области делеции генома находится экспрессирующая кассета с геном р53 человека.
Данной плазмидой, обработанной рестиктазой PacI (№ R0547S «New England BioLabs», США), и плазмидой pCELO20HN, обработанной рестиктазой AscI (№ R0558S «New England BioLabs», США), котрансфецируют клетки линии LMH. В результате гомологичной рекомбинации в клетках линии LMH получают рекомбинантный аденовирус птиц CELONdl3-р53, несущий ген р53 человека.
Далее двум группам мышей (по 10 мышей в группе) производится подкожная инъекция опухолевых клеток A431/waflConALacZ. Первой группе совместно с опухолевыми клетками вводится рекомбинантный аденовирус птиц CELONdl3-р53 в дозе 109 БОЕ/мышь. Второй группе вирус не вводится (контрольная группа). Через 14 дней после инъекций производится измерение объема опухоли. Размер опухоли у мышей контрольной группы в 4 раза больше по сравнению с объемом опухоли мышей, которым был введен вирус CELONdl3-р53.
Пример 17. Конструирование рекомбинантных аденовирусов CELONdl3-Ag85A, CELONdl3-Ag85B, CELONdl3-ESAT6, несущих гены протективных антигенов Mycobacterium tuberculosis под контролем экзогенного промотора, к пп.20, 21, 22, 23 формулы изобретения. Детекция экспрессии гена Ag85B in vitro после заражения соответствующим рекомбинантным аденовирусом клеток.
Гены антигенов М. tuberculosis Ag85A, Ag85B, ESAT6 получают методом ПЦР при условии 94°С - 5 мин; 5 циклов: 58°С - 2 мин, 72°С - 20 с и 94°С - 30 с; 20 циклов: 58°С - 30 с, 72°С - 20 с и 94°С - 30 с; затем 58°С - 5 мин и 72°С - 10 мин, где в качестве матрицы используют геномную ДНК М. tuberculosis. Для каждого антигена используют пару праймеров tub-F 5'-atgacagacgtgagccgaaa-3 и tub-R 5'-tcagccggcgcctaacgaactct-3, подобранных на концы гена согласно последовательности GENE-Bank BX842579 ДНК М.tuberculosis штамма H37Rv. Каждый из ПЦР-продуктов, кодирующих гены вышеуказанных антигенов, клонируют в плазмиду pGEM-T Easy («Promega», Cat. No A1360). Из полученных плазмид pGEM-Ag85A, pGEM-Ag85B и pGEM-ESAT6, обработанных эндонуклеазой рестрикции NotI (№ ER0592 «Fermentas», Латвия) и фрагментом Кленова (№ ЕР0052 «Fermentas», Латвия), гены антигенов клонируют в плазмидной конструкции pCELOdl3right по примеру 2, гидролизованной по сайту SpeI (№ ER1251 «Fermentas», Латвия) и обработанной фрагментом Кленова. В результате получают плазмидные конструкции pCELOdl3-Ag85A, pCELOdl3-Ag85B и pCELOdl3-ESAT6, несущие фрагмент генома вируса птиц CELO, где в области делеции генома содержится экспрессирующая кассета с геном протективного антигена М tuberculosis Ag85A, Ag85B и ESAT6 соответственно.
Данными плазмидами, обработанными рестиктазой PacI (№ R0547S «New England BioLabs», США), и плазмидой pCELO20HN, обработанной рестиктазой AscI (№ R0558S «New England BioLabs», США), котрансфецируют клетки линии LMH. В результате гомологичной рекомбинации в клетках линии LMH получают рекомбинантные аденовирусы птиц CELONdl3-Ag85A, CELONdl3-Ag85B, CELONdl3-ESAT6 несущие гены протективных антигенов М.tuberculosis Ag85A, Ag85B и ESAT6 соответственно.
На следующем этапе проводят детекцию экспрессии гена протективного антигена М.tuberculosis Ag85B при инфекции клеток вирусом CELONdl3-Ag85B in vitro.
Для этого вирусами CELONdl3-Ag85B и CELO дикого типа (в качестве отрицательного контроля) инфицируют клетки линии LMH в дозе 5 БОЕ/кл. Через 48 часов после инфекции клетки обрабатывают лизирующим буфером (0,05 М Tris HCl ph 7,2; 0,15 М NaCl; 0,1% SDS; 0,1% Dezoxycholat Na; 0,1% Triton X100, 1 mM DTT, ингибитор протеаз) для детекции экспрессии гена протективного антигена М. tuberculosis Ag85B в цитоплазматической фракции клеток методом Western blotting с использованием моноклональных антител, полученных к белку ag85B M. tuberculosis. В результате выявлено, что рекомбинантный белок ag85B по своим антигенным свойствам и молекулярному весу соответствует белку ag85B М. tuberculosis.
Пример 18. Конструирование рекомбинантного аденовируса CELONdl3-Ag85AB, несущего гены протективных антигенов Mycobacterium tuberculosis под контролем экзогенного промотора, и выявление его иммунного эффекта к пп.24-25 формулы изобретения.
Из полученной плазмиды pGEM-Ag85A, обработанной эндонуклеазой рестрикции EcoRI, ген Ag85A M.tuberculosis клонируют в плазмидную конструкцию pIRES («Clontech», № 631605), обработанную той же эндонуклеазой рестрикции. В результате получают плазмидную конструкцию pIRES-Ag85A, к которую после ее обработки эндонуклеазой рестрикции NotI клонируют ген Ag85B из полученной ранее плазмиды pGEM-Ag85B. Таким образом создают плазмиду pIRES-Ag85AB, несущую IRES и гены Ag85A, Ag85B M.tuberculosis. Далее фрагмент плазмиды pIRES-Ag85AB, состоящий из двух генов (Ag85A, Ag85B) и IRES, полученный в результате обработки данной плазмиды эндонуклеазами рестрикции NheI и NotI («Fermentas», Латвия), а также фрагментом Кленова, клонируют в плазмиду pCELOdl3right, гидролизованную по сайту SpeI (№ ER1251 «Fermentas», Латвия) и обработанную фрагментом Кленова.
В результате получают плазмидную конструкцию pCELOd13-Ag85AB, несущую фрагмент генома вируса птиц CELO, где в области делеции генома содержится экспрессирующая кассета с генами протективных антигенов M. tuberculosis Ag85A и Ag85B. Данной плазмидой, обработанной рестиктазой Pad (№ R0547S «New England BioLabs», США), и плазмидой pCEL020HN, обработанной рестиктазой AscI (№ R0558S «New England BioLabs», США), котрансфецируют клетки линии LMH. В результате гомологичной рекомбинации в клетках линии LMH получают рекомбинантный аденовирус птиц CELONd13-Ag85AB, несущий гены протективных антигенов M. tuberculosis Ag85A и Ag85B под контролем экзогенного промотора CMV.
Для повышения протективной функции вакцины BCG против туберкулеза, представляющей собой непатогенный штамм M.tuberculosis, двум группам мышей (по 15 мышей в каждой группе) вводится 50000 КОЕ/мышь вакцинного штамма BCG, через 8 недель одной группе мышей вводится рекомбинантный аденовирус птиц CELONd13-Ag85AB в дозе 109 БОЕ/мышь. Через 12 недель после введения BCG обе группы мышей аэрозольно инфицируют патогенным штаммом M. tuberculosis в дозе 109 КОЕ/мышь. Через 4 недели после инфекции производят высев M. tuberculosis из селезенки и легкого мышей обеих групп. Количество колоний, образованных M. tuberculosis, высеянной из группы мышей, которым вводился вирус CELONd13-Ag85AB, в 4 раза меньше, чем в контрольной группе, где инфекция вирусом CELONd1l3-Ag85AB не производилась.
Пример 19. Конструирование рекомбинантного аденовируса CELONd13-hex, несущего ген гексона вируса птиц ССЯ-76 под контролем экзогенного промотора, к пп.26, 27 формулы изобретения.
Ген гексона вируса птиц ССЯ-76 получают с помощью ПЦР на матрице ДНК генома вируса ССЯ-76 (Gene bank № Z86065, U63515) при условиях 94°С - 5 мин; 5 циклов: 58°С - 2 мин, 72°С - 20 с и 94°С - 30 с; 20 циклов: 58°С - 30 с, 72°С - 20 с и 94°С - 30 с; затем 58°С - 5 мин и 72°С - 10 мин, с использованием праймеров hex-F 5'-tgttacagatgaagcgactacgg-3 и hex-R 5'-caaagtctactgtgctccaac-3. Полученную кДНК гена гексона клонируют в плазмидном векторе pGEM-T Easy («Promega», Cat. No A1360). На следующем этапе из полученной плазмиды pGEM-hex, обработанной эндонуклеазой рестрикции NotI (№ ER0592 «Fermentas», Латвия) и фрагментом Кленова (№ ЕР0052 «Fermentas», Латвия), ген гексона hex клонируют в плазмидной конструкции pCELOd13right, гидролизованной по сайту SpeI (№ ER1251 «Fermentas», Латвия) и обработанной фрагментом Кленова. В результате получают плазмидную конструкцию pCELOd13-hex, несущую фрагмент генома вируса птиц CELO, где в области делеции генома содержится экспрессирующая кассета с геном гексона hex вируса птиц ССЯ-76.
Данной плазмидой, обработанной рестиктазой PacI (№ R0547S «New England BioLabs», США), и плазмидой pCEL020HN, обработанной рестиктазой AscI (№ R0558S «New England BioLabs», США), проводят котрансфекцию клеток линии LMH. В результате гомологичной рекомбинации в клетках линии LMH получают рекомбинантный аденовирус птиц CELONd13-hex, несущий ген гексона вируса птиц ССЯ-76 под контролем экзогенного промотора CMV.
Пример 20. Конструирование рекомбинантных аденовирусов CELOHNd13-fiber, CELOHN-fiber, несущих ген отростка пентона (фибера) вируса птиц ССЯ-76 под контролем промоторов CMV и MLP соответственно к пп.26, 28 формулы изобретения.
Ген отростка пентона (фибера) вируса синдрома снижения яйценоскости кур ССЯ-76 получают методом ПЦР с использованием в качестве матрицы ДНК генома вируса ССЯ-76 (Gene bank № Z86065, U63515) при условиях 94°С - 5 мин; 5 циклов: 58°С - 2 мин, 72°С - 20 с и 94°С - 30 с; 20 циклов: 58°С - 30 с, 72°С - 20 с и 94°С - 30 с; затем 58°С - 5 мин и 72°С - 10 мин, с использованием праймеров: fib-F 5'-ggaggcattgggatcgtctcg-3, fib-R 5'-gattactcaatcagctttgggaa-3. Полученную кДНК гена фибера клонируют в плазмидном векторе pGEM-T Easy («Promega», Cat. No A1360).
Из полученной плазмиды pGEM-fiber, обработанной эндонуклеазой рестрикции NotI (№ ER0592 «Fermentas», Латвия) и фрагментом Кленова (№ ЕР0052 «Fermentas», Латвия), ген фибера клонируют в плазмидной конструкции pCELOd13right, гидролизованной по сайту SpeI (№ ER 1251 «Fermentas», Латвия) и обработанной фрагментом Кленова. В результате получают плазмидную конструкцию pCELOd13-fiber, несущую фрагмент генома вируса птиц CELO, где в области делеции генома содержится экспрессирующая кассета с геном фибера fiber вируса птиц ССЯ-76.
Данной плазмидой, обработанной рестиктазой PacI (№ R0547S «New England BioLabs», США), и плазмидой pCELO20HN, обработанной рестиктазой AscI (№ R0558S «New England BioLabs», США), проводят котрансфекцию клеток линии LMH. В результате гомологичной рекомбинации в клетках линии LMH получают рекомбинантный аденовирус птиц CELOHNdl3-fiber, несущий ген отростка пентона-фибера (fiber) вируса птиц ССЯ-76 под контролем промотора CMV.
Также из полученной плазмиды pGEM-fiber, обработанной эндонуклеазой рестрикции NotI (№ ER0592 «Fermentas», Латвия) и фрагментом Кленова (№ ЕР0052 «Fermentas», Латвия), ген отростка пентона (фибера) был клонирован в плазмидную конструкцию pCELO20HN, гидролизованную по сайту SpeI (№ ER1251 «Fermentas», Латвия) и обработанную фрагментом Кленова. В результате была получена плазмидная конструкция pCELO20HN-fiber, несущая фрагмент генома вируса птиц CELO и ген отростка пентона (фибера) вируса птиц ССЯ-76 под контролем промотора MLP.
Далее, данной плазмидой, обработанной рестиктазой AscI, и плазмидой pCELOd13right, обработанной рестиктазой PacI, были котрансфецированы клетки линии LMH. Таким образом, в результате гомологичной рекомбинации в клетках линии LMH был получен рекомбинантный аденовирус птиц CELOHN-fiber, несущий ген отростка пентона fiber вируса птиц ССЯ-76 под контролем промотора MLP.
Пример 21. Конструирование рекомбинантного аденовируса CELOHN-fib/dI3-fib, несущего гены отростка пентона (фибера) вируса птиц ССЯ-76 под контролем промоторов MLP и CMV, и выявление уровня иммунизации in ovo при его использовании к пп.29, 30 формулы изобретения. В результате гомологичной рекомбинации в клетках линии LMH при их котрансфекции плазмидными конструкциями pCELO20HN-fiber, обработанной рестиктазой AscI, и pCELOd13-fiber, обработанной рестиктазой PacI (по примеру 20), был получен вирус CELOHN-fib/dl3-fib, несущий ген отростка пентона (фибера) вируса птиц ССЯ-76 под контролем промотора MLP и ген отростка пентона (фибера) вируса птиц ССЯ-76 под контролем промотора CMV.
Для выяснения увеличения влияния дозы вносимого целевого гена на уровень специфических антител проводят инфекцию цыплят в возрасте трех недель вирусами CELOHNd13-fiber и CELOHN-fib/d13-fib. Первой группе вводят вирус CELOHNd13-fiber (по примеру 20), второй группе - CELOHN-fib/d13-fib, третьей группе - вирус CELO дикого типа. Все препараты вирусов вводятся дозе 108 БОЕ/особь. Через 3 недели после инфекции в сыворотке крови цыплят всех трех групп проводят исследование уровня специфических антител к вирусу ССЯ-76 методом ИФА («Набор для определения антител к вирусу синдрома снижения яйценоскости-76 (ССЯ-76) иммуноферментным методом», ФГУ ВНИИЗЖ). В сыворотке крови цыплят, инфицированных вирусом CELO дикого типа, антител не обнаруживают. В сыворотке крови цыплят инфицированных вирусом CELOHNd13-fiber титр антител составляет 1:64, а инфицированных CELOHN-fib/d13-fib - 1:128.
Пример 22. Конструирование рекомбинантного аденовируса CELOHN-aIFNγ/d13-fib, несущего гены интерферона у птиц и отростка пентона (фибера) вируса птиц ССЯ-76 под контролем промоторов MLP и CMV соответственно, и определение его противовирусной активности к пп.31, 32 формулы изобретения.
Плазмидной конструкцией CELOHNd13-fiber, несущей ген отростка пентона (фибера) вируса птиц ССЯ-76 под контролем промотора CMV, и pCELO20HN-chIFNγ, несущей ген IFNγ птиц под контролем промотора MLP, после обработки их рестиктазами PacI (№ R0547S «New England BioLabs», США) и AscI (№ R0558S «New England BioLabs», США) соответственно, проводят котрансфекцию клеток линии LMH. В результате гомологичной рекомбинации получают рекомбинантный аденовирус птиц CELOHN-aIFNγ/d13-fib, несущий ген отростка пентона (фибера) вируса птиц ССЯ-76 под контролем промотора CMV и ген IFNγ птиц под контролем промотора MLP.
На следующем этапе работы проводят детекцию экспрессии генов IFNγ птиц и отростка пентона (фибера) вируса птиц ССЯ-76 при инфекции клеток вирусом CELOHN-aIFNγ/d13-fib in vitro. Для этого вирусами CELOHN-aIFNγ/d13-fib и CELO дикого типа (в качестве отрицательного контроля) инфицируют клетки линии LMH в дозе 5 БОЕ/кл. Через 48 часов после инфекции отбирают культуральную среду для детекции экспрессии гена IFNγ птиц путем исследования биологической активности белка, а клетки обрабатывают лизирующим буфером (0,05 М Tris HCl ph 7,2; 0,15 М NaCl; 0,1% SDS; 0,1% Dezoxycholat Na; 0,1% Triton X100, 1 mM DTT, ингибитор протеаз) для детекции экспрессии гена отростка пентона (фибера) вируса птиц ССЯ-76 в цитоплазматической фракции клеток методом иммуноблотинга.
Исследование противовирусной активности препаратов проводят по стандартной методике титрования интерферона на культуре клеток птицы. В качестве индикаторного тест-вируса используют вирус энцефаломиокардита мышей. В результате анализа выявлено, что культуральная среда клеток, инфицированных вирусом CELO дикого типа, не обладает противовирусной активностью. Противовирусная активность опытных образцов - культуральной среды клеток, инфицированных вирусом CELOHN-aIFNγ/d13-fib, составляет 1,2·104 МЕ/мл.
Детекцию экспрессии гена отростка фибера вируса птиц ССЯ-76 в цитоплазматической фракции клеток проводят методом Вестерн-блоттинга с использованием нативного очищенного фибера вируса ССЯ-76. В результате выявлено то, что рекомбинантный белок фибера по своим антигенным свойствам и молекулярному весу соответствует белку мономера фибера вируса ССЯ-76, имеется экспрессия гена фибера в составе рекомбинантного аденовируса CELOHN-aIFNγ/d13-fib, а также экспрессируемый белок содержит неизмененные антигенные детерминанты и биологически активен.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СОЗДАНИЯ РЕКОМБИНАНТНОГО АДЕНОВИРУСА ПТИЦ ДЛЯ ВАКЦИНАЦИИ ПРОТИВ ВИРУСА ГРИППА ПТИЦ Н5N1 | 2006 |
|
RU2326943C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ЛАКТОФЕРРИНА ЧЕЛОВЕКА | 2007 |
|
RU2340674C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРОРАЛЬНОЙ ВАКЦИНЫ ПРОТИВ ВИРУСА БЕШЕНСТВА | 2010 |
|
RU2432963C1 |
| НЕИНФЕКЦИОННЫЙ ДЛЯ ЧЕЛОВЕКА АДЕНОВИРУС КАК ВЕКТОР ДЛЯ ЗАМЕСТИТЕЛЬНОЙ ГЕННОЙ ТЕРАПИИ НАРУШЕНИЙ АНГИОГЕНЕЗА, ОБЕСПЕЧИВАЮЩИЙ ЭФФЕКТИВНЫЙ СИНТЕЗ АНГИОГЕНИНА ЧЕЛОВЕКА В ТРАНСФЕЦИРОВАННЫХ КЛЕТКАХ МЛЕКОПИТАЮЩИХ, СПОСОБ ИНДУКЦИИ АНГИОГЕНЕЗА, СПОСОБ ЛЕЧЕНИЯ ИШЕМИЧЕСКОЙ БОЛЕЗНИ, КОМПОЗИЦИЯ ДЛЯ ИНДУКЦИИ АНГИОГЕНЕЗА И ЛЕЧЕНИЯ ИШЕМИЧЕСКОЙ БОЛЕЗНИ | 2005 |
|
RU2321631C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК РС VА ДЛЯ ЭКСПРЕССИИ РИБОЗИМА В ЭУКАРИОТИЧЕСКОЙ КЛЕТКЕ | 1995 |
|
RU2097429C1 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИГЕНОВ АДЕНОВИРУСОВ ПТИЦ | 2001 |
|
RU2217496C2 |
| НУКЛЕИНОКИСЛОТНЫЕ И АМИНОКИСЛОТНЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ АДЕНОВИРУСА ОБЕЗЬЯН, ВЕКТОРЫ, СОДЕРЖАЩИЕ УКАЗАННЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ, И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2604815C2 |
| ДЕФЕКТНЫЙ РЕКОМБИНАНТНЫЙ АДЕНОВИРУСНЫЙ ВЕКТОР (ВАРИАНТЫ) | 1994 |
|
RU2219241C2 |
| СПОСОБ ВСТРАИВАНИЯ ГЕТЕРОЛОГИЧНОЙ ДНК В ГЕНОМ АДЕНОВИРУСА CELO И РЕКОМБИНАНТНЫЙ АДЕНОВИРУСНЫЙ ВЕКТОР CELO/РUC19 | 1992 |
|
RU2031122C1 |
| ПОЛИВАЛЕНТНЫЕ ВИРУСНЫЕ ВЕКТОРЫ И СИСТЕМА ДЛЯ ИХ ПОЛУЧЕНИЯ | 2005 |
|
RU2416646C2 |
Изобретение относится к молекулярной биологии, биотехнологии, генной инженерии вирусов. Способ заключается в том, что на основе геномной ДНК аденовируса птиц CELO конструируют две плазмиды, одна из которых содержит ее левый фрагмент (1-20028 н.п.), включающий экспрессирующую кассету под контролем собственного главного позднего промотора аденовируса MLP, а другая - правый фрагмент генома CELO (17390-43804 н.п.) с зоной, гомологичной нуклеотидной последовательности первой плазмиды для проведения рекомбинации, а также с делецией в 3787 н.п. для увеличения пакующей емкости аденовируса CELO. В области делеции клонируют экспрессирующую кассету, состоящую из экзогенного промотора, обеспечивающего высокий уровень экспрессии в эукариотических клетках, полилинкера для клонирования одного и более целевых генов и сигнала полиаденилирования. Гомологичную рекомбинацию между сконструированными плазмидами проводят в культуре клеток гепатомы петуха леггорн (LMH), обеспечивая получение рекомбинантного аденовируса птиц CELO. Для клонирования в экспрессирующих кассетах используют гены цитокинов, факторов роста, антигенов и онкосупрессоров человека, птиц и микроорганизмов как по отдельности, так и в определенных комбинациях для достижения нужного геннотерапевтического эффекта или высокого уровня иммунизации. Изобретение может быть использовано для создания генно-инженерных рекомбинантных вакцин нового поколения и препаратов для генной терапии. 31 з.п. ф-лы, 4 ил.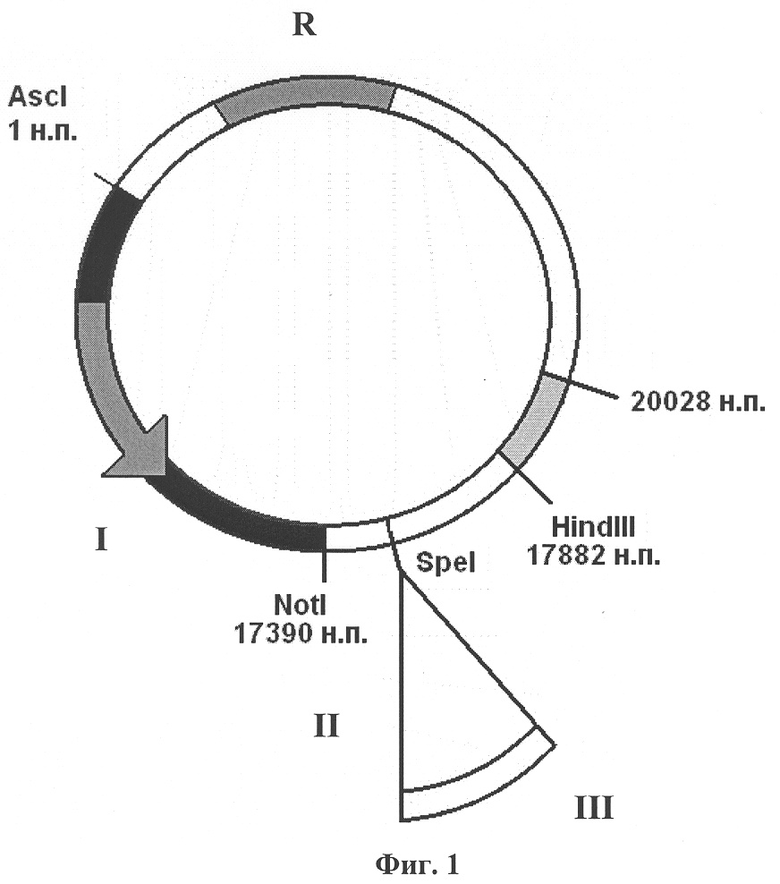
| SU 1490962 А1, 10.04.1995 | |||
| СПОСОБ ВСТРАИВАНИЯ ГЕТЕРОЛОГИЧНОЙ ДНК В ГЕНОМ АДЕНОВИРУСА CELO И РЕКОМБИНАНТНЫЙ АДЕНОВИРУСНЫЙ ВЕКТОР CELO/РUC19 | 1992 |
|
RU2031122C1 |
| US 6335016, 01.01.2002 | |||
| US 6797506, 28.09.2004. | |||
Авторы
Даты
2008-06-20—Публикация
2007-06-13—Подача