ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к области антагонистов меланокортин-5 рецептора. В частности, данное изобретение относится к семейству 1,4-диазепан-2-онов и их производных, которые являются антагонистами меланокортин-5 рецептора. Данное изобретение также относится к фармацевтическим композициям, содержащим эти соединения.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Меланокортин-5 рецептор (MC5R) представляет собой сопряженный с G-белком рецептор (GPCR), относящийся к семейству меланокортиновых рецепторов. Существует пять меланокортиновых рецепторов, которые были выделены и клонированы к настоящему времени: MC1R, MC2R, MC3R, MC4R и MC5R. Меланокортиновые рецепторы участвуют в различных физиологических функциях, обеспечивая ряд возможностей для терапевтического вмешательства в физиологические процессы при помощи изменения (т.е. статистически значимое увеличение или уменьшение) или модуляции (например, повышающая регуляция или понижающая регуляция) сигнальной активности меланокортинового рецептора.
Опубликованы обзоры о меланокортиновых рецепторах и их потенциале в качестве мишеней для терапии (Wikberg 2001; Bohm 2006). Члены семейства меланокортиновых рецепторов регулируются природными пептидными агонистами, такими как АСТН (адренокортикотропный гормон), и меланоцит-стимулирующими гормонами (α-, β-, γ-MSH), полученными из проопиомеланокортина (РОМС), и пептидными антагонистами, такими как Агути-сигнальный белок (ASP) и Агути-родственный белок (AGRP). MC1R широко экспрессируется и связан с пигментацией в меланоцитах и с воспалительными ответами во многих клетках, вовлеченных в иммунную систему. MC2R отличается от других меланокортиновых рецепторов тем, что он связывает только АСТН, но не MSH лиганды. Он высоко экспрессируется в надпочечной железе и регулирует синтез кортикостероидов. MC3R встречается в мозге, а также в других местах в теле и, как оказывается, играет роль в регуляции энергетического гомеостаза и возможно половой дисфункции. MC4R встречается фактически только в мозге, иногда сообщается о его присутствии в других местах. Он тесно связан с контролем питания, а также связан с половым влечением. MC5R широко экспрессируется в периферических тканях, особенно в экзокринных железах, при этом некоторое количество рецептора также экспрессируется в мозге. Принимая во внимание охват активности, связанной с меланокортиновыми рецепторами, необходимо при наведении на мишень одного из этих рецепторов делать это избирательно во избежание побочных эффектов, связанных с антагонизмом или агонизмом другого рецептора в этом семействе.
MC5R клонировали и экспрессировали из множества видов, включая людей в 1993 (хотя называется МС2 в данном документе) (Chhajlani 1993), крысу в 1994 (Griffon 1994), мышей в 1994 (Gantz 1994; Labbe 1994) и в 1995 (Fathi 1995), представителя собачьих (Houseknecht 2003), макак-резус (Huang 2000), овцу (Barrett 1994), полосатую перцину (Ringholm 2002), серебряного карася (Cerda-Reverter 2003), колючую акулу (Klovins 2004), радужную форель (Haitina 2004) и курицу (Ling 2004), с помощью MC5R гена, также идентифицированного у свиньи (Kim 2000). Были опубликованы патенты, охватывающие MC5R последовательность у людей (Wikberg 2002), мышей (Yamada 1997), макак-резус (Fong 2003) и собак (Houseknecht 2003).
Ряд исследований связывают MC5R с регулированием салоотделения, как подытожено в 2006 (Zhang 2006). Мыши, испытывающие нехватку MC5R, имеют уменьшенную выработку кожного сала, о чем свидетельствует отмеченная неспособность сбрасывать воду с их меха и уменьшенное количество кожного сала, выделенного из их шерсти. В значительной степени эти мыши в остальном в целом были здоровыми, без легко заметных нарушений (внешний вид, поведение, рост, мышечная масса, жировая масса, размножение, уровни базального и вызванного стрессом кортикостерона, глюкозы и инсулина) (Chen 1997). Дальнейшие исследования идентифицировали уменьшение феромонов, вызывающее изменения в агрессивном поведении между мышами (Caldwell 2002; Morgan 2004a; Morgan 2004b; Morgan 2006). Мыши, у которых РОМС-производные пептидные нативные лиганды MC5R «нокаутированы», проявляют сходный фенотип (Yaswen 1999). Крысы, инъецированные α-MSH, имели увеличенные на 30-37% нормы выработки кожного сала, в то время как удаление промежуточной доли гипофиза (источника MSH) вызвало понижение салоотделения на 35%, которое было восстановлено после введения α-MSH (Thody 1973). Синергетическое действие между α-MSH и тестостероном наблюдалось у крыс, при этом тестостерон увеличивает сальную железу и клеточные объемы (вероятно посредством повышенной пролиферации), α-MSH увеличивает жирообразование кожи, а сочетание увеличивает салоотделение (Thody 1975а; Thody 1975b).
Посредством обнаружения MC5R транскриптов в микрорассеченных сальных железах (Thiboutot 2000), обнаружения MC5R в человеческих лицевых сальных железах окрашиванием с использованием иммунной метки (Hatta 2001), обнаружения MC5R мРНК и MC5R в человеческих сальных железах, культивированных человеческих себоцитах и крысиных препуциальных клетках (Thiboutot 2000) и обнаружения MC5R в виде пунктатных частиц в сальных железах окрашиванием поликлональными антителами было показано, что на клеточном уровне человеческие себоциты экспрессируют MC5R, который виден в дифференцированных, но не в недифференцированных себоцитах (Zhang 2006). MC5R мРНК также обнаружена в сальных железах из кожи мышей дикого типа, но не в срезах кожи «МС5Р-нокаутированных» мышей (Chen 1997). Обработка человеческих себоцитов холерным токсином (СПТ), экстрактом гипофиза быка (ВРЕ), а-MSH или NDP-MSH увеличивает формирование липидных капель, синтез сквалена и экспрессию MC5R (Zhang 2003; Zhang 2006). В то время как и MC1R, и MC5R обнаружены в жировых клетках, обработка первичной себоцитной клеточной культуры человека NDP-MSH или ВРЕ вызвала у человека значительное увеличение экспрессии MC5R по сравнению с бессывороточными состояниями, коррелируя с дифференцировкой себоцитов. Иммортализованные линии жировых клеток (SZ-95, TSS-1 и SEB-1) также демонстрируют экспрессию MC5R (Jeong 2007; Smith 2007a; Phan 2007). Эти исследования наводят на мысль, что MC5R антагонисты могут применяться при уменьшении салоотделения у млекопитающих и, следовательно, при лечении состояний, связанных с избыточным салоотделением.
Было обнаружено, что семейство 1,2,4-тиадиазольных производных с антагонистической активностью MC5R (138-320 нМ) уменьшают салообразование как в культурах человеческих клеток себоцитов, так и при нанесении местно на человеческую кожу, пересаженную на иммунодефицитных мышей (Eisinger 2003a-d; 2006a,b).
Избыточное салоотделение, или себорея, представляет собой обычный недуг. Сальные железы встречаются на большей части тела с плотными сосредоточениями больших желез на лице, волосистой части кожи головы и верхней части торса (Simpson и Cunliffe p43.1). Салоотделение зависит частично от андрогенных гормонов, возможно частично опосредуется 5а-редуктазой, которая перерабатывает тестостерон в 5a-DHT (дигидротестостерон). Кожное сало состоит из видоспецифической смеси липидов. У людей оно состоит из приблизительно 58% глицеридов, 26% сложных восковых эфиров, 12% сквалена и 4% холестерина/сложных эфиров холестерина (Simpson и Cunliffe p43.5). Присутствие сквалена является едва ли не исключительной особенностью человеческого кожного сала. Функция кожного сала четко не определена, но считается, что оно имеет фунгистатические свойства и играет роль в потере влаги из эпидермиса и его водоотталкивающей способности (Simpson и Cunliffe p43.6; Danby 2005; Porter 2001; Shuster 1976; Kligman 1963).
Избыточное салоотделение связано с развитием обыкновенных угрей. Обыкновенные угри является обычным заболеванием, поражающим примерно 80% населения земного шара на определенном этапе своей жизни. У человека скорее разовьется акне, чем любое другое заболевание, несмотря на то, что тяжесть значительно варьирует (Simpson и Cunliffe p43.16). Акне достигает максимума в распространенности и тяжести у подростков в возрасте 14-19 лет с приблизительно 35-40% пораженными, но у значительного числа пациентов (7-24%) он продолжается за пределами 25-летнего возраста (Simpson и Cunliffe p43.15). Из пациентов, лечащихся от акне, одно исследование обнаружило, что 80% все еще имели симптомы в 30-40-летнем возрасте (Simpson и Cunliffe p43.16). Несмотря на то что акне не является опасным для жизни заболеванием, оно может сильно воздействовать на качество жизни пациентов (Follador 2006), при этом одно исследование пациентов с тяжелым акне показывает подобное влияние как у более серьезных хронических медицинских состояний, таких как астма, эпилепсия, диабет, боль в спине или артрит (Mallon 1999).
Считается, что четыре основных фактора вовлечены в патогенез акне: (i) увеличенная выработка кожного сала (себорея), (ii) гиперороговение/закупоривание протока, относящегося к волосу и сальной железе (угревая сыпь), (iii) инфицирование протока Р.acnes, и (iv) воспаление протока, относящегося к волосу и сальной железе (Simpson и Cunliffe p43.15; Williams 2006). Ряд исследований показал четкую связь между увеличенной выработкой кожного сала и наличием и тяжестью акне (Simpson и Cunliffe р43.17; Youn 2005; Pierard 1987; Harris 1983; Cotterill 1981; Thody 1975; Pochi 1964). Исследование в 2007 году установило взаимосвязь между экскрецией кожного сала и развитием акне у детей в предподростковом возрасте (Mourelatos 2007). Кожное сало является основным питательным веществом Р.acnes, таким образом, уменьшение кожного сала будет уменьшать последующую бактериальную инфекцию и воспалительный ответ.
Андрогенные половые гормоны, по-видимому, играют роль в развитии акне с сильной взаимосвязью с выработкой кожного сала (Makrantonaki 2007). Драже двух пероральных противозачаточных средств одобрены FDA (Комиссия по контролю за лекарствами и питательными веществами) для лечения обыкновенных угрей (Harper 2005), и эти соединения, по-видимому, действуют при помощи уменьшения андроген-опосредованного салообразования. Режим питания (Cordain 2005; Smith 2007b), стресс (Zouboulis 2004) и генетические факторы (Goulden 1999; Bataille 2006) также могут играть роль в акне, опять же потенциально посредством увеличенной выработки кожного сала.
Нынешние методы лечения обыкновенных угрей сосредоточены преимущественно на лечении инфекции и воспалительных стадий заболевания с помощью большого числа различных составов местнодействующих антибиотиков (например, бензоилпероксид, тетрациклин, эритромицин, клиндамицин) и ретиноидов (например, ретиноевая кислота, изотретиноин, адапален, тазаротен), применяемых или отдельно, или в сочетании; некоторые из них также обладают противовоспалительным действием (Simpson и Cunliffe p43.36-43.38). Многие из этих методов лечения имеют ограниченную эффективность, особенно в тяжелых случаях акне. Растущей проблемой является развитие антибиотик-резистентных штаммов Р.acnes (Simpson и Cunliffe p43.37, 43.46; Williams 2006). Как местнодействующие ретиноиды, так и бензоилпероксид вызывают раздражение кожи, а ретиноиды могут вызывать светочувствительность (Williams 2006). Пероральные методы лечения включают изотретиноин, антибиотики, гормоны и стероиды. Было показано, что у женских особей антиандрогены уменьшают выработку кожного сала (приблизительно на 40-80%, хотя и без плацебо контрольной группы) и уменьшают акне (Simpson и Cunliffe р43.44; Burke 1984; Goodfellow 1984). Лазерные и основанные на УФ терапии получают распространение и, как предполагается, действуют при помощи нагревания сальной железы с последующим уменьшением салообразования; с уменьшением как салообразования, так и измеренных поражений акне (Jih 2006; Bhardwaj 2005). Из многих терапий, пригодных для акне, только пероральный изотретиноин и гормональные терапии действуют путем регулирования сальной железы для уменьшения салоотделения (Clarke 2007).
Наиболее эффективное лечение акне, пероральный изотретиноин (13-цис-ретиноевая кислота, Roaccutane, Accutane), был внедрен в 1983 и все еще остается наиболее клинически эффективной терапией против акне. Это единственное известное лечение с сильной супрессивной активностью на выработку сала, уменьшающее экскрецию кожного сала до 90% после 8-12 недель терапии (60-70% через 2 недели) (Simpson и Cunliffe p43.47; Jones 1983; Goldstein 1982; King 1982). Местнодействующие ретиноиды, в отличие от этого, не оказывают влияния на выработку кожного сала. Пероральный изотретиноин является также противовоспалительным, уменьшает возникновение угревой сыпи и уменьшает инфекцию Р.acnes. Механизм действия до сих пор неясен, и, по-видимому, важную роль играют метаболиты изотретиноина.
Изотретиноин индуцирует апоптоз и прекращение клеточного цикла у человеческой иммортализованной SEB-1 себоцитной клеточной культуры (Nelson 2006). К сожалению, пероральный изотретиноин имеет серьезные побочные действия; в значительной степени он является тератогеном, и ему необходима программа регистрации для применения в США. FDA выдал предупреждение против онлайн покупок изотретиноина. Во время лечения также рекомендуют исследование крови на липиды, сдаваемой натощак, и функцию печени (Williams 2006). Изотретиноин связывали (хотя и несущественно) с побочными психологическими эффектами, включая суицид и депрессию (Marqueling 2005).
Другие формы акне, такие как шаровидные угри или молниеносные угри, могут также реагировать на вещество, уменьшающее кожное сало. Себорея, или избыточное продуцирование кожного жира, часто связана с тяжелым состоянием акне. Себорейный дерматит (СД) представляет собой кожное заболевание, связанное с богатыми кожным салом областями волосистой части головы, лица и торса с чешуйчатым, хлопьевидным, зудящим покраснением кожи, поражающим 3-5% населения; перхоть представляет легкую форму этого дерматита, поражающее 15-20% населения. Себорея и СД встречаются чаще у пациентов с болезнью Паркинсона или аффективными расстройствами (паралич лицевого нерва, супраорбитальное повреждение, полиомиелит, сирингомиелия, квадриплегия, одностороннее повреждение в гассеровом ганглие и таковые с ВИЧ/СПИД) (Plewig 1999). Исследования показали, что себорейный дерматит также связан с хроническим алкогольным панкреатитом, вирусом гепатита С и различными раковыми опухолями. Он также обычно встречается у пациентов с генетическими нарушениями, такими как синдром Дауна, болезнь Хейли-Хейли и кардио-фацио-кожный синдром (Gupta 2004). Для лечения этих симптомов MC5R антагонисты могут применяться.
Хотя и немногочисленно, но описаны различные опухоли, поражающие сальные железы или жировые клетки (например, Ide 1999; Mariappan 2004; Kruse 2003). Синдром Мюир-Торре включает аденомы сальной железы, связанные с внутренней аденокарциномой (обычно толстой кишки, молочной железы, яичника или простаты). Предотвращение дифференцировки жировых клеток может дать эффективное лечение для купирования роста опухоли. Для этой цели применяли пероральный изотретиноин (Graefe 2000). Гиперплазия сальных желез является доброкачественной гиперплазией сальных желез, образовывающей желтоватые маленькие папулы на поверхности кожи, обычно лица. Заболевание связано с избыточный пролиферацией недифференцированных себоцитов, но не с избыточным салообразованием.
Эктопические сальные железы (гранулы Фордайса) представляют собой сходные желтые папулы, обнаруживаемые во рту или на теле полового члена. И те, и другие реагируют на пероральный изотреиноин. Эффективное лечение может представлять собой соединение, которое уменьшало пролиферацию себоцитов.
a-MSH демонстрирует иммуносупрессивные эффекты у людей, подавляя ряд воспалительных ответов, и MC5R вовлекался в эти иммуномодулирующие активности. Было обнаружено, что MC5R мРНК экспрессируется на высоких уровнях в человеческих CD4+ Т-хелперных (ТП) клетках и на умеренных уровнях в других человеческих лейкоцитах периферической крови (Andersen 2005). У мышей MC5R выявили в лимфоидных органах (Labbe, 1994) и MC5R обнаружили на поверхности мышиных про-В-лимфоцитных клеток, где он, как оказалось, опосредует α-MSH активацию JAK2 сигнального проводящего пути, усиливающую клеточную пролиферацию (Buggy 1998). Индуцирование CD25+ CD4+ регуляторных Т-клеток с помощью a-MSH также, как оказалось, осуществляется посредством MC5R (Тауlor 2001).
Вследствие вышеописанных причин было бы желательным обеспечение MC5R антагонистов, которые можно было бы применять в ряде терапевтических областей. Терапевтическая регуляция биологической сигнальной трансдукции включает модуляцию МС5Р-опосредованных клеточных событий, включая, среди прочего, ингибирование или потенцирование взаимодействий среди МС5Р-связывающих и активирующих или деактивирующих молекул или других веществ, которые регулируют MC5R активности. Увеличенная способность к такому регулированию MC5R может облегчить развитие способов модулирования салоотделения или других биологических процессов и лечения состояний, связанных с такими путями, как акне, как описано выше.
Заявители в настоящее время идентифицировали семейство 1,4-диазепан-2-онов, которые проявляют MC5R антагонистическую активность, которая может быть полезной в лечении МС5Р-связанных состояний.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение предлагает соединения формулы (I):
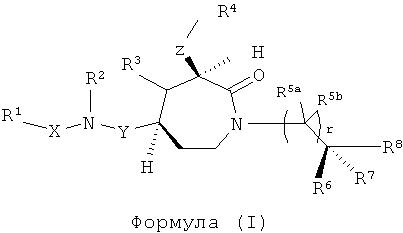
где
Y представляет собой группу формулы -(СR9R10)n-;
Х выбран из группы, включающей -С(=O)-, -ОС(=O)-, -NHC(=O)-, -(CR11R12)s- и -S(=O)2-;
Z представляет собой группу формулы -(CR13R14)q-;
R1 выбран из группы, включающей Н, факультативно замещенный С1-С12алкил, факультативно замещенный С2-С12алкенил, факультативно замещенный С1-С12алкинил, факультативно замещенный С1-С12гетероалкил, факультативно замещенный С3-С12циклоалкил, факультативно замещенный С2-С12гетероциклоалкил, факультативно замещенный C6-C18арил и факультативно замещенный С1-С18гетероарил;
R2 и R3 каждый независимо выбран из группы, включающей Н, факультативно замещенный С1-С12алкил, факультативно замещенный С2-С12алкенил, факультативно замещенный С2-С12алкинил, факультативно замещенный С1-С12гетероалкил, факультативно замещенный С3-С12циклоалкил, факультативно замещенный С2-С12гетероциклоалкил, факультативно замещенный С6-С18арил и факультативно замещенный С1-С18гетероарил;
R4 выбран из группы, включающей Н, факультативно замещенный С1-С12алкил, факультативно замещенный С2-С12алкенил, факультативно замещенный С2-С12алкинил, С3-С12циклоалкил, факультативно замещенный С6-С18арил, факультативно замещенный С-связанный С1-С18гетероарил, C(=O)R15, C(=O)NR16R17, -C(=NR16)NR17R18, SR20, SC(=O)R20, SO2R20, OR20, ONR16R17, OCR17R18R20, OC(=O)R20, OC(=O)OR20, OC(=O)NR16R17 и ONR16C(=NR17)NR18R19;
каждый R5a и R5b независимо выбраны из группы, включающей Н, галоген, С1-С12алкил, С1-С12гидроксиалкил и С1-С12галоалкил, или
один или более из R5a и R5b, взятые вместе с одним или более из R6, R7 и R8, и атомы, к которым они прикреплены, образуют часть, выбранную из группы, включающей факультативно замещенный С3-С12циклоалкил, факультативно замещенный C2-C12гетероциклоалкил, факультативно замещенный С6-С18арил и факультативно замещенный С1-С18гетероарил;
R6, R7 и R8 каждый независимо выбран из группы, включающей Н, галоген, гидрокси, факультативно замещенный С1-С12алкил, факультативно замещенный С2-С12алкенил, факультативно замещенный С2-С12алкинил, факультативно замещенный С1-C12гетероалкил, факультативно замещенный C1-С10гетероалкенил, факультативно замещенный С3-С12циклоалкил, факультативно замещенный C2-C12гетероциклоалкил, факультативно замещенный С6-С18арил, факультативно замещенный С1-С18гетероарил, факультативно замещенный амино, факультативно замещенный карбокси, C1-С12алкилокси и факультативно замещенный тио, или
(a) взятые вместе с атомом углерода, к которому они прикреплены, два или более из R6, R7 и R8 образуют часть, выбранную из группы, включающей факультативно замещенный С2-С12алкенил, факультативно замещенный С3-С12циклоалкил, факультативно замещенный С2-С12гетероциклоалкил, факультативно замещенный С6-С18арил и факультативно замещенный С1-С18гетероарил, или
(b) один или более из R6, R7 и R8, взятые вместе с одним или более из R5a и R5b, и атомы, к которым они прикреплены, образуют часть, выбранную из группы, включающей факультативно замещенный С3-С12циклоалкил, факультативно замещенный C2-C12гетероциклоалкил, факультативно замещенный С6-С18арил и факультативно замещенный С1-С18гетероарил;
каждый R9 и R10 независимо выбран из группы, включающей Н и факультативно замещенный С1-С12алкил;
каждый R11 и R12 независимо выбран из группы, включающей Н и факультативно замещенный С1-С12алкил;
каждый R13 и R14 независимо выбран из группы, включающей Н, галоген, ОН, С1-С12алкил, С3-С12циклоалкил, С6-С18арил, С1-С12галоалкил, С1-С12гидроксиалкил, С1-С12алкилоксил и C1-C12галоалкилоксил, или
взятые вместе с углеродом, к которому они прикреплены, R13 и R14 образуют С3-С12циклоалкильную группу, или
один из R13 или R14, взятый вместе с одним из R15 или R20, и атомы, к которым они прикреплены, образуют циклическую группу;
R15 независимо выбран из группы, включающей Н, факультативно замещенный С1-С12алкил, факультативно замещенный С3-С12циклоалкил, факультативно замещенный C6-C18арил и факультативно замещенный С1-С18гетероарил,
каждый R16, R17, R18, R19 и R20 независимо выбран из группы, включающей Н, факультативно замещенный С1-С12алкил, факультативно замещенный С1-С12гетероалкил, факультативно замещенный С3-С12циклоалкил, факультативно замещенный С6-С18арил и факультативно замещенный С1-С18гетероарил, или
любые два из R16, R17, R18, R19 и R20, взятые вместе с атомами, к которым они прикреплены, образуют факультативно замещенную циклическую группу, или
R15 или R20, взятый вместе с одним из R13 или R14, и атомы, к которым они прикреплены, образуют циклическую группу;
n представляет собой целое число, выбранное из группы, включающей 1, 2, 3 и 4;
q представляет собой целое число, выбранное из группы, включающей 0, 1, 2, 3, 4 и 5;
r представляет собой целое число, выбранное из группы, включающей 1, 2, 3 и 4;
s представляет собой целое число, выбранное из группы, включающей 1, 2, 3 и 4;
или его фармацевтически приемлемая соль или пролекарство.
Данное изобретение также относится к фармацевтическим композициям, включающим соединение данного изобретения с фармацевтически приемлемым носителем, разбавителем или наполнителем.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В данном описании используется ряд выражений, хорошо известных специалисту в данной области. Тем не менее, в целях ясности будет определен ряд выражений.
Как используется здесь, выражение "незамещенный" означает, что нет заместителя или что единственным заместителем является водород.
Выражение "факультативно замещенный", как используется во всем описании, означает, что группа может или не может дополнительно быть замещенной или слитой (так, чтобы образовать конденсированную полициклическую систему) с одной или более неводородными замещающими группами. В определенных вариантах осуществления замещающие группы представляют собой одну или более групп, независимо выбранных из группы, включающей галоген, =O, =S, -CN, -NO2, -CF3, -OCF3, алкил, алкенил, алкинил, галоалкил, галоалкенил, галоалкинил, гетероалкил, циклоалкил, циклоалкенил, гетероциклоалкил, гетероциклоалкенил, арил, гетероарил, циклоалкилалкил, гетероциклоалкилалкил, гетероарилалкил, арилалкил, циклоалкилалкенил, гетероциклоалкилалкенил, арилалкенил, гетероарилалкенил, циклоалкилгетероалкил, гетероциклоалкилгетероалкил, арилгетероалкил, гетероарилгетероалкил, гидрокси, гидроксиалкил, алкилокси, алкилоксиалкил, алкилоксициклоалкил, алкилоксигетероциклоалкил, алкилоксиарил, алкилоксигетероарил, алкилоксикарбонил, алкиламинокарбонил, алкенилокси, алкинилокси, циклоалкилокси, циклоалкенилокси, гетероциклоалкилокси, гетероциклоалкенилокси, арилокси, фенокси, бензилокси, гетероарилокси, арилалкилокси, амино, алкиламино, ациламино, аминоалкил, ариламино, сульфониламино, сульфиниламино, сульфонил, алкилсульфонил, арилсульфонил, аминосульфонил, сульфинил, алкилсульфинил, арилсульфинил, аминосульфиниламиноалкил, -С(=O)ОН, -С(=О)Ra, -C(=O)ORa, C(=O)NRaRb, C(NOH)Ra, C(=NRa)NRbRc, NRaRb, NRaC(=O)Rb, NRaC(=O)ORb, NRaC(=O)NRbRc, NRaC(=NRb)NRcRd, NRaSO2Rb, -SRa, SO2NRaRb, -ORa, OC(=O)NRaRb, ОС(=O)Ra и ацил,
где Ra, Rb, Rc и Rd каждый независимо выбран из группы, включающей Н, C1-C12алкил, C1-C12галоалкил, С1-С10алкенил, C2-C12алкинил, C1-С10гетероалкил, С3-С12циклоалкил, С3-С12циклоалкенил, C1-C12гетероциклоалкил, C1-C12гетероциклоалкенил, С6-С18арил, С1-С18гетероарил и ацил, или любые два или более из Ra, Rb, Rc и Rd, взятые вместе с атомами, к которым они прикреплены, образуют гетероциклическую кольцевую систему с 3-12 кольцевыми атомами.
В одном варианте осуществления каждый факультативный заместитель независимо выбран из группы, включающей: галоген, =O, =S, -CN, -NO2, -CF3, -ОСF3, алкил, алкенил, алкинил, галоалкил, галоалкенил, галоалкинил, гетероалкил, циклоалкил, циклоалкенил, гетероциклоалкил, гетероциклоалкенил, арил, гетероарил, гидрокси, гидроксиалкил, алкилокси, алкилоксиалкил, алкилоксиарил, алкилоксигетероарил, алкенилокси, алкинилокси, циклоалкилокси, циклоалкенилокси, гетероциклоалкилокси, гетероциклоалкенилокси, арилокси, гетероарилокси, арилалкил, гетероарилалкил, арилалкилокси, амино, алкиламино, ациламино, аминоалкил, ариламино, сульфонил, алкилсульфонил, арилсульфонил, аминосульфонил, аминоалкил, -СООН, -SH и ацил.
Примеры особенно подходящих факультативных заместителей включают F, Cl, Вr, I, СН3, СH2СН3, ОН, ОСН3, СF3, ОСF3, NO2, NH2 и CN.
В определениях ряда заместителей ниже установлено, что "группа может представлять собой терминальную группу или мостиковую группу". Предполагается, что это означает, что использование выражения имеет целью включение ситуации, где группа представляет собой связующее звено между двумя другими участками молекулы, а также где она представляет собой терминальную часть. Использование выражения алкил в качестве примера, в некоторых публикациях используется выражение "алкилен" для мостиковой группы, и, следовательно, в этих других публикациях существует различие между выражениями "алкил" (терминальная группа) и "алкилен" (мостиковая группа). В данной заявке не делается такого различия, и большинство групп могут представлять собой или мостиковую группу, или терминальную группу.
Несколько выражений начинаются с индексного регистра, показывающего количество атомов углерода, присутствующих в части. Например, индексный регистр "C1-С6" перед выражением "алкил" показывает, что алкильная часть имеет 1-6 атомов углерода. Кроме того, индексный регистр "C1-C18" перед выражением "гетероарил" показывает, что гетероароматическое кольцо может иметь 1-18 атомов углерода в составе общего числа атомов в кольцевой системе.
"Ацил" означает R-C(=O)- группу, в которой R группа может представлять собой алкильную, циклоалкильную, гетероциклоалкильную, арильную или гетероарильную группу, как определено здесь. Примеры ацила включают ацетил и бензоил. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через карбонильный углерод.
"Ациламино" означает R-C(=O)-NH- группу, в которой R группа может представлять собой алкильную, циклоалкильную, гетероциклоалкильную, арильную или гетероарильную группу, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом азота.
"Алкенил" как группа или часть группы означает алифатическую углеводородную группу, содержащую, по меньшей мере, одну углерод-углеродную двойную связь, которая может быть прямой или разветвленной, предпочтительно с 2-14 атомами углерода, более предпочтительно 2-12 атомами углерода, наиболее предпочтительно 2-6 атомами углерода в нормальной цепи. Группа может содержать несколько двойных связей в нормальной цепи, и ориентацией вокруг каждой является независимо Е или Z. Примерные алкенильные группы включают, но не ограничиваются, этенил, пропенил, бутенил, пентенил, гексенил, гептенил, октенил и ноненил. Группа может представлять собой терминальную группу или мостиковую группу.
"Алкенилокси" относится к алкенил-O- группе, в которой алкенил представляет собой, как определено здесь. Предпочтительные алкенилокси группы представляют собой C1-С6алкенилокси группы. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом кислорода.
"Алкил" как группа или часть группы относится к прямой или разветвленной алифатической углеводородной группе, предпочтительно C1-C14алкил, более предпочтительно С1-С10алкил, наиболее предпочтительно C1-C6, если не указано иначе. Примеры подходящих прямых и разветвленных C1-C6алкильных заместителей включают метил, этил, н-пропил, 2-пропил, н-бутил, втор-бутил, трет-бутил, гексил и подобное. Группа может представлять собой терминальную группу или мостиковую группу.
"Алкиламино" включает и моноалкиламино, и диалкиламино, если не уточнено. "Моноалкиламино" означает алкил-NН- группу, в которой алкил представляет собой, как определено здесь. "Диалкиламино" означает (алкил)2N- группу, в которой каждый алкил может быть одинаковым или различным и каждый представляет собой, как определено здесь для алкила. Алкильная группа представляет собой предпочтительно C1-C6алкильную группу. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом азота.
"Алкиламинокарбонил" относится к группе формулы (Алкил)х(Н)уNС(=O)-, в которой х равно 1 или 2, и сумма х+у=2. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через карбонильный углерод.
"Алкилокси" относится к алкил-O- группе, в которой алкил представляет собой, как определено здесь. Предпочтительно алкилокси представляет собой С1-С6алкилокси. Примеры включают, но не ограничиваются, метокси и этокси. Группа может представлять собой терминальную группу или мостиковую группу.
"Алкилоксиалкил" относится к алкилокси-алкил- группе, в которой алкилокси и алкильная части представляют собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через алкильную группу.
"Алкилоксиарил" относится к алкилокси-арил- группе, в которой алкилокси и арильная части представляют собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через арильную группу.
"Алкилоксикарбонил" относится к алкил-O-С(=O)- группе, в которой алкил представляет собой, как определено здесь. Алкильная группа представляют собой предпочтительно C1-C6алкильную группу. Примеры включают, но не ограничиваются, метоксикарбонил и этоксикарбонил. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через карбонильный углерод.
"Алкилоксициклоалкил" относится к алкилокси-циклоалкил- группе, в которой алкилокси и циклоалкильная части представляют собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через циклоалкильную группу.
"Алкилоксигетероарил" относится к алкилокси-гетероарил- группе, в которой алкилокси и гетероарильная части представляют собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через гетероарильную группу.
"Алкилоксигетероциклоалкил" относится к алкилокси-гетероциклоалкил- группе, в которой алкилокси и гетероциклоалкильная части представляют собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через гетероциклоалкильную группу.
"Алкилсульфинил" означает алкил-S-(=O)- группу, в которой алкил представляет собой, как определено здесь. Алкильная группа представляет собой предпочтительно С1-С6алкильную группу. Примерные алкилсульфинильные группы включают, но не ограничиваются, метилсульфинил и этилсульфинил. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом серы.
"Алкилсульфонил" относится к алкил-S(=O)2- группе, в которой алкил представляет собой, как определено выше. Алкильная группа представляет собой предпочтительно C1-С6алкильную группу. Примеры включают, но не ограничиваются, метилсульфонил и этилсульфонил. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом серы.
"Алкинил" как группа или часть группы означает алифатическую углеводородную группу, содержащую углерод-углеродную тройную связь, которая может быть прямой или разветвленной, предпочтительно имеющую 2-14 атомов углерода, более предпочтительно 2-12 атомов углерода, более предпочтительно 2-6 атомов углерода в нормальной цепи. Примерные структуры включают, но не ограничиваются, этинил и пропинил. Группа может представлять собой терминальную группу или мостиковую группу.
"Алкинилокси" относится к алкинил-O- группе, в которой алкинил представляет собой, как определено здесь. Предпочтительные алкинилокси группы представляют собой C1-C6алкинилокси группы. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом кислорода.
"Аминоалкил" означает NН2-алкил- группу, в которой алкильная группа представляет собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через алкильную группу.
"Аминосульфонил" означает NH2-S(=O)2- группу. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом серы.
"Арил" как группа или часть группы означает (i) факультативно замещенный моноциклический или слитый полициклический, ароматический углеродный цикл (кольцевая структура, имеющая кольцевые атомы, при этом все представляют собой углерод), предпочтительно имеющий 5-12 атомов в кольце. Примеры арильных групп включают фенил, нафтил и подобное; (ii) факультативно замещенную частично насыщенную бициклическую ароматическую карбоциклическую часть, в которой фенил и С5-7 циклоалкильная или C5-7 циклоалкенильная группа слиты вместе для образования циклической структуры, такой как тетрагидронафтил, инденил или инданил. Группа может представлять собой терминальную группу или мостиковую группу. В основном арильная группа представляет собой C6-C18 арильную группу.
"Арилалкенил" означает арил-алкенил- группу, в которой арил и алкенил представляют собой, как определено здесь. Примерные арилалкенильные группы включают фенилаллил. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через алкенильную группу.
"Арилалкил" означает арил-алкил- группу, в которой арильная и алкильная части представляют собой, как определено здесь. Предпочтительные арилалкильные группы содержат C1-5 алкильную часть. Примерные арилалкильные группы включают бензил, фенэтил, 1-нафталинметил и 2-нафталинметил. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через алкильную группу.
"Арилалкилокси" относится к арил-алкил-O- группе, в которой алкил и арил представляют собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом кислорода.
"Ариламино" включает и моноариламино, и диариламино, если не уточнено. Моноариламино означает группу формулы арилNН-, в которой арил представляет собой, как определено здесь. Диариламино означает группу формулы (арил)2N-, где каждый арил может быть одинаковым или различным и каждый представляет собой, как определено здесь для арила. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом азота.
"Арилгетероалкил" означает арил-гетероалкил- группу, в которой арильная и гетероалкильная части представляют собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через гетероалкильную группу.
"Арилокси" относится к арил-O- группе, в которой арил представляет собой, как определено здесь. Предпочтительно арилокси представляет собой С6-С18арилокси, более предпочтительно С6-С10арилокси. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом кислорода.
"Арилсульфонил" означает арил-S(=O)2- группу, в которой арильная группа представляет собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом серы.
"Связь" представляет собой соединение между атомами в соединении или молекуле. Связь может представлять собой одинарную связь, двойную связь или тройную связь.
"Циклическая группа" относится к насыщенной, частично ненасыщенной или полностью ненасыщенной моноциклической, бициклической или полициклической кольцевой системе. Примеры циклических групп включают циклоалкил, циклоалкенил и арил.
"Циклоалкенил" означает неароматическую моноциклическую или многоциклическую кольцевую систему, содержащую, по меньшей мере, одну углерод-углеродную двойную связь и, предпочтительно, имеющую 5-10 атомов углерода в кольце. Примерные моноциклические циклоалкенильные кольца включают циклопентенил, циклогексенил или циклогептенил. Циклоалкенильная группа может быть замещенной одной или более группами заместителей. Группа может представлять собой терминальную группу или мостиковую группу.
"Циклоалкил" относится к насыщенному моноциклическому или слитому, или спирополициклическому углеродному циклу, предпочтительно, содержащему 3-9 углеродов в кольце, такому как циклопропил, циклобутил, циклопентил, циклогексил и подобное, если не указано иначе. Он включает моноциклические системы, такие как циклопропил и циклогексил, бициклические системы, такие как декалин, и полициклические системы, такие как адамантан. Группа может представлять собой терминальную группу или мостиковую группу.
"Циклоалкилалкил" означает циклоалкил-алкил- группу, в которой циклоалкильная и алкильная части представляют собой, как определено здесь. Примерные моноциклоалкилалкильные группы включают циклопропилметил, циклопентилметил, циклогексилметил и циклогептилметил. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через алкильную группу.
"Циклоалкилалкенил" означает циклоалкил-алкенил- группу, в которой циклоалкильная и алкенильная части представляют собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через алкенильную группу.
"Циклоалкилгетероалкил" означает циклоалкил-гетероалкил- группу, в которой циклоалкильная и гетероалкильная части представляют собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через гетероалкильную группу.
"Циклоалкилокси" относится к циклоалкил-O- группе, в которой циклоалкил представляет собой, как определено здесь. Предпочтительно циклоалкилокси представляет собой С1-С6циклоалкилокси. Примеры включают, но не ограничиваются, циклопропанокси и циклобутанокси. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом кислорода.
"Циклоалкенилокси" относится к циклоалкенил-O- группе, в которой циклоалкенил представляет собой, как определено здесь. Предпочтительно циклоалкенилокси представляет собой C1-С6циклоалкенилокси. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом кислорода.
"Галоалкил" относится к алкильной группе, как определено здесь, в которой один или более водородных атомов заменены атомом галогена, выбранным из группы, включающей фтор, хлор, бром и йод. Галоалкильная группа обычно имеет формулу CnH(2n+1-m)Xm, где каждый Х независимо выбран из группы, включающей F, Cl, Вr и I. В группах такого типа n обычно равно 1-10, более предпочтительно 1-6, наиболее предпочтительно 1-3. m обычно равно 1-6, более предпочтительно 1-3. Примеры галоалкила включают фторметил, дифторметил и трифторметил.
"Галоалкенил" относится к алкенильной группе, как определено здесь, в которой один или более из атомов водорода заменены атомом галогена, независимо выбранным из группы, включающей F, Cl, Вr и I.
"Галоалкинил" относится к алкинильной группе, как определено здесь, в которой один или более атомов водорода заменены атомом галогена, независимо выбранным из группы, включающей F, Cl, Вr и I.
"Галоген" представляет хлор, фтор, бром или йод.
"Гетероалкил" относится к алкильной группе с прямой или разветвленной цепью, предпочтительно имеющей 2-14 углеродов, более предпочтительно 2-10 углеродов в цепи, один или более из которых замещены гетероатомом, выбранным из S, О, Р и N. Примерные гетероалкилы включают алкильные эфиры, вторичные и третичные алкильные амины, амиды, алкильные сульфиды и подобное. Группа может представлять собой терминальную группу или мостиковую группу.
"Гетероарил" или отдельно, или как часть группы относится к группам, содержащим ароматическое кольцо (предпочтительно 5- или 6-членное ароматическое кольцо), имеющее один или более гетероатомов в качестве кольцевых атомов в ароматическом кольце с остатком кольцевых атомов, представляющих собой атомы углерода. Подходящие гетероатомы включают азот, кислород и серу. Примеры гетероарила включают тиофен, бензотиофен, бензофуран, бензимидазол, бензоксазол, бензотиазол, бензизотиазол, нафто[2,3-b]тиофен, фуран, изоиндолизин, ксантолен, феноксатин, пиррол, имидазол, пиразол, пиридин, пиразин, пиримидин, пиридазин, тетразол, индол, изоиндол, 1H-индазол, пурин, хинолин, изохинолин, фталазин, нафтиридин, хиноксалин, циннолин, карбазол, фенантридин, акридин, феназин, тиазол, изотиазол, фенотиазин, оксазол, изооксазол, фуразан, феноксазин, 2-, 3- или 4- пиридил, 2-, 3-, 4-, 5- или 8- хинолил, 1-, 3-, 4- или 5- изохинолинил, 1-, 2- или 3- индолил и 2- или 3-тиенил. Группа может представлять собой терминальную группу или мостиковую группу.
"Гетероарилалкил" означает гетероарил-алкильную группу, в которой гетероарильная и алкильная части представляют собой, как определено здесь. Предпочтительные гетероарилалкильные группы содержат низшую алкильную часть. Примерные гетероарилалкильные группы включают пиридилметил. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через алкильную группу.
"Гетероарилалкенил" означает гетероарил-алкенил- группу, в которой гетероарильная и алкенильная части представляют собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через алкенильную группу.
"Гетероарилгетероалкил" означает гетероарил-гетероалкил- группу, в которой гетероарильная и гетероалкильная части представляют собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через гетероалкильную группу.
"Гетероарилокси" относится к гетероарил-O- группе, в которой гетероарил представляет собой, как определено здесь. Предпочтительно гетероарилокси представляет собой С1-С12гетероарилокси. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом кислорода.
"Гетероциклический" относится к насыщенной, частично ненасыщенной или полностью ненасыщенной моноциклической, бициклической или полициклической кольцевой системе, содержащей, по меньшей мере, один гетероатом, выбранный из группы, включающей азот, серу и кислород в качестве кольцевого атома. Примеры гетероциклических частей включают гетероциклоалкил, гетероциклоалкенил и гетероарил.
"Гетероциклоалкенил" относится к гетероциклоалкилу, как определено здесь, но содержит, по меньшей мере, одну двойную связь. Группа может представлять собой терминальную группу или мостиковую группу.
"Гетероциклоалкил" относится к насыщенному моноциклическому, бициклическому или полициклическому кольцу, содержащему, по меньшей мере, один гетероатом, выбранный из азота, серы, кислорода, предпочтительно 1-3 гетероатома, по меньшей мере, в одном кольце. Каждое кольцо представляет собой предпочтительно 3-10-членное, более предпочтительно 4-7-членное. Примеры подходящих гетероциклоалкильных заместителей включают пирролидил, тетрагидрофурил, тетрагидротиофуранил, пиперидил, пиперазил, тетрагидропиранил, морфилино, 1,3-диазапан, 1,4-диазапан, 1,4-оксазепан и 1,4-оксатиапан. Группа может представлять собой терминальную группу или мостиковую группу.
"Гетероциклоалкилалкил" относится к гетероциклоалкил-алкил- группе, в которой гетероциклоалкильная и алкильная части представляют собой, как определено здесь. Примерные гетероциклоалкилалкильные группы включают (2-тетрагидрофурил)метил, (2-тетрагидротиофуранил)метил. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через алкильную группу.
"Гетероциклоалкилалкенил" относится к гетероциклоалкил-алкенил- группе, в которой гетероциклоалкильная и алкенильная части представляют собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через алкенильную группу.
"Гетероциклоалкилгетероалкил" означает гетероциклоалкил-гетероалкил- группу, в которой гетероциклоалкильная и гетероалкильная части представляют собой, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через гетероалкильную группу.
"Гетероциклоалкилокси" относится к гетероциклоалкил-O- группе, в которой гетероциклоалкил представляет собой, как определено здесь. Предпочтительно гетероциклоалкилокси представляет собой С1-С6гетероциклоалкилокси. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом кислорода.
"Гетероциклоалкенилокси" относится к гетероциклоалкенил-O- группе, в которой гетероциклоалкенил представляет собой, как определено здесь. Предпочтительно гетероциклоалкенилокси представляет собой С1-С6гетероциклоалкенилокси. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом кислорода.
"Гидроксиалкил" относится к алкильной группе, как определено здесь, в которой один или более из атомов водорода заменены ОН группой. Гидроксиалкильная группа как правило имеет формулу CnH(2n+1-m)(OH)m. В группах этого типа n как правило равно 1-10, более предпочтительно 1-6, наиболее предпочтительно 1-3. X как правило равно 1-6, более предпочтительно 1-3.
"Низший алкил" как группа означает, если не указано иначе, алифатическую углеводородную группу, которая может быть прямой или разветвленной с 1-6 атомами углерода в цепи, более предпочтительно 1-4 углеродами, такую как метил, этил, пропил (н-пропил или изопропил) или бутил (н-бутил, изобутил или третичный-бутил). Группа может представлять собой терминальную группу или мостиковую группу.
"Сульфинил" означает R-S(=O)- группу, в которой R группа может представлять собой ОН, алкильную, циклоалкильную, гетероциклоалкильную; арильную или гетероарильную группу, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом серы.
"Сульфиниламино" означает R-S(=O)-NH- группу, в которой R группа может представлять собой ОН, алкильную, циклоалкильную, гетероциклоалкильную; арильную или гетероарильную группу, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом азота.
"Сульфонил" означает R-S(=O)2-группу, в которой R группа может представлять собой ОН, алкильную, циклоалкильную, гетероциклоалкильную; арильную или гетероарильную группу, как определено здесь. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом серы.
"Сульфониламино" означает R-S(=O)2-NH- группу. Группа может представлять собой терминальную группу или мостиковую группу. Если группа представляет собой терминальную группу, она связана с остатком молекулы через атом азота.
Понятно, что включенными в семейство соединений формулы (I) являются изомерные формы, включая диастереоизомеры, энантиомеры, таутомеры и геометрические изомеры в "Е" или "Z" конфигурационном изомере или смесь Е и Z изомеров. Также понятно, что некоторые изомерные формы, такие как диастереомеры, энантиомеры и геометрические изомеры можно разделить физическими и/или химическими способами и специалистами в данной области техники.
Некоторые из соединений раскрытых вариантов осуществления могут существовать в качестве отдельных стереоизомеров, рацематов и/или смесей энантиомеров и/или диастереомеров. Все такие отдельные стереоизомеры, рацематы и их смеси, как предполагается, подпадают под объем описанной и заявленной сущности данного изобретения.
Данное изобретение включает все фармацевтически приемлемые изотопно-меченые соединения формулы (I), где один или более атомов имеют такой же атомный номер, но атомная масса или массовое число отличаются от атомной массы или массового числа, обычно встречающегося в природе.
Примеры изотопов, подходящих для включения в соединения данного изобретения, включают изотопы водорода, такие как 2H и 3H, углерода, такие как 11С, 13С и 14С, хлора, такой как 36Cl, фтора, такой как 18F, йода, такие как 123I и 125I, азота, такие как 13N и 15N, кислорода, такие как 15О, 17О и 18О, фосфора, такой как 32P, и серы, такой как 35S.
Определенные изотопно-меченые соединения формулы (I), например, включающие радиоактивный изотоп, применимы при изучениях тканевого распределения лекарственного средства и/или субстрата. Радиоактивные изотопы трития, т.е. 3H, и углерод-14, т.е. 14С, особенно применимы для этой цели в связи с простотой их включения и легких способов обнаружения.
Замена более тяжелыми изотопами, такими как дейтерий, т.е. 2H, может обеспечить определенные терапевтические преимущества, полученные в результате большей метаболической стабильности, например увеличенное in vivo время полужизни или уменьшенные требования дозировки, и, следовательно, могут быть предпочтительными при некоторых условиях.
Замена позитрон излучающими изотопами, такими как 11С, 18F, 15O и 13N, может быть применимой в исследованиях Позитронной Эмиссионной Томографией (PET) для проверки занятости рецептора субстратом.
Изотопно-меченые соединения формулы (I) можно обычно приготовить общепринятыми методами, известными специалисту в данной области, или процессами, аналогичными описанным в сопутствующих Примерах и Приготовлениях, применяя подходящие изотопно-меченые реактивы вместо предварительно используемого немеченого реактива.
Кроме этого Формула (I), как подразумевается, охватывает, где применимо, сольватированные, а также несольватированные формы соединений. Таким образом, каждая формула включает соединения, имеющие указанную структуру, включая гидратированные, а также негидратированные формы.
Выражение "фармацевтически приемлемые соли" относится к солям, которые сохраняют желаемую биологическую активность вышеустановленных соединений и включают фармацевтически приемлемые соли присоединения кислоты и соли присоединения основания. Подходящие фармацевтически приемлемые соли присоединения кислоты соединений формулы (I) можно приготовить из неорганической кислоты или из органической кислоты. Примерами таких неорганических кислот являются соляная, серная и фосфорная кислота. Подходящие органические кислоты можно выбрать из алифатического, циклоалифатического, ароматического, гетероциклического карбоксильного и сульфонового классов органических кислот, примерами которых являются муравьиная, уксусная, пропионовая, янтарная, гликолевая, глюконовая, молочная, яблочная, винная, лимонная, фумаровая, малеиновая, алкилсульфоновая, арилсульфоновая. Дополнительную информацию по фармацевтически приемлемым солям можно найти в Remington's Pharmaceutical Sciences, 19th Edition, Mack Publishing Co., Easton, PA 1995. В случае веществ, которые представляют собой твердые вещества, специалисту в данной области понятно, что патентоспособные соединения, вещества и соли могут существовать в различных кристаллических или полиморфных формах, все из которых, как подразумевается, находятся в объеме данного изобретения и уточняются формулами.
"Пролекарство" означает соединение, которое подвергается превращению в соединение формулы (I) в биологической системе, обычно метаболическими средствами (например, гидролизом, восстановлением или окислением). Например, эфирное Пролекарство соединения формулы (I), содержащее гидроксильную группу, может быть превращаемым гидролизом in vivo в исходную молекулу. Подходящие сложные эфиры соединений формулы (I), содержащие гидроксильную группу, представляют собой, например, ацетаты, цитраты, лактаты, тартраты, малонаты, оксалаты, салицилаты, пропионаты, сукцинаты, фумараты, малеат, метилен-бис-β-гидроксинафтоаты, гентизаты, изетионаты, ди-р-толуоилтартраты, метансульфонаты, этансульфонаты, бензолсульфонаты, р-толуолсульфонаты, циклогексилсульфаматы и соли хинной кислоты. В качестве другого примера сложноэфирное Пролекарство соединения формулы (I), содержащее карбоксигруппу, может быть превращено гидролизом in vivo в исходную молекулу. (Примерами сложноэфирных пролекарств являются таковые, описанные F.J.Leinweber, Drug Metab. Res., 18:379, 1987.) Подобным образом, ацильное Пролекарство соединения формулы (I), содержащее аминогруппу, может быть превращено гидролизом in vivo в исходную молекулу. (Большинство примеров пролекарств для этих и других функциональных групп, включая амины, описаны в Prodrugs: Challenges and Rewards (Parts 1 and 2); Ed V.Stella, R.Borchardt, M.Hageman, R.Oliyai, H.Maag and J Tilley; Springer, 2007.)
Как и в случае любой группы структурно родственных соединений, которые обладают особым полезным свойством, определенные варианты осуществления переменных соединений формулы (I) являются особенно полезными при их конечном применении.
В соединениях данного изобретения Y представляет собой группу формулы -(CR9R10)n-. В одном варианте осуществления данного изобретения n равно 1 и Y представляет собой -CR9R10-. В другом варианте осуществления данного изобретения n равно 2 и Y представляет собой -CR9R10CR9R10-.
В одном варианте осуществления соединений данного изобретения каждый R9 и R10 независимо выбран из Н и СН3. В одном определенном варианте осуществления R9 и R10 оба представляют собой Н. Соответственно в одном варианте осуществления данного изобретения Y представляет собой -CH2-. В другом варианте осуществления данного изобретения Y представляет собой -CH2CH2-. В еще одном варианте осуществления данного изобретения Y представляет собой -С(СН3)2-.
В одном варианте осуществления соединений данного изобретения R2 представляет собой Н или C1-C6алкил. В определенном варианте осуществления R2 представляет собой Н.
В одном варианте осуществления соединений данного изобретения R3 представляет собой Н или C1-C6алкил. В определенном варианте осуществления R3 представляет собой Н.
В одном варианте осуществления соединений данного изобретения Х выбирают из группы, включающей -С(=O)- и -(CR11R12)s-. В одном определенном варианте осуществления Х представляет собой -С(=O)-. В одном варианте осуществления данного изобретения, где Х представляет собой -(CR11R12)s-, s равно 1. В другом варианте осуществления данного изобретения, где Х представляет собой -(CR11R12)s-, s равно 2. В одной форме каждого из этих вариантов осуществления R11 и R12 каждый независимо выбран из группы, включающей Н и C1-C6алкил. В определенном варианте осуществления как R11, так и R12 представляют собой Н, и s равно 1 так, что Х представляет собой -СН2-.
В одном варианте осуществления соединений данного изобретения Y представляет собой СН3, R2 представляет собой Н, R3 представляет собой Н, Х представляет собой -С(=O)-. Это обеспечивает соединения формулы (II).

где R1, R4, R5a, R5b, R6, R7, R8, Z и r представляют собой, как определено для формулы (I).
В одном варианте осуществления соединений данного изобретения и в отдельных соединениях формулы (I) и формулы (II) r выбирают из группы, включающей 1, 2, 3 и 4. В одном определенном варианте осуществления r равно 1. В другом определенном варианте осуществления r равно 2. В еще одном определенном варианте осуществления r равно 3. В еще одном дополнительном определенном варианте осуществления r равно 4.
В одном варианте осуществления соединений данного изобретения и в отдельных соединениях формулы (I) и формулы (II) R5a и R5b независимо выбраны из Н и C1-C6алкила. В одном варианте осуществления R5a и R5b каждый независимо выбран из Н и СН3. В одном определенном варианте осуществления R5a и R5b оба представляют собой Н. В еще одном варианте осуществления, по меньшей мере, один из R5a и R5b, взятый вместе, по меньшей мере, с одним из R6, R7 и R8, и атомы, к которым они прикреплены, образуют факультативно замещенную циклоалкильную группу. В одном определенном варианте осуществления, по меньшей мере, один из R5a и R5b, взятый вместе, по меньшей мере, с одним из R6, R7 и R8 и атомами, к которым они прикреплены, образует циклогексильную группу.
В одном варианте осуществления соединений данного изобретения Y представляет собой CH2, R2 представляет собой Н, R3 представляет собой Н, R5a и R5b представляют собой Н, и Х представляет собой -С(=O)-, и r равно 1. Это обеспечивает соединения формулы (III).
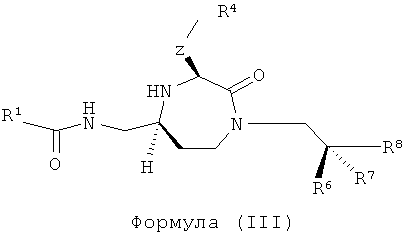 ,
,
где R1, R4, R6, R7, R8 и Z представляют собой, как определено для формулы (I).
В одном варианте осуществления соединений данного изобретения и, в частности, соединений формулы (I), (II) и (III) R13 и R14 представляют собой Н, так что Z представляет собой группу формулы - (CH2)q-, где q представляет собой, как определено выше.
В одном варианте осуществления соединений данного изобретения q выбирают из группы, включающей 1, 2, 3 и 4. В одном определенном варианте осуществления q равно 1. В другом определенном варианте осуществления q равно 2. В еще одном определенном варианте осуществления q равно 3. В еще одном определенном варианте осуществления q равно 4. Это обеспечивает соединения, где Z представляет собой -CH2-, -(CH2)2-, - (СH2)3- и -(СН2)4- соответственно.
В одном варианте осуществления соединений данного изобретения и, в частности, соединений формулы (I), (II) и (III) R14 выбирают из группы, включающей Н, С1-С12алкил, С3-С12циклоалкил, факультативно замещенный С6-С18арил, факультативно замещенный С-связанный С1-С18гетероарил, C(=O)NR16R17, OR16 и ONR16C(=NR17)NR18R19.
В одном варианте осуществления R4 представляет собой С1-С12алкил. В другом варианте осуществления R4 представляет собой C(=O)NR16R17.
В одной форме этого определенного варианта осуществления, где R4 представляет собой C(=O)NR16R17, R16 и R17, взятые вместе с атомом азота, к которому они прикреплены, образуют факультативно замещенную C2-C12 гетероциклоалкильную группу. В определенных вариантах осуществления R16 и R17, взятые вместе с атомом азота, к которому они прикреплены, образуют факультативно замещенную гетероциклоалкильную группу, выбранную из группы, включающей пиперидин-1-ил, пиперидин-4-ил, пирролидин-1-ил, пирролидин-2-ил, азетидин-1-ил, циклогексан, морфолин-4-ил, пиперазин-1-ил, 4-метил-пиперазин-1-ил и азепан-1-ил.
В другом определенном варианте осуществления R4 представляет собой факультативно замещенный С-связанный С1-С18гетероарил. В другом определенном варианте осуществления R4 представляет собой С3-С12циклоалкил.
В одном варианте осуществления соединений данного изобретения R16 выбирают из группы, включающей Н, СН3, СН2СН3, СН2СН2СН2, СН(СН3)2 СН2СН2СН2СН3, СН(СН3)СН2СН3 СН2СН(СН3)2 С(СН3)3, циклопропил, циклобутил, циклопентил, циклогексил, бензил и фенил или их галогенированные производные.
В одном варианте осуществления соединений данного изобретения R17 выбирают из группы, включающей Н, СН3, СН2СН3, CH2CH2CH3, СН(СН3)2, CH2СН2СH2СН3, СН(СН3)СН2СН3, СН2СН(СН3)2, С(СН3)3, циклопропил, циклобутил, циклопентил, циклогексил, бензил и фенил или их галогенированные производные.
В одном варианте осуществления соединений данного изобретения и в особенности соединений формулы (I), (II) и (III) R7 представляет собой Н.
В одном варианте осуществления данного изобретения и в особенности соединений формулы (I), (II) и (III) R6 и R8 каждый независимо выбран из группы, включающей Н, факультативно замещенный С1-С12алкил, факультативно замещенный C2-С12алкенил, факультативно замещенный С6-С18арил и факультативно замещенный C1-С18гетероарил.
В одном определенном варианте осуществления данного изобретения и в особенности соединений формулы (I), (II) и (III) R6 и R8 каждый независимо выбран из группы, включающей факультативно замещенный С1-С12алкил, факультативно замещенный С2-С12алкенил, факультативно замещенный С6-С18арил и факультативно замещенный С1-С18гетероарил.
В одном определенном варианте осуществления данного изобретения и в особенности соединений формулы (I), (II) и (III) R6 и R8 каждый независимо выбран из группы, включающей факультативно замещенный С2-С12алкил, факультативно замещенный С2-С12алкенил, факультативно замещенный С6-С18арил и факультативно замещенный С1-С18гетероарил.
В одном определенном варианте осуществления соединений данного изобретения и в особенности соединений формулы (I), (II) и (III) R6 выбран из группы, включающей Н, метил, трифторметил, этил, 2,2,2-трифторэтил, изопропил, изопропенил, пропил, 2-этилпропил, 3,3-диметилпропил, бутил, 2-метилбутил, изобутил, 3,3-диметилбутил, 2-этилбутил, пентил, 2-метилпентил, факультативно замещенный фенил и факультативно замещенный C1-C5гетероарил.
В одном определенном варианте осуществления соединений данного изобретения и в особенности соединений формулы (I), (II) и (III) R6 представляет собой факультативно замещенный фенил или факультативно замещенный С1-С18гетероарил.
В одном варианте осуществления соединений данного изобретения и в особенности соединений формулы (I), (II) и (III) R8 выбран из группы, включающей Н, метил, трифторметил, этил, 2,2,2-трифторэтил, изопропил, изопропенил, пропил, 2-этилпропил, 3,3-диметилпропил, бутил, 2-метилбутил, изобутил, 3,3-диметилбутил, 2-этилбутил, пентил, 2-метилпентил, факультативно замещенный фенил и факультативно замещенный С1-С5гетероарил.
В одном определенном варианте осуществления соединений данного изобретения и в особенности соединений формулы (I), (II) и (III) R8 представляет собой метил, этил, фенил или факультативно замещенный С1-С5гетероарил.
В одном определенном варианте осуществления соединений данного изобретения и в особенности соединений формулы (I), (II) и (III) R6, R7 и R8, взятые вместе с атомом углерода, к которому они прикреплены, образуют часть, выбранную из группы, включающей факультативно замещенный С2-С12алкенил, факультативно замещенный С3-С12циклоалкил, факультативно замещенный С2-С12гетероциклоалкил, факультативно замещенный С6-С18арил и факультативно замещенный С1-С18гетероарил.
В одном определенном варианте осуществления соединений данного изобретения и в особенности соединений формулы (I), (II) и (III) R6, R7 и R8, взятые вместе с атомом углерода, к которому они прикреплены, образуют факультативно замещенную С1-С18арильную группу.
В одном определенном варианте осуществления соединений данного изобретения и в особенности соединений формулы (I), (II) и (III) R6, R7 и R8, взятые вместе с атомом углерода, к которому они прикреплены, образуют двузамещенную фенильную группу. В одном варианте осуществления двузамещенная фенильная группа представляет собой 2,4-двузамещенную фен-1-ильную группу или 3,5-двузамещенную фен-1-ильную группу. На двузамещенной фенильной группе, как определено выше, может присутствовать широкий спектр заместителей. Примеры особенно подходящих заместителей включают, но не ограничиваются, F, Br, Cl, метил, трифторметил, этил, 2,2,2-трифторэтил, изопропил, пропил, 2-этилпропил, 3,3-диметилпропил, бутил, изобутил, 3,3-диметилбутил, 2-этилбутил, пентил, 2-метилпентил, пент-4-енил, гексил, гептил, октил, фенил, NH2, циано, фенокси, гидрокси, метокси, этокси, метилендиокси, пиррол-1-ил и 3,5-диметил-пиразол-1-ил. В одном определенном варианте осуществления двузамещенная фенильная группа представляет собой дихлорфен-1-ильную группу.
В одном варианте осуществления соединений данного изобретения и в особенности соединений формулы (I), (II) и (III) R1 выбирают из группы, включающей факультативно замещенный С2-С12алкенил, факультативно замещенный С6-С18арил и факультативно замещенный С1-С18гетероарил.
В одном варианте осуществления соединений данного изобретения и в особенности соединений формулы (I), (II) и (III) R1 представляет собой факультативно замещенный С6-С18арил. С6-С18арил может представлять собой моноциклическую, бициклическую или полициклическую часть. В определенных вариантах осуществления C6-C18арил представляет собой моноциклическую часть. В определенных вариантах осуществления C6-C18арил представляет собой бициклическую часть.
В одном определенном варианте осуществления R1 представляет собой факультативно замещенный С6-С18арил, выбранный из группы, включающей факультативно замещенный фенил, бифенил и факультативно замещенный нафтил.
Части могут быть незамещенными или могут быть замещенными одним или более факультативными заместителями. Большое число факультативных заместителей можно применять, как определено выше. Примеры особенно подходящих факультативных заместителей включают, но не ограничиваются, F, Br, Cl, метил, трифторметил, этил, 2,2,2-трифторэтил, изопропил, пропил, 2-этилпропил, 3,3-диметилпропил, бутил, изобутил, 3,3-диметилбутил, 2-этилбутил, пентил, 2-метилпентил, пент-4-енил, гексил, гептил, октил, фенил, NH2, циано, фенокси, гидрокси, метокси, этокси, пиррол-1-ил и 3,5-диметил-пиразол-1-ил.
Заместители могут быть расположены в любом замещаемом положении вокруг арильного кольца, доступного для замены, как будет ясно специалисту в данной области. Примеры подходящих факультативно замещенных фенильных соединений включают, но не ограничиваются, 2-метокси-фенил, 3-метокси-фенил, 4-метокси-фенил, 2-трифторметил-фенил, 3-трифторметил-фенил, 4-трифторметил-фенил, 2-хлор-фенил, 3-хлор-фенил, 4-хлор-фенил, 4-бром-фенил, 2-фтор-фенил, 3-фтор-фенил, 4-фтор-фенил, 4-гидрокси-фенил, 4-фенил-фенил, 4-метил-фенил, 2,4-дихлор-фенил, 3,4-дихлор-фенил, 2,5-дихлор-фенил, 2,6-дифтор-фенил, 2-хлор-6-фтор-фенил, 3-фтор-4-хлор-фенил, 3-метил-4-хлор-фенил, 3-хлор-4-фтор-фенил, 3-хлор-4-метил-фенил, 2-гидрокси-фенил, 3-гидрокси-фенил, 4-гидрокси-фенил, 4-этокси-фенил, 3-фенокси-фенил, 4-фенокси-фенил, 2-метил-фенил, 3-метил-фенил, 4-метил-фенил, 4-изопропил-фенил, 4-циано-фенил, 3,4-диметил-фенил, 2,4-диметил-фенил, 4-трет-бутил-фенил, 2,4-диметокси-фенил и 3,4-метилендиокси-фенил.
В случае когда R1 представляет собой факультативно замещенный бифенил, точка крепления R1 к остатку молекулы может быть в 2, 3 или 4 положении по отношению к точке крепления второго фенильного кольца. Как таковой бифенил может представлять собой факультативно замещенный бифен-2-ил, или факультативно замещенный бифен-3-ил, или факультативно замещенный бифен-4-ил. В основном факультативно замещенный бифенил представляет собой факультативно замещенный бифен-4-ил. Факультативно замещенный бифенил может быть замещенным в любом подходящем положении.
В случае когда R1 представляет собой факультативно замещенный нафтил, точка крепления R1 к остатку молекулы может быть в 1 или 2 положении. Как таковой нафтил может представлять собой факультативно замещенный нафт-1-ил или факультативно замещенный нафт-2-ил. В основном факультативно замещенный нафтил представляет собой факультативно замещенный нафт-2-ил. Факультативно замещенный нафтил может быть замещенным в любом подходящем положении. Примеры подходящих факультативно замещенных нафт-2-илов включают, но не ограничиваются, 6-фтор-нафт-2-ил, 6-бром-нафт-2-ил, 6-хлор-нафт-2-ил, 1-метокси-нафт-2-ил, 3-метокси-нафт-2-ил, 6-метокси-нафт-2-ил, 1-гидрокси-нафт-2-ил и 6-амино-нафт-2-ил.
В одном варианте осуществления соединений данного изобретения и в особенности соединений формулы (I), (II) и (III) R1 представляет собой факультативно замещенный С1-С18гетероарил. С1-С18гетероарил может представлять собой моноциклическую, бициклическую или полициклическую часть. В определенных вариантах осуществления С1-С18гетероарил представляет собой моноциклическую часть. В определенных вариантах осуществления С1-С18гетероарил представляет собой бициклическую часть. Примеры подходящих гетероарильных частей включают, но не ограничиваются, индол-2-ил, индол-3-ил, хинолин-2-ил, хинолин-3-ил, изохинолин-3-ил, хиноксалин-2-ил, бензо[b]фуран-2-ил, бензо[b]тиофен-2-ил, бензо[b]тиофен-5-ил, тиазол-4-ил, бензимидазол-5-ил, бензотриазол-5-ил, фуран-2-ил, бензо[а]тиазол-6-ил, пиразол-1-ил, пиразол-4-ил и тиофен-2-ил. Они также могут быть факультативно замещенными, как обсуждалось выше.
В одном варианте осуществления соединений данного изобретения и в особенности соединений формулы (I), (II) и (III) R1 представляет собой факультативно замещенный С2-С12алкенил. Факультативно замещенный алкенил может содержать одну или более двойных связей с каждой из двойных связей, при этом каждая из двойных связей находится независимо в Е или Z конфигурации. В одном варианте осуществления данного изобретения алкенил содержит одну двойную связь, которая находится в Е конфигурации.
В одной определенной форме этого варианта осуществления R1 представляет собой факультативно замещенный С2-С12алкенил формулы:

R13 выбран из группы, включающей Н, галоген и факультативно замещенный C1-C12алкил;
R1b и R1c каждый независимо выбран из группы, включающей Н, галоген, факультативно замещенный С1-С12алкил, факультативно замещенный С2-С12алкенил, факультативно замещенный С2-С12алкинил, факультативно замещенный С1-С12гетероалкил, факультативно замещенный С3-С12циклоалкил, факультативно замещенный C2-C12гетероциклоалкил, факультативно замещенный С6-С18арил и факультативно замещенный С1-С18гетероарил.
В одной форме этого варианта осуществления R1a представляет собой Н. В одной форме этого варианта осуществления R1b представляет собой Н. Это обеспечивает соединения, где R1 формулы:
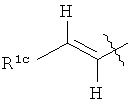
В одном варианте осуществления соединений данного изобретения R1c представляет собой факультативно замещенный С6-С18арил. С6-С18арил может представлять собой моноциклическую, бициклическую или полициклическую часть. В определенных вариантах осуществления С6-С18арил представляет собой моноциклическую часть. В определенных вариантах осуществления С6-С18арил представляет собой бициклическую часть.
В одном определенном варианте осуществления R1c представляет собой факультативно замещенный С6-С18арил, выбранный из группы, включающей факультативно замещенный фенил и факультативно замещенный нафтил. Части могут быть незамещенными или могут быть замещенными одним или более факультативными заместителями. Можно применять широкий спектр факультативных заместителей, как определено выше. Примеры, в частности, подходящих факультативных заместителей включают, но не ограничиваются, F, Br, Cl, метил, трифторметил, этил, 2,2,2-трифторэтил, изопропил, пропил, 2-этилпропил, 3,3-диметилпропил, бутил, изобутил, 3,3-диметилбутил, 2-этилбутил, пентил, 2-метилпентил, пент-4-енил, гексил, гептил, октил, фенил, NH2, циано, фенокси, гидрокси, метокси, этокси, метилендиокси, пиррол-1-ил и 3,5-диметил-пиразол-1-ил.
Заместители могут быть расположены в любом замещаемом положении вокруг арильного кольца, доступного для замены, как будет ясно специалисту в данной области. Примеры подходящих факультативно замещенных фенильных соединений включают, но не ограничиваются, 2-метокси-фенил, 3-метокси-фенил, 4-метокси-фенил, 2-трифторметил-фенил, 3-трифторметил-фенил, 4-трифторметил-фенил, 2-хлор-фенил, 3-хлор-фенил, 4-хлор-фенил, 4-бром-фенил, 2-фтор-фенил, 3-фтор-фенил, 4-фтор-фенил, 4-гидрокси-фенил, 4-фенил-фенил, 4-метил-фенил, 2,4-дихлор-фенил, 3,4-дихлор-фенил, 2,5-дихлор-фенил, 2,6-дифтор-фенил, 2-хлор-6-фтор-фенил, 3-фтор-4-хлор-фенил, 3-метил-4-хлор-фенил, 3-хлор-4-фтор-фенил, 3-хлор-4-метил-фенил, 2-гидрокси-фенил, 3-гидрокси-фенил, 4-гидрокси-фенил, 4-этокси-фенил, 3-фенокси-фенил, 4-фенокси-фенил, 2-метил-фенил, 3-метил-фенил, 4-метил-фенил, 4-изопропил-фенил, 4-циано-фенил 3,4-диметил-фенил, 2,4-диметил-фенил, 4-трет-бутил-фенил, 2,4-диметокси-фенил и 3,4-метилендиокси-фенил.
Определенные соединения данного изобретения включают следующие:

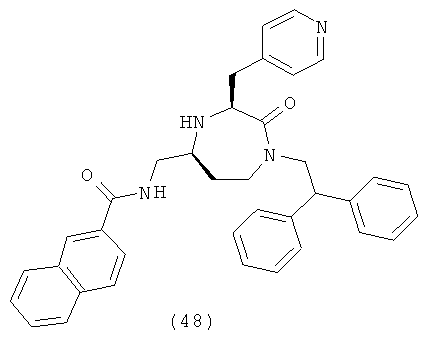
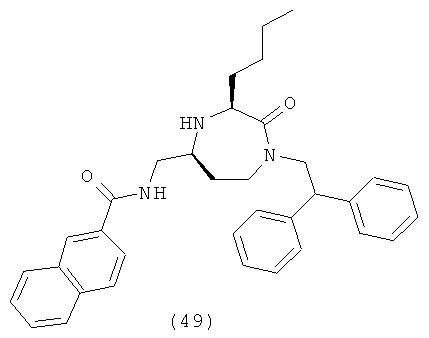




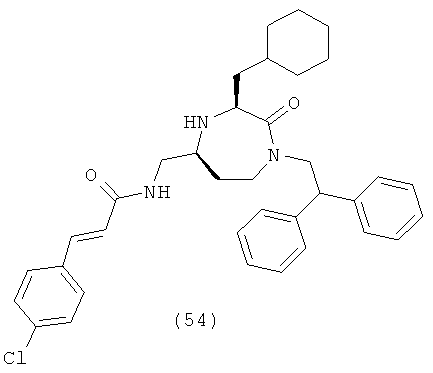
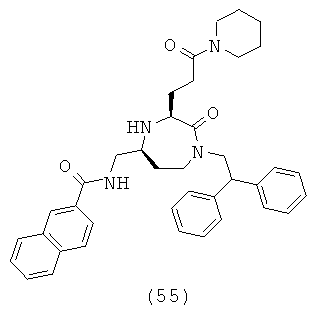













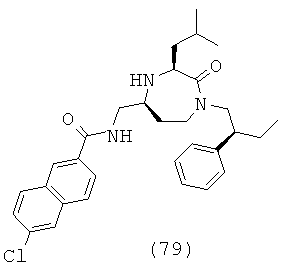

или их фармацевтически приемлемую соль или пролекарство.
С целью помочь читателю названия соединений данного изобретения, как обсуждалось выше, указаны далее:
(17) 6-хлор-N-(((3S,5S)-3-изопентил-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-6-ил)метил)-2-нафтамиддиазепан-5-ил)метил)-3-(4-хлорфенил)акриламид
(45) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(пиридин-2-илметил)-1,4-диазепан-5-ил)метил)акриламид
(46) N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(2-гуанидиноокси)этил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
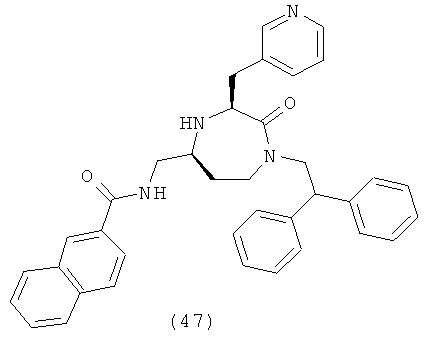
(47) N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(пиридин-3-илметил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(48) N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(пиридин-4-илметил)-1,4-диазепан-6-ил)метил)-2-нафтамид
(49) N-(((3S,5S)-3-бутил-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(50) (Е)-N-(((3S,5S)-3-бутил-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-хлорфенил)акриламид
(51) (Е)-N-(((3S,5S)-3-(3-амино-3-оксопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-хлорфенил)акриламид
(52) N-(((3S,5S)-3-(3-амино-3-оксопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(53) N-(((3S,5S)-3-(циклогексилметил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(54) N-(((3S,5S)-3-(2-аминоэтил)-1-(3,5-дихлорбензил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(55) N-(((3S,5S)-1-(2,2-дифeнилэтил)-2-oкco-3-(3-oкco-3-(пипepидин-1-ил)пpoпил)-1,4-диазепан-5-ил)метил)-2-нафтамид
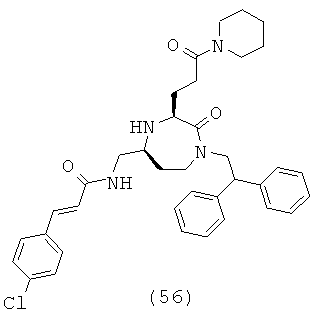
(56) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(3-оксо-3-(пиперидин-1-ил)пропил)-1,4-диазепан-5-ил)метил)акриламид
(57) N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-фенэтил-1,4-диазепан-5-ил)метил)-2-нафтамид
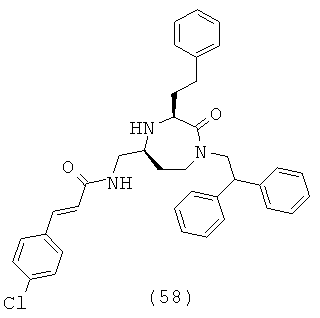
(58) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-фенэтил-1,4-диазепан-5-ил)метил)акриламид
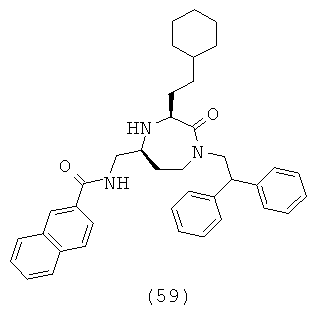
(59) N-(((3S,5S)-3-(2-циклогексилэтил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(60) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-3-(2-циклогексилэтил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)акриламид
(61) N-(((3S,5S)-3-бензил-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
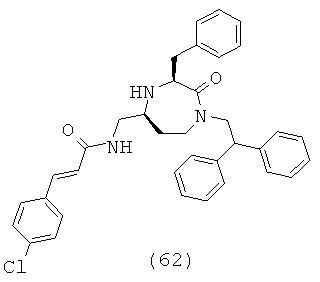
(62) (Е)-N-(((3S,5S)-3-бензил-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-хлорфенил)акриламид
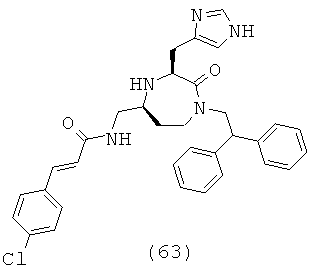
(63) (Е)-N-(((3S,5S)-3-((1Н-имидазол-4-ил)метил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)акриламид
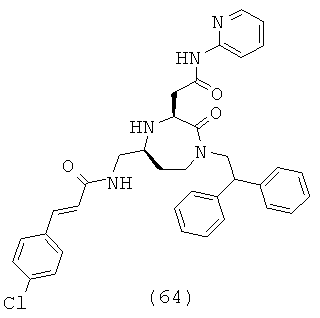
(64) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-оксо-2-(пиридин-2-иламино)этил)-1,4-диазепан-5-ил)метил)акриламид
(65) (Е)-3-(4-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-оксо-2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)акриламид
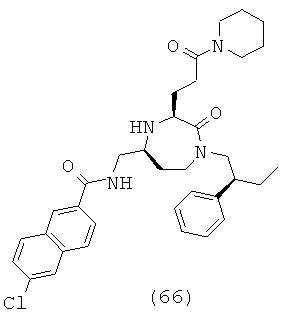
(66) 6-хлор-N-(((3S,5S)-2-оксо-3-(3-оксо-3-(пиперидин-1-ил)пропил)-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(67) 3,4-дихлор-N-(((3S,5S)-2-оксо-3-(3-оксо-3-(пиперидин-1-ил)пропил)-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)бензамид
(68) (5S,9аS)-5-(2-аминобензил)-2-((Е)-3-(4-хлорфенил)акрилоил)-7-(2,2-дифенилэтил)гексагидро-1Н-имидазо[1,5-d][1,4]диазепин-6(5Н)-он
(69) N-(((3S,5S)-3-(2-аминобензил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамид
(70) N-(((3S,5S)-3-бутил-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-6-хлор-2-нафтамид
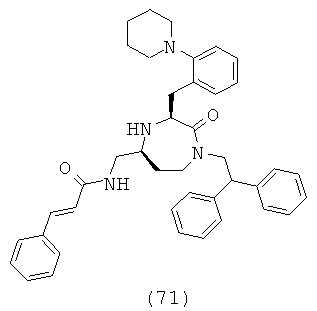
(71) N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пиперидин-1-ил)бензил)-1,4-диазепан-5-ил)метил)-2-нафтамид
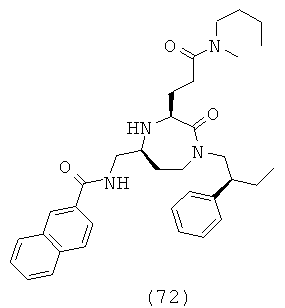
(72) N-(((3S,5S)-3-(3-(бутил(метил)амино)-3-оксопропил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(73) N-(((3S,5S)-3-(3-(циклогексиламино)-3-оксопропил)-2-оксо-1 -((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
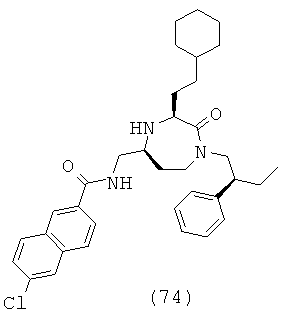
(74) 6-хлор-N-(((3S,5S)-3-(2-циклогексилэтил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(75) 6-хлор-N-(((3S,5S)-3-гексил-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
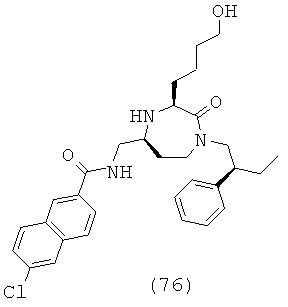
(76) 6-хлор-N-(((3S,5S)-3-(4-гидроксибутил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
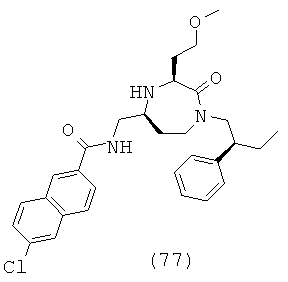
(77) 6-хлор-N-(((3S,5S)-3-(2-метоксиэтил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(78) N-(((3S,5S)-3-(2-(бензилокси)этил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-6-хлор-2-нафтамид
(79) 6-хлор-N-(((3S,5S)-3-изобутил-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамид
(80) 3,4-дихлор-N-(((3S,5S)-3-(2-гидроксиэтил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)бензамид
или их фармацевтически приемлемые соли.
Промышленная полезность
Как указано ранее, соединения данного изобретения представляют собой антагонисты MC5R и, следовательно, могут применяться для модуляции активности MC5R, или его фрагмента, или аналога, или функционального эквивалента путем того, что подвергают MC5R, или его фрагмент, или аналог, или функциональный эквивалент воздействию соединения данного изобретения.
Соответственно, соединения данного изобретения можно применять при лечении любого состояния, при котором модуляция активности MC5R, или его фрагмента, или аналога, или функционального эквивалента приведет к благоприятному воздействию на это состояние. Как таковые соединения данного изобретения можно применять в способах лечения, предотвращения или контролирования состояния, или непосредственно, или косвенно связанного с активностью MC5R, или его фрагмента, или аналога, или функционального эквивалента у млекопитающего, где модулирующее MC5R количество соединения данного изобретения вводят млекопитающему. Одно состояние, связанное с активностью MC5R, представляет собой избыточное салоотделение и состояния, связанные с ним. В одном варианте осуществления способа состояние выбирают из группы, включающей акне, себорею и себорейный дерматит. В одном варианте осуществления акне выбирают из группы, включающей обыкновенные угри, акне, шаровидные угри и молниеносные угри. В одном определенном варианте осуществления состояние представляет собой обыкновенные угри.
Например, понижающая регуляция MC5R приводит к уменьшению салоотделения и, таким образом, может применяться при лечении или профилактике ряда состояний, в которых наблюдают избыточное салоотделение, а именно акне, себореи и себорейного дерматита.
Соединения данного изобретения могут быть также пригодными при лечении, предотвращении или контроле ряда состояний, которые относятся к биологическим процессам, контролируемым MC5R, таким как заболевания, связанные с воспалением. Соединения могут быть также пригодными для лечения или предотвращения раковых опухолей, таких как синдром Мюир-Торре или другие раковые опухоли сальной железы.
Благодаря своему влиянию на салоотделение соединения данного изобретения могут также найти применение при лечениях, где является желательным уменьшенное салоотделение, а именно при косметических лечениях. Соединения могут, таким образом, применяться в способах уменьшения салоотделения млекопитающим, при этом способ включает этап, на котором вводят эффективное количество соединения формулы (I).
Введение соединений формулы (I) пациенту, такому как люди, можно осуществить посредством местного применения, посредством любого из общепринятых методов для энтерального введения, такого как пероральное или ректальное, или посредством парентерального введения, такого как подкожный, внутримышечный, внутривенный и внутрикожный способы применения. Инъекция может быть в виде инъекции ударной дозы вещества или посредством постоянной или прерывистой инфузии. Активное соединение как правило включается в фармацевтически приемлемый носитель или разбавитель и в количестве, достаточном для доставки пациенту терапевтически эффективной дозы.
При применении соединений данного изобретения их можно вводить в любой форме или виде, который делает соединение биодоступным. Специалист в данной области по приготовлению составов может легко выбрать подходящую форму и вид введения в зависимости от отдельных характеристик выбираемого соединения, состояния, которое следует лечить, стадии состояния, которое следует лечить, и других относящихся обстоятельств. Авторы ссылаются на Remingtons Pharmaceutical Sciences, 19th edition, Mack Publishing Co. (1995) для получения дополнительной информации.
Соединения данного изобретения можно вводить отдельно или в форме фармацевтической композиции совместно с фармацевтически приемлемым носителем, разбавителем или наполнителем. Соединения данного изобретения, несмотря на то что эффективны и сами по себе, обычно составляются и вводятся в форме их фармацевтически приемлемых солей, поскольку эти формы обычно более стабильны, легче кристаллизуются и имеют повышенную растворимость.
Однако соединения как правило применяют в форме фармацевтических композиций, которые составляются в зависимости от желаемого вида введения. Как таковой в дополнительном варианте осуществления данное изобретение обеспечивает фармацевтическую композицию, включающую соединение формулы (I) и фармацевтически приемлемый носитель, разбавитель или наполнитель. Композиции готовят в порядке, хорошо известном из уровня техники.
Соединения формулы (I) можно применять или вводить совместно с одним или более дополнительным лекарственным средством(ами). Соединения данного изобретения можно применять совместно с одним или более другими фармацевтически активными соединениями, такими как другие лечения против акне. В одном варианте осуществления другое фармацевтически активное вещество выбирают из группы, включающей антибиотики, ретиноиды, антиандрогены и стероиды. Примеры других фармацевтически активных соединений, которые можно объединять с соединением формулы (I) и вводить в одновременной или последовательной их комбинации, могут включать, в качестве неограничивающего примера, другие вещества против акне, такие как пероральные ретиноиды (например, изотретиноин), местные ретиноиды (например, изотретиноин, адапален, тазаротен), пероральные или местные антибиотики (например, клиндамицин, эритромицин, миноциклин, тетрациклин, бензоилпероксид) или гормональные терапии (например, дроспиренон, норгестимат - этинилэстрадиол, ципротеронацетат). Как указано, эти компоненты можно вводить в одном составе или в отдельных составах. При введении в отдельных составах соединения данного изобретения можно вводить последовательно или одновременно с другим(и) лекарственным(и) средством(ами).
Соединение данного изобретения обычно комбинируют с носителем для получения лекарственной формы, подходящей для конкретного пациента, которого лечат, и конкретного метода введения. Например, состав, предназначенный для перорального введения людям, может содержать от приблизительно 0,5 мг до приблизительно 5 г соединения данного изобретения, смешанного с подходящим и пригодным количеством материала-носителя, которое может изменяться в пределах от приблизительно 5 до приблизительно 99,95 процентов от общей композиции. Типичные лекарственные формы обычно будут содержать от приблизительно 1 мг до приблизительно 500 мг соединения данного изобретения, как правило 25 мг, 50 мг, 100 мг, 200 мг, 300 мг, 400 мг, 500 мг, 600 мг, 800 мг или 1000 мг. Соединения данного изобретения можно также составить для местной доставки в составах, таких как растворы, мази, лосьоны, гели, крема, микроэмульсии или трансдермальные пластыри. Например, эти местные составы могут содержать 0,005-5% (вес/вес или вес/объем) соединения данного изобретения.
Фармацевтические композиции данного изобретения для парентеральной инъекции включают фармацевтически приемлемые стерильные водные или неводные растворы, дисперсии, суспензии или эмульсии, а также стерильные порошки для преобразования непосредственно перед применением в стерильные инъецируемые растворы или дисперсии. Примеры подходящих водных и неводных носителей, разбавителей, растворителей или сред включают воду, этанол, полиолы (такие, как глицерин, пропиленгликоль, полиэтиленгликоль и подобное) и их подходящие смеси, растительные масла (такие, как оливковое масло) и инъецируемые органические сложные эфиры, такие как этилолеат. Подходящая текучесть может поддерживаться, например, посредством применения покрывающих материалов, таких как лецитин, посредством поддержания требуемого размера частиц в случае дисперсий и посредством применения поверхностно-активных веществ.
Эти композиции могут также содержать вспомогательные средства, такие как консервант, увлажняющие вещества, эмульгирующие вещества и диспергирующие вещества. Предотвращение воздействия микроорганизмов можно обеспечить включением различных антибактериальных и противогрибковых веществ, например парабена, хлорбутанола, фенолсорбиновой кислоты и подобное. Также может быть желаемым включение изотонических веществ, таких как сахара, хлорид натрия и подобное. Пролонгированную абсорбцию инъецируемой фармацевтической формы можно вызвать включением веществ, которые задерживают абсорбцию, таких как моностеарат алюминия и желатин.
При необходимости и для более эффективного распределения соединения можно включить в медленно высвобождающиеся или нацеленные системы доставки, такие как полимерные матрицы, липосомы и микросферы.
Инъецируемые составы можно стерилизовать, например, посредством фильтрации через задерживающий бактерии фильтр или посредством включения стерилизующих веществ в форме стерильных твердых композиций, которые можно растворить или диспергировать в стерильной воде или другой стерильной инъецируемой среде непосредственно перед применением.
Твердые лекарственные формы для перорального введения включают капсулы, таблетки, драже, порошки и гранулы. В таких твердых лекарственных формах активное соединение смешивают, по меньшей мере, с одним инертным, фармацевтически приемлемым наполнителем или носителем, такими как цитрат натрия или дикальцийфосфат и/или а) наполнителями или разбавителями, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота, b) связующими веществами, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и гуммиарабик, с) увлажнителями, такими как глицерин, d) распадающимися веществами, такими как карбонат кальция, картофельный или маниоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия, e) замедлителями растворения, такими как парафин, f) ускорителями абсорбции, такими как соединения четвертичного аммония, g) увлажняющими веществами, такими как, например, цетиловый спирт и глицеролмоностеарат, h) абсорбентами, такими как каолин и бентонитовая глина, и i) смазывающими веществами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси. В случае капсул, таблеток и драже лекарственная форма может также содержать буферные вещества.
Твердые композиции подобного типа можно также использовать в качестве наполнителей в мягких и твердо-заполненных желатиновых капсулах, используя такие наполнители, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и подобное.
Твердые лекарственные формы таблеток, драже, капсул, пилюль и гранул можно приготовить с покрытиями и оболочками, такими как энтеросолюбильные покрытия таблеток и другие покрытия, хорошо известные в области фармацевтического составления. Они могут факультативно содержать замутняющие компоненты и также могут включать композицию, из которой они высвобождают только активный ингредиент(ы), или предпочтительно, в определенных частях кишечника, факультативно, пролонгированным способом. Примеры заливочных композиций, которые можно применять, включают полимерные вещества и воски.
При необходимости и для более эффективного распределения соединения можно включать в медленно высвобождающиеся или нацеленные системы доставки, такие как полимерные матрицы, липосомы и микросферы.
Активные соединения могут также быть в микроинкапсулированной форме, при необходимости, с одним или более вышеупомянутыми наполнителями.
Жидкие лекарственные формы для перорального введения включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активным соединениям жидкие лекарственные формы могут содержать инертные разбавители, обычно применяемые в данной области техники, такие как, например, вода или другие растворители, солюбилизирующие вещества и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое масло, земляного ореха, кукурузное, зародышевое, оливковое, касторовое и сезамовое масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и жирнокислотные сложные эфиры сорбитана и их смеси.
Кроме того, инертные разбавители, пероральные композиции могут также включать адъюванты, такие как увлажняющие вещества, эмульгирующие и суспендирующие вещества, подслащивающие, ароматизирующие и отдушивающие вещества.
Суспензии кроме активных соединений могут содержать суспендирующие вещества, как, например, этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и сорбитановые сложные эфиры, микрокристаллическую целлюлозу, алюминия метагидроксид, бентонит, агар-агар и трагакант и их смеси.
Композиции для ректального или вагинального введения представляют собой предпочтительно суппозитории, которые можно приготовить смешиванием соединений данного изобретения с подходящими нераздражающими наполнителями или носителями, такими как масло какао, полиэтиленгликоль или воск суппозитория, которые являются твердыми при комнатной температуре, но жидкими при температуре тела и, следовательно, тают в прямой кишке или вагинальной полости и высвобождают активное соединение.
Для местного применения активное вещество может быть в форме мази, крема, суспензии, лосьона, порошка, раствора, пасты, геля, распыляемого раствора, аэрозоля или масла. Как вариант, композиция может доставляться с помощью липосомы, наносомы, ривосомы или нутри-диффузорной среды. С другой стороны, состав может включать трансдермальный пластырь или повязку, такую как перевязку, пропитанную активным ингредиентом и факультативно одним или более носителями или разбавителями. Для введения в форме трансдермальной системы доставки, введение дозировки будет, конечно, скорее непрерывным, а не прерывистым в ходе схемы приема. Способы производства составов для местного применения известны в данной области техники.
Композиции, используемые для местного применения, обычно содержат фармацевтически приемлемый носитель, который может представлять собой любую среду, которая является токсикологически и фармацевтически приемлемой. Обычные фармацевтически приемлемые носители, которые могут применяться в композициях данного изобретения, включают воду, этанол, ацетон, изопропиловый спирт, стеариловый спирт, фреоны, поливинилпирролидон, пропиленгликоль, полиэтиленгликоль, душистые вещества, гель-продуцирующие материалы, минеральное масло, стеариновую кислоту, спермацет, сорбитан, монолеат, полисорбат, "твины", сорбит, метилцеллюлозу, пертолатум, минеральное масло (вазелиновое масло), которое может представлять собой любой продукт на нефтяной основе; модифицированные или немодифицированные растительные масла, такие как арахисовое масло, масло пшеничных зародышей, льняное масло, масло жожоба, масло из косточек абрикоса, ореховое масло, пальмовое масло, фисташковое масло, сезамовое масло, сурепное масло, можжевеловое масло, масло из зародышей кукурузы, масло персиковых косточек, маковое масло, сосновое масло, касторовое масло, масло из соевых бобов, сафлоровое масло, кокосовое масло, масло лесного ореха, масло из виноградных косточек, масло авокадо, соевое масло, масло сладкого миндаля, масло калофилла, касторовое масло, оливковое масло, подсолнечное масло, или животные масла, такие как китовый жир, тюлений жир, менхэденовый жир, жир печени палтуса, жир печени трески, тресковый, тунцовый, черепаший жир, жир лошадиного копыта, овечьей лапы, норки, выдры, сурка и подобное; синтетические масла, такие как силиконовое масло, такое как диметилполисилоксан; алкильные и алкенильные сложные эфиры жирных кислот, такие как изопропильные сложные эфиры миристиновых, пальмитиновых и стеариновых кислот и жирные сложные эфиры, которые являются твердыми при комнатной температуре; воски, такие как ланолиновый воск, канделильский воск, спермацетовый, масло какао, масло карите, силиконовый воски, гидрогенизированные масла, которые являются твердыми при комнатной температуре, сахаро-глицериды, олеаты, миристаты, линолеаты, стеараты, парафин, пчелиный воск, карнаубский воск, озокеритовый, канделильский воск, микрокристаллический воск; жирные спирты, такие как лауриловый, цетиловый, миристиловый, стеариловый, пальмитиловый и олеиловый спирты; полиоксиэтилированные жирные спирты; и восковые сложные эфиры, ланолин и его производные, пергидросквален и насыщенные сложные эфиры, этилпальмитат, изопропилпальмитат, алкилмиристаты, такие как изопропилмиристат, бутилмиристат и децилмиристат, гексилстеарат, триглицеридные сложные эфиры, триглицериды октеновой и декановой кислоты, цетилрицинолеат, стеарилоктаноат (пурцеллиновое масло), жирные кислоты, многоатомные спирты, полиэфирные производные, жирнокислотные моноглицериды, полиэтиленгликоль, пропиленгликоль, алкилэтоксиэфирсульфонаты, аммонийалкилсульфаты, мыла жирных кислот и гидрогенизированный полиизобутен и смеси восков и масел.
Композиции для местного применения можно составить в различных формах. Однако композиция может часто принимать форму водного или масляного раствора, или дисперсии, или эмульсии, или геля, или крема. Эмульсия может представлять собой эмульсию типа масло-в-воде или эмульсию типа вода-в-масле.
Масляная фаза эмульсий типа вода-в-масле или масло-в-воде может содержать, например: а) углеводородные масла, такие как парафин или минеральные масла; b) воски, такие как пчелиный воск или парафиновый воск; с) натуральные масла, такие как подсолнечное масло, масло из косточек абрикоса, масло из масляного дерева или масло жожоба; d) силиконовые масла, такие как диметикон, циклометикон или цетилдиметикон; е) жирнокислотные сложные эфиры, такие как изопропилпальмитат, изопропилмиристат, диоктилмалеат, глицерилолеат и цетостеарилизононаноат; f) жирные спирты, такие как цетиловый спирт или стеариловый спирт и их смеси (например, цетиариловый спирт); g) полипропиленгликолевые или полиэтиленгликолевые эфиры, например PPG-14 бутиловый эфир; или h) их смеси.
Применяемые эмульгаторы могут представлять собой любые эмульгаторы, известные в данной области техники для применения в эмульсиях типа вода-в-масле или масло-в-воде. Известные косметически приемлемые эмульгаторы включают; a) сесквиолеаты, такие как сорбитансесквиолеат, доступный коммерчески, например, под торговым названием Arlacel 83 (ICI), или полиглицерил-2-сесквиолеат; b) этоксилированные сложные эфиры производных натуральных масел, такие как полиэтоксилированный сложный эфир гидрогенизированного касторового масла, доступного коммерчески, например, под торговым названием Arlacel 989 (ICI); с) силиконовые эмульгаторы, такие как силиконполиолы, доступные коммерчески, например, под торговым названием ABIL WS08 (Тh.Goldschmidt AG); d) анионные эмульгаторы, такие как мыла жирных кислот, например стеарат калия и сульфаты жирных кислот, например цетостеарилсульфат натрия, доступный коммерчески под торговым названием Dehydag (Henkel); e) этоксилированные жирные спирты, например эмульгаторы, доступные коммерчески под торговым названием Brij (ICI); f) сложные эфиры сорбитана, например эмульгаторы, доступные коммерчески под торговым названием Span (ICI); g) этоксилированные сложные эфиры сорбитана, например эмульгаторы, доступные коммерчески под торговым названием Tween (ICI); h) этоксилированные жирнокислотные сложные эфиры, такие как этоксилированные стеараты, например эмульгаторы, доступные коммерчески под торговым названием Myrj (ICI); i) этоксилированные моно-, ди- и триглицериды, например эмульгаторы, доступные коммерчески под торговым названием Labrafil (Alfa Chem.); j) неионные самоэмульгирующиеся воски, например воск, доступный коммерчески под торговым названием Polawax (Croda); k) этоксилированные жирные кислоты, например эмульгаторы, доступные коммерчески под торговым названием Tefose (Alfa Chem.); l) метилглюкозные сложные эфиры, такие как полиглицерин-3 метилглюкозы дистеарат, доступный коммерчески под названием Tegocare 450 (Degussa Goldschmidt); или m) их смеси.
Гели для местного применения могут быть водными или неводными. Водные гели предпочтительны. Гель будет содержать загуститель или желатинирующее вещество для придания достаточной вязкости гелю. Ряд загустителей можно применять в соответствии с природой жидкого носителя и требуемой вязкостью, и они перечислены ниже. Особенно подходящим загустителем является сополимер акрилоилдиметилтауриновой кислоты (или ее соли), предпочтительно сополимер этого мономера с другим виниловым мономером. Например, загуститель представляет собой сополимер соли акрилоилдиметилтауриновой кислоты с другим виниловым мономером. Соль может представлять собой соль щелочных металлов 1 группы, но более предпочтительно представляет собой аммонийную соль. Примерами подходящих сополимерных загустителей являются: i) аммонийный акрилоилдиметилтаурат 1 винилпирролидон сополимер, то есть сополимер аммонийного акрилоилдиметилтаурата и винилпирролидона (1-винил-2-пирролидон).
Композиция может дополнительно включать другие активные вещества ухода за кожей, которые хорошо известны из уровня техники, которые могут быть эффективными для поддержки нормального функционирования кожи. Одна группа предпочтительных композиций включает гидролизованный молочный белок для регулирования выработки кожного сала.
Композиция может дополнительно включать другие компоненты, которые будут хорошо известны специалисту в данной области техники, такие как смягчители, увлажнители, стабилизирующие эмульсию соли, консерванты, хелатирующие вещества или комплексообразующие соединения (связывающие соединения), абразивы, антиоксиданты, стабилизаторы, регулировщики рН, поверхностно-активные вещества, загустители, разбавители, отдушки и красящие вещества.
Составы для местного применения могут желательно включать соединение, которое усиливает абсорбцию или проникновение активного ингредиента через кожу или другие пораженные зоны. Примеры таких усилителей дермального проникновения включают диметилсульфоксид и родственные аналоги.
СИНТЕЗ СОЕДИНЕНИЙ ДАННОГО ИЗОБРЕТЕНИЯ
Общий подход синтеза к заявляемым продуктам протекает через ключевой промежуточный продукт А, производимый, как изложено в схемах 1 или 2.
На схеме 1 аминокислотное производное V-N(R2)-Y-CO2H (V=R1X или защитная группа амина Р1) превращают в амид Вейнреба посредством активации карбоксильной группы и амидирования N-метилметоксиамина. Добавление винилового реактива Гриньяра продуцирует аминоалкилвинилкетон, который подвергают сопряженному присоединению с R6R7R8C-(CR5aR5b)rNH2 аминовым компонентом (показанным как WNH2 для простоты). Получившийся вторичный амин ацилируют при стандартных условиях пептидного соединения с защищенной аминокислотой, P2-NHCH(U)-CO2H, где U представляет или конечную боковую цепь ZR4, защищенную конечную боковую цепь ZR4-Р3, или предшественник, которому необходимо химическое модифицирование для образования конечной боковой цепи ZR4. Снятие защитной группы Р2 с последующим внутримолекулярным восстановительным аминированием кетона при помощи стандартных условий восстановления, таких как H2/Pd катализатор, NaBH4, NaBH3CN или NaBH(OAc)3, с образованием ключевого промежуточного продукта А. Если Y=СН2 или CH2CH2, то А образуется как преимущественный диастереомер. Если V=R1X и U=ZR4, то А является конечным продуктом.
Схема 1: Синтез промежуточного продукта А посредством внутримолекулярного восстановительного аминирования
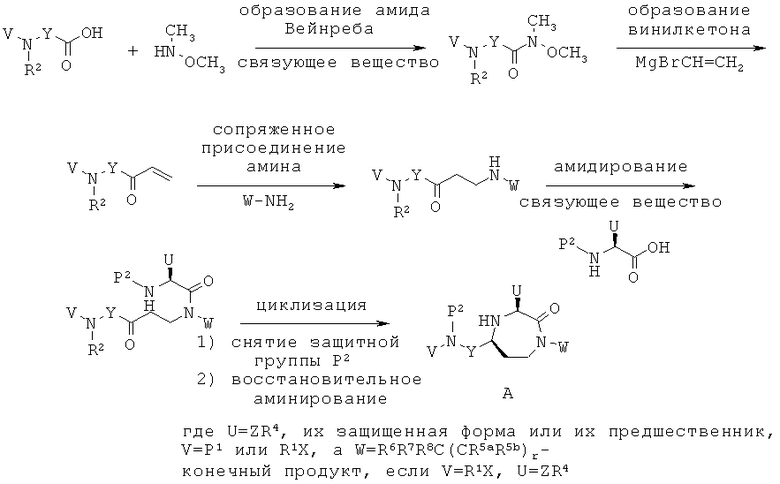
На схеме 2 альтернативный путь к требуемому промежуточному продукту А начинается с такого же образования амида Вейнреба, присоединения винила Гриньяра и аминового сопряженного присоединения. На этом этапе вторичный амин защищен защитной группой амина Р4. Кетон затем восстановительно аминируют защищенным аминосложным эфиром, Н2NСН(U)-СО2Р5, продуцируя смесь диастереомеров, которая проводится через последующие этапы реакции. Кольцевую систему получают в результате снятия защитных групп Р4 и Р5 с последующим образованием амидной связи при помощи стандартных реактивов пептидного соединения. Альтернативно, защитную группу Р4 удаляют и достигают циклизации посредством термической или основание-индуцируемой циклизации с Р5-защищенным сложным эфиром. Циклизация продуцирует смесь двух диастереомеров, А и В, из которых предпочтительные диастереомеры А можно отделить хроматографией.
Схема 2: Синтез промежуточного продукта А посредством внутримолекулярного восстановительного аминирования
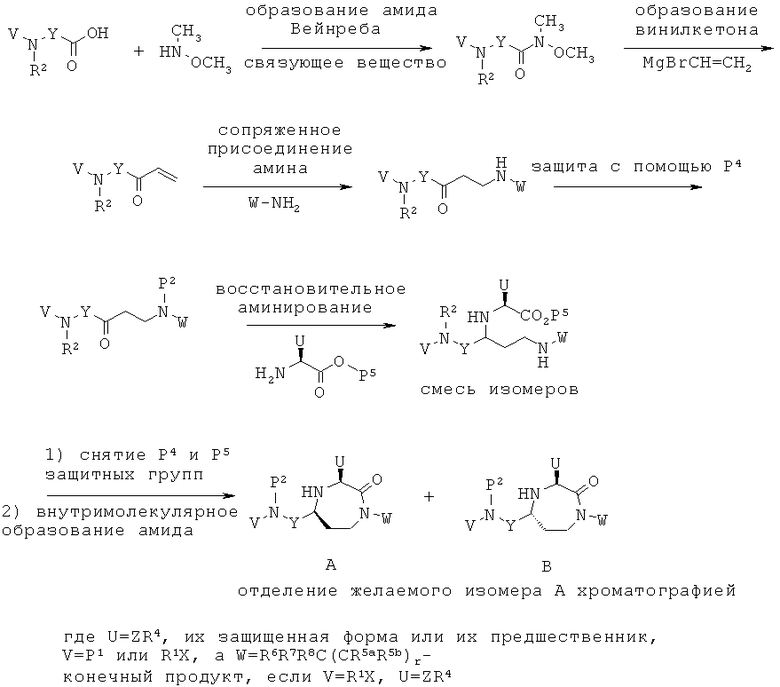
Ключевой промежуточный продукт А может представлять собой конечный продукт, если U=ZR4 и V=R1X, но в остальных случаях превращается в конечный продукт, как показано на схемах 3, 4 и 5.
На схеме 3, где V=R1X, конечный продукт получают модифицированием боковой цепи U, например удалением защитной группы Р3 или удалением защитной группы Р3 с последующим дополнительным химическим модифицированием.
Схема 3: V=R1Х
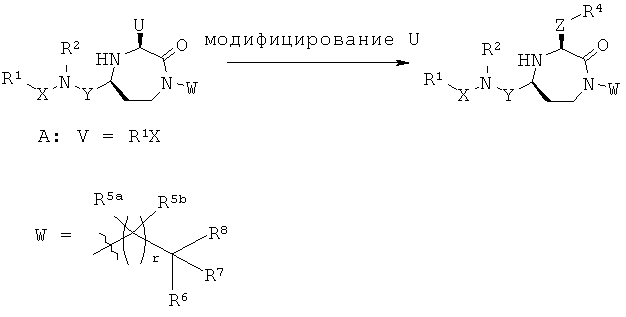
На схеме 4, где V=P1, конечный продукт получают удалением защитной группы Р1 с последующим введением заместителя R1X. Если U=ZR4, это продуцирует конечный продукт. Альтернативно, боковую цепь U затем модифицируют для получения конечной ZR4 группы, как на схеме 3.
Схема 4: V=P1
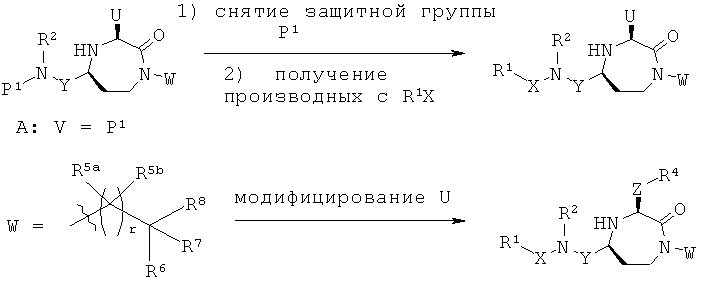
На схеме 5, где V=P1, конечный продукт получают, сначала модифицируя боковую цепь U для получения конечной ZR4 группы, как на схеме 3. За ним следует удаление защитной группы Р1 с последующим введением заместителя R1X.
Схема 5: V=P1

Также возможно модифицировать заместитель W, если необходимо, во время последовательностей этих реакций.
ПРИМЕРЫ
Следующие примеры предназначены для иллюстрации раскрытых вариантов осуществления и не должны истолковываться как ограничивающие их. Дополнительные соединения помимо тех, которые описаны ниже, можно получить при помощи следующих описанных схем реакций, как отмечалось выше, или подходящих их вариаций или модификаций. Все исходные вещества, описанные в Примерах ниже, коммерчески доступны или легко синтезируются специалистами в данной области.
Оборудование
Анализ ВЭЖХ (высокоэффективная жидкостная хроматография) проводили на системе очистки Agilent серии 1100 с Phenomenex Synergi 4µ Max-RP 80A, 50×2,00 мм аналитической ВЭЖХ колонке, с обнаружением пиков посредством УФ. При стандартном анализе использовали скорость потока 1 мл/мин 0,05% трифторуксусной кислоты (TFA) в воде (растворитель А) и 0,05% TFA в 90:10 ацетонитрил:вода (растворитель В), используя градиент от 5% В (начальный) до 95% В в течение 9 минут. Массовые спектры получали на Applied Biosystems MDS Sciex API 2000 LC/MS/MS тройном квадрупольном масс-спектрометре и анализировали ионораспыляющей масс-спектрометрией (ISMS). Препаративную ВЭЖХ проводили на Waters Delta Prep 3000 ВЭЖХ системе с обнаружением пиков посредством УФ (Waters модель 486 настраиваемый абсорбционный детектор), используя Phenomenex Luna 10µ С5 100А, 250×21,20 мм (20 мг шкала), Phenomenex Luna 15µ С8(2) 100А, 250×30,00 мм (50 мг шкала) или Phenomenex Luna 15µ С8(2) 100А, 250×50,00 мм (100 мг шкала) ВЭЖХ колонки. Для системы растворителя использовали различные градиенты 0,05% TFA в воде (растворитель А) и 0,05% TFA в 90:10 ацетонитрил:вода (растворитель В).
Следующие примеры 1-6 предлагают общие методики синтеза, которым можно следовать для проведения превращений, описанных на схемах 1-5. Для образования различных конечных продуктов при помощи этих методик необходимо или изменять изменяемую группу на исходном материале, или изменять изменяемую группу на одном из реактивов в зависимости от характера реакции. Специалисту в данной области будет ясно из прочтения общих методик, как изменить или исходный материал, или реактивы, используемые в методике для продуцирования различных конечных продуктов. К тому же, в зависимости от исходных материалов и реактивов, может возникнуть необходимость и/или желание сделать незначительные модификации в описанных общих методиках для того, чтобы обеспечить наиболее легкий синтез необходимого конечного продукта.
Пример 1 - Общая методика - образование амида Вейнреба

ВОР (бензотриазол-1-ил-окси-трис-(диметиламино)-фосфонийгексафтор фосфат) реактив (100 ммоль) и диизопропилэтиламин (DIPEA) (100 ммоль) добавляют к перемешиваемому раствору аминокислоты (1) (100 ммоль) в дихлорметане (DCM) (100 мл). Раствор затем перемешивают при комнатной температуре в течение 10 мин перед добавлением предварительно смешанного раствора N,O-диметилгидроксиламин гидрохлорида (100 ммоль) и DIPEA (100 ммоль) с последующим перемешиванием при комнатной температуре всю ночь. DCM затем удаляют посредством ротационного испарения и остаток поглощают в этилацетате (EtOAc) (200 мл). Органическую фазу затем промывают 1 н. HCl (3×100 мл), Н2O (3×100 мл), насыщенным водным раствором NаНСО3 (3×100 мл) и соляным раствором (1×10 мл). Органическую фазу затем высушивают (MgSO4) и EtOAc удаляют для получения амида Вейнреба (2) в форме белого твердого вещества или масла.
Пример 2 - Общая методика - присоединение винила Гриньяра к амиду Вейнреба для образования α,β - ненасыщенных кетонов формулы (3)
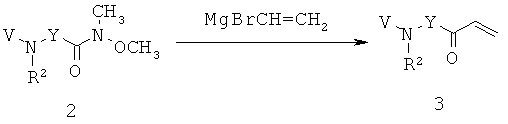
К амиду Вейнреба (2) (15 ммоль) в DCM (10 мл) при 0°С добавляют винилмагнийбромид (45 ммоль) в THF (45 мл). Реакцию перемешивают в течение 2 часов и проверяют при помощи ВЭЖХ. Реакцию затем быстро охлаждают при помощи добавления к ней смеси льда и 1 М HCl (200 мл). Водную смесь экстрагируют DCM (3×100 мл) и органические слои объединяют и промывают 1 М HCl (2×200 мл) и Н2O (3×100 мл). Органическую фазу высушивают (MgSO4) для получения раствора α,β-ненасыщенного кетона (3). α,β-Ненасыщенный кетон (3) можно выделить ротационным испарением или его можно применять в растворе без дополнительной очистки. Если цель заключается в применении α,β-ненасыщенного кетона (3) в растворе, объем уменьшают до 100 мл при помощи ротационного испарения и хранят для дальнейшего применения.
Пример 3 - Общая методика - сопряженное присоединение амина к α,β-ненасыщенным кетонам формулы (3) для получения соединений формулы (4)
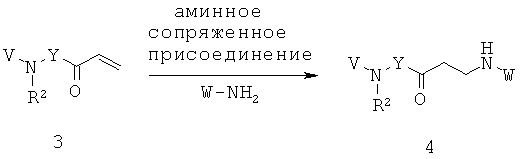
К амину W-NH2 (7,4 ммоль) в DCM (10 мл) добавляют раствор α,β-ненасыщенного кетона (3) (5,7 ммоль) в DCM (50 мл). Раствор перемешивают при комнатной температуре в течение 15 минут или до тех пор, пока анализ не покажет, что все из (3) израсходованы. Раствор соединения (4) непосредственно применяют без очистки для последующей реакции.
Пример 4 - Общая методика - ацилирование аминокетона (4)
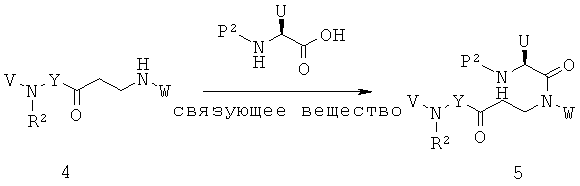
Аминокислоту P2-NHCH(U)-CO2H (15 ммоль) и DIC (15 ммоль) добавляют к раствору DCM, содержащему 10 ммоль аддукта 4 сопряженного присоединения. Реакцию перемешивают при комнатной температуре всю ночь. DCM удаляют при помощи ротационного испарения и остаток затем подвергают колоночной хроматографии на силикагеле с применением уайт-спирит:ЕtOАс для получения 5.
В качестве альтернативы DIC можно заменить на HATU (2-(7-аза-1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфат) (15 ммоль) и DIPEA (15 ммоль). Реакцию перемешивают при комнатной температуре всю ночь. DCM удаляют при помощи ротационного испарения и остаток поглощают в ЕtOАс (100 мл). Органический слой промывают насыщенным раствором бикарбоната натрия (2×100 мл), насыщенным раствором хлорида аммония (2×100 мл) и соляным раствором (2×100 мл). Органическую фазу высушивают и растворитель удаляют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, используя петролейный эфир : ЕtOАс для получения 5.
Пример 5 - Общая методика - снятие защитной группы Р2 и циклизация

Методика, выбранная для удаления защитной группы Р2, будет изменяться в зависимости от конкретной природы защитной группы. Как будет оценено специалистом в данной области, можно использовать большее количество возможных защитных групп, и специалист в данной области без труда сможет определить подходящую методику для удаления любой отдельной защитной группы из методик, известных из уровня техники. Тем не менее, для того чтобы помочь читателю, приводятся общие методики удаления наиболее известных защитных групп.
Р2 = Fmoc: К соединению 5 (2 ммоль) в DCM (3 мл) добавляют диэтиламин (20 ммоль). Реакцию перемешивают при комнатной температуре в течение 1 часа. DCM и диэтиламин затем удаляют при помощи ротационного испарения. Добавляют DCM (5 мл) и затем триацетоксиборогидрид натрия (3 ммоль) и реакцию перемешивают всю ночь при комнатной температуре. Органическую фазу промывают насыщенным раствором бикарбоната натрия (25 мл), высушивают (NgSO4) и удаляют DCM для получения циклизованного продукта А. Его можно очистить флэш-хроматографией на силикагеле или использовать без очистки.
Р2=Воc: К соединению 5 (2 ммоль) в DCM (3 мл) добавляют TFA (3 мл) и реакцию перемешивают при комнатной температуре в течение 2 часов. DCM и TFA затем удаляют при помощи ротационного испарения. Затем добавляют DCM (5 мл) и триацетоксиборогидрид натрия (3 ммоль) и реакцию перемешивают всю ночь при комнатной температуре. Органическую фазу промывают насыщенным раствором бикарбоната натрия (25 мл), высушивают (MgSO4) и удаляют DCM для получения циклизованного продукта А. Его можно очистить флэш-хроматографией на силикагеле или использовать без очистки.
Р2=Cbz: Смесь неочищенного 5 (1 ммоль) и 5% Pd/C (200 мг) в 2-пропаноле (15 мл) встряхивают при комнатной температуре под водородом (30 psi (фунтов на квадратный дюйм)) в течение 24 часов. Смесь затем фильтруют через прокладку из Целита и фильтрат концентрируют при пониженном давлении для получения неочищенного продукта. Для получения А можно применять очистку при помощи флэш-хроматографии на силикагеле (100% EtOAc).
Пример 6 - Общая методика - снятие защитной группы Р1 и получение производных с R1X

Методика, выбранная для удаления защитной группы Р1, будет изменяться в зависимости от конкретной природы защитной группы. Как будет оценено специалистом в данной области, можно применять большое количество возможных защитных групп, и специалист в данной области без труда сможет определить подходящую методику для удаления любой отдельной защитной группы из методик, известных из уровня техники. Тем не менее, для того чтобы помочь читателю, приводятся общие методики удаления наиболее известных защитных групп.
Снятие защитных групп, Р1=Cbz:
К циклизованному продукту А (1 ммоль) в метаноле (5 мл) добавляют каталитический Pd/C. Реакцию перемешивают в атмосфере водорода всю ночь. Реакционную смесь фильтруют через Целит и метанол удаляют при помощи ротационного испарения для получения свободного амина. Амин можно использовать в последующей реакции без очистки.
Снятие защитных групп, Р1=Воc:
К циклизованному продукту А (1 ммоль) в DCM (1 мл) добавляют TFA (1 мл) и реакцию перемешивают при комнатной температуре в течение 2 часов. Растворитель удаляют при помощи ротационного испарения для получения аминной TFA соли, которую можно использовать в последующей реакции без очистки.
Снятие защитных групп, Р1=Аllос:
К циклизованному продукту А (1 ммоль) в DCM (6 мл) добавляют 1,3-диметилбарбитуровую кислоту (0,2 ммоль) и палладия тетракистрифенилфосфин (10 мг). Реакцию вакуумируют и перемешивают при комнатной температуре в течение 1 часа. DCM удаляют при пониженном давлении для получения неочищенного свободного амина, который можно использовать в последующей реакции без очистки.
Получение производных с P1X, когда Х=С(=O):
К свободному амину (1 ммоль) в DCM (5 мл) добавляют DIPEA (1 ммоль), ВОР реактив (1,5 ммоль) и кислотный компонент R1CO2H (1,5 ммоль). Реакцию перемешивают при комнатной температуре в течение 2 часов. Ротационное испарение и препаративная ВЭЖХ дает очищенный аддукт.
Пример 7 - Синтез соединения 7 6-хлор-2-нафтойной кислоты
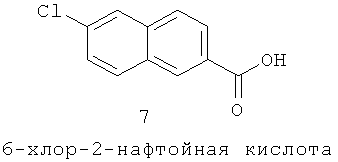
Суспензию 6-бром-2-нафтойной кислоты (3,0 г, 11,47 ммоль), CuCl (11,7 г, 114,64 ммоль) и Cul (2,19 г, 11,50 ммоль) в дегазированном DMF (диметилформамид) (45 мл) нагревали до кипения под аргоном в темноте в течение 4 часов. После охлаждения до комнатной температуры раствор декантировали в Н2O (200 мл) и получившуюся смесь экстрагировали ЕtOАс (2×500 мл). Объединенные органические слои затем промыли Н2O (4×500 мл), затем соляным раствором (1×500 мл), высушили над MgSO4, профильтровали и сконцентрировали при пониженном давлении досуха. Остаток растерли в порошок с CH3CN и полученное твердое вещество затем повторно кристаллизовали из ЕtOАс для получения чистого продукта 7 (2,2 г, 93%) в форме грязно-белого твердого вещества. ВЭЖХ (высокоэффективная жидкостная хроматография) tр 6,47 мин.
Пример 8 - Синтез соединения 8 (S)-2-фенилбутанола

К суспензии борогидрида натрия (2,36 г, 62,4 ммоль) в THF (тетрагидрофуран) (50 мл) медленно добавили раствор (8)-2-фенилмасляной кислоты (4,27 г, 26,0 ммоль) в THF (40 мл) при 0°С. Смесь перемешивали до тех пор, пока не прекратилось образование газа. Раствор йода (6,60 г, 26,0 ммоль) в THF (40 мл) затем медленно добавили при 0°С. После добавления получившейся смеси позволили нагреться до комнатной температуры и перемешивали в течение 1 часа. Реакционный раствор затем медленно вылили в 1 н. раствор HCl (280 мл) и получившуюся смесь разбавили ЕtOАс (250 мл). Водный слой экстрагировали ЕtOАс (150 мл × 3) и объединенные органические слои затем промыли насыщенным NаНСО3 (водн.), 0,5 М Nа2S2O3 (водн.) и соляным раствором. Этот органический раствор высушили над MgSO4, профильтровали и сконцентрировали при пониженном давлении для получения неочищенного продукта. Очисткой флэш-хроматографией на силикагеле (петролейный эфир : ЕtOАс 4:1) получили желаемый продукт 8 в форме бесцветного масла с количественным выходом. ВЭЖХ tR 5,24 мин.
Пример 9 - Синтез соединения 9 (S)-1-мезилокси-2-фенилбутана
К смеси спирта 8 (3,9 г, 26,0 ммоль) и триэтиламина (5,5 мл, 39,5 ммоль) в DCM (90 мл) медленно добавили раствор метансульфохлорида (4,47 г, 39,0 ммоль) в DCM (30 мл) при 0°С. После добавления получившейся смеси позволили нагреться до комнатной температуры и перемешивали в течение 2 часов. Затем добавили 1 н. HCl (70 мл) к вышеописанной смеси и водный слой экстрагировали DCM (1×70 мл). Объединенные органические слои промыли соляным раствором (150 мл), высушили над MgSO4, профильтровали и сконцентрировали при пониженном давлении для получения неочищенного продукта 9 в форме бесцветного масла. Этот неочищенный продукт затем применяли на следующем этапе без дополнительной очистки. ВЭЖХ tR 6,48 мин.
Пример 10 - Синтез соединения 10 (S)-1-азидо-2-фенилбутана

Суспензию мезилата 9 (5,93 г, 26,0 ммоль) и азида натрия (5,7 г, 78,0 ммоль) в DMF (60 мл) нагревали при 85°С в течение 3 часов. После охлаждения до комнатной температуры смесь разбавили Н2O (200 мл) и экстрагировали EtOAc (250 мл). Органический слой затем промыли H2O (4×150 мл), затем соляным раствором (150 мл), высушили над MgSO4, профильтровали и сконцентрировали при пониженном давлении для получения неочищенного продукта. Очисткой флэш-хроматографией на силикагеле (100% петролейный эфир в качестве элюента) получили чистый продукт азида 10 (4,03 г, 88%) в форме бесцветного масла. ВЭЖХ tR 7,67 мин.
Пример 11 - Синтез соединения 11 (S)-2-фенилбутиламина
Смесь азида 10 (4,0 г, 22,8 ммоль) и катализатор Линдлара (1,5 г) в ЕtOАс (50 мл) встряхивали при комнатной температуре под H2 (40 psi) всю ночь. Смесь затем профильтровали через прокладку из Целита и фильтрат сконцентрировали при пониженном давлении для получения неочищенного продукта амина 11 (3,4 г, 100%) в форме светло-желтоватого масла. Этот неочищенный продукт применяли для реакций сопряженного присоединения без дополнительной очистки. MS (ESI) 150 (М+1); ВЭЖХ tR 1,84 мин.
Пример 12 - Синтез соединения 12 бензил2-(метокси(метил)амино)-2-оксоэтилкарбамата

К Сbz(хабазит)-глицину (10 г, 47,8 ммоль, Aldrich) в DCM (100 мл) добавили ВОР реактив (21,5 г, 48,6 ммоль) и DIPEA (6,5 мл, 46,0 ммоль). После перемешивания при комнатной температуре в течение 10 мин добавили N,O-диметилгидроксиламин гидрохлорид (4,9 г, 50,2 ммоль) и DIPEA (6,5 мл, 46,0 ммоль). Реакцию перемешивали при комнатной температуре всю ночь. DCM удалили при помощи ротационного испарения и остаток поглощали в ЕtOАс (100 мл). Органическую фазу промыли водой (3×100 мл), насыщенным раствором бикарбоната натрия (3×100 мл), водой (3×100 мл), 1 М соляной кислотой (3×100 мл), соляным раствором (3×100 мл). Органическую фазу высушили (сульфат магния) и ЕtOАс удалили для получения амида Вейнреба 12 в форме твердого белого вещества (7,78 г, 64%).
Пример 13 - Синтез соединения 13 бензил 2-оксобут-3-енилкарбамата

К амиду Вейнреба 12 (3,89 г, 15,42 ммоль) в DCM (10 мл) при 0°С добавили винилмагнийбромид (45 ммоль) в THF (45 мл). Реакцию перемешивали в течение 2 часов и проверяли при помощи ВЭЖХ. Реакцию добавили к смеси из льда и 1 М соляной кислоты (200 мл). Водную смесь экстрагировали DCM (3×100 мл) и промыли 1 М соляной кислотой (2×200 мл) и водой (3×100 мл). Органическую фазу высушили (сульфат магния) и объем уменьшили до 100 мл при помощи ротационного испарения. α,β-Ненасыщенный кетон 13 хранили и применяли в растворе без очистки.
Пример 14 - Синтез соединения 14 (S)-9-флуоренилметил 7-[(S)-2-фенилбутил]-2-метил-15-фенил-6,10,13-триоксо-14-окса-7,12-диазаоктадекан-5-илкарбамата
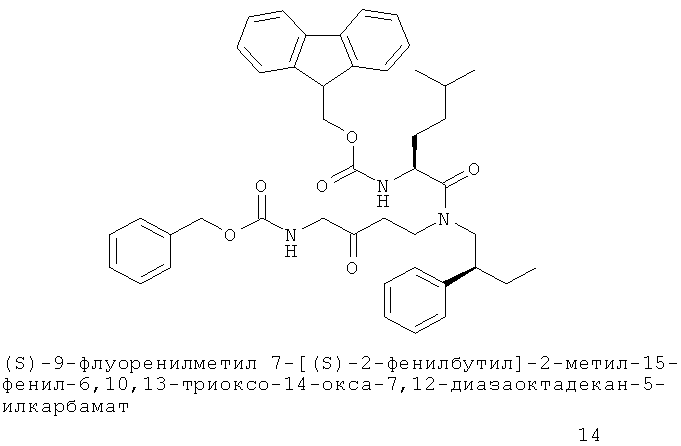
К (S)-фенилбутиламину (0,14 г, 0,9 ммоль) в DCM (3 мл) добавили α,β-ненасыщенный кетон 13 (0,9 ммоль) в DCM (7,5 мл). После перемешивания при комнатной температуре в течение 15 мин добавили Fmoc-L-Homoleucine (0,4 г, 1,09 ммоль) и DIC (0,18 мл, 1,16 ммоль). Реакцию перемешивали при комнатной температуре всю ночь. DCM удалили при помощи ротационного испарения и остаток очистили колоночной хроматографией (силикагель, 1:1 к 0:1 петролейный эфир : ЕtOАс) для получения 14 (0,54 г, 84%).
Пример 15 - Синтез соединения 15 бензил ((3S,5S)-3-изопентил-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метилкарбамата
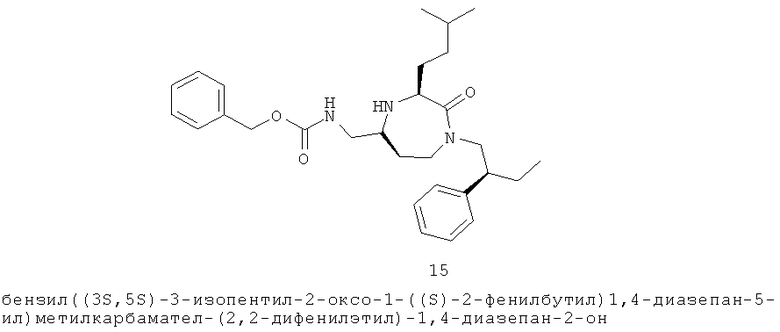
К соединению 14 (0,54 г, 0,75 ммоль) в DCM (3 мл) добавили диэтиламин (1,5 мл, 14,5 ммоль). Реакцию перемешивали при комнатной температуре в течение 1 часа. DCM и диэтиламин удалили при помощи ротационного испарения. Добавили DCM (5 мл) и триацетоксиборогидрид натрия (0,2 г, 0,94 ммоль) и реакцию перемешивали всю ночь при комнатной температуре. Органическую фазу промыли насыщенным раствором бикарбоната натрия (25 мл), высушили (сульфат магния) и DCM удалили для получения циклизованного продукта, который очистили при помощи колоночной хроматографии (силикагель, петролейный эфир : ЕtOАс) для получения 0,32 г (89%) 15.
Пример 16 - Синтез соединения 16 (3S,5S)-5-(аминометил)-3-изопентил-1-((S)-2-фенилбутил)-1,4-диазепан-2-она
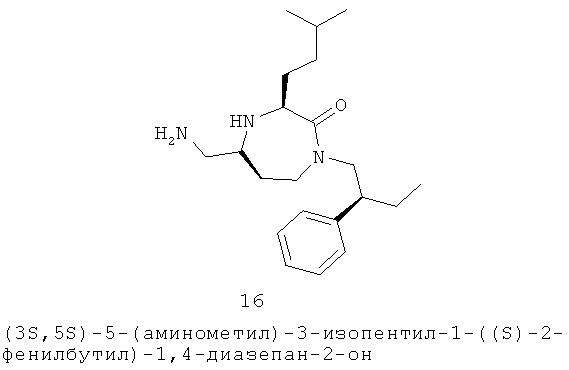
К циклизованному продукту 15 (0,32 г, 0,67 ммоль) в метаноле (5 мл) добавили катализатор Pd/C. Реакцию перемешивали в атмосфере водорода в течение 1 часа. Реакционную смесь профильтровали через Целит и метанол удалили при помощи ротационного испарения для получения амина 16 (0,23 г, 100%), который применяли на следующем этапе без очистки,
Пример 17 - Синтез соединения 17 6-хлор-N-(((3S,5S)-3-изопентил-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамида
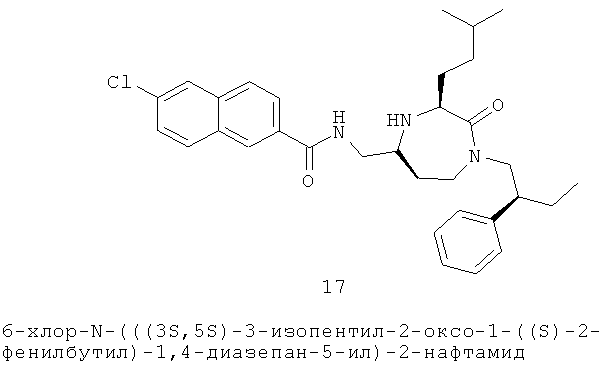
К амину 16 (0,12 мг, 0,34 ммоль) в DCM (1 мл) добавили DIPEA (0,1 мл, 0,57 ммоль), ВОР реактив (0,16 г, 0,36 ммоль) и 6-хлор-2-нафтойную кислоту (0,07 г, 0,34 ммоль). Реакцию перемешивали при комнатной температуре в течение 2 часов. Растворитель удалили под высоким вакуумом и остаток очистили при помощи препаративной ВЭЖХ для получения 32,0 мг (18%) 17 в форме соли TFA. Соль TFA (30 мг) в DCM (15 мл) промыли насыщенным раствором бикарбоната натрия (15 мл). DCM удалили и добавили 1 M HCl (2 мл) и ацетонитрил (2 мл). Удалением растворителя при помощи лиофилизации получили 24 мг 17 в форме соли HCl. MS (ESI) 534,4 (М+1); ВЭЖХ tR 7,64 мин.
ЯМР: 1H ЯМР (CDCl3, 400 MHz): 8,08-7,75 (m, 5H), 7,41 (dd, J=8,8, 2,OHz, 1H), 7,32-7,13 (m, 5H), 4,05-3,99 (m, 2H), 3,64-3,54 (m, 2H), 3,29 (m, 1H), 3,23-3,12 (m, 3H), 2,88-2,82 (m, 1H), 2,04-1,94 (m, 2H), 1,69-1,58 (m, 3H), 1,51 -1,47 (m, 1H), 0,90-0,83 (m, 3H), 0,81-0,76 (m, 9H).
ЯМР: 13С ЯМР (CDCl3, 100 MHz): 167,6, 142,4, 135,5, 133,7, 130,8 (2C), 130,6, 128,7 (2C), 128,3, 128,0 (2C), 127,8, 127,6, 127,4, 126,9, 126,4, 125,1, 56,6, 46,7, 46,5, 35,3, 32,2, 29,6, 28,9, 28,0, 26,6, 22,9, 22,6, 22,3, 14,3, 12,1 УФ: λмакс=235 нм, ε=34100; λ2=287 нм, ε=5750.
Пример 18 - Синтез соединения 18 N-(2-(метокси(метил)амино)-2-оксоэтил)-2-нафтамида

К смеси 2-нафтойной кислоты (5,8 г, 33,7 ммоль), 2-амино-N-метокси-N-метилацетамида (Gly амид Вейнреба; приготовленный из Boc-Gly амида Вейнреба 27, как в альтернативной методике Примера 22) (3,8 г, 32,1 ммоль) и DIPEA (12,0 мл, 68,9 ммоль) в DCM (70 мл) добавили ВОР (14,9 г, 33,7 ммоль) за одну порцию при комнатной температуре. Получившуюся смесь перемешивали в течение 1 часа, затем добавили насыщенный водный раствор NaHCO3.
Органический слой промыли соляным раствором (5×60 мл) и 1 н. HCl (2×30 мл), высушили над MgSO4, профильтровали и сконцентрировали при пониженном давлении для получения неочищенного продукта 18, который применяли в последующей реакции без дополнительной очистки.
Пример 19 - Синтез соединения 19 N-(2-(метокси(метил)амино)-2-оксоэтил)-2-нафтамида
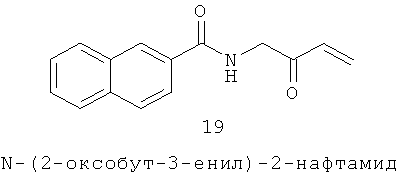
К раствору 18 (3,5 г, 12,85 ммоль) в сухом THF (10 мл) медленно добавили раствор винилмагнийбромида в THF (1 М, 31 мл) при 0°С. После добавления получившуюся смесь перемешивали при комнатной температуре в течение 1 часа, затем вылили в ледяной раствор 1 н. HCl (50 мл). Водный слой экстрагировали DCM (3×80 мл) и объединенные органические слои высушили над MgSO4, профильтровали и сконцентрировали при пониженном давлении для получения неочищенного α,β-ненасыщенного кетона 19. MS (ESI) 240 (М+1); ВЭЖХ tR 5,46 минут.
Пример 20 - Синтез соединения 20 N-(4-(3,5-дихлорбензиламино)-2-оксобутил)-2-нафтамида

К раствору 3,5-дихлорбензиламина (12 мг, 0,068 ммоль) в DCM (0,2 мл) добавили раствор α,β-ненасыщенного кетона 19 (13 мг, 0,054 ммоль) в DCM (0,5 мл) при комнатной температуре. Получившуюся смесь перемешивали до тех пор, пока все из α,β-ненасыщенного кетона не израсходовались (в течение одного часа), и затем применяли для реакций ацилирования/циклизации без очистки. MS (ESI) 415 (М+1); ВЭЖХ tR 6,00 минут.
Пример 21 - Синтез соединения 21 аллил 2-(метокси(метил)амино)-2-оксоэтилкарбамата

К Аllос(аллилоксикарбонил)-глицину (1,45 г, 9,1 ммоль) в DCM (20 мл) добавили ВОР реактив (3,3 г, 7,46 ммоль) и DIPEA (1,5 мл, 10,7 ммоль). После перемешивания при комнатной температуре в течение 10 мин добавили N,O-диметилгидроксиламин гидрохлорид (0,8 г, 8,2 ммоль) и DIPEA (1,5 мл, 10,7 ммоль). Реакцию перемешивали при комнатной температуре всю ночь. DCM удалили при помощи ротационного испарения и остаток поглотили в EtOAc (100 мл). Органическую фазу промыли водой (3×100 мл), насыщенным раствором бикарбоната натрия (3×50 мл), водой (3×50 мл), 1 М соляной кислотой (3×50 мл), соляным раствором (3×50 мл). Органическую фазу высушили (сульфат магния) и EtOAc удалили для получения амида Вейнреба 21 в форме белого твердого вещества (0,43 г, 23%).
Альтернативно, трет-бутил 2-(метокси(метил)амино)-2-оксоэтилкарбамат 27 (Boc-Gly амид Вейнреба, 1,4 г, 6,4 ммоль) в DCM (5 мл) и TFA (3 мл) перемешивали при комнатной температуре 1 час. Растворитель удалили при пониженном давлении с последующим добавлением DCM (20 мл) и затем DIPEA до основного. Раствор охладили до 0°С и аллил хлорформат добавили (1,4 мл, 13,2 ммоль). Реакцию перемешивали при комнатной температуре всю ночь. Реакционную смесь нейтрализовали 1 М соляной кислотой и экстрагировали EtOAc. EtOAc удалили при помощи ротационного испарения и остаток подвергли колоночной хроматографии на силикагеле при помощи петролейный эфир : ЕtOАс (1:1 к 0:1), обеспечивая амид Вейнреба 21 (0,86 г, 66%).
Пример 22 - Синтез соединения 22 аллил 2-оксобут-3-енилкарбамата

К амиду Вейнреба 21 (0,43 г, 2,1 ммоль) в DCM (5 мл) при 0°С добавили винил магнийбромид (10 ммоль) в THF (10 мл). Реакцию перемешивали в течение 2 часов и проверяли при помощи ВЭЖХ. Реакцию добавили к смеси из льда и 1 М соляной кислоты (100 мл). Водную смесь экстрагировали DCM (3×50 мл) и промыли 1 М соляной кислотой (2×100 мл) и водой (3×50 мл). Органическую фазу высушили (сульфат магния) и объем уменьшили до 50 мл при помощи ротационного испарения. α,β-Ненасыщенный кетон 22 хранили и применяли в растворе без дополнительной очистки.
Пример 23 - Синтез соединения 23 (S)-2-(аллилоксикарбониламино)-3-(нафталин-2-ил) пропановой кислоты

К перемешиваемой смеси L-3-(2-нафтил)аланин гидрохлорида (5,0 г, 19,8 ммоль), Nа2СО3 (7,3 г, 69,3 ммоль) и 1,4-диоксана (30 мл) в Н2O (50 мл) добавили аллилхлорформат (2,1 мл, 19,8 ммоль) при 0°С. Получившуюся смесь перемешивали в течение 16 часов, затем сконцентрировали при пониженном давлении. Остаток разбавили этилацетатом (50 мл) и при 0°С подкислили до рН 2. Водную фазу экстрагировали этилацетатом (3×20 мл), объединенную органическую фазу промыли Н2O (50 мл) и соляным раствором (20 мл), высушили над MgSO4, профильтровали и сконцентрировали при пониженном давлении для получения Aloc-2Nal-OH 23 в форме бесцветного масла (5,8 г, 97%), которое применяли на последующем этапе без дополнительной очистки. ВЭЖХ tR 6,60 мин.
Пример 24 - Синтез соединения 24 (S)-аллил 1-(метокси(метил)амино)-3-(нафталин-2-ил)-1-оксопропан-2-илкарбамата
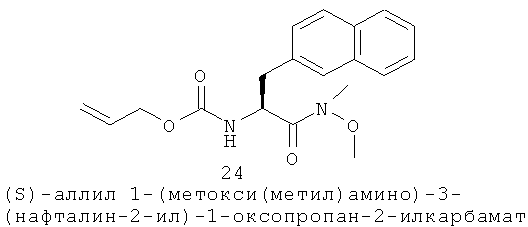
К перемешиваемой смеси кислоты 23 (5,84 г, 19,5 ммоль), DIPEA (3,7 мл, 2,09 ммоль) и ВОР (8,63 г, 19,5 ммоль) в DCM (10 мл) добавили предварительно смешанный раствор N,O-диметилгидроксиламин гидрохлорида (1,9 г, 19,5 ммоль) и DIPEA (7,3 мл, 41,6 ммоль) в DCM (10 мл) при комнатной температуре. Перемешивание продолжалось в течение 16 часов, реакционную смесь промыли 1 н. HCl (3×60 мл), H2O (3×60 мл), насыщенным водным раствором NaHCO3 (3×60 мл) и соляным раствором (60 мл), высушили над MgSO4. Очисткой хроматографии на силикагеле с помощью 20% ЕtOАс в петролейном эфире в качестве элюента получили амид Вейнреба 24 (4,83 г, 71%) в форме бесцветного масла. MS (ESI) 343 (М+1); ВЭЖХ tR 7,07 мин.
Пример 25 - Синтез соединения 25 (S)-аллил 1-(нафталин-2-ил)-3-оксопент-4-ен-2-илкарбамата

При 0°С добавили раствор винилмагнийбромида в THF (1 1,5 мл, 1 М) за одну порцию к амиду Вейнреба 24 (1,58 г, 4,62 ммоль) под азотом с перемешиванием. Получившейся смеси позволили перемешиваться в течение 2 часов, и вылили в смесь 1 н. HCl/лед (50 мл). Водную смесь экстрагировали DCM (3×20 мл), обединенный экстракт DCM промыли 1 н. HCl (50 мл), насыщенным водным раствором NaHCO3 (50 мл) и соляным раствором (20 мл), высушили над МgSO4. Растворитель удалили при пониженном давлении, обеспечивая α,β-ненасыщенный кетон 25 (1,14 г, 80%), который применяли на последующем этапе без дополнительной очистки. MS(ESI) 310 (М+1); ВЭЖХ tR 7,51 мин.
Пример 26 - Синтез соединения 26 (S)-аллил 5-(2,2-дифенилэтиламино)-1-(нафталин-2-ил)-3-оксопентан-2-илкарбамата

К перемешиваемому раствору 2,2-дифенилэтиламина (0,45 г, 2,3 ммоль) в DCM (55 мл) добавили винилкетон 25 (0,71 г, 2,3 ммоль) за одну порцию. Перемешивание продолжали в течение 2 часов с реакционной смесью, применяемой для реакций ацилирования/циклизации без очистки. MS(ESI) 507 (М+1); ВЭЖХ tR 7,22 мин.
Пример 27 - Синтез соединения 27 трет-бутил 2-(метокси(метил)амино)-2-оксоэтилкарбамата (Boc-Gly амид Вейнреба)

К перемешанной смеси Boc-Gly-OH (20 г, 114,1 ммоль), DIPEA (19,8 мл, 114,1 ммоль) и ВОР (50,5 г, 114,1 ммоль) в DCM (20 мл) добавили предварительно смешанный раствор N,O-диметилгидроксиламингидрохлорида (11,2 г, 114,1 ммоль) и DIPEA (19,8 мл, 114,1 ммоль) в DCM (20 мл) при комнатной температуре. Получившуюся смесь перемешивали в течение 16 часов, затем промыли 1 Н HCl (3×120 мл), H2O (3×120 мл), насыщенным водным раствором (NаНСО3 (3×120 мл) и соляным раствором (40 мл), высушили над MgSO4, профильтровали и сконцентрировали при пониженном давлении для получения 27 в форме белого твердого вещества (20 г, 80%), которое применяли на следующем этапе без дополнительной очистки. MS(ESI) 219 (M+1); ВЭЖХ tR 4,12 минут.
Пример 28 - Синтез соединения 28 трет-бутил 2-оксобут-3-енилкарбамата
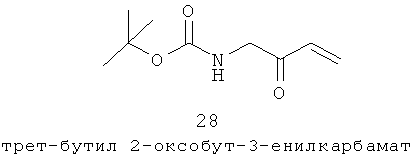
При 0°С раствор винилмагнийбромида в THF (184 мл, 1 М) добавили за одну порцию к амиду Вейнреба 27 (20 г, 91,6 ммоль) под азотом с перемешиванием. Полученной смеси позволили перемешиваться в течение 2 часов и вылили в смесь 1н. HCl/лед (400 мл). Водную смесь экстрагировали DCM (5×100 мл), объединенный DCM экстракт промыли 1 н. HCl (2×100 мл), насыщенным водным раствором NаНСО3 (100 мл) и соляным раствором (100 мл), затем высушили над MgSO4. Растворитель удалили при пониженном давлении, получили кетон 28 (12,9 г, 76%) в форме бледно-желтого масла, который применяли на следующем этапе без дополнительной очистки. MS(ESI) 186 (М+1); ВЭЖХ tR 4,19 минут.
Пример 29 - Синтез соединения 29 трет-бутил 4-(2,2-дифенилэтиламино)-2-оксобутилкарбамата

К перемешиваему раствору 2,2-дифенилэтиламина (0,33 г, 1,66 ммоль) в DCM (10 мл) добавили α,β-ненасыщенный кетон 28 (0,31 г, 1,66 ммоль) при комнатной температуре. Перемешивание продолжали в течение 2 часов; неочищенную реакционную смесь 29 применяли для реакций ацилирования/циклизации без очистки. MS(ESI) 383 (М+1); ВЭЖХ tR 5,98 минут.
Пример 30 - Синтез соединения 30 (S)-трет-бутил 3-метил-4,8-диоксо-10-фенил-2,9-диокса-3,7-диазадекан-6-карбоксилата

К суспензии соли Cbz-L-Asp-OtBu-DCHA (10,1 г, 20,0 ммоль), N,O-диметилгидроксиламин-HCl (5,9 г, 60,5 ммоль) и DIPEA (12,0 мл, 68,9 ммоль) в DCM (150 мл) добавили ВОР (10,6 г, 24,0 ммоль) за одну порцию при комнатной температуре. Получившуюся суспензию перемешивали в течение 3 часов, затем добавили Н2O (100 мл). Органический слой промыли 1 н. HCl (2×100 мл), насыщенным водным раствором NaHCO3 (2×100 мл) и соляным раствором (3×100 мл) и затем высушили над MgSO4, профильтровали и сконцентрировали при пониженном давлении для получения неочищенного продукта. Очистка при помощи флэш-хроматографии на силикагеле (пет. эфир/ ЕtOАс 1:2) дала 30 (6,4 г, 87%) в форме бесцветного масла. MS (ESI) 367 (М+1); ВЭЖХ tR 6,87 минут.
Пример 31 - Синтез соединения 31 (S)-3-метил-4,8-диоксо-10-фенил-2,9-диокса-3,7-диазадекан-6-карбоновой кислоты
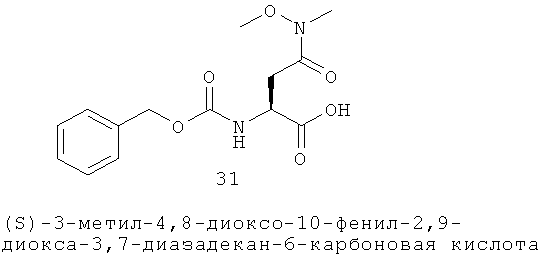
Соединение 30 (300 мг, 0,82 ммоль) растворили в TFA/DCM (1:1) растворе (2 мл) и получившуюся смесь перемешивали при комнатной температуре в течение 2 часов. Растворители удалили при пониженном давлении и остаток повторно растворили в DCM (10 мл). Этот раствор промыли 1н. HCl (1×10 мл) и органический слой высушили над MgSO4, профильтровали и сконцентрировали при пониженном давлении для получения неочищенного продукта 31 (235 мг, 92%), который применяли в последующей реакции без дополнительной очистки. MS (ESI) 311 (М+1); ВЭЖХ tR 4,96 минут.
Пример 32 - Синтез соединения 32 (S)-бензил 8-(2,2-дифенилэтил)-3,16,16-триметил-4,7,11,14-тетраоксо-2,15-диокса-3,8,13-триазагептадекан-6-илкарбамата
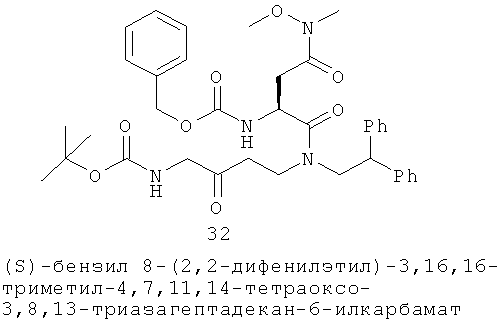
Соединение 32 получили из соединения 29 и 31, следуя методике Примера 14. MS (ESI) 675 (М+1); ВЭЖХ tR 8,31 минут.
Пример 33 - Синтез соединения 33 трет-бутил ((3S,5S)-1-(2,2-дифенилэтил)-3-(2-(метокси(метил)амино)-2-оксоэтил)-2-оксо-1,4-диазепан-5-ил)метилкарбамата

Смесь неочищенного 32 (350 мг) и 5% Pd/C (200 мг) в 2-пропаноле (15 мл) взбалтывали при комнатной температуре под водородом (30 psi) в течение 24 часов. Смесь затем профильтровали через прокладку из Целита и фильтрат сконцентрировали при пониженном давлении для получения неочищенного продукта. Очистка при помощи флэш-хроматографии на силикагеле (100% ЕtOАс) дала 33 (175 мг, 65% через 3 этапа) в форме белого твердого вещества. MS (ESI) 525 (М+1); ВЭЖХ tR 6,24 минут.
Пример 34 - Синтез соединения 34 2-((2S,7S)-7-(аминометил)-4-(2,2-дифенилэтил)-3-оксо-1,4-диазепан-2-ил)-N-метокси-N-метилацетамида
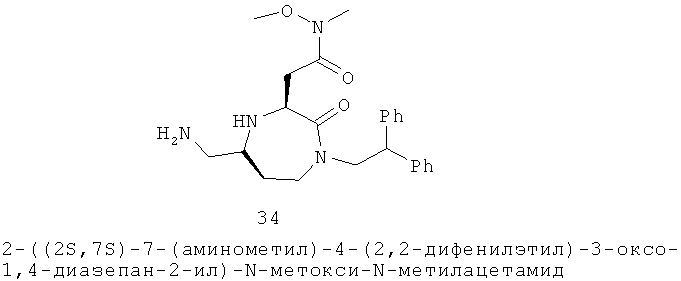
Соединение 33 (175 мг, 0,333 ммоль) растворили в TFA/DCM (1:1) растворе (1 мл) и получившуюся смесь перемешивали при комнатной температуре в течение 2 часов. Растворители удалили при пониженном давлении и остаток повторно растворили в ЕtOАс (20 мл). Насыщенный водный раствор NaHCO3 (10 мл) и солевой раствор (10 мл) добавили к вышеупомянутому раствору и водный слой экстрагировали ЕtOАс (9×20 мл). Объединенные органические слои высушили над NgSO4, профильтровали и сконцентрировали при пониженном давлении для получения неочищенного продукта 34 (120 мг, 85%) в форме желтого твердого вещества, который применили в последующей реакции без дополнительной очистки. MS (ESI) 425 (М+1); ВЭЖХ fR 5,20 минут.
Пример 35 - Синтез соединения 35 N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(2-(метокси(метил)амино)-2-оксоэтил)-2-оксо-1,4-диазепан-5-ил)метил)-6-фтор-2-нафтамида
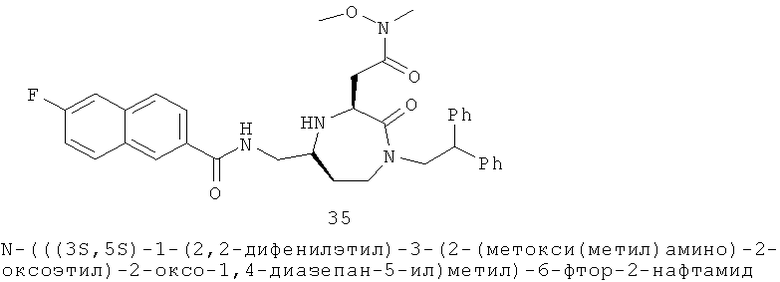
К раствору 34 (50 мг, 0,118 ммоль) и 6-фтор-2-нафтойной кислоты (27 мг, 0,142 ммоль) в DCM (4 мл) добавили DIC (22 мкл, 0,142 ммоль) при комнатной температуре. Получившуюся смесь перемешивали в течение 2 часов, затем растворитель удалили при пониженном давлении для получения неочищенного продукта. Очистка при помощи флэш-хроматографии на силикагеле (элюируя петролейным эфиром : ЕtOАс (1:1), затем ЕtOАс) дала 35 (29 мг, 41%) в форме белого твердого вещества. MS (ESI) 597 (М+1); ВЭЖХ tR 6,75 минут.
Пример 36 - Синтез соединения 36 N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-оксоэтил)-1,4-диазепан-5-ил)метил)-6-фтор-2-нафтамида
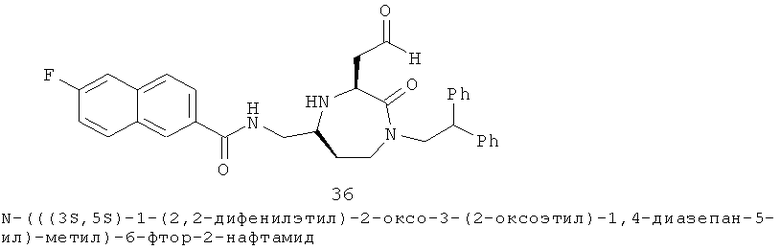
К раствору 35 (29 мг, 0,049 ммоль) в сухом THF (1 мл) добавили LiAlH(OtBu)3 (38 мг, 0,145 ммоль) за одну порцию при комнатной температуре и получившуюся суспензию перемешивали всю ночь. Эту суспензию затем медленно вылили в холодный (0°С) 0,4 М водный раствор KHSO4 (2 мл, 0,8 ммоль) и получившуюся смесь разбавили ЕtOАс (3 мл). Водный слой экстрагировали ЕtOАс (3×3 мл) и объединенные органические слои промыли 1 н. HCl (3×6 мл), насыщенным водным раствором NaHCO3 (1×6 мл) и соляным раствором (1×6 мл). Органический раствор затем высушили над MgSO4, профильтровали и сконцентрировали при пониженном давлении для получения 36 (24 мг, 91%). MS (ESI) 538 (M+1); ВЭЖХ tR 6,41 минут.
Пример 37 - Синтез Вос-Glu(пиперидин)-ОН 37 (S)-2-(трет-бутоксикарбониламино)-5-оксо-5-(пиперидин-1-ил)пентановой кислоты
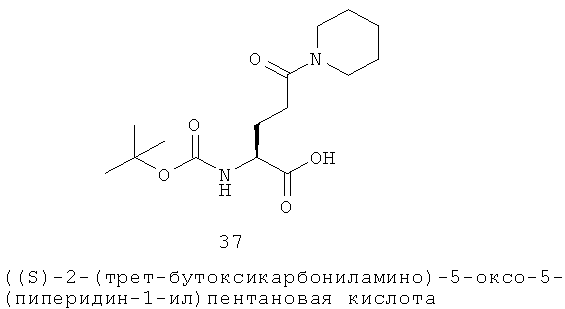
HATU (2,5 г) и DIPEA (1,5 мл) добавили к Boc-L-Glu(OH)-OBn (2,0 г) в DCM (50 мл), перемешивали в течение 10 минут, затем добавили пиперидин (0,7 мл) и реакцию перемешивали всю ночь при комнатной температуре. Реакцию промыли раствором бикарбоната натрия (2х), насыщенным NH4Cl (2x), соляным раствором (2х), высушили над MgSO4, профильтровали и выпарили для получения 2,9 г Вос-L-Glu (пиперидин)-ОВn. Бензиловый сложный эфир (0,6 г) растворили в ЕtOН (15 мл) с каталитическим Pd/C и гидрогенизировали в течение 1 часа, профильтровали через Целит и выпарили ЕtOН при помощи ротационного испарения для получения 0,51 г 37.
Пример 38 - Синтез соединения 38 1-фенил-9-(2,2-дифенилэтил)-3,6,10-триоксо-2,11-диокса-4,9-диазатетрадец-13-ена
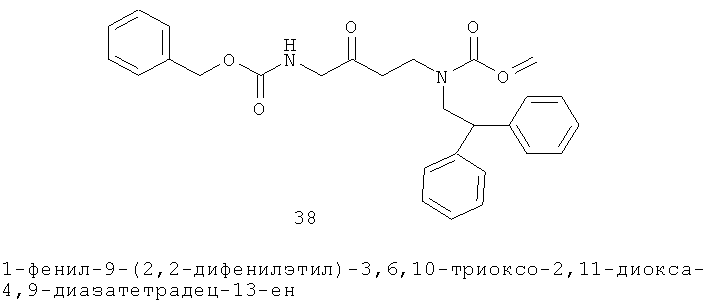
2,2-Дифенилэтиламин (412 мг, 2,09 ммоль) добавили к раствору Cbz-винилкетон 13 (1,9 ммоль) в DCM (40 мл). Через 5 мин добавили Alloc-Cl (0,41 мл, 3,80 ммоль) и DIPEA (0,99 мл, 5,70 ммоль) и реакцию перемешивали еще в течение 1 часа. Раствор промыли нас. NaHCО3 и выпарили досуха для получения коричневого масла. Очисткой при помощи колоночной хроматографии (гель SiO2, пет. эфир/ЕtOАс) получили 815 мг 38.
Пример 39 - Синтез соединения 39 (S)-аллил 2-амино-3-(пиридин-2-ил)пропаноата

К раствору Вос-L-3-(2-пиридил)-Аlа-ОН (810 мг, 3,04 ммоль) в DCM (12 мл) добавили аллиловый спирт (0,31 мл, 4,56 ммоль), затем HATU (1736 мг, 4,57 ммоль) и DIPEA (0,79 мл, 4,57 ммоль). После перемешивания в течение 2 часов раствор сконцентрировали и половину смеси очистили колоночной хроматографией (гель SiO2, пет. эфир/ЕtOАс) для получения 670 мг Вос-L-3-(2-пиридил)-Аlа-Оаллил. Порцию этого продукта (290 мг, 0,95 ммоль) растворили в DCM (3 мл) и TFA (3 мл) и перемешивали в течение 5 мин. Раствор сконцентрировали, затем добавили DCM, промыли насыщ. NaHCO3 и выпарили досуха для получения 39 в форме бесцветного масла (280 мг), которое применяли без очистки на следующем этапе.
Пример 40 - Синтез соединения 40 (2S)-аллил 2-(9-(2,2-дифенилэтил)-3,10-диоксо-1-фенил-2,11-диокса-4,9-диазатетрадец-13-ен-6-иламино)-3-(пиридин-2-ил)пропаноата

Защищенный аминокетон 38 (474 мг, 0,95 ммоль), L-3-(2-пиридил)-Аlа-Оаллил 39 (0,95 ммоль) и NаВН(ОАс)3 (403 мг, 1,90 ммоль) в DCM (6,7 мл) перемешивали в течение 17 часов. Добавили насыщенный NaHCO3, экстрагировали DCM (3х) и органические экстракты объединили и промыли насыщенным NаНСО3 и H2O, высушили над MgSO4 и выпарили досуха для получения 40 (810 мг) в форме бледно-желтого масла (как смесь диастереоизомеров), которое применяли в последующей реакции без очистки.
Пример 41 - Синтез соединения 41 (2S)-2-(1-(бензилоксикарбониламино)-4-(2,2-дифенилэтиламино)бутан-2-иламино)-3-(пиридин-2-ил)пропановой кислоты
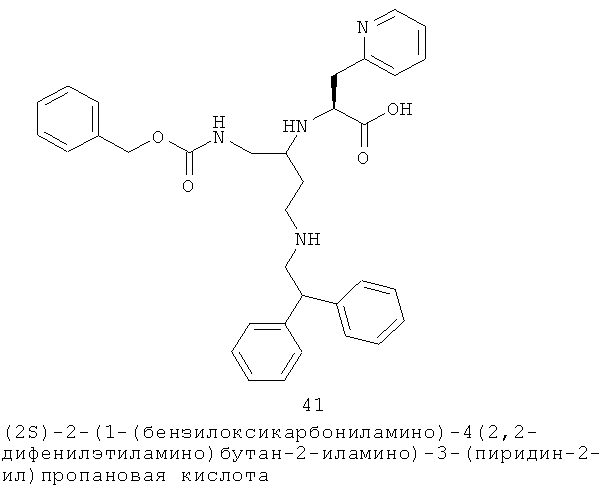
Аllос/аллил-защищенное производное 40 (656 мг, 0,95 ммоль) растворили в DCM (10 мл) и раствор дегазировали под вакуумом. Добавили 1,3-диметилбарбитуровую кислоту (296 мг, 1,90 ммоль) и каталитический Рd(РРh3)4 (220 мг, 0,19 ммоль) и реакцию перемешивали в течение 1 часа для получения раствора 41 со снятыми защитными группами, который применяли на следующем этапе без очистки.
Пример 42 - Синтез соединений 42 и 43: бензил((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(пиридин-2-илметил)-1,4-диазепан-5-ил)метилкарбамата и бензил((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(пиридин-2-илметил)-1,4-диазепан-5-ил)метилкарбамата
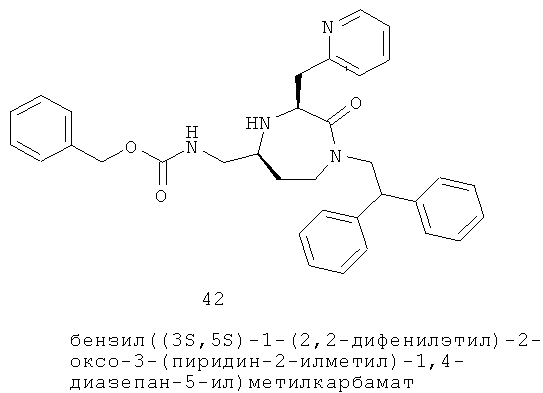
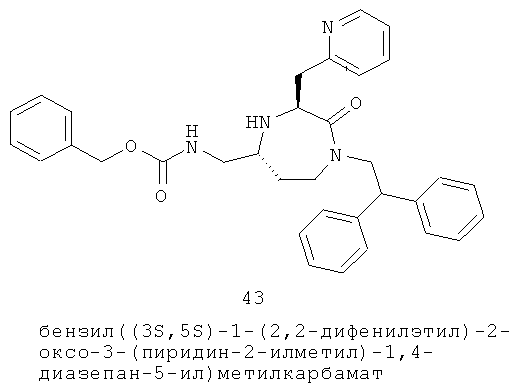
К неочищенному 41 со снятыми защитными группами (0,95 ммоль) в DCM (10 мл) добавили HATU (541 мг, 1,43 ммоль), затем DIPEA (0,50 мл, 2,85 ммоль). Через 30 мин раствор промыли (насыщ. NaHCO3, соляным раствором), высушили (MgSO4) и выпарили. Два диастереоизомерных продукта разделили колоночной хроматографией (гель SiO2, пет. эфир/ЕtOАс) для получения 260 мг ранее элюированного (3S,5S) изомера 42 и 175 мг позднее элюированного (3S,5R) изомера 43.
Пример 43 - Синтез соединения 44 (3S,5S)-5-(аминометил)-1-(2,2-дифенилэтил)-3-(пиридин-2-илметил)-1,4-диазепан-2-она
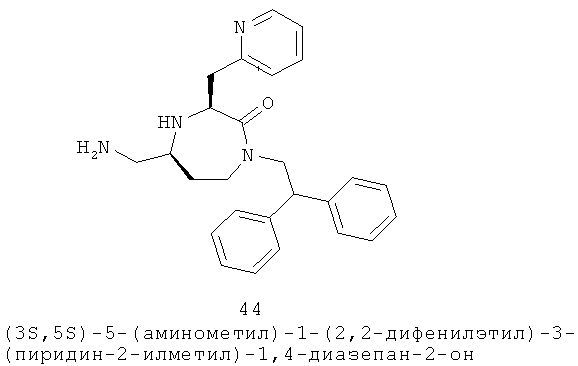
Cbz-группу предпочтительного диастереомера 42 удалили гидрогенизацией (Н2, 1 атм.) суспензии 42 (35 мг) и Pd/C (50 мг) в ЕtOАс/метаноле всю ночь. Раствор профильтровали через Целит и выпарили для получения 44 в форме бесцветного масла (25 мг).
Пример 44 - Синтез соединения 45 (Е)-3-(4-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(пиридин-2-илметил)-1,4-диазепан-5-ил)метил)акриламида

К неочищенному свободному амину 44 (25 мг, 0,06 ммоль) в DCM добавили 4-хлоркоричную кислоту (13 мг, 0,07 ммоль), DIPEA (25 мкл, 0,14 ммоль) и ВОР (31 мг, 0,07 ммоль). После перемешивания в течение всей ночи раствор промыли (насыщ. NaHCO3, соляной раствор), высушили (MgSO4) и выпарили под высоким вакуумом, остаток очистили при помощи препаративной ВЭЖХ для получения 30 мг 45. MS (ESI) 579,3 (M+1); ВЭЖХ tR 6,60 мин.
Пример 45 - Синтезы соединений 46-80.
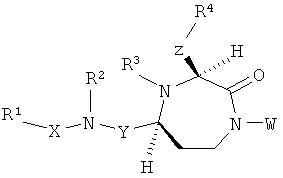
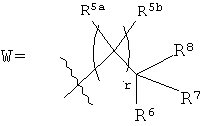
Соединения 17 и 45-80 с заместителями, как идентифицировано в Таблице 1, были получены, как в предыдущих примерах, согласно путям, указанным на схемах 1-5, как подытожено в таблице 2, с экспериментальными свойствами, подытоженными в таблице 3.
Пример 46 - испытание радиолигандного связывания человеческого MC5R
Оценки связывания соединения с человеческим MC5R (hMC5R) посредством перемещения 125I-меченого NDP-MSH рецепторного лигандного пептида осуществили в основном, как описано в спецификациях, выпускаемых Perkin Elmer для сопровождения их замороженных hMC5R мембран (Perkin Elmer номер по каталогу RBXMC5M400UA).
[125I] NDP-MSH: меченный радиоактивной меткой собственного производства и очищенный посредством ВЭЖХ:
Na125I (0,5 мКи, 17,4 Ки/мг) добавили к 50 мкл фосфата натрия (50 мМ, рН 7,4) в пробирке Эппендорфа, предварительно покрытой IODOGEN. После инкубации в течение 10 минут фосфатный буфер, содержащий йод, добавили к NDP-MSH (10 мкл в 1 мг/мл) в отдельной пробирке Эппендорфа. Ее инкубировали в течение еще 10 минут. Йодированный NDP-MSH очистили посредством ВЭЖХ на Zorbax SB 300 колонке при помощи растворителя А: 0,05% TFA и растворителя В: 90% ацетонитрил 0,045% TFA с линейным градиентом, 0-67% В в течение 60 минут. 125I NDP-MSH элюировали в 52 минуты после немеченого исходного материала (48 минут), подсчитали и хранили в морозильной камере. Его применяли не позднее 48 часов в качестве радиоактивного распада и разложения лиганда, что приводило к значительно уменьшенному специфическому связыванию, наблюдаемому через 72 часа.
Реактивы:
Инкубационный буфер: 25 мМ HEPES(N-2-гидроксиэтилпиперазин-N-2-этансульфоновая кислота)-КОН (рН 7,0), 1,5 мМ CaCl2, 1 мМ MgSO4, 0,1 М NaCl, 1 мМ 1,10-фенантролин и 1 таблетка протеазного ингибитора Complete™/100 мл (Roche, номер по каталогу 1873580).
Замороженные мембраны ПМС5 Perkin Elmer; номер по каталогу RBXMC5M400UA, 0,4 мл/пробирка; 400 микроиспытаний/пробирка, 0,78 мг/мл концентрация белка.
Пробирки замороженных мембран быстро размораживали непосредственно перед применением, разбавляли связывающим буфером и встряхивали. Держали ресуспендированные мембраны на льду до тех пор, пока их не добавили в лунки планшета.
Протокол связывания для 400 микроиспытаний на пробирку:
Испытания выполнили в 96-луночных полипропиленовых планшетах. Мембраны (0,78 мкг 40 мкл 1:40 разведение в инкубационном буфере) добавили к [125I] NDP-MSH (0,84 нМ; 2200 Ки/ммоль) и тестовым соединениям в общем объеме 140 мкл. Их инкубировали в течение 1 часа при 37°С. Неспецифическое связывание определяли с помощью 3 мМ NDP-MSH. Планшеты профильтровали при помощи Tomtec харвестера клеток с GF/A фильтрами (Wallac) (предварительно пропитанные в 0,6% полиэтиленимине) и промыли три раза 1,0 мл ледяного промывочного буфера (вышеупомянутый инкубационный буфер без 1,10-фенантролина и таблетки протеазного ингибитора Complete™). Фильтры высушили в 37°С печи, поместили в мешок для образцов и добавили 5 мл Betaplatescint (Wallac). Полученные фильтры подсчитали в кассетах в Microbeta Trilux (Wallac) в течение 1 минуты. Неспецифическое связывание только при 5%. Анализ данных осуществили при помощи GraphPad Prism 4, задействовав конкурентное связывание с односайтовой моделью и постоянным коэффициентом Хилла. Использовали следующее уравнение: Y=Нижнее значение + (Верхнее значение - Нижнее значение)/1/10∧(X-logEC50), где Х= log(концентрация), и Y = связывание для соответствия с данными.
Пример 47 - Активность выбранных соединений: связывание hMCSR
Типичные соединения данного изобретения были протестированы на связывание в испытании hMC5R, как в Примере 46, как перечислено в Таблице 3. Соединения были протестированы как их трифторацетат, или гидрохлоридные соли, или как их свободные основания.
Пример 48 - Испытание радиолигандного связывания MC5R при помощи МС5 рецепторов из других видов
Радиолигандное связывание и испытания цАМФ также проводили при помощи мембран и клеток, экспрессирующих MC5R, клонированных из других видов (мышиные MC5R мембраны из Euroscreen, собаки, макак-резуса, яванского макака и морской свинки, клонированные и экспрессированные из кДНК библиотек, как описано в Примерах 50 и 52. Мембраны плазмы из клеток протестировали в радиолигандном испытании, как в Примере 46).
Пример 49 - Активность выбранных соединений: MC5R других видов
Типичные соединения данного изобретения были протестированы на связывание с MC5R из других видов, как описано в Примере 48, результаты приведены в Таблице 4.
Эти результаты показывают избирательность соединений данного изобретения для человеческого MC5R по сравнению с MC5R у других видов. Хотя и имеется активность в других видах, она значительно уменьшена по сравнению с человеческим MC5R, которую и не следовало бы ожидать, принимая во внимание высокую рецепторную гомологию между видами.
Пример 50 - Испытание радиолигандного связывания MC1R, MC3R и MC4R человека
Испытания радиолигандного связывания проводили при помощи коммерческих или приготовленных собственной разработкой hMC1R, hMC3R и DMC4R мембран и [125I] NDP-MSH согласно hMC5R методике в Примере 46.
Мембраны плазмы собственной разработки приготовили из трансфицированных клеток млекопитающих (приготовленных, как в Примере 52, при помощи плазмидной ДНК, содержащей человеческий MC1R, MC3R или MC4R ген в плазмидном векторе с точкой начала репликации млекопитающего)
Прикрепленные к субстрату клетки промыли теплым буферным солевым раствором Ханка (HBSS). 1 мл холодного HBSS добавили в каждый сосуд и клетки соскребли резиновым скребком. Соскобленные клетки добавили в 50 мл пробирку на льду. Планшеты затем прополоскали дважды 5 мл холодного HBSS, и это также добавили в пробирку. Клетки центрифугировали при 1000×g в течение 5 минут в настольной центрифуге и супернатант декантировали. Оставшийся клеточный осадок ресуспендировали в 0,25 М сахарозе. Клеточную суспензию снова центрифугировали, как ранее, и осадок ресуспендировали в 5 мл 0,25 М сахарозы, содержащей протеазные ингибиторы. Клетки гомогенизировали посредством 10-секундной пульсации Ika диспергатором с последующими 30 секундами на льду. Гомогенизацию и инкубацию на льду повторили три раза. Смесь затем центрифугировали при 1260×g в течение 5 минут. Супернатант декантировали в другую центрифужную пробирку, в которую добавили буфер, содержащий 50 мМ Tris (трис(гидроксиметил)аминометан), рН 7,4, 12,5 мМ MgCl2, 5 мМ EGTA (этиленгликольтетрауксусная кислота) и протеазные ингибиторы для доведения объема до 30 мл. Его центрифугировали при 30000×g в течение 90 минут при 4°С. Получившийся осадок ресуспендировали в 1 мл вышеупомянутого буфера, который также содержал 10% глицерина. Взяли аликвоты мембран в криопробирки, которые были быстро заморожены в бане сухой лед/этанол перед хранением при -80°С до тех пор, пока не потребуются для применения.
Пример 51 - избирательность выбранных соединений: связывание hMCR
Типичные соединения данного изобретения были протестированы на связывание в испытаниях hMC1R, hMCSR, hMC4R и hMC5R, как описано в Примерах 46 и 50, результаты перечислены в Таблице 5.
Эти результаты демонстрируют избирательность соединений данного изобретения для человеческого MC5R по сравнению с другими членами человеческого меланокортинового рецепторного семейства.
Пример 52 - ингибирование или стимулирование цАМФ сигнала в клетках, экспрессирующих MC5R человека
Временная трансфекция клеточных линий млекопитающих:
Линию клеток млекопитающего, клеток человеческой эмбриональной почки (НЕК 293), содержали в модифицированной по способу Дульбекко среде Игла (DMEM) с 5% зародышевой бычьей сывороткой, L-глутамином, высокой глюкозой и антибиотиками/противогрибковыми средствами. В день перед трансфекцией клетки были пересеяны с использованием трипсина/ЭДТА и высеяны в 75 см2 сосуды так, чтобы они были приблизительно на 90% конфлюэнтными на следующий день. На следующий день клеточную среду заменили на свежую DMEM, содержащую антибиотик/противогрибковое средство. Приблизительно 100 мкл трансфекционного липида Turbofectin 8.0 (Origene Technologies, MD, США) разбавили в 1,0 мл сыворотки и не содержащей антибиотик/противогрибковое средство OptiMEM в стерильной 15 мл пробирке и инкубировали в течение 5 минут при комнатной температуре. После инкубации приблизительно 10-20 мкг плазмидной ДНК, экспрессирующей интересующий ген (например: pCMV6-XL4:Homo sapiens меланокортин 5 рецептор (Origene Technologies, MD, США)), разбавили в трансфекционной смеси и инкубировали в течение еще 30 минут при комнатной температуре. Раствор ДНК/липида затем добавили по капле к среде, покрывающей клетки, при осторожном покачивании сосуда. Через 24 часа после трансфекции клетки были пересеяны и высеяны непосредственно в два 75 см2 сосуда и оставлены для восстановления. Через 48 часов после трансфекции клетки были собраны для применения в испытаниях с раствором для клеточной диссоциации.
Испытание стимулирования циклического аденозинмонофосфата [цАМФ]:
Клетки НЕК 293, временно экспрессирующие меланокортиновый МС5 рецептор, были суспендированы в стимулирующем буфере (буферный солевой раствор Ханка (HBSS), 0,1% бычий сывороточный альбумин, протеазные ингибиторы и 0,5 мМ 3-изобутил-1-метилксантин) при 4×106 клеток/мл. 5 мкл клеток плюс соединения/пептиды, как описано ниже, добавили в лунки 384-луночного планшета как можно быстрее после ресуспендирования.
Для обнаружения антагонистической активности разбавили тестовые соединения при переменных концентрациях в стимулирующем буфере в четырехкратном концентрате и добавили 2,5 мкл в лунки, содержащие клетки. 2,5 мкл четырехкратной нужной концентрации NDP-MSH или альфа-MSH добавили во все лунки, содержащие соединения. Лунки отрицательного контроля содержали двухкратно концентрированный NDP-MSH или альфа-MSH отдельно без соединения.
Для обнаружения антагонистической активности разбавили тестовые соединения при переменных концентрациях в стимулирующем буфере в двухкратном концентрате и добавили 5 мкл в лунки, содержащие клетки. Лунки положительного контроля содержали только NDP-MSH или альфа-MSH (без соединения) в двухкратном концентрате.
Лунки контроля базального уровня (цАМФ) содержали только стимулирующий буфер (без агониста или соединений). Планшет включал известные концентрации цАМФ (стандарты) в стимулирующем буфере, но клетки в эти лунки не добавлялись. Планшет затем инкубировали в течение 30 минут при 37°С со слабым взбалтыванием. После инкубации добавили 10 мкл лизирующего буфера (10% Твин 20, 1 М HEPES, 0,1% BSA (бычий сывороточный альбумин), протеазные ингибиторы, ddH2O (дважды дистиллированная вода)) во все лунки, подлежащие измерению. Обнаружение цАМФ затем выполнили с помощью набора Alphascreen cAMP (Perkin Elmer, США), как кратко описано далее. Разведение 10 мкл гранул акцептора/мл лизирующего буфера приготовили в условиях слабой освещенности. 5 мкл разбавленных гранул акцептора добавили в каждую лунку, подлежащую измерению, затем планшет инкубировали в течение 30 минут при комнатной температуре в темноте с осторожным взбалтыванием. В условиях слабой освещенности донорные гранулы были разбавлены в 10 мкл/мл лизирующего буфера, к которому добавили 0,75 мкл биотинилированного цАМФ/мл лизирующего буфера. Этой смеси позволили инкубироваться в течение 30 минут при комнатной температуре (в темноте) перед тем, как продолжили испытание. После инкубации по 5 мкл/мл смеси биотинилированного цАМФ/донорной гранулы добавили на лунку в условиях слабой освещенности и планшет инкубировали в темноте при комнатной температуре в течение дополнительного часа. Планшеты считывали на планшет-ридере Envision (Perkin Elmer) после 1 часа и ~16 часов инкубации. Концентрацию цАМФ в клетках определили с применением 'стандартной кривой', полученной из результатов известных концентраций цАМФ, как описано ниже.
Каждый аналитический планшет содержал "стандартную кривую" известных концентраций цАМФ в 10-кратных разведениях. Это существенная часть анализа, так как имеется высокая межпланшетная изменчивость. Планшеты считывались на многомаркировочном планшет-ридере Envision, оснащенном Alphascreen технологией, и исходные данные импортировались в программное обеспечение GraphPad Prism 4 (GraphPad, США) для анализа. Кривую приспособили к известным концентрациям с помощью нелинейной регрессии, в особенности при помощи сигмоидального уравнения "доза - ответная реакция" (Y = Нижнее значение + (Нижнее значение + (Верхнее значение-Нижнее значение)/1+10logEC50-X), где уравнение показывает ответ как функцию логарифма концентрации. Х представляет собой логарифм концентрации пептида/соединения, и Y представляет собой ответ. Также в этом уравнении рассматриваются нижнее плато, верхнее плато кривой и EC50 (эффективная концентрация, 50%)
Пример 53 - Активность выбранных соединений: hMC5R
Типичные соединения данного изобретения были протестированы на агонизм или антагонизм hMC5R, как описано в Примере 52, результаты перечислены в Таблице 6.
Ссылки
Andersen, G.N.; Hagglund, M.; Nagaeva, O.; Frangsmyr, L.; Petrovska, R.; Mincheva-Nilsson,
L.; Wikberg, J.E.S. Scand. J. Immunol. 2005, 61, 279-284 "Quantitative measurement of
the levels of melanocortin receptor subtype 1, 2, 3 and 5 and pro-opio-melanocortin
peptide gene expression in substes of human peripheral blood leukocytes" Barrett, P.; MacDonald, A.; Helliwell, R.; Davidson, G.; Morgan, P.J. Molec. Endocrin. 1994, 12,
203-213 "Cloning and expression of a new member of the melanocyte-stimulating
hormone receptor family" Bataille, V.; Snieder, H.; MacGregor, A.J.; Sasieni, P.; Spector, T.D. J. Invest. Dermatol. 2002,
119, 1317-1322 " The Influence of Genetics and Environmental Factors in the
Pathogenesis of Acne: A Twin Study of Acne in Women" Bhardwaj, S.S.; Rohrer, Т.Е.; Arndt, K.A. Semin. Cutan. Med. Surg. 2005, 24, 107-112 "Lasers
and light therapy for acne vulgaris" Bohm, M.; Luger, T.A.; Tobin, D.J.; Garcia-Borron, J.C. J. Invest. Dermatol. 2006, 126, 1966-
1975 "Melanocortin Receptor Ligands: New Horizons for Skin Biology and Clinical
Dermatology" Buggy, J.J. Biochem J. 1998, 331, 211-216 "Binding of α-melanocyte-stimulating hormone to its
G-protein-coupled receptor on B-lymphocytes activates the Jak/STAT pathway" Burke, B.M.; Cunliffe, W.J.; Br. J. Dermatol. 1984, 112 124-126 " Oral spironolactone therapy
for female patients with acne, hirsutism or androgenic alopecia" Caldwell, H.K.; Lepri, J.J. Chem. Senses 2002, 27, 91-94 "Disruption of the fifth melanocortin
receptor alters the urinary excretion of aggression-modifying pheromones in male house
mice" Cerda-Reverter, J.M.; Ling, M.K.; Schioth, H.B.; Peter, R.E. J. Neurochem. 2003, 1354-1367
"Molecular cloning, characterization and brain mapping of the melanocortin 5 receptor in
goldfish" Chen, W.; Kelly, M.A.; Opitz-Araya, X.; Thomas, R.E.; Low, M.J.; Cone, R.D. Cell, 1997, 91,
789-798 "Exocrine gland dysfunction in MC5-R-deficient micee: evidence for coordinated
regulation of exocrine gland function by melanocortin peptides" Chhajlani, V.; Muceniece, R.; Wikberg, J.E.S. BBRC 1993, 195, 866-873 "Molecular Cloning of
a Novel Human Melanocortin Receptor" Clarke, S.B.; Nelson, A.M.; George, R.E.; Thiboutot, D.M. Dermatol. Clin. 2007, 25, 137-146
"Pharmacologic Modulation of Sebaceous Gland Activity: Mechanisms and Clinical
Applications".
Cordain, L. Sem. Cut. Med Surg. 2005, 24, 84-91 "Implications for the Role of Diet in Acne" Cotterill, J.A.; Cunliffe, W.J.; Williamson, B. Brit. J. Dermatol. 1971, 85, 93-94 "Severity of Acne
and Sebum Excretion Rate"
Danby, F.W. J. Am. Acad. Dermatol. 2005, 52, 1071-1072 "Why we have sebaceous glands" Eisinger, M.; Fitzpatrick, L.J.; Lee, D.H.; Pan, K.; Plata-Salaman, C.; Reitz, A.B.; Smith-
Swintosky, V.L.; Zhao, B. WО 03/040117 15 May 2003a "Novel 1,2,4-thiadiazole
derivatives as melanocortin receptor modulators" Eisinger, M.; Fitzpatrick, L.J.; Lee, D.H.; Pan, K.; Plata-Salaman, C.; Reitz, A.B.; Smith-
Swintosky, V.L,; Zhao, B. WО 03040118A1 15 May 2003b "Novel 1,2,4-thiadiazolium
derivatives as melanocortin receptor modulators" Eisinger, M.; Fitzpatrick, L.J.; Lee, D.H.; Pan, K.; Plata-Salaman, C.; Reitz, A.B.; Smith-
Swintosky, V.L.; Zhao, B. US 2003/0162819A1 Aug 28 2003 с "Novel 1,2,4-thiadiazolium
derivatives as melanocortin receptor modulators" Eisinger, M.; Fitzpatrick, L.J.; Lee, D.H.; Pan, K.; Plata-Salaman, C.; Reitz, A.B.; Smith-
Swintosky, V.L.; Zhao, B. US 2003/0176425A1 Sep 18 2003d "Novel 1,2,4-thiadiazole
derivatives as melanocortin receptor modulators" Eisinger, M.; Fitzpatrick, L.J.; Lee, D.H.; Pan, K.; Plata-Salaman, C.; Reitz, A.B.; Smith-
Swintosky, V.L.; Zhao, B. US 2006/0030604A1 Feb 9 2006a "Novel 1,2,4-thiadiazolium
derivatives as melanocortin receptor modulators" Eisinger, M.; Fitzpatrick, L.J.; Lee, D.H.; Pan, K.; Plata-Salaman, C.; Reitz, A.B.; Smith-
Swintosky, V.L.; Zhao, B. US 2006/0128772A1 Jun 15 2006b "Novel 1,2,4-thiadiazole
derivatives as melanocortin receptor modulators" Fathi, Z.; Iben, L.G.; Parker, E.M. Neurochemical Res. 1995, 20, 107-113 "Cloning, Expression,
and Tissue Distribution of a Fifth Melanocortin Receptor Subtype" Follador, I.; Campelo, L. Expert Rev. Dermatol. 2006, 1 181-184 "Impact of acne on quality of
life" Fong, T.M.; Van der Ploeg, LH.T.; Huang, R.-R.C. US 6645738B1 Nov 11 2003 "DNA
molecules encoding the melanocortin 5 receptor protein from rhesus monkey" Gantz, I.; Shimoto, Y.; Konda, Y.; Miwa, H.; Dickinson, C.J.; Yamada, T. BBRC 1994, 200,
1214-1220 "Molecular cloning, expression and characterization of a fifth melanocortin
receptor" Goldstein, J.A.; Socha-Szott, A.; Thomsen, R.J.; Pochi, P.E.; Shalita, A.R.; Strauss, J.S. Am. J.
Dermatol. 1982, 6, 760-765 "Comparative effect of isotretinoin and etretinate on acne and
sebaceous gland secretion" Goodfellow, A.; Alaghband-Zadeh, J.; Carter, G.; Cream, J.J.; Holland, S.; Scully, J.; Wise, P.
Brit. J. Dermatol. 1984, 111, 209-214 "Oral spironolactone improves acne vulgaris and
reduces sebum excretion" Goulden, V.; Mcgeown, C.H.; Cunliffe, W.J. Brit. J. Dermatol. 1999, 141, 297-300 "Familial Risk
of Adult Acne: A comparison between first-degree realatives of affected and unaffected
individuals"
Graefe, Т.; Wollina, U.; Schuiz, H.-J.; Burgdorf, W. Dermatology 2000, 200, 331-333 "Muir-Torre
Syndrome - Treatment with Isotretinoin and Interferon Alpha-2a Can Prevent Tumour
Development" Griffon, N.; Mignon, V.; Facchinetti, P.; Diaz, J.; Schwartz, J.-C.; Sokoloff, P. BBRC 1994, 200,
1007-1014 "Molecular cloning and characterization of the rat fifth melanocortin receptor" Gupta, A.K.; Bluhm, R. Journal of the European Academy of Dermatology and Venereology
2004 18:1 13"Seborrheic dermatitis" Haitina, Т.; Klovins, J.; Andersson, J.; Fredriksson, R.; Lagerstrom, M.C.; Larhammar, D.;
Larson, E.T.; Schioth, H.B. Biochem. J. 2004, 380, 475-486 "Cloning, tissue distribution,
pharmacology and three-dimensional modelling of melanocortin receotors 4 and 5 in
rainbow trout suggest close evolutionary relationships of these subtypes" Harper, J.C. Semin. Cutan. Med. Surg. 2005, 24, 103-106 "Hormonal Therapy for Acne using
oral contraceptive pills Harris, H.H.; Downing, D.T.; Stewart, M.E.; Strauss, J.S. J. Am. Acad. Dermatol. 1983, 8, 200-
203 "Sustainable rates of sebum secretion in acne patients and mayched normal controls" Hatta, N.; Dixon, C.; Ray, A.J.; Phillips, S.R.; Cunliffe, W.J.; Dale, M.; Todd, C.; Meggit, S.;
Birch-Machin, M.A.; Rees, J.L. J. Invest. Dermatol. 2001, 116, 564-570 "Expression,
candidate gene, and population studies of the melanocortin 5 receptor" Houseknecht, K.L; Robertson, A.S.; Xiao, X. US 2003/0110518A1 Jun 12 2003 "Melanocortin-5
receptor sequences and uses thereof" Huang, R.-R.C.; Singh, G.; Van der Ploeg, L.H.T.; Fong, T.M. J. Receptor & Signal
Transduction Res. 2000, 20, 47-59 "Species-dependent pharmacological properties of the
melanocortin-5 receptor" Ide, F.; Shimoyama, Т.; Hone, N.; Kaneko, Т.; Matsumoto, M. Oral Surg. Oral Med. Oral Pathol.
Oral Radiol. Endod. 1999, 87, 721-724 "Benign lymphoepithelial lesion of the parotid gland
with sebaceous differentiation" Jeong, S.K.; Hwang, S.W.; Choi, S.Y.; An, J.M.; Seo, J.T.; Zouboulis, C.C.; Lee, S.H. J.
Investigative Dermatol. 2007, 127, pS72 "Intracellular calcium mobilization is mediated by
the melanocortin receptors in SZ95 sebocytes" (Abstract 431, Society for Investigative
Dermatology, May 2007, Los Angeles CA) Jih, M.H-; Friedman, P.M.; Goldberg, L.H.; Robles, M.; Glaich, A.S.; Kimyai-Asadi, A.J. Am.
Acad. Dermatol. 2006, 55, 80-87 "The 1450-nm diode laser for facial inflammatory acne
vulgaris: Dose-response and 12-month follow-up study". Jones, D.H.; King, K.; Miller, A.J.; Cunliffe, W.J. Brit. J. Dermatol. 1983, 108, 333-343 "A dose-response study of 13-cis-retinoic acid in acne vulgaris" Kirn, K.S-; Marklund, S.; Rothschild, M.F. Animal Genetics 2000, 31, 230-231. "The porcine
melanocortin-5-receptor (MC5R) gene: polymorphisms, linkage and physical mapping"
King, К.; Jones, D.H.; Daltrey, D.C.; Cunliffe, W.J. Brit. J. Dermatol. 1982, 107, 583-590 "A
double-blind study of the effects of 13-cis-retinoic acid on acne, sebum excretion rate and
microbial population"
Kligman, A.M. Brit. J. Dermatol. 1963, 75, 307-319 "The uses of sebum" Klovins, J.; Haitina, Т.; Ringholm, A.; Lowgren, M.; Fridmanis, D.; Slaidina, M.; Stier, S.;
Schioth, H.B. Eur. J. Biochem. 2004, 271, 4320-4331 "Cloning of two melanocortin (MC)
receptors in spiny dogfish" Kruse, R.; Rdtten.A.; Schweiger, N.; Jakob, E.; Mathiak, M.; Propping, P.; Mangold, E.;
Bisceglia, M; Ruzicka, T.J. Invest. Dermatol. 2003, 120, 858-864 "Frequency of
Microsatellite Instability in Unselected Sebaceous Gland Neoplasias and Hyperplasias" Labbe, 0.; Desarnaud, F.; Eggerickx, D.; Vassart, G.; Parmentier, M. Biochem. 1994, 33, 4543-
4549 "Molecular Cloning of a mouse melanocortin 5 receptor gene widely expressed in
peripheral tisssues" Ling, M.K.; Hotta, E.; Kilianova, Z.; Haitina, Т.; Ringholm, A.; Johansson, L; Gallo-Payet, N.;
Takeuchi, S.; Schioth, H.B. Brit. J. Pharmacol. 2004, 143, 626-637 "The melanocortin
receptor subtypes in chicken have high preference to ACTH-derived peptides" Makrantonaki, E.; Zouboulis, C.C. Brit. J. Dermatol. 2007, 156, 428-432 "Testosterone
metabolism to 5a-dihydrotestosterone and synthesis of sebaceous lipids is regulated by
the peroxisome prol iterator-activated receptor ligand linoleic acid in human sebocytes" Mariappan, M.R.; Fadare, O.; Jain, D. Arch. Pathol. Lab. Med. 2004, 128, 245-246 "Sebaceous
Differentiation in Salivary Glands" Mallon, E.; Newton, J.N.; Klassen, A.; Stewart-Brown, S.L; Ryan, T.J.; Finlay, A.Y. Brit. J.
Dermatol. 1999, 140, 672-676 "The quality of life in acne: a comparison with general
medical conditions using generic questionanaires" Marqueling A.L; Zane, L.T. Semin. Cutan. Med. Surg. 2005, 24, 92-102 "Depression and
Suicidal Behavior in Acne Patients Treated with Isotretinoin: A Systematic Review" Morgan, C.; Thomas, R.E.; Ma, W.; Novotny, M.V.; Cone, R.D. Chem. Senses 2004a, 29, 111-
115 "Melanocortin-5 receptor deficiency reduces a pheromonal signal for aggression in
male mice" Morgan, C.; Thomas, R.E.; Cone, R.D. Horm. Behav.2004b, 45, 58-83 "Melanocortin-5
receptor deficiency promotes defensive behaviour in male mice" Morgan, C.; Cone, R.D. Behaviour Genetics 2006, 36, 291-300 "Melanocortin-5 receptor
deficiency in mice blocks a novel pathway influencing pheromone-induced aggression" Mourelatos, K.; Eady, E.A.; Cunliffe, W.J.; dark, S.M.; Cove, J.H. Brit. J. Dermatol. 2007, 156,
22-31 "Temporal changes in sebum excretion and propionibacterial colonization in
preadolescent children with and without acne"
Nelson, A.M.; Gilliland, K.L; Cong, Z.; Thiboutot, D.M. J. Investigative Dermatol. 2006, 126, 2178-2189 "13-c/s-Retinoic Acid Induces Apoptosis and Cell Cycle Arrest in Human SEB-
1 Sebocytes" Phan, J.; Kanchanapoomi, M.; Liu, P.; Jalian, H.; Gilliland, K.; Nelson, A.; Thiboutot, D.; Kirn, J.
J. Investigative Dermatol. 2007, 127, pS126 "P. acnes induces inflammation via TLR2 and
upregulates antimicrobial activity in sebocytes" (Abstract 754, Society for Investigative
Dermatology, May 2007, Los Angeles CA)
Pierard, G.E.; Pierard-Franchimont, T.L. Dermatologica 1987, 175, 5-9 "Seborrhoea in Acne-Prone and Acne-Free Patients" Plewig G, Jansen T. Seborrheic dermatitis. In: Freedberg IM, EisenAZ, Wolff K, Austen KF,
Goldsmith LA, Katz Sl, Fitzpatrick TB,(Eds). Dermatology in General Medicine, 5th ed.
New York: McGraw Hill, 1999: 1482-1489 Pochi, P.E.; Strauss, J.S. J. Invest. Dematol. 1964, 43, 383-388 "Sebum production, casual
sebum levels, titratable acidity of sebum and urinary fractioonal 17-ketosteroid excretion in
males with acne" Porter, A.M.W. J. Royal Soc. Med. 2001, 94, 236-237 "Why do we have apocrine and
sebaceous glands" Ringholm, A.; Fredriksson, R.; Poliakova, N.; Yan, Y.-L; Postlethwait, J.H.; Larhammar, D.;
Schioth, H.B. J. Neurochem. 2002, 82, 6-18 "One melanocortin 4 and two melanocortin 5
receptors from zebrafish show remarkable conservation in structure and pharmacology" Smith, K.R.; Nelson, A.; Cong, Z.; Thiboutot, D. J. Investigative Dermatol. 2007a, 127, pS68
"Iron status affects human sebocyte survival" (Abstract 408, Society for Investigative
Dermatology, May 2007, Los Angeles CA) Smith, R.N.; Mann, N.J.; Braue, A.; Makelainen, H.; Varigos, G.A. J. Am. Acad. Dermatol.
2007b, 57, 247-256 "The effect of a high-protein, low glycemic-load diet versus a
conventional, high glycemic-load diet on biochemical parameters associated with acne
vulgaris: A randomized investigator-masked, controlled trial" Shuster, S. Lancet 1976, 7973, 1328-1329 "Biological purpose of acne" Taylor, A.; Namba, K. Immunologyy Cell В/о/. 2001, 79, 358-367 "In vitro induction of
CD25+CD4+ regulatory T cells by the neuropeptide alpha-melanocyte stimulating
hormone (α-MSH)" Thiboutot, D.; Sivarajah, A.; Gilliland, K.; Cong, Z.; Clawson, G. J. Invest. Dermatol. 2000, 115,
614-619 "The melanocortin 5 receptor is expressed in human sebaceous glands and rat
preputial cells"
Thody, A.J.; Shuster, S. Nature 1973, 245, 207-209 "Possible role of MSH in the mammal" Thody, A.J.; Cooper, M.F.; Bowden, P.E.; Shuster, S. J. Endocrinol. 1975a, 67, 18P-19P "The sebaceous gland response to α-melanocyte-stimulating hormone and testosterone"
Thody, A.J.; Shuster, S.J. Endocrinol. 1975b, 64, 503-510 "Control of sebaceous gland function
in the rat by α-melanocyte-stimulating hormone" Thody, A.J.; Goolamali, S.K.; Burton, J.L.; Plummer, N.A.; Shuster, S. Brit. J. Dermatol. 1975 с,
92, 43-47 " Plasma a-MSH levels in acne vulgaris" Wikberg, J.E.S. Exp. Opin. Ther. Patents 2001, 11, 61-76 "Melanocortin receptors: new
opportunities in drug discovery";
Wikberg, J.; Chhajlani, V. US 6448032B1 Sep 10 2002 "Human melanocyte stimulating hormone
receptor polypeptide and DNA" Williams, C.; Layton, A.M. Exp. Rev. Dermatol. 2006, 1, 429-438 "Treatment of Acne: an
update"
Yamada, Т.; Gantz, I. US 5622860, Apr. 22 1997, "Genes Encoding Melanocortin Receptors" Yaswen, L; Diehl, N.; Brennan, M.B.; Hochgeschwender, U. Nature Med. 1999, 5, 1066-1070
"Obesity on the mouse model of proo-opiomelanocortin deficiency responds to peripheral
melanocortin" Youn, S.-W.; Park, E.-S.; Lee, D.-H.; Huh, C.-H.; Park, K.-C. Brit. J. Dermatol. 2005, 153, 919-
924 "Does facial sebum secretion really affect the development of acne?" Zhang, L.; Anthonavage, M.; Huang, Q.; Li, W.-H.; Eisinger, M. Ann. N.Y. Acad. Sci. 2003, 994,
154-161 " Proopiomelanocortin peptides and sebogenesis" Zhang, L.; Li, W.-H.; Anthonavage, M.; Eisinger, M. Peptides 2006, 27, 413-420 "Melanocortin-5
receptor: a marker of human sebocyte differentiation" Zouboulis, C.C-; Bohm, M. Exp. Dermatol. 2004, 13, 31-35 "Neurocrine regulation ofsebocytes - a pathogenetic link between stress and acne"
Детали определенных вариантов осуществления, описанных в данном изобретении, не должны истолковываться как ограничения. Разнообразные аналоги и видоизменения можно сделать без отклонения от сущности и объема данного изобретения, и понятно, что такие эквивалентные варианты осуществления являются частью данного изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТАГОНИСТЫ 3-АМИНОАЛКИЛ-1,4-ДИАЗЕПАН-2-ОН МЕЛАНОКОРТИНА-5 РЕЦЕПТОРА | 2009 |
|
RU2530017C2 |
| СПОСОБЫ МОДУЛИРОВАНИЯ АКТИВНОСТИ МС5 РЕЦЕПТОРА И ЛЕЧЕНИЕ СОСТОЯНИЙ, ОТНОСЯЩИХСЯ К ДАННОМУ РЕЦЕПТОРУ | 2009 |
|
RU2555343C9 |
| 5-[(ПИПЕРАЗИН-1-ИЛ)-3-ОКСО-ПРОПИЛ]-ИМИДАЗОЛИДИН-2,4-ДИОНОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ADAMTS ДЛЯ ЛЕЧЕНИЯ ОСТЕОАРТРИТА | 2015 |
|
RU2693459C2 |
| ПРОИЗВОДНЫЕ 5,6-БИСАРИЛ-2-ПИРИДИНКАРБОКСАМИДОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ В КАЧЕСТВЕ АНТАГОНИСТОВ РЕЦЕПТОРОВ УРОТЕНЗИНА II | 2009 |
|
RU2497808C2 |
| ПРОИЗВОДНЫЕ С-АРИЛГЛЮКОЗИДОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2011 |
|
RU2606501C2 |
| ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ИММУНОЛОГИЧЕСКИХ И ОНКОЛОГИЧЕСКИХ СОСТОЯНИЙ | 2009 |
|
RU2545023C9 |
| ИНГИБИТОРЫ РЕЦЕПТОРА ФАКТОРА РОСТА ФИБРОБЛАСТОВ И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2732127C1 |
| МОДУЛЯТОРЫ SHIP1 И ОТНОСЯЩИЕСЯ К НИМ СПОСОБЫ | 2014 |
|
RU2679805C2 |
| НОВЫЕ СОЕДИНЕНИЯ ЗАМЕЩЕННОГО N-(3-ФТОРПРОПИЛ)ПИРРОЛИДИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2017 |
|
RU2742278C2 |
| КОНДЕНСИРОВАННЫЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА И ПИРАЗОЛА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2686117C1 |
Изобретение относится к соединению формулы (I), где Y представляет собой группу формулы -(CR9R10)n-; Х представляет собой -C(=O)-; Z представляет собой группу формулы -(CR13R14)q-; R1 выбран из группы, состоящей из (a) C2-C12алкенила, замещенного 4-хлорфенилом; или (b) C6-C10арила, необязательно замещенного одним или двумя атомами галогена; R2 и R3 представляют собой Н; R4 выбран из группы, состоящей из Н, C1-C12алкила, необязательно замещенного гидрокси, метокси или бензилокси, C3-C12циклоалкила, C6арила, необязательно замещенного аминогруппой или пиперидином, C-связанного C1-C18гетероарила, выбранного из пиридина и имидазола, C(=O)R15, C(=O)NR16R17 и ONR16C(=NR17)NR18R19; каждый R5a и R5b представляет собой Н, каждый R6, R7 и R8 независимо выбран из группы, состоящей из H, C1-C12алкила и C6-C18арила, каждый R9 и R10 представляет собой H; каждый R13 и R14 представляет собой H; R15 представляет собой H, каждый R16, R17, R18, R19 и R20 независимо выбран из группы, состоящей из Н, C1-С12алкила, C3-C12циклоалкила, C6арила и пиридила, или любые два из R16, R17, взятые вместе с атомами, к которым они присоединены, образуют циклическую группу, содержащую 5 атомов углерода, или n равно 1; q представляет собой целое число, выбранное из группы, состоящей из 1, 2, 3, 4 и 5; r равно 1; или его фармацевтически приемлемой соли. Изобретение также относится к фармацевтической композиции для лечения MC5R-связанных состояний, содержащей соединение формулы (I) и фармацевтически приемлемый носитель, разбавитель или наполнитель. 2 н. и 21 з.п. ф-лы, 6 табл., 53 пр.

1. Соединение формулы (I):
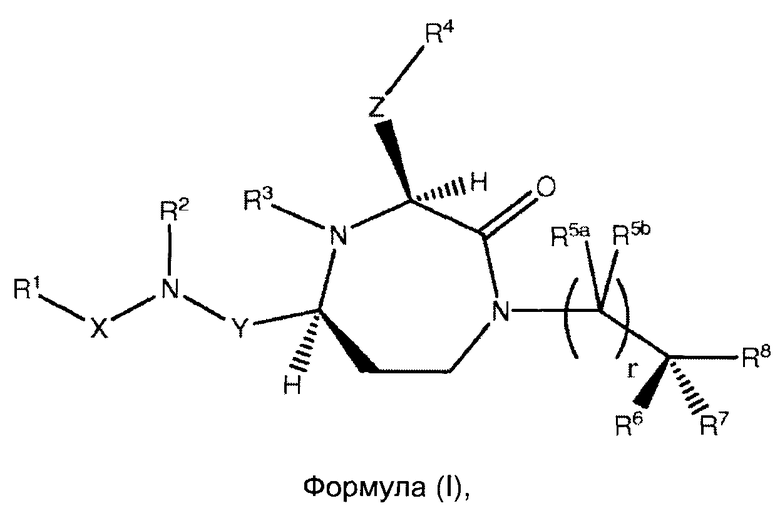
где
Y представляет собой группу формулы -(CR9R10)n-;
Х представляет собой -C(=O)-;
Z представляет собой группу формулы -(CR13R14)q-;
R1 выбран из группы, состоящей из
(a) C2-C12алкенила, замещенного 4-хлорфенилом; или
(b) C6-C10арила, необязательно замещенного одним или двумя атомами галогена;
R2 и R3 представляют собой Н;
R4 выбран из группы, состоящей из Н, C1-C12алкила, необязательно замещенного гидрокси, метокси или бензилокси, C3-C12циклоалкила, C6арила, необязательно замещенного аминогруппой или пиперидином, C-связанного C1-C18гетероарила, выбранного из пиридина и имидазола, C(=O)R15, C(=O)NR16R17 и ONR16C(=NR17)NR18R19;
каждый R5a и R5b представляет собой Н,
каждый R6, R7 и R8 независимо выбран из группы, состоящей из H, C1-C12алкила и C6-C18арила,
каждый R9 и R10 представляет собой H;
каждый R13 и R14 представляет собой H;
R15 представляет собой H,
каждый R16, R17, R18, R19 и R20 независимо выбран из группы, состоящей из Н, C1-С12алкила, C3-C12циклоалкила, C6арила и пиридила, или
любые два из R16, R17, взятые вместе с атомами, к которым они присоединены, образуют циклическую группу, содержащую 5 атомов углерода, или
n равно 1;
q представляет собой целое число, выбранное из группы, состоящей из 1, 2, 3, 4 и 5;
r равно 1;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где R1 представляет собой C6-C10арил, необязательно замещенный одним или двумя атомами галогена.
3. Соединение по п.2, где R1 представляет собой фенил, необязательно замещенный одним или двумя атомами галогена.
4. Соединение по п.2, где R1 представляет собой нафтил, необязательно замещенный одним или двумя атомами галогена.
5. Соединение по п.1, где R1 представляет собой C2-C12алкенил, замещенный 4-хлорфенилом.
6. Соединение по любому из пп.1-5, где q выбран из группы, состоящей из 1, 2, 3 и 4.
7. Соединение по любому из пп.1-5, где q равно 1.
8. Соединение по любому из пп.1-5, где q равно 2.
9. Соединение по любому из пп.1-5, где q равно 3.
10. Соединение по любому из пп.1-5, где q равно 4.
11. Соединение по любому из пп.1-5, где R4 выбран из группы, состоящей из Н, C3-C12циклоалкила, C1-C12алкила, C6арила, необязательно замещенного аминогруппой или пиперидином, C-связанного гетероарила, выбранного из пиридина и имидазола, C(=O)NR16R17 и ONR16C(=NR17)NR18R19.
12. Соединение по п.11, где R4 представляет собой C(=O)NR16R17.
13. Соединение по п.12, где R16 и R17, взятые вместе с атомом азота, к которому они присоединены, образуют циклическую группу, содержащую 5 атомов углерода.
14. Соединение по п.12, где каждый из R16 и R17 независимо выбран из группы, состоящей из H, CH3, CH2CH3, CH2CH2CH3, CH(CH3)2, CH2CH2CH2CH3, CH(CH3)CH2CH3, CH2CH(CH3)2, C(CH3)3, циклопропила, циклобутила, циклопентила и циклогексила.
15. Соединение по любому из пп.1-5, 12-14, где R7 представляет собой H.
16. Соединение по любому из пп.1-5, 12-14, где каждый из R6 и R8 независимо выбран из группы, состоящей из C1-C12алкила или C6арила.
17. Соединение по любому из пп.1-5, 12-14, где R6 выбран из группы, состоящей из Н, метила, этила, изопропила, пропила, 2-этилпропила, 3,3-диметилпропила, бутила, 2-метилбутила, изобутила, 3,3-диметилбутила, 2-этилбутила, пентила, 2-метилпентила и фенила.
18. Соединение по п.17, где R6 представляет собой фенил.
19. Соединение по любому из пп.1-5, 12-14, 18, где R8 выбран из группы, состоящей из Н, метила, этила, изопропила, пропила, 2-этилпропила, 3,3-диметилпропила, бутила, 2-метилбутила, изобутила, 3,3-диметилбутила, 2-этилбутила, пентила, 2-метилпентила, гексила, гептила, октила и фенила.
20. Соединение по п.19, где R8 представляет собой метил, этил или фенил.
21. Соединение по п.1, выбранное из группы, состоящей из:
N-(((3S,5S)-1-(2,2-дифенилэтил)-3-(2-(гуанидинокси)этил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамида;
N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(пиридин-3-илметил)-1,4-диазепан-5-ил)метил)-2-нафтамида;
N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(пиридин-4-илметил)-1,4-диазепан-5-ил)метил)-2-нафтамида;
N-(((3S,5S)-3-бутил-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамида;
(Е)-N-(((3S,5S)-3-бутил-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-хлорфенил)акриламида;
(Е)-N-(((3S,5S)-3-(3-амино-3-оксопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-хлорфенил)акриламида;
N-(((3S,5S)-3-(3-амино-3-оксопропил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамида;
N-(((3S,5S)-3-(циклогексилметил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамида;
(Е)-N-(((3S,5S)-3-(циклогексилметил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-хлорфенил)акриламида;
N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(3-оксо-3-(пиперидин-1-ил)пропил)-1,4-диазепан-5-ил)метил)-2-нафтамида;
(Е)-3-(4-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(3-оксо-3-(пиперидин-1-ил)пропил)-1,4-диазепан-5-ил)метил)акриламида;
N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-фенэтил-1,4-диазепан-5-ил)метил)-2-нафтамида;
(E)-3-(4-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-фенэтил-1,4-диазепан-5-ил)метил)акриламида;
N-(((3S,5S)-3-(2-циклогексилэтил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамида;
(Е)-3-(4-хлорфенил)-N-(((3S,5S)-3-(2-циклогексилэтил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)акриламида;
(N-(((3S,5S)-3-бензил-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамида;
(Е)-N-(((3S,5S)-3-бензил-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-хлорфенил)акриламида;
(E)-N-(((3S,5S)-3-((1Н-имидазол-4-ил)метил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-хлорфенил)акриламида;
(Е)-3-(4-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(пиридин-2-илметил)-1,4-диазепан-5-ил)метил)акриламида;
(Е)-3-(4-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-оксо-2-(пиридин-2-иламино)этил)-1,4-диазепан-5-ил)метил)акриламида;
(Е)-3-(4-хлорфенил)-N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-оксо-2-(пиперидин-1-ил)этил)-1,4-диазепан-5-ил)метил)акриламида;
6-хлор-N-(((3S,5S)-2-оксо-3-(3-оксо-3-(пиперидин-1-ил)пропил)-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамида;
3,4-дихлор-N-(((3S,5S)-2-оксо-3-(3-оксо-3-(пиперидин-1-ил)пропил)-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)бензамида;
(Е)-N-(((3S,5S)-3-(2-аминобензил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-3-(4-хлорфенил)акриламида;
N-(((3S,5S)-3-(2-аминобензил)-1-(2,2-дифенилэтил)-2-оксо-1,4-диазепан-5-ил)метил)-2-нафтамида;
N-(((3S,5S)-3-бутил-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-6-хлор-2-нафтамида;
6-хлор-N-(((3S,5S)-3-изопентил-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамида;
N-(((3S,5S)-1-(2,2-дифенилэтил)-2-оксо-3-(2-(пиперидин-1-ил)бензил)-1,4-диазепан-5-ил)метил)-2-нафтамида;
N-(((3S,5S)-3-(3-(бутил(метил)амино)-3-оксопропил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамида;
N-(((3S,5S)-3-(3-(циклогексиламино)-3-оксопропил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамида;
6-хлор-N-(((3S,5S)-3-(2-циклогексилэтил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамида;
6-хлор-N-(((3S,5S)-3-гексил-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамида;
6-хлор-N-(((3S,5S)-3-(4-гидроксибутил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамида;
6-хлор-N-(((3S,5S)-3-(2-метоксиэтил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамида;
N-(((3S,5S)-3-(2-(бензилокси)этил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-6-хлор-2-нафтамида; и
6-хлор-N-(((3S,5S)-3-изобутил-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)-2-нафтамида.
22. Соединение по п.1, где указанное соединение представляет собой 3,4-дихлор-N-(((3S,5S)-3-(2-гидроксиэтил)-2-оксо-1-((S)-2-фенилбутил)-1,4-диазепан-5-ил)метил)бензамид.
23. Фармацевтическая композиция для лечения МС5R-связанных состояний, содержащая соединение по любому из пп.1-22 и фармацевтически приемлемый носитель, разбавитель или наполнитель.
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| ЗАМЕЩЕННЫЕ 1-АМИНОАЛКИЛЛАКТАМЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2001 |
|
RU2241702C2 |
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
Авторы
Даты
2014-07-27—Публикация
2009-02-27—Подача