Область техники, к которой относится изобретение
Изобретение относится к производным индолизина, полезным в качестве лекарственных средств.
Более конкретно, настоящее изобретение относится к производным индолизина, обладающим ингибирующей активностью в отношении ксантиноксидазы и полезным в качестве средств для предупреждения или лечения заболевания, связанного с аномальным уровнем мочевой кислоты в сыворотке, или к их пролекарствам или к их фармацевтически приемлемым солям.
Предпосылки создания изобретения
Мочевая кислота является конечным продуктом метаболизма пуринов у человека. В отличие от человека, у многих млекопитающих мочевая кислота под действием уратоксидазы (уриказы) в печени расщепляется далее до аллантоина, который выводится почками. У человека главным путем выведения мочевой кислоты являются почки, где приблизительно две трети мочевой кислоты выводится с мочой. Остальное выводится с калом. Избыточное продуцирование или пониженная степень выведения мочевой кислоты вызывают гиперурикемию. Гиперурикемию классифицируют по типу избыточного продуцирования мочевой кислоты, типу недостаточной степени выведения мочевой кислоты и их смешанному типу. Такая классификация гиперурикемии является клинически важной. Пытаясь уменьшить неблагоприятные побочные эффекты терапевтических средств, их выбирают в соответствии с каждым из классов (см., например, ссылку на непатентный документ 1).
При гиперурикемии, относящейся к типу с избыточным продуцированием мочевой кислоты, увеличивается выведение мочевой кислоты с мочой, и когда выведение мочевой кислоты с мочой дополнительно увеличивается при применении урикозурического лекарственного средства, возможно развитие осложнений в виде образования мочевых конкрементов. Поэтому при типе с избыточным продуцированием мочевой кислоты, в принципе, применяют аллопуринол - ингибитор продуцирования мочевой кислоты (иногда называемый ингибитором синтеза мочевой кислоты, далее в настоящем описании называемый «ингибитором продуцирования мочевой кислоты»).
Мочевая кислота продуцируется из пуриновых телец, которые производятся из пищевых продуктов и синтезируются эндогенно, на конечной стадии, посредством окисления ксантина ксантиноксидазой. Аллопуринол разработан в качестве ингибитора ксантиноксидазы и является единственным ингибитором продуцирования мочевой кислоты, применяемым в медицинской практике. Хотя аллопуринол, как сообщается, эффективен при гиперурикемии и многих заболеваниях, обусловленных гиперурикемией, однако имеются сообщения о его тяжелых побочных эффектах, таких как токсикологический синдром (ангиит сверхчувствительности), синдром Стивенса-Джонсона, эксфолиативный дерматит, апластическая анемия, дисфункция печени и т.п. (см., например, ссылку на непатентный документ 2). В качестве одной из причин указывают на то, что аллопуринол имеет структуру, подобную структуре нуклеиновых кислот, и ингибирует путь метаболизма пиримидинов (см., например, ссылку на непатентный документ 3).
С другой стороны, при гиперурикемии, относящейся к типу с недостаточной степенью выведения, выведение мочевой кислоты снижается. Сообщалось, что когда применяют аллопуринол, который метаболизируется до оксипуринола, выводимого через почки по тому же механизму, что и мочевая кислота, снижается также выведение оксипуринола и увеличивается частота расстройств печени (см., например, ссылку на непатентный документ 4). Поэтому при типе с недостаточной степенью выведения мочевой кислоты, в принципе, применяют урикозурические лекарственные средства, такие как пробенецид, бензбромарон и т.п. Однако такие урикозурические лекарственные средства также оказывают неблагоприятные побочные эффекты, такие как желудочно-кишечные расстройства, образование мочевых конкрементов и т.п. В частности, известно, что бензбромарон, возможно, является причиной фульминантного гепатита у идиосинкразических пауиентов (см., например, ссылку на непатентные документы 5 и 6).
Таким образом, утверждают, что существующий ингибитор продуцирования мочевой кислоты и существующие урикозурические лекарственные средства имеют ограничения для применения у пациентов или оказывают тяжелые неблагоприятные эффекты. Поэтому требуется разработать средство, удобное для применения при лечении гиперурикемии и т.п.
Мочевая кислота удаляется главным образом почками, и динамику урата в почках до недавнего времени исследовали в некоторых экспериментах, используя везикулы из мембраны щеточной каемки (BBMV), приготовленные из коркового вещества почки (см., например, ссылку на непатентные документы 7 и 8). Известно, что у людей мочевая кислота свободно проходит через почечный клубочек и имеются механизмы реабсорбции и секреции мочевой кислоты в проксимальном канальце (см., например, ссылку на непатентный документ 9).
В последние годы был идентифицирован ген (SLC22A12), кодирующий транспортер урата в почке человека (см., например, ссылку на непатентный документ 10). Транспортер, кодируемый этим геном (транспортер урата 1, далее в настоящем описании называемый «URAT1»), представляет собой тип молекулы с 12-трансмембранными доменами и принадлежит к семейству ОАТ. Матричная РНК белка URAT1 специфично экспрессирована в почке, и на срезах почки человека локализацию URAT1 наблюдали на апикальной стороне проксимального канальца. В эксперименте с использованием системы экспрессии в овоцитах Xenopus было показано поглощение мочевой кислоты, опосредуемое URAT1. Более того, было показано, что поглощенная мочевая кислота переносится посредством обмена с органическими анионами, такими как молочная кислота, пиразинкарбоновая кислота (PZA), никотиновая кислота и т.п., и что поглощение мочевой кислоты, опосредуемое URAT1, ингибируют урикозурические лекарственные средства (пробенецид и бензбромарон). Таким образом, как ожидалось на основании результатов эксперимента с использованием мембранных везикул, были получены убедительные свидетельства того, что URAT1 представляет собой белок, осуществляющий урат/анионный обмен. То есть было показано, что URAT1 является транспортером, играющим важную роль в реабсорбции мочевой кислоты в почке (см., например, ссылку на непатентный документ 10).
В дополнение, стала более ясной взаимосвязь между URAT1 и патологическими состояниями. Идиопатическая почечная гипоурикемия представляет собой заболевание, при котором выведение мочевой кислоты увеличивается вследствие аномальной динамики урата в почке и уровень мочевой кислоты в сыворотке становится низким. Известно, что это заболевание часто сопровождается образованием мочевых конкрементов или острой почечной недостаточностью после физической нагрузки. URAT1 был идентифицирован как ген, который является причинным фактором почечной гипоурикемии (см., например, ссылку на непатентный документ 10). Эти факты также убедительно указывают на то, что URAT1 является ответственным за регулирование уровня мочевой кислоты в сыворотке.
Поэтому вещество, обладающее ингибирующей активностью в отношении URAT1, является полезным в качестве средства для лечения и предупреждения заболеваний, связанных с высокими уровнями мочевой кислоты в сыворотке, т.е. гиперурикемии, подагрических узлов, подагрического артрита, связанного с гиперурикемией почечного расстройства, мочевых конкрементов и т.п.
Были сообщения о том, что при лечении гиперурикемии комбинация аллопуринола (ингибитора продуцирования мочевой кислоты) с агентом, обладающим урикозурической активностью, понижала уровень мочевой кислоты в сыворотке более сильно, чем применение одного аллопуринола (см., например, ссылку на непатентные документы 11 и 12). Поэтому в тех случаях, когда лечение одним имеющимся агентом не оказывает достаточного эффекта, большего терапевтического эффекта можно ожидать при сочетанном применении ингибитора продуцирования мочевой кислоты с урикозурическим агентом. Кроме того, считают, что при гиперурикемии, относящейся к типу, характеризующемуся недостаточным выведением мочевой кислоты, можно уменьшить риск образования мочевых конкрементов, вызванного монотерапией урикозурическим агентом, поскольку выведение мочевой кислоты с мочой можно уменьшить, снижая уровень мочевой кислоты в сыворотке. Кроме того, можно ожидать высокий терапевтический эффект при гиперурикемии смешанного типа. Следовательно, можно ожидать, что агент, обладающий одновременно ингибирующей активностью в отношении продуцирования мочевой кислоты и урикозурической активностью, станет исключительно полезным агентом для предупреждения или лечения гиперурикемии и т.п.
Известно, что морин (продукт естественного происхождения) является соединением, обладающим ингибирующей активностью как в отношении ксантиноксидазы, так и в отношении URAT1 (см. ссылку на непатентный документ 13).
Известны производные бензойной кислоты или салициловой кислоты, обладающие ингибирующей активностью в отношении ксантиноксидазы (см. ссылки на патентные документы 1-5). Однако в ссылках нет какого-либо описания и предложений, относящихся к производным индолизина, являющимся предметом настоящего изобретения.
Ссылка на патентный документ 1: Брошюра международной публикации № W02007/043400
Ссылка на патентный документ 2: Брошюра международной публикации № W02007/043401
Ссылка на патентный документ 3: Брошюра международной публикации № W02008/126898
Ссылка на патентный документ 4: Брошюра международной публикации № W02008/126899
Ссылка на патентный документ 5: Брошюра международной публикации № W02008/126901
Ссылка на непатентный документ 1: Atsuo Taniguchi and 1 person, Modern Physician, 2004, Vol. 24, No. 8, pp.1309-1312
Ссылка на непатентный документ 2: Kazuhide Ogino and 2 persons, Nippon Rinsho (Japan Clinical), 2003, Vol. 61, Extra edition 1, pp. 197-201
Ссылка на непатентный документ 3: Hideki Horiuchi and 6 persons, Life Science, 2000, Vol. 66, No. 21, pp. 2051-2070
Ссылка на непатентный документ 4: Hisashi Yamanaka and 2 persons, Konyosankessyo to Tsufu (Hyperuricemia and gout), issued by Medical Review Co., 1994, Vol. 2, No. 1, pp. 103-111
Ссылка на непатентный документ 5: Robert A Terkeltaub, N. Engl. J. Med., 2003, Vol. 349, pp. 1647-1655
Ссылка на непатентный документ 6: Ming-Han H. Lee and 3 persons, Drug. Safety, 2008, Vol. 31, pp. 643-665
Ссылка на непатентный документ 7: Francoise Roch-Ramel and 2 persons, Am. J. Physiol., 1994, Vol. 266 (Renal Fluid Electrolyte Physiol., Vol. 35), F797-F805
Ссылка на непатентный документ 8: Francoise Roch-Ramel and 2 persons, J. Pharmacol. Exp. Ther., 1997, Vol. 280, pp. 839-845
Ссылка на непатентный документ 9: Gim Gee Teng and 2 persons, Drugs, 2006, Vol. 66, pp. 1547-1563
Ссылка на непатентный документ 10: Atsushi Enomoto and 18 persons, Nature, 2002, Vol. 417, pp. 447-452
Ссылка на непатентный документ 11: S.Takahashi and 5 persons, Ann. Rheum. Dis., 2003, Vol. 62, pp. 572-575
Ссылка на непатентный документ 12: M. D. Feher and 4 persons, Rheumatology, 2003, Vol. 42, pp. 321-325
Ссылка на непатентный документ 13: Zhifeng Yu and 2 persons, J. Pharmacol. Exp. Ther., 2006, Vol. 316, pp. 169-175
Описание изобретения
Задача, решаемая настоящим изобретением
Задачей настоящего изобретения является предоставление агента, который обладает ингибирующей активностью в отношении продуцирования мочевой кислоты, для предупреждения или лечения заболевания, связанного с аномальным уровнем мочевой кислоты в сыворотке.
Средства решения указанной задачи
Для решения указанной выше задачи авторы настоящего изобретения провели тщательное исследование. В результате было обнаружено, что производные индолизина, представленные следующей формулой (I), демонстрируют превосходную ингибирующую активность в отношении ксантиноксидазы и исключительно низкие уровни мочевой кислоты в сыворотке, и поэтому они могут представлять собой новое средство для предупреждения или лечения заболевания, связанного с аномальным уровнем мочевой кислоты в сыворотке, что составило основу настоящего изобретения.
Таким образом, настоящее изобретение относится к:
[1] производному индолизина, представленному формулой (I):
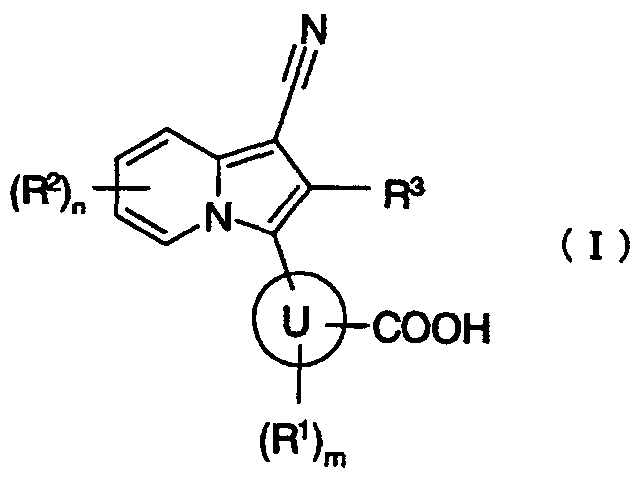
где
кольцо U представляет собой арил или гетероарил;
R1 представляет собой атом галогена, гидроксигруппу, нитрогруппу, аминогруппу или C1-6алкил, который может быть замещен атомом фтора;
R2 представляет собой любой из следующих (1)-(7):
(1) атом галогена;
(2) гидроксигруппу;
(3) аминогруппу;
(4) карбамоил;
(5) цианогруппу;
(6) карбоксигруппу;
(7) C1-6алкил, C2-6алкенил, C2-6алкинил, C1-6алкоксигруппу, моно(ди)C1-6алкиламиногруппу, C2-7ацил, C2-7ациламиногруппу, моно(ди)C1-6алкилкарбамоил, C1-6алкилсульфонил, C1-6алкилсульфониламиногруппу, моно(ди)C1-6алкилсульфамоил, C1-6алкилтиогруппу, C2-6алкенилC1-6алкоксигруппу, C3-8циклоалкил, 3-8-членный гетероциклоалкил, C5-8циклоалкенил, 5-8-членный гетероциклоалкенил, C3-8циклоалкилоксигруппу, C3-8циклоалкиламиногруппу, C3-8циклоалкилC1-6алкил, C3-8циклоалкилC1-6алкоксигруппу, C3-8циклоалкилC1-6алкиламиногруппу, арил, гетероарил, арилоксигруппу, ариламиногруппу, арилкарбонил, арилкарбониламиногруппу, арилC1-6алкоксигруппу, гетероарилоксигруппу, гетероариламиногруппу, гетероарилкарбонил или гетероарилкарбониламиногруппу, каждый из которых может содержать любую группу, выбранную из группы заместителей α;
m представляет целое число от 0 до 2, и когда m равно 2, группы R1 необязательно отличаются друг от друга;
n представляет целое число от 0 до 3, и когда n равно 2 или 3, группы R2 необязательно отличаются друг от друга; и когда существуют две группы R2, связанные с соседними атомами в индолизиновом кольце и независимо представляющие собой группу, выбранную из группы, состоящей из C1-6алкила, который может быть замещен атомом фтора, и C1-6алкоксигруппы, которая может быть замещена атомом фтора, две такие группы R2 необязательно образуют 5-8-членное кольцо вместе со связывающими атомами в индолизиновом кольце;
R3 представляет собой атом водорода, атом хлора или атом фтора; и
группа заместителей α состоит из атома фтора, атома хлора, гидроксигруппы, аминогруппы, карбоксигруппы, карбамоила, цианогруппы, C1-6алкила, C1-6алкоксигруппы и моно(ди)C1-6алкиламиногруппы, или к его пролекарству или их фармацевтически приемлемой соли;
[2] производному индолизина, как описано выше в [1], представленному формулой (Ia):
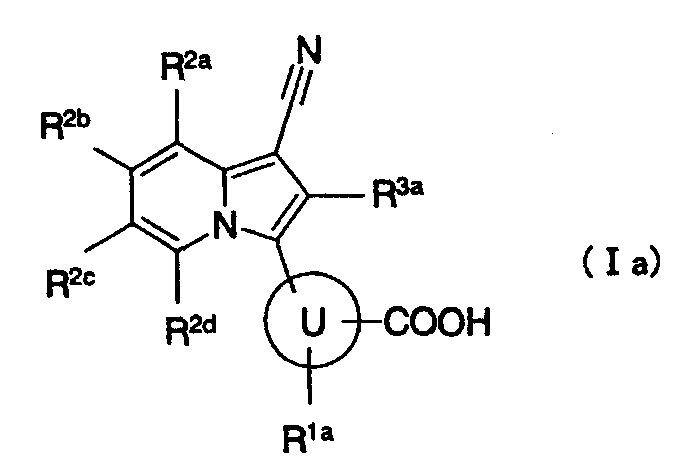
где
кольцо U представляет собой арил или гетероарил;
R1a представляет собой атом водорода, атом фтора, гидроксигруппу, аминогруппу, метил или трифторметил;
R2a и R2b независимо представляют собой любой из следующих (a1)-(a4):
(a1) атом водорода;
(a2) атом галогена;
(a3) гидроксигруппу;
(a4) C1-6алкил, C1-6алкокси, моно(ди)C1-6алкиламиногруппу, C2-7ацил, C1-6алкилтиогруппу, C3-8циклоалкил, 3-8-членный гетероциклоалкил, арил или гетероарил, каждый из которых может содержать любую группу, выбранную из группы заместителей α;
R2c представляет собой атом водорода, атом галогена, гидроксигруппу, C1-6алкил, который может содержать любую группу, выбранную из группы заместителей α, или C1-6алкоксигруппу, которая может содержать любую группу, выбранную из группы заместителей α; или
когда R2a и R2b или R2b и R2c независимо представляют собой группу, выбранную из группы, состоящей из C1-6алкила, который может быть замещен атомом фтора, и C1-6алкоксигруппы, которая может быть замещена атомом фтора, они необязательно образуют 5-8-членное кольцо вместе со связывающими атомами в индолизиновом кольце;
R2d представляет собой атом водорода или атом фтора;
R3a представляет собой атом водорода или атом фтора; и
группа заместителей α имеет такое же значение, как описано выше в [1], или к его пролекарству или их фармацевтически приемлемой соли;
[3] производному индолизина, как описано выше в [2], где кольцо U представляет собой бензольное кольцо, пиридиновое кольцо, тиофеновое кольцо или тиазольное кольцо, или к его пролекарству или их фармацевтически приемлемой соли;
[4] производному индолизина, как описано выше в [2], где группа, представленная формулой:
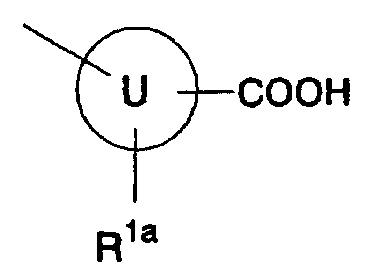
является группой, представленной формулой:
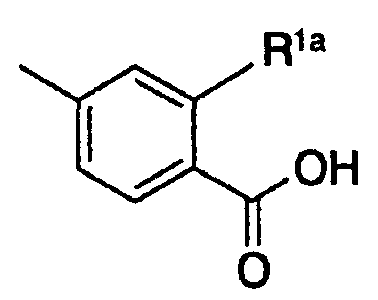
и R1a представляет собой атом водорода или гидроксигруппу, или к его пролекарству или их фармацевтически приемлемой соли;
[5] производному индолизина, как описано выше в [3] или [4], где R2a и R2b независимо представляют собой любой из следующих (b1)-(b4):
(b1) атом водорода;
(b2) атом галогена;
(b3) гидроксигруппу;
(b4) C1-6алкил, C1-6алкоксигруппу, моно(ди)C1-6алкиламиногруппу или гидроксиC1-6алкил, каждый из которых может быть замещен атомом фтора; и
R2c представляет собой атом водорода, атом галогена, гидроксигруппу, C1-6алкил, который может быть замещен атомом фтора, или C1-6алкоксигруппу, которая может быть замещена атомом фтора, или к его пролекарству или их фармацевтически приемлемой соли;
[6] производному индолизина, как описано выше в любом из [2]-[5], где R2d представляет собой атом водорода, или к его пролекарству или их фармацевтически приемлемой соли;
[7] производному индолизина, как описано выше в любом из [1]-[6], где R3 или R3a представляет собой атом водорода, или к его пролекарству или их фармацевтически приемлемой соли;
[8] производному индолизина, как описано выше в [6] или [7], где R1a представляет собой атом водорода или гидроксигруппу;
R2a представляет собой атом водорода, атом фтора, атом хлора, метил, этил, метоксигруппу, монофторметил, дифторметил, трифторметил, дифторметоксигруппу или трифторметоксигруппу;
R2b представляет собой атом водорода, атом фтора, атом хлора, метил, этил, метоксигруппу, монофторметил, дифторметил, трифторметил, дифторметоксигруппу или трифторметоксигруппу; и
R2c представляет собой атом водорода, атом фтора, атом хлора, метил, монофторметил, дифторметил или трифторметил, или к его пролекарству или их фармацевтически приемлемой соли;
[9] производному индолизина, как описано выше в [8], где R2b представляет собой атом водорода, метил, этил, метоксигруппу, монофторметил, дифторметил, трифторметил, дифторметоксигруппу или трифторметоксигруппу, или к его пролекарству или их фармацевтически приемлемой соли;
[10] производному индолизина, как описано выше в [8] или [9], где R1a представляет собой атом водорода, или к его пролекарству или их фармацевтически приемлемой соли;
[11] производному индолизина, как описано выше в [8] или [9], где R1a представляет собой гидроксигруппу, или к его пролекарству или их фармацевтически приемлемой соли;
[12] производному индолизина, как описано выше в любом из [1]-[11], которое представляет собой ингибитор ксантиноксидазы, или к его пролекарству или их фармацевтически приемлемой соли;
[13] фармацевтической композиции, содержащей в качестве активного ингредиента производное индолизина, как описано выше в любом из [1]-[11], или его пролекарство или их фармацевтически приемлемую соль;
[14] фармацевтической композиции, как описано выше в [13], которая представляет собой средство для предупреждения или лечения заболевания, выбранного из группы, состоящей из гиперурикемии, подагрического узла, подагрического артрита, связанного с гиперурикемией почечного расстройства и мочевых конкрементов;
[15] фармацевтической композиции, как описано выше в [14], которая представляет собой средство для предупреждения или лечения гиперурикемии;
[16] фармацевтической композиции, как описано выше в [13], которая представляет собой средство для снижения уровня мочевой кислоты в сыворотке;
[17] фармацевтической композиции, как описано выше в [13], которая представляет собой ингибитор продуцирования мочевой кислоты; и т.п.
В производном индолизина, представленном формулой (1), согласно настоящему изобретению, каждый термин имеет следующее значение, если не указано иное.
Термин «атом галогена» означает атом фтора, атом хлора, атом брома или атом йода.
Термин «C1-6алкил» означает алкильную группу с прямой или разветвленной цепью, имеющую 1-6 атомов углерода, в качестве иллюстрации которой можно указать метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил и т.п.
Термин «C1-6алкилен» означает двухвалентную группу, производную вышеуказанного C1-6алкила.
Термин «C2-6алкенил» означает алкенильную группу с прямой или разветвленной цепью, имеющую 2-6 атомов углерода, в качестве иллюстрации которой можно указать винил, аллил, 1-пропенил, изопропенил и т.п.
Термин «C2-6алкинил» означает алкинильную группу с прямой или разветвленной цепью, имеющую 2-6 атомов углерода, в качестве иллюстрации которой можно указать этинил, 2-пропинил и т.п.
Термин «C1-6алкоксигруппа» означает алкоксигруппу с прямой или разветвленной цепью, имеющую 1-6 атомов углерода, в качестве иллюстрации которой можно указать метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу и т.п.
Термин «гидроксиC1-6алкил» означает гидроксиалкильную группу с прямой или разветвленной цепью, имеющую 1-6 атомов углерода.
Термин «C1-6алкилсульфонил» означает группу, представленную группой (C1-6алкил)-SO2-, в качестве иллюстрации которой можно указать метилсульфонил, этилсульфонил и т.п.
Термин «C1-6алкилсульфониламиногруппа» означает группу, представленную группой (C1-6алкил)-SO2NH-, в качестве иллюстрации которой можно указать метилсульфониламиногруппу, этилсульфониламиногруппу и т.п.
Термин «C2-7ацил» означает ацильную группу с прямой или разветвленной цепью, имеющую 2-7 атомов углерода, в качестве иллюстрации которой можно указать ацетил, пропионил, бутирил, изобутирил, пивалоил и т.п.
Термин «C2-7ациламиногруппа» означает группу, представленную группой (C1-6алкил)-C(O)NH-.
Термин «C1-6алкилтиогруппа» означает группу, представленную группой (C1-6алкил)-S-.
Термин «C2-6алкенилC1-6алкоксигруппа» означает указанную выше C1-6алкоксигруппу, замещенную указанным выше C2-6алкенилом.
Термин «моно(ди)C1-6алкиламиногруппа» означает аминогруппу, замещенную одним или двумя указанными выше C1-6алкилами.
Термин «моно(ди)C1-6алкилсульфамоил» означает сульфамоил, замещенный одним или двумя указанными выше C1-6алкилами.
Термин «моно(ди)C1-6алкилкарбамоил» означает карбамоил, замещенный одним или двумя указанными выше C1-6алкилами.
В случае двойного замещения заместители могут отличаться друг от друга.
Термин «C3-8циклоалкил» означает 3-8-членную насыщенную циклическую углеводородную группу, в качестве иллюстрации которой можно указать циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил.
Термин «C5-8циклоалкенил» означает 5-8-членную циклоалкенильную группу, в качестве иллюстрации которой можно указать циклопентенил, циклогексенил, циклогептенил, циклооктенил и т.п.
Термин «3-8-членный гетероциклоалкил» означает 3-8-членную гетероциклоалкильную группу, имеющую в кольце 1 или 2 одинаковых или различных гетероатома, выбранных из атома кислорода, атома серы и атома азота, в качестве иллюстрации которой можно указать азиридиногруппу, азетидиногруппу, морфолиногруппу, 2-морфолинил, тиоморфолиногруппу, 1-пирролидинил, пиперидиногруппу, 4-пиперидинил, 1-пиперидинил, 1-пирролил, тетрагидрофуранил, тетрагидропиранил и т.п.
Термин «5-8-членный гетероциклоалкенил» означает 5-8-членную гетероциклоалкенильную группу, имеющую в кольце 1 или 2 одинаковых или различных гетероатома, выбранных из атома кислорода, атома серы и атома азота, в качестве иллюстрации которой можно указать дигидрофуранил, дигидротиофенил, дигидропирролил, оксатионил и т.п.
Термин «C3-8циклоалкилоксигруппа» означает группу, представленную группой (C3-8циклоалкил)-O-.
Термин «C3-8циклоалкиламиногруппа» означает группу, представленную группой (C3-8циклоалкил)-NH-.
Термин «C3-8циклоалкилC1-6алкил» означает указанный выше С1-6алкил, замещенный указанным выше С3-8циклоалкилом.
Термин «C3-8циклоалкилC1-6алкоксигруппа» означает указанную выше С1-6алкоксигруппу, замещенную указанным выше С3-8циклоалкилом.
Термин «C3-8циклоалкилC1-6алкиламиногруппа» означает группу, представленную группой (C1-6алкил)-NH-, замещенную указанным выше С3-8циклоалкилом.
Термин «арил» означает фенил.
Термин «арилоксигруппа» означает группу, представленную группой (арил)-O-.
Термин «ариламиногруппа» означает группу, представленную группой (арил)-NH-.
Термин «арилкарбонил» означает группу, представленную группой (арил)-C(O)-.
Термин «арилкарбониламиногруппа» означает группу, представленную группой (арил)-C(O)NH-.
Термин «арилC1-6алкокси» означает указанную выше С1-6алкоксигруппу, замещенную указанным выше арилом.
Термин «гетероарил» означает 5- или 6-членную ароматическую гетероциклическую группу, имеющую 1-4 одинаковых или различных гетероатома, выбранных из атома кислорода, атома серы и атома азота в кольце, в качестве иллюстрации которой можно указать тиазолил, оксазолил, изотиазолил, изоксазолил, пиридил, пиримидил, пиразил, пиридазил, пирролил, фуранил, тиофенил, имидазолил, пиразолил, оксадиазолил, тиадиазолил, триазолил, тетразолил, фуразанил и т.п.
Термин «гетероарилоксигруппа» означает группу, представленную группой (гетероарил)-O-.
Термин «гетероариламиногруппа» означает группу, представленную группой (гетероарил)-NH-.
Термин «гетероарилкарбонил» означает группу, представленную группой (гетероарил)-C(O)-.
Термин «гетероарилкарбониламиногруппа» означает группу, представленную группой (гетероарил)-C(O)NH-.
Две группы R2, R2a и R2b или R2b и R2c вместе со связывающими атомами в индолизиновом кольце необязательно образуют 5-8-членное кольцо, в качестве иллюстрации которого можно указать, например, циклопентил, циклогексил, [1,4]диоксил, [1,3]диоксолил и т.п., каждый из которых может иметь на кольце метил или метоксигруппу.
Термин «может быть замещенным атомом фтора» означает необязательно наличие 1-5 атомов фтора в качестве заместителей. Кроме того, если группа, которая может быть замещенной атомом фтора, представляет собой метил, метоксигруппу или N-метиламиногруппу, это означает необязательно наличие 1-3 атомов фтора или, в случае гидроксиметила, это означает необязательно наличие 1 или 2 атомов фтора.
Термин «может содержать любую группу, выбранную из группы заместителей α», означает необязательно наличие 1-3 одинаковых или различных групп, выбранных из группы заместителей α, и отсутствие заместителей или, предпочтительно, наличие 1 заместителя. При условии что если группа, выбранная из группы заместителей α, представляет собой атом фтора, это имеет такое же значение, как и указанный выше термин «может быть замещенным атомом фтора».
Термин «моно(ди)гидроксиC1-6алкил» означает указанный выше С1-6алкил, замещенный 1 или 2 гидроксильными группами.
Термин «C1-6алкоксиC1-6алкоксиC1-6алкил» означает указанный выше С1-6алкил, замещенный указанной выше С1-6алкоксигруппой, замещенной указанной выше С1-6алкоксигруппой.
Термин «моно(ди)C1-6алкиламиноC1-6алкил» означает указанный выше С1-6алкил, замещенный указанной выше моно(ди)C1-6алкиламиногруппой.
Термин «3-8-членный гетероциклоалкилC1-6алкил» означает указанный выше С1-6алкил, замещенный указанным выше 3-8-членным гетероциклоалкилом.
Термин «аминоC1-6алкилен» означает указанный выше С1-6алкилен, замещенный аминогруппой.
В качестве иллюстрации одного из предпочтительных вариантов осуществления настоящего изобретения можно указать, например, производное индолизина, представленное следующей общей формулой (IA):
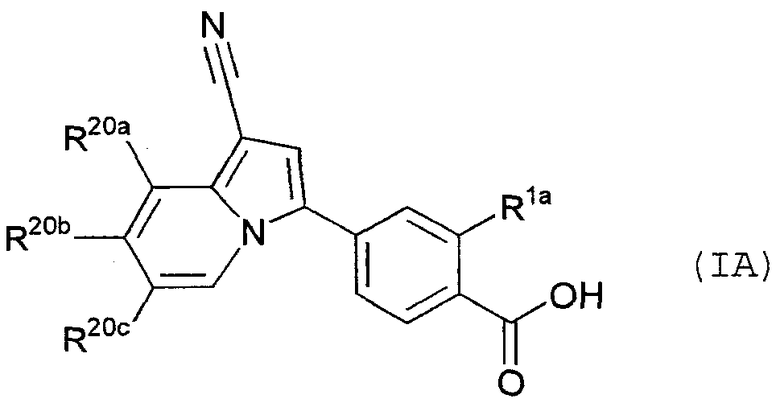
В данной формуле R1a представляет собой атом водорода или гидроксигруппу; R20a представляет собой атом водорода, атом фтора, атом хлора, метил или метоксигруппу; R20b представляет собой атом водорода, атом хлора, метил, этил, метоксигруппу, монофторметил или трифторметил; и R20c представляет собой атом водорода, атом фтора, атом хлора, метил или трифторметил.
Кроме того, в качестве другого предпочтительного варианта осуществления настоящего изобретения, в виде иллюстрации можно указать производное индолизина, представленное следующей общей формулой (IB):
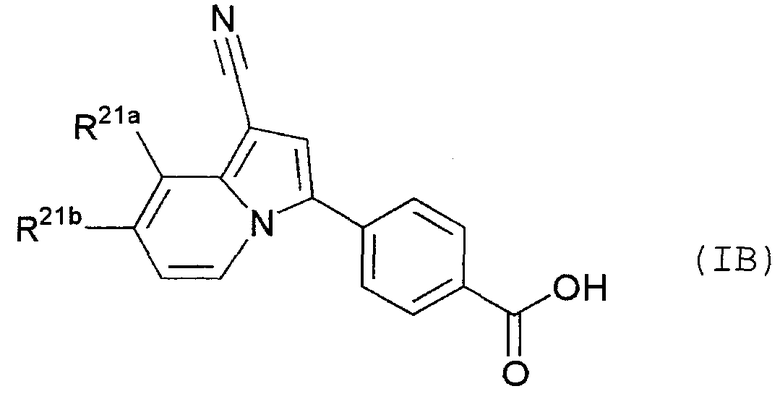
В данной формуле R21a представляет собой атом водорода, атом фтора или атом хлора; и R21b представляет собой атом водорода, метил, монофторметил или трифторметил.
Кроме того, в качестве другого предпочтительного варианта осуществления настоящего изобретения, в виде иллюстрации можно указать производное индолизина, представленное следующей общей формулой (IC):
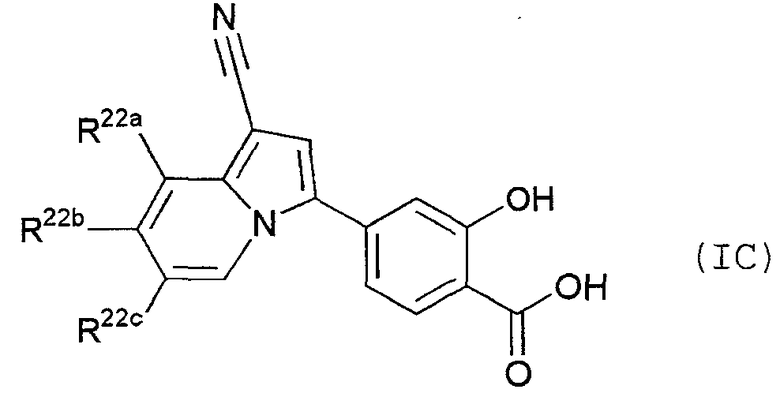
В данной формуле R22a представляет собой атом водорода или атом фтора; R22b представляет собой атом водорода, метил, метоксигруппу, монофторметил или трифторметил; и R22c представляет собой атом водорода, атом фтора, атом хлора, метил или трифторметил.
Производное индолизина, представленное формулой (1), согласно настоящему изобретению может быть получено, например, способом, описанным ниже, или способом, подобно указанному, или способом, описанным в литературе, или способом, подобно указанному в литературе, и т.п. Кроме того, если требуется защитная группа, операции введения и снятия защиты можно также проводить необязательно комбинированным образом согласно общему способу. Каждую реакцию можно также необязательно проводить, используя реакционный контейнер, устойчивый к давлению.
[Способ синтеза 1]
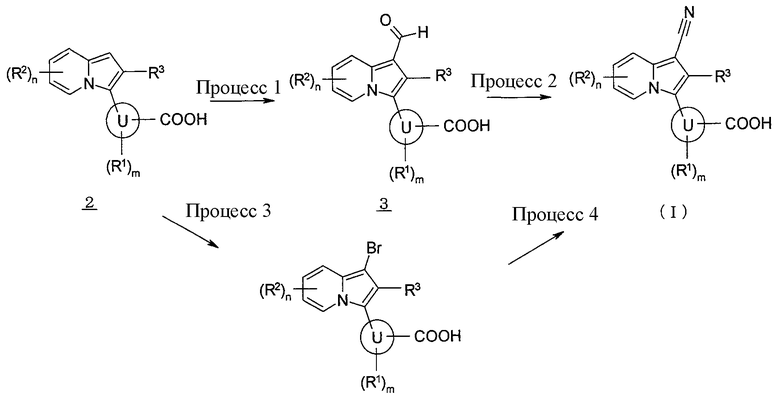
В указанных формулах кольцо U, R1, R2, R3, m и n имеют такие же значения, как определено выше.
Процесс 1
Альдегидное соединение (3) также может быть получено, подвергая соединение (2) формилированию в инертном растворителе в присутствии N,N-диметилформамида и фосфорилхлорида. В качестве инертного растворителя можно в виде иллюстрации указать N,N-диметилформамид, бензол, толуол, хлорбензол, дихлорметан, 1,2-дихлорэтан, хлороформ, смесь указанных растворителей и т.п. Температура реакции обычно составляет от 0°C до температуры кипения с обратным холодильником, и время реакции обычно составляет от 30 минут до 7 дней, варьируя в зависимости от используемого исходного вещества, растворителя, температуры реакции и т.п.
Процесс 2
Производное индолизина, представленное формулой (I), согласно настоящему изобретению также может быть получено, подвергая альдегидное соединение (3) цианированию, используя гидроксиламин или его гидрохлоридную соль в инертном растворителе в присутствии или в отсутствие основания, в присутствии или в отсутствие конденсирующего реагента. В качестве инертного растворителя можно в виде иллюстрации указать N,N-диметилформамид, ацетонитрил, бензол, толуол, хлорбензол, дихлорметан, 1,2-дихлорэтан, хлороформ, тетрагидрофуран, 1,4-диоксан, N-метилпирролидон, смесь указанных растворителей и т.п. В качестве основания можно в виде иллюстрации указать триэтиламин, N,N-диизопропилэтиламин, пиридин, 2,6-лутидин, 1,8-диазабицикло[5,4,0]-7-ундецен, карбонат калия, карбонат натрия и т.п. В качестве конденсирующего реагента можно в виде иллюстрации указать уксусный ангидрид, тионилхлорид, пентахлорид фосфора, N,N-дициклогексилкарбодиимид, N,N'-карбонилимидазол и т.п. Температура реакции обычно составляет от 0°C до температуры кипения с обратным холодильником, и время реакции обычно составляет от 30 минут до 7 дней, варьируя в зависимости от используемого исходного вещества, растворителя, температуры реакции и т.п.
Указанную выше реакцию цианирования можно проводить, давая возможность альдегидному соединению (3) и гидроксиламину или его гидрохлоридной соли взаимодействовать с формиатом натрия в муравьиной кислоте в качестве растворителя. Температура реакции обычно составляет от 0°C до температуры кипения с обратным холодильником, и время реакции обычно составляет от 30 минут до 7 дней, варьируя в зависимости от используемого исходного вещества, растворителя, температуры реакции и т.п.
Процесс 3
Бромированное соединение (4) также может быть получено, подвергая соединение (2) бромированию в присутствии бромирующего реагента, такого как N-бромсукцинимид или подобного, в инертном растворителе. В качестве инертного растворителя можно в виде иллюстрации указать дихлорметан, 1,2-дихлорэтан, хлороформ, четыреххлористый углерод, уксусную кислоту, ацетонитрил, метанол, диметилформамид, смесь указанных растворителей и т.п. Температура реакции обычно составляет от 0°C до температуры кипения с обратным холодильником, и время реакции обычно составляет от 30 минут до 7 дней, варьируя в зависимости от используемого исходного вещества, растворителя, температуры реакции и т.п.
Процесс 4
Производное индолизина, представленное формулой (I), согласно настоящему изобретению также может быть получено, подвергая бромированное соединение (4) цианированию в присутствии палладиевого катализатора и цианида цинка в инертном растворителе. В качестве инертного растворителя можно в виде иллюстрации указать бензол, толуол, ксилол, диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан, дихлорметан, 1,2-дихлорэтан, хлороформ, метанол, этанол, 2-пропанол, бутанол, N,N-диметилформамид, N-метилпирролидон, диметилсульфоксид, воду, смесь указанных растворителей и т.п. В качестве палладиевого катализатора можно в виде иллюстрации указать тетракис(трифенилфосфин)палладий, дихлорбис(трифенилфосфин)палладийдихлорид, 1,1'-бис(дифенилфосфино)ферроценпалладий и т.п. Температура реакции обычно составляет от 0°C до температуры кипения с обратным холодильником, и время реакции обычно составляет от 30 минут до 7 дней, варьируя в зависимости от используемого исходного вещества, растворителя, температуры реакции и т.п.
Среди производных индолизина, представленных формулой (I), согласно настоящему изобретению, применяя способы следующих способов синтеза 2 и 3, также может быть получено производное индолизина (Ib), где R3 представляет собой атом водорода.
[Способ синтеза 2]
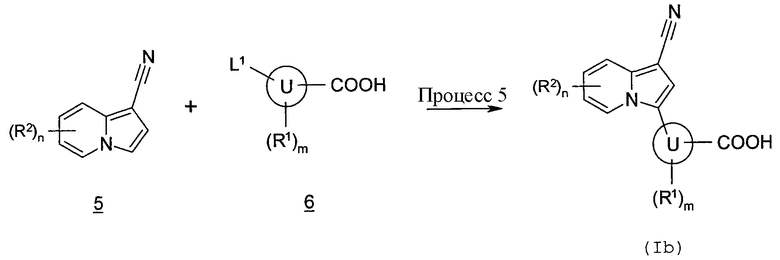
В данных формулах L1 представляет собой уходящую группу, такую как атом хлора, атом брома, атом йода, трифторметансульфонилоксигруппа и т.п., и кольцо U, R1, R2, m и n имеют такие же значения, как определено выше.
Процесс 5
Производное индолизина (Ib) согласно настоящему изобретению также может быть получено проведением реакции сочетания соединения индолизина (5) и соединения (6) в инертном растворителе в присутствии основания и палладиевого катализатора. В качестве инертного растворителя можно в виде иллюстрации указать бензол, толуол, ксилол, диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан, дихлорметан, 1,2-дихлорэтан, хлороформ, N,N-диметилформамид, N-метилпирролидон, диметилсульфоксид, воду, смесь указанных растворителей и т.п. В качестве основания можно в виде иллюстрации указать ацетат натрия, ацетат калия, карбонат натрия, карбонат калия, карбонат цезия, гидроксид натрия, гидроксид калия, гидроксид лития, этоксид натрия, метоксид натрия, фторид калия, фторид цезия, триэтиламин, N,N-диизопропилэтиламин, пиридин, 2,6-лутидин, 1,8-диазабицикло[5,4,0]-7-ундецен и т.п. В качестве палладиевого катализатора в виде иллюстрации можно указать дихлорбис(трифенилфосфин)палладий, ацетат палладия и т.п. Температура реакции обычно составляет от 0°C до температуры кипения с обратным холодильником, и время реакции обычно составляет от 30 минут до 7 дней, варьируя в зависимости от используемого исходного вещества, растворителя, температуры реакции и т.п.
[Способ синтеза 3]
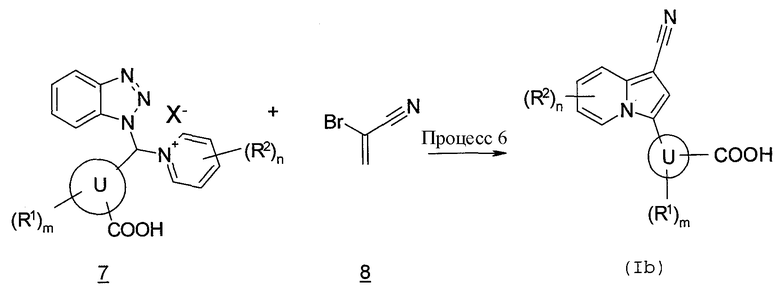
В данных формулах X представляет собой хлор, бром, йод, мезильную группу, тозильную группу и т.п., и кольцо U, R1, R2, m и n имеют такие же значения, как определено выше.
Процесс 6
Производное индолизина (Ib) согласно настоящему изобретению также может быть получено, давая возможность соединению бензотриазола (7) взаимодействовать с 2-бромакрилонитрилом (8) в инертном растворителе в присутствии основания. В качестве инертного растворителя можно в виде иллюстрации указать ацетонитрил, тетрагидрофуран, N,N-диметилформамид, диэтиловый эфир, N-метилпирролидон, этанол, метанол, воду, смесь указанных растворителей и т.п. В качестве основания можно в виде иллюстрации указать гидроксид натрия, гидроксид калия, гидрид натрия, трет-бутоксид калия, метоксид натрия, этоксид натрия, диизопропиламид лития, триэтиламин, N,N-диизопропилэтиламин и т.п. Температура реакции обычно составляет от 0°C до температуры кипения с обратным холодильником, и время реакции обычно составляет от 30 минут до 7 дней, варьируя в зависимости от используемого исходного вещества, растворителя, температуры реакции и т.п.
Соединение (2), используемое в указанном выше способе синтеза 1, также может быть получено, используя различные соединения индолизина, способом, описанным в литературе (например, Choul-Hong Park, Org. Lett., 2004, 6, pp. 1159-1162 и т.п.), или подобным ему способом и т.п. Соединения индолизина, используемые в указанном способе, также могут быть получены способом, описанным в литературе (например, David, Virieux, Тетраhedron, 2006, 62, pp. 3710-3720, или т.п.), или подобным ему способом и т.п.
Соединение (2a), где R3 представляет собой атом фтора, относящееся к вариантам соединения (2), используемого в указанном выше способе синтеза 1, также может быть получено способом, указанным в следующем способе синтеза 4.
[Способ синтеза 4]
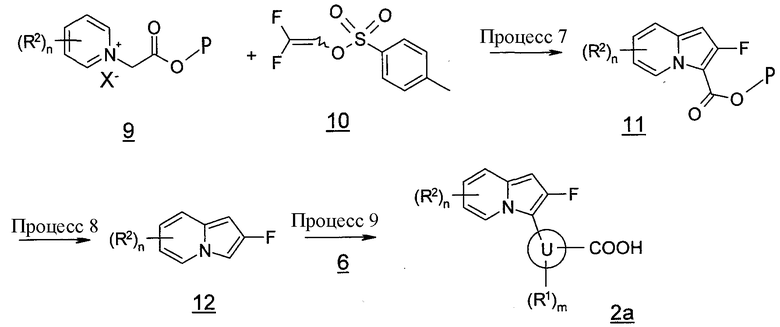
В данных формулах P представляет собой защитную группу, и кольцо U, R1, R2, m, n и X имеют такие же значения, как определено выше.
Процесс 7
Соединение (11) также может быть получено, давая возможность соединению (9) взаимодействовать с соединением (10) в инертном растворителе в присутствии основания. В качестве инертного растворителя можно в виде иллюстрации указать N,N-диметилформамид, N-метилпирролидон, диметилсульфоксид, диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан, бензол, толуол, ксилол, смесь указанных растворителей и т.п. В качестве основания можно в виде иллюстрации указать карбонат калия, карбонат натрия, карбонат цезия, гидроксид натрия, гидроксид калия, гидроксид лития, фторид калия, фторид цезия, триэтиламин, пиридин, N,N-диизопропилэтиламин, 2,6-лутидин, 1,8-диазабицикло[5,4,0]-7-ундецен и т.п. Температура реакции обычно составляет от 0°C до температуры кипения с обратным холодильником, и время реакции обычно составляет от 30 минут до 7 дней, варьируя в зависимости от используемого исходного вещества, растворителя, температуры реакции и т.п.
Процесс 8
Соединение (12) также может быть получено, удаляя защитную группу соединения (11) и подвергая декарбоксилированию полученное соединение карбоновой кислоты в инертном растворителе в присутствии или в отсутствие катализатора. В качестве инертного растворителя можно в виде иллюстрации указать хинолин, метафосфорную кислоту, уксусную кислоту, трифторуксусную кислоту, хлористоводородную кислоту, серную кислоту, метанол, смесь указанных растворителей и т.п. В качестве катализатора можно в виде иллюстрации указать медь и т.п. Температура реакции обычно составляет от 0°C до температуры кипения с обратным холодильником, и время реакции обычно составляет от 30 минут до 7 дней, варьируя в зависимости от используемого исходного вещества, растворителя, температуры реакции и т.п.
Процесс 9
Соединение (2a) также может быть получено, подвергая сочетанию соединение (12) и указанное выше соединение (6) способом, подобно указанному выше процессу 5.
Соединение индолизина (5), используемое в указанном выше способе синтеза 2, также может быть получено, например, способами, указанными в следующих способах синтеза 5 и 6.
[Способ синтеза 5]
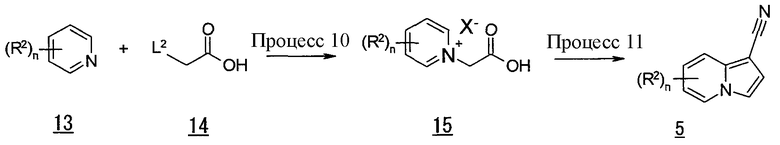
В данных формулах L2 представляет собой уходящую группу, такую как атом хлора, атом брома, атом йода, мезильная группа, тозильная группа и т.п., и R2, n и X имеют такие же значения, как определено выше.
Процесс 10
Соединение (15) также может быть получено, давая возможность соединению (13) взаимодействовать с соединением (14) в инертном растворителе. В качестве инертного растворителя можно в виде иллюстрации указать этилацетат, ацетон, диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан, дихлорметан, 1,2-дихлорэтан, хлороформ, N,N-диметилформамид, N-метилпирролидон, диметилсульфоксид, бензол, толуол, ксилол, метанол, этанол, 2-пропанол, смесь указанных растворителей и т.п. Температура реакции обычно составляет от 0°C до температуры кипения с обратным холодильником, и время реакции обычно составляет от 30 минут до 7 дней, варьируя в зависимости от используемого исходного вещества, растворителя, температуры реакции и т.п.
Процесс 11
Соединение индолизина (5) также может быть получено, давая возможность соединению (15) взаимодействовать с акрилонитрилом в инертном растворителе в присутствии основания и диоксида марганца. В качестве инертного растворителя можно в виде иллюстрации указать бензол, толуол, ксилол, диэтиловый эфир, 1,2-диметоксиэтан, дихлорметан, 1,2-дихлорэтан, хлороформ, N,N-диметилформамид, N-метилпирролидон, смесь указанных растворителей и т.п. В качестве основания можно в виде иллюстрации указать триэтиламин, N,N-диизопропилэтиламин, пиридин, 2,6-лутидин, 1,8-диазабицикло[5,4,0]-7-ундецен и т.п. Температура реакции обычно составляет от 0°C до температуры кипения с обратным холодильником, и время реакции обычно составляет от 30 минут до 7 дней, варьируя в зависимости от используемого исходного вещества, растворителя, температуры реакции и т.п.
[Способ синтеза 6]
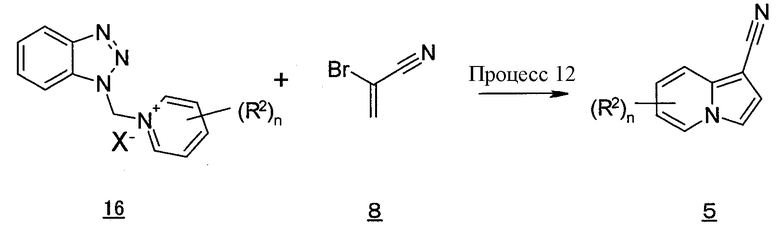
В данных формулах R2, n и X имеют такие же значения, как определено выше.
Процесс 12
Соединение индолизина (5) также может быть получено, давая возможность производному бензотриазола (16) взаимодействовать с 2-бромакрилонитрилом (8) способом, подобно описанному выше процессу 6.
Соединения триазола (7) и (16), используемые в указанных выше способах синтеза, также могут быть получены способом, описанным в литературе (например, Katrizky, A. R, J. Org. Chem., 1999, 64, pp. 7618-7621, или т.п.), или подобным ему способом и т.п.
В качестве защитных групп, используемых в настоящем изобретении, можно использовать многие защитные группы, обычно используемые в реакциях органического синтеза. Например, в качестве гидроксизащитных групп можно в дополнение к п-метоксибензильной группе в виде иллюстрации указать бензильную группу, метоксиметильную группу, ацетильную группу, пивалоильную группу, бензоильную группу, трет-бутилдиметилсилильную группу, трет-бутилдифенилсилильную группу, аллильную группу и т.п.; когда две гидроксильные группы являются соседними, в качестве защитной группы в виде иллюстрации можно указать изопропилиденовую группу, циклопентилиденовую группу, циклогексилиденовую группу и т.п. В качестве тиолзащитных групп в виде иллюстрации можно указать п-метоксибензильную группу, бензильную группу, ацетильную группу, пивалоильную группу, бензоильную группу, бензилоксикарбонильную группу и т.п. В качестве аминозащитных групп можно в виде иллюстрации указать бензилоксикарбонильную группу, трет-бутоксикарбонильную группу, бензильную группу, п-метоксибензильную группу, трифторацетильную группу, ацетильную группу, фталоильную группу и т.п. В качестве карбоксизащитных групп можно в виде иллюстрации указать C1-6алкильную группу, бензильную группу, трет-бутилдиметилсилильную группу, аллильную группу и т.п.
Производное индолизина, представленное формулой (I), согласно настоящему изобретению можно также выделить или очистить традиционными методами выделения, такими как дробная кристаллизация, очистка хроматографией, экстракция растворителем, твердофазная экстракция и т.п.
Производное индолизина, представленное формулой (I), согласно настоящему изобретению можно также обычным путем преобразовать в его фармацевтически приемлемые соли. В качестве такой соли можно в виде иллюстрации указать кислотно-аддитивную соль с минеральной кислотой, такой как хлористоводородная кислота, бромистоводородная кислота, йодистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., кислотно-аддитивную соль с органической кислотой, такой как муравьиная кислота, уксусная кислота, метансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, пропионовая кислота, лимонная кислота, янтарная кислота, винная кислота, фумаровая кислота, масляная кислота, щавелевая кислота, малоновая кислота, малеиновая кислота, молочная кислота, яблочная кислота, угольная кислота, бензойная кислота, глутаминовая кислота, аспарагиновая кислота и т.п., соль с неорганическим основанием, такую как соль натрия, соль калия, соль кальция, соль магния, соль цинка, соль лития, соль алюминия и т.п., аддитивную соль с органическим основанием, таким как N-метил-D-глюкамин, N,N-дибензилэтилендиамин, 2-аминоэтанол, трис(гидроксиметил)аминометан, аргинин, лизин, пиперидин, холин, диэтиламин, 4-фенилциклогексан и т.п.
Среди производных индолизина, представленных формулой (I), согласно настоящему изобретению соединения, имеющие ненасыщенную связь, присутствуют в двух геометрических изомерах - соединение цис-формы (Z) и соединение транс-формы (Е). В настоящем изобретении можно использовать каждое из таких соединений, а также можно использовать их смесь.
Среди производных индолизина, представленных формулой (I) согласно настоящему изобретению, соединения, имеющие хиральный атом углерода, присутствуют в R-конфигурации и S-конфигурации для каждого хирального атома углерода. В настоящем изобретении можно использовать каждый из оптических изомеров, а также можно использовать смесь оптических изомеров.
Производные индолизина, представленные формулой (1), согласно настоящему изобретению могут присутствовать в виде некоторых таутомеров, и эти таутомеры также относятся к соединениям согласно настоящему изобретению.
В настоящем изобретении термин «пролекарство» означает соединение, которое в организме должно быть преобразовано в производное индолизина, представленное формулой (1). Пролекарство производного индолизина, представленного формулой (I), согласно настоящему изобретению может быть получено путем введения подходящей группы, образующей пролекарство, в любую одну или более из групп, выбранных из гидроксигруппы, аминогруппы, карбоксигруппы и других групп, которые могут образовывать пролекарство соединения, представленного формулой (I), обычно используя соответствующий реагент, пригодный для получения пролекарства, такой как галоидное соединение или т.п., и затем путем подходящего выделения и очистки, как того требуют обстоятельства. См. Gekkan-Yakuji iyakuhin tekiseisiyou no tameno rinsyou yakubutsudoutai (monthly pharmaceutical, clinical pharmacokinetics for the proper use of pharmaceutical products), 2000.3. Extra edition, Vol. 42, No. 4, pp. 669-707, и New Drug Delivery System, published by CMC Co., Ltd., 2000.1.31, pp. 67-173. В качестве группы, образующей пролекарство с использованием гидроксигруппы или аминогруппы, можно в виде иллюстрации указать, например, группу C1-6алкил-CO-, такую как ацетил, пропионил, бутирил, изобутирил, пивалоил и т.п.; арил-CO-, такую как бензоил и т.п.; C1-6алкил-O-C1-6алкилен-CO-; C1-6алкил-OCO-C1-6алкилен-CO-; C1-6алкил-OCO-, такую как метилоксикарбонил, этилоксикарбонил, пропилоксикарбонил, изопропилоксикарбонил, трет-бутилоксикарбонил и т.п.; C1-6алкил-O-C1-6алкилен-OCO-; C1-6алкил-COO-C1-6алкилен, такой как ацетилоксиметил, пивалоилоксиметил, 1-(ацетилокси)этил, 1-(пивалоилокси)этил и т.п.; C1-6алкил-OCOO-C1-6алкилен, такой как метоксикарбонилоксиметил, 1-(метоксикарбонилокси)этил, этоксикарбонилоксиметил, 1-(этоксикарбонилокси)этил, изопропилоксикарбонилоксиметил, 1-(изопропилоксикарбонилокси)этил, трет-бутилоксикарбонилоксиметил, 1-(трет-бутилоксикарбонилокси)этил и т.п.; C3-8циклоалкил-OCOO-C1-6алкилен, такой как циклогексилоксикарбонилоксиметил, 1-(циклогексилоксикарбонил)этил и т.п.; эфир или амид аминокислоты, такой как глицин и т.п.; и т.п.
В качестве группы, образующей пролекарство с использованием карбоксигруппы, можно в виде иллюстрации указать, например, C1-6алкил, такой как метил, этил, пропил, изопропил, бутил, трет-бутил и т.п.; C1-6алкил-COOC1-6алкилен, такой как пивалоилоксиметил, ацетилоксиметил, 1-(пивалоилокси)этил, 1-(ацетилокси)этил и т.п.; C1-6алкил-OCOO-C1-6алкилен, такой как этилоксикарбонилоксиметил, 1-(этилоксикарбонилокси)этил, изопропилоксикарбонилоксиметил, 1-(изопропилоксикарбонилокси)этил, трет-бутилоксикарбонилоксиметил, 1-(трет-бутилоксикарбонилокси)этил и т.п.; C3-8циклоалкил-OCOO-C1-6алкилен, такой как циклогексилоксикарбонилоксиметил, 1-(циклогексилоксикарбонилокси)этил и т.п.; моно(ди)гидроксиC1-6алкил, такой как гидроксиэтил, гидроксипропил, 1,2-дигидроксипропил, 1-гидрокси(2-гидроксиметил)пропил и т.п.; моно(ди)гидроксиC1-6алкил-OCOO-C1-6алкилен, такой как 1-(гидроксиэтилоксикарбонилокси)этил и т.п.; C1-6алкоксиC1-6алкоксиC1-6алкил, такой как метоксиэтоксиэтил и т.п.; моно(ди)C1-6алкиламиноC1-6алкил, такой как диметиламиноэтил и т.п.; (3-8-членный гетероциклоалкил)-C1-6алкил, такой как пирролидин-1-илэтил и т.п.; C1-6алкил-OCO-амино-C1-6алкилен, такой как метилоксикарбонил(амино)этил и т.п.; и т.п.
В качестве пролекарства согласно настоящему изобретению предпочтительным является соединение, имеющее группу, образующую указанное выше пролекарство с использованием карбоксигруппы. В качестве группы, образующей такое пролекарство, более предпочтительным является моно(ди)гидроксиC1-6алкил, такой как гидроксиэтил, гидроксипропил, 1,2-дигидроксипропил, 1-гидрокси(2-гидроксиметил)пропил и т.п.; моно(ди)гидроксиC1-6алкил-OCOO-C1-6алкилен, такой как 1-(гидроксиэтилоксикарбонилокси)этил и т.п.; C1-6алкоксиC1-6алкоксиC1-6алкил, такой как метоксиэтоксиэтил и т.п.; моно(ди)C1-6алкиламиноC1-6алкил, такой как диметиламиноэтил и т.п.; (3-8-членный гетероциклоалкил)-C1-6алкил, такой как пирролидин-1-илэтил и т.п.; C1-6алкил-OCO-аминоC1-6алкилен, такой как метилоксикарбонил(амино)этил и т.п.; и т.п.
В настоящем изобретении фармацевтически приемлемая соль также включает ее сольват с фармацевтически приемлемым растворителем, таким как вода, этанол и т.п.
Фармацевтическую композицию согласно настоящему изобретению можно применять для предупреждения или лечения заболеваний, связанных с высокими уровнями мочевой кислоты в сыворотке, таких как гиперурикемия, подагрический узел, связанное с гиперурикемией почечное расстройство, мочевые конкременты и т.п., особенно для предупреждения или лечения гиперурикемии.
Когда фармацевтическую композицию согласно настоящему изобретению применяют на практике для профилактики или лечения, решение о дозировании соединения, представленного формулой (I), или его пролекарства или их фармацевтически приемлемой соли, используемых в качестве активного ингредиента, принимают в зависимости от возраста, пола, массы тела, степени расстройства и способа лечения каждого пациента и т.п., например, приблизительно в диапазоне от 1 до 2000 мг в день взрослому человеку в случае перорального введения, причем дневную дозу можно разделять на части, соответствующие приему от одного до нескольких раз в день.
Когда фармацевтическую композицию согласно настоящему изобретению применяют на практике для профилактики или лечения, различные дозированные формы вводят перорально или парентерально в зависимости от их назначения, например, для перорального введения предпочтительны такие препараты, как порошки, мелкие гранулы, более крупные гранулы, таблетки, капсулы, сухие сиропы и т.п.
Такие фармацевтические композиции, в зависимости от их рецептур, могут быть получены необязательно путем смешивания соответствующих фармацевтических добавок, таких как эксципиенты, дезинтегранты, связующие, лубриканты и т.п., согласно традиционным фармацевтическим способам и составления в композицию полученных смесей согласно традиционным способам.
Например, порошки можно изготавливать, если желательно, тщательно смешивая активный ингредиент с соответствующими эксципиентами, лубрикантами и т.п. Например, таблетки можно изготавливать традиционными способами, таблетируя активный ингредиент с соответствующими эксципиентами, дезинтегрантами, связующими, лубрикантами; кроме того, если требуется, на них можно наносить подходящее покрытие, предоставляя таблетки с пленочным покрытием, таблетки с сахарным покрытием, таблетки с кишечнорастворимым покрытием и т.п. Например, капсулы можно изготавливать, тщательно смешивая активный ингредиент с соответствующими эксципиентами, лубрикантами и т.п., или изготавливая тонкие гранулы или более крупные гранулы согласно традиционным способам и заполняя ими соответствующие капсулы. Кроме того, в случае лекарственного средства, вводимого перорально, в зависимости от профилактического или терапевтического способа применения, его также можно изготавливать в виде препарата с быстрым или замедленным высвобождением.
Кроме того, производное индолизина согласно настоящему изобретению, представленное формулой (I), или его пролекарство или их фармацевтически приемлемую соль можно также применять в комбинации с любым другим лекарственным средством для лечения гиперурикемии или лекарственным средством для лечения подагры. В качестве лекарственного средства для лечения гиперурикемии можно в виде иллюстрации указать, например, средства, подщелачивающие мочу, такие как гидрокарбонат натрия, цитрат калия, цитрат натрия и т.п. В дополнение, в качестве лекарственного средства для лечения подагры можно в виде иллюстрации указать колхицин или нестероидные противовоспалительные лекарственные средства, такие как индометацин, напроксен, фенбуфен, пранопрофен, оксапрозин, кетопрофен, эторикоксиб, теноксикам и т.п., и стероиды и т.п. При сочетанном применении можно применять не только единую фармацевтическую композицию, содержащую вместе с активным ингредиентом согласно настоящему изобретению еще и другой активный ингредиент, но можно применять и фармацевтические композиции, содержащие каждый активный ингредиент раздельно, как для одновременного введения, так и для введения с различными интервалами дозирования. Кроме того, дозы производного индолизина согласно настоящему изобретению можно уменьшать в зависимости от дозирования другого лекарственного средства, используемого совместно.
Эффект настоящего изобретения
Производные индолизина, представленные формулой (1), согласно настоящему изобретению проявляют превосходную ингибирующую активность в отношении ксантиноксидазы и подавляют продуцирование мочевой кислоты. Предпочтительное соединение согласно настоящему изобретению может также проявлять превосходную ингибирующую активность в отношении URAT1 и повышать выделение мочевой кислоты. Поэтому производные индолизина согласно настоящему изобретению, представленные формулой (1), или их пролекарства или их фармацевтически приемлемые соли могут исключительно сильно подавлять рост уровня мочевой кислоты в сыворотке и могут быть использованы в качестве средства предупреждения или лечения заболеваний, связанных с увеличением уровня мочевой кислоты в сыворотке, таких как гиперурикемия и т.п.
Наилучший способ осуществления настоящего изобретения
Настоящее изобретение дополнительно проиллюстрировано более подробно посредством следующих примеров, справочных примеров и примеров испытаний. Однако настоящее изобретение ими не ограничивается.
Справочный пример 1
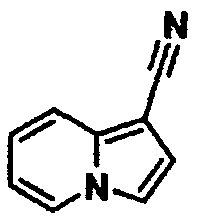
Индолизин-1-карбонитрил
К раствору пиридина (4,0 г) в этилацетате (10 мл) при комнатной температуре добавляли хлоруксусную кислоту (4,7 г) и смесь кипятили с обратным холодильником в течение ночи. После охлаждения реакционной смеси до комнатной температуры осадок твердого вещества отделяли фильтрованием и сушили при пониженном давлении, получая 1-карбоксиметилпиридинийхлорид (5,7 г). К раствору полученного соединения (5,7 г) в толуоле (300 мл) добавляли акрилонитрил (8,7 г), диоксид марганца (16,4 г) и триэтиламин (4,0 г) и перемешивали смесь при 100°C в течение 5 часов. Реакционную смесь фильтровали через слой целита и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат), с получением указанного в заголовке соединения (2,8 г).
Справочные примеры 2-12
Соединения справочных примеров 2-12 получали по методике, аналогичной описанной в справочном примере 1, используя соответствующие исходные вещества.
Справочный пример 13
7-Трифторметилиндолизин-1-карбонитрил
К раствору 4-трифторметилпиридина (2,0 г) в этилацетате (10 мл) при комнатной температуре добавляли бромуксусную кислоту (1,4 г) и смесь кипятили с обратным холодильником в течение ночи. После охлаждения реакционной смеси до комнатной температуры осадок твердого вещества отделяли фильтрованием и сушили при пониженном давлении, получая 1-карбоксиметил-4-трифторметилпиридинийбромид (1,0 г). К раствору полученного соединения (1,0 г) в толуоле (10 мл) добавляли акрилонитрил (0,93 г), диоксид марганца (0,91 г) и триэтиламин (0,42 г) и перемешивали смесь при 100°C в течение 5 часов. Реакционную смесь фильтровали через слой целита и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат) с получением указанного в заголовке соединения (0,31 г).
Справочные примеры 14-16
Соединения справочных примеров 14-16 получали по методике, аналогичной описанной в справочном примере 13, используя соответствующие исходные вещества.
Справочный пример 17
Соединение справочного примера 17 получали по методике, аналогичной описанной в справочном примере 1, используя соответствующее исходное вещество.
Справочный пример 18
7-Гидроксиметилиндолизин-1-карбонитрил
К смешанному раствору этилового эфира 1-цианоиндолизин-7-карбоновой кислоты (0,42 г) в тетрагидрофуране (4,2 мл), этаноле (2,1 мл) и воде (2,1 мл) при комнатной температуре добавляли гидроксид лития (0,25 г) и перемешивали смесь при той же температуре в течение ночи. Реакционную смесь подкисляли, добавляя 2М хлористоводородную кислоту, и осадок твердого вещества отделяли фильтрованием. Полученное твердое вещество промывали водой и н-гексаном, получая 1-цианоиндолизин-7-карбоновую кислоту (0,29 г).
К раствору 1-цианоиндолизин-7-карбоновой кислоты (0,20 г) в тетрагидрофуране (4,0 мл) при охлаждении льдом добавляли 3-метилбутирилхлорид (0,16 г) и 4-метилморфолин (0,13 г) и перемешивали смесь при комнатной температуре в течение 1 часа. Нерастворимые вещества удаляли из реакционной смеси фильтрованием. К фильтрату добавляли этанол (4,0 мл), при охлаждении льдом добавляли боргидрид натрия (0,20 г) и перемешивали смесь при комнатной температуре в течение ночи. К реакционной смеси добавляли хлористоводородную кислоту (2М, 5,0 мл) и полученную в результате смесь экстрагировали этилацетатом. Органический слой сушили над сульфатом магния и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (элюент: этилацетат/н-гексан, от 30/70 до 100/0) с получением указанного в заголовке соединения (0,050 г).
Справочные примеры 19-31
Соединения справочных примеров 19-31 получали по методике, аналогичной описанной в справочном примере 13, используя соответствующие исходные вещества.
Справочный пример 32
7-Метоксииндолизин-1-карбонитрил
К раствору 4-метоксипиридина (3,0 г) в этилацетате (30 мл) добавляли метилбромацетат (4,6 г) и смесь кипятили с обратным холодильником в течение ночи. После охлаждения до комнатной температуры осадок твердого вещества отделяли фильтрованием и сушили при пониженном давлении, получая 4-метокси-1-метоксикарбонилметилпиридинийбромид (7,0 г). К раствору полученного соединения (6,0 г) в толуоле (50 мл) добавляли акрилонитрил (6,1 г), диоксид марганца (6,0 г) и триэтиламин (2,8 г) и перемешивали смесь при 100°C в течение 5 часов. Реакционную смесь фильтровали через слой целита и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат), получая метиловый эфир 1-циано-7-метоксииндолизин-3-карбоновой кислоты (1,0 г). К смешанному раствору полученного соединения (1,0 г) в тетрагидрофуране (20 мл), этанола (7 мл) и воды (7 мл) добавляли моногидрат гидроксида лития (0,27 г) и перемешивали смесь при комнатной температуре в течение ночи. К реакционной смеси добавляли 1М хлористоводородную кислоту и воду, осадок твердого вещества отделяли фильтрованием, промывали водой и н-гексаном и сушили при пониженном давлении при 50°C, получая 1-циано-7-метоксииндолизин-3-карбоновую кислоту (0,80 г). К суспензии полученного соединения (0,80 г) и хинолина (8 мл) добавляли медь (0,05 г) и перемешивали смесь при 220°C в течение 30 минут. После охлаждения до комнатной температуры к реакционной смеси добавляли 1М хлористоводородную кислоту и полученную в результате смесь экстрагировали этилацетатом. Органический слой промывали 1М хлористоводородной кислотой, водой и насыщенным раствором соли, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат) с получением указанного в заголовке соединения (0,37 г).
Справочный пример 33
7-Диметиламиноиндолизин-1-карбонитрил
Соединение справочного примера 33 получали по методике, аналогичной описанной в справочном примере 32, используя соответствующее исходное вещество.
Справочный пример 34
7-Метокси-6-метилиндолизин-1-карбонитрил
Соединение справочного примера 34 получали по методике, аналогичной описанной в справочном примере 32, используя соответствующее исходное вещество.
Справочный пример 35
Метиловый эфир 4-(1-циано-7-изопропокси-8-трифторметилиндолизин-3-ил)бензойной кислоты
К раствору гидрохлоридной соли 4-хлор-3-трифторметилпиридина (2,0 г) в тетрагидрофуране (5 мл) добавляли гидрид натрия (60%, 2,8 г) и пропан-2-ол (2,8 г) и перемешивали смесь при 50°C в течение 2 часов. После охлаждения до комнатной температуры к реакционной смеси добавляли воду и полученную в результате смесь экстрагировали диэтиловым эфиром. Органический слой сушили над сульфатом магния и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат), получая 4-изопропокси-3-трифторметилпиридин (1,5 г). К раствору полученного соединения (1,5 г) в этилацетате (20 мл) при комнатной температуре добавляли метиловый эфир 4-бромметилбензойной кислоты (2,0 г) и смесь кипятили с обратным холодильником в течение ночи. После охлаждения до комнатной температуры удаляли растворитель, получая 4-изопропокси-1-(4-метоксикарбонилбензил)-3-трифторметилпиридинийбромид (2,1 г). К раствору полученного соединения (2,1 г) в диметоксиэтане (10 мл) добавляли акрилонитрил (1,3 г), диоксид марганца (2,1 г) и триэтиламин (1,5 г) и перемешивали смесь при 80°C в течение 6 часов. Реакционную смесь фильтровали через слой целита и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат) с получением указанного в заголовке соединения (0,04 г).
Справочный пример 36
1-Бром-2-фториндолизин
К раствору 1-этоксикарбонилметилпиридинийбромида (4,8 г) в N,N-диметилформамиде (50 мл) добавляли 2,2-дифторвиниловый эфир толуол-4-сульфоновой кислоты (4,6 г), карбонат калия (4,0 г) и триэтиламин (3,0 г) и перемешивали смесь при 70°C в течение ночи. После охлаждения до комнатной температуры к реакционной смеси добавляли воду и полученную в результате смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным раствором соли, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат), получая этиловый эфир 2-фториндолизин-3-карбоновой кислоты (1,9 г). К раствору полученного соединения (1,9 г) в дихлорметане (30 мл) добавляли N-бромсукцинимид (1,8 г) и перемешивали смесь при комнатной температуре в течение 2 часов. К реакционной смеси добавляли 1М водный раствор тиосульфата натрия, и полученную в результате смесь экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным раствором соли, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат), получая этиловый эфир 1-бром-2-фториндолизин-3-карбоновой кислоты (1,3 г). К смешанному раствору полученного соединения (1,3 г) в тетрагидрофуране (20 мл), этаноле (7 мл) и воде (7 мл) добавляли моногидрат гидроксида лития (0,29 г) и перемешивали смесь при комнатной температуре в течение ночи. К реакционной смеси добавляли 1М хлористоводородную кислоту и воду. Осадок твердого вещества отделяли фильтрованием, промывали водой и н-гексаном и сушили при пониженном давлении при 50°C, получая 1-бром-2-фториндолизин-3-карбоновую кислоту (0,76 г). К суспензии полученного соединения (0,56 г) и хинолина (5 мл) добавляли медь (0,03 г) и перемешивали смесь при 220°C в течение 30 минут. После охлаждения до комнатной температуры к реакционной смеси добавляли 1М хлористоводородную кислоту и полученную в результате смесь экстрагировали этилацетатом. Органический слой промывали 1М хлористоводородной кислотой, водой и насыщенным раствором соли, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат) с получением указанного в заголовке соединения (0,47 г).
Справочный пример 37
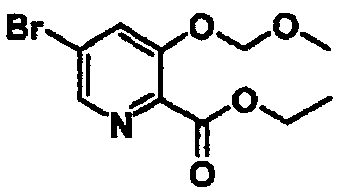
Этиловый эфир 5-бром-3-метоксиметоксипиридин-2-карбоновой кислоты
К раствору 5-бром-3-гидроксипиридин-2-карбоновой кислоты (2,18 г) в этаноле (20 мл) при охлаждении льдом добавляли тионилхлорид (4,76 г) и перемешивали смесь при 80°C в течение 24 часов. После охлаждения до комнатной температуры растворитель удаляли. К раствору полученного соединения (2,05 г) и диизопропилэтиламина (5,38 г) в дихлорметане (17 мл) при охлаждении льдом по каплям добавляли хлорметоксиметан (2,01 г) и перемешивали смесь при комнатной температуре в течение 4 часов. К реакционной смеси добавляли хлористоводородную кислоту и воду и полученную в результате смесь экстрагировали этилацетатом. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат) с получением указанного в заголовке соединения (2,26 г).
Пример 1
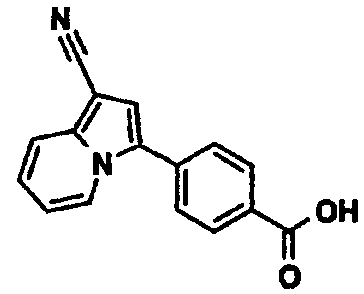
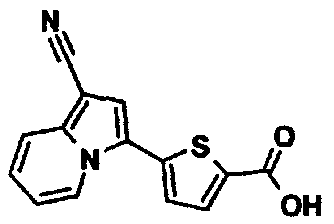
4-(1-Цианоиндолизин-3-ил)бензойная кислота
К раствору индолизин-1-карбонитрила (0,80 г) в N-метилпирролидоне (16 мл) добавляли метил-4-йодбензоат (1,60 г), дихлорбис(трифенилфосфин)палладий(II) (0,20 г), ацетат калия (1,10 г) и воду (0,2 мл) и перемешивали смесь при 100°C в течение 3 часов. После охлаждения до комнатной температуры к реакционной смеси добавляли воду и полученную в результате смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным раствором соли, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат, от 100/0 до 34/66), получая метил-4-(1-цианоиндолизин-3-ил)бензоат (0,45 г). К смешанному раствору полученного соединения (0,45 г) в тетрагидрофуране (10 мл), этаноле (5 мл) и воде (5 мл) добавляли моногидрат гидроксида лития (0,20 г) и перемешивали смесь при комнатной температуре в течение ночи. К реакционной смеси добавляли 1М хлористоводородную кислоту и воду, осадок твердого вещества отделяли фильтрованием, промывали водой и н-гексаном и сушили при пониженном давлении при 50°C с получением указанного в заголовке соединения (0,42 г).
Примеры 2-16
Соединения примеров 2-16 получали по методике, аналогичной описанной в примере 1, используя соответствующие исходные вещества.
Пример 17
4-(1-Цианоиндолизин-3-ил)-2-гидроксибензойная кислота
К раствору индолизин-1-карбонитрила (0,20 г) в N-метилпирролидоне (5 мл) добавляли метил-4-йод-2-метоксиметоксибензоат (0,5 г), дихлорбис(трифенилфосфин)палладий(II) (0,05 г), ацетат калия (0,28 г) и воду (0,05 мл) и перемешивали смесь при 100°C в течение 1 часа. После охлаждения до комнатной температуры к реакционной смеси добавляли воду и полученную в результате смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным раствором соли, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат, от 100/0 до 0/100), получая метил-4-(1-цианоиндолизин-3-ил)-2-метоксиметоксибензоат (0,17 г). К смешанному раствору полученного соединения (0,17 г) в тетрагидрофуране (4,5 мл), этаноле (1,5 мл) и воде (1,5 мл) добавляли моногидрат гидроксида лития (0,10 г) и перемешивали смесь при комнатной температуре в течение ночи. К реакционной смеси добавляли 2М хлористоводородную кислоту (1,5 мл) и перемешивали смесь при 50°C в течение ночи. После охлаждения до комнатной температуры к реакционной смеси добавляли воду. Осадок твердого вещества отделяли фильтрованием, промывали водой и н-гексаном и сушили при пониженном давлении при 50°C с получением указанного в заголовке соединения (0,11 г).
Примеры 18-27
Соединения примеров 18-27 получали по методике, аналогичной описанной в примере 17, используя соответствующие исходные вещества.
Примеры 28, 29
Соединения примеров 28 и 29 получали по методике, аналогичной описанной в примере 1, используя соответствующие исходные вещества.
Пример 30
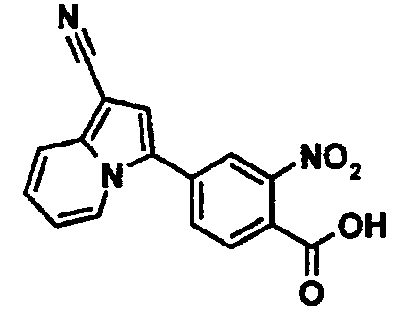
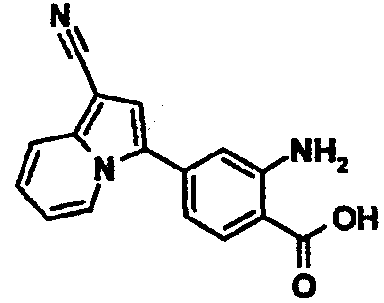
2-Амино-4-(1-цианоиндолизин-3-ил)бензойная кислота
Этил-4-(1-цианоиндолизин-3-ил)-2-нитробензоат (0,13 г) получали по методике, аналогичной описанной в примере 1, используя соответствующее исходное вещество. К раствору полученного соединения (0,13 г) в этилацетате (10 мл) добавляли палладий-углеродный порошок (0,02 г) и перемешивали смесь в атмосфере водорода при комнатной температуре в течение ночи. Нерастворимые вещества удаляли из смеси фильтрованием и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат, от 100/0 до 0/100), получая этил-2-амино-4-(1-цианоиндолизин-3-ил)бензоат (0,02 г). К смешанному раствору полученного соединения (0,02 г) в тетрагидрофуране (0,6 мл), этаноле (0,2 мл) и воде (0,2 мл) добавляли моногидрат гидроксида лития (0,01 г) и перемешивали смесь при комнатной температуре в течение ночи. К реакционной смеси добавляли 1М хлористоводородную кислоту и воду, осадок твердого вещества отделяли фильтрованием, промывали водой и н-гексаном и сушили при пониженном давлении при 50°C с получением указанного в заголовке соединения (0,01 г).
Пример 31
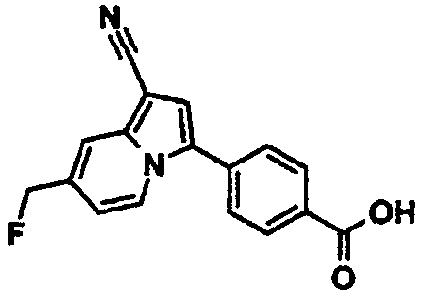
4-(1-Циано-7-фторметилиндолизин-3-ил)бензойная кислота
К раствору 7-гидроксиметилиндолизин-1-карбонитрила (0,05 г) в N-метилпирролидоне (2,0 мл) добавляли метил-4-бромбензоат (0,031 г), дихлорбис(трифенилфосфин)палладий (0,005 г), воду (0,005 г) и ацетат калия (0,029 г) и перемешивали смесь при 100°C в течение 2 часов. После охлаждения до комнатной температуры к смеси добавляли ацетон, этилацетат и воду и разделяли два слоя. Органический слой промывали водой и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (элюент: этилацетат/н-гексан, от 10/90 до 80/20). Полученное твердое вещество промывали диэтиловым эфиром, получая метил-4-(1-циано-7-гидроксиметилиндолизин-3-ил)бензоат (0,026 г). К суспензии полученного соединения (0,025 г) в дихлорметане (2,0 мл) при охлаждении льдом добавляли трифторид N,N-диэтиламиносеры (0,036 г) и перемешивали смесь при той же температуре в течение 1 часа. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и полученную в результате смесь экстрагировали диэтиловым эфиром. Органический слой промывали водой, сушили над сульфатом магния и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (элюент: этилацетат/н-гексан), получая метил-4-(1-циано-7-фторметилиндолизин-3-ил)бензоат (0,021 г). К смешанному раствору полученного соединения (0,021 г) в тетрагидрофуране (1,0 мл), этаноле (0,5 мл) и воде (0,5 мл) при комнатной температуре добавляли гидроксид лития (0,008 г) и перемешивали смесь при той же температуре в течение ночи. Реакционную смесь подкисляли 2М хлористоводородной кислотой и полученную в результате смесь экстрагировали этилацетатом. Органический слой промывали водой, сушили над сульфатом магния и концентрировали с получением указанного в заголовке соединения (0,005 г).
Пример 32
Соединение примера 32 получали по методике, аналогичной описанной в примере 1, используя соответствующее исходное вещество.
Примеры 33-34
Соединения примеров 33-34 получали по методике, аналогичной описанной в примере 1, используя соответствующие исходные вещества.
Пример 35
Соединение примера 35 получали по методике, аналогичной описанной в примере 1, используя метил-4-бром-2-метилбензоат вместо метил-4-йодбензоата.
Примеры 36-46
Соединения примеров 36-46 получали по методике, аналогичной описанной в примере 1, используя соответствующие исходные вещества.
Пример 47
4-(1-Циано-7-изопропокси-8-трифторметилиндолизин-3-ил)бензойная кислота
К смешанному раствору метил-4-(1-циано-7-изопропокси-8-трифторметилиндолизин-3-ил)бензоата (0,04 г) в тетрагидрофуране (2 мл), этаноле (1 мл) и воде (1 мл) добавляли моногидрат гидроксида лития (0,01 г) и перемешивали смесь при комнатной температуре в течение ночи. К реакционной смеси добавляли 1М хлористоводородную кислоту и воду, осадок твердого вещества отделяли фильтрованием, промывали водой и н-гексаном и сушили при пониженном давлении при 50°C с получением указанного в заголовке соединения (0,02 г).
Примеры 48-60
Соединения примеров 48-60 получали по методике, аналогичной описанной в примере 17, используя соответствующие исходные вещества.
Пример 61
4-(1-Циано-2-фториндолизин-3-ил)бензойная кислота
К раствору 1-бром-2-фториндолизина (0,15 г) в N-метилпирролидоне (2,5 мл) добавляли метил-4-бромбензоат (0,18 г), дихлорбис(трифенилфосфин)палладий(II) (0,02 г), ацетат калия (0,13 г) и воду (0,03 мл) и перемешивали смесь при 100°C в течение 3 часов. После охлаждения до комнатной температуры к реакционной смеси добавляли воду и полученную в результате смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным раствором соли, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат), получая метил-4-(1-бром-2-фториндолизин-3-ил)бензоат (0,17 г). К раствору полученного соединения (0,17 г) в N-метилпирролидоне (2 мл) добавляли цианид цинка (0,23 г) и тетракис(трифенилфосфин)палладий (0,21 г) и перемешивали смесь при 150°C в течение 1 часа, используя микроволновый реактор. К реакционной смеси добавляли воду, и полученную в результате смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным раствором соли, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток промывали диэтиловым эфиром, получая метил-4-(1-циано-2-фториндолизин-3-ил)бензоат (0,10 г). К смешанному раствору полученного соединения (0,10 г) в тетрагидрофуране (4,0 мл), этаноле (1,5 мл) и воде (1,5 мл) добавляли моногидрат гидроксида лития (0,07 г) и перемешивали смесь при комнатной температуре в течение ночи. К реакционной смеси добавляли 1М хлористоводородную кислоту и воду, осадок твердого вещества отделяли фильтрованием, промывали водой и метанолом и сушили при пониженном давлении при 50°C с получением указанного в заголовке соединения (0,07 г).
Пример 62
4-(1-Циано-2-фториндолизин-3-ил)-2-гидроксибензойная кислота
К раствору 1-бром-2-фториндолизина (0,30 г) в N-метилпирролидоне (6,0 мл) добавляли метил-4-йод-2-метоксиметоксибензоат (0,54 г), дихлорбис(трифенилфосфин)палладий(II) (0,05 г), ацетат калия (0,27 г) и воду (0,05 мл) и перемешивали смесь при 100°C в течение 5 часов. После охлаждения до комнатной температуры к реакционной смеси добавляли воду, и полученную в результате смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным раствором соли, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат), получая метил-4-(1-бром-2-фториндолизин-3-ил)-2-метоксиметоксибензоат (0,39 г). К раствору полученного соединения (0,39 г) в N-метилпирролидоне (3 мл) добавляли цианид цинка (0,44 г) и тетракис(трифенилфосфин)палладий (0,22 г) и перемешивали смесь при 150°C в течение 1 часа, используя микроволновый реактор. К реакционной смеси добавляли воду и полученную в результате смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным раствором соли, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток промывали диэтиловым эфиром, получая метил-4-(1-циано-2-фториндолизин-3-ил)-2-метоксиметоксибензоат (0,07 г). К смешанному раствору полученного соединения (0,07 г) в тетрагидрофуране (3,0 мл), этаноле (1,0 мл) и воде (1,0 мл) добавляли моногидрат гидроксида лития (0,04 г) и перемешивали смесь при комнатной температуре в течение ночи. К реакционной смеси добавляли 2М хлористоводородную кислоту (1,0 мл) и перемешивали смесь при 50°C в течение ночи. После охлаждения до комнатной температуры к реакционной смеси добавляли воду. Осадок твердого вещества отделяли фильтрованием, промывали водой и метанолом и сушили при пониженном давлении при 50°C с получением указанного в заголовке соединения (0,05 г).
Пример 63
4-(1-Циано-7-фторметилиндолизин-3-ил)-2-гидроксибензойная кислота
Соединение примера 63 получали по методике, аналогичной описанной в примере 31, используя соответствующее исходное вещество.
Пример 64
Соединение примера 64 получали по методике, аналогичной описанной в примере 1, используя соответствующее исходное вещество.
Примеры 65-67
Соединения примеров 65-67 получали по методике, аналогичной описанной в примере 17, используя этиловый эфир 5-бром-3-метоксиметоксипиридин-2-карбоновой кислоты вместо 4-йод-2-метоксиметоксибензойной кислоты.
Примеры 68-71
Соединения примеров 68-71 получали по методике, аналогичной описанной в примере 1, используя соответствующие исходные вещества.
Примеры 72-73
Соединения примеров 72-73 получали по методике, аналогичной описанной в примере 1, используя соответствующие исходные вещества.
В таблицах 1-16 показаны химические структуры и данные 1H-ЯМР указанных выше соединений справочных примеров 1-37 и примеров 1-73.
Сокращения в таблицах «№ справ. пр.», «№ пр.», «стр.» и «раств.» означают номер справочного примера, номер примера, химическую структуру и растворитель, в котором получены данные 1H-ЯМР, соответственно.
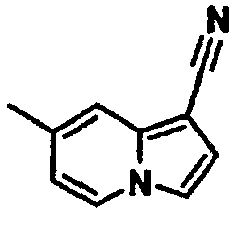
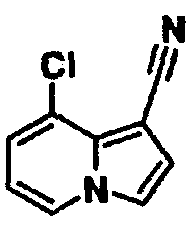
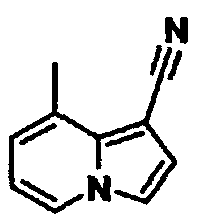
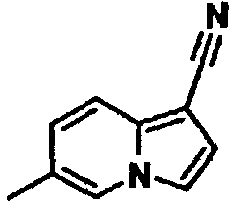
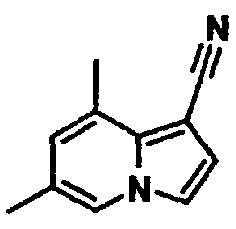
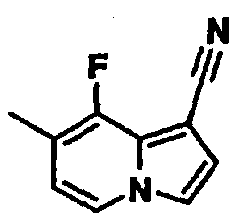
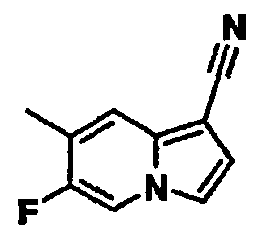
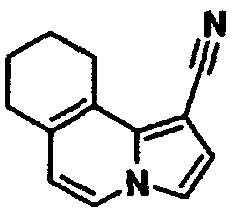
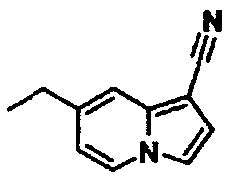
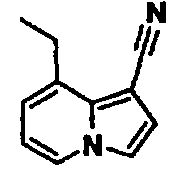
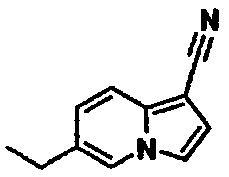
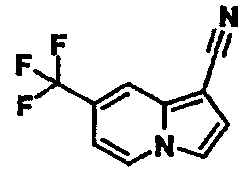
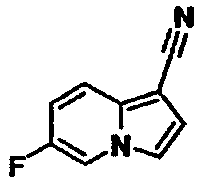
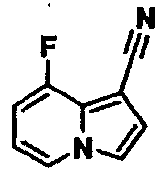
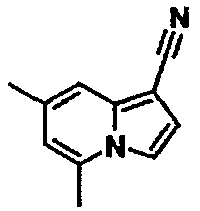
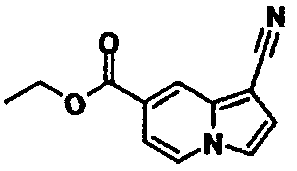
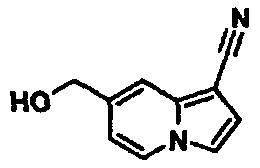
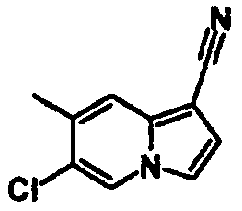
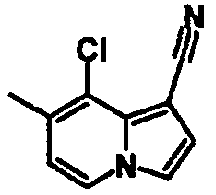
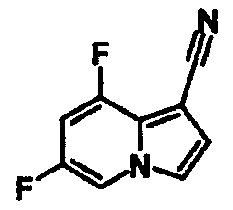
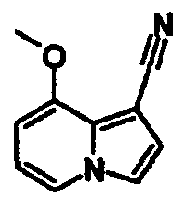
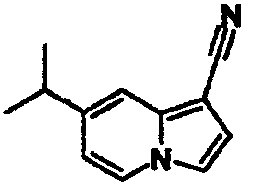
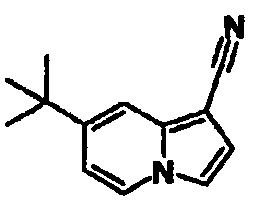
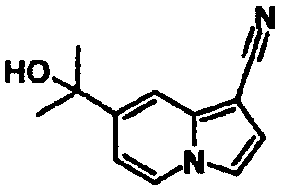
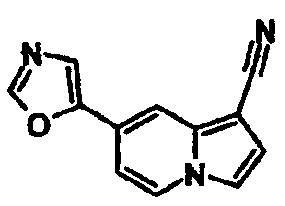
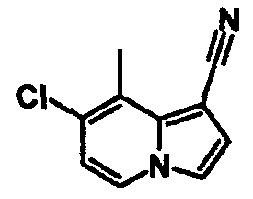
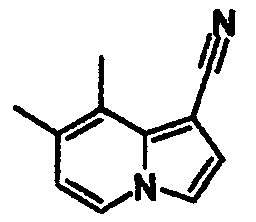
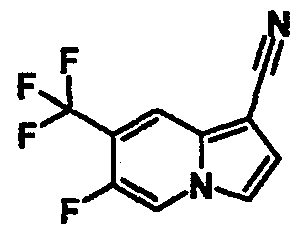
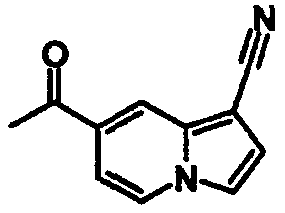
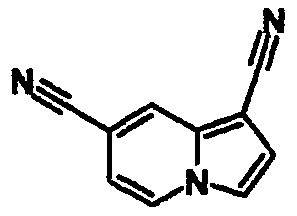
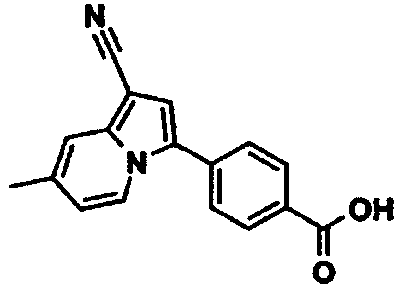
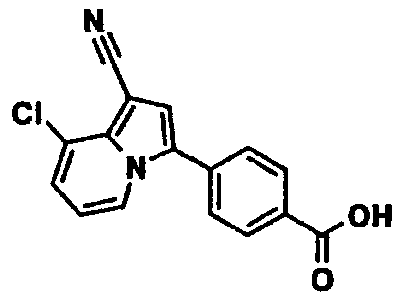
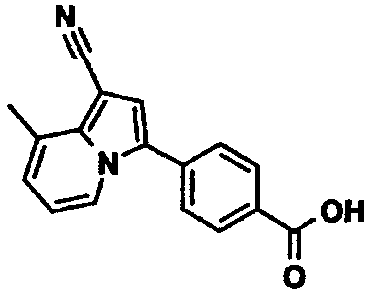
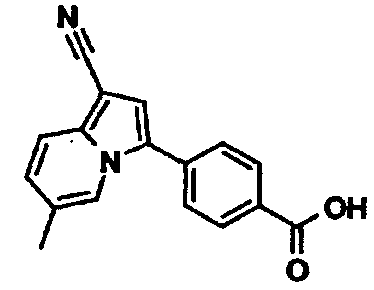
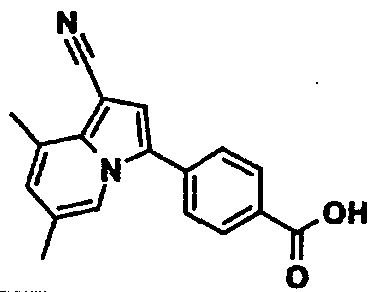
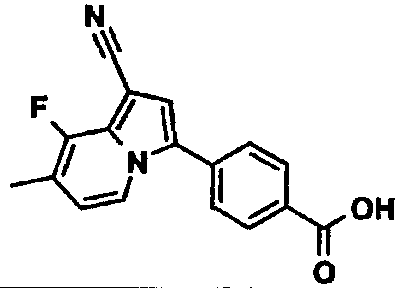
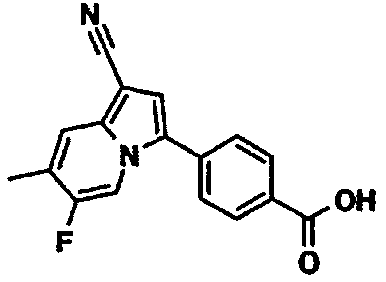
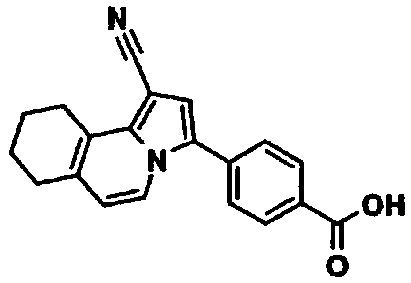
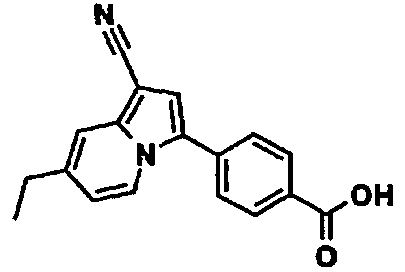
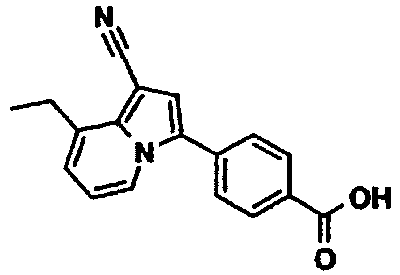
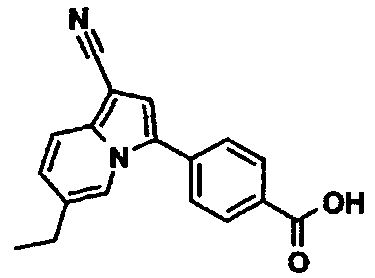
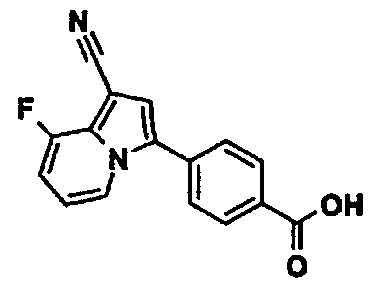
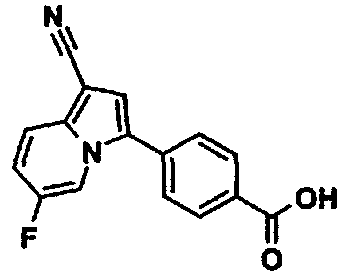
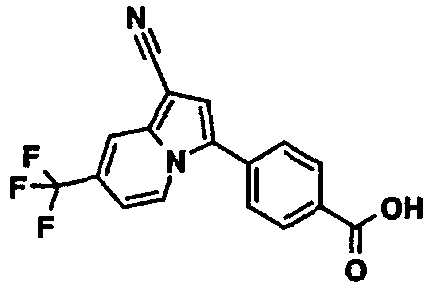
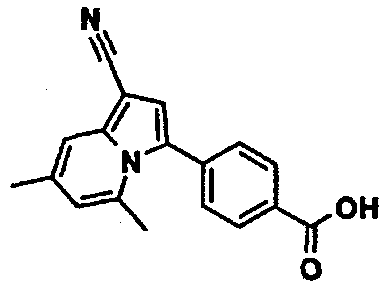
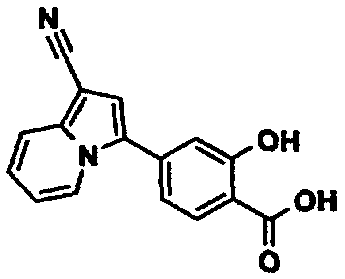
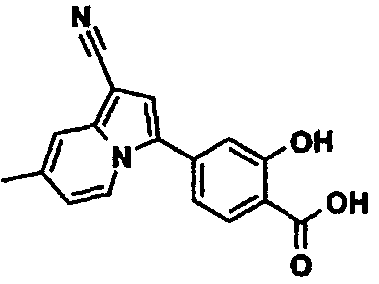
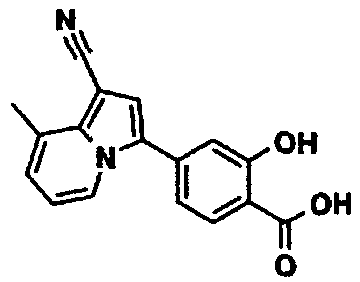
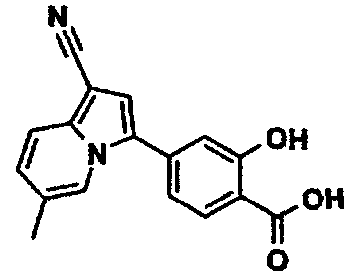
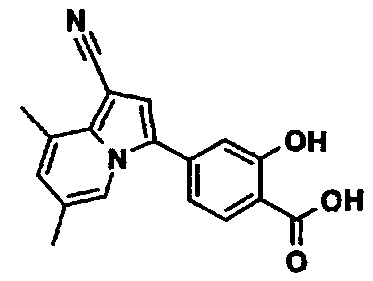
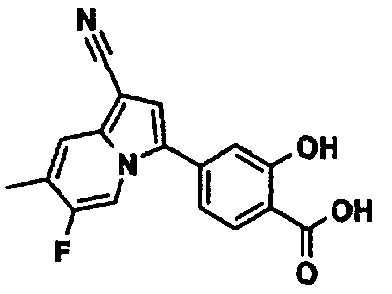
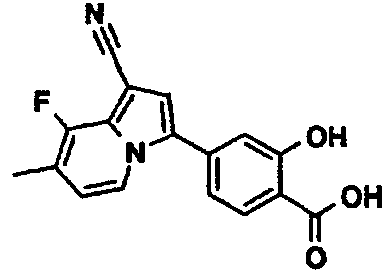
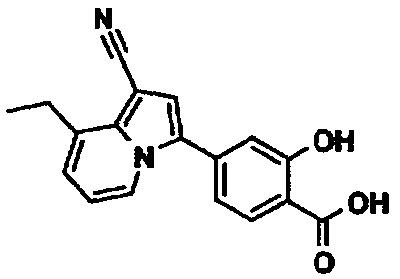
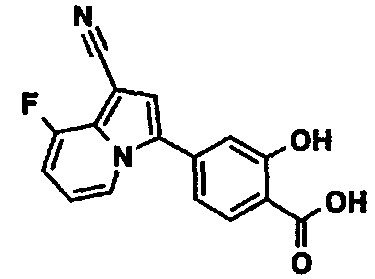
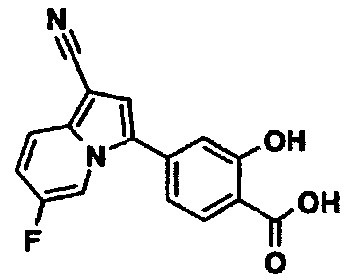
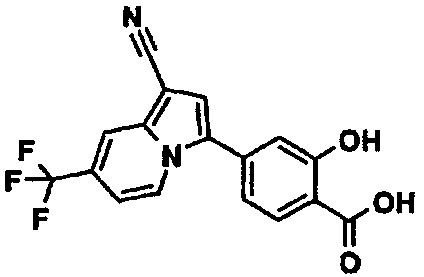
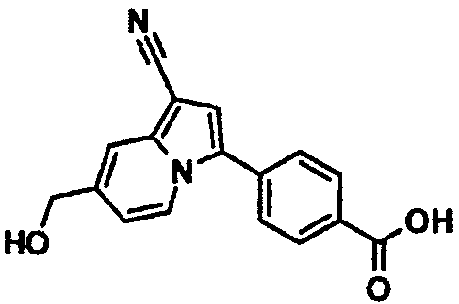
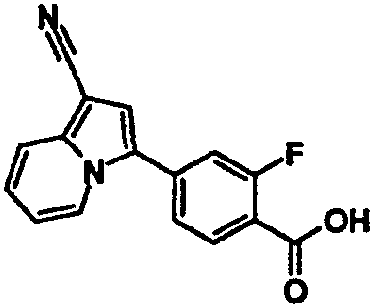
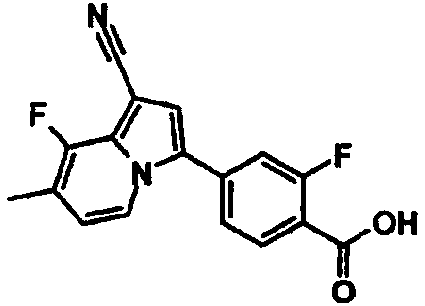
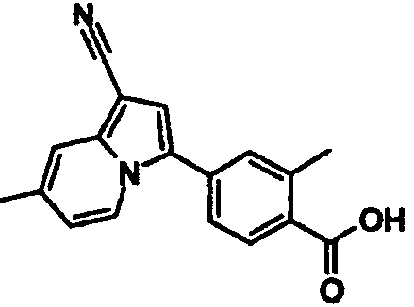
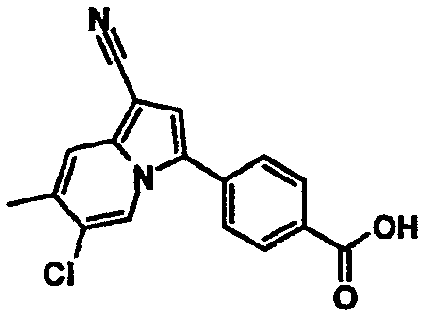
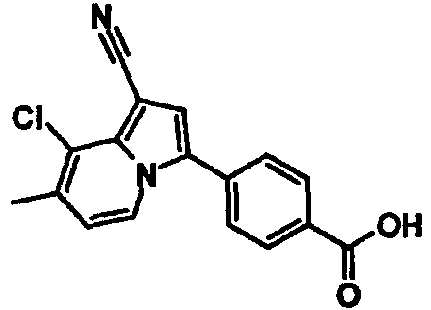
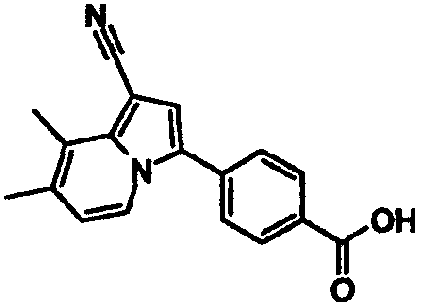
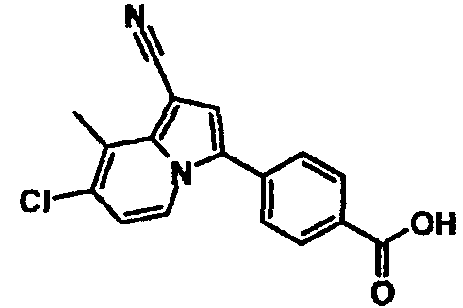
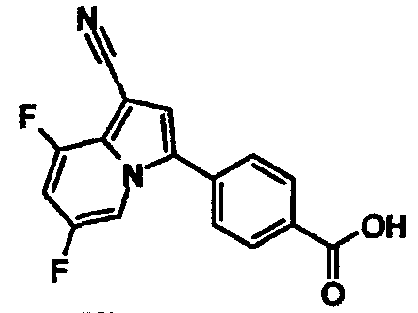
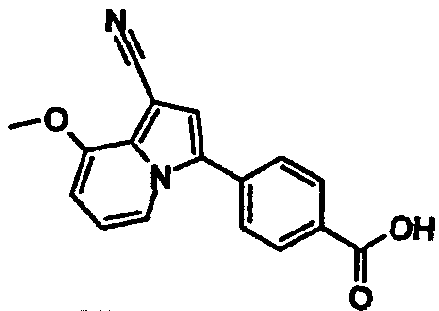
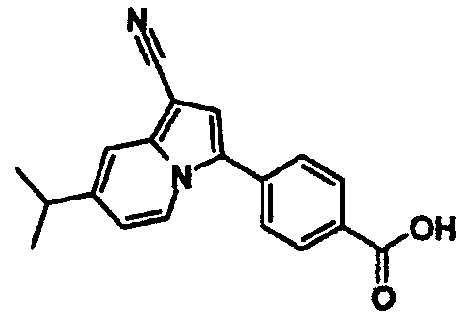
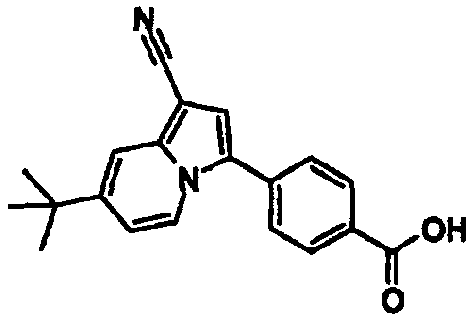
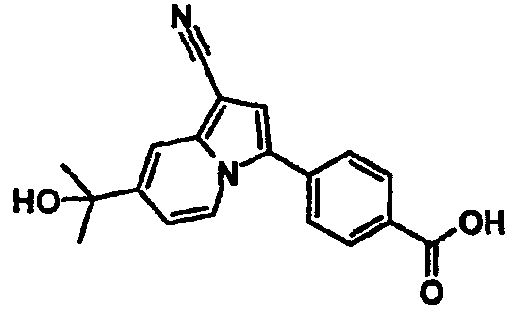
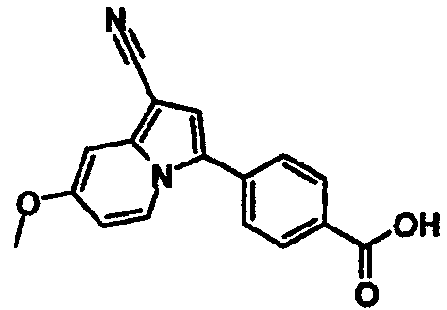
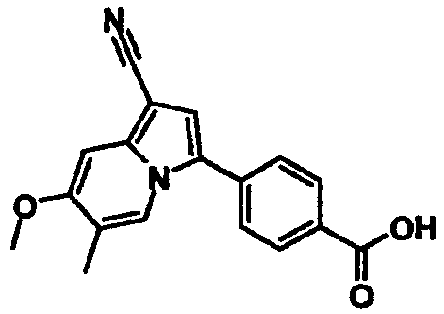
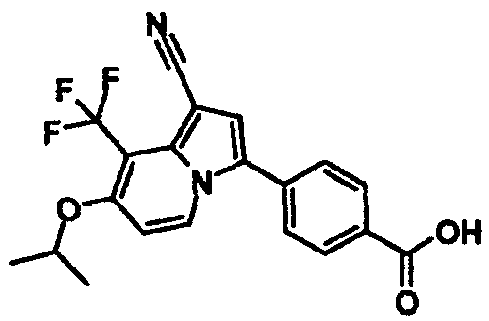
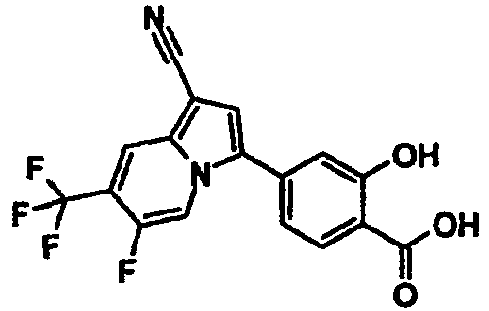
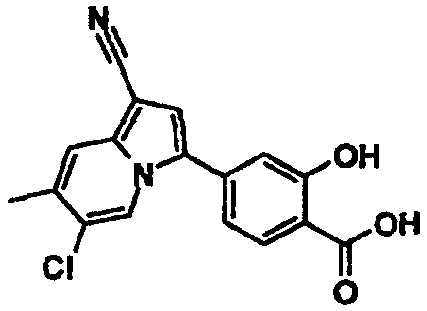
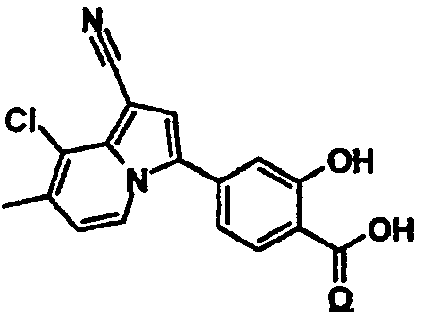
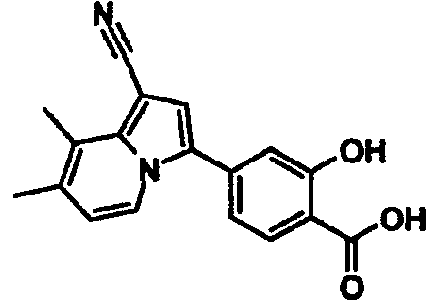
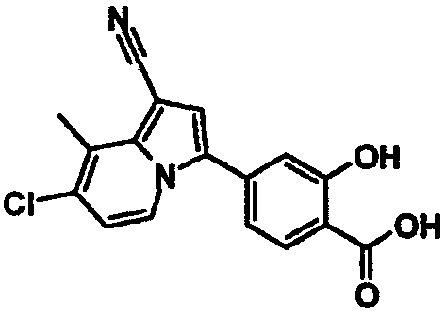
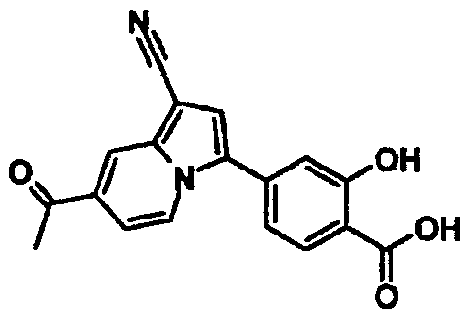
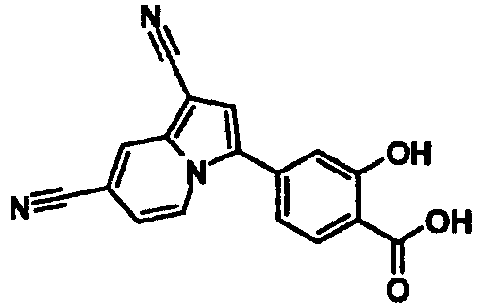
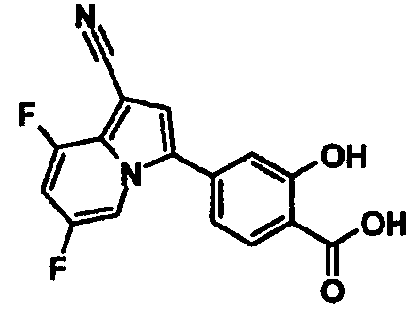
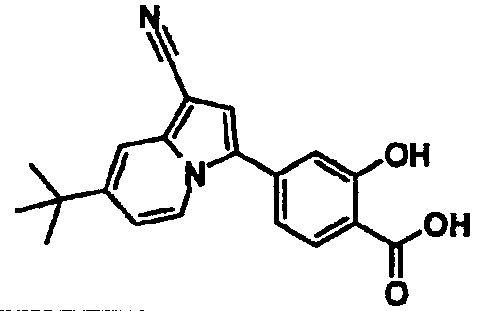
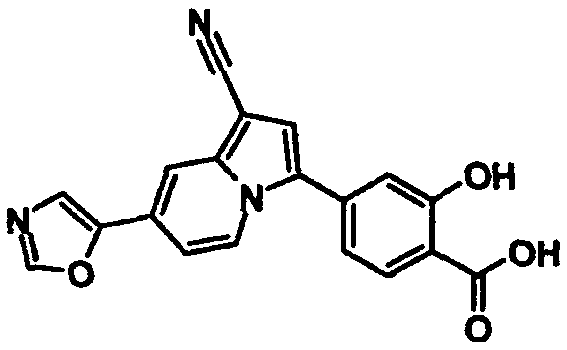
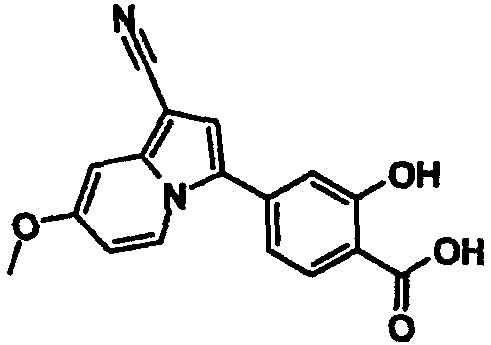
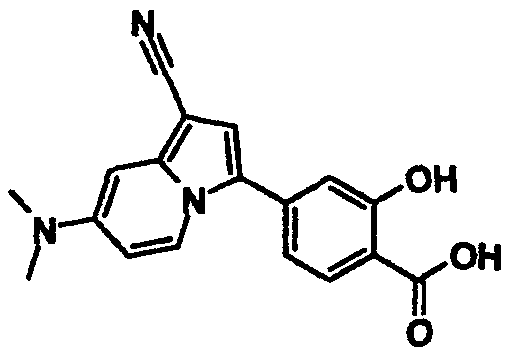
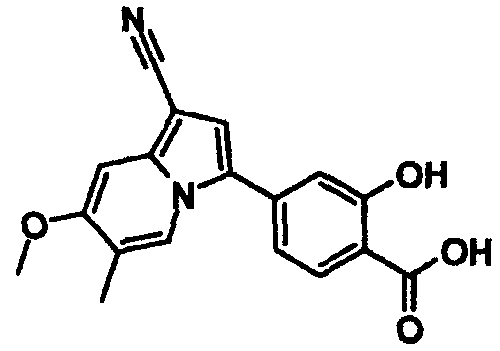
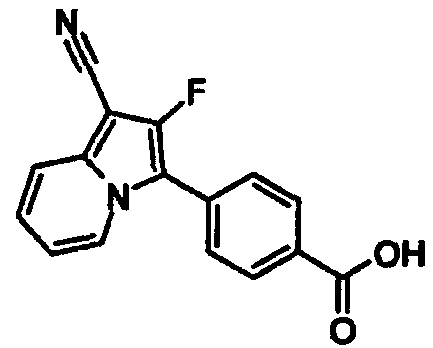
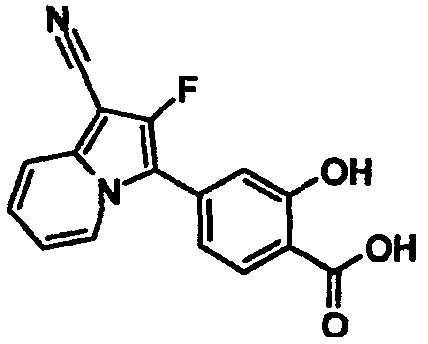
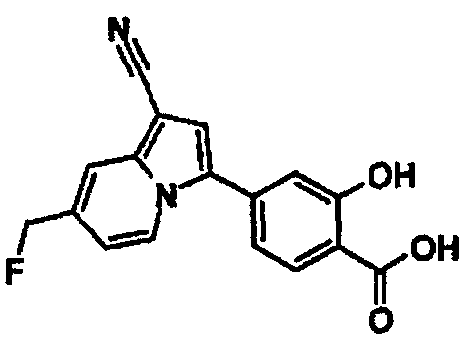

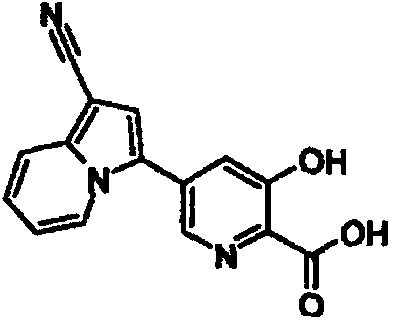
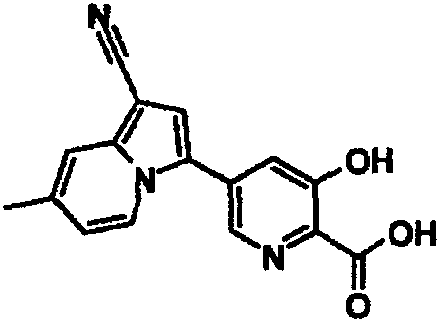
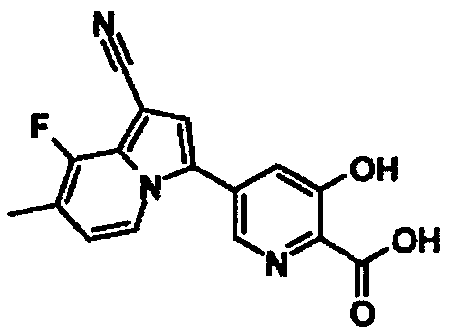
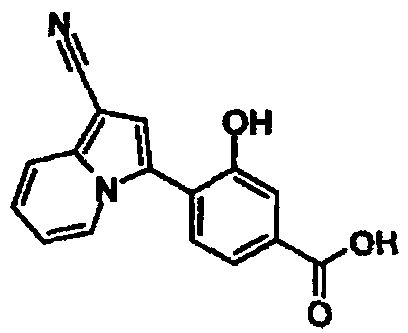
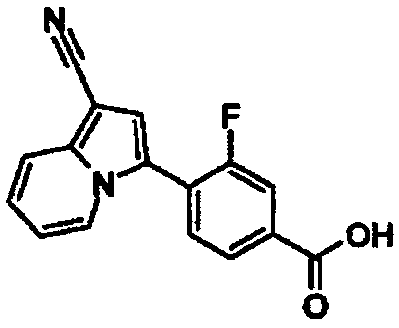
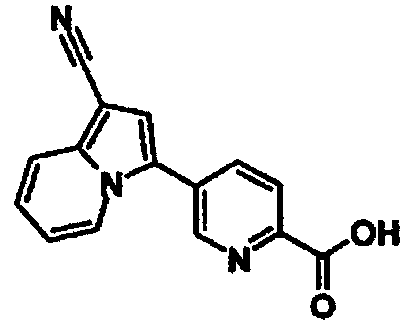
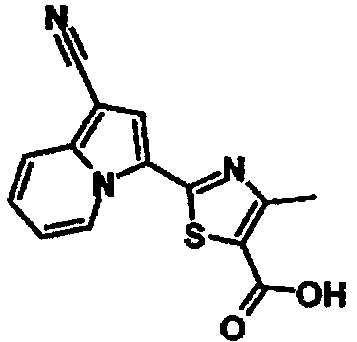
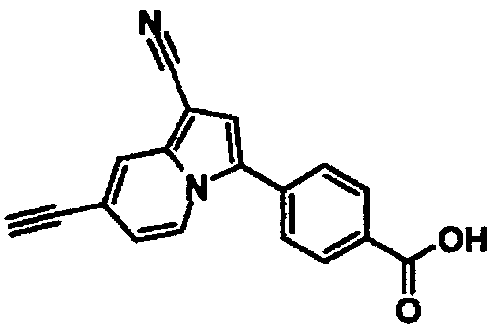
Пример испытаний 1
Ингибирующая активность в отношении ксантиноксидазы
(1) Подготовка тестируемых соединений
Тестируемые соединения растворяли в ДМСО (Wako pure chemical) в концентрации 40 мМ и затем разводили до необходимых концентраций забуференным фосфатом солевым раствором (PBS).
(2) Способ измерения
Ксантиноксидазу (из коровьего молока, Sigma) готовили с забуференным фосфатом солевым раствором (PBS) при концентрации 0,02 единиц/миллилитр и затем полученный раствор вносили в лунки 96-луночного планшета (по 50 мкл/лунка). В дополнение, в каждую лунку добавляли по 50 мкл раствора тестируемого соединения в PBS. Затем в каждую лунку добавляли по 100 мкл 200 мкМ раствора ксантина (Wako pure chemical), приготовленного с PBS, и в этой смеси в течение 10 минут при комнатной температуре проводили реакцию. Измеряли поглощение при 290 нм на микропланшет-ридере SpectraMax Plus 384 (Molecular device). Поглощение в условиях отсутствия ксантина принимали за 0%, контроль без тестируемого соединения принимали за 100%. Рассчитывали концентрацию 50%-ного ингибирования (IC50) (таблица 17).
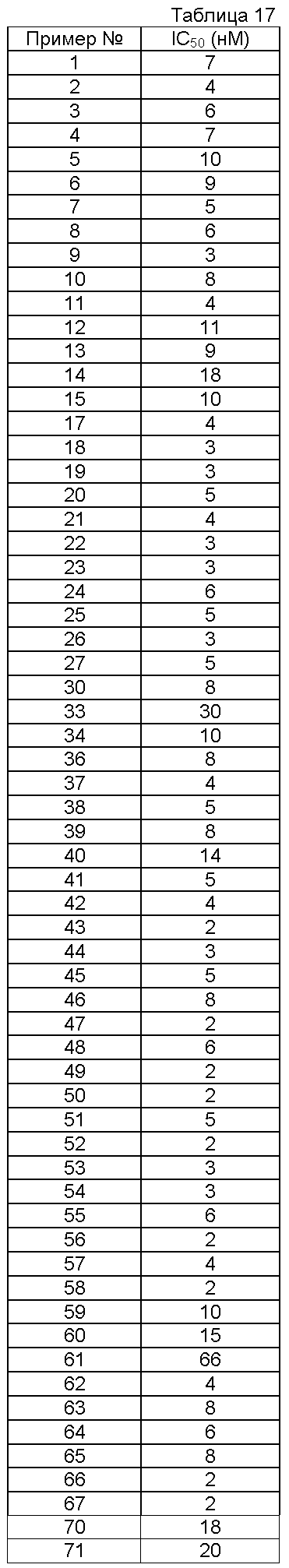
Пример испытаний 2
Ингибирующая активность в отношении транспорта мочевой кислоты, определенная с человеческими клетками, экспрессирующими URAT1
(1) Получение человеческих клеток, временно экспрессирующих URAT1
Человеческую кДНК полной длины для URAT1 (NCBI код доступа No. NM_144585) субклонировали в вектор экспрессии pcDNA3,1 (Invitrogen). Вектор экспрессии человеческого URAT1 трансфицировали в клетки COS7 (RlKEN CELL BANK RCB0539), используя Lipofectamine 2000 (Invitrogen). Клетки COS7 высевали в 24-луночные планшеты, покрытые коллагеном (Beckton Dickinson), в концентрации 3×105 клеток/лунка и культивировали в культуральной среде D-MEM, содержащей 10% фетальную телячью сыворотку (Sanko Junyaku), в течение 2 часов при 37°C в атмосфере с 5% CO2. В лунку добавляли по 2 мкл препарата Lipofectamine 2000, разведенного в 50 мкл OPTI-MEM (Invitrogen), и планшетам давали возможность стоять при комнатной температуре в течение 7 минут (далее в настоящем описании этот состав называется Lipo2000-OPTI). В лунку добавляли 0,8 мкг вектора, экспрессирующего человеческий URAT1, растворенного в 50 мл OPTI-MEM (Invitrogen), и полученный раствор осторожно объединяли с Lipo2000-OPTI. После стояния при комнатной температуре в течение 25 минут полученную смесь добавляли к клеткам COS7 в количестве 100 мкл/лунка. Затем клетки COS7 культивировали в течение 2 дней при 37°C в атмосфере с 5% СО2 и использовали для измерения ингибирующей активности в отношении поглощения.
(2) Подготовка тестируемых соединений
Тестируемые соединения растворяли в ДМСО (Wako pure chemical) в концентрации 10 мМ и затем разводили буфером предварительной обработки (125 мМ глюконата натрия, 4,8 мМ глюконата калия, 1,2 мМ дигидрофосфата калия, 1,2 мМ сульфата магния, 1,3 мМ глюконата кальция, 5,6 мМ глюкозы, 25 мМ Hepes, pH 7,4) до концентрации, вдвое превышавшей желаемую конечную концентрацию. Буфер предварительной обработки без тестируемых соединений использовали в качестве контроля. Затем к тестируемым соединениям и контролю добавляли равный объем буфера предварительной обработки, содержавшего мочевую кислоту, меченную 14С (American Radiolabeled Chemicals, Inc.), в результате получая рабочий буфер, содержавший 20 мкМ мочевой кислоты.
(3) Способ измерения
Все испытания проводили при 37°C на нагревательной плитке. Буфер предварительной обработки и рабочий буфер инкубировали при 37°С и затем использовали в исследованиях. С планшетов удаляли инкубационную среду, добавляли 700 мкл буфера предварительной обработки и проводили предварительную инкубацию клеток в течение 10 минут. После повторения этой стадии удаляли буфер предварительной обработки и добавляли рабочий буфер (400 мкл на лунку). Реакцию поглощения проводили в течение 5 минут. После остановки реакции быстро удаляли рабочий буфер, и клетки дважды промывали, добавляя охлажденный на льду буфер предварительной обработки (1,2 мл на лунку). Затем клетки подвергали лизису, добавляя 0,2М гидроксида натрия (300 мкл/лунка). Лизированные растворы переносили на планшет Picoplate (PerkinElmer) и добавляли Microscinti 40 (PerkinElmer) (600 мкл/лунка). После перемешивания просчитывали радиоактивность на жидкостном сцинтилляционном счетчике (PerkinElmer). Радиоактивность в клетках COS7, не трансфицированных вектором экспрессии URAT1, просчитывали в таких же условиях, как в контроле. В результате было показано, что соединения примеров 5, 8, 17, 18, 22, 40 и 55 имели 50%-ную или большую ингибирующую активность в концентрации 10 мкМ.
Пример испытаний 3
Гипоурикемический эффект в сыворотке
Тестируемые соединения, суспендированные в 0,5%-ном растворе метилцеллюлозы, в дозе 1 мг/кг через желудочный зонд вводили самцам крыс CD (SD) IGS (5-недельного возраста, Charls River Japan), не получавшим пищи в течение ночи. Через 2 часа после введения, при эфирной анестезии из брюшной аорты отбирали кровь и обычным образом отделяли сыворотку. Значения мочевой кислоты в сыворотке определяли, используя набор для измерения мочевой кислоты (Uric acid C-Test Wako: Wako pure chemical), и по формуле, приведенной ниже, рассчитывали процент снижения мочевой кислоты. В результате было показано, что соединения примеров 2, 7, 10, 22, 23, 25, 37, 49, 50 и 58 вызывали снижение мочевой кислоты, составлявшее не менее 60%.
Процент уменьшения мочевой кислоты (%)=(Значения мочевой кислоты в сыворотке контрольных животных-Значения мочевой кислоты в сыворотке животных, которым вводили тестируемые соединения)×100/Значения мочевой кислоты в сыворотке контрольных животных
Промышленная применимость
Производные индолизина, представленные формулой (I), согласно настоящему изобретению или их пролекарства или их фармацевтически приемлемые соли демонстрируют превосходную ингибирующую активность в отношении ксантиноксидазы, и поэтому они могут проявлять ингибирующую активность в отношении продуцирования мочевой кислоты и снижать уровень мочевой кислоты в сыворотке. Поэтому настоящее изобретение может предоставить средство для предупреждения или лечения гиперурикемии, подагрического узла, подагрического артрита, связанного с гиперурикемией расстройства почек, почечных конкрементов и т.п.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНОЕ (АЗА)ИНДОЛА И ЕГО ПРИМЕНЕНИЕ В ЛЕЧЕБНЫХ ЦЕЛЯХ | 2008 |
|
RU2477274C2 |
| СОДЕРЖАЩЕЕ КОНДЕНСИРОВАННУЮ КОЛЬЦЕВУЮ СТРУКТУРУ ПРОИЗВОДНОЕ И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2009 |
|
RU2512547C2 |
| 5-ЧЛЕННОЕ ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ И ЕГО ПРИМЕНЕНИЕ ДЛЯ ЛЕКАРСТВЕННЫХ ЦЕЛЕЙ | 2008 |
|
RU2515968C2 |
| 3-АЛКИЛИДЕНГИДРАЗИНО-ЗАМЕЩЕННЫЕ ГЕТЕРОАРИЛЬНЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ АКТИВАТОРОВ РЕЦЕПТОРА ТРОМБОПОЭТИНА | 2004 |
|
RU2358970C2 |
| ПРОИЗВОДНЫЕ ИЗОКСАЗОЛА, ИХ ПРИМЕНЕНИЕ В ПРОИЗВОДСТВЕ ИНГИБИРУЮЩЕГО МОНОАМИНООКСИДАЗУ АГЕНТА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИНГИБИРОВАНИЯ МОНОАМИНООКСИДАЗЫ ТИПА В | 1995 |
|
RU2140414C1 |
| АНТАГОНИСТЫ АРИЛСУЛЬФОНАМИДА CCR3 | 2010 |
|
RU2539591C2 |
| НОВОЕ ПРОИЗВОДНОЕ ФЕНОЛА | 2010 |
|
RU2536689C2 |
| АЗОТСОДЕРЖАЩЕЕ ГЕТЕРОЦИКЛИЧЕСКОЕ ПРОИЗВОДНОЕ, ОБЛАДАЮЩЕЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ 11β-ГИДРОКСИСТЕРОИДДЕГИДРОГЕНАЗЫ ТИПА 1 | 2008 |
|
RU2455285C2 |
| 2,5-ДИЗАМЕЩЕННЫЕ АРИЛСУЛЬФОНАМИДНЫЕ АНТАГОНИСТЫ CCR3 | 2010 |
|
RU2532515C2 |
| ХИНОЛИНОВЫЕ СОЕДИНЕНИЯ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ЛЕКАРСТВЕННОГО СРЕДСТВА, ИНГИБИРУЮЩЕГО ТРАНСПОРТЕР УРАТОВ | 2016 |
|
RU2715229C2 |
Изобретение относится к новым производным индолизина формулы

к их фармацевтически приемлемым солям или пролекарствам, которые представляют собой С1-6алкиловые эфиры, где значения U, R1, R2, R3 приведены в пункте один формулы. Соединения обладают ингибирующей активностью в отношении ксантиноксидазы, что позволяет использовать их в фармацевтической композиции для предупреждения или лечения заболевания, выбранного из группы, состоящей из гиперурикемии, подагрического узла, подагрического артрита, связанного с гиперурикемией почечного расстройства и мочевых конкрементов. 2 н. и 16 з.п. ф-лы. 17 табл., 76 пр.
1. Производное индолизина, представленное формулой (1):
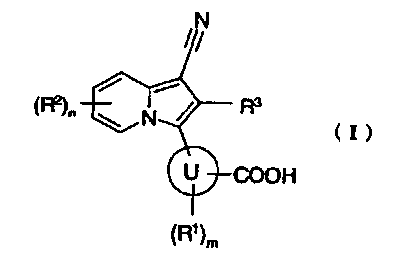
где
кольцо U представляет собой фенил или 5- или 6-членную ароматическую гетероциклическую группу, имеющую от 1 до 4 одинаковых или разных гетероатомов в кольце, выбранных из кислорода, серы и азота;
R1 представляет собой атом галогена, гидроксигруппу, нитрогруппу, аминогруппу или C1-6алкил, который может быть замещен атомом фтора;
R2 представляет собой любой из следующих (1)-(7):
(1) атом галогена;
(2) гидроксигруппу;
(3) аминогруппу;
(4) карбамоил;
(5) цианогруппу;
(6) карбоксигруппу;
(7) C1-6алкил, C2-6алкенил, C2-6алкинил, C1-6алкоксигруппу, моно(ди)C1-6алкиламиногруппу, C2-7ацил, C2-7ациламиногруппу, моно(ди)C1-6алкилкарбамоил, C1-6алкилтиогруппу, C3-8циклоалкил, 3-8-членный гетероциклоалкил, имеющий от 1 до 2 одинаковых или разных гетероатомов в кольце, выбранных из кислорода, серы и азота, C5-8циклоалкенил, 5-8-членный гетероциклоалкенил, имеющий от 1 до 2 одинаковых или разных гетероатомов в кольце, выбранных из кислорода, серы и азота, фенил, 5- или 6-членную ароматическую гетероциклическую группу, имеющую от 1 до 4 одинаковых или разных гетероатомов в кольце, выбранных из кислорода, серы и азота, каждый из которых может содержать любую группу, выбранную из группы заместителей α;
m представляет целое число от 0 до 2, и когда m равно 2, группы R1 необязательно отличаются друг от друга;
n представляет целое число от 0 до 3, и когда n равно 2 или 3, группы R2 необязательно отличаются друг от друга; и когда существуют две группы R2, связанные с соседними атомами в индолизиновом кольце и независимо представляющие собой группу, выбранную из группы, состоящей из C1-6алкила, который может быть замещен атомом фтора, и C1-6алкоксигруппы, которая может быть замещена атомом фтора, две такие группы R2 необязательно образуют 5-8-членное кольцо вместе со связывающими атомами в индолизиновом кольце;
R3 представляет собой атом водорода, атом хлора или атом фтора; и
группа заместителей α состоит из атома фтора, атома хлора или гидроксигруппы; или его пролекарство или их фармацевтически приемлемая соль,
где термин "пролекарство" обозначает соединение формулы (I), в котором одна или более карбоксильных групп замещена C1-6алкилом.
2. Производное индолизина по п.1, представленное формулой (Ia):
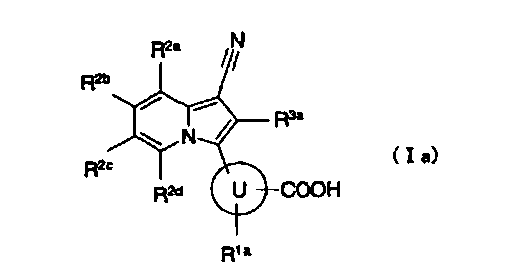
где
кольцо U представляет собой фенил или 5- или 6-членную ароматическую гетероциклическую группу, имеющую от 1 до 4 одинаковых или разных гетероатомов в кольце, выбранных из кислорода, серы и азота;
R1a представляет собой атом водорода, атом фтора, гидроксигруппу, аминогруппу, метил или трифторметил;
R2a и R2b независимо представляют собой любой из следующих (a1)-(a4):
(a1) атом водорода;
(a2) атом галогена;
(a3) гидроксигруппу;
(a4) C1-6алкил, C1-6алкоксигруппу, моно(ди)C1-6алкиламиногруппу, C2-7ацил, C1-6алкилтиогруппу, C3-8циклоалкил, 3-8-членный гетероциклоалкил, имеющий от 1 до 2 одинаковых или разных гетероатомов в кольце, выбранных из кислорода, серы и азота, фенил или 5- или 6-членную ароматическую гетероциклическую группу, имеющую от 1 до 4 одинаковых или разных гетероатомов в кольце, выбранных из кислорода, серы и азота, каждый из которых может содержать любую группу, выбранную из группы заместителей α;
R2c представляет собой атом водорода, атом галогена,
гидроксигруппу, C1-6алкил, который может содержать любую группу, выбранную из группы заместителей α, или C1-6алкоксигруппу, которая может содержать любую группу, выбранную из группы заместителей α, или
когда R2a и R2b или R2b и R2c независимо представляют собой группу, выбранную из группы, состоящей из C1-6алкила, который может быть замещен атомом фтора, и C1-6алкоксигруппы, которая может быть замещена атомом фтора, они необязательно образуют 5-8-членное кольцо вместе со связывающими атомами в индолизиновом кольце;
R2d представляет собой атом водорода или атом фтора;
R3a представляет собой атом водорода или атом фтора; и
группа заместителей α имеет такое же значение, как описано в п.1, или его пролекарство или их фармацевтически приемлемая соль,
где термин "пролекарство" обозначает соединение формулы (I), в котором одна или более карбоксильных групп замещена C1-6алкилом.
3. Производное индолизина по п.2, где кольцо U представляет собой бензольное кольцо, пиридиновое кольцо, тиофеновое кольцо или тиазольное кольцо, или его пролекарство или их фармацевтически приемлемая соль.
4. Производное индолизина по п.2, где группа, представленная формулой:
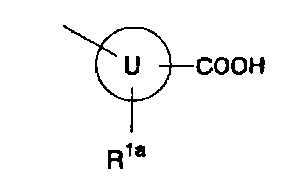
является группой, представленной формулой:
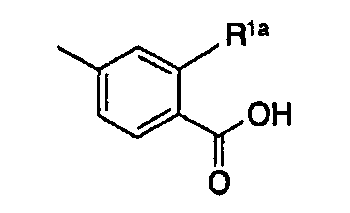
и R1a представляет собой атом водорода или гидроксигруппу, или его пролекарство или их фармацевтически приемлемая соль.
5. Производное индолизина по п.3 или 4, где R2a и R2b независимо представляют собой любой из следующих (b1)-(b4):
(b1) атом водорода;
(b2) атом галогена;
(b3) гидроксигруппу;
(b4) C1-6алкил, C1-6алкоксигруппу, моно(ди)C1-6алкиламиногруппу или гидроксиC1-6алкил, каждый из которых может быть замещен атомом фтора; и
R2c представляет собой атом водорода, атом галогена, гидроксигруппу, C1-6алкил, который может быть замещен атомом фтора, или C1-6алкоксигруппу, которая может быть замещена атомом фтора, или его пролекарство или их фармацевтически приемлемая соль.
6. Производное индолизина по п.2, где R2d представляет собой атом водорода, или его пролекарство или их фармацевтически приемлемая соль.
7. Производное индолизина по п.1, где R3 или R3a представляет собой атом водорода, или его пролекарство или их фармацевтически приемлемая соль.
8. Производное индолизина по п.6, где R1a представляет собой атом водорода или гидроксигруппу;
R2a представляет собой атом водорода, атом фтора, атом хлора, метил, этил, метоксигруппу, монофторметил, дифторметил, трифторметил, дифторметоксигруппу или трифторметоксигруппу;
R2b представляет собой атом водорода, атом фтора, атом хлора, метил, этил, метоксигруппу, монофторметил, дифторметил, трифторметил, дифторметоксигруппу или трифторметоксигруппу; и
R2c представляет собой атом водорода, атом фтора, атом хлора, метил, монофторметил, дифторметил или трифторметил, или его пролекарство или их фармацевтически приемлемая соль.
9. Производное индолизина по п.8, где R2b представляет собой атом водорода, метил, этил, метоксигруппу, монофторметил, дифторметил, трифторметил, дифторметоксигруппу или трифторметоксигруппу, или его пролекарство или их фармацевтически приемлемая соль.
10. Производное индолизина по п.8 или 9, где R1a представляет собой атом водорода, или его пролекарство или их фармацевтически приемлемая соль.
11. Производное индолизина по п.8 или 9, где R1a представляет собой гидроксигруппу, или его пролекарство или их фармацевтически приемлемая соль.
12. Производное индолизина по п.8, выбранное из группы, включающей:
4-(1-Цианоиндолизин-3-ил)бензойную кислоту,
4-(1-Циано-7-метилиндолизин-3-ил)бензойную кислоту,
4-(8-Хлоро-1-цианоиндолизин-3-ил)бензойную кислоту,
4-(1-Циано-8-метилиндолизин-3-ил)бензойную кислоту,
4-(1-Циано-6-метилиндолизин-3-ил)бензойную кислоту,
4-(1-Циано-6,8-диметилиндолизин-3-ил)бензойную кислоту,
4-(1-Циано-8-фторо-7-метилиндолизин-3-ил)бензойную кислоту,
4-(1-Циано-6-фторо-7-метилиндолизин-3-ил)бензойную кислоту,
4-(1-Циано-7-этилиндолизин-3-ил)бензойную кислоту,
4-(1-Циано-8-этилиндолизин-3-ил)бензойную кислоту,
4-(1-Циано-8-фтороиндолизин-3-ид)бензойную кислоту,
4-(1-Циано-6-фтороиндолизин-3-ил)бензойную кислоту,
4-(1-Циано-7-трифторометилиндолизин-3-ил)бензойную кислоту,
4-(1-Цианоиндолизин-3-ил)-2-гидроксибензойную кислоту,
4-(1-Циано-7-метилиндолизин-3-ил)-2-гидроксибензойную кислоту,
4-(1-Циано-8-метилиндолизин-3-ил)-2-гидроксибензойную кислоту,
4-(1-Циано-6-метилиндолизин-3-ил)-2-гидроксибензойную кислоту,
4-(1-Циано-6,8-диметилиндолизин-3-ил)-2-гидроксибензойную кислоту,
4-(1-Циано-6-фторо-7-метилиндолизин-3-ил)-2-гидроксибензойную кислоту,
4-(1-Циано-8-фторо-7-метилиндолизин-3-ил)-2-гидроксибензойную кислоту,
4-(1-Циано-8-этилиндолизин-3-ил)-2-гидроксибензойную кислоту,
4-(1-Циано-8-фтороиндолизин-3-ил)-2-гидроксибензойную кислоту,
4-(1-Циано-6-фтороиндолизин-3-ил)-2-гидроксибензойную кислоту,
4-(1-Циано-7-трифторометилиндолизин-3-ил)-2-гидроксибензойную кислоту,
4-(1-Циано-7-фторометилиндолизин-3-ил)бензойную кислоту,
4-(6-Хлоро-1-циано-7-метилиндолизин-3-ил)бензойную кислоту,
4-(8-Хлоро-1-циано-7-метилиндолизин-3-ил)бензойную кислоту,
4-(1-Циано-7,8-диметилиндолизин-3-ил)бензойную кислоту,
4-(7-Хлоро-1-циано-8-метилиндолизин-3-ил)бензойную кислоту,
4-(1-Циано-6,8-дифтороиндолизин-3-ил)бензойную кислоту,
4-(1-Циано-8-метоксииндолизин-3-ил)бензойную кислоту,
4-(1-Циано-7-метоксииндолизин-3-ил)бензойную кислоту,
4-(1-Циано-7-метокси-6-метилиндолизин-3-ил)бензойную кислоту,
4-(1-Циано-6-фторо-7-трифторометилиндолизин-3-ил)-2-гидроксибензойную кислоту,
4-(6-Хлоро-1-циано-7-метилиндолизин-3-ил)-2-гидроксибензойную кислоту,
4-(8-Хлоро-1-циано-7-метилиндолизин-3-ил)-2-гидроксибензойную кислоту,
4-(1-Циано-7,8-диметилиндолизин-3-ил)-2-гидроксибензойную кислоту,
4-(7-Хлоро-1-циано-8-метилиндолизин-3-ил)-2-гидроксибензойную кислоту,
4-(1-Циано-6,8-дифтороиндолизин-3-ил)-2-гидроксибензойную кислоту,
4-(1-Циано-7-метоксииндолизин-3-ил)-2-гидроксибензойную кислоту,
4-(1-Циано-7-метокси-6-метилиндолизин-3-ил)-2-гидроксибензойную кислоту и
4-(1-Циано-7-фторометилиндолизин-3-ил)-2-гидроксибензойную кислоту
или их фармацевтически приемлемые соли.
13. Производное индолизина по п.1, которое представляет собой ингибитор ксантиноксидазы, или его пролекарство или их фармацевтически приемлемая соль.
14. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении ксантиноксидазы, содержащая в качестве активного ингредиента производное индолизина по п.1, или его пролекарство или их фармацевтически приемлемую соль.
15. Фармацевтическая композиция по п.14, которая представляет собой средство для предупреждения или лечения заболевания, выбранного из группы, состоящей из гиперурикемии, подагрического узла, подагрического артрита, связанного с гиперурикемией почечного расстройства и мочевых конкрементов.
16. Фармацевтическая композиция по п.15, которая представляет собой средство для предупреждения или лечения гиперурикемии.
17. Фармацевтическая композиция по п.14, которая представляет собой средство для снижения уровня мочевой кислоты в сыворотке.
18. Фармацевтическая композиция по п.14, которая представляет собой ингибитор продуцирования мочевой кислоты.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| US 4400387 A1, 23.08.1983 | |||
| Способ получения производных индолизина | 1980 |
|
SU993817A3 |
Авторы
Даты
2014-10-10—Публикация
2010-03-30—Подача