Область изобретения
Настоящее изобретение относится к содержащим конденсированные кольца производным, полезным в качестве лекарственных средств.
Более конкретно, настоящее изобретение относится к содержащим конденсированные кольца производным, обладающим ингибирующей активностью в отношении ксантиноксидазы и являющимся полезными в качестве средств для профилактики или лечения заболевания, связанного с аномальным уровнем мочевой кислоты в сыворотке, или их пролекарствам, или их фармацевтически приемлемым солям.
Предпосылки изобретения
Мочевая кислота является конечным продуктом метаболизма пурина в организме человека. У многих млекопитающих, в отличие от человека, мочевая кислота далее разлагается под действием уратоксидазы (уриказы) в печени до аллантоина, который экскретируется через почки. У человека основным путем экскреции мочевой кислоты являются почки, где приблизительно две трети мочевой кислоты экскретируется с мочой. Остальная часть экскретируется в фекалиях. Когда имеет место избыточная продукция или пониженная экскреция мочевой кислоты, это вызывает гиперурикемию. Гиперурикемию подразделяют на тип с чрезмерной продукцией мочевой кислоты, тип с недостаточной экскрецией мочевой кислоты и смешанный тип. Эта классификация гиперурикемии является клинически важной. Имея целью снижение неблагоприятных эффектов терапевтических средств, терапевтические средства выбирают в соответствии с каждым классом (например, см. не-патентный документ 1).
При гиперурикемии с чрезмерной продукцией мочевой кислоты экскреция с мочой мочевой кислоты увеличивается, и когда экскреция с мочой мочевой кислоты еще более увеличивается при использовании средства, способствующего выведению из организма мочевой кислоты, возможно развитие такого осложнения, как мочевые конкременты. Поэтому, в принципе, аллопуринол, ингибитор продукции мочевой кислоты (или иногда называемый ингибитором синтеза мочевой кислоты, далее в настоящей заявке указан как "ингибитор продукции мочевой кислоты"), используют при типе с чрезмерной продукцией мочевой кислоты.
Мочевая кислота образуется из пуриновых веществ, которые имеют пищевое происхождение и синтезируются эндогенно, в конечном счете, путем окисления ксантина ксантиноксидазой. Аллопуринол разработан как ингибитор ксантиноксидазы, и это единственный ингибитор продукции мочевой кислоты, используемый в медицинской практике. Однако хотя аллопуринол, согласно сообщениям, является эффективным при гиперурикемии и различных заболеваниях, которые она вызывает, также сообщалось и о тяжелых неблагоприятных эффектах, таких как синдром отравления (аллергический ангиит), синдром Стивенса-Джонсона, эксфолиативный дерматит, апластическая анемия, дисфункция печени и подобные (например, см. не-патентный документ 2). В качестве одной из причин указывалось, что аллопуринол имеет структуру, сходную с нуклеиновыми кислотами, и ингибирует путь метаболизма пиримидина (например, см. не-патентный документ 3).
С другой стороны, при типе гиперурикемии с недостаточной экскрецией мочевой кислоты экскреция мочевой кислоты снижатеся. Сообщалось о том, что когда используют аллопуринол, который метаболизируется в оксипуринол, эксретируемый через почки посредством такого же механизма, что и мочевая кислота, экскреция оксипуринола также снижается, и что увеличивается число случаев расстройств печени (например, см. не-патентный документ 4). Поэтому, в принципе, средства, способствующие выведению из организма мочевой кислоты, такие как пробенецид, бензбромарон и подобные, используют при типе заболевания с недостаточной экскрецией мочевой кислоты. Эти средства, способствующие выведению из организма мочевой кислоты, однако, также имеют побочные эффекты, такие как желудочно-кишечные расстройства, образование мочевых конкрементов или подобные. В частности, известно, что бензбромарон может вызывать фульминантный гепатит в случае идиосинкратических пациентов (например, см. не-патентные документы 5 и 6).
Таким образом, считают, что существующие в настоящее время ингибитор продукции мочевой кислоты, а также средство, способствующее выведению из организма мочевой кислоты, ограничены в применении для пациентов или имеют тяжелые побочные эффекты. Поэтому разработка легкого в применении средства для лечения гиперурикемии или подобных заболеваний является желательной.
Мочевая кислота выводится, в основном, почками, и динамику урата в почках до настоящего времени исследовали в некоторых экспериментах с использованием мембранных пузырьков щеточной каемки (BBMV), полученных из коркового вещества почки (например, см. не-патентные документы 7 и 8). Известно, что у человека мочевая кислота проходит через почечные клубочки свободно, и существуют механизмы реабсорбции и секреции мочевой кислоты в проксимальных канальцах (например, см. не-патентный документ 9).
В последние годы был идентифицирован ген (SLC22A12), кодирующий траспортер урата в почках человека (например, см. не-патентный документ 10). Траспортер, кодируемый этим геном (траспортер урата 1, в настоящей заявке далее указан как "URAT1"), представляет собой 12-трансмембранного типа молекулу, относящуюся к семейству OAT. URAT1 мРНК специфически экспрессируется в почках, и локализацию URAT1 на апикальной стороне проксимального канальца наблюдали на срезе ткани почки человека. В эксперименте с использованием системы экспрессии xenopus ооцитов было показано поглощение мочевой кислоты через URAT1. Кроме того, было показано, что поглощение мочевой кислоты транспортируется путем обмена с органическими анионами, такими как молочная кислота, пиразинкарбоновая кислота (PZA), никотиновая кислота и подобные, и поглощение мочевой кислоты через URAT1 ингибируется средствами, способствующими выведению из организма мочевой кислоты, пробенецидом и бензбромароном. Таким образом, как ожидалось на основании эксперимента с использованием мембранных пузырьков, есть серьезные основания предполагать, что URAT1 является урат/анионо-обменником. То есть было показано, что URAT1 представляет собой траспортер, который играет важную роль в реабсорбции мочевой кислоты в почках (например, см. не-патентный документ 10).
Кроме того, связь между URAT1 и заболеваниями становится понятной. Идиопатическая почечная гипоурикемия представляет собой заболевание, при котором экскреция мочевой кислоты увеличивается из-за аномальной динамики урата в почках, и уровень мочевой кислоты в сыворотке становится низким. Известно, что это заболевание часто связывают с мочевыми конкрементами или острой почечной недостаточностью после физических нагрузок. URAT1 был идентифицирован как ген, ответственный за почечную гипоурикемию (например, см. не-патентный документ 10). Это также дает сильное основание для предположения, что URAT1 является ответственным за контроль уровня мочевой кислоты в крови.
Поэтому вещество, обладающее ингибирующей активностью в отношении URAT1, является полезным в качестве средства для лечения и профилактики заболеваний, связанных с высокими уровнями мочевой кислоты в крови, таких, как гиперурикемия, подагрический узел, подагрический артрит, почечное расстройство, связанное с гиперурикемией, мочевые конкременты или подобные.
Были сообщения о том, что при лечении гиперурикемии сочетание аллопуринола как ингибитора продукции мочевой кислоты и средства, способствующего выведению из организма мочевой кислоты, снижало уровень мочевой кислоты в сыворотке намного сильнее, чем при применении аллопуринола отдельно (например, см. не-патентные документы 11 и 12). Поэтому, когда лечение только одним из существующих средств не может дать достаточный эффект, более высокий терапевтический эффект можно ожидать при использовании комбинированного применения ингибитора продукции мочевой кислоты и средства, способствующего выведению из организма мочевой кислоты. Кроме того, что касается типа гиперурикемии с недостаточной экскрецией мочевой кислоты, считают, что, поскольку экскреция с мочой мочевой кислоты может снижаться при снижении в крови уровня мочевой кислоты, риск образования мочевых конкрементов, являющихся результатом монотерапии с использованием средства, способствующего выведению из организма мочевой кислоты, может быть снижен. Кроме того, что касается гиперурикемии смешанного типа, ожидается высокий терапевтический эффект. Таким образом, ожидается, что средство, обладающее как ингибирующей активностью в отношении продукции мочевой кислоты, так и активностью выведения из организма мочевой кислоты, будет чрезвычайно полезным средством для профилактики или лечения гиперурикемии или подобных заболеваний.
В качестве соединения, обладающего как ингибирующей активностью в отношении ксантиноксидазы, так и ингибирующей активностью в отношении URAT1, известен морин, являющийся природным продуктом (см. не-патентный документ 13). Кроме того, в качестве соединения, обладающего активностью выведения из организма мочевой кислоты, известны соединения биариловых или диариловых эфиров (см. Патентный документ 1).
В качестве соединения, где конденсированная кольцевая структура связана с ароматическим кольцом, содержащим карбоксигруппу, известны, например, нафталиновое производное, обладающее терапевтическим эффектом в отношении ВИЧ (см. Патентный документ 2), хинолиновое производное, обладающее гипотензивным эффектом (см. Патентный документ 3) и подобные. Однако эти соединения имеют структуры, отличные от содержащего конденсированную кольцевую структуру производного по настоящему изобретению. Кроме того, в этом ссылочном документе ничего не говорится и нет никакого предположения о том, что содержащее конденсированную кольцевую структуру производное по настоящему изобретению обладает ингибирующей активностью в отношении ксантиноксидазы и является полезным для профилактики или лечения заболевания, связанного с аномальным уровнем мочевой кислоты в сыворотке, такого как подагра, гиперурикемия или подобные.
Патентный документ 1: Патентная публикация Японии № 2000-001431
Патентный документ 2: Международная публикация № WO95/33754, брошюра
Патентный документ 3: Европейская патентная публикация № 0569013, описание
Не-патентный документ 1: Atsuo Taniguchi and 1 person, Modern Physician, 2004, Vol.24, No.8, pp.1309-1312
Не-патентный документ 2: Kazuhide Ogino and 2 persons, Nihon Rinsho (Japan Clinical), 2003, Vol.61, Extra edition 1, pp.197-201
Не-патентный документ 3: Hideki Horiuchi and 6 persons, Life Science, 2000, Vol.66, No.21, pp.2051-2070
Не-патентный документ 4: Hisashi Yamanaka and 2 persons, Konyosankessyo to Tsufu (Hyperuricemia and gout), issued by Medical Review Co., 1994, Vol.2, No.1, pp.103-111
Не-патентный документ 5: Robert A Terkeltaub, N. Engl. J. Med., 2003, Vol.349, pp.1647-1655
Не-патентный документ 6: Ming-Han H. Lee and 3 persons, Drug. Safety, 2008, Vol.31, pp.643-665
Не-патентный документ 7: Francoise Roch-Ramel and 2 persons, Am. J. Physiol., 1994, Vol.266 (Renal Fluid Electrolyte Physiol., Vol.35), F797-F805
Не-патентный документ 8: Francoise Roch-Ramel and 2 persons, J. Pharmacol. Exp. Ther. 1997, Vol.280, pp.839-845
Не-патентный документ 9: Gim Gee Teng and 2 persons, Drugs, 2006, Vol.66, pp. 1547-1563
Не-патентный документ 10: Atsushi Enomoto and 18 persons, Nature, 2002, Vol.417, pp.447-452
Не-патентный документ 11: S Takahashi and 5 persons, Ann. Rheum. Dis., 2003, Vol.62, pp.572-575
Не-патентный документ 12: M. D. Feher and 4 persons, Rheumatology, 2003, Vol.42, pp.321-325
Не-патентный документ 13: Zhifeng Yu and 2 persons, J. Pharmacol. Exp. Ther., 2006, Vol.316, pp.169-175
Раскрытие настоящего изобретения
Задача, на решение которой направлено настоящее изобретение
Настоящее изобретение предназначено для обеспечения средства, которое обладает ингибирующей активностью в отношении продукции мочевой кислоты, для профилактики или лечения заболевания, связанного с аномальным уровнем мочевой кислоты в сыворотке.
Средства решения задачи
Авторы настоящего изобретения провели всесторонние исследования для решения указанной задачи. Как результат, было обнаружено, что содержащие конденсированную кольцевую структуру производные, представленные следующей формулой (I), проявляют отличную ингибирующую активность в отношении ксантиноксидазы и существенно снижают уровни мочевой кислоты в сыворотке, и поэтому они могут представлять собой новое средство для профилактики или лечения заболевания, связанного с аномальным уровнем мочевой кислоты в сыворотке, что послужило основой настоящего изобретения.
Таким образом, настоящее изобретение относится к:
[1] содержащему конденсированную кольцевую структуру производному, представленному формулой (I):
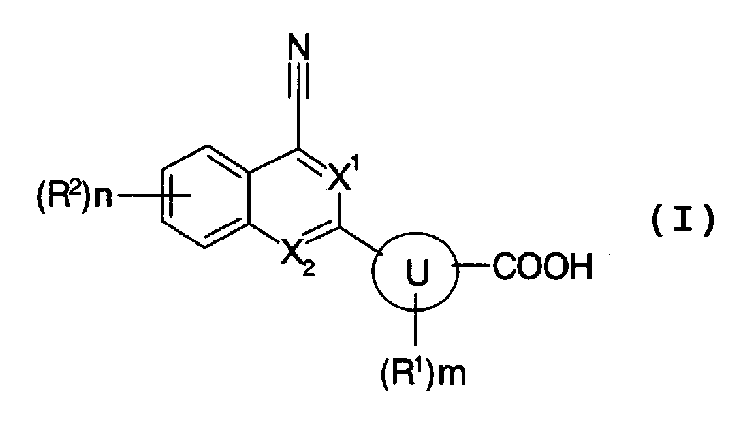 ,
,
где
X1 и X2 независимо представляют собой CH или N;
кольцо U представляет собой С6 арил или 5- или 6-членный гетероарил;
m представляет собой целое число, имеющее значение от 0 до 2;
n представляет собой целое число, имеющее значение от 0 до 3;
R1 представляет собой гидроксигруппу, атом галогена, амино или C1-6 алкил, и когда m имеет значение 2, два R1, необязательно, являются отличными друг от друга;
R2 представляет собой любой из (1)-(11):
(1) атом галогена;
(2) гидроксигруппа;
(3) циано;
(4) нитро;
(5) карбокси;
(6) карбамоил;
(7) амино;
(8) C1-6 алкил, C2-6 алкенил или C1-6 алкокси, каждый из которых может независимо содержать любую (предпочтительно 1-3) группу, выбранную из группы заместителей α;
(9) C2-6 алкинил, C1-6 алкилсульфонил, моно(ди)C1-6 алкилсульфамоил, C2-7 ацил, C1-6 алкоксикарбонил, C1-6 алкоксикарбонилокси, моно(ди)C1-6 алкиламино, моно(ди)C1-6 алкокси C1-6 алкиламино, C1-6 алкокси C1-6 алкил(C1-6 алкил)амино, C2-7 ациламино, C1-6 алкоксикарбониламино, C1-6 алкоксикарбонил(C1-6 алкил)амино, моно(ди)C1-6 алкилкарбамоил, моно(ди)C1-6 алкокси C1-6 алкилкарбамоил, C1-6 алкокси C1-6 алкил(C1-6 алкил)карбамоил, моно(ди) C1-6 алкиламинокарбониламино, C1-6 алкилсульфониламино или C1-6 алкилтио, каждый из которых может независимо содержать любые 1-3 группы, выбранные из атома фтора, гидроксигруппы и амино;
(10) C3-8 циклоалкил, 3-8-членный гетероциклоалкил, C5-8 циклоалкенил или 5-8-членный гетероциклоалкенил, каждый из которых независимо может содержать любые 1-3 группы, выбранные из атома фтора, гидроксигруппы, амино, оксо, C1-6 алкила, C1-6 алкокси, C1-6 алкокси C1-6 алкила, карбокси, C2-7 ацила, C1-6 алкоксикарбонила, карбамоила, моно(ди) C1-6 алкилкарбамоила, моно(ди) C1-6 алкокси C1-6 алкилкарбамоила и C1-6 алкокси C1-6 алкил(C1-6 алкил)карбамоила;
(11) С6 арил, С6 арилокси, С6 арилкарбонил, 5 или 6-членный гетероарил, 5- или 6-членный гетероарилокси, 5- или 6-членный гетероарилкарбонил, С6 ариламино, С6 арил(C1-6 алкил)амино, 5- или 6-членный гетероариламино или 5- или 6-членный гетероарил(C1-6 алкил)амино, каждый из которых может независимо содержать любые 1-3 группы, выбранные из атома галогена, гидроксигруппы, амино, циано, нитро, C1-6 алкила, C1-6 алкокси, C1-6 алкокси C1-6 алкила, карбокси, C2-7 ацила, C1-6 алкоксикарбонила, карбамоила, моно(ди) C1-6 алкилкарбамоила, моно(ди) C1-6 алкиламино, моно(ди) C1-6 алкокси C1-6 алкиламино, C1-6 алкокси C1-6 алкил(C1-6 алкил)амино, C1-6 алкоксикарбониламино, моно(ди) C1-6 алкокси C1-6 алкилкарбамоила и C1-6 алкокси C1-6 алкил(C1-6 алкил)карбамоила; и когда n имеет значение 2 или 3, эти R2, необязательно, являются отличными друг от друга, и когда присутствуют два R2, связанные с соседними атомами, и независимо представляют собой C1-6 алкил или C1-6 алкокси, каждый из которых может содержать C1-6 алкокси, эти два R2 необязательно образуют 5-8-членное кольцо вместе с атомами, с которыми они связаны;
группа заместителей α включает атом фтора; гидроксигруппу; амино; карбокси; C1-6 алкокси, моно(ди)C1-6 алкиламино, моно(ди)C1-6 алкокси C1-6 алкиламино, C1-6 алкокси C1-6 алкил(C1-6 алкил)амино, C1-6 алкоксикарбониламино, C2-7 ацил, C1-6 алкоксикарбонил, моно(ди)C1-6 алкилкарбамоил, моно(ди)C1-6 алкокси C1-6 алкилкарбамоил, C1-6 алкокси C1-6 алкил(C1-6 алкил)карбамоил, C1-6 алкилсульфониламино, C2-7 ациламино и C1-6 алкоксикарбониламино, каждый из которых может содержать любые 1-3 группы, выбранные из атома фтора, гидроксигруппы и амино; C3-8 циклоалкил и 3-8-членный гетероциклоалкил, каждый из которых может независимо содержать любые 1-3 группы, выбранные из атома фтора, гидроксигруппы, амино, оксо, C1-6 алкила, C1-6 алкокси, C1-6 алкокси C1-6 алкила, карбокси, C2-7 ацила, C1-6 алкоксикарбонила, карбамоила, моно(ди) C1-6 алкилкарбамоила, моно(ди) C1-6 алкокси C1-6 алкилкарбамоила и C1-6 алкокси C1-6 алкил(C1-6 алкил)карбамоила; и С6 арил и 5- или 6-членный гетероарил, каждый из которых может независимо содержать любые 1-3 группы, выбранные из атома галогена, гидроксигруппы, амино, циано, нитро, C1-6 алкила, C1-6 алкокси, C1-6 алкокси C1-6 алкила, карбокси, C2-7 ацила, C1-6 алкоксикарбонила, карбамоила, моно(ди) C1-6 алкилкарбамоила, моно(ди) C1-6 алкиламино, моно(ди) C1-6 алкокси C1-6 алкиламино, C1-6 алкокси C1-6 алкил(C1-6 алкил)амино, C1-6 алкоксикарбониламино, моно(ди) C1-6 алкокси C1-6 алкилкарбамоила и C1-6 алкокси C1-6 алкил(C1-6 алкил)карбамоила, или его пролекарству, или его фармацевтически приемлемой соли;
[2] содержащему конденсированную кольцевую структуру производному, описанному выше в пункте [1], где X1 представляет собой CH, или его пролекарству, или его фармацевтически приемлемой соли;
[3] содержащему конденсированную кольцевую структуру производному, описанному выше в пункте [1] или [2], где X2 представляет собой CH, или его пролекарству, или его фармацевтически приемлемой соли;
[4] содержащему конденсированную кольцевую структуру производному, описанному выше в любом из пунктов [1]-[3], где кольцо U представляет собой бензольное кольцо, пиридиновое кольцо, тиазольное кольцо, пиразольное кольцо или тиофеновое кольцо, или его пролекарству, или его фармацевтически приемлемой соли;
[5] содержащему конденсированную кольцевую структуру производному, описанному выше в пункте [4], где m имеет значение 0, или m имеет значение 1, и кольцо U представляет собой любое из колец, представленных следующей формулой:
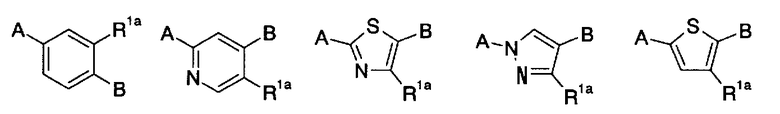
в указанной формуле R1a представляет собой гидроксигруппу, амино или C1-6 алкил; A представляет собой связь с конденсированным кольцом; и В представляет собой связь с карбокси; соответственно, или его пролекарству, или его фармацевтически приемлемой соли;
[6] содержащему конденсированную кольцевую структуру производному, описанному выше в пункте [5], где кольцо U представляет собой тиазольное кольцо, или его пролекарству, или его фармацевтически приемлемой соли;
[7] содержащему конденсированную кольцевую структуру производному, описанному выше в пункте [5], где кольцо U представляет собой пиридиновое кольцо, или его пролекарству, или его фармацевтически приемлемой соли;
[8] содержащему конденсированную кольцевую структуру производному, описанному выше в пункте [6], где R1a представляет собой метильную группу; n имеет значение 0, или n имеет значение 1-3, и R2 представляет собой атом галогена, гидроксигруппу или C1-6 алкил, который может содержать 1-3 атома фтора, или его пролекарству, или его фармацевтически приемлемой соли;
[9] содержащему конденсированную кольцевую структуру производному, описанному выше в пункте [7], где m имеет значение 0; или m имеет значение 1, R1a представляет собой гидроксигруппу, и R2 представляет собой атом галогена, гидроксигруппу или C1-6 алкил, который может содержать 1-3 атома фтора, или его пролекарству, или его фармацевтически приемлемой соли;
[10] содержащему конденсированную кольцевую структуру производному, описанному выше в любом из пунктов [1]-[7], где n имеет значение 0, или n имеет значение 1-3, и R2 представляет собой атом галогена, гидроксигруппу или C1-6 алкил или C1-6 алкокси, каждый из которых может независимо содержать любые 1-3 группы, выбранные из атома фтора, гидроксигруппы и амино, или его пролекарству, или его фармацевтически приемлемой соли;
[11] содержащему конденсированную кольцевую структуру производному, описанному выше в пункте [10], где n имеет значение 0, или n имеет значение 1-3, и R2 представляет собой атом галогена, или C1-6 алкил или C1-6 алкокси, каждый из которых может независимо содержать любые 1-3 группы, выбранные из атома фтора, гидроксигруппы и амино; и кольцо U представляет собой тиазольное кольцо или пиридиновое кольцо, или его пролекарству, или его фармацевтически приемлемой соли;
[12] содержащему конденсированную кольцевую структуру производному, описанному выше в любом из пунктов [1]-[11], где m имеет значение 0, или его пролекарству, или его фармацевтически приемлемой соли;
[13] содержащему конденсированную кольцевую структуру производному, описанному выше в любом из пунктов [1]-[12], где n имеет значение 0, или его пролекарству, или его фармацевтически приемлемой соли;
[14] содержащему конденсированную кольцевую структуру производному, описанному выше в пункте [10], где n имеет значение 1-3, и R2 представляет собой атом фтора, или его пролекарству, или его фармацевтически приемлемой соли;
[15] содержащему конденсированную кольцевую структуру производному, описанному выше в пункте [11], представленному формулой (Ib):
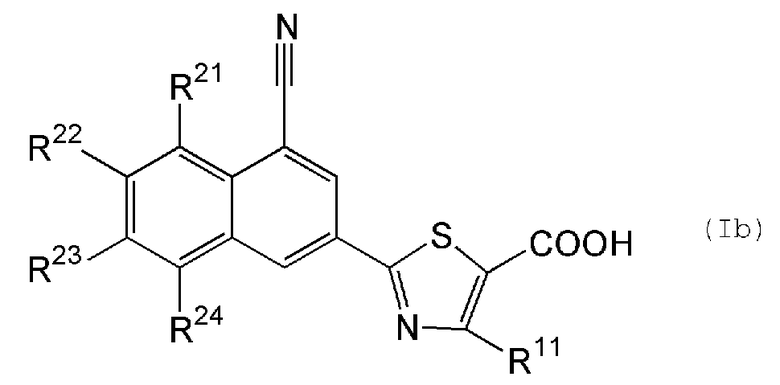 ,
,
где R21 представляет собой атом водорода, атом фтора или метильную группу; R22 представляет собой атом водорода или атом фтора; R23 представляет собой атом водорода, атом фтора или метильную группу; R24 представляет собой атом водорода или атом фтора; и R11 представляет собой атом водорода или метильную группу, или его пролекарству, или его фармацевтически приемлемой соли;
[16] содержащему конденсированную кольцевую структуру производному, описанному выше в любом из пунктов [1]-[15], которое является ингибитором ксантиноксидазы, или его пролекарству, или его фармацевтически приемлемой соли;
[17] фармацевтической композиции, включающей в качестве активного ингредиента содержащеее конденсированную кольцевую структуру производное, описанное выше в любом из пунктов [1]-[15], или его пролекарство, или его фармацевтически приемлемую соль;
[18] фармацевтической композиции, описанной выше в пункте [17], которая представляет собой средство для профилактики или лечения заболевания, выбранного из группы, включающей гиперурикемию, подагрический узел, подагрический артрит, почечное расстройство, связанное с гиперурикемией, и мочевые конкременты;
[19] фармацевтической композиции, описанной выше в пункте [18], которая представляет собой средство для профилактики или лечения гиперурикемии;
[20] фармацевтической композиции, описанной выше в пункте [17], которая представляет собой средство для снижения уровня мочевой кислоты в плазме;
[21] фармацевтической композиции, описанной выше в пункте [17], которая является ингибитором продукции мочевой кислоты; и т.п.
В настоящем изобретении каждый термин имеет следующее значение, если не указано иное.
Термин "атом галогена" означает атом фтора, атом хлора, атом брома или атом иода.
Термин "C1-6 алкил" означает линейную или разветвленную алкильную группу, содержащую 1-6 атомов углерода, и в качестве иллюстрации можно указать, например, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил и подобные.
Термин "C1-6 алкилен" означает двухвалентную группу, образованную из указанного выше C1-6 алкила.
Термин "C2-6 алкенил" означает линейную или разветвленную алкенильную группу, содержащую 2-6 атомов углерода, и в качестве иллюстрации можно указать винил, аллил, 1-пропенил, изопропенил и подобные.
Термин "C2-6 алкинил" означает линейную или разветвленную алкинильную группу, содержащую 2-6 атомов углерода, и в качестве иллюстрации можно указать этинил, 2-пропинил и подобные.
Термин "C1-6 алкокси" означает линейную или разветвленную алкоксигруппу, содержащую 1-6 атомов углерода, и в качестве иллюстрации можно указать метокси, этокси, пропокси, изопропокси и подобные.
Термин "C1-6 алкоксикарбонил" означает группу, представленную формулой (C1-6 алкокси)-C(O)-, и в качестве иллюстрации можно указать метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил и подобные.
Термин “C1-6 алкоксикарбонилокси” означает группу, представленную формулой (C1-6 алкокси)-C(O)O-.
Термин "C1-6 алкокси C1-6 алкил" означает указанный выше C1-6 алкил, замещенный указанным выше C1-6 алкокси.
Термин "C1-6 алкилсульфонил" означает группу, представленную формулой (C1-6 алкил)-SO2-, и в качестве иллюстрации можно указать метилсульфонил, этилсульфонил и подобные.
Термин "C1-6 алкилсульфониламино" означает группу, представленную формулой (C1-6 алкил)-SO2NH-, и в качестве иллюстрации можно указать метилсульфониламино, этилсульфониламино и подобные.
Термин "моно(ди)C1-6 алкилсульфамоил" означает сульфамоильную группу, моно- или ди-замещенную указанным выше C1-6 алкилом.
Термин "C2-7 ацил" означает группу, представленную формулой (C1-6 алкил)-C(O)-, и в качестве иллюстрации можно указать ацетил, пропионил, бутирил, изобутирил, пивалоил и подобные.
Термин "C1-6 алкилтио" означает группу, представленную формулой (C1-6 алкил)-S-.
Термин "моно(ди)C1-6 алкиламино" означает аминогруппу, моно- или ди-замещенную указанным выше C1-6 алкилом, термин "моно(ди)C1-6алкокси C1-6алкиламино" означает аминогруппу, моно- или ди-замещенную указанным выше C1-6 алкокси C1-6 алкилом, и термин "C1-6 алкокси C1-6 алкил(C1-6 алкил)амино" означает аминогруппу, замещенную указанным выше C1-6 алкокси C1-6 алкилом и указанным выше C1-6 алкилом.
Термин "C2-7 ациламино" означает группу, представленную формулой (C1-6 алкил)-C(O)NH-.
Термин "C1-6 алкоксикарбониламино" означает аминогруппу, замещенную указанным выше C1-6 алкоксикарбонилом, и термин “C1-6 алкоксикарбонил(C1-6 алкил)амино” означает аминогруппу, замещенную указанным выше C1-6 алкоксикарбонилом и указанным выше C1-6 алкилом.
Термин "моно(ди)C1-6 алкиламинокарбониламино" означает группу, представленную формулой (моно(ди)C1-6 алкиламино)-C(O)NH-.
Термин "моно(ди)C1-6 алкилкарбамоил" означает карбамоильную группу, моно- или ди-замещенную указанным выше C1-6 алкилом, термин "моно(ди)C1-6 алкокси C1-6 алкилкарбамоил" означает карбамоильную группу, моно- или ди-замещенную указанным выше C1-6 алкокси C1-6 алкилом, и термин "C1-6 алкокси C1-6 алкил(C1-6 алкил)карбамоил" означает карбамоильную группу, замещенную указанным выше C1-6 алкокси C1-6 алкилом и указанным выше C1-6 алкилом. Эти заместители могут быть отличными друг от друга в случае ди-замещения.
Термин "C3-8 циклоалкил" означает 3-8-членную насыщенную циклическую углеводородную группу, и в качестве иллюстрации можно указать циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил.
Термин "C5-8 циклоалкенил" означает 5-8-членную циклоалкенильную группу, и в качестве иллюстрации можно указать циклопропенил, циклобутенил, циклопентенил и подобные.
Термин “3-8-членный гетероциклоалкил” означает 3-8-членную гетероциклоалкильную группу, содержащую 1 или 2 гетероатома, выбранные из атома кислорода, атома серы и атома азота, в кольце, и в качестве иллюстрации можно указать азиридино, азетидино, морфолино, 2-морфолинил, тиоморфолино, 1-пирролидинил, пиперидино, 4-пиперидинил, 1-пиперазинил, 1-пирролил, тетрагидрофурил, тетрагидропиранил и подобные.
Термин “5-8-членный гетероциклоалкенил” означает 5-8-членную гетероциклоалкенильную группу, содержащую любые 1 или 2 гетероатома, выбранные из атома кислорода, атома серы и атома азота, в кольце, и в качестве иллюстрации можно указать 2,3-дигидрофурил, 2,5-дигидрофурил, 3,4-дигидро-2Н-пиран и подобные.
Термин "С6 арил" означает фенил.
Термин "С6 арилокси" означает группу, представленную формулой (С6 арил)-O-, и в качестве иллюстрации можно указать фенилокси и подобные.
Термин "С6 арилкарбонил" означает группу, представленную формулой (С6 арил)-C(O)-, и в качестве иллюстрации можно указать бензоил и подобные.
Термин "С6 ариламино" означает группу, представленную формулой (С6 арил)-NH-.
Термин "С6 арил(C1-6 алкил)амино" означает аминогруппу, замещенную указанным выше С6 арилом и указанным выше C1-6 алкилом.
Термин "5- или 6-членный гетероарил" означает 5- или 6-членную ароматическую гетероциклическую группу, содержащую любые 1-4 гетероатома, выбранные из атома кислорода, атома серы и атома азота, в кольце, и в качестве иллюстрации можно указать тиазолил, оксазолил, изотиазолил, изоксазолил, пиридил, пиримидил, пиразинил, пиридазинил, пирролил, фурил, тиенил, имидазолил, пиразолил, оксадиазолил, тиадиазолил, триазолил, тетразолил, фуразанил и подобные.
Термин "5- или 6-членный гетероарилокси" означает группу, представленную формулой (5- или 6-членный гетероарил)-O-.
Термин "5- или 6-членный гетероарилкарбонил" означает группу, представленную формулой (5- или 6-членный гетероарил)-C(O)-.
Термин "5- или 6-членный гетероариламино" означает группу, представленную формулой (5- или 6-членный гетероарил)-NH-.
Термин "5- или 6-членный гетероарил(C1-6 алкил)амино" означает аминогруппу, замещенную указанным выше 5- или 6-членным гетероарилом и указанным выше C1-6 алкилом.
Содержащее конденсированную кольцевую структуру производное, представленное формулой (I), по настоящему изобретению можно получить, например, способом, описанным ниже, или подобным ему способом или способом, описанным в литературных источниках, или подобным способом и т.п. Кроме того, когда необходима защитная группа, процедуры введения и удаления такой группы можно осуществить, необязательно, в сочетании в соответствии с общим способом.
Каждую реакцию также, необязательно, можно осуществить с использованием реакционной емкости с сопротивлением повышенному давлению.
[Способ синтеза 1]
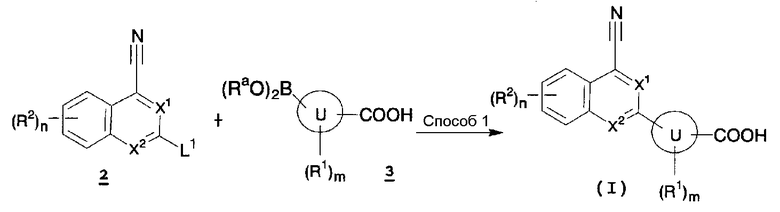
В указанной формуле Ll представляет собой удаляемую группу, такую как атом хлора, атом брома, атом иода, трифторметансульфонилоксигруппу или подобные, Ra представляет собой атом водорода или C1-6 алкил, при условии, что два Ra могут быть отличными друг от друга или оба Ra могут связываться вместе с образованием кольца, и X1, X2, кольцо U, m, n, R1 и R2 имеют значения, определенные выше.
Способ 1
Содержащее конденсированную кольцевую структуру производное (I) по настоящему изобретению также можно получить путем осуществления сочетания по методу Сузуки-Мияура соединения (2) и соединения (3) в инертном растворителе, в присутствии основания и палладиевого катализатора и, необязательно, удаления защитной группы. В качестве инертного растворителя можно указать в качестве иллюстрации бензол, толуол, ксилол, диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан, дихлорметан, 1,2-дихлорэтан, хлороформ, метанол, этанол, 2-пропанол, бутанол, N,N-диметилформамид, N-метилпирролидон, диметилсульфоксид, воду, растворитель, представляющий собой смесь вышеуказанных, и подобные. В качестве основания можно указать в качестве иллюстрации карбонат натрия, карбонат калия, карбонат цезия, гидроксид натрия, гидроксид калия, гидроксид лития, этоксид натрия, метоксид натрия, фторид калия, фторид цезия, триэтиламин, N,N-диизопропилэтиламин, пиридин, 2,6-лутидин, 1,8-диазабицикло[5,4,0]-7-ундецен и подобные. В качестве палладиевого катализатора можно указать в качестве иллюстрации тетракис(трифенилфосфин)палладий, дихлор-бис(трифенилфосфин)палладий, 1,1'-бис(дифенилфосфино)ферроцен-палладийдихлорид и подобные. Температура реакции обычно находится в пределах от 0°C до температуры кипения растворителя, и время реакции обычно составляет от 30 минут до 7 дней, варьируя в зависимости от используемого исходного вещества, растворителя и температуры реакции или подобных параметров.
Из содержащих конденсированную кольцевую структуру производных, представленных формулой (I), по настоящему изобретению, соединение (Ia), где X1 и X2 представляют собой CH, также можно получить, например, способом синтеза 2.
[Способ синтеза 2]
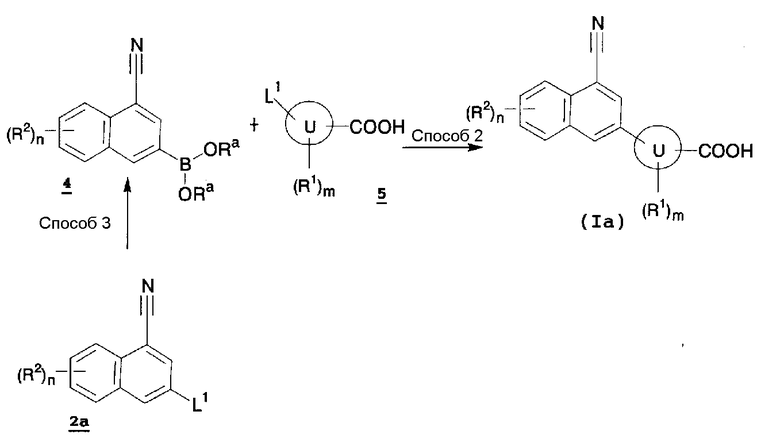
В указанной формуле L1, Ra, кольцо U, m, n, R1 и R2 имеют значения, определенные выше.
Способ 2
Содержащее конденсированную кольцевую структуру производное (Ia) по настоящему изобретению также можно получить путем осуществления реакции сочетания по методу Сузуки-Мияура соединения (4) и соединения (5) способом, аналогичным способу 1 и, необязательно, удаления защитной группы.
Способ 3
Соединение (4), используемое в описанном выше Способе 2, также можно получить путем осуществления взаимодействия соответствующего соединения (2а) с соответствующим реагентом на основе бороновой кислоты, в инертном растворителе, в присутствии основания и палладиевого катализатора, в присутствии или в отсутствие лиганда. В качестве инертного растворителя можно указать в качестве иллюстрации бензол, толуол, ксилол, N,N-диметилформамид, 1,2-диметоксиэтан, 1,4-диоксан, тетрагидрофуран, диметилсульфоксид, N-метилпирролидон, растворитель, представляющий собой смесь вышеуказанных, и подобные. В качестве основания можно указать в качестве иллюстрации триэтиламин, N,N-диизопропилэтиламин, пиридин, 2,6-лутидин, карбонат натрия, карбонат калия, карбонат цезия, ацетат калия, ацетат натрия, и подобные. В качестве палладиевого катализатора можно указать в качестве иллюстрации ацетат палладия, тетракис(трифенилфосфин)палладий, дихлор-бис(трифенилфосфин)палладий, 1,1'-бис(дифенилфосфино)ферроцен-палладийдихлорид и подобные. В качестве лиганда можно указать в качестве иллюстрации бис(дифенилфосфино)ферроцен, трициклогексилфосфин, 2-(дициклогексилфосфино)бифенил и подобные. В качестве реагента на основе бороновой кислоты можно указать в качестве иллюстрации пинаколборан, катехолборан, бис(пинаколат)дибор и подобные. Температура реакции обычно находится в пределах от 0°C до температуры кипения растворителя, и время реакции обычно составляет от 30 минут до 7 дней, варьируя в зависимости от используемого исходного вещества, растворителя и температуры реакции или подобных параметров.
В Способе 3, когда L1 представляет собой атом брома или атом иода, Соединение (4) также можно получить путем обработки соединения (2a) металлоорганическим реагентом и осуществления его взаимодействия с боратным сложным эфиром в инертном растворителе. В качестве инертного растворителя можно указать в качестве иллюстрации диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан, диоксан, бензол, толуол, гексан, растворитель, представляющий собой смесь вышеуказанных, и подобные. В качестве металлоорганического реагента можно указать в качестве иллюстрации изопропилмагнийбромид, фенилмагнийбромид, н-бутиллитий, втор-бутиллитий, трет-бутиллитий и подобные. В качестве боронатного сложного эфира можно указать в качестве иллюстрации триметилборат, триэтилборат, триизопропилборат, трибутилборат, триизопропилборат, трис(триметилсилил)борат и подобные. Температура реакции обычно находится в пределах от -78°C до температуры кипения растворителя, и время реакции обычно составляет от 30 минут до 7 дней, варьируя в зависимости от используемого исходного вещества, растворителя и температуры реакции или подобных параметров.
Из соединений, представленных Соединением (2), Соединение (2b), где X1 и X2 представляют собой CH, и L1 представляет собой атом хлора, атом брома или атом иода, также можно получить, например, способом синтеза 3.
[Способ синтеза 3]
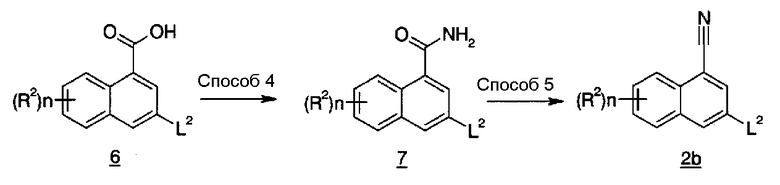
В указанной формуле L2 представляет собой атом хлора, атом брома или атом иода, n и R2 имеют значения, определенные выше.
Способ 4
Соединение (7) можно получить, подвергая Соединение (6) и аммиак реакции амидирования, необязательно, с использованием добавки, такой как 1-гидроксибензотриазол или подобные, в инертном растворителе, в присутствии агента конденсации, в присутствии или в отсутствие основания. В качестве инертного растворителя можно указать в качестве иллюстрации тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан, бензол, толуол, ксилол, дихлорметан, 1,2-дихлорэтан, хлороформ, растворитель, представляющий собой смесь вышеуказанных, и подобные. В качестве агента конденсации можно указать в качестве иллюстрации уксусный ангидрид, тионилхлорид, оксалилхлорид, N,N'-карбонилдиимидазол, N,N-дициклогексилкарбодиимид, диизопропилкарбодиимид, N-этил-N'-3-диметиламинопропилкарбодиимид и его гидрохлоридную соль, дифенилфосфорилазид и подобные. В качестве основания можно указать в качестве иллюстрации триэтиламин, N,N-диизопропилэтиламин, пиридин, 2,6-лутидин и подобные. Температура реакции обычно находится в пределах от 0°C до температуры кипения растворителя, и время реакции обычно составляет от 30 минут до 7 дней, варьируя в зависимости от используемого исходного вещества, растворителя и температуры реакции или подобных параметров.
Способ 5
Соединение (2b) можно получить путем обработки соединения (7) в инертном растворителе в присутствии агента дегидратации, в присутствии или в отсутствие основания. В качестве инертного растворителя можно указать в качестве иллюстрации тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан, N,N-диметилформамид, ацетонитрил, бензол, толуол, ксилол, дихлорметан, 1,2-дихлорэтан, хлороформ, растворитель, представляющий собой смесь вышеуказанных, и подобные. В качестве агента дегидратации можно указать в качестве иллюстрации уксусный ангидрид, трифторуксусный ангидрид, тионилхлорид, фосфорилхлорид, метансульфонилимидазол, п-толуолсульфонилхлорид, N,N'-дициклогексилкарбодиимид, дифосфорпентахлорид, трифосген и подобные. В качестве основания можно указать в качестве иллюстрации триэтиламин, N,N'-диизопропилэтиламин, пиридин, 2,6-лутидин и подобные. Температура реакции обычно находится в пределах от 0°C до температуры кипения растворителя, и время реакции обычно составляет от 30 минут до 7 дней, варьируя в зависимости от используемого исходного вещества, растворителя и температуры реакции или подобных параметров.
Также указанное выше Соединение (Ia) по настоящему изобретению также можно получить, например, способом синтеза 4.
[Способ синтеза 4]
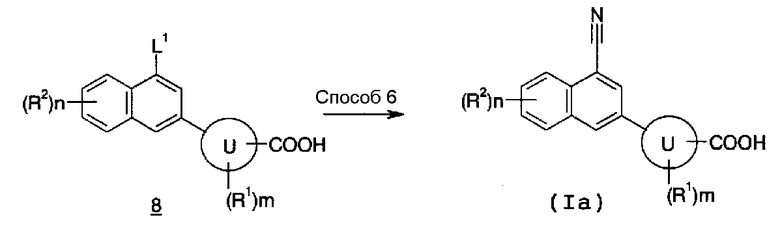
В указанной формуле L1, кольцо U, m, n, R1 и R2 имеют значения, определенные выше.
Способ 6
Содержащее конденсированную кольцевую структуру производное (Ia) по настоящему изобретению также можно получить путем осуществления взаимодействия Соединения (8) с реагентом цианирования в инертном растворителе, в присутствии или в отсутствие основания, в присутствии или в отсутствие палладиевого катализатора, и, необязательно, удаления защитной группы. В качестве инертного растворителя можно указать в качестве иллюстрации бензол, толуол, ксилол, диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан, метанол, этанол, 2-пропанол, бутанол, этиленгликоль, N,N-диметилформамид, N,N-диметилацетамид, N-метилпирролидон, диметилсульфоксид, гексаметилфосфориламид, воду, растворитель, представляющий собой смесь вышеуказанных, и подобные. В качестве основания можно указать в качестве иллюстрации карбонат натрия, карбонат калия, карбонат цезия, гидроксид натрия, гидроксид калия, гидроксид лития, этоксид натрия, метоксид натрия, фторид калия, фторид цезия, триэтиламин, N,N-диизопропилэтиламин, пиридин, 2,6-лутидин, 1,8-диаза-бицикло[5,4,0]-7-ундецен и подобные. В качестве палладиевого катализатора можно указать в качестве иллюстрации тетракис(трифенилфосфин)палладий, дихлорбис(трифенилфосфин)палладий, 1,1'-бис(дифенилфосфино)ферроцен-палладий дихлорид, ацетат палладия, трифторацетат палладия и подобные. В качестве реагента цианирования можно указать в качестве иллюстрации цианид меди, цианид натрия, цианид калия, цианид цинка, триметилсилилцианид, ферроцианид калия и подобные. Температура реакции обычно находится в пределах от 0°C до температуры кипения растворителя, и время реакции обычно составляет от 30 минут до 7 дней, варьируя в зависимости от используемого исходного вещества, растворителя и температуры реакции или подобных параметров.
В Соединении (8), Соединение (8a), где L1 представляет собой атом хлора, атом брома или атом иода, кольцо U представляет собой тиазольное кольцо, m имеет значение 1, и R1 представляет собой C1-6 алкил, также можно получить, например, способом синтеза 5.
[Способ синтеза 5]
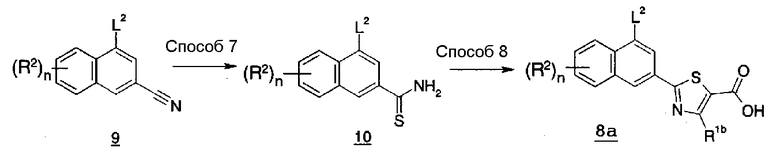
В указанной формуле R1b представляет собой C1-6 алкил, L2, n и R2 имеют значения, определенные выше.
Способ 7
Соединение (10) также можно получить путем взаимодействия Соединения (9) с тиоацетамидом в инертном растворителе в кислотных условиях. В качестве инертного растворителя можно указать в качестве иллюстрации тетрагидрофуран, диметоксиэтан, 1,4-диоксан, N,N-диметилформамид, N-метилпирролидон, бензол, толуол, ксилол, растворитель, представляющий собой смесь вышеуказанных, и подобные. Температура реакции обычно находится в пределах от 0°C до температуры кипения растворителя, и время реакции обычно составляет от 30 минут до 7 дней, варьируя в зависимости от используемого исходного вещества, растворителя и температуры реакции или подобных параметров.
Способ 8
Соединение (8a) также можно получить путем взаимодействия Соединения (10) с производным 2-хлор-3-оксомасляной кислоты в инертном растворителе и, необязательно, удаления защитной группы. В качестве инертного растворителя можно указать в качестве иллюстрации метанол, этанол, н-бутанол, изопропанол, N,N-диметилформамид, тетрагидрофуран, бензол, толуол и подобные. Температура обычно находится в пределах от 0°C до температуры кипения растворителя, и время реакции обычно составляет от 30 минут до 7 дней, варьируя в зависимости от используемого исходного вещества, растворителя и температуры реакции или подобных параметров.
В Соединении (8), Соединение (8b), где кольцо U представляет собой тиазольное кольцо, m имеет значение 1, R1 представляет собой C1-6 алкил и L2 представляет собой трифторметансульфонилоксигруппу, также можно получить, например, способом синтеза 6.
[Способ синтеза 6]
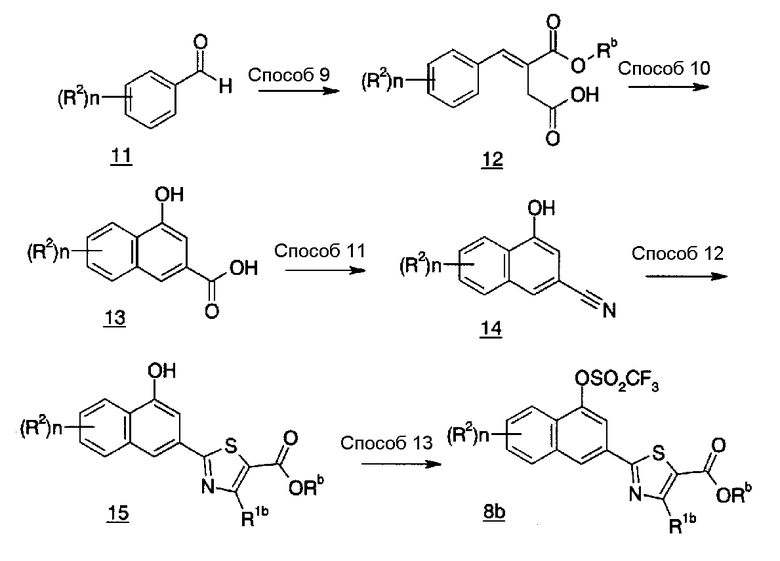
В указанной формуле Rb представляет собой C1-6 алкил, R1b, n и R2 имеют значения, определенные выше.
Способ 9
Соединение (12) также можно получить, подвергая Соединение (11) конденсации с реагентом Хорнера-Вадсворта-Эммонса, таким как 1-этил-4-трет-бутил-2-диэтилфосфоносукцинат или подобные, и затем удаляя защитную группу, или подвергая Соединение (11) конденсации с диэтилсукцинатом в инертном растворителе, в присутствии основания. В качестве инертного растворителя можно указать в качестве иллюстрации бензол, толуол, ксилол, диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан, N,N-диметилформамид, N-метилпирролидон, метанол, этанол, растворитель, представляющий собой смесь вышеуказанных, и подобные. В качестве основания можно указать в качестве иллюстрации гидрид натрия, трет-бутоксид калия, метоксид натрия, этоксид натрия и подобные. Температура реакции обычно находится в пределах от 0°C до температуры кипения растворителя, и время реакции обычно составляет от 30 минут до 7 дней, варьируя в зависимости от используемого исходного вещества, растворителя и температуры реакции или подобных параметров.
Способ 10
Соединение (13) также можно получить путем взаимодействия Соединения (12) в подходящем растворителе в присутствии агента дегидратации, или в растворителе, таком как ангидрид кислоты, в присутствии или в отсутствие основания, и, необязательно, с последующей гидролизацией. В качестве подходящего растворителя можно указать в качестве иллюстрации, например, уксусную кислоту, серную кислоту, фосфорную кислоту, тетрагидрофуран, N,N-диметилформамид, N-метилпирролидон, бензол, толуол, ксилол, 1,4-диоксан, воду, растворитель, представляющий собой смесь вышеуказанных, и подобные. В качестве агента дегидратации можно указать в качестве иллюстрации уксусный ангидрид, трифторуксусный ангидрид, метилхлороформиат, этилхлороформиат и подобные. В качестве растворителя, выбранного из ангидрида кислоты, можно указать в качестве иллюстрации уксусный ангидрид, трифторуксусный ангидрид и подобные. В качестве основания можно указать в качестве иллюстрации ацетат натрия, ацетат калия и подобные. Температура реакции обычно находится в пределах от комнатной температуры до температуры кипения растворителя, и время реакции обычно составляет от 30 минут до 7 дней, варьируя в зависимости от используемого исходного вещества, растворителя и температуры реакции или подобных параметров. В качестве инертного растворителя, используемого при гидролизации, можно указать в качестве иллюстрации метанол, этанол, изопропанол, тетрагидрофуран, N,N-диметилформамид, N-метилпирролидон, диметоксиэтан, воду и растворитель, представляющий собой смесь вышеуказанных. В качестве основания, используемого при гидролизации, можно указать в качестве иллюстрации гидроксид натрия, гидроксид калия и гидроксид лития. Температура реакции обычно находится в пределах от комнатной температуры до температуры кипения растворителя, и время реакции обычно составляет от 30 минут до 7 дней, варьируя в зависимости от используемого исходного вещества, растворителя и температуры реакции или подобных параметров.
Способ 11
Соединение (14) также можно получить, подвергая Соединение (13) цианированию способом, аналогичным описанному выше в Способах 4 и 5.
Способ 12
Соединение (15) также можно получить путем взаимодействия Соединения (14) способом, аналогичным описанному выше в Способах 7 и 8.
Способ 13
Соединение (8b) можно получить путем взаимодействия Соединения (15) с трифторметансульфоновым ангидридом в инертном растворителе, в присутствии основания. В качестве инертного растворителя можно указать в качестве иллюстрации дихлорметан, дихлорэтан, хлороформ, этилацетат, тетрагидрофуран, N,N-диметилформамид, N-метилпирролидон, бензол, толуол, ксилол, 1,4-диоксан и подобные. В качестве основания можно указать в качестве иллюстрации триэтиламин, N,N-диизопропилэтиламин, пиридин, 2,6-лутидин, 1,8-диазабицикло[5,4,0]-7-ундецен и подобные. Температура реакции обычно находится в пределах от 0°C до температуры кипения растворителя, и время реакции обычно составляет от 30 минут до 7 дней, варьируя в зависимости от используемого исходного вещества, растворителя и температуры реакции или подобных параметров.
В качестве защитных групп для использования в настоящем изобретении можно использовать различные защитные группы, которые обычно используют в органических реакциях. Например, в качестве защитных групп для гидроксигруппы, помимо п-метоксибензильной группы, можно указать в качестве иллюстрации бензильную группу, метоксиметильную группу, ацетильную группу, пивалоильную группу, бензоильную группу, трет-бутилдиметилсилильную группу, трет-бутилдифенилсилильную группу, аллильную группу и подобные, и когда две гидроксигруппы являются смежными, можно указать в качестве иллюстрации изопропилиденовую группу, циклопентилиденовую группу, циклогексилиденовую группу и подобные. В качестве защитных групп для группы тиола можно указать в качестве иллюстрации п-метоксибензильную группу, бензильную группу, ацетильную группу, пивалоильную группу, бензоильную группу, бензилоксикарбонильную группу и подобные. В качестве защитных групп для аминогруппы можно указать в качестве иллюстрации бензилоксикарбонильную группу, трет-бутоксикарбонильную группу, бензильную группу, п-метоксибензильную группу, трифторацетильную группу, ацетильную группу, фталоильную группу и подобные. В качестве защитных групп для карбоксигруппы можно указать в качестве иллюстрации C1-6 алкильную группу, бензильную группу, трет-бутилдиметилсилильную группу, аллильную группу и подобные.
Соединение, представленное формулой (I), по настоящему изобретению может быть выделено или очищено традиционными способами выделения, такими как фракционная перекристаллизация, очистка методом хроматографии, экстракция растворителем, твердофазная экстракция и подобные.
Содержащее конденсированную кольцевую структуру производное, представленное формулой (I), по настоящему изобретению может быть преобразовано в его фармацевтически приемлемые соли обычным способом. В качестве такой соли можно указать в качестве иллюстрации кислотно-аддитивную соль с неорганической кислотой, такой как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и подобные, кислотно-аддитивную соль с органической кислотой, такой как муравьиная кислота, уксусная кислота, метансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, пропионовая кислота, лимонная кислота, янтарная кислота, винная кислота, фумаровая кислота, масляная кислота, щавелевая кислота, малоновая кислота, малеиновая кислота, молочная кислота, яблочная кислота, угольная кислота, бензойная кислота, глутаминовая кислота, аспарагиновая кислота и подобные, неорганическую соль, такую как соль натрия, соль калия, соль кальция, соль магния, соль цинка, соль лития, соль алюминия и подобные, соль с органическим амином, таким как N-метил-D-глюкамин, N,N'-дибензилэтилендиамин, 2-аминоэтанол, трис(гидроксиметил)аминометан, аргинин, лизин, пиперазин, холин, диэтиламин, 4-фенилциклогексан и подобные.
Из содержащих конденсированную кольцевую структуру производных, представленных формулой (I), по настоящему изобретению в соединении, содержащем ненасыщенную связь, присутствуют два геометрических изомера, соединение цис (Z) формы и соединение транс (E) формы. В настоящем изобретении можно использовать любые соединения, и их смесь также можно использовать.
Из содержащих конденсированную кольцевую структуру производных, представленных формулой (I), по настоящему изобретению в соединении, содержащем хиральный атом углерода, присутствуют соединение R конфигурации и соединение S конфигурации для каждого хирального углерода. В настоящем изобретении можно использовать любые из оптических изомеров, и смесь оптических изомеров также можно использовать.
В содержащих конденсированную кольцевую структуру производных, представленных формулой (I), по настоящему изобретению могут присутствовать некоторые таутомеры, соединения по настоящему изобретению также включают эти таутомеры.
В настоящем изобретении термин "пролекарство" означает соединение, которое должно преобразовываться в соединение, представленное формулой (I), в организме. Пролекарство соединения, представленного формулой (I), по настоящему изобретению можно получить путем введения подходящей группы, образующей пролекарство, в любую одну или несколько групп, выбранных из гидроксигруппы, аминогруппы, карбоксигруппы и других групп, которые могут образовывать пролекарство соединения, представленного формулой (I), с использованием соответствующего реагента с получением пролекарства, такого как галогенид соединения или подобные, обычным путем, с последующим подходящим выделением и очисткой обычным путем, как это необходимо в конкретном случае. См. Gekkan-Yakuji iyakuhin tekiseisiyou no tameno rinsyou yakubutsudoutai (monthly pharmaceutical, clinical pharmacokinetics for the proper use of pharmaceutical products), 2000,3. extra edition, Vol.42, No.4, pp.669-707, и New Drug delivery system, published by CMC Co., Ltd., 2000,1,31., pp.67-173. В качестве группы, образующей пролекарство, используемой в гидроксигруппе или аминогруппе, в качестве иллюстрации можно указать, например, C1-6 алкил-CO-, такой как ацетил, пропионил, бутирил, изобутирил, пивалоил и подобные; C6 арил-CO-, такой как бензоил и подобные; C1-6 алкил-O-C1-6 алкилен-CO-; C1-6 алкил-OCO-C1-6 алкилен-CO; C1-6 алкил-OCO-, такой как метилоксикарбонил, этилоксикарбонил, пропилоксикарбонил, изопропилоксикарбонил, трет-бутилоксикарбонил и подобные; C1-6 алкил-O-C1-6 алкилен-OCO-; C1-6 алкил-COO-C1-6 алкилен, такой как ацетилоксиметил, пивалоилоксиметил, 1-(ацетилокси)этил, 1-(пивалоилокси)этил и подобные; C1-6 алкил-OCOO-C1-6 алкилен, такой как метоксикарбонилоксиметил, 1-(метоксикарбонилокси)этил, этоксикарбонилоксиметил, 1-(этоксикарбонилокси)этил, изопропилоксикарбонилоксиметил, 1-(изопропилоксикарбонилокси)этил, трет-бутилоксикарбонилоксиметил, 1-(трет-бутилоксикарбонилокси)этил и подобные; C3-8 циклоалкил-OCOO-C1-6 алкилен, такой как циклогексилоксикарбонилоксиметил, 1-(циклогексилоксикарбонил)этил и подобные; сложный эфир или амид с аминокислотой, такой как глицин и подобные; и т.п.
В качестве группы, образующей пролекарство, используемой в карбоксигруппе, в качестве иллюстрации можно указать, например, C1-6 алкил, такой как метил, этил, пропил, изопропил, бутил, трет-бутил и подобные; C1-6 алкил-COO-C1-6 алкилен, такой как пивалоилоксиметил, ацетилоксиметил, 1-(пивалоилокси)этил, 1-(ацетилокси)этил и подобные; C1-6 алкил-OCOO-C1-6 алкилен, такой как этилоксикарбонилоксиметил, 1-(этилоксикарбонилокси)этил, изопропилоксикарбонилоксиметил, 1-(изопропилоксикарбонилокси)этил, трет-бутилоксикарбонилоксиметил, 1-(трет-бутилоксикарбонилокси)этил и подобные; C3-8 циклоалкил-OCOO-C1-6 алкилен, такой как циклогексилоксикарбонилметил, 1-(циклогексилоксикарбонил)этил и подобные; и т.п.
В настоящем изобретении фармацевтически приемлемая соль включает ее сольват с фармацевтически приемлемым растворителем, таким как вода, этанол или подобные.
Фармацевтическая композиция по настоящему изобретению является полезной в качестве средства для профилактики или лечения заболеваний, связанных с высокими уровнями мочевой кислоты в крови, таких как гиперурикемия, подагрический узел, подагрический артрит, почечное расстройство, связанное с гиперурикемией, мочевые конкременты или подобные, особенно для гиперурикемии.
При практическом использовании фармацевтической композиции по настоящему изобретению для профилактики или лечения дозу соединения, представленного формулой (I), или его пролекарства, или его фармацевтически приемлемой соли в качестве активного ингредиента подходящим образом определяют в зависимости от возраста, пола, массы тела, степени расстройств и лечения каждого пациента и т.п., например, она находится приблизительно в пределах от 1 до 2000 мг в сутки в расчете на взрослого человека в случае перорального введения, и суточную дозу можно разделить и вводить в виде одной-нескольких доз в сутки.
При практическом использовании фармацевтической композиции по настоящему изобретению для профилактики или лечения используют различные лекарственные формы перорально или парентерально, в зависимости от их применений, например, предпочтительными являются композиции для перорального введения, такие как порошки, тонкодисперсные гранулы, гранулы, таблетки, капсулы, сухие сиропы или подобные.
Эти фармацевтические композиции можно получить в зависимости от их препаратов, необязательно, путем смешивания с использованием подходящей фармацевтической добавки, такой как эксципиенты, разрыхлители, связующие, смазывающие вещества и подобные, в соответствии с традиционными фармацевтическими способами, и формулирования смеси в соответствии с традиционными способами.
Например, порошки можно сформулировать, если это желательно, путем тщательного смешивания активного ингредиента с подходящими эксципиентами, смазывающими веществами и подобными. Например, таблетки можно сформулировать путем таблетирования активного ингредиента с подходящими эксципиентами, разрыхлителями, связующими, смазывающими веществами и подобными в соответствии с традиционными способами, затем, если это желательно, на них можно нанести подходящее покрытие с получением таблеток с пленочным покрытием, таблеток с сахарным покрытием, таблеток с энтеросолюбильным покрытием и подобных. Например, капсулы можно сформулировать путем тщательного смешивания активного ингредиента с подходящими эксципиентами, смазывающими веществами и подобными, или путем формулирования тонкодисперсных гранул, в соответствии с традиционными способами, и заполнения ими подходящих капсул. Кроме того, в случае такого лекарственного средства для перорального введения, его также можно сформулировать с получением композиции быстрого высвобождения или замедленного высвобождения, в зависимости от способов профилактики или лечения.
Соединение, представленное формулой (I), по настоящему изобретению или его пролекарство, или его фармацевтически приемлемую соль можно использовать также в сочетании с любым другим лекарственным средством для лечения гиперурикемии или лекарственным средством для лечения подагры. В качестве лекарственного средства для лечения гиперурикемии, которое можно использовать в настоящем изобретении, в качестве иллюстрации можно указать, например, подщелачиватели мочи, такие как гидрокарбонат натрия, цитрат калия, цитрат натрия и подобные. Кроме того, в качестве лекарственного средства для лечения подагры в качестве иллюстрации можно указать колхицин или нестероидные противовоспалительные лекарственные средства, такие как индометацин, напроксен, фенбуфер, пранопрофен, оксапрозин, кетопрофен, эторикоксиб, теноксикам и подобные, и стероиды и подобные средства. В настоящем изобретении активный ингредиент по настоящему изобретению также можно использовать в сочетании с, по меньшей мере, одним из этих лекарственных средств, и фармацевтическая композиция, включающая сочетание с, по меньшей мере, одним из этих лекарственных средств, включает любые лекарственные формы, включающие не только единый препарат вместе с активным ингредиентом по настоящему изобретению, но также комбинированный препарат, состоящий из фармацевтической композиции, включающей активный ингредиент по настоящему изобретению, и отдельно полученную фармацевтическую композицию, для одновременного введения или введения с различными интервалами дозирования. Кроме того, при использовании в сочетании с любым лекарственным средством, отличным от активного ингредиента по настоящему изобретению, дозу содержащего конденсированную кольцевую структуру производного по настоящему изобретению можно уменьшить в зависимости от дозы другого лекарственного средства, используемого в сочетании, как это требуется для данного конкретного случая, можно достичь благоприятного эффекта, большего, чем аддитивный эффект, в профилактике или лечении указанных выше заболеваний, или можно избежать или уменьшить неблагоприятный эффект другого лекарственного средства, используемого в сочетании.
Эффект настоящего изобретения
Содержащие конденсированную кольцевую структуру производные, представленные формулой (I), по настоящему изобретению проявляют отличную ингибирующую активность в отношении ксантиноксидазы и подавляют продукцию мочевой кислоты. Кроме того, предпочтительное соединение по настоящему изобретению также может проявлять отличную ингибирующую активность в отношении URAT1 и усиливать экскрецию мочевой кислоты. Поэтому содержащие конденсированную кольцевую структуру производные, представленные формулой (I), по настоящему изобретению или их пролекарства, или их фармацевтически приемлемые соли могут существенным образом подавлять повышение уровней мочевой кислоты в сыворотке и являются полезными в качестве средства для профилактики или лечения заболеваний, связанных с аномальным уровнем мочевой кислоты в сыворотке, таких как гиперурикемия или подобные.
Лучший способ осуществления настоящего изобретения
Настоящее изобретение далее более подробно проиллюстрировано представленными ниже Ссылочными Примерами, Примерами и Примерами испытаний. Однако настоящее изобретение не ограничивается ими.
Ссылочный Пример 1
3-Бромнафталин-1-карбонитрил
К раствору 3-бромнафталин-1-карбоновой кислоты (0,30 г) в тетрагидрофуране (3 мл) добавляли 1,1'-карбонилдиимидазол (0,29 г) при охлаждении льдом и смесь перемешивали при комнатной температуре в течение 2 часов. К этой реакционной смеси добавляли аммиачную воду (1,0 мл, 28% водный раствор) и смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли воду и смесь перемешивали при комнатной температуре в течение 15 минут. Осажденное твердое вещество собирали фильтрованием. Полученное твердое вещество промывали водой и 1 моль/л хлористоводородной кислоты и сушили с получением амида 3-бромнафталин-1-карбоновой кислоты (0,28 г).
К раствору полученного соединения (0,27 г) в дихлорметане (5 мл) добавляли триэтиламин (0,44 г) и трифторуксусный ангидрид (0,47 г) при охлаждении льдом и смесь перемешивали при комнатной температуре в течение 6 часов. К реакционной смеси добавляли метанол и смесь концентрировали при пониженном давлении. Полученное твердое вещество собирали фильтрованием, промывали водой и н-гексаном и сушили с получением указанного в заголовке соединения (0,22 г).
Ссылочный Пример 2
4-Циано-2-нафталинбороновая кислота
К раствору 3-бромнафталин-1-карбонитрила (0,69 г) и триизопропилбората (0,89 г) в тетрагидрофуране (10 мл) добавляли н-бутиллитий (1,6 мл, 2,63 моль/л раствор в гептане) при -78°C в атмосфере аргона. После нагревания до комнатной температуры смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония при комнатной температуре и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония и насыщенным солевым раствором, сушили над сульфатом магния и концентрировали. Остаток суспендировали в н-гексане и твердое вещество собирали фильтрованием. Полученное твердое вещество суспендировали в воде. Суспензию подкисляли хлористоводородной кислотой и смесь перемешивали в течение 30 минут. Твердое вещество собирали фильтрованием, промывали водой и сушили при пониженном давлении с получением указанного в заголовке соединения (0,49 г).
Ссылочный Пример 3
2-Хлорхинолин-4-карбонитрил
Указанное в заголовке соединение получали способом, аналогичным описанному в Ссылочном Примере 1, с использованием 2-хлорхинолин-4-карбоновой кислоты вместо 3-бромнафталин-1-карбоновой кислоты.
Ссылочный Пример 4
Этиловый эфир 2-(4-бромнафталин-2-ил)-4-метилтиазол-5-карбоновой кислоты
К раствору 4-бромнафталин-2-карбонитрила (0,57 г) в N,N-диметилформамиде (4 мл) и растворе 4 моль/л HC1 в 1,4-диоксане (4 мл) добавляли тиоацетамид (1,1 г) при комнатной температуре и реакционную смесь перемешивали при 70°C в течение ночи. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и концентрировали. Остаток очищали колоночной хроматографией на силикагеле с получением 4-бромнафталин-2-карботиоамида (0,48 г). К суспензии этого соединения (0,48 г) в этаноле (6 мл) добавляли этил 2-хлор-ацетоацетат (0,59 г) и смесь перемешивали при 65°C в течение 24 часов. После охлаждения до комнатной температуры осажденное твердое вещество собирали фильтрованием, промывали этанолом и сушили с получением указанного в заголовке соединения (0,41 г).
Ссылочный Пример 5
4-Гидрокси-6-метилнафталин-2-карбоновая кислота
К раствору 4-метилбензальдегида (0,70 г) и диметилсукцината (0,95 г) в тетрагидрофуране (15 мл) добавляли трет-бутоксид калия (0,73 г) при комнатной температуре и реакционную смесь перемешивали в течение ночи. К реакционной смеси добавляли воду и диэтиловый эфир и два слоя разделяли. Водный слой подкисляли при помощи 1 моль/л хлористоводородной кислоты и полученную смесь экстрагировали диэтиловым эфиром. Этот органический слой промывали насыщенным водным раствором карбоната натрия. Водный слой подкисляли при помощи 1 моль/л хлористоводородной кислоты и смесь экстрагировали диэтиловым эфиром. Органический слой сушили над сульфатом магния и концентрировали. К остатку добавляли уксусную кислоту (5 мл), уксусный ангидрид (5 мл) и ацетат натрия (3,0 г) и смесь нагревали при температуре кипения с обратным холодильником в течение 6 часов. После охлаждения до комнатной температуры реакционную смесь выливали в воду. Полученную смесь экстрагировали диэтиловым эфиром. Органический слой промывали водой и насыщенным водным раствором гидрокарбоната натрия и концентрировали. К полученному остатку добавляли метанол (20 мл) и 1 моль/л водный раствор гидроксида натрия (20 мл) и смесь нагревали при температуре кипения с обратным холодильником в течение 5 часов. После охлаждения реакционной смеси до комнатной температуры метанол удаляли при пониженном давлении. Полученный раствор подкисляли при помощи 2 моль/л хлористоводородной кислоты и полученную смесь экстрагировали этилацетатом. Органический слой промывали водой, сушили над сульфатом магния и концентрировали с получением указанного в заголовке соединения (0,20 г).
Ссылочный Пример 6
4-Гидрокси-6-метилнафталин-2-карбонитрил
Указанное в заголовке соединение получали способом, аналогичным описанному в Ссылочном Примере 1, с использованием 4-гидрокси-6-метилнафталин-2-карбоновой кислоты (0,20 г) вместо 3-бромнафталин-1-карбоновой кислоты.
Ссылочный Пример 7
Этиловый эфир 2-(4-гидрокси-6-метилнафталин-2-ил)-4-метилтиазол-5-карбоновой кислоты
Указанное в заголовке соединение получали способом, аналогичным описанному в Ссылочном Примере 4, с использованием 4-гидрокси-6-метилнафталин-2-карбонитрила вместо 4-бромнафталин-2-карбонитрила.
Ссылочный Пример 8
Этиловый эфир 2-(6-хлор-4-гидроксинафталин-2-ил)-4-метилтиазол-5-карбоновой кислоты
Указанное в заголовке соединение получали способом, аналогичным описанному в Ссылочном Примере 4, с использованием 6-хлор-4-гидроксинафталин-2-карбонитрила вместо 4-бромнафталин-2-карбонитрила.
Ссылочный Пример 9
8-Бром-4-гидрокси-7-метилнафталин-2-карбоновая кислота
Указанное в заголовке соединение получали способом, аналогичным описанному в Ссылочном Примере 5, с использованием соответствующего исходного вещества.
Ссылочный Пример 10
4-Гидрокси-7-метилнафталин-2-карбоновая кислота
К раствору 8-бром-4-гидрокси-7-метилнафталин-2-карбоновой кислоты (0,45 г) в этаноле (8 мл) добавляли палладий на углероде (180 мг) 3 порциями и смесь перемешивали при комнатной температуре в течение 2 дней в атмосфере водорода. Нерастворимое вещество удаляли фильтрованием через слой целита и фильтрат концентрировали с получением указанного в заголовке соединения (0,32 г).
Ссылочный Пример 11
Этиловый эфир 2-(4-гидрокси-7-метилнафталин-2-ил)-4-метилтиазол-5-карбоновой кислоты
Указанное в заголовке соединение получали способом, аналогичным описанному в Ссылочном Примере 8, с использованием соответствующего исходного вещества.
Ссылочный Пример 12
Метиловый эфир 4-ацетокси-8-бром-5-фторнафталин-2-карбоновой кислоты
К раствору диметилсукцината (4,6 г) в толуоле (3,5 мл) добавляли метоксид натрия (28% раствор в метаноле, 2,9 мл) при комнатной температуре и смесь перемешивали при 70°C в атмосфере аргона. К этой реакционной смеси добавляли по каплям раствор 2-бром-5-фторбензальдегида (3,0 г) в толуоле (6,5 мл) и смесь перемешивали при 85°C в течение 5 часов. После охлаждения реакционной смеси до комнатной температуры к смеси добавляли диэтиловый эфир и смесь выливали в воду. Водный слой отделяли и органический слой промывали водой. Объединенный водный слой подкисляли при помощи 2 моль/л хлористоводородной кислоты и полученную смесь экстрагировали диэтиловым эфиром. Органический слой промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали. К остатку добавляли уксусный ангидрид (10 мл) и ацетат натрия (3,7 г) и смесь перемешивали при 140°C в течение ночи. После охлаждения реакционной смеси до комнатной температуры к смеси добавляли толуол (20 мл) и смесь концентрировали при пониженном давлении. К остатку добавляли 2 моль/л хлористоводородной кислоты и полученную смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (элюент: этилацетат/н-гексан) с получением указанного в заголовке соединения.
Ссылочный Пример 13
Метиловый эфир 4-ацетокси-5-фторнафталин-2-карбоновой кислоты
К раствору метилового эфира 4-ацетокси-8-бром-5-фторнафталин-2-карбоновой кислоты (2,0 г) и триэтиламина (0,72 г) в этилацетате (60 мл) добавляли палладий на углероде (600 мг) при комнатной температуре и смесь перемешивали в течение 1 часа при указанной температуре в атмосфере водорода. Нерастворимое вещество удаляли фильтрованием через слой целита и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: этилацетат/н-гексан) с получением указанного в заголовке соединения.
Ссылочный Пример 14
4-Гидроксинафталин-2-карбонитрил
Указанное в заголовке соединение получали способом, аналогичным описанному в Ссылочном Примере 6, с использованием соответствующего исходного вещества.
Ссылочный Пример 15
Этиловый эфир 3-(4-гидроксинафталин-2-ил)-[1,2,4]оксадиазол-5-карбоновой кислоты
Смешанный раствор 4-гидроксинафталин-2-карбонитрила (0,34 г), гидрохлорида гидроксиламина (0,14 г) и карбоната калия (0,30 г) в трет-бутиловом спирте (4,5 мл) и воде (0,5 мл) перемешивали при 80°C в течение 6 часов. К реакционной смеси добавляли гидрохлорид гидроксиламина (0,14 г) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор разбавляли этилацетатом и промывали водой и насыщенным солевым раствором. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол). Это соединение (0,22 г) растворяли в дихлорметане (5,3 мл). К смеси добавляли этилоксалилхлорид (0,35 мл) и пиридин (0,52 мл) и смесь перемешивали при комнатной температуре в течение 1,5 часов. К реакционному раствору добавляли воду и органический слой промывали водой и насыщенным водным раствором гидрокарбоната натрия. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением указанного в заголовке соединения (0,15 г).
Ссылочный Пример 16
Этиловый эфир 3-(4-бромнафталин-2-ил)-[1,2,4]тиадиазол-5-карбоновой кислоты
К раствору амида 4-бромнафталин-2-карбоновой кислоты (1,10 г) в толуоле (11,0 мл) добавляли хлоркарбонилсульфенилхлорид (0,73 мл) и смесь перемешивали при 100°C в течение 18 часов. К реакционному раствору добавляли воду (50 мл). Осажденное твердое вещество собирали фильтрованием и промывали водой и гексаном с получением 5-(4-бромнафталин-2-ил)-[1,3,4]оксатиазол-2-она (1,13 г). Это соединение (1,12 г) растворяли в дихлорбензоле (18 мл). К раствору добавляли этилцианоформиат (1,42 мл) и смесь перемешивали при 160°C в течение 22 часов. К смеси добавляли воду (30 мл) при комнатной температуре и полученную смесь экстрагировали дихлорметаном. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением указанного в заголовке соединения (1,21 г).
Ссылочный Пример 17
Этиловый эфир 3-(4-бромнафталин-2-ил)изотиазол-5-карбоновой кислоты
К раствору амида 4-бромнафталин-2-карбоновой кислоты (1,10 г) в толуоле (11,0 мл) добавляли хлоркарбонилсульфенилхлорид (0,73 мл) и смесь перемешивали при 100°C в течение 18 часов. К реакционному раствору добавляли воду (50 мл) и осажденное твердое вещество собирали фильтрованием. Полученное твердое вещество промывали водой и гексаном с получением 5-(4-бромнафталин-2-ил)-[1,3,4]оксатиазол-2-она (1,13 г). Это соединение (1,13 г) растворяли в дихлорбензоле (18 мл). К раствору добавляли этилпропиолат (1,52 мл) и смесь перемешивали при 160°C в течение 18 часов. Реакционный раствор очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением указанного в заголовке соединения (0,66 г).
Ссылочный Пример 18
4-Цианонафталин-2-карбоновая кислота
К раствору этилового эфира 4-гидроксинафталин-2-карбоновой кислоты (2,16 г) и пиридина (1,60 мл) в дихлорметане (100 мл) добавляли трифторметансульфоновый ангидрид (2,5 мл) при охлаждении льдом и смесь перемешивали при указанной температуре в течение 10 минут. К реакционному раствору добавляли воду (30 мл) и полученную смесь экстрагировали диэтиловым эфиром. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток растворяли в N-метилпирролидоне (33 мл). К раствору добавляли цианид цинка (1,41 г) и тетракис(трифенилфосфин)палладий (0,58 г) и полученную смесь перемешивали при 110°C в течение 40 минут. После охлаждения реакционной смеси до комнатной температуры к реакционному раствору добавляли воду (50 мл) и дихлорметан (50 мл). Нерастворимое вещество удаляли фильтрованием через слой целита. Водный слой отделяли и органический слой фильтровали через гель аминопропил-кремниевой кислоты (элюент: дихлорметан). Органический слой концентрировали при пониженном давлении. К остатку добавляли этилацетат (20 мл) и смесь промывали водой (30 мл, 5 раз). Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением этилового эфира 4-цианонафталин-2-карбоновой кислоты (2,25 г). К смешанному раствору этого соединения (0,45 г) в тетрагидрофуране (10 мл), этаноле (5,0 мл) и воде (5,0 мл) добавляли гидроксид лития моногидрат (0,25 г) и смесь перемешивали в течение 1 часа. К реакционному раствору добавляли воду (20 мл) и полученную смесь промывали диэтиловым эфиром. К водному слою добавляли 1 моль/л хлористоводородной кислоты (3,3 мл) и осажденное твердое вещество собирали фильтрованием. Полученное твердое вещество сушили при пониженном давлении при 50°C с получением указанного в заголовке соединения (0,37 г).
Ссылочный Пример 19
Метиловый эфир 2-(4-цианонафталин-2-ил)-4-метилоксазол-5-карбоновой кислоты
К раствору 4-цианонафталин-2-карбоновой кислоты (0,37 г) в дихлорметане (20 мл) добавляли диметилформамид (5 капель) и оксалилдихлорид (0,5 мл) при охлаждении льдом и смесь перемешивали при комнатной температуре в течение 30 минут. Растворитель удаляли при пониженном давлении. К остатку добавляли толуол (10 мл) и смесь концентрировали при пониженном давлении. К раствору гидрохлорида этилового эфира 2-аминопропионовой кислоты (0,29 г) и триэтиламина (0,66 мл) в дихлорметане (10 мл) добавляли по каплям полученный остаток при охлаждении льдом и смесь перемешивали при комнатной температуре в течение 30 минут. К смеси добавляли воду и 1 моль/л хлористоводородной кислоты (1,56 мл). Водный слой отделяли и органический слой промывали насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным солевым раствором. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением этил 2-[(4-цианонафталин-2-карбонил)амино]пропионата (0,43 г). К раствору этого соединения (0,43 г) в тетрагидрофуране (10 мл) добавляли 1 моль/л водного раствора гидроксида натрия (3,8 мл) и смесь перемешивали в течение 30 минут. К смеси добавляли 1 моль/л хлористоводородной кислоты (4,4 мл) при охлаждении льдом и полученную смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением 2-[(4-цианонафталин-2-карбонил)амино]пропионовой кислоты (0,39 г). К раствору этого соединения (0,39 г) в дихлорметане (7,0 мл) добавляли диметилформамид (2 капели) и оксалилдихлорид (1,26 мл) и смесь перемешивали при комнатной температуре в течение 30 минут. Растворитель удаляли при пониженном давлении. К остатку добавляли толуол (10 мл) и смесь концентрировали при пониженном давлении. После растворения полученного остатка в дихлорметане (7,0 мл) к смеси добавляли триэтиламин (0,31 мл) и метанол (1,0 мл) при охлаждении льдом. Смесь перемешивали при комнатной температуре в течение 16 часов и растворитель удаляли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением указанного в заголовке соединения (0,045 г).
Ссылочный Пример 20
Метиловый эфир 4-ацетокси-8-бром-5,6-дифторнафталин-2-карбоновой кислоты
Указанное в заголовке соединение получали способом, аналогичным описанному в Ссылочном Примере 12, с использованием 2-бром-4,5-дифторбензальдегида вместо 2-бром-5-фторбензальдегида.
Ссылочный Пример 21
5-Фтор-2-иод-3-метилбензальдегид
К раствору метилового эфира 5-фтор-2-иод-3-метилбензойной кислоты (11,2 г) в дихлорметане (80 мл) добавляли по каплям в течение 25 минут диизобутилалюминийгидрид (113 мл, 1,02 моль/л раствор в гексане) при -78°C и смесь перемешивали при указанной температуре в течение 30 минут. К реакционной смеси добавляли по каплям метанол (10 мл) при указанной температуре и смесь перемешивали в течение 10 минут. К реакционной смеси добавляли насыщенный водный раствор тартрата калия-натрия тетрагидрата (300 мл) при охлаждении льдом и смесь перемешивали в течение 30 минут. Реакционную смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток промывали гексаном с получением (5-фтор-2-иод-3-метилфенил)метанола (7,15 г). К суспензии полученного соединения (7,15 г) в хлороформе (53 мл) и ацетоне (5,2 мл) добавляли диоксид марганца и смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь фильтровали через слой целита и фильтрат концентрировали. Остаток очищали колоночной хроматографией на силикагеле (элюент: этилацетат/н-гексан = 0-15%) с получением указанного в заголовке соединения (3,54 г).
Ссылочный Пример 22
Метиловый эфир 4-ацетокси-5-фтор-8-иод-7-метилнафталин-2-карбоновой кислоты
Указанное в заголовке соединение получали способом, аналогичным описанному в Ссылочном Примере 12, с использованием 5-фтор-2-иод-3-метилбензальдегида вместо 2-бром-5-фторбензальдегида.
Ссылочные Примеры 23-24
Метиловый эфир 4-ацетокси-5,6-дифторнафталин-2-карбоновой кислоты
Метиловый эфир 4-ацетокси-5-фтор-7-метилнафталин-2-карбоновой кислоты
Указанные в заголовке соединения получали способом, аналогичным описанному в Ссылочном Примере 13, с использованием соответствующих исходных веществ.
Ссылочные Примеры 25-43
Соединения Ссылочных Примеров 25-43 получали способом, аналогичным описанному в Ссылочном Примере 6, с использованием соответствующих исходных веществ.
Ссылочные Примеры 44-62
Соединения Ссылочных Примеров 44-62 получали способом, аналогичным описанному в Ссылочном Примере 7, с использованием соответствующих исходных веществ.
Ссылочный Пример 63
Этиловый эфир 2-(4-гидроксинафталин-2-ил)тиазол-5-карбоновой кислоты
Указанное в заголовке соединение получали способом, аналогичным описанному в Ссылочном Примере 7, с использованием этил 2-хлор-оксопропионата вместо этил 2-хлор-ацетоацетата.
Ссылочные Примеры 64-75
Соединения Ссылочных Примеров 64-75 получали способом, аналогичным описанному в Ссылочном Примере 63, с использованием соответствующих исходных веществ.
Пример 1
2-(4-Цианонафталин-2-ил)изоникотиновая кислота
К суспензии 4-циано-2-нафталинбороновой кислоты (0,10 г), этилового эфира 2-бромизоникотиновой кислоты (0,12 г) и фторида цезия (0,09 г) в диметоксиэтане (6 мл) добавляли тетракис(трифенилфосфин)палладий (0,06 г) и смесь перемешивали при 150°C в течение 40 минут с использованием микроволнового реактора (Biotage). Реакционную смесь фильтровали через слой целита и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат = 100/0-66/34) с получением этилового эфира 2-(4-цианонафталин-2-ил)изоникотиновой кислоты (0,14 г). К раствору этого соединения (0,14 г) в смешанном растворителе, состоящем из тетрагидрофурана (4 мл), этанола (1 мл) и воды (1 мл), добавляли гидроксид лития моногидрат (0,060 г) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли уксусную кислоту (0,27 мл). Осажденное твердое вещество собирали фильтрованием и промывали водой и н-гексаном. Твердое вещество сушили при пониженном давлении с получением указанного в заголовке соединения (0,098 г).
Пример 2
2-(4-Цианонафталин-2-ил)-5-гидроксиизоникотиновая кислота
Этиловый эфир 2-(4-цианонафталин-2-ил)-5-метоксиметоксиизоникотиновой кислоты (0,12 г) получали способом, аналогичным описанному в Примере 1, с использованием этилового эфира 2-бром-5-метоксиметоксиизоникотиновой кислоты вместо этилового эфира 2-бромизоникотиновой кислоты. К смешанному раствору этого соединения в тетрагидрофуране (4 мл), этаноле (1 мл) и воде (1 мл) добавляли гидроксид лития моногидрат (0,043 г) и смесь перемешивали при комнатной температуре в течение ночи. К этой реакционной смеси добавляли 2 моль/л хлористоводородной кислоты (1 мл) и смесь перемешивали при 50°C в течение 8 часов. После охлаждения реакционной смеси до комнатной температуры осажденное твердое вещество собирали фильтрованием и сушили при пониженном давлении с получением указанного в заголовке соединения (0,087 г).
Пример 3
1-(4-Цианонафталин-2-ил)-1Н-пиразол-3-карбоновая кислота
Суспензию этилового эфира 1Н-пиразол-3-карбоновой кислоты (0,1 г), 3-бромнафталин-1-карбонитрила (0,17 г), иодида меди (0,0068 г), (1R,2R)-(-)-N,N'-диметилциклогексан-1,2-диамина (0,010 г) и карбоната калия (0,21 г) в толуоле (3 мл) перемешивали при 90°C в течение ночи. После охлаждения до комнатной температуры к реакционной смеси добавляли этилацетат. Полученную смесь фильтровали через слой целита. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат = 100/0-66/34) с получением этилового эфира 1-(4-цианонафталин-2-ил)-1Н-пиразол-3-карбоновой кислоты (0,040 г). К раствору этого соединения (0,040 г) в смешанном растворителе, состоящем из тетрагидрофурана (0,2 мл), этанола (0,08 мл) и воды (0,08 мл), добавляли гидроксид лития моногидрат (0,017 г) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли 2 моль/л хлористоводородной кислоты (0,35 мл). Осажденное твердое вещество собирали фильтрованием, промывали водой и н-гексаном и сушили при пониженном давлении с получением указанного в заголовке соединения (0,026 г).
Пример 4
4-(4-Цианонафталин-2-ил)бензойная кислота
4-Метоксикарбонилфенилбороновую кислоту (0,039 г), 3-бромнафталин-1-карбонитрил (0,05 г), тетракис(трифенилфосфин)палладий (0,012 г) и карбонат цезия (0,11 г) суспендировали в смешанном растворителе, состоящем из N,N-диметилформамида (3 мл) и воды (1 мл), и полученную смесь перемешивали при 150°C в течение 40 минут с использованием микроволнового реактора (Biotage). Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Органический слой концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат = 100/0-66/34) с получением метилового эфира 4-(4-цианонафталин-2-ил)бензойной кислоты (0,025 г).
Указанное в заголовке соединение (0,020 г) получали способом, аналогичным описанному в Примере 3, с использованием метилового эфира 4-(4-цианонафталин-2-ил)бензойной кислоты вместо этилового эфира 1-(4-цианонафталин-2-ил)-1Н-пиразол-3-карбоновой кислоты.
Пример 5
4-(4-Цианохинолин-2-ил)бензойная кислота
2-Хлорхинолин-4-карбонитрил (0,20 г), 4-метоксикарбонилфенилбороновую кислоту (0,21 г), тетракис(трифенилфосфин)палладий (0,061 г) и карбонат натрия (0,22 г) суспендировали в смешанном растворителе, состоящем из диметоксиэтана (2 мл) и воды (0,5 мл), и полученную смесь перемешивали при 150°C в течение 30 минут с использованием микроволнового реактора (Biotage). К реакционной смеси добавляли этилацетат и реакционную смесь фильтровали через слой целита. Фильтрат выливали в воду и органический слой промывали водой и насыщенным солевым раствором. Органический слой концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат = 100/0-66/34) с получением метилового эфира 4-(4-цианонафталин-2-ил)бензойной кислоты (0,12 г). К раствору этого соединения (0,12 г) в смешанном растворителе, состоящем из тетрагидрофурана (2 мл), этанола (1 мл) и воды (1 мл), добавляли гидроксид лития моногидрат (0,14 г) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли 2 моль/л хлористоводородной кислоты (0,35 мл). Осажденное твердое вещество собирали фильтрованием, промывали метанолом и сушили при пониженном давлении с получением указанного в заголовке соединения (0,024 г).
Пример 6
4-(4-Цианохинолин-2-ил)-2-гидрокси-бензойная кислота
2-Хлорхинолин-4-карбонитрил (0,15 г), метиловый эфир 2-метоксиметокси-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)бензойной кислоты (0,26 г), тетракис(трифенилфосфин)палладий (0,045 г) и карбонат натрия (0,16 г) суспендировали в смешанном растворителе, состоящем из диметоксиэтана (2 мл) и воды (0,5 мл), и полученную смесь перемешивали при 150°C в течение 30 минут с использованием микроволнового реактора (Biotage). К реакционной смеси добавляли этилацетат и смесь фильтровали через слой целита. Фильтрат выливали в воду. Органический слой промывали водой и насыщенным солевым раствором и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат = 100/0-66/34) с получением метилового эфира 4-(4-цианохинолин-2-ил)-2-гидрокси-бензойной кислоты (0,1 г). К смешанному раствору этого соединения (0,1 г) в тетрагидрофуране (4 мл), этаноле (1 мл) и воде (1 мл) добавляли гидроксид лития моногидрат (0,060 г) и смесь перемешивали при комнатной температуре в течение ночи. К этой реакционной смеси добавляли 2 моль/л хлористоводородной кислоты (2,8 мл) и смесь перемешивали при 50°C в течение 10 часов. После охлаждения реакционной смеси до комнатной температуры осажденное твердое вещество собирали фильтрованием и сушили при пониженном давлении с получением указанного в заголовке соединения (0,068 г).
Пример 7
2-(4-Цианонафталин-2-ил)-4-метилтиазол-5-карбоновая кислота
Суспензию этилового эфира 2-(4-бромнафталин-2-ил)-4-метилтиазол-5-карбоновой кислоты (0,050 г), цианида цинка (0,031 г) и тетракис(трифенилфосфин)палладия (0,015 г) в N-метилпирролидоне (2 мл) перемешивали при 150°C в течение 50 минут с использованием микроволнового реактора (Biotage). К реакционной смеси добавляли воду (15 мл) и осажденное твердое вещество собирали фильтрованием и промывали водой и н-гексаном с получением этилового эфира 2-(4-цианонафталин-2-ил)-4-метилтиазол-5-карбоновой кислоты (0,042 г).
Указанное в заголовке соединение (0,035 г) получали способом, аналогичным описанному в Примере 6, с использованием этилового эфира 2-(4-цианонафталин-2-ил)-4-метилтиазол-5-карбоновой кислоты вместо метилового эфира 4-(4-цианохинолин-2-ил)-2-гидрокси-бензойной кислоты.
Пример 8
2-(4-Циано-6-метилнафталин-2-ил)-4-метилтиазол-5-карбоновая кислота
К суспензии этилового эфира 2-(4-гидрокси-6-метилнафталин-2-ил)-4-метилтиазол-5-карбоновой кислоты (0,030 г) в дихлорметане (2 мл) добавляли пиридин (0,058 г) и трифторметансульфоновый ангидрид (0,10 г) при комнатной температуре и смесь перемешивали в течение 2 часов. Реакционную смесь выливали в 1 моль/л хлористоводородной кислоты (4 мл) и полученную смесь экстрагировали диэтиловым эфиром. Органический слой промывали водой и насыщенным солевым раствором и сушили над сульфатом магния с получением этилового эфира 4-метил-2-(6-метил-4-трифторметансульфонилоксинафталин-2-ил)тиазол-5-карбоновой кислоты. К раствору полученного соединения в N-метилпирролидоне добавляли цианид цинка (0,043 г) и тетракис(трифенилфосфин)палладий (0,021 г) при комнатной температуре и смесь перемешивали при 150°C в течение 40 минут с использованием микроволнового реактора (Biotage). К реакционной смеси добавляли воду и осажденное твердое вещество собирали фильтрованием. Это твердое вещество промывали водой и очищали колоночной хроматографией на геле аминопропил-кремниевой кислоты (элюент: этилацетат) с получением этилового эфира 2-(4-циано-6-метилнафталин-2-ил)-4-метилтиазол-5-карбоновой кислоты (0,022 г). К смешанному раствору этого соединения (0,022 г) в тетрагидрофуране (2 мл), этаноле (0,5 мл) и воде (0,5 мл) добавляли гидроксид лития моногидрат (0,008 г) и смесь перемешивали при комнатной температуре в течение ночи. К этой реакционной смеси добавляли воду (2 мл) и полученную смесь экстрагировали диэтиловым эфиром. К водному слою добавляли 1 моль/л хлористоводородной кислоты (2 мл) и полученную смесь экстрагировали этилацетатом (8 мл). Органический слой промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и концентрировали с получением указанного в заголовке соединения (0,012 г).
Примеры 9-10
Соединения Примеров 9-10 получали способом, аналогичным описанному в Примере 8, с использованием соответствующих исходных веществ.
Примеры 11-44
Соединения Примеров 11-44 получали способом, аналогичным описанному в Примере 8, с использованием соответствующих исходных веществ.
Примеры 45-46
Соединения Примеров 45-46 получали способом, аналогичным описанному в Примере 7, с использованием соответствующих исходных веществ.
Пример 47
2-(4-Цианонафталин-2-ил)-4-метилоксазол-5-карбоновая кислота
К смешанному раствору метилового эфира 2-(4-цианонафталин-2-ил)-4-метилоксазол-5-карбоновой кислоты (0,045 г) в тетрагидрофуране (1,5 мл), этаноле (0,8 мл) и воде (0,8 мл) добавляли гидроксид лития моногидрат (0,02 г) и смесь перемешивали в течение 30 минут. К реакционному раствору добавляли воду и полученную смесь промывали диэтиловым эфиром. К водному слою добавляли 1 моль/л хлористоводородной кислоты (0,5 мл). Осажденное твердое вещество собирали фильтрованием и сушили при пониженном давлении с получением указанного в заголовке соединения (0,028 г).
Пример 48
2-(4-Циано-8-фтор-7-гидроксинафталин-2-ил)-4-метилтиазол-5-карбоновая кислота
К суспензии 2-(4-циано-8-фтор-7-метоксинафталин-2-ил)-4-метилтиазол-5-карбоновой кислоты (0,22 г) в дихлорметане (1 мл) добавляли трибромид бора (1 моль/л раствор в дихлорметане, 128 мкл) при охлаждении на бане метанол-лед и смесь перемешивали при комнатной температуре в течение 30 минут, с последующим перемешиванием с нагреванием при 40°C в течение 2,5 часов. После охлаждения до комнатной температуры к смеси добавляли 1 моль/л хлористоводородной кислоты. Осажденное кристаллическое вещество собирали фильтрованием и сушили при пониженном давлении при 50°C с получением указанного в заголовке соединения (0,018 г).
Пример 49
2-(4-Циано-7-гидроксинафталин-2-ил)-4-метилтиазол-5-карбоновая кислота
К суспензии этилового эфира 2-(7-бензилокси-4-цианонафталин-2-ил)-4-метилтиазол-5-карбоновой кислоты (0,27 г) в тетрагидрофуране (20 мл) добавляли палладий на углероде (100 мг) при комнатной температуре и смесь перемешивали при указанной температуре в течение 1,5 часов в атмосфере водорода. Смесь перемешивали при 50°C в течение ночи. Реакционную смесь фильтровали через слой целита и фильтрат концентрировали при пониженном давлении. Остаток суспендировали в этилацетате и полученную смесь фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 95/5-40/60) с получением этилового эфира 2-(4-циано-7-гидроксинафталин-2-ил)-4-метилтиазол-5-карбоновой кислоты (0,067 г). Указанное в заголовке соединение (0,019 г) получали путем удаления защиты у этого соединения (0,030 г) способом, аналогичным описанному в Примере 47.
В Таблицах 1-10 представлены химические структуры описанных выше соединений Ссылочных Примеров 25-75 и химические структуры и данные 1H-ЯМР соединений Примеров 1-49.
Аббревиатуры в этих Таблицах: "Ссыл. Прим. №", "Пр. №", "Структ." и "Раств.", означают номер Ссылочного Примера, номер Примера, химическую структуру и растворитель для измерений 1H-ЯМР, соответственно.
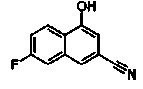
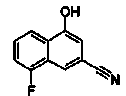
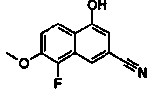
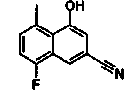
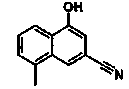
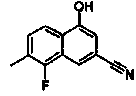
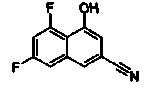
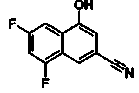
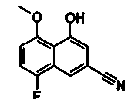
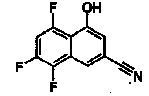
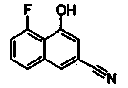
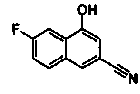
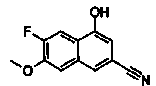
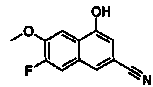
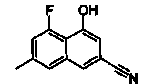
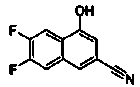
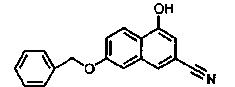
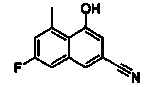
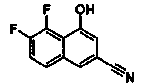
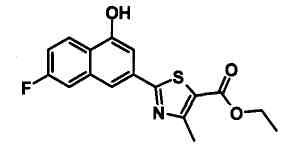
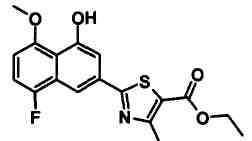
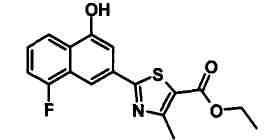
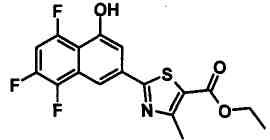
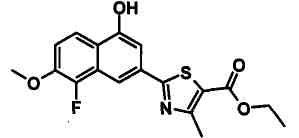
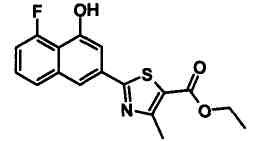
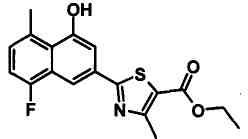
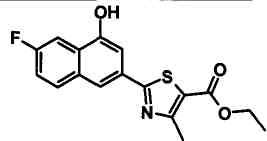
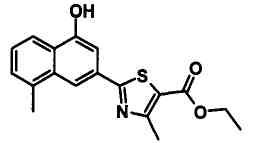
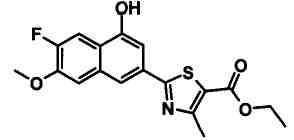
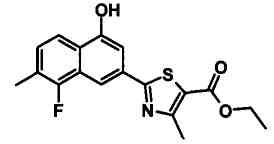
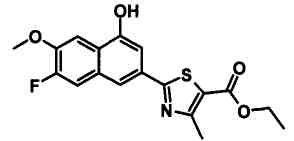
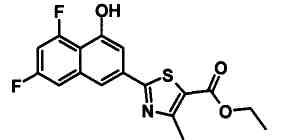
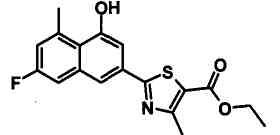
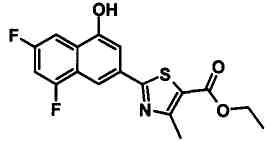
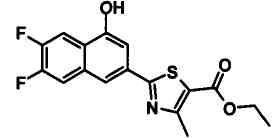
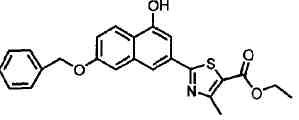
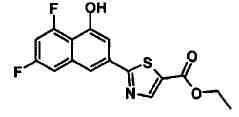
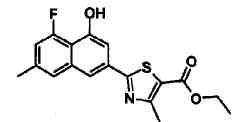
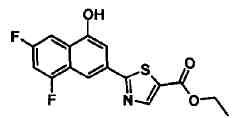
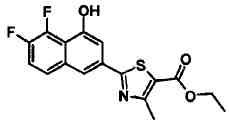
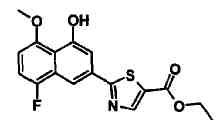
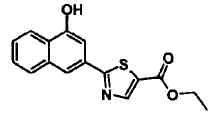
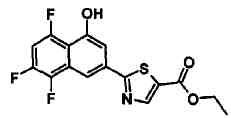
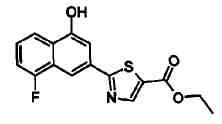
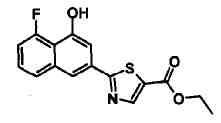
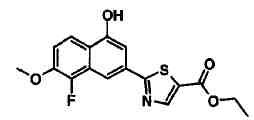
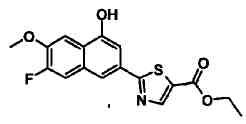
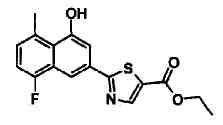
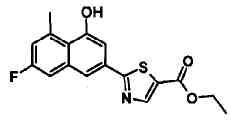
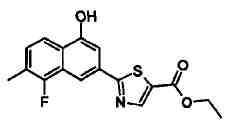
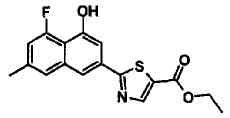
(DMSO-d6)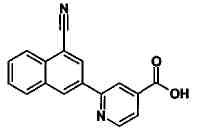
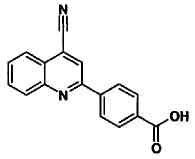
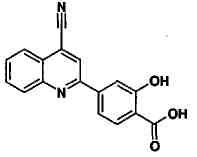
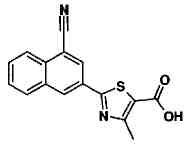
(DMSO-d6)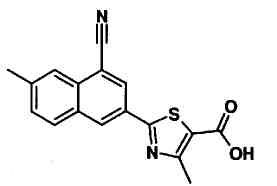
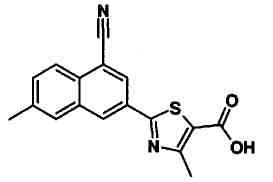
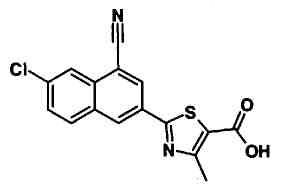
(DMSO-d6)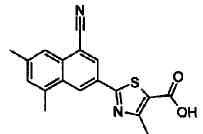
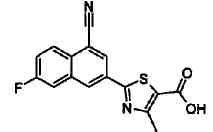
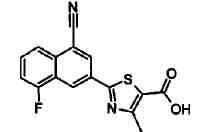
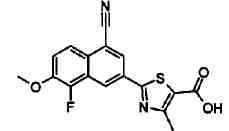
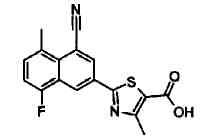
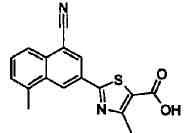
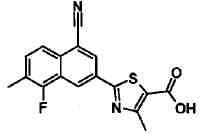
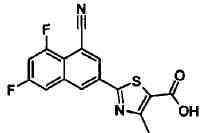
(DMSO-d6)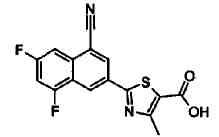
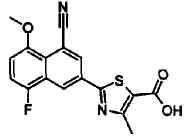
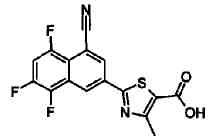
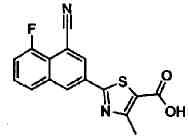
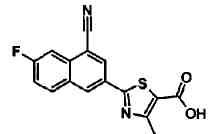
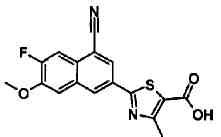
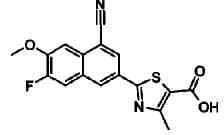
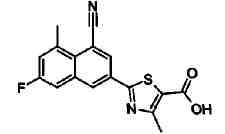
(DMSO-d6)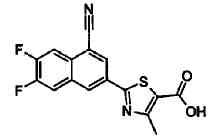
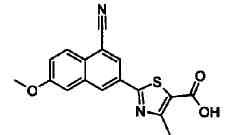
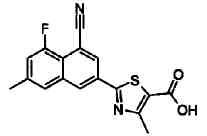
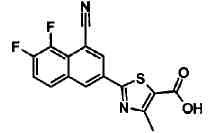
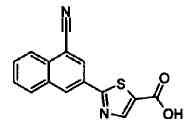
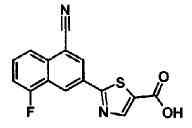
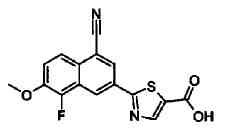
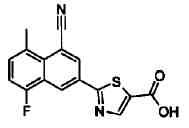
(DMSO-d6)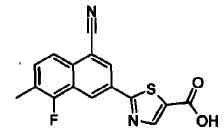
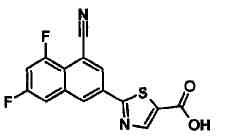
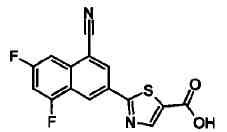
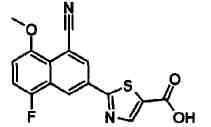
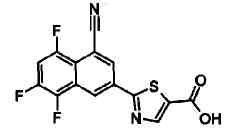
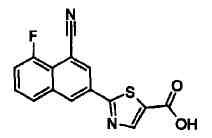
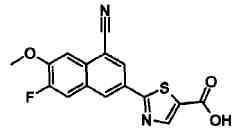
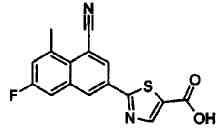
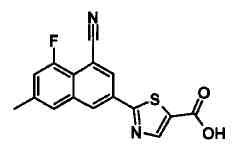
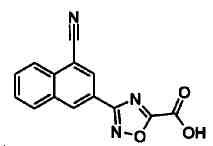
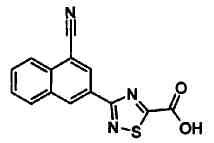
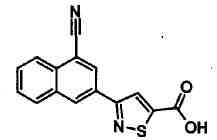
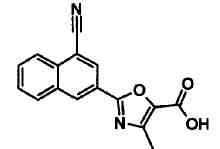
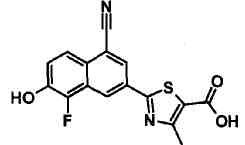
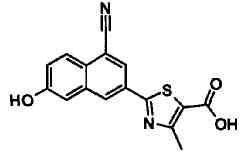
Пример испытания 1
Ингибирующая активность в отношении ксантиноксидазы
(1) Получение испытываемых соединений
Испытываемые соединения растворяли в DMSO (Wako) при концентрации 40 мМ и затем разбавляли до нужных концентраций фосфатно-буферным солевым раствором (PBS).
(2) Способ измерения
Ксантиноксидазу (из коровьего молока, Sigma) получали с использованием фосфатно-буферного солевого раствора (PBS) при 0,02 единиц/мл и затем раствор добавляли в 96-луночные планшеты при 50 мкл/лунка. Кроме того, добавляли испытываемые соединения, разбавленные PBS, при 50 мкл/лунка. Ксантин (Wako) при 200 мкМ, приготовленный с использованием PBS, добавляли при 100 мкл/лунка и реакционную смесь измеряли в течение 10 минут при комнатной температуре. Спектральную поглощательную способность при 290 нм измеряли с использованием считывающего устройства для микропланшетов SpectraMax Plus 384 (Molecular device). Спектральная поглощательная способность в условиях без ксантина составляет 0%, и контроль без испытываемых соединений составляет 100%. Рассчитывали концентрацию испытываемых соединений, при которой достигается 50% ингибирование (ИК50) (Таблица 11). Пр. № в таблице указывает номер примера.
Пример испытания 2
Ингибирующая активность в отношении транспорта мочевой кислоты с использованием клеток, экспрессирующих человеческий URAT1
(1) Получение клеток, нестабильно экспрессирующих человеческий URAT1
Полноразмерную человеческую кДНК URAT1 (NCBI Номер доступа NM_144585) субклонировали вектор экспрессии, ркДНК3.1 (Invitrogen). Вектор, экспрессирующий человеческий URAT1, трансфицировали в COS7 клетки (RIKEN CELL BANK RCB0539) с использованием Липофектамина 2000 (Invitrogen). COS7 клетки высевали в покрытые коллагеном 24-луночные планшеты (Japan Becton Dickinson) при 90-95% конфлюентности и культивировали в D-MEM культуральной среде (Invitrogen), содержащей 10% фетальную бычью сыворотку (Sanko Junyaku), в течение 2 часов при 37°C в условиях 5% CO2. Для 1 лунки, 2 мкл Липофектамина 2000 разводили в 50 мкл OPTI-MEM (Invitrogen) и давали выстояться при комнатной температуре в течение 7 минут (далее указан как Lipo2000-OPTI). Для 1 лунки, 0,8 мкг вектора, экспрессирующего человеческий URAT1, разводили в 50 мкл OPTI-MEM (Invitrogen) и осторожно объединяли с Lipo2000-OPTI. После выстаивания при комнатной температуре в течение 25 минут смесь добавляли к COS7 клеткам при 100 мкл/лунка. Кроме того, COS7 клетки культивировали в течение 2 дней при 37°C в условиях 5% CO2 и использовали для измерения ингибирующей активности в отношении поглощения.
(2) Получение испытываемых соединений
Испытываемые соединения растворяли в DMSO (Wako) при концентрации 10 мМ и затем разводили до концентрации в 2 раза большей, чем желаемая концентрация, буфером для предварительной обработки (125 мМ глюконата натрия, 4,8 мМ глюконата калия, 1,2 мМ дигидрофосфата калия, 1,2 мМ сульфата магния, 1,3 мМ глюконата кальция, 5,6 мМ глюкозы, 25 мМ Hepes, pH 7,4). Буфер для предварительной обработки без испытываемых соединений использовали для контроля. Кроме того, равный объем буфера для предварительной обработки, содержащего 14C-меченную мочевую кислоту (American Radiolabeled Chemicals, Inc.), добавляли к испытываемым соединениям и контролю и, в результате, получали буфер для анализа, включающий 20 мкМ мочевой кислоты.
(3) Способ измерения
Все испытания осуществляли на горячей пластине при 37°C. Буфер для предварительной обработки и буфер для анализа инкубировали при 37°C и затем использовали для анализов. Среду удаляли из планшетов и добавляли 700 мкл буферы для предварительной обработки и клетки предварительно инкубировали в течение 10 минут. После повторения этой стадии буфер для предварительной обработки удаляли и добавляли буфер для анализа при 400 мкл/лунка. Реакцию поглощения осуществляли в течение 5 минут. После остановки реакции буфер для анализа быстро удаляли и клетки промывали два раза путем добавления охлажденного льдом буфера для предварительной обработки при 1,2 мл/лунка. Затем клетки лизировали путем добавления 0,2н раствора гидроксида натрия при 300 мкл/лунка. Лизированные растворы переносили в Picoplate (PerkinElmer) и добавляли Microscinti 40 (PerkinElmer) при 600 мкл/лунка. После смешивания подсчитывали радиоактивность с использованием жидкостного сцинтилляционного счетчика (PerkinElmer). Радиоактивность в COS7 клетках, не трансфицированных вектором, экспрессирующим человеческий URAT1, также подсчитывали в тех же условиях, которые использовали для контроля. Кроме того, процент ингибирования для испытываемых соединений рассчитывали в соответствии с формулой, описанной ниже. Как результат, было показано, что все Примеры 2, 6, 7, 12, 13, 15, 22 и 31 имеют более 80% ингибирования при концентрации 100 мкМ.
Процент ингибирования (%) = [1-(B-C)/(A-C)] X 100
A: Радиоактивность в контроле
B: Радиоактивность в случае добавления испытываемых соединений
C: Радиоактивность в COS7 клетках, не трансфицированных вектором, экспрессирующим человеческий URAT1
Промышленная применимость
Содержащие конденсированную кольцевую структуру производные, представленные формулой (I), по настоящему изобретению или их пролекарства, или фармацевтически приемлемые соли проявляют отличную ингибирующую активность в отношении ксантиноксидазы и поэтому могут проявлять ингибирующую активность в отношении продукции мочевой кислоты и снижать уровень мочевой кислоты в крови. Поэтому настоящее изобретение может обеспечить средство для профилактики или лечения гиперурикемии, подагрического узла, подагрического артрита, почечного расстройства, связанного с гиперурикемией, мочевых конкрементов или т.п.
| название | год | авторы | номер документа |
|---|---|---|---|
| 5-ЧЛЕННОЕ ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ И ЕГО ПРИМЕНЕНИЕ ДЛЯ ЛЕКАРСТВЕННЫХ ЦЕЛЕЙ | 2008 |
|
RU2515968C2 |
| ПРОИЗВОДНОЕ ИНДОЛИЗИНА И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНСКИХ ЦЕЛЯХ | 2010 |
|
RU2529868C2 |
| ПРОИЗВОДНОЕ (АЗА)ИНДОЛА И ЕГО ПРИМЕНЕНИЕ В ЛЕЧЕБНЫХ ЦЕЛЯХ | 2008 |
|
RU2477274C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ЭПОТИЛОНА | 2003 |
|
RU2343155C2 |
| ТИОФЕНОВОЕ СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2017 |
|
RU2709473C1 |
| ФАРМАЦЕВТИЧЕСКИЕ СОЕДИНЕНИЯ | 2005 |
|
RU2422449C2 |
| СОЕДИНЕНИЕ ТРИАЗИНА И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНСКИХ ЦЕЛЯХ | 2015 |
|
RU2692789C2 |
| АРИЛКАРБОНИЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ | 2003 |
|
RU2340605C2 |
| АЗОЛЬНЫЕ И ТИАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЯ | 2006 |
|
RU2436779C2 |
| СПОСОБ ЛЕЧЕНИЯ АЛЛЕРГИИ С ИСПОЛЬЗОВАНИЕМ ЗАМЕЩЕННЫХ ПИРАЗОЛОВ | 2001 |
|
RU2259202C2 |
Настоящее изобретение относится к соединениям, представленным формулой (I), где Х1 и X2 независимо представляют собой СН или N; кольцо U представляет собой бензольное кольцо, пиразольное кольцо, 1,2,4-оксадиазольное кольцо, 1,2,4-тиадиазольное кольцо, изотиазольное кольцо, оксазольное кольцо, пиридиновое кольцо, тиазольное кольцо или тиофеновое кольцо; m представляет собой целое число, имеющее значение от 0 до 1; n представляет собой целое число, имеющее значение от 0 до 3; R1 представляет собой гидроксигруппу или C1-6 алкил; R2 представляет собой любой из (1)-(3): (1) атом галогена; (2) гидроксигруппу; (3) C1-6 алкил, или C1-6 алкокси, каждый из которых может независимо содержать любую группу, выбранную из группы заместителей α; группа заместителей α включает атом фтора и гидроксигруппу, или его фармацевтически приемлемая соль. Также изобретение относится к фармацевтической композиции, обладающей ингибирующей активностью в отношении ксантиноксидазы, включающей в качестве активного ингредиента соединение формулы (I) или его фармацевтически приемлемую соль. Технический результат - содержащее конденсированную кольцевую структуру производное, предназначенное в качестве средства для профилактики или лечения заболевания, связанного с аномальным уровнем мочевой кислоты в сыворотке. 2 н. и 13 з.п. ф-лы, 11 табл., 126 пр.
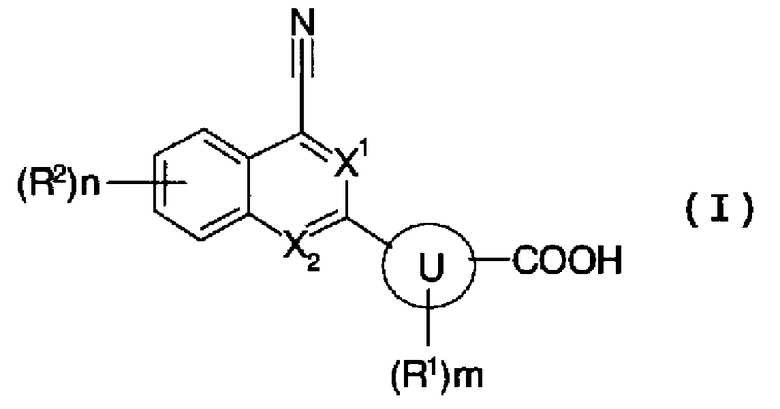
1. Содержащее конденсированную кольцевую структуру производное, представленное формулой (I):
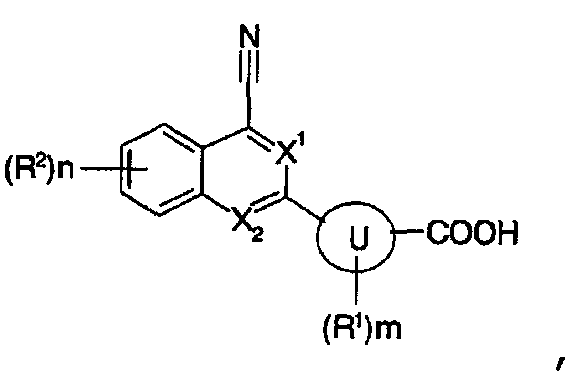
где
Х1 и X2 независимо представляют собой СН или N;
кольцо U представляет собой бензольное кольцо, пиразольное кольцо, 1,2,4-оксадиазольное кольцо, 1,2,4-тиадиазольное кольцо, изотиазольное кольцо, оксазольное кольцо, пиридиновое кольцо, тиазольное кольцо или тиофеновое кольцо.
m представляет собой целое число, имеющее значение от 0 до 1;
n представляет собой целое число, имеющее значение от 0 до 3;
R1 представляет собой гидроксигруппу или C1-6 алкил;
R2 представляет собой любой из (1)-(3):
(1) атом галогена;
(2) гидроксигруппу;
(3) C1-6 алкил, или C1-6 алкокси, каждый из которых может независимо содержать любую группу, выбранную из группы заместителей α;
группа заместителей α включает атом фтора и гидроксигруппу, или его фармацевтически приемлемая соль.
2. Содержащее конденсированную кольцевую структуру производное по п.1, где Х1 представляет собой СН, или его фармацевтически приемлемая соль.
3. Содержащее конденсированную кольцевую структуру производное по п.1 или 2, где X2 представляет собой СН, или его фармацевтически приемлемая соль.
4. Содержащее конденсированную кольцевую структуру производное по любому из пп.1-3, где m имеет значение 0, или m имеет значение 1 и кольцо U представляет собой любое из колец, представленных следующей формулой:
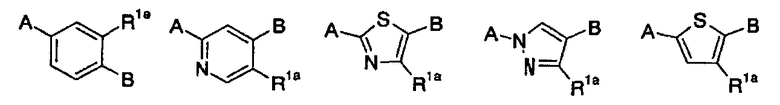
в представленных формулах R1а представляет собой гидроксигруппу, или C1-6 алкил; А представляет собой связь с конденсированным кольцом; и В представляет собой связь с карбокси; соответственно, или его фармацевтически приемлемая соль.
5. Содержащее конденсированную кольцевую структуру производное по п.4, где кольцо U представляет собой тиазольное кольцо, или его фармацевтически приемлемая соль.
6. Содержащее конденсированную кольцевую структуру производное по п.4, где кольцо U представляет собой пиридиновое кольцо, или его фармацевтически приемлемая соль.
7. Содержащее конденсированную кольцевую структуру производное по п.5, где R1a представляет собой метильную группу; n имеет значение 0, или n имеет значение 1-3 и R2 представляет собой атом галогена, гидроксигруппу или C1-6 алкил, который может содержать 1-3 атома фтора, или его фармацевтически приемлемая соль.
8. Содержащее конденсированную кольцевую структуру производное по п.6, где m имеет значение 0; или m имеет значение 1, R1a представляет собой гидроксигруппу и R2 представляет собой атом галогена, гидроксигруппу или C1-6 алкил, который может содержать 1-3 атома фтора, или его фармацевтически приемлемая соль.
9. Содержащее конденсированную кольцевую структуру производное по любому из пп.1-8, где m имеет значение 0, или его фармацевтически приемлемая соль.
10. Содержащее конденсированную кольцевую структуру производное по любому из пп.1-9, где n имеет значение 0, или его фармацевтически приемлемая соль.
11. Содержащее конденсированную кольцевую структуру производное по любому из пп.1-6, где n имеет значение 1-3 и R2 представляет собой атом фтора, или его фармацевтически приемлемая соль.
12. Содержащее конденсированную кольцевую структуру производное по любому из пп.1-6, представленное формулой:
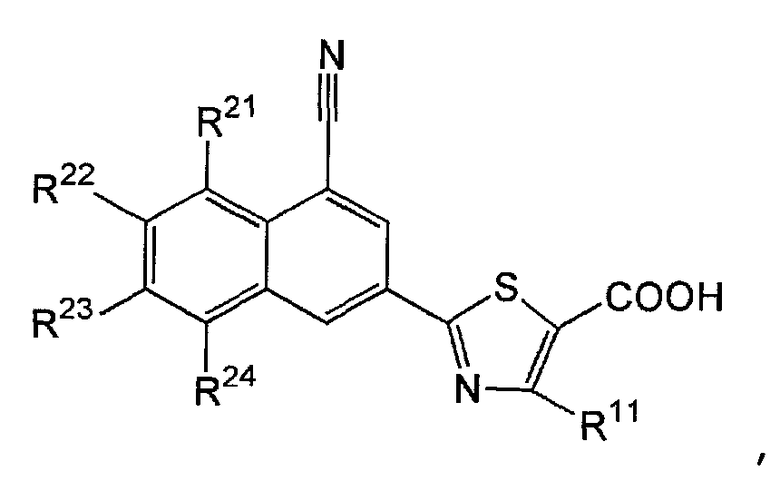
где R21 представляет собой атом водорода, атом фтора или метильную группу; R22 представляет собой атом водорода или атом фтора; R23 представляет собой атом водорода, атом фтора или метильную группу; R24 представляет собой атом водорода или атом фтора; и R11 представляет собой атом водорода или метильную группу, или его фармацевтически приемлемая соль.
13. Содержащее конденсированную кольцевую структуру производное по п.1, которое выбрано из группы, состоящей из
2-(4-цианонафталин-2-ил)-5-гидроксиизоникотиновой кислоты,
2-(4-цианонафталин-2-ил)-4-метилтиазол-5-карбоновой кислоты,
2-(4-циано-7-метилнафталин-2-ил)-4-метилтиазол-5-карбоновой кислоты,
2-(4-циано-7-фторнафталин-2-ил)-4-метилтиазол-5-карбоновой кислоты,
2-(4-циано-8-фторнафталин-2-ил)-4-метилтиазол-5-карбоновой кислоты,
2-(4-циано-8-фтор-5-метилнафталин-2-ил)-4-метилтиазол-5-карбоновой кислоты,
2-(4-циано-8-фтор-7-метилнафталин-2-ил)-4-метилтиазол-5-карбоновой кислоты,
2-(4-циано-5,7-дифторнафталин-2-ил)-4-метилтиазол-5-карбоновой кислоты,
2-(4-циано-6,8-дифторнафталин-2-ил)-4-метилтиазол-5-карбоновой кислоты,
2-(4-циано-5,7,8-трифторнафталин-2-ил)-4-метилтиазол-5-карбоновой кислоты,
2-(4-циано-5-фторнафталин-2-ил)-4-метилтиазол-5-карбоновой кислоты,
2-(4-циано-6-фторнафталин-2-ил)-4-метилтиазол-5-карбоновой кислоты,
2-(4-циано-7-фтор-5-метилнафталин-2-ил)-4-метилтиазол-5-карбоновой кислоты,
2-(4-циано-6,7-дифторнафталин-2-ил)-4-метилтиазол-5-карбоновой кислоты,
2-(4-циано-5-фтор-7-метилнафталин-2-ил)-4-метилтиазол-5-карбоновой кислоты,
2-(4-циано-5,6-дифторнафталин-2-ил)-4-метилтиазол-5-карбоновой кислоты,
2-(4-цианонафталин-2-ил)-тиазол-5-карбоновой кислоты,
2-(4-циано-8-фторнафталин-2-ил)-тиазол-5-карбоновой кислоты,
2-(4-циано-8-фтор-5-метилнафталин-2-ил)-тиазол-5-карбоновой кислоты,
2-(4-циано-8-фтор-7-метилнафталин-2-ил)-тиазол-5-карбоновой кислоты,
2-(4-циано-5,7-дифторнафталин-2-ил)-тиазол-5-карбоновой кислоты,
2-(4-циано-6,8-дифторнафталин-2-ил)-тиазол-5-карбоновой кислоты,
2-(4-циано-5,7,8-трифторнафталин-2-ил)-тиазол-5-карбоновой кислоты,
2-(4-циано-5-фторнафталин-2-ил)-тиазол-5-карбоновой кислоты,
2-(4-циано-7-фтор-5-метилнафталин-2-ил)-тиазол-5-карбоновой кислоты, и
2-(4-циано-5-фтор-7-метилнафталин-2-ил)-тиазол-5-карбоновой кислоты или их фармацевтически приемлемых солей.
14. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении ксантиноксидазы, включающая в качестве активного ингредиента конденсированное кольцевое производное по пп.1-13 или его фармацевтически приемлемую соль.
15. Фармацевтическая композиция по п.14, которая представляет собой средство для профилактики или лечения заболевания, выбранного из группы, включающей гиперурикемию, подагрический узел, подагрический артрит, почечное расстройство, связанное с гиперурикемией, и мочевые конкременты.
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| СПОСОБ ПОЛУЧЕНИЯ КАРБОНОВЫХ КИСЛОТ ПИРИДИНОВОГО РЯДА ИЛИ ИХ СОЛЕЙ | 0 |
|
SU332629A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Статический несимметричный триггер | 1975 |
|
SU569013A1 |
Авторы
Даты
2014-04-10—Публикация
2009-10-14—Подача