Область техники
Настоящее изобретение относится к фармацевтической области и, в частности, к некоторым соединениям хиназолина, композиции, содержащей указанные соединения, и их применению. Предложенные соединения хиназолина способны эффективно ингибировать гиперэкспрессиию и/или гиперактивность рецептора эпидермального фактора роста (EGFR).
Уровень техники
Связывание эпидермального фактора роста (EGF) с рецептором эпидермального фактора роста (EGFR) может запускать активность тирозинкиназы и тем самым может вызывать реакции, которые приводят к пролиферации клеток. Гиперэкспрессия и/или гиперактивность EGFR может приводить к неконтролируемому делению клеток, которые имеют предрасположенность к раковому заболеванию. Поэтому соединения, которые могут ингибировать гиперэкспрессию и/или гиперактивность EGFR, являются потенциальными кандидатами для лечения рака.
Краткое описание изобретения
Предложено по меньшей мере одно соединение, выбранное из:
(3aR,6aR)-N-(4-(1-(3-фторбензил)-1Н-индазол-5-иламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида;
(3aS,6aS)-N(4-(1-(3-фторбензил)-1Н-индазол-5-иламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида;
(3aR,6aR)-N-(4-(3-этинилфениламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида;
(3aS,6aS)-N-(4-(3-хлор-4-(3-фторбензилокси)фениламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида;
(3aR,6aR)-N-(4-(3-хлор-4-(3-фторбензилокси)фениламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида;
(3aS,6aS)-Н-(4-(3-хлор-4-(3-фторбензилокси)фениламино)хиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида; и
(3aR,6aR)-N-(4-(3-хлор-4-(3-фторбензилокси)фениламино)хиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида,
и/или по меньшей мере одна фармацевтически приемлемая соль указанных соединений.
Также предложена фармацевтическая композиция, содержащая по меньшей мере один фармацевтически приемлемый носитель и по меньшей мере одно соединение и/или по меньшей мере одну фармацевтически приемлемую соль, описанные в настоящей заявке.
Также предложен способ лечения ракового заболевания, восприимчивого к ингибированию гиперэкспрессии и/или гиперактивности рецептора эпидермального фактора роста, включающий введение пациенту, нуждающемуся в лечении, эффективного количества по меньшей мере одного соединения и/или по меньшей мере одной фармацевтически приемлемой соли указанного соединения, описанных в настоящей заявке.
Также предложено применение соединения согласно настоящему изобретению и/или по меньшей мере одной фармацевтически приемлемой соли указанного соединения для получения медикамента для лечения ракового заболевания. В предпочтительном варианте реализации настоящего изобретения раковое заболевание выбрано из рака легких, рака головы и шеи, колоректального рака, рака глотки, эпидермоидного рака и рака поджелудочной железы.
Далее предложен способ ингибирования гиперэкспрессии и/или гиперактивности рецептора эпидермального фактора роста, включающий приведение в контакт рецептора эпидермального фактора роста с эффективным количеством по меньшей мере одного соединения и/или по меньшей мере одной фармацевтической соли указанного соединения.
Подробное описание изобретения
Согласно настоящему описанию следующие слова, фразы и символы, как правило, используются в значениях, указанных ниже, за исключением тех случаев, когда из контекста, в котором они используются, следует иное. Следующие сокращения и термины имеют указанные значения на протяжении всего описания.
Соединения, описанные в настоящей заявке, включают, но не ограничиваются ими, их оптические изомеры, рацематы и другие смеси. Отдельные энантиомеры или диастереомеры, т.е. оптически активные формы, можно получать путем асимметрического синтеза или разделения рацематов или смесей диастереомеров. Разделения рацематов или смесей диастереомеров можно достигать, например, общепринятыми способами, такими как кристаллизация в присутствии разделяющего агента или хроматография с использованием, например, колонки хиральной высокоэффективной жидкостной хроматографии (ВЭЖХ).
В случаях если соединения, описанные в настоящей заявке, существуют в различных таутомерных формах, термин "соединение" включает все таутомерные формы соединения. Такие соединения также включают кристаллические формы, включая полиморфы и клатраты. Аналогичным образом термин "соль" включает все изомеры, рацематы, другие смеси, Z- и Е-формы, таутомерные формы и кристаллические формы соли соединения.
"Фармацевтически приемлемые соли" включают, но не ограничиваются ими, соли неорганических кислот, такие как гидрохлорат, фосфат, дифосфат, гидробромат, сульфат, фульфинат, нитрат и схожие соли; а также соли органических кислот, такие как малат, малеат, фумарат, тартрат, сукцинат, цитрат, ацетат, лактат, метансульфонат, n-толуолсульфонат, 2-гидроксиэтилсульфонат, бензоат, салицилат, стеарат и алканоат, такой как ацетат, HOOC-(CH2)N-COOH, где n составляет от 0-4, и схожие соли. Кроме того, фармацевтически приемлемые катионы включают, но не ограничиваются ими, натрий, калий, кальций, алюминий, литий и аммоний.
Кроме того, если соединение, описанное в настоящей заявке, получается в виде соли присоединения кислоты, свободное основание можно получать подщелачиванием раствора кислой соли. И, наоборот, если продукт является свободным основанием, соль присоединения, в частности фармацевтически приемлемую соль присоединения, можно получать растворением свободного основания в подходящем органическом растворителе и обработкой раствора кислотой в соответствии с общепринятыми способами приготовления солей присоединения кислоты из основных соединений. Специалистам в данной области известны различные методики синтеза, которые можно использовать для получения нетоксичных фармацевтически приемлемых солей присоединения.
"Сольват", такой как "гидрат", образуется в результате взаимодействия растворителя и соединения. Термин "соединение" включает сольваты соединений, в том числе гидраты. Аналогичным образом, "соли" включают сольваты солей, в том числе гидраты. Подходящие растворители представляют собой фармацевтически приемлемые сольваты, такие как гидраты, включая моногидраты и гемигидраты.
"Хелаты" образуется в результате координации соединения и иона металла в двух (или более) точках. Термин "соединение" включает хелаты соединений. Аналогичным образом "соли" включают хелаты солей.
"Нековалентный комплекс" образуется в результате взаимодействия соединения и другой молекулы, где ковалентная связь не образуется между соединением и молекулой. Например, комплексообразование может происходить за счет ван-дер-ваальсовских взаимодействий, водородных связей или электростатических взаимодействий (также называемых ионными связями). Получают такие нековалентные комплексы, включенные в термин "соединение".
Термин "активный агент" используется для обозначения химического вещества, которое имеет биологическую активность. В некоторых вариантах реализации, "активный агент" представляет собой химическое вещество, имеющее фармацевтическое применение.
"Проведение лечения", или "лечение", или "облегчение" относятся к введению по меньшей мере одного соединения и/или по меньшей мере одной фармацевтически приемлемой соли, описанной в настоящей заявке, пациенту, имеющему заболевание или нарушение, или имеющему симптом заболевания или нарушения, или имеющему предрасположенность к заболеванию или нарушению, с целью исцеления, лечения, облегчения, уменьшения, изменения, исправления, улучшения, усовершенствования или воздействия на заболевание или нарушение, симптомы заболевания или нарушения или предрасположенность к заболеванию или нарушению. Заболеванием или нарушением может быть, например, раковое заболевание.
Термин "ингибирование" указывает на уменьшение исходной активности биологической активности или процесса. "Ингибирование гиперэкспрессии и/или гиперактивности рецептора эпидермального фактора роста" относится к снижению экспрессии и/или активности EGFR, в виде прямого или косвенного ответа на присутствие по меньшей мере одного соединения и/или по меньшей мере одной фармацевтически приемлемой соли, описанной в настоящей заявке, по отношению к активности EGFR в отсутствие по меньшей мере одного соединения и/или по меньшей мере одной его фармацевтически приемлемой соли. Снижение активности может быть связано с прямым взаимодействием, по меньшей мере, одного соединения и/или, по меньшей мере, одной фармацевтически приемлемой соли указанного соединения, описанной в настоящей заявке, с EGFR или взаимодействием по меньшей мере одного соединения и/или по меньшей мере одной фармацевтически приемлемой соли указанного соединения, описанной в настоящей заявке, с одним или более другими факторами, которые, в свою очередь, влияют на активность EGFR. Например, присутствие по меньшей мере одного соединения и/или по меньшей мере одной фармацевтически приемлемой соли, описанной в настоящей заявке, может снижать активность EGFR путем прямого связывания с EGFR, путем вызывания (прямого или косвенного) снижения активности EGFR при помощи другого фактора или снижением (прямым или косвенным) количества EGFR в клетке или организме.
Термин "эффективное количество" относится к количеству по меньшей мере одного соединения и/или по меньшей мере одной фармацевтически приемлемой соли, описанной в настоящей заявке, эффективного при "лечении" заболевания или нарушения у пациента. В случае ракового заболевания эффективное количество может вызывать любые наблюдаемые или измеряемые изменения у пациента, как описано выше при определении терминов "обработка", "лечение" или "облегчение". Например, эффективное количество может уменьшать количество раковых или опухолевых клеток; уменьшать размер опухоли; ингибировать или останавливать инфильтрацию опухолевых клеток в периферические органы, включая, например, распространение опухоли в мягкие ткани и кости; ингибировать или останавливать метастазирование опухоли; ингибировать или останавливать рост опухоли; облегчать в некоторой степени один или более симптомов, связанных с раком, снижать заболеваемость и смертность; улучшать качество жизни; или приводить к комбинации этих эффектов. Эффективное количество может составлять количество, достаточное для уменьшения симптомов заболевания, реагирующих на ингибирование гиперэкспрессии и/или гиперактивности рецептора эпидермального фактора роста. Для лечения ракового заболевания эффективность in vivo можно, например, измерять путем определения продолжительности выживаемости, времени до прогрессирования заболевания (ТТР), скорости ответа (RR), длительности ответа и/или качества жизни. Как понятно специалистам в данной области, эффективные количества можно варьировать в зависимости от способа введения, используемого вспомогательного вещества и совместного использования с другими агентами.
Термин "эффективное количество" может также относиться к количеству, по меньшей мере, одного соединения и/или, по меньшей мере, одной фармацевтически приемлемой соли, описанной в настоящей заявке, эффективного при ингибировании гиперэкспрессии и/или гиперактивности рецептора эпидермального фактора роста.
Ниже более подробно описан один или более вариант реализации настоящего изобретения.
Предложено по меньшей мере одно соединение, выбранное из:
(3aR,6aR)-N-(4-(1-(3-фторбензил)-1Н-индазол-5-иламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида;
(3aS,6aS)-N-(4-(1-(3-фторбензил)-1Н-индазол-5-иламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида;
(3aR,6aR)-N-(4-(3-этинилфениламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида;
(3aS,6aS)-N-(4-(3-хлор-4-(3-фторбензилокси)фениламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида;
(3aR,6aR)-N-(4-(3-хлор-4-(3-фторбензилокси)фениламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида;
(3aS,6aS)-N-(4-(3-хлор-4-(3-фторбензилокси)фениламино)хиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида; и
(3aR,6aR)-Н-(4-(3-хлор-4-(3-фторбензилокси)фениламино)хиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида,
и/или по меньшей мере их одна фармацевтически приемлемая соль.
Соединения хиназолина и/или их фармацевтически приемлемые соли, описанные в настоящей заявке, можно получать из коммерчески доступных исходных материалов способами, хорошо известными специалистам в данной области. Подробные описание способов приведены в разделе Примеры настоящей заявки.
Способы синтетической химии, используемые при получении целевых соединений хиназолина, также описаны, например, в R.Larock, Comprehensive Organic Transformations, VCH Publishers (1989); T.W.Greene and P.G.M.Wuts, Protective Groups in Organic Synthesis, 3rd Ed., John Wiley and Sons (1999); L.Fieser and M.Fieser, Fieser and Fieser′s Reagents for Organic Synthesis, John Wiley and Sons (1994); и L.Paquette, ed., Encyclopedia of Reagents for Organic Synthesis, John Wiley and Sons (1995) и их последующих изданий.
По меньшей мере одно соединение и/или по меньшей мере одну фармацевтически приемлемую соль, описанную в настоящей заявке, можно очищать с помощью колоночной хроматографии, высокоэффективной жидкостной хроматографии, кристаллизации или других подходящих способов.
По меньшей мере одно соединение хиназолина и/или по меньшей мере одна его фармацевтически приемлемая соль, описанная в настоящей заявке, может взаимодействовать с EGFR киназой и/или ингибировать активность EGFR.
Также предложена композиция, включающая по меньшей мере один фармацевтически приемлемый носитель и по меньшей мере одно соединение и/или, по меньшей мере, одну фармацевтически приемлемую соль, описанную в настоящей заявке.
Композицию, включающую по меньшей мере одно соединение и/или по меньшей мере одну фармацевтически приемлемую соль, описанную в настоящей заявке, можно вводить различными известными способами, такими как пероральный, парентеральный, ингаляционный или с помощью имплантированного резервуара. Термин "парентеральный", используемый в настоящей заявке, включает подкожные, внутрикожные, внутривенные, внутримышечные, внутрисуставные, внутриартериальные, внутригрудинные, внутриоболочечные, внутриочаговые и внутричерепные способы инъекции или инфузии.
Пероральная композиция может представлять собой любую перорально приемлемую лекарственную форму, включая, но, не ограничиваясь ими, таблетки, капсулы, эмульсии и водные суспензии, дисперсии и растворы. Широко используемые носители для таблеток включают лактозу и кукурузный крахмал. Смазывающие агенты, такие как стеарат магния, также обычно добавляют в таблетки. Для перорального введения в форме капсул используют растворители, включая лактозу и сухой кукурузный крахмал. При пероральном введении водных суспензий или эмульсий активный ингредиент можно суспендировать или растворять в масляной фазе в сочетании с эмульгирующими или суспендирующими агентами. При желании, можно добавлять определенные подсластители, ароматизаторы или красители.
Стерильные инъекционные композиции (например, водные или масляные суспензии) можно изготавливать в соответствии со способами, известными в данной области при использовании подходящих диспергирующих или смачивающих агентов (таких как, например, Tween 80) и суспендирующих агентов. Стерильный инъекционный препарат также может представлять собой стерильный инъекционный раствор или суспензию в нетоксичном приемлемом для парентерального введения разбавителе или растворителе, например, как раствор 1,3-бутандиола. В число фармацевтически приемлемых носителей и растворителей, которые можно использовать, входят маннитол, вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла обычно используют в качестве растворителя или суспензионной среды (например, синтетические моно- и диглицериды). Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные пригодны для получения инъекционных препаратов, так же как и натуральные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, особенно в полиоксиэтилированном виде. Эти масляные растворы или суспензии могут также содержать спиртовой разбавитель или диспергатор с длинной цепью, карбоксиметилцеллюлозу или аналогичные диспергирующие агенты.
Ингаляционные композиции можно изготавливать в соответствии со способами, хорошо известными в области приготовления фармацевтических средств, и можно получать в виде солевых растворов с использованием бензилового спирта или других подходящих консервантов, стимуляторов абсорбции для повышения биологической доступности, фторуглеродов и/или других известных солюбилизаторов или диспергирующих агентов.
Композицию для наружного применения можно изготавливать в виде масла, крема, лосьона, мази и т.д. Подходящие носители для композиции включают, но не ограничиваются ими, растительные или минеральные масла, белый вазелин (белый мягкий парафин), жиры или масла с разветвленной цепью, животные жиры и высокомолекулярные спирты (более С12). В некоторых вариантах реализации активный ингредиент является растворимым в фармацевтически приемлемом носителе. При желании эмульгаторы, стабилизаторы, увлажнители и антиоксиданты также могут включать красители или ароматизаторы. Кроме того, в этих препаратах для наружного применения могут содержаться усилители проникновения через кожу. Примеры таких усилителей можно найти в патентах США №3,989,816 и №4,444,762.
Крема можно изготавливать из смеси минерального масла, самоэмульгирующегося пчелиного воска и воды, к которой добавлен активный ингредиент, растворенный в небольшом количестве масла, такого как миндальное масло. Пример такого крема включает около 40 частей воды, около 20 частей пчелиного воска, около 40 частей минерального масла и около 1 части миндального масла. Мази можно изготавливать смешиванием раствора активного ингредиента в растительном масле, таком как миндальное масло, с теплым мягким парафином и с последующим охлаждением смеси. Пример такой мази включает около 30% по весу миндаля и около 70% по весу белого мягкого парафина.
Фармацевтически приемлемый носитель относится к носителю, совместимому с активными ингредиентами композиции (и, в некоторых вариантах реализации, способному стабилизировать активные ингредиенты) и не оказывающему вредного воздействия на пациента. Например, солюбилизирующие агенты, такие как циклодекстрины (которые образуют определенные, более растворимые комплексы с, по меньшей мере, одним соединением и/или, по меньшей мере, одной фармацевтически приемлемой солью, описанной в настоящей заявке), можно использовать в качестве фармацевтических вспомогательных веществ для доставки активных ингредиентов. Примеры других носителей включают коллоидный диоксид кремния, стеарат магния, целлюлозу, лаурилсульфат натрия и D&C Yellow #10. Гидрофобные вспомогательные вещества, такие как синтетические и натуральные полимеры (например, альбумин и его производные), также представляют собой примеры фармацевтически приемлемых носителей.
Подходящие in vitro тесты можно использовать для предварительной оценки эффективности, по меньшей мере, одного соединения и/или, по меньшей мере, одной фармацевтически приемлемой соли, описанной в настоящей заявке, при ингибировании активности EGFR. По меньшей мере, одно соединение и/или, по меньшей мере, одну фармацевтически приемлемую соль, описанную в настоящей заявке, можно дополнительно проверить на эффективность при лечении раковых заболеваний в in vivo тестах. Например, соединения, описанные в настоящей заявке, и/или их фармацевтически приемлемые соли можно вводить животным (например, мышам), больным раком, и оценивать их терапевтические эффекты. На основе результатов также можно определять подходящие диапазоны дозировки и способы введения лекарств животным, в том числе людям.
Также предложен способ лечения ракового заболевания чувствительного к ингибированию гиперэкспрессии и/или гиперактивности рецептора эпидермального фактора роста, включающий введение пациенту, нуждающемуся в лечении, эффективного количества по меньшей мере одного соединения и/или по меньшей мере одной фармацевтически приемлемой соли, описанной в настоящей заявке.
По меньшей мере одно соединение и/или, по меньшей мере, одну фармацевтически приемлемую соль, описанную в настоящей заявке, можно использовать для достижения полезного терапевтического или профилактического эффекта, например, у пациентов страдающих раковым заболеванием. Согласно настоящему описанию, термин "раковое заболевание" относится к клеточным нарушениям, характеризующимся неконтролируемой или нарушенной клеточной пролиферацией, снижением клеточной дифференцации, ненормальной способностью вторгаться в окружающие ткани и/или способности формировать область нового роста в эктопической области. Термин "раковое заболевание" включает, но не ограничивается ими, солидные опухоли и переносимые кровью опухоли. Термин "раковое заболевание" охватывает заболевания кожи, тканей, органов, костей, хрящей, крови или сосудов. Термин "раковое заболевание " также охватывает первичные и метастатические раковые заболевания.
Неограничивающие примеры солидных опухолей включают рак поджелудочной железы; рак мочевого пузыря; колоректальный рак; рак молочной железы, включая метастатический рак молочной железы; рак предстательной железы, включая андроген-зависимый и андроген-независимый рак предстательной железы; рак почек, включая, например, метастатическую почечно-клеточную карциному; гепатоцеллюлярный рак; рак легких, включая, например, немелкоклеточный рак легких (НМРЛ), бронхиолоальвеолярную карциному (БАК) и аденокарциному легких; рак яичников, включая, например, нарастающий эпителиальный или первичный перитонеальный рак; рак шейки матки; рак желудочно-кишечного тракта; желудочный рак; рак головы и шеи, включая, например, плоскоклеточную карциному головы и шеи; рак кожи, включая, например, злокачественную меланому; нейроэндокринный рак, включая метастатические нейроэндокринные опухоли; опухоли мозга, включая, например, глиомы, анапластическую олигодендроглиому, мультиформную глиобластому и анапластическую астроцитому; рак костей; саркому мягких тканей и рак щитовидной железы.
Не ограничивающие примеры гематологических злокачественных опухолей включают острую миелоцитарную лейкемию (ОМЛ), хроническую гранулоцитную лейкемию (ХГЛ), включая фазы акселерации и бластного криза ХГЛ (ХГЛ-БК); острую лимфобластную лейкемию (ОЛЛ); хроническую лимфоцитарную лейкемию (ХЛЛ); болезнь Ходжкина (БХ); неходжкинскую лимфому (НХЛ), включая фолликулярную лимфому и лимфому из клеток мантии; В-клеточную лимфому; Т-клеточную лимфому; множественную миелому (ММ); макроглобулинемию Вальденстрема; миелодиспластический синдром (МДС), включая рефракторную анемию (РА), рефракторную анемию с кольцевидными сидеробластами (РАКС), рефракторную анемию с избытком бластов (РАИБ) и РАИБ в трансформации (РАИБ-Т) и миелопролиферативные синдромы.
В некоторых вариантах реализации примеры подвергаемого лечению ракового заболевания включают, но не ограничиваются ими, рак легких, рак головы и шеи, колоректальный рак, рак поджелудочной железы, рак толстой кишки, рак молочной железы, рак яичников, рак предстательной железы, рак желудка, рак почек, рак печени, рак мозга, рак костей и лейкемию. В некоторых вариантах реализации примеры подвергаемого лечению ракового заболевания выбирают из рака легких, рака головы и шеи, колоректального рака, рака глотки, эпидермоидного рака и рака поджелудочной железы.
В некоторых вариантах реализации по меньшей мере одно соединение и/или по меньшей мере одну фармацевтически приемлемую соль, описанную в настоящей заявке, вводят в сочетании с эффективным количеством другого терапевтического агента, который отличается от указанных по меньшей мере одного соединения и/или по меньшей мере одной его фармацевтически приемлемой соли, описанной в настоящей заявке. В некоторых вариантах реализации другой терапевтический агент представляет собой противораковый агент. В некоторых вариантах реализации другой терапевтический агент представляет собой одно из веществ, которые обычно вводят пациентам с заболеванием или состоянием, которое подвергается лечению. По меньшей мере, одно соединение и/или, по меньшей мере, одну его фармацевтически приемлемую соль, описанную в настоящей заявке, можно вводить с другим терапевтическим агентом в виде одной или раздельных лекарственных форм. В случае раздельного введения другой терапевтический агент можно вводить до, в то же время или после введения по меньшей мере одного соединения и/или по меньшей мере одной его фармацевтически приемлемой соли, описанной в настоящей заявке.
В некоторых вариантах реализации по меньшей мере одно соединение и/или, по меньшей мере, одну его фармацевтически приемлемую соль, описанную в настоящей заявке, вводят в сочетании с противораковым агентом. Согласно настоящей заявке термин "противораковый агент" относится к любому агенту, который вводят пациенту с раковым заболеванием с целью лечения ракового заболевания. Не ограничивающие примеры противораковых агентов включают: радиотерапию; иммунотерапию; химиотерапевтических агентов, вызывающих повреждение ДНК, и химиотерапевтических агентов, которые разрушают клетки репликации.
Неограничивающие примеры химиотерапевтических агентов, вызывающих повреждение ДНК, включают ингибиторы топоизомеразы I (например, иринотекан, топотекан, камптотецин и его аналоги или метаболиты и доксорубицин); ингибиторы топоизомеразы II (например, этопозид, тенипозид и даунорубицин); алкилирующие агенты (например, мелфалан, хлорамбуцил, бусульфан, тиотепа, ифосфамид, кармустин, ломустин, семустин, стрептозоцин, декарбазин, метотрексат, митомицин С и циклофосфамид); интеркаляторы ДНК (например, цисплатин, оксалиплатин и карбоплатин); интеркаляторы ДНК и генераторы свободных радикалов, такие как блеомицин; миметики нуклеозидов (например, 5-фторурацил, капецитабин, гемцитабин, флударабин, цитарабин, меркаптопурин, тиогуанин, пентостатин и гидроксимочевина).
Химиотерапевтические агенты, которые разрушают клетки репликации, включают: паклитаксел, доцетаксел и аналоги; винкристин, винбласти и аналоги; талидомид и аналоги (например, СС-5013 и СС-4047); ингибиторы протеин-тирозин киназы (например, иматиниб и гефитиниб); ингибиторы протесом (например, бортезомиб); ингибиторов NF-kappa В, включая ингибиторы I kappa В киназы; антитела, которые связываются с белками, гиперэкспрессивными при раковых заболеваниях, и тем самым подавляют репликацию клеток (например, трастузумаб, ритуксимаб, цетуксимаб и бевацизумаб); и другие ингибиторы белков или ферментов, проявляющих повышение регуляции, гиперэкспрессию или активацию при раковых заболеваниях, ингибирование которых приводит к подавлению репликации клеток.
Также предложен способ ингибирования гиперэкспрессии и/или гиперактивности рецептора эпидермального фактора роста, включающий контактирование рецептора эпидермального фактора роста с эффективным количеством, по меньшей мере, одного соединения и/или, по меньшей мере, одной фармацевтически приемлемой соли, описанной в настоящей заявке.
ПРИМЕРЫ
Следующие примеры представлены исключительно для иллюстрации и не ограничивают настоящее изобретение.
В следующих примерах используются приведенные ниже сокращения:
Пример 1: (3aR,6aR)-N-(4-(1-(3 -фторбензил)-1Н-индазол-5-иламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамид
Соединение 1 получали согласно нижеприведенной схеме.
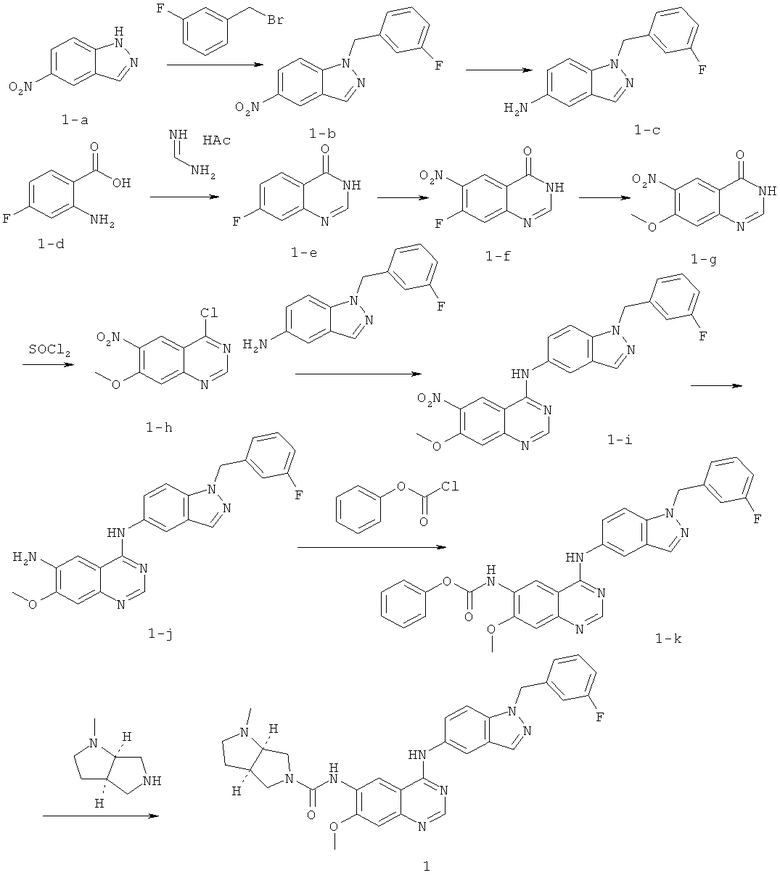
Смесь 5-нитро-1Н-индазола (1-а, 5 г, 30,65 ммоль), 1-(бромметил)-3-фторбензола (3,76 мл, 30,65 ммоль) и порошка карбоната калия (4,66 г, 30,65 ммоль) в ДМФА (3 мл) перемешивали при 80°C в течение 3 ч, а затем вливали в воду (100 мл). Осадок получали путем фильтрации и дальнейшей очистки путем хроматографии на силикагеле (ПЭ/EtOAc=3:1) с получением 1-b (5,3 г, 19,7 ммоль).
Никель Ренея (0,53 г сырой массы) в атмосфере азота добавляли к раствору 1-b (5,3 г, 19,7 ммоль) в метаноле (20 мл), смесь дегазировали и перемешивали в атмосфере водорода при комнатной температуре в течение ночи. Катализатор тщательно отфильтровывали и фильтрат концентрировали под вакуумом с получением 1-е (4,65 г, 19,3 ммоль).
Смесь 2-амино-4-фторбензойной кислоты (1-d, 7,75 г, 50 ммоль) и метанимидамид ацетата (15,6 г, 150 ммоль) в этаноле перемешивали при температуре кипения в течение ночи, а затем охлаждали до температуры окружающей среды. Осадок отфильтровывали и сушили под вакуумом с получением 1-е (8,0 г, 48 ммоль).
7-Фторхиназолин-4(3Н)-он (1-е, 8,0 г, 48 ммоль) растворяли в концентрированной H2SO4 (24 мл) и раствор охлаждали до 0°C на ледяной бане. Затем к раствору по каплям добавляли HNO3 (24 мл) с поддержанием температуры реакции ниже 0°C. После этого смесь медленно нагревали до 100°C и перемешивали в течение 3 дней. Полученную смесь охлаждали до температуры окружающей среды и погружали в ледяную воду. Осадок получали путем фильтрации и последующей рекристаллизации из АсОН с получением 1-f (3,25 г, 15,53 ммоль).
Металлический натрий (0,71 г, 31 ммоль) в атмосфере азота осторожно добавляли к метанолу (безводный, 100 мл) и перемешивали в течение 10 минут с получением свежего раствора метоксида натрия. К раствору добавляли 7-фтор-6-нитрохиназолин-4(3Н)-он (1-f, 3,25 г, 15,53 ммоль) и смесь нагревали до кипения в течение 3 ч. Полученную смесь охлаждали до температуры окружающей среды и подкисляли HCl (2 N) до рН=3~4. Летучие компоненты удаляли при пониженном давлении. Остаток суспендировали в воде, твердое вещество отфильтровывали и сушили под вакуумом с получением 1-g (3,17 г, 14,4 ммоль).
К раствору 7-метокси-6-нитрохиназолин-4(3Н)-она (1-g, 1,23 г, 5,56 ммоль) в SOCl2 (8 мл) добавляли ДМФА (0,5 мл) и смесь нагревали до кипения в течение 4 ч. Летучие компоненты удаляли при пониженном давлении с получением (1-h, 1,2 г, 5,0 ммоль).
Смесь 4-хлор-7-метокси-6-нитрохиназолина (1-h, 1,2 г, 5,02 ммоль) и 1-(3-фторбензил)-1Н-индазол-5-амина (1-е, 1,2 г, 4,98 ммоль) в диоксане (40 мл) нагревали до кипения в течение 3 ч. Смесь охлаждали до температуры окружающей среды. Осадок получали путем фильтрации и очистки путем хроматографии на силикагеле с получением 1-i (1,7 г, 3,88 ммоль) в виде желтого твердого вещества.
Никель Ренея (0,13 г сырой массы) в атмосфере азота добавляли к раствору 1-i (1,5 г, 3,7 ммоль) в метаноле (20 мл). Смесь дегазировали и трижды продували Н2, а затем перемешивали в атмосфере водорода при комнатной температуре в течение 4 ч.
Катализатор тщательно отфильтровывали. Фильтрат концентрировали под вакуумом с получением 1-j (1,36 г, 3,29 ммоль) в виде желтого твердого вещества.
К раствору 1-j (1,36 г, 3,29 ммоль) и пиридина (0,78 г, 9,86 ммоль) в ДМФА (3 мл) добавляли фенилхлорформиат (1,53 г, 9,86 ммоль). Смесь перемешивали при комнатной температуре в течение 1 ч. Осадок получали путем фильтрации и сушили с получением 1-k (1,40 г, 2,63 ммоль).
Раствор 1-k (1,1 г, 2,2 ммоль), пиридина (0,2 г, 2,6 ммоль) и (3aR,6aR)-l-метилоктагидропирроло[3,4-b]пиррола (0,33 г, 2,6 ммоль) в ДМФА (3 мл) перемешивали при 80°C в течение 1 ч, а затем погружали в ледяную воду и экстрагировали с EtOAc (3×40 мл). Объединенные экстракты промывали солевым раствором, сушили над Na2SO4 (безводный), фильтровали и концентрировали. Остаток очищали путем хроматографии на силикагеле (EtOAc/метанол=2:1) с получением соединения 1 (0,79 г, 1,4 ммоль). МС (m/е): 567,1 (M+1)+.
Пример 2: (3aS,6aS)-N-(4-(1-(3-фторбензил)-1Н-индазол-5-иламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамид
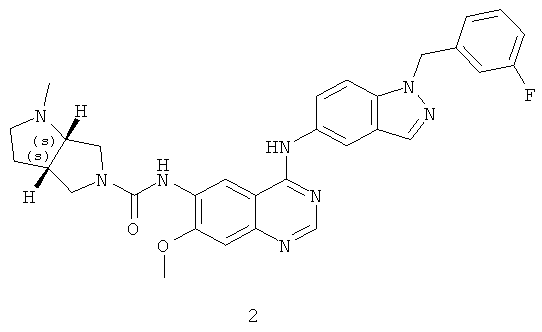
Соединение 2 получали в соответствии со способом из Примера 1 при тех же условиях с использованием (3aS,6aS)-1-метилоктагидропирроло[3,4-b]пиррола. МС (m/е): 566,8 (М+1)+.
Пример 3: (3aR,6aR)-N-(4-(3-этинилфениламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамид
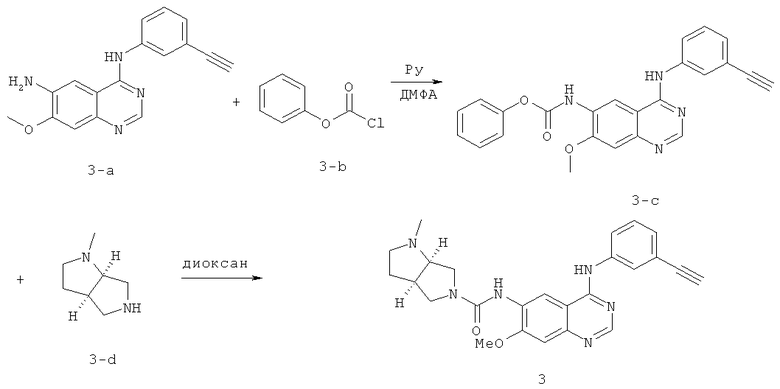
К раствору Соединения 3-а (40 г, 0,138 ммоль, приготовленному в соответствии со способом, описанным в WO 2010002845), пиридина (40 мл, 0,495 ммоль) и ДМФА (безводный, 22 мл) в безводном ТГФ (500 мл) по каплям при -10°C добавляли фенилхлорформиат 3-b (22 мл, 0,175 ммоль). Смесь перемешивали при комнатной температуре в течение 12 часов. Осадок отфильтровывали, а затем суспендировали в насыщенном растворе NaHCO3 (500 мл). Твердое вещество отфильтровывали, промывали водой и EtOAc и сушили под вакуумом с получением соединения 3-е (46 г). Смесь соединения 3-е (1 г, 2,44 ммоль) и соединения 3-d (369 мг, 2,92 ммоль) в диоксане (30 мл) перемешивали при 70°C в течение 5 часов, а затем охлаждали до температуры окружающей среды. Осадок отфильтровывали, промывали EtOAc и сушили под вакуумом с получением соединения 3 (0,8 г). МС (m/е): 443,4 (М+1)+.
Пример 4: (3aS,6aS)-N-(4-(3-хлор-4-(3-фторбензилокси)фениламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло [3,4-b]пиррол-5(1Н)-карбоксамид
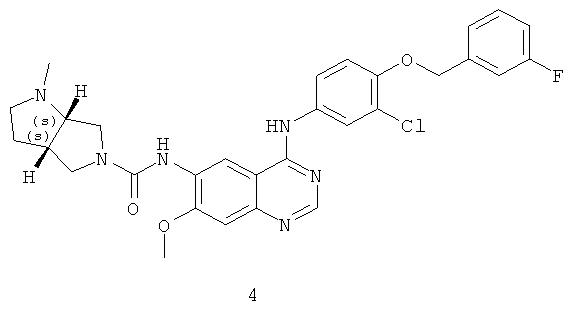
Соединение 4 получали в соответствии со способом из Примера 2. МС (m/e): 576,9 (М+1)+.
Пример 5: (3aR,6aR)-N-(4-(3-хлор-4-(3-фторбензилокси)фениламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамид
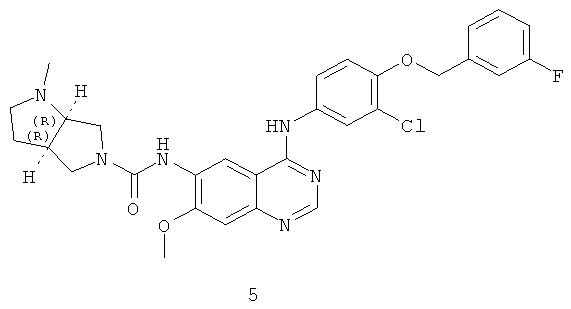
Соединение 5 получали в соответствии со способом из Примера 1. МС (m/e): 576,7 (М+1)+.
Пример 6: (3aS,6aS)-N-(4-(3-хлор-4-(3-фторбензилокси)фениламино)хиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамид
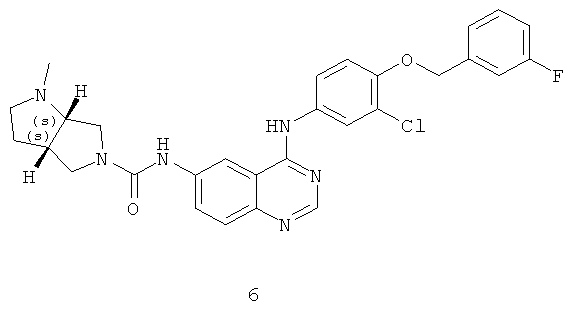
Соединение 6 получали в соответствии со способом из Примера 2. МС (m/e): 546,8 (M+1)+.
Пример 7: (3aR,6aR)-N-(4-(3-хлор-4-(3-фторбензилокси)фениламино)хиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамид
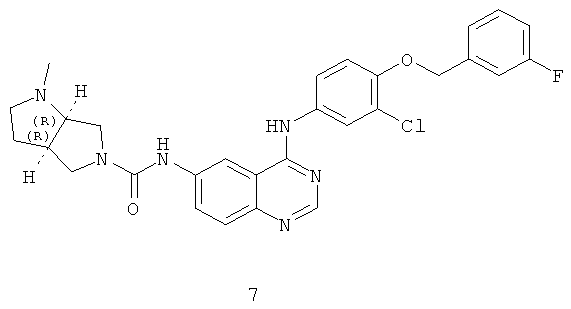
Соединение 7 получали в соответствии со способом из Примера 1. МС (m/e): 546,8 (М+1)+.
Фармакологические исследования
Исследование ингибирования активирования EGFR
Высеивание и истощение клеток: клетки А431 (эпидермоидная карцинома у людей), разбавленные в 10% ФБС, содержащей DMEM, были посеяны в количестве 1,3×104 клеток/лунку в 96-луночные планшеты и инкубировали в течение ночи. Затем среду клеточной культуры заменяли на бессывороточную DMEM среду в количестве 90 мкл/лунка. Планшеты инкубировали в течение ночи для истощения.
Разбавление соединения и лечение: исследуемые соединения трижды разбавляли в бессывороточной среде, содержащей 5% ДМСО. Разбавленное соединение в количестве 10 мкл/лунку добавляли в клетки, в контрольные лунки добавляли 5% ДМСО без исследуемого соединения в количестве 10 мкл/лунку. Повторное исследование выполняли для каждой контрольной точки. Затем планшеты инкубировали 37°C в течение 60 минут в инкубаторе с 5%-ным содержанием СО2.
Получение лизата: среду удаляли и в каждую лунку к клеткам, подвергающимся лизису, добавляли 100 мкл/лунка 50 мМ Трис-Cl, рН 8,0 клеточного лизирующего буфера (содержащего 0,5 М NaCl, 0,2 мМ ЭДТА, 0,1% Triton Х-100, 1 мкг/мл апротинина, 0,75 мкг/мл лейпептина, 1 мкг/мл пепстатина, 1 мМ ДТТ, 500 мкм ванадата натрия и 1 мМ ФМСФ). Непосредственно перед использованием добавляли ингибиторы протеазы. Клеточный лизат замораживали при -80°C в течение ночи.
Покрытие и блокирование планшета: анти-EGFR антитела (Perkin Elmer, AF231) с концентрацией 0,5 мкг/мл в количестве 100 мкл/лунку, разбавленные в PBS, добавляли к 96-луночному DELFIA планшету (Perkin Elmer, AAAND-0001) и инкубировали при 25°C в течение ночи при осторожном встряхивании. Раствор удаляли. Планшет трижды промывали промывочным буфером DELFIA (PBS буфер, содержащий 0,05% Tween-20) в количестве 200 мкл/лунку. 200 мкл/лунка блокирующего буфера (PBS буфер, содержащий 0,137 М NaCl, 0,0027 М KCl, 0,01 М Na2PO4.12H2O, 0,0015 М KH2PO4, рН 7,4 и 1% BSA) добавляли к каждой лунке и планшет инкубировали при 25°C в течение 2 ч при осторожном встряхивании.
Связывание: блокирующий буфер удаляли и планшет трижды промывали промывочным буфером DELFIA в количестве 200 мкл/лунку. А затем образцовый разбавитель (20 мМ Трис-Cl/pH 7,3, 150 мМ NaCl, 0,1% BSA и 0,05% Tween-20) в количестве 80 мкл/лунку и клеточный лизат в количестве 20 мкл/лунку добавляли к каждой лунке. Планшет инкубировали при 25°C в течение еще 1 ч при осторожном встряхивании.
Детектирование: планшет снова трижды промывали промывочным буфером DELFIA в количестве 200 мкл/лунку. Добавляли Eu-РТ66 антитела (Perkin Elmer, AD0040) с концентрацией 0,5 мкг/мл в количестве 100 мкл/лунку, разбавленных в буфере анализа DELFIA (Perkin Elmer, 1244-106), и инкубировали планшет при 25°C в течение 1 ч при осторожном встряхивании. После трехкратной промывки промывочным буфером DELFIA в количестве 200 мкл/лунку добавляли стимулирующий буфер DELFIA (Perkin Elmer, 4001-0010) в количестве 100 мкл/лунку. Планшет инкубировали при 25°C в течение 30 мин при осторожном встряхивании.
Считывание показаний: сигнал флуоресценции измеряли при 340 нм возбуждения и 620 нм испускания на Victor3 (PerkinElmer).
Проценты ингибирования рассчитывали по нижеприведенной формуле:
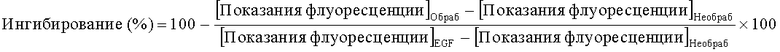
где
[Показания флуоресценции]Обраб представляют собой показания лунок, обработанных исследуемым соединением при стимуляции EGF.
[Показания флуоресценции]Необраб представляют собой показания лунок без обработки соединением и в отсутствие стимуляции EGF, которые использовали в качестве лунок для фонового сигнала.
[Показания флуоресценции]EGF представляют собой показания лунок со стимуляцией EGF, но без обработки соединением, которые использовали в качестве максимального сигнала.
IC50 рассчитывали с использованием программного обеспечения XL-Fit 2.0.
Значения IC50 для соединений 1-7 составили 0,185, 0,439, 0,006, 0,016, 0,044, 0,210 и 0,241 мкМ соответственно.
In vivo противоопухолевые исследования в моделях человеческих ксенотрансплантатов
1. Материалы и способы
Линии опухолевых клеток у человека: клеточные линии Fadu (человеческие голова и шея, карцинома глотки, НТВ-43), НСС827 (человеческий немелкоклеточный рак легких, NSCLC; CRL-2868), A431 (человеческая эпидермоидная карцинома, CRL-2592) были куплены у АТСС; клетки Fadu, НСС827 и A431, выращивали в среде ЕМЕМ, RPMI 1640 и DMEM с добавлением 10% ФБС соответственно. Эти клетки инкубировали в увлажняющем инкубаторе при 37°C и в присутствии 5% СО2.
Животные: бестимусных мышей (6-8 недель) приобретали в Shanghai SLAC laboratory animal CO. LTD. Животных содержали в SPF среде, по 4 животных в клетке в стандартных условиях (12:12 ч свет/темнота, 40-50% относительной влажности при 20-25°C) и обеспечивали свободный доступ к Со60 радиационно-стерилизованной диете и стерильной воде.
Агенты: исследуемые соединения получали в стерильном 0,5% КМЦ-Na при различных концентрациях (0,05~1,0 мг/мл), а затем хранили при 4°C.
Подкожные имплантации опухолевых клеток и исследование противоопухолевой эффективности: опухолевые клетки инкубировали при 37°C в 5% СО инкубаторе, пока они не достигли приблизительно 80% слияния. Клетки отделяли с 0,05% Трипсин-ЭДТА, центрифугировали при 800 оборотах в минуту и суспендировали в бессывороточной среде. Концентрацию подбирали для имплантации бестимусным мышам. Бестимусных мышей помещали на карантин на несколько дней перед имплантацией и подкожно вводили в правый бок 3×106 клеток FaDu или A431 в 0,1 мл среды или 5×106 клеток НСС827 в 0,2 мл среде.
Спустя от одной до трех недель после прививки, когда средний объем опухоли достигал 100-300 мм3, животных отбирали случайным образом и разделяли на группы, для которых применяли различные носители и лекарственные соединения. Мышам один раз в день перорально вводили или носитель, 0,5% КМЦ-Na, или исследуемые соединения в различных дозировках. Объем доз составлял 10 мл/кг массы тела (режим дозирования представлен в Таблице 1 и Таблице 2). Объем опухоли измеряли 2~3 раза в неделю по длине и ширине, определенных при помощи циркуля, и рассчитывали по формуле: Объем опухоли (ТВ, мм3)=ширина2×длина/2. Массу тела животного и его поведение наблюдали в ходе эксперимента. Ингибирование роста опухоли рассчитывали по следующей формуле: TGI (%)=100-(Т-Т0)/(С-С0)×100%, где Т представляет собой средний объем опухоли в группе, получающей лечение, в определенный день эксперимента, Т0 представляет собой средний объем опухоли в той же группе, получающей лечение, в первый день эксперимента, С представляет собой средний объем опухоли в контрольной группе в определенный день эксперимента, а С0 представляет собой средний объем опухоли в той же контрольной группе в первый день эксперимента.
2. Статистический анализ
Данные по объемам опухолей выражали в виде Среднее ± СКО. Однофакторный дисперсионный анализ использовали для множественных сравнений, а критерий Стьюдента использовали для сравнения с контрольным растворителем. Различия считали статистически значимыми при Р<0,05.
3. Результаты
Исследуемое соединение показало значительное ингибирование роста опухоли на трех модельных опухолях в способе, зависящем от дозирования. Кроме того, ни одна из мышей, получавших исследуемое соединение, не показала значительной потери массы тела в ходе эксперимента.
TGIы (%), полученные на основе представленного в Примере 3 исследуемого. соединения, представлены в нижеприведенной таблице:
Исследование hERG
1. Клеточная культура
Для исследования использовали линию клеток СНО, стабильно трансфицированную hERG кДНК и экспрессирующую hERG-каналы. Клетки культивировали в среде, содержащей:
- модифицированную по способу Дульбекко среду Игла (DMEM/F12)
- 10% (об./об.) активированную теплом фетальную бычью сыворотку (ФБС)
- 1% (об./об.) пенициллин/стрептомицин
- 500 мкг/мл реагента Geneticin® (G418)
Перед исследованием клетки отбирали при помощи Accumax (Innovative Cell Technologies).
2. Растворы
Для электрофизиологических исследований применяли следующие растворы
3. Система регистрации
Цельноклеточную регистрацию проводили с использованием ЕРС10 USB(HEKA). Клетки подвергали фиксации напряжения при исходном потенциале, равном -80 мВ. Ток hERG активировали путем деполяризации при +20 мВ в течение 2 сек, после которой ток возвращали на уровень в -50 мВ в течение 2 сек для удаления инактивации и наблюдения деактивации следового тока. Первую стадию при -50 мВ использовали в качестве базовой линии для измерения амплитуды пика следового тока.
4. Подготовка и разбавление соединения
Соединения получали в виде 10 мМ ДМСО исходного раствора в стеклянном сосуде. Исходный раствор энергично перемешивали в течение 10 минут при комнатной температуре. Для исследования соединение разбавляли в стеклянном сосуде при помощи подготовленного раствора; разбавитель готовили не более чем за 30 минут перед использованием. Равные количества ДМСФ (0,1%) присутствовали при конечном разбавлении.
5. Электрофизиологические исследования
После достижения цельноклеточной конфигурации за клетками наблюдали в течение 90 сек для оценки стабильности и промывали внешним раствором в течение 66 сек. Схему приложения напряжения, описанную выше, затем применяли к клеткам каждые 20 сек на протяжении всего исследования. Только стабильные клетки с исследуемыми параметрами выше пороговой величины отбирали для использования в исследовании введения лекарств.
Внешний раствор, содержащий 0,1% ДМСО (носитель), применяли к клеткам для установления базовой линии. Соединение применяли после стабилизации тока в течение 3 минут. Раствор соединения добавляли в 4 стадии и клетки хранили в исследуемом растворе до тех пор, пока эффект соединения не достигал устойчивого состояния или максимума на протяжении 6 мин. Далее добавляли положительный контроль (100 нМ Cisapride). Вымывание вместе с внешним раствором проводили до тех пор, пока восстановление тока не достигало устойчивого состояния.
6. Анализ данных
Данные анализировали при помощи Pulsefit and Origin 7 (Originlab Corporation).
7. Результат
Соединение 3 ингибировало следовые токи hERG с IC50, равным 9,3±1,2 мкМ (пять концентраций, 5×2), при анализе с помощью ручного цельноклеточного пэтч-кламп исследования.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ОКТАГИДРОПИРРОЛО[3,4-b]ПИРРОЛА (ВАРИАНТЫ), СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ОКТАГИДРОПИРРОЛО[3,4-b]ПИРРОЛА (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ ИЛИ НАРУШЕНИЯ СОСТОЯНИЯ ОРГАНИЗМА, ЧУВСТВИТЕЛЬНОГО К МОДУЛЯЦИИ АКТИВНОСТИ РЕЦЕПТОРА ГИСТАМИНА-3 | 2007 |
|
RU2492172C2 |
| N-ОКСИДЫ ОКТАГИДРО-ПИРРОЛО[3,4-b]ПИРРОЛА | 2008 |
|
RU2486187C2 |
| ПРОИЗВОДНЫЕ ПИРРОЛОПИРИМИДИНА, ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ JAK-КИНАЗЫ | 2012 |
|
RU2618673C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ ДЛЯ ОПОСРЕДОВАНИЯ АКТИВНОСТИ ТИРОЗИНКИНАЗЫ 2 | 2020 |
|
RU2826012C2 |
| ЗАМЕЩЕННЫЕ ПУРИНОВЫЕ И 7-ДЕАЗАПУРИНОВЫЕ СОЕДИНЕНИЯ | 2011 |
|
RU2606514C2 |
| ЗАМЕЩЕННЫЕ 4-(СЕЛЕНОФЕН-2(ИЛИ 3)-ИЛАМИНО)ПИРИМИДИНОВЫЕ СОЕДИНЕНИЯ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2597609C2 |
| Соединения 1-циано-пирролидинов в качестве ингибиторов USP30 | 2016 |
|
RU2717238C2 |
| ХИНАЗОЛИНОВЫЕ ИНГИБИТОРЫ АКТИВИРУЮЩИХ МУТИРОВАННЫХ ФОРМ РЕЦЕПТОРА ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА | 2014 |
|
RU2656597C2 |
| СОЛИ ПРОИЗВОДНОГО ХИНАЗОЛИНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2016 |
|
RU2720810C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМБИНАЦИЯ, СОДЕРЖАЩАЯ TNO155 И РИБОЦИКЛИБ | 2020 |
|
RU2813111C2 |
Изобретение относится к (3aR,6aR)-N-(4-(3-этинилфениламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамиду или его фармацевтически приемлемой соли, а также к фармацевтической композиции для лечения ракового заболевания, чувствительного к ингибированию гиперэкспрессии и/или гиперактивности рецептора эпидермального фактора роста, содержащей указанное соединение, способу лечения ракового заболевания, способу ингибирования и к применению указанного соединения для приготовления лекарственного средства. Технический результат - (3aR,6aR)-N-(4-(3-этинилфениламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамид, проявляющий ингибирующую активность к гиперэкспрессии и/или гиперактивности рецептора эпидермального фактора роста. 5 н. и 7 з.п. ф-лы, 4 табл., 7 пр.
1. Соединение (3aR,6aR)-N-(4-(3-этинилфениламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамид или его фармацевтически приемлемая соль.
2. Фармацевтическая композиция для лечения ракового заболевания, чувствительного к ингибированию гиперэкспрессии и/или гиперактивности рецептора эпидермального фактора роста, содержащая по меньшей мере один фармацевтически приемлемый носитель и терапевтически эффективное количество соединения (3aR,6aR)-N-(4-(3-этинилфениламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида или его фармацевтически приемлемой соли.
3. Способ лечения ракового заболевания, чувствительного к ингибированию гиперэкспрессии и/или гиперактивности рецептора эпидермального фактора роста, включающий введение пациенту, нуждающемуся в лечении, эффективного количества соединения (3aR,6aR)-N-(4-(3-этинилфениламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида или его фармацевтически приемлемой соли.
4. Способ по п.3, отличающийся тем, что раковое заболевание выбирают из рака легких, рака головы и шеи, колоректального рака, рака глотки, эпидермоидного рака и рака поджелудочной железы.
5. Способ по п.4, отличающийся тем, что рак легких представляет собой немелкоклеточный рак легких.
6. Способ ингибирования гиперэкспрессии и/или гиперактивности рецептора эпидермального фактора роста, включающий приведение в контакт рецептора эпидермального фактора роста с эффективным количеством соединения по п.1 или его фармацевтически приемлемой соли.
7. Применение соединения по п.1 или его фармацевтически приемлемой соли для приготовления лекарственного средства для лечения ракового заболевания.
8. Применение п.7, отличающееся тем, что раковое заболевание выбирают из рака легких, рака головы и шеи, колоректального рака, рака глотки, эпидермоидного рака и рака поджелудочной железы.
9. Применение по п.8, отличающееся тем, что рак легких представляет собой немелкоклеточный рак легких.
10. Соединение или его фармацевтически приемлемая соль по п.1 для ингибирования гиперэкспрессии и/или гиперактивности рецептора эпидермального фактора роста или для лечения ракового заболевания, чувствительного к ингибированию гиперэкспрессии и/или гиперактивности рецептора эпидермального фактора роста.
11. Соединение и/или его фармацевтически приемлемая соль по п.10, отличающееся тем, что раковое заболевание выбирают из рака легких, рака головы и шеи, колоректального рака, рака глотки, эпидермоидного рака и рака поджелудочной железы.
12. Соединение или его фармацевтически приемлемая соль по п.11, отличающееся тем, что рак легких представляет собой немелкоклеточный рак легких.
| CN 101619043 А, 06.01.2010 | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СПОСОБ ДОСТИЖЕНИЯ АНТИАНГИОГЕННОГО И/ИЛИ ЭФФЕКТА СНИЖЕНИЯ ПРОНИЦАЕМОСТИ КРОВЕНОСНЫХ СОСУДОВ У ТЕПЛОКРОВНОГО ЖИВОТНОГО | 1997 |
|
RU2198879C2 |
Авторы
Даты
2014-10-20—Публикация
2011-05-25—Подача