Настоящее изобретение относится к лекарственному средству, применяемому для профилактики и/или лечения синуклеинопатий.
Синуклеинопатии представляют собой группу разнообразных нейродегенеративных расстройств, которые имеют общую патологическую характеристику: при невропатологических обследованиях могут быть обнаружены характерные поражения, содержащие аномальные агрегаты белка альфа-синуклеина (альфа-син, а-син) в отдельных популяциях нейронов и глиальных клеток.
Альфа-син (исходно идентифицированный как PARK1 и PARK4) представляет собой белок из 140 аминокислот, широко экспрессирующийся в новой коре головного мозга, в гиппокампе, в зубчатой извилине, обонятельной луковице, в полосатом теле, таламусе и мозжечке. Альфа-син также имеет высокий уровень экспрессии в гемопоэтических клетках, включающих В-, Т-, NK-клетки, а также моноциты и тромбоциты. Его точная роль в этих клетках не известна, но он вовлечен в дифференцировку мегакариоцитов (предшественников тромбоцитов).
Наиболее распространенные синуклеинопатии включают, в частности расстройства, связанные с тельцами Леви, (LBD) типа болезни Паркинсона (PD), болезнь Паркинсона с деменцией (PDD) и деменцию, связанную с тельцами Леви (DLB), а также множественную системную атрофию (MSA) или нейродегенерацию с накоплением в мозге железа 1-го типа (NBIA Типа I). Современные способы лечения для этих заболеваний включают симптоматические лекарственные средства, такие как L-dopa, антихолинергические средства, а также ингибиторы моноаминоксидазы. Однако возможности лечения, имеющиеся в настоящий момент, приводят только к симптоматическому улучшению, но не вызывают продолжительного модифицирующего заболевание эффекта.
Расстройства, связанные с тельцами Леви (LBD), представляют собой прогрессирующие нейродегенеративные расстройства, характеризующиеся тремором, ригидностью, брадикинезией и потерей дофаминергических нейронов в мозге. В случае DLB и PDD признаки также включают когнитивное расстройство. В западных странах у около 2% населения старше 60 лет развиваются типичные признаки PD/LBD. В настоящее время доступно только симптоматическое лечение. К сожалению, эти терапии обеспечивают только временное облегчение от ранних симптомов и не останавливают прогрессию заболевания. Патогенез PD/LBD все еще не до конца ясен, но очевидно, что генетическая предрасположенность и факторы окружающей среды вовлечены в развитие заболевания. Несмотря на все успехи в области генетики, PD/LBD представляет собой первичное спорадическое заболевание неизвестной причины (также называемое идиопатическим PD/LBD).
У пациентов, страдающих этим заболеванием, развиваются характерные убиквитинированные внутриклеточные включения, называемые тельцами Леви (LB) в кортикальной и субкортикальной областях мозга. Особенно участки с высоким содержанием допаминергических нейронов или нейронные выросты демонстрируют эту типичную патологическую черту. Недавно в некоторых исследованиях смогли продемонстрировать, что в патогенезе LBD центральную роль играет синаптический белок альфа-син. При LBD альфа-син накапливается в LB, воздействуя на все области мозга. Кроме того, было показано, что точечные мутации, а также удвоения или умножения в гене альфа-син ассоциированы с редкими наследственными формами паркинсонизма. Важно, что на основе результатов, полученных при исследовании сверхэкспрессии в трансгенных (tg) мышах, а также в Drosophila melanogaster, подтверждена ключевая роль данного белка при патогенезе PD/LBD, поскольку эти животные модели имитируют некоторые характеристики PD.
Другой очень важной синуклеинопатией является Множественная Системная Атрофия (MSA). MSA представляет собой спорадическое нейродегенеративное расстройство, которое характеризуется симптомами L-DOPA-устойчивого паркинсонизма, мозжечковой атаксией и вегетативной дистонией. Пациенты страдают от многосистемной потери нейронов, которой подвержены различные области мозга, включающие полосатое тело, черную субстанцию, мозжечок, мост, а также нижнюю оливу и спинной мозг. MSA отличается альфа-син-положительными глиальными цитоплазматическими (GCI) и редкими нейронными включениями по всей центральной нервной системе. Эти включения ассоциированы с дегенерацией полосатого тела и черного вещества, атрофию нижней оливы и вовлечение автономных ядер в спинном мозге. Важность GCI для патогенеза MSA, как правило, известна и подтверждена недавним анализом с использованием моделей трансгенных мышей, с помощью которых анализируют эффект альфа-син-сверхэкспрессии в олигодендроглии. В tg-мышах, сверхэкспрессирующих человеческий альфа-син, наблюдали как GCI-подобные агрегаты, так и биохимические маркеры MSA.
Хотя еще не до конца понятны точные механизмы, с помощью которых накопление белка альфа-син приводит к типичным признакам нейродегенерации в синуклеинопатии, недавние исследования свидетельствуют о том, что аномальное образование и накопление альфа-син вовлечено в нейродегенеративные процессы, лежащие в основе синуклеинопатии. Недавно были идентифицированы различные формы альфа-син в LB. Кроме полноразмерной формы белка были идентифицированы различные формы модифицированного альфа-син, включающие фосфорилированный, нитрированный и моно-, ди- или три-убиквитинированный альфа-син. Кроме того, укороченные по С-концу формы белка типа альфа-син 1-119, альфа-син 1-122 и альфа-син 1-123 были детектированы в ткани мозга как у трансгенных мышей, так и в PD-случаях. В настоящее время считается, что до 15% альфа-син, который детектировали в LB и в нейритах Леви, является укороченным. В проводимых ранее исследованиях in vitro с использованием укороченного альфа-син было показано, что альфа-син, лишенный 20-30 С-концевых аминокислот, демонстрирует повышенную тенденцию к агрегации и к образованию волокон, обнаруженных в нейритах Леви и в LB. Соответственно, такие укороченные варианты могли функционировать аналогично функционированию укороченных и модифицированных форм бета-амилоида (Ар) при болезни Альцгеймера (AD). Считается, что эти укороченные и модифицированные формы Ар функционируют в качестве затравочных молекул для отложения бляшек и демонстрируют более высокую склонность к агрегации, а также высокую нейротоксичность и синаптотоксичность in vivo и in vitro.
Поэтому считается, что полноразмерный альфа-син, а также укороченные и/или модифицированные формы альфа-син, которые демонстрируют потенциальный затравочный эффект, накапливаются, приводя к образованию олигомеров. На основе недавних исследований считается, что такое образование олигомеров, например, в синаптических окончаниях и в аксонах, играет важную роль при развитии PD/LBD и может, таким образом, усиливаться присутствием укороченных форм альфа-син. Следовательно, снижение депонирования и олигомеризации альфа-син должно быть полезным при лечении синуклеинопатии, особенно идиопатических LBD/PD и MSA, и может представлять собой первую стратегию для лечения нейродегенеративных заболеваний в дополнение к простому облегчению симптомов в результате применяемых в настоящее время стратегий лечения, таких как применение L-DOPA.
В работе Iwatsubo Т. (Neuropathology 27 (5)(2007): 474-478) исследовали корреляцию депонирования альфа-син, а также его фосфорилирования с патогенезом альфа-синуклеинопатий. Автор данной публикации обнаружил, что серин 129 альфа-синуклеина, депонированного в очагах синуклеинопатии, является в высокой степени фосфорилированным. US 2007/213253 относится к мутированному человеческому альфа-синуклеину, а также к пептидам, полученным на его основе, которые можно применять для ингибирования агрегации человеческого альфа-синуклеина дикого типа. В WO 2004/041067 раскрыты средства и способы для профилактики или лечения заболеваний, ассоциированных с агрегацией альфа-синуклеина, которые включают применение фрагментов альфа-синуклеина. В US 2003/166558 описаны пептиды, которые можно применять для индукции иммунного ответа на отложения белка. US 2005/198694 относится к фрагментам альфа-синуклеина, содержащим, по меньшей мере, 100 аминокислот и имеющим С-концевую делецию из 1-23 аминокислот.
Liang et al. (J. Neurochem. 99(2006): 470-482) исследовали регуляцию альфа-синуклеина у крыс. Они наблюдали, что у крыс, предпочитающих спирт, степень экспрессии альфа-синуклеина была повышена по сравнению с крысами, не предпочитающими спирт.
В работе Hamilton BA (Genomics 83(2004): 739-742) исследовали распространение альфа-синуклеина 53Thr и 53Ala среди приматов.
В US 2005/0037013 раскрыты иммуногенные фрагменты альфа-синуклеина, которые способны индуцировать иммунный ответ против специфического эпитопа внутри области синуклеина, содержащей остатки 70-140.
WO 2006/045037 относится к укороченным по С-концу молекулам альфа-синуклеина, которые можно применять для скрининга на предмет поиска агентов, которые обладают фармакологической активностью, пригодной для лечения заболевания, ассоциированного с тельцами Леви.
Хотя экспериментальные терапии, применяющие нейротрофические факторы и пересадку допаминергических клеток, приносили многообещающие результаты, тем не менее, требуются альтернативные способы, разработанные для снижения нейронного накопления альфа-син. Накоплены очевидные факты о том, что агрегаты альфа-син могут быть подвергнуты иммунотерапии. Действительно, недавно была продемонстрирована возможность лечения синуклеинопатий. Tg-мышей, сверхэкспрессирующих человеческий альфа-син, вакцинировали белком альфа-син. У мышей, которые в результате вакцинации продуцировали относительно высокоаффинные антитела, было пониженное накопление агрегированного альфа-син в тельцах нейронных клеток и синапсах, что приводило к уменьшению нейродегенерации. Кроме того, антитела, продуцируемые иммунизированными животными, также детектировали аномальные агрегированные формы альфа-син, ассоциированные с нейронной мембраной, и стимулировали деградацию этих агрегатов, вероятно посредством лизосомных путей. Аналогичные эффекты наблюдали при применении пассивной иммунотерапии с помощью экзогенно вносимых антител, специфичных к альфа-син. На основании этих результатов можно предположить, что вакцинация эффективна при снижении нейронного накопления альфа-син агрегатов и что дальнейшее развитие данного способа может оказать полезное воздействие при лечении LBD и синуклеинопатий.
Целью настоящего изобретения является получение лекарственного средства на основе вакцины для предотвращения и лечения синуклеинопатий.
Настоящее изобретение относится к предложению, по меньшей мере, одного пептида или полипептида, содержащего аминокислотную последовательность

где
X1 представляет собой любой аминокислотный остаток,
Х2 представляет собой аминокислотный остаток, выбранный из группы, состоящей из лизина (К), аргинина (R), аланина (А) и гистидина (Н),
Х3 представляет собой аминокислотный остаток, выбранный из группы, состоящей из аспарагина (N), глутамина (Q), серина (S), глицина (G) и аланина (А), предпочтительно из аспарагина (N), серина (S), глицина (G) и аланина (А),
Х4 представляет собой аминокислотный остаток, выбранный из группы, состоящей из глутаминовой кислоты (Е), аспарагиновой кислоты (D) и аланина (А),
Х5 представляет собой аминокислотный остаток, выбранный из группы, состоящей из глутаминовой кислоты (Е) и аспарагиновой кислоты (D),
Х6 представляет собой аминокислотный остаток, выбранный из группы, состоящей из аланина (А) и тирозина (Y),
Х7 представляет собой любой аминокислотный остаток,
n и m, независимо, равны 0 или представляют собой целое число больше 0
и где аминокислотная последовательность согласно Формуле I не идентична или не содержит 7-мерный полипептидный фрагмент альфа-синуклеина, имеющего аминокислотную последовательность KNEEGAP,
причем, по меньшей мере, один указанный пептид или полипептид обладает способностью связывания с антителом, которое специфично к эпитопу альфа-синуклеина, содержащего аминокислотную последовательность KNEEGAP для применения в предотвращении и/или лечении синуклеинопатий.
Эти пептиды или полипептиды в соответствии с настоящим изобретением могут быть представлены в композициях, подходящих для предписанного использования для предотвращения и/или лечения синуклеинопатий, особенно в фармацевтических композициях, предпочтительно объединенных с фармацевтически приемлемым носителем. Такие фармацевтические композиции можно вводить нуждающемуся в этом пациенту в эффективном количестве для достижения профилактического и/или терапевтического эффекта.
Пептиды и полипептиды в соответствии с настоящим изобретением способны индуцировать in vivo-образование антител, направленных на (связывающихся) альфа-синуклеин и его фрагменты, конкретно фрагменты альфа-синуклеина, содержащие аминокислотную последовательность KNEEGAP. Однако антитела, направленные на (связывающие) указанные пептиды и полипептиды, демонстрируют отсутствие или фактическое отсутствие иммунной реактивности на бета-синуклеин (бета-син, b-син). Таким образом, в отличие от исходного альфа-синуклеина или его фрагментов, пептиды и полипептиды в соответствии с настоящим изобретением обеспечивают специфичность по отношению к агенту, связанному с заболеванием, и позволяют избежать перекрестной реактивности с синуклеинами, не связанными с заболеванием. Это убедительно указывает на значительное превосходство в отношении эффективности и безопасности, причем последняя достигается в том числе за счет нейрозащитных характеристик, которые были описаны для бета-синуклеина (Hashimoto M. et al., J Biol Chem. 2004 May 28; 279(22):23622-9. Hashimoto M, Neuron. 2001 Oct 25; 32(2):213-23).
Специфичные к альфа-синуклеину антитела, индуцированные путем введения соединений по настоящему изобретению, могут не только связывать мономерные формы альфа-синуклеина, но также и мультимерные формы. Это дает возможность уменьшения количества олигомеров альфа-синуклеина в организме индивидуума, подвергаемого лечению. Уменьшение альфа-синуклеина особенно полезно при лечении синуклеинопатий.
Предполагается, что аминокислотная последовательность (Х1)nX2X3X4X5GX6P(Х7)m является мимеотопом эпитопа альфа-синуклеина, содержащим аминокислотную последовательность KNEEGAP. В соответствии с настоящим изобретением термин «мимеотоп» обозначает молекулу, которая имеет конформацию, обладающую топологией, эквивалентной эпитопу, который она имитирует. Мимеотоп связывается с тем же антигенсвязывающим участком антитела, который иммуноспецифично связывается с целевым антигеном. Мимеотоп будет вызывать иммунологический ответ у хозяина, который реактивен к антигену, который он имитирует. Мимеотоп также может функционировать в качестве конкурента для эпитопа, который он имитирует в in vitro-анализах ингибирования (например, ингибирующий твердофазный ИФА (тИФА)), которые включают эпитоп и антитело, связывающееся с указанным эпитопом. Однако мимеотоп по настоящему изобретению необязательно может предотвращать или конкурировать за связывание эпитопа, который он имитирует в in vivo-анализе ингибирования, хотя он способен индуцировать специфичный иммунный ответ при введении млекопитающему.
При использовании в настоящем документе термин «эпитоп» обозначает иммуногенный участок антигена, который распознается молекулой конкретного антитела. Как правило, антиген будет обладать одним или несколькими эпитопами, каждый из которых способен связываться с антителом, которое распознает конкретный эпитоп.
Мимеотопы по настоящему изобретению могут быть получены синтетически с помощью методов химического синтеза, которые хорошо известны в данной области, как в виде выделенного пептида, так и в виде части другого пептида или полипептида. Альтернативно, пептидный мимеотоп может быть получен в микроорганизме, который продуцирует пептидный мимеотоп, который затем выделяют и, если целесообразно, дополнительно очищают. Пептидный мимеотоп может быть получен в таких микроорганизмах, как бактерии, дрожжи или грибы, в эукариотических клетках, таких как клетки млекопитающего или клетки насекомого, или в рекомбинантном вирусном векторе, таком как аденовирус, поксвирус, герпесвирус, вирус леса Семлики, бакуловирус, бактериофаг, вирус синдбис или вирус Сендай. Подходящие бактерии для продуцирования пептидного мимеотопа включают Е. coli, В. subtilis или любые другие бактерии, которые способны экспрессировать пептиды, такие как пептидный мимеотоп. Подходящие типы дрожжей для экспрессии пептидного мимеотопа, включают Saccharomyces cerevisiae, Schizosaccharomyces pombe, Candida, Pichia pastoris или любые другие дрожжи, которые способны экспрессировать пептиды. Соответствующие методы хорошо известны в данной области. Также в данной области хорошо известны способы выделения и очистки рекомбинантно полученных пептидов, которые включают, например, гель-фильтрацию, аффинную хроматографию, ионообменную хроматографию и т.д.
Для облегчения выделения пептидного мимеотопа может быть сконструирован химерный белок, в котором пептидный мимеотоп трансляционно объединен (ковалентно связан) с гетерологичным полипептидом, который делает возможным выделение с помощью аффинной хроматографии. Типичные гетерологичные полипептиды представляют собой His-таг (например, His6; 6 остатков гистидина), GST-таг (Глутатион-S-трансфераза) и т.д. Химерный полипептид облегчает не только очистку миметопов, но также может предотвращать деградацию полипептида мимеотопа при очистке. Если после очистки целесообразно удалить гетерологичный полипептид, то химерный полипептид должен содержать сайт расщепления в месте соединения между пептидным мимеотопом и гетерологичным полипептидом. Сайт расщепления состоит из аминокислотной последовательности, которая отщепляется с помощью фермента, специфичного для аминокислотной последовательности в сайте (например, протеазы).
Согласно предпочтительному воплощению настоящего изобретения X2 представляет собой аминокислотный остаток, выбранный из группы, состоящей из лизина (K) и аргинина (R), и/или Х6 представляет собой аланин (А).
Согласно конкретному предпочтительному воплощению настоящего изобретения пептид или полипептид содержит аминокислотную последовательность, выбранную из группы, состоящей из (X1)nKNDEGAP(X7)m, (X1)nANEEGAP(X7)m, (X1)nKAEEGAP(X7)m, (X1)nKNAEGAP(X7)m, (X1)nRNEEGAP(X7)m, (X1)nHNEEGAP(X7)m, (X1)nKNEDGAP(X7)m, (X1)nKQEEGAP(X7)m, (X1)nKSEEGAP(X7)m, (X1)nKNDDGAP(X7)m, (X1)nRNDEGAP(X7)m, (X1)nRNEDGAP(X7)m, (X1)nRQEEGAP(X7)m, (X1)nRSEEGAP(X7)m, (X1)nANDEGAP(X7)m, (X1)nANEDGAP(X7)m, (X1)nHSEEGAP(X7)m, (X1)nASEEGAP(X7)m, (X1)nHNEDGAP(X7)m, (X1)nHNDEGAP(X7)m, (X1)nRNAEGAP(X7)m, (X1)nHNAEGAP(X7)m, (X1)nKSAEGAP(X7)m, (X1)nKSDEGAP(X7)m, (X1)nKSEDGAP(X7)m, (X1)nRQDEGAP(X7)m, (X1)nRQEDGAP(X7)m, (X1)nHSAEGAP(X7)m, (X1)nRSAEGAP(X7)m, (X1)nRSDEGAP(X7)m, (X1)nRSEDGAP(X7)m, (X1)nHSDEGAP(X7)m, (X1)nHSEDGAP(X7)m, (X1)nRQDDGAP(X7)m, предпочтительно (X1)nKNDEGAP(X2)m, (X1)nRNEEGAP(X2)m, (X1)nRNDEGAP(X2)m, (X1)nKNAEGAP(X2)m, (X1)nKSDEGAP(X2)m, (X1)nRNAEGAP(X2)m или (X1)nRSEEGAP(X2)m.
Отсюда вытекает, что при лечении и профилактике синуклеинопатий можно применять не только пептиды и полипептиды согласно формуле I, но также и другие пептиды и полипептиды. Таким образом, другой аспект настоящего изобретения относится, по меньшей мере, к одному пептиду или полипептиду, содержащему аминокислотную последовательность, выбранную из группы, состоящей из (X1)nKNEAGAP(X7)m, (X1)nKNEEAAP(X7)m, (X1)nKNEEGAA(X7)m, (X1)nKPSFKNE(X7)m, (X1)nQPSFAME(X7)m, (X1)nSPSFKQE(X7)m, (X1)nTPSWKGE(X7)m, (X1)nDPSFALE(X7)m, (X1)nLPSFRLE(X7)m, (X1)nEPNSRMD(X7)m, (X1)nQPSSKLD(X7)m, (X1)nHIHQSKFFDAPP(X7)m, (X1)nQASFAME(X7)m, (X1)nTASWKGE(X7)m, (X1)nQASSKLD(X7)m, (X1)nQPAFAME(X7)m, (X1)nTPAWKGE(X7)m, (X1)nQPASKLD(X7)m, (X1)nQPSFAMA(X7)m, (X1)nTPSWKGA(X7)m, (X1)nQPSSKLA(X7)m, (X1)nAPSWKGE(X7)m, (X1)nTPSAKGE(X7)m, (X1)nTPSWAGE(X7)m, (X1)nTPSWKAE(X7)m, (X1)nTPSWKGE(X7)m, особенно содержащему аминокислотную последовательность, выбранную из группы, состоящей из (X1)nQASFAME(X7)m, (X1)nTASWKGE(X7)m, (X1)nQASSKLD(X7)m, (X1)nTPAWKGE(X7)m, (X1)nTPSWAGE(X7)m, (X1)nTPSWKGE(X7)m,
где
X1 представляет собой любой аминокислотный остаток,
Х7 представляет собой любой аминокислотный остаток,
n и m, независимо, равны 0 или представляют собой целое число более чем 0,
причем, по меньшей мере, один указанный пептид или полипептид обладает способностью связывания с антителом, которое специфично к эпитопу альфа-синуклеина, содержащего аминокислотную последовательность KNEEGAP для применения в предотвращении и/или лечении синуклеинопатий, особенно в получении лекарственного средства на его основе.
Пептиды и полипептиды по настоящему изобретению также могут быть модифицированными по N- и/или С-концу или в соседней области так, чтобы в указанных положениях остаток цистеина был с ними связан. В предпочтительном воплощении расположенные в концевых областях (локализованные на N- и С-концах пептида) остатки цистеина используются для перекрестной сшивки указанной молекулы с молекулами носителей, таких как KLH, или для циклизации пептидов посредством дисульфидной связи. Таким образом, n и/или m предпочтительно равны 1, a X1 и/или Х7 предпочтительно представляют собой цистеин (С).
Мимеотопы по настоящему изобретению также можно применять в различных анализах и наборах реагентов, конкретно в иммунологических анализах и наборах реагентов. Таким образом, особенно предпочтительно, что пептиды и полипептиды по настоящему изобретению могут быть частью другого пептида или полипептида, особенно фермента, который используется в качестве репортера в иммунологических анализах. Такие репортерные ферменты включают, например, щелочную фосфатазу или пероксидазу хрена.
Мимеотопы синуклеина по настоящему изобретению предпочтительно представляют собой антигенные полипептиды, которые в своей аминокислотной последовательности варьируются от аминокислотной последовательности альфа-синуклеина или его фрагментов. В этом отношении мимеотопы по изобретению могут не только содержать аминокислотные замены одного или нескольких природных аминокислотных остатков, но также одной или нескольких синтетических аминокислот (т.е. не из 20 «классических» аминокислот), или они могут полностью состоять из таких синтетических аминокислот. Кроме того, антигены по изобретению, которые индуцируют антитела к альфа-синуклеину, могут состоять из D- или L-аминокислот или из комбинаций DL-аминокислот, и, необязательно, они могут быть изменены с помощью дополнительных модификаций, циклизаций или дериватизаций. Подходящие антигены, индуцирующие антитела к альфа-синуклеину, могут быть получены из коммерчески доступных пептидных библиотек. Предпочтительно эти пептиды состоят, по меньшей мере, из 7 аминокислот, и предпочтительная длина может достигать до 16, предпочтительно до 14 или 20 аминокислотных остатков (например, от 7 или 8 до 20, от 7 или 8 до 16 и т.д.). Таким образом, пептид или полипептид по настоящему изобретению содержит 7-30 аминокислотных остатков, предпочтительно 7-20, более предпочтительно 7-16, наиболее предпочтительно 8 аминокислотных остатков. Однако в соответствии с изобретением также можно прекрасно применять более длинные пептиды в качестве антигенов, индуцирующих антитела к альфа-синуклеину. Кроме того, мимеотопы по настоящему изобретению также могут быть частью полипептида и, следовательно, содержат на своем N- и/или С-конце, по меньшей мере, один дополнительный аминокислотный остаток.
Для получения мимеотопов альфа-синуклеина (т.е. антигенов, индуцирующих альфа-синуклеиновых антител), также подходят фаговые библиотеки, пептидные библиотеки, например, полученные посредством комбинаторной химии или полученные посредством высокопроизводительных методов скрининга для большинства различных структур (Display: A Laboratory Manual by Carlos F. Barbas (Editor), et al.; Willats WG Phage display: practicalities and prospects. Plant Mol. Biol. 2002 Dec.; 50(6):837-54).
Кроме того, в соответствии с изобретением также можно применять антигены, индуцирующие антитела к альфа-синуклеину, на основе нуклеиновых кислот («аптамеров»), и они также могут быть обнаружены с помощью большинства различных (олигонуклеотидных) библиотек (например, с помощью 2-180 остатков нуклеиновых кислот) (например, Burgstaller et al., Curr. Opin. Drug Discov. Dev. 5(5) (2002), 690-700; Famulok et al., Ace. Chem. Res. 33 (2000), 591-599; Mayer et al., PNAS 98 (2001), 4961-4965, etc.). В антигенах, индуцирующих антитела к альфа-синуклеину на основе нуклеиновых кислот, каркас нуклеиновой кислоты может быть представлен, например, в виде природных фосфор-диэфирных соединений или также в виде фосфоротиоатов, или комбинаций, или химических вариаций (например, таких как ПНК (PNA)), где в качестве оснований в соответствии с изобретением можно применять главным образом U, Т, А, С, G, Н и mC. 2'-остатки нуклеотидов, которые можно применять в соответствии с настоящим изобретением, предпочтительно представляют собой Н, ОН, F, Cl, NH, O-метил, O-этил, O-пропил или O-бутил, где нуклеиновые кислоты также могут быть модифицированы различным образом, т.е., например, с помощью защитных групп, поскольку они широко применяются в олигонуклеотидном синтезе. Таким образом, антигены, индуцирующие антитела к альфа-синуклеину, на основе аптамеров также являются предпочтительными антигенами, индуцирующими антитела к альфа-синуклеину, в рамках настоящего изобретения.
В соответствии с настоящим изобретением термин «синуклеинопатия» включает все нейродегенеративные расстройства, характеризующиеся патологическими агрегациями синуклеина. Некоторые нейродегенеративные расстройства, включающие болезнь Паркинсона (PD), заболевание, связанное с тельцами Леви (LBD), болезнь диффузных телец Леви (DLBD), Деменция, связанная с тельцами Леви (DLB), Паркинсонизм с деменцией (PDD), Множественная системная атрофия (MSA) и Нейродегенерация с накоплением в мозге железа типа I (NBIA Типа I), вместе объединяются как синуклеинопатии.
Пептиды и полипептиды в соответствии с настоящим изобретением можно применять не только для лечения синуклеинопатий, но также для профилактики указанных заболеваний у индивидуумов, у которых имеется риск развития синуклеинопатий (например, предрасположенных, например, генетически предрасположенных к развитию синуклеинопатий).
Сокращения для аминокислотных остатков, раскрытых в настоящем изобретении, представлены согласно рекомендациям IUPAC:
Пептиды и полипептиды по настоящему изобретению также могут быть частью полипептида, содержащего 7-30 аминокислотных остатков. Следовательно, n и m могут быть, независимо, равны целому числу, выбранному из группы 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20 и 25.
По меньшей мере, один пептид или полипептид в соответствии с настоящим изобретением может состоять из аминокислотной последовательности (X1)nX2X3X4X5GX6P(X7)m, где n и m, независимо, представляют собой 0 или 1 или являются частью полипептида, который содержит, по меньшей мере, 7 аминокислотных остатков, предпочтительно, по меньшей мере, 10 аминокислотных остатков, более предпочтительно, по меньшей мере, 15 аминокислотных остатков и/или максимально 50 аминокислотных остатков, предпочтительно максимально 30 аминокислотных остатков, более предпочтительно 16 аминокислотных остатков.
Неожиданно оказалось, что соединения в соответствии с настоящим изобретением, содержащие или состоящие из аминокислотных последовательностей, перечисленных выше, особенно подходят для использования для производства лекарственного средства, используемого для лечения или предотвращения синуклеинопатий. Эти пептиды (мимеотопы) способны индуцировать in vivo-образование антител, направленных на исходный эпитоп человеческого альфа-синуклеина, содержащего аминокислотную последовательность KNEEGAP, на сам человеческий белок альфа-синуклеина. Однако указанные пептиды (мимеотопы) не способны индуцировать иммунную реактивность против человеческого белка альфа-синуклеина. Индуцированные пептидом антитела отвечают за удаление альфа-синуклеина (который вовлечен в образование агрегатов альфа-синуклеина, телец Леви) и/или за растворение агрегатов альфа-синуклеина (телец Леви) у индивидуума.
Пептиды и полипептиды по настоящему изобретению можно применять для получения лекарственного средства, конкретно вакцины, которую можно использовать для лечения альфа-синуклеинопатии, тем самым лекарственное средство особенно подходит для лечения синуклеинопатии, выбранной из группы, состоящей из болезни Паркинсона (PD), заболевания, связанного с тельцами Леви, (LBD), болезни диффузных телец Леви (DLBD), деменции, связанной с тельцами Леви, (DLB), паркинсонизма, связанного с деменцией (PDD), множественной системной атрофии (MSA) и нейродегенерации с накоплением в мозге железа типа I (NBIA Типа I).
Согласно предпочтительному воплощению настоящего изобретения, по меньшей мере, один пептид или полипептид связывается с фармацевтически приемлемым носителем, предпочтительно с KLH (гемоцианин лимфы улитки), со столбнячным токсином, альбумин-связывающим белком, бычьим сывороточным альбумином, дендримером (MAP; Biol. Chem. 358: 581), пептидными линкерами (или фланкирующими участками), а также с адъювантными веществами, описанными в Singh et al., Nat. Biotech. 17 (1999), 1075-1081 (конкретно с теми, которые представлены в таблице 1 этого документа), и в O'Hagan et al., Nature Reviews, Drug Discovery 2 (9) (2003), 727-735 (конкретно с эндогенными иммуностимулирующими соединениями и их системами доставки) и с другими или с их смесями. Химические реакции конъюгации (например, через гетеробифункциональные соединения, такие как GMBS, а также, конечно, другие, такие, как описанные в "Bioconjugate Techniques", Greg T.Hermanson), в этом контексте могут быть выбраны из реакций, известных специалисту в данной области. Кроме того, композиция вакцины может быть составлена с включением адъюванта, предпочтительно композиции слаборастворимого алюминия, конкретно гидроксида алюминия. Конечно, также можно применять адъюванты типа MF59, фосфата алюминия, фосфата кальция, цитокинов (например, IL-2, IL-12, GM-CSF), сапонинов (например, QS21), MDP-производных, CpG-олигонуклеотидов, IC31, LPS, MPL, полифосфазенов, эмульсий (например, адъювант Фрейнда, SAF), липосом, виросом, иммуностимуляторного комплекса (ISCOM), кохлеатов, PLG-микрочастиц, полоксамерных частиц, вирусоподобных частиц, теплочувствительного энтеротоксина (LT), холерного экзотоксина (СТ), мутантных токсинов (например, LTK63 и LTR72), микрочастиц и/или полимеризованных липосом.
Пептид или полипептид по настоящему изобретению предпочтительно связаны с носителем или адъювантом посредством линкера, который выбран из группы, состоящей из NHS-поли (этиленоксида) (РЕО) (например NHS-PEO4-малеимид).
Вакцина, которая содержит соединение по настоящему изобретению (мимеотоп) и фармацевтически приемлемый носитель, может вводиться любым подходящим способом применения, например, внутрикожно, внутрибрюшинно, внутримышечно, внутриназально, перорально, подкожно и т.д., и в любом подходящем устройстве доставки (O'Hagan et al., Nature Reviews, Drug Discovery 2 (9), (2003), 727-735). Соединение по настоящему изобретению предпочтительно составлено для подкожного, внутрикожного или внутримышечного введения (см., например, "Handbook of Pharmaceutical Manu-facturing Formulations", Sarfaraz Niazi, CRC Press Inc, 2004).
Как правило, вакцина содержит соединение в соответствии с изобретением в количестве от 0,1 нг до 10 мг, предпочтительно, 10 нг - 1 мг, конкретно 100 нг - 100 мкг, или альтернативно, например, 100 фмоль - 10 мкмоль, предпочтительно 10 пмоль - 1 мкмоль, конкретно 100 пмоль - 100 нмоль. Как правило, вакцина также может содержать вспомогательные вещества, например, буферы, стабилизаторы и т.д. Предпочтительно, такие вспомогательные вещества, например, фармацевтически приемлемый наполнитель, такой как вода, буфер и/или стабилизаторы содержатся в количестве 1-99% (по массе), более предпочтительно 5-80% (по массе), особенно 10-70% (по массе). Возможные графики введения включают еженедельное введение, раз в две недели, раз в четыре недели (ежемесячно) или раз в два месяца в течение около 1-12 месяцев; однако предпочтительны также 2-5, особенно 3-4 исходных введений вакцины (в один или два месяца), с последующими бустерными вакцинациями через 6-12 месяцев или даже несколько лет, помимо других графиков, уже предложенных для других вакцин. Другой аспект настоящего изобретения относится к пептиду, имеющему аминокислотную последовательность, выбранную из группы, состоящей из (X1)nKNDEGAP(X7)m, (X1)nANEEGAP(X7)m, (X1)nKAEEGAP(X7)m, (X1)nKNAEGAP(X7)m, (X1)nKNEAGAP(X7)m, (X1)nKNEEAAP(X7)m, (X1)nKNEEGAA(X7)m, (X1)nRNEEGAP(X7)m, (X1)nHNEEGAP(X7)m, (X1)nKNEDGAP(X7)m, (X1)nKQEEGAP(X7)m, (X1)nKSEEGAP(X7)m, (X1)nKNDDGAP(X7)m, (X1)nKPSFKNE(X7)m, (X1)nQPSFAME(X7)m, (X1)nSPSFKQE(X7)m, (X1)nTPSWKGE(X7)m, (X1)nDPSFALE(X7)m, (X1)nLPSFRLE(X7)m, (X1)nEPNSRMD(X7)m, (X1)nQPSSKLD(X7)m, (X1)nHIHQSKFFDAPP(X7)m, (X1)nQASFAME(X7)m, (X1)nTASWKGE(X7)m, (X1)nQASSKLD(X7)m, (X1)nQPAFAME(X7)m, (X1)nTPAWKGE(X7)m, (X1)nQPASKLD(X7)m, (X1)nQPSFAMA(X7)m, (X1)nTPSWKGA(X7)m, (X1)nQPSSKLA(X7)m, (X1)nAPSWKGE(X7)m, (X1)nTPSAKGE(X7)m, (X1)nTPSWAGE(X7)m, (X1)nTPSWKAE(X7)m, (X1)nTPSWKGE(X7)m, (X1)nRNDEGAP(X7)m, (X1)nRNEDGAP(X7)m, (X1)nRQEEGAP(X7)m, (X1)nRSEEGAP(X7)m, (X1)nANDEGAP(X7)m, (X1)nANEDGAP(X7)m, (X1)nHSEEGAP(X7)m, (X1)nASEEGAP(X7)m, (X1)nHNEDGAP(X7)m, (X1)nHNDEGAP(X7)m, (X1)nRNAEGAP(X7)m, (X1)nHNAEGAP(X7)m, (X1)nKSAEGAP(X7)m, (X1)nKSDEGAP(X7)m, (X1)nKSEDGAP(X7)m, (X1)nRQDEGAP(X7)m, (X1)nRQEDGAP(X7)m, (X1)nHSAEGAP(X7)m, (X1)nRSAEGAP(X7)m, (X1)nRSDEGAP(X7)m, (X1)nRSEDGAP(X7)m, (X1)nHSDEGAP(X7)m, (X1)nHSEDGAP(X7)m и (X1)nRQDDGAP(X7)m, особенно к имеющему аминокислотную последовательность, выбранную из группы, состоящей из (X1)nKNDEGAP(X7)m, (X1)nANEEGAP(X7)m, (X1)nKAEEGAP(X7)m, (X1)nKNAEGAP(X7)m, (X1)nRNEEGAP(X7)m, (X1)nHNEEGAP(X7)m, (X1)nKNEDGAP(X7)m, (X1)nKQEEGAP(X7)m, (X1)nKSEEGAP(X7)m, (X1)nKNDDGAP(X7)m, (X1)nQASFAME(X7)m, (X1)nTASWKGE(X7)m, (X1)nQASSKLD(X7)m, (X1)nTPAWKGE(X7)m, (X1)nTPSWAGE(X7)m, (X1)nTPSWKGE(X7)m, (X1)nRNDEGAP(X7)m, (X1)nRNEDGAP(X7)m, (X1)nRQEEGAP(X7)m, (X1)nRSEEGAP(X7)m, (X1)nANDEGAP(X7)m, (X1)nANEDGAP(X7)m, (X1)nHSEEGAP(X7)m, (X1)nASEEGAP(X7)m, (X1)nHNEDGAP(X7)m, (X1)nHNDEGAP(X7)m, (X1)nRNAEGAP(X7)m, (X1)nHNAEGAP(X7)m, (X1)nKSAEGAP(X7)m, (X1)nKSDEGAP(X7)m, (X1)nKSEDGAP(X7)m, (X1)nRQDEGAP(X7)m, (X1)nRQEDGAP(X7)m, (X1)nHSAEGAP(X7)m, (X1)nRSAEGAP(X7)m, (X1)nRSDEGAP(X7)m, (X1)nRSEDGAP(X7)m, (X1)nHSDEGAP(X7)m, (X1)nHSEDGAP(X7)m и (X1)nRQDDGAP(X7)m, где X1 и Х7 представляют собой цистеин, а n и m, независимо, равны 0 или 1.
Согласно предпочтительному воплощению настоящего изобретения пептид объединен с фармацевтически приемлемым носителем, предпочтительно KLH (гемоцианин лимфы улитки).
Фармацевтический состав по настоящему изобретению, который может быть составлен в виде вакцины, например, для подкожного, внутрикожного и/или внутримышечного введения, может использоваться в лечении любого типа синуклеинопатии.
Настоящее изобретение дополнительно проиллюстрировано в следующих чертежах и примерах, которые, однако, не являются ограничением.
Фиг.1 демонстрирует последовательность полноразмерного альфа-синуклеина (140 ак; номер swiss prot: P37840) и последовательность, используемую для создания моноклонального антитела для детектирования полноразмерного альфа-синуклеина, а также его укороченного по С-концу и модифицированного варианта. Пептид в положении 100-109, используемый для генерации моноклонального антитела, подчеркнут. Пептид (р4453) конденсировали с С в С-концевом положении.
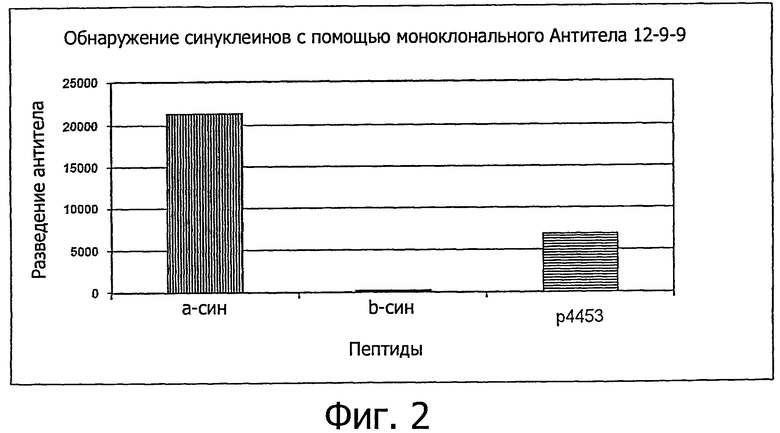
Фиг.2 демонстрирует обнаружение альфа-синуклеина с помощью тИФА с использованием полученного моноклонального антитела, специфичного к человеческому альфа-синуклеину в положении 100-109. Моноклональное антитело 12-9-9 получали и тестировали на предмет его специфичности к синуклеинам с помощью тИФА. Детектировали альфа-синуклеин (р4446) и человеческий эпитоп р4453. Белок отрицательного контроля р4447 (бета-синуклеин) не обнаруживался.
Фиг.3 демонстрирует определение минимального эпитопа моноклонального антитела 12-9-9 с помощью тИФА.
Пептиды р4446 (альфа-синуклеин), р4453 (человеческий эпиотоп, используемый для создания тестируемого антитела) детектировали с помощью антитела. Исходный эпитоп р4453 был укорочен по N- или С-концу и использовался для тИФА с целью определения минимального эпитопа, требуемого для специфичного связывания. Пептиды р5399 и р5403 потеряли связывание с моноклональным антителом 12-9-9. Таким образом, прогнозируется минимальная последовательность, необходимая для связывания 12-9-9, а именно KNEEGAP, локализованная в положении 102-108 альфа-синуклеина, в то время как удаление одной из фланкирующих аминокислот приводит к прекращению связывания. Данные представлены в линейном масштабе.
Фиг.4 демонстрирует обнаружение эпитопов и мимеотопов с помощью тИФА с использованием моноклонального антитела, специфичного к человеческому альфа-синуклеину в положении 100-109. Альфа-синуклеин, а также пептиды р5436 (человеческий минимальный эпитоп) и мимеотопы р5439 детектируют аналогично с помощью моноклонального антитела 12-9-9. Моноклональным антителом 12-9-9 мимеотоп р5440 не детектируется, в то время как мимеотоп р5444 детектируется гораздо слабее, чем человеческий эпитоп.
Фиг.5 демонстрирует индукцию иммунного ответа против альфа-синуклеина после пептидной иммунизации. Сыворотка иммунизированных мышей (р5436-р5590) демонстрирует титры против альфа-синуклеина после 3 вакцинаций. В сыворотке иммунизированных мышей (р5463-р5466) не детектируют альфа-синуклеин (титры, измеренные в тИФА, составляют около или менее 1:50 половины максимального значения). Класс иммуногенности определяли следующим образом. Класс 2: пептиды, индуцирующие иммунный ответ при половине максимального значения OD выше, чем 1:1000. Класс 1: пептиды, индуцирующие иммунный ответ при половине максимального значения OD от 1000 до 51. Класс 0: пептиды, индуцирующие иммунный ответ или очень слабый иммунный ответ при половине максимального значения OD около 50 или ниже.
Примеры
Для идентификации пептидов и полипептидов, которые можно применять при лечении и/или при профилактике синуклеинопатий, использовали антитело, которое способно детектировать аминокислотную последовательность LGKNEEGAPQ (=исходный эпитоп, SEQ ID No.3, р4453), полученную из человеческого альфа-синуклеина, и полноразмерный человеческий альфа-синуклеин (SEQ ID No.1, р4446). Оно не распознает человеческий бета-синуклеин (SEQ ID No.2, р4447;регистрационный номер Q 16143: mdvfmkgism akegvvaaae ktkqgvteaa ektkegvlyv gsktregvvq gvasvaektk eqashlggav fsgagniaaa tglvkreefp tdlkpeevaq eaaeepliep lmepegesye dppqeeyqey epea). Антитело может быть препаратом моноклонального или поликлонального антитела или любой частью антитела или его производным и специфично связывается с эпитопом LGKNEEGAPQ человеческого альфа-синуклеина, т.е. оно связывается с пептидом и полноразмерным белком, но не связывается с человеческим бета-синуклеином. Мимеотопы идентифицировали и далее охарактеризовывали с использованием таких моноклональных антител (которые обнаруживают последовательность внутри области из аминокислот 100-109 белка человеческого альфа-синуклеина) и пептидных библиотек.
Пример 1: Получение моноклональных антител для специфического обнаружения исходного эпитопа человеческого альфа-синуклеина LGKNEEGAPOC SEQ ID No.3. р4453 и человеческого альфа-синуклеина. но не человеческого бета-синуклеина.
Моноклональное антитело, полученное из химерных мышей "AFFiRiS 6": Balb/c (Charles River) иммунизировали с исходным эпитопом альфа-синуклеина LGKNEEGAPQ-С, объединенного с BTG (бычий тироглобулин) и с CFA (полный адъювант Фрейнда; первая инъекция), а также с IFA (неполный адъювант Фрейнда; 3 бустерные инъекции) в качестве адъюванта. Гибридомы, продуцирующие антитела специфичные к пептиду LGKNEEGAPQ, детектировали с помощью тИФА (тИФА-планшеты с покрытием в виде пептида LGKNEEGAPQC). Человеческий альфа-синуклеин (рекомбинантный белок, р444б) использовали в качестве пептида положительного контроля: отбирались гибридомы, распознающие рекомбинантный белок, иммобилизованный на тИФА-планшетах, так как они специфично связывались как с пептидом, так и с полноразмерным альфа-синуклеином. Человеческий бета-синуклеин (рекомбинантный белок, р4447) использовали в качестве пептида отрицательного контроля: исключались гибридомы, распознающие оба рекомбинантных белка, иммобилизованных на тИФА-планшетах, так как они не различали между двумя различными формами белков синуклеинов. Гибридомный клон (12-9-9; IgG1, каппа) анализировали для специфичного обнаружения природного эпитопа альфа-синуклеина LGKNEEGAPQ. 12-9-9 распознает введенный эпитоп, а также полноразмерный белок альфа-синуклеина (рекомбинантный белок; получен из rPeptide, Богарт, Джорджия, США) в анализе тИФА (см. фиг.2). Однако оно не обнаруживает белок бета-синуклеина (рекомбинантный белок, получен из rPeptide, Богарт, Джорджия, США) в анализе тИФА (см. фиг.2). Последовательно с помощью анализа тИФА был определен минимальный эпитоп, требующийся для связывания антитела, с использованием пептидов р444б, р4453, р5397, р5398, р5399, р5400, р5401, р5402, р5403, р5404, р5405, р5406 (см. фиг.3) и р5436 (см. фиг.4). р444б, р4453, р5397, р5398 и р5402, а также р5436 сохраняли полноценные способности связывания, тогда как р5399, р5400, р5401, р5403, р5404, р5405 и р5406 потеряли способность связывания с 12-9-9. Таким образом, минимальный эпитоп, требуемый для связывания, был определен как KNEEGAP.
Пример 2: Фаговый дисплей, in vitro-связывание и ингибирующий анализ тИФА
Библиотеки для Фагового Дисплея, использованные в данном примере: Ph.D. 7: New England BioLabs E8102L (библиотека линейных 7-меров), Ph.D. 12: New England BioLabs E8111L (библиотека линейных 12-меров) и Ph.D. C7C: New England BioLabs E8120L (ограниченная по дисульфидным связям гептапептидная библиотека). Фаговый дисплей проводили в соответствии с протоколом производителя (www.neb.com). После 2 или 3 последовательных раундов пэннинга отбирали отдельные фаговые клоны и фаговые надосадочные жидкости подвергали анализу тИФА на планшетах с покрытием в виде антитела, которое использовали для процедуры пэннинга. Положительные в данном анализе тИФА фаговые клоны (сильный сигнал для мишени, но отсутствие сигнала для неспецифичного контроля) секвенировали. Из последовательностей ДНК получали пептидные последовательности. Эти пептиды синтезировали и охарактеризовывали в анализах тИФА связывания и ингибирования. К некоторым пептидам присоединяли на С-конце дополнительные АА. Кроме того, некоторые новые мимеотопы создавали путем объединения информации о последовательностях из мимеотопов, идентифицированных в скрининге. Обе группы, содержащие вновь сконструированных мимеотопов, использовали для поддержки идентификации консенсусной последовательности для мимеотопной вакцинации.
1. In vitro-анализ связывания (тИФА)
Пептиды, полученные из Фагового дисплея, а также их укороченные по N-концу варианты объединяли с BSA и связывали с тИФА-планшетами (1 мкМ), а затем инкубировали вместе с моноклональным антителом, которое использовали для процедуры скрининга для анализа способности связывания идентифицированных пептидов (см. фиг.4).
2. In vitro-анализ ингибирования (тИФА)
Различные количества пептидов (концентрации в интервале от 400 мкг/мл до 3 мкг/мл (последовательные разведения), полученные из фагового дисплея, инкубировали вместе с моноклональным антителом, которое использовали для процедуры скрининга. Пептиды, ослабляющие последующее связывание антитела с исходным эпитопом человеческого альфа-синуклеина (р5436) и с белком человеческого альфа-синуклеина (р4446), нанесенного в виде покрытия на планшеты с тИФА, рассматривали как ингибирующие в данном анализе.
Пример 3: in vivо-тестирование мимеотопов: анализ иммуногенности
1. In vivo-тестирование мимеотопов
Ингибирующие, а также неингибирующие пептиды конденсировали с KLH и инъецировали мышам (дикий тип С57/В16 или мыши BalbC; подкожная инъекция в бок) вместе с соответствующим адъювантом (гидроксид алюминия). Животных вакцинировали 3 раза с интервалом в две недели и также проводили забор сыворотки раз в две недели. Определяли титры к инъецированным пептидам, а также к посторонним пептидам в каждой сыворотке. Титры против рекомбинантного белка человеческого альфа-синуклеина и рекомбинантного белка бета-синуклеина определяли, начиная с Сыворотки 2, соответственно. Как правило, сыворотку анализировали с помощью реакции против пептидов, конденсированных с бычьим сывороточным альбумином, который был иммобилизован на тИФА-планшетах. Титры определяли с использованием анти-мышиных IgG-специфичных антител. Для примеров иммуногенности против инъецированного пептида и альфа-синуклеина см. таблицу 5 и таблицу 6.
2. Результаты
2.1. Идентификация альфа-синуклеин-специфичного мАТ: на фиг.2 изображена характеризация альфа-синуклеин-специфичного моноклонального антитела 12-9-9 (IgG1, каппа), полученного из сшивки «Afflris 6».
2.2. Скрининг на предмет поиска мимеотопов, специфичных для альфа-синуклеина:
2.2.1. Фаговый Дисплей PhD 7, PhD 12 и PhD C7C и мутационный скрининг,
2.2.1.1. Скрининг с использованием моноклонального антитела, нацеленного на LGKNEEGAPQ.
С помощью скрининга библиотек для фагового дисплея PhD7, PhD 12 и PhD C7C и селективного замещения отдельных аминокислот всего было идентифицировано 60 последовательностей (см. таблицу 1; ID 18-77).
В таблице 1 представлены примеры всех использованных пептидов.
В таблице 2 представлены примеры пептидов и их способность связывания по сравнению с исходным эпитопом.
Таблица 2. Примеры эпитопов и мимеотопов альфа-синуклеина, связывающихся с моноклональным антителом 12-9-9.
Способность связывания кодируется следующим кодом:
0: нет связывания с 12-9-9, определяемым тИФА.
1: слабое связывание: связывание мимеотопа слабее по сравнению с минимальной исходной последовательностью р5436.
2: сильное связывание: связывание мимеотопа аналогично связыванию минимальной исходной последовательностью р5436.
2.3. In vitro описание характеристик мимеотопов, идентифицированных в скрининге (фаговый дисплей и пептидный скрининг) с помощью моноклонального антитела, направленного против альфа-синуклеина:
Фиг.2 и 3 демонстрируют характерные примеры анализов связывания и ингибирования, использованных для описания характеристик мимеотопов in vitro. Данные суммированы в таблицах 2 и 3 соответственно.
Таблица 3. Мимеотопы альфа-синуклеина, идентифицированные в данном изобретении, которые дают положительные результаты в анализах ингибирования.
Подписи к таблице 3: конкурентную способность обозначали следующим кодом:
0: нет конкуренции с 12-9-9, детектируемой в тИФА.
1: слабая конкуренция: конкуренция мимеотопа слабее по сравнению с минимальной исходной последовательностью р5436.
2: сильная конкуренция: конкуренция мимеотопа аналогична конкуренции минимальной исходной последовательностью р5436.
2.4. In vivo описание характеристик мимеотопов, идентифицированных в скрининге библиотек фагового дисплея с помощью моноклонального антитела, направленного против альфа-синуклеина.
Самок мышей С57/В16 или BalbC, по 5-6 мышей на группу, подкожно иммунизировали с помощью 30 мкг пептида, конденсированного с K.LH. Контрольным группам инъецировали PBS или исходный эпитоп. В качестве адъюванта использовали алюминиевые квасцы Пептиды, которые вводили, все были способны связываться с моноклональными антителами, специфично связывающимися с 100-109 а.к. человеческого альфа-синуклеина, хотя некоторые из пептидов слабо ингибировали связывание исходного эпитопа с его родительским антителом in vitro (в in W/ro-анализе ингибирования). После каждой вакцинации с интервалом в две недели осуществляли in W/ro-анализ тИФА для определения титра антител с использованием сыворотки отдельных мышей (см. таблицу 5). На лунки тИФА-планшета наносили покрытие в виде конъюгатов мимеотоп-BSA. Положительный контроль осуществляли с помощью реакции родительского антитела с соответствующим конъюгатом мимеотоп-BSA. Детектирование осуществляли с помощью анти-мышиного IgG. Кроме того, рекомбинантные белки иммобилизовали на тИФА-планшетах, и сыворотка соответственно реагировала. Для всех мимеотопов, протестированных в мышах С57/В16 или BalbC, антитела, реагирующие с индивидуальным инъецируемым пептидом, можно было обнаружить после повторной вакцинации. При этом не все мыши индуцировали более высокий титр против альфа-синуклеина (см. таблицу 5 для примеров).
Класс иммуногенности:
пептиды располагали согласно их способности индуцировать иммунный ответ.
2: пептиды, индуцирующие иммунный ответ с полумаксимальным значением OD выше чем 1000.
1: пептиды, индуцирующие иммунный ответ с полумаксимальным значением OD от 1000 до 51.
0: пептиды, индуцирующие иммунный ответ или очень слабый иммунный ответ с полумаксимальным значением OD около 50 или ниже.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА, КОТОРЫЕ РАСПОЗНАЮТ АЛЬФА-СИНУКЛЕИН | 2012 |
|
RU2575629C2 |
| СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ АМИЛОИДОЗОВ | 2009 |
|
RU2491953C2 |
| АНТИТЕЛА ПРОТИВ АЛЬФА-СИНУКЛЕИНА | 2018 |
|
RU2787039C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С ПРОТОФИБРИЛЛАМИ, И ИХ ПРИМЕНЕНИЕ В МЕТОДАХ ТЕРАПИИ И ДИАГНОСТИКИ БОЛЕЗНИ ПАРКИНСОНА, ДЕМЕНЦИИ, АССОЦИИРОВАННОЙ С ОБРАЗОВАНИЕМ ДИФФУЗНЫХ ТЕЛЕЦ ЛЕВИ, И ДРУГИХ АЛЬФА-СИНУКЛЕИНОПАТИЙ | 2011 |
|
RU2555526C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА, КОТОРЫЕ РАСПОЗНАЮТ АЛЬФА-СИНУКЛЕИН | 2012 |
|
RU2743738C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА, КОТОРЫЕ РАСПОЗНАЮТ АЛЬФА-СИНУКЛЕИН | 2013 |
|
RU2642262C2 |
| ПРИМЕНЕНИЕ МИМОТОПОВ ДЛЯ ЛЕЧЕНИЯ БЕТТА-АМИЛОИДОЗОВ | 2009 |
|
RU2553345C2 |
| ПЕПТИДНЫЕ ИММУНОГЕНЫ ИЗ С-ТЕРМИНАЛЬНОГО КОНЦА БЕЛКА АЛЬФА-СИНУКЛЕИНА И СОСТАВЫ НА ИХ ОСНОВЕ ДЛЯ ЛЕЧЕНИЯ СИНУКЛЕИНОПАТИЙ | 2018 |
|
RU2810774C2 |
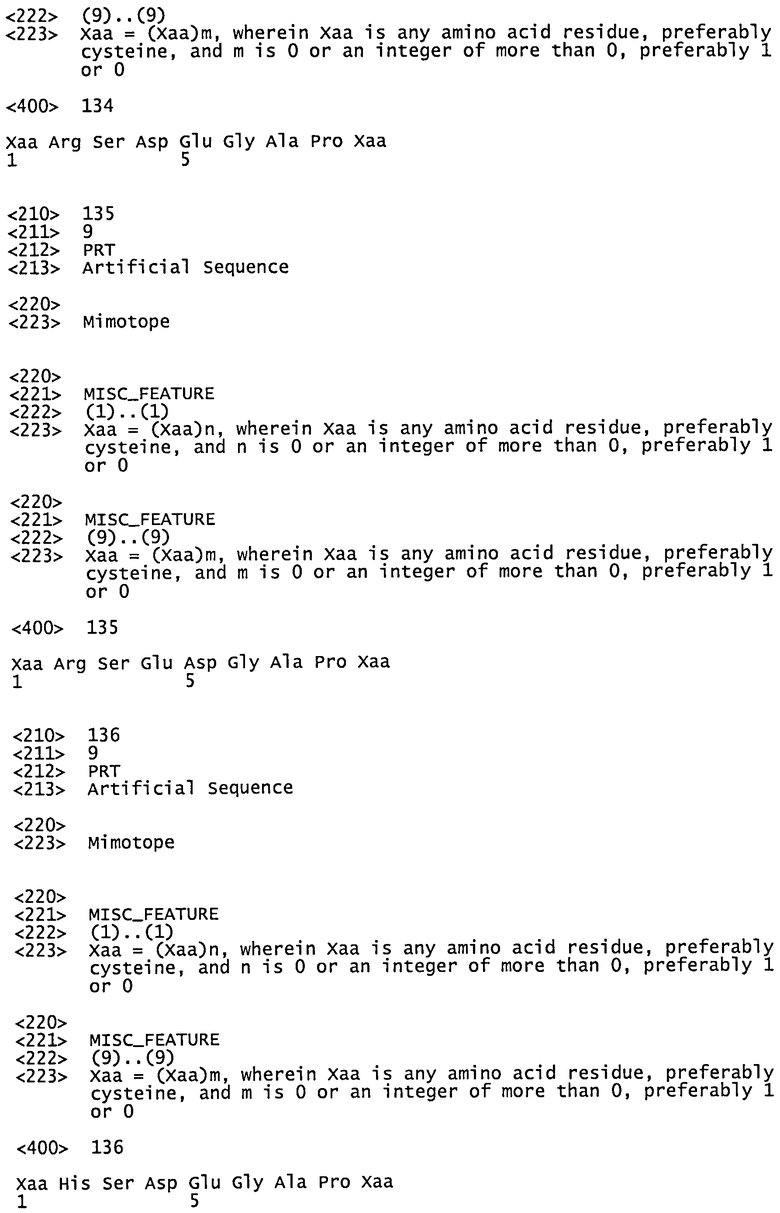
| АНТИТЕЛА К АЛЬФА-СИНУКЛЕИНУ И СПОСОБЫ ПРИМЕНЕНИЯ | 2014 |
|
RU2697098C1 |
| АНТИТЕЛА К АЛЬФА-СИНУКЛЕИНУ И СПОСОБЫ ПРИМЕНЕНИЯ | 2014 |
|
RU2718990C1 |














































Группа изобретений относится к области фармацевтики и медицины и касается пептидов или полипептидов, индуцирующих образование антител, направленных на альфа-синуклеин in vivo для получения лекарственных средств для профилактики и/или лечения синуклеинопатий. Группа изобретений обеспечивает получение пептидов или полипептидов, которые индуцируют антитела, отвечающие за удаление альфа-синуклеина, который вовлечен в образование агрегатов альфа-синуклеина, телец Леви и/или за растворение агрегатов альфа-синуклеина, телец Леви у индивидуума с синуклеинопатией. 4 н. и 18 з.п. ф-лы, 3 пр., 5 табл, 5 ил.
1. Композиция, содержащая, по меньшей мере, один пептид или полипептид, содержащий аминокислотную последовательность

где
X1 представляет собой любой аминокислотный остаток,
Х2 представляет собой аминокислотный остаток, выбранный из группы, состоящей из лизина (К), аргинина (R), аланина (А) и гистидина (Н),
Х3 представляет собой аминокислотный остаток, выбранный из группы, состоящей из аспарагина (N), глутамина (Q), серина (S), глицина (G) и аланина (А), предпочтительно из аспарагина (N), серина (S), глицина (G) и аланина (А),
Х4 представляет собой аминокислотный остаток, выбранный из группы, состоящей из глутаминовой кислоты (Е), аспарагиновой кислоты (D) и аланина (А),
Х5 представляет собой аминокислотный остаток, выбранный из группы, состоящей из глутаминовой кислоты (Е) и аспарагиновой кислоты (D),
Х6 представляет собой аминокислотный остаток, выбранный из группы, состоящей из аланина (А) и тирозина (Y),
Х7 представляет собой любой аминокислотный остаток,
n и m, независимо, равны 0 или представляют собой целое число более чем 0
и где аминокислотная последовательность согласно Формуле I не идентична или не содержит 7-мерный полипептидный фрагмент альфа-синуклеина, имеющего аминокислотную последовательность KNEEGAP,
указанный, по меньшей мере, один пептид или полипептид обладает способностью связывания с антителом, которое специфично к эпитопу альфа-синуклеина, содержащего аминокислотную последовательность KNEEGAP,
для применения при профилактике и/или лечении синуклеинопатий.
2. Композиция по п.1, где Х2 представляет собой аминокислотный остаток, выбранный из группы, состоящей из лизина (К) и аргинина (R), и/или Х6 представляет собой аланин (А).
3. Композиция по п.1, отличающаяся тем, что пептид или полипептид содержит аминокислотную последовательность, выбранную из группы, состоящей из (X1)nKNDEGAP(X7)m, (X1)nANEEGAP(X7)m, (X1)nKAEEGAP(X7)m, (X1)nKNAEGAP(X7)m, (X1)nRNEEGAP(X7)m, (X1)nHNEEGAP(X7)m, (X1)nKNEDGAP(X7)m, (X1)nKQEEGAP(X7)m, (X1)nKSEEGAP(X7)m, (X1)nKNDDGAP(X7)m, (X1)nRNDEGAP(X7)m, (X1)nRNEDGAP(X7)m, (X1)nRQEEGAP(X7)m, (X1)nRSEEGAP(X7)m, (X1)nANDEGAP(X7)m, (X1)nANEDGAP(X7)m, (X1)nHSEEGAP(X7)m, (X1)nASEEGAP(X7)m, (X1)nHNEDGAP(X7)m, (X1)nHNDEGAP(X7)m; (X1)nRNAEGAP(X7)m, (X1)nHNAEGAP(X7)m, (X1)nKSAEGAP(X7)m, (X1)nKSDEGAP(X7)m, (X1)nKSEDGAP(X7)m, (X1)nRQDEGAP(X7)m, (X1)nRQEDGAP(X7)m, (X1)nHSAEGAP(X7)m, (X1)nRSAEGAP(X7)m, (X1)nRSDEGAP(X7)m, (X1)nRSEDGAP(X7)m, (X1)nHSDEGAP(X7)m, (X1)nHSEDGAP(X7)m, (X1)nRQDDGAP(X7)m, предпочтительно (X1)nKNDEGAP(X2)m, (X1)nRNEEGAP(X2)m, (X1)nRNDEGAP(X2)m, (X1)nKNAEGAP(X2)m, (X1)nKSDEGAP(X2)m, (X1)nRNAEGAP(X2)m или (X1)nRSEEGAP(X2)m, где пептид или полипептид содержит 7-50 аминокислотных остатков.
4. Композиция по п.1, отличающаяся тем, что n и/или m равны 1, а Х1 и/или Х7 представляют собой цистеин (С).
5. Композиция по п.1, отличающаяся тем, что пептид или полипептид содержит 7-30, предпочтительно 7-20, более предпочтительно 7-16, наиболее предпочтительно 8 аминокислотных остатков.
6. Композиция по п.1, отличающаяся тем, что синуклеинопатия выбрана из группы, состоящей из Расстройств, Ассоциированных с Тельцами Леви (LBD), предпочтительно Болезни Паркинсона (PD), Болезни Паркинсона с деменцией (PDD) и Деменции, ассоциированной с тельцами Леви (DLB), а также множественной системной атрофии (MSA) или нейродегенерации с накоплением в головном мозге железа 1-го типа (NBIA Типа I).
7. Композиция по п.1, отличающаяся тем, что, по меньшей мере, один пептид или полипептид объединяют с фармацевтически приемлемым носителем, предпочтительно KLH (гемоцианин лимфы улитки).
8. Композиция по п.1, отличающаяся тем, что, по меньшей мере, один пептид или полипептид включен в состав для внутривенного, подкожного, внутрикожного или внутримышечного введения.
9. Композиция по п.1, отличающаяся тем, что, по меньшей мере, один пептид или полипептид включен в состав вместе с адъювантом, предпочтительно с гидроксидом алюминия.
10. Композиция по любому из пп.1-9, отличающаяся тем, что она является лекарственным средством, содержащим, по меньшей мере, один пептид или полипептид в количестве от 0,1 нг до 10 мг, предпочтительно от 10 нг до 1 мг, конкретно от 100 нг до 100 мкг.
11. Композиция для индукции иммунного ответа против альфа-синуклеина, содержащая, по меньшей мере, один пептид или полипептид, содержащий аминокислотную последовательность, выбранную из группы, состоящей из (X1)nQASFAME(X7)m, (X1)nTASWKGE(X7)m, (X1)nQASSKLD(X7)m, (X1)nTPAWKGE(X7)m, (X1)nTPSWAGE(X7)m,
где
X1 представляет собой любой аминокислотный остаток,
Х7 представляет собой любой аминокислотный остаток,
N и m, независимо, равны 0 или представляют собой целое число более чем 0,
указанный, по меньшей мере, один пептид или полипептид обладает способностью связывания с антителом, которое специфично к эпитопу альфа-синуклеина, содержащего аминокислотную последовательность KNEEGAP,
для применения в предотвращении и/или лечении синуклеинопатий.
12. Композиция по п.11, отличающаяся тем, что n и/или m равны 1, a X1 и/или Х7 представляют собой цистеин (С).
13. Композиция по п.11, отличающаяся тем, что пептид или полипептид содержит 7-30, предпочтительно 7-20, более предпочтительно 7-16, наиболее предпочтительно 8 аминокислотных остатков.
14. Композиция по п.11, отличающаяся тем, что синуклеинопатия выбрана из группы, состоящей из Расстройств, Ассоциированных с Тельцами Леви (LBD), предпочтительно Болезни Паркинсона (PD), Болезни Паркинсона с деменцией (PDD) и Деменции, ассоциированной с тельцами Леви (DLB), а также множественной системной атрофии (MSA) или нейродегенерации с накоплением в головном мозге железа 1-го типа (NBIA Типа I).
15. Композиция по п.11, отличающаяся тем, что по меньшей мере, один пептид или полипептид объединяют с фармацевтически приемлемым носителем, предпочтительно, KLH (гемоцианин лимфы улитки).
16. Композиция по п.11, отличающаяся тем, что, по меньшей мере, один пептид или полипептид включен в состав для внутривенного, подкожного, внутрикожного или внутримышечного введения.
17. Композиция по п.11, отличающаяся тем, что, по меньшей мере, один пептид или полипептид включен в состав вместе с адъювантом, предпочтительно с гидроксидом алюминия.
18. Композиция по любому из пп.11-17, отличающаяся тем, что, по меньшей мере, один пептид или полипептид содержится в лекарственном средстве в количестве от 0,1 нг до 10 мг, предпочтительно от 10 нг до 1 мг, конкретно от 100 нг до 100 мкг.
19. Пептид, индуцирующий образование антител, направленных на альфа-синуклеин in vivo, имеющий аминокислотную последовательность, выбранную из группы, состоящей из (X1)nKNDEGAP(X7)m, (X1)nANEEGAP(X7)m, (X1)nKAEEGAP(X7)m, (X1)nKNAEGAP(X7)m, (X1)nRNEEGAP(X7)m (X1)nHNEEGAP(X7)m, (X1)nKNEDGAP(X7)m, (X1)nKQEEGAP(X7)m, (X1)nKSEEGAP(X7)m, (X1)nKNDDGAP(X7)m, (X1)nQASFAME(X7)m, (X1)nTASWKGE(X7)m, (X1)nQASSKLD(X7)m, (X1)nTPAWKGE(X7)m, (X1)nTPSWAGE(X7)m, (X1)nRNDEGAP(X7)m, (X1)nRNEDGAP(X7)m, (X1)nRQEEGAP(X7)m, (X1)nRSEEGAP(X7)m, (X1)nANDEGAP(X7)m, (X1)nANEDGAP(X7)m, (X1)nHSEEGAP(X7)m, (X1)nASEEGAP(X7)m, (X1)nHNEDGAP(X7)m, (X1)nHNDEGAP(X7)m, (X1)nRNAEGAP(X7)m, (X1)nHNAEGAP(X7)m, (X1)nKSAEGAP(X7)m, (X1)nKSDEGAP(X7)m, (X1)nKSEDGAP(X7)m, (X1)nRQDEGAP(X7)m, (X1)nRQEDGAP(X7)m (X1)nHSAEGAP(X7)m, (X1)nRSAEGAP(X7)m, (X1)nRSDEGAP(X7)m, (X1)nRSEDGAP(X7)m, (X1)nHSDEGAP(X7)m, (X1)nHSEDGAP(X7)m и (X1)nRQDDGAP(X7)m, где X1 и X7 представляют собой цистеин и n и m, независимо, равны 0 или 1.
20. Пептид по п.19, отличающийся тем, что пептид конденсирован с фармацевтически приемлемым носителем, предпочтительно KLH (гемоцианин лимфы улитки).
21. Пептид по п.19 или 20 для предотвращения и/или лечения синуклеинопатий.
22. Фармацевтический состав, обладающий свойством индуцировать иммунный ответ против альфа-синуклеина, содержащий, по меньшей мере, один пептид по любому из пп.19-21.
| WO2004041067 A2, 21.05.2004 |
Авторы
Даты
2014-11-10—Публикация
2010-08-20—Подача