Изобретение относится к биотехнологии, иммунологии, медицине, в частности к способу повышения пролиферативных свойств диплоидных клеток фибробластов человека для использования таких клеток в лечебных и диагностических целях, в том числе для определения антивирусной активности интерферонов человека, для заместительной клеточной терапии.
Линии диплоидных клеток человека (ЛДКЧ) обладают неоспоримыми преимуществами перед всеми известными видами клеточных культур своей способностью сохранять в пассажах стабильные биологические и генетические характеристики. Аттестацию ЛДКЧ, предназначенных для производства вакцин, проводят в соответствии с едиными требованиями, разработанными Всемирной организацией здравоохранения [Requirements for Poliomyelitis Vaccine Oral:WHO Expert Committee on biological Standardization: 33 Report WHO. - Geneva, 1983]. Эти рекомендации взяты за основу национальных критериев аттестации вакцинных ЛДКЧ, разработанных ГНИИСиК МИБП им. Л.А. Тарасевича и МЗ СССР [Методические рекомендации «Аттестация перевиваемых клеточных линий - субстратов производства и контроля медицинских иммунобиологических препаратов» РД-42-28-10-89. МЗ СССР. М., 1989. - С. 16]. Аттестованная линия диплоидных клеток человека имеет ограниченный срок жизни и обладает стабильными биологическими, культуральными и генетическими характеристиками, она свободна от контаминантов (бактерий, грибов, микоплазм, вирусов) и не вызывает образования опухолей у иммуносупрессированных животных. Линия диплоидных клеток должна иметь аттестованный банк посевных клеток на ранних уровнях пассажей (до 10 пассажа), состоящий не менее чем из 200 криопробирок. При пассировании посевных клеток из одной или нескольких криопробирок до уровня 16 пассажа получают рабочий банк клеток, из которого могут быть получены необходимые культуры-продуценты для производства или для исследовательской работы. В России и за рубежом существуют всего несколько линий диплоидных клеток человека (Wi-38, MRC-5, М-22 и др.), аттестованных согласно перечисленным требованиям. Аттестованные ЛДКЧ используют при изгототовлении вакцин против полиомиелита, кори, краснухи, бешенства, респираторной и цитомегаловирусной инфекций, а также интерферона [Т.К. Борисова, Л.Л. Миронова, О.И. Конюшко, В.Д. Попова, В.П. Грачев, Н.Р. Шухмина, В.В. Зверев. Отечественные штаммы диплоидных клеток человека - субстрат для производства вакцин. Медицинская вирусология. Материалы научно-практической конференции «Актуальные проблемы медицинской вирусологии, посвященной 100-летию М.П. Чумакова». М. 2009. Том XXVI. С. 305-307; Л.Л. Миронова, В.Д. Попова, О.И. Конюшко. Опыт создания банка авторских линий перевиваемых клеток и их применение в вирусологической практике. Биотехнология. 2000, с. 41-47]. ЛДКЧ широко применяются in vitro для диагностики вирусных инфекций, анализа токсичности различных препаратов и изделий, для заместительной терапии [Патент РФ №2373944, 23.06.2008. Способ лечения ожоговой раны. А.С. Ермолов, С.В. Смирнов, В.Б. Хватов, Л.Л. Миронова; С.В. Смирнов, В.Б. Хватов. Инновационные технологии местного лечения ожогов в НИИ скорой помощи им. Н.В. Склифосовского. В книге: Новая экономика. Инновационный портрет России. М., Центр стратегического партнерства, 2009. С. 388-390].
В ИПВЭ им. М.П. Чумакова РАМН в 80-х годах 20 века было установлено несколько линий диплоидных клеток из кожи и мышц 8-10 недельных эмбрионов человека. Настоящая работа посвящена модификации производства диплоидных клеток человека для диагностических целей и заместительной клеточной терапии, а именно получению диплоидных клеток фибробластов человека с повышенными пролиферативными свойствами.
Прототип. Патент РФ №1440029 от 22.03.93 г. [Миронова Л.Л., Преображенская Н.К., Соловьева М.Н., Орлова Т.Г. Стобецкий В.И., Крючкова Г.П., Кармышева В.Я., Кудинова С.И., Попова В.Д., Алпатова Г.А. ИПВЭ и НИИЭиМ им. Н.Ф. Гамалеи. Штамм диплоидных клеток кожи и мышц эмбриона человека, используемый в качестве тест-системы для определения антивирусной активности интерферонов человека и размножения вирусов].
Этот штамм ЛДКЧ обозначен М-21, однако культура фибробластов М-21 обладала недостаточной пролиферативной активностью, что снижало время образования монослоя и повышало расход клеток и материалов, и это, в конечном итоге, привело к полному истощению ее запасов. В результате возникла необходимость в новой клеточной линии, пригодной для определения антивирусной активности интерферонов человека и других медико-биологических целей, более экономически выгодной, отличающейся высокой пролиферативной активностью, имеющей банки посевных и рабочих клеток. Эта линия обозначена М-20. На уровне 7 пассажа изготовлен банк посевных клеток. В 2012 году из ампулы банка 7 пассажа изготовлен банк рабочих клеток на уровне 16 пассажа. Банки посевных и рабочих клеток на уровнях 7 и 16 пассажей хранятся в ИПВЭ им. М.П. Чумакова РАМН и позволяют обеспечить как производственные процессы, так и научные исследования.
Отличием настоящего изобретения от ближайшего аналога (прототипа) является повышение пролиферативной активности клеток линии М-20 при использовании 10% фибринолитически активной плазмы (ФАП).
Таким образом, объектом изобретения является способ повышения пролиферативных свойств диплоидных клеток фибробластов человека для медико-биологических целей посредством культивирования клеток из криобанка ИПВЭ им. М.П. Чумакова РАМН, в котором используют диплоидные клетки охарактеризованной линии М-20, которые масштабируют из ампулы банка посевных клеток 7 пассажа и получают банк рабочих клеток 16 пассажа, при этом клетки 20-33 пассажей, пригодные для использования в лечебных и/или диагностических целях, получают путем культивирования в питательной среде, содержащей 10% фибринолитически активной плазмы (ФАП) человека. При культивировании клеток используют, предпочтительно, питательную среду ДМЕМ с 10% ФАП.
Диплоидные клетки человека охарактеризованной линии М-20, получаемые вышеуказанным способом, обладают высокой пролиферативной активностью и пригодны для использования в лечебных и/или диагностических целях.
Схема осуществления способа:
1. Используется одна криопробирка из банка посевных клеток 7 пассажа ИПВЭ им. М.П. Чумакова РАМН
2. Приготовление банка рабочих клеток на уровне 16 пассажа ИПВЭ им. М.П. Чумакова РАМН
3. Восстановление фибробластов линии М-20 из банка рабочих клеток 16 пассажа (ИПВЭ им. М.П. Чумакова РАМН).
4. Получение монослойной культуры фибробластов линии М-20, 17 пассаж.
5. Восстановление биологических свойств фибробластов линии М-20 путем трехкратного пассирования (до 20 пассажа включительно) для репарации возможных повреждений ДНК в процессе криоконсервирования.
6. Получение культур клеток для диагностических целей и заместительной клеточной терапии тиражированием фибробластов линии М-20 с 20 по 33 пассаж с использованием питательной среды, содержащей 10% фибринолитически активной плазмы (с содержанием PDGF от 155 до 342 пг/мл).
Предлагаемый способ обеспечивает получение клеток, обладающих высокой пролиферативной активностью и пригодных для использования в диагностических и/или лечебных целях.
Данный технический результат достигается культивированием фибробластов человека линии М-20 в питательной среде с добавлением 10 % фибринолитически активной плазмы (ФАП), обладающей ростстимулирующим действием и обеспечивающей усиление пролиферативной активности культуры клеток.
ФАП - клинически используемая трансфузионная среда, которую получают из крови внезапно умерших от инфаркта миокарда, острой сердечной недостаточности, кровоизлияния в головной мозг, в первые 6 часов после смерти [приказ МЗ СССР №482 от 14.06.1972 года «Об улучшении обеспечения лечебно-профилактических учреждений и клиник трупными тканями, костным мозгом и кровью»]. Посмертная кровь является полноценной трансфузионной средой, имеющей ряд биологических свойств - в первую очередь повышенный фибринолитический потенциал. В этой связи посмертную кровь предложено также называть фибринолизной. Основные показания к переливанию посмертной крови: острая кровопотеря, шок, анемия различного происхождения, ожоговая травма, обменное замещение при экзогенных отравлениях, заполнение АИКа при использовании экстракорпорального кровоообращения в хирургии [Е.Г. Цуринова. Переливание фибринолизной крови. М., 1960, 159 с; С.В. Рыжков. Заготовка и возможности использования фибринолизной крови в зависимости от срока взятия и причины смерти. Автореф. докт. дисс. Л., 1968, 21 с.; Г.А. Пафомов. Биологическая характеристика крови внезапно умерших и ее использование в хирургической практике. Дисс. докт. мед. Наук. М., 1971, 355 с.; К.С. Симонян, К.П. Гутионтова, Е.Г. Цуринова. Посмертная кровь в аспекте трансфузиологии. М., Медицина, 1975, 271 с.]. В настоящее время используются компоненты посмертной крови: фибринолитически активная плазма, эритроцитная масса, лейкоцитная масса, тромбоцитная масса [Г.Я. Левин. Гемокоагуляционные свойства и клиническое применение плазмы и тромбоцитов кадаверной крови. Автореф. докт. дисс. М., 1978, 31 с; В.Б. Хватов. Препараты фибринолитического и антипротеназного действия из плазмы крови внезапно умерших людей. Дисс. докт. мед наук, 1984, 417 с.; V.B. Khvatov Plasmakinase - a new thrombolytic preparation from postmortem plasma In: Thrombosis and Thrombolysis edd. E.I. Chazov, V.V. Smirnov). Consultants Bureau, N.Y., L, 1986, p. 283-310; В.Б. Хватов. Медико-биологические аспекты использования посмертной крови. Вестник АМН СССР, 1991, 9. С. 18-24; В.Б. Хватов. Трупная кровь - история и современное состояние вопроса. Пробл. гематол. и перелив. крови, 1997, 1. С. 51-59]. Компоненты трупной крови, получаемые от доноров органов, также получили клиническое применение [погибший индивидуум с бьющимся сердцем согласно “Инструкции по констатации смерти человека на основании диагноза смерти мозга» от 20.12.2001 г. №460, регистрация Минюста №3170 от 17 января 2002]. Трансплантация органов, тканей и клеток осуществляется согласно Закону РФ «О трансплантации органов и (или) тканей человека» - в ред. Федеральных законов от 20.06.2000 №91-Ф3, от 16.10.2006 №160-Ф3; В.Б. Хватов, С.В. Журавель, В.А. Гуляев, Е.Н. Кобзева, М.С. Макаров. Биологическая полноценность и функциональная активность клеточных компонентов крови доноров органов. Трансплантология, 2011, 4, с. 13-19; Хубутия М.Ш., Хватов В.Б., Гуляев В.А. и др. Способ компенсации глобулярного объема крови и иммуномодулирующего воздействия при трансплантации. Патент РФ на изобретение №2452519, опубл. 10.06.2012, бюл. №16].
Фибринолитически активную плазму получают из крови внезапно умерших людей, заготовленной на консерванте Глюгицир (соотношение кровь: консервант 4:1) для сохранения ее фибринолитически активных свойств. Отделение плазмы от клеточных элементов крови производят в стерильном боксе с соблюдением всех правил асептики и антисептики и аналогично получению донорской плазмы из консервированной донорской крови. Клиническое использование ФАП в хирургии и травматологии выявило эффект стимуляции заживления ран [И.Ю. Клюквин, М.В. Звездина, В.Б. Хватов, Ф.А. Бурдыга. Способ лечения укушенных ран. Патент на изобретение РФ №2372927, опубл., 20.11.2009, бюлл. №32]. Этот эффект мы связывали с присутствием ростстимулирующих факторов в ФАП, выделяемых активированными тромбоцитами. В дальнейшем в ФАП нами идентифицирован тромбоцитарный фактор роста (PDGF). Ростстимулирующее действие ФАП в культуре клеток человека показано в специальных исследованиях. В клеточную суспензию фибробластов человека линии М-20, содержащую известное количество клеток, добавляли исследуемые образцы ФАП в 10% концентрации и по 10 мл полученной смеси помещали в культуральные флаконы с площадью ростовой поверхности 25 см2. Клетки выращивали в течение 3-4 суток при содержании в атмосфере 5% CO2 и при 37°C. После 3-кратного пассирования проводили подсчет выросших клеток в камере Фукс-Розенталя и определяли отношение числа выросших клеток к числу посаженных - индекс пролиферации (в таблице 1).
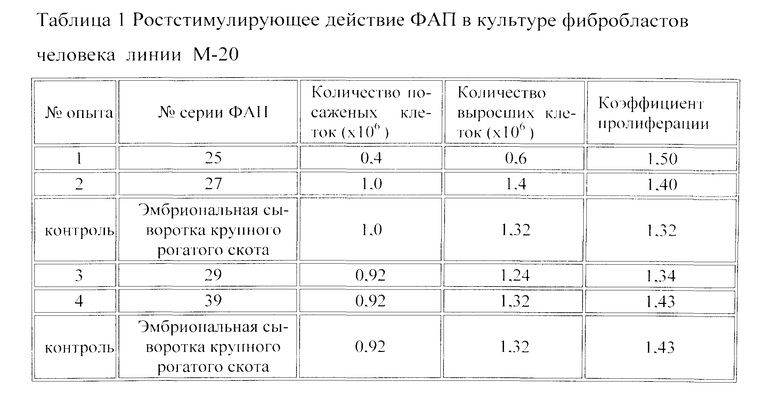
Из проведенных опытов следует, что ростовые свойства ФАП обеспечивают высокую пролиферативную активность и не отличаются от таковой эмбриональной сыворотки крупного рогатого скота. При этом ФАП содержит ростовые факторы тромбоцитов человека, т.е. аллогенного типа, в отличие от эмбриональной сыворотки крупного рогатого скота - ксеногенного типа. Этот факт является определяющим при трансплантации клеток при заместительной терапии. Отметим, что ростстимулирующее действие на культуру клеток линии М-20 обусловлено, в частности, наличием в ФАП PDGF в концентрации от 155 до 342 пг/мл. Эти данные получены с помощью набора реагентов «Qantikine, Human PDGF-BB Immunoassay» фирмы «R & D Systems» и системы «Multiskan ascent» фирмы «Thermo». Концентрация PDGF-BB в ФАП сходна с его содержанием в сыворотке крови. Так в сыворотке доноров крови и обследованных пациентов содержание PDGF составило от 110 до 880 пг/л, в среднем 244 пг/мл, тогда как в плазме содержание PDGF варьировало от 0-2 пг/мл.
Для лучшего понимания предлагаемого технического решения «производство диплоидных клеток человека линии М-20 для медико-биологических целей» приводим следующий пример.
Клетки линии М-20 16 пассажа восстанавливают из рабочего банка. Для этого криопробирку с клетками извлекают из жидкого азота и помещают в водяную баню при температуре 38°C и после оттаивания содержимое переносят в культуральный сосуд с питательной средой ДМЕМ, содержащей 10% ФАП (с содержанием PDGF от 155 до 342 пг/мл), добавляют антибиотик гентамицин из расчета 1 мл 4% раствора на 1 л питательной среды. Для формирования монослоя клетки культивируют в течение 4-5 суток при 37°C и содержании CO2 в атмосфере 5%. После формирования монослоя клеток проводят 3 последовательных пассажа, необходимых для репарации ДНК после криоконсервирования. Затем проводят тиражирование клеток с 20 по 33 пассаж. Клетки этих пассажей предназначены для медико-биологических целей. Полученная линия клеток подробно охарактеризована в соответствии с требованиями ВОЗ и ГНИИСиК МИБП им. Л.А. Тарасевича, включая HLA-типирование клеток линии М-20, а также проведено изучение ее цитокинового спектра. Приводим сравнительную характеристику свойств линии М-20 и линии М-22 (таблица 2). Линия М 22 (диплоидные фибробласты человека) лицензирована в качестве вакцинного субстрата и разрешена для производства любых видов медицинских вирусных вакцин, а также применена для лечения ожоговых ран II-IIIA степени [Патент РФ на изобретение №2373944, 23.06.2008. Способ лечения ожоговой раны. А.С. Ермолов, С.В. Смирнов, В.Б. Хватов, Л.Л. Миронова, О.И. Клнюшко, Е.А. Жиркова, B.C. Бочарова].
Линия М-20 установлена в ИПВЭ им. М.П. Чумакова РАМН в 1986 году из кожи и мышц 10-недельного эмбриона человека, полученного в результате аборта от здоровой женщины. Онкологических, венерических заболеваний, гепатита, туберкулеза в анамнезе не обнаружено; генетических и врожденных заболеваний в семье не наблюдалось. Среда культивирования клеток ДМЕМ с добавлением 10% ФАП. Коэффициент рассева 1:3-1:4 дважды в неделю при посевной дозе клеток 7×104 кл/мл. Клеточный монослой состоит из ориентированных однородных веретеновидных клеток с овальными ядрами, содержащими 1-3 ядрышка и мелкие глыбки хроматина. В жизненном цикле линии можно выделить 3 фазы развития: становление 1-3 пассажи, активный рост 4-40 и старение 41-52, затем наступала гибель. Клетки линии имеют кариотип человека 2т=46, ХУ. Линия характеризуется высокой генетической стабильностью: 93,3-96,9% клеток имеют диплоидный набор хромосом, клеток с полиплоидным набором не более 1,6%. Пробелов и разрывов, а также кольцевых хромосом не наблюдали. Количество полос изоэнзимов Г-6ФДЕ и ЛДЕ и их электрофоретическая подвижность совпадают с таковыми для эритроцитов человека. Г-6ФДГ медленного типа. При посеве на селективные питательные среды контаминации бактериями, грибами, микоплазмами не обнаружено. Кроме этого контаминации микоплазмами не выявлено при окраске ДНК-флуорохромами Hochst 33258 и оливомицином, а также методом ПЦР. Контаминации вирусами в опытах на сосунках и взрослых белых мышах, морских свинках, кроликах и куриных эмбрионах, а также на гомологичных и гетерологичных культурах клеток не обнаружено. Контроль туморогенности. При введении клеток линии иммунодепрессированным животным опухоли не образовывались. Обратной транскриптазы не обнаружено. HLA-маркеры: Класс I: A*(02.03)/B*(07.40)/CW*(03.07). Класс II: DRB1*(15.16)/DQB1*(05.06). Клетки линии М-20 на уровне 20 пассажа продуцируют мРНК α-интерферона (ИФНα) и интерлейкинов: ИЛ1β, 2, 4, 6, 8, 10, 18.
Таким образом, предлагаемая линия является диплоидной - обладает ограниченным сроком жизни, сохраняет кариотип нормальных клеток человека на протяжении всей жизни, свободна от контаминантов и не обладает онкогенными потенциями. Она охарактеризована на безопасность в соответствии с рекомендациями ВОЗ и требованиями ГНИИСиК МИБП им. Л.А. Тарасевича. В ИПВЭ им. М.П. Чумакова РАМН имеются банки посевных и рабочих клеток, способные обеспечить все потребности производства и научных исследований. Клетки линии М-20 чувствительны к заражению различными вирусами. Дополнительно изучен цитокиновый спектр линии М-20. Знание цитокинового спектра клеток позволяет более точно оценивать результаты при определении интерферонового статуса больных и давать обоснованные рекомендации по применению лечебно-профилактических препаратов.
Диплоидные клетки человека - фибробласты штамма М-20 с повышенной пролиферативной активностью, получаемые предлагаемым способом, могут быть использованы для диагностических целей, в частности для определения активности интерферона (ИФН) в сыворотке крови человека, а также в лечебных целях, например для местного лечения пролежней, укушенных ран, длительно не заживающих и ожоговых ран.

| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ МЕСТНОГО ЛЕЧЕНИЯ РАН С ПОМОЩЬЮ БИОЛОГИЧЕСКОЙ ПОВЯЗКИ, СОДЕРЖАЩЕЙ ЖИВЫЕ КЛЕТКИ ЛИНИИ ДИПЛОИДНЫХ ФИБРОБЛАСТОВ ЧЕЛОВЕКА | 2013 |
|
RU2526811C1 |
| ТЕСТ-СИСТЕМА ДЛЯ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ИНТЕРФЕРОНА ЧЕЛОВЕКА | 2013 |
|
RU2553431C2 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ТРОМБОФИБРИНОВОГО СГУСТКА, ОБЛАДАЮЩЕГО РОСТСТИМУЛИРУЮЩИМИ СВОЙСТВАМИ | 2018 |
|
RU2679616C1 |
| КОМБИНИРОВАННЫЙ КОСТНЫЙ АЛЛОТРАНСПЛАНТАТ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2524618C1 |
| СПОСОБ ЛЕЧЕНИЯ ОЖОГОВОЙ РАНЫ | 2008 |
|
RU2373944C1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ЛИЗАТА ТРОМБОЦИТОВ С ВЫСОКИМ СОДЕРЖАНИЕМ ФАКТОРОВ РОСТА | 2020 |
|
RU2739515C1 |
| КОСТНО-ПЛАСТИЧЕСКИЙ МАТЕРИАЛ С ВЫСОКОАДГЕЗИВНЫМИ СВОЙСТВАМИ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2023 |
|
RU2813132C1 |
| ЛИНИЯ ДИПЛОИДНЫХ КЛЕТОК ФИБРОБЛАСТОВ ЛЕГКОГО ЭМБРИОНА ЧЕЛОВЕКА ДЛЯ ВЫДЕЛЕНИЯ, ИДЕНТИФИКАЦИИ ВИРУСОВ И ПОЛУЧЕНИЯ ДИАГНОСТИЧЕСКИХ И ВАКЦИННЫХ ПРЕПАРАТОВ | 2006 |
|
RU2343194C2 |
| КОМБИНИРОВАННЫЙ ТРАНСПЛАНТАТ ДЕРМАЛЬНОГО МАТРИКСА С МЕЗЕНХИМАЛЬНЫМИ МУЛЬТИПОТЕНТНЫМИ СТРОМАЛЬНЫМИ КЛЕТКАМИ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ РАН С ЕГО ИСПОЛЬЗОВАНИЕМ | 2013 |
|
RU2526813C1 |
| КОСТНО-ПЛАСТИЧЕСКИЙ МАТЕРИАЛ С УПРАВЛЯЕМЫМИ СВОЙСТВАМИ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2023 |
|
RU2812733C1 |
Изобретение относится к области биотехнологии, конкретно к клеточным технологиям, и может быть использовано в медицине. Способ включает масштабирование диплоидных клеток линии М-20 из криобанка ИПВЭ им. М.П. Чумакова РАМН из ампулы банка посевных клеток 7 пассажа с получением банка рабочих клеток 16 пассажа. При этом клетки 20-33 пассажей, пригодные для использования в лечебных и/или диагностических целях, получают путем культивирования в питательной среде, содержащей 10% фибринолитически активной плазмы (ФАП) человека, содержащей тромбоцитарный фактор роста PDGF в концентрации от 155 до 342 пг/мл. Изобретение позволяет повысить пролиферативную активность диплоидных клеток фибробластов человека. 1 з.п. ф-лы, 2 табл.
1. Способ повышения пролиферативных свойств диплоидных клеток фибробластов человека, отличающийся тем, что диплоидные клетки охарактеризованной линии М-20 из криобанка ИПВЭ им. М.П. Чумакова РАМН масштабируют из ампулы банка посевных клеток 7 пассажа и получают банк рабочих клеток 16 пассажа, при этом клетки 20-33 пассажей, пригодные для использования в лечебных и/или диагностических целях, получают путем культивирования в питательной среде, содержащей 10% фибринолитически активной плазмы (ФАП) человека, содержащей тромбоцитарный фактор роста PDGF в концентрации от 155 до 342 пг/мл.
2. Способ по п.1, в котором при культивировании клеток используют питательную среду ДМЕМ с 10% ФАП.
| RU 1440029 C, 15.11.1994 | |||
| ЮДИН Б.Г | |||
| БИОЭТИКА: принципы, правила, проблемы, Москва, Эдиториал УРСС, 1998, с | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| PETTI LISA M | |||
| et al., Transforming signals resulting from sustained activation of the PDGFbeta receptor in mortal human fibroblasts, | |||
Авторы
Даты
2014-12-27—Публикация
2013-07-09—Подача