Изобретение относится к области фармацевтики и медицины и касается продукта на основе водоросли Laminaria Angustata для улучшения регенерации и пролиферации клеток, способа его получения и применения в составе лекарственного средства для восстановления и улучшения состояния организма в комплексной терапии иммунодефицитных состояний различного генеза, включая состояния организма после химиотерапии при онкологических заболеваниях.
Предшествующий уровень техники
Препараты из водорослей широко используются для лечебного питания как источник микроэлементов, йода и биологически активных веществ, которые оказывают общеукрепляющее действие, повышают работоспособность, регулируют иммунитет и оказывают другие благоприятные эффекты. Замечено также, что в местностях, где в рацион питания входит много морепродуктов, включая водоросли, выше продолжительность жизни.
Положительное воздействие применения водорослей и препаратов на их основе на организм человека наблюдается при иммунодефицитных состояниях, онкологических заболеваниях, при старении. Многочисленные исследования были направлены на получение из водорослей биологически активных препаратов (Беспалов В.Г., 2005, Беспалов В.Г., Некрасова В.Б., 2000).
Известно, что получение ряда препаратов из водорослей связано с их термической обработкой в присутствии агрессивных кислот (патент RU № 2030885 С1, 20.03.1995). Такая обработка разрушает многие биологически активные соединения и ведет к накоплению относительно инертных полисахаридов и родственных агарозе соединений.
Известен способ переработки водоросли Laminaria Angustata с получением пищевого продукта «Ламифарэн» с максимальным содержанием в нем свободного альгината в виде солей кальция и натрия (36%) и макро- и микроэлементов в максимально доступной для организма биоорганической форме (Патент RU № 2230464, 20.06.2004). Пищевой продукт «Ламифарэн» используется как источник макро- и микроэлементов и в качестве сорбента. Способ получения «Ламифарена» включает подготовку водорослей, обработку их в кислой среде при рН 6 при соотношении массы водорослей и раствора 1:1,5 и выдерживание в течение 5-6 ч, затем массу водорослей промывают 4-кратным настаиванием в пресной воде при температуре 20°С по 10-30 мин при соотношении массы водоросли и воды 1:3. Затем осуществляют стечку воды, обрабатывают глухим водяным паром при температуре воды 40-60°С при соотношении массы водорослей и воды 1:1 в течение 16-24 ч с непрерывным перемешиванием, после чего полученную массу водорослей гомогенизируют до получения мелкодисперсной гелеобразной массы. Использование кислой среды при получении пищевого продукта «Ламифарэн» также приводит к разрушению биологически активных соединений и многокомпонентности его состава.
Имеются сведения о том, что многие белки в водорослях прочно связаны с полисахаридами клеточных стенок и при водной экстракции они не переходят в раствор, а остаются в клеточных осадках.
Известно, что эффективность лечения различных иммунодефицитных состояний, проведения противоопухолевой химиотерапии и прогноз заболевания во многом зависит от состояния организма и проводимой поддерживающей терапии. В последнее время широкое распространение получила практика применения биологически активных добавок (БАД) и препаратов на основе природных биологически активных соединений в качестве сопровождающей терапии при профилактике и лечении иммунодефицитных состояний, онкологических заболеваний. Однако, недостаток научно обоснованных критериев применения таких препаратов, невозможность четко определить необходимые дозы используемых препаратов в силу их многокомпонентности, приводит к эмпирическому назначению таких препаратов, иногда с обратным результатом применения, что связано с возникновением побочных эффектов, обусловленных их многокомпонентностью.
Применение биологически активных препаратов, имеющих узкокомпонентный состав, установленный биохимическими и/или химическими методами, позволило бы повысить эффективность лечения широкого круга заболеваний, включая сопровождающую терапию при онкологических заболеваниях.
Таким образом, задача настоящего изобретения состоит в получении биологически активного продукта из водоросли Laminaria Angustata, улучшающего регенерацию и пролиферацию клеток и не вызывающего побочных эффектов, обусловленных многокомпонентностью его состава.
Сущность изобретения
Настоящее изобретение относится к биологически активному продукту для улучшения регенерации и пролиферации клеток, представляющему собой фракцию с молекулярной массой 5-10 кДа, подвергнутому ультрафильтрации водно-изобутанольного экстракта водоросли Laminaria Angustata.
Настоящее изобретение также относится к способу получения указанного продукта путем приготовления водно-изобутанольного экстракта водоросли Laminaria Angustata, который подвергают ультрафильтрации с последующим отбором фракции с молекулярной массой 5-10 кДа.
Кроме того, настоящее изобретение относится к лекарственному средству для улучшения регенерации и/или пролиферации клеток, содержащему указанный продукт и фармацевтически приемлемые добавки.
Указанное лекарственное средство может применяться для восстановления и улучшения состояния организма в комплексной терапии иммунодефицитных состояний различного генеза, включая состояние организма после химиотерапии при онкологических заболеваниях.
Подробное описание изобретения
Биологически активный продукт согласно настоящему изобретению получают в условиях, обеспечивающих сохранение биологической активности экстрагированных веществ, следующим способом. Высушенный и гранулированный препарат водорослей Laminaria Angustata смешивают с изобутанолом, инкубируют, затем добавляют воду, нагревают полученную смесь, предпочтительно до 55-65°С, и инкубируют в течение суток. Затем отбирают супернатант, осуществляют его центрифугирование, повторно отбирают супернатант и подвергают его вакуумной сушке, после чего полученный порошок разводят водой и полученный раствор вновь центрифугируют с последующим отбором супернатанта, который подвергают ультрафильтрации, отбирая из ультрафильтрата фракцию с молекулярной массой 5-10 кДа.
Лекарственное средство для улучшения регенерации и/или пролиферации клеток получают путем объединения продукта согласно настоящему изобретению в эффективном для регенерации и/или пролиферации клеток количестве и фармацевтически приемлемых добавок. В зависимости от выбора фармацевтически приемлемых добавок лекарственное средство может представлять собой такие лекарственные формы, как суппозитории для ректального применения, таблетки или капсулы для перорального применения, растворы для внутривенных и внутримышечных инъекций. Предпочтительно содержание продукта по настоящему изобретению в составе единичной стандартной лекарственной формы составляет 0,1-10 мг. В качестве приемлемых добавок для получения суппозиториев обычно используют твердый жир; для получения таблеток в качестве вспомогательных веществ обычно используют лактозы моногидрат, крахмал картофельный, кальция стеарат. При применении продукта в капсулах к нему обычно добавляют вспомогательные вещества, такие как тальк, магния стеарат, кремния оксид, в состав капсул обычно входит желатин, титана диоксид, консерванты типа натрия лаурилсульфат, метилпарагидроксибензоат, также могут использоваться различные пищевые красители. Для внутривенных и внутримышечных инъекций продукт разводят в физиологическом растворе. Схемы лечения (режим и доза введения препарата) выбираются специалистами, исходя из тяжести заболевания, состояния и возраста пациента и уточняются в процессе применения.
Полученное лекарственное средство можно использовать для улучшения регенерации и/или пролиферации клеток, в частности для восстановления и улучшения состояния организма в комплексной терапии иммунодефицитных состояний различного генеза, включая состояние организма после химиотерапии при онкологических заболеваниях.
Пример получения
В изобутанол (2,5 части, 250 мл) добавляют порошок ламинарии Laminaria Angustata (1 часть, 100 г), перемешивают до гомогенного состояния (получения однородной смеси темно-зеленого цвета), смесь инкубируют в течение 10 минут при температуре 18-25°С, после чего к смеси добавляют 250 мл дистиллированной воды и все содержимое тщательно перемешивают до получения гомогенного раствора. Полученную смесь нагревают на водяной бане или в термостате в течение 1 часа при температуре 55-65°С, после чего инкубируют в течение 22-28 часов при температуре 18-25°С, далее отбирают супернатант и центрифугируют его в течение 30 минут при 3000 об/мин при температуре 2-8°С, затем опять отбирают супернатант, который помещают в роторный испаритель и продувают аргоном. Вакуумную сушку в роторном испарителе проводят в течение 1 часа при температуре 18-25°С, постепенно понижая давление, после чего температуру в роторном испарителе повышают до 55-65°С и продукт оставляют при данной температуре до полного высыхания. Полученный порошок разводят в дистиллированной воде до получения 3%-го раствора с последующим центрифугированием при 5000 об/мин, а затем при 3000 об/мин при 4-8°С и отбором супернатанта. Полученный раствор подвергают ультрафильтрации и отбирают фракцию с молекулярной массой 5-10 КДа.
Полученный продукт представляет собой раствор, имеющий слабый светло-желтый оттенок. В его состав, установленный с использованием методов хроматографии и фильтрации, входят низкомолекулярные белки, полипептиды и отдельные пептидные фрагменты.
Для изучения биологической активности продукта к полученному раствору добавляют хлористый натрий до конечной концентрации 0,09% или смешивают его с физиологическим раствором в соотношении 1:1.
Примеры изучения биологической активности полученного продукта
Изучение влияния полученного продукта на пролиферацию клеток
В работе использовали клетки Н-9 , которые помещали в 24-луночный планшет для культивирования в концентрации 250×103/ мл по 1,0 мл на лунку. Полученный раствор исследуемого продукта добавляли в лунки в концентрации 10 мкл/мл. В контрольные лунки добавляли соответствующее количество среды для культивирования, в состав которой входил RPMI-1640, содержащий в своем составе 10% эмбриональной сыворотки теленка, глютамин (146 мг на 500 мл) и гентамицин (20 мг на 500 мл).
Клетки с добавленным раствором продукта или без него инкубировали в течение 24 часов в CO2 инкубаторе при 37°С. По окончании инкубации подсчитывали число и процент мертвых клеток. Полученные результаты представлены в таблице 1.
Изучение влияния полученного продукта на пролиферацию клеток
Как видно из таблицы 1, полученный продукт в концентрации 10 мкл/мл вызывает пролиферацию клеток.
Установлено, что при хранении полученного продукта при температуре -80°С в течение 1 года его способность вызывать пролиферацию клеток полностью сохраняется.
В отличие от продукта согласно настоящему изобретению аналогичные исследования, проведенные с известным препаратом «Ламифарен», показали, что этот препарат не обладает способностью вызывать пролиферацию клеток.
Изучение действия полученного продукта на мезенхимальные стволовые клетки костного мозга
Было изучено действие полученного продукта на мезенхимальные стволовые клетки (МСК) костного мозга доноров. Забор материала от доноров производился в стерильные мешки с антикоагулянтом. Выделение мононуклеарной фракции проводили на фиколле. Полученные после выделения клетки разделяли на 3 части: 1. контроль (культивирование костно-мозговых клеток без изучаемого продукта, 2. культивирование костно-мозговых клеток вместе с изучаемым продуктом, используемым в дозе 10 мкл/мл, 3. культивирование костно-мозговых клеток вместе с изучаемым веществом (препаратом), используемым в дозе 50 мкл/мл.
Культивирование костно-мозговых клеток проводили в стерильных флаконах при температуре 37°С в условиях абсолютной влажности и 5% CO2 в воздухе. Для этого в культуральный флакон с площадью дна 175 мм помещали 80-100 млн мононуклеарных клеток костного мозга в 30 мл полной питательной среды. После определенного времени осуществляли отмывку флакона от неприлипших клеток. Пассирование стромальных предшественников проводили 1 раз в неделю.
При проведении исследования полученный продукт использовали в концентрации 10 и 50 мкл/мл. Продукт вводили в культуру при инициации, а также при каждом пассаже в течение всего времени культивирования клеток. Пассирование культуры проводили на 14 день от начала культивирования. Результаты культивирования оценивали по подсчету количества МСК, собранных с пассажа.
ЭК (эффективность клонирования) первичной культуры определяли на 14 день по количеству колоний стромальных предшественников в расчете на 105 эксплантированных клеток. Динамику роста клеточной популяции определяли по кратности прироста клеток как отношение количества клеток, полученного с данного пассажа, к количеству клеток, посаженному на предыдущем пассаже.
Результаты исследований по оценке влияния полученного продукта на пролиферацию и процентное содержание ранних предшественников пуповинной крови при длительном культивировании представлены в таблице 2.
Влияние полученного продукта на пролиферацию и процентное содержание ранних предшественников пуповинной крови при длительном культивировании
ОК - общее количество клеток в группе
Результаты, представленные в таблице, показывают, что введение полученного продукта в культуру клеток оказывает стимулирующее влияние на пролиферацию стромальных предшественников. Изучаемый продукт увеличивает количество предшественников МСК в первичной культуре.
Изучение колониестимулирующей активности полученного продукта
При изучении влияния полученного продукта на пролиферацию и процентное содержание ранних предшественников пуповинной крови в качестве клеток-мишеней были использованы следующие клеточные элементы: стволовые клетки пуповинной крови доношенного новорожденного с хорошо известной базовой колониеобразующей активностью, выделенные на фиколле.
При исследовании in vitro полученный продукт использовали в оптимальной концентрации 10 мкл/мл.
Изучение воздействия полученного продукта на длительные культуры кроветворных предшественников проводили с использованием наборов для экспансии гемопоэтических стволовых клеток (ГСК) фирмы CellGenix. Культивирование в этой системе проводится всегда со стандартным набором колониестимулирующих факторов, действие изучаемых средств реализуется на их фоне.
Изучаемый продукт вводили в культуру при инициации (день 0).
Снятие культуры проводили на 0 день, далее из мешка 1 на 14, 28 день, из мешка 2 на 42 и 56 день и из мешка 3 на 70 и 84 день от начала культивирования. Проводили подсчет колоний под инверт-микроскопом (40х) и оценку содержания CD34+ клеток на проточном цитофлуориметре FACSCalibur™ производства фирмы Becton Dickinson (США).
Изучение воздействия полученного продукта на кроветворные стволовые клетки проводили в культуральной системе - метилцеллюлозе. Культивирование в метилцеллюлозе дает возможность изучать характер воздействия полученного продукта на пролиферацию всего спектра кроветворных предшественников и направление дифференцировки: ранние, дающие смешанные колонии (КОЕ микс), промежуточные - гранулоцитарно/макрофагальные колонии (КОЕ г/м) и поздние - гранулоцитарные, макрофагальные и эритроидные колонии (КОЕ г, КОЕ м и КОЕ эр). Культивирование в этой системе проводится всегда со стандартным набором колониестимулирующих факторов, действие изучаемых веществ реализуется на их фоне.
Снятие культуры проводили на 14 день. Подсчет колоний проводили под инверт-микроскопом (40х).
Оценку результатов культивирования проводили с подсчетом числа колониеобразующих предшественников каждого вида на 105 эксплантированных клеток. Были проанализированы следующие показатели:
1. КОЕ микс - смешанные колонии (ранние предшественники);
2. КОЕ эр - эритроидные предшественники;
3. КОЕ гм - гранулоцитарно-макрофагальные предшественники;
4. КОЕ г - гранулоцитарные предшественники;
5. КОЕ м - макрофагальные предшественники.
ЭК (эффективность клонирования) определяли по сумме колониеобразующих предшественников всех видов на 105 эксплантированных клеток.
Результаты по оценке влияния полученного продукта на пролиферацию и процентное содержание ранних предшественников пуповинной крови при длительном культивировании представлены в таблице 3.
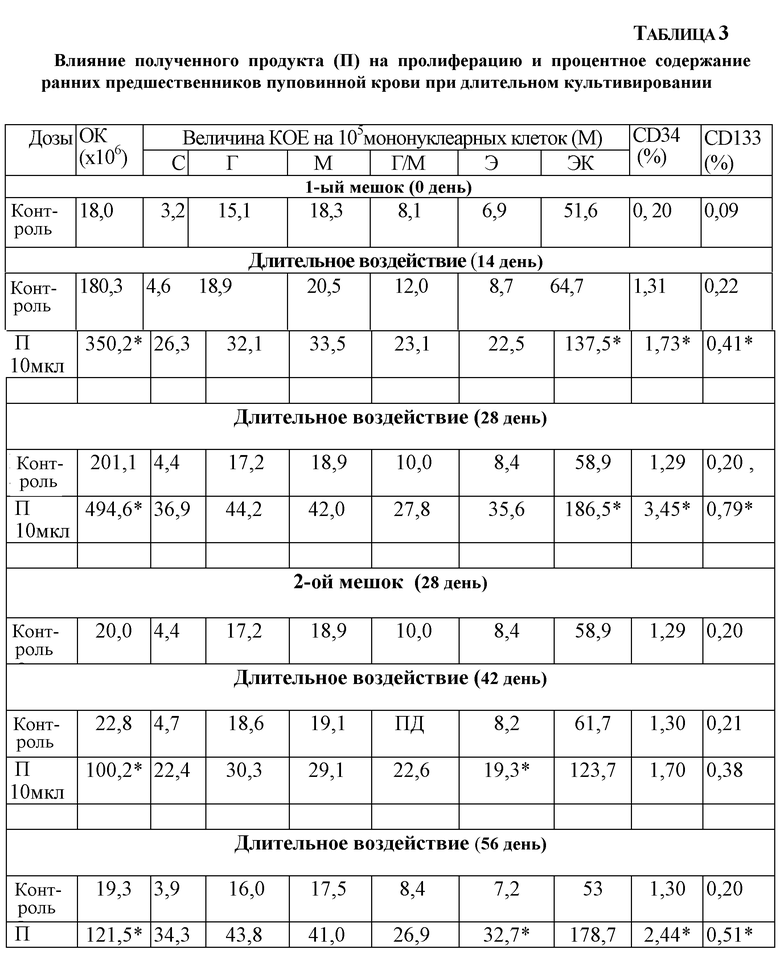
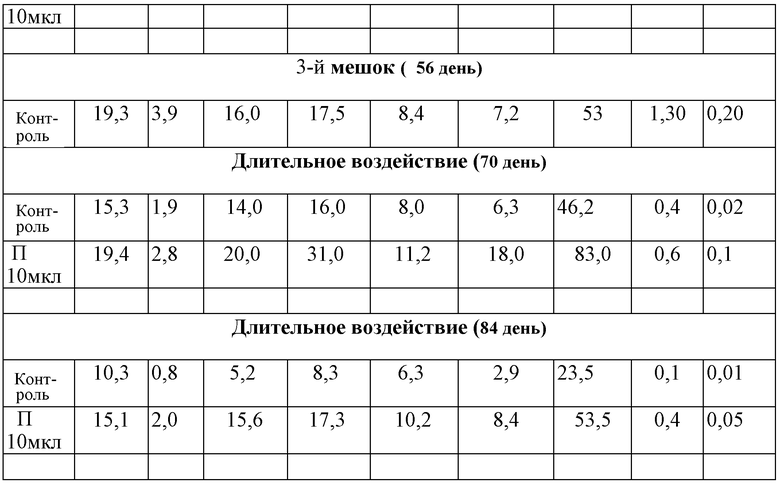
OK - общая клеточность (количество ядерных клеток);
С - смешанные колонии;
Г - гранулоцитарные колонии;
М - макрофагальные колонии;
Г/М - гранулоцитарно-макрофагальные колонии;
Э - эритроидные колонии;
ЭК - эффективность клонирования.
Достоверность отличия от контроля (по критерию Стьюдента):* р<0,05
Как видно из данных, представленных в таблице 3, при длительном контакте (в течение 14, 28, 42 и 56 дней постоянного воздействия) полученный продукт в концентрации 10 мкл/мл оказывает статистически выраженный достоверный стимулирующий эффект на пролиферацию ранних предшественников гемопоэза (в наибольшей степени CD34+ и CD133+), КОЕ смеш. и КОЕ г/м. Степень экспансии гемопоэтических клеток (общая клеточность культуры) достоверно выше при добавлении в культуральную среду полученного продукта, чем в контроле.
Полученный продукт обеспечивает отсроченную естественную убыль выживших клеток по сравнению с контролем (56 дней). При длительном культивировании содержание стволовых клеток и их пролиферативный потенциал снижаются, однако, под действием полученного продукта наблюдается замедленная деградация культуры (70 и 84 дней), в то время как в контроле этот эффект наблюдается значительно раньше (уже через 56 дней).
Изучение гемостимулирующей активности полученного продукта
Для изучения гемостимулирующей активности полученного продукта в качестве клеток-мишеней были использованы стволовые клетки пуповинной крови доношенного новорожденного с хорошо известной базовой колониеобразующей активностью, выделенные на фиколле. При исследовании полученный продукт использовали в концентрации 10 мкл/мл. Изучение воздействия полученного продукта на длительные культуры кроветворных клеток-предшественников проводили с использованием наборов для экспансии гемопоэтических стволовых клеток (ГСК) фирмы CellGenix. Культивирование в этой системе проводится всегда со стандартным набором колониестимулирующих факторов, действие изучаемых веществ реализуется на их фоне.
Полученный продукт вводили в культуру при инициации (день 0) и повторно на 84 день. Снятие культуры проводили на 14 день от начала культивирования. Подсчет колоний проводили под инверт-микроскопом (40х), оценку содержания CD34+ клеток осуществляли на проточном цитофлуориметре FACSCaliburTM производства фирмы Becton Dickinson (США).
Изучение воздействия полученного продукта на кроветворные стволовые клетки проводили в культуральной системе: метилцеллюлозе, что дает возможность изучить характер воздействия полученного продукта на пролиферацию всего спектра кроветворных предшественников и определить направления дифференцировки: ранние, дающие смешанные колонии (КОЕ микс), промежуточные - гранулоцитарно/макрофагальные колонии (КОЕ г/м) и поздние - гранулоцитарные, макрофагальные и эритроидные колонии (КОЕ г, КОЕ м и КОЕ эр). Культивирование в этой системе проводится всегда со стандартным набором колониестимулирующих факторов, действие изучаемых веществ реализуется на их фоне.
Снятие культур проводили на 14 день. Подсчет колоний проводили под инверт-микроскопом (40х).
Оценку результатов культивирования проводили с подсчетом числа колониеобразующих предшественников каждого вида на 105 эксплантированных клеток. Были проанализированы следующие показатели:
КОЕ микс - смешанные колонии (ранние предшественники);
КОЕ эр -эритроидные предшественники;
КОЕ гм - гранулоцитарно-макрофагальные предшественники;
КОЕ г - гранулоцитарные предшественники;
КОЕ м - макрофагальные предшественники.
ЭК (эффективность клонирования) определяли по сумме колониеобразующих предшественников всех видов на 105 эксплантированных клеток.
Было изучено также влияние полученного продукта на жизнеспособность гемопоэтических предшественников при размораживании культуры после длительного культивирования в мешках.
Результаты изучения влияния полученного продукта на пролиферацию и процентное содержание ранних предшественников пуповинной крови при длительном культивировании представлены в таблице 4.
Влияние полученного продукта на пролиферацию и процентное содержание ранних предшественников пуповинной крови при длительном культивировании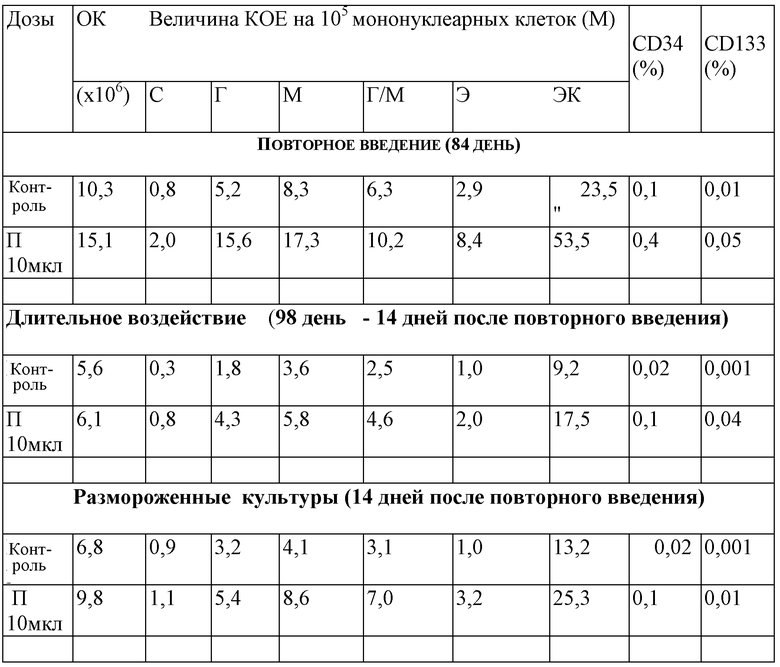
ОК - общая клеточность (количество ядерных клеток) колонии;
С - смешанные колонии;
Г - гранулоцитарные колонии;
М - макрофагальные колонии;
Г/М - гранулоцитарно-макрофагальные колонии;
Э - эритроидные колонии;
ЭК - эффективность клонирования.
Как видно из данных, представленных в таблице 4, повторное введение полученного продукта в культуру не оказывает дополнительного стимулирующего влияния на пролиферацию предшественников гемопоэза.
Добавление полученного продукта в размороженную культуру приводит к лучшей сохранности клеток в культуре по сравнению с контролем.
Таким образом, в результате проведенных исследований получены данные о выраженной способности полученного продукта улучшать регенерацию и пролиферацию клеток, особенно ранних предшественников гемопоэза.
Установлено, что полученный продукт в концентрации 10 мкл/мл вызывает пролиферацию клеток в культуре.
При хранении полученного продукта при температуре -80°С в течение 1 года его способность вызывать пролиферацию клеток в культуре полностью сохраняется.
Введение полученного продукта в культуру клеток оказывает стимулирующее влияние на пролиферацию стромальных предшественников. Под его влиянием увеличивается количество предшественников мезенхимальных стволовых клеток костного мозга в первичной культуре.
При длительном контакте с культурой клеток (в течение 14, 28, 42 и 56 дней постоянного воздействия) полученный продукт даже в концентрации 10 мкл/мл оказывает выраженный стимулирующий эффект на пролиферацию ранних предшественников гемопоэза. При этом под действием полученного продукта повышается и общая клеточность культур.
Полученный продукт обеспечивает отсроченную естественную убыль выживших клеток. Под действием полученного продукта наблюдается значительное замедление деградации культуры клеток. Полученные данные имеют принципиальное значение для работ по приготовлению клеточных препаратов для дальнейшего их применения в таких целях как замедление старения и, возможно, омоложения; они указывают на принципиальную возможность использования данного продукта для восстановления и улучшения состояния организма, что является крайне важным при проведении терапии иммунодефицитных состояний различного генеза, включая состояние организма онкологических больных после химиотерапии.
Повторное введение полученного продукта в культуру не оказывает дополнительного стимулирующего влияния на пролиферацию предшественников гемопоэза, вместе с тем, добавление полученного продукта в размороженную культуру приводит к улучшению сохранности клеток в данной культуре. Этот эффект представляется очень важным при использовании полученного продукта для приготовления клеточных препаратов для целей дальнейшего терапевтического применения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ ЭФФЕКТИВНОСТИ ГЕМОСТИМУЛЯТОРОВ ПРИ ЦИТОСТАТИЧЕСКОЙ МИЕЛОСУПРЕССИИ | 2009 |
|
RU2421720C2 |
| СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ | 2006 |
|
RU2322264C1 |
| ИНГИБИТОР И СТИМУЛЯТОР ПРОЛИФЕРАЦИИ СТВОЛОВОЙ КЛЕТКИ И ИХ ИСПОЛЬЗОВАНИЕ | 1997 |
|
RU2292352C9 |
| ПЕРЕПРОГРАММИРОВАНИЕ ЭНДОТЕЛИЯ ЧЕЛОВЕКА В ГЕМОПОЭТИЧЕСКИХ ПРЕДШЕСТВЕННИКОВ МНОЖЕСТВЕННЫХ ЛИНИЙ ДИФФЕРЕНЦИРОВКИ С ИСПОЛЬЗОВАНИЕМ ОПРЕДЕЛЕННЫХ ФАКТОРОВ | 2014 |
|
RU2691062C2 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ, ФИБРОБЛАСТ, СПОСОБ ОТДЕЛЕНИЯ КЛЕТОК | 1991 |
|
RU2164240C2 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ СТИМУЛЯЦИИ ПРОДУКЦИИ СТВОЛОВЫХ КЛЕТОК В КОСТНОМ МОЗГЕ | 2007 |
|
RU2410116C2 |
| СПОСОБ ВОССТАНОВЛЕНИЯ МИЕЛОИДНОЙ ТКАНИ СТАРЫХ ЛАБОРАТОРНЫХ ЖИВОТНЫХ ПОСЛЕ ВОЗДЕЙСТВИЯ ИОНИЗИРУЮЩЕГО ИЗЛУЧЕНИЯ | 2008 |
|
RU2394585C1 |
| СПОСОБ СТИМУЛЯЦИИ IN VITRO ПОЛИПОТЕНТНЫХ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК | 2010 |
|
RU2439147C1 |
| СПОСОБ ЭКСПАНСИИ МОНОНУКЛЕАРНЫХ КЛЕТОК ПУПОВИННОЙ КРОВИ (пкМНК) ex vivo В ПРИСУТСТВИИ МУЛЬТИПОТЕНТНЫХ СТРОМАЛЬНЫХ МЕЗЕНХИМАЛЬНЫХ КЛЕТОК (ММСК) | 2013 |
|
RU2525143C1 |
| СПОСОБ РАЗМНОЖЕНИЯ КРОВЕТВОРНЫХ СТВОЛОВЫХ КЛЕТОК | 2002 |
|
RU2297451C2 |
Изобретение относится к фармацевтической промышленности, а именно к продукту для улучшения регенерации и/или пролиферации клеток. Способ получения продукта для улучшения регенерации и/или пролиферации клеток путем переработки водоросли Laminaria Angustata, при этом получают водно-изобутанольный экстракт водоросли Laminaria Angustata, отбирают супернатант, осуществляют его центрифугирование, повторно отбирают супернатант и подвергают его вакуумной сушке, после чего полученный порошок разводят водой и полученный раствор вновь центрифугируют с последующим отбором супернатанта, который подвергают ультрафильтрации, отбирая из ультрафильтрата фракцию с молекулярной массой 5-10 кДа. Продукт для улучшения регенерации и/или пролиферации клеток. Лекарственное средство для улучшения регенерации и/или пролиферации клеток. Вышеописанный продукт и средство на его основе эффективны для улучшения регенерации и/или пролиферации клеток. 3 н. и 1 з.п. ф-лы, 4 табл.
1. Способ получения продукта для улучшения регенерации и/или пролиферации клеток путем переработки водоросли Laminaria Angustata, характеризующийся тем, что в условиях, обеспечивающих сохранение биологической активности экстрагированных веществ, получают водно-изобутанольный экстракт водоросли Laminaria Angustata, затем отбирают супернатант, осуществляют его центрифугирование, повторно отбирают супернатант и подвергают его вакуумной сушке, после чего полученный порошок разводят водой и полученный раствор вновь центрифугируют с последующим отбором супернатанта, который подвергают ультрафильтрации, отбирая из ультрафильтрата фракцию с молекулярной массой 5-10 кДа.
2. Продукт для улучшения регенерации и/или пролиферации клеток, полученный способом по п.1.
3. Лекарственное средство для улучшения регенерации и/или пролиферации клеток, содержащее продукт по п.2 и фармацевтически приемлемые добавки.
4. Лекарственное средство по п.3, предназначенное для восстановления и улучшения состояния организма в комплексной терапии иммунодефицитных состояний различного генеза, включая состояние организма после химиотерапии онкологических заболеваний.
Авторы
Даты
2015-02-10—Публикация
2013-08-06—Подача