Изобретение относится к медицине, фармакологии и биологии и касается нового средства, влияющего на активность холестеролэстеразы.
Важную роль в обмене липидов в живых организмах играет холестеролэстераза. Выделенная из поджелудочной железы ряда животных и человека холестеролэстераза является составной частью многих тканей и секретов живых организмов. Она является мономером с молекулярной массой 65000-69000, склонным к олигомеризации до молекулярной массы 300000-800000, причем ее оптимальная каталитическая активность проявляется при кислотности pH - 4,25 (для лизосомальных ферментов). Холестеролэстераза гидролизует эфиры холестерина до свободного холестерина и жирных кислот.
В статье Васильев А.В., Варсанович Е.А., Погожева А.В., Самсонов М.А., Бобкова С.Н.: Липолитические ферменты лизосом тромбоцитов и мононуклеаров в патогенезе ИБС // «Вопр. мед. химии», 1992, №5. С.27-29 показано, что холестеролэстераза является биомаркером активности атеросклеротического процесса и эффективности проводимого лечения как больных атеросклерозом, так и больных с осложнениями атеросклероза, в частности - больных ишемической болезнью сердца (стенокардией напряжения II ФК) - ИБС.
Известно, что нарушения липидного обмена в виде атерогенных гиперхолестеринемий сопровождаются повышением свертываемости крови, что оправдывает применение в этих условиях препаратов с антикоагулянтным и липолитическим действием, например, гепарина. В свою очередь, коагуляционный гемостаз и липидный профиль в значительной мере определяется состоянием тромбоцитов, их ферментативными реакциями. В этом плане заслуживают внимания исследования и разработки средств, изменяющих активность липаз тромбоцитов, в частности - холестеролэстеразы (ХЭ) тромбоцитов (КФ 3.1.1.13) с оптимальной кислотностью pH - 4,25, участвующих в регуляции катаболизма ЛПНП, гидролизующие эфиры холестерина (ЭХС) полиеновых жирных кислот (ЖК) с длинной цепью (C18, C20). Среди насыщенных эфиров ХЭ гидролизует с большой скоростью холестериновый эфир меристиновой кислоты (C14), катализирует гидролиз эфиров холестерина, а также их синтез из холестерина и свободных жирных кислот в лизосомах различных клеток (А.А. Покровский, В.А. Тутельян. Лизосомы. - Наука, 1976, 380 с.; X. Брокерхоф, Р. Дженсен. Липолитические ферменты, пер. с англ., М., 1978, с.242-356).
В научной литературе имеются сведения о возможностях модуляции холестеролэстеразы химическими соединениями (А.В. Ефремов и др. Роль лизосомальных ферментов в генезе ведущих клинико-патофизиологических синдромов: факты и гипотезы // Патологическая физиология и экспериментальная терапия. - 2007. - N1. - С.18-21; О.В. Цыганкова, Л.А. Руяткина, З.Г. Бондарева. Лизосомальные ферменты. Новый взгляд на фундаментальные материи с позиций кардиолога // Ж. Цитокины и воспаление. 2009, Т.8, №4, с.17-24; Venu Т Tadiboyina, Dora М Liu, Brooke A Miskie, Jian Wang, Robert A Hegele Treatment of dyslipidemia with lovastatin and ezetimibe in an adolescent with cholesterol ester storage disease // Lipids Health Dis. 2005; 4:26).
Известно также, что при введении некоторых препаратов, например липостабила, оказывающего гиполипидемическое действие, происходит модуляция холестеролэстеразы (М.А. Самсонов, А.В. Васильев, А.В. Погожева, С.Н. Бобкова. Сравнительная оценка гиполипидемического действия ПНЖК w-3 и липостабила // Вопр. Питания, 1996, №4, с.12-16).
Известно, что некоторые соединения не активируют, а ингибируют активность холестеролэстеразы. Так, при исследовании субстратной специфичности установлено, что галактозилцереброзид и фосфатидилсерин активируют активность холестеролэстеразы, а ганглиозид и лизолецитин, наоборот, ингибируют ее (Ф. Хухо. Нейрохимия, основы и принципы, М., Мир, 1990 г., стр.32).
Однако существует потребность в поиске и внедрении в практику новых диагностических и лекарственных средств, обладающих активностью в отношении данного фермента.
Близким по сущности к предложенному нами является средство, снижающее активность холестеролэстеразы, в качестве которого применяется трикрезан (Патент RU №2444357, МПК A61K 31/205, A61P 9/10, 10.03.2012).
Задачей настоящего изобретения является применение известного вещества, обладающего свойством понижения активности холестеролэстеразы (ХЭ).
Для решения поставленной задачи предлагается в качестве средства, понижающего общую активность холестеролэстеразы, использовать биологически активное соединение - комплекс трис-(2-гидроксиэтил)амина с бис-(2-метилфеноксиацетатом) цинка [цинкатран или цитримин] формулы:
(HOCH2CH2)3N·Zn(OOCCH2OC6H4CH3-2)2
[Воронков М.Г., Адамович С.Н., Мирсков Р.Г., Мирскова А.Н. Синтез новых биологически активных O-гидрометаллоатранов // ЖОХ, 2009, т.79, №1, с.162-163].
Заявляемая биологическая активность цинкатрана, которая понижает общую активность холестеролэстеразы, ранее не была известна.
Впервые показано, что использование цинкатрана снижает активность лизосомального липолитического фермента из класса гидролаз (КФ 3.1.1) - холестеролэстеразы (КФ 3.1.1.13).
Новая, ранее неизвестная физиологическая активность цинкатрана - угнетение активности холестеролэстеразы (ХЭ).
Возможность осуществления изобретения может быть проиллюстрирована ниже представленными данными.
Пример 1 (по прототипу)
Эксперименты проводились на кроликах породы Шиншилла с исходной массой тела 1,8-2,0 кг. Кроликам опытных групп (10 животных) вводят внутримышечно свежеприготовленный водный раствор трекрезана в дозе 25 мг/кг, в течение 3 мес. В конце экспериментов у животных в грудном отделе аорты стандартными методами определяют содержание липидов, триацилглицеринов, β-липопротеинов и холестерина. Планиметрически оценили индекс ее пораженности атеросклеротическими бляшками. Для определения активности ХЭ из кусочков грудной аорты диспергированием выделяют клетки интимы. Для этого используют раствор (0,5 мл), содержащий коллагеназу тип 4 и эластазу тип 3 («sigma», США). Время диспергирования 75 мин при 37°C (1 мл/50 мг ткани). Полученную суспензию клеток промывают холодным раствором Хенкса. Осадок при последней промывке гомогенизируют в 2 мл 0,25 М раствора сахарозы pH 7,4 с 0,001 м ЭДТА. Конечное разведение гомогенатов аорты соответствует 1:20, (вес : объем). Супернатант используют для исследования активности ХЭ. Активность ХЭ определяют по методу, описанному в работе Pittman R.C., Khao J.C., Steinberg D. Cholesterol esterase in rat adipose tissue and its activation by cyclic adanosin 3′5′-monophosphate-dependent protein kinase. // J. Biol. Chem. (1975); Vol.250. - P. 4505-4510, в модификации Severson D.J., Fletcher T. Characterisation of cholesterol ester hydrolase activities in rabbit and guinea pig aortas. // Atherosclerosis (1978); Vol.31. - P. 21-32, используя в качестве субстрата 12,7 мкмолей холестерол-(1-14c)-олеата (удельная мКи/ммоль («Amershem», Англия). Субстрат предварительно освобождают от загрязнения жирными кислотами экстракцией, затем добавляют в небольшое количество бензола, содержащего 1,25 ммоль немеченого холестерол олеата и 127 ммоль яичного лецетина. Растворитель упаривают в токе азота. Несколько раз промывают хлороформом при 37°C. Затем в колбу, содержащую субстратную смесь, заливают 10 мл 10 мм тирс-HCl буфера pH 7,0 с 100 мм ЛСД. Суспензию переносят в 15 мл сосуд с охлаждением (или баню со льдом) и озвучивают 12 мин на Brenson W-350 дезинтеграторе со стандартным диаметром наконечника 0,5-дюймовым и мощностью около 100 Вт. Полученную опалесцирующую суспензию центрифугируют в течение 15 мин при 30000 об/мин («Beckmen» L-5). Препарат хранят при 4°C в течение 2 нед.
Источник фермента - суспензию клеток (аорта) разбавляют в 3 раза буфером pH 7,4 (среда выделения с дигитоником), субстрат разводят в 0,1 М ацетатном буфере pH 3,9 с 5,0 мм таурохолатом натрия в соотношении 1:4 (об./об.). К 0,1 мл материала добавляют 0,1 мл раствора субстрата, инкубируют на водяной бане при 37°C 90 мин и останавливают реакцию органической смесью, состоящей из метанола, хлороформа и гептана (2,5 мл) в соотношении 1,4:1,3:1 (об./об.) соответственно, после чего добавляют 0,1 М боратный буфер pH 10,0 (1,05 мл) и проводят активное смешивание на встряхивателе «Vortex» в течение 5 мин. Далее смесь центрифугируют в течение 10 мин при 2500-3000 об/мин на центрифуге PC-6. После разделения фаз отбирают 0,5 мл верхней светлой фазы и подсчитывают ее в сцинциляционной жидкости (на 1 л толуола - 4 г РРО и 0,2 г РОРОР) на счетчике «Mark-3» (Голландия).
Пример 2
Эксперименты проводят на кроликах породы Шиншилла с исходной массой тела 1,8-2,0 кг. Кроликам опытных групп (10 животных) вводят внутримышечно свежеприготовленный водный раствор цинкатрана в дозе 10 мг/кг в течение 2 мес. В конце экспериментов, у животных в грудном отделе аорты стандартными методами определяют содержание липидов, триацилглицеринов, β-липопротеинов и холестерина. Планиметрически оценивают индекс ее пораженности атеросклеротическими бляшками (ИПА). Для определения активности ХЭ из кусочков грудной аорты диспергированием выделяют клетки интимы методом, предложенным в работе Haley N.J., Powler S., De Duve С. Lysosomal and cholesteryl esterase activity in normal and lipid laden aortic cells // J. Lipid Research. - 1980. - N 8. - P. 961-969. Для этого используют раствор (0,5 мл), содержащий коллагеназу тип 4 и эластазу тип 3 («sigma», США). Время диспергирования - 75 мин при 37°C (1 мл/50 мг ткани). Полученную суспензию клеток промывают холодным раствором Хенкса. Осадок при последней промывке гомогенизируют в 2 мл 0,25 М раствора сахарозы pH 7,4 с 0,001 м ЭДТА. Конечное разведение гомогенатов аорты соответствует 1:20 (вес: объем). Супернатант используют для исследования активности ХЭ. Активность ХЭ определяют по методу Меньшиков В.В. Лабораторные методы исследования в клинике. М.: Медицина. (1987), с.106-174, в модификации (Friedwald W.T., Levy R.I., Fredrickson D.S Estimation of plasma low density lipoprotein cholesterol concentration with use of the preparative ultracentrifuge. // Clin Chem (1972); V.18, P. -502), используя в качестве субстрата 12,7 мкмолей холестерол-(1-14c)-олеата (удельная мКи/ммоль («Amershem», Англия). Субстрат предварительно освобождают от загрязнения жирными кислотами экстракцией, затем добавляют в небольшое количество бензола, содержащего 1,25 ммоль немеченого холестерол олеата и 127 ммоль яичного лецитина. Растворитель упаривают в токе азота. Несколько раз промывают хлороформом при 37°C. Затем в колбу, содержащую субстратную смесь, заливают 10 мл 10 мм тирс-HCl буфера pH 7,0 с 100 мм ЛСД. Суспензию переносят в 15 мл сосуд с охлаждением (или баню со льдом) и озвучивают 12 мин на Brenson W-350 дезинтеграторе со стандартным диаметром наконечника 0,5-дюймовым и мощностью около 100 Вт. Полученную опалесцирующую суспензию центрифугируют в течение 15 мин при 30000 об/мин («Beckmen» L-5). Препарат хранят при 4°C в течение 2 недель.
Источник фермента - суспензию клеток (аорта) разбавляют в 3 раза буфером pH 7,4 (среда выделения с дигитоником), субстрат разводят в 0,1 М ацетатном буфере pH 3,9 с 5,0 мм таурохолатом натрия в соотношении 1:4 (об./об.). К 0,1 мл материала добавляют 0.1 мл раствора субстрата, инкубируют на водяной бане при 37°C 90 мин и останавливают реакцию органической смесью, состоящей из метанола, хлороформа и гептана (2,5 мл) в соотношении 1,4:1,3:1 (об./об.) соответственно, после чего добавляют 0,1 М боратный буфер pH 10,0 (1,05 мл) и проводят активное смешивание на встряхивателе «Vortex» в течение 5 мин. Далее смесь центрифугируют в течение 10 мин при 2500-3000 об/мин на центрифуге PC-6. После разделения фаз отбирают 0,5 мл верхней светлой фазы и подсчитывают ее в сцинциляционной жидкости (на 1 л толуола - 4 г PPO и 0,2 г РОРОР) на счетчике «Mark-З» (Голландия).
Активность холестеролэстеразы (A) рассчитывают по формуле
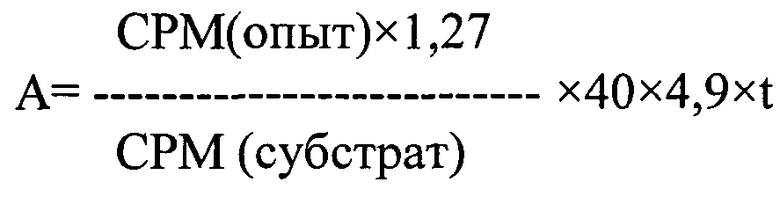 ,
,
где СРМ - счет в импульсах/мин;
1,27 - количество немеченого холестерол-олата в пробе, мкмоль;
40 - разведение в ходе энзиматической реакции;
4,9 - коэффициент фазового распределения меченого холестерол-олеата;
t - время инкубации, мин.
Активность выражают в количестве образующихся микромолей холестерол-олеата с учетом распределения в фазах под действием холестеролэстеразы в мин на 1 г белка. Результаты обрабатывают статистически.
На основании полученных результатов можно сделать следующие выводы, что при использовании цинкотрана в качестве средства, снижающего активность холестеролэстеразы, происходит ее снижение по сравнению с эталоном в два раза, а в случае применения трикрезана на 8,4 мкмоль/мин на 1 г белка.
Результаты ферментативного анализа иллюстрирует табл.1.
Активацию системы лизосомального липолиза можно рассматривать как компенсаторную реакцию ферментных систем на фоне преобладания неспецифического, нерегулируемого эндоцитоза модифицированных липопротеинов низкой плотности (ЛПНП) или надмолекулярных ЛПНП-содержащих комплексов. При этом в условиях субстратного насыщения может возникнуть относительная недостаточность отдельных лизосомальных ферментов (в частности, ХЭ), гидролизующей эфиры холестерина (ЭХС), что приводит к аккумуляции ЭХС и триглицеридов в клетках крови и повышению риска развития атеросклероза (Packard R.R., Libby P. Inflammation in atherosclerosis: from vascular biology to biomarker discovery and risk prediction // din Chem. (2008). Vol.54, №1. P. 24-38). Наряду с этим, изменения в состоянии лизосомального аппарата интимы можно расценивать и как адаптационные перестройки на стадии липоидоза, и как результат функциональной недостаточности на стадии образования фиброзной бляшки.
Таким образом, реакции холестеролэстеразы указывают на структурно-функциональные нарушения в деятельности субклеточных структур при развитии атеросклероза и соответственно полезными могут быть средства, активные в отношении таких реакций.
Установление новых свойств цинкатрана позволит использовать его, например, для повышения устойчивости сосудистой системы к холестерину при развитии атеросклеротического процесса. Также он может быть использован для образования вторичных посредников или предшественников в синтезе биологически активных веществ - эйкозаноидов. Ввиду важности выявленного механизма корреляции активности ферментной системы в зависимости от состояния организма, цинкатран можно использовать не только для профилактики и/или лечения состояний, связанных с нарушением нормальной функции холестеролэстеразы, но и при диагностике структурно-функциональных нарушений в деятельности субклеточных структур при развитии атеросклероза, а также при скрининге соединений, обладающихй такой же активностью.

Корреляционный анализ указывает на связь между уровнем активности ХЭ и показателями липидного обмена после введения цинкатрана (табл.2).

| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ ПРОТАТРАН 4-ХЛОР-2-МЕТИЛФЕНОКСИАЦЕТАТА (ХЛОРКРЕЗАЦИНА) ДЛЯ УГНЕТЕНИЯ АКТИВНОСТИ ХОЛЕСТЕРОЛЭСТЕРАЗЫ | 2014 |
|
RU2563831C1 |
| СРЕДСТВО, СНИЖАЮЩЕЕ АКТИВНОСТЬ ХОЛЕСТЕРОЛЭСТЕРАЗЫ | 2010 |
|
RU2444357C1 |
| ПРИМЕНЕНИЕ КОМПЛЕКСА-ТРИС-(2-ГИДРОКСИЭТИЛ)АМИНА С БИС-(2-МЕТИЛФЕНОКСИАЦЕТАТОМ) ЦИНКА (ЦИНКАТРАНА) ДЛЯ СНИЖЕНИЯ ОБЩЕЙ АКТИВНОСТИ КИСЛОЙ ФОСФОЛИПАЗЫ А1 | 2014 |
|
RU2545888C1 |
| Способ коррекции атерогенеза в эксперименте с помощью 1-гидроксигерматрана | 2020 |
|
RU2741229C1 |
| Применение 1-гидроксигерматрана для торможения развития атеросклероза в эксперименте | 2020 |
|
RU2742972C1 |
| ПРИМЕНЕНИЕ КОМПЛЕКСА-ТРИС-(2-ГИДРОКСИЭТИЛ)АМИНА С БИС-(2-МЕТИЛФЕНОКСИАЦЕТАТОМ) ЦИНКА (ЦИНКАТРАНА) В КАЧЕСТВЕ СРЕДСТВА, УГНЕТАЮЩЕГО ОБЩУЮ АКТИВНОСТЬ ОСНОВНОЙ (ЩЕЛОЧНОЙ) ФОСФОЛИПАЗЫ А2 МОНОНУКЛЕАРОВ | 2014 |
|
RU2546537C1 |
| Применение 1-(герматран-1-ил)-1-оксиэтиламина для торможения развития атеросклероза в эксперименте | 2020 |
|
RU2746321C1 |
| Способ коррекции атерогенеза в эксперименте с помощью 1-(герматран-1-ил)-1-оксиэтиламина | 2020 |
|
RU2741906C1 |
| СРЕДСТВО, МОДУЛИРУЮЩЕЕ АКТИВНОСТЬ КИСЛОЙ ФОСФОЛИПАЗЫ А1 | 2010 |
|
RU2445087C1 |
| ПРИМЕНЕНИЕ ПРОТАТРАН 4-ХЛОР-2-МЕТИЛФЕНОКСИАЦЕТАТА ДЛЯ УГНЕТЕНИЯ СУММАРНОЙ АКТИВНОСТИ ОСНОВНОЙ (ЩЕЛОЧНОЙ) ФОСФОЛИПАЗЫ А2 МОНОНУКЛЕАРОВ | 2016 |
|
RU2619860C1 |
Изобретение относится к медицине, фармакологии и биологии. Предложен комплекс трис-(2-гидроксиэтил)амина с бис-(2-метилфеноксиацетатом)цинка [цинкатрана или цитримина] формулы: (НОСН2СН2)3N·Zn(ООССН2ОС6Н4СН3-2)2 в качестве средства, снижающего активность холестеролэстеразы. 2 табл.
Применение комплекса трис-(2-гидроксиэтил)амина с бис-(2-метилфеноксиацетатом)цинка [цинкатрана или цитримина] формулы: (HOCH2CH2)3N·Zn(OOCCH2OC6H4CH3-2)2 в качестве средства, снижающего активность холестеролэстеразы.
| СРЕДСТВО, СНИЖАЮЩЕЕ АКТИВНОСТЬ ХОЛЕСТЕРОЛЭСТЕРАЗЫ | 2010 |
|
RU2444357C1 |
| Х | |||
| Брокерхов и др | |||
| Липолитические ферменты.- Наука, 1976, 380 с | |||
| Ефремов и др | |||
| Роль лизосомальных ферментов в генезе ведущих клинико-патофизиологических синдромов: факты и гипотезы // Патологическая физиология и эксперементальная терапия | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| - С | |||
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
| Самсонов М.А | |||
| и др | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Питания, 1996, N4 | |||
| с | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
Авторы
Даты
2015-02-10—Публикация
2014-03-27—Подача