Изобретение относится к медицине, фармакологии и биологии и касается нового средства, влияющего на активность фосфолипаз.
Фосфолипазы играют важную роль в обмене липидов в живых организмах. Составной частью многих тканей и секретов живых организмов являются фосфолипазы группы А. Фосфолипазы А1 в большинстве своем - внутриклеточные ферменты, часто мембраносвязанные, не нуждаются в коферменте. Их молекулярные массы варьируют в пределах 15-90 тыс; оптимальная каталитическая активность проявляется при pH 4,0 (для лизосомальных ферментов) или 8,0-9,5 (для ферментов микросом, плазматических мембран и цитозоля); широко распространены в животных тканях (печень, сердце, мозг) и в микроорганизмах (Bacillus subtilis, В. megateiium, Mycobacter phlei, Escherichia coli). Фосфолипазы А1 отщепляют ацильную цепь фосфолипида в sn-1 положении. При действии фосфолипазы А1 на фосфолипид образуется 1-лизофосфолипид и жирная кислота.
Доказано, что фосфолипазы являются биомаркерами активности атеросклеротического процесса [1], эффективности проводимой терапии как у больных атеросклерозом, так и у больных с осложнениями атеросклероза, в частности ишемической болезни сердца - ИБС (стенокардией напряжения II ФК) [2, 3].
Известно, что на раннем этапе атерогенеза происходит активация эндотелия, который экспрессирует на своей поверхности адгезионные молекулы для моноцитов, нейтрофилов и лейкоцитов крови и продуцирует хемоаттрактанты, привлекающие моноциты в интиму сосудов. Моноциты, мигрирующие в субэндотелиальное пространство, дифференцируются в макрофаги, которые выступают как катализаторы образования окисленных ЛНП, миграции и пролиферации гладкомышечных клеток из мышечной оболочки в интиму. Частицы модифицированных ЛНП предпочтительно захватываются с помощью специфических рецепторов макрофагами, которые трансформируются в пенистые клетки. Активированные макрофаги, продуцирующие металлопротеиназы и коллагеназу, в определенных ситуациях способствуют распаду коллагена в бляшке и возникновению такого грозного осложнения, как разрыв бляшки, образование тромба и развитие инфаркта миокарда. Липидный профиль в значительной мере определяется состоянием макрофагов, их ферментативными реакциями. В этом плане заслуживают внимания исследования и разработки средств, изменяющих активность липаз макрофагов, в частности кислой фосфолипазы А1 (ФЛА1к) (КФ 3.1.1.32) с оптимумом pH 4,0, вызывающей деградацию структуры фосфолипидов, отщепляя ацильные остатки от углеродных атомов C1 в молекуле лецитина и других фосфолипидов с образованием промежуточных продуктов гидролиза - лизолецитина и лизофосфолипидов, обладающих сильным мембранотоксическим действием [4, 5].
В литературе имеются сведения о возможности снижения общей (суммарной) активности ФЛА различными химическими соединениями [Н.Б.Губергриц. «Эссенциале форте Н», «Эссенциале Н» в гепатологии и гастроэнтерологии. Сучасна гастроентерологiя, №5 (43), 2008, с.79-89] [18].
Известно также, что при введении некоторых препаратов, например липостабила, который оказывает гиполипидемическое действие, происходит активация кислых и щелочных фосфолипаз [М.А.Самсонов, А.В.Васильев, А.В.Погожева, С.Н.Бобкова. Сравнительная оценка гиполипидемического действия ПНЖК w-3 и липостабила. //Вопр. питания, 1996, №4, с.12-16 [6].
Однако существует потребность в поиске и внедрении в практику новых диагностических и лекарственных средств, обладающих активностью в отношении фосфолипаз.
Задачей изобретения является разработка нового средства, модулирующего активность кислой фосфолипазы А1 (ФЛА1к).
Поставленная задача решается новым отечественным препаратом трекрезан, что позволяет расширить область его применения. Трекрезан обладает широким спектром терапевтического действия и отвечает формуле:
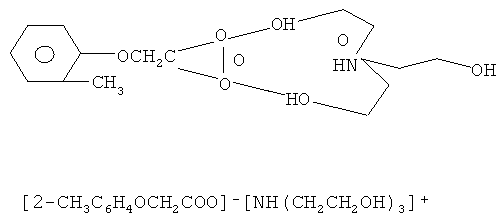
Известно применение трекрезана как препарата, повышающего иммунитет и адаптивные свойства организма [7]. Свойство трекрезана влиять на общую активность кислой фосфолипазы А1 в литературе не описаны.
Применение трекрезана по новому назначению стало возможным благодаря выявленным нами его новым свойствам. Впервые показано, что введение трекрезана влияет на активность лизосомального липолитического фермента из класса гидролаз (КФ 3.1.1): ФЛА1к (КФ 3.1.1.32).
Возможность осуществления изобретения может быть проиллюстрирована следующими ниже представленными данными.
Пример 1
Методика. В исследование включены 27 больных ИБС: стенокардией напряжения II ФК (17 мужчин и 10 женщин), средний возраст - 55,4±6,7 лет. Диагноз верифицировали на основании рекомендаций ААК/ААС/ЕОК, 2003 и Канадской классификации СтН в модификации ВКНЦ СССР.
В исследование не включались больные с нестабильной стенокардией, инфарктом миокарда давностью менее 3 месяцев, с тяжелой и злокачественной артериальной гипертензией, с хронической сердечной недостаточностью ФК III-IV по NYHA, со стойкой артериальной гипотензией (САД<100 мм рт.ст.), с AV-блокадой II-III степени, синдромом слабости синусового узла, с выраженной почечной и печеночной недостаточностью, а также с заболеваниями или состояниями, которые могли повлиять на объективность исследования.
Все пациенты в течение 30 дней до начала исследования получали стандартную терапию СтН, которая при необходимости включала нитраты (изосорбида динитрат 40-80 мг/сут), β-адреноблокаторы (атенолол 25-50 мг/сут), дезагреганты (аспирин 125 мг/сут), ингибиторы АПФ (каптоприл 25-50 мг/сут), а затем в составе комплексного лечения трекрезан по 600 мг в сутки в течение 30 дней. Динамику клинического состояния больных оценивали по количеству ангинозных приступов стенокардии за сутки (АПС) и количеству потребляемого нитроглицерина за сутки (НТГС). Толерантность к физической нагрузке у больных контролировали с помощью тредмила «Schiller AT-104» по протоколу Bruce. Качество жизни больных оценивали по «Сиэтлскому опроснику для стенокардии» (Seattle Angina Questionnaire, SAQ). Содержание холестерина (ХС) и триглицеридов (ТГ) определяли ферментативным способом на анализаторе FP-900 (Финляндия), ХС липопротеидов высокой плотности (ЛПВП) - в супернатанте после преципитации липопротеидов других классов хлоридом магния. ХС липопротеидов низкой плотности (ЛПНП) рассчитывали по формуле W.Friedwald [8]. Индекс атерогенности (ИА) определяли методом [9]. Исследования проводили до начала лечения и через 1,5 месяца комплексного лечения. Макрофаги выделяли из крови путем последовательного центрифугирования в градиенте фикол-верографин согласно модифицированному методу [10]. Активность ФЛА1к определяли радиометрическим методов [11] с использованием в качестве субстрата синтезированного нами 1-ацил-2(1-14С)-олеоил-глицеро-3, Sn-фосфорилхолина [12].
Результаты обрабатывали статистически.
Результаты. Установлено, что после включения трекрезана в состав комплексной терапии показатели качества жизни по SAQ через 1,5 месяца претерпели достоверные изменения (табл.1). В разделе 1 «ограничение физической активности» отмечено увеличение физической активности на 34,8%; в разделе 2 «стабильность стенокардии» - улучшение показателя на 12,2%; в разделе 3 «тяжесть стенокардии» - на 28,1%; в разделе 4 «удовлетворенность лечением» - на 9,5%; в разделе 5 «восприятие болезни» - на 13,5%. Итоговое значение SAQ достоверно улучшилось на 24,2%. Также выявлено, что и клинические характеристики больных через 1,5 месяца претерпели существенные изменения. В частности, достоверно уменьшились АПС и НТГС. К концу наблюдений отмечено достоверное увеличение толерантности к физической нагрузке по результатам тредмил-теста (табл.2). При этом не выявлено значимых побочных эффектов или осложнений, связанных с приемом трекрезана, требовавших его отмены. Вместе с тем на фоне проводимого стандартного лечения наблюдался повышенный уровень активности кФЛА1 макрофагов. После добавления к стандартизованному лечению СтН трекрезана у больных ИБС отмечалось достоверное понижение общей активности ФЛА1к макрофагов на 34,3% по сравнению с активностью этого фермента до начала лечения и снижение уровня ХС, ЛПНП, ТГ, ИА (табл.3).
Таким образом, одним из ключевых звеньев в сложной цепи механизма действия трекрезана является влияние на общую активность ФЛА1к в условиях развития атеросклеротического процесса.
Пример 2
Эксперименты проведены на кроликах породы Шиншилла с исходной массой тела 1,8-2,0 кг. Кроликам опытных групп (10 животных) вводили внутримышечно свежеприготовленный водный раствор трекрезана (Тк) в дозе 25 мг/кг в течение 3 мес. В конце экспериментов у животных в грудном отделе аорты стандартными методами определяли содержание липидов, триацилглицеринов, β-липопротеинов и холестерина. Планиметрически оценивали индекс ее пораженности атеросклеротическими бляшками (ИПА). Для определения активности ФКЛ из кусочков грудной аорты диспергированием выделяли клетки интимы методом [15]. Для этого использовали раствор (0,5 мл), содержащий коллагеназу - тип 4 и эластазу - тип 3 («sigma», США). Время диспергирования -75 мин при 37°С (1 мл/50 мг ткани). Полученную суспензию клеток промывали холодным раствором Хенкса. Осадок при последней промывке гомогенизировали в 2 мл 0,25М раствора сахарозы pH 7,4 с 0,001 м ЭДТА. Конечное разведение гомогенатов аорты соответствовало 1:20 (вес:объем). Супернатант использовали для исследования активности КЛ. Активность КЛ определяли спектрофотометрически по методу [16], используя в качестве субстрата B-нафтилкаприлат («sigma», США). К 0,2 мл исследуемого материала добавляли 0,5 мл субстратного раствора в 0,2 М ацетатном буфере pH 5,2 с 0,2% тритоном Х-100, инкубировали на водяной бане в течение 30 мин при 37°С. Реакцию останавливали добавлением 0,5 мл «fast blue В» («serva», ФРГ) (1 мг/мл в 0,05 М фосфатном буфере pH 7,2), через 5 мин добавляли 1 мл 10% охлажденного раствора трихлоруксусной кислоты, еще через 3 мин 1,5 мл этилового эфира уксусной кислоты, затем образцы встряхивали, центрифугировали на центрифуге WKH-1 при 150 g 15 мин. Отбирали 0,5 мл верхней фазы в микрокювету и проводили спектрометрию при 525 нм. Суммарную активность ФКЛ выражали в микромолях В-нафтола, образовавшегося за 1 мин на 1 г белка.
Результаты обрабатывали статистически.
Результаты ферментативного анализа, представлены в табл.4.
Корреляционный анализ выявил связь между уровнем активности ФКЛ и показателями липидного обмена после введения трекрезана (табл.5).
Активацию системы лизосомального липолиза можно рассматривать как компенсаторную реакцию ферментных систем на фоне преобладания неспецифического, нерегулируемого эндоцитоза модифицированных липопротеинов низкой плотности (ЛПНП) или надмолекулярных ЛПНП-содержащих комплексов. При этом в условиях субстратного насыщения может возникнуть относительная недостаточность отдельных лизосомальных ферментов (в частности, ФКЛ), расщепляющих этерифицированный холестерин (ЭХС), что приводит к аккумуляции ЭХС и триглицеридов в клетках крови и повышению риска развития атеросклероза [17]. Наряду с этим изменения в состоянии лизосомального аппарата интимы можно расценивать и как адаптационные перестройки на стадии липоидоза, и как результат функциональной недостаточности на стадии образования фиброзной бляшки.
Таким образом, реакции кислой липазы указывают на структурно- функциональные нарушения в деятельности субклеточных структур при развитии атеросклероза и, соответственно, полезными могут быть средства - модуляторы таких реакций.
Установление новых свойств трекрезана позволит использовать его, например, для повышения устойчивости сосудистой системы к холестерину при развитии атеросклеротического процесса. Также он может быть использован для образования вторичных посредников или предшественников в синтезе биологически активных веществ - эйкозаноидов. Ввиду важности выявленного механизма корреляции активности ферментной системы в зависимости от состояния организма трекрезан можно использовать не только для профилактики и/или лечения состояний, связанных с нарушением нормальной функции фосфолипаз А1 макрофагов, но и при скрининге, например, соединений, обладающих аналогичной активностью.
Литература
1. М.И.Душкин. Макрофаги и атеросклероз: патофизиологические и терапевтические аспекты. // Бюлл. СО РАМН (2006); №2 (120), с.47-55.
2. С.Н.Богданова. Клинико-экспериментальное изучение влияния фактора питания на активность лизосомальных гидролаз тромбоцитов и мононуклеарных лейкоцитов при атеросклерозе. Автореф. дисс. канд., Москва (1992), 28 с.
3. Е.Н.Данковцев, Д.А.Затейщиков. Биомаркеры в кардиологии: липопротеинассоциированная фосфолипаза А2. // Фарматека (2007); №15 (149). Кардиология, неврология, с.22-28.
4. А.А.Покровский, В.А.Тутельян. Лизосомы. - Наука, 1976, 380 с.
5. X.Брокерхоф, Р.Дженсен. Липолитические ферменты, пер. с англ., М., 1978, с.242-356.
6. М.А.Самсонов, А.В.Васильев, А.В.Погожева, С.Н.Бобкова. Сравнительная оценка гиполидемического действия ПНЖК ω-3 и липостабила. // «Вопр. питания», 1996, №4, с.12-16.
7. М.Г.Воронков, М.М.Расулов. Трекрезан - родоначальник нового класса адаптогенов и иммуномодуляторов. // Хим.-фарм.ж., 2007, №1, с.3-9.
8. W.T.Friedwald, R.I., Levy, D.S Fredrickson Estimation of plasma low density lipoprotein cholesterol concentration with use of the preparative ultracentrifuge. // Clin Chem (1972); v.18, p.499-502.
9. B.B.Меньшиков. Лабораторные методы исследования в клинике. М.: Медицина. (1987), С.106-174.
10. F.Gmeling-Meyling F., T.Waldmann. Separation of human blood mono-cytes and lymphocytes on an as continuous percoll gradient. // J. Immun. Methods, (1980). Vol.33, №1, P.1-9.
11. W.Stoffel, U.Trabert, Studies on the occurrence and properties of lisosomal phospholipases A1 and А2 and the degradation of phosphatidic acid in rat liver lysosomes // Hoppe Seylers Z. Fhysiol. Chem. - 1969. - Bd.350. - S.836-844.
12. A.F.Robertson, W.E.M.Leuds. Positional specificities in phospholipid hydrolyses // Biochemistry (Wash.). - 1962. - Vol.1. - P.804-810.
13. A.H.Климов. Атеросклероз. В кн. Превентивная кардиология. М.: Медицина (1977); с.260-271.
14. R.R.Packard, P.Libby. Inflammation in atherosclerosis: from vascular biology to biomarker discovery and risk prediction. // Clin Chem. (2008). Vol.54, №1, р.24-38.
15. Haley N.J., Powler S., De Duve C. Lysosomal and cholesteryl esterase activity in normal and lipid laden aortic cells. // J. Lipid Research. - 1980. - N8. - P.961-969.
16. Булычев А.Г., Семенова Е.Г., Ассиновская О.А. Влияние аггрегации нейтрального красного, акридинового оранжевого и хлористого аммония клетками (сублинии) на активность лизосомальных гидролаз. // Цитология. - (1986). Т.28, №7. С.703-711.
17. Нагорнев В.А. Методология в изучении проблемы атеросклероза. // Мед. акад. ж. 2005, т.5, в.3, с.121-133.
18. Н.Б.Губергриц. «Эссенциале форте Н». «Эссенциале Н» в гепатологии и гастроэнтерологии. Сучасна гастроентерологiя, №5 (43), 2008, с.79-89.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО, СНИЖАЮЩЕЕ АКТИВНОСТЬ ХОЛЕСТЕРОЛЭСТЕРАЗЫ | 2010 |
|
RU2444357C1 |
| СРЕДСТВО, ПОВЫШАЮЩЕЕ АКТИВНОСТЬ КИСЛОЙ ЛИПАЗЫ ТРОМБОЦИТОВ | 2010 |
|
RU2429833C1 |
| ПРИМЕНЕНИЕ КОМПЛЕКСА-ТРИС-(2-ГИДРОКСИЭТИЛ)АМИНА С БИС-(2-МЕТИЛФЕНОКСИАЦЕТАТОМ) ЦИНКА (ЦИНКАТРАНА) ДЛЯ СНИЖЕНИЯ ОБЩЕЙ АКТИВНОСТИ КИСЛОЙ ФОСФОЛИПАЗЫ А1 | 2014 |
|
RU2545888C1 |
| Применение 1-гидроксигерматрана для торможения развития атеросклероза в эксперименте | 2020 |
|
RU2742972C1 |
| Способ коррекции атерогенеза в эксперименте с помощью 1-гидроксигерматрана | 2020 |
|
RU2741229C1 |
| Применение 1-(герматран-1-ил)-1-оксиэтиламина для торможения развития атеросклероза в эксперименте | 2020 |
|
RU2746321C1 |
| Способ коррекции атерогенеза в эксперименте с помощью 1-(герматран-1-ил)-1-оксиэтиламина | 2020 |
|
RU2741906C1 |
| ПРИМЕНЕНИЕ КОМПЛЕКСА-ТРИС-(2-ГИДРОКСИЭТИЛ)АМИНА С БИС-(2-МЕТИЛФЕНОКСИАЦЕТАТОМ) ЦИНКА (ЦИНКАТРАНА) В КАЧЕСТВЕ СРЕДСТВА, УГНЕТАЮЩЕГО ОБЩУЮ АКТИВНОСТЬ ОСНОВНОЙ (ЩЕЛОЧНОЙ) ФОСФОЛИПАЗЫ А2 МОНОНУКЛЕАРОВ | 2014 |
|
RU2546537C1 |
| ПРИМЕНЕНИЕ ТРЕКРЕЗАНА ДЛЯ ЛЕЧЕНИЯ БОЛЬНЫХ АРТЕРИАЛЬНОЙ ГИПЕРТОНИЕЙ И ОЖИРЕНИЕМ | 2010 |
|
RU2429832C1 |
| ВЕЩЕСТВО, СНИЖАЮЩЕЕ АКТИВНОСТЬ ХОЛЕСТЕРОЛЭСТЕРАЗЫ | 2014 |
|
RU2540518C1 |
Изобретение относится к медицине, фармакологии и биологии и касается применения трекрезана в качестве модулятора кислой фосфолипазы А1. Изобретение позволяет расширить ассортимент модуляторов кислой фосфолипазы А1. 5 табл., 2 пр.
Применение трекрезана в качестве средства, модулирующего активность кислой фосфолипазы А1.
| СПОСОБ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА (ТРЕКРЕЗАНА) С ИММУНОТРОПНЫМ ДЕЙСТВИЕМ | 1996 |
|
RU2098088C1 |
| БИОЛОГИЧЕСКИ АКТИВНАЯ ДОБАВКА К ПИЩЕ | 2000 |
|
RU2158098C1 |
| RU 2063749 C1, 20.07.1996. | |||
Авторы
Даты
2012-03-20—Публикация
2010-12-22—Подача