ОБЛАСТЬ ТЕХНИКИ
[0001] Настоящее изобретение относится к цитратной соли 9Е-15-(2-пирролидин-1-ил-этокси)-7,12,25-триокса-19,21,24-триазатетрацикло[18.3.1.1 (2,5).1 (14, 18)]гексакоза-1(24),2,4,9,14,16, 18(26),20,22-нонаена. Кроме того, настоящее изобретение относится к фармацевтическим композициям, содержащим указанную цитратную соль, и способам применения этой соли для лечения некоторых медицинских состояний.
УРОВЕНЬ ТЕХНИКИ
[0002] Соединение 9Е-15-(2-пирролидин-1-ил-этокси)-7,12,25-триокса-19,21,24-триазатетрацикло[18.3.1.1 (2,5).1 (14, 18)]гексакоза-1(24),2,4,9,14,16,18(26), 20,22-нонаен (Соединение I) было впервые описано в PCT/SG2006/000352 и показало себя в качестве многообещающего фармацевтически активного агента для лечения ряда медицинских состояний. В настоящее время проводится исследование фармацевтических свойств этого соединения на основании профилей активности, демонстрируемых этим соединением.
[0003] При разработке лекарства, подходящего для массового производства и, в конечном счете, для коммерческого использования, приемлемый уровень активности лекарства по отношению к представляющей интерес мишени является лишь одной из важных переменных, которые необходимо принимать во внимание. Например, при составлении рецептур фармацевтических композиций обязательно, чтобы фармацевтически активное вещество находилось в форме, которую можно надежно воспроизвести в коммерческом процессе производства и которая достаточно устойчива, чтобы выдерживать воздействие условий, которым подвергается фармацевтически активное вещество.
[0004] С точки зрения возможности производства важно обеспечить, чтобы в процессе коммерческого производства фармацевтически активного вещества использование одинаковых условий производства приводило к получению одинакового материала. Кроме того, желательно, чтобы фармацевтически активное вещество находилось в такой твердой форме, при которой внесение небольших изменений в условиях производства не приводило бы к существенным изменениям твердой формы производимого фармацевтически активного вещества. Например, является существенным, чтобы способ получения обеспечивал получение материала, имеющего одинаковые кристаллические свойства с хорошей воспроизводимостью, а также чтобы указанный способ обеспечивал получение материала, имеющего одинаковую степень гидратации.
[0005] Кроме того, важно, чтобы фармацевтически активное вещество было устойчиво к разложению, поглощению влаги из воздуха и последующим изменениям твердой формы. Указанные показатели важны для облегчения включения фармацевтически активного ингредиента в фармацевтические составы. Если фармацевтически активное вещество является гигроскопичным («клейким») в том смысле, что оно со временем абсорбирует воду, то почти невозможно надежно ввести фармацевтически активное вещество в состав лекарства, так как количество вещества, которое следует добавить для обеспечений такой же дозировки, будет сильно меняться в зависимости от степени гидратации. Более того, изменения степени гидратации или твердой формы («полиморфизм») могут приводить к изменениям физико-химических свойств, таким как растворимость или скорость растворения, которые, в свою очередь, могут приводить к несоответствующему пероральному поглощению в организме пациента.
[0006] Следовательно, химическая стабильность, стабильность в твердом состоянии и «срок годности» фармацевтически активного агента являются очень важными факторами. В идеальной ситуации фармацевтически активный агент и любые содержащие его композиции должны обеспечивать возможность их эффективного хранения в течение значительных периодов времени без проявления значительных изменений физико-химических характеристик активного компонента, таких как его активность, содержание влаги, характеристики растворимости, твердая форма и тому подобное.
[0007] В отношении 9Е-15-(2-пирролидин-1-ил-этокси)-7,12,25-триокса-19,21,24-триазатетрацикло[18.3.1.1 (2,5). 1 (14,18)]гексакоза-1(24),2,4,9,14,16,18(26),20,22-нонаена первоначальные исследования проводили на гидрохлоридной соли, при этом указанные исследования показали преобладание полиморфизма, и было обнаружено, что соединение может находиться более чем в одной кристаллической форме в зависимости от условий производства. Кроме того, наблюдалось изменение соотношения полиморфных модификаций от партии к партии даже когда условия производства оставались постоянными. Такие расхождения между разными партиями снижали коммерческую привлекательность гидрохлоридной соли.
[0008] Следовательно, было бы желательно разработать соли 9Е-15-(2-пирролидин-1-ил-этокси)-7,12,25-триокса-19,21,24-триазатетрацикло[18.3.1.1 (2,5).1(14,18)]гексакоза-1(24),2,4,9,14,16,18(26),20,22-нонаена, которые позволили бы решить или нивелировать одну или более из упомянутых выше проблем.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0009] Согласно настоящему изобретению предложен цитрат (соль лимонной кислоты) 9Е-15-(2-пирролидин-1-ил-этокси)-7,12,25-триокса-19,21,24-триазатетрацикло[18.3.1.1(2,5).1(14,18)]гексакоза-1(24),2,4,9,14,16,18(26),20,22-нонаена.
[0010] В некоторых вариантах реализации изобретения указанная соль является кристаллической.
[0011] В некоторых вариантах реализации изобретения указанная соль представляет собой цитрат 1:1. В некоторых вариантах реализации указанный цитрат характеризуется пиком рентгеновской дифракции при 22,4°±0,5° по шкале 2-тета.
[0012] В некоторых вариантах реализации указанный цитрат характеризуется пиками рентгеновской дифракции при 10°±0,5°, 15,6°±0,5° и 17,2°±0,5° по шкале 2-тета.
[0013] В некоторых вариантах указанный цитрат характеризуется по меньшей мере четырьмя пиками рентгеновской дифракции, выбранными из группы, состоящей из 7,9°±0,5°, 10,0°±0,5°, 15,6°±0,5°, 15,9°±0,5°, 16,8°±0,5°, 17,2°±0,5°, 21,1°±0,5° и 22,4°±0,5° по шкале 2-тета.
[0014] В некоторых вариантах реализации указанный цитрат характеризуется по меньшей мере шестью пиками рентгеновской дифракции, выбранных из группы, состоящей из 7,9°±0,5°, 10,0°±0,5°, 15,6°±0,5°, 15,9°±0,5°, 16,8°±0,5°, 17,2°±0,5°, 21,1°±0,5° и 22,4°±0,5° по шкале 2-тета.
[0015] В некоторых вариантах реализации указанный цитрат характеризуется пиками рентгеновской дифракции при 7,9°±0,5°, 10,0°±0,5°, 15,6°±0,5°, 15,9°±0,5°, 16,8°±0,5°, 17,2°±0,5°, 21,1°±0,5° и 22,4°±0,5° по шкале 2-тета.
[0016] В некоторых вариантах реализации указанный цитрат также характеризуется пиками рентгеновской дифракции при 11,1°±0,5°, 18,1°±0,5°, 21,8°±0,5°, 23,2°±0,5° и 27,6°±0,5° по шкале 2-тета.
[0017] В некоторых вариантах реализации указанный цитрат также характеризуется пиками рентгеновской дифракции при 7,0°±0,5°, 14,0°±0,5°, 19,0°±0,5°, 19,8°±0,5°, 23,6°±0,5°, 24,3°±0,5°, 25,2°±0,5°, 25,7°±0,5°, 26,1°±0,50, 26,5°±0,50 и 32,1°±0,5° по шкале 2-тета.
[0018] Согласно настоящему изобретению также предложена фармацевтическая композиция, содержащая описанный выше цитрат.
[0019] В другом варианте реализации настоящего изобретения предложен способ лечения или предотвращения пролиферативного расстройства, включающий введение терапевтически эффективного количества цитрата согласно изобретению нуждающемуся в этом пациенту. В некоторых вариантах реализации изобретения пролиферативное расстройство представляет собой рак.
[0020] В другом варианте реализации настоящего изобретения предложено применение предложенного цитрата согласно изобретению для лечения пролиферативного расстройства. В некоторых вариантах реализации изобретения пролиферативное расстройство представляет собой рак.
[0021] В другом варианте реализации настоящего изобретения предложено применение предложенного цитрата согласно изобретению для получения лекарственного средства для лечения пролиферативного расстройства. В некоторых вариантах реализации изобретения пролиферативное расстройство представляет собой рак.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
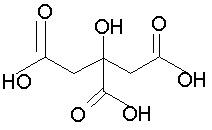
[0022] На Фиг.1 представлены дифрактограммы порошковой рентгеновской дифракции высокого разрешения (XRPD) для Партии 1, гидрохлоридной соли, полученной в тетрагидрофуране (ТГФ).
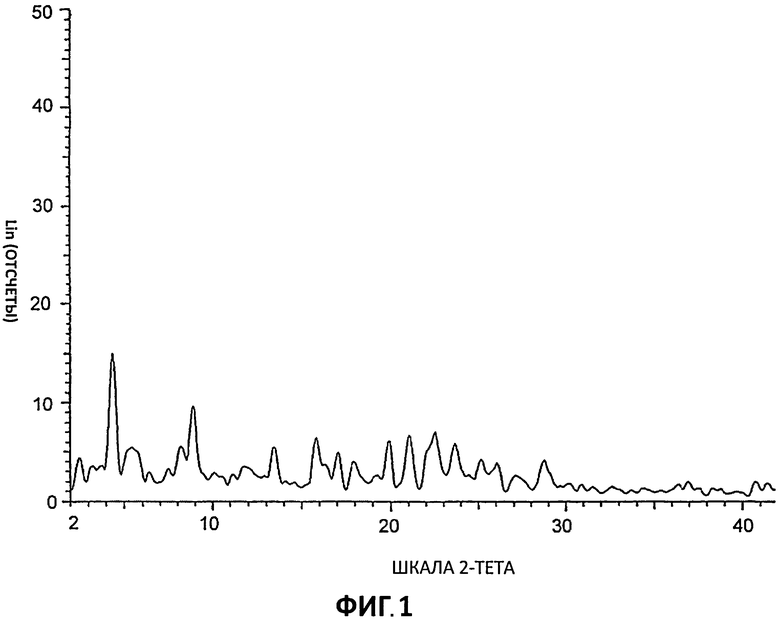
[0023] На Фиг.2 представлены дифрактограммы порошковой рентгеновской дифракции высокого разрешения (XRPD) для Партии 2, гидрохлоридной соли, полученной в MeCN.
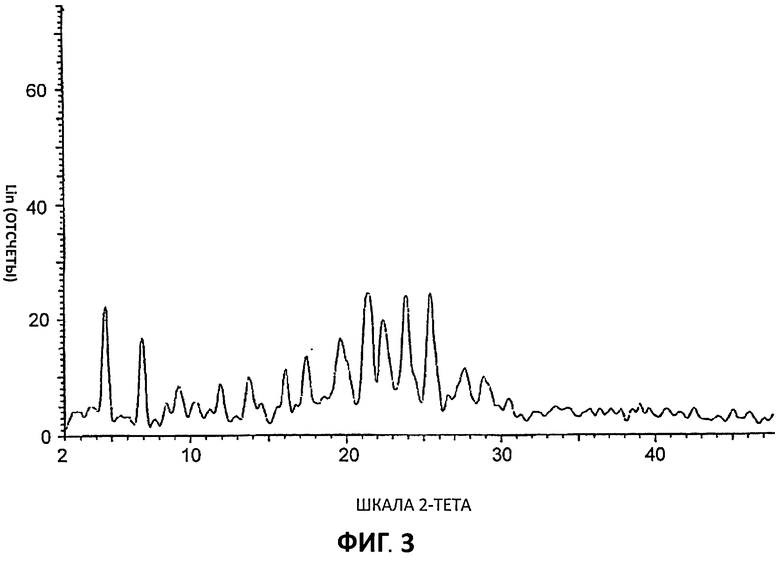
[0024] На Фиг.3 представлены дифрактограммы порошковой рентгеновской дифракции высокого разрешения (XRPD) для Партии 3, гидрохлоридной соли, полученной в ацетоне.
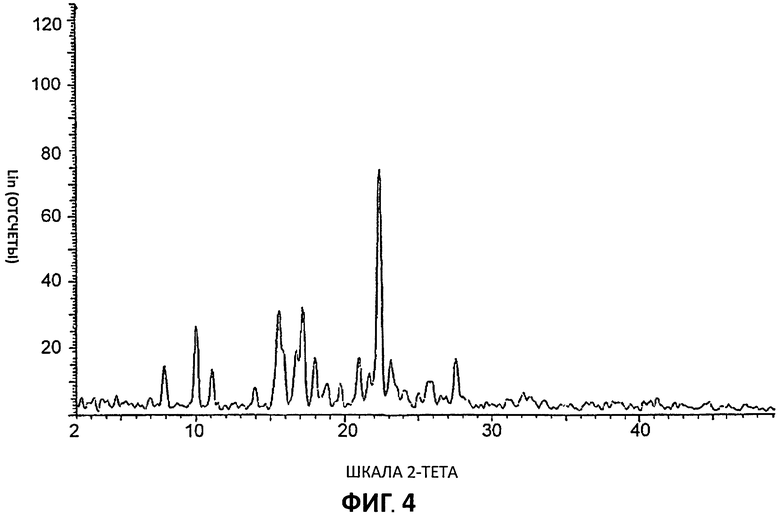
[0025] На Фиг.4 представлены дифрактограммы порошковой рентгеновской дифракции высокого разрешения (XRPD) для Партии 4, цитратной соли, полученной в ТГФ.
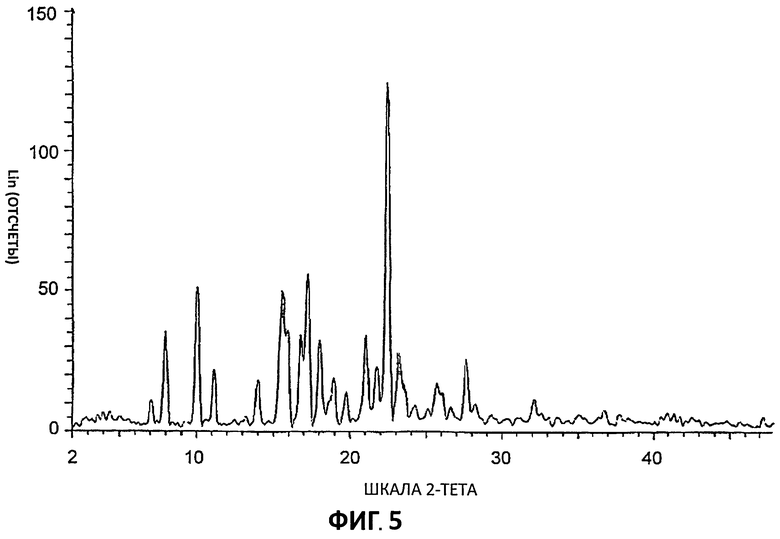
[0026] На Фиг.5 представлены дифрактограммы порошковой рентгеновской дифракции высокого разрешения (XRPD) для Партии 5, цитратной соли, полученной в ТГФ.
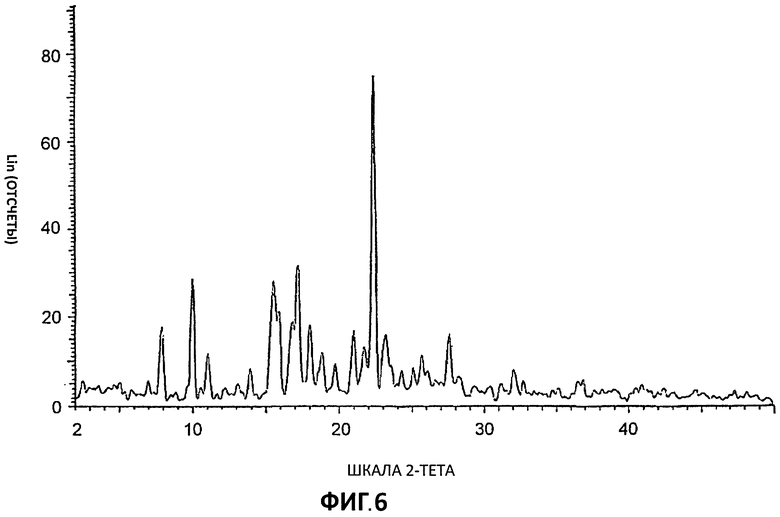
[0027] На Фиг.6 представлены дифрактограммы порошковой рентгеновской дифракции высокого разрешения (XRPD) для Партии 6, гидрохлоридной соли, полученной в ацетоне.
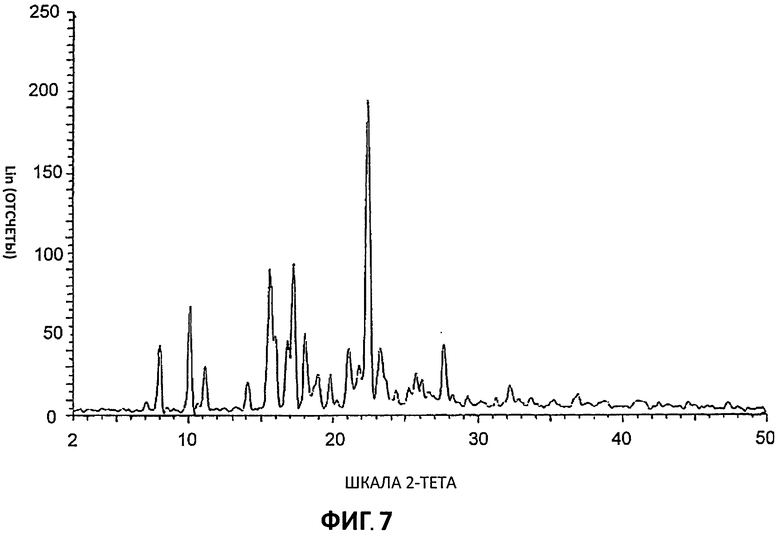
[0028] На Фиг.7 представлены дифрактограммы порошковой рентгеновской дифракции высокого разрешения (XRPD) для Партии 7, цитратной соли, полученной в ацетоне (шкала 20 г).
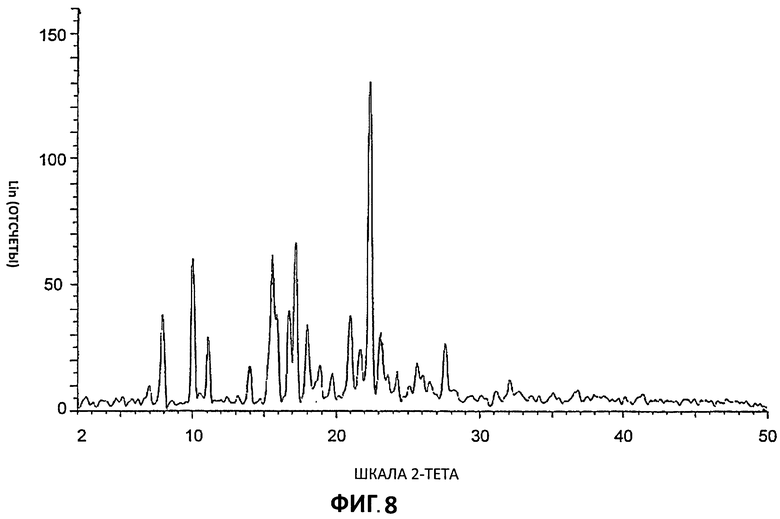
[0029] На Фиг.8 представлены дифрактограммы порошковой рентгеновской дифракции высокого разрешения (XRPD) для Партии 8, цитратной соли, полученной в ацетоне (шкала 20 г).
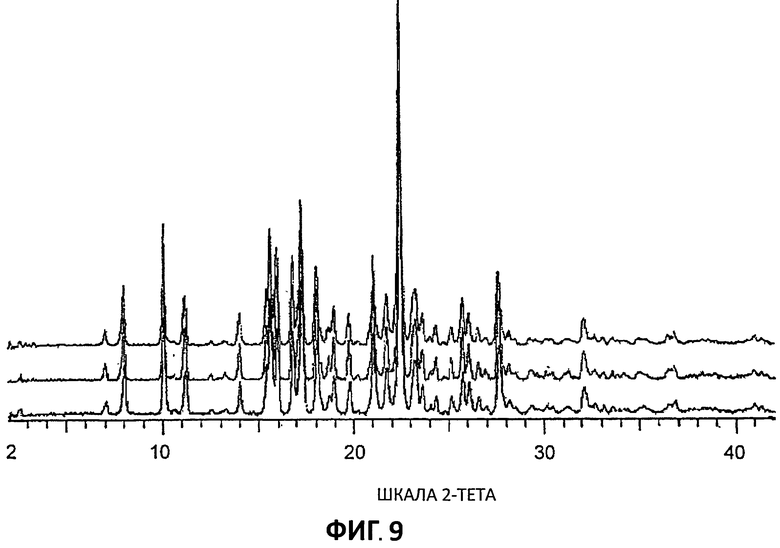
[0030] На Фиг.9 представлены дифрактограммы порошковой рентгеновской дифракции высокого разрешения (XRPD) для Партий 4-6.
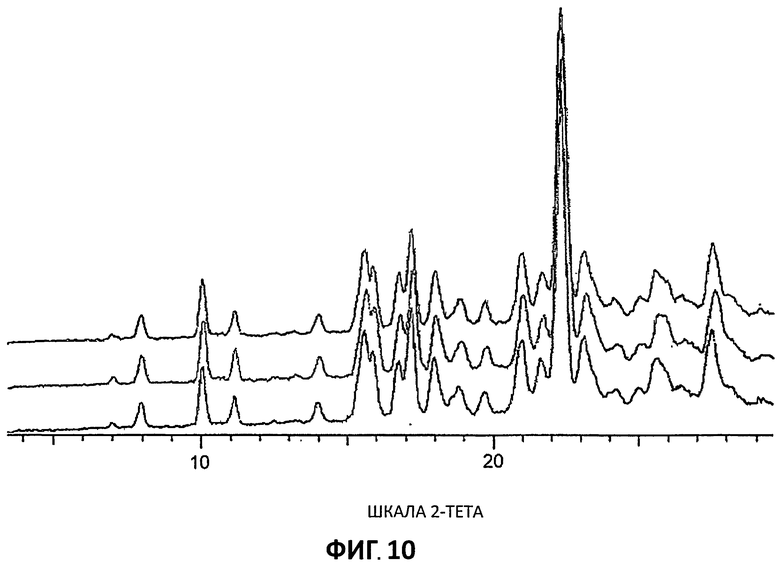
[0031] На Фиг.10 представлены дифрактограммы порошковой рентгеновской дифракции низкого разрешения для Партий 4-6.
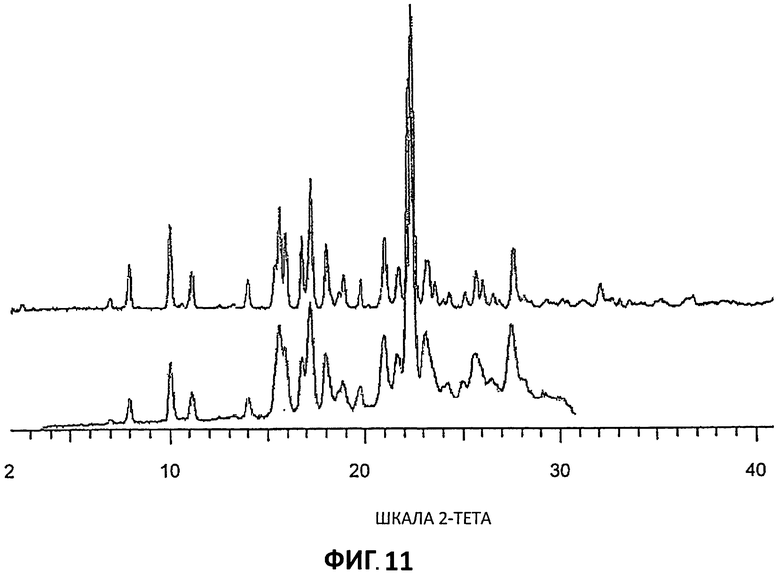
[0032] На Фиг.11 представлены дифрактограммы порошковой рентгеновской дифракции высокого и низкого разрешения для Партии 4.
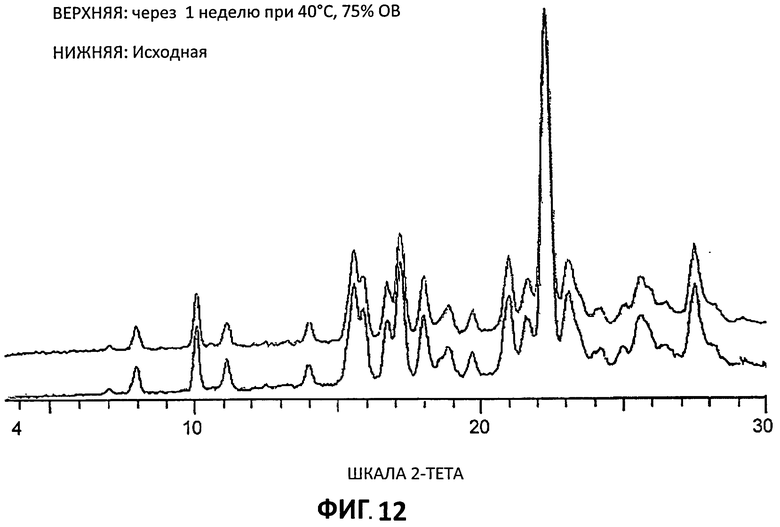
[0033] На Фиг.12 представлены кривые порошковой рентгеновской дифракции для Партии 4 до и после хранения при 40°С и относительной влажности 75% в течение 1 недели.
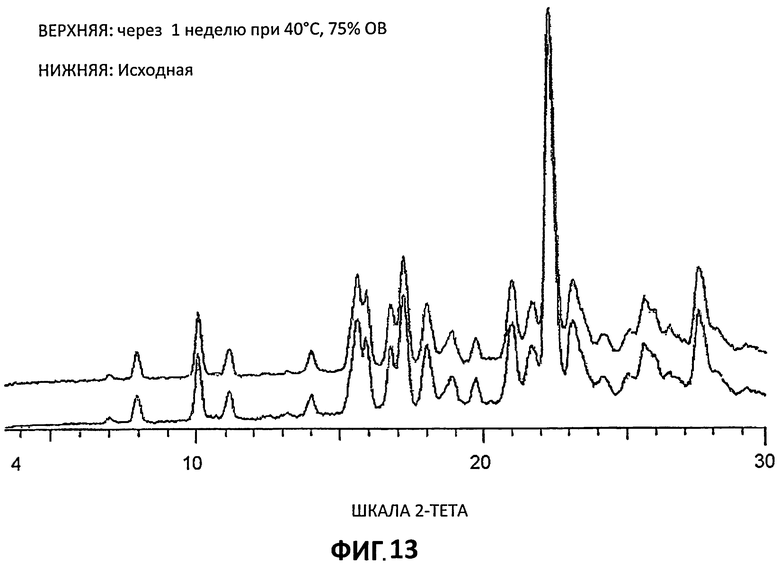
[0034] На Фиг.13 представлены порошковые дифрактограммы рентгеновской дифракции на порошке (РДП) для Партии 5 до и после хранения при 40°С и относительной влажности 75% в течение 1 недели.
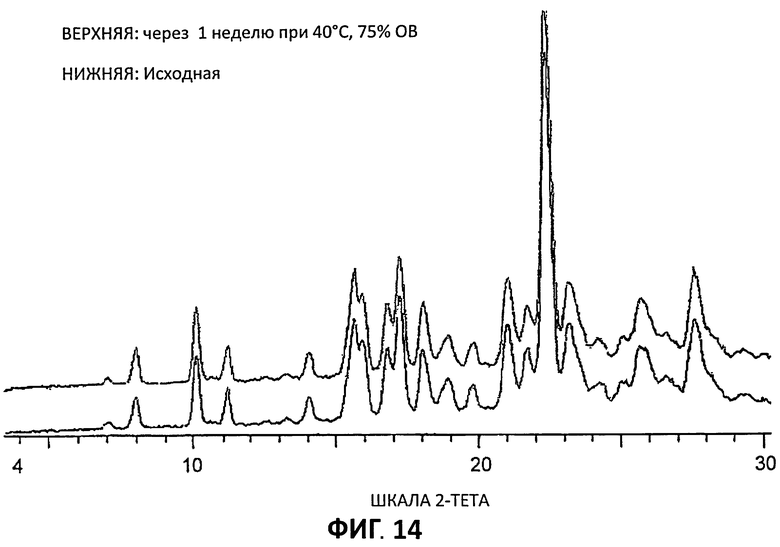
[0035] На Фиг.14 представлены порошковые дифрактограммы рентгеновской дифракции на порошке (РДП) для Партии 6 до и после хранения при 40°С и относительной влажности 75% в течение 1 недели.
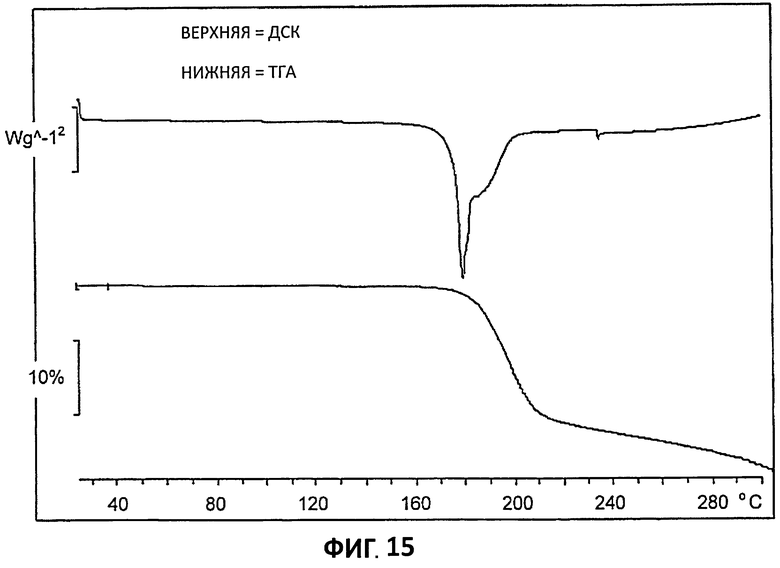
[0036] На Фиг.15 представлены данные дифференциальной сканирующей калориметрии (ДСК, верх) и термогравиметрического анализа (ТГА) для партии 4.
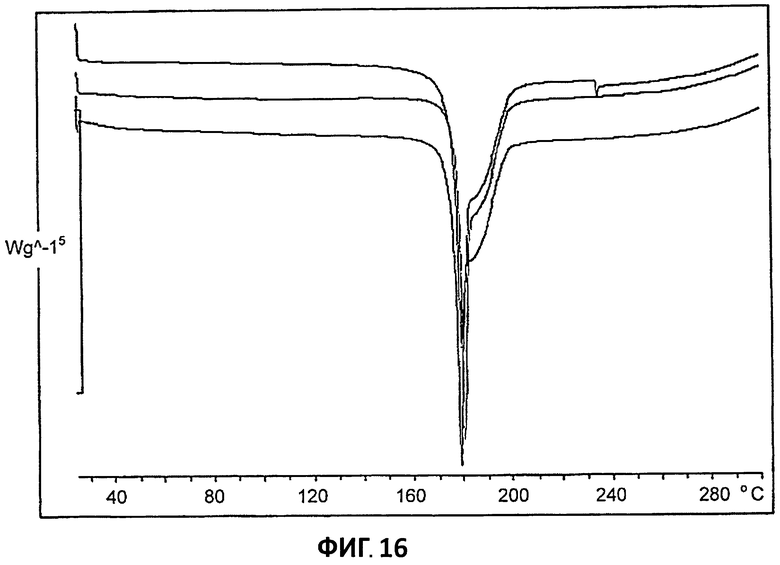
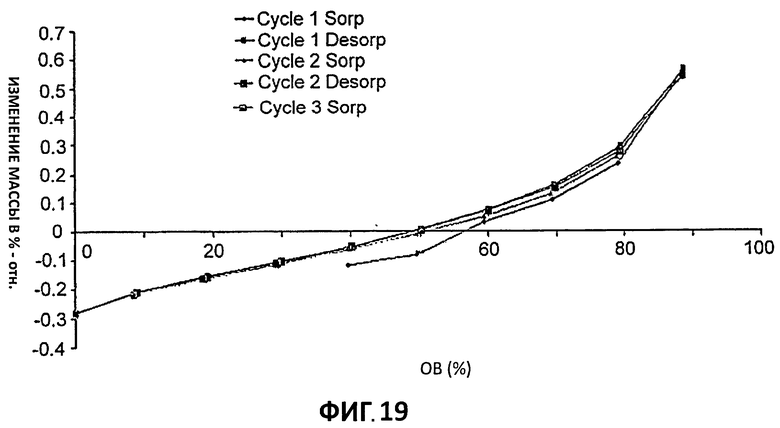
[0037] На Фиг.16 представлено наложение кривых ДСК для партий 4-6.
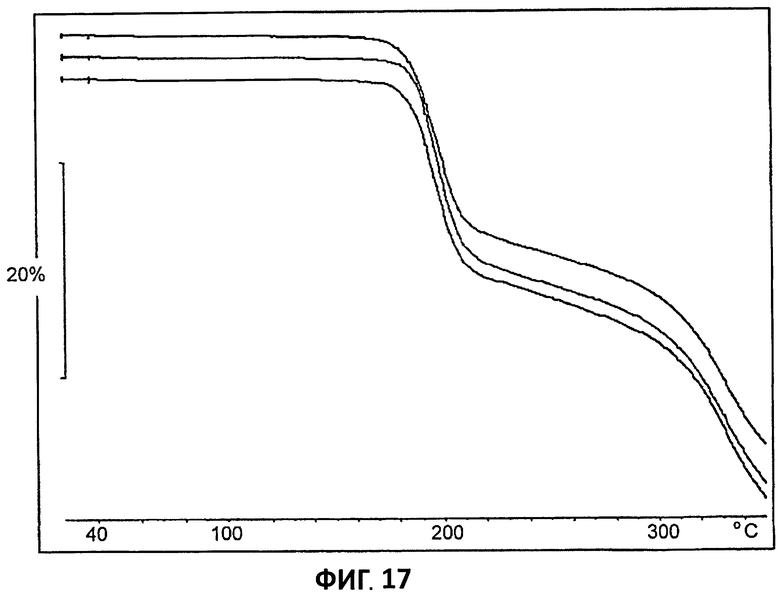
[0038] На Фиг.17 представлено наложение кривых ТГА для партий 4-6.
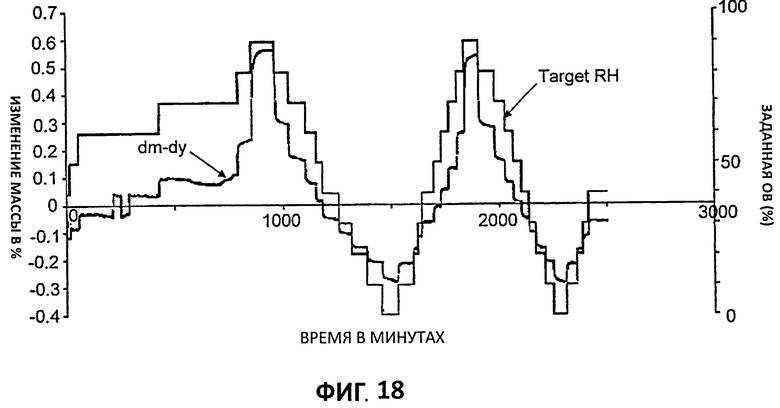
[0039] На Фиг.18 представлена кинетическая зависимость гравиметрической сорбции паров для партии 4.
[0040] На Фиг.19 представлена изотерма гравиметрической сорбции паров для партии 4.
[0041] На Фиг.20 представлены кривые рентгеновской порошковой дифракции для партии 4 до и после проведения эксперимента по гравиметрической сорбции паров.
[0042] На Фиг.21 представлены дифрактограммы рентгеновской дифракции на порошке для образцов в зависимости от растворимости.
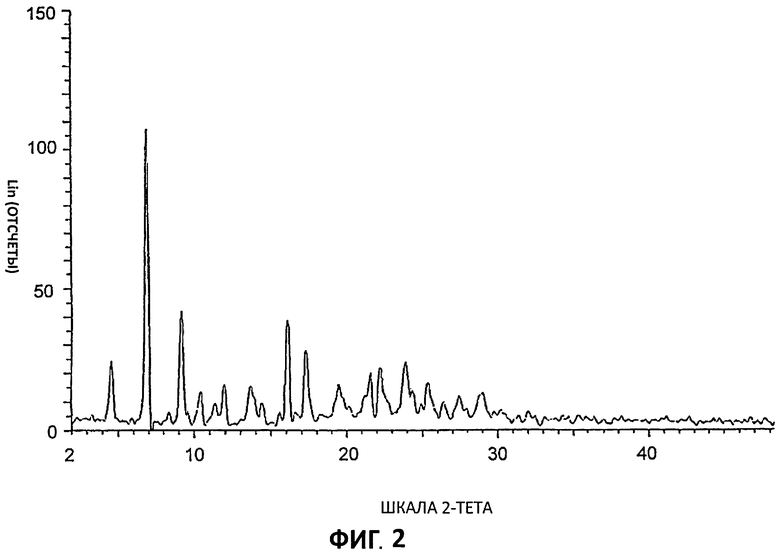
[0043] На Фиг.22 представлен 1Н ЯМР спектр для партии 4 в d6-ДМСО (диметилсульфоксиде).
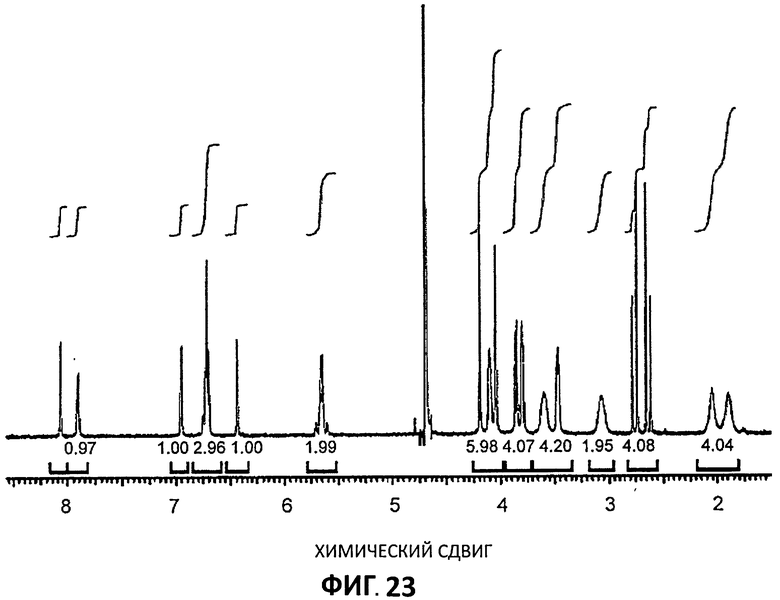
[0044] На Фиг.23 представлен 1Н ЯМР спектр для партии 4 в d6-D2O.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0045] Как указано выше, в настоящем изобретении обнаружено, что некоторые соли 9Е-15-(2-пирролидин-1-ил-этокси)-7,12,25-триокса-19,21,24-триазатетрацикло[18.3.1.1(2,5).1(14,18)]гексакоза-1(24),2,4,9,14,16,18(26),20,22-нонаена существуют в виде единственных устойчивых полиморфных форм. В частности, заявители обнаружили, что цитратная соль (лимоннокислая соль) этого соединения существует в виде единственной полиморфной формы.
[0046] Несмотря на то что структура лимонной кислоты считается очевидной для специалиста в данной области техники, во избежание неопределенности указанная структура приведена ниже.
Лимонная кислота
[0047] Приведенные в настоящей заявке сравнительные исследования в отношении гидрохлоридной и цитратной солей были выполнены на партиях, описанных в Таблице 1.
[0048]
[0049] Первоначальные исследования соединения 1 проводили с применением гидрохлоридной соли. Как обобщено ниже, было обнаружено, что первоначально полученная гидрохлоридная соль приводит к получению нестабильной твердой формы со значительной вариабельностью данных порошковой рентгеновской дифракции (XRPD).
[0050] Соединение I в виде гидрохлоридной соли было приготовлено в 3 разных растворителях с получением Партии 1 (приготовлена в ТГФ), Партии 2 (приготовлена в ацетонитриле) и Партии 3 (приготовлена в ацетоне) в виде кристаллических образцов. Фигуры 1, 2 и 3 демонстрируют значительные расхождения дифрактограмм XRPD для этих партий, что указывает на общую нестабильность кристаллической структуры этих гидрохлоридных солей даже при приготовлении в сходных условиях, но в разных растворителях.
[0051] В результате неприемлемой вариабельности, наблюдаемой для гидрохлоридной соли, как обсуждалось выше, потребовалась альтернативная устойчивая твердая форма.
Дополнительные исследования выявили, что цитратная соль является одной из таких устойчивых форм.
[0052] Были охарактеризованы пять партий 9Е-15-(2-пирролидин-1-ил-этокси)-7,12,25-триокса-19,21,24-триазатетрацикло[18.3.1.1(2,5). 1(14,18)]гексакоза-1(24),2,4,9,14,16,18(26),20,22-нонаена. Результаты анализа представлены в следующих Примерах.
[0053] Для получения характеристик цитратных солей применяли рентгеновскую дифракцию на порошке (XRPD). Список значимых пиков рентгеновской дифракции для цитратных солей согласно изобретению в условиях высокого разрешения включен в Таблицу 2.
[0054]
[0055] Как можно видеть, цитратную соль можно охарактеризовать как демонстрирующую пик рентгеновской дифракции при 22,4°±0,5° по шкале 2-тета.
[0056] Цитратную соль также можно охарактеризовать как демонстрирующую пики рентгеновской дифракции при 10,0°±0,5°, 15,6°±0,5°и 17,2°±0,5° по шкале 2-тета.
[0057] В некоторых вариантах реализации цитратную соль можно дополнительно охарактеризовать как демонстрирующую по меньшей мере четыре пика рентгеновской дифракции, выбранных из группы, состоящей из 7,9°±0,5°, 10,0°±0,5°, 15,6°±0,5°, 15,9°±0,5°, 16,8°±0,5°, 17,2°±0,5°, 21,1°±0,5° и 22,4°±0,5° по шкале 2-тета.
[0058] В некоторых вариантах реализации цитратную соль можно дополнительно охарактеризовать как демонстрирующую по меньшей мере 6 пиков рентгеновской дифракции, выбранных из группы, состоящей из 7,9°±0,5°, 10,0°±0,5°, 15,6°±0,5°, 15,9°±0,5°, 16,8°±0,5°, 17,2°±0,5°, 21,1°±0,5° и 22,4°±0,5° по шкале 2-тета.
[0059] В некоторых вариантах реализации цитратную соль можно дополнительно охарактеризовать, как демонстрирующую пики рентгеновской дифракции при 7,9°±0,5°, 10,0°±0,5°, 15,6°±0,5°, 15,9°±0,5°, 16,8°±0,5°, 17,2°±0,5°, 21,1°±0,5° и 22,4°±0,5° по шкале 2-тета.
[0060] В некоторых вариантах реализации цитратная соль также демонстрирует пики рентгеновской дифракции при 11,1°±0,5°, 18,1°±0,5°, 21,8°±0,5°, 23,2°±0,5° и 27,6°±0,5° по шкале 2-тета.
[0061] В некоторых вариантах реализации цитратную соль можно дополнительно охарактеризовать как демонстрирующую пики рентгеновской дифракции при 7,9°±0,5°, 10,0°±0,5°, 11,1°±0,5°, 15,6°±0,5°, 15,9°±0,5°, 16,8°±0,5°, 17,2°±0,5°, 18,1°±0,5°, 21,8°±0,5°, 21,1°±0,5°, 22,4°±0,5°, 23,2°±0,5° и 27,6°±0,5° по шкале 2-тета.
[0062] Несмотря на то, что обсуждавшиеся выше пики являются характеристическими пиками, цитратная соль также может демонстрировать пики рентгеновской дифракции при 7,0°±0,5°, 14,0°±0,5°, 19,0°±0,5°, 19,8°±0,5°, 23,6°±0,5°, 24,3°±0,5°, 25,2°±0,5°, 25,7°±0,5°, 26,1°±0,5° и 32,1°±0,5° по шкале 2-тета.
[0063] Как будет понятно специалисту в данной области техники, относительные интенсивности дифракции также могут зависеть от ряда факторов, таких как метод приготовления пробы и тип использованного прибора. Кроме того, в некоторых случаях некоторые из приведенных выше пиков могут не детектироваться.
[0064] Соли согласно настоящему изобретению можно получить в результате реакции свободного основания соединения 1 с лимонной кислотой в подходящем растворителе и извлечения из реакционной смеси полученной соли после кристаллизации, осаждения или выпаривания.
[0065] Реакцию с образованием соли можно провести в любом не мешающем растворителе или смеси растворителей, в которых свободное основание имеет подходящую растворимость. Примеры подходящих растворителей этого типа включают ацетонитрил, тетрагидрофуран и ацетон. Этот процесс обычно включает растворение свободного основания в подходящем растворителе при повышенной температуре, такой как температура выше 20°С. В некоторых вариантах реализации, например, в случае применения ацетона, свободное основание растворяют в растворителе при температуре около 56°С. В некоторых вариантах реализации, например, в случае применения ацетонитрила, свободное основание растворяют в этом растворителе при температуре около 82°С.
[0066] После того, как свободное основание растворили в подходящем растворителе, последующий процесс включает добавление подходящего количества кислоты. Обычно кислоту добавляют в виде раствора в подходящем растворителе, обычно в том же растворителе, который используют для растворения свободного основания. Количество кислоты может меняться, хотя обычно используют стехиометрически эквивалентное количество или небольшой стехиометрический избыток. После добавления кислоты процесс затем обычно включает перемешивание реакционной смеси при температуре добавления в течение 1 часа с последующим охлаждением реакционной смеси до температуры ниже температуры реакции для облегчения кристаллизации. После того, как достигнут желательный уровень образования кристаллов, кристаллы могут быть выделены путем фильтрования и высушены с применением способов, традиционно применяемых в данной области техники.
[0067] Согласно другому варианту реализации настоящего изобретения предложено применение солей согласно настоящему изобретению для лечения пролиферативного расстройства. Составы и методология применения соединений этого типа, а также расстройства, которые можно лечить таким образом, описаны в PCT/SG2006/000352.
[0068] Настоящее изобретение далее будет описано со ссылкой на следующие неограничивающие примеры. Гидрохлоридные соли готовили как обсуждалось выше для сравнительных примеров и анализировали аналогичным образом.
[0069] Пример 1 - Получение гидрохлоридной соли (Партия 1) в ТГФ в качестве растворителя:
[0070] Свободное основание Соединения 1 (0,200 г, 0,432 ммоль, 1 экв.) добавляли к 15 мл ТГФ. Раствор нагревали до кипения до того, как наблюдалось полное растворение, и поддерживали в течение 1 часа. Затем при кипячении с обратным холодильником медленно добавляли 1н. HCl (0,518 мл, 0,518 ммоль, 1,2 экв.). Смесь кипятили с обратным холодильником еще 15 мин, затем охлаждали. При постепенном охлаждении наблюдали кристаллизацию. Кристаллы перемешивали при комнатной температуре в течение 12 часов и фильтровали под вакуумом. Продукт сушили под вакуумом, получив 165 мг продукта.
[0071] Пример 2: Получение гидрохлоридной соли (Партия 1) в CH3CN в качестве растворителя:
[0072] Свободное основание Соединения 1 (0,300 г, 0,648 ммоля, 1 эквивалент) добавляли к 70 мл CH3CN. Раствор нагревали до кипения до того, как наблюдалось полное растворение, и поддерживали в течение 1 часа. Затем при кипячении с обратным холодильником медленно добавляли 1н. HCl (0,778 мл, 0,778 ммоль, 1,2 экв.). Смесь кипятили с обратным холодильником еще 15 мин, затем охлаждали. При постепенном охлаждении наблюдали кристаллизацию. Кристаллы перемешивали при комнатной температуре в течение 12 часов и фильтровали под вакуумом. Продукт сушили под вакуумом, получив 190 мг продукта.
[0073] Пример 3: Получение гидрохлоридной соли (Партия 3) в ацетоне в качестве растворителя:
[0074] Свободное основание Соединения 1 (0,200 г, 0,432 ммоль, 1 экв.) добавляли к 50 мл ацетона. Раствор нагревали до кипения до того, как наблюдалось полное растворение, и поддерживали в течение 1 часа. Затем при кипячении с обратным холодильником медленно добавляли 1н. HCl (0,518 мл, 0,518 ммоль, 1,2 эквивалента). Смесь кипятили с обратным холодильником еще 15 мин, затем охлаждали. При постепенном охлаждении наблюдали кристаллизацию. Кристаллы перемешивали при комнатной температуре в течение 12 часов и фильтровали под вакуумом. Продукт сушили под вакуумом, получив 180 мг продукта.
[0075] Пример 4: Получение цитратной соли (Партия 4) в ТГФ в качестве растворителя:
[0076] Свободное основание Соединения 1 (0,300 г, 0,648 ммоль, 1 экв.) добавляли к 12 мл ТГФ. Раствор нагревали до кипения до того, как наблюдалось полное растворение, и поддерживали в течение 1 часа. Затем при кипячении с обратным холодильником медленно добавляли раствор лимонной кислоты (0,149 г, 0,778 ммоль, 1,2экв.), растворенный в 12 мл ТГФ. Смесь кипятили с обратным холодильником еще 15 мин, затем охлаждали. При постепенном охлаждении наблюдали кристаллизацию. Кристаллы перемешивали при комнатной температуре в течение 12 часов и фильтровали под вакуумом. Продукт сушили под вакуумом, получив 250 мг продукта.
[0077] Пример 5: Получение цитратной соли (Партия 5) в CH3CN в качестве растворителя:
[0078] Свободное основание Соединения 1 (0,200 г, 0,432 ммоль, 1 экв.) добавляли к 45 мл CH3CN. Раствор нагревали до кипения до того, как наблюдалось полное растворение, и поддерживали в течение 1 часа. Затем при кипячении с обратным холодильником медленно добавляли раствор лимонной кислоты (0,099 г, 0,518 ммоль, 1,2 экв.), растворенный в 12 мл ацетонитрила. Смесь кипятили с обратным холодильником еще 15 мин, затем охлаждали. При постепенном охлаждении наблюдали кристаллизацию. Кристаллы перемешивали при комнатной температуре в течение 12 часов и фильтровали под вакуумом. Продукт сушили под вакуумом, получив 220 мг продукта.
[0079] Пример 6: Получение цитратной соли (Партия 6) в ацетоне в качестве растворителя:
[0080] Свободное основание Соединения 1 (0,200 г, 0,432 ммоль, 1 экв.) добавляли к 50 мл ацетона. Раствор нагревали до кипения до того, как наблюдалось полное растворение, и поддерживали в течение 1 часа. Затем при кипячении добавляли с обратным холодильником медленно раствор лимонной кислоты (0,099 г, 0,518 ммоль, 1,2 экв.), растворенный в 20 мл ацетона. Смесь дополнительно кипятили 15 мин, затем охлаждали. При постепенном охлаждении наблюдали кристаллизацию. Кристаллы перемешивали при комнатной температуре в течение 12 часов и фильтровали под вакуумом. Продукт сушили под вакуумом, получив 198 мг продукта.
[0081] Пример 7 - Исследования порошковой рентгеновской дифракции
[0082] Условия 1а (Высокое Разрешение)
[0083] Дифрактограммы порошковой рентгеновской дифракции (XRPD) снимали на дифрактометре aSIEMENS D5000 с использованием излучения Cu К (1,54 А), 40 кВ, режим непрерывного сканирования 30 с размером шага 0,03° и временем шага - 0,5 с, был θ-θ мА. Использовали диапазон θ с расстоянием образец - детектор, который дает эффективные 22-50°. Время анализа образца (может быть подвергнут действию пучка рентгеновских лучей) составляло 13 минут и 33 секунд. Для сбора данных использовали программу DIFFRACplus-D5000 #1, а данные анализировали и представляли с применением diffrac-Plus-D5000 #1.
[0084] Образцы, обрабатываемые в условиях окружающей атмосферы, готовили в виде плоских пластинок, используя порошок, приготовленный без измельчения. Приблизительно 100-200 мг образца несильно прессовали на стеклянной пластинке с получением плоской поверхности.
[0085] Условия 1b (Высокое Разрешение)
[0086] Дифрактограммы рентгеновской порошковой дифракции (XRPD) снимали на дифрактометре Bruker AXS С2 GADDS с использованием излучения Cu К (40 кВ, 40 мА), автоматизированной стадии XYZ, лазерного видеомикроскопа для автоматического позиционирования и 2-размерного детектора площади HiStar. Рентгеновская оптика состоит из одного многослойного детектора Gobel, соединенного с точечным коллиматором 0,3 мм. Расхождение пучка, т.е. эффективный размер рентгеновского пучка на пробе, составляло приблизительно 4 мм. θ-θ непрерывный режим сканирования применяли с расстоянием образец - детектор 20 см, которое дает эффективный диапазон 2θ 3,2°-29,7°. Обычно пробу можно было бы подвергнуть действию пучка рентгеновских лучей в течение 120 секунд. Для сбора данных использовали программу GADDS для WNT 4.1.16, а данные анализировали и представляли с использованием Diffrac Plus EVA v 9.0.0.2 или v 13.0.0.2. Пробы, работающие в условиях окружающей среды, готовили в виде экземпляров плоских пластинок, используя порошок, приготовленный без измельчения. Приблизительно 1-2 мг пробы немного прессовали на стекле с получением плоской поверхности.
[0087] Условия 2 (низкое разрешение)
[0088] Образцы рентгеновской порошковой дифракции также снимали на дифрактометре Bruker D8, используя Cu К излучение (40 кВ, 40 мА), θ-θ гониометр и расхождение V4 и приемные щели, Ge монохроматор и детектор Lynxeye. Прибор имеет эффективность, проверенную с помощью сертифицированного эталона Corundum (NIST 1976). Для сбора использовали программу Diffrac Plus XRD Commander V2.5.0, данные анализировали, используя Diffrac Plus EVA v13.0.0.2. Образцы обрабатывали в условиях окружающей среды в виде плоских пластинок, используя порошки в том виде, как они были получены. Приблизительно 15 мг образца осторожно утрамбовывали в полость, вырезанную в полированной силиконовой подложке (510), принятой за нулевой уровень фона. Во время анализа образец вращали в его плоскости. Данные получали при:
* Диапазоне значений углов: θ-θ 2-42 2 θ
* Величине шага: 0,05 2 θ
* Времени получения данных: 0,5 с на шаг -1
[0089] Дифрактограммы XRPD высокого разрешения (Условия 1а) получали для каждого из образцов, а результаты, представленные на Фиг.4-8, показывают, что все пять образцов цитратной соли являются одинаковой кристаллической фазой. Данные для Партий 4-6 также получали в Условиях 1b, и на Фиг.9 представлено наложение, показывающее, что образцы очень похожи, что также характеризует все образцы как имеющие одинаковую кристаллическую фазу.
[0090] Дифрактограммы XRPD низкого разрешения (Условия 2) также получали, используя дифрактометр Bruker GADDS, так что сравнительные образцы были доступны для скринингового анализа полиморфизма. Наложение кривых Партий 4-6 представлены на Фиг.10, а сравнение кривых высокого и низкого разрешения для Партии 4 представлено на Фиг.11.
[0091] Образцы, приготовленные для получения дифрактограмм XRPD, помещали в камеру, в которой поддерживали 40°С и 75% относительной влажности. Через одну неделю образцы анализировали повторно с помощью XRPD низкого разрешения (Условия 2) для проверки фазовых изменений. Результаты по сравнению с первоначальным XRPD показываются на Фиг.12-14. Можно видеть, что фазовых изменений не произошло и что цитратные соли согласно изобретению стабильны в течение по меньшей мере одной недели в этих условиях.
[0092] Пример 8 - Исследования методом ядерного магнитного резонанса (ЯМР)
[0093] Спектры 1Н ЯМР снимали на приборе Bruker 400MHz, снабженном автосамплером и контролируемом пультом DRX400. Автоматизированные эксперименты проводили с использованием ICON-NMR v.4.04 (конструкция 1), работающим с Topspin v 1.3 (уровень участка 8), используя стандартные загруженные эксперименты Bruker. Образцы готовили в b6-ДМСО и D2O. Оффлайн анализ выполняли с использованием ACD SpecManager v 9.09 (конструкция 7703).
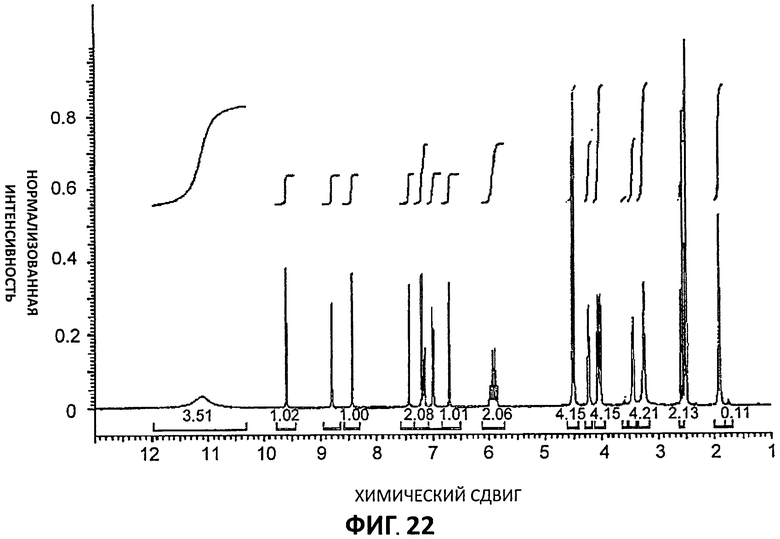
[0094] Спектры 1Н-ЯМР показали, что все три образца являются одним и тем же соединение. Определение стехиометрии цитратной соли проводили путем интегрирования сигналов противоиона. Однако в спектре они оказываются под сигналом ДМСО (Партия 4, Фиг.22) и в результате интегрирование сигналов лимонной кислоты не могло быть проведено. Фиг.23 представляет 1Н-ЯМР Партии 4 в D2O. В этом растворителе интегрирование сигнала лимонной кислоты показало, как и ожидалось, стехиометрию, равную 1:1.
[0095] Пример 9 - Дифференциальная сканирующая калориметрия (ДСК) и термогравиметрический анализ (ТГА)
[0096] Данные дифференциальной сканирующей калориметрии (ДСК) получали на приборе Mettler DSC 823е, снабженном автосамплером на 34 позиции. Прибор калибровали по энергии и температуре, используя сертифицированный индий. Обычно 0,5-3 мг каждого образца в перфорированной алюминиевой чашке нагревали со скоростью 10°С/мин от 25°С до 350°С. Пространство над образцом продували азотом со скоростью 50 мл/мин. Для регулирования прибора и анализа данных использовали программу STARe v9.10.
[0097] Данные термогравиметрического анализа (ТГА) получали на приборе Mettler TGA/SDTA 851е, снабженном автосамплером на 34 позиции. Прибор был откалиброван по температуре с использованием сертифицированного индия. Обычно 5-30 мг каждого образца загружали в предварительно взвешенный алюминиевый тигель и нагревали со скоростью 10°С/мин от температуры окружающей среды до 350°С.Пространство над образцом продували азотом со скоростью 50 мл/мин. Для регулирования прибора и анализа данных использовали программу STARe v9.10.
[0098] Кривая ДСК для Партии 4 (Фиг.15) показывает, что имеет место значительное термическое событие при 176°С. Соответствующая потеря массы на - 20%, видна на ТГА (Фиг.15). Эта потеря массы вместе с сложным профилем эндотермы ДСК указывает, что при >176°С происходит интенсивное разложение. Не желая быть ограниченным теорией, полагают, что это может указывать на диссоциацию соли и последующее разложение лимонной кислоты.
[0099] Партии 5 и 6 демонстрируют сходные кривые ДСК и ТГА (на Фиг.16 и 17 представлено наложение данных ДСК и ТГА, соответственно).
[0100] Пример 10 - Гравиметрическая сорбция паров (ГСП)
[0101] Изотермы сорбции получали, используя анализатор сорбции влаги SMS DVS Intrinisic, регулируемый программой Analysis Suite. Температуру образца поддерживали при 25°С с помощью средств регулирования прибора. Влажность регулировали путем смешивания потоков сухого и влажного азота с общей скоростью потока 200 мл/мин. Относительную влажность измеряли с помощью зонда Rotronic (динамический диапазон 1,0-100% ОВ (относительной влажности), размещенного около образца. Изменение массы (уменьшение массы) образца как функцию %ОВ постоянно контролировали с помощью микровесов (точность ±0,005 мг). Обычно 5-20 мг образца помещали во взвешенную сетчатую корзинку из нержавеющей стали в условиях окружающей среды. Образец загружали и выгружали при 40% ОВ и 25°С (обычные комнатные условия). Изотерму сорбции влаги получали, как описано ниже (2 скана дают 1 полный цикл). Стандартную изотерму получали при 25°С при 10% ОВ интервалах в диапазоне 0,5-90% ОВ.
[0102]
[0103] Гигроскопичность цитратной соли исследовали, проводя эксперимент по гравиметрической сорбции паров на Партии 4. Образец около 20 мг выдерживали при 25°С, пока влажность ее окружения изменялась через два полных цикла. Кинетическая зависимость, показанная на Фиг.18, указывает, что образец Партии 4 достигает равновесного веса на каждом шаге % ОВ. Установление равновесия требует больше времени на ранних стадиях эксперимента. Это может быть обусловлено удалением остаточного растворителя.
[0104] Изотерма, приведенная на Фиг.19, показывает, что образец принимает <0,6% воды между 40% ОВ и 90% ОВ. Максимальная разность массы (между 0% ОВ и 90% ОВ) меньше 1% масс./масс., указывает, что цитратная соль не гигроскопична. Кроме того, нет доказательств существования гидратированной формы цитрата.
[0105]
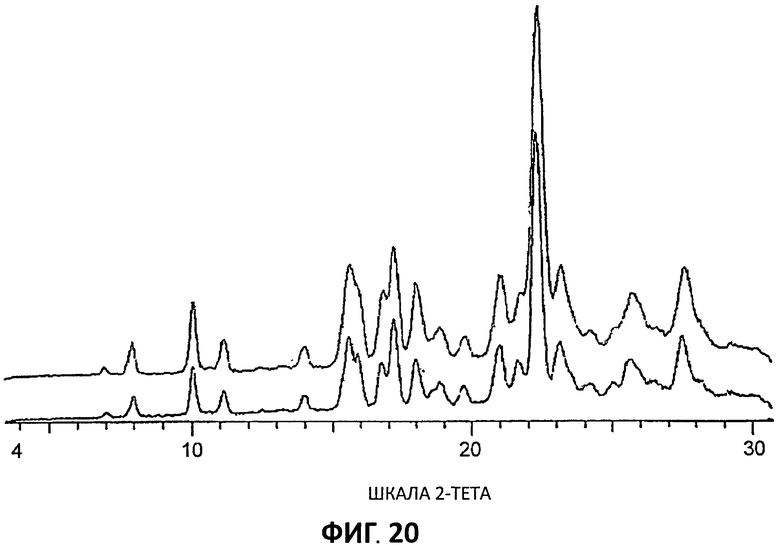
[0106] В конце эксперимента ГСП образец извлекали и анализировали методом XRPD для проверки любого общего фазового изменения. Результаты (Фиг.20) показывают, что общего фазового изменения нет.
[0107] Пример 11 - Определение химической чистоты методом высокоэффективной жидкостной хроматографии (ВЭЖХ)
[0108] Анализ чистоты выполняли на системе серии Agilent НР1100, оборудованной диодным матричным детектором с использованием программы ChemStation SR1. Использованные параметры обобщены в Таблице 5.
[0108]
Параметры метода ВЭЖХ для определений химической чистоты
[0110] Химическую чистоту Партий 4-6 цитратной соли определяли методом ВЭЖХ. Численные значения представлены в Табл. 6.
[0111]
0112] Как можно видеть, измеренная чистота каждого образца больше 98,1%.
[0113] Пример 12 - Оценка растворимости и полиморфизма
[0114] Для каждого исследованного растворителя около 8 мг соединения 1 взвешивали в стеклянном флаконе на 8 мл с завинчивающейся крышкой. Растворитель добавляли в 10 аликвот и смесь обрабатывали ультразвуком и нагревали (с помощью пистолета горячего воздуха), чтобы способствовать растворению. Если растворение не было достигнуто после добавления 100 объемов растворителя, то дополнительно добавляли 100 объемов. Подробности каждого эксперимента и наблюдения (Таблица 7) показывают, что полное растворение достигалось только в воде.
[0115]
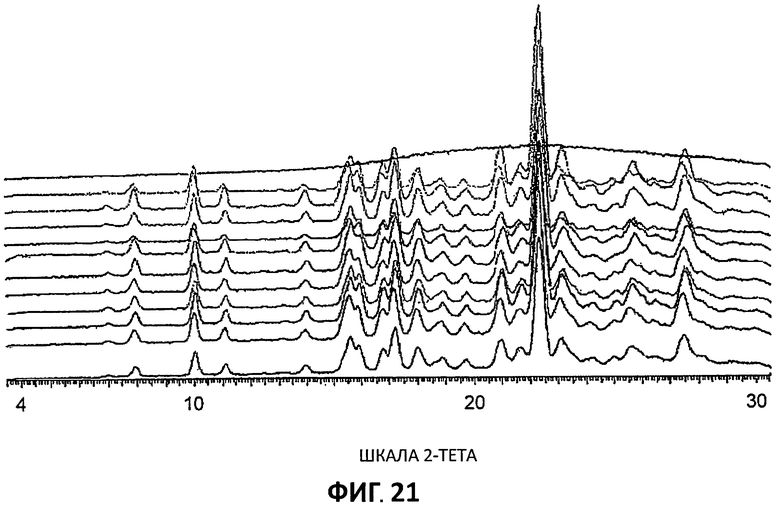
[0116] Затем флаконы помещали в увлажнительную камеру и подвергали циклам 25°С/50°С (циклы по 8 часов) в течение 24 часов. В конце этого времени образцы осматривали и затем открывали ослабленные крышки, чтобы обеспечить испарение растворителя. Высушенные образцы затем переносили в кварцевую матрицу, при этом те, в которых еще присутствовал растворитель, фильтровали под вакуумом до агломерата. Затем образцы анализировали методом XRPD для оценки их кристаллического состояния и формы. Результаты XRPD анализа (Фиг.21) показывают, что (с водой как единственным исключением) все образцы были в Форме 1. Образец, полученный из водного раствора, был аморфным (Фиг.21, верхняя линия не показывает выраженных пиков).
[0117] Было доказано, что растворимость цитратной соли соединения 1 в органических растворителях чрезвычайно ограничена. Отсутствие окрашивания в растворителе при контакте с желтыми кристаллами указывает, что растворимость была минимальной. Все кристаллические остатки из органического растворителя по данным скрининга образцов были в Форме 1. Было установлено, что цитратная соль растворяется в воде на уровне 100 мг/мл. Было установлено, что твердое вещество, полученное испарением растворителя, является аморфным. Скрининг растворимости не выявил существование каких-либо сольватов или полиморфных модификаций цитратных солей.
[0118] Результаты Примеров 1-12 обобщены в таблице ниже.
[0119]
-20% масс./масс., от 160 до 250°С
-21% масс./масс., от 160 до 250°С
-20% масс./масс., от 160 до 250°С
Начало при 176°С
Начало при 178°С
Начало при 176°С
[0120] Подробное описание конкретных вариантов реализации, описанных для настоящего изобретения, не следует толковать как ограничивающее. Возможны различные эквиваленты и модификации изобретения, не выходящие за рамки настоящего изобретения, при этом очевидно, что такие эквивалентные варианты реализации являются частью настоящего изобретения.
Изобретение относится к кристаллическому цитрату 9Е-15-(2-пирролидин-1-ил-этокси)-7,12,25-триокса-19,21,24-триазатетрацикло[18.3.1.1(2,5).1(14,18)]гексакоза-1(24),2,4,9,14,16,18(26),20,22-нонаена (Соединение I), фармацевтической композиции на его основе, способу лечения с его использованием и его применению для лечения пролиферативных заболеваний. Соединение I существует в единственной полиморфной форме и имеет улучшенные свойства стабильности, является негигроскопичным и не растворяется в органических растворителях. 5 н. и 10 з.п. ф-лы, 8 табл., 23 ил., 12 пр.

1. Кристаллический цитрат 9Е-15-(2-пирролидин-1-ил-этокси)-7,12,25-триокса-19,21,24-триазатетрацикло[18.3.1.1(2,5).1(14,18)]гексакоза-1(24),2,4,9,14,16,18(26),20,22-нонаена, характеризующийся пиком рентгеновской дифракции при 22,4°±0,5° по шкале 2-тета.
2. Цитрат по п. 1, отличающийся тем, что указанная соль представляет собой соль 1:1.
3. Цитрат по п. 1, также характеризующийся пиками рентгеновской дифракции при 10,0°±0,5°, 15,6°±0,5°, 17,2°±0,5° по шкале 2-тета.
4. Цитрат по любому из пп. 1-3, характеризующийся по меньшей мере четырьмя пиками рентгеновской дифракции, выбранными из группы, состоящей из 7,9°±0,5°, 10,0°±0,5°, 15,6°±0,5°, 15,9°±0,5°, 16,8°±0,5°, 17,2°±0,5°, 21,1°±0,5 и 22,4°±0,5°по шкале 2-тета.
5. Цитрат по п. 3, характеризующийся по меньшей мере 6 пиками рентгеновской дифракции, выбранными из группы, состоящей из 7,9°±0,5°, 10,0°±0,5°, 15,6°±0,5°, 15,9°±0,5°, 16,8°±0,5°, 17,2°±0,5°, 21,1°±0,5° и 22,4°±0,5° по шкале 2-тета.
6. Цитрат по п. 4, характеризующийся пиками рентгеновской дифракции при 7,9°±0,5°, 10,0°±0,5°, 15,6°±0,5°, 15,9°±0,5°, 16,8°±0,5°, 17,2°±0,5°, 21,1°±0,5° и 22,4°±0,5° по шкале 2-тета.
7. Цитрат по п. 6, также характеризующийся пиками рентгеновской дифракции при 11,1°±0,5°, 18,1°±0,5°, 21,8°±0,5°, 23,2°±0,5° и 27,6°±0,5° по шкале 2-тета.
8. Цитрат по п. 7, также характеризующийся пиками рентгеновской дифракции при 7,0°±0,5°, 14,0°±0,5°, 19,0°±0,5°, 19,8°±0,5°, 23,6°±0,5°, 24,3°±0,5°, 25,2°±0,5°, 25,7°±0,5°, 26,1°±0,5°, 26,5°±0,5° и 32,1°±0,5° по шкале 2-тета.
9. Фармацевтическая композиция, обладающая антипролиферативными свойствами, содержащая цитрат по любому из пп. 1-8.
10. Способ лечения или предотвращения пролиферативного расстройства, включающий введение нуждающемуся в этом пациенту терапевтически эффективного количества цитрата по любому из пп. 1-8.
11. Способ по п. 10, отличающийся тем, что пролиферативное расстройство представляет собой рак.
12. Применение цитрата по любому из пп. 1-8 для лечения пролиферативного расстройства.
13. Применение по п. 12, отличающееся тем, что пролиферативное расстройство представляет собой рак.
14. Применение цитрата по любому из пп. 1-8 для получения лекарственного средства для лечения пролиферативного расстройства.
15. Применение по п. 14, отличающееся тем, что пролиферативное расстройство представляет собой рак.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| ПРОИЗВОДНЫЕ ТЕТРАГИДРОПИРАНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1994 |
|
RU2130460C1 |
Авторы
Даты
2015-03-10—Публикация
2010-07-14—Подача