Изобретение относится к химико-фармацевтической промышленности и касается способа получения высокоочищенного лекарственного средства для лечения дегенеративно-дистрофических заболеваний периферических синовиальных суставов и позвоночника.
Дегенеративные заболевания периферических синовиальных суставов (остеоартрозы) и позвоночника (межпозвонковый остеохондроз, спондилоз, спондилоартроз) составляют более 75% всех заболеваний костно-мышечной системы [1, 2, 3, 4].
По данным Всемирной организации здравоохранения, остеохондрозом позвоночника страдает от 30 до 87% наиболее трудоспособного населения в возрасте от 30 до 60 лет. На долю остеохондроза позвоночника приходится от 20 до 80% случаев временной нетрудоспособности населения [4, 5]. Дегенеративно-дистрофическими поражениями периферических суставов в России страдают около 15 млн. человек, что составляет 10-12% населения, причем, по данным официальной статистики РФ, распространенность этого заболевания за последние годы возросла на 35% [1]. Высокая распространенность дегенеративных заболеваний суставов и позвоночника имеет огромное социально-экономическое значение, так как эти заболевания характеризуются большой частотой развития инвалидности, а также связанным с этим снижением качества жизни пациентов.
В связи с этим, создание качественных, эффективных и безопасных лекарственных средств, претендующих называться «структурно-модифицирующими препаратами» - одна из важных задач современной отечественной фармацевтики. В мире проводятся многоплановые исследования по разработке эффективных средств для лечения и реабилитации больных с дегенеративно-дистрофическими заболеваниями опорно-двигательного аппарата, усовершенствованию методологий промышленного производства препаратов данного ряда с целью улучшения качества продукции и др.
В 2003 г. EULAR (Европейская антиревматическая лига) опубликовала рекомендации по лечению остеоартритов суставов, в которые была включена группа хондропротекторов, называемых препаратами замедленного действия (SYSADOA - symptomatic slow acting drugs for osteoarthritis) [6]. В России хондропротективные препараты также применяют для лечения воспалительных и дегенеративных заболеваний суставов и позвоночника, наряду с нестероидными противовоспалительными препаратами и глюкокортикоидами [7-11].
Любые хондропротекторы, которые применяют для лечения заболеваний опорно-двигательного аппарата, производят из вытяжек хрящевой ткани разных животных: крупного рогатого скота (КРС), свиней, куриных, акульих хрящей, хрящей других гидробионтов методами, представляющими собой многостадийные процессы гидролиза, экстракции, осаждения, высушивания.
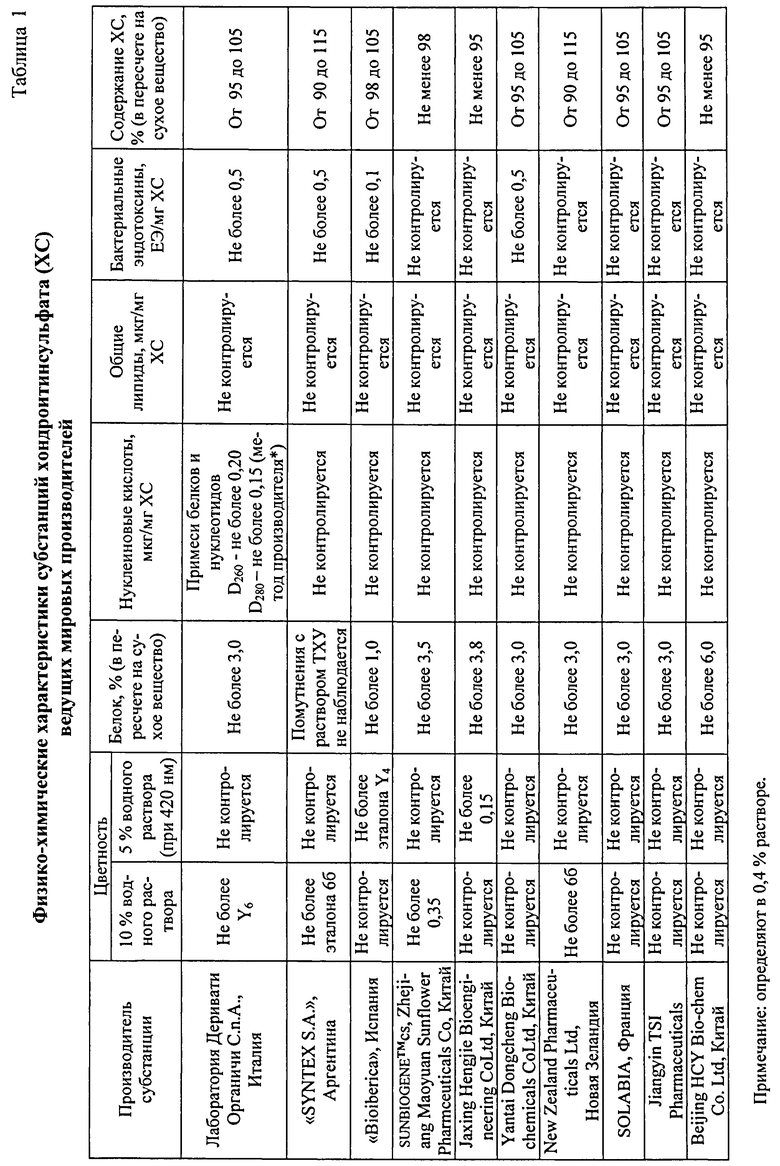
Вариабельность технологий разных производителей хондропротективных препаратов приводит к значительным различиям состава продукта, количественного содержания основного вещества, содержания примесей, эффективности и безопасности конечного продукта [12-16]. У производителей могут меняться последовательность и количество операций, концентрации используемых реагентов, фермент-субстратные соотношения, температурные режимы и др. [17-21]. Согласно НД разных производителей, в субстанциях допускается высокое содержание животного белка (до 6% в пересчете на сухое вещество), бактериальных эндотоксинов (до 0,5 ЕЭ/мг), примесей белков и нуклеотидов (только один производитель «Лаборатория Деривати Органичи C.n.A.» (Италия) регламентирует их количественное содержание по показателям оптической плотности, перерасчет которых спектрофотометрическим методом позволяет получить показатель 0,678 мкг данных примесей на 1 мг основного вещества ХС), остаточное содержание липидов в субстанциях и готовом продукте никем не контролируется (Таблица 1). Вал субстанций разного качества привел к тому, что хондропротективные препараты содержат много примесей, которые не всегда контролируются, но могут оказывать побочное действие в виде аллергических и анафилактических реакций [22, 23]. Нестандартность качества используемых субстанций хондроитин сульфата (ХС) приводит к необходимости гармонизации их качества в соответствии с требованиями зарубежных фармакопей (монографии на хондроитинсульфат включены в ведущие зарубежные фармакопеи) [24-26].
При проведении поиска высококачественного препарата ХС, отвечающего критериям, предъявляемым для лекарственных средств, и планируемого для использования в крупном рандомизированном контролируемом испытании GAIT, были проанализированы 20 коммерческих препаратов ХС [23, 27, 34]. При оценке качества и безопасности продуктов было установлено, что ассортиментный ряд продукции характеризовался нестандартностью по ряду показателей: чистоте препарата, содержанию активного вещества, наличию примесей белковой и липидной природы, микроэлементов, бактериальных эндотоксинов [23].
На основании сравнительного анализа однокомпонентных и комбинированных хондропротективных препаратов отечественного и зарубежного производства, представленных на фармацевтическом рынке страны (Мукосат (ГУ «Государственный институт кровезаменителей и медицинских препаратов», ОАО «Синтез», Россия), Румалон («Робафарм», Швейцария), Хондрогард («Сотекс», Россия), Артепарон («Луитпольд Верк», Германия), Мукартрин («Фармхимия», Болгария) и др., установлено, что производители лекарственных хондропротективных препаратов при изготовлении продукции не предусматривают в технологиях доочистку полупродуктов от примесей, вводят в состав препаратов различные химические вещества антибактериального действия - противомикробные консерванты в виде органических спиртов, кислот, фенола и его производных, металлоорганических и неорганических соединений и др. [28-31]. Известно, что в связи с увеличением частоты побочных реакций, регистрация некоторых ЛС, которые ранее считались «хондропротективными», была аннулирована. Так, в 1997 г. перестал применяться препарат Артепарон (Мукартрин), в 2000 г. прекращено использование препарата Румалон (гликозоаминогликан-пептидный комплекс). Причиной повсеместного прекращения использования этих инъекционных препаратов стали частые аллергические и анафилактические реакции, геморрагические осложнения вследствие их гепариноподобной структуры, болезненность инъекций и др. [23, 28, 30, 32-34]. В экспериментах на животных было показано, что препарат Артепарон в лечебных дозах обостряет течение экспериментального воспаления.
В связи с вышеизложенным, разработка технологии получения качественного высокоочищенного хондропротективного препарата, обладающего значительным потенциалом структурной модификации при дегенеративно-дистрофических заболеваниях опорно-двигательного аппарата, является актуальной задачей химико-фармацевтической промышленности.
Известно, что чаще всего технологии получения ХС включают стадии растворения хряща в щелочной среде, щелочного или ферментативного гидролиза, осаждения полисахаридных комплексов и высушивания полученного продукта [21, 35-43]. Получаемые методом щелочного и ферментативного гидролиза продукты нестандартны по составу, содержат балластные вещества и примеси различной природы [21]. Кроме того, существующие основные технологии получения ХС, предусматривающие переработку сырья методами щелочного и ферментативного гидролиза, несут следующие угрозы:
1. Повышенной цветности, которую удаляют не совсем безопасными способами за счет использования окислителей перекиси водорода или перманганата калия. Использование перекиси водорода [44] или насыщенного раствора перманганата калия [37, 45] приводит к дополнительным проблемам в виде появления продуктов перекисного окисления или остаточного содержания солей марганца (коагуляцию диоксида марганца осуществляют добавлением небезопасных реагентов - формальдегида или метанола) [46].
2. Пирогенности, для удаления которой используются заряженные модифицированные мембраны, имеющие положительный дзета-потенциал. Для инъекционного, в т.ч. внутрисуставного введения, требуются не стандартные 10% растворы ХС для подкожного, внутримышечного, внутривенного введения, а 15-25% растворы для внутрисуставного введения, к которым предъявляются более жесткие требования в отношении содержания эндотоксинов (менее 0,05 ЕЭ/мг основного вещества ХС). В связи с этим, для удаления пирогенов предлагается проведение пятиступенчатой фильтрации через мембраны Posidyne® производства Pall Corporation [16]. Использование других методов депирогенизации, в т.ч. фосфата кальция, не нашло практического применения для снижения уровня бактериальных эндотоксинов [47].
3. Высокого содержания липидов, которые приводят к увеличению частоты побочных реакций и нестабильности продукта в процессе хранения. Часть исследователей обращают внимание на возможность снижения липидов в субстанции ХС при использовании высоких температур с последующей обработкой перманганатом калия и активированным углем. Но при этом происходит довольно незначительное снижение содержания липидов (с 6-8% до 2-3%) [37]. Есть способ обезжиривания ХС ацетоном, который относится к 3 классу растворителей [48], но его содержание ограничивается требованиями контролирующих организаций, в частности Food and Drug Administration (FDA) [49].
Использование высоких концентраций щелочи и воздействие температуры приводят к N-деацетилированию ХС, повышению цветности, частичной потере биологической активности за счет деструкции полимерных цепей ХС [38].
Для решения вышеизложенных проблем предлагаются различные способы доочистки водных растворов субстанций от примесей различной природы.
Известен способ извлечения ХС из акульих хрящей, в технологии которого удаление примесей осуществляется методом колоночной хроматографии [39]. Данный способ доочистки гидролизованного продукта с использованием ионного обмена достаточно эффективен, но недостатком является дороговизна, длительность элюирования, уменьшение концентрации выходящих растворов, трудности при промышленном масштабировании. Помимо этого, известно, что колоночная хроматография обычно служит для первичного фракционирования, поскольку с ее помощью удается выделить только относительно узкие фракции, содержащие несколько соединений.
Также известен способ очистки хондроитинсульфат натрия (ХСН) с использованием хроматографического разделения водного раствора ХСН через крупносетчатые сильнокислотные катионообменные смолы [40]. Данный метод позволяет достигнуть содержания основного вещества в пределах 99%, уменьшить содержание белка до 1%, но хроматография с использованием ионообменной смолы в промышленности требует постоянного контроля вследствие нестабильности ионогенных материалов, что является одним из недостатков ионообменной хроматографии. Уменьшение или набухание объема смол приводят к изменениям скорости потока, потерям эффективности, снижению выхода продукта, в связи с чем часто требуются использование предколонок, регенерация колонок сильными растворителями, увеличиваются трудозатраты на длительные подготовительные и эксплуатационные работы. Помимо этого, катионообменная хроматография является дорогостоящей процедурой.
Известен способ удаления примесей из ферментированного субстрата ХС путем двойного осаждения раствора с целью освобождения от балластных белков при рН 8,8-9,0 и 4,4-4,6 [41]. Но использование в технологическом процессе стадии очистки раствора двойным осаждением при различных рН не может дать продукту нужной степени чистоты, помимо этого, процессу присуща многостадийность, а большое количество операций, связанных с осаждением белков и фильтрованием, ведет к потерям основного вещества. Помимо этого, ферментативный гидролиз не решает проблемы пирогенности, в растворе могут остаться нейтральные, кислые и щелочные протеины [16].
В патенте [42] предложен способ доочистки ХС, полученного из хрящей рыб, путем переосаждения раствора трихлоруксусной кислотой (ТХУ) с целью удаления примесей белков и нуклеиновых кислот. Однако использование ядовитой трихлоруксусной кислоты для осаждения белков и нуклеиновых кислот в промышленных масштабах встречается крайне редко, так как при физико-химическом воздействии ТХУ на белки и нуклеиновые кислоты нарушаются их структура и конфигурация и, как следствие, остаточное содержание их фрагментов в продукте может служить причиной появления неспецифических реакций.
Для селективной адсорбции белков и низкомолекулярных продуктов их распада, других органических примесей из водного раствора ХС используется порошковый активный уголь. При сорбционном извлечении примесей молекулы органических веществ сорбируются на поверхностях специально подготовленных сорбентов, в качестве которых наибольшее распространение имеют активные угли различного типа. С учетом того, что активный углерод имеет удельную поверхность от 1,2 до 1,6 м/г, уголь добавляют в количестве, необходимом для достижения 50-500 мас.% к субстрату [50]. Известны способы доочистки раствора ХС из трахей КРС путем добавления 30% раствора перманганата натрия, нагрева до обесцвечивания раствора с последующим добавлением активного угля при температуре 55°С [37], доочистки ХС из хрящей рыб активным углем в количестве от 0,3 до 1,0% [43]. В другом патенте приведена комбинация обработки раствора ХС в процессе его получения неорганической кислотой при рН 2,5-3,8, а затем окислителями и активным углем [35]. В данных технологиях механизм доочистки растворов субстратов от примесей состоит в сорбции примесей на образующихся хлопьях угля, имеющих большую сорбционную поверхность.
Прототипом настоящего изобретения выбран способ удаления примесей из фракций гликозаминогликанов [51]. Данный способ удаления примесей, таких, как нуклеиновые кислоты, белки и железо, предусматривает обработку растворов фракций гликозаминокликанов (по химической структуре ХС - сульфатированный гликозаминогликан) порошковым активным углем при рН 5-9 и температуре 20-70°С, отделения сорбировавшихся на частицах угля балластных веществ сепарированием и дальнейшего осаждения этанолом очищенных фракций гликозаминогликанов.
Способ доочистки раствора гликозаминокликанов позволяет получить фракции гликозаминокликанов, обладающих следующими характеристиками: содержание нуклеиновых кислот - менее 0,08 мкг на 1 мг фракции гликозаминогликанов, содержание белка - не более 0,4%, содержание железа - не более 0,07 ppm.
Недостатком известного способа удаления примесей из гликозаминогликанов, в том числе из раствора сульфатированного гликозаминогликана, является использование в технологической схеме порошкового активного угля, который, в свою очередь, необходимо подготовить к введению в реакционную смесь. Для данного способа удаления примесей характерны трудоемкость операций, связанных с извлечением угля (сепарирование, осаждение и др.), необходимость подбора угля активного с более высокими прочностными и адсорбционными характеристиками, подбора времени экспозиции реакционной смеси, необходимость ее интенсивного перемешивания, нестабильность эффективности очистки от партии к партии продукта.
Активные угли обладают определенной избирательностью адсорбции: хорошо растворимые в воде и легко гидратирующиеся вещества плохо сорбируются угольными адсорбентами, гидрофобные вещества, слабо растворимые в воде, хорошо сорбируются углем. Под действием перемешивания частицы активного угля хаотично двигаются в растворе, но контакт частиц угля с балластными веществами имеет случайный характер. Для эффективного контакта всего объема приходится прибегать к длительному перемешиванию и увеличению удельного количества угля в расчете на единицу объема раствора, но чем больше угля, тем больше возникает проблем с его последующим удалением из раствора. Помимо этого, кроме физической адсорбции, вызываемой межмолекулярными, или ван-дер-ваальсовыми, силами, уголь обладает химической сорбцией, или хемосорбцией: необратимая сорбция кислорода углем приводит к образованию окислов основного характера, которые при взаимодействии с водой дают основание и влияют на качество продукта [52].
Проведенный анализ очистки ХС показал, что все вышеупомянутые производители извлечение органических примесей из растворов ХС осуществляли различными трудоемкими методами, в т.ч. ионообменной хроматографией, осаждением, коагуляцией, сорбцией. Однако известно, что многостадийный технологический процесс, в ходе которого неоднократно меняются характеристики исходного продукта, в данном случае животного происхождения, подвергаемого операциям жесткого щелочного или ферментативного гидролиза, экстракции, осаждения и др., приводит к возникновению в продукте многих побочных продуктов различной природы, молекулярной массы, полярности и др. В связи с различным содержанием определенного перечня органических примесей в субстанциях ХС разных производителей (Таблица 1), подбор технологических параметров доочистки водных растворов ХС для эффективного удаления примесей является актуальной задачей в области производства хондропротективных препаратов. Данная проблема актуализируется в свете увеличения частоты побочных реакций при введении ряда хондропротекторов, обусловленных, в первую очередь, тем, что в последнее время во всем мире наблюдается увеличение общего количества людей с отягощенным аллергологическим анамнезом.
Задачей, на решение которой направлено изобретение, является разработка технологии доочистки водного раствора ХС от органических примесей и получение жидкой и лиофилизированной лекарственных форм высокоочищенного стабилизированного хондропротективного препарата.
Технический результат предлагаемого изобретения заключается в разработке способа, приводящего к получению высокоочищенного раствора из субстанций ХС разных производителей, и создание стабильного лекарственного средства на основе активного действующего вещества и стабилизатора.
Поставленная задача решается следующим образом.
Для получения лекарственного препарата в водный раствор ХС добавляют аминокислоту L-пролин и фильтруют через угольные фильтры. Получают препарат ХС с чистотой не менее 99%, стабилизированный аминокислотой L-пролин, с остаточным содержанием органических примесей: белка - не более 0,2%, липидов (на 1 мг хондроитинсульфата) - не более 0,5 мкг, нуклеиновых кислот (на 1 мг хондроитинсульфата) - не более 0,05 мкг, бактериальных эндотоксинов (на 1 мг хондроитинсульфата) - не более 0,05 ЕЭ.
В водный раствор ХС, содержащий не более 11,5% основного вещества, добавляют аминокислоту L-пролин в количестве 10-70 г/л, фильтруют раствор при температуре 20-50°C через угольные фильтры следующих марок ZetaCarbon (Cuno) -R54SLP, R51SLP, R53SLP или фильтры AKS (Pall) - AKS 1, 2, 6, 7.
Полученный препарат представляет собой хондроитинсульфат с чистотой не менее 99%, стабилизированный аминокислотой L-пролин, в виде жидкой формы.
Отличительные признаки заявленного изобретения позволили получить следующие преимущества.
Для увеличения эффективности очистки раствора от органических примесей, ухудшающих качество продукта, и увеличения выхода целевого продукта водный раствор ХС до фильтрации стабилизируется подобранным количеством аминокислоты L-пролин, которая была выбрана из ряда других гидрофобных аминокислот (Alanine, Isoleucine, Leucine, Phenylalanine, Valine) в связи с ее известными биологическими и стабилизирующими свойствами. Теоретические предпосылки дают основание предполагать наличие синергизма у ХС и аминокислоты L-пролин в плане хондропротективного эффекта. Он заключается в стимулировании метаболизма хондроцитов и синовиоцитов, ингибировании активности ферментов, способствующих деградации матрикса хряща, улучшении микроциркуляции сосудистого русла периартрикулярных тканей (гепариноподобный эффект ХС). Полианионная молекула ХС является неотъемлемой частью аггрекановой структуры и ответственна за ячеистые и физико-химические свойства хряща, а аминокислота L-пролин служит основой для синтеза коллагена, одного из основных фибриллярных белков соединительной ткани, где чередующиеся остатки пролина и гидроксипролина способствуют созданию стабильной, придающей молекуле прочность трехспиральной структуры коллагена. Коллагеновое волокно, в свою очередь, несет стабилизирующую опорную функцию для соединительной ткани организма.
Растворение субстанции ХС и амфифильного стабилизатора L-пролина до фильтрации позволяет сократить потери ХС на глубинных фильтрах. Возможно, это вызвано тем, что при добавлении подобранного количества амфифильного стабилизатора в раствор, в котором идет явление полиэлектролитного набухания ХС, меняются ионная сила раствора и соответственно гидродинамический радиус макромолекулы [53]. Известно, что максимальный гидродинамический радиус молекул ХС наблюдается в дистиллированной воде, что, в свою очередь, препятствует сорбции в окнах пор активного вещества, растворенного в стерильной инъекционной воде. Помимо этого, амфифильный стабилизатор пролин содержит внутри молекулы гидрофильную (полярную) область и гидрофобную (неполярную) область, и при взаимодействии с ХС увеличивает его растворимость за счет гидрофильной (полярной) области.
В результате вышеизложенного, водный раствор ХС, стабилизированный аминокислотой L-пролином, при подобранных соотношениях компонентов и условиях фильтрации беспрепятственно фильтруется через глубинный угольный фильтр, не проникая в поры глубинного угольного фильтра, и вследствие увеличения гидрофильности макромолекулы не сорбируется на поверхностных сайтах адгезии угля. В материале фильтра уголь зафиксирован, но очищаемый раствор обязательно проконтактирует с углем, т.к. фильтр работает подобно угольной колонне. Это увеличивает время контакта загрязнений с активными сайтами угля, таким образом повышая эффективность очистки по сравнению с насыпным углем, и значительно уменьшает время производственного процесса, которое минимизируется за счет отсутствия необходимости подготовки угля, извлечения угля из реакционной смеси и т.д.
В качестве фильтров могут быть использованы угольные фильтры с наиболее высокой сорбционной активностью по отношению к органическим примесям (белкам, нуклеиновым кислотам, липидам, бактериальным эндотоксинам), например, фильтры ZetaCarbon фирмы Cuno (R54SLP, R51SLP, R53SLP) или фильтры Pall (AKS 1, 2, 6, 7), или аналогичные фильтры других производителей.
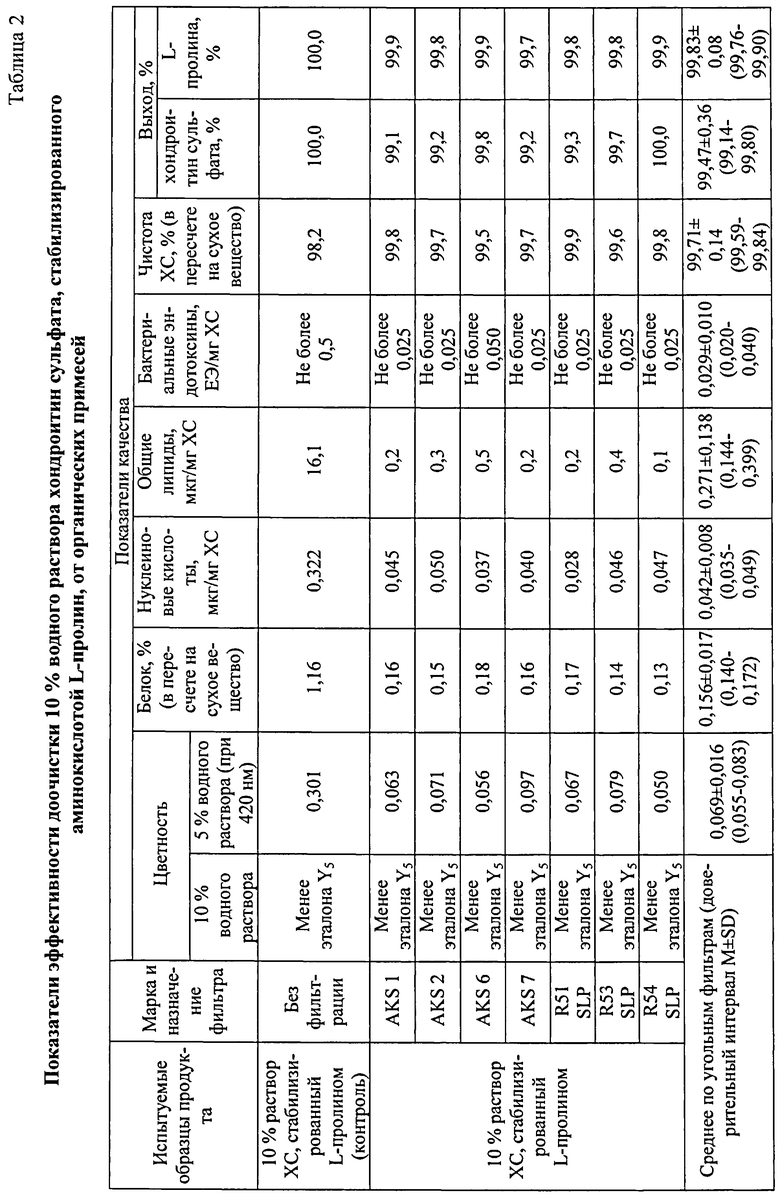
Фильтрация стабилизированного 20 г/л аминокислоты L-пролин водного раствора ХС через глубинный фильтр ZetaCarbon марки R54SLP позволила в 6 раз снизить показатель цветности раствора, в 8-9 раз уменьшить содержание белка (по Лоури, в % в пересчете на сухое вещество), в 6-7 раз содержание нуклеиновых кислот, в 3-4 раза содержание невидимых частиц размером 5 мкм и более, в 20 раз содержание бактериальных эндотоксинов, а содержание липидов и невидимых частиц размером 25 мкм и более довести практически до нуля. Выход ХС и аминокислоты L-пролин составил 100%, т.е. использование фильтра данной марки позволило сохранить количественное содержание основного активного действующего вещества и стабилизатора в пределах исходных параметров.
Доочистка полупродукта с использованием фильтров ZetaCarbon других марок (R51SLP и R53SLP) и фильтров фирмы Pall (AKS 1, 2, 6, 7) позволила получить сопоставимые результаты (Таблица 2).
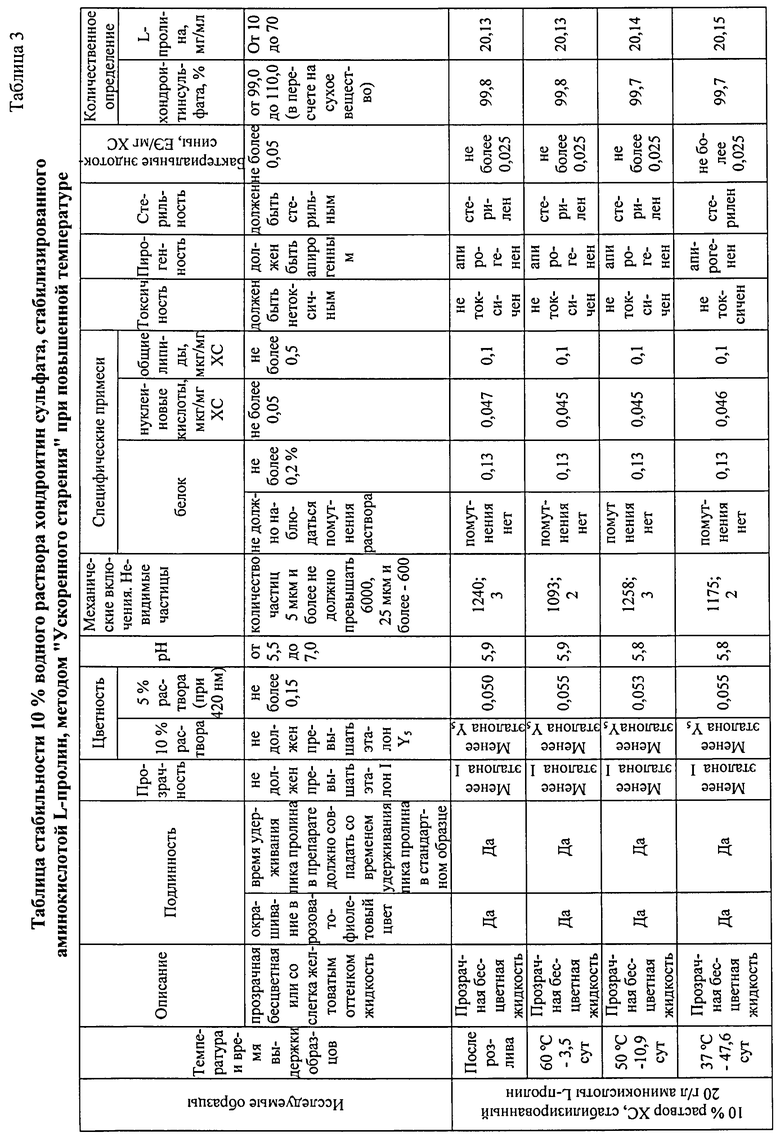
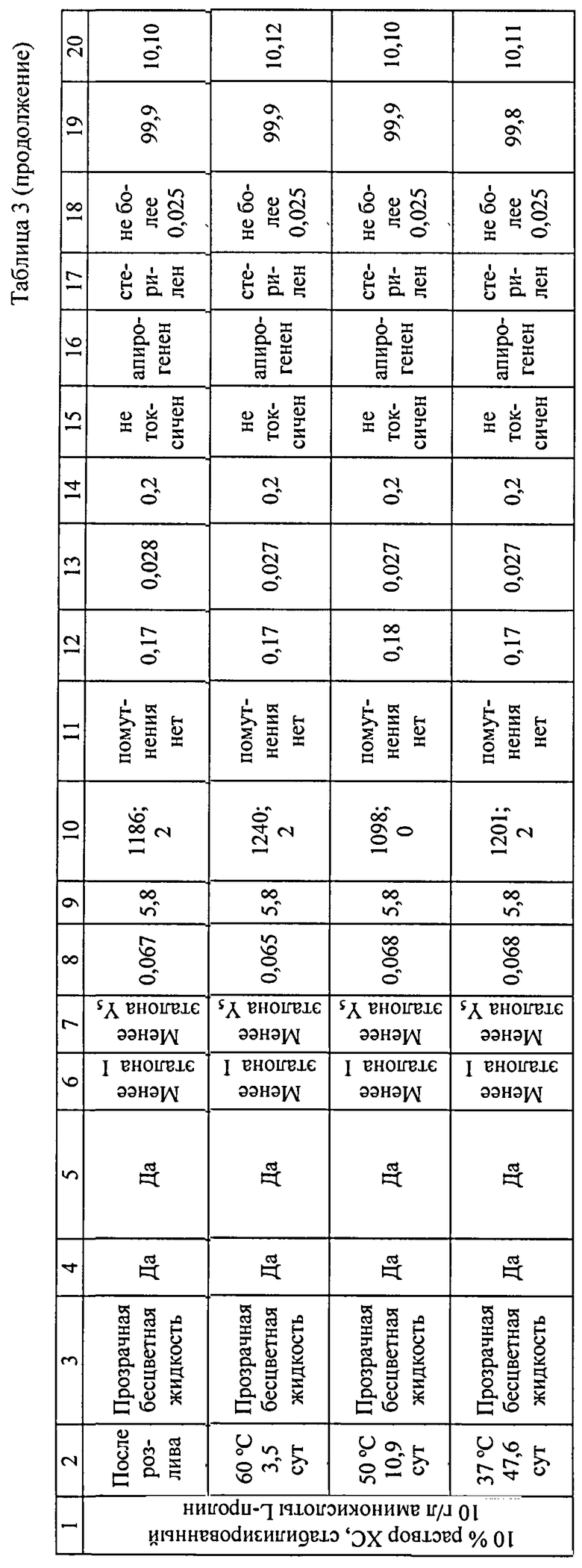
Полученный продукт с заданной степенью очистки без добавления антимикробного консерванта (в отличие от ряда инъекционных хондропротективных препаратов, содержащих в своем составе различные консерванты в виде органических (спиртов, кислот, фенола и его производных), металлоорганических (тиомерсал) и неорганических соединений) [28-31], сохраняет стабильность физико-химических свойств в течение длительного срока хранения (3 года) (Таблица 3). Стабильность препарата обеспечивается минимальным содержанием остаточных органических примесей белка, нуклеиновых кислот, липидов, бактериальных эндотоксинов, т.к. известно, что на стабильность лекарственных средств в процессе хранения большое влияние оказывают как физические факторы, так и побочные химические реакции, в которые могут вступать различные примесные соединения.
Таким образом, совокупность отличительных признаков заявляемого способа позволяет получить оптимальный выход целевого продукта, обладающего улучшенными и стабильными качественными характеристиками, с высоким терапевтическим эффектом. Заявляемая технология обеспечивает высокую степень очистки водного раствора ХС, достигаемой путем последовательного проведения технологических операций, направленных на стабилизацию активного вещества в водном растворе ХС за счет добавления аминокислоты L-пролин в количестве, обеспечивающем синергидный терапевтический эффект активного действующего вещества и стабилизатора и фильтрацию полученного продукта через угольный фильтр.
Полупродукт на промежуточных этапах производства контролируют по следующим методикам.
Внешний вид (описание) контролируют визуально. Подлинность раствора на содержание ХС - качественной реакцией на уроновые кислоты по ФСП 42-0504144206 и на содержание L-пролина - методом высокоэффективной жидкостной хроматографии (ВЭЖХ) по ГФ XI, ч.2, стр.110. Прозрачность контролируют по ГФ XII, ч.1, с.98; цветность - по ГФ XII, ч.1, с.93 и по USP31-NF26, Р.921 спектрофотометрическим методом при длине волны 420 нм. Контроль рН - потенциометрическим методом по ГФ XII, ч.1, с.85. Потерю в массе при высушивании контролируют по ГФ XI, вып.1, с.176. Механические включения определяют визуально и счетно-фотометрическим методом по РД 42-501-98. Специфические примеси (белок) контролируют качественной реакцией с 20% раствором трихлоруксусной кислоты по ФСП 42-0504144206; количественное содержание специфических примесей (белка) - методом Лоури (метод А) по ГФ XII, ч.1, с.105. Нуклеиновые кислоты контролируют спектрофотометрическим методом по методу Спирина по МУК 4.1/4.2.588-96, стр.79. Общие липиды - колориметрическим методом (фосфованилин) в присутствии раствора серной кислоты (Набор для определения общих липидов. Код: 1001270. Spinreact.). Аномальную токсичность контролируют по ГФ XII, ч.1, с.124; пирогенность - по ГФ XII, ч.1, с.125; бактериальные эндотоксины - по ГФ XII, ч.1, с.128. Стерильность методом прямого посева контролируют по ГФ XII, ч.1, с.150. Количественное определение хондроитинсульфата в 1 мл - спектрофотометрическим методом по ФСП 42-0504144206, L-пролина - методом ВЭЖХ по ГФ XI, ч.2, стр.110. Тест на ускоренное старение осуществляется выдерживанием препарата в термостате при температуре 60°С - 3,5 сут, 50°С - 10,9 сут, 37°С - 47,6 сут и является аналогом условий хранения в течение 3 лет. Тест проводят согласно Временной инструкции по проведению работ с целью определения сроков годности лекарственных средств на основе метода "Ускоренного старения" при повышенной температуре: И-42-2-82 [Утв. Министерством мед. промышленности, Министерством Здравоохранения СССР в 1982 г.). Стабильность препарата контролируют согласно ОФС 42-0029-07 Сроки годности лекарственных средств.
Примеры конкретного выполнения.
Пример 1. В качестве исходного сырья используют субстанцию ХС («SYNTEX S.A.», Аргентина), представляющую собой гигроскопичный белый с желтоватым оттенком порошок, с количественным содержанием основного вещества 98,2%, показателем характеристической вязкости - 0,38, показателем рН 10% раствора - 6,1, цветностью и прозрачностью 10% раствора - не интенсивнее эталонных растворов №1 и №66, содержанием специфических примесей (белка) - при проведении качественной реакции помутнения раствора не наблюдается.
3,3 кг субстанции ХС растворяют в 32 л стерильной воды для инъекций температуры 40°С и рН 5,4 при постоянном перемешивании в течение 20 мин. В полученный раствор ХС добавляют навеску аминокислоты L-пролин в количестве 660 г (20 г/л водного раствора ХС), перемешивают в течение 10 мин и доводят конечный объем до 33 л. Получают 10% водный раствор ХС, стабилизированный аминокислотой L-пролин.
Раствор представляет собой прозрачную со слегка желтоватым оттенком жидкость, со следующими показателями:
- Подлинность - раствор окрашивается в розово-фиолетовый цвет (качественная реакция на уроновые кислоты), время удерживания пика пролина в растворе совпадает со временем удерживания пролина в стандартном образце.
- Прозрачность 10% раствора - менее эталона I.
- Цветность 10% раствора - менее эталона Y5; 5% раствора при длине волны 420 нм - 0,301.
- рН - 5,9.
- Механические включения. Невидимые частицы размером 5 мкм и более - 4650 частиц в одной пробе; размером 25 мкм и более - 753 частиц в одной пробе.
- Механические включения визуально - отсутствуют видимые механические включения.
- Специфические примеси (белок) - помутнения нет; в пересчете на сухое вещество 1,16%.
- Примеси нуклеиновых кислот - 0,322 мкг/мг основного вещества ХС.
- Общие липиды - 16,1 мкг/мг основного вещества ХС.
- Аномальная токсичность - нетоксичен.
- Пирогенность - апирогенен.
- Бактериальные эндотоксины - не более 0,5 ЕЭ/мг основного вещества ХС.
- Количественное определение ХС - 98,2% ХС (в пересчете на сухое вещество).
- Количественное определение L-пролина - 20,15 мг/мл.
Полученный раствор подвергают доочистке методом глубинной фильтрации через фильтр ZetaCarbon марки R54SLP 293 мм (3 М Фильтрующие системы, Россия). Фильтрацию (скорость потока через глубинный фильтр 2,8 л/мин) осуществляют при температуре раствора 20°С.
Далее раствор подвергают стерилизующей фильтрации через микрофильтрационную мембрану с размером с размером пор 0,22 мкм (Pall).
Разливают по 1 мл в ампулы стеклянные ШП-В-2.
После доочистки водного раствора ХС с аминокислотой L-пролином через глубинный фильтр ZetaCarbon марки R54SLP стерилизующей фильтрации и розлива повторно контролируют образцы продукции по вышеперечисленным показателям.
Получают раствор, представляющий собой прозрачную бесцветную жидкость, со следующими показателями:
- Подлинность - раствор окрашивается в розово-фиолетовый цвет (качественная реакция на уроновые кислоты), время удерживания пика пролина в растворе совпадает со временем удерживания пролина в стандартном образце.
- Прозрачность 10% раствора - менее эталона I.
- Цветность 10% раствора - менее эталона Y5; 5% раствора при длине волны 420 нм - 0,050.
- рН - 5,9.
- Механические включения. Невидимые частицы размером 5 мкм и более - 1240 частиц в ампуле; размером 25 мкм и более - 3 частицы в ампуле. Соответствует требованиям РД 42-501-98.
- Механические включения визуально - соответствует требованиям РД 42-501-98.
- Специфические примеси (белок) - помутнения нет; в пересчете на сухое вещество - 0,13%.
- Примеси нуклеиновых кислот - 0,047 мкг/мг основного вещества ХС.
- Общие липиды - 0,1 мкг/мг основного вещества ХС.
- Аномальная токсичность - нетоксичен.
- Пирогенность - апирогенен.
- Бактериальные эндотоксины - не более 0,025 ЕЭ/мг основного вещества ХС.
- Количественное определение ХС - 99,8% ХС (в пересчете на сухое вещество).
- Количественное определение L-пролина - 20,13 мг/мл.
Пример 2.
В качестве исходного сырья используют субстанцию ХС (Bioiberica S.A., Барселона, Испания), представляющую собой гигроскопичный белый, со слегка желтоватым оттенком порошок, с количественным содержанием основного вещества 98,8%, показателем характеристической вязкости - 0,05 м3/кг, показателем рН 10% раствора - 5,5, прозрачностью 2,5% раствора - не интенсивнее эталонного раствора I, цветностью 5% раствора - не интенсивнее эталонного раствора Y4, содержанием белка - 0,7%, содержанием бактериальных эндотоксинов - 0,1 ЕЭ/мг.
3,3 кг субстанции ХС растворяют до 32 л стерильной воды для инъекций температуры 45°С, рН 5,2 и при постоянном перемешивании в течение 20 мин. В полученный раствор ХС добавляют навеску аминокислоты L-пролина в количестве 330 г (10 г/л водного раствора ХС), перемешивают в течение 10 мин. Получают 10% водный раствор ХС, стабилизированный аминокислотой L-пролином.
Раствор представляет собой прозрачную, со слегка желтоватым оттенком жидкость, со следующими показателями:
- Подлинность - раствор окрашивается в розово-фиолетовый цвет (качественная реакция на уроновые кислоты), время удерживания пика пролина в растворе совпадает со временем удерживания пролина в стандартном образце.
- Прозрачность 10% раствора - менее эталона I.
- Цветность 10% раствора - менее эталона Y5; 5% раствора при длине волны 420 нм - 0,280.
- рН - 5,7.
- Механические включения. Невидимые частицы размером 5 мкм и более - 4845 частиц в одной пробе; размером 25 мкм и более - 647 частиц в одной пробе.
- Механические включения визуально - отсутствуют видимые механические включения.
- Специфические примеси (белок) - помутнения нет; в пересчете на сухое вещество - 0,7%.
- Примеси нуклеиновых кислот - 0,434 мкг/мг основного вещества ХС.
- Общие липиды - 1,8 мкг/мг основного вещества ХС.
- Аномальная токсичность - нетоксичен.
- Пирогенность - апирогенен.
- Бактериальные эндотоксины - не более 0,1 ЕЭ/мг основного вещества ХС.
- Количественное определение ХС - 98,8% ХС (в пересчете на сухое вещество).
- Количественное определение L-пролина - 10,12 мг/мл.
Полученный раствор подвергают доочистке методом глубинной фильтрации через фильтр ZetaCarbon марки R51SLP 293 мм (3 М Фильтрующие системы, Россия). Фильтрацию (скорость потока через глубинный фильтр 2,8 л/мин) осуществляют при температуре раствора 35°С.
Далее раствор подвергают стерилизующей фильтрации через микрофильтрационную мембрану с размером с размером пор 0,22 мкм (Pall).
Разливают по 1 мл в ампулы стеклянные ШП-В-2, помещают кассеты с препаратом в сублимационную камеру, где замораживают не менее 10 ч, включая выдержку препарата при температуре минус 30°С и ниже не менее 4-х ч. Затем камеру вакуумируют, при стабилизации остаточного давления начинают процесс сублимационного высушивания, температуру медленно поднимают до конечного значения (22±4)°С к (40±7) ч и поддерживают на этом уровне до конца высушивания.
После доочистки водного раствора ХС, стабилизированного аминокислотой L-пролин, через глубинный фильтр ZetaCarbon марки R51SLP стерилизующей фильтрации, розлива и лиофильного высушивания контролируют образцы продукции по вышеперечисленным показателям.
Получают раствор, представляющий собой прозрачную бесцветную жидкость, со следующими показателями:
- Подлинность качественной реакцией на уроновые кислоты - окрашивается в розово-фиолетовый цвет; качественной реакцией на L-пролин - время удерживания основного пика на хроматограмме испытуемого препарата совпадает со временем удерживания пика пролина на хроматограмме стандартного раствора.
- Прозрачность 10% раствора - менее эталона I.
- Цветность 10% раствора - менее эталона Y5; 5% раствора при длине волны 420 нм - 0,067.
- рН - 5,8.
Потеря в массе при высушивании - 2%.
- Механические включения. Невидимые частицы размером 5 мкм и более - 1186 частиц в ампуле; размером 25 мкм и более - 2 частицы в ампуле. Соответствует требованиям РД 42-501-98.
- Механические включения визуально - соответствует требованиям РД 42-501-98.
- Специфические примеси (белок) - помутнения нет; в пересчете на сухое вещество - 0,17%.
- Примеси нуклеиновых кислот - 0,028 мкг/мг основного вещества ХС.
- Общие липиды - 0,2 мкг/мг основного вещества ХС.
- Аномальная токсичность - нетоксичен.
- Пирогенность - апирогенен.
- Бактериальные эндотоксины - не более 0,025 ЕЭ/мг основного вещества ХС.
- Количественное определение ХС - 99,9% ХС (в пересчете на сухое вещество).
- Количественное определение L-пролина - 10,10 мг/мл.
Литература
1. Фоломеева О.М., Амирджанова В.Н., Якушева Е.О. и др. Анализ структуры XIII класса болезней. Рос. Ревматол. 1998; 1: 2-7.
2. Фоломеева О.М., Дубинина Т.В., Логинова Е.Ю. и др. Заболеваемость населения России ревматическими заболеваниями в начале нового столетия. Терапевтический архив. 2003; 75(5): 5-9.
3. Фоломеева О.М., Эрдес Ш. Ревматические заболевания у взрослого населения в федеральных округах Российской Федерации. Научно-практическая ревматология. 2006(2): 4-10.
4. Поздеева Н.А., Сороковиков В.А. Дегенеративно-дистрофические изменения пояснично-крестцового отдела позвоночника (распространенность, клиника, профилактика). Бюллетень ВСНЦ СО РАМН, 2006, №4 (50).
5. Епифанов В.А., Ролик И.С., Епифанов А.В. Остеохондроз позвоночника. -М.: Медицина, 2000. - 344 с.
6. EULAR Recommendations 2003: an evidence based approach to the management of knee osteoarthritis: Report or a Task Force of Stending Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT). Ann Rheum Dis 2003, 62: 1145-1155.
7. Федеральное руководство для врачей по использованию лекарственных средств (формулярная система): Выпуск 1. - М.: ГЭОТАР Медицина, 2000, стр.444.
8. Насонов Е.Л. Клинические рекомендации и алгоритмы для практикующих врачей. Ревматология, М.: Волга Медиа, 2004. - 111 с.
9. Алексеева Л.И. Перспективы хондропротективной терапии остеоартроза. Научно-практическая ревматология. 2003; (4): 83-6.
10. Руденко В.Г. Хондропротекторы - основа конструктивной терапии заболеваний суставов. Медицинская газета «Здоровье Украины», 11.2003. №83.
11. Клинические рекомендации для практических врачей, основанные на доказательной медицине. М., 2001. С.606-611.
12. Adebowale АО, Сох DS, Liang Z, Eddington ND. Analysis of glucosamine and chondroitin sulfate content in marketed products and the Caco-2 permaebility of chondroitin sulfate raw materials. // J Am Nutraceutical Assoc 2000; 3: 37-44.
13. Foley CM, Kratz AM. Nutraceuticals - challenges and opportunities for the new millennium that affect consumers and healthcare professionals who use and recommend nutraceuticals. // J Am Nutraceutical Assoc. 1999; 2: 6-10.
14. McCoy М. Stiff competition in arthritis salve. // Chem Eng News. 2000 (Apr 3): 20-21.
15. Epub 2010 Jan 28. Calamia V, Fernandez-Puente P, Mateos J. et al Pharmacoproteomic Study of Three Different Chondroitin Sulfate Compounds on Intracellular and Extracellular Human Chondrocyte Proteomes. Mol Cell Proteomics. 2012 Jun; 11(6): M111.013417. Epub 2011 Dec 27.
16. WO 9309766 (A1) Hartung Glen. Method for treatment of acute and chronic painful arthropathic conditions in human and other mammals, опубл. 27.05.1993 г.
17. US 2003162744, Takai М., Kono H. Salmon-origin chondroitin-sulfate. заявл.02.03.2002 г., опубл. 28.08.2003 г.
18. WO 2004039994, Tadashi E. Sodium chondroitin sulfate, chondroitin-sulfate-containing material fnd processes for producingthe same.; заявл. 01.11.2002 г., опубл. 13.05.2004 г.
19. US 20040146993 Khare A., Houliston S., Black Т. Isolating chondroitin sulfate. заявл. 13.11.2002 г., опубл. 29.07.2004 г.
20. Tat S.K., Pelletier J.P., Mineau F., Duval N., Martel-Pelletier J. Variable effects of 3 different chondroitin sulfate compounds on human osteoarthritic cartilage/chondrocytes: relevance of purity and production process. J Rheumatol. 2010 Mar; 37(3): 656-64.
21. Lignot B, Lahogue V, Bourseau P. 2003. Enzymatic extraction of chondroitin sulfate from skate cartilage and concentration-desalting by ultrafiltration. J Biotechnol 103: (281-284).
22. Nakashima A. Removal of Pyrogen from Commercial Chondroitin Sulfate. Bulletin of Fukuoka Women's Junior College №9. 1975-03-31. P.1-6.
23. Barnhill JG, Fye CL, Williams DW, Reda DJ, Harris CL, Clegg DO. Chondroitin product selection for the glucosamine/chondroitin arthritis intervention trial. // J Am Pharm Assoc (2003). 2006 Jan-Feb; 46(1): 14-24.
24. Chondroitin Sulfate. Monography №2064. European Pharmacopoeia 6.0. P.1525-1527.
25. Dietary Supplements: Chondroitin Sulfate Sodium. USP31-NF26. P.921.
26. Official monography «Sodium Chondroitin Sulphate». №04805. Japanese «Japonica» (JSPI 1991).
27. Clegg DO, Reda DJ, Harris CL, et al. Glucosamine, chondroitin sulfate, and the two in combination for painful knee osteoarthritis. // N Engl J Med. 2006 Feb 23; 354(8): 795-808.
28. Патент RU 2200018 C1. Хлябич Г.Н.; Пак М.Ф.; Бондарева Л.Н.; Пак Т.В.; Персанова Л.В.; Колдышев А.Е.; Кондратьев B.C. Способ приготовления инъекционной формы препарата хондроитинсульфата. Государственный институт кровезаменителей и медицинских препаратов, опубл. 10.03.2003 г.
29. Патент RU 282437 C1. Васюков С.Е., Нестерова Е.И., Александрова Т.Ю., Маслова О.Ю., Есенкова Н.Е. Средство для лечения болезней суставов. Нижегородский химико-фармацевтический завод, опубл. 27.08.2006 г.
30. Патент RU 2021812 C1. Коростин В.И.; Меркишева З.А.; Белова В.В.; Кирьянов Н.А.; Васюков С.Е.; Фиалкова М.А.; Новохатский А.С., Хлябич Г.Н. Средство для лечения артрологических заболеваний. Всесоюзный научно-исследовательский институт технологии кровезаменителей и гормональных препаратов, опубл. 30.10.1994 г.
31. Патент RU 275190 C1. Васюков С.Е., Нестерова Е.И., Александрова Т.Ю., Маслова О.Ю., Моругина Л.В. Средство для лечения болезней суставов. Нижегородский химико-фармацевтический завод, опубл. 27.04.2006 г.
32. Brandt K.D. Management of Osteoarthritis. In: Kelley's Textbook of Rheumatology, 6th ed., 2001, 1419-32.
33. Pavelka К., Gatterova J., Gollerova V. et al. A 5-year randomized controlled, doubleblind study of glycosaminoglycan polysulphuric acid complex (Rumalon) as a structure modifying therapy in osteoarthritis of the hip and knee. Osteoarthritis Cartilage 2000; 8(5): 335-42.
34. Голубев Г.Ш., Кригштейн О.С. Оценка доказательств эффективности средств, претендующих называться «структурно-модифицирующими препаратами», 2000-2007 гг. Клиническая фармакология и фармакоэкономика. 2008; 1: 55-88.
35. Заявка RU 2004104617. Полунина Е.Е; Знаменский Ю.В; Касаткин С.А. Способ выделения хондроитинсульфата из животных тканей. ОАО «Биосинтез», опубл. 27.07.2005 г.
36. US 524066 WOLF KARL H [DE]. Process for the preparation of injectable chondroitin polysulfate. заяв. 11.05.1981 г. опубл. 18.06.1985 г.
37. Патент RU 2061485 Способ выделения хондроитинсульфата из животных тканей. Васюков С.Е., Кирьянов И.А., Лукина И.В., опубл. 10.06.1996 г.
38. S. Harano, Yo Akimoto, and M. Ishigami, Carbohydr. Res. ~ 41, 323 (1975), Methods of synthesis and technology of production of drugs production, properties and use of chondroitin sulfate.
39. CN 101358220. Qingrong Wang, Yinghua Fu, Cheng Luo, Minghu Yang. Method for extracting calcium chondroitin sulfate in shark cartilage, заявл. 25.09.2008 г., опубл. 04.02.2009 г.
40. CN 101215339 Zhang Guozhi. Method for purifying sodium chondroitin sulfate. заявл. 11.01.2008 г. опубл. 09.07.2008 г.
41. CN 101348814 Huang, Wentano Yu, Tan, Yuanyuan Long. Method for improving chondroitin sulfate quality by protein isoelectric point, заявл. 03.09.2008 г., опубл. 21.01.2009 г.
42. KR 20080010201. Extract of lophiomus setigerus or chondroitin sulfate isolated, preparation method and cartilage articulation protection composition containing thereof. Kim Yeong Shik, Sim Jun Coo, Im Rang. опубл. 30.01.2008 г.
43. US 2006/0014256. ETO TADASHI [JP]. Sodium chondroitin sulfate, chondroitin-sulfate-containing material and processes for producing the same, опубл. 19.01.2006 г.
44. BE 893097. WOLF K.H. Injectable chondroitin polysulfate. Опубл. 30.08.1982 г.
45. Federal Republic of Germany Patent No. 2037942, 1970; Chem. Abstr., 7-6, No. 37423 (1972)
46. Иванкин А.Н., Васюков С.Е., Панов В.П. Получение, свойства и применение хондроитинсульфатов. Химико-фармацевтический журнал, 1985, т.19 №3 с.192-202.
47. Nakashima A. Removal of Pyrogen from Commercial Chondroitin Sulfate. Bulletin of Fukuoka Women's Junior College №9. 1975-03-31. P.1-6.
48. J. Einbinder and M. Schubert, Separation of chondroitin sulfate from cartilage. J Biol Chem., 1950 Aug; 185(2): 725-730.
49 Guidance for Industry. Q3C Impurities: Residual Solvents. FDA. CDER. CBER. ICH. 1997. P.1-16.
50. JP 2005336352 (A) TOCUYAMA CORP. Method for producing Chondroitin sulfate. опубл. 08.12.2005 г.
51. JP 2006104461 (A) Koyama Hiroshi, Imamura Kimihiro, Koshinbo Akira, Onuki Edzy. Method for removing impurity in glycosaminoglycan fraction, опубл 20.04.2006 г.
52. Бачурин П.Я., Смирнов В.А. Физико-химические основы обработки водочной сортировки активным углем. -M.: Пищевая промышленность, 1975.
53. Порцель М.Н. Разработка технологии получения хондроитинсульфата из гидробионтов Баренцева моря и изучение его физико-химических свойств. Автореф. диссертации на соискание ученой степени кандидата техн. наук. Мурманск, 2011 г.
| название | год | авторы | номер документа |
|---|---|---|---|
| Раствор хондроитина сульфата для внутримышечного введения и способ его получения | 2015 |
|
RU2623050C2 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ВИРУСИНАКТИВИРОВАННЫХ РАСТВОРОВ ИММУНОГЛОБУЛИНОВ С НИЗКИМ ОСТАТОЧНЫМ СОДЕРЖАНИЕМ КАПРИЛОВОЙ КИСЛОТЫ | 2013 |
|
RU2561596C2 |
| ХОНДРОИТИНАЗА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ВКЛЮЧАЮЩИЕ ЕЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1993 |
|
RU2144833C1 |
| ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ АРТРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2020 |
|
RU2739746C1 |
| ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ АРТРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2015 |
|
RU2743274C2 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОЙ ЭНДОНУКЛЕАЗЫ SERRATIA MARCESCENS | 2021 |
|
RU2795623C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСНОГО ПРЕПАРАТА, СОДЕРЖАЩЕГО МУКОПОЛИСАХАРИДЫ И КОЛЛАГЕН ИЗ ЖИВОТНОГО СЫРЬЯ | 1993 |
|
RU2082416C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ АРТРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ В ЛИОФИЛИЗИРОВАННОЙ ФОРМЕ ДЛЯ ИНЪЕКЦИЙ | 2024 |
|
RU2827073C1 |
| СПОСОБ ПОЛУЧЕНИЯ ХОНДРОИТИНА СУЛЬФАТА ИЗ ТКАНЕЙ МОРСКИХ ГИДРОБИОНТОВ | 2010 |
|
RU2458134C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОНЦЕНТРИРОВАННОГО ИММУНОГЛОБУЛИНОВОГО ПРЕПАРАТА ДЛЯ ПОДКОЖНОГО ВВЕДЕНИЯ | 2012 |
|
RU2487725C1 |
Группа изобретений относится к медицине. Описан способ получения высокоочищенного лекарственного средства для лечения дегенеративно-дистрофических заболеваний периферических синовиальных суставов и позвоночника. Способ предусматривает введение в водный раствор хондроитинсульфата, содержащий не более 11,5% основного вещества, аминокислоты L-пролин в количестве 10-70 г/л и фильтрацию раствора температуры 20-50°C через угольные фильтры следующих марок ZetaCarbon (Cuno) R54SLP, R51SLP, R53SLP или фильтры AKS (Pall) - AKS 1, 2, 6, 7. Способ позволяет создать высокоочищенный жидкий или лиофилизированный хондропротективный препарат с чистотой не менее 99%, стабилизированный аминокислотой L-пролин, с остаточным содержанием органических примесей: белка - не более 0,2%, липидов (на 1 мг хондроитинсульфата) - не более 0,5 мкг, нуклеиновых кислот (на 1 мг хондроитинсульфата) - не более 0,05 мкг, бактериальных эндотоксинов (на 1 мг хондроитинсульфата) - не более 0,05 ЕЭ. 2 н. и 4 з.п. ф-лы, 3 табл., 2 пр.
1. Способ получения высокоочищенного лекарственного препарата для лечения дегенеративных заболеваний опорно-двигательного аппарата путем очистки растворов хондроитинсульфата активным углем от примесей, отличающийся тем, что берут водный раствор хондроитинсульфата и добавляют аминокислоту L-пролин, фильтруют через угольные фильтры, получают хондроитинсульфат с чистотой не менее 99%, стабилизированный аминокислотой L-пролин, с минимально допустимым содержанием следующих примесей: белка - не более 0,2%, липидов (на 1 мг хондроитинсульфата) - не более 0,5 мкг, нуклеиновых кислот (на 1 мг хондроитинсульфата) - не более 0,05 мкг, бактериальных эндотоксинов (на 1 мг хондроитинсульфата) - не более 0,05 ЕЭ.
2. Способ по п. 1, отличающийся тем, что раствор хондроитинсульфата содержит хондроитинсульфат в количестве не более 11,5%.
3. Способ по п. 1, отличающийся тем, что концентрация аминокислоты L-пролин в растворе составляет 10-70 г/л.
4. Способ по п. 1, отличающийся тем, что фильтрацию через глубинные угольные фильтры осуществляют при температуре 20-50°C.
5. Способ по п. 1, отличающийся тем, что для фильтрации используют угольные фильтры следующих типов марок ZetaCarbon (Cuno) R54SLP, R51SLP, R53SLP или фильтры AKS (Pall) - AKS 1, 2, 6, 7.
6. Препарат, представляющий собой хондроитинсульфат с чистотой не менее 99%, стабилизированный аминокислотой L-пролин, полученный способом по пп. 1-5, в виде жидкой формы.
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ИНЪЕКЦИОННОЙ ФОРМЫ ПРЕПАРАТА ХОНДРОИТИНСУЛЬФАТА | 2001 |
|
RU2200018C1 |
| СПОСОБ ПОЛУЧЕНИЯ ОБЛАДАЮЩИХ ПОНИЖЕННОЙ РАСТВОРИМОСТЬЮ В ВОДЕ ПЛЕНОЧНЫХ МАТЕРИАЛОВ НА ОСНОВЕ МОДИФИЦИРОВАННЫХ АМИНОСАЛИЦИЛОВЫМИ КИСЛОТАМИ КАРБОКСИЛСОДЕРЖАЩИХ ПОЛИСАХАРИДОВ | 2007 |
|
RU2343932C1 |
Авторы
Даты
2015-04-10—Публикация
2013-04-09—Подача