Изобретение относится к области медицины, в частности к лекарственным средствам для лечения артрологических заболеваний.
Уровень техники
Согласно данным Всемирной организации здравоохранения заболевания опорно-двигательного аппарата являются ведущим фактором инвалидизации во всем мире. Такие заболевания ограничивают подвижность и моторику, приводя к преждевременному прекращению трудовой деятельности, сокращая возможности выполнения социальных функций.
Большая часть болезней опорно-двигательного аппарата относится к нарушениям, поражающим суставы. К ним можно отнести остеоартроз, ревматоидный артрит, псориатический артрит, подагру, анкилозирующий спондилоартрит и т.д.
Характерным признаком данных заболеваний является разрушение хрящей и изменение структуры костей. Чаще всего заболеваниям суставов подвержены люди старше сорока лет, но сегодня он все чаще встречается и у молодого поколения.
В основе поддержания функции сустава лежит хондромодулирующая терапия, в которой на сегодняшний день широко применяются препараты на основе натриевой соли хондроитина сульфата - мукополисахарида, полученного из животных тканей. Препарат эффективно влияет на обменные процессы в соединительной ткани пациента, в том числе в хряще, стимулируя и нормализуя биосинтез гликозаминогликанов.
Хондроитина сульфат (далее также - ХС) - это высокомолекулярный гетерополисахарид, который относится к группе гликозаминогликанов, линейных неразветвленных полимеров.
Строение молекулы ХС обуславливает ее полианионные свойства и участие в процессах транспорта воды, аминокислот и липидов в аваскулярных участках хряща. Длинные цепи ХС, входящие в состав экстрацеллюлярного матрикса, определяют важнейшие биомеханические свойства хрящевой ткани. Хондроитина сульфат - структурный модулятор, который не только синтезируется организмом, но также после введения интегрирует в структуры хрящевой ткани, стимулируя ее синтез и ингибируя деструкцию. Его своевременное назначение и регулярное использование обеспечивают торможение, стабилизацию и профилактику развития деструктивных процессов в суставе. Основная функция хондроитина сульфата в организме - удержание воды и питательных веществ в хряще и обеспечение движения молекул через хрящевую ткань. Это является важнейшим свойством, поскольку в хрящах отсутствует кровь, обеспечивающая метаболитный обмен. Также хондроитина сульфат является хондропротектором. Сохраняемая им в толще хряща вода, создает хорошую амортизацию и поглощает удары, что в итоге повышает прочность соединительной ткани.
Хондроитина сульфат - естественный компонент суставного хряща, играющий важную роль в поддержании необходимого осмотического давления, благодаря чему матрикс и нити коллагена растягиваются. Это вещество обладает противовоспалительной активностью, воздействуя в основном на клеточный компонент воспаления, стимулирует синтез гиалуроновой кислоты и протеогликанов и угнетает действие протеолитических ферментов. Хондроитина сульфат представляет собой основную часть суставного хряща. Он сформирован из повторяющихся дисахаридных единиц глюкуроновой кислоты и N-ацетил-D-галактозамина. При дегенеративно-дистрофическом процессе количество хондроитина резко уменьшается, что приводит к деградации хряща [Буйлова Т.В. Открытое рандомизированное исследование эффективности и безопасности препарата Хондроксид® в комплексном лечении больных с хронической вертеброгенной люмбоишалгией//РМЖ. 2010. №17. С. 1678-1686].
Сегодня на рынке лекарственные средства хондроитина сульфата представлены в инъекционных и неинъекционных формах.
Неинъекционные формы представлены таблетками и капсулами.
Препарат "Артра" представляет собой таблетки, покрытые пленочной оболочкой, 500 мг +500 мг: 30, 60, 100 или 120 шт. Действующие вещества: Хондроитина сульфат натрия (Chondroitin sulfate sodium), Глюкозамин (Glucosamine). 1 таб. содержит хондроитин сульфат натрия - 500 мг, глюкозамина гидрохлорид - 500 мг. Вспомогательные вещества: кальция сульфат двузамещенный - 230 мг, целлюлоза микрокристаллическая - 185 мг, натрия кроскармеллоза - 80 мг, стеариновая кислота - 70 мг, магния стеарат - 10 мг.
Состав оболочки: гидроксипропилметилцеллюлоза - 35 мг, титана диоксид (Е171) - 8.2 мг, триацетин - 6.8 мг.
Капсулы на основе ХС представлены препаратами "Структум", "Терафлекс адванс", "Терафлекс", "Хондроитин АКОС", "Хондроитин", "Кондронова".
Все указанные выше препараты имеют действующее вещество: Хондроитина сульфат натрия (Chondroitin sulfate sodium).
Капсулы желатиновые, имеют вспомогательные вещества, например: тальк, стеариновая кислота, магния стеарат, марганца сульфат.
Обычно состав оболочки капсулы включает диоксид титана и желатин.
Известны гели на основе ХС, например, препарат Хондроитин (Chondroitine, ВЕРТЕКС АО (Россия) - гель для наружного применения 5% г: тубы 30 г или 50 г, банки 30 г. Действующее вещество: Хондроитина сульфат натрия (Chondroitin sulfate sodium). Гель для наружного применения 5% - 1 г. Состав: хондроитин сульфат - 50 мг. В гель добавлены вспомогательные вещества: диметилсульфоксида; пропиленгликоля; карбомера; троламина; макрогола; эдетата; метилпарабена; нипагина; масел нероли и лаванды; воды очищенной.
Мази на основе ХС представлены следующими препаратами: Мукосат мазь 5%, Артрафик мазь 5%, Хондроитин АКОС мазь 5%. Мази содержат хондроитина сульфат натрия и вспомогательные вещества: лактоза, кальция стеарат.
Инъекционные формы представлены лиофилизатами и растворами.
Известны растворы для внутримышечного введения в ампулах: Драстоп, Хондрогард, Инъектран, Атравир-Инкамфарм, Артогистан.
Примером лиофилизата является препарат Хондролон, представляющий собой лиофилизованную форму инъекционного препарата на основе субстанции натриевой соли хондроитина сульфата.
Все вышеописанные препараты на основе хондроитина сульфата (ХС), будь то инъекционные формы, гели, мази, таблетки или капсулы для приема внутрь, обладая хондропротектным действием, противовоспалительной активностью, воздействуя в основном на медиаторы воспаления, стимулируют синтез гиалуроновой кислоты и протеогликанов и угнетают действие протеолитических ферментов.
Препараты ХС оказывают хондростимулирующее, регенерирующее, противовоспалительное и анальгезирующее действие, обладают хондропротекторными свойствами, усиливают обменные процессы в гиалиновом и волокнистом хрящах, субхондриальной кости; ингибируют ферменты, вызывающие деградацию (разрушение) суставного хряща; ХС стимулирует выработку хондроцитами протеогликанов, способствует снижению выброса в синовиальную жидкость медиаторов воспаления и болевых факторов, подавляет секрецию лейкотриенов и простагландинов, замедляет резорбцию костной ткани и снижает потери кальция, ускоряет процессы восстановления костной ткани, замедляет прогрессирование остеоартроза и остеохондроза, способствует восстановлению суставной сумки и хрящевых поверхностей суставов, препятствует коллапсу соединительной ткани, нормализует продукцию суставной жидкости.
Из приведенных данных видно, что лекарственные средства ХС в различных формах активно используются для лечения артрологических заболеваний.
Проблемой известных препаратов является низкая биодоступность хондроитина сульфата, варьирующая в зависимости от формы препарата и приводящая к малой эффективности.
Исследования показывают, что эффективность использования препаратов хондроитина возникает только при длительном постоянном применении их курсом в течение 3, 6 или 9 месяцев, что приводит к возрастанию риска возникновения побочных эффектов из-за длительности применения.
Такой длительный курс нередко сопровождается следующими побочными эффектами: аллергическими реакциями, отеками, покраснениями и даже воспалениями в месте инъекции из-за многократности введения.
Раскрытие изобретения
Предметом настоящего изобретения является средство для лечения артрологических заболеваний, включающее эффективное количество хондроитина сульфата натрия и, по меньшей мере, одно вспомогательное вещество или носитель, отличающееся тем, что дополнительно содержит молибден в относительном количестве от 0,1 мг/кг до 15 мг/кг в пересчете на массу действующего вещества - хондроитина сульфата натрия.
Технический результат настоящего изобретения заключается в повышении биодоступности препаратов хондроитина сульфата в различных формах, достигаемой за счет использования его в комбинации с молибденом, сокращении курса лечения и снижении негативных побочных эффектов.
Использование средства по изобретению приводит также к нормализации метаболических процессов, ускорению снятия отеков при травмах и/или инъекциях и более быстрому процессу регенерации.
Выявлено, что введение определенных (относительно небольших) доз молибдена в состав композиций, включающих в качестве действующего вещества хондоитин сульфат, значительно повышает терапевтическую эффективность композиции.
Данный эффект сочетания молибдена и хондроитина сульфата в композиции является неожиданным, хотя известно, что молибден входит в состав таких ферментов, как альдегидроксидаза, сульфитоксидаза.
Сульфитоксидаза необходима для нормального протекания процессов метаболизма белковых веществ в организме. Молибденоэнзимы выполняют сложные каталитические реакции в обмене веществ, без их участия невозможны анаболические реакции в организме.
Молибден активизирует работу фермента ксантиноксидазы, участвующей в метаболизме азота.
Микроэлемент принимает активное участие в процессах гемопоэза. Без молибдена невозможен синтез эритроцитов, он отвечает за метаболизм железа в организме, использование его для построения гемоглобина.
Молибден оказывает влияние на образование серосодержащих аминокислот и их дальнейшее использование в работе высшей нервной системы.
Еще одна важная функция молибдена в организме - защита витаминов и биологически активных веществ от преждевременного разрушения. Элемент активизирует антиоксидантное действие аскорбиновой кислоты.
Влияет молибден и на состояние костной и зубной ткани. Под его влиянием организм медленнее теряет фтор из зубной эмали, и зубы меньше подвергаются кариесу.
Согласно известным исследованиям, какого-либо заметного накопления молибдена в организме человека не происходит. Растворимые соединения молибдена выводятся из организма с мочой и калом.
Суточная норма молибдена - 2 мкг/кг, то есть для взрослого человека дневная потребность составляет около 150 мкг. Доза в 5 мг молибдена токсична для человека, а 50 мг - летальна.
При избыточном содержании молибдена в пище повышается формирование оснований пурина, входящих в нуклеиновые кислоты. Если почки не справляются с их выведением, то в организме накапливается излишняя мочевая кислота, которая, откладываясь в хрящах и сухожилиях, вызывает развитие подагры.
Как правило, известные средства молибдена являются витаминными комплексами или биологически активными добавками.
Так, известен витаминно-минеральный комплекс, содержащий витамины В12, В2, В3 (никотинамид), B5 (кальция пантотенат), В6, В9 (фолиевая кислота), В12, А, С, Д3, Е и минералы: магний, медь, йод, железо, молибден, селен, кальций, хром, разделенный с учетом их взаимного влияния на две принимаемые в различное время твердые препаративные формы, отличающийся тем, что он дополнительно содержит в качестве витаминов ликопин и бета-каротин, минералы: цинк, фосфор и марганец. При этом первая твердая препаративная форма содержит B1, В2, В3 (никотинамид), В5 (кальция пантотенат), В6, В9 (фолиевая кислота), В12 и минералы: йод, магний, медь, железо, молибден (см. RU 2275192).
Известно средство для поддерживающей терапии заболеваний сердечно-сосудистой системы, характеризующееся тем, что оно содержит в качестве активных ингредиентов витамины, биофлавоноиды, микро- и макроэлементы, экстракты лекарственных растений, комплекс полифенолов красного винограда, концентрат брокколи, масло бурачника, L-цистеин, L-глютатион, DL-метионин и целевые добавки целлюлозу, двуокись кремния, стеариновую кислоту, магния стеарат, гидроксипропилметилцеллюлозу. Средство выполнено в форме таблетки, содержащей среди других компонентов молибден в количестве 40,5-49,5 мкг (см. RU 2292901).
Известна композиция с антиоксидантной активностью, содержащая от 10 до 90 масс. % геля из листьев алоэ вера; от 5 до 50 масс. % сока винограда; от 0,1 до 5 масс. % экстракта зеленого чая; от 0,01 до 0,2 масс. % витаминной смеси, содержащей витамин В1, витамин В9 (фолиевая кислота), витамин В12 и витамин Е; от 0,01 до 0,1 масс. % хлорофилла; от 0,05 до 0,15 масс. % кофермента Q10; от 0,01 до 0,1 масс. % холина; от 0,005 до 0,015 масс. % селена; и от 0,005 до 0,1 масс. % экстракта из узла пшеницы, содержащего 10% ресвератрола. Комплекс в конкретном варианте также содержит микроэлементы: селен (Se), хром (Cr), кобальт (Со), железо (Fe), йод (I), медь (Cu), марганец (Mn), молибден (Мо) и цинк (Zn) (см. RU 2630579).
Средства, согласно заявленному назначению, содержащие в своем составе молибден, из уровня техники не выявлены.
Как будет показано в приведенных ниже примерах, самостоятельное использование молибдена в указанных концентрациях не приводит к проявлению достоверно значимого эффекта. Молибден не обладает самостоятельной терапевтической активностью в отношении артрологических заболеваний.
В составе настоящего препарата молибден способствует увеличению биодоступности хондроитина сульфата и значительно повышает эффективность последнего за счет применения в композиции.
В составе средства по изобретению используется молибден в виде хелата.
Выбор конкретного хелата молибдена определяется конкретной лекарственной формой.
Так, для добавления в препараты в виде таблеток, капсул, мазей и кремов могут использоваться различные хелатные формы молибдена, например, Country Life, Молибден, хелатный [https://zavitaminom.ru/product/country-life-molibden-helatnyj-150mkg-100-tabletok] или хелаты аминокислот молибдена [https://ru.luckyvitamin.com/p-353556-kal-molybdenum-amino-acid-chelate-250-mcg-100-micro-tablets].
Для использования в инъекционных формах необходимы субстанции, содержащие молибден, которые полностью растворимы в воде. К таковым относятся, например, кристаллы молибдата аммония. Они пригодны для использования в лиофилизованном порошке и для приготовления раствора.
Кристаллы молибдата аммония в водных растворах подвергаются полному гидролизу. По этой причине данное вещество является наиболее удобным средством для приготовления инъекционных растворов.
В контексте настоящего изобретения могут также использоваться молибдаты щелочных и щелочно-земельных металлов, таких как, например, молибдат калия, натрия, кальция, магния.
Средство по настоящему изобретению включает хелат молибдена в относительном количестве от 0,1 мг/кг до 15 мг/кг в пересчете на массу активного вещества - хондроитина сульфата.
В частном варианте в относительном количестве от 0,2 мг/кг до 10 мг/кг, а также от 0,3 мг/кг до 8 мг/кг в пересчете на массу активного вещества.
В частном варианте в относительном количестве от 0,4 мг/кг до 6 мг/кг, а также от 0,5 мг/кг до 4 мг/кг, а также от 0,2 мг/кг до 2 мг/кг, а также от 0,15 мг/кг до 2 мг/кг, а также от 7 мг/кг до 10 мг/кг, а также от 4 мг/кг до 8 мг/кг в пересчете на массу активного вещества.
Предлагаемые концентрации хелата молибдена оказались оптимальными для решения поставленной задачи.
Количество хондроитина сульфата натрия в средстве может составлять от 50 мг до 2500 мг.
Количество хондроитина сульфата натрия в средстве может составлять от 100 мг до 2000 мг.
Количество хондроитина сульфата натрия в средстве может составлять от 300 мг до 1500 мг.
Количество хондроитина сульфата натрия в средстве может составлять от 500 мг до 1200 мг.
Количество хондроитина сульфата натрия в средстве может составлять от 50 мг до
250 мг.
Количество хондроитина сульфата натрия в средстве может составлять от 250 мг до 1000 мг.
Массовое соотношение хондроитина сульфата натрия к молибдену может составлять 1:1×10-7 - 1:1×10-5.
Средство по настоящему изобретению может быть изготовлено в жидкой или твердой форме.
Средство может быть использовано для перорального, инъекционного или местного применения.
Формы, предназначенные для местного применения, включают кремы, гели и мази.
Пероральные формы включают таблетки и капсулы.
Инъекционные формы включают лиофилизаты и инъекционные растворы.
Вспомогательные компоненты выбираются в зависимости от формы изготовления.
Средство, выполненное в форме крема, геля или мази, может содержать одно или более вспомогательных веществ, выбранных из группы: диметилсульфоксид; пропиленгликоль; карбомер; троламин; макрогол; эдетат; масла нероли и лаванды; ланолин; вазелин.
Средство, выполненное в форме таблетки, может дополнительно содержать глюкозамина гидрохлорид.
В частном варианте реализации соотношение хондроитина сульфат натрия к глюкозамина гидрохлориду в таблетке составляет 1:1.
Таблетка дополнительно может содержать следующие вспомогательные вещества, взятые по отношению к хондроитина сульфату натрия: кальция сульфат двузамещенный -1:0,46, целлюлозу микрокристаллическую - 1:0,37 мг, натрия кроскармеллозу - 1:0,16, стеариновую кислоту - 1:0,14, магния стеарат - 1:0,02.
В частном варианте реализации таблетка может быть покрыта пленочной оболочкой, в этом случае оболочка таблетки имеет следующий состав, взятый по отношению к хондроитина сульфату натрия: гидроксипропилметилцеллюлоза - 1:0,07, титана диоксид (Е171) - 1:0,016, триацетин - 1:0,014 мг.
Средство, выполненное в форме капсулы, может дополнительно содержать вспомогательные вещества, выбранные из группы: тальк, стеариновая кислота, магния стеарат, марганца сульфат
Состав оболочки капсулы может включать диоксид титана и желатин.
Средство, выполненное в форме раствора, содержит в своем составе воду.
Конкретнее, средство содержит в своем составе дистиллированную или апирогенную воду.
Готовое средство может включать в своем составе некоторое количество консервантов, таких как бензиловый спирт и бензоат натрия или аналогичные.
Конкретные соотношения компонентов определяются формой изготовления и степенью тяжести заболевания.
Заявленное средство предназначено для лечения артрологических заболеваний.
К таким заболеваниям относятся дегенеративно-дистрофические заболевания суставов и позвоночника: остеоартроз периферических суставов; межпозвонковый остеохондроз и остеоартроз, ревматоидный артрит, подагра, реактивный артрит, спондилоартропатии, артрит при системной красной волчанке, дерматомиозите и других системных болезнях, псориатический артрит, постравматические повреждения суставного хряща, связок, менисков.
Список изображений:
Фиг. 1: рентгенограмма коленных суставов кроликов I и V групп;
Фиг 2: рентгенограмма коленных суставов кроликов, получавших внутрисуставно в правый (П) сустав папаин и препараты А и Б. Левый (Л) сустав интактный;
Фиг. 3: показана рентгенограмма коленных суставов кроликов IV группы, получавших внутрисуставно папаин и контрольный препарат (сравнения) в правый (П) сустав;
Фиг. 4: суставной хрящ коленного сустава кролика I группы;
Фиг. 5: синовиальная оболочка правого коленного сустава кролика I группы;
Фиг. 6: показан суставной хрящ коленного сустава кролика после внутримышечного введения Препарата А, Препарата Б, физраствора (В).
Осуществление изобретения
Ниже приведены примеры приготовления различных лекарственных препаратов на основе заявленных средств хондроитин сульфата.
Пример 1
Препарат в виде геля, включающий хондроитин сульфат натрия, воду очищенную, и который дополнительно содержит хелат молибдена от 0,10 мг/кг до 15 мг/кг, может быть получен с использованием различных вспомогательные веществ.
1. Препарат в виде геля получают, сначала образуя раствор А: перемешав воду очищенную и карбомер, который берут в объеме 3% от общей массы. Затем образуют раствор Б: растворяя метилпарагидроксибензоат в этаноле, где этанол и метилпарагидроксибензоат берут в объеме 10% и 0,1% от общей массы, соответственно. Для получения раствора В смешивают при нагревании до температуры 65-75°С в воде очищенной (мас./об. %): 2 г хондроитина сульфата, диметилсульфоксид - 7,5; пропиленгликоль - 7,5; троламин (триэтаноламин) - 3; макрогола глицерилгидроксистеарат - 0,4; динатрия эдетат - 0,1. После чего растворы А, Б, В постоянно перемешивают в течение нескольких часов до образования гелевой массы, добавляя молибдат аммония 0,0005% от общей массы от общей массы. При необходимости добавляют ароматизаторы (мас./об. %): лаванды масло - 0,1; апельсина цветков масло (нероли масло) - 0,05. Полученная готовая композиция препарата в форме геля содержит (мас./об.%): хондроитина сульфата - 5; этанол - 10; диметилсульфоксид - 7,5; пропиленгликоль - 7,5; карбомер - 3; троламин (триэтаноламин) - 3; макрогола глицерилгидроксистеарат - 0,4; динатрия эдетат - 0,1; метилпарагидроксибензоат (метилпарабен, нипагин) - 0,1; лаванды масло - 0,1; апельсина цветков масло (нероли масло) - 0,05; молибдат аммония - 0,0005; вода очищенная - остальное до 100.
2. Раствор А получают добавлением на 120 мл воды очищенной 10 г карбомера с последующим перемешиванием. Для получения раствора Б в 60 г этанола растворяют 0,2 г метилпарагидроксибензоата. Раствор В получают перемешиванием при нагревании до температуры 70°С в 181,6 мл воды очищенной, 2 г хондроитина сульфата, 2 г глюкозамина сульфата, 4 г метилсульфонилметана, 0,04 г натрия метабисульфита, 20 г. пропиленгликоля. После чего растворы А, Б, В постоянно перемешивают в течение нескольких часов до образования гелевой массы, добавляя молибдат аммония 0,0002% от общей массы. При необходимости добавляют отдушку в количестве 0,2 г. Полученная готовая композиция препарата в форме геля содержит (мас./об. %): хондроитина сульфата - 5; глюкозамина сульфат - 0, 5; метилсульфонилметан - 1,0; натрия метабисульфит - 0,01; метилпарагидроксибензоат - 0,05; пропиленгликоль - 5,0; этанол - 15,0; карбомер - 2,5; отдушка - 0,05; молибдат аммония - 0,0002; вода очищенная - остальное до 100.
Пример 2
Препарат в виде мази, включающий хондроитина сульфат натрия, воду очищенную, и который дополнительно содержит молибден от 0,1 мг/кг до 15 мг/кг, также может быть получен с использованием различных вспомогательные веществ.
1. Вазелин медицинский в количестве 37 мас. %, ланолин безводный в количестве 15 мас. %, кислоту стеариновую в количестве 3 мас. %, пентол в количестве 5 мас. % расплавляют при температуре (70±2)°С, перемешивают, затем охлаждают до температуры (55±2)°С (мазевая основа). Хондроитина сульфат в количестве 5 мас. % растворяют в 20 мас. % дистиллированной воды. Диклофенак натрия в количестве 5 мас. % растворяют в 10 мас. % диметилсульфоксида. В растворы диклофенака натрия в диметилсульфоксиде и хондроитин сульфата в воде при перемешивании, добавляя молибдат аммония 0,00005% от общей массы, полученную субстанцию прибавляют к мазевой основе, гомогенизируют, а затем передают на фасовку. Получают готовую мазь, имеющую состав (мас./об. %): хондроитина сульфат натрия (в пересчете на сухое вещество) - 5; диметилсульфоксид - 10; диклофенак натрия - 5; ланолин - 0,15; вазелин - 0,5; молибдат аммония - 0,00005; вода очищенная - остальное до 100.
2. Вазелин медицинский в количестве 37 мас. %, ланолин безводный в количестве 15 мас. %, кислоту стеариновую в количестве 3 мас. %, пентол в количестве 5 мас. % расплавляют при температуре (70±2)°С, перемешивают, затем охлаждают до температуры (55±2)°С (мазевая основа). Хондроитин сульфат в количестве 5 мас. % растворяют в 20 мас. % дистиллированной воды. Диклофенак натрия в количестве 5 мас. % растворяют в 10 мас. % диметилсульфоксида. В растворы диклофенака натрия в диметилсульфоксиде и хондроитин сульфата в воде при перемешивании добавляя молибдат аммония до 0,0002% от общей массы, полученную субстанцию прибавляют к мазевой основе, гомогенизируют, а затем передают на фасовку. Получают готовую мазь, имеющую состав (мас./об. %): хондроитина сульфат натрия (в пересчете на сухое вещество) - 5; диметилсульфоксид - 10; диклофенак натрия - 5; ланолин - 0,15; вазелин - 0,5; молибдат аммония - 0,0002; вода очищенная - остальное до 100.
Пример 3
Препарат содержит 95-120 мг лиофилизованного порошка Na-соли хондроитина сульфата, который получен из растворенной в апирогенной инъекционной воде натриевой соли хондроитина сульфата.
Приготовленный из указанного лиофилизата раствор для инъекций с использованием апирогенной воды содержит Na-соль хондроитина сульфата в терапевтической дозировке 9,0-11,5, мас. %.
Препарат может быть получен, например, следующим способом.
Субстанцию с содержанием натриевой соли хондроитина сульфата 96,2-97,1% растворяют в 1000 мл апирогенной инъекционной воды, устанавливают рН от 6,0 до 7,5 раствором гидроокиси натрия, после чего в отношении полученной смеси проводят процесс насыщения молибдатом аммония до уровня 0,01-1,0 мг/л смеси, затем осуществляют стерилизующую фильтрацию, разливают в ампулы по 1 мл и осуществляют сублимацию известным способом, ампулы с лиофилизованным лекарственный средством запаивают.
1. 104 г субстанции с содержанием натриевой соли хондроитина сульфата 96,2% растворяют в 1000 мл апирогенной инъекционной воды, устанавливают рН от 6,0 до 7,5 раствором гидроокиси натрия. После чего в отношении полученной смеси проводят процесс насыщения молибдатом аммония до уровня 0,10 мг/л смеси. Затем проводят процесс стерилизующей фильтрации, разливают в ампулы по 1 мл и осуществляют сублимацию известным способом. Ампулы с лиофилизованным лекарственный средством запаивают. Получают 103 мг лиофилизованного порошка в 1 ампуле, что соответствует 99,7 мг натриевой соли хондроитина сульфата, остаточная влага - остальное, что при растворении в 1 мл инъекционной воды даст раствор с содержанием активного вещества 9,97%.
2. 103 г субстанции с содержанием натриевой соли хондроитина сульфата 96,2% растворяют в 1000 мл апирогенной инъекционной воды, устанавливают рН от 6,0 до 7,5 раствором гидроокиси натрия. После чего в отношении полученной смеси проводят процесс насыщения молибдатом аммония до уровня 0,50 мг/л смеси. Затем проводят процесс стерилизующей фильтрации, разливают в ампулы по 1 мл и осуществляют сублимацию известным способом. Ампулы с лиофилизованным лекарственным средством запаивают. Получают 102 мг лиофилизованного порошка в 1 ампуле, что соответствует 99,7 мг натриевой соли хондроитина сульфата, остаточная влага - остальное, что при растворении в 1 мл инъекционной воды даст раствор с содержанием активного вещества 9,97%.
Пример 4
Таблетка, содержащая хондроитина сульфат. Композиция в виде таблетки может быть изготовлена следующим образом: взвешенные хондроитина сульфат натрия, глюкозамина гидрохлорид в соотношении 1:1, хелат молибдена от 0,10 мг/кг до 10 мг/кг перемешивают в смесителе барабанного типа. Полученную смесь формуют и прессуют, затем сушат до необходимой остаточной влажности и калибруют. Затем заключают в твердые оболочку, которая может иметь состав, взятый по отношению к хондроитина сульфату натрия: гидроксипропилметилцеллюлоза - 1:0,07, титана диоксид (Е171) -1:0,016, триацетин - 1:0,014 мг. Также, таблетка дополнительно может содержать вспомогательные вещества, взятые по отношению к хондроитина сульфату натрия: кальция сульфат двузамещенный - 1:0,46, целлюлозу микрокристаллическую - 1:0,37 мг, натрия кроскармеллозу - 1:0,16, стеариновую кислоту - 1:0,14, магния стеарат - 1:0,02.
1. Таблетка, содержащая хондроитина сульфат. Композиция в виде таблетки может быть изготовлена следующим образом: взвешенные хондроитина сульфат натрия 250 мг, молибдат натрия - 0,6 мг/кг; кальция стеарат 1:0,019; кросповидон 1:0,05; повидон-К30 1:0,04; целлюлоза микрокристаллическая 1:0,38; магния гидрокарбоната пентагидрат 1:0,429 перемешивают в смесителе барабанного типа. Полученную смесь формуют и прессуют, затем сушат до необходимой остаточной влажности и калибруют.
2. Таблетка, содержащая хондроитина сульфат и глюкозамина гидрохлорид. Композиция в виде таблетки, покрытой оболочкой, может быть изготовлена следующим образом: хондроитина сульфат натрия, глюкозамина гидрохлорид в соотношении 1:1,25; молибдат натрия - 0,2 мг/кг; метилсульфонил метан 1:0,75. Могут быть также добавлены: целлюлоза - 1:0,50; кальция гидрофосфат дигидрата - 1:0,3; стеариновая кислота - 1:0,18; кроскармеллоза натрия - 1:0,125; магния стеарат - 1:0,025; кремния диоксид коллоидной - 1:0,01. Полученную смесь формуют и прессуют, затем сушат до необходимой остаточной влажности и калибруют. Далее заключают в оболочку, которая может иметь следующий состав, взятый в соотношении к количеству хондроитина сульфата: гипромеллоза - 1:0,04; полидекстроза. - 1:0,02; титана диоксид - 1:0,0001; тальк - 1:0,02; мальтодекстрин - 1:0,0117; триглицериды - 1:0,0015; Е110 - 1:0,0023.
Представленные выше примеры показывают, что приготовление препаратов может быть реализовано с использованием различных вспомогательные веществ, не влияющих на конечный результат, поскольку функциональная роль средства для лечения артрологических заболеваний и достижения заявленного технического результата определяется действующим веществом на основе хондроитина сульфата натрия, к которому дополнительно вносят молибден от 0,1 мг/кг до 10 мг/кг.
Проводился микробиологический контроль контаминации в твердой форме. В частности, после 6 месяцев и 12 месяцев хранения готовой формы не было выявлено никаких существенных изменений.
Пример 5
Эффективность препаратов хондроитина сульфата.
1. Эффективность средств в виде геля или мази, включающих ХС натрия, воду очищенную, хелат молибдена от 0,1 мг/кг до 10 мг/кг проверялась на кроликах.
Исследованные образцы наносили на животных за несколько раз. Активность оценивали на модели деструкции, которую вызывали 6-ти кратными инъекциями папаина с интервалом в 5 дней в полость правого коленного сустава в дозе 50 мг на инъекцию (1 мл 5% раствора) - I, II, III, IV, V группы по 10 кроликов в каждой.
Подопытным животным на коленный сустав с легким растиранием ежедневно в течение 15 дней наносили:
для I и II групп - исследованные образцы мази (концентрация молибдата аммония 0,04 мг/л) и геля (концентрация молибдата аммония 0,1 мг/л), соответственно,
для III группы - мазь хондроитина сульфата, не содержащая молибдена.
для IV группы - раствор молибдата аммония 0,1 мг/л.
для контрольной V группы - изотонический раствор натрия хлорида.
Выраженность отека оценивали, измеряя его толщину до и после введения папаина.
При накожном нанесении в I, II, III группах спустя 15 дней отмечалось уменьшение выраженности отеков коленного сустава в сравнении с контрольными группами в 1,9 раза.
Выраженный противовоспалительный эффект от применения исследуемых согласно изобретению средств (мази и геля) и мази, не содержащей молибден, наблюдался в I, II, III группах и не проявлялся в контрольных группах IV, V.
При более длительном наблюдении было отмечено, что у I, II групп проявлялась более активная регенерация, чем в III группе.
В частности, из 10 кроликов каждой из I, II, III групп у 9 из 10 в I группе, у 8 из 10 во II группе спустя 35 дней фиксировали полную регенерацию костной ткани, а у III группы только 6 из 10.
2. Эффективность инъекционных форм
Была исследована эффективность предназначенных для инъекционного введения аналогичных форм ХС, содержащих молибден, и сравнение их с влиянием инъекций препарата ХС, не содержащего молибден.
А именно использовали средства:
A) Средство для лечения артрологических заболеваний, представляющее собой препарат в виде лиофилизованного порошка Na-соли хондроитина сульфата и остаточной влаги, содержащий молибдат аммония 0,1 мг/мл
Б) Средство для лечения артрологических заболеваний, представляющее собой препарат в форме раствора для внутримышечного введения, включающий Na-соль хондроитина сульфата, воду очищенную, содержащий молибдат аммония 0,2 мг/мл.
B) Контрольный препарат: Средство для лечения артрологических заболеваний, представляющее собой препарат в форме раствора для внутримышечного введения, включающий Na-соль хондроитина сульфата, воду очищенную.
При этом проверяемый инъекционный раствор готовился однократно, хранился в стандартных условиях и вводился, в том числе после хранения. Так препарат вводился после 12 и 25 недель хранения. При этом по результатам биохимического исследования компонентов соединительной ткани посредством спектрофотометрии какого-либо отличия при применении препарата непосредственно после его изготовления и после его хранения (в стандартных условиях в течение 12 и 25 недель) не было установлено. Методы контроля применялись стандартные.
Исследование препаратов А и Б проверялась на 70 белых крысах разного пола и начальной массой 250-300 г. Животные были разделены на 5 групп по 14 голов в каждой.
Препарат по А и Б вариантам изобретения вводили внутримышечно в дозах 0,25 и 0,5 г/кг и внутривенно в дозах 0,1 и 0,25 г/кг.
Использовали опытные серии лекарственной формы препарата. По варианту А раствор для введения готовили на основе лиофилизованного порошка, полученного согласно заявленного изобретения.
Контрольные животные получали препарат сравнения в тех же дозах внутривенно и внутримышечно.
Влияние препарата на течение воспалительного процесса оценивали по изменению величины воспалительного отека конечности (онкометрически), по содержанию в крови лейкоцитов и эозинофилов.
Прочность кожного рубца у крыс оценивали по двум показателям - силе, вызывающей разрыв рубца и относительному разрывному удлинению, характеризующего эластичность ткани.
Влияние препаратов на заживление ран изучали на модели плоскокостной кожной раны.
Патоморфологические и гистохимические исследования суставов проводили случайным образом.
Материал (синовиальная оболочка, суставной хрящ коленного сустава) фиксировали, заливали в парафин, окрашивали гематоксилин-эозином, определяли суммарные ГАГ сафранином-Т. для раздельного выявления ХС применяли окраску альциановым синим на ацетатном буфере (рН-5,8) с различным содержанием MgCl2 (0,4М MgCl2 при реакции на ХС).
Содержание ГАГ оценивали визуально в баллах. Так, отсутствие окрашивания сафранином рассматривали как субпороговое (минимальное) для данного красителя (-). Содержание ГАГ очаговое, светло-красное окрашивание - как низкое содержание ГАГ (+), диффузное светло-красное - как умеренное (++), диффузное ярко-красное - явно выраженное (+++). Отсутствие окрашивания альциановым синим - (-), бледно-голубое окрашивание - как низкое (+), голубое - как умеренное (++), ярко-голубое - как значительное (+++).
Деструкцию вызывали 6-ти кратными инъекциями папаина.
Крысам I, II, III, IV групп внутривенно вводили папаин по 10 мг/кг (1% раствор) - 4 инъекции с интервалом 3-4 дня.
Животные V (контрольной) группы получали в те же сроки физиологический раствор.
Через сутки после последней инъекции папаина крысам II группы начинали вводить внутримышечно препарат А по 0,5 мл ежедневно в течение месяца. Крысы III группы в те же сроки получали внутримышечно препарат Б по 0,5 мл. Крысы IV группы в те же сроки получали внутримышечно контрольный препарат по 0,5 мл.
По окончании опыта крыс забивали. Реберные хрящи отсепаровывали, очищали от мягких тканей, сушили ацетоном и в них определяли суммарное содержание ГАГ по методу Косягина Д.В. [Косягин Д.В. - "Вопросы медицинской химии", 1982 г., 28, 4, 68-71 с.].
Результаты исследований показали, что при введении папаина содержание ГАГ в реберных хрящах крыс несколько снижается. По норме оно равно 14,25±2,7 мг уроновой кислоты на г сухой ткани, то у нелеченых крыс I группы снижение ГАГ составляло 15% (12,11±2,4 мг/г).
При введении Препарата Б содержание ГАГ увеличивалось и было выше нормы до уровня 17,98±3,16 мг/г.
У крыс, получавших Препарат А содержание ГАГ также оказалось выше, чем у контрольных животных (18,54±3,01 мг/г).
У крыс, получавших контрольный препарат, содержание ГАГ также оказалось выше, чем у контрольных животных (17,20±3,12 мг/г).
Таким образом, результаты экспериментов на крысах показали, что Препарат А и Препарат Б оказывают хондропротективное действие при поражении хрящевой ткани папаином, симулируя накопление ГАГ в реберных хрящах крыс лучше, чем контрольный препарат.
Оценка влияния препаратов на деструктивные изменения сустава у кроликов.
В опытах использовали 35 кроликов самцов породы шиншилла с массой 2,1-2,6 кг. Деструкцию вызывали 6-ти кратными инъекциями папаина с интервалом в 5 дней в полость правого коленного сустава в дозе 50 мг на инъекцию (1 мл 5% раствора) - I, II, III, IV группы по 7 кроликов в каждой. Кроликам 5 группы производилось внутрисуставное введение по 1,0 мл физиологического раствора после которого фиксировался естественный прирост окружности сустава, внутрисуставно вводили по 1,0 мл физиологического раствора - V группа (7 кроликов).
В течение 2 месяцев кроликам I группы вводили физиологический раствор, II группе - Препарат А по 1,0 мл 3 раза в неделю, III группе - Препарат Б по 1,0 мл 3 раза в неделю, IV группе (контроль) - по 1,0 мл препарата сравнения.
Препараты вводили внутримышечно. Таким образом изучали хондропротективное действие Препаратов А и Б и контрольного препарата, чтобы оценить лечебный эффект от влияния комплекса молибден + ХС и сравнить его с препаратом на основе ХС (Мукосат), также доказавшим эффективность.
Окружность отека сустава после инъекций папаина увеличивалась. К концу второго месяца эксперимента окружность сустава у кроликов I группы (без лечения) была увеличена значительно (более 18 мм). У групп II, III, получавших Препараты А и Б, отек был немного меньшим - 6,4±1,3 мм и 6,2±1Д мм, соответственно, по сравнению с IV группой, которым вводили препарат сравнения (8,2±1,5).
У кроликов I группы, получавших только папаин, к завершению 2 месяца содержание ГАГ составило 13,01 мг/мл, что указывало на деструкцию хрящевой ткани. У животных, леченных Препаратами А, Б и контрольным, уровень ГАГ был 6,72 мг/мл, 7,04 мг/мл и 7,86 мг/мл, соответственно, из чего был сделан вывод о выраженности деструктивных процессов меньшей степенью. Состояние V группы было выражено в пределах прироста 3,08 мг/мл.
Патологические изменения суставов кроликов I группы (без лечения) зафиксированы при рентгенологическом исследовании.
На Фиг. 1 показана рентгенограмма коленных суставов кроликов I и V групп (двухмесячный опыт). Инъекции в правый (П) сустав. Левый (Л) интактный.
А - Кролик №1 - V группа. Раствор ХС. Оба сустава без изменений.
Б - Кролик №2 - I группа без лечения (внутрисуставно папаин); П - признаки артрито-артроза, деструктивные изменения в мыщелках бедренной кости; Л - без изменений.
В - Кролик №3 - I группа без лечения (внутрисуставно папаин); П-синовит; Л - без изменений.
На Фиг. 2 показана рентгенограмма коленных суставов кроликов, получавших внутрисуставно в правый (П) сустав папаин и препараты А и Б. Левый (Л) сустав интактный. Опыт 2 месяца.
А. кролик №4 - II группа. Оба сустава без изменений.
Б. Кролик №5 - IV группа. Оба сустава без изменений.
На Фиг. 3 показана рентгенограмма коленных суставов кроликов IV группы, получавших внутрисуставно папаин и контрольный препарат (сравнения) в правый (П) сустав. Левый сустав (Л) интактный. Опыт 2 месяца.
А. Кролик №6 - П - артрит, остеопороз; Л - без изменений.
Б. Кролик №7 - оба сустава без изменений.
Общие данные по результатам наблюдений к окончанию 2 месяца сведены в Таблицу 1.

Из них видно, что у I группы деструктивные изменения сохранились ко 2 месяцу у каждого кролика. Большинство кроликов данной группы имело выраженные комплексные признаки артрито-артроза и артрита-остеопороза.
У II и III групп, получавших Препараты А и Б только у 1 кролика из III группы были выявлены признаки артрита. У кроликов IV группы, получавших внутрисуставно папаин и внутримышечно препарат, тоже наблюдался хороший лечебный эффект, и только у 2 кроликов наблюдался артрит и остеопороз одновременно. Все остальные кролики II, III, IV групп изменения в суставах не выявили.
По результатам исследования можно сделать вывод о том, что введение Препаратов А и Б предупредило развитие патологических изменений суставов, как и использование контрольного препарата сравнения, но эффект Препаратов А и Б выражен лучше, чем у контрольного на основе ХС.
Положительный эффект от действия Препаратов А и Б подтвердился и при патоморфологических исследованиях.
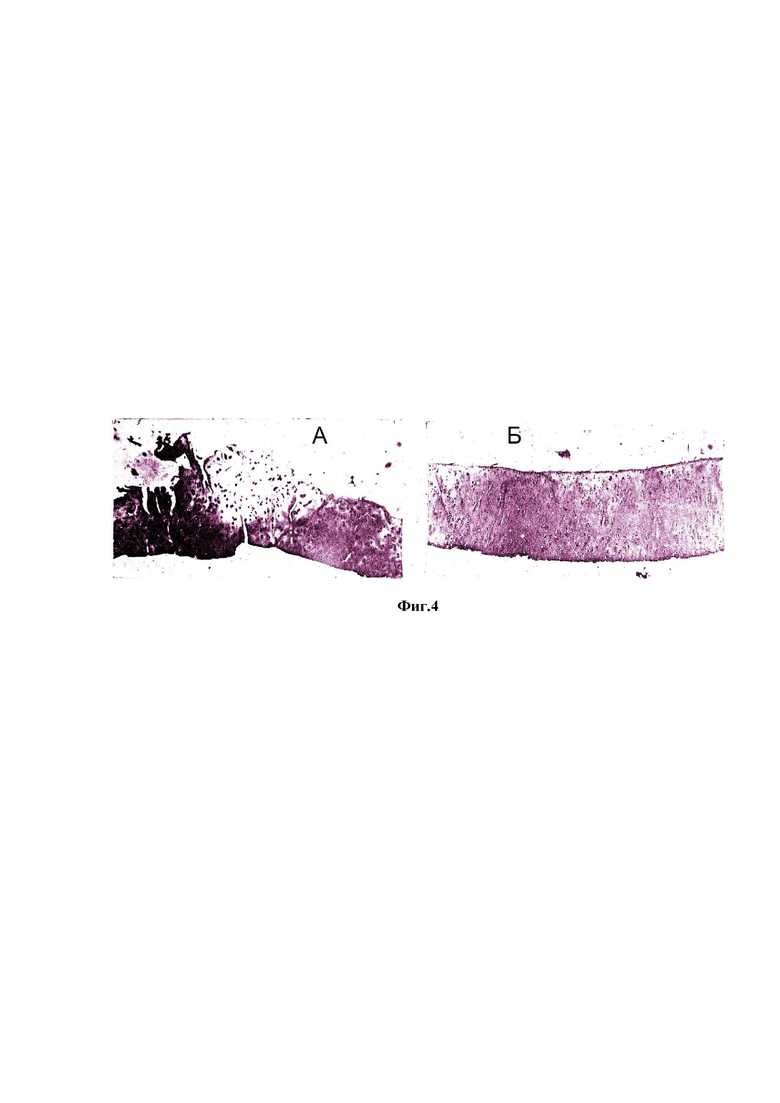
Аутопсия кроликов I группы показала наличие у каждого из них в правом суставе явно выраженные признаки деструкции суставного хряща (см. Фиг. 4 и Фиг. 5).
На Фиг. 4 показан суставной хрящ коленного сустава кролика I группы.
А. После внутрисуставного введения раствора папаина. Видны узуры, проникающие до середины промежуточного слоя. Пролиферация хондроцитов чередуется с участками опустошения. Отмечается уменьшение ГАГ. Окраска сафранином - Т. 10x6,3.
Б. Контроль. Гистологическое строение хряща сохранено. Количество ГАГ нормальное. Окраска сафранином - Т. 10x6,3.
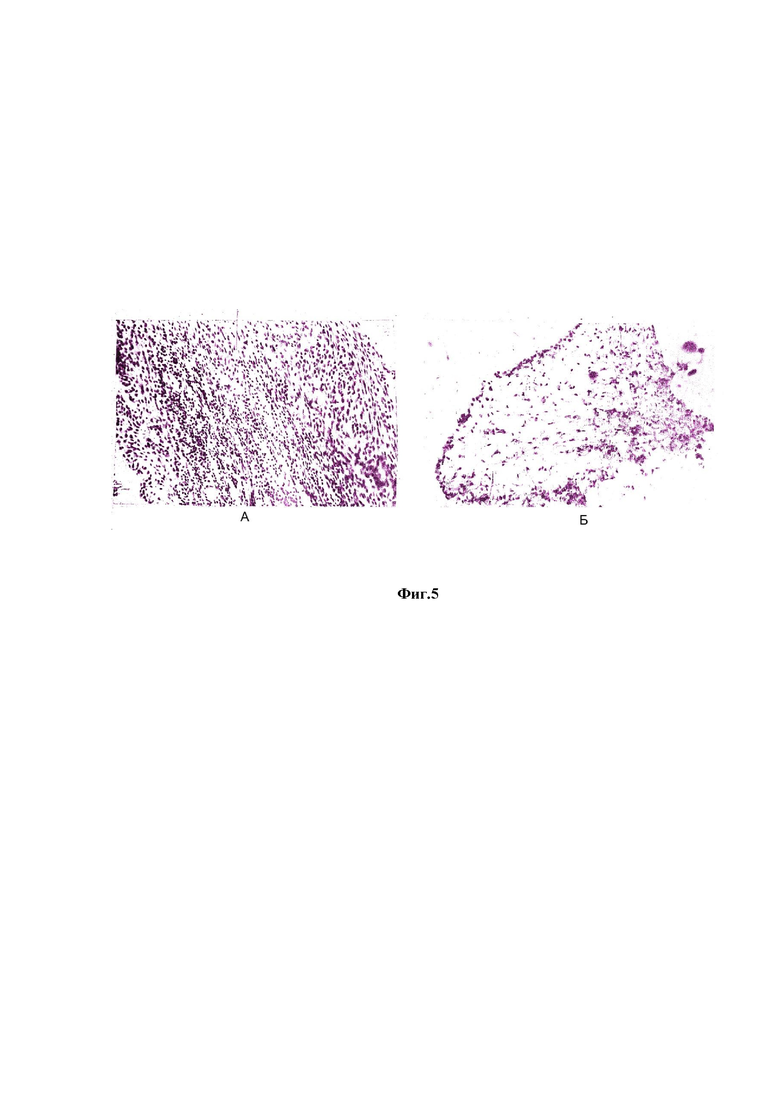
На Фиг. 5 показана синовиальная оболочка правого коленного сустава кролика I группы.
А - после внутрисуставного введения папаина. Выраженная гиперплазия синоиальной оболочки, синовиоциты крупные, расположены рыхло, формируют 5-5 слоев. В субсиновиальном слое видна пролиферация гистицитов, фибробластов и диффузная крупноочаговая плазмоцитарная инфильтрация. Гем.-эозин 25x6,3. Б - контроль - нормальное строение.
При аутопсии кроликов II, III (см. Фиг. 6) поверхность суставного хряща была гладкой, блестящей.
На Фиг. 6 показан суставной хрящ коленного сустава кролика после внутримышечного введения Препарата А, Препарата Б, физраствора (В).
На А и Б видна усиленная пролиферация хондроцитов со значительным увеличением ГАГ в матриксе.
В. Гистологическое строение сохранено. V группа. Сафранин - Т 25x6,6.
У 2 кроликов IV группы, получавших одновременно с папаином внутримышечно контрольный Мукосат, выявлено малое количество серозного экссудата в полости сустава. И все кролики данной группы имели поверхность гладкую и блестящую поверхность суставного хряща.
Данные исследования показывают, что препараты А и Б, оказывают наилучший эффект в отношении регенерации костных тканей при этом биохимически и иммунологически у указанных групп животных не было зафиксировано покраснений в месте инъекций, проявлений аллергических реакций и иных побочных эффектов. Исследования на использованной модели могут с известной достоверностью быть использованы для вывода о действии в отношении организма человека.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ АРТРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2020 |
|
RU2739184C1 |
| ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ АРТРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2020 |
|
RU2739747C1 |
| ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ АРТРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2023 |
|
RU2813891C1 |
| ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ АРТРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2024 |
|
RU2835423C1 |
| КОМБИНИРОВАННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ АРТРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2024 |
|
RU2827069C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ АРТРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ В ЛИОФИЛИЗИРОВАННОЙ ФОРМЕ ДЛЯ ИНЪЕКЦИЙ | 2024 |
|
RU2827073C1 |
| ПРИМЕНЕНИЕ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ АРТРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2024 |
|
RU2840197C1 |
| ЛИОФИЛИЗИРОВАННАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРИГОТОВЛЕНИЯ РАСТВОРА ДЛЯ ИНЪЕКЦИЙ ДЛЯ ЛЕЧЕНИЯ ДЕГЕНЕРАТИВНО-ДИСТРОФИЧЕСКИХ ЗАБОЛЕВАНИЙ ОПОРНО-ДВИГАТЕЛЬНОГО АППАРАТА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2011 |
|
RU2458693C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНЕЙ СУСТАВОВ | 2005 |
|
RU2282437C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНЕЙ СУСТАВОВ | 2005 |
|
RU2275190C1 |




Изобретение относится к фармацевтической промышленности, а именно к средству для лечения артрологических заболеваний. Средство для лечения артрологических заболеваний, включающее от 50 до 2500 мг хондроитина сульфата натрия и по меньшей мере одно вспомогательное вещество или носитель, также содержит молибден в относительном количестве от 0,15 до 2 мг/кг в пересчете на массу хондроитина сульфата натрия. Вышеописанное средство позволяет повысить биодоступность препаратов хондроитина сульфата в различных формах за счет использования его в комбинации с молибденом, а также позволяет сократить курс лечения и снизить негативные побочные эффекты. 22 з.п. ф-лы, 5 пр., 1 табл., 6 ил.
1. Средство для лечения артрологических заболеваний, включающее от 50 до 2500 мг хондроитина сульфата натрия и по меньшей мере одно вспомогательное вещество или носитель, отличающееся тем, что дополнительно содержит молибден в относительном количестве от 0,15 до 2 мг/кг в пересчете на массу хондроитина сульфата натрия.
2. Средство по п.1, в котором молибден представляет собой хелат молибдена.
3. Средство по п.1, в котором хелат молибдена, выбран из группы молибдата аммония или молибдата натрия.
4. Средство по п.1, в котором количество хондроитина сульфата натрия составляет от 100 до 2000 мг.
5. Средство по п.1, в котором количество хондроитина сульфата натрия составляет от 300 до 1500 мг.
6. Средство по п.1, в котором количество хондроитина сульфата натрия составляет от 500 до 1200 мг.
7. Средство по п.1, в котором количество хондроитина сульфата натрия составляет от 50 мг до 250 мг.
8. Средство по п.1, в котором количество хондроитина сульфата натрия составляет от 250 до 1000 мг.
9. Средство по п.1, в котором массовое соотношение хондроитина сульфата натрия к молибдену составляет 1:(1×10-7 - 1×10-5).
10. Средство по п.1, отличающееся тем, что оно выполнено в форме мази, геля или крема.
11. Средство по п.1, отличающееся тем, что вспомогательное вещество выбрано из группы: диметилсульфоксид; пропиленгликоль; карбомер; троламин; макрогол; эдетат; масла нероли и лаванды; ланолин; вазелин.
12. Средство по п.1, отличающееся тем, что оно выполнено в форме таблетки или капсулы.
13. Средство по п. 12, отличающееся тем, что оно выполнено в форме таблетки, покрытой пленочной оболочкой.
14. Средство по п. 12, отличающееся тем, что таблетка дополнительно содержит вспомогательные вещества, взятые по отношению к хондроитина сульфату натрия: кальция сульфат двузамещенный - 1:0,46, целлюлозу микрокристаллическую - 1:0,37, натрия кроскармеллозу - 1:0,16, стеариновую кислоту - 1:0,14, магния стеарат - 1:0,02.
15. Средство по п. 12, отличающееся тем, что таблетка дополнительно содержит глюкозамина гидрохлорид, причем состав таблетки подобран таким образом, что соотношение хондроитина сульфат натрия к глюкозамина гидрохлориду составляет 1:1.
16. Средство по п. 13, отличающееся тем, что оболочка таблетки имеет состав, взятый по отношению к хондроитину сульфата натрия: гидроксипропилметилцеллюлоза - 1:0,07, титана диоксид (Е171) - 1:0,016, триацетин - 1:0,014.
17. Средство по п. 12, отличающееся тем, что состав оболочки капсулы состоит из диоксида титана и желатина.
18. Средство по п. 12, отличающееся тем, что капсула содержит одно или более из вспомогательных веществ: тальк, стеариновая кислота, магния стеарат, марганца сульфат.
19. Средство по п.1, отличающееся тем, что оно выполнено в форме лиофилизата.
20. Средство по п.1, отличающееся тем, что оно выполнено в форме раствора.
21. Средство по п.1, отличающееся тем, что раствор приготовлен растворением лиофилизата по п. 19.
22. Средство по п.1, отличающееся тем, что оно дополнительно содержит консервант.
23. Средство по п. 22, отличающееся тем, что в качестве консерванта используется бензиловый спирт или бензоат натрия.
| Source Naturals, Glucosamine Chondroitin Complex with MSM, 120 таблеток | |||
| Способ обработки медных солей нафтеновых кислот | 1923 |
|
SU30A1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ СУСТАВОВ И КОСТНЫХ ТКАНЕЙ | 2013 |
|
RU2547572C2 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ РЕГЕНЕРАТИВНОЙ АКТИВНОСТЬЮ | 1994 |
|
RU2080871C1 |
| КОМПОЗИЦИЯ ДЛЯ ЖЕВАТЕЛЬНОЙ РЕЗИНКИ С ЖИДКИМ НАПОЛНИТЕЛЕМ | 2007 |
|
RU2420088C2 |
| БИОЛОГИЧЕСКИ АКТИВНАЯ ДОБАВКА (ВАРИАНТЫ) | 2007 |
|
RU2352147C2 |
| ЛИОФИЛИЗИРОВАННАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРИГОТОВЛЕНИЯ РАСТВОРА ДЛЯ ИНЪЕКЦИЙ ДЛЯ ЛЕЧЕНИЯ ДЕГЕНЕРАТИВНО-ДИСТРОФИЧЕСКИХ ЗАБОЛЕВАНИЙ ОПОРНО-ДВИГАТЕЛЬНОГО АППАРАТА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2011 |
|
RU2458693C1 |
| US | |||
Авторы
Даты
2020-12-28—Публикация
2020-06-29—Подача