ТЕХНИЧЕСКАЯ ОБЛАСТЬ
Настоящее изобретение относится, главным образом, к области исследования злокачественной опухоли и, более конкретно, к идентификации новых связанных с образованием опухоли и метастазированием белков и генов. Изобретение относится к новому маркеру злокачественной опухоли. Кроме того, изобретение относится к области генной терапии.
УРОВЕНЬ ТЕХНИКИ
В 2005 году 7,6 миллионов человек по всему миру умерли от злокачественной опухоли из 58 миллионов смертей. Исходя из прогнозов, смертность от злокачественной опухоли продолжит расти, и, согласно оценке, в 2015 году от злокачественной опухоли погибнет 9 миллионов человек, и в 2030 году погибнет 11,4 миллионов человек (данные ВОЗ). Лечение злокачественной опухоли может вовлекать хирургическую операцию, лучевую терапию, химиотерапию, гормональную терапию или некоторые их комбинации, однако в настоящее время уровни выживания для большинства пациентов со злокачественной опухолью являются очень низкими. По данным Всемирной организации здравоохранения, одна треть случаев злокачественной опухоли может быть вылечена в случае ранней детекции и надлежащего лечения. Патологическое исследование является способом постановки диагноза в случае большинства солидных опухолей. Хотя многие случаи можно достоверно классифицировать с помощью современных патологических критериев, в значительной части случаев согласие не может быть достигнуто даже среди высококвалифицированных патологов. Диагностическая неточность имеет значительные неблагоприятные последствия для пациентов. Ошибочная классификация опухоли как доброкачественной может быть фатальной, и диагностика доброкачественного повреждения может привести к значительной смертности. В настоящее время не существует способа устранения этой неточности. Таким образом, существует очевидная необходимость в диагностическом тесте, который может снизить эту неточность.
Фагоцитоз представляет собой процесс, посредством которого клетки интернализуют большие частицы (как правило, диаметром 0,1 мм), такие как бактерии и клеточный дебрис. Ранняя стадия фагоцитоза может быть условно подразделена на отдельные стадии: окружение клеточной мембраной частицы, образование фагосомы и интернализацию фагосомы. Было предположено, что в процессе образования и интернализации фагосомы эти стадии запускает актиновый цитоскелет, обеспечивая поглощение.
Фагоцитарные клетки были идентифицированы в злокачественных опухолях вплоть до столетия назад, и позднее клетки с фагоцитарным поведением (также определенным как каннибалическое поведение) были выявлены в опухолях различной гистологии, таких как овсяно-клеточный рак легкого, рак молочной железы, рак мочевого пузыря, медуллобластома, аденокарциномы желудка, меланома и плоскоклеточная карцинома кожи.
Недавно авторы настоящего изобретения обнаружили, что фагоцитоз свойственен метастатическим клеткам меланомы, способным фагоцитировать апоптотические клетки, покрытые дрожжами пластмассовые гранулы и живые лимфоциты, обладающие эффективным фагоцитарным аппаратом, ответственным за подобную макрофагам активность, хотя клетки меланомы, происходящие из первичных очагов, не проявляли какой-либо каннибалической или фагоцитарной активности. Более того, каннибалические клетки могут выявляться в 100% метастатических очагов меланомы (Lugini et al., 2004; Lugini et al., 2006).
Одним из основных признаков каннибалических клеток является повышенная кислотность подобных лизосомам везикул и сверхэкспрессия катепсина B - протеолитического фермента, который, согласно сообщенным данным, вовлечен в инвазию и метастазирование опухоли (Sloane et al., 1981). В отличие от профессиональных подобных фагоцитам макрофагов, каннибалические опухолевые клетки не используют структуры, такие как выпячивания или какое-либо движение псевдоподий. Вместо этого, живой или погибший материал, который прикасается к наружной мембране опухолевой клетки, сразу подвергается эндоцитозу и расщепляется с помощью механизма по типу зыбучих песков, который, по-видимому, не вовлекает какой-либо специфический рецептор.
Эти данные привели авторов настоящего изобретения к предположению, что каннибалические клетки питаются другими клетками, возможно, без конкретной необходимости в доставке питательных веществ через кровь, но также что этот каннибализм опухолевых клеток в отношении лимфоцитов может представлять собой рудиментарный механизм избегания опухолью иммунного ответа. Более того, эти данные привели авторов настоящего изобретения к новым революционным выводам, заключающимся в том, что злокачественные клетки, с их особенностью использовать другие клетки для питания, могут вести себя как одноклеточные эукариоты, единственной целью которых является выживание в постоянной борьбе с другими клетками и неблагоприятным окружением. Это теория далее привела авторов настоящего изобретения к предположению, что амебы и метастатические клетки могут иметь одинаковую базовую структуру с одинаковыми регуляторными элементами, позволяющими им выживать в условиях неблагоприятного микроокружения. Однако до настоящего времени с каннибалическим поведением злокачественных клеток конкретно не ассоциировали никаких генов.
Клеточную слизистую плесень Dictyostelium discoideum ранее использовали в качестве модельного организма для исследования фагоцитоза. Механизмы, вовлеченные в фагоцитоз Dictyostelium cells, очень сходны с механизмами, используемыми фагоцитами млекопитающих, и вовлекают активновый цитоскелет и RacF1, представитель семейства Rho GTP-связывающих белков. Однако у млекопитающих не было когда-либо идентифицировано ассоциированных с фагоцитозом специфических белков.
Недавно было обнаружено, что белок, кодируемый геном PHG1A, вовлечен в клеточную адгезию и фагоцитоз у амебы Dictyostelium discoideum. Этот белок относится к суперсемейству TM9 и гены, кодирующие белки TM9, однозначно могут быть идентифицированы в эукариотических геномах. Это семейство включает многих представителей в организмах, варьирующих от дрожжей до растений и человека. В качестве примера, существует три представителя этого семейства в Saccharomyces cerevisiae, Dictyostelium amoebae и Drosophila flies и четыре у человека и мыши. Все из них обладают сходной общей структурой с вариабельным в некоторой степени потенциальным доменом просвета с последующим консервативным мембранным доменом и девятью или десятью предполагаемыми трансмембранными доменами.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Исходя из теории авторов настоящего изобретения, состоящей в том, что злокачественные клетки используют другие клетки для питания и ведут себя как одноклеточные эукариоты, и, возможно, обладают одинаковой с амебами каркасной областью с одинаковыми регуляторными элементами, авторы настоящего изобретения сравнили ген PHG1A с геномом человека. Было полностью отсеквенировано три гомолога phg1 у человека (TM9SF4, U81006 и U94831), и авторы настоящего изобретения выявили, что наиболее близким гомологом phg1 Dictyostelium dicoideum у человека является tm9sf4 (другие обозначения: KIAA0255, dJ836N17.2), расположенный на хромосоме 20q11.21. Хотя этот ген и является полностью отсеквенированным, его функция или продукт экспрессия еще не были охарактеризованы.
Таким образом, авторы настоящего изобретения исследовали функцию и экспрессию белка, кодируемого tm9sf4, более подробно. В этом описании, авторы настоящего изобретения описывают функцию белка и предоставляют ряд применений.
В этом описании показано, что указанный белок высоко экспрессируется в злокачественных клетках. Исследования нескольких клеточных линий меланомы, полученных от пациентов, показывают, что TM9SF4 является маркером злокачественности, поскольку этот белок не выявляется на клетках, полученных из первичных очагов. Более того, этот белок вовлечен в фагоцитарное поведение метастатических клеток меланомы, поскольку подавление гена, кодирующего этот белок, сильно ингибирует фагоцитарное поведение метастатических клеток. Исходя из этих наблюдений, авторы настоящего изобретения назвали этот белок TUCAP-1 (ассоциированный с опухолью каннибалический белок 1). Ген, кодирующий этот белок, в настоящем документе соответственно обозначают как ген tucap-1.
Настоящее изобретение направлено на необходимость в быстром тесте для детекции злокачественных клеток и диагностики меланомы и других опухолей. Таким образом, в этом описании предоставлены антитела, праймеры, олигопептиды и полипептиды, пригодные для детекции, анализа TUCAP-1 и его потенциальных терапевтических эффектов.
Настоящее изобретение относится к полинуклеотидам, соответствующим или комплементарным всему гену tucap-1 или его части, и полинуклеотидам или олигонуклеотидам, которые гибридизуются с геном tucap-1, мРНК, или с кодирующими TUCAP-1 полинуклеотидами. Предоставлены рекомбинантные молекулы ДНК, содержащие полинуклеотиды TUCAP-1, клетки, трансформированные или трансдуцированные такими молекулами, и системы хозяин-вектор для экспрессии продуктов гена tucap-1. Кроме того, в описании предоставлен белок TUCAP-1 и его полипептидные фрагменты.
Кроме того, изобретение относится к антителам, которые связываются с белками TUCAP-1 и их полипептидными фрагментами, включая поликлональные и моноклональные антитела, антитела мыши и других млекопитающих, химерные антитела, гуманизированные и полностью человеческие антитела, и антитела, меченные поддающимся детекции маркером, и антитела, конъюгированные с радионуклидами, токсинами или другими терапевтическими композициями. Кроме того, изобретение относится к способам детекции наличия полинуклеотидов и белков TUCAP-1 в различных биологических образцах, а также к способам идентификации клеток, которые экспрессируют TUCAP-1.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1. Молекулярная структура белка TM9SF4/TUCAP-1.
(A) Профиль гидрофобности белковой последовательности TUCAP-1. Гидрофобные области указаны выше линии положительными значениями. На оси абсцисс указана нумерация аминокислот. За гидрофильным участком в N-концевой области следуют девять гидрофобных областей. Анализ проводили согласно Claros и von Heijneb с использованием программы для предсказания TopPred.
(B) Графическое представление вторичной структуры TUCAP-1 согласно предсказывающему серверу TopPred.
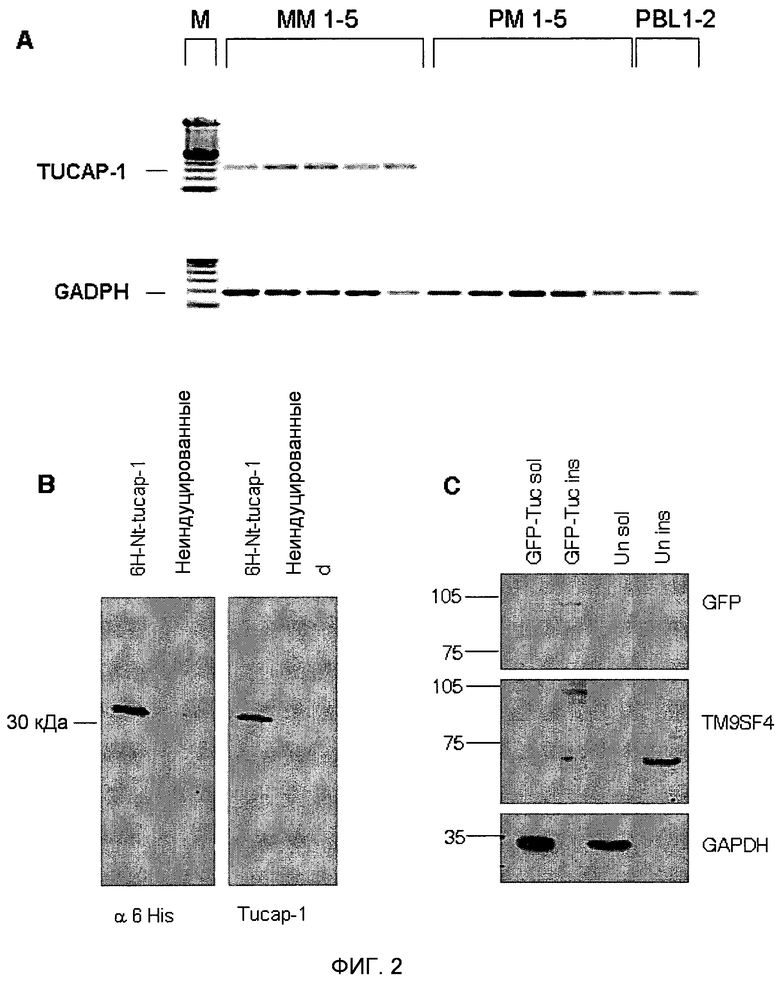
Фигура 2. Детекция транскриптов TM9SF4/TUCAP-1 и охарактеризовывание антител против TUCAP-1.
(A) Анализ ОТ-ПЦР TUCAP-1 (верхняя панель) и GAPDH (нижняя панель) на пяти метастатических клеточных линиях (MM1-5) и пяти клеточных линиях первичной меланомы (PM1-5), незадолго до этого полученных in vitro из метастатического очага, и клетках периферической крови от двух различных доноров (PBL1-2); M маркер размера.
(B) Вестерн-блоты для 6-гистидина или TUCAP-1 в меченном шестью остатками гистидина пептиде TUCAP-1, использованном для иммунизации мышей, и в неиндуцированных бактериальных лизатах. Равные количества очищенного белка и бактериального лизата наносили на восстанавливающие гели и подвергали блоттингу с антителом против 6-His или антисывороткой мышей против TUCAP-1. Белки визуализировали с использованием конъюгированных с HRP вторичных антител и выявляли с помощью системы ECL (Pierce).
(C) Вестерн-блоттинг для GFP-TUCAP-1 и GAPDH на растворимых в Triton (дорожка 1) и нерастворимых в Triton (дорожка 2) фракциях трансфицированных посредством GFP-TUCAP-1 (GFP-Tuc) клеток MM1, и растворимых и нерастворимых в Triton фракциях нетрансфицированных клеток MM1 (дорожки 3-4). M - маркер размера. Белки визуализировали с использованием конъюгированных с HRP вторичных антител и выявляли с помощью ECL (Pierce). В качестве маркеров молекулярной массы использовали предварительно окрашенные стандарты RainbowTM (Amersham UK).
Фигура 3. Вестерн-блот-анализ TUCAP-1.
Вестерн-блоттинг для детекции TUCAP-1 на трансфицированных GFP-Tuc клетках MM2, четырех метастатических клеточных линиях меланомы (MM2-5), и фибробластах кожи человека CCD-1064SK (HSC). Наносимое количество контролировали путем иммунодетекции актина. Белки визуализировали с использованием конъюгированных с HRP вторичных антител и системы DAB (DAKO, Denmark) в качестве хромогена. В качестве маркеров молекулярной массы использовали предварительно окрашенные стандарты RainbowTM (AmershamUK).
Фигура 4. Иммуноцитохимический и иммуногистохимический анализ TUCAP-1. На фигуре 4A представлено то же самое в черно-белом цвете. Иммуноцитохимический анализ преиммунной сыворотки (A) клеток MM2; (B) лимфоцитов периферической крови человека; (C) дифференцированных in vitro макрофагов.
Иммуногистохимический анализ TUCAP-1 в: (D) клетках M2; (E) клетках периферической крови; (F) макрофагах.
Иммуногистохимический анализ тканей злокачественной меланомы, окрашенных: (G) преиммунной сывороткой мыши; (H) иммунной сывороткой против TUCAP-1 и (I) антителом против GP100.
Иммуногистохимический анализ здоровой кожи, окрашенной с помощью: (J) преиммунной сыворотки мыши, (K) иммунной сыворотки против TUCAP-1, и (L) антителом против эзрина. Увеличение 10X.
Фигура 5. Субклеточная локализация TUCAP-1/-I. На фигуре 5A представлено то же самое в черно-белом цвете.
(A) Вестерн-блот-анализ субклеточных фракций иммунопреципитатов TUCAP-1 из тотальных лизатов MM2. M - маркер размера, TE - тотальные экстракты.
(B) Анализ иммунофлуоресценции (IF) с двойным окрашиванием для TUCAP-1 (зеленый) и Rab5 (красный).
(C) IF-анализ с двойным окрашиванием для TUCAP-1 (зеленый) и Lamp-1 (красный).
(D) IF-анализ с двойным окрашиванием для TUCAP-1 (зеленый) и окрашенных Mitotracker митохондрий (красный). Желтые/оранжевые области указывают на колокализацию. Ядра окрашивали Hoechst 33258. Увеличение 100X.
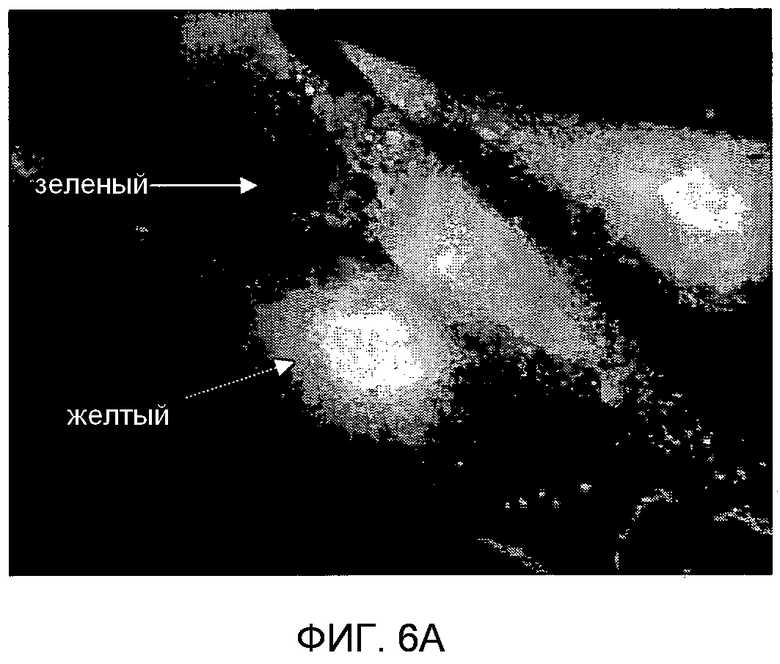
Фигура 6. Субклеточная локализация TUCAP-1-II. На фигуре 6A представлено то же самое в черно-белом цвете. Анализ иммунофлуоресценции (IF) с двойным окрашиванием для TUCAP-1 (зеленый) и EEA1 (красный) на клетках MM2. Желтые/оранжевые области указывают на колокализацию. Ядра окрашивали Hoechst 33258. Увеличение 100X.
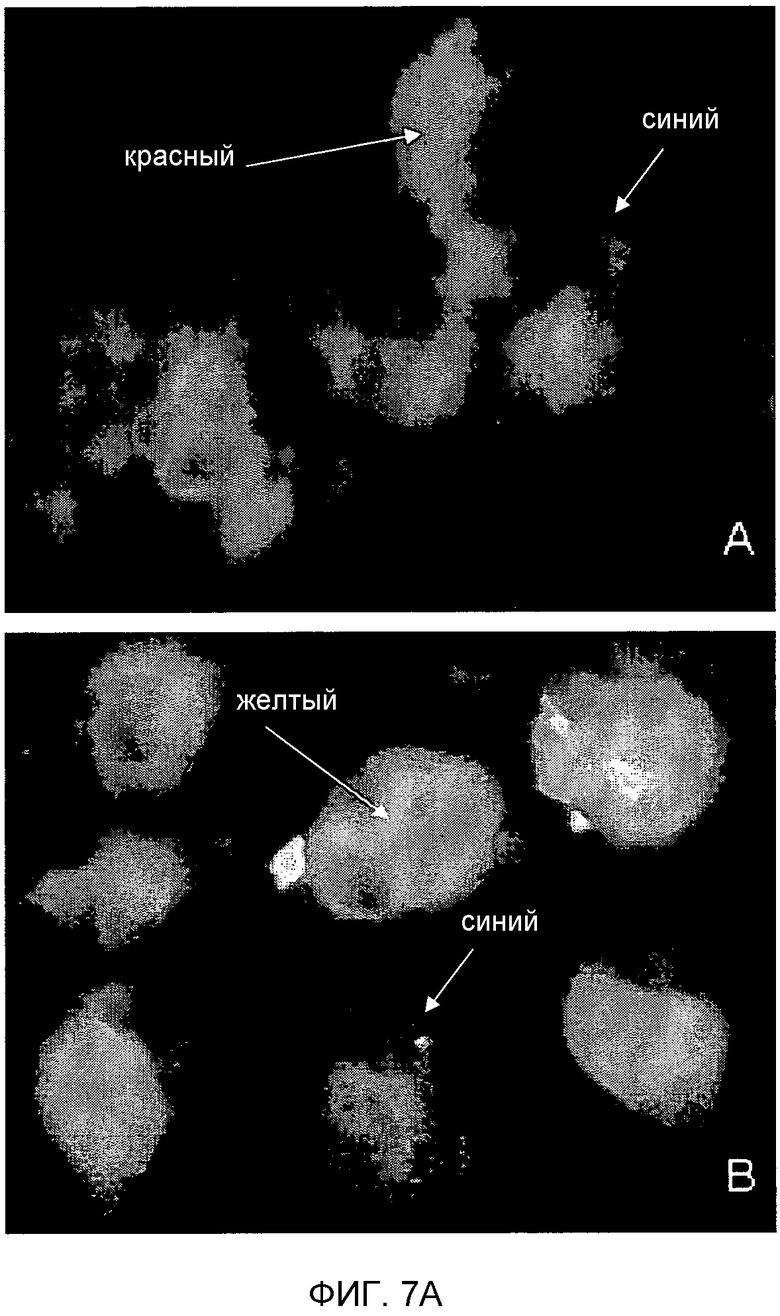
Фигура 7. Детекция TUCAP-1 в каннибалических клетках. На фигуре 7A представлено то же самое в черно-белом цвете. (A) Детекция и определение локализации TUCAP-1 в клетках метастатической меланомы MM1, кокультивированных с живыми лимфоцитами. IVM-анализ TUCAP-1 (зеленый). На фигуре показано, что TUCAP-1 поддается детекции исключительно на клетках меланомы.
(B) Двойной анализ флуоресценции TUCAP-1 (зеленый) и EEA-1 (красный) в метастатических клетках меланомы MM1, кокультивированных с живыми лимфоцитами. Желтые/оранжевые области указывают на колокализацию. Ядра окрашивали Hoechst 33258.
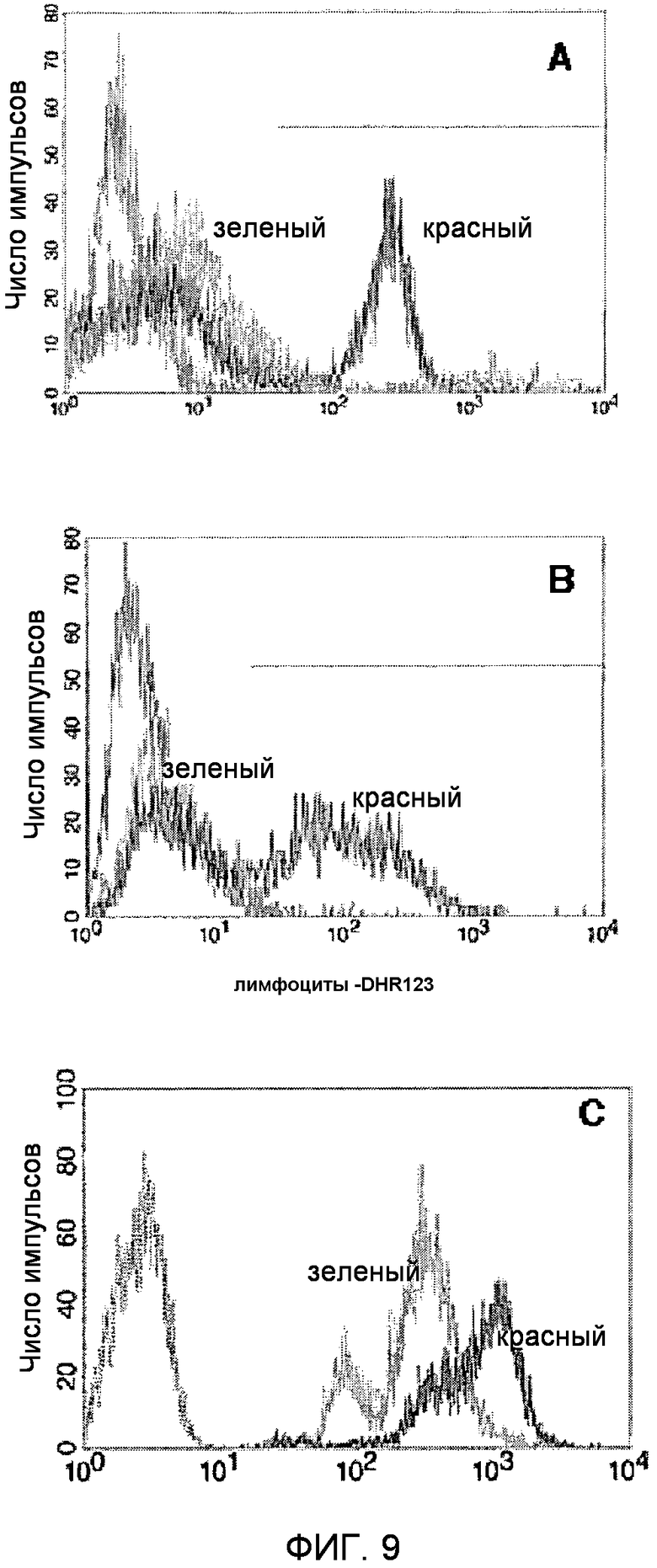
Фигура 8. FACS-анализ экспрессии TUCAP-1.
Facs-анализ экспрессии TUCAP-1 в нетрансфицированных клетках MM2 и в клетках MM2, трансфицированных siRNA с переставленными элементами и siRNA TUCAP-1 (siRNA TM9SF4) через 48 часов после трансфекции.
Фигура 9. Функциональный анализ TM9SF4/TUCAP-1.
(A). FACS-анализ фагоцитарной активности клеток MM2, трансфицированных siRNA с переставленными элементами (SC-siRNA) или siRNA TUCAP-1 (siRNA TM9SF4). Серый: неокрашенные контрольные клетки; красный: отрицательный контроль в виде клеток, трансфицированных siRNA с переставленными элементами; зеленый: клетки, трансфицированные siRNA TM9SF4.
(B) FACS-анализ каннибалической активности клеток MM2, трансфицированных SC-siRNA или siRNA TM9SF4, инкубированных в течение 18 часов с окрашенными DHR123 лимфоцитами. Серый: неокрашенные контрольные клетки; красный: трансфицированные SC-siRNA клетки; зеленый: клетки, трансфицированные siRNA TM9SF4. Для исключения окрашенных DHR123 лимфоцитов, не поглощенных клетками меланомы, оценивали исключительно испускание флуоресценции меланомных клеток.
(C) FACS-анализ окрашивания с помощью LysoTracker DND-26 клеток MM2, трансфицированных SC-siRNA или siRNA TM9SF4. Серый: неокрашенные контрольные клетки; красный: клетки, трансфицированные SC-siRNA; зеленый: клетки, трансфицированные TM9SF4 siRNA.
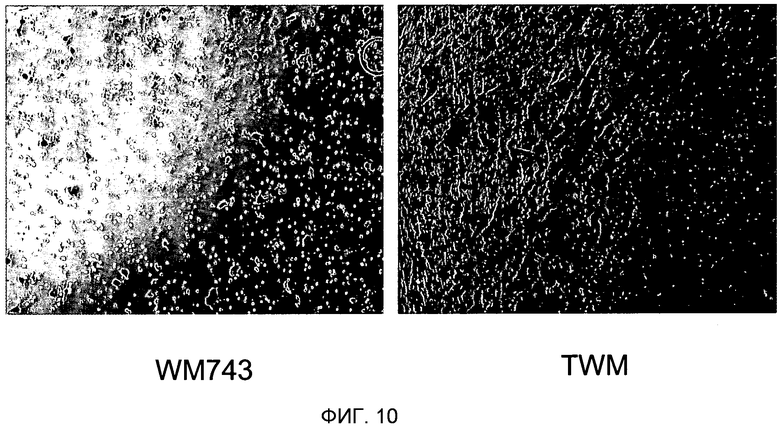
Фигура 10. Сверхэкспрессия TUCAP-1 усиливает инвазию клеток через матригель. На фигуре 10A представлено то же самое в черно-белом цвете. Фотография, полученная с помощью фазового микроскопа, инвазивных клеток меланомы WM743 по сравнению с меченными GFP трансфицированными полноразмерным TUCAP-1 клетками меланомы WM743 (TWM). Инвазивные клетки фиксировали в формальдегиде и окрашивали кристаллическим фиолетовым. На изображении отчетливо показано, что число инвазивных клеток было значительно более высоким для TWM, причем среднее количество нетрансфицированных клеток составляло 25, а среднее количество клеток TWM, трансфицированных TUCAP 1, составляло 132.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
TUCAP-1/TM9SF4 (официальное полное название официального комитета по номенклатуре HUGO: представитель 4 суперсемейства трансмембранных белков с 9 трансмембранными доменами) относится к суперсемейству трансмембранных белков с 9 трансмембранными доменами (TM9SF) - высококонсервативному семейству белков, характеризующемуся наличием большого вариабельного внеклеточного N-концевого домена и от девяти до десяти предполагаемых трансмембранных доменов. Однако функция и локализация TM9SF4 не были описаны для клеток человека. В этом описании, авторы настоящего изобретения описывают локализацию экспрессии белка и предоставляют полезные и новые применения для этого белка. В этом описании этот белок идентифицирован в качестве нового онкобелка и показано, что этот белок экспрессируется в клетках злокачественной опухоли, в то время как он не поддается детекции в различных здоровых клетках и тканях. Также в этом описании предоставлена структура белка, и аналогия с другими белками показывает, что этот белок может быть вовлечен в регуляцию pH внутриклеточных везикул. На протяжении этого описания белок называют TUCAP-1, а ген, кодирующий этот белок, соответственно называют tucap-1.
В таблице 1, ниже, показаны физико-химические параметры белка TUCAP-1
Анализ гидрофобности TUCAP-1 с помощью предсказывающего сервера TopPred выявил в основном гидрофильную N-концевую часть, простирающуюся до аминокислоты 262, в то время как остальная часть белка является крайне гидрофобной и содержит девять потенциальных трансмембранных доменов (фиг.1A). Исходя из этой предсказанной структуры, можно с большой уверенностью предположить, что TUCAP-1 является интегральным мембранным белком, как показано на фиг.1B. Данные авторов настоящего изобретения о достаточно высокой гомологии между TUCAP-1 и PHG1 (45%, которые возрастают до 63%, если рассматривать положительное выравнивание белков программой NCBI Blast) привели к новому предположению авторов настоящего изобретения о том, что TUCAP-1 может участвовать в каннибалической активности клеток метастатической меланомы человека.
Согласно одному предпочтительному варианту осуществления настоящего изобретения предусмотрены полинуклеотиды, соответствующие или комплементарные всему гену, мРНК и/или кодирующим последовательностям tucap-1, или их частям, предпочтительно в выделенной форме, включая полинуклеотиды, кодирующие белки TUCAP-1 и их фрагменты, ДНК, РНК, гибрид ДНК/РНК и родственные молекулы, олигонуклеотиды, комплементарные последовательностям гена или мРНК tucap-1 или их частям, и полинуклеотиды или олигонуклеотиды, которые гибридизуются с генами, мРНК TUCAP-1, или с кодирующими TUCAP-1 полинуклеотидами.
Согласно другому предпочтительному варианту осуществления изобретения предусмотрено "антитело", которое представляет собой молекулу целого антитела или его фрагмента, которые распознают (или могут связываться с) "конкретные последовательности" белка TUCAP-1, который представляет собой его антиген. Антитело может представлять собой либо поликлональное антитело, либо моноклональное антитело. В этом варианте осуществления, белок TUCAP-1 представляет собой полипептид, имеющий аминокислотную последовательность согласно SEQ ID NO:1, и конкретные последовательности представляют собой полипептиды, имеющие аминокислотную последовательность, содержащую делецию, замену или вставку одной или нескольких аминокислот по сравнению с аминокислотной последовательностью SEQ ID NO:1 или ее фрагмента. Антитело по настоящему изобретению охватывает мутанты антитела. "Мутант антитела" представляет собой мутант, в котором один или несколько аминокислотных остатков антитела модифицированы по сравнению с исходными.
Согласно следующим вариантам осуществления предусмотрены ингибиторы TUCAP-1. Такие молекулы ингибиторов могут представлять собой полинуклеотидные последовательности, которые по существу комплементарны последовательности SEQ ID NO: 2 или ее части, и олигонуклеотидные последовательности, по существу комплементарные фрагменту SEQ ID NO:2.
Согласно другому варианту осуществления изобретения, предусмотрены способы лечения злокачественной опухоли у пациента-человека, включающие стадию введения пациенту терапевтически эффективного количества композиции, содержащей связывающее TUCAP-1 средство, конъюгированное с химиотерапевтическим средством. Антитела и фрагменты, которые специфично связываются с белком TUCAP-1, можно использовать для лечения злокачественных опухолей. Изобретение включает применение антител и фрагментов антител, которые слиты с другими группами, которые могут иметь цитотоксический эффект на злокачественную опухоль.
Другим предпочтительным вариантом осуществления настоящего изобретения являются клеточные линии, продуцирующие моноклональные антитела против белка TUCAP-1 или его фрагментов.
Согласно другому предпочтительному варианту осуществления, предусмотрены рекомбинантные молекулы ДНК или РНК, содержащие полноразмерную последовательность TUCAP-1 дикого типа или мутантного TUCAP-1, или мутанты TUCAP-1 с делециями, включая, но не ограничиваясь ими, фаги, плазмиды, фагмиды, космиды, YAC, BAC, а также различные вирусные и невирусные экспрессирующие векторы, хорошо известные в данной области, и клетки, трансформированные или трансфицированные такими рекомбинантными молекулами ДНК или РНК. С использованием этих экспрессирующих векторов TUCAP-1 может быть предпочтительно экспрессирован в нескольких злокачественных опухолевых клеточных линиях. Предпочтительные варианты осуществления включают системы хозяин - вектор, которые пригодны для продукции белка TUCAP-1 или его фрагмента. Такие системы хозяин - вектор можно использовать: i) для исследования функциональных свойств TUCAP-1 и мутаций TUCAP-1; ii) в качестве модели для разработки протокола генной терапии на основе использования векторов для подавления TUCAP-1 и векторов, экспрессирующих мутанты TUCAP-1.
Таким образом, настоящее изобретение относится к уникальному инструменту для измерения, исследования и детекции TUCAP-1, в качестве маркера злокачественности многих типов злокачественной опухоли. Более того, настоящее изобретение обеспечивает новый инструмент для клинического онколога для управления лечением и наблюдения пациентов со злокачественной опухолью. Более того, в объеме настоящего изобретения находятся пептиды других молекул, способных препятствовать экспрессии или действовать в качестве блокирующих TUCAP-1 средств, в качестве антинеопластических соединений.
Другой предпочтительный вариант осуществления настоящего изобретения представляет собой набор для детекции TUCAP-1 из образцов тканей и жидкостей организма пациентов с опухолью в качестве диагностического и/или прогностического инструмента, такого как набор для детекции. Такой набор содержит: a) антитела против TUCAP-1; b) положительный контроль, состоящий из очищенного белка TUCAP-1, и необходимые буферы.
Далее настоящее изобретение описано с помощью примеров, которые не предназначены для ограничения объема изобретения. Объем изобретения определен в прилагаемой формуле изобретения.
ПРИМЕР
ПРИМЕР 1
Транскрипты Tucap-1 и белок TUCAP-1 выявляются в клетках злокачественной меланомы человека, но не в клетках первичной меланомы, мононуклеарных клетках периферической крови или клетках здоровой кожи.
Клеточная культура. Первичные и метастатические клеточные линии меланомы человека соответственно были получены из первичных или метастатических очагов пациентов, которым проводили хирургическую резекцию в Istituto Nazionale dei Tumori, Milan, Italy. Все клетки, использованные в данном исследовании, были обозначены как PM (первичная меланома) или MM (метастатическая меланома) с последующим порядковым номером. Мононуклеарные клетки периферической крови (PBMC) человека очищали в градиенте плотности Ficoll-Hypaque (Pharmacia) из лейкоцитарной пленки от здоровых доноров. Моноциты отделяли от PBMC с использованием меченных CD14 микрогранул Miltenyi согласно инструкции изготовителя и оставляли дифференцироваться на 2 недели при 37°С в RPMI 1640 с 15% FCS. Остальные лимфоциты периферической крови человека (PBL) получали после опосредуемого гранулами с CD14 устранения моноцитов. Все клетки высевали в RPMI 1640, дополненную 100 МЕ/мл пенициллина, 100 мкг/мл стрептомицина, 10% FCS в условиях 5% CO2 при 37°С (все реагенты были приобретены от Cambrex).
ПЦР-анализ. Экспрессию транскриптов Tucap-1 оценивали с помощью ОТ-ПЦР на нескольких клеточных линиях первичной и метастатической меланомы, полученных от пациентов с меланомой после хирургической резекции в Instituto Nazionale Tumori, Milan, по сравнению с лимфоцитами периферической крови человека (PBL). Из клеток получали тотальную РНК способом RNAzol (Invitrogen) и РНК-матрицы использовали для ОТ-ПЦР амплификации. Праймеры для детекции TUCAP-1 представляли собой: tgtgtgaaacaagcgccttc (SEQ ID NO: 3) и atgaggtggacgtagtagt (SEQ ID NO: 4). Эти праймеры амплифицируют фрагмент из 349 пар оснований.
Праймеры, использованные для прямого синтеза меченного His N-концевого домена TUCAP-1, представляли собой: gaattcatgtgtgaaacaagcgcctt (SEQ ID NO:5) и gtcgacagaaaaccagtggatctg (SEQ ID NO:6).
Праймеры для детекции GAPDH представляли собой: ccatggagaaggctgggg (SEQ ID NO:7) и caaagttgtcatggatgacc (SEQ ID NO: 8).
Клонирование TUCAP 1 и экспрессия слитого белка TUCAP-1 в клетках меланомы человека:
Продукты ПЦР клонировали в вектор pTopo (Invitrogen), а затем разрезали с помощью пары соответствующих ферментов рестрикции (EcoRI, SalI) с получением одного фрагмента, который затем лигировали в вектор pTrcHis2 (Invitrogen). Экспрессированный рекомбинантный белок очищали с использованием смолы Ni NTA-агароза (Qiagen) в соответствии с инструкциями изготовителя и использовали для иммунизации мышей.
Праймеры, которые использовали для прямого GFP-меченого полноразмерного TUCAP-1, представляли собой: gaattcatgtgtgaaacaagcg (SEQ ID NO:9) и gtcgatgtctatcttcacagcata (SEQ ID NO: 10).
Продукты ПЦР клонировали в вектор pTopo (Invitrogen), а затем разрезали с помощью соответствующей пары ферментов рестрикции (EcoRI-SalI) и лигировали с получением одного фрагмента, который впоследствии лигировали в вектор pEGFPN1 (Clontech) в участках EcoRI и SalI с получением слитого белка GFP-TUCAP-1. Плазмиды, кодирующие слитый белок GFP-TUCAP-1, трансфицировали в клетки MM1 и MM2 с использованием набора для трансфекции Lipofectamine 2000 (Invitrogen) согласно инструкциям изготовителя, таким образом получая GFP-TUCAP-1.
(GFP-Tuc) Клетки MM1 или MM2. Процент трансфицированных клеток оценивали с помощью анализа активированной флуоресценцией сортировки клеток.
Вестерн-блоттинг и иммунопреципитация
Бактериальные лизаты, лизаты целых клеток меланомы и фибробласты здоровой кожи CCD-1064SK (SantaCruz) ресуспендировали в буфере для образца с SDS, денатурировали кипячением, разделяли путем SDS-PAGE и анализировали вестерн-блоттингом. Меченый 6xHis белок, GFP, TUCAP-1 и GAPDH, выявляли соответственно с помощью mAb против 6His (Sigma), антитела против GFP (clone 1E4 MBL), сыворотки мыши против TUCAP-1 и антитела против GAPDH (SantaCruz). Белки TUCAP-1 подвергали иммунопреципитации в течение ночи при 4°С в присутствии гранул с белком A+G-Sepharose (Pierce) из предварительно очищенных клеточных лизатов, с использованием антитела pAb кролика против TUCAP-1. В качестве отрицательного контроля использовали преиммунную сыворотку кролика. Детекцию актина проводили с помощью mAb против актина (Sigma).
Для характеризации продукта гена tucap-1, кДНК, полученную из клеток MM1, клонировали в бактериальные экспрессирующие векторы с получением первых 265 аминокислот TUCAP-1, слитых с N-концевой меткой из 6 остатков гистидина (6H-Nt-TUCAP 1) (SEQ ID NO: 11). Вестерн-блот-анализ очищенного рекомбинантного белка выявил продукт трансляции размером приблизительно 30 кДа, отсутствующий в контрольных бактериальных цельных лизатах (отрицательный контроль). Таким образом, His-меченый рекомбинантный пептид TUCAP-1 использовали в качестве иммуногена для получения антител против TUCAP-1 у мышей. Специфичность антисыворотки против TUCAP-1 определяли вестерн-блот-анализом очищенного 6H-Nt-TUCAP-1, подвергнутого иммуноблоттингу с антисывороткой мыши против 6His и TUCAP-1 (фиг.2B). Антисыворотку мыши против TUCAP-1 далее анализировали вестерн-блоттингом на растворимых в Triton и нерастворимых в Triton фракциях клеток MM1, трансфицированных или нетрансфицированных меченным GFP полноразмерным TUCAP-1 (GFP-TUCAP-1). Антитело против GFP выявило один специфичный продукт трансляции в области 100 кДа, в то время как антитела против TUCAP-1 распознавали как меченый GFP, так и эндогенный белок TUCAP-1, соответствующий 70 кДа, выявляемый в обеих клеточных линиях (фиг.2C). Интересно, что TUCAP-1 был более представлен в нерастворимых в Triton фракциях (фракция, обогащенная GAPDH-отрицательными белками цитоскелета), таким образом подтверждая предварительные модели, предполагающие, что TUCAP-1 является трансмембранным белком. Для дальнейшего подтверждения результатов ПЦР антитела против TUCAP-1 подвергали блоттингу в клеточных экстрактах четырех клеточных линий метастатической меланомы (MM2-MM5), ранее анализированных в отношении их каннибалического поведения по сравнению с фибробластами здоровой кожи (HSC) и клетками MM2, трансфицированными GFP-TUCAP-1, в качестве контроля. TUCAP-1 выявлялся исключительно в клетках меланомы и не выявлялся в клетках кожи (фиг.3).
ПРИМЕР 2
Иммуногистохимия выявляет TUCAP-1 исключительно в клетках меланомы
Иммуноцитохимия и иммуногистохимия. Для иммуноцитохимии клетки меланомы и макрофаги, культивированные на стеклянных предметных стеклах с камерами (Falcon), и PBL, осажденные с помощью цитоцентрифуги на стеклянные предметные стекла, фиксировали 80% метанолом в течение 10 минут при 4°С и окрашивали на TUCAP-1 с помощью сыворотки против TUCAP-1 или преиммунной контрольной сыворотки. Злокачественная меланома и соответствующая нормальная ткань кожи с набора предметных стекол Biomax (Biomax) иммунологически окрашивалась преиммунной сывороткой и антисывороткой мыши против TUCAP-1. Меланома окрашивалась антителами против gp100 (Immunotech), а нормальная кожа также окрашивалась антителом против эзрина (Sigma). Белки визуализировали с использованием способа с пероксидазой-антипероксидазой в одном окрашивании (Dako) и контрастно красили гематоксилином Майера.
На фиг.4 A-C показано, что клеточные линии MM2 (A), лимфоциты периферической крови человека (B) и дифференцированные in vitro макрофаги (C) были отрицательными по преиммунной сыворотке мыши. В соответствии с результатами ПЦР, культивированные клетки злокачественной меланомы показали отчетливое положительное окрашивание по TUCAP-1 (фиг.4D), а PBL (фиг.4E) и макрофаги (фиг.4F) были отрицательными по окрашиванию на TUCAP-1. Иммуногистохимическй анализ тканей злокачественной меланомы по сравнению со здоровой кожей показал, что TUCAP-1 выявлялся только в тканях меланомы (фиг.4H), в то время как он не выявлялся в здоровой коже (4K). В качестве положительных контрольных маркеров для меланомы и нормальной кожи использовали GP100 (фиг.41) и эзрин (фиг.4L) соответственно. Окрашивание преиммунной сывороткой мыши было всегда отрицательным в обеих тканях (фиг.4G, 4J). Эти результаты обеспечивают данные о том, что TUCAP-1 выявлялся исключительно в клетках меланомы и, таким образом, подтверждают результаты примера 1.
ПРИМЕР 3
Субклеточная локализация TUCAP-1
Следующие эксперименты проводили для анализа внутриклеточной локализации TUCAP-1.
Фракционирование клеточных компартментов. Клетки собирали и обрабатывали согласно протоколу набора для плазматической мембраны Qproteome (Quiagen) для получения неденатурированных фракций клеточных компартментов, соответствующих очищенным плазматическим мембранам и цитозолю. Затем указанные фракции осаждали ацетоном и ресуспендировали в буфере для иммунопреципитации B (0,1% SDS, 1% NP40, 0,5% холат натрия), чтобы подвергнуть их иммунопреципитации с антителом кролика против TUCAP-1. Из остаточного осадка после фракционирования клеточных компартментов, содержащего целые клетки и органеллы, удаляли целые клетки с помощью центрифугирования и подвергали его экстракции с Triton X-100 для получения растворимых и нерастворимых фракций, которые подвергали иммунопреципитации с антителом кролика против TUCAP-1. После электрофореза образцов, нитроцеллюлозу подвергали блоттингу с антителом мыши против TUCAP-1.
Иммунофлуоресцентный анализ. Клетки MM2 высевали на покровное стекло, помещенное в 60-мм чашки Петри. Клетки фиксировали 2% параформальдегидом и повышали их проницаемость (Triton X-100 (0,1%)) в течение 24 часов. Для двойного окрашивания по TUCAP-1 и Rab5 клетки метили антисывороткой мыши против TUCAP-1 и антителом кролика против Rab5 (SantaCruz) и соответственно выявляли с помощью конъюгированного с Alexa Fluor 488 антитела против IgG мыши и конъюгированного с Alexa Fluor 594 антитела против IgG кролика (Molecular Probes). Для детекции TUCAP-1 и Lamp-1 клетки метили pAb кролика против TUCAP-1 и Mab мыши против Lamp-1, (BD Pharmingen) соответственно, окрашивали конъюгированным с Alexa Fluor 594 антителом против IgG кролика и конъюгированным с Alexa Fluor 488 антителом против IgG мыши. TUCAP-1 и митохондрии выявляли и окрашивали по TUCAP-1 с помощью pAb мыши против TUCAP-1 и метили конъюгированным с Alexa Fluor 488 антителом против IgG мыши, в то время как митохондрии метили с помощью Mithotracker Red (Invitrogen). После промываний из всех образцов делали препарат с помощью смеси глицерин: PBS (2:1) и наблюдали с помощью флуоресцентного микроскопа Leica DM 2500. Изображения регистрировали с помощью цифровой камеры Spot Insight (Delta Sistemi), оборудованной системой анализа изображений IAS 8.2 (Delta Sistemi).
Лизаты цельных клеток MM2 подвергали иммунопреципитации с антителами против TUCAP-1 и различные субклеточные фракции разделяли и анализировали вестерн-блоттингом. Результаты показали, что TUCAP-1 выделялся, главным образом, из фракций, обогащенных клеточным органеллами, в то время как он не поддавался детекции в цитозольных фракциях и фракциях плазматических мембран (фиг.5A). Для идентификации субклеточной локализации TUCAP-1 клетки MM2 подвергали двойному окрашиванию по TUCAP-1 и либо по ранним эндосомальным маркерам Rab5, либо по компоненту поздних эндосом и лизосом Lamp-1, либо по митохондриальному маркеру MitotrackerTM. Анализ с помощью флуоресцентной микроскопии показал, что TUCAP-1 колокализовывался как с Rab5 (фиг.5B), так и с EEA-1 (фиг.6 и фиг.7B), в то время как он не колокализовывался ни с Lamp-1 (фиг.5C), ни с MitotrackerTM (фиг.5D), ни с окрашенными Hoechst ядрами.
Более того, на фигуре 7 представлена флуоресценция с двойным окрашиванием на тех же клетках, кокультивированных с живыми лимфоцитами. TUCAP-1 выявляется исключительно на поверхности клеток меланомы, а лимфоциты являются полностью неокрашенными (фигура 7A). Также TUCAP-1 колокализуется с первичным маркером эндосом EEA-1 (фигура 7B) подтверждая экспрессию этого белка на ранних эндосомах.
ПРИМЕР 4
Функциональный анализ TUCAP-1
Подавление Tucap-1 ингибирует фагоцитарное поведение
Роль белка TUCAP-1 в клетках метастатической меланомы человека оценивали путем ингибирования его экспрессии с помощью подавления Tucap-1.
Для подавления tucap-1 использовали следующие дуплексы StealthR RNAi (Invitrogen): gagugacguccagauccacugguuu (SEQ ID NO: 13) и aaaccaguggaucuggacgucacuc (SEQ ID NO: 14) и их подвергали отжигу согласно инструкциям изготовителя. В качестве отрицательного контроля использовали отрицательные контрольные дуплексы Stealth RNAi со средним содержанием GC (Invitrogen). Клетки меланомы трансфицировали с использованием реагента Lipofectamine RNAiMAX (Invitrogen) согласно инструкциям изготовителя. В кратком изложении, за сутки до трансфекции, клетки меланомы высевали в шестилуночные планшеты (1×105 на лунку) и через 24 часа клетки трансфицировали 30 пмоль siRNA на лунку. Через 48 часов после трансфекции клетки анализировали в отношении экспрессии TUCAP-1 с помощью анализа FACS.
Три различных фагоцитарных метастатических клеточных линии трансфицировали малой интерферирующей РНК к Tucap-1 (Tucap-1 siRNA) или трансфицировали незначащей олиго-siRNA (SC-siRNA). На фиг.8 представлен FACS-анализ экспрессии TUCAP-1 на нетрансфицированных клетках MM2 и клетках MM2, трансфицированных siRNA с переставленными элементами или siRNA TUCAP-1, через 48 часов после трансфекции. Сходные результаты были получены для клеток MM3, трансфицированных siRNA с переставленными элементами, и в клетках MM3 с подавлением TUCAP-1 (не показано). Это подтвердило эффективный нокдаун TUCAP-1.
Для оценки фагоцитарной активности этих клеток, авторы сначала определили способность нетрансфицированных, трансфицированных SC-siRNA клеточных линий меланомы, или клеточных линий меланомы с подавлением Tucap-1, поглощать окрашенные клетки дрожжей или живые лимфоциты. Через 48 часов после трансфекции клетки меланомы MM2 и MM3, трансфицированные SC-siRNA или siRNA TUCAP-1, инкубировали при 37°C с окрашенными FITC дрожжами Saccaromyces (1:60) или живыми лимфоцитами, окрашенными 10 микромолярным дигидрородамином 123 (DHR123) (Molecular Probes) (1:10). Фагоцитоз/каннибализм измеряли через 4 часа путем смывания избыточных лимфоцитов или дрожжевых клеток посредством PBS и добавления раствора PBS, содержащего трипсин (1,5 г/л) и ЭДТА (0,44 г/л). После промывания клетки меланомы собирали и анализировали на цитометре, оборудованном 488-нм аргоновым лазером. Было получено по меньшей мере 10000 результатов и они были проанализирована компьютером Macintosh с использованием программного обеспечения CellQuest (Becton Dickinson). Клетки меланомы, которые флуоресцировали зеленой флуоресценцией, считали фагоцитарными/каннибалическими. Результаты показали, что нокаут TUCAP-1 значительно ингибировал как фагоцитарную, так и каннибалическую активность клеток меланомы (фиг.9A, 9B, таблица 1), подтверждая, что TUCAP-1 играет ключевую роль в каннибалическом поведении метастатических меланом человека, и белок, таким образом, можно использовать в качестве маркера злокачественности.
Таблица 2. Роль TUCAP-1 в фагоцитозе/каннибализме.
Фагоцитарная/каннибалическая активность клеток метастатической меланомы MM2 и MM3, трансфицированных siRNA с переставленными элементами (SC-siRNA), и клеток метастатической меланомы MM2 и MM3 с подавлением Tucap-1 (siRNA Tucap-1) относительно окрашенных FITC дрожжей и окрашенных DHR123 живых лимфоцитов. Фагоцитарная активность выражена как % фагоцитарных клеток. Числа представляют собой средние значения ± s.d. для 5 различных экспериментов.
ПРИМЕР 5
TUCAP-1 участвует в регуляции закисления эндосомальных везикул
Клетки MM2 и MM3, трансфицированные siRNA с переставленными элементами, и клетки MM2 и MM3 с подавлением TUCAP-1 окрашивали 1 мкМ зондом LysoTracker (Molecular Probes) в течение 30 минут при 37°С и сразу анализировали с помощью цитометра. Сравнения между различными клеточными линями меланомы проводили с помощью программного обеспечения CellQuest с использованием средних значений гистограмм интенсивности флуоресценции.
Исходя из результата, что TUCAP-1 локализуется на имеющих Rab5 эндосомах (см. ПРИМЕР 3), авторы настоящего изобретения тестировали гипотезу, что белок TUCAP-1 может участвовать в регуляции pH фаго/эндосомальных компартментов злокачественных клеток. Для проверки этой гипотезы клетки, трансфицированные контрольной SC-RNAi и siRNA TUCAP-1, окрашивали тропным к кислотам зондом LysoTracker green и анализировали проточной цитометрией. Подавление гена Tucap-1 индуцировало появление менее кислотных везикул в клетках меланомы, по сравнению с контрольными клетками, трансфицированными SC-RNA (ФИГ.9C). Эти эксперименты подтверждают гипотезу, что TUCAP-1 участвует в регуляции закисления внутренних везикул, таких как ранние эндосомы.
ПРИМЕР 6
Вовлечение TUCAP-1 в ранние фазы процесса метастазирования
Продолжающиеся эксперименты, основанные на применении клеток, сверхэкспрессирующих TUCAP-1, указывают на то, что этот белок вовлечен в инвазивность опухолевых клеток в ходе ранних фаз процесса метастазирования. Способность этих клеток к инвазии оценивают с использованием камер для инвазии из матригеля (Becton-Dickenson, Bedford, MA, USA). В кратком изложении, нетрансфицированные WM743 или клетки меланомы WM743, трансфицированные меченным GFP полноразмерным TUCAP-1 (TWM), ресуспендировали в бессывороточной среде и помещали в верхнюю камеру, в то время как в нижнюю камеру помещали среду, дополненную 10% FCS в качестве хемоаттрактанта. Клетки инкубировали при 37°С в увлажненной атмосфере и позволяли им мигрировать через камеру для хемотаксиса в течение 48 часов. После инкубации клетки, оставшиеся на верхней поверхности, полностью удаляли с использованием хлопкового носителя. Мигрировавшие клетки на дне камеры для хемотаксиса окрашивали кристаллическим фиолетовым. Инвазивные клетки подсчитывали микроскопически (40<) в четырех различных полях на фильтр. На фигуре 10 представлена нижняя сторона мембраны transwell, отчетливо указывающая на то, что число инвазивных клеток было значимо повышенным для TWM, со средним значением, составляющим 25 нетрансфицированных клеток, против среднего значения, составляющего 132 клеток TWM, трансфицированных TUCAP 1.
ПРИМЕР 7
Вовлечение TUCAP-1 в устойчивость клеток меланомы к цисплатину
В нескольких публикациях была показана роль белков, вовлеченных в транспорт ионов, и роль эндосомального компармента в секвестрировании, инактивации и высвобождении лекарственного средства в качестве механизмов устойчивости лекарственного средства. Экспрессия TUCAP-1 в ранних эндосомах и его вовлечение в регуляцию pH эндосомальных везикул (как представлено в примерах выше) привела авторов настоящего изобретения к предположению о роли этого белка в устойчивости злокачественной клетки к лекарственным средствам. Для доказательства этого клетки меланомы MM2, высоко экспрессирующие TUCAP-1, предварительно обрабатывали siRNA с переставленными элементами (SC-siRNA) или siRNA Tucap-1 в течение 48 часов (как показано в представленных выше примерах) и после трансфекции клетки обрабатывали 2 мкМ цисплатином. Через 48 часов после индукции цисплатином оценивали цитотоксичность с помощью FACS-анализа раннего (аннексин-V, однократно положительный) и позднего (PI/Аннексин V, двойной положительный) апоптоза. Подавление Tucap-1 значительно повышало цитотоксические эффекты цисплатина по сравнению с клетками WM743, обработанными siRNA с переставленными элементами, поведение которых совпадало с поведением нетрансфицированных контрольных клеток, со средним значением, составляющим 63% живых клеток в контрольных трансфицированных клетках против среднего значения 37% в клетках с подавлением TUCAP-1.
Этот ряд экспериментов доказывает, что TUCAP-1 вовлечен в устойчивость к лекарственному средству клеток, сверхэкспрессирующих TUCAP-1, и что подавление tucap-1 является перспективным способом ингибирования фагоцитарного характера опухолевых клеток.
Исходя из результатов, показанных в указанных выше примерах, в настоящем описании также представлены чувствительные и специфичные способы детекции меланомы и нескольких других опухолей, характеризующихся описанным фагоцитарным поведением, т.е. рака молочной железы, карциномы легкого, рака мочевого пузыря, медуллобластомы и аденокарциномы желудка. Более того, в этом описании предоставлены средства для отличия злокачественных от доброкачественных опухолевых повреждений путем демонстрации того, что TUCAP-1 экспрессируется исключительно в злокачественных опухолях. Способы детекции злокачественной опухоли включают оценку биологического образца из предполагаемого очага повреждения, как правило, путем гибридизации in situ, rt-PC, или иммуноферментных способов.
ПРИМЕР 8
Поликлональные и моноклональные антитела к TUCAP-1
Исходя из примеров, указанных выше, поликлональные (pAb) и моноклональные антитела (mAb), специфичные к TUCAP-1, могут быть пригодны для различных целей, включая, например, диагностику для определения злокачественности опухоли и лечение злокачественной опухоли.
Для получения поликлональных антител кДНК из клеток MM1 клонировали в бактериальные экспрессирующие векторы для получения аминокислот 18-282 TUCAP-1, слитых с N-концевой меткой из 6 остатков гистидина (SEQ ID NO: 11). Для получения антител против TUCAP-1 у мышей использовали очищенный рекомбинантный пептид. Антитела против TUCAP-1 распознавали иммуноген, меченный GFP полноразмерный белок, в качестве положительного контроля, а также эндогенный белок TUCAP-1.
Поликлональные антитела также получали иммунизацией кролика, козы и осла очищенным пептидным фрагментом, имеющим аминокислотую последовательность согласно SEQ ID NO: 12. Полученные антитела были способны распознавать белок TUCAP-1 человека, связываясь с пептидным фрагментом, который состоит из аминокислот 221-235 SEQ ID NO: 1. Поликлональные антитела также получали иммунизацией козы и осла.
Для получения моноклональных антител мышей иммунизировали пептидным фрагментом, имеющим аминокислотную последовательность согласно SEQ ID NO: 11 или SEQ ID NO: 12 или их фрагмента. Альтернативно мышей иммунизировали пептидным фрагментом, имеющим аминокислотную последовательность согласно SEQ ID NO: 15. Выбранные гибридомные клоны получали с использованием клеток селезенки отобранных мышей. В кратком изложении, B-клетки, полученные из селезенок иммунизированных мышей, подвергали слиянию с миеломной опухолевой клеточной линией, специально отобранной для получения гибридом. Полученные слитые (гибридные) клетки могут неопределенно долго расти в культуре с последующей продукцией больших количеств желаемых антител. Гибридомы получали в соответствии со стандартными протоколами. После скрининга выбранных гибридов гибридомы клонировали и подвергали крупномасштабному выращиванию для продукции антитела. Различные положительные гибридомы выбирают для различных применений, например, для: a) лабораторных экспериментальных применений (вестерн-блоттинг, иммунопреципитация, FACS-анализ, иммунофлуоресценця и иммуногистохимический и иммуноцитохимический анализ тканей человека и культивированных клеток); b) доклинических и клинических испытаний, c) средств для диагностики и прогноза опухоли, таких как набор для детекции. Полученные моноклональные антитела связываются с конформационными или линейными эпитопами из аминокислот 18-282 белка TUCAP-1 с SEQ ID NO: 1 или пептидного фрагмента, состоящего из аминокислот 221-235 или состоящего из аминокислот 303-352 SEQ ID NO: 1. Антитела также связываются с белком TUCAP-1 мыши, крысы, кошки, собаки и овцы.
В приведенных выше примерах подробно представлены конкретные варианты осуществления изобретения. Однако они представлены в качестве примера и только для целей иллюстрации. Примеры не предназначены для ограничения объема прилагаемой формулы изобретения, которая определяет изобретение.
ССЫЛКИ
Bukrinskaya A, Brichacek B, Mann A, Stevenson M. Establishment of a functional human immunodeficiency virus type 1 (HIV-1) reverse transcription complex involves the cytoskeleton. J Exp Med. 1998; 188: 2113-2125.
Caruso RA, Muda AO, Bersiga A, Rigoli L, Inferrera C. Morphological evidence of neutrophil-tumor cell phagocytosis (cannibalism) in human gastric adenocarcinomas. Ultrastruct Pathol 2002; 26: 315-21.
Chou, K.C. (2005). "Using amphiphilic pseudo amino acid composition to predict enzyme subfamily classes". Bioinformatics, 21, 10-19.
DeSimone PA, East R, Powell RD. Phagocytic tumor cell activity in oat cell carcinoma of the 6y7y-j - -- ol 1980; 11: 535-9.
Fujii M, Ishii Y, Wakabayashi T, et al. Cytologic diagnosis of male breast cancer with nipple discharge. A case report. Acta Cytol 1986; 30: 2.
Gasteiger E., Gattiker A., Hoogland C, Ivanyi I., Appel R.D., Bairoch A. ExPASy: the proteomics server for in-depth protein knowledge and analysis Nucleic Acids Res. 31: 3784-3788 (2003).
Kojima S, Sekine H, Fukui I, Ohshima H. Clinical significance of "cannibalism" in urinary cytology of bladder cancer. Acta Cytol 1998; 42: 1365-9.
Kumar PV, Hosseinzadeh M, Bedayat GR. Cytologic findings of medulloblastoma in crush smears. Acta Cytol 2001; 45: 542-6.
Lugini L, Lozupone F, Matarrese P, Funaro C, Luciani F, Malorni W, Rivoltini L, Castelli C, Tinari A, Piris A, Parmiani G, Fais S.Potent phagocytic activity discriminates metastatic and primary human malignant melanomas: a key role of ezrin. Lab Invest. 2003 Nov; 83(l1): 1555-67.
Lugini L, Matarrese P, Tinari A, Lozupone F, Federici C, Iessi E, Gentile M, Luciani F, Parmiani G, Rivoltini L, Malorni W, Fais S.Cannibalism of live lymphocytes by human metastatic but not primary melanoma cells. Cancer Res. 2006 Apr 1; 66(7): 3629-38.
В Rost, G Yachdav and J Liu (2004) Server. Nucleic Acids Research 32 (Web Server issue): W321-W326.
В Rost (1996) Methods in Enzymology, 266: 525-539.
Shen, H. B. and Chou, К. С (2007) "Hum-mPLoc: an ensemble classifier for large-scale human protein subcellular location prediction by incorporating samples with multiple sites", Biochemical and Biophysical Research Communications. 355(4): 1006-11.
Sloane BF, Dunn JR, Honn KV. Lysosomal cathepsin B: correlation with metastatic potential. Science 1981; 212: 1151-3.
Steinhaus J. Ueber carcinoma-einschlusse. Virchows Arch 1891; 126: 533-5.
Stroebe H. Zur Kenntniss verschiedener cellularer Vorgange und Erscheinungen in Geschwulsten. Beitrage Pathol 1892; 11: 1.
Shen, H.B. and Chou, К. C. (2006). "Ensemble classifier for protein folding pattern recognition". Bioinformatics, Jul 15; 22(14): 1717-22.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА К РОДСТВЕННОЙ РАКОВО-ЭМБРИОНАЛЬНОМУ АНТИГЕНУ МОЛЕКУЛЕ КЛЕТОЧНОЙ АДГЕЗИИ (СЕАСАМ) | 2012 |
|
RU2650869C2 |
| СВЯЗАННЫЙ С РАКОМ ТОЛСТОГО КИШЕЧНИКА ГЕН ТОМ34 | 2006 |
|
RU2526196C2 |
| КОМПОЗИЦИИ ГУМАНИЗИРОВАННЫХ СЛИТЫХ БЕЛКОВ NOTCH И СПОСОБЫ ЛЕЧЕНИЯ | 2008 |
|
RU2532830C2 |
| СВЯЗАННЫЙ С РАКОМ ТОЛСТОГО КИШЕЧНИКА ГЕН ТОМ34 | 2006 |
|
RU2449020C2 |
| НОВЫЙ ОПУХОЛЕВЫЙ БИОМАРКЕР | 2010 |
|
RU2567005C2 |
| ПЕПТИДЫ CDC45L И ВАКЦИНЫ, ВКЛЮЧАЮЩИЕ ТАКОВЫЕ | 2010 |
|
RU2562160C2 |
| КОНСТРУКЦИИ ГОМОДИМЕРНЫХ БЕЛКОВ | 2011 |
|
RU2624041C2 |
| ГЕН MTS, МУТАЦИИ ДАННОГО ГЕНА И СПОСОБЫ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ С ИСПОЛЬЗОВАНИЕМ ПОСЛЕДОВАТЕЛЬНОСТИ ГЕНА MTS | 1995 |
|
RU2164419C2 |
| РЕЦЕПТОР-НАПРАВЛЕННЫЕ КОНСТРУКЦИИ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2682335C2 |
| ЛЕЧЕНИЕ РАКА ПРИ ПОМОЩИ НАПРАВЛЕННЫХ НА МИШЕНЬ АНТИТЕЛ IN VIVO | 2011 |
|
RU2642305C2 |




















Группа изобретений относится к области медицины, фармацевтики и биохимии и касается маркера метастазов злокачественности меланомной опухоли, содержащего аминокислотную последовательность SEQ ID NO:1. Заявлены также выделенное антитело и моноклональное антитело, которые распознают белок TM9SF4 человека путем связывания с пептидным фрагментом SEQ ID NO:1, а также набор для детекции злокачественности опухолей, содержащий указанное антитело, применение SEQ ID NO:1 для определения метастатического характера меланомы. Группа изобретений обеспечивает быструю детекцию метастазирования меланомной опухоли. 7 н. и 3 з.п. ф-лы, 8 пр., 2 табл., 10 ил.
1. Маркер метастазов злокачественности опухоли, содержащий аминокислотную последовательность согласно SEQ ID NO: 1, где опухоль представляет собой меланомную опухоль.
2. Выделенное антитело, полученное иммунизацией мыши, кролика, козы или осла пептидным фрагментом, имеющим аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 11, SEQ ID NO: 12 и SEQ NO: 15, где антитело способно распознавать белок TM9SF4 человека путем связывания с пептидным фрагментом, выбранным из группы, состоящей из аминокислот 18-282, 221-235 и 303-352 SEQ ID NO: 1.
3. Антитело по п. 2 или его фрагмент, где антитело представляет собой моноклональное антитело и относится к IgG2A-изотипу IgG или к IgG1-изотипу IgG.
4. Моноклональное антитело против белка TM9SF4 человека, причем указанное антитело имеет активность блокирования роста опухоли или активность блокирования метастазирования, где указанные антитела получают иммунизацией мыши пептидным фрагментом, выбранным из группы, состоящей из SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 15, и указанное антитело распознает белок TM9SF4 человека путем связывания конформационных или линейных эпитопов, расположенных между а.к. 18 и 282, или 221-235, или 303-352 SEQ ID NO: 1.
5. Гибридома, полученная с использованием клеток селезенок отобранных мышей, иммунизированных пептидным фрагментом, имеющим аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 11, SEQ ID NO: 12 и SEQ NO: 15, и продуцирующая моноклональные антитела или фрагменты или гуманизированные формы таких моноклональных антител или одноцепочечные формы фрагментов, способные связываться с конформационными или линейными эпитопами TM9SF4 человека, причем указанные эпитопы расположены между аминокислотами 18-282, или 221-235, или 303-352 SEQ ID NO: 1.
6. Набор для детекции злокачественных опухолей in vitro, содержащий антитело, способное распознавать белок TM9SF4 человека путем связывания с пептидным фрагментом, выбранным из группы, состоящей из аминокислот 18-282, 221-235 и 303-352 SEQ ID NO: 1; и титрованный положительный контроль, содержащий пептидный фрагмент, имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 15, где антитело используют для детекции онкогенного белка согласно SEQ ID NO: 1 из тканей и жидкостей организма пациентов с опухолями.
7. Набор по п. 6, где опухоль представляет собой меланомную опухоль.
8. Применение SEQ ID NO: 1 для определения метастатического характера меланомы.
9. Применение по п. 8, дополнительно отличающееся тем, что применяют антитело, способное распознавать белок TM9SF4 человека путем связывания с пептидным фрагментом, выбранным из группы, состоящей из аминокислот 18-282, 221-235 и 303-352 SEQ ID NO: 1.
10. Применение ингибитора экспрессии SEQ ID NO: 1 для получения лекарственного средства против метастатической меланомы, где ингибитором экспрессии является миРНК TM9SF4.
| EP1104771 A1, 06.06.2001 | |||
| WO2006110593 A2, 19.10.2006 | |||
| SUGASAWA T et al, "The iodocyanopindolol and SM-11044 binding protein belongs to the TM9SF multispanning membrane protein superfamily", Gene, 2001, Aug8, 273(2):227-37/ |
Авторы
Даты
2015-04-10—Публикация
2009-01-26—Подача