Изобретение относится к области аналитической химии, в частности к способам выделения и определения железа(III) в водных растворах, солях металлов.
Известен способ эктсракционно-фотометрического определения железа, основанный на образовании комплексного соединения железа с реагентом, экстракции его в органическую фазу и измерении оптической плотности экстракта, а в качестве комплексообразующего реагента используют трихлорацетат натрия в слабокислой среде (pH 2,8-3,2), а экстракцию проводят метилбутилкетоном (а.с. СССР №971802; C01G 49/00, G01N 21/77, B01D 11/04; опубл. 07.11.82, Бюл. №41).
Недостатком данного метода является низкая избирательность и чувствительность определения железа вследствие использования в качестве экстрагентов высших спиртов и трибутилфосфата. Использование метилбутилкетона сужает интервал оптимальных значений pH. Также недостатком данного метода является плохая растворимость метилбутилкетона в воде.
Известен способ экстракционно-фотометрического определения железа, основанный на образовании тройного окрашенного комплексного соединения железо - о-фенантролин - органический реагент, в качестве органического реагента используют неразбавленную пеларгоновую кислоту, которая одновременно служит и реагентом и экстрагентом (а.с. СССР №880989; C01G 49/00, G01N 21/27, B01D 11/04; опубл. 15.11.81, Бюл. №42).
Недостатком данного метода является использование в качестве органического реагента пеларгоновой кислоты, растворимость которой составляет 0,026 г в 100 г воды. Также пеларгоновая кислота летуча с водяным паром, что может привести к существенным ошибкам определения.
Наиболее близким по технической сущности к предлагаемому является способ определения железа в металлах, их оксидах, солях и сплавах, включающий маскирование мешающих элементов, введение органических реагентов, экстракцию образовавшегося комплекса хлороформом и последующее его спектрофотометрирование, отличающийся тем, что с целью повышения точности определения и упрощения процесса в качестве маскирующего вещества используют глицин, а в качестве органических реагентов - 3-нитроализарин и дифенилгуанидин (а.с. СССР №1125542; G01N 31/22, B01D 11/04, опубл. 23.11.84, Бюл. №43).
Однако известный способ-прототип обладает малой селективностью реакций и длителен, поскольку необходимо варьирование условий определения и применение маскирующих агентов, позволяющих устранить этот недостаток.
Задачей создания изобретения является повышение селективности и упрощение процесса определения микросодержаний железа(III) в водных растворах.
Поставленная задача решается с помощью признаков, указанных в 1-м пункте формулы изобретения, общих с прототипом, таких как способ выделения и определения железа(III) из водных растворов с использованием в качестве органического реагента дифенилгуанидина, и отличительных существенных признаков, таких как в качестве второго органического реагента используют салициловую кислоту, а в качестве разбавителя органической фазы хлороформ при кислотности среды pH=1,5-2,5 с последующим определением железа(III) титриметрическим методом.
Согласно пункту 2 формулы изобретения в органическую микрофазу извлекается комплекс с мольным соотношением компонентов ДФГ:Fe3+:СК, равным 1:1:1.
Цель достигается тем, что создаются оптимальные условия для образования микрофазы в системе дифенилгуанидин - салициловая кислота - HCl - вода, и экстракции в нее комплексного соединения железа(III).
Вышеперечисленная совокупность существенных признаков позволяет получить следующий технический результат - повышение селективности и упрощение процесса определения микросодержаний железа(III) в водных растворах.
Предложенный способ поясняется следующими графиками.
Фиг.1. Распределение ионов железа(III) в системе ДФГ-СК-HCl-H2O в зависимости от кислотности водной среды (СДФГ=ССК=0,2 моль/л, CFe=0,01 моль/л, Vобщ=20 мл)
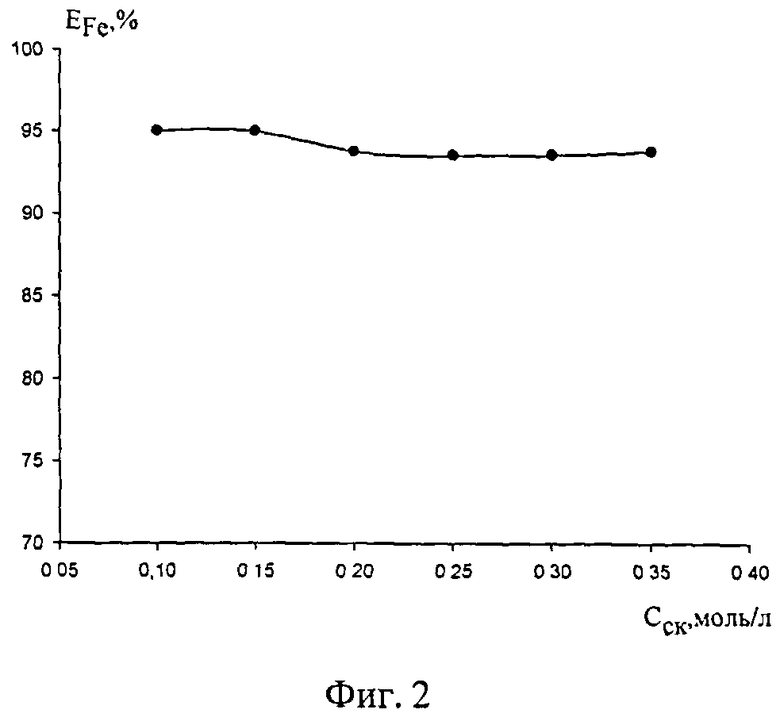
Фиг.2. Распределение ионов железа(III) в системе ДФГ-СК-HCl-H2O в зависимости от концентрации салициловой кислоты (CHCl=0,05 моль/л, СДФГ=0,2 моль/л, CFe=0,01 моль/л, Vобщ=20 мл)
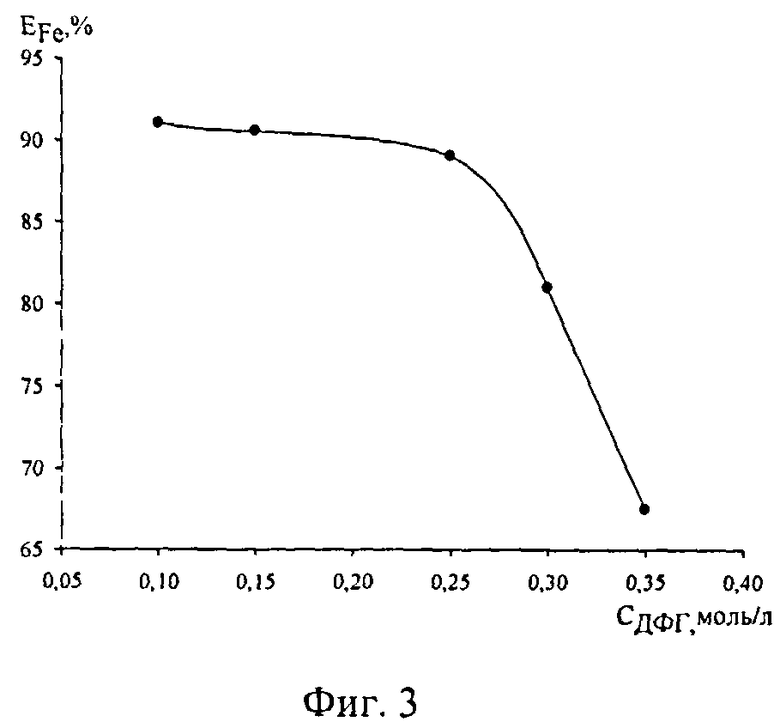
Фиг.3. Распределение ионов железа(III) в системе ДФГ-СК-HCl-H2O в зависимости от концентрации ДФГ (CCHl=0,05 моль/л, CCK=0,2 моль/л, CFe=0,1 моль/л, Vобщ=20 мл)
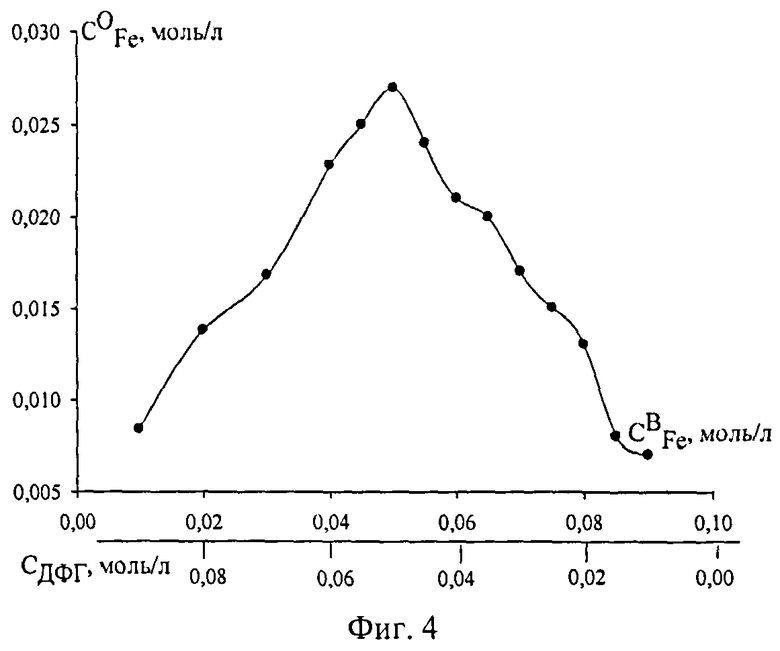
Фиг.4. Зависимость соотношения ДФГ:Fe в экстрагируемом комплексе от состава изомолярного раствора
(∑C(ДФГ+Fe)=0,1 моль/л, CCK=0,2 моль/л, CHCl=0,05 моль/л, Vобщ=20 мл)
Фиг.5. Зависимость соотношения СК:Fe в экстрагируемом комплексе от состава изомолярного раствора
(∑C(СК+Fe)=0,1 моль/л, СДФГ=0,1 моль/л, CHCl=0,05 моль/л, Vобщ=20 мл)
Органическая микрофаза образуется в интервале температур 50-95°C. С ростом температуры процесс образования двухфазного равновесия ускоряется. При охлаждении после экстракции органическая фаза, которая является экстрагентом, застывает, однако наблюдается высокая степень экстракции в нее ионов железа(III).
Образование и экстракция экстрагируемого комплексного соединения железа проходит в узком интервале концентраций HCl (0,025-0,1 моль/л). Максимальная экстракция железа наблюдается в интервале 0,05-0,15 моль/л HCl [фиг.1].
Изучена зависимость экстракции железа от концентрации салициловой кислоты (СК) при CHCl=0,05 моль/л. На графике кривой зависимости EFe, % - ССК видно, что максимальное значение степени извлечения железа составляет 95% и наблюдается при ССК=0,1-0,15 моль/л [фиг.2].
При оптимальных концентрациях СК и HCl исследовали влияние концентрации дифенилгуанидина (ДФГ) на степень извлечения ионов железа. Максимальная экстракция железа наблюдается при СДФГ=0,1 моль/л и CHCl=0,05 моль/л и составляет 91% [фиг.3].
Таким образом, оптимальными условиями экстракции железа салициловой кислотой в присутствии дифенилгуанидина следует считать: CHCl=0,025-0,15 моль/л, СДФГ=0,1-0,25 моль/л, ССК=0,1-0,2 моль/л (в общем объеме экстракционной системы 20 мл).
Чувствительность определения составляет 0,25 мг/мл. Для определения железа в органической фазе, образованной СК и ДФГ, органическую микрофазу разбавляли 3-5 мл хлороформа. Далее хлороформный раствор выливали в колбу для титрования. Содержание железа определяли прямым комплексонометрическим титрованием в кислой среде. При оптимальных концентрациях СК и HCl определяли соотношение ДФГ:Fe, которое оказалось равным 1:1. Таким образом, на один атом железа в комплексном соединении приходится одна молекула ДФГ [фиг.4].
Соотношение Fe:СК также определяли методом изомолярной серии. Как видно, соотношение Fe:СК составляет 1:1. Таким образом, в состав экстрагируемого комплексного соединения железа входит одна молекула салициловой кислоты на один ион железа [фиг.5].
Таким образом, в органическую микрофазу извлекается комплекс с мольным отношением компонентов ДФГ:Fe3+:СК, равным 1:1:1. Вероятнее всего, в процессе экстракции образуется салицилат железа [FeSal·ДФГ]Х2, где X - неорганический анион (в кислой среде ион железа координирует одну молекулу СК), который сольватируется одной молекулой ДФГ.
Полученные данные о составе извлекающихся комплексных соединений железа позволяют предложить следующие уравнения его экстракции в микрофазу, а также процесса образования самой микрофазы:
ДФГ+HSal↔(ДФГ·Н)Sal,
FeSal2++2Х-+(ДФГ·H)Sal=[FeSal·ДФГ]X2+HSal.
Пример. Для определения железа(III) в расслаивающейся системе ДФГ-СК-HCl-вода поступали следующим образом. Навески СК, массой 0,55 г и ДФГ, массой 0,85 г помещали в пробирку на 20 мл, создавали концентрацию HCl 0,05 моль/л, добавляли хлорид железа(III) (1·10-4-2·10-2 моль/л) и доводили водой до объема 20 мл. Пробирки помещали на водяную баню и нагревали в течение 20-30 мин. Затем всю систему охлаждали до комнатной температуры. Водную фазу сливали в колбу для титрования и титровали раствором ЭДТА до желтой окраски. Образовавшуюся органическую фазу разбавляли 3-5 мл хлороформа, затем переносили в колбу для титрования и титровали раствором ЭДТА.
Таким образом, предлагаемый способ выделения и определения железа(III) в водных растворах дифенилгуанидином, обладает высокой чувствительностью, отличается хорошей воспроизводимостью и селективностью.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ МАРГАНЦА (II) | 2009 |
|
RU2415415C1 |
| СПОСОБ ИЗВЛЕЧЕНИЯ ИОНОВ ИНДИЯ (III) | 2013 |
|
RU2555463C2 |
| Способ экстрагирования содержащих сульфогруппы растворимых в воде комплексных соединений металлов | 1960 |
|
SU133257A1 |
| Состав для экстракции в водных расслаивающихся системах без органического растворителя | 2015 |
|
RU2640340C2 |
| СПОСОБ РАЗДЕЛЕНИЯ МЕДИ (I) И МЕДИ (II) | 2009 |
|
RU2416452C1 |
| СПОСОБ ВЫДЕЛЕНИЯ СКАНДИЯ | 1993 |
|
RU2049728C1 |
| Способ экстракции ионов металлов | 2016 |
|
RU2650948C2 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ИОНОВ ОЛОВА (II) И (IV) В ВОДНЫХ РАСТВОРАХ | 2011 |
|
RU2475548C1 |
| Способ определения микроколичеств железа (III) и титана (IV) | 1979 |
|
SU881603A1 |
| Способ извлечения скандия(III) для его последующего определения в системе, содержащей антипирин и сульфосалициловую кислоту | 2015 |
|
RU2645068C2 |


Изобретение может быть использовано в аналитической химии. Для выделения железа (III) из водных растворов используют в качестве первого органического реагента дифенилгуанидин (ДФГ). В качестве второго органического реагента используют салициловую кислоту (СК), а в качестве разбавителя органической фазы - хлороформ. В органическую фазу извлекают комплекс с мольным соотношением компонентов ДФГ:Fе3+:СК, равным 1:1:1. Процесс выделения железа (III) проводят при кислотности среды рН=1,5-2,5 с последующим определением железа (III) титриметрическим методом. Изобретение позволяет повысить селективность и упростить процесс выделения и определения железа (III) из водных растворов. 1 з.п. ф-лы, 5 ил., 1 пр.
1. Способ выделения и определения железа (III) из водных растворов с использованием в качестве органического реагента дифенилгуанидина, отличающийся тем, что в качестве второго органического реагента используют салициловую кислоту, а в качестве разбавителя органической фазы - хлороформ при кислотности среды рН=1,5-2,5 с последующим определением железа (III) титриметрическим методом.
2. Способ по п.1, отличающийся тем, что в органическую микрофазу извлекается комплекс с мольным соотношением компонентов ДФГ:Fе3+:СК, равным 1:1:1.
| Способ определения железа | 1982 |
|
SU1125542A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЖЕЛЕЗА В ВОДЕ | 2002 |
|
RU2216019C1 |
| Способ определения железа | 1988 |
|
SU1682921A1 |
| Способ определения железа (III) | 1984 |
|
SU1270692A1 |
| EP 1884283 B1, 24.04.2013. | |||
Авторы
Даты
2015-04-27—Публикация
2013-11-12—Подача