Изобретение относится к области микробиологии, в частности к методам определения чувствительности штаммов Pseudomonas aeruginosa (P. Aeruginosa) к антибиотикам.
Инфекции, вызванные синегнойной палочкой, нередко характеризуются тяжелым течением и сопровождаются высокой летальностью. Широкое применение антибиотиков приводит к формированию резистентных к ним штаммов, что значительно затрудняет проведение этиотропной терапии [1]. P. aeruginosa является крайне неприхотливым микроорганизмом с широкими адаптивными возможностями и способностью быстро формировать резистентность к антибиотикам.
В зависимости от конкретных условий применения и исследования действия антибиотиков используют микробиологические анализы, которые включают в себя инкубирование биологического образца на различных ростовых средах и определение роста микроорганизмов на них в присутствии антибиотика.
Известен и широко используется в клинической практике метод бумажных дисков (диско-диффузионный метод) [2], основанный на том, что на поверхность, засеянную определенной культурой микроорганизма, накладываются бумажные диски, каждый из которых пропитан определенным количеством антибиотика. Вокруг дисков формируются зоны задержки роста микроорганизмов. По диаметру этой зоны судят о величине чувствительности микроорганизма к антибиотику. Метод является полуколичественным и применяется в силу своей простоты. Недостаток метода - зависимость результатов от скорости диффузии в агаре антибиотика, которая зависит от многих факторов (молекулярная структура и масса антибиотика, состав, примеси и pH питательной среды).
Известен метод серийных (стандартных) разведений антибиотика в бульоне или в плотной питательной среде. В этом случае чувствительность микроорганизма к антибиотику определяют по минимальной концентрации антибиотика, задерживающей видимый рост микроба в пробирках или чашках с питательной средой, содержащих убывающие концентрации антибиотика [3]. Признано, что метод является наиболее точным, но и наиболее трудоемким и требует много времени. Для ускорения процедуры созданы автоматизированные тест-системы, в которых в специальные полоски с критическими концентрациями препаратов (около 30 антибиотиков) вносят определенную концентрацию испытываемого штамма на специальной среде для роста микроорганизмов. После инкубации в течение 4-6 ч определяют изменение мутности раствора по сравнению с контрольными на автоматическом анализаторе или визуально.
Известны методы определения чувствительности микроорганизмов к антибиотикам, в которых о способности микроорганизмов расти в присутствии антибиотика судят по изменению окислительно-восстановительного потенциала, вследствие продукции микроорганизмами биологически активных веществ [4].
Известны модифицированные методы, в которых при использовании метода бумажных дисков или серийных разведений антибиотиков в питательной среде через 4-6 часов роста культуры в пробирки или на поверхность среды вносится вещество-индикатор, окрашивающий места активного роста микроорганизмов [3].
Недостатками вышеперечисленных методов определения чувствительности микроорганизмов к антибиотикам являются:
- высокая стоимость питательных сред, реактивов и других расходных материалов, а также специальной техники, специально оборудованных помещений, что ограничивает сферу их применения;
- трудоемкость выбора антибиотика для лечения, которая сопряжена как с затратами времени на определение чувствительности, так и с тем, что по мере распространения антибиотиков в практике лечения появляются все новые и новые штаммы, резистентные к известным видам антибиотиков.
Известен способ определения чувствительности микроорганизмов к антимикробным препаратам, выбранный в качестве прототипа, основанный на воздействии лазерным излучением на пробы и измерении интенсивности флуоресценции проб по различным схемам [5].
Недостатками способа являются сравнительно высокая стоимость и энергоемкость лазерной флуоресцентной установки, необходимость ее обслуживания специально обученным персоналом, зависимость результатов анализов от стабильности лазерного излучения, необходимость использования дополнительного образца для дифференциального измерения интенсивности флуоресценции.
Технический результат предлагаемого изобретения - упрощение технологии, снижение ее стоимости и энергозатрат.
Указанный технический результат достигается тем, что на суспензии, полученные после культивации штаммов P. aeruginosa на питательных средах, стимулирующих синтез пиовердина, центрифугирования и фильтрования, воздействуют спонтанным излучением в интервале длин волн 200-300 нм, фиксируют спектры флуоресценции, о резистентности штамма к антибиотикам судят по наличию в полосе флуоресценции максимума в диапазоне длин волн 435-445 нм. О чувствительности штамма к антибиотикам судят по наличию в полосе флуоресценции максимума в диапазоне длин волн 455-470.
Устойчивость бактерий к антибиотикам связана с появлением веществ, защищающих от действия антибиотиков. Такие вещества отсутствуют у чувствительных штаммов, что обусловливает различия в спектрах флуоресценции. Для обнаружения этих различий предлагается использовать не лазерное, а спонтанное ультрафиолетовое излучение.
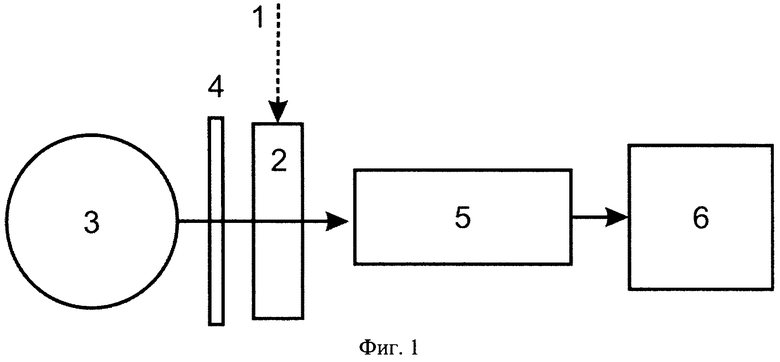
Способ реализуется следующим образом (фиг.1).
Суспензии 1, полученные после культивации штаммов P. aeruginosa на питательных средах, не подавляющих синтез пиовердина, центрифугирования и фильтрования, помещаются в оптическую кювету 2. Спонтанное излучение в интервале длин волн 200-300 нм от лампы 3 освещает кювету 2, вызывая флуоресценцию суспензии. Спонтанное излучение от лампы 3 фильтруется светофильтром 4, а флуоресценция в видимом диапазоне спектра попадает на спектрометр 5 и визуализируется на устройстве 6.
Если в полученном спектре флуоресценции наблюдается максимум в диапазоне длин волн 435-445 нм, то штамм P. aeruginosa, взятый для получения суспензии, обладает полирезистетнтостью к антибиотикам.
Если в полученном спектре флуоресценции наблюдается максимум в диапазоне длин волн 455-470 нм, то штамм проявляет чувствительность к антибиотикам.
В качестве источника спонтанного ультрафиолетового излучения можно использовать эксилампы на молекулах XeBr*, KrCl*, KrBr*, XeI*, Cl2*, Br2*, которые характеризуются моментальным выходом на режим, высокими сроками службы и обеспечивают узкополосное излучение в диапазоне спектра от 200 до 300 нм [6].
Способ обеспечивает упрощение оптической технологии, снижение ее стоимости и энергозатрат, дополнительно, не требует квалифицированного персонала по обслуживанию источника оптического излучения.
Конкретным примером, доказывающим работоспособность способа, является эксперимент, проведенный с 42 штаммами синегнойной палочки, выделенными от больных с различной патологией, на базе Томской областной клинической больницы. Из них у 39 была выявлена способность к синтезу пиовердина.
Идентификацию выделенных культур проводили на основании морфологических, тинкториальных, культуральных, биохимических методов. Биохимические свойства определяли с использованием тест систем NEFERMtest 24 Лахема Микро-Ла-Тест (MIKRO-LA-TEST, Чехия).
У выделенных штаммов определяли наличие факторов патогенности, для чего делали посевы чистых культур на кровяной агар для выявления гемолитической активности, на желточный агар - для обнаружения фосфолипазной активности. Протеолитическую активность оценивали по стандартной методике [7].
Чувствительность к антибиотикам выявляли по стандартному диско-диффузионному методу, основанному на оценке диаметра зоны задержки роста исследуемого микроорганизма [2].
Для получения суспензий культуры выращивали на натрий-калиевом фосфатном буфере с добавлением 0,4% сукцината (для стимуляции синтеза пиовердина), в течение 4-6 сут. После чего суспензию центрифугировали (8000 об/мин) в течение 10-15 минут, а затем фильтровали через бактериальные фильтры.
Для возбуждения флуоресценции использовали эксилампы на молекулах XeBr* и KrCl*, которые обеспечивали плотность мощности облучения на кювете 20 и 10 мВт/см2.
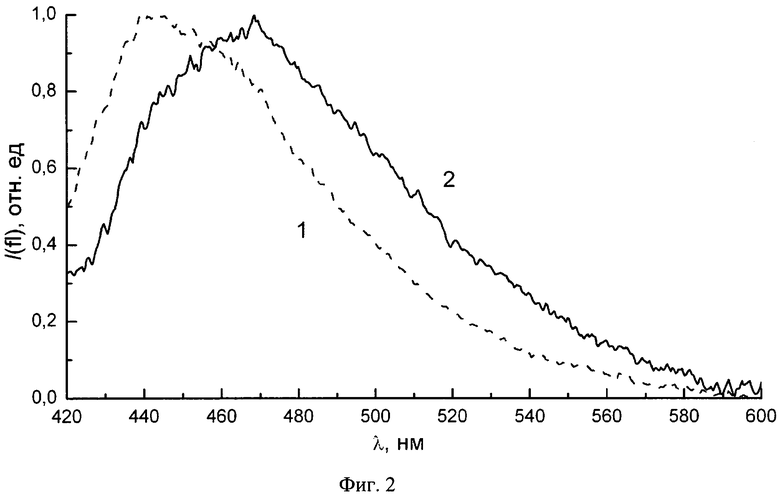
Полученные от фильтратов спектры флуоресценции сравнивали с данными о чувствительности штаммов к антибиотикам. На фиг.2 показан пример полученных спектров от двух суспензий. Спектр 1 соответствует суспензии, полученной от штамма Р. aeruginosa, показавшего резистентность к семи антибиотикам (карбиницилин, цефтазедим, цефоперазон, меропенем, имипенем, ципрофлоксацин, левофлоксацин), а спектр 2 соответствует суспензии, полученной от штамма P. aeruginosa, чувствительного ко всем использованным антибиотикам (карбиницилин, цефтазедим, цефоперазон, меропенем, имипинем, ципрофлоксацин, левофлоксацин, гентамицин, амикацин). Видно, что маркером резистентности штамма к антибиотикам служит наличие в полосе флуоресценции максимума в диапазоне длин волн 435-445 нм, а маркером чувствительности штамма к антибиотикам служит наличие в полосе флуоресценции максимума в диапазоне длин волн 455-470 нм.
В нашем исследовании флуоресценция с максимумом в диапазоне длин волн 435-445 нм была получена в 10 случаях. Среднее значение для количества антибиотиков, к которым эти штаммы проявляют резистентность, составляет 5.9. Флуоресценция с максимумом в диапазоне длин волн 455-470 нм была получена в 7 случаях. Среднее значение для количества антибиотиков, к которым эти штаммы проявляют резистентность, составляет 0.4.
Таким образом, испытания показали, что в сравнении с другими способами предложенный способ обеспечивает упрощение оптической технологии, снижение ее стоимости и энергозатрат, не требует квалифицированного персонала по обслуживанию источника оптического излучения [5]. Что, в конечном счете, облегчает выработку решения по назначению антибиотиков при лечении.
Дополнительно способ может использоваться в научных исследованиях чувствительности штаммов P. aeruginosa, в том числе изменивших свою чувствительность к препаратам.
Источники информации
1. Сидоренко С.В., Резван С.П., Стерхова Г.А., Грудинина С.А. Госпитальные инфекции, вызванные Pseudomonas aeruginosa. Распространение и клиническое значение антибиотикорезистентности // Антибиотики и химиотерапия. 1999. №3. С.25-34.
2. Скала Л.З., Сидоренко С.В., Нехорошева А.Г. и др. Практические аспекты современной клинической микробиологии. Тверь: ООО «Издательство «Триада», 2004. 312 с.
3. Новиков Д.К., Генералов И.И., Данющенкова Н.М. Медицинская микробиология. Витебск: ВГУ, 2010. 597 с.
4. Гудкова Е.И., Адарченко А.А., Скороход Г.А., Ласточкина Т.М. Ускоренные и экспресс-методы определения чувствительности-устойчивости микроорганизмов к антибиотикам // Медицинский журнал. 2006. №3. С.114-116.
5. Александров М.Т., Бажанов Н.Н., Грачев С.В., Жогун В.Н., Косарев В.И., Магомедов З.А., Мазур М.М., Пашков Е.П., Шорин В.Н. Способ определения чувствительности микроорганизмов к антимикробным препаратам // Патент RU 2321855, МПК G01N 33/48, 21/00. Опубликовано: 10.04.2008.
6. Бойченко A.M., Ломаев М.И., Панченко А.Н., Соснин Э.А., Тарасенко В.Ф. Ультрафиолетовые и вакуумно-ультрафиолетовые эксилампы: физика, техника и применения. Томск: STT, 2011. 512 с.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ИНАКТИВАЦИИ БАКТЕРИЙ Enterococcus faecalis (ВАРИАНТЫ) | 2013 |
|
RU2550132C1 |
| ФОТОСТАБИЛЬНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ТЕРАПИИ ОЧАГОВ БАКТЕРИАЛЬНОГО ПОРАЖЕНИЯ | 2017 |
|
RU2662082C2 |
| СПОСОБ ОБЕЗЗАРАЖИВАНИЯ ТЕКУЧИХ СРЕД И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2010 |
|
RU2458011C2 |
| БИОМАРКЕРЫ ИНФЕКЦИЙ ДЫХАТЕЛЬНЫХ ПУТЕЙ | 2012 |
|
RU2611385C2 |
| Лечение резистентного бактериального кератита с помощью мягкой контактной линзы на квантовых точках | 2023 |
|
RU2811935C1 |
| Композиция на основе ципрофлоксацина и 7-гидроксикумарина, подавляющая систему чувства кворума LuxI/LuxR-типа у бактерий | 2024 |
|
RU2833847C1 |
| Применение низкоразмерных двумерных (2D) складчатых структур оксигидроксида алюминия (ALOOH) для преодоления устойчивости бактерий к антибиотикам | 2018 |
|
RU2705989C1 |
| Синтетические аналоги природных пептидов, обладающих антибактериальной активностью | 2023 |
|
RU2826459C1 |
| СПОСОБ ФОТОКАТАЛИТИЧЕСКОГО ОБЕЗЗАРАЖИВАНИЯ ПОВЕРХНОСТЕЙ | 2009 |
|
RU2404814C1 |
| РЕКОМБИНАНТНЫЙ ШТАММ Escherichia COLI ZV1 - НОСИТЕЛЬ КЛОНИРОВАННОЙ ПОСЛЕДОВАТЕЛЬНОСТИ ХРОМОСОМНОЙ ДНК Burkholderia pseudomallei, ДЕТЕРМИНИРУЮЩЕЙ СИНТЕЗ БЕЛКА 32 kDa И РЕЗИСТЕНТНОСТЬ К ПЕФЛОКСАЦИНУ И СТРЕПТОМИЦИНУ | 2004 |
|
RU2280688C1 |
Изобретение относится к области микробиологии, в частности к методам определения чувствительности штаммов Pseudomonas aeruginosa (P. aeruginosa) к антибиотикам. Способ определения чувствительности по спектрам флуоресценции включает культивацию штаммов P. aeruginosa на питательных средах, стимулирующих синтез пиовердина, центрифугирование и фильтрование культур для получения пробы, облучение пробы спонтанным ультрафиолетовым излучением в интервале длин волн 200-300 нм, получение спектров флуоресценции, маркером резистентности штамма к антибиотикам служит наличие в полосе флуоресценции максимума в диапазоне длин волн 435-445 нм. Маркером чувствительности штамма к антибиотикам служит наличие в полосе флуоресценции максимума в диапазоне длин волн 455-470 нм. Изобретение позволяет упростить технологию оптических методов исследования и оптимизировать лечение бактериальных инфекций. 2 ил.
Способ определения чувствительности штаммов Pseudomonas aeruginosa к антибиотикам по спектрам флуоресценции, включающий культивацию штаммов P. aeruginosa на питательных средах, стимулирующих синтез пиовердина, центрифугирование и фильтрование культур для получения пробы; облучение пробы спонтанным ультрафиолетовым излучением в интервале длин волн 200-300 нм; получение спектров флуоресценции; маркером резистентности штамма к антибиотикам служит наличие в полосе флуоресценции максимума в диапазоне длин волн 435-445 нм; маркером чувствительности штамма к антибиотикам служит наличие в полосе флуоресценции максимума в диапазоне длин волн 455-470 нм.
| СПОСОБ ОПРЕДЕЛЕНИЯ ЧУВСТВИТЕЛЬНОСТИ МИКРООРГАНИЗМОВ К АНТИМИКРОБНЫМ ПРЕПАРАТАМ | 2006 |
|
RU2321855C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЧУВСТВИТЕЛЬНОСТИ МИКРООРГАНИЗМОВ С МНОЖЕСТВЕННОЙ ЛЕКАРСТВЕННОЙ УСТОЙЧИВОСТЬЮ К СОЧЕТАНИЯМ АНТИБАКТЕРИАЛЬНЫХ ПРЕПАРАТОВ | 2008 |
|
RU2388827C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЧУВСТВИТЕЛЬНОСТИ МИКРООРГАНИЗМОВ К АНТИБИОТИКАМ ПРИ ЛЕЧЕНИИ ГНОЙНО-ВОСПАЛИТЕЛЬНОГО ЗАБОЛЕВАНИЯ | 2003 |
|
RU2262533C2 |
| СПОСОБ ЛЮМИНЕСЦЕНТНОЙ ДИАГНОСТИКИ И/ИЛИ КАЧЕСТВЕННОЙ ОЦЕНКИ СОСТОЯНИЯ БИОЛОГИЧЕСКОГО ОБЪЕКТА И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2004 |
|
RU2254372C1 |
Авторы
Даты
2015-05-10—Публикация
2013-11-18—Подача