Предлагаемое изобретение относится к способам получения новых фосфорорганических соединений, конкретно к способу получения полициклических 3-фенилфосфоланов формулы 1а-г,

которые могут найти применение в качестве лигандов [MacKay, J.A., Vedejs, Е.; J. Org. Chem., 2006, 71, 498; Kollar, L.; Keglevich, G.; Chem. Rev., 2010, 110, 4257; Klosin, J., Landis, C.R. Acc. Chem. Ress. 2007, 40, 1251], промежуточных реагентов для тонкого органического и металлоорганического синтеза [Keglevich, G., Forintos, Н., Keseru, G.M., Hegedus, L., Toke, L. Tetrahedron 2000, 56, 4823; Yamashita, M., Reddy, V.K., Rao, L.N., Haritha, В., Maeda, M., Suzuki, K., Totsuka, H., Takahashi, M., Oshikawa, T. Tetrahedron Lett. 2003, 44, 2339] и потенциальных биологически активных соединений [Yamada, М., Yamashita, М., Suyama, Т., Yamashita, J., Asai, K, Niimi, Т., Ozaki, N., Fujie, M., Maddali, K., Nakamura, S., Ohnishi, K. Bioorg. Med. Chem. Lett. 2010, 20, 5943].
Известен способ [M.J. Burk, J.E. Feaster, R.L. Harlow. New electron-rich chiral phosphines for asymmetric catalysis. Organometallics, 1990, 9, 2653-2655] получения 2,5-диалкилзамещенных фосфоланов из ациклических диолов взаимодействием их мезилатов с литийфенилфосфином Li2PPh. Реакция протекает по схеме 
Известным способом не могут быть получены полициклические 3-фенилфосфоланы.
Известен способ [Chen, Z., Jtang, Q., Zhu, G., Xiao, D., Cao, P., Guo, C., Zhang, X. Synthesis of novel chiral monophosphines. 2,5-dialkyl-7-phenylphosphabicyclo[2.2.1]heptanes, and their application in highlyenantioselective Pd-catalyzed allylic alkylations. // J. Organic Chemistry, 1997, 62, 4521-4523] получения бициклических фосфоланов, исходя из циклических 1,4-диолов, превращением их в соответствующие мезилаты, последующее нуклеофильное замещение последних литийфенилфосфином Li2PPh приводит к целевым фосфоланам по схеме

Известный способ не позволяет получать полициклические 3-фенилфосфоланы.
Известен способ [Джемилев У.М., Толстиков Г.А., Ибрагимов А.Г., Золотарев. А.П. Авторское свидетельство №1747452, 1992] получения 1-фенил-3-алкилфосфоланов взаимодействием линейных олефинов с триэтилалюминием (AlEt3) в присутствии катализатора цирконоцендихлорида (Cp2ZrCl2), взятых в молярном соотношении соответственно 1:(1-1.2):(0.01-0.03) в атмосфере инертного газа при комнатной температуре в течение 8 часов в среде алифатического растворителя, с последующей обработкой образующейся реакционной смеси фенилдихлорфосфином, в количестве 1:1.25 по отношению к олефину, в среде эфира при 0°C с последующим перемешиванием реакционной массы в атмосфере аргона при комнатной температуре 6-8 ч. Реакция протекает по схеме

Известный способ не позволяет получать полициклические 3-фенилфосфоланы формулы 1а-г.
Известен способ [Джемилев У.М., Ибрагимов А.Г., Хафизова Л.О., Ялалова Д.Ф., Ханов В.Х., Кириченко Г.Н., Кулакова Р.В. Патент РФ №2220974, 2002] получения 1-фенил-транс-3,4-диалкилфосфоланов взаимодействием α-олефинов с этилалаюминийдихлоридом и металлическим магнием в мольном соотношении (20-22):10-12:10, в присутствии катализатора цирконоцендихлорида (Cp2ZrCl2), взятого в количестве 3-7 мол.% по отношению к металлическому магнию, в атмосфере аргона при комнатной температуре и атмосферном давлении в ТГФ, с последующим добавлением при -15°C 8-10 мол.% катализатора CuCl по отношению к олефину и эквимольного по отношению к этилалюминийдихлориду количества фенилдихлорфосфина. Реакция протекает по схеме

По известному способу в качестве алюминийорганического соединения используется этилалюминийдихлорид, реакция проводится в эфирном растворителе, замещение атома алюминия на атом фосфора проходит в присутствии катализатора CuCl.
Известным способом не могут быть получены полициклические 3-фенилфосфоланы формулы 1а-г.
Известен способ [Guillen, F., Fiaud, J.-C. Enantiomerically pure 1,2,5-triphenylphospholane through the synthesis and resolution of the chiral trans-(2,5)-diphenylphospholanic acid. // Tetrahedron Lett., 1999, 40, 2939-2942] синтеза транс-2,5-трифенилфосфолана через образование и последующую декомплексацию соответствующего боранового комплекса 1-оксо-1,2,5-трифенилфосфолана, полученного двумя различными методами: взаимодействием 1-оксо-1-хлор-2,5-дифенилфосфолана с дифенилкупратом лития при -78°C или реакцией кросс-сочетания PhI с соответствующим вторичным фосфиноксидом, полученным из 1-оксо-1-хлор-2,5-дифенилфосфолана. Реакции протекают по схеме
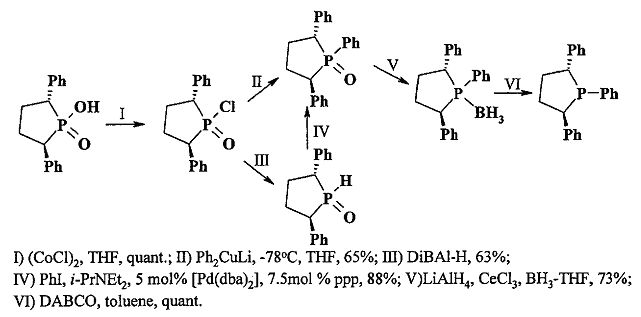
Известным способом не могут быть получены полициклические 3-фенилфосфоланы формулы 1а-г.
Известен способ [MacKay, J.A., Vedejs, Е. Synthesis and reactivity of new chiral bicyclic phospholanes as acyl-transfer catalysts. // J. Organic Chemistry, 2006, 71, 498-503] получения полициклозамещенных фосфоланов, а именно 3-фенил-3-фосфатрицикло[5.2.1.02,6]декана, декомплексацией нагреванием в пирролидине его боранового комплекса, полученного из соответствующего алюмина- либо цирконациклопентана замещением атома металла на атом фосфора в результате реакции с дихлорфенилфосфином, с одновременным добавлением раствора борана в ТГФ по схеме 2

Реакция алюминациклопентана с галогенидом трехвалентного фосфора приводит к преимущественному образованию эпимера с экзо-положением фенильного заместителя при фосфоре, тогда как цирконацикл дает преимущественно эндо-фенилзамещенный эпимер. По данному способу 3-фенил-3-фосфатрицикло[5.2.1.02,6]декан 1а получен через трехстадийный синтез.
Таким образом, в литературе отсутствуют сведения по синтезу полициклических фосфоланов 1а-г, исходя из каркасных углеводородов ряда норборнена.
Предлагается способ синтеза полициклических 3-фенилфосфаланов.
Сущность предлагаемого способа заключается во взаимодействии каркасного углеводорода, содержащего двойную С-С связь в норборненовом фрагменте, таких как бицикло[2.2.1]гептен-2, или экзо-трицикло[3.2.1.02,4]октен-6, или тетрацикло[4.3.0.02,4.03,7]нонен-8, или дициклопентадиен (непредельное соединение), с триэтилалюминием (AlEt3) в присутствии катализатора Cp2ZrCl2, при мольном соотношении реагентов Cp2ZrCl2:непредельное соединение:AlEt3=0.01-0.1:1:1.05-1.1, в атмосфере аргона при температуре 15-25°C в течение 12 ч с последующим добавлением растворителя и при -10°C галогенида трехвалентного фосфора RPCl2 (где R=Ph) в количестве 1:1 (моль/моль) по отношению к AlEt3, после чего реакционную массу перемешивают в течение 30 мин при 15-25°C. В качестве растворителя можно использовать ароматические (толуол, бензол) или алифатические (гексан) растворители. В эфирных растворителях (ТГФ, диэтиловый эфир) реакция не идет. Выход полициклических фосфоланов (1а-г), определенный по продуктам гидролиза с помощью ГЖХ, составляет 77-84%. Реакция протекает по схеме:

Триэтилалюминий AlEt3 и галогенид фосфора (III) RPCl2 (где R=Ph) берут в эквимольных количествах, с целью предотвращения образования побочных продуктов. Снижение количества AlEt3 по отношению к непредельному соединению на первой стадии реакции либо снижение количества галогенида фосфора (III) RPCl2 (где R=Ph) по отношению к образующемуся алюминациклопентану на второй стадии приводит к снижению конверсии каркасного углеводорода норборненового ряда либо алюминациклопентана, соответственно, и, как следствие, вызывает уменьшение выхода целевого продукта. Изменение соотношения исходных реагентов в сторону увеличения содержания триэтилалюминия и PhPCl2 приводит к образованию побочного диэтилфенилфосфина.
Проведение указанной реакции в присутствии катализатора Cp2ZrCl2 более 5 мол.% не приводит к существенному увеличению выхода целевых продуктов. Использование катализатора Cp2ZrCl2 менее 1 мол.% снижает выход алюминациклопентана, что связано, возможно, со снижением каталитически активных центров в реакционной массе. Опыты проводят при температуре 15-25°C. При более высокой температуре, например 50°C, уменьшается селективность реакции, при меньшей температуре, например 0°C, снижается скорость реакции.
Существенные отличия предлагаемого способа.
Предлагаемый способ базируется на использовании в качестве исходных реагентов AlEt3, каркасных углеводородов норборненового ряда и галогенидов трехвалентного фосфора RPCl2 (где R=Ph), а в качестве катализатора - не более 5 мол.% Cp2ZrCl2. В литературе имеется всего один пример получения конкретно 3-фенил-3-фосфатрицикло[5.2.1.02,6]декана 1а, исходя из алюмина- или цирконациклопентана, однако целевой фосфолан получают через дополнительную стадию образования и разложения его боранового комплекса. В других известных способах в качестве исходных реагентов, кроме триэтилалюминия, используют 1,4-диол, литийфецилфосфин, α-олефин, магний, этилалюминийдихлорид, а реакцию с галогенидом фосфора(III) проводят в каталитическом варианте и более продолжительное время. Кроме того, если по известным методикам образуются алкилзамещенные и 2,5-диалкилзамещенные бициклические 1-фенилфосфоланы, то в предлагаемом способе образуются полициклические 3-фенилфосфоланы 1а-г.
Предлагаемый способ обладает следующими преимуществами
1. Способ позволяет получать с высокой селективностью 3-фенил-3-фосфаполициклоалканы формулы (1а-г), синтез которых в литературе не описан.
Способ поясняется следующими примерами.
Пример 1. В стеклянный реактор объемом 50 мл, установленный на магнитной мешалке в атмосфере сухого аргона при 0°C и перемешивании, последовательно помещают 0.0584 г (0.20 ммоль) Cp2ZrCl2, 0.376 г (4 ммоль) норборнена и 0.66 мл (4.4 ммоль (92%)) AlEt3. Температуру доводят до комнатной (~20°C) и перемешивают 12 ч. Затем в реакционную смесь добавляют 5 мл толуола и охлаждают до -10°C, прикапывают 0.6 мл (4.4 ммоль) дихлорфенилфосфина PhPCl2 и перемешивают при комнатной температуре еще 30 мин. Реакционную массу обрабатывают насыщенным водным раствором NH4Cl, продукты реакции экстрагируют диэтиловым эфиром, сушат над MgSO4. Растворитель упаривают, целевой фосфолан выделяют вакуумной разгонкой. Все операции проводят в токе аргона. Получают 3-фенил-3-фосфатрицикло[5.2.1.02,6]декан 1а с выходом 83%.
Другие примеры, подтверждающие способ, приведены в табл.1.
Таблица 1
Реакции проводят при 15-25°C.
В качестве растворителя используют толуол, бензол либо гексан. Для соединений 1а-г удалось выделить только цис-стереоизомеры, образующиеся в преимущественном количестве. Спектральные характеристики соединений 1а-г.
3-фенил-3-фосфатрицикло [5.2.1.02,6]декан 1а:

Спектр ЯМР 1H (δ, м.д., J/Гц, CDCl3): 1.10-1.30 (м, 3Н, С(10)На, С(8)На, С(9)На), 1.46-1.70 (м, 4Н, С(10)Нб, С(8)Нб, С(7)Нб, С(5)На), 1.79-1.88 (м, 1H, С(4)На), 1.97-2.10 (м, 2Н, С(4)Нб, С(7)Н), 2.14-2.20 (м, 1H, С(4)Нб), 2.22-2.27 (м, 2Н, С(3)Н, С(2)Н), 2.46-2.52 (м, 1H, С(6)Н), 7.26-7.43, 7.44-7.52, 7.54-7.57 (м, 5Н, Ph).
Спектр ЯМР 13С (δ, м.д., J/Гц): 28.09 (С(4), JCP=10.05), 29.27 (С(8)), 30.23 (С(9), JCP=11.1), 33.52 (С(5), JCP=6), 34.72 (С(10), JCP=4), 41.54 (С(2), JCP=26.15), 42.25 (C(7)), 50.76 (C(1), JCP=2), 52.55 (C(6), JCP=11.1), 127.53, 128.22 (Ph, JCP=5), 128.30, 130.92 (Ph, JCP=15.1). Спектр ЯМР 31P (δ, м.д.): 2.97 м.д. Т.кип.=193-195/10 мм рт.ст.
3-фенил-3-фосфа-экзя-тетрацикло [5.3.1.02,608,10]ундекан (1б):

Спектр ЯМР 1Н (δ, м.д., J/Гц, CDCl3): 0.17-0.20 (м, 1Н, С(9)На), 0.55-0.64 (м, 1H, С(9)Нб), 0.75-0.98 (м, 4Н, С(8)Н, С(10)Н, С(5)Н2), 1.24-1.35 (м, 1H, С(11)На), 1.57-1.65 (м, 1H, С(11)Нб), 1.85-1.92 (м, 1Н, С(4)На), 2.08-2.18 (м, 2Н, С(7)Н, (4)Нб), 2.34-2.45 (м, 2Н, С(2)Н, С(1)Н), 2.47-2.52 (м, 1Н, С(6)Н), 7.26-7.43, 7.44-7.52,
7.54-7.57 (м, 5Н, Ph). Спектр ЯМР 13C (δ, м.д., J/Гц):4.51 (С(9)), 16.45 (С(8)), 17.35 (С(10), JCP=13.1), 23.23 (С(5), JCP=5), 28.27 (С(4), JCP=5), 31.56 (С(11), JCP=6), 40.97 (G(2), JCP=27.15), 41.85 (С(7)), 51.58 (С(1)), 52.98 (С(6), JCP=8.05), 128.05, 128.35 (Ph, JCP=6), 128.62 (Ph, JCP=81.5), 131.16 (Ph, JCP=15.1). Спектр ЯМР 31P (δ, м.д.): -2.64 м.д. Т.кип.=197-199/10 мм рт.ст.
3-фенил-3-фосфапентацикло[6.4.0.02,6.08.10]додекан (1в):

Спектр ЯМР 1H (δ, м.д., J/Гц, CDCl3): 0.93-1.02 (м, 1Н, С(8)Н), 1.02-1.09 (м, 1H, С(10)Н), 1.15-1.17 (м, 1H, С(9)Н), 1.55-1.64 (м, 2Н, С(12)Н2), 1.70-1.80 (м, 1H, (С(5)На), 1.81-2.06 (м, 5Н, С(7)Н, С(11)Н, С(4)Н2, С(5)Нб), 2.23-2.31 (м, 1Н, С(2)Н), 2.72-2.85 (м, 2Н, С(1)Н, С(6)Н), 7.21-7.49 (м, 5Н, Ph). Спектр ЯМР 13С (δ, м.д., J/Гц): 14.35 (С(9)), 16.53 (С(8)), 17.11 (С(10), JCP=15.1), 28.08 (С(4), JCP=10.1), 32.29 (С(12)), 33.48 (С(5)), 39.14 (С(11)), 48.12 (С(2), JCP=28.1), 48.66 (C(1), JCP=3), 49.21 (С(7)), 49.91 (С(6), JCP=11.1), 127.39, 128.18 (Ph, JCP=4.1), 130.81 (Ph, JCP=15.1), 131.50 (Ph, JCP=12.1). Спектр ЯМР 31P (δ, м.д.): 2.52. Т.кип.=201-203/5 мм рт.ст.
3-фенил-3-фосфатетрацикло[5.5.1.02,6.08,12]тридец-10-ен (1 г):
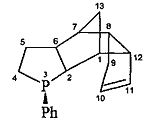
Спектр ЯМР 1H (δ, м.д., J/Гц, CDCl3): 1.36-1.43 (м, 1Н, (С(13)На), 1.54-1.86 (м, 2Н, (С(5)На, С(13)Нб), 1.75-1.88 (м, 1H, С(4)На), 1.95-2.01 (м, 1H, С(7)Н), 2.01-2.20 (м, 2Н, С(4)Нб, С(5)Нб), 2.20-2.38 (м, 2Н, С(9)Н2, С(8)Н, С(6)Н), 2.50-2.62 (м, 2Н, С(1)Н, С(2)Н), 3.12-3.19 (м, 1H, С(12)Н), 5.55-5.60 (м, 1H, С(10)Н), 5.67-5.71 (м, 1H, С(11)Н), 7.24-7.30, 7.30-7.37, 7.37-7.44 (м, 5Н, Ph).
Спектр ЯМР 13С (δ, м.д., J/Гц): 28.40 (С(4), JCP=9.05), 32.10 (С(9)), 33.91 (С(5), JCP=6), 37.95 (С(13), JCP=5), 42.03 (С(8)), 42.14 (C(1), JCP=2), 44.68 (С(2), JCP=26.2), 47.06 (С(7)), 47.67 (С(6), JCP=10,1), 53.50 (С(12), JCP=10.1), 131.42 (С(10)), 132.23 (C(11)), 127.41, 128.19 (Ph, JCP=5), 128.34, 130.82 (Ph, JCP=15.1). Спектр ЯМР 31P (δ, м.д.): 2.62. Т.кип.=202-205/5 мм рт.ст.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИЦИКЛИЧЕСКИХ 3-ФЕНИЛФОСФОЛАН-3-СУЛЬФИДОВ | 2013 |
|
RU2551664C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИЦИКЛИЧЕСКИХ 3-АЛКИЛ(ФЕНИЛ)ФОСФОЛАН-3-ОКСИДОВ | 2013 |
|
RU2551684C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛ-1-ФЕНИЛ(АЛКИЛ)ЗАМЕЩЕННЫХ ФОСФОЛ-2-ЕН-1-ОКСИДОВ | 2014 |
|
RU2570205C2 |
| Способ получения 3-алкил(арил)-1-дихлорметилфосфолан оксидов | 2023 |
|
RU2812208C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛ-1-ФЕНИЛ(АЛКИЛ)ЗАМЕЩЕННЫХ ФОСФОЛ-2-ЕН-1-СУЛЬФИДОВ | 2014 |
|
RU2556008C1 |
| Способ получения 2-[(оксифенил)метил]бутан-1,4-диолов | 2016 |
|
RU2646222C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ДИЭТИЛАЛЮМИНА-2-ЭТИЛАЛКАНОВ | 2008 |
|
RU2440358C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2,6-ДИЭТИЛ-5,7-ДИФЕНИЛ-1,2,3,3a,4,6,8,8a-ОКТАГИДРОАЛЮМАЦИКЛОПЕНТАДИЕНО[3,4-f]ИЗОАЛЮМАИНДОЛА | 2004 |
|
RU2280037C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПИРИДИНАТОВ 1-ФТОР(ХЛОР)-3-АЛКИЛ(АРИЛ)БОРОЛАНОВ | 2013 |
|
RU2532925C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ЭТИЛ-3-[(ОКСИФЕНИЛ)МЕТИЛ]АЛЮМИНАЦИКЛОПЕНТАНОВ | 2013 |
|
RU2540089C1 |
Изобретение относится к способу получения новых фосфорорганических производных формулы 1а-г,

которые могут найти применение в качестве лигандов металлокомплексных катализаторов, промежуточных реагентов для тонкого органического и металлорганического синтеза. Способ заключается во взаимодействии каркасных углеводородов норборненового ряда с триэтилалюминием (AlEt3) в присутствии катализатора цирконоцендихлорида (Cp2ZrCl2) в атмосфере аргона при температуре 15-25°C и атмосферном давлении в течение 12 часов без растворителя с добавлением на второй стадии толуола, бензола или гексана и PhPCl2 при температуре -10°C в количестве 1:1 по отношению к триэтилалюминию с последующим перемешиванием реакционной массы в атмосфере аргона при комнатной температуре в течение 30 мин. 1 з.п. ф-лы, 1 пр., 1 табл.
1. Способ получения полициклических фосфоланов формулы 1а-г

взаимодействием каркасного непредельного соединения с триэтилалюминием в присутствии катализатора Cp2ZrCl2, отличающийся тем, что в качестве каркасного непредельного соединения используют бицикло[2.2.1]гептен-2, или экзо-трицикло[3.2.1.02,4]октен-6, или тетрацикло[4.3.0.02,4.03,7]нонен-8, или дициклопентадиен, реакцию проводят при мольном соотношении реагентов Cp2ZrCl2:непредельное соединение:AlEt3=0.01-0.1:1:1.05-1.1, в атмосфере аргона при температуре 15-25°C и атмосферном давлении в течение 12 ч, с последующим добавлением растворителя, затем дихлорфенилфосфина PhPCl2 при -10°C в количестве 1:1 (моль/моль) по отношению к триэтилалюминию, после чего реакционную смесь перемешивают при температуре 15-25°C в атмосфере аргона 30 мин.
2. Способ по п.1, отличающийся тем, что в качестве растворителя используют толуол, бензол или гексан.
Авторы
Даты
2015-05-27—Публикация
2013-10-16—Подача