Изобретение относится к органической химии, в частности способу получения 2,3-диалкил-1-фенил(алкил)фосфол-2-ен-1-оксидов формулы (1):

где R=Et, Pr, Bu; R′=Me, Bu, Ph.
Указанные соединения могут найти применение в качестве эффективных интермедиатов и лигандов в металлоорганической химии и катализе [Kollar L., Keglevich G. P-Heterocycles as Ligands in Homogeneous Catalytic Reactions, Chem. Rev., 2010, 4257-4302], в качестве прекурсоров при производстве фосфосахаров [Reddy V.K., Haritha В., Oshikawa Т., Yamashita М. A novel conversion of eritro phospholane epoxides to one-carbon atom homologated allylic alcohols, 2004, 45, 2851-2854; Reddy V.K., Rao L.N., Oshikawa Т., Takahashi M., Yamashita M. Synthesis of novel 1-(substiyuytd phenyl)-2-phospholene 1-oxide derivatives, Phosphorus, Sulfur and Silicon, 2002, 177, 1801-1806] и биологически активных соединений [Yamada М., Yamashita M., Suyama Т., Yamashita J., Asai K., Niimi Т., Ozaki N., Fujie M., Maddali K., Nakamura S. Preparation and characterization of novel 4-bromo-2,4-dimethyl-1-phenyl-2-phospholene 1-oxide and the analogous phosphorus heterocycles or phospha sugars, Bioorg. Med. Chem. Lett., 2010, 20, 5943-5946].
Известен способ (У.М. Джемилев, А.Г. Ибрагимов, Г.А. Толстиков, А.П. Золотарев. Способ получения 1-фенил-3-алкилфосфоланов. Авторское свидетельство №1747452 от 15.03.1992) получения 3-алкилфосфоланов (2) взаимодействием α-олефина с Et3Al в алифатическом растворителе под действием катализатора Cp2ZrCl2 при температуре 25°C в течение 8 ч, с последующей обработкой образующейся реакционной смеси фенилдихлорфосфином в среде эфира при 0°C и перемешиванием реакционной смеси при комнатной температуре в течение 6-8 часов. Реакция протекает по схеме:

Известным способом не могут быть получены 2,3-диалкил-1-фенил(алкил)фосфол-2-ен-1-оксиды формулы (1).
Известен способ (Y. Zhou, X. Yan, С. Xi. Preparation of 2-phospholene derivatives from zirconacyclopentenes. Tetrahedron Lett., 2010, 51, 6136-6138) получения 2,3-диалкил-1-фенилфосфоленов (4) взаимодействием фенилдихлорфосфина с цирконациклопентеном (3), полученным из ZrCp2Et2 и дизамещенных ацетиленов, по схеме:
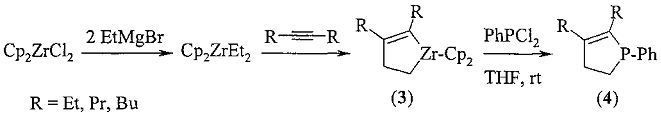
Предлагается новый способ получения 2,3-диалкил-1-фенил(алкил)фосфол-2-ен-1-оксидов (1).
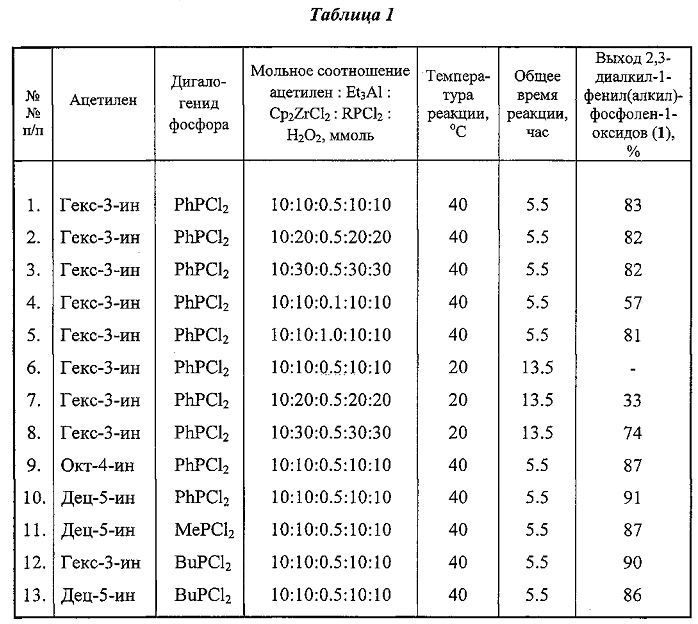
Сущность способа заключается во взаимодействии дизамещенных ацетиленов общей формулы R-≡-R (5), где R=Et, Pr, Bu, с триэтилалюминием (Et3Al) в присутствии катализатора цирконацендихлорида (Cp2ZrCl2), взятых в мольном соотношении ацетилен: Et3Al:Cp2ZrCl2=10:(10÷30):(0.1÷1.0), предпочтительно 10:10:0.5, в толуоле в атмосфере аргона при температуре 20-40°C в течение 4-12 ч, с последующим добавлением при (-5)-(-10)°C фенилдихлорфосфина или алкилдихлорфосфина общей формулы R′PCl2, где R′=Me, Bu, Ph, взятого в эквимольном по отношению к Et3Al количестве, и перемешиванием при комнатной температуре в течение 10-30 мин. Последующее взаимодействие полученных фосфоланов с 30%-ной перекисью водорода, взятой в эквимольном по отношению к фосфину количестве, в хлороформе в течение 1 часа приводит к 2,3-диалкил-1-фенил(алкил)фосфол-2-ен-1-оксидам (1) с выходами 33-91%. Реакция протекает по схеме:

2,3-Диалкил-1-фенил(алкил)фосфол-2-ен-1-оксиды формулы (1) образуются только лишь с участием Et3Al, симметричных ацетиленов, циркониевого катализатора Cp2ZrCl2, и дигалогенидов фосфора. В присутствии других соединений алюминия (например, 

Проведение указанной реакции в присутствии катализатора Cp2ZrCl2 больше 10 мол.% по отношению к симметричным ацетиленам не приводит к существенному увеличению выхода целевого продукта (1). Использование катализатора Cp2ZrCl2 менее 1 мол.% снижает выход 2,3-диалкил-1-фенил(алкил)фосфоленов (1), что связано, возможно, со снижением каталитически активных центров в реакционной массе.
Изменение соотношения исходных реагентов в сторону увеличения их содержания по отношению к исходным ацетиленам не приводит к существенному повышению выхода целевого продукта (1).
Существенные отличия предлагаемого способа:
В известном способе 1-фенил-3-алкилфосфолан (3) получают взаимодействием α-олефинов с Et3Al под действием катализатора Cp2ZrCl2 последующей обработкой образующейся реакционной смеси фенилдихлорфосфином в среде эфира при 0°C и перемешиванием реакционной смеси при комнатной температуре 6-8 часов.
В известном четырехступенчатом способе 2,3-диалкил-1-фенилфосфол-2-ен (1) получают исходя из фенилдихлорфосфина и 2,3-дизамещенного цирконациклопент-2-ена, получаемого из стехиометрических количеств дорогостоящего Cp2ZrCl2, который при -78°C обрабатывается в течение 1 ч EtMgBr и затем образующийся Cp2ZrEt2 вовлекается в реакцию с дизамещенным алкином.
В предлагаемом трехступенчатом способе 2,3-диалкил-1-фенил(алкил)фосфолен-1-оксиды (1) получают из дизамещенных ацетиленов и Et3Al с участием в качестве катализатора Cp2ZrCl2 при температуре 40°C с дальнейшей обработкой реакционной массы с помощью фенилдихлорфосфина или алкилдихлорфосфина в течение 10-30 мин. Последующее взаимодействие 2,3-диалкил-1-фенилфосфол-2-ена (3) с 30%-ной перекисью водорода в хлороформе в течение 1 часа приводит к образованию целевого 2,3-диалкил-1-фенилфосфол-2-ен-1-оксида (1).
Предлагаемый способ обладает следующими преимуществами.
1. Способ позволяет получать с высоким выходом 2,3-диалкил-1-фенил(алкил)фосфол-2-ен-1-оксиды общей формулы (1).
2. Нет необходимости применения низких температур - (-78)°C, реакция проходит при 20-40°C.
3. Дорогостоящий Cp2ZrCl2 используется в каталитических количествах - 1-5 мол.% на исходный алкин.
Способ поясняется следующими примерами.
ПРИМЕР 1. В стеклянный реактор объемом 50 мл, установленный на магнитной мешалке, в атмосфере сухого аргона при 0°C и перемешивании последовательно помещают 20 мл толуола, 1,1 мл (10 ммолей) гекс-3-ина, 0,149 г (0,5 ммолей) Cp2ZrCl2, и 1,5 мл (10 ммолей) Et3Al. Температуру реакционной массы доводят до 40°C и перемешивают 4 ч. Затем реакционную смесь охлаждают до (-5)-(-10)°C, прикапывают 4,1 мл (30 ммоль) фенилдихлорфосфина и перемешивают при комнатной температуре еще 30 мин. Реакционную массу обрабатывают насыщенным водным раствором NH4Cl, продукты реакции экстрагируют диэтиловым эфиром, сушат над MgSO4, растворитель упаривают, целевой фосфолен выделяют вакуумной разгонкой с выходом 83%. К раствору 1,17 г (5 ммоль) синтезированного фосфолена в 10 мл хлороформа при интенсивном перемешивании медленно прикапывают 0,6 мл (5 ммоль) 30%-ной перекиси водорода и перемешивают 1 ч. Затем реакционную смесь промывают водой 3×5 мл, органический слой сушат над MgSO4. Растворитель упаривают.
Другие примеры, подтверждающие способ, приведены в табл. 1.
Спектральные характеристики (1)*:

2,3-Диэтил-1-фенилфосфол-2-ен-1-оксид.
 Найдено (%): C, 71.9; H, 8.3. С14Н19РО. Вычислено (%): C, 71.77; H, 8.17.
Найдено (%): C, 71.9; H, 8.3. С14Н19РО. Вычислено (%): C, 71.77; H, 8.17. 
2,3-Дипропил-1-фенилфосфол-2-ен-1-оксид.
 Найдено (%): С, 73.3; Н, 8.9. C16H23OP. Вычислено (%): С, 73.26; Н, 8.84.
Найдено (%): С, 73.3; Н, 8.9. C16H23OP. Вычислено (%): С, 73.26; Н, 8.84. 
2,3-Дибутил-1-фенилфосфол-2-ен-1-оксид.
 Найдено (%): С, 74.6; H, 9.5. C18H27PO. Вычислено (%): С, 74.45; Н, 9.37.
Найдено (%): С, 74.6; H, 9.5. C18H27PO. Вычислено (%): С, 74.45; Н, 9.37. 
2,3-Дибутил-1-метилфосфол-2-ен 1-оксид.
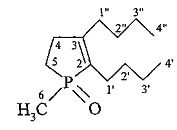 Найдено (%): С, 68.5; Н, 11.2. С13Н25РО. Вычислено (%): С, 68.39; Н, 11.04.
Найдено (%): С, 68.5; Н, 11.2. С13Н25РО. Вычислено (%): С, 68.39; Н, 11.04. 
2,3-Диэтил-1-бутил-1-фосфол-2-ен-1-оксид.
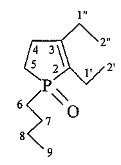 Найдено (%): C, 67.4; H, 10.9. C12H23OP. Вычислено (%): C, 67.26; H, 10.82.
Найдено (%): C, 67.4; H, 10.9. C12H23OP. Вычислено (%): C, 67.26; H, 10.82. 
1,2,3-Трибутил-1-фосфол-2-ен-1-оксид.
 Найдено (%): C, 71.2; H, 11.7. С16Н31ОР. Вычислено (%): С, 71.07; Н, 11.56.
Найдено (%): C, 71.2; H, 11.7. С16Н31ОР. Вычислено (%): С, 71.07; Н, 11.56. 
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛ-1-ФЕНИЛ(АЛКИЛ)ЗАМЕЩЕННЫХ ФОСФОЛ-2-ЕН-1-СУЛЬФИДОВ | 2014 |
|
RU2556008C1 |
| Способ получения 3-алкил(арил)-1-дихлорметилфосфолан оксидов | 2023 |
|
RU2812208C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛ-1-ФЕНИЛ(АЛКИЛ)ЗАМЕЩЕННЫХ ФОСФОЛ-2-ЕНОВ | 2014 |
|
RU2555845C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИЦИКЛИЧЕСКИХ 3-АЛКИЛ(ФЕНИЛ)ФОСФОЛАН-3-ОКСИДОВ | 2013 |
|
RU2551684C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИЦИКЛИЧЕСКИХ 3-ФЕНИЛФОСФОЛАН-3-СУЛЬФИДОВ | 2013 |
|
RU2551664C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФОСФОНАТОВ ИЗ ДИАЛКИЛФОСФИТОВ И ПРОИЗВОДНЫХ НЕПРЕДЕЛЬНЫХ КАРБОНОВЫХ КИСЛОТ | 2014 |
|
RU2551287C1 |
| СПОСОБ СОВМЕСТНОГО ПОЛУЧЕНИЯ 1-(ДИАЛКИЛАМИН)-2,3,4,5-ТЕТРААЛКИЛ(АРИЛ)АЛЮМАЦИКЛОПЕНТАДИЕНОВ И 1-(ДИАЛКИЛАМИН)-2,3-ДИАЛКИЛ(АРИЛ)АЛЮМАЦИКЛОПРОПЕНОВ | 1997 |
|
RU2131432C1 |
| СПОСОБ СОВМЕСТНОГО ПОЛУЧЕНИЯ 1-(АЛКОКСИ)-2,3,4,5- ТЕТРААЛКИЛ(АРИЛ)АЛЮМАЦИКЛОПЕНТАДИЕНОВ И 1-(АЛКОКСИ)-2,3- ДИАЛКИЛ(АРИЛ)АЛЮМАЦИКЛОПРОПЕНОВ | 1997 |
|
RU2130024C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИЦИКЛИЧЕСКИХ 3-ФЕНИЛФОСФОЛАНОВ | 2013 |
|
RU2551650C2 |
| ДИЭТИЛ (3,5-БИС(АРИЛИДЕН)-4-ОКСОПИПЕРИДИН-1-ИЛ)-(АРИЛ)-МЕТИЛФОСФОНАТЫ, ОБЛАДАЮЩИЕ АНТИПРОЛИФЕРАТИВНЫМИ СВОЙСТВАМИ | 2015 |
|
RU2603194C1 |
Изобретение относится к пригодному для применения в химической промышленности способу получения 2,3-диалкил-1-фенил(алкил)фосфол-2-ен-1-оксидов формулы (1)
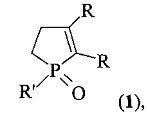
где R=Et, Pr, Bu; R'=Me, Bu, Ph. В предложенном способе симметричные ацетилены формулы R-≡-R (R=Et, Pr, Bu) подвергают взаимодействию с триэтилалюминием (Et3Al) в присутствии катализатора Cp2ZrCl2 при мольном соотношении ацетилен:Et3Al:Cp2ZrCl2=10:(10÷30):(0.1÷1.0) в толуоле в атмосфере аргона при комнатной температуре и атмосферном давлении в течение 4-12 ч, затем в реакционную массу добавляют при -5 ÷ -10°C фенил- или алкилдихлорфосфин общей формулы R′PCl2, где R′=Me, Bu, Ph, взятый в эквимольном по отношению к Et3Al количестве, и перемешивают при комнатной температуре в течение 10-30 мин, образующиеся фосфолены подвергают взаимодействию с 30%-ной перекисью водорода в хлороформе в течение 1 часа. Предложен новый эффективный способ получения соединений формулы (1). 1 пр., 1 табл.
Способ получения 2,3-диалкил-1-фенил(алкил)фосфол-2-ен-1-оксидов общей формулы (1)

где R=Et, Pr, Bu; R'=Me, Bu, Ph,
отличающийся тем, что симметричные дизамещенные ацетилены общей формулы R-≡-R (R=Et, Pr, Bu) подвергают взаимодействию с триэтилалюминием (Et3Al) в присутствии катализатора цирконацендихлорида (Cp2ZrCl2) при мольном соотношении ацетилен:Et3Al:Cp2ZrCl2=10:(10÷30):(0.1÷1.0) в толуоле в атмосфере аргона при комнатной температуре и атмосферном давлении в течение 4-12 ч, затем в реакционную массу добавляют при -5 ÷ -10°C фенил- или алкилдихлорфосфин общей формулы R′PCl2, где R′=Me, Bu, Ph, взятый в эквимольном по отношению к Et3Al количестве, и перемешивают при комнатной температуре в течение 10-30 мин, образующиеся фосфолены подвергают взаимодействию с 30%-ной перекисью водорода в хлороформе в течение 1 ч, что приводит к 2,3-диалкил-1-фенил(алкил)фосфол-2-ен-1-оксидам (1) с выходами 33-91%.
| Zhou, Yiqing et al, Tetrahedron Letters, 2010, 51(47), 6136-6138 | |||
| Способ получения 1-фенил-3-алкилфосфоланов | 1990 |
|
SU1747452A1 |
| Kollar, L.; Keglevich, Chem | |||
| Rev., 2010, 4257-4302. | |||
Авторы
Даты
2015-12-10—Публикация
2014-03-20—Подача