Изобретение относится к области медицины, а именно травматологии и ортопедии и может использоваться при формировании спейсера, обладающего антимикробными свойствами в течение длительного временив отношении устойчивых к антибиотикам микроорганизмов.
Общеизвестно, что к каждому новому антибиотику постепенно возрастает число резистентных микроорганизмов - возбудителей инфекционно-воспалительных процессов. Временной период возникновения антибиотикоустойчивости микробов зависит от структуры антибиотика и от механизма резистентности к нему у различных штаммов микроорганизмов [Поляк М.С. Антибиотикотерапия. Теория и практика / М.С. Поляк. - СПб.: ИнфомМед, 2010. - 424 с.]. Таким образом, введение в состав костного цемента антисептических средств, эффективных в отношении антибиотикорезистентных микроорганизмов, является оптимальным решением данной проблемы.
Частота развития осложнений при первичном эндопротезировании колеблется от 1% до 5%. Ревизионные вмешательства увеличивают риск гнойных осложнений еще в большем количестве случаев [Gallo J., Kolar М., Florschütz A.V., Novotny R., Pantüček R., Kesselova M. In vitro testing of gentamicin-vancomycin loaded bone cement to prevent prosthetic joint infection // Biomed. Papers. - 2005. - 149(1). - P. 153-158; Magnan, B. Antibiotic-loaded cement spacer for two-stage revision of infected total hip replacements / Magnan В.; Regis D.; Corallo F. // Orthopaedic Department, University of Verona, Italy. Bone and Joint Surgery - British Volume, Vol. 87-B, Issue SUPP.II, 188, 2005; Steckelberg JM, Osmon DR. (2000) Prosthetic joint infections. In: Infections associated with indwelling medical devices. Edited by Waldvogel FA, Bisno AL. Washington, ASM Press, 173-79]. При этом некоторые авторы указывают, что частота развития глубокой инфекции при ревизионных процедурах достигает от 40% до 87,5% [Tunney М.М., Patrick S., Curran M.D., Ramage G., Hanna D., Nixon J.R., Gorman S.P., Davis R.I., Anderson N. Detection of prosthetic hip infection at revision arthroplasty by immunofluorescence microscopy and PCR amplification of the bacterial 16S rRNA gene // J. of Clinical Microbiology. - 1999. - V. 37, N. 10. - P. 3281-3290; Widmer A.F. New Developments in Diagnosis and Treatment of Infection in Orthopedic Implants // Clinical Infectious Diseases. - 2001. - 33(Suppl 2). - P. 94-106]. Развитие подобных осложнений связано с недостаточной санацией полости сустава перед реэндопротезированием, что, в свою очередь, может быть связано с коротким или малоэффективным антимикробным действием используемых спейсеров.
В доступной литературе существуют единичные описания исследований, посвященных оценке длительности и эффективности антимикробного действия костного цемента с антибиотиками, используемого при тотальном или ревизионном эндопротезировании крупных суставов. Так, например, коллектив канадских исследователей изучал время истощения антибиотиков из вытяжек из костного цемента с ванкомицином и тобрамицином методом поляризационного флуоресцентного иммунного анализа, которое составило 67 дней [Penner M.J., Duncan С.Р., Marsi В.А. The in vitro elution characteristics of antibiotic-loaded CMS and Palacos-R bone cements // J. Arthroplasty. - 1999. - 14(2). - P. 209-214]. В своем исследовании Г.Г. Дзюба хроматографически оценивал уровень элиминации ванкомицина, дополнительно добавленного в костный цемент с гентамицином. При этом время элюции самого гентамицина не оценивалось. Показано, что к 30-м суткам эксперимента концентрация ванкомицина в растворе не определялась или была ниже его минимальной ингибирующей концентрации в отношении чувствительных к этому антибиотику изолятов стафилококков [Дзюба Г.Г. Ортопедическая хирургия остеомиелитических кокситов: Автореф. дисс … докт. мед. наук. - Омск, 2018. - 44 с.].
Существуют данные, что не рассасывающийся костный цемент может являться местом адгезии микроорганизмов, их роста и как следствие - формирование антибиотикорезистентности [Gitelis S., Brebach G.T. The treatment of chronic osteomyelitis with a biodegradable antibiotic-impregnated implant. J. Orthopaed. Surg. (Hong-Kong) 2002; 10:53-60].
Существует ряд патентов на антимикробные спейсеры, отличающиеся дополнительным введением антибиотика (в основном, ванкомицина) в костный цемент с гентамицином или нанесением его на поверхность спейсера в процессе его формирования (например, RU 2558466; RU 110979; RU 138352). При этом авторы таких изобретений не подтверждают длительный антимикробный эффект спейсера.
Бактериальная колонизация имплантата может осуществляться через два альтернативных механизма. Первый - путем прямого неспецифического взаимодействия между бактерией и не покрытой белками искусственной поверхностью «хозяина», за счет электростатического поля, поверхностного натяжения, сил Ван-дер-Ваальса, гидрофобности и водородных связей. Показано, что существует избирательная адгезия микробов к имплантату в зависимости от материала, из которого он выполнен. Например, адгезия штаммов Staphylococcus epidermidis лучше происходит к полимерным частям эндопротеза, а штаммов S. aureus - к металлическим [Кильметов ТА, Ахтямов И.Ф. и др. Локальная антибиотикотерапия при инфекции области эндопротеза сустава. Казанский медицинский журнал. 2014; 3 (95): 405-411]. В связи с этим в дальнейшем при оценке антимикробного действия предложенной антимикробной композиции используют в качестве тест-штамма Staphylococcus epidermidis.
В качестве прототипа по наиболее близкой технической сущности нами выбрана антимикробная композиция для формирования спейсера на основе костного цемента с гентамицином. Длительность антимикробного действия антимикробной композиции, выбранной в качестве прототипа, составляет 56 дней [Местное применение антибиотиков в лечении инфекций костной ткани. В.В. Привольнее, А.В. Родин, Е.В. Каракулина. Клиническая микробиология и антимикробная химиотерапия, 2012, Том 14, №2, с. 118-131; Hoff S.F., Fizgerald Jr. R.H., Kelly P.J. (1981) The depot administration of penicillin G and gentamicin in acrylic bone cement. J Bone Joint Surg (Am) 63(5):798-804].
Недостатками как вышеперечисленных аналогов, так и прототипа являются:
- Недостаточно длительный срок антимикробного действия - 56 дней для полноценной санации полости сустава перед реэндопротезированием, что существенно влияет на развитие инфекционных осложнений при реэндопротезировании, проведение которого возможно в период от 6 недель до 12 месяцев с момента установки спейсера. Как нами было уже указано выше, частота развития глубокой инфекции при ревизионных вмешательствах достигает от 40% до 87,5% [Tunney М.М., Patrick S., Curran M.D., Ramage G., Hanna D., Nixon J.R., Gorman S.P., Davis R.I., Anderson N. Detection of prosthetic hip infection at revision arthroplasty by immunofluorescence microscopy and PCR amplification of the bacterial 16S rRNA gene // J. of Clinical Microbiology. - 1999. - V. 37, N. 10. - P. 3281-3290; Widmer A.F. New Developments in Diagnosis and Treatment of Infection in Orthopedic Implants // Clinical Infectious Diseases. - 2001. - 33(Suppl 2). - P. 94-106].
- Отсутствие в доступной литературе, посвященной аналогам и прототипу, данных о наличии антимикробного действия костного цемента с гентамицином в отношении устойчивых к антибиотикам микроорганизмов.
- Недостаточная длительность полимеризации костного цемента с гентамицином, составляющая 4,5-9 минут, согласно инструкции по применению костного цемента с гентамицином, в 38% случаев, по собственным данным, не позволяет сформировать спейсер в связи с ограниченным временем отвердевания костного цемента с гентамицином, что приводит к необходимости дополнительного использования 2-ой стандартной упаковки костного цемента с гентамицином, повышает стоимость оперативного вмешательства и увеличивает его длительность.
Техническим результатом изобретения является:
- увеличение срока антимикробного действия антимикробной композиции для формирования спейсера на основе костного цемента с гентамицином;
- возможность обеспечения антимикробного действия костного цемента с гентамицином в отношении устойчивых к антибиотикам микроорганизмов;
- увеличение срока отвердевания костного цемента с гентамицином при формировании спейсера за счет увеличения времени полимеризации костного цемента, что позволит использовать только одну стандартную упаковку костного цемента с гентамицином, снизит стоимость оперативного вмешательства и сократит его длительность.
Технический результат изобретения достигается тем, что антимикробная композиция для формирования спейсера на основе костного цемента с гентамицином, а также включающая пластификатор, дополнительно содержит антисептики повиаргол, диоксидин, а также высокомолекулярный поливинилпирролидон медицинский с молекулярной массой 1000000 Д, при соотношении компонентов, масс. %:
Антимикробную композицию на основе костного цемента с гентамицином, повиарголом, диоксидином и ПВП для формирования спейсера получают в стерильных условиях следующим образом:
В стерильную ступку помещают порошок костного цемента 39,5 г с гентамицином 0,5 г, порошок повиаргола 0,62 г, порошок диоксидина 0,62 г, порошок ПВП 0,62 г, перемешивают стерильным шпателем, добавляют жидкий пластификатор 20 мл и тщательно перемешивают в соответствии с инструкцией фирмы-производителя, в результате чего получают пластичную массу, в процессе полимеризации которой формируют спейсер.
Существенные отличительные признаки изобретения и причинно-следственная связь между ними и достигаемым результатом:
Антимикробная композиция для формирования спейсера на основе костного цемента с гентамицином, а также включающая пластификатор, дополнительно содержит антисептики повиаргол, диоксидин, а также высокомолекулярный поливинилпирролидон медицинский с молекулярной массой 1000000 Д, при соотношении компонентов, масс. %:
Повиаргол - высокодисперсное металлическое серебро, стабилизированное поливинилпирролидоном низкомолекулярным медицинским; представляет собой легкий порошок от зеленовато-серого до зеленовато-коричневого цвета. В медицинской практике повиаргол используют в качестве водного раствора для наружного применения, который готовят непосредственно перед употреблением. Повиаргол - антимикробное средство с широким спектром действия, активное в отношении аэробной и анаэробной микрофлоры, в том числе антибиотикорезистентной. В концентрациях до 100 мкг/мл он подавляет рост большинства бактерий (стафилококков, стрептококков, синегнойной и кишечной палочки, протея, шигелл, сальмонелл и др.). Антимикробное действие повиарголаснижается в растворах хлорида натрия, поэтому использование повиаргола в физиологическом растворе не рекомендуется. Препарат в концентрациях 1-3% обладает противовоспалительным действием и стимулирует репаративные процессы в ране на стадии эпителизации; малотоксичен, не обладает раздражающим действием на кожу и слизистые оболочки, не вызывает аллергических реакций и дерматитов. Повиаргол применяют как антимикробное средство для профилактики и лечения гнойно-септических осложнений ран, язв, ожогов и пролежней, в том числе длительно не заживающих при лечении антибиотиками; при инфекционных заболеваниях верхних дыхательных путей, уха, горла, носа, глаз и полости рта; при заболеваниях мочеполовой системы и опорно-двигательного аппарата [http://sktb-technolog.ru/poviargolum2; «Повиаргол: новое бактерицидное средство для лечения инфицированных ран. (Опыт клинического использования в травматологии, гнойной хирургии, ожоговой терапии, гинекологии, урологии и офтальмологии). Справочное пособие для врачей / Под ред. чл.-корр. РАН Панарина Е.Ф., д.м.н., проф. Благитко Е.М. Новосибирск: Изд-во. 1998. - 66 с.»].
Диоксидин - 2,3-бис-(оксиметил)хиноксалина-1,4-ди-N-оксид. Антибактериальный бактерицидный препарат широкого спектра действия. Активен в отношении Proteus vulgaris, Pseudomonas aeruginosa, палочки Фридлендера, Escherichia coli, Shigella dysenteria, Shigella flexneri, Shigella boydii, Shigella sonnei, Salmonella spp., Staphylococcus spp., Streptococcus spp., патогенных анаэробов (Clostridium perfringens). Диоксидин губительно воздействует на патогенные клетки путем торможения образования ДНК, при этом не оказывает влияния на продуцирование РНК и белка, а также разрушает структуру микроорганизма (оболочку и нуклеотиды, играющие важную роль в образовании внутриклеточной энергии). Препарат широко распространен в медицине благодаря его эффективному подавлению патогенной микрофлоры в анаэробных условиях. Действует на штаммы бактерий, устойчивых к другим противомикробным лекарственным средствам, включая антибиотики. Не оказывает местно-раздражающего действия. Обработка препаратом ожоговых и гнойно-некротических ран способствует более быстрому очищению раневой поверхности, стимулирует репаративную регенерацию и краевую эпителизацию и благоприятно влияет на течение раневого процесса. Наружное применение диоксидина целесообразно в следующих случаях: инфицированные ожоги; флегмоны мягких тканей; глубокие или поверхностные раны на теле; трофические язвы и длительно незаживающие раны; гнойные раны при остеомиелитах. Внутриполостное введение диоксидина показано в следующих случаях: перитониты; абсцессы; гнойные плевриты; гнойные процессы в брюшной или грудной полости; раны желчевыводящих и мочевыводящих путей; эмпиемы плевры; раны и флегмоны с наличием глубоких гнойных полостей (флегмоны тазовой клетчатки, абсцессы мягких тканей, гнойный мастит, послеоперационные раны желчевыводящий и мочевыводящих путей) [«Местное лечение инфицированных ран, гнойно-некротических процессов в брюшной полости и забрюшинном пространстве антимикробным препаратом - диоксидин. Учебное пособие для хирургов / Под ред. Галимзянова Ф.В., Прудкова М.И. Екатеринбург: УГМА, 2012. - 20 с.].
Поливинилпирролидон высокомолекулярный медицинский - зарегистрирован в Регистре лекарственных средств как связующее средство. ПВП выпускается в виде порошка марки фармацевтически чистый, сыпучий белый или желтовато-белый порошок с частицами различного размера, запах специфический. Среднемассовая молекулярная масса ПВП составляет 1000000-1500000 Да [Фолькер Бюлер. Коллидон®. Поливинилпирролидон для фармацевтической промышленности / Перевод с англ. под ред. д.ф.н. К.В. Алексеева. BASF: 2001. - 310 с]. Водный раствор ПВП представляет собой стерильную вязкую прозрачную слабоокрашенную жидкость со специфическим слабым запахом. Среднемассовая молекулярная масса зависит от получаемой вязкости раствора и составляет от 500000 до 2000000 Да. ПВП обладает сорбирующими и антитоксическими свойствами.
Антимикробные композиции на основе костного цемента с гентамицином для изучения антимикробного действия получали следующим образом:
В стерильную ступку (1) помещали порошок костного цемента 39,5 г с содержанием гентамицина 0,5 г.
В стерильную ступку (2) помещали порошок костного цемента 39,5 г с содержанием гентамицина 0,5 г, порошок ванкомицина (Эдицин) 4 г.
В стерильную ступку (3) помещали порошок костного цемента 39,5 г с содержанием гентамицина 0,5 г, порошок повиаргола 0,61 г (1%).
В стерильную ступку (4) помещали порошок костного цемента 39,5 г с содержанием гентамицина 0,5 г, порошок диоксидина 0,61 г (1%).
В стерильную ступку (5) помещали порошок костного цемента 39,5 г с содержанием гентамицина 0,5 г, порошок повиаргола 0,62 г (1%), порошок диоксидина 0,62 г (1%).
В стерильную ступку (6) помещали порошок костного цемента 39,5 г с содержанием гентамицина 0,5 г, порошок повиаргола 0,62 г (1%), порошок диоксидина 0,62 г (1%), порошок ПВП 0,62 г (1%).
При добавлении 20 мл жидкого пластификатора к соответствующей смеси в каждой ступке в соответствии с инструкцией фирмы-производителя при тщательном перемешивании получали пластичную массу, в процессе полимеризации которой формировали полусферы весом 1 г на 96-луночных полистироловых планшетах.
При этом в процессе полимеризации и отвердевания цементной смеси при формировании спейсера фиксировали срок отвердевания костного цемента с гентамицином в ступке 1 и в ступке 6 при дополнительном введении порошка повиаргола 0,62 г, порошка диоксидина 0,62 г и порошка ПВП 0,62 г.
Далее в работе использовали вытяжки из приготовленных цементных составов. Вытяжки получали стандартным методом согласно требованиям, изложенным в [Сборник руководящих методических материалов по токсиколого-гигиеническим исследованиям полимерных материалов и изделий на их основе медицинского назначения МЗ СССР, М., 1987. - 98 с.; Mader J.T., Calhoun J., Cobos J. In vitro evaluation of antibiotic diffusion from antibiotic-impregnated biodegradable beads and polymethylmethacrylate beads // Antimicrob Agents and Chemother. - 1997. - vol. 47, no. 2. - p. 415-418].
Вытяжки готовили из цементных полусфер, выдерживая их 24 часа в стерильном фосфатном буфере (рН 7,2-7,4) при температуре 37°C в термостате.
Для изучения антимикробного действия использовали метод диффузии в агар [МУК 4.2.1890-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам». Государственное санитарно-эпидемиологическое нормирование Российской Федерации. М., 2004], оценивая величину зоны задержки роста соответствующего тест-штамма. В качестве тест-штаммов тестировали Staphylococcus epidermidis АТСС 14990 /S/ (чувствительный к гентамицину) и клинический изолят S. epidermidis 102/18 /R/ (устойчивый к гентамицину, МИК - 30 мкг/мл [МУК 4.2.1890-04]). Микробная нагрузка составила 0,5 по стандарту мутности Макфарланда (108 КОЕ/мл). Посевы инкубировали при 37°C в течение 24 часов.
Посев вытяжек проводили каждые 3 суток в течение 3 месяцев, а затем - каждые 14 суток в течение 8 месяцев. После очередного высева меняли стерильный фосфатный буфер в емкостях с цементом для получения очередной вытяжки.
Полученные величины зон задержки роста чувствительного к гентамицину штамма стафилококка сравнивали с требованиями EUCAST-2018 по уровню чувствительности к гентамицину (зона задержки роста чувствительного к гентамицину тест-штамма коагулазонегативного S. epidermidis должна быть ≥22 мм).
При оценке эффективности действия антимикробной композиции, содержащей антисептики, требования EUCAST-2018 не применимы. Мы считаем, что наличие любой зоны задержки роста тест-микроорганизма свидетельствует о проявлении антимикробной активности композиции в отношении него. Однако эффективные антисептики должны снижать уровень микробной популяции не менее чем на 2 log10 [Kramer A., et al. Octenidine, Chlorhexidine, Iodine and lodophores. Preprint, 2008. - Georg Thieme Verlag KG. - 85 p.].
В период эксперимента, когда методом диффузии в агар получали величины зон задержки роста обоих тест-штаммов ниже уровня чувствительности к гентамицину по EUCAST-2018 (<22 мм), дополнительно проводили количественный тест чашечно-суспензионным методом [Афиногенов Г.Е., Краснова М.В. Чашечный метод оценки эффективности дезинфектантов и антисептиков. Методические рекомендации МЗ РФ №2003/17, 2004 г. - 13 с.] с целью подтверждения антимикробного действия вытяжек из образцов костного цемента с антисептиками и ПВП в отношении любого изолята S. epidermidis, микробная нагрузка которых составила 108 КОЕ/мл. При высеве 0,1 мл инокулята на чашку Петри конечная микробная нагрузка составила 107 КОЕ/мл.
Все исследования проведены в повторах не менее 3 и обработаны с использованием t-критерия Стьюдента с определением средней арифметической величины и квадратической ошибки средней внутри каждой группы.
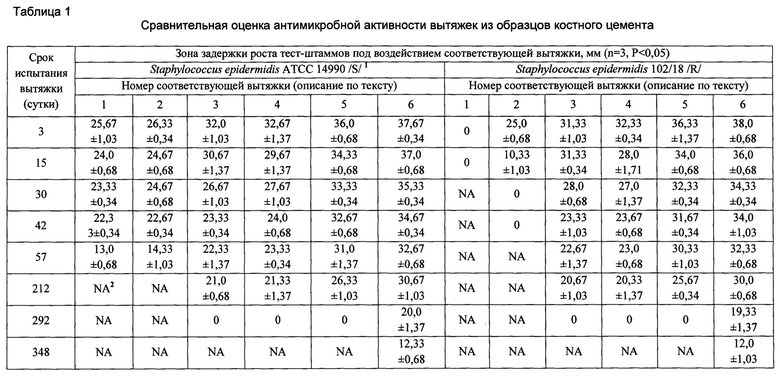
Результаты сравнительной оценки антимикробной активности вытяжек из различных образцов костного цемента представлены в таблице 1.
Из данных таблицы 1 видно, что в отношении чувствительного штамма S. epidermidis АТСС 14990 антимикробный эффект контрольной вытяжки (1) сохранялся на уровне требований EUCAST-2018 по уровню чувствительности S. epidermidis к гентамицину (зона задержки ≥22 мм) в течение 42 суток. Таким образом, определена эффективность гентамицина в костном цементе в точке, переходной от его бактерицидного действия к отсутствию такового (точка нарушения предела чувствительности).
Примечание: 1. Уровень чувствительности к гентамицину по результатам оценки эффективности каждой вытяжки на конкретный срок наблюдения оценивали на соответствие требованиями EUCAST-2018.
2. NA - исследования не проводили.
Вытяжка с ванкомицином (2) оказывала эффект на уровне контрольной вытяжки только с гентамицином до 42 суток (зона задержки роста составляла 22,67±0,34 мм).
При действии вытяжки (3) с повиарголом 0,61 г (1%), вытяжки (4) с диоксидином 0,61 г (1%) и вытяжки (5) с комбинацией повиаргола 1% и диоксидина 1% наблюдали наличие зоны задержки роста чувствительного тест-штамма в течение 212 суток.
Вытяжка (6) с повиарголом 1%, диоксидином 1% и ПВП 1% оказывала антимикробное действие в период до 348 дней, при этом зона задержки роста тест-штамма составляла 12,33±0,68 мм.
В случаях, когда при действии вытяжек с антисептиками (3-4) зоны задержки роста чувствительного тест-штамма составляли менее 22 мм, в чашечно-суспензионном тесте показано снижение уровня микробной популяции стафилококка на 3log10. При действии вытяжки (5) с комбинацией 1% повиаргола и 1% диоксидина показано снижение уровня микробной популяции стафилококка на 4 log10. Действие вытяжки (6) из образца костного цемента с гентамицином, 1% повиарголом, 1% диоксидином и 1% ПВП в данном тесте снижало уровень микробной популяции стафилококка на 7 log10.
В отношении резистентного к гентамицину клинического изолята S. epidermidis 102/18 вытяжка из контрольного костного цемента (1) не эффективна. При добавлении ванкомицина (вытяжка 2) антимикробное действие наблюдали до 15 дня, но на уровне ниже требований EUCAST-2018 по уровню чувствительности S. epidermidis к гентамицину (зона задержки роста составила 10,33±1,03 мм). Вытяжки с антисептиками повиарголом 1% или диоксидином 1% (3-4) и вытяжка (5) с антисептиками повиарголом 1% и диоксидином 1% оказывали антимикробный эффект на протяжении 212 дней наблюдения. Вытяжка (6) с антисептиками повиарголом 1%, диоксидином 1% и ПВП 1% оказывала пролонгированный антимикробный эффект на протяжении 348 суток наблюдения, при этом зона задержки роста резистентного тест-штамма составляла 12,0±1,03 мм.
В опытах с резистентным к гентамицину тест-штаммом S. epidermidis во всех случаях, когда зоны задержки роста тест-штамма составляли менее 22 мм, при действии вытяжек с антисептиками (3-4) в чашечно-суспензионном тесте показано снижение уровня микробной популяции стафилококка на 3 log10, при действии вытяжки (5) с комбинацией повиаргола 1% и диоксидина 1% - на 4 log10. Действие вытяжки (6) из образца костного цемента с гентамицином, повиарголом 1%, диоксидином 1% и ПВП 1% в данном тесте снижало уровень микробной популяции резистентного к гентамицину стафилококка на 7 log10.
На Фиг. 1 представлены результаты количественного чашечно-суспензионного теста по оценке действия вытяжки (1) из костного цемента с гентамицином в отношении резистентного к гентамицину клинического штамма S. epidermidis 102/18 на 348 день (исходная микробная нагрузка 108 КОЕ/мл), где на чашке Петри показан сплошной рост клинического изолята S. epidermidis 102/18 при воздействии контрольной вытяжки (1) из костного цемента с гентамицином.
На Фиг. 2 показан результат количественного чашечно-суспензионного теста по оценке действия вытяжки (6) из костного цемента с гентамицином, 1% повиарголом, 1% диоксидином, 1% ПВП в отношении резистентного к гентамицину клинического штамма S. epidermidis 102/18 на 348 день (исходная микробная нагрузка 108 КОЕ/мл), где наблюдали отсутствие роста резистентного штамма стафилококка при воздействии вытяжки (6) с 1% повиарголом, 1% диоксидином и 1% ПВП, когда методом диффузии в агар получена зона задержки роста 12,0±1,03 мм.
Наши данные по активности гентамицина в костном цементе совпадают с данными зарубежных авторов, проводивших аналогичные опыты [Привольнее В.В., Родин А.В., Каракулина Е.В. Местное применение антибиотиков в лечении инфекций костной ткани // Клин. Микроб. И Антимикр. Химиотер. - 2012. - Т. 14, №2. - с. 118-131; Gallo J., Kolar М., Florschutz A.V., Novotny R., Pantucek R., Kesselova M. In vitro testing of gentamicin-vancomycin loaded bone cement to prevent prosthetic joint infection // Biomed. Papers. - 2005. - Vol. 149, №1. - P. 153-158; Cui Quanjun, Mihalko William M., Shields John S., Ries Michael, Saleh Khaled J. Antibiotic-Impregnated Cement Spacers for the Treatment of Infection Associated with Total Hip or Knee Arthroplasty // J. Bone Joint Surg. Am. - 2007. - Vol. 89. - P. 871-882]. В единичных публикациях приведены данные по оценке вытяжек из антимикробного костного цемента в отношении полирезистентных микроорганизмов различных видов [Е. Bertazzoni Minelli, Т. DellaBora, A. Benini. Different microbial biofilm formation on polymethylmethacrylate (PMMA) bone cement loaded with gentamicin and vancomycin // Anaerobe. - 2011. - Vol. 17. - P. 380-383]. В этом исследовании авторы показали, что через 24 часа на поверхности костного цемента с гентамицином происходит и рост, и адгезия полирезистентных клинических штаммов: S. aureus 3А10 MS-GS, S. aureus 5/7 MRSA/VRSA/GRSA, S. epidermidis 137/25 MR/GI, S. hominis126/26 MR/GI, S. epidermidis 8/28 MR/GR, S. haemolyticus 8/28 MR/GR, S. epidermidis 3/2 MR/GR, E. coli 7A27 G-S1 (1 - MS-GS - methicillin-susceptible & gentamicin-susceptible; MR-GR - methicillin-resistant & gentamicin-resistant; MR-GI - methicillin-resistant & gentamicin-intermediate; MRSA/VRSA/GRSA - methicillin-resistant, vancomycin-resistant & gentamicin-resistant; G-S - gentamicin-susceptible.).
Полученные нами результаты по эффективности вытяжки (2) из костного цемента с гентамицином и ванкомицином свидетельствуют об отсутствии усиления действия за счет второго антибиотика, что совпадает с данными других авторов, которые продемонстрировали полную элиминацию ванкомицина из полиметилметакрилатных дисков к 12 дню микробиологическим методом [Mader J.T., Calhoun J., Cobos J. In Vitro Evaluation of Antibiotic Diffusion from Antibiotic-Impregnated Biodegradable Beads and Polymethylmethacrylate Beads // Antimicrob. Agents and Chemother. - 1997. - Vol. 41, №2. - P. 415-418], а также методом жидкостной хроматографии показали, что содержание ванкомицина в вытяжке находилось ниже уровня минимальной ингибирующей концентрации на 14-е сутки эксперимента [Дзюба Г.Г. Ортопедическая хирургия остеомиелитических кокситов: Автореф. дисс … докт. мед. наук. - Омск, 2018. - 44 с.].
Внесение в костный цемент 0,61 г (1%) повиаргола, представляющего собой нанокластеры серебра, стабилизированного низкомолекулярным поливинилпирролидоном, или 0,61 г (1%) диоксидина способствовало усилению антимикробного эффекта вытяжек (соответственно, 3 или 4) в отношении чувствительного и резистентного штаммов стафилококка до 212 дней. Антимикробная композиция (5), содержащая повиаргол 0,62 г (1%) и диоксидин 0,62 г (1%), также оказывала бактерицидный эффект в течение 212 дней в отношении чувствительного и резистентного к гентамицину штаммов S. epidermidis, при этом зоны задержки роста тест-штаммов /S/ и /R/ составляли 26,33±1,03 и 25,67±0,34, соответственно. Антимикробная композиция (6) с повиарголом 0,62 г (1%), диоксидином 0,62 г (1%) и высокомолекулярным ПВП 0,62 г (1%) оказывала пролонгированное бактерицидное действие в отношении обоих штаммов S. epidermidis в течение 348 суток. При этом зоны задержки роста тест-штаммов /S/ и /R/ составляли 12,33±0,68 и 12,0±1,03, соответственно. Кроме того, вытяжка (6) в количественном тесте в обоих случаях снижала уровень микробной популяции на 7log10.
Таким образом, оптимальное соотношение компонентов антимикробной композиции на основе костного цемента с гентамицином подобрано в процессе исследований опытным путем. При этом показано усиление антимикробного действия костного цемента с гентамицином в присутствии повиаргола и диоксидина, и пролонгация этого эффекта в присутствии полимера высокомолекулярного поливинилпирролидона в течение 348 дней.
Результаты сравнительной оценки срока отвердевания костного цемента с гентамицином при формировании спейсера за счет увеличения времени полимеризации костного цемента при дополнительном введении в него антисептиков повиаргола и диоксидина и поливинилпирролидона высокомолекулярного медицинского, представлены в таблице 2.


Как видно из данных таблицы 2, в контроле время отвердевания костного цемента с гентамицином составило 9,74±0,64 мин, что соответствует данным инструкции по применению костного цементас гентамицином. В опыте при дополнительном введении в костный цемент с гентамицином антисептиков повиаргола 1% и диоксидина 1% и поливинилпирролидона высокомолекулярного медицинского 1% время отвердевания костного цемента с гентамицином составило 16,98±0,81 мин за счет увеличения времени полимеризации костного цемента с гентамицином.
Таким образом, срок отвердевания костного цемента с гентамицином при формировании спейсера при комнатной температуре в условиях операционной увеличивается на 7,24±0,17 мин, что позволит использовать только одну стандартную упаковку костного цемента с гентамицином, что, в свою очередь, снизит финансовые затраты на проведение оперативного вмешательства и сократит его длительность.
Таким образом, заявляемое изобретение позволяет:
- увеличить срок антимикробного действия антимикробной композиции для формирования спейсера на основе костного цемента с гентамицином;
- обеспечить антимикробное действие костного цемента с гентамицином в отношении устойчивых к антибиотикам микроорганизмов;
- увеличить срок отвердевания костного цемента с гентамицином при формировании спейсера за счет увеличения времени полимеризации костного цемента, что позволяет использовать только одну стандартную упаковку костного цемента с гентамицином, что, в свою очередь, снизит стоимость оперативного вмешательства и сократит его длительность.
Все вышеперечисленные эффекты заявляемого изобретения позволят значительно снизить риск нагноения в инфицированном суставе, это не потребует проведения повторных санирующих операций с заменой спейсера, что, в свою очередь, позволит провести реэндопротезирование в оптимальные сроки, снизить стоимость оперативного вмешательства и сократить его длительность, по сравнению с прототипом.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЗАМЕЩЕНИЯ КОСТНЫХ ПОЛОСТЕЙ ПРИ ЛЕЧЕНИИ БОЛЬНЫХ ХРОНИЧЕСКИМ ОСТЕОМИЕЛИТОМ | 2019 |
|
RU2710252C1 |
| Антимикробная композиция для замещения костных полостей | 2023 |
|
RU2812662C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ЦЕМЕНТНОГО СПЕЙСЕРА ДЛЯ ЭТИОТРОПНОЙ МЕСТНОЙ АНТИБАКТЕРИАЛЬНОЙ ТЕРАПИИ ПРИ ИНФЕКЦИОННЫХ ПОРАЖЕНИЯХ КОСТЕЙ И СУСТАВОВ | 2020 |
|
RU2754075C1 |
| Полимерный гель для локальной антибактериальной терапии инфекционных осложнений травм и операций на опорно-двигательном аппарате и способ его приготовления | 2023 |
|
RU2822155C1 |
| СПОСОБ МЕСТНОЙ АНТИБАКТЕРИАЛЬНОЙ ПРОФИЛАКТИКИ РЕЦИДИВА ПРИ ОДНОЭТАПНОМ РЕВИЗИОННОМ ЭНДОПРОТЕЗИРОВАНИИ У ПАЦИЕНТОВ С ПЕРИПРОТЕЗНОЙ ИНФЕКЦИЕЙ | 2021 |
|
RU2757263C1 |
| Способ профилактики послеоперационных гнойных осложнений | 2024 |
|
RU2835745C1 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИМИКРОБНОГО ГЕЛЯ | 2020 |
|
RU2746709C1 |
| Способ комплексной эмпирической антибактериальной терапии имплантат-ассоциированных ортопедических инфекций | 2015 |
|
RU2641608C2 |
| СПОСОБ ПРЕОДОЛЕНИЯ УСТОЙЧИВОСТИ К ГЕНТАМИЦИНУ У МЕТИЦИЛЛИНОРЕЗИСТЕНТНЫХ ШТАММОВ СТАФИЛОКОККА | 2013 |
|
RU2553601C2 |
| ИНТРАНАЗАЛЬНАЯ КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ И/ИЛИ ЛЕЧЕНИЯ ИНФЕКЦИЙ ВИРУСНОЙ И БАКТЕРИАЛЬНОЙ ЭТИОЛОГИИ | 2023 |
|
RU2825642C1 |


Изобретение относится к области медицины, а именно травматологии и ортопедии, а именно к антимикробной композиции для формирования спейсера. Антимикробная композиция для формирования спейсера на основе костного цемента с гентамицином также содержит пластификатор, антисептики повиаргол, диоксидин, а также высокомолекулярный поливинилпирролидон медицинский с молекулярной массой 1000000 Да, при определенном соотношении компонентов. Использование вышеописанной композиции увеличивает срок антимикробного действия антимикробной композиции для формирования спейсера на основе костного цемента с гентамицином; обеспечивает антимикробное действие костного цемента с гентамицином в отношении устойчивых к антибиотикам микроорганизмов; увеличивает срок отвердевания костного цемента с гентамицином при формировании спейсера. 2 ил., 2 табл.
Антимикробная композиция для формирования спейсера на основе костного цемента с гентамицином, а также включающая пластификатор, отличающаяся тем, что дополнительно содержит антисептики повиаргол, диоксидин, а также высокомолекулярный поливинилпирролидон медицинский с молекулярной массой 1000000 Да, при соотношении компонентов, масс. %:
| ПРИВОЛЬНЕВ В.В | |||
| и др | |||
| Местное применение антибиотиков в лечении инфекций костной ткани //Клин | |||
| микробиол | |||
| антимикроб | |||
| химиотер | |||
| Антимикробные препараты | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| US 2013150979 A1, 13.06.2013 | |||
| АНТИМИКРОБНОЕ СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ ИМПЛАНТ-АССОЦИИРОВАННОЙ ИНФЕКЦИИ И СПОСОБ ЕГО ПРИМЕНЕНИЯ | 2013 |
|
RU2535156C1 |
| БОЖКОВА С.А | |||
| Преодоление устойчивости к гентамицину у метиллинорезистентных штаммов стафилококка //международный журнал | |||
Авторы
Даты
2019-11-29—Публикация
2019-04-03—Подача