Область изобретения
Настоящее изобретение относится к области биотехнологии и фармацевтической промышленности, в частности, к разработке и применению рекомбинантных антител человека, которые специфически распознают фактор роста эндотелия сосудов А человека (сокращенно VEGF-A) (Ferrara, N. et al. 2003. Nature Medicine 9: 669-676). Различные типы рекомбинантных антител, охватываемые настоящим изобретением, были получены путем комбинирования вариабельной области легкой цепи (VL) с другими тремя вариабельными областями тяжелой цепи (VH) одного и того же иммуноглобулина методами генной инженерии. Рекомбинантные антитела, распознающие эпитоп VEGF-A, не описанные ранее, блокируют взаимодействие VEGF-A со своим рецептором VEGFR2, и в результате чего, препятствуют стимулирующему и проангиогенному эффекту VEGF-A в условиях in vitro и in vivo. Благодаря этим свойствам, новые рекомбинантные антитела человека могут использоваться для иммунотерапии патологических образований, связанных с увеличением сосудистой сети, таких как, возрастная макулодистрофия, злокачественное новообразование, ревматоидный артрит и других.
Существующий уровень техники
Процесс образования новых кровеносных сосудов из уже существующих (ангиогенез) регулируется соотношением про- и антиангиогенных факторов, которые влияют на сосудистый эндотелий и его клетки-предшественники в костном мозге. Факторы роста эндотелия сосудов являются семейством молекул, которые непосредственным и определенным образом вызывают образование новых сосудов (Leung, D. et al. 1989. Science 246:1306-1309). Это семейство включает сосудистый фактор проницаемости (сокращенно VPF), также известный как фактор роста эндотелия сосудов А (VEGF-A), плацентарный фактор роста (сокращенно PLGF), тромбоцитарный фактор роста А и В (сокращенно PDGF), и другие молекулы, относящиеся структурно и биохимически к VEGF-A, которые были обозначены как, VEGF-В, VEGF-С, VEGF-D и VEGF-Е (Olofsson, B. et al. 1996. Proc Natl Acad Sci USA 93: 2576-2581; Joukov, V. et al. 1996. EMBO J 15:290-298; Yamada, Y. et al. 1997. Genomics 42:483-488; Ogawa, S. et al. 1998. J Biol Chem 273:31273-31282).
VEGF-А - гомодимерный гликопротеин, образованный двумя субъединицами массой 23 кДа (Ferrara, N. et al. 1989. Biochem Biophys Res Comun 161:851-858). Существует пять изоформ, возникших в результате дифференциального сплайсинга одной и той же рибонуклеиновой кислоты (РНК). Они содержат две мембрансвязанные изоформы (VEGF 189 и VEGF 206) и три, секретирующихся в виде растворимых факторов (VEGF 121, VEGF 145 и VEGF 165). VEGF 165 наиболее широко распространен в тканях млекопитающих, за исключением сердца и легких, где преобладает VEGF 189 (Neufeld G et al. 1995. Canc Met Rev 15:153-158). В плаценте очень высока экспрессия VEGF 121 (Shibuya, M. 1995. Adv Cancer Res 67:281-316). Семейство молекул VEGF проявляет свои функции и эффекты путем связывания с тирозинкиназными клеточными рецепторами III класса, которые содержат VEGFR1 (Flt1), VEGFR2 (KDR/Flk1) и VEGFR3 (Flt4) (Kaipainen, A. 1993. J Exp Med 178:2077-2088).
VEGF-A является наиболее изученным и охарактеризованным белком данного семейства и уже описаны некоторые заболевания, при которых этот белок связывают с патогенетическим процессом (Carmeliet, P. y Jain, RK. 2000. Nature 407:249-257; Kuwano M, et al. 2001. Intern Med 40:565-572). Гиперэкспрессия VEGF-A связана с ростом опухолей различного генеза и локализации, а также и с их метастазированием (Grunstein, J. et al. 1999. Cancer Res 59:1592-1598). При определенных опухолях, клетки, которые экспрессируют три основные изоформы VEGF-A (121, 165 и 189), являются единственными быстрорастущими в условиях in vivo (Grunstein, J. 2000. Mol Cell Biol 20:7282-7291).
VEGF-A также связывают с хроническими воспалительными процессами, такими как, неспецифический язвенный колит и болезнь Крона (Kanazawa, S. et al. 2001. Am J Gastroenterol 96:822-828), псориаз (Detmar, M. et al. 1994. J Exp Med 180:1141-1146), респираторный дистресс-синдром (Thickett, DR. et al. 2001. Am J Respir Crit Care Med 164:1601-1605), атеросклероз (Celletti, FL. et al. 2001. Nat Med 7:425-429), эндометриоз (McLaren, J. 2000. Hum Reprod Update 6:45-55), астма (Hoshino, M. et al. 2001. J Allergy Clin Immunol 107:295-301), ревматоидный артрит и остеоартрит (Pufe, T. et al. 2001. J Rheumatol 28:1482-1485), тиреоидит (Nagura, S. et al. 2001. Hum Pathol 32:10-17), диабет и ретинопатия новорожденных (Murata, T. et al. 1996. Lab Invest 74:819-825; Reynolds, JD. 2001. Paediatr Drugs 3:263-272), макулодистрофия и глаукома (Wells, JA. et al. 1996. Br J Ophthalmol 80:363-366), отек мягких тканей (Kaner, RJ. et al. 2000. Am J Respir Cell Mol Biol 22:640-641), ожирение (Tonello, C. et al. 1999. FEBS Lett 442:167-172), гемангиома (Wizigmann, S. y Plate, KH. 1996. Histol Histopathol 11:1049-1061), воспалительные артропатии (Bottomley, MJ. et al. 2000. Clin Exp Immunol 119:182-188) и отторжение трансплантата (Vasir, B. et al. 2001. Transplantation 71:924-935).
Перспективный терапевтический метод для многих из вышеперечисленных заболеваний основан на ингибировании активности проангиогенных факторов, которые вызывают образование аномальных кровеносных сосудов, посредством молекул, способных нейтрализовать их действие. Многие из новых терапевтических стратегий, основанных на ингибировании ангиогенеза, в особенности для злокачественных новообразований, основаны на блокировании VEGF-A и/или его рецепторов. Среди препаратов, разрешенных для клинического исследования, авторы выделяют: (1) моноклональные антитела, которые блокируют VEGF-A или KDR-рецептор, (2) ингибиторы металлопротеиназ, такие как, неовастат и приномастат, (3) ингибиторы VEGF, такие как талидомид, сурамин, тропонин I и IFN-α, (4) блокаторы рецепторов VEGF, такие как, SU5416, FTK787 и SU6668, (5) индукторы апоптоза опухоли эндотелия, такие как Эндостатин и CA4-P, а также, (6) рибозимы, которые снижают экспрессию VEGF или его рецепторов (ангиозим).
Из всего вышеперечисленного, антитела и фрагменты антител, которые нейтрализуют проангиогенный эффект VEGF-А, наиболее распространены для применения в качестве терапевтических средств. В медицинской практике гуманизированное рекомбинантное антитело бевацизумаб (коммерческое название -Авастин (Ferrara, N. et al. 2005. Biochem Biophys Res Comun 333:328-335; Kim, KJ. et al. 1992. Growth Factors 7:53-64), которое распознает VEGF-А человека и нейтрализует его проангиогенный эффект, было разрешено к применению в нескольких странах для лечения опухолей различного генеза (Allison, M. 2010. Nature Biotechnology, 28(9):879-880).
За последнее время в некоторых странах было получено разрешение на применение ранибизумаба (коммерческое название - люцентис) (Gaudreault, J. et al. 2005. Invest Ophthalmol Visual Sci 46:726-733) для лечения возрастной макулодистрофии, ее экссудативной формы. Ранибизумаб представляет собой Fab-фрагмент рекомбинатного антитела, разработанный путем обработки бевацизумаба методами генной инженерии. Инъекция ранибизумаба в стекловидное тело нейтрализует локально продуцируемый VEGF-А и нарушает неоангиогенез в глубоких слоях сетчатки, который лежит в основе данного заболевания.
Кроме примеров с бевацизумабом и ранибизумабом, которые уже зарегистрированы органами санитарного надзора, имеются сообщения по другим антителам и фрагментам антител, которые распознают и нейтрализуют VEGF человека (Muller, Y. et al. 1997. Proc Natl Acad Sci USA 94:7192-7197; Asano, M. et al. 1998. Hybridoma 17:185-190; Vitaliti A. et al. 2000. Cancer Res 60:4311-4314; Brekken, RA. y Thorpe, PE. 2001. J Controlled Release 74:173-181; Jayson, G. et al. 2002. JNCI 94:1484-1493; Brekken, RA. et al. 2000. Cancer Res 60:5117-5124; Fuh, G. et al. 2006. J Biol Chem 281:6625-6631; US 5730977; WO2008/052489 A1).
2H1 - одноцепочечный фрагмент Fv антитела человека (сокращенно scFv), который специфически распознает VEGF человека (WO2008/052489 A1). 2H1 был получен из исходного scFv человека библиотеки филаментного фагового дисплея. 2H1 scFv специфичен для VEGF-А человека, однако, проявляет низкую аффинность к этой молекуле. Это может быть объяснено, если принять во внимание, что библиотека, из которой он взят, была создана из исходных вариабельных областей, полученных из лимфоидных клеток человека из различных источников (периферической крови, селезенки, миндалин, костного мозга) и от разных здоровых индивидов (Rojas G., et al. 2005. Biochem Biophys Res Comun 336:1207-1213). Как известно из существующего уровня техники, отображенный фагом scFv из библиотек наивных вариабельных областей, может продуцировать антитела средней и низкой аффинности к их специфическим антигенам. Это может быть хорошо известно в случае собственных антигенов, а также, и в данном случае (Marks J.D., et al. 1991. J. Mol. Biol. 222:581-597). Средняя или низкая аффинность антитела, как правило, соответствует наличию малого числа мутаций в вариабельных областях относительно последовательностей иммуноглобулина зародышевой линии, из которого они возникли. Низкоаффинные рекомбинантные антитела обладают недостаточным действием при иммунохимическом применении и терапевтических методах в условиях in vivo, по сравнению со сходными молекулами, обладающими высокой аффинностью к тому же самому антигену.
В настоящее время интерес направлен на создание новых антител, которые нейтрализуют эффекты VEGF человека, и также могут быть использованы в терапии образований, которые обнаруживаются вследствие чрезмерного ангиогенеза.
Описание изобретения
Настоящее изобретение решает вышеупомянутую проблему, поскольку предлагает новые рекомбинантные антитела человека, которые специфически распознают VEGF-А человека.
Различные рекомбинантные антитела, описанные в настоящем изобретении, показывают превосходные иммунохимические, биологические и терапевтические характеристики по сравнению со сходными молекулами, полученными из 2Н1 фрагмента антитела scFv. Для разработки таких антител, были вызваны мутации в гипервариабельных участках 3 (CDR3) вариабельных областей легкой VL и тяжелой VH цепи 2Н1 фрагмента антитела scFv. Новые мутированные вариабельные участки, выбранные для лучшего распознавания VEGF-А человека с использованием технологии филаментного фагового дисплея, были скомбинированы с помощью методов генной инженерии для получения новых связывающих участков антитела с нужными усовершенствованными и принципиально новыми иммунохимическими и биологическими свойствами. В этой работе был впервые проведен анализ последовательностей генов, кодирующих 2Н1 scFv фрагмент антитела, который показал, что CDR3 VL и VH имели очень небольшие изменения относительно V, D и/или J областей первоначального гена человека зародышевого типа. Это обнаружение объяснило низкую аффинность 2Н1 к антигену.
Затем была разработана подробная стратегия мутагенеза, направленная исключительно на последовательности гена, кодирующего домены CDR3 областей VL (8 аминокислотных остатков) и VH (7 аминокислотных остатков) 2Н1 фрагмента антитела scFv. Метод «Экономного мутагенеза» (сокращенно PM) (Balint, R. y Larrick J.W. 1993. Gene, 137:109-118) был использован для того, чтобы вызвать мутации. В РМ был проведен анализ мутированных последовательностей и минимальные изменения, которые могли изменить характеристики связывающего участка антитела обработаны на компьютере, принимая во внимание существующую информацию по известным иммуноглобулиновым последовательностям, предоставляемую базами данных общего пользования. Используя вырожденные синтетические олигонуклеотиды и полимеразную цепную реакцию (ПЦР), РМ продуцировал миллионы новых мутантов для нужного участка гена за очень короткий промежуток времени.
РМ использовали независимо на доменах CDR3 областей VL и VH 2Н1 scFv фрагмента антитела, и, путем клонирования новых вариабельных областей в подходящий фагмидный вектор, были продуцированы две большие библиотеки scFv фрагмента антитела (приблизительно 5×108 фрагментов), в которых связывающие участки мутировали в вышеупомянутые аминокислотные последовательности (Пример 1). В библиотеке, обозначенной №1, исходный 2Н1 scFv фрагмент антитела области VL был сохранен, связанный с миллионами новых областей VH, мутированных в CDR3. В библиотеке, обозначенной №2, исходный 2Н1 scFv фрагмент антитела области VH был сохранен, связанный с миллионами новых областей VL, мутированных в CDR3.
Представленные фагом новые фрагменты антител scFv, характерные для двух библиотек, были отобраны против VEGF-А человека, одновременно используя увеличение концентрации растворимого 2Н1 scFv, чтобы способствовать выделению новых scFv фрагментов антител с высокой аффинностью к VEGF-А (Пример 2).
Начиная с новых клонов scFv фрагментов, представленных каждой из двух библиотек, экспериментальная оценка их относительного распознавания VEGF-А была осуществлена с помощью ELISA, по отношению к 2Н1 scFv, также обнаруженных фагом (Пример 2). Эти эксперименты показали, какая из мутированных вариабельных областей VL и VH представляет превосходные характеристики распознавания антигена и аффинности к новым фрагментам.
Новые идентифицированные вариабельные области были секвенированы для определения нуклеотидного состава новых CDR3. Что касается новых доменов CDR3 области VH, из лучших scFv фрагментов антител, отобранных из библиотеки №1, все эти домены имели различные аминокислотные последовательности, как среди своих, так и в отношении исходного VH 2Н1 scFv фрагмента антитела (Пример 2, таблица 2). scFv фрагменты антител с лучшим распознаванием антигена были обозначены как 3F3, 3E3 и 4D8, и содержали новые области VH. 3F3 scFv, содержащий VH, был обозначен авторами изобретения, как Н6 (SEQ ID NO:1 для нуклеотидной последовательности и SEQ ID NO:4 для расшифрованной аминокислотной последовательности). 3E3 scFv, содержащий VH, был обозначен авторами изобретения, как Н5 (SEQ ID NO:2 для нуклеотидной последовательности и SEQ ID NO:5 для расшифрованной аминокислотной последовательности). 4D8 scFv, содержащий VH, был обозначен авторами изобретения, как Н7 (SEQ ID NO:3 для нуклеотидной последовательности и SEQ ID NO:6 для расшифрованной аминокислотной последовательности).
Что касается новых доменов CDR3 области VL из лучших scFv фрагментов антител, отобранных из библиотеки №2 (Пример 2, таблица 3), авторы определили, что мутации в новых scFv фрагментах антител были объединены в отдельные позиции относительно исходного домена. В 3-х из 4-х scFv фрагментов с лучшим распознаванием VEGF человека, 7 из 8 остатков CDR3 были сохранены, с одной аминокислотой в пятой позиции, которая изменялась от одного положения к другому. Результаты этого анализа показывают на возможность увеличения связи между сайтом связывания и антигеном, что могло быть изучено в дальнейшем путем продуцирования дополнительных замен в отдельной пятой позиции. Новые scFv фрагменты антител, обнаруженные фагом были позже сконструированы, принимая за основу типичный VL CDR3 из группы с лучшим связыванием, где последовательность CDR3, кодирующая пятую аминокислоту, была заменена для того, чтобы продуцировать аминокислоты P, E или D. Новые клоны области VL, которые были, таким образом, продуцированы, обозначены L1, L2 и L3, соответственно.
Из этих замен, одна, содержащая аминокислоту D, оказалась единственной, которая дала в качестве результата scFv фрагмент антитела с лучшим распознаванием антигена, отображенный фагом, по отношению к двум другим новым мутантам, всех предшествующих VL мутантов, и, безусловно, исходного 2Н1 scFv (Пример 3, таблица 4).
Чтобы продолжить улучшение характеристик распознавания антигена, авторы объединили далее VH области Н6, Н5 и Н7, установленные как лучшие из библиотеки №1, с новым L3 области VL (SEQ ID NO:7 для нуклеотидной и SEQ ID NO:8 для расшифрованной аминокислотной последовательности). Этим трем новым scFv фрагментам антител, единожды отображенным фагом, обозначенным как L3H6, L3H5 и L3H7, было проведено сопоставление по аффинности к VEGF-А, относительно 2Н1 scFv фрагмента антитела и других scFv, отображенных фагом, отобранных из библиотек №1 и №2 (Пример 4, таблица 5). Это исследование показало, что три новых scFv фрагмента антител L3H6, L3H5 и L3H7, обнаруженных фагом, превосходят все другие scFv. Среди этих трех, L3H6 является единственным, показывающим лучшее IC50 в реакции ингибирования, с указанием на то, что необходимо добавлять большее количество растворимого 2Н1 scFv фрагмента в реакцию, чтобы ингибировать среднее связывание L3H6 с VEGF человека.
В различных вариантах осуществления настоящего изобретения, гены, кодирующие вариабельные области Н6 (SEQ ID NO:1), H5 (SEQ ID NO:2), H7 (SEQ ID NO:3) и L3 (SEQ ID NO:7) были использованы для создания различных типов рекомбинантных антител: (а) растворимые scFv фрагменты, обозначенные как, scFv L3H6, scFv L3H5 и scFv L3H7, (b) растворимые фрагменты Fab, обозначенные как, Fab L3H6, Fab L3H5 и Fab L3H7, и (с) бивалетные антитело-подобные молекулы scFv2-Fc L3H6, scFv2-Fc L3H5 и scFv2-Fc L3H7.
Для создания рекомбинантных фрагментов антител scFvL3H6, scFvL3H5 и scFvL3H7, гены, кодирующие области VH Н6 (SEQ ID NO:1), H5 (SEQ ID NO:2), H7 (SEQ ID NO:3), были скомбинированы с областью VL L3 (SEQ ID NO:7), заполнены с помощью линкерного сегмента в следующем порядке VH-линкер-VL, используя вектор pACR.1 (Пример 5). Вектор pACR.1 сконструирован для экспрессии рекомбинантных белков в бактериальной периплазме, и добавляет к С-концу молекул пептидный домен c-myc, подходящий в качестве метки для аналитических целей, за которым следует шестой гистидиновый домен, чтобы облегчить очистку с помощью металл-аффинной хроматографии (сокращенно IMAC) (Porath J. 1992. Prot. Expr. Purif. 3:263-281). Фрагменты антитела scFv L3H6 (SEQ ID NO:9 для нуклеотидной последовательности и SEQ ID NO:10 для аминокислотной последовательности), scFv L3H5 (SEQ ID NO:11 для нуклеотидной последовательности и SEQ ID NO:12 для аминокислотной последовательности) и scFv L3H7 (SEQ ID NO:13 для нуклеотидной последовательности и SEQ ID NO:14 для аминокислотной последовательности), с очевидным молекулярным весом приблизительно 29 кДа в додецилсульфат-натриевом полиакриламидном гель-электрофорезе (сокращенно SDS-PAGE), могут быть получены из среды для культивирования трансформированных бактерий, и легко очищены с помощью IMAC.
Для создания рекомбинантных фрагментов Fab антител Fab L3H6, Fab L3H5 и Fab L3H7, гены, кодирующие последовательности, содержащиеся в вариабельных областях Н6 (SEQ ID NO:1), H5 (SEQ ID NO:2), H7 (SEQ ID NO:3) и L3 (SEQ ID NO:7) были клонированы в вектор pFabHum-1 (Пример 9). Плазмида pFabHum-1 является бицистронным вектором, сконструированным для экспрессии фрагмента Fab с СН1 иммуноглобулина человека и константными участками С Lambda в бактериальной периплазме. Вектор добавляет 6 гистидиновый и c-myc домен к С-концу клонированной молекулы. В этой плазмиде, области Н6, Н5 и Н7 были генетически связаны с константным участком СН1, в то время как L3 был связан с константным участком С Lambda, приводя в результате к Fab фрагментам антител Fab L3H6 (с нуклеотидными последовательностями SEQ ID NO:15 и SEQ ID NO:16, которые кодируют аминокислотные последовательности SEQ ID NO:17 и SEQ ID NO:18), Fab L3H5 (с нуклеотидными последовательностями SEQ ID NO:19 и SEQ ID NO:20, которые кодируют аминокислотные последовательности SEQ ID NO:21 и SEQ ID NO:22) и Fab L3H7 (с нуклеотидными последовательностями SEQ ID NO:23 и SEQ ID NO:24, которые кодируют аминокислотные последовательности SEQ ID NO:25 и SEQ ID NO:26).
Фрагменты антител Fab L3H6, Fab L3H5 и Fab L3H7 экспрессируют в Escherichia coli и очищают с помощью IMAC из культуральной среды трансформированных бактерий, и имеют очевидный молекулярный вес приблизительно 50 кДа в неденатурирующем SDS-PAGE.
Бивалентные рекомбинантные антитела scFv2-Fc L3H6, scFv2-Fc L3H5 и scFv2-Fc L3H7 содержат последовательности фрагментов антител scFv L3H6, L3H5 и L3H7, связанные в каждом положении с 3′-последовательностью, которая кодирует 10 аминокислотный линкер, за которым следует нуклеотидная последовательность, кодирующая шарнир, домены СН2 и СН3 иммуноглобулина IgG1 человека. Упомянутые антитела были получены с помощью клонирования ПЦР-продуктов генов, кодирующих вышеуказанные scFv фрагменты, в векторе pVSJG-HucFc (Пример 10). Вектор pVSJG-HucFc был сконструирован для экспрессии антитело-подобных молекул, которые содержат два одинаковых scFv, связанных с Fc иммуноглобулина типа IgG1 человека, в клетках млекопитающих. Молекулы scFv2-Fc L3H6 (SEQ ID NO:27 для нуклеотидной последовательности и SEQ ID NO:28 для аминокислотной последовательности), scFv2-Fc L3H5 (SEQ ID NO:29 для нуклеотидной последовательности и SEQ ID NO:30 для аминокислотной последовательности) и scFv2-Fc L3H7 (SEQ ID NO:31 для нуклеотидной последовательности и SEQ ID NO:32 для аминокислотной последовательности) были созданы в супернатанте клеток СНО (клетки яичников китайских хомячков), трансфицированных с соответствующими плазмидами. Молекулы scFv2-Fc, очищенные с помощью протеина А или протеина G аффинной хроматографии, показывают очевидный молекулярный вес между 100 и 120 кДа в SDS-PAGE.
Целью настоящего изобретения являются рекомбинантные антитела, являющиеся принципиально новыми по отношению к другим антителам и фрагментам антител, которые распознают или нейтрализуют VEGF-A человека, включая и те, которые получены из исходных вариабельных областей 2H1 scFv фрагмента антитела. Это происходит потому, что целью настоящего изобретения являются рекомбинантные антитела:
(а) Имеют принципиально новые последовательности ДНК в их вариабельной области CDR3. Это позволяет отличить их от других антител против VEGF-A, которые описаны другими авторами, также как и тех, которые получены из гибридом (Kim, KJ. et al. 1992. Growth Factors 7:53-64; Muller, Y. et al. 1997. Proc Natl Acad Sci USA 94:7192-7197; Asano, M. et al. 1998. Hybridoma 17:185-190; Schaeppi, JM. et al. 1999. J Cancer Res Clin Oncol 125:336-342; Brekken, RA. et al. 2000. Cancer Res 60:5117-5124; Brekken, RA. and Thorpe, PE. 2001. J Controlled Release 74:173-181), или получены изменением клеток человека вирусной трансформацией (US 5730977), модификацией уже существующих антител с помощью методов генной инженерии (Jayson, G. et al. 2002. JNCI 94:1484-1493; Ferrara, N. et al. 2005. Biochem Biophys Res Comun 333:328-335), а также тех, которые получены из библиотек фрагментов антител человека (Vitaliti A. et al. 2000. Cancer Res 60:4311-4314; Fuh, G. et al. 2006. J Biol Chem 281:6625-6631).
Относительно областей VL и VH 2H1 фрагмента scFv антитела (WO2008/052489 A1), антитела, описанные в настоящем изобретении, также отличаются. Области VH H6 (SEQ ID NO:4), H5 (SEQ ID NO:5) и H7 (SEQ ID NO:6) различаются по всем 7 аминокислотам CDR3 по отношению к 2H1. Область VL L3 (SEQ ID NO:8) отличается по 3 из 8 аминокислот CDR3 по отношению к 2H1.
b) Обладают иммунохимической специфичностью к VEGF-A человека в отличие от тех фрагментов Fab антитела человека, которые получены из других библиотек (Fuh, G. et al. 2006. J Biol Chem 281:6625-6631), а также с теми, которые в бевацизумабе. В отличие от антител, описанных в настоящем изобретении, бевацизумаб не способен распознавать VEGF мыши. Кроме этого, бевацизумаб обнаруживает редуцированный VEGF-A, в то время как антитела, описанные в настоящем изобретении, не могут обнаружить. В примерах 6, 7 и 9 настоящего изобретения описано, как новые рекомбинантные антитела обладают также отличным и превосходным распознавание VEGF-A человека, по отношению к 2H1 фрагмента scFv антитела и рекомбинантным антителам, полученным из 2H1 (WO2008/052489 A1).
(с) Фрагмент антитела scFv L3H6 и рекомбинантные антитела, полученные из него (Fab L3H6 и scFv2-Fc-L3H6) распознают функциональный эпитоп VEGF-A человека, который отличается от всех остальных, установленных другими антителами, нейтрализующими эффекты VFGF-A человека (Muller, Y. et al. 1997. PNAS USA 94:7192-7197; Muller, AY. et al. 1998. Structure 6:1153-1167; Schaeppi, JM. et al. 1999. J Cancer Res Clin Oncol 125:336-342; Brekken, RA. et al. 2000. Cancer Res 60:5117-5124; Fuh, G. et al. 2006. J Biol Chem 281:6625-6631; WO2005012359; WO2008/052489 A1). Новый функциональный эпитоп, обнаруженный в VEGF-A человека с помощью новых рекомбинантных антител ScFv L3H6, Fab L3H6 и scFv2-Fc-L3H6, которые описаны в настоящем изобретении, имеет в качестве незаменимых аминокислот остатки К101, R103, E105 и Y25 (Пример 11). Если эти аминокислоты замещены, распознавание антител, описанных в настоящем изобретении, сильно затруднено.
Новые рекомбинантные антитела, описанные в настоящем изобретении, могут связываться с растворимым VEGF-A человека, VEGF-A человека, адсорбированном на твердой поверхности, или VEGF-A человека, связанном с клетками человека или близкими к ним, которые продуцируют этот фактор, среди последних, клетки, представленные в опухолях человека, которые растут у “голых” мышей.
Новые рекомбинантные антитела, описанные в настоящем изобретении, специфически распознают изоформы 121 и 165 VEGF-А человека, определяют VEGF мыши и блокируют взаимодействие VEGF-A с рецептором VEGFR2, но не с рецептором VEGFR1. Последние два свойства отличают новые рекомбинантные антитела, описанные в настоящем изобретении, от бевацизумаба и ранибизумаба.
Новые рекомбинантные антитела, описанные в настоящем изобретении, имеют более высокую аффинность к VEGF-A человека, чем те, которые получены из 2H1 scFv фрагмента антитела, как показано в Примере 8. Следовательно, эти новые антитела имеют превосходные характеристики по отношению к ScFv 2H1 и антителам, полученным из 2H1, по тестам, которые оценивают: (а) блокирование связи VEGF и VEGFR2 (Пример 7), (b) ингибирование пролиферации эндотелиальных клеток в культуре, в условиях стимуляции VEGF-A человека (Пример 12), (c) ингибирование подкожного ангиогенеза у мышей, вызванного гранулами матригеля, которые содержат VEGF (Пример 13), а также, ингибирование роста опухолей человека, трансплантированных “голым” мышам (Пример 14).
Определение терминов, используемых в настоящем изобретении
Антигенсвязывающий участок
Этот термин описывает часть антитела, которое специфически взаимодействует с антигеном (или его частями). Участок связывания антитела формируется, в основном, двумя вариабельными областями антитела - вариабельными областями легкой (VL) и тяжелой (VH) цепей. Участок связывания антитела формируется нековалентными взаимодействиями вариабельных областей. Участок связывания антитела может быть искусственно стабилизирован посредством сцепления двух вариабельных областей с пептидом, который не будет препятствовать свойствам специфического связывания антигена. Таким вариантом является фрагмент типа scFv. В природе, участки связывания антител соединены с помощью нековалентных взаимодействий вариабельных областей, усиленных нековалентными взаимодействиями CH1 и CL (Kappa и Lambda) константных доменов, а также дисульфидной связью, установленной между цистеином, присутствующим в CL, и другим цистеином, расположенном в шарнирном участке тяжелой цепи антитела. Полные нативные антитела имеют два или более одинаковых антигенсвязывающих участков.
Рекомбинантные антитела
Этот термин описывает иммуноглобулин или его части, продуцированные полностью или частично в синтетической форме, с помощью методов рекомбинантной ДНК или искусственного синтеза генов, со специфическим распознаванием антигена посредством одного или более антигенсвязывающих участков (Gavilondo, J. Y Larrick. J.W. 2000. Biotechniques 29:128-136). Примерами рекомбинантных антител являются, так называемые, химерные и гуманизированные антитела, в которых генная инженерия используется для связывания вариабельных участков генов (или их частей), полученных от одного вида, с константными участками иммуноглобулинов другого вида. Среди рекомбинантных антител авторы изобретения также нашли фрагменты антител, продуцированных с помощью генной инженерии, которые охватывают один или более антигенсвязывающих участков. Примерами рекомбинантных фрагментов антител являются: (i) фрагмент Fab, который содержит иммуноглобулиновые домены VL, VH, CL и СН1; (ii) фрагмент Fd, состоящий из доменов VH и СН1; (iii) фрагмент Fv, состоящий из одного антитела VL и VH; (iv) фрагмент scFv, где домены VH и VL этого антитела скомбинированы в различном порядке (VH-VL или VL-VH) с пептидным линкером, который позволяет двум вариабельным областям связать и сформировать антигенсвязывающий участок (Bird et al. 1998. Science 242:423-426; Huston et al. 1998. PNAS USA 85:5879-5883); (v) "ди-антитела", которые являются поливалентными или полиспецифичными фрагментами, созданными по аналогии с scFv, но с коротким пептидным линкером, который не позволяет доменам VH и VL одной и той же молекулы объединяться в участок связывания, и последние должны быть созданы путем объединения двух или более scFv, таким образом, обеспечивая поливалентность (WO94/13804; Holliger P et al. 1993. PNAS USA 90:6444-6448); (vi) другие фрагменты, такие как dAb (Ward SE et al. 1989. Nature 341:544-546), изолированные CDR, фрагменты F(ab')2, нанотела и би-специфичные димеры scFv (PCT/US92/09965; Holliger P y Winter G. 1993. Current Opinion Biotechnol. 4:446-449; de Haard, H et al. 1998. Adv. Drug Delivery Rev. 31:5-31). Некоторые типы фрагментов, такие как scFv и Fab, могут быть получены из библиотек антител, где большой спектр (репертуар) синтетических или природных генов вариабельных областей вида комбинируется случайным образом, чтобы продуцировать специфические связывания вариабельных областей, которые затем обнаруживаются в виде фрагментов антител на поверхности филаментного фага.
Также рассматривается, что рекомбинантные антитела являются «антитело-подобными» молекулами, продуцированными с помощью методов генной инженерии, где фрагменты антител собраны в константные участки антител. Например, возможно сконструировать бивалентную «антитело-подобную» молекулу (обозначенную в настоящем описании, как scFv2-Fc) путем присоединения scFv к участку, образованному шарниром, CH2, CH3 и в случаях доменов CH4 иммуноглобулина Fc. В зависимости от частей, связанных с этой конструкцией, а также наличия гликозилирования, обозначенная молекула может проявлять все эффекторные функции, связанные с иммуноглобулином Fc. Как только она экспрессируется в подходящем хозяине, молекула scFv2-Fc имеет два сайта связывания, которые представлены двумя одинаковыми scFv.
В заключение, рекомбинантные антитела также являются молекулами, в которых вариабельные области легкой и тяжелой цепей получены из одного источника (т.е. scFv или Fab), собраны в константные области иммуноглобулина человека, например, CH1, шарнир, CH2, CH3 и в случаях CH4, для вариабельной области тяжелой цепи, а C Kappa или C Lambda для вариабельной области легкой цепи.
Эквивалентные варианты антител
Эквивалентными вариантами антител являются полипептидные молекулы, полученные из связываний и манипуляций точных последовательностей их вариабельных областей, которые сохраняют способность специфического распознавания антигена и развития эффектов на нем, а также на его биологических свойствах. Эти полипептидные молекулы могут принимать форму других рекомбинантных фрагментов антител, подобных тем, в которых VL домен расположен перед линкером и VH scFv доменами или другими линкерными сегментами, известными из существующего уровня техники, которые используются, или продуцированы в качестве F(ab')2, Fabc, Facb, димерных, тримерных или тетрамерных фрагментов scFv (Winter G, Milstein C. 1991. Nature 349:293-299; WO94/13804; de Haard, H et al. 1998. Adv. Drug Delivery Rev. 31:5-31). Также, когда поливалентные молекулы продуцируют добавлением иммуноглобулина, полученного из нуклеотидных последовательностей (Bestango M et al. 2001. Biochemistry 40:10686-10692). Эквивалентные варианты антител также продуцируют, когда точные последовательности их вариабельных областей содержатся в биспецифических антителах или в форме полноразмерных антител, связанных с константными доменами иммуноглобулинов человека или от другого вида. Все эти генно-инженерные манипуляции известны специалистам в данной области техники.
Эквивалентные варианты антител также рассматривают те молекулы или варианты, которые продуцированы с помощью, так называемого CDR трансплантата, в котором CDR последовательность вариабельных областей искусственно помещена в чужеродную иммуноглобулиновую конструкцию и данная манипуляция не влияет на способность распознавать исходный антиген и вызывать биологические и биохимические эффекты.
Специфичность антитела или его варианта
Обратимся к ситуации, в которой антитело или его фрагмент не будет в значительной степени связываться с другими молекулами, отличающимися от своей специфически связывающей пары (антигена). Этот термин также применим к случаю, где антигенсвязывающий участок является специфичным для характерного эпитопа, выступающего в числе родственных или неродственных антигенов, в этом случае, участок связывания антитела будет способен распознать несколько антигенов, которые несут упомянутый эпитоп.
Эпитоп. Функциональный эпитоп
Когда антиген большой, то антитело может связаться, исключительно, с определенной частью антигена, которая обозначается эпитопом. Эпитоп распознается участком, связывающим антитело, в случае, если антиген является белком, он может быть образован первичной аминокислотной последовательностью или может быть конформационным, что означает, что аминокислоты в антигене, взаимодействующие с участком связывания антитела структурно собраны в третичную структуру белка, а не являются обязательным продолжением своей первичной структуры. В случае белков, данный эпитоп, по своей природе, является дискретным, характеризующийся группой специфических аминокислот, которые взаимодействуют с теми антителами через нековалентные связи.
Функциональный эпитоп является таким, который определяется экспериментально посредством замены специфической аминокислоты в антигене, и эффект на потерю распознавания антигена (или его самого или его вариантов) устанавливается с помощью иммунохимических методов.
Новые антитела, описанные в настоящем изобретении, являются полезными для предупреждения неоваскуляризации хориоидеи на экспериментальной модели низших приматов, где повреждение глаза вызвано лазерной фотокоагуляцией (Пример 16).
Поскольку они препятствуют взаимодействию между VEGF и рецептором VEGFR2, новые антитела, описанные в настоящем изобретении, влияют на способность активированных эндотелиальных клеток и их предшественников в костном мозге пролиферировать, а также на поддержание физиологической стабильности новых кровеносных сосудов, патологически образующихся при различных заболеваниях. Такое блокирование также может нарушать другие биологические функции, описанные для VEGF, например, его роль в качестве отрицательного регулятора иммунного ответа (Chouaib S et al. 1997. Immunology Today 18:493-497).
Последнее то, что новые рекомбинантные антитела, описанные в настоящем изобретении, являются полезными для разработки принципиально новых терапевтических методов для заболеваний, которые развиваются из-за аномального или чрезмерного ангиогенеза, среди которых можно найти:
(а) Злокачественное новообразование, имеется в виду первичные солидные опухоли и их метастазы; эти терапевтические возможности включают, но не ограничиваются: эпидермоидные опухоли, злокачественные опухоли головы и шеи, колоректальные опухоли, рак простаты, опухоли молочной железы, мелкоклеточный и немелкоклеточный рак легкого, опухоли поджелудочной железы, рак щитовидной железы, рак яичников, опухоль печени, саркому Капоши, неоплазии центральной нервной системы (нейробластома, гемангиобластома, менингиома и метастазы мозга), меланому, гастроинтестинальную карциному и карциному почки, рабдомиосаркому, глиобластому и лейомиосаркому.
Рекомбинантные антитела scFv2-Fc L3H6, scFv2-Fc L3H5 и scFv2-Fc L3H7, описанные в настоящем изобретении, показали действие на рост опухолей человека, трансплантированных “голым” мышам (Пример 14). В виду того, что рекомбинантные антитела, описанные в настоящем изобретении, обладают принципиально новым распознаванием эпитопа VEGF-А человека, они отличаются от других антител и анти-ангиогенных молекул своим способом препятствовать соединению VEGF-А человека со своим рецептором VEGFR2, что смогло привести к различным терапевтическим эффектам в условиях in vivo. Документально известно, что возможно продуцировать различные терапевтические эффекты в условиях in vivo, включая уменьшение побочных эффектов у ракового больного, с антителами, продуцированными против одного и того же антигена, но, которые распознают различные эпитопы или имеют разную аффинность (Allan D.G.P. 2005. The Oncologist 10:760-761; Boland, W.K y Bebb, G. 2009. Expert Opin. Biol. Ther. 9(9):1-8).
(b) Заболевания глаз, такие как возрастная макулодистрофия в экссудативной форме, неоваскулярная глаукома, а также диабетическая и ретинопатия новорожденных. scFv L3H6 и молекулы scFv2-Fc L3H6, описанные в настоящем изобретении, проявили профилактический и терапевтический эффект (Пример 16) при неоваскуляризации хориоидеи, вызванной ожогами лазера на экспериментальной модели низших приматов, свидетельствуя о полезности этих антител в лечении возрастной макулодистрофии (AMD) (Gaudreault, J. et al. 2005. Invest Ophthalmol Visual Sci 46:726-733; Costa, RA et al. 2006. Investing Ophthalmol Visual Sci 47:4569-4578) и других заболеваний глаз, которые имеют схожую патологическую основу.
(с) Хронические и острые воспалительные процессы, подобно астме, респираторному дистресс-синдрому, эндометриозу, а также атеросклерозу и отеку мягких тканей.
(d) Инфекционные заболевания, подобно гепатиту и саркоме Капоши.
(е) Аутоиммунные заболевания, подобно диабету, псориазу, ревматоидному артриту и тиреоидиту.
(f) Еще несколько заболеваний и состояний, такие как, отторжение трансплантированного органа, гемангиома и ангиофиброма.
Рекомбинантные антитела, описанные в настоящем изобретении, могут быть связаны или конъюгированы с ферментом или его фрагментами, с модификатором биологического ответа (BRM), с токсином или препаратом, а также радиоактивными изотопами, которые могут быть добавлены к исходной молекуле, функциональные характеристики которой, отличаются от ее связывания с VEGF-A человека. Молекула scFv L3H6, описанная в настоящем изобретении, была помечена радиоактивной меткой и введена “голым” мышам, несущим опухоли человека (Пример 15). Было показано, что молекула депонировалась в опухоли и оставалась в морфологической области даже через три дня после введения. Таким образом, рекомбинантные антитела, описанные в настоящем изобретении, соединяясь с другими терапевтическими средствами, могут быть основой методов лечения, которые включают их применение в качестве лекарственных препаратов или фармацевтических композиций. Антитела, которые химически или генетически связаны с терапевтическими радионуклидами, токсинами, препаратами или BRM, могут воздействовать терапевтическим эффектом связанного элемента на морфологическую область с аномальной концентрацией VEGF-A человека, а также на опухоль, или в непосредственной близости от нее и, оказывать терапевтическое действие. Количество применений, частота и периодичность лечения зависят от природы и тяжести болезни и данные решения являются ответственностью специалистов и врачей, которые основываются на том, что хорошо известно в данной области.
Другим аспектом настоящего изобретения является использование описанных рекомбинантных антител для продуцирования фармацевтических композиций, которые могут ингибировать ангиогенез, и могут быть использованы в лечении патологических состояний, связанных с ним. Такое лечение включает назначение эффективного количества описанных молекул человеку.
Композиции, продуцированные с рекомбинантными антителами, описанными в настоящем изобретении, могут быть назначены отдельно или в сочетании с другими лекарственными средствами, одновременно или последовательно, все зависит от заболевания, которое лечат. Фармацевтические композиции содержат, в дополнение к действующим активным веществам, принятый фармацевтический эксципиент, буфер, стабилизатор или носитель и другие вещества, хорошо известные специалистам в данной области. Эти вещества не токсичны, не препятствуют эффективности действующих активных веществ, и их тип зависит от способа применения, перорально, на слизистую или парентерально, например, внутривенно. В предпочтительном варианте осуществления изобретения, композиции являются композициями с контролируемым высвобождением рекомбинантных антител по настоящему изобретению и других действующих активных веществ в композиции.
Рекомбинантные антитела, описанные в настоящем изобретении, или их эквивалентные варианты продуцируются путем экспрессии кодирующих нуклеиновых кислот. Вследствие этого, последовательности нуклеиновых кислот, которые кодируют какие-либо из описанных рекомбинантных антител, также являются частью настоящего изобретения, как и способы экспрессии вышеуказанных нуклеиновых кислот. В предпочтительном варианте осуществления изобретения, нуклеиновые кислоты, кодирующие, преимущественно, но не только, нуклеотидные последовательности, приведенные в качестве примера в SEQ ID NO:9, SEQ ID NO:11, SEQ ID NO:13 (scFv L3H6, scFv L3H5 и scFv L3H7, соответственно); SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:23, SEQ ID NO:24 (Fab L3H6, Fab L3H5 и Fab L3H7 отдельные цепи, соответственно); SEQ ID NO:27, SEQ ID NO:29, SEQ ID NO:31 (scFv2-Fc L3H6, scFv2-Fc L3H5 и scFv2-Fc L3H7, соответственно).
Для рекомбинантной экспрессии молекул, описанных в настоящем изобретении или их эквивалентных вариантов, должны быть сконструированы или выбраны соответствующие векторы, которые содержат необходимые регуляторные последовательности, включая промотор, терминатор, энхансер и полиаденилированные последовательности, маркерные гены и другие, которые считаются подходящими. Векторы могут быть плазмидами.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
игура 1. Схематическое изображение плазмиды pACR.1, используемой для создания растворимых scFv фрагментов в периплазме E.coli и супернатанте культуры. Вектор имеет LacZ промотор, участок связывания рибосомы (RBS) и pelB сигнальный пептид (SP).
Фигура 2. (A) Электрофорез в 12% SDS-полиакриламидном геле с результатами очистки scFv L3H6 фрагмента антитела с помощью IMAC, начиная с супернатанта клеток E.coli BL-21, трансформированных плазмидой pACR.1 scFv L3H6; образцы приготовлены в загрузочном буфере с бета-меркаптоэтанолом. Дорожка 1: маркеры молекулярного веса; Дорожка 2: элюция 250 мМ имидазолом, показывающая полосу, соответствующую фрагменту, размером приблизительно 29 кДа. (B) Вестерн-блоттинг реплики на электрофорезе, проведенный с использованием анти c-myc антитела 9Е10.
Фигура 3. Конкурентный метод ELISA для оценки способности различных концентраций фрагментов антител scFv L3H6, scFv L3H5 и scFv L3H7, блокирующих доступ растворимых форм рецепторов VEGFR2 (KDR-Fc) и VEGFR1 (FLT-1-Fc) к VEGF-A человека, адсорбированному на твердой фазе. Обнаружение связанных растворимых рецепторов было проведено с помощью анти-человеческих антител IgG, конъюгированных с HRPO (пероксидазой хрена). (A) Блокирование KDR-Fc. Фрагмент scFv 2H1 был использован в качестве стандарта, а анти-HBsAg несвязанного scFv в качестве отрицательного контроля. (B) Блокирование FLT-1-Fc. Анти-HBsAg несвязанного scFv был использован в качестве отрицательного контроля, а Fab фрагмент люцентис© (ранибизумаб) в качестве контроля ингибирования.
Фигура 4. Схематическое изображение плазмиды pFabHum-1, используемой для создания растворимых Fab фрагментов в периплазме E.coli и супернатанте культуры. Вектор имеет LacZ промотор, участок связывания рибосомы (RBS), pelB и p3M13 сигнальные пептиды (PS) в каждой экспрессионной кассете, вместе с тем или другим, константными доменами иммуноглобулина человека CH1 и С Lambda.
Фигура 5. (A) Электрофорез в 12% SDS-полиакриламидном геле с результатами очистки Fab L3H6 фрагмента антитела с помощью IMAC, начиная с супернатанта клеток E.coli BL-21, трансформированных плазмидой pFabHum-1 Fab scFv L3H6; образцы приготовлены в загрузочном буфере с бета-меркаптоэтанолом. Дорожка 1: маркеры молекулярного веса. Дорожка 2: визуализируются две цепи Fab, размером приблизительно 28-30 кДа. Дорожка 3: Вестерн-блоттинг реплики на электрофорезе, проведенный с использованием анти c-myc антитела 9Е10. Визуализируется только тяжелая цепь Fab, которая содержит c-myc домен. (B) Образцы, полученные в загрузочном буфере без бета-меркаптоэтанола (без сокращения). Дорожка 1: Видимая полоса Fab, с размером приблизительно 50 кДа. Дорожка 2: Вестерн-блоттинг реплики на электрофорезе, проведенный с использованием анти c-myc антитела 9Е10.
Фигура 6. (A) Схематическое изображение плазмиды pVSJG-HucFc, используемой для создания "антитело-подобных" бивалентных молекул путем клонирования гена scFv фрагмента между рестрикционными сайтами AfI II и Xba. (B) Схематическое изображение типа молекулы, продуцируемой клетками млекопитающих после трансфекции с этой плазмидой, как только ген scFv клонируется в вектор.
Фигура 7. Изображение гидрофильных остатков (поверхность) VEGF-A человека, с использованием программы PyMol. Две гомодимерные цепи изображены белым и светло-серым. В белой цепи незаменимые аминокислоты K101, R103, E105 и Y25, связанные с эпитопом, распознаваемым рекомбинантными антителами, описанными в настоящем изобретении, были выделены темно-серым. Как можно увидеть, они определяют "кластер" или конформационную структуру в области молекулы, которая показывает хорошую гидрофильность.
Фигура 8. Способность фрагментов антител (А) scFv L3H6, scFv L3H5 и scFv L3H7, и бивалентных рекомбинантных антител (B) scFv2-Fc L3H6, scFv2-Fc L3H5 и scFv2-Fc L3H7 блокировать стимулирующий эффект VEGF-A человека на пролиферацию эндотелиальных клеток вены пуповины человека (HuVEC). Фрагмент антитела scFv 2H1 и бивалентное рекомбинантное антитело scFv2-Fc 2H1 8.2, были использованы в качестве стандартов. На фигуре показаны относительные значения пролиферации по отношению к добавлению VEGF, а не антител (100%), когда образцы: фрагментов антител в концентрации 40 мкг/мл (A), или бивалентных молекул в концентрации 10 мкг/мл (В) добавлены к клеткам. Отрицательными контролями служили несвязанные анти-HBsAg scFv и рецептор гуманизированного анти-EGF антитела нимотузумаб. В качестве контроля ингибирования был использован растворимый KDR-Fc. Каждый столбец представляет среднее значение из трех реплик, отобранных в группу, с соответствующим стандартным отклонением.
Фигура 9. Способность бивалентных рекомбинантных антител scFv2-Fc L3H6, scFv2-Fc L3H5 и scFv2-Fc L3H7 препятствовать стимулирующему эффекту ангиогенеза VEGF-A человека, который содержится в имплантированных подкожно гранулах матригеля, у C57BI/6 мышей. В качестве отрицательного контроля использовали несвязанное анти-HBsAg моноклональное антитело. В качестве контроля ингибирования использовали растворимый KDR-Fc. Бивалентная молекула scFv2-Fc 2H1 8.2 была использована в качестве стандарта. В конце эксперимента содержимое гранул матригеля обработали гемоглобином, чтобы определить относительное количество новых кровеносных сосудов. График отображает относительные значения концентрации гемоглобина (100%) по отношению к добавлению VEGF, а не антител. Каждый столбец представляет среднее значение для животных, включенных в каждую группу, с соответствующим стандартным отклонением.
Фигура 10. Влияние внутрибрюшинной инъекции бивалентных молекул scFv2-Fc L3H6, scFv2-Fc L3H5, scFv2-Fc L3H7 и scFv2-Fc 2H1 8.2 при 2,5 мг/кг дозы веса на рост подкожных опухолей, полученных от инокуляции клеточной линии A673 опухоли человека мышам “nude”. Точки на кривых означают средние значения опухоли, оцененные для 5 животных в группе. В качестве отрицательного контроля использовали несвязанное CB-Hep.1 моноклональное антитело, в той же самой дозе.
ПРИМЕРЫ
Пример 1. Конструкция фрагментов антител scFv библиотек фагового дисплея, содержащая мутированные вариабельные области
(а) Получение мутированных вариабельных областей с помощью полимеразной цепной реакции (ПЦР)
Последовательности LVVRDTE и LLSYSGAR, соответствующие CDR3 доменов VH и VL 2H1 scFv фрагмента антитела (WO2008/052489 A1), соответственно, были использованы в качестве мишени для мутагенеза. Набор синтетических олигонуклеотидов (таблица 1) был разработан в соответствии с принципом «Экономного мутагенеза» (PM, Balint, R. and Larrick, J.W. 1993. Gene, 137:109-118).
Дизайн и состав синтетических олигонуклеотидов, используемых для мутагенеза 2H1 VH и VL вариабельных областей с помощью ПЦР.
MixTCAG140%20%20%20%220%40%20%20%320%20%40%20%420%20%20%40%(**)Смесь фосфорамидитов:
MixTCAG1
46%18%18%18%
Был проведен двухстадийный метод ПЦР. На первой стадии ПЦР, для выработки и амплификации мутированных scFv VH областей были использованы праймеры VH-B и VH, а для мутированных scFv VL областей - праймеры VL-B и VL (см. таблицу 1). Фагмидный вектор pHG-1m (Rojas, G. et al. 2004 J. Immunol. Meth. 293:71-83), несущий ген "дикого типа" 2H1 scFv фрагмента антитела (обозначенный 2H1-F; WO2008/052489 A1), использовали в качестве ДНК-матрицы в обоих случаях и KOD термостабильный фермент (Novagen) в соответствии с инструкциями фирмы-производителя. На первой стадии ПЦР были проведены 20 циклов амплификации. В конце продукты реакции были независимо друг от друга очищены от агарозного геля с использованием колонок QIAQuick (Qiagen) и элюированы водой. Концентрация ДНК была оценена с помощью электрофореза с использованием ДНК-стандартов (NEB). Далее, проводили вторую стадию ПЦР с использованием праймеров VH-B и VH-F для амплификации VH областей и праймеров VL-B и VL-F - для амплификации VL областей (см. таблицу 1). И в том, и другом случаях, использовали 10 нг очищенной ДНК из соответствующей первой стадии ПЦР. Тот же термостабильный фермент (Novagen) был использован в соответствии с инструкциями фирмы-производителя, и проведено 15 циклов амплификации. Далее, продукты реакции были независимо друг от друга очищены от агарозного геля с использованием колонок QIAQuick (Qiagen) и элюированы водой. Концентрация ДНК была оценена с помощью электрофореза с использованием ДНК-стандартов (NEB).
(b) Клонирование ПЦР-мутированных вариабельных областей в фагмидный вектор.
Образцы вектора 2H1-F и продукт очищенной ДНК из мутированных VH областей, разрезали с помощью рестриктаз SfiI и ApalI (Fermentas и NEB), очищали от агарозного геля с использованием колонок QIAQuick (Qiagen) и лигировали 1:1,5, соответственно, с использованием ДНК-лигазы Т4 (NEB). Продукт лигирования очищали с помощью колонок QIAQuick (Qiagen) и элюировали водой.
Подобным образом, вектор 2H1-F и продукт очищенной ДНК из мутированных VL областей, разрезали с помощью рестриктаз Sal I и NotI (Fermentas и NEB), очищали и лигировали, как было описано выше.
Электрокомпетентные клетки XL 1-Blue MRF' (1×109/мкг, Stratagene) были трансформированы независимо с каждым лигированием в 50 различных реакциях для каждой из них, высеяны также, независимо, на больших чашках в 2xYT/ампицилин, и инкубированы в течение 24 часов при 37°C. Референсные чашки для определения размера библиотеки показывают, что обе библиотеки содержат около 5×108 клеток. Библиотека, содержащая мутированные CDR3 VH областей и VL дикого типа из 2H1 scFv была обозначена как библиотека №1, в то время как другую, с мутированными CDR3 VL областей и VH дикого типа из 2H1 scFv обозначили библиотека №2.
(с) Очистка ДНК из библиотек, содержащих мутированные вариабельные области
Бактериальные колонии собрали с чашек, объединили в соответствии с их происхождением и клетки осадили центрифугированием. Высокоочищенная ДНК была получена из клеточного осадка с помощью набора MaxiPrep (Qiagen) в соответствии с инструкциями фирмы-производителя.
Пример 2. Отбор фрагментов антител scFv отображенных фагом, несущих мутантные вариабельные области тяжелой и легкой цепей с более высокой аффинностью к VEGF человека.
Из библиотек мутированных вариабельных областей была использована ДНК, чтобы независимо электропорировать клетки TG1 E.coli, которые затем были инфицированы фагом-хелпером М13К07 для получения фагов. Фаги очищали и сохраняли в аликвотах при -20°С до последующего выбора экспериментов.
Для отбора, 2×1012 фагов из каждой библиотеки были разведены в PBS с 4% обезжиренным молоком с 50 мкг/мл растворимого scFv 2H1 (WO2008/052489 A1), последний, чтобы способствовать выделению scFv фагом с высокой аффинностью к VEGF-A человека, более высокой, чем у scFv 2H1. Эти смеси были инкубированы, независимо, в течение 5 часов с GST-VEGF человека (Morera, Y et al. 2006. Biotechnol. Appl. Biochem. 44:45-53), и иммобилизованы в иммунопробирках Maxisorp (Nunc). Иммунопробирки предварительно покрывали 10 мкг/мл белка в PBS при 4°С в течение 16 часов, а затем блокировали в PBS с 4% обезжиренным молоком. Несвязанные фаги удаляли 20-кратными промывками в PBS с 0,1% Tween, c последующими двумя дополнительными промывками PBS. Затем связанные фаги элюировали в 100 ммоль/л раствора триэтиламина в течение 10 мин и незамедлительно нейтрализовали в 0,5 моль/л растворе Tris (рН 7,5). Элюированные фаги были амплифицированы в клетках E.coli TG1 и использованы в качестве исходного материала для другого отборочного цикла. Эту методику повторяли два раза с соблюдением тех же условий. Фаги, элюированные из первого и второго отборочных циклов, были использованы для инфицирования TG1 клеток, посеянных на чашках. Репрезентативные случайно отобранные бактериальные колонии были выделены и инфицированы, чтобы воспроизвести фаг в масштабе 96-луночного планшета (Marks, J. et al. 1991, J. Molec. Biol. 222:581-587). Способность таких фаговых клонов, отображающих scFv на своих белках III, связывать GST-VEGF, оценивали с помощью ELISA. 96-луночные планшеты Maxisorp (Nunc) покрыли 10 мкг/мл GST-VEGF человека, и затем блокировали PBS с 4% обезжиренным молоком в течение 1 часа при 22°С, с последующими несколькими промывками в PBS с 0,1% раствором Tween 20. Связанные фаги были обнаружены с анти-M13 антителом, конъюгированным с пероксидазой (Amersham-Pharmacia) в течение 1 часа при 22°С. После нескольких промывок, проводили реакции с раствором субстрата. Поглощение измеряли при 492 нм на автоматическом фотометре для микропланшет (планшет-ридер).
Широкий образец (19 и более) клонов, выделенных из каждой библиотеки, которые получали более высокие значения поглощения на ELISA, были независимо обработаны для получения нуклеотидных последовательностей, кодирующих scFv (Macrogen, Корея).
В таблице 2 представлены аминокислотные последовательности, полученные из нуклеотидных последовательностей CDR3 вариабельной области тяжелой цепи (VH) от клонов, выделенных из библиотеки №1. Все полученные последовательности (19) различались. В той же самой таблице, для каждого фага значения IC50 описывают концентрацию растворимого scFv 2H1 фрагмента, который необходим, чтобы ингибировать связывание фага в ELISA с VEGF на твердой фазе. Для этого 96-луночные планшеты Maxisorp (Nunc) покрывали 10 мкг/мл GST-VEGF, с последующим блокированием в PBS с 4% обезжиренным молоком. Для того, чтобы оценить то же самое количество фагов из каждого клона, смешивали с серийными разведениями растворимого scFv 2H1 и инкубировали в планшетах в течение 1 часа при 22°С. После нескольких промывок в PBS с 0,1% Tween 20, VEGF-связанные фаги были обнаружены с помощью анти-M13 антитела, конъюгированного с пероксидазой (Amersham-Pharmacia) в течение 1 часа при 22°С. После нескольких промывок, проводили реакции с раствором субстрата. Поглощение измеряли при 492 нм на автоматическом фотометре для микропланшет (планшет-ридере). Полученные значения поглощения, по сравнению с концентрациями растворимого scFv 2H1 были отображены графически и необходимая концентрация, чтобы блокировать 50% (IC50) связывания, отображенного фагом scFv с иммобилизованным VEGF, была рассчитана в мкг/мл. Это значение является относительным показателем аффинности различных клонов с антигеном. Более высокие значения IC50 соответствуют более высокой аффинности. Таблица 2 также показывает значение IC50 для исходного отображенного фагом scFv 2H1, с целью сравнения. Из новых клонов отображенного фагом scFv с мутированными CDR3 последовательностями тяжелой цепи, ранее обозначенных, как 3F3, 3E3 и 4D8, имели самую высокую относительную аффинность к VEGF человека. Эти значения в 6-10 раз выше, чем те, которые получены для исходного отображенного фагом scFv 2H1. Последовательности VH этих клонов были обозначены H6 (SEQ ID NO:1 для нуклеотидной последовательности и SEQ ID NO:4 для расшифрованной аминокислотной последовательности), H5 (SEQ ID NO:2 для нуклеотидной последовательности и SEQ ID NO:5 для расшифрованной аминокислотной последовательности) и H7 (SEQ ID NO:3 для нуклеотидной последовательности и SEQ ID NO:6 для расшифрованной аминокислотной последовательности).
VH CDR3 последовательности, и значения IC50 для различных мутантов, отобранных из библиотеки №1.
В таблице 3 представлены расшифрованные аминокислотные последовательности из CDR3 нуклеотидных последовательностей вариабельной области легкой цепи (VL) от клонов, выделенных из библиотеки №2. Анализ последовательности 21 клона показал, что 13 из них различались, а 3 повторяли образцы, которые объединялись в группу из 5, 3 и 3 клонов, соответственно обнаруженных. В таблице 3 также представлены значения IC50, описывающие концентрацию исходного растворимого scFv 2H1, который необходим, чтобы ингибировать связывание фага с VEGF человека на твердой поверхности, в методе ELISA, как было описано выше. В таблице приведено значение IC50 для исходного отображенного фагом scFv 2H1, с целью сравнения. Наибольшие значения IC50 соответствуют клонам, обозначенным, как 1B1, 1H2, 2F6 и 1H3. Эти значения в 23-30 раз выше тех, которые были получены для исходного отображенного фагом scFv 2H1.
VL CDR3 последовательности и значения IC50 для различных мутантов, отобранных из библиотеки №2
Пример 3. Новые мутанты вариабельной области CDR3 легкой цепи.
Принимая во внимание последовательности и IC50, представленные в двух таблицах примера 2, был проведен анализ из возможных новых мутаций, которые создают в CDR3 VL, для того, чтобы в дальнейшем увеличить относительную аффинность к антигену. Было решено сохранить последовательность RLSY(х)LAR из-за ее консервативности в 3 из 4 лучших IC50 клонов и локализовать мутации в пятом положении этой последовательности. Предполагаемые новые аминокислоты для мутаций в этом положении были P, D или E, принимая в расчет характеристики этих специфических остатков, а также то, возникнут ли они в данном положении или нет в других клонах.
Двухстадийная ПЦР, аналогичная описанной в Примере 1a, была использована для получения этих новых мутантов, с использованием ДНК из клона 2F6, в качестве матрицы, а синтетических олигонуклеотидов, в качестве праймеров.
Для клонирования новых фрагментов, было проведено последовательное разрезание фагмидного вектора 2H1-F и новых ПЦР-фрагментов, методом, подобным описанному в Примере 1b. Три новых рекомбинантных вектора были независимо трансформированы и отобраны пять колоний, представляющих каждую трансформацию. ДНК из каждого образца очистили и проверили на наличие ожидаемых мутаций. Была получена высокоочищенная ДНК и независимо электропорированы клетки TG1 E.coli, которые затем инфицировали фагом-хелпером М13. Полученные фаги были очищены и проверены, чтобы определить IC50, как описано выше в аналогичном примере.
Значения IC50, описывающие концентрации исходного растворимого scFv 2H1, необходимые, чтобы ингибировать 50% связывания фагов с VEGF человека на твердой фазе, определили с помощью теста ELISA, аналогичному тому, который был использован в вышеуказанном примере, и представили в таблице 4 для каждого нового фагового клона. Значение для исходного отображенного фагом scFv 2H1 также было включено с целью сравнения. Также представлены другие, описанные ранее клоны. Наибольшее значение IC50 соответствует новому клону L3, которое в 73 раза выше, чем значение исходного отображенного фагом scFv 2H1.
VL CDR3 последовательности и IC50 для различных фаговых клонов
Пример 4. Конструкция scFv фрагментов антител, сочетающая мутированные VH и VL вариабельные области для высокой аффинности к VEGF человека.
Было проведено разрезание рестриктазами и клонирование, как описано выше, чтобы получить 3 новых фрагмента антител, которые сочетают ген, кодирующий VL, из клона L3 (обозначенного одинаковым образом, как L3; SEQ ID NO:7 для нуклеотидной последовательности и SEQ ID NO:8 для расшифрованной аминокислотной последовательности) с теми генами, которые уже упоминались в примере 2, кодирующими тяжелую цепь: H6 (SEQ ID NO:1 для нуклеотидной последовательности и SEQ ID NO:4 для расшифрованной аминокислотной последовательности), H5 (SEQ ID NO:2 для нуклеотидной последовательности и SEQ ID NO:5 для расшифрованной аминокислотной последовательности) и H7 (SEQ ID NO:3 для нуклеотидной последовательности и SEQ ID NO:6 для расшифрованной аминокислотной последовательности). Электрокомпетентные клетки XL 1-Blue MRF′ были независимо трансформированы с этими 3 новыми рекомбинантными плазмидами, а 5 независимых колоний, из каждой клетки были отобраны и выращены, чтобы получить ДНК. После подтверждения соответствующих последовательностей, эти плазмиды были использованы, чтобы независимо электропорировать клетки TG1 E.coli, которые затем были инфицированы фагом-хелпером М13К07 для получения фагов. Фаги очищали и использовали, чтобы оценить IC50 в ELISA, как описывалось в примере 2.
В таблице 5 представлены значения IC50 для каждого нового фагового клона, которые описывают концентрацию растворимого scFv 2H1 фрагмента антитела, необходимого, чтобы ингибировать связывание фага в ELISA с VEGF на твердой фазе, как было описано выше. Высокое значение IC50 и, вследствие этого, лучшее распознавание антигена соответствует новому клону L3H6.
CDR3 последовательности и значения IC50 для новых scFv отображенных фагом клонов, полученных из комбинаций, по отношению к соответствующим исходным клонам
Пример 5. Бактериальная экспрессия и очистка фрагментов антител scFv L3H6, scFv L3H5 и scFv L3H7.
(а) Клонирование фрагментов антител scFv L3H6, scFv L3H5 и scFv L3H7 в вектор pACR.1
Вектор pACR.1 представляет собой плазмиду, сконструированную для экспрессии фрагментов антител в периплазму E.coli (фигура 1). Он имеет, в качестве основных элементов, промотор LacZ, сигнальный пептид, сайты рестрикции NcoI и NotI для инсерции фрагмента, кодирующего ген, домен, кодирующий с-myc пептид, и последовательность, которая кодирует 6 гистидинов, последние для очистки с помощью IMAC. ДНК, соответствующую фагмидам, которая кодирует отображенные scFv фрагменты антител L3H6, L3H5 и L3H7, использовали в качестве матрицы для трех отдельных ПЦР-реакций. Данные методы были проведены с использованием фермента ProofStart (Stratagene) в соответствии с инструкциями фирмы-производителя. Синтетические олигонуклеотиды, приведенные в таблице 6, были использованы в качестве праймеров.
Синтетические олигонуклеотиды для амплификации и модификации scFv L3H6, входящих в состав фагмидного вектора, для клонирования их в плазмиде pACR.1.
Фрагменты ожидаемого размера (700 п.о.), полученные из трех амплификаций, были очищены от 1% агарозного геля с помощью набора QIAquick Gel Extraction (QIAGEN). Различные ДНК были разрезаны рестрикционными ферментами NcoI и NotI (Promega), и повторно очищены для лигирования. Вектор pACR.1 был, подобным образом, разрезан и повторно очищен, а разрезанные фрагменты были независимо лигированы с вектором при помощи ДНК-лигазы Т4 (Promega). Продукты реакции лигирования были использованы для трансформации компетентных клеток E.coli (XL-1Blue; Stratagene) путем электропорации. Трансформированные клетки высевали на плотную селективную среду и культивировали при 37°С. Использованные методы широко известны (Sambrook, Fritsch у Maniatis. 1989 Molecular Cloning, A Laboratory Manual, Second Edition).
Плазмидную ДНК очищали от колоний различных трансформаций (QIAGEN DNA Plasmid MiniPrep kit), проверяли инсертированные (вставленные) гены путем рестрикционного анализа, и плазмиды из нескольких колоний с трансформации отправляли на автоматическое секвенирование ДНК с использованием праймеров, которые гибридизуются за пределами области клонирования вектора pACR.1. Консенсусными последовательностями служили SEQ ID NO:9 для scFv L3H6, SEQ ID NO:11 для scFv L3H5 и SEQ ID NO:13 для scFv L3H7. Эти последовательности описывали фрагменты, как кодирующие VH-линкер-VL-с-myc-гистидины. Характерные для этих конструкций плазмиды, были обозначены, как pACR.1-scFv L3H6, pACR.1-scFv L3H5 и pACR.1-scFv L3H7.
(b) Экспрессия scFv L3H6, scFv L3H5, scFv L3H7 в E.coli и очистка
Компетентные клетки BL21 E.coli были трансформированы плазмидами pACR.1-scFv L3H6, pACR.1-scFv L3H5 и pACR.1-scFv L3H7.
Трансформированные клетки высевали на плотную селективную среду и культивировали в течение 16 часов при 37°С. Колонии, характерные для каждой конструкции, выращивали в жидкой питательной среде и при 600 нм оптической плотности, приравненной к 1, стимулировали в течение 12 часов добавлением 1 ммоль изопропил-β-D-тиогалактопиранозида (ИПТГ) в среду. Клетки центрифугировали, а культуры супернатантов подвергали диализу в связывающем буфере (50 ммоль NaH2PO4, 300 ммоль NaCl, рН 7-8) и наносили непосредственно и независимо в Agarose-NTA (QIAGEN). После удаления загрязнений промывками 10 ммоль имидазолом, связанные белки элюировали в 250 ммоль имидазола.
Полученные фракции оценивали с помощью 12% SDS-полиакриламидного геля и Вестерн-блоттинга, используя в последнем моноклональное антитело 9Е10, конъюгированное с пероксидазой, распознающее с-myc полученного пептида, который имеют эти белки. Фигура 2 показывает результаты проведенных методик в случае фрагмента антитела scFv L3H6. Фигура 2А, дорожка 2, демонстрирует высокую чистоту элюирования, что содержит фрагмент антитела, которое приблизилось к 29 кДа. Фигура 2В показывает, что очищенный белок распознается иммунохимически моноклональным антителом 9Е10.
Пример 6. Характеристика с помощью ELISA иммунохимического распознавания различных вариантов VEGF фрагментами антител scFv L3H6, scFv L3H5 и scFv L3H7 по сравнению с scFv 2H1.
96-луночные иммунопланшеты Nunc Maxisorp покрыли изоформами 121 и 165 VEGF-A человека (Peprotech), VEGF мыши (Peprotech) и P64K-VEGFKDR- (Morera, Y., et al. 2008. Angiogenesis 11(4):381-393) с концентрацией 1 мкг/мл в PBS в течение 16 ч при 4°С. P64K-VEGFKDR- представляет собой рекомбинантный белок, вырабатываемый в E.coli, относящийся к VEGF человека, мутированный в остатках 82, 84 и 86, чтобы уменьшить его взаимодействие с рецептором VEGFR2 (KDR). После блокирования планшетов с PBS и 4% обезжиренным молоком, добавили фрагменты антител scFv L3H6, L3H5, L3H7 и 2H1, разведенные в PBS с 4% обезжиренным молоком, в концентрации 10 мкг/мл и инкубировали в течение 1 часа при 22°С. После нескольких промывок добавили моноклональное антитело 9Е10, конъюгированное с пероксидазой в течение 1 часа. После промывки, фрагменты, связавшиеся с твердой фазой, были обнаружены путем добавления раствора субстрата. Поглощение измеряли при 492 нм на автоматическом фотометре для микропланшет (планшет-ридер). Несвязанный анти-HBsAg scFv был использован в качестве отрицательного контроля (Ayala, М. et al. 1995 Biotechniques 18:832-842).
В таблице 7 показано, что фрагменты антител scFv L3H6, scFv L3H5 и scFv L3H7 имеют различное распознавание паттерна по отношению к scFv 2H1 и обеспечивают более высокие значения поглощения (при 492 нм) (среднее значение по трем лункам, взятое в качестве стандарта, который представлен отрицательным контролем). Это указывает на более высокую аффинность к антигену человека.
Значения поглощения (при 492 нм), показывающие распознавание VEGF-A человека и мыши фрагментами антител scFv L3H6, L3H5, L3H7 и 2H1.
Пример 7. Блокирование взаимодействия рецептора VEGF фрагментами антител scFv L3H6, scFv L3H5, scFv L3H7 и scFv 2H1.
Используя конкурентную систему ELISA, авторы оценили способность очищенных фрагментов антител scFv L3H6, scFv L3H5, scFv L3H7 и scFv 2H1 блокировать взаимодействие между рецептором VEGF человека и рекомбинантными рецепторами VEGF-VEGFR2 (KDR) и VEGFR1 (FLT-1). Подходы были основаны на ингибировании связывания растворимых рецепторов KDR-Fc и FLT-1-Fc с VEGF-A человека, адсорбированном на твердой поверхности, путем добавления возрастающих концентраций фрагментов.
96-луночные планшеты Nunc Maxisorp покрывали изоформой 121 VEGF-A человека (Peprotech) в концентрации 1 мкг/мл в PBS в течение 16 часов при 4°С. Эти планшеты блокировали, промывали и лунки инкубировали с возрастающими концентрациями (до 70 мкг/мл) очищенных фрагментов антител scFv L3H6, scFv L3H5, scFv L3H7 и scFv 2H1, или PBS с 4% молоком, а также 0,5 мкг/мл растворимых рецепторов KDR-Fc (R&D) или FLT-1-Fc (R&D). Несвязанные анти-HBsAg scFv были использованы в качестве отрицательного контроля (Ayala, M et al. 1995 Biotechniques 18:832-842), а Fab фрагмент люцентис© (ранибизумаб) в качестве контроля ингибирования. Растворимые рецепторы KDR-Fc или FLT-1-Fc, связанные с VEGF-A человека на твердой фазе, были обнаружены с анти-IgG антителами человека, конъюгированными с пероксидазой (Sigma). В случае с KDR-Fc (VEGFR2), как показано на фигуре 3А, фрагменты антител scFv L3H6, scFv L3H5 и scFv L3H7 блокируют связывание рецептора с VEGF-A человека на твердой фазе, при четкой дозовой зависимости. Значения ингибирования для фрагментов антител scFv L3H6, scFv L3H5 и scFv L3H7 намного выше тех, которые наблюдались в подобном эксперименте со стандартным scFv 2H1 фрагментом антитела.
В случае с FLT-1-Fc (VEGFR1), как показано на фигуре 3В, фрагменты антител scFv L3H6, scFv L3H5, scFv L3H7 и scFv 2H1 не блокируют связывание рецептора с VEGF-A человека, в то время как ранибизумаб блокирует.
Пример 8. Измерения аффинности фрагментов антител scFv L3H6, scFv L3H5, scFv L3H7 и scFv 2H1 к VEGF человека.
Связывающая аффинность фрагментов антител scFv L3H6, scFv L3H5, scFv L3H7 и scFv 2H1 с VEGF человека была измерена с помощью BIAcore-X (BIAcore, Швеция). Сенсорный чип CM5 был активирован через ковалентное связывание VEGF человека, используя N-этил-N′-(3-диметиламинопропил) гидрохлорид карбодиимида (EDC) и N-гидроксисукцинимид (NHS) в соответствии с инструкциями фирмы-производителя. Изоформу 165 VEGF человека (PeproTech) развели до 5 мкг/мл в 10 ммоль/л ацетат-натриевого буфера (рН 5,5), и ввели со скоростью потока 5 мкл/мин, чтобы получить приблизительно 290 единиц ответа связанного белка.
Для кинетических измерений серийные разведения препаратов очищенных фрагментов scFv L3H6, scFv L3H5, scFv L3H7 и scFv 2H1, вводили в буфер HBS (10 ммоль/л HEPES, 150 ммоль/л NaCl, 3 ммоль/л ЭДТА, 0,005% поверхностно-активного вещества P20, рН 7,4) при 25°С и скорости потока 25 мкл/мин.
Кинетические параметры и константы равновесной диссоциации (KD) были рассчитаны с использованием программного обеспечения BIA Evaluation 3.2. Данные по связыванию приведены в целом в соответствие с моделью адсорбции Ленгмюра в отношении 1:1. Полученные KD приведены в таблице 8.
Константы равновесной диссоциации (KD)
Эти результаты показывают, что фрагменты антител scFv L3H6, scFv L3H5 и scFv L3H7 распознают VEGF-A человека с аффинностью от 5 до 20 раз выше, чем фрагмент антитела scFv 2H1.
Пример 9. Получение и характеристика фрагментов антител Fab L3H6, Fab L3H5 и Fab L3H7.
(а) Клонирование в вектор pFabHum-1 и секвенирование
Фигура 4 представляет собой схематическое изображение плазмиды pFabHum-1, которая используется для получения растворимых Fab-фрагментов антител в периплазме и культуральной среде трансформированной Е.coli. Вектор имеет промотор LacZ, участок связывания рибосомы (RBS), последовательность сигнального пептида (SP), участки клонирования для вариабельной области легкой цепи (SaI I и Avr II), и последовательность, кодирующую иммуноглобулиновый домен Cλ человека, за которым следуют другие RBS, SP, и участки клонирования для вариабельной области тяжелой цепи (Ара LI и Bst EII), и, следующая за ними последовательность, кодирующая иммуноглобулиновый домен СН1 человека, которая была расширена, чтобы включить первый цистеин шарнирной области Fc IgG1 человека. Вариабельная область СН1 тяжелой цепи экспрессируется вместе с 6-ти гистидиновым доменом для очистки с помощью IMAC и с-myc пептидом для аналитических целей, которые находятся в С-конце, включенном в вектор.
Фагмидная ДНК, которая кодирует фрагменты антител scFv L3H6, scFv L3H5 и scFv L3H7 была сначала разрезана с помощью ферментов Ара LI и Bst EII, чтобы получить соответствующие VH области. После проверки размеров фрагментов в 1,5% агарозном геле, три VH клонировали отдельно в pFabHum-1, предварительно разрезанном теми же ферментами. Как только клонирование было проверено с помощью рестрикционного анализа, промежуточные плазмиды (обозначенные как, pFab-RVH6, pFab-RVH5 и pFab-RVH7) были реплицированы, очищены и подвергнуты новой рестрикции с ферментами SaI I и Avr II. После проверки размеров в 1,5% агарозном геле, фагмид, который кодирует фрагмент антитела scFv L3H6, был разрезан ферментами SaI I и Avr II, чтобы получить уникальный L3 области VL, который затем клонировали в разрезанные плазмиды pFab-RVH6, pFab-RVH5 и pFab-RVH7. Как только клонирование проверили с помощью рестрикционного анализа, три полученные плазмиды (обозначенные как, pFab L3H6, pFab L3H5 и pFab L3H7) были реплицированы, очищены и подвергнуты автоматическому ДНК-секвенированию. Последовательность ДНК, кодирующая две зрелые белковые цепи (без 6-ти гистидинового и с-myc доменов в тяжелой цепи), которые составляют фрагменты антител Fab L3H6, L3H5 Fab и Fab L3H7, представлены SEQ ID NO:15 и SEQ ID NO:16, SEQ ID NO:19 и SEQ ID NO:20, SEQ ID NO:23 и SEQ ID NO:24, соответственно. Расшифрованные аминокислотные последовательности этих Fab фрагментов антител описаны в SEQ ID NO:17 и SEQ ID NO:18, SEQ ID NO:21 и SEQ ID NO:22, SEQ ID NO:25 и SEQ ID NO:26, соответственно.
(b) Экспрессия Fab L3H6, Fab L3H5 и Fab L3H7 в E.coli и очистка
Компетентные клетки BL21 E.coli были трансформированы pFab L3H6, pFab L3H5 и pFab L3H7. Трансформации высевали на плотную селективную среду и культивировали в течение 16 часов при 37°С. Репрезентативные колонии от каждой конструкции выращивали в жидкой среде и при 600 нм оптической плотности, приравненной к 1, стимулировали экспрессию Fab путем добавления ИПТГ к среде. Клетки центрифугировали и культуры супернатантов подвергали диализу в связывающем буфере и наносили непосредственно и независимо в Agarose-NTA (QIAGEN). После удаления загрязнений промывками, связанные белки элюировали в 250 ммоль имидазола.
Для электрофоретических исследований были использованы два условия. В первом случае, образцы инкубировали в электрофоретическом буфере с бета-меркаптоэтанолом, чтобы выработать снижение. Во втором случае, бета-меркаптоэтанол не использовали. На фигуре 5а показаны результаты очистки и Вестерн-блоттинга (со сниженными образцами и анти c-myc 9E10 антителом для развития). В SDS-PAGE визуализируются обе цепи Fab (дорожка 2), с приблизительным размером 28-30 кДа. В Вестерн-блоттинге обнаруживается только Fab тяжелой цепи, поскольку она содержит с-myc (дорожка 3). На фигуре 5В, видны образцы, представленные без снижения. SDS-PAGE показывает полосу, соответствующую Fab, с приблизительным размером 50 кДа (дорожка 1), который распознается в Вестерн-блоттинге с использованием моноклонального конъюгированного антитела 9Е10 (дорожка 2).
(с) Характеристика распознавания VEGF человека в ELISA фрагментами антител Fab L3H6, Fab L3H5 и Fab L3H7
Для очищенных фрагментов антител Fab L3H6, Fab L3H5 и Fab L3H7 было оценено распознавание VEGF-A человека в ELISA, с использованием в качестве стандарта Fab 2H1-32 (WO2008/052489 A1). 96-луночные иммунопланшеты Nunc Maxisorp покрыли изоформами 121 и 165 VEGF-A человека (Peprotech), VEGF мыши (Peprotech) и P64K-VEGFKDR-(Morera, Y., et al. 2008. Angiogenesis 11(4):381-393), в концентрации 1 мкг/мл в PBS в течение 16 часов при 4°С. После блокирования планшет в PBS с 4% обезжиренным молоком, фрагменты антител Fab разводили в PBS с 4% обезжиренным молоком, куда была добавлена концентрация 10 мкг/мл, и инкубировали в течение 1 часа при 22°С. После нескольких промывок, добавили моноклональное антитело 9Е10, конъюгированное с пероксидазой, в течение 1 часа. После промывки фрагменты, связанные с твердой фазой, были обнаружены путем добавления раствора субстрата. Поглощение измеряли при 492 нм на автоматическом фотометре для микропланшет (планшет-ридере). Несвязанные Fab, полученные в результате рестрикции анти-человеческого EGF рецептора антитела Нимотузумаб, также обозначены, как hR3 (Boland, W. К у Bebb, G. 2009. Expert Opin. Biol. Ther. 9(9):1-8).
В таблице 9 показано, что фрагменты антител Fab L3H6, Fab L3H5 и Fab L3H7 имеют паттерн распознавания, отличный от Fab-2H1-32, и обнаруживают более высокие значения поглощения (492 нм, среднее по трем лункам), принимая в качестве стандарта те, которые наработаны отрицательным контролем, все, что свидетельствует о лучшей аффинности к антигену человека.
Значения поглощения (492 нм), указывающие на распознавание VEGF-А человека и мыши фрагментами антител Fab L3H6, Fab L3H5, Fab L3H7 и Fab 2H1-32.
Пример 10. Генерация и характеристика распознавания димерных молекул scFv2-Fc L3H6, scFv2-Fc L3H5 и scFv2-Fc L3H7.
(а) Генерация трансфектом, вырабатывающих антитело-подобные молекулы scFv2-Fc L3H6, scFv2-Fc L3H5 и scFv2-Fc L3H7
Чтобы получить антитело-подобные молекулы scFv2-Fc L3H6, scFv2-Fc L3H5 и scFv2-Fc L3H7, была проведена ПЦР с использованием плазмид pACR.1-scFv L3H6, pACR.1-scFv L3H5 и pACR.1-scFv L3H7 в качестве матриц, и синтетических олигонуклеотидов, представленных в таблице 10, для изменения последовательностей ДНК, кодирующих эти фрагменты антител, чтобы совместить их с последующим клонированием. Данный метод проводили с KOD ДНК-полимеразой (Novagen) в соответствии с инструкциями фирмы-производителя.
Синтетические олигонуклеотиды, используемые в ПЦР-амплификации для получения scFv2-Fc L3H6, scFv2-Fc L3H5 и scFv2-Fc L3H7.
Последовательности ДНК, амплифицированные с помощью ПЦР, были клонированы в вектор pVSJG-HucFc. Данный вектор (фигура 6А) был сконструирован для экспрессии в клетках млекопитающих из полипептидной цепи, содержащей, в следующем порядке: сигнальный пептид тяжелой цепи из моноклонального антитела мыши, за которым идет последовательность, кодирующая scFv, разделенная 10-ю аминокислотами (выступающие в качестве спейсера), консенсусные последовательности, кодирующие шарнир, домены СН2 и СН3 иммуноглобулина IgG1 человека. Это обуславливает то, что сигнальный пептид этой полипептидной цепи направлен на эндоплазматический ретикулум, где происходит димеризация через образование ковалентных дисульфидных связей в шарнирной области и комплементарная связь доменов СН2 и СН3. Шарнир, домены СН2 и СН3 образуют Fc-участок иммуноглобулина человека, который связывается своим N-концом с двумя одинаковыми scFv, создавая бивалентную антитело-подобную молекулу (фигура 6В).
Фрагменты, амплифицированные с помощью ПЦР, были разрезаны рестрикционными ферментами AfI II и Xba I и независимо клонированы в вектор pVSJG-HucFc. Автоматическое секвенирование ДНК подтвердило идентичность клонированных продуктов. Нуклеотидные последовательности, кодирующие три зрелых белка, полученные в результате, scFv2-Fc L3H6, scFv2-Fc L3H5 и scFv2-Fc L3H7, описаны в SEQ ID NO:27, SEQ ID NO:29, SEQ ID NO:31, соответственно, а расшифрованные аминокислотные последовательности, описаны в SEQ ID NO:28, SEQ ID NO:30, SEQ ID NO:32, соответственно.
Плазмиды pVSJG-HucFc L3H6, pVSJG-HucFc L3H5 и pVSJG-HucFc L3H7 были очищены от свободных эндотоксинов с использованием набора Pure Yield Plasmid Midiprep Kit (Promega). Клетки СНО (яичников китайских хомячков) (EACC Кат.№85050302) трансфицировали указанными плазмидами, используя SuperFect (QIAGEN). Трансфектомы были отобраны в среду, содержащую G418, в качестве маркера устойчивости. Супернатанты клеточных культур, полученные из трансфектом колоний, растущих с G418, оценивали с помощью ELISA. 96-луночные планшеты Maxisorp (Nunc) покрывали VEGF121 человека (Peprotech). Супернатанты, разведенные в PBS с 2% обезжиренным молоком, добавляли в планшеты и молекулы scFv2-Fc анти-VEGF обнаруживали анти-Fc антителами человека, конъюгированными с пероксидазой (Sigma). Трансфектому клеточных колоний с более высоким уровнем секреции молекул scFv2-Fc анти-VEGF, обнаруженную с помощью ELISA, неоднократно клонировали путем ограниченного разведения в среде, содержащей G418, всегда проверяя ее способность к секреции с помощью ELISA. После, по крайней мере, двух последовательных клонирований, были получены три стабильных клона, вырабатывающих антитело-подобные молекулы, обозначенные как, scFv2-Fc L3H6, scFv2-Fc L3H5 и scFv2-Fc L3H7.
(b) Очистка молекул scFv2-Fc L3H6, scFv2-Fc L3H5 и scFv2-Fc L3H7 и оценка связывающей активности с VEGF человека методом ELISA
Трансфектомы клонов, вырабатывающих молекулы scFv2-Fc L3H6, scFv2-Fc L3H5 и scFv2-Fc L3H7 культивировали на матрасах, размером 162 см2 в среде, содержащей 0,5% эмбриональной бычьей сыворотки. После высокой плотности клеточной популяции был получен супернатант, который собирали и разводили в соотношении 1:1 в 0,1 М натрий-фосфатном буфере, рН 7,0, а затем молекулы scFv2-Fc очищали с помощью аффинной хроматографии с использованием Protein A Sepharose Fast Flow 4 (Amersham). Различные молекулы scFv2-Fc были независимо элюированы в 0,2 М глициновом буфере, рН 4,0, и незамедлительно нейтрализованы 1 М Трис, рН 10,0. После диализа в PBS, рассчитали концентрацию белка путем измерения поглощения при 280 нм. Чистоту оценивали с помощью 12% SDS-PAGE. Образцы очищенных молекул были проверены в ELISA, как описывалось в (а), по сравнению с неочищенным супернатантом, показывая соответствующую активность распознавания VEGF-A человека.
Пример 11. Выявление функционального эпитопа на VEGF человека, который распознается фрагментами антител scFv L3H6, scFv L3H5 и scFv L3H7.
Для получения и отображения мутантов VEGF121 человека впервые были отобраны мутированные (измененные) остатки на основе анализа трехмерной структуры молекулы (PDB: 1FLT), расположения зон, для которых описано распознавание другими антителами и различия между VEGF человека и мыши. Мутированные остатки представлены в таблице 11.
Мутированные остатки VEGF121 человека
Мутации были получены с помощью ПЦР с использованием синтетических олигонуклеотидов (таблица 12), гибридизующихся с N- и С-концевыми последовательностями, кодирующими VEGF121 человека и в специфических зонах, где должны быть введены ожидаемые мутации.
Синтетические олигонуклеотиды, используемые для получения мутантов VEGF121 человека
Была проведена двухстадийная ПЦР, чтобы ввести мутации, используя плазмиду pVEGF (Ojalvo, A. G. et al. 2003. Electronic J. Biotechnol. 6, 208-222), содержащую VEGF121 человека, в качестве матрицы, и фермент KOD ДНК-полимеразу (Novagen). На первой стадии, были использованы олигонуклеотиды, комплементарные концам (VEGF-FOR или VEGF-BACK), соединяющимся в реакции с соответствующими мутантными (М-BACK или М-FOR), в реакции из 15 циклов согласно инструкций фирмы-производителя термостабильного фермента полимеразы. На второй стадии ПЦР, смесь из двух предыдущих реакций стадии 1 была использована в качестве матрицы для каждого мутанта. Олигонуклеотиды, примененные для введения мутации (M-BACK и M-FOR), разводили в соотношении 1:100 и использовали вместе с олигонуклеотидами, комплементарными концам (VEGF-FOR или VEGF-BACK). ДНК амплифицированных фрагментов были независимо очищены с помощью колонок QIAquick (Qiagen), а затем дважды разрезаны ферментами ApaL I и Not-I HF (NEB) в течение 4 часов. После очистки продуктов колонками QIAquick (Qiagen) и элюирования в воде, разрезанные фрагменты ДНК были клонированы в вектор pHG-1m (Rojas, G. et al. 2004. J. Immunol. Meth. 293:71-83), предварительно разрезанный теми же ферментами, обработанный фосфатазой (NEB) в течение 1 часа и очищенный от агарозного геля с использованием тех же колонок. Гены, клонированные в вектор pHG-1m, отображались на поверхности филаментных фагов в виде слияния с Белком III. В соотношении 1:5 вектор к фрагменту и лигазу Т4 (NEB) использовали в реакции лигирования в течение 12 часов при 16°С.
Клетки TOP 10 F1′ (Invitrogen) трансформировали независимо с каждой реакцией лигирования мутанта, высевали в селективную среду LB, содержащую ампициллин, и инкубировали в течение 24 часов при 37°С. От каждого мутанта отбирали пять колоний и культивировали в 5 мл культур, для того чтобы очистить плазмиды с помощью набора plasmid Miniprep Kit (Qiagen). ДНК секвенировали и проверяли наличие ожидаемых мутаций. Был получен соответствующий продукт для исследований фаговой экспрессии.
Электрокомпетентные клетки TG1 E.coli были независимо трансформированы с фагмидами, кодирующими каждый мутант. Фагмиды, кодирующие дикий тип (WT) VEGF и несвязанный белок (NR), также были включены в качестве контроля в данный эксперимент. Трансформированные клетки были инфицированы М13К07 для получения фагов. Фаги были очищены и использованы, чтобы оценить с помощью ELISA распознавание каждого различными анти-VEGF антителами: Бевацизумабом, поликлональными антителами кролика (pAb) и фрагментом антитела scFv L3H6. 96-луночные планшеты покрывали этими антителами, в концентрации 10 мкг/мл в PBS в течение 16 часов при 4°С. После блокирования планшет в PBS с 4% обезжиренным молоком, мутанты или VEGF дикого типа, отображенные фагом, добавляли к планшетам и инкубировали в течение 1 часа. Планшеты были промыты PBS с 0,1% раствором Tween 20 и обнаружены связанные фаги с анти-M13 антителом, конъюгированным с пероксидазой (Amersham-Pharmacia) в течение 1 часа. Планшеты снова промывали и проводили реакции с раствором субстрата. Через 20 мин реакции останавливали 1М H2SO4 и при 492 нм измеряли поглощение на автоматическом фотометре для микропланшет (планшет-ридер).
В таблице 13 представлена иммунологическая реактивность, выраженная средними значениями поглощения по трем лункам для каждого анти-VEGF антитела против различных мутантов, VEGF дикого типа или несвязанного белка, отображенных фагом.
Иммунологическая реактивность, выраженная значениями поглощения для каждого анти-VEGF антитела против различных мутантов и VEGF дикого типа, отображенных фагом
В таблице 13 мутанты M2 (R56E) и М10 (R56A) выделены серыми клетками, которые вызывают ухудшение распознавания тремя проверенными антителами. Известно, что эта аминокислота играет важную роль в структурной целостности VEGF человека и других членов семейства, таких как, PLGF и PDGF (Keyt, B.A. et. al. 1996. J. Biol. Chem. 271:5638-5646). Вышеуказанные мутанты были использованы в эксперименте в качестве внутреннего контроля по отношению к нарушению структуры молекулы, в целом. В этой же таблице 13, данные, соответствующие мутантам: M11 (K101R), M22 (E103A), M23 (R105A) и M24 (Y25A), выделены жирным шрифтом и курсивом. Эти мутации заметно влияют на распознавание scFv L3H6 фрагментом антитела, в то время как на распознавание анти-VEGF поликлональными антителами, полученными от кроликов или гуманизированным терапевтическим антителом бевацизумабом, которые были использованы в этом же эксперименте, не повлияли.
Эти результаты показывают, что новый функциональный эпитоп VEGF человека распознается scFv L3H6 фрагментом антитела и другими рекомбинантными антителами, полученными от него (Fab L3H6 и scFv2-Fc-L3H6); описанный в настоящем изобретении, определенно имеет, в качестве незаменимых аминокислот, остатки K101, R103, E105 и Y25.
На фигуре 7 представлено схематическое изображение поверхности остатков на гомодимере VEGF-A человека, полученного с помощью программного обеспечения PyMol. На данном изображении выделены темно-серым в одном из двух гомодимеров аминокислоты K101, R103, E105 и Y25, которые крайне необходимы для распознавания антигена новыми рекомбинантными антителами, описанными в настоящем изобретении.
Графическое изображение гомодимера VEGF-A человека, полученное с использованием программного обеспечения PyMol, показывает, что аминокислоты K101, R103, E105 и Y25 устанавливают конформационный кластер в области молекулы, с хорошей гидрофильностью.
Пример 12. Оценка в условиях in vitro антипролиферативного эффекта различных рекомбинантных антител, которые распознают VEGF человека, на модели эндотелиальных клеток вены пуповины человека (HuVEC), стимулированных VEGF человека.
В условиях in vitro антипролиферативный эффект молекул scFv L3H6, scFv L3H5, scFv L3H7, scFv2-Fc L3H6, scFv2-Fc L3H5 и scFv2-Fc L3H7 определяли на модели эндотелиальных клеток вены пуповины человека (HuVEC), стимулированных VEGF человека.
Антитела scFv 2H1 и scFv2-Fc 2H1-8.2 (WO2008/052489 A1) были использованы в качестве стандарта, а scFv анти-HBsAg (Ayala, M. et al. 1995. Biotechniques 18:832-842) и нимотузумаб (Центр молекулярной иммунологии в Гаване) в качестве отрицательного контроля. Растворимый KDR-Fc 1 мкг/мл (Sigma) использовали в качестве контроля ингибирования.
В нескольких словах, 3000 клеток HuVEC (PromoCell GmbH) высевали в каждую лунку 96-луночного культурального планшета (Costar), предварительно покрытого 1% желатином (Sigma), в среду RPMI 1640, дополненную 1% (объем на объем) эмбриональной бычьей сывороткой (Gibco), и выращивали при 37°С в 5% СО2 в течение 72 часов. Клетки стимулировали только 10 нг/мл VEGF-A человека (Peprotech; контроль роста произвольно установили за 100%) либо 10 нг/мл VEGF-A человека и 40 мкг/мл фрагментов scFv, либо 10 мкг/мл бивалентных молекул. В конце эксперимента клетки окрашивали 0,5% кристаллическим фиолетовым в 20% метаноле. Планшеты промывали водой и высушивали на воздухе. Окрашивание элюировали смесью раствора этанола и 0,1М цитрата натрия в соотношении 1:1 и измеряли поглощение при 562 нм на планшет-ридере. Значение поглощения пролиферации базальных клеток приняли за 100%. Данные поглощения, полученные от эффекта каждой из исследуемых молекул, были оценены в процентах по отношению к максимальному контролю пролиферации. Эти значения пролиферации по отношению к 100%, свидетельствует о способности этой молекулы ингибировать рост клеток HuVEC, стимулированных VEGF человека. Как показано на фигурах 8А (для молекул scFv L3H6, scFv L3H5 и scFv L3H7) и 8В (scFv2-Fc L3H6, scFv2-Fc L3H5 и scFv2-Fc L3H7), рекомбинантные антитела, являющиеся целью настоящего изобретения, ингибируют пролиферацию клеток HuVEC при применяемых дозах. Ингибирование, созданное каждым типом рекомбинантных антител (scFv или бивалентной молекулой), превосходит то, которое произвели в равных дозах фрагмент антитела scFv 2H1 или бивалентная молекула scFv2-Fc 2H1 8.2. Как правило, бивалентные молекулы являются более эффективными в блокировании доступа VEGF к клеточным рецепторам и, следовательно, ингибируют пролиферацию клеток HuVEC при более низких дозах.
Пример 13. Оценка в условиях in vitro антиангиогенного эффекта различных рекомбинантных антител, которые распознают VEGF человека, на модели мышей с имплантированными подкожно гранулами матригеля.
В условиях in vivo антиангиогенный эффект бивалентных молекул scFv2-Fc L3H6, scFv2-Fc L3H5 и scFv2-Fc L3H7 изучался на экспериментальной модели, описанной Passaniti с соавт. (Passaniti A et al. 1992. Lab Invest. 67:519-28). Для сравнения была использована бивалентная антитело-подобная молекула scFv2-Fc 2H1 8.2 (WO2008/052489 А1).
В данной модели, ангиогенез вызывается путем подкожного введения (инокуляции) мышам C57BI/6 (CENPALAB, Гавана) экстракта белков внеклеточного матрикса (Matrigel, Becton Dickinson) в присутствии проангиогенных факторов. Животные были разделены на группы по 10 и инъецированы подкожно в брюшную область 500 мкл матригеля, содержащего 200 нг VEGF человека (Peprotech), 100 мкг молекул, подлежащих исследованию, включая несвязанные антитела (CB-Hep.1, анти-HBsAg, Heber Biotec, Гавана) или 10 мкг KDR-Fc (Sigma), в качестве контроля ингибирования. По истечении шести дней животных забивали, гранулы матригеля извлекали, и определяли содержание гемоглобина в каждой методом Драбкина с использованием набора Drabkin's reagent (Sigma) в соответствии с инструкциями фирмы-производителя. Молекулы scFv2-Fc L3H6, scFv2-Fc L3H5 и scFv2-Fc L3H7 значительно ингибируют (р<0,001) васкуляризацию, вызванную VEGF человека в гранулах матригеля, при сопоставлении со снижением содержания гемоглобина. Полученные значения ингибирования в 3 раза выше тех, которые произведены рекомбинантным антителом scFv2-Fc 2H1 8.2, как можно видеть на фигуре 9.
Пример 14. Оценка в условиях in vivo противоопухолевого эффекта рекомбинантных антител scFv2-Fc L3H6, scFv2-Fc L3H5 и scFv2-Fc L3H7 на модели “голых” мышей ксенотрансплантированных опухолевыми клетками A673 рабдомиосаркомы человека.
Ангиогенез, вызванный опухолью и некоторыми клетками стромы опухоли, имеет важное значение для роста опухоли и ее метастазирования. Основным посредником этого проангиогенного эффекта является VEGF, производимый этими клеточными элементами. Поэтому, моделью, используемой для анализа антиангиогенных веществ, является ингибирование роста опухоли у животных. Поскольку новые антитела, описанные в настоящем патенте, распознают преимущественно VEGF человека, модель опухолевого роста у мышей осуществляется введением опухолевых клеток человека изогенным бестимусным мышам (голые мыши; nu/nu). В эксперименте авторы использовали 5 групп из 5 nu/nu бестимусных мышей линии BALB/с (CENPALAB, Гавана), в возрасте 8-10 недель. Основные группы распределили среди рекомбинантных антител scFv2-Fc L3H6, scFv2-Fc L3H5 и scFv2-Fc L3H7, рекомбинантной молекулы scFv2-Fc 2H1-8.2 (WO2008/052489 A1) в качестве стандартной, а мышиные моноклональные антитела анти-HBsAg CB-Hep.1 (Heber Biotec, Гавана) в качестве отрицательного контроля, все в дозе 2,5 мг/кг в PBS, рН 7,2. Мышам подкожно вводили 1,5×107 опухолевых клеток А673 человека (АТСС, CRL 1598) в правую спинную зону. Этот высокой плотности клеточный инокулят вместе с применяемой терапевтической дозой, был использован, чтобы быстро показать отличия в противоопухолевой эффективности разных исследуемых антител. Когда опухоли достигли объемов 200 мм3, мышей распределили случайным образом на 5 групп по 5 животных и начали лечение, как показано для каждой экспериментальной группы. Введения проводились внутрибрюшинно в объеме 200 мкл, каждые 2 дня в течение 3 недель. Отслеживание роста опухолей проводили по измерениям самых высоких (длина) и самых низких (ширина) диаметров опухоли, с использованием электронного циркуля. Объемы опухолей рассчитывали как: объем опухоли (мм3) = 0,52 × длина (мм) × ширина2 (мм). Объемы опухолей на протяжении периода наблюдения сравнивали с помощью однофакторного дисперсионного анализа ANOVA и апостериорного теста Бонферрони. После установленного периода лечения, животных забивали, опухоли удаляли хирургическим путем и проводили гистологический анализ с использованием гематоксилина и эозина.
Как представлено на фигуре 10, все животные, инокулированные scFv2-Fc L3H6, scFv2-Fc L3H5 и scFv2-Fc L3H7, показали почти полный контроль над ростом опухоли по отношению к отрицательному контролю. Фигура также показывает, что новые рекомбинантные антитела, которые являются целью настоящего изобретения, превосходили по результативности относительно рекомбинантного антитела scFv2-Fc 2H1 8.2. Гистологический анализ показал, что опухоли животных, леченных scFv2-Fc L3H6, scFv2-Fc L3H5 и scFv2-Fc L3H7 имели значительное снижение плотности сосудов, уменьшение диаметра кровеносных сосудов, увеличение апоптоза опухолевых клеток, а также сокращение фигур митоза.
Пример 15. Способность фрагмента scFv L3H6, меченного радиоактивным 131I, депонироваться избирательно в области опухоли у “голых” мышей, инокулированных опухолевыми клетками линии А673 рабдомиосаркомы человека.
Для того, чтобы определить способность фрагмента scFv L3H6 депонироваться в области, соответствующей росту опухолевых клеток A673, данный фрагмент, и отрицательный контроль (мышиный анти-HBs В поверхностный антиген scFv; scFv-Hep.1; Ayala, M. et al. 1995. Biotechniques 18:832-842) были помечены 131I (Amersham, Великобритания) с помощью метода йодирования (Fraker PJ, Speck JC Jr. 1978. Biochem Biophys Res Comm 80:849-857) до конечных специфических активностей 1,51 МБк/5 мкг и 1,55 МБк/5 мкг, соответственно.
Меченые продукты анализировали с помощью тонкослойной хроматографии, чтобы обнаружить включения в белок, описывая значения радиоактивности 93 и 95%, соответственно. Способность меченых продуктов обнаруживать их соответствующие антигены (человеческий VEGF и HBsAg) была изучена в системе, где полистироловые иммунопробирки покрывали изоформой 121 рекомбинантного VEGF человека (5 мкг/мл; Peprotech) или рекомбинантного HBsAg (5 мкг/мл; Heber Biotec, Гавана), которые затем блокировали, и вводили в контакт с образцами радиоактивно меченых фрагментов соответствующей специфичности, доводя до количеств, которые могут быть теоретически иммобилизованы на твердой фазе. После инкубаций и промывок авторы определили, что твердая фаза способна связать 87,3% и 84,5% радиоактивности для scFv L3H6 и scFv-Hep.1, соответственно, показывая, что метод радиоактивного мечения значительно не изменил биологической активности фрагментов.
Для исследования биораспределения авторы использовали 30 nu/nu мышей. Животным подкожно ввели 5×106 опухолевых клеток человека культуральной линии А673 в правую спинную зону. Когда опухоли достигли объемов приблизительно 300 мм3, животных распределили случайным образом на 6 групп по 5 животных и начали лечение. Мышам в хвостовую вену вводили радиоактивно меченый продукт (15 с scFv L3H6 и 15 с scFv Hep.1), а затем забивали в группах из пяти, для каждого продукта, после 24, 48 и 72 часов. Опухоль, селезенку, печень, почки, кишечник, мышцы, костный мозг и кровь удаляли хирургическим путем или проводили забор образца. Накопление радиоактивности выражали как процент введенной дозы на грамм ткани. Калибровку проводили с использованием стандартного образца введенной дозы. Радиоактивность измеряли с помощью сцинтилляционного гамма-счетчика.
В таблице 14 показано соотношение радиоактивности опухоль:кровь, вычисленное из измерений, сделанных в этих тканях. Эксперимент показывает, что между 24 и 72 часами, фрагмент scFv L3H6 локализован преимущественно в опухолевой ткани, в отличие от неспецифического фрагмента scFv Hep.1. Никакого специфического накопления радиоактивно меченого scFv L3H6 в других тканях отличных от опухоли, обнаружено не было, по истечении 48 часов после введения.
Соотношение радиоактивности опухоль:кровь у “голых” мышей, трансплантированных клетками A673 опухоли человека, которые экспрессируют VEGF человека
Каждое соотношение рассчитывали из средних значений, полученных по тканям, извлеченным у 5 мышей. Эти результаты показывают, что scFv L3H6 может специфически локализоваться в морфологической области, где существует большая очаговая концентрация VEGF человека. Соотношение радиоактивности опухоль:кровь у “голых” мышей, трансплантированных клетками A673 опухоли человека, которые экспрессируют VEGF человека., и, вследствие этого, является полезным, в особенности, доставлять в эту область различные терапевтические средства, такие как, радиоактивный изотоп или, в конечном итоге, препарат или токсин.
Пример 16. Предупреждение экспериментальной неоваскуляризации хориоидеи (CNV) на модели низших приматов с использованием фрагмента scFv L3H6 и бивалентной молекулы scFv2-Fc L3H6.
В качестве модели экспериментальной неоваскуляризации хориоидеи (CNV) авторы использовали модель, описанную Krzystolik с соавт. (Krzystolik M.G., et al. 2006. Acta Ophthalmol, 120:338-346). Шесть макак (Macaca fascicularis, CENPALAB, Гавана) содержали и обращались с ними в соответствии с Правилами надлежащей лабораторной практики обращения с животными учреждения (Good Laboratory Animal Practice guidance). Животным вводили анестезию при всех процедурах в виде внутримышечных инъекций кетамина гидрохлорид, ацепромазина малеат, и атропина сульфата. Была также использована местная анестезия с пропаракаина гидрохлорид. Анестезия перед вылущиванием и эвтаназией проводилась внутривенно фенобарбиталом натрия. Оболочки CNV были стимулированы в макуле фотокоагуляцией аргоновым лазером, удостоверившись, что процедура вызвала ожоговый пузырь и небольшое кровоизлияние, с точкой приложения от 50 до 100 мкм. Были использованы фотографирование и флуоресцентная ангиография для обнаружения и измерения увеличения и характеристик поражений. Глаза животных проверяли в разные дни, до и после применения фрагмента, плацебо и процедуры фотокоагуляции лазером, а также в конце эксперимента, который заканчивался вылущиванием и умерщвлением животных.
Животные были разделены на две группы по 3 в каждой, в соответствии с молекулами, подлежащими изучению: scFv L3H6 фрагмента антитела или бивалентной молекулой типа иммуноглобулина scFv2-Fc L3H6. В правый глаз каждого животного вводили 300 мкг scFv L3H6 или scFv2-Fc L3H6, в соответствии с группой, в 50 мкл PBS путем интравитреальной инъекции, а левый глаз был инъецирован только носителем. В глаза вводили по 2 инъекции до воздействия лазером (0 и 14 дни). На 21 день, на глаза действовали лазером для стимулирования CNV. Инъекцию повторяли для каждого глаза в день 2-мя - специфическим продуктом или носителем. Через три недели после лазерной стимуляции (42 день), животным вводили интравитреальные инъекции, в этот раз все с фрагментом scFv L3H6 или молекулой scFv2-Fc L3H6, в зависимости от группы, чтобы закончить последней соответствующей инъекцией на 56-й день.
На I стадии лечения (до 42-го дня), исследования показали сокращение проявлений 4-й степени поражений глаз, где были применены scFv L3H6 или scFv2-Fc L3H6, по сравнению с соответствующими контрольными глазами, все из которых означают, что молекулы помогают в предупреждении CNV. На второй стадии лечения, когда во все глаза вводили scFv L3H6 или scFv2-Fc L3H6, авторы обнаружили сокращение поражений 4-й степени, которое указывает на то, что фрагмент и бивалентная молекула также оказывают лечебное действие на сформировавшиеся повреждения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СИСТЕМА ЭКСПРЕССИИ И СЕКРЕЦИИ | 2013 |
|
RU2670491C2 |
| СПОСОБ ЛЕЧЕНИЯ РАН | 2014 |
|
RU2672377C1 |
| ВЫДЕЛЕННОЕ АНТИТЕЛО ЧЕЛОВЕКА ИЛИ ЕГО АНТИГЕН-СВЯЗЫВАЮЩИЙ ФРАГМЕНТ (ВАРИАНТЫ), СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ОПОСРЕДОВАННЫХ hTNFα С ИХ ПОСРЕДСТВОМ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, РЕКОМБИНАНТНОЕ АНТИТЕЛО ЧЕЛОВЕКА ИЛИ ЕГО АНТИГЕН-СВЯЗЫВАЮЩИЙ ФРАГМЕНТ, ВЫДЕЛЕННАЯ НУКЛЕИНОВАЯ КИСЛОТА (ВАРИАНТЫ) | 2005 |
|
RU2458704C9 |
| СПОСОБЫ РАЗРУШЕНИЯ КЛЕТОК С ИСПОЛЬЗОВАНИЕМ ЭФФЕКТОРНЫХ ФУНКЦИЙ АНТИ-EphA4 АНТИТЕЛ | 2007 |
|
RU2429246C2 |
| АНТИТЕЛА ПРОТИВ ПРЕДСТАВИТЕЛЯ А5 СЕМЕЙСТВА 19 СО СХОДСТВОМ ПОСЛЕДОВАТЕЛЬНОСТЕЙ И СПОСОБ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2785436C2 |
| ГУМАНИЗАЦИЯ АНТИТЕЛ КРОЛИКА С ИСПОЛЬЗОВАНИЕМ УНИВЕРСАЛЬНОГО КАРКАСА АНТИТЕЛА | 2018 |
|
RU2696202C1 |
| ГУМАНИЗАЦИЯ АНТИТЕЛ КРОЛИКА С ИСПОЛЬЗОВАНИЕМ УНИВЕРСАЛЬНОГО КАРКАСА АНТИТЕЛА | 2014 |
|
RU2652907C2 |
| ВЫСОКОАФФИННЫЕ АНТИТЕЛА К CD3 И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2020 |
|
RU2831840C2 |
| АНТИТЕЛА ПРОТИВ НЕЙРОПИЛИНА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2571226C2 |
| СПОСОБ ЛЕЧЕНИЯ ИЛИ ПРЕДОТВРАЩЕНИЯ ИНСУЛЬТА | 2015 |
|
RU2744909C2 |






















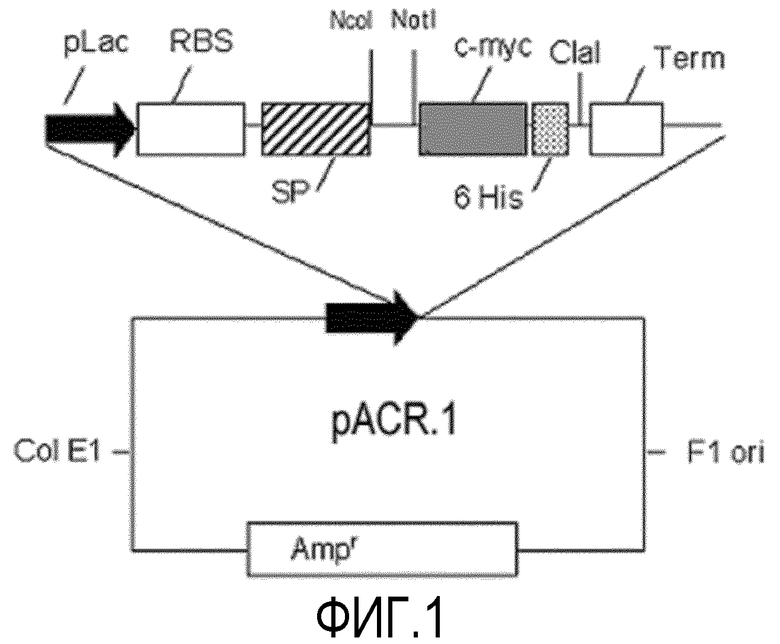

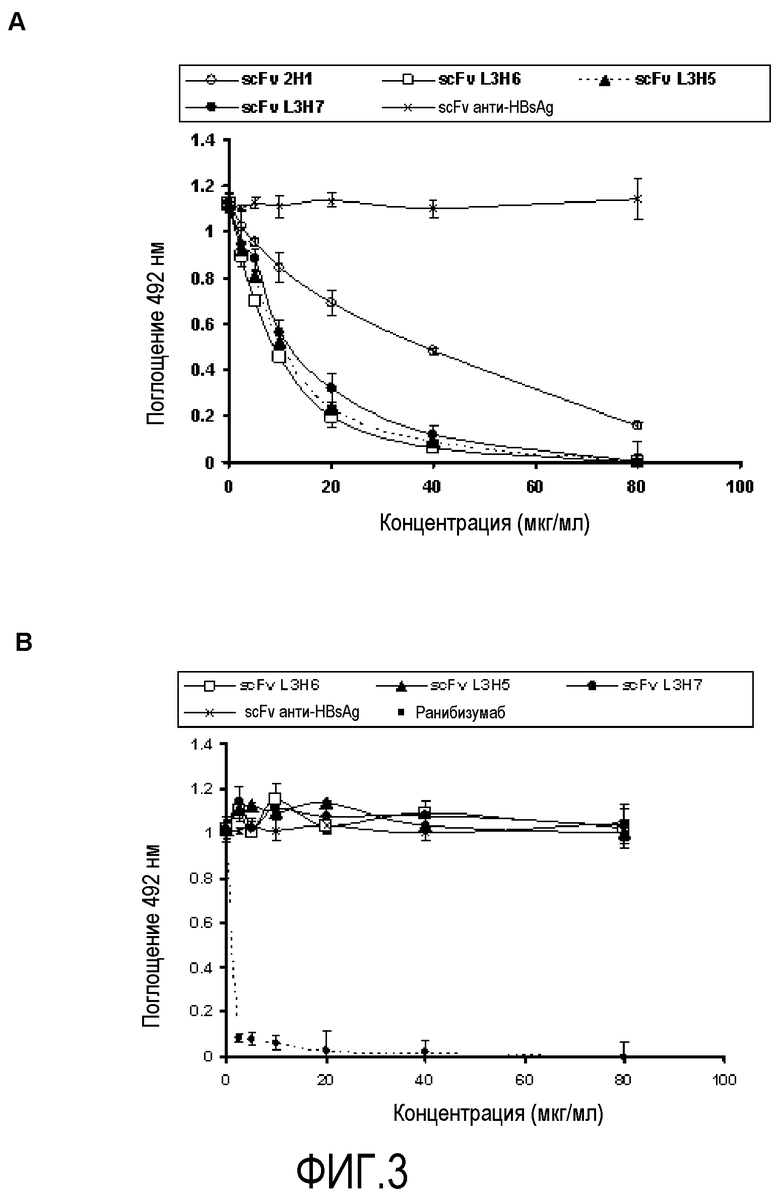
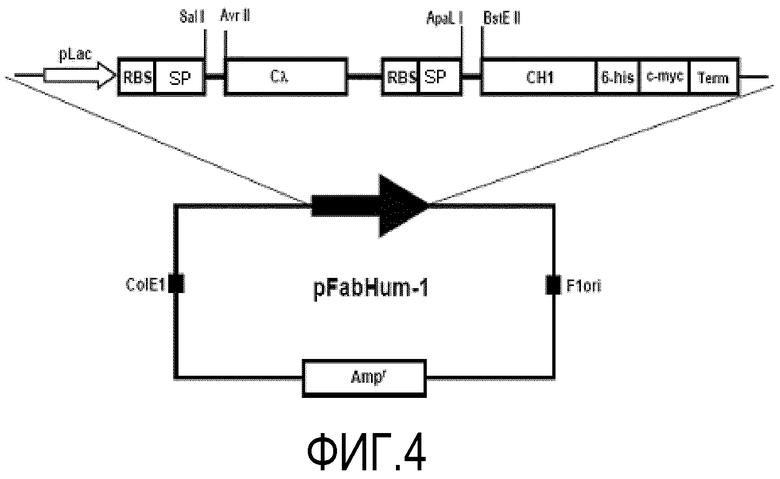
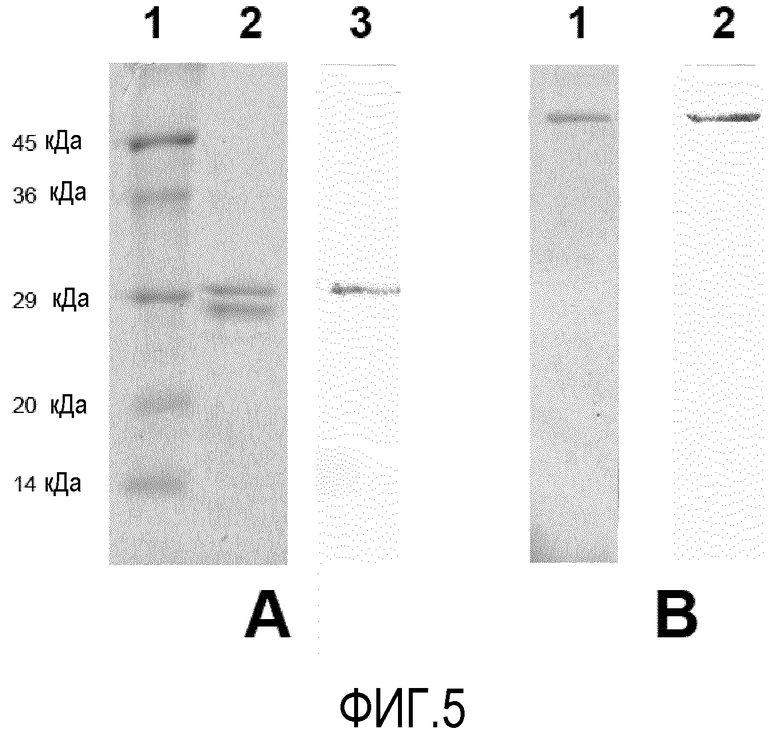
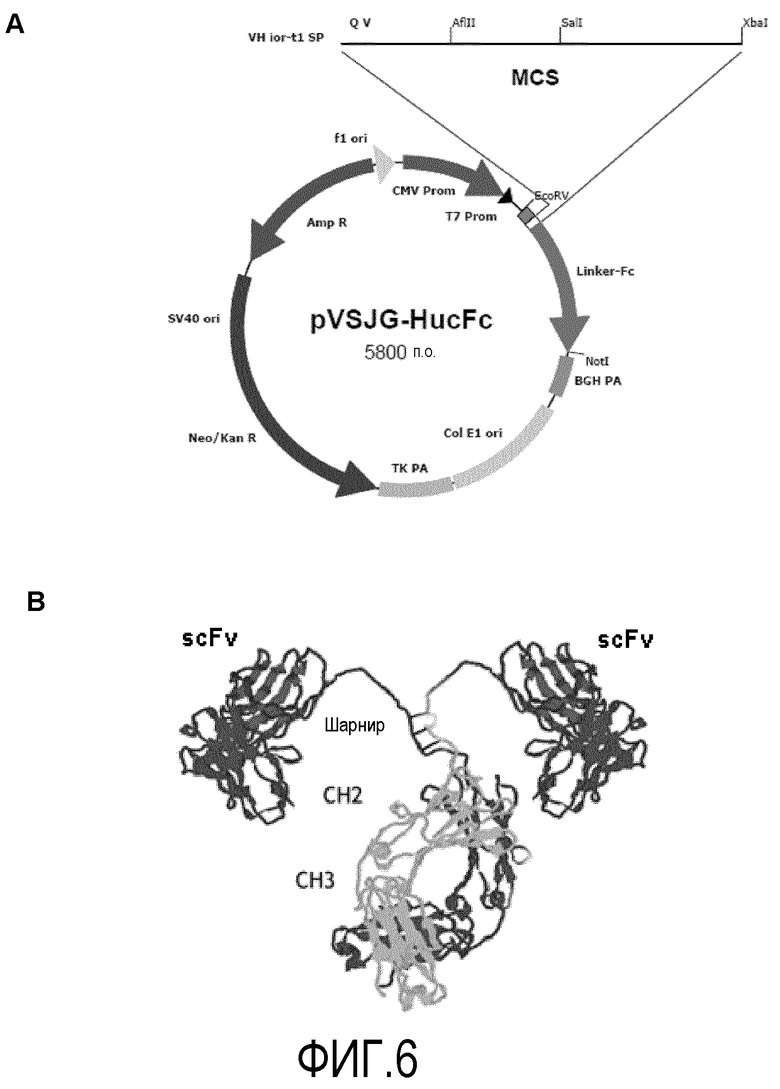
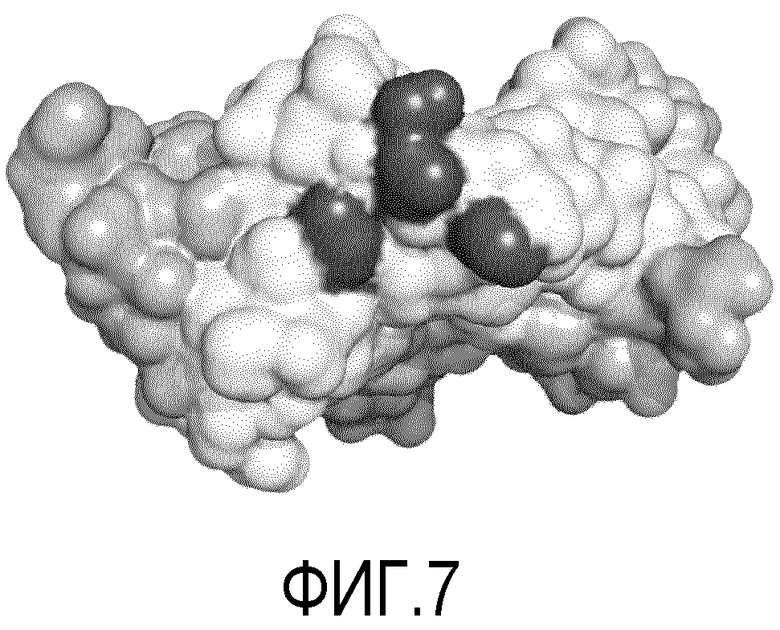

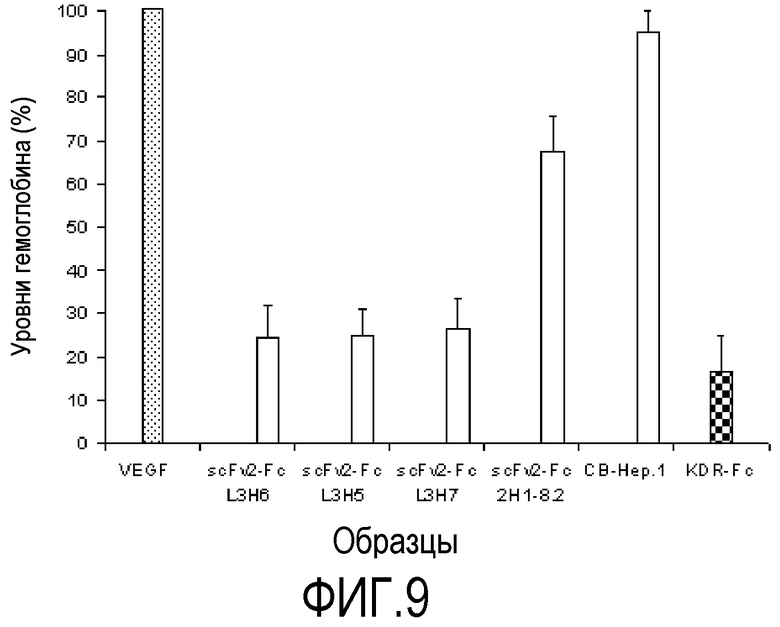
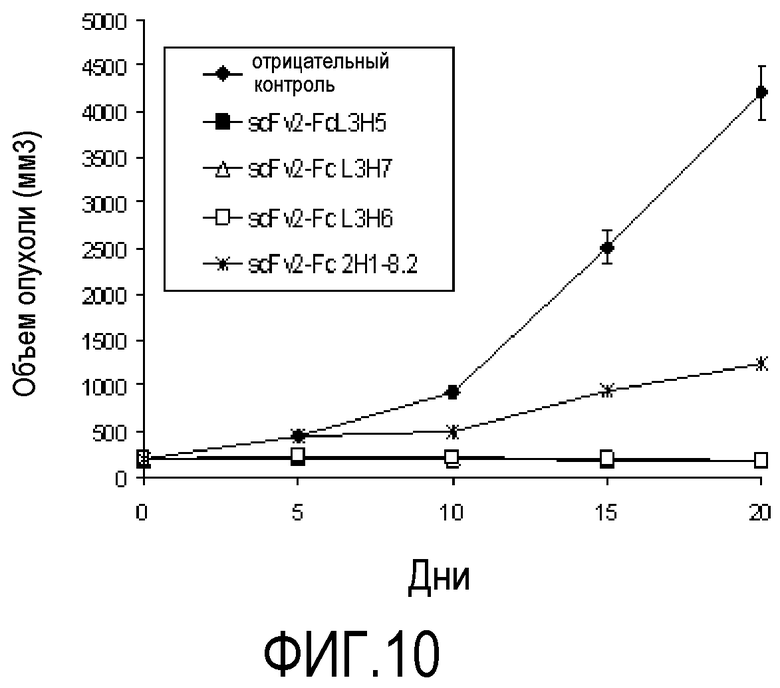
Изобретение относится к биохимии. Описаны рекомбинантные антитела человека, которые распознают фактор роста эндотелия сосудов человека (VEGF-A), блокируют его взаимодействие с рецептором VEGFR2, и препятствуют его пролиферативному эффекту в условиях in vitro и проангиогенному эффекту в условиях in vivo. Антитела были получены путем комбинирования вариабельной области легкой цепи одного иммуноглобулина с другими тремя вариабельными областями тяжелой цепи. Также раскрыты вектор экспрессии и нуклеиновая кислота, кодирующая описанное антитело. Также описана фармацевтическая композиция, содержащая описанное антитело. Поскольку антитела были получены посредством мутагенеза вариабельной области иммуноглобулина человека, то они могут быть применены для иммунотерапии патологических форм, связанных с увеличением сосудистой сети, таких как, возрастная макулодистрофия, злокачественное новообразование и других.6 н. и 14 з.п. ф-лы, 10 ил., 14 табл., 16 пр.
1. Рекомбинантное антитело или его функциональный эквивалентный вариант, которые специфически распознают фактор роста эндотелия сосудов А человека (сокращенно VEGF-A), которые содержат:
i) вариабельную область тяжелой цепи, кодируемые нуклеотидной последовательностью, выбранной из группы, состоящей из последовательностей SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3, и вариабельную область легкой цепи, кодируемую нуклеотидной последовательностью SEQ ID NO: 7 или
ii) вариабельную область тяжелой цепи, выбранную из группы, состоящей из аминокислотных последовательностей SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6, и вариабельную область легкой цепи с аминокислотной последовательностью SEQ ID NO: 8.
2. Рекомбинантное антитело по п. 1, которое распознает функциональный эпитоп фактора роста эндотелия сосудов человека (VEGF-A), в котором аминокислотные остатки K101, E103, R105 и Y25 являются основными для взаимодействия антитело-антиген.
3. Рекомбинантное антитело по п. 1 или 2, которое препятствует в условиях in vitro стимулирующим эффектам, а в условиях in vivo проангиогенным эффектам различных изоформ VEGF-А человека.
4. Рекомбинантное антитело по любому из пп. 1-3, которое представляет собой одноцепочечный Fv (scFv) фрагмент антитела.
5. Рекомбинантное антитело по п. 4, которое:
i) кодируется нуклеотидной последовательностью, выбранной из группы нуклеотидных последовательностей, состоящей из SEQ ID NO: 9, SEQ ID NO: 11 и SEQ ID NO: 13, или
ii) имеющее аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 10, SEQ ID NO: 12 и SEQ ID NO: 14.
6. Рекомбинантное антитело по любому из пп. 1-3, которое представляет собой фрагмент Fab антитела.
7. Рекомбинантное антитело по п. 6, которое:
i) кодируется парами нуклеотидных последовательностей, выбранных из группы, состоящей из SEQ ID NO: 15 и SEQ ID NO: 16, SEQ ID NO: 19 и SEQ ID NO: 20, SEQ ID NO: 23 и SEQ ID NO: 24, для их двух цепей, или
ii) состоит из пары аминокислотных последовательностей, выбранных из группы, состоящей из SEQ ID NO: 17 и SEQ ID NO: 18, SEQ ID NO: 21 и SEQ ID NO: 22, SEQ ID NO: 25 и SEQ ID NO: 26, для их двух цепей.
8. Рекомбинантное антитело по любому из пп. 1-3 типа scFv2-Fc, где фрагмент scFv присоединяется спейсером к шарнирной области, константным доменам СН2 и СН3 иммуноглобулина человека, которые в своей белковой форме ковалентно связываются с другой идентичной полипептидной цепью с образованием димерной молекулы.
9. Рекомбинантное антитело по п. 8, которое:
i) кодируется нуклеотидной последовательностью, выбранной из группы, состоящей из нуклеотидных последовательностей SEQ ID NO: 27, SEQ ID NO: 29 и SEQ ID NO: 31; или
ii) имеющее аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 28, SEQ ID NO: 30 и SEQ ID NO: 32.
10. Рекомбинантное антитело по п. 8, в котором Fc константных доменов иммуноглобулинов человека состоят из типов IgG1, IgG2, IgG3 или IgG4.
11. Рекомбинантное антитело по любому из пп. 1-3, в котором нуклеотидные последовательности SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 3, кодирующие вариабельную область тяжелой цепи, и SEQ ID NO: 7, кодирующая вариабельную область легкой цепи, содержат последовательность, которая кодирует две полипептидные цепи, одну как вариабельную область тяжелой цепи, следующую за константными доменами СН1, шарниром, СН2 и СН3 иммуноглобулина человека IgG1, а вторую как вариабельную область легкой цепи, следующую за константными доменами человека С kappa или С lambda.
12. Рекомбинантное антитело по п. 11, в котором константные домены иммуноглобулина человека состоят из типов IgG2, IgG3 или IgG4.
13. Рекомбинантное антитело по любому из пп. 1-12, которое дополнительно конъюгировано с радиоактивным изотопом, химическим веществом или биологическим веществом.
14. Рекомбинантное антитело по любому из пп. 1-12, которое продуцируется в рекомбинантных бактериях или в клетках млекопитающих.
15. Вектор экспрессии, содержащий последовательности нуклеиновой кислоты, которые кодируют рекомбинантное антитело по любому из пп. 1-12.
16. Нуклеиновая кислота, содержащая последовательности, которая кодирует рекомбинантное антитело по любому из пп. 1-12.
17. Фармацевтическая композиция для иммунотерапии патологических образований, связанных с увеличением сосудистой сети, которая содержит эффективное количество рекомбинантного антитела по пп. 1-12 и принятый фармацевтический эксципиент, буфер, стабилизатор или носитель.
18. Фармацевтическая композиция по п. 17, отличающаяся тем, что позволяет контролировать высвобождение.
19. Применение рекомбинантного антитела по пп. 1-12 для получения лекарственного средства для иммунотерапии образований, при которых развивается ангиогенез, таких как злокачественные опухоли и их метастазы, острые и хронические воспалительные процессы, аутоиммунные процессы, заболевания глаз при возрастной макулодистрофии.
20. Применение рекомбинантного антитела по пп. 1-12 для получения радиофармацевтических препаратов для диагностирования злокачественных опухолей и их метастазов в условиях in vivo с помощью методов визуализации.
| ДВУХСТУПЕНЧАТЫЙ ПЛЕНОЧНЫЙ ИСПАРИТЕЛЬ | 1992 |
|
RU2093236C1 |
| Способ работы регенераторного устройства в паросиловых установках | 1926 |
|
SU12622A1 |
Авторы
Даты
2015-07-20—Публикация
2011-12-26—Подача