Родственные заявки
По настоящей заявке испрашивается приоритет предварительной патентной заявки США с серийным № 61/208487, поданной 24 февраля 2009 года, заявка, таким образом, включена в настоящий документ в качестве ссылки в полном объеме.
Список последовательностей
Настоящая заявка содержит список последовательностей, который предоставлен посредством EFS-Web и, таким образом, включен в качестве ссылки в полном объеме. Указанная ASCII-копия создана 18 февраля 2010 года, названа ALXN146WO1.txt, и ее размер составляет 18946 байт.
Область техники
Настоящее изобретение относится к медицине, иммунологии, молекулярной биологии и химии белков.
Предшествующий уровень техники
Тромбоцитопения связана с рядом заболеваний и характеризуется патологически низким количеством тромбоцитов в крови, часто вследствие недостаточного образования тромбоцитов, секвестрации тромбоцитов, образования дефектных тромбоцитов или повышенного разрушения тромбоцитов. Симптомы тромбоцитопении включают, например, беспокойство, гематомы (например, пурпуру) и кровотечение (например, из носа или десен). Одним из примеров связанного с тромбоцитопенией заболевания является тромботическая тромбоцитопеническая пурпура (TTP), которая представляет собой нарушение, характеризуемое диссеминированным формированием микроскопических сгустков крови (тромбов) в малых кровеносных сосудах по всему организму. Если заболевание оставить без лечения, то состояние пациента может быстро ухудшаться и приобретать тяжелые неврологические нарушения (например, ступор или кома), почечную недостаточность, инсульт и остановку сердца. Уровень смертности TTP, оставленной без лечения, составляет более 90%.
Связанные с тромбоцитопенией заболевания также могут быть результатом воздействия радиации (например, радиотерапевтические схемы лечения), злокачественных опухолей, введения определенных соединений (например, цитотоксических лекарственных средств) и иммунного ответа на определенные вакцины.
Тромбопоэтин (TPO) представляет собой гликозилированный фактор роста, стимулирующий образование и дифференцировку мегакариоцитов, клеток костного мозга, которые дают начало большому количеству тромбоцитов. (см., например, Kaushansky (2006) N. Engl. J. Med. 354(19):2034-45). TPO связывается с рецептором c-Mpl, экспрессируемым на клетках-предшественниках мегакариоцитов со стимуляцией, таким образом, пролиферации и дифференцировки клеток в тромбоциты. Парадоксально, что лечение пациентов рекомбинантным TPO человека приводит к образованию нейтрализующих антител против TPO, которые связываются с природным TPO пациента и препятствуют его активности (см., например, Kuter and Begley (2002) Blood 100:3457-3469; Li et al. (2001) Blood 98:3241-3248; и Vadhan-Raj et al. (2000) Ann. Intern. Med. 132:364-368). Таким образом, существует необходимость в новых и улучшенных способах лечения пациентов с заболеваниями, связанными с тромбоцитопенией.
Сущность
Изобретение относится к терапевтически активным рекомбинантным антителам, содержащим терапевтические пептиды (далее в настоящем документе эти антитела обозначены как "терапевтические антитела"). В определенных вариантах осуществления антитела содержат пептиды-миметики тромбопоэтина (TPO) (далее в настоящем документе эти антитела обозначают как "антитела с миметиками TPO") в соответствии с описанием. Изобретение также относится к терапевтически активным фрагментам терапевтических антител (например, терапевтически активным фрагментам антител с миметиками TPO). Терапевтические антитела и их фрагменты можно использовать, например, в ряде диагностических и/или терапевтическим применений. Например, как описано в демонстрационных примерах, антитела с миметиками TPO и/или их фрагменты можно использовать для лечения индивидуума с необходимостью увеличенной продукции тромбоцитов, например, индивидуума, подвергаемого воздействию радиации (например, пациента со злокачественной опухолью, проходящего лучевую терапию) или других средств, которые обедняют костный мозг, снижают продукцию тромбоцитов и/или увеличивают разрушение тромбоцитов. Антитела и/или фрагменты с миметиками TPO также можно использовать для лечения индивидуума с нарушением, связанным с недостаточными уровнями тромбоцитов (с тромбоцитопенией), таким как любое из этих нарушений, описываемых в настоящем документе или известных в данной области.
Терапевтические антитела и их терапевтически активные фрагменты, описываемые в настоящем документе, обладают рядом преимуществ по сравнению с соответствующими выделенными терапевтическими пептидами. Во-первых, антитела обладают повышенным временем полужизни в сыворотке. Во-вторых, конформацию активного участка терапевтического пептида в поддерживающей структуре антитела можно стабилизировать, делая его более активным и специфичным в отношении его связывания с мишенью по сравнению с отдельными терапевтическими пептидами. Кроме того, антитела и фрагменты с миметиками TPO, описываемые в настоящем документе имеют рад дополнительных преимуществ по сравнению с их аналогами в виде отдельных природных пептидов TPO. Например, при введении млекопитающему (например, человеку) антитела с миметиками TPO или их терапевтически активные фрагменты по существу снижают вероятность получения вредного иммунного ответа на природный TPO. Это отличается от лечения с использованием рекомбинантных форм природного белка TPO, что часто приводит к образованию у пациентов нейтрализующих TPO антител, где эти антитела препятствуют активности природного TPO пациента. См., например, Kuter and Begley (2002) Blood 100:3457-3469; Li et al. (2001) Blood 98:3241-3248; и Vadhan-Raj et al. (2000) Ann. Intern. Med. 132:364-368. Еще одним преимуществом антител с миметиками TPO (и терапевтически активных фрагментов), описываемых в настоящем документе, является то, что однократная доза антител с миметиками TPO является такой же эффективной или более эффективной для увеличения уровней тромбоцитов у индивидуума, как схема лечения с несколькими дозами.
Многие из преимуществ терапевтических антител, описываемых в настоящем документе, являются следствием уникальному положению(ям) терапевтических пептидов в поддерживающей структуре антитела. Как подробно описано в настоящем документе и проиллюстрировано в демонстрационных примерах, авторы изобретения разработали терапевтические антитела, содержащие терапевтический пептид, который встроен в уникальное положение в константной области полипептида легкой цепи, и/или терапевтический пептид, который встроен в уникальное положение в константной области полипептида тяжелой цепи. Например, авторы изобретения определили, что терапевтический пептид, встроенный в шарнирную область полипептида тяжелой цепи или рядом с ней приводит к терапевтическому антителу, обладающему многими из преимуществ, описываемых в настоящем документе. Подобным образом, посредством встраивания терапевтического пептида в положение в константной области легкой цепи, которая структурно допускает обеспечение представления терапевтического пептида в центральной щели антитела (например, области β-изгиба константной области полипептида легкой цепи или на C-конце константной области легкой цепи), получают терапевтическое антитело, обладающее многими из преимуществ, описываемых в настоящем документе. Как используют в настоящем документе, "центральная щель" антитела относится к области целого антитела, где сходятся два "плеча" антитела. А именно, все полноразмерные молекулы иммуноглобулинов (Ig) состоят из четырех белковых цепей (два полипептида тяжелых цепей и два полипептида легких цепей), принимающие трехмерную структуру, имеющую вид заглавной буквы "Y", которые связаны вместе дисульфидными связями. "Плечи" структуры "Y" содержат вариабельные области антитела, а область центральной щели расположена в точке соединения двух плеч структуры "Y".
Таким образом, в одном из аспектов изобретение относится к терапевтическому антителу или терапевтически активному фрагменту антитела, где антитело или фрагмент содержат по меньшей мере два терапевтических пептида и где по меньшей мере один из терапевтических пептидов встроен в константную область полипептида легкой цепи в положении, которое структурно допускает обеспечение представления терапевтического пептида в центральной щели антитела. Терапевтическое антитело или его фрагмент также могут содержать полипептид тяжелой цепи, содержащий по меньшей мере один из терапевтических пептидов. По меньшей мере один терапевтический пептид встроен в шарнирную область следующим образом: (a) в шарнирную область полипептида тяжелой цепи; (b) в участке соединения N-конца шарнирной области и области полипептида тяжелой цепи, расположенной выше шарнирной области; (c) в участке соединения C-конца шарнирной области и области полипептида тяжелой цепи, расположенного ниже шарнирной области; или (d) в положении, начиная в пределах менее 20 аминокислот выше N-конца или менее 20 аминокислот ниже C-конца шарнирной области полипептида тяжелой цепи.
В другом аспекте изобретение относится к терапевтическому антителу или терапевтически активному фрагменту антитела, где антитело или фрагмент содержат по меньшей мере два терапевтических пептида и где полипептид тяжелой цепи антитела содержит по меньшей мере один из терапевтических пептидов, встроенный в тяжелую цепь следующим образом: (a) в шарнирную область полипептида тяжелой цепи; (b) в участке соединения N-конца шарнирной области и области полипептида тяжелой цепи выше шарнирной области; (c) в участке соединения C-конца шарнирной области и области полипептида тяжелой цепи ниже шарнирной области или (d) в положении, начиная в пределах менее 20 аминокислот выше N-конца или менее 20 аминокислот ниже C-конца шарнирной области полипептида тяжелой цепи. Терапевтическое антитело или его терапевтически активный фрагмент также могут содержать полипептид легкой цепи, в котором константная область полипептида легкой цепи содержит по меньшей мере один из терапевтических пептидов. Терапевтический пептид (например, пептид-миметик TPO) встроен в константную область полипептида легкой цепи в положении, которое структурно допускает обеспечение представления терапевтического пептида в центральной щели антитела.
В определенных вариантах осуществления любого из терапевтических антител или их фрагментов, описываемых в настоящем документе, терапевтический пептид можно встраивать в качестве вставки и/или замены в области β-изгиба константной области полипептида легкой цепи. В определенных вариантах осуществления любого из терапевтических антител или их фрагментов, описываемых в настоящем документе, терапевтический пептид можно встраивать в виде добавления на C-конце полипептида легкой цепи. В определенных вариантах осуществления терапевтический пептид можно встраивать в качестве вставки и/или замены области константной области полипептида легкой цепи ниже последней структуры β-слоя в полипептиде.
В определенных вариантах осуществления любого из терапевтических антител или их терапевтически активных фрагментов терапевтическим пептидом заменена вся шарнирная область тяжелой цепи.
В определенных вариантах осуществления любого из терапевтических антител или их терапевтически активных фрагментов C-конец полипептида легкой цепи содержит по меньшей мере один из терапевтических пептидов и полипептид тяжелой цепи содержит по меньшей мере один из терапевтических пептидов.
В определенных вариантах осуществления любого из терапевтических антител или их терапевтически активных фрагментов антитело или фрагмент содержат по меньшей мере три (например, по меньшей мере четыре, пять, шесть, семь, восемь, девять, 10, 11, 12 или 15 или более) терапевтических пептида.
В определенных вариантах осуществления любого из терапевтических антител или их терапевтически активных фрагментов по меньшей мере два терапевтических пептида являются идентичными. В определенных вариантах осуществления по меньшей мере два терапевтических пептида отличаются друг от друга. Например, по меньшей мере два различных терапевтических пептида могут иметь различные аминокислотные последовательности, но тот же тип терапевтической активности (например, два миметика TPO с различными аминокислотными последовательностями) или по меньшей мере два различных терапевтических пептида могут иметь различные аминокислотные последовательности и различную терапевтическую активность (например, миметик TPO и миметик EPO). В определенных вариантах осуществления любого из терапевтических антител или их терапевтически активных фрагментов все терапевтические пептиды идентичны. В определенных вариантах осуществления все терапевтические пептиды отличаются друг от друга (например, в одном или обоих из различных аминокислотных последовательностей и различной терапевтической активности).
В определенных вариантах осуществления любого из терапевтических антител или их терапевтически активных фрагментов по меньшей мере один антиген-связывающий участок терапевтического антитела или его терапевтически активного фрагмента сохраняет способность связываться с антигеном. В определенных вариантах осуществления по меньшей мере два антиген-связывающих участка терапевтического антитела или его терапевтически активного фрагмента сохраняют способность связываться с антигеном.
В определенных вариантах осуществления любые терапевтические антитела или их терапевтически активные фрагменты могут включать спейсерную аминокислотную последовательность, расположенную с N-конца по меньшей мере от одного терапевтического пептида, и/или спейсерную аминокислотную последовательность, расположенную с C-конца по меньшей мере от одного терапевтического пептида. В определенных вариантах осуществления спейсерная аминокислотная последовательность может присутствовать и с N-конца и с C-конца от терапевтического пептида. Два спейсера могут иметь одинаковую аминокислотную последовательность или различные аминокислотные последовательности.
В определенных вариантах осуществления любого из терапевтических антител или их терапевтически активных фрагментов по меньшей мере один терапевтический пептид представляет собой антагонистический пептид. В определенных вариантах осуществления любого из терапевтических антител или их терапевтически активных фрагментов по меньшей мере один терапевтический пептид представляет собой агонистический пептид. В определенных вариантах осуществления любого из терапевтических антител или их терапевтически активных фрагментов по меньшей мере один терапевтический пептид представляет собой пептидомиметик (например, миметик TPO или миметик EPO). В определенных вариантах осуществления любого из терапевтических антител или их терапевтически активных фрагментов все терапевтические пептиды представляют собой миметик TPO (например, миметик TPO, содержащий аминокислотную последовательность, представленную в SEQ ID NO:1 или SEQ ID NO:2 или состоящий из нее).
В определенных вариантах осуществления любого из терапевтических антител или их терапевтически активных фрагментов терапевтическое антитело может содержать полипептид легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:10, и/или полипептид тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:12. В определенных вариантах осуществления любого из терапевтических антител или их терапевтически активных фрагментов антитело содержит полипептид легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:10, и полипептид тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:12, или состоит из них. В определенных вариантах осуществления любого из терапевтических антител или их терапевтически активных фрагментов антитело состоит из полипептидов легких цепей, содержащих аминокислотную последовательность SEQ ID NO:10, и полипептидов тяжелых цепей, содержащих аминокислотную последовательность SEQ ID NO:12.
В определенных вариантах осуществления любого из терапевтических антител или их терапевтически активных фрагментов антитело может представлять собой моноклональное антитело, гуманизированное антитело, химеризованное антитело, химерное антитело, деиммунизированное антитело человека, полностью человеческое антитело или F(ab')2-фрагмент.
В определенных вариантах осуществления любого из терапевтических антител или их терапевтически активных фрагментов терапевтически активный фрагмент можно выбирать из группы, состоящей из Fd-фрагмента, Fab-фрагмента и Fab'-фрагмента, где терапевтически активный фрагмент содержит по меньшей мере два терапевтических пептида и по меньшей мере часть шарнирной области полипептида тяжелой цепи или по меньшей мере часть C-конца полипептида легкой цепи.
В определенных вариантах осуществления любого из терапевтических антител или их терапевтически активных фрагментов антитело или терапевтически активный фрагмент содержат гетерологичную молекулу.
В определенных вариантах осуществления любые терапевтически активные фрагменты, описываемые в настоящем документе, содержат по меньшей мере часть или всю вариабельную область полипептида легкой цепи и/или полипептида тяжелой цепи антитела. Часть вариабельной области содержит по меньшей мере две (например, по меньшей мере три, четыре, пять, шесть, семь, восемь, девять, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31. 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100 или более 100) аминокислоты полипептида легкой цепи и/или полипептида тяжелой цепи. По меньшей мере часть вариабельной области может содержать одну или несколько CDR полипептида легкой цепи (LC) или полипептида тяжелой цепи (HC) (например, LC-CDR1, LC-CDR2, LC-CDR3, HC-CDR1, HC-CDR2 или HC-CDR3), каркасных областей (FR) полипептида легкой цепи (LC) или полипептида тяжелой цепи (HC) (например, LC-FR1, LC-FR2, LC-FR3, LC-FR4, HC-FR1, HC-FR2, HC-FR3 или HC-FR4) или любую комбинацию любого из указанного выше. В определенных вариантах осуществления терапевтически активный фрагмент не представляет собой Fc-фрагмент антитела.
В другом аспекте изобретение относится к композиции любого из терапевтических антител или их терапевтически активных фрагментов и фармацевтически приемлемого носителя. Например, в определенных вариантах осуществления композиции могут содержать любые антитела с миметиками TPO, описываемые в настоящем документе.
В определенных вариантах осуществления любые из композиций, описываемые в настоящем документе, можно формулировать для применения в виде однократной дозы. В определенных вариантах осуществления любые из композиций, описываемые в настоящем документе, можно формулировать для применения в виде многократных доз.
В определенных вариантах осуществления любые из композиций, описываемые в настоящем документе, также могут содержать по меньшей мере одно активное средство для снижения побочных эффектов воздействия радиации или для снижения побочных эффектов химиотерапии. По меньшей мере одно активное средство можно выбрать из группы, состоящей из антибиотика, анестетика, противорвотного средства, стероида, хелатирующего средства и диуретика.
В определенных вариантах осуществления любые из композиций, описываемые в настоящем документе, также могут содержать по меньшей мере одно дополнительное активное средство для повышения продукции тромбоцитов у индивидуума. По меньшей мере одно дополнительное активное средство может представлять собой, например, элтромбопаг, опрелвекин, ромиплостим, пэгфилграстим, стимулирующее эритропоэтин средство (ESA) или любое другое подходящее средство, описываемое в настоящем документе или известное в данной области.
В еще одном аспекте изобретение относится к способу повышения продукции тромбоцитов у индивидуума. Способ включает стадию введения индивидууму, при необходимости, терапевтически эффективного количества композиции, содержащей любое из антител с миметиками TPO или их терапевтически активных фрагментов, описываемых в настоящем документе.
В другом аспекте изобретение относится к способу повышения продукции тромбоцитов у индивидуума, где способ включает введение индивидууму, при необходимости, композиции, содержащей терапевтически эффективное количество любого из антител с миметиками TPO или их терапевтически активных фрагментов, описываемых в настоящем документе.
В определенных вариантах осуществления любого из способов, описываемых в настоящем документе, индивидуум представляет собой млекопитающего, например, человека или не являющегося человеком примата. В определенных вариантах осуществления любого из способов, описываемого в настоящем документе, индивидуум представляет собой не являющееся человеком млекопитающее.
В определенных вариантах осуществления любого из способов, описываемых в настоящем документе, у индивидуума присутствует нарушение, связанное с недостаточным количеством тромбоцитов. Например, нарушение может представлять собой любое из синдром Бернара-Сулье, идиопатическую тромбоцитопеническую пурпуру, синдром Вискотта-Олдрича, спленомегалию, тромботические микроангиопатии, диссеминированное внутрисосудистое свертывание, индуцированную гепарином тромбоцитопению (HIT), болезнь фон Виллебранда, вариант болезни фон Виллебранда, тромбоцитопению в результате инфекции ВИЧ, тромбоцитопению в результате острого заболевания печени или тромбастению Гланцманна. В определенных вариантах осуществления нарушение может быть результатом лечения индивидуума от вирусной инфекции, злокачественной опухоли или воспалительного нарушения. Например, нарушение может представлять собой результат терапии цитотоксическим лекарственным средством (например, индуцированная лекарственным средством тромбоцитарная недостаточность). В определенных вариантах осуществления нарушение может быть результатом применения для индивидуума радиотерапевтической схемы лечения.
В определенных вариантах осуществления любого из способов, описываемых в настоящем документе, у индивидуума может присутствовать злокачественная опухоль, в качестве неограничивающих примеров, такая как, рак легких, рак молочной железы, рак толстого кишечника, рак поджелудочной железы, злокачественная опухоль почки, рак желудка, рак печени, злокачественная опухоль кости, гематологическая злокачественная опухоль, злокачественная опухоль нервной ткани, меланома, рак щитовидной железы, рак яичников, рак яичка, рак предстательной железы, рак шейки матки, рак влагалища или рак мочевого пузыря.
В определенных вариантах осуществления любого из способов, описываемых в настоящем документе, тромбоцитарная недостаточность индуцирована химиотерапевтическим лекарственным средством.
В определенных вариантах осуществления любого из способов, описываемых в настоящем документе, для индивидуума применяли или применяют химиотерапевтическую схему лечения или радиотерапевтическую схему лечения. Химиотерапевтическая схема лечения может включать введение индивидууму одного или нескольких цитотоксических средств, выбранных из группы, состоящей из циклофосфамида, таксола, метотрексата, азотистого иприта, азатиоприна, хлорамбуцила, фторурацила, цисплатина, нокодазола, гидроксимочевины, винкристина, винбластина, этопозида, доксорубицина, блеомицина, карбоплатина, гемцитабина, паклитаксела, топотекана и тиогуанина. Радиотерапевтическая схема лечения может включать облучение рентгеновскими или гамма-лучами. Радиотерапевтическая схема лечения может включать введение индивидууму радиоактивного средства. В определенных вариантах осуществления композицию можно вводить индивидууму до применения химиотерапевтической схемы лечения или радиотерапевтической схемы лечения. В определенных вариантах осуществления композиция можно вводить индивидууму в течение или после химиотерапевтической схемы лечения или радиотерапевтической схемы лечения.
В определенных вариантах осуществления любого из способов, описываемых в настоящем документе, композицию можно вводить индивидууму внутривенно, подкожно, внутрибрюшинно или внутримышечно. В определенных вариантах осуществления любого из способов, описываемых в настоящем документе, композицию вводят индивидууму в виде однократной дозы или в виде более одной (например, двух, трех, четырех, пяти, шести, семи, восьми, девяти, 10 или 15 или более) дозы композиции.
В определенных вариантах осуществления любого из способов, описываемых в настоящем документе, композицию можно вводить индивидууму: (i) до и (ii) в течение или после применения химиотерапевтической или радиотерапевтической схемы лечения.
В определенных вариантах осуществления любого из способов, описываемых в настоящем документе, химиотерапевтическая или радиотерапевтическая схема лечения может быть (i) более мощной или (ii) ее можно проводить у индивидуума более часто, чем можно было бы безопасно осуществлять в отсутствии введения композиции.
В определенных вариантах осуществления любой из способов, описываемых в настоящем документе, также может включать введение индивидууму по меньшей мере одного дополнительного средства для снижения побочных эффектов химиотерапевтической схемы лечения или радиотерапевтической схемы лечения. По меньшей мере одно средство можно выбирать из группы, состоящей из антибиотика, анестетика, противорвотного средства и стероида, такого как андростендиол. В определенных вариантах осуществления любой из способов, описываемых в настоящем документе, также может включать введение индивидууму по меньшей мере одного дополнительного средства для повышения продукции тромбоцитов. По меньшей мере одно дополнительное средство для повышения продукции тромбоцитов может представлять собой средство, выбранное из группы, состоящей из элтромбопаг, опрелвекин, ромиплостим, пэгфилграстим и ESA.
В определенных вариантах осуществления любой из способов, описываемых в настоящем документе, также может включать мониторинг повышения уровня тромбоцитов у субъекта после введения композиции.
В еще одном аспекте изобретение относится к способу повышения продукции тромбоцитов у индивидуума, где способ включает введение индивидууму, при необходимости, однократной дозы увеличивающего продукцию тромбоцитов количества антитела с миметиком TPO или его терапевтически активного фрагмента, описываемых в настоящем документе. Изобретение также относится к способу лечения индивидуума от воздействия радиации или снижающей уровень тромбоцитов химиотерапевтической схемы лечения. Способ включает введение индивидууму однократной дозы увеличивающего продукцию тромбоцитов количества антитела с миметиком TPO или его терапевтически активного фрагмента, описываемых в настоящем документе. Индивидуум может представлять собой индивидуума, для которого используют, возможно будут использовать или у которого запланировано использовать химиотерапевтическую или радиотерапевтическую схему лечения. Индивидуум может представлять собой индивидуума, которого подвергают, возможно будут подвергать или которого запланировано подвергать воздействию радиации.
В еще одном аспекте изобретение относится к способу повышения продукции тромбоцитов у индивидуума, где способ включает введение индивидууму, при необходимости, нескольких (например, по меньшей мере две, три, четыре, пять, шесть, семь, восемь, девять, 10, 11 или 12 или более) доз увеличивающего продукцию тромбоцитов количества антитела с миметиком TPO или его терапевтически активного фрагмента, описываемых в настоящем документе. Изобретение также относится к способу лечения индивидуума от воздействия радиации или снижающей уровень тромбоцитов химиотерапевтической схемы лечения. Способ включает введение индивидууму нескольких доз увеличивающего продукцию тромбоцитов количества антитела с миметиком TPO или его терапевтически активного фрагмента, описываемых в настоящем документе. Индивидуум может представлять собой индивидуума, для которого используют, возможно будут использовать или у которого запланировано использовать химиотерапевтическую или радиотерапевтическую схему лечения. Индивидуум может представлять собой индивидуума, которого подвергают, возможно будут подвергать или которого запланировано подвергать воздействию радиации.
В другом аспекте изобретение относится к нуклеиновой кислоте, кодирующей полипептид, содержащий по меньшей мере один (например, по меньшей мере два, три, четыре, пять, шесть, или восемь) пептид(ы)-миметик TPO, где аминокислотная последовательность полипептида по меньшей мере на 80 (например, по меньшей мере на 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100) % идентична аминокислотной последовательности, представленной в SEQ ID NO:10 или SEQ ID NO:12. В определенных вариантах осуществления нуклеиновая кислота кодирует полипептид с аминокислотной последовательностью, которая по меньшей мере на 80% идентична аминокислотам 1-214 SEQ ID NO:10 или по меньшей мере на 80% идентична аминокислотам 1-218 SEQ ID NO:10, где аминокислоты 219-232 SEQ ID NO:10 у аминокислотной последовательности и SEQ ID NO:10 идентичны на 100%. В определенных вариантах осуществления нуклеиновая кислота кодирует полипептид с аминокислотной последовательностью, которая по меньшей мере на 80% идентична аминокислотам 1-234 SEQ ID NO:12 и по меньшей мере на 80% идентична с аминокислотами 249-461 SEQ ID NO:12, где аминокислоты 235-248 SEQ ID NO:12 у аминокислотной последовательности и SEQ ID NO:12 идентичны на 100%. В определенных вариантах осуществления нуклеиновая кислота кодирует аминокислотную последовательность, которая по меньшей мере на 80% идентична аминокислотам 1-232 SEQ ID NO:12 и по меньшей мере на 80% идентична аминокислотам 251-461 SEQ ID NO:12, где аминокислоты 235-248 SEQ ID NO:12 у аминокислотной последовательности и SEQ ID NO:12 идентичны на 100%.
Процент (%) идентичности аминокислотных последовательностей или последовательностей нуклеиновых кислот определяют как процент аминокислот или нуклеиновых кислот в последовательности-кандидате, которые после выравнивания последовательностей и внесения, если необходимо, пропусков для достижения максимального процента идентичности последовательностей, идентичны аминокислотам или нуклеиновым кислотам в эталонной последовательности. Выравнивание с целью определения процента идентичности последовательностей можно проводить различными способами, которые известны специалистам в данной области, например, с использованием общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN, ALIGN-2 или Megalign (DNASTAR). Соответствующие параметры для определения выравнивания, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей, можно определять известными способами.
Если не определено иначе, все технические и научные термины, используемые в настоящем документе, имеют то же значение, как обычно понимает специалист в области, к которой принадлежит настоящее изобретение. В случае конфликта приоритет имеет настоящий документ, содержащий определения. Ниже описаны предпочтительные способы и материалы, хотя в практическом осуществлении или тестировании описываемых в настоящем описании способов и композиций также можно использовать способы и материалы, сходные с описываемыми в настоящем документе или эквивалентные им. Все публикации, патентные заявки, патенты и другие ссылки, приведенные в настоящем документе, в полном объеме включены в качестве ссылки.
Все характеристики и преимущества настоящего изобретения, например, способы повышения продукции тромбоцитов у индивидуума, будут понятны из приведенных ниже описания, примеров и из формулы изобретения.
Краткое описание рисунков
Фиг. 1 представляет собой линейный график, отображающий влияние схемы лечения с несколькими дозами рекомбинантного TPO человека и несколькими композициями миметиков TPO на уровни тромбоцитов у мышей. Ось Y представляет количество тромбоцитов в единицах 106/мл. Ось X представляет количество суток после начала схемы лечения. Как указано двунаправленной стрелкой, обработку продолжали в течение 5 суток. Закрашенные черным окружности представляют мышей, обрабатываемых F(ab')2-фрагментом антитела, содержащим миметик TPO в области CDR3 тяжелой цепь и в области CDR2 легкой цепи F(ab')2-фрагмента антитела. Незакрашенные окружности представляют мышей, обрабатываемых антителом к компоненту комплемента C5 (5G1.1), не содержащим миметика TPO. Закрашенные черным квадраты представляют мышей, обрабатываемых рекомбинантным TPO человека, а закрашенные черным ромбы представляют мышей, обрабатываемых антителом к компоненту комплемента C5 (5G1.1), содержащим в области CDR3 миметик TPO. Антитело против C5, содержащее миметик TPO, не связывается с C5. константная область тяжелой цепи антител против C5 представляет собой слитую константную область IgG2/IgG4.
Фиг. 2 представляет собой линейный график, отображающий влияние схемы лечения с несколькими дозами антител с миметиками TPO на уровни тромбоцитов у мышей. Ось Y представляет количество тромбоцитов в единицах 106/мл. Ось X представляет количество суток после начала схемы лечения. Как указано двунаправленной стрелкой, обработку продолжали в течение 5 суток. Закрашенные черным ромбы представляют мышей, обрабатываемых антителом к компоненту комплемента C5 (5G1.1), содержащим миметик TPO в области CDR3 тяжелой цепи. Антитело против C5, содержащее миметик TPO не связывается с C5, а константная область тяжелой цепи антитела против C5 представляет собой слитую константную область IgG2/IgG4. Незакрашенные квадраты представляют мышей, обрабатываемых антителом к сибирской язве, не содержащим миметика TPO и содержащим константную область изотипа IgG1. Закрашенные черным треугольники (прямой угол внизу слева) представляют мышей, обрабатываемых антителом к сибирской язве, в котором каждый из полипептидов легких цепей на своем C-конце содержит пептид-миметик TPO. Закрашенные черным треугольники (прямой угол внизу справа) представляют мышей, обрабатываемых антителом к сибирской язве, в котором каждый из полипептидов тяжелых цепей рядом с шарнирной областью содержит миметик TPO. Закрашенные черным квадраты представляют мышей, обрабатываемых антителом к сибирской язве, в котором каждый из полипептидов легких и тяжелых цепей содержит пептид-миметик TPO. Каждое из антител к сибирской язве, содержащее миметик TPO, также содержит слитую константную область тяжелой цепи IgG2/IgG4.
Фиг. 3 представляет собой линейный график, отображающий влияние схемы лечения с однократной дозой антител с миметиками TPO на уровни тромбоцитов у мышей. Ось Y представляет количество тромбоцитов в единицах 106/мл. Ось X представляет количество суток после начала схемы лечения. Закрашенные квадраты представляют мышей, обрабатываемых антителом к компоненту комплемента C5 (5G1.1), содержащим в области CDR3 миметик TPO. Антитело против C5, содержащее миметик TPO не связывается с C5. Каждое из антител против C5, содержащее миметик TPO, также содержит слитую константную область тяжелой цепи IgG2/IgG4. Звездочки представляют мышей, обрабатываемых антителом к сибирской язве, не содержащим миметика TPO. Антитело к сибирской язве содержит константную область тяжелой цепи изотипа IgG1. Закрашенные треугольники представляют мышей, обрабатываемых антителом к сибирской язве, в котором каждые полипептиды легких цепей содержат пептид-миметик TPO. Незакрашенные треугольники представляют мышей, обрабатываемых антителом к сибирской язве, в котором каждый из полипептидов легких и тяжелых цепей содержит пептид-миметик TPO. Антитело к сибирской язве содержит слитую константную область тяжелой цепи IgG2/IgG4. Ромбы представляют мышей, обрабатываемых антителом к сибирской язве, не содержащим миметика TPO, где константная область тяжелой цепи представляет собой константную область IgG2/IgG4.
Фиг. 4 представляет собой линейный график, отображающий влияние антитела CDR-TPO на уровни тромбоцитов после миелосупрессивной терапии. Ось Y представляет количество тромбоцитов в единицах 106/мл. Ось X представляет количество суток после начала схемы лечения. Закрашенные окружности представляют мышей, обрабатываемых митомицином C (MMC) и антителом к C5 (5G1.1), не содержащим миметика TPO. Закрашенные квадраты представляют мышей, обрабатываемых MMC и антителом CDR-TPO (антитело против C5 (5G1.1), содержащее миметик TPO, встроенный в CDR3). Антитело против C5, содержащее миметик TPO, не связывается с C5. Закрашенные ромбы представляют мышей, которых не обрабатывали антителом или MMC. Каждое из антител против C5, содержащее миметик TPO, также содержит слитую константную область тяжелой цепи IgG2/IgG4.
Подробное описание
Настоящее изобретение относится к терапевтическим антителам (например, антителам с миметиками TPO) и их терапевтически активным фрагментам, а также способам получения и применения антител и фрагментов. Хотя никоим образом не предназначаясь для ограничения, ниже конкретизированы и проиллюстрированы в демонстрационных примерах характерные антитела и фрагменты, конъюгаты, фармацевтические композиции и составы и способы применения любого из указанного выше.
Терапевтические антитела и их терапевтически активные фрагменты
Терапевтические антитела (например, антитела с миметиками TPO), описываемые в настоящем документе, содержат по меньшей мере два (например, два, три, четыре, пять, шесть, семь, восемь, девять или 10 или более) терапевтических пептидов (например, пептиды-миметики TPO), где имеет место одно или оба: (i) полипептид легкой цепи антитела содержит по меньшей мере один из терапевтических пептидов (например, пептид-миметик TPO); и (ii) полипептид тяжелой цепи антитела содержит по меньшей мере один из терапевтических пептидов (например, пептид-миметик TPO). По меньшей мере один терапевтический пептид (например, пептид-миметик TPO) встроен в тяжелую цепь следующим образом: (a) в саму шарнирную область; (b) в участке соединения N-конца шарнирной области и расположенной выше области тяжелой цепи; (c) в участке соединения C-конца шарнирной области и расположенной ниже области тяжелой цепи; или (d) в положении, начиная в пределах менее 20 (например, менее 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, девяти, восьми, семи, шести, пяти, четырех, трех, двух или одной) аминокислот выше N-конца или менее 20 (например, менее 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, девяти, восьми, семи, шести, пяти, четырех, трех, двух или одной) аминокислот ниже C-конца шарнирной области.
В соответствии с описанием по меньшей мере один терапевтический пептид (например, пептид-миметик TPO) встроен в константную область полипептида легкой цепи в положении, которое структурно допускает обеспечение представления терапевтического пептида в центральной щели антитела. Как используют в настоящем документе, область или положение, которые "структурно допускают", по отношению к константной области полипептида легкой цепи, относятся к области или положению в константной области легкой цепи, которые (1) могут переносить вставку, замену и/или добавление терапевтического пептида по существу без влияния на трехмерную структуру константной области и (2) позволяют представление терапевтического пептида в центральной щели антитела без влияния на терапевтическую активность терапевтического пептида. Например, терапевтический пептид можно встраивать в качестве: (a) вставки на C-конце константной области полипептида легкой цепи или (b) в качестве вставки и/или замены аминокислот в положении ниже последней C-концевой структуры β-слоя в константной области полипептида легкой цепи. В определенных вариантах осуществления терапевтический полипептид можно встраивать в области β-изгиба константной области полипептида легкой цепи, где β-изгиб структурно находится в положении, которое может обеспечивать предоставление встроенного терапевтического пептида в центральной щели антитела.
Специалист в данной области знает, как определить, какая аминокислота или аминокислотная последовательность в константной области полипептида легкой цепи может допускать такие добавления, вставки или замены. Например, для моделирования трехмерной структуры антитела или его фрагмента, например, для идентификации соответствующей области β-изгиба константной области легкой цепи, в которую можно встраивать терапевтический пептид, можно использовать любое количество свободно доступных компьютерных программ. Подходящие компьютерные программы включают, например, C3nD и Rasmol, которые обе доступны в электронном виде в U.S. National Center for Biotechnology Information/National Institutes of Health и the U.S. National Science Foundation, соответственно. Дополнительные программы включают, например, JMol, YASARA, Oscail, TINKER, MAGE, ArgusLab и SwissPDB Viewer.
В одном из примеров для визуализации молекулярной структуры Fab-фрагмента антитела человека к столбнячному токсину, описанному в Faber et al. (1998) Immunotechnology 3(4):253-270, специалисты в данной области могут использовать C3nD. (Также см. MMDB Id No. 6997). Специалист в качестве потенциального подходящего участка для встраивания терапевтического пептида может идентифицировать во фрагменте последовательность C-концевого β-изгиба легкой цепи: "EQWKSHK" (SEQ ID NO:13). Специалист в качестве потенциального подходящего участка для встраивания терапевтического пептида также может идентифицировать во фрагменте C-концевую последовательность аминокислот легкой цепи: "PAECS" (SEQ ID NO:14). В другом примере C3nD можно использовать для визуализации молекулярной структуры Fab-фрагмента антитела 2F5 человека, которое связывается с эпитопом в gp140 ВИЧ-1. (см. MMDB Id No. 65747). Таким образом, специалисты в данной области в качестве потенциальных структурно соответствующих встраиванию терапевтического пептида в соответствии с описанием могут идентифицировать во фрагменте последовательности C-концевого β-изгиба легкой цепи: "SDEQLKS" (SEQ ID NO:15) и "ADYEKH" (SEQ ID NO:16) и/или C-концевую последовательность аминокислот легкой цепи: "GEC". Аминокислотные последовательности структурно сходных областей других антител можно идентифицировать с использованием, например, Kabat et al. (1991) "Sequences of Proteins of Immunological Interest", Volume 1, 5th Edition, U.S. Department of Health and Human Services, National Institutes of Health (публикация NIH No. 91-3242).
В таких вариантах осуществления терапевтический пептид можно вставлять в константную область полипептида легкой цепи индивидуума (например, область β-изгиба константной области или область, расположенную ниже последней структуры β-слоя), и/или встраивание пептида может заменять ее всю или ее часть. Как используют в настоящем документе, "часть константной области полипептида легкой цепи" относится по меньшей мере к 1 (например, по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 или более) аминокислоте области. Таким образом, в определенных вариантах осуществления терапевтическим пептидом (например, пептидом-миметиком TPO) можно замещать по меньшей мере 5 аминокислот константной области полипептида легкой цепи. Следует понимать, что замену необязательно проводить "один в один", т.е., когда одну аминокислоту исходной константной области легкой цепи заменяют одной аминокислотой терапевтического пептида (например, пептида-миметика TPO). Например, можно удалять последние пять (5) аминокислот константной области легкой цепи и замещать пептидом-миметиком TPO (например, пептидом-миметиком TPO с аминокислотной последовательностью, представленной в SEQ ID NO:1) из 14 аминокислот, таким образом, получая в результате частичную замену C-концевой области легкой цепи и фактически добавление девяти аминокислот на конце легкой цепи. В другом примере, пять (5) аминокислот области β-изгиба константной области полипептида легкой цепи можно замещать пептидом-миметиком TPO (например, пептидом-миметиком TPO с аминокислотной последовательностью, представленной в SEQ ID NO:1) из 14 аминокислот, таким образом, получая в результате частичную замену области β-изгиба и фактически вставку девяти аминокислот.
В вариантах осуществления, где терапевтический пептид (например, пептид-миметик TPO) встроен в саму шарнирную область, терапевтический пептид может представлять собой вставку и/или терапевтическим пептидом можно замещать всю шарнирную область или ее часть. Как используют в настоящем документе "часть шарнирной области" относится по меньшей мере к 1 (например, по меньшей мере к 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 или более) аминокислоте шарнирной области антитела. Таким образом, в определенных вариантах осуществления терапевтическим пептидом (например, пептид-миметик TPO) можно замещать по меньшей мере 5 аминокислот шарнирной области. Часть шарнирной области может включать аминокислоты на N-конце или на C-конце шарнирной области полипептида тяжелой цепи, или часть может включать аминокислоты внутри шарнирной области. Следует понимать, замену необязательно проводить "один к одному", т.е. когда одну аминокислоту исходной шарнирной области замещают одной аминокислотой терапевтического пептида (например, пептида-миметика TPO). Например, можно удалить пять (5) аминокислот N-конца шарнирной области и заменить пептидом-миметиком TPO (см., например, SEQ ID NO:1) из 14 аминокислот, таким образом, получая в результате частичную замену шарнира и фактически вставку девяти аминокислот между константной областью тяжелой цепи 1 (CH1) и частью шарнира. Однако в определенных вариантах осуществления, например, 14 аминокислот шарнирной области можно замещать эквивалентными 14 аминокислотами терапевтического пептида (такого как пептид-миметик TPO с аминокислотной последовательностью SEQ ID NO:1 или 2). В определенных вариантах осуществления всю шарнирную область замещают терапевтическим пептидом. В вариантах осуществления, где часть шарнирной области или вся шарнирная область замещены терапевтическим пептидом, может быть полезным включение спейсерной аминокислотной последовательности, фланкирующей один или оба из N-конца и C-конца пептида (см. ниже).
Таким образом, в определенных вариантах осуществления терапевтическое антитело (например, антитело с миметиком TPO) может содержать два (2) полипептида легких цепей, каждый содержащий по меньшей мере один терапевтический пептид, и два полипептида тяжелых цепей, которые не содержат терапевтических пептидов. В определенных вариантах осуществления терапевтическое антитело, описываемое в настоящем документе, может содержать два полипептида тяжелых цепей, каждый содержащий по меньшей мере один терапевтический пептид (например, пептид-миметик TPO) и два полипептида легких цепей, которые не содержат терапевтических пептидов. В еще одном примере терапевтическое антитело (например, антитело с миметиком TPO) может содержать две тяжелые цепи и две легкие цепи, где каждый из полипептидов тяжелых и легких цепей содержит по меньшей мере один терапевтический пептид (например, пептид-миметик TPO) в соответствии с описанием.
В определенных вариантах осуществления терапевтический пептид в каждом из полипептидов легких цепей и тяжелых цепей может представлять собой один и тот же терапевтический пептид. Например, каждый из легких цепей и тяжелых цепей может содержать один и тот же пептид-миметик TPO (например, пептид-миметик TPO с аминокислотной последовательностью, представленной в SEQ ID NO:1). В определенных вариантах осуществления терапевтический пептид в полипептидах легких цепей может отличаться от терапевтического пептида в полипептидах тяжелых цепей. Например, антитело может содержать два полипептида легких цепей, где каждый содержит первый пептид-миметик TPO (например, с аминокислотной последовательностью SEQ ID NO:1), и два полипептида тяжелых цепей, где каждый содержит второй пептид-миметик TPO (например, с аминокислотной последовательностью SEQ ID NO:2).
В определенных вариантах осуществления терапевтическое антитело может быть двойственно терапевтическим в том отношении, что одно "плечо" (например, область Fab) терапевтического антитела содержит один тип терапевтического пептида (например, пептид-миметик TPO), а второе "плечо" (например, вторая область Fab) терапевтического антитела содержит другой тип терапевтического пептида (например, пептид-миметик EPO), оба в соответствии с описанием (см. ниже).
Следует понимать, что терапевтическое антитело может содержать более двух (например, более трех, четырех, пяти, шести, семи, восьми, девяти, 10, 11, 12 или 15 или более) терапевтических пептидов, при условии, что по меньшей мере один из терапевтических пептидов встроен в тяжелую цепь или легкую цепь в соответствии с описанием. В определенных вариантах осуществления, где терапевтическое антитело содержит более двух терапевтических пептидов, по меньшей мере один из терапевтических пептидов встроен в легкую цепь в соответствии с описанием и по меньшей мере один из терапевтических пептидов встроен в тяжелую цепь в соответствии с описанием.
Расположение и аминокислотные последовательности шарнирной области в тяжелой цепи антитела хорошо известны специалистам в данной области. Характерные аминокислотные последовательности шарнирной области приведены на фиг. 28 публикации PCT WO07/048022, описание которой (в частности фиг. 28) включено в настоящий документ в качестве ссылки в полном объеме.
В определенных вариантах осуществления по меньшей мере один (например, два, три, четыре или все) терапевтический пептид(ы) терапевтического антитела содержат пептид-миметик TPO с аминокислотной последовательностью IEGPTLRQWLAARA (SEQ ID NO:1) или IEGPTLRQWLAARAP (SEQ ID NO:2) или состоит из него. В определенных вариантах осуществления по меньшей мере один (например, два, три, четыре или все) терапевтический пептид(ы) терапевтического антитела содержат пептид-миметик TPO с аминокислотной последовательностью, приведенной на фигуре 5 публикации патентной заявки США № 20030049683, описание которой (в частности, фигура 5) в полном объеме включено в качестве ссылки, или состоит из него. В определенных вариантах осуществления по меньшей мере один (например, два, три, четыре или все) терапевтический пептид(ы) терапевтического антитела содержит пептид-миметик TPO с аминокислотной последовательностью, приведенной в таблице 1 или таблице 2 патента США № 6083913, описание которого (в частности, таблица 1 и таблица 2) включено в настоящий документ в качестве ссылки в полном объеме, или состоит из него.
Дополнительные терапевтические пептиды, которые можно включать в терапевтические антитела, описываемые в настоящем документе, включают, например, другие пептиды-миметики, в качестве неограничивающих примеров, такие как пептид-миметик EPO. Например, подходящие пептиды-миметики EPO включают, например, DYHCRMGPLTWVCKPLGG (SEQ ID NO:3) или любой из миметиков EPO, описанных, например, в патентах США № 5835382 и 5830851. Другие примеры включают пептиды, которые связываются с рецепторами, активируемыми посредством индуцированной лигандами гомодимеризации, включая активные фрагменты, демонстрирующие активность G-CSF, активность GHR и пролактиновую активность, как описано в Whitty and Borysenko (1999) Chem. Biol. 4:R107-18. Дополнительные примеры подходящих пептидов включают миметик фактора роста нервов из петли CD, как описано в Zaccaro et al. (2000) Med. Chem. 43(19):3530-40; миметик IL-2, как описано в Eckenberg et al. (2000) J. Immunol. 165(8):4312-8; глюкагоноподобный пептид-1, как описано в Evans et al. (1999) Drugs R.D. 2(2):75-94; пептид FasL, способный стимулировать апоптоз и вовлеченный, например, в гомеостаз T-клеток, иммунные привилегии и материнскую толерантность (см., например, Sheikh et al. (2000) Leukemia 14(8):1509-1513); c-пептид инсулина; β-цепь инсулина; и тетрапептид I (D-лизин-L-аспарагинил-L-пролил-L-тирозин), стимулирующий активируемую митогенами пролиферацию B клеток, как описано в Gagnon et al. (2000) Vaccine 18(18):1886-92. Терапевтический пептиды (например, пептиды-миметики) в отношении распознаваемых ими лигандов или рецепторов могут обладать агонистической или антагонистической активностью. Например, пептиды, демонстрирующие агонистическую активность в отношении рецепторов, для применения в терапевтических антителах, описываемых в настоящем документе, могут включать, например, N-концевой пептид vMIP-II в качестве антагониста CXCR4 для применения при лечении ВИЧ, как описано в Luo et al. (2000) Biochemistry 39(44): 13545-50; антагонистический пептидный лиганд "AFLARAA" (SEQ ID NO:4) рецептора тромбина для антитромботической терапии, как описано в Pakala et al. (2000) Thromb. Res. 100(1):89-96; антагонист рецептора пептида CGRP CGRP(8-37) для снижения толерантности к наркотикам, как описано в Powell et al. (2000) Br. J. Pharmacol. 131(5):875-84; антагонист рецептора паратиреоидного гормона (PTH)-1, как описано в Hoare et al. (2000) Pharmacol. Exp. Ther. 295(2):761-70; специфичные к интегрину антагонисты-пептидомиметики для лечения тромбоза коронарных артерий, астмы, воспалительного заболевания кишечника и/или злокачественной опухоли, как описано, например, в публикации PCT № WO97/36858, Tcheng et al. (1995) Circulation 91:2151 и Bovy et al. (1994) Bioorg. Med Chem. 2:881; опиоидный фактор роста, как описано в Zagon et al. (2000) Int. J. Oncol. 17(5): 1053-61; антагонист высокоаффинного рецептора интерлейкина 1 типа I как описано в Yanofsky et al. (1996) Proc. Natl. Acad. Sci. USA 93:7381-7386 и Vigers et al. (2000) J. Biol. Chem. 275(47):36927-36933; пептид, связывающий кислотный фактор роста фибробластов, как описано в Fan et al. (2000) IUBMB Life 49(6):545-48; и пептиды-миметики, пригодные для лечения ангиогенеза у индивидуума, как описано, например, в Mazitschek et al. (2002) Mini Rev. Med. Chem. 2(5):491-506.
В данной области известны способы идентификации дополнительных терапевтических пептидов (например, пептидомиметиков). Например, для идентификации области белка, вовлеченной в конкретную биологическую функцию, ответственный линейный пептидный эпитоп может выявить исследование более коротких пептидных фрагментов, составляющих этот белок. Альтернативно, пептид, представляющий собой оптимальный линейный эпитоп или прерывистый эпитоп, который имитирует активность природного белка, можно выявить, исследуя библиотеки случайных пептидов. Один из способов отбора называется фаговым дисплеем пептидов. При этом подходе получают библиотеку случайных пептидных эпитопов так, чтобы пептиды находились на поверхности частицы бактериофага. Затем эти коллекции или библиотеки пептидов можно исследовать на пептиды, способные связываться с конкретным иммобилизованным белком-мишенью. См., например, Kieber-Emmons et al. (1997) Curr. Opin. Biotechnol. 8(4):435-441; Gentilucci et al. (2006) Curr. Med. Chem. 13(20):2449-2466; Pasqualini et al. (1995) J. Cell Biol. 130:1189-1196; Wrighton et al. (1996) Science 273:458-463; Cwirla et al. (1997) Science 276:1696-1699; Koivunen et al. (1993) J. Biol Chem. 268:20205-20210; Koivunen et al. (1995) Bio/Technol. 13:265-270; Healy et al. (1995) Biochem. 34:3948-3955; Pasqualini et al. (1995) J. Cell Biol. 130:1189-1196. Также возможны альтернативные системы отбора пептидов, включающие дисплей на клеточной поверхности и рибосомный дисплей.
Как используют в настоящем документе, "полипептид", "пептид" и "белок" используют взаимозаменяемо, и они означают любую связанную пептидными связями цепь аминокислот вне зависимости от длины или посттрансляционной модификации.
В определенных вариантах осуществления терапевтический пептид (например, пептид-миметик TPO) на одном или обоих из C-конца и N-конца может быть фланкирован спейсерной аминокислотной последовательностью (или спейсерной последовательностью). Спейсерную последовательность можно использовать, например, для уменьшения структурных ограничений миметика с обеспечением более простого принятия миметиком биологически активной конформации и/или с более эффективным представлением пептида в окружении поддерживающей структуры антитела. В определенных вариантах осуществления спейсерная последовательность в качестве неограничивающих примеров может содержать одну или несколько (например, два, три, четыре, пять, шесть, семь, восемь, девять, 10, 11, 12, 13, 14, 15, 20, 25 или 30 или более) аминокислот. Спейсерная последовательность может содержать, например, один или несколько остатков пролина или глицина. В определенных вариантах осуществления спейсерная аминокислотная последовательность может представлять собой или содержать аминокислоты ARSL (SEQ ID NO:5). В определенных вариантах осуществления спейсерная аминокислотная последовательность может содержать или представлять собой "PI" (SEQ ID NO:6), "NP" (SEQ ID NO:7), или "LVG" (SEQ ID NO:8). В определенных вариантах осуществления миметик TPO может содержать спейсерную последовательность "ARSL" на N-конце и спейсерную последовательность "LVG" на C-конце.
В качестве поддерживающей последовательности, в которую встраивают терапевтические пептиды (например, пептиды-миметики TPO), может служить любое антитело (или фрагмент антитела). Однако когда антитела или их фрагменты, необходимо применять у людей, антитела, предпочтительно, представляют собой антитела человека или гуманизированные антитела. Одним подходящим антителом для применения в качестве поддерживающей структуры является антитело к столбнячному токсину (TT) человека или его фрагмент (например, Fab-фрагмент). См., например, Barbas et al. (1994) J. Am. Chem. Soc. 116:2161-2162 и Barbas et al. (1995) Proc. Natl. Acad. Sci. USA 92:2529-2533. Другие подходящие антитела, которые могут использоваться в качестве поддерживающих структур в соответствии с описанием включают, например, антитела к сибирской язве (например, антитела к антигенам сибирской язвы PA83 или сибирской язвы PA63), как указано в демонстрационных примерах.
В определенных вариантах осуществления одну или несколько определяющих комплементарность областей (CDR) поддерживающего антитела можно модифицировать (например, замещать, удалять или посттрансляционно модифицировать) в степени, достаточной для изменения или частичного или полного устранения антиген-связывающей специфичности антитела. Способы модификации CDR антитела хорошо известны в молекулярной биологии и описаны, например, в Sambrook et al. (1989) "Molecular Cloning: A Laboratory Manual, 2nd Edition", Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. и Ausubel et al. (1992) "Current Protocols in Molecular Biology", Greene Publishing Associates. Кроме того, в данной области известны способы определения того, связывается ли антитело с белковым антигеном и/или аффинности (или потери аффинности) антитела к белковому антигену. Например, связывание антитела с белковым антигеном можно обнаруживать и/или количественно определять с применением ряда способов, в качестве неограничивающих примеров, таких анализов как, вестерн-блоттинг, дот-блоттинг, способ поверхностного плазмонного резонанса (например, BIAcore system; Pharmacia Biosensor AB, Uppsala, Sweden и Piscataway, N.J). или твердофазный иммуноферментный анализ (ELISA). См., например, Harlow and Lane (1988) "Antibodies: A Laboratory Manual" Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.; Benny K. C. Lo (2004) "Antibody Engineering: Methods and Protocols", Humana Press (ISBN: 1588290921); Borrebaek (1992) "Antibody Engineering, A Practical Guide", W.H. Freeman and Co., NY; Borrebaek (1995) "Antibody Engineering", 2nd Edition, Oxford University Press, NY, Oxford; Johne et al. (1993) J. Immunol. Meth. 160:191-198; Jonsson et al. (1993) Ann. Biol. Clin. 51:19-26; и Jonsson et al. (1991) Biotechniques 11:620-627. Также см. патент США № 6355245. Такие способы также могут использоваться для определения того, сохраняет ли терапевтический пептид (например, пептид-миметик TPO) в окружении терапевтического антитела способность связываться с распознаваемой им мишенью (например, с рецептором клеточной поверхности, таким как c-Mpl). Например, подходящие способы определения аффинности антитела с миметиком TPO к c-Mpl приведены в демонстрационных примерах.
В определенных вариантах осуществления можно модифицировать одну или несколько константных областей Fc (например, CH2, CH3 или CH4) терапевтического антитела (например, антитело с миметиком TPO) с частичным или полным устранением их способности связываться с Fc-рецепторами, экспрессируемыми на клетках-хозяевах. Модификации включают, например, мутагенез одной или нескольких константных областей Fc, а также посттрансляционные модификации. В определенных вариантах осуществления терапевтическое антитело (например, антитело с миметиком TPO) можно модифицировать так, чтобы антитело обладало менее 50 (например, менее 45, 40, 35, 30, 25, 20, 15, 10, девяти, восьми, семи, шести, пяти, четырех, трех, двух, одного, 0,5 или менее 0,01) % способности немодифицированного терапевтического антитела связываться с Fc-рецептором. Способы определения того, связывается ли антитело с Fc-рецептором, известны в данной области и описаны, например, в Lund et al. (1991) J. Immunol. 147(8):2657-62.
В определенных вариантах осуществления по меньшей мере часть терапевтического антитела (например, антитела с миметиком TPO) может содержать аминокислотную последовательность, кодируемую нуклеотидной последовательностью SEQ ID NO:9. В определенных вариантах осуществления по меньшей мере часть терапевтического антитела (например, антитела с миметиком TPO) может содержать аминокислотную последовательность, кодируемую нуклеотидной последовательностью, представленной в SEQ ID NO:1. В определенных вариантах осуществления терапевтическое антитело (например, антитело с миметиком TPO) может содержать последовательность аминокислот легкой цепи, кодируемую нуклеотидной последовательностью, представленной в SEQ ID NO:9, и последовательность аминокислот тяжелой цепи, кодируемую нуклеотидной последовательностью, представленной в SEQ ID NO:11, или состоять из них.
В определенных вариантах осуществления по меньшей мере часть терапевтического антитела (например, антитела с миметиком TPO) может содержать полипептид легкой цепи со следующей аминокислотной последовательностью: DIQMTQSPSSLSASVGDRVTLTCRASQGVRNALVWYQQKPGKAPERLIYAASILQSGVPSRFSGSGSGTEFTLTIGGLQPEDFATYYCLQHNSYPWTFGQGTKVEIKR TVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGECARSLIEGPTLRQWLAARAPI (SEQ ID NO:10). В определенных вариантах осуществления по меньшей мере часть терапевтического антитела (например, антитела с миметиком TPO) может содержать полипептид тяжелой цепи со следующей аминокислотной последовательностью: QVQLVQSGAEVKKPGASVKVSCKASGYTFTYYAMHWVRQAPGQRPEWMGWINGGDGKTKYAQKFQGRLAITRDTSARTAYMELISLTSEDTAVYYCAKGAEMTVGSWGPGTLVTVSS ASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSNFGTQTYTCNVDHKPSNTKVDKTVERKCCVECPPCPAPPVANPIEGPTLRQWLAARARGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK (SEQ ID NO:12). (В приведенном выше: последовательности вариабельных областей антитела подчеркнуты; аминокислотная последовательность пептида-миметика TPO в каждом полипептиде приведена жирным шрифтом; а аминокислотные последовательности константных областей антитела приведены курсивом. Невыделенные аминокислотные последовательности соответствуют спейсерным последовательностям).
Как используют на всем протяжении настоящего описания термины "терапевтическое антитело" и "антитело с миметиком TPO" относятся к молекуле целого или интактного антитела (например, IgM, IgG (включая IgG1, IgG2, IgG3 и IgG4), IgA, IgD или IgE), содержащей по меньшей мере два (например, по меньшей мере два, три или четыре) терапевтических пептида (например, пептиды-миметики TPO) в соответствии с описанием. Терапевтические антитела (например, антитела с миметиками TPO) также включают полноразмерные антитела по меньшей мере с двумя терапевтическими пептидами и гибридной константной областью или ее частью, такой как гибридная константная область G2/G4 (см. например, Burton et al. (1992) Adv. Immun. 51:1-18; Canfield et al. (1991) J. Exp. Med. 173:1483-1491; и Mueller et al. (1997) Mol. Immunol. 34(6):441-452). Например (и в соответствии с нумерацией по Kabat), константные области IgG1 и IgG4 содержат остатки G249G250, тогда как константная область IgG2 не содержит остатка 249, но содержит G250. В гибридной константной области G2/G4, где область 249-250 взята из последовательности G2, константную область можно дополнительно модифицировать с введением остатка глицина в положение 249 с получением слияния G2/G4 с G249/G250. Также в качестве поддерживающих структур для антител с миметиками TPO в соответствии с описанием можно использовать другие гибридные константные домены, содержащие G249/G250.
Термин "антитело" включает, например, химеризованное или химерное антитело, гуманизированное антитело, деиммунизированное антитело человека и полностью человеческое антитело. Поддерживающую структуру на основе антитела можно получать или она может происходить из любого из ряда видов, например, млекопитающих, таких как люди, не являющиеся человеком приматы (например, мартышки, павианы или шимпанзе), лошади, крупный рогатый скот, свиньи, овцы, козы, собаки, кошки, кролики, морские свинки, песчанки, хомяки, крысы и мыши.
Как используют в настоящем документе, термин "терапевтически активный фрагмент антитела" или, в некоторых случаях, "фрагмент антитела" или "терапевтически активный фрагмент" относится к фрагменту терапевтического антитела (например, фрагменту антитела с миметиком TPO), который: (i) структурно сохраняет по меньшей мере два (например, по меньшей мере два, три или четыре; см. выше) терапевтических пептида (например, пептиды-миметики TPO), присутствующие в интактном терапевтическом антителе в соответствии с описанием; и (ii) функционально сохраняет по меньшей мере 10% (например, по меньшей мере 12%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98%, по меньшей мере 99%, по меньшей мере 99,5% или 100% или более) терапевтической активности интактного терапевтического антитела. Например, терапевтически активный фрагмент антитела с миметиком TPO, описываемый в настоящем документе, может сохранять по меньшей мере 10% сходной с TPO активности интактного антитела с миметиком TPO (см. ниже в "Способах получения терапевтического антитела или его терапевтически активного фрагмента"). В другом примере терапевтически активный фрагмент антитела, содержащий пептид-миметик эритропоэтина (EPO) может сохранять по меньшей мере 10% сходной с EPO активностью интактного "антитела с миметиком EPO". Терапевтически активные фрагменты терапевтического антитела включают, например, одноцепочечное антитело, одноцепочечный Fv-фрагмент (scFv), Fd-фрагмент, Fab-фрагмент, Fab'-фрагмент или F(ab')2-фрагмент. Фрагмент scFv представляет собой единую полипептидную цепь, которая содержит вариабельные области тяжелой и легкой цепей антитела, из которого scFv получен. Кроме того, можно получать и использовать в способах, описываемых в настоящем документе, миниантитела, триатела и диатела (см., например, Todorovska et al. (2001) J. Immunol. Methods 248(l):47-66; Hudson and Kortt (1999) J. Immunol. Methods 231(1): 177-189; и Poljak (1994) Structure 2(12): 1121-1123, описания которых включены в настоящий документ в качестве ссылки в полном объеме), слитые по меньшей мере с частью константной области тяжелой цепи и/или легкой цепи и содержащие по меньшей мере два терапевтических пептида в соответствии с описанием.
В определенных вариантах осуществления в качестве поддерживающей структуры для встраивания по меньшей мере двух терапевтических пептидов в соответствии с описанием могут служить биспецифические антитела (или их фрагмент, такой как F(ab')2). В определенных вариантах осуществления сохранена антиген-связывающая способность по меньшей мере одного (или обоих) из антиген-связывающих участков биспецифического антитела. Например, два или более терапевтических пептида можно встраивать в одно плечо (например, область Fab) биспецифического антитела в соответствии с описанием, но не встраивать во второе плечо (например, вторую область Fab) биспецифического антитела. В другом примере терапевтические пептиды можно встраивать в оба плеча (например, обе области Fab) биспецифического антитела, где антиген-связывающая способность по меньшей мере одного (или обоих) плеч антитела при встраивании терапевтических пептидов не изменяется. Такое терапевтическое биспецифическое антитело (которое полностью включено в термин "терапевтическое антитело") можно использовать, например, для нацеливания терапевтических пептидов терапевтического антитела на конкретную клетку-мишень. Например, когда терапевтическое биспецифическое антитело содержит пептиды-миметики TPO, по меньшей мере один антиген-связывающий участок терапевтического биспецифического антитела может связываться с белком-маркером на мегакариоците. Подходящие белки-маркеры мегакариоцитов включают, например, CD41 (IIb/IIIa) и CD42 (Ib).
Способы получения терапевтического антитела или его терапевтически активного фрагмента
Терапевтические антитела (например, антитела с миметиками TPO) или их терапевтически активные фрагменты можно получать рядом способов, известных в области молекулярной биологии и химии белков. Например, можно проводить встраивание последовательности ДНК, кодирующей терапевтический пептид (например, пептид-миметик TPO) в последовательность ДНК, кодирующую антитело так, чтобы заместить шарнирную область антитела последовательностью пептида, способами рекомбинантной ДНК, в качестве неограничивающих примеров, такими как перекрывание при ПЦР, клонирование по участкам распознавания рестрикционных ферментов, сайт-специфический мутагенез и полностью синтетические способы. Сайт-специфический мутагенез можно осуществлять различными способами. Один основан на мутагенезе dut/ung по Кункелю (Kunkel (1985) Proc. Natl. Acad. Sci. USA 82:488-92). Также коммерчески доступны несколько основанных на амплификации ПЦР способов мутагенеза, такие как набор QuickChange® Site-Directed Mutagenesis Kit и набор ExSite™ PCR-based Site-Directed Mutagenesis Kit (Stratagene, La Jolla, California). Другим не основанном на ПЦР способом является система GeneEditor™ in vitro Site-Directed Mutagenesis System (Promega Corporation, Madison, Wisconsin). Полностью синтетические способы также хорошо известны и описаны, например, в Deng et al. (1995) Methods Mol. Biol. 51:329-42; Kutemeler et al. (1994) Biotechniques 17(2):242-246; Shi et al. (1993) PCR Methods Appl. 3(1):46-53; and Knuppik et al. (2000) J. Mol. Biol. 296(l):571-86.
Стандартные способы молекулярной биологии также можно использовать для введения фланкирующих спейсерных аминокислотных последовательностей на C- и/или N-концах терапевтического пептида (например, пептида-миметика TPO). Как описано выше, такие фланкирующие последовательности могут быть подходящими, например, для уменьшения структурных ограничений терапевтического пептида и для обеспечения более простого принятия пептидом конформации, необходимой для биологической активности.
В определенных вариантах осуществления фланкирующая область может содержать, например, один или несколько остатков пролина. См., например, Kini and Evans (1995) BioChem. Biophys Res Commun 212(3): 115-24 и Kini et al. (1995) FEBS Letters 375:15-17. В определенных вариантах осуществления один или несколько остатки пролина добавляют на C-конце терапевтического пептида (например, пептида-миметика TPO).
В определенных вариантах осуществления спейсерные аминокислотные последовательности могут включать, например, одну или несколько из любых SEQ ID NO:5-8.
Нуклеиновые кислоты можно встраивать в вектор экспрессии, содержащий последовательности регуляции транскрипции и трансляции, которые включат, например, промоторные последовательности, участки связывания рибосомы, последовательности начала и остановки транскрипции, последовательности начала и остановки трансляции, сигналы терминации транскрипции, сигналы полиаденилирования и энхансерные или активаторные последовательности. Регуляторные последовательности включают промотор и последовательности начала и остановки транскрипции. Кроме того, вектор экспрессии может включать более одной системы репликации так, что он может поддерживаться в двух различных организмах, например в клетках млекопитающих или насекомых для экспрессии и в прокариотическом хозяине для клонирования и амплификации.
Для экспрессии клонированных полипептидов тяжелых цепей и легких цепей с нуклеиновых кислот в клетках млекопитающих доступны несколько возможных векторных систем. Один класс векторов основан на интеграции желаемой генной последовательности в геном клетки-хозяина. Клетки, несущие стабильно интегрированную ДНК, можно выбирать по одновременно введенным генам устойчивости к лекарственным средствам, таким как gpt E. coli (Mulligan and Berg (1981) Proc. Natl. Acad. Sci. USA, 78:2072) или neo Tn5 (Southern and Berg (1982) Mol. Appl. Genet. 1:327). Ген селективного маркера может быть или соединен с последовательностью ДНК экспрессируемого гена, или введен в ту же клетку посредством котрансфекции (Wigler et al. (1979) Cell 16:77). Во втором классе векторов используют элементы ДНК, которые придают внехромосомной плазмиде способности к автономной репликации. Эти векторы можно получать из вирусов животных, таких как вирус папилломы крупного рогатого скота (Sarver et al. (1982) Proc. Natl. Acad. Sci. USA, 79:7147), вирус полиомы (Deans et al. (1984) Proc. Natl. Acad. Sci. USA 81:1292) или вирус SV40 (Lusky and Botchan (1981) Nature 293:79).
Векторы экспрессии можно вводить в клетки способом, подходящим для последующей экспрессии нуклеиновой кислоты. Способ введения в значительной степени определяется намеченным типом клеток, обсуждаемых ниже. Характерные способы включают осаждение CaPO4, слияние липосом, липофекцию, электропорацию, вирусную инфекцию, опосредованную декстраном трансфекцию, опосредованную полибреном трансфекцию, слияние протопластов и прямую микроинъекцию.
Подходящие клетки-хозяева для экспрессии терапевтических антител (например, антител с миметиками TPO) или их терапевтически активных фрагментов, включают клетки дрожжей, бактерий, насекомых, растений и млекопитающих. Особый интерес представляют бактерии, такие как E. coli, грибы, такие как Saccharomyces cerevisiae и Pichia pastoris, клетки насекомых, такие как SF9, клеточные линии млекопитающих (например, клеточные линии человека), а также первичные клеточные линии.
В определенных вариантах осуществления терапевтическое антитело можно экспрессировать и очищать у трансгенных животных (например, трансгенные млекопитающие). Например, терапевтические антитела можно получать у трансгенных не являющихся человеком млекопитающих (например, у грызунов) и выделять из молока, как описано, например, в Houdebine (2002) Curr. Opin. Biotechnol. 13(6):625-629; van Kuik-Romeijn et al. (2000) Transgenic Res 9(2):155-159; и Pollock et al. (1999) J. Immunol. Способы 231(1-2):147-157.
Терапевтические антитела (например, антитела с миметиками TPO) и их фрагменты получают из клеток посредством культивирования клеток-хозяев, трансформированных вектором экспрессии, содержащим нуклеиновую кислоту, кодирующую антитела или фрагменты, в условиях и в течение периода времени, достаточных для обеспечения экспрессии белков. Такие условия для экспрессии белков изменяются с выбором вектора экспрессии и клетки-хозяина, и их легко определит специалист в данной области посредством общепринятых экспериментов. Например, терапевтические антитела, экспрессируемые в E. coli можно подвергать рефолдингу из телец включения (см., например, Hou et al. (1998) Cytokine 10:319-30). Бактериальные экспрессирующие системы и способы их использования хорошо известны в данной области (см. Current Protocols in Molecular Biology, Wiley & Sons и Molecular Cloning: A Laboratory Manual, 3rd Ed., Cold Spring Harbor Laboratory Press, New York (2001)). Выбор кодонов, подходящих векторов экспрессии и подходящих клеток-хозяев изменяется в зависимости от ряда факторов, и его по мере необходимости можно легко оптимизировать. Терапевтические антитела (например, антитела с миметиками TPO) или их фрагменты, можно экспрессировать в клетках млекопитающих или в других экспрессирующих системах, включая в качестве неограничивающих примеров дрожжевые, бакуловирусные экспрессирующие системы и экспрессирующие системы in vitro (см., например, Kaszubska et. al. (2000) Protein Expression and Purification 18:213-220).
После экспрессии терапевтические антитела (например, антитела с миметиками TPO) или их фрагменты можно выделять. Термины "очищенные" или "выделенные", как используют для любых белков, описываемых в настоящем документе, (например, белки антител с миметиком TPO или их фрагменты) относятся к полипептиду, который отделен или очищен от компонентов (например, белков или других природных биологических или органических молекул), которые в природе его сопровождают, например, другие белки, липиды и нуклеиновые кислоты у экспрессирующего белки прокариотического организма. Как правило, полипептид очищают, когда он составляет по меньшей мере 60 (например, по меньшей мере 65, 70, 75, 80, 85, 90, 92, 95, 97 или 99) % по массе от общего белка в образце.
Терапевтические антитела (например, антитела с миметиками TPO) или их фрагменты можно выделять или очищать рядом способов, известных специалистам в данной области в зависимости от того, какие другие компоненты присутствуют в образце. Стандартные способы очистки включают электрофоретический, молекулярный, иммунологический и хроматографический способы, включая ионообменную, гидрофобную, аффинную хроматографию и хроматографию ВЭЖХ с обращенной фазой. Например, антитело с миметиком TPO можно очищать с использованием стандартной колонки с антителами (например, колонки с белком A или с белком G). Также пригодны способы ультрафильтрации и диафильтрации в сочетании с концентрированием белков. См., например, Scopes (1994) "Protein Purification, 3rd edition", Springer-Verlag, New York City, New York. Степень необходимой очистки изменяется в зависимости от желаемого применения. В некоторых случаях, необходимости в очистке экспрессированных терапевтических антител (например, антител с миметиками TPO) или фрагментов нет.
Способы определения выхода или чистоты очищенного терапевтического антитела (например, антитела с миметиком TPO) или его фрагмента известны в данной области и включат, например, анализ по Брэдфорду, УФ-спектроскопию, биуретовый анализ белка, анализ белка по Лоури, анализ белка с амидочерным, высокоэффективную жидкостную хроматографию (ВЭЖХ), масс-спектрометрию (MS) и гель-электрофоретические способы (например, использование красителей белка, таких как краситель кумасси синий или коллоидное серебро).
В определенных вариантах осуществления из терапевтических антител или фрагментов можно удалять эндотоксин. Способы удаления эндотоксина из образца белка известны в данной области и проиллюстрированы в демонстрационных примерах. Например, эндотоксин можно удалять из образца белка с использованием ряда коммерчески доступных реагентов, без ограничения, включая наборы ProteoSpin™ Endotoxin Removal Kit (Norgen Biotek Corporation), гель Detoxi-Gel Endotoxin Removal Gel (Thermo Scientific; Pierce Protein Research Products), набор MiraCLEAN® Endotoxin Removal Kit (Mirus) или мембрану Acrodisc™ - Mustang® E (Pall Corporation).
Способы обнаружения и/или измерения количества эндотоксина, присутствующего в образце (до и после очистки) известны в данной области и коммерческие наборы доступны. Например, концентрацию эндотоксина в образце белка можно определять с применением набора QCL-1000 Chromogenic kit (BioWhittaker), наборов на основе лизата амебоцитов Limulus (LAL), таких как наборы Pyrotell®, Pyrotell®-T, Pyrochrome®, Chromo-LAL и CSE, доступных в Associates of Cape Cod Incorporated.
Подходящие способы получения и очистки терапевтических антител также приведены в демонстрационных примерах.
Модификация терапевтических антител и фрагментов
Терапевтические антитела (например, антитела с миметиками TPO) или их терапевтически активные фрагменты после их экспрессии и очистки можно модифицировать. Модификации могут представлять собой ковалентные или нековалентные модификации. Такие модификации можно вводить в антитела или фрагменты, например, посредством реакции намеченных аминокислотных остатков полипептида с органическим дериватизирующим средством, способным к реакции с выбранными боковыми цепями или концевыми остатками. Подходящие участки для модификации можно выбирать с применением ряда критериев, включая, например, структурный анализ или анализ аминокислотной последовательности белков терапевтических антител или фрагментов.
В определенных вариантах осуществления терапевтические антитела или их терапевтически активные фрагменты можно конъюгировать с гетерологичной молекулой. Гетерологичная молекула может представлять собой, например, гетерологичный полипептид, терапевтическое средство (например, токсин или лекарственное средство) или детектируемую метку, в качестве неограничивающих примеров такую как радиоактивная метка, ферментативная метка, флуоресцентная метка или люминесцентная метка. Подходящие гетерологичные полипептиды включают, например, антигенную метку (например, FLAG, полигистидин, гемагглютинин (HA), глутатион-S-трансферазу (GST) или связывающий мальтозу белок (MBP)) для применения в очистке терапевтических антител или фрагментов. Гетерологичные полипептиды также включают полипептиды, которые пригодны в качестве диагностических или детектируемых маркеров, например, люциферазу, зеленый флуоресцентный белок (GFP) или хлорамфениколацетилтрансферазу (CAT). Подходящие радиоактивные метки включают, например, 32P, 33P, 14C, 125I, 1311,35S и 3H. Подходящие флуоресцентные метки в качестве неограничивающих примеров включают флуоресцеин, флуоресцеинизотиоцианат (FITC), GFP, DyLight 488, фикоэритрин (PE), йодид пропидия (PI), PerCP, PE-Alexa Fluor® 700, Cy5, аллофикоцианин и Cy7. Люминесцентные метки включают, например, любую из ряда хелатов люминесцентных лантанидов (например, европия или тербия). Например, подходящие хелаты европия включают хелат европия диэтилентриаминпентауксусной кислоты (DTPA). Ферментативные метки включают, например, щелочную фосфатазу, CAT, люциферазу и пероксидазу хрена.
Два белка (например, антитело с миметиком TPO и гетерологичная аминокислотная последовательность) можно связывать с использованием ряда известных химических связывающих средств. Примеры таких связывающих средств представляют собой связывающие средства, связывающие два аминокислотных остатка посредством связи, содержащей "пространственно-затрудненную" дисульфидную связь. В этих связях, дисульфидная связь в связывающей единице защищена (посредством пространственно затрудняющих групп на каждой стороне дисульфидной связи) от восстановления под действием, например, восстановленного глутатиона или фермента дисульфидредуктазы. Один из подходящих реагентов, 4-сукцинимидилоксикарбонил-α-метил-α(2-пиридилдитио)толуол (SMPT), формирует связь между двумя белками с использованием концевого лизина на одном из белков и концевого цистеина на другом. Также можно использовать гетеробифункциональные реагенты, связывающие различные связывающие группы на каждом белке. Другие подходящие связывающие средства в качестве неограничивающих примеров включают реагенты, связывающие две аминогруппы (например, N-5-азидо-2-нитробензоилоксисукцинимид), две сульфгидрильные группы (например, 1,4-бис-малеимидобутан), аминогруппу и сульфгидрильную группу (например, сложный м-малеимидобензоил-N-гидроксисукцинимидный эфир), аминогруппу и карбоксильную группу (например, 4-[п-азидосалициламидо]бутиламин) и аминогруппу и гуанидиниевую группу, которая присутствует в боковой цепи аргинина (например, моногидрат п-азидофенилглиоксаля).
Радиоактивную метку можно непосредственно конъюгировать с аминокислотным каркасом белка. Альтернативно, радиоактивную метку можно включать в виде части более крупной молекулы (например, 125I в мета-[125I]йодофенил-N-гидроксисукцинимид ([125I]mIPNHS), которая связывается со свободными аминогруппами с образованием мета-йодофенильных (mIP) производных соответствующих белков (см., например, Rogers et al. (1997) J. Nucl. Med. 38:1221-1229), или хелата (например, с DOTA или DTPA), который в свою очередь связывается с каркасом белка. Способы конъюгации радиоактивных меток или более крупных молекул/хелатов, содержащих их, с терапевтическими антителами или их терапевтически активными фрагментами известны в данной области. Такие способы включают инкубацию белков с радиоактивной меткой в условиях (например, pH, концентрация солей и/или температура), которые способствуют связыванию радиоактивной метки или хелата с белком (см., например патент США № 6001329).
Способы конъюгации флуоресцентной метки (иногда обозначаемой как "флуорофор") с белком (например, терапевтическим антителом или его терапевтически активным фрагментом) известны в области химии белков. Например, флуорофоры можно конъюгировать со свободными аминогруппами (например, лизинов) или сульфгидрильными группами (например, цистеинов) белков с использованием молекул сложного сукцинимидильного (NHS) эфира или сложного TFP эфира, присоединенных к флуорофорам. В определенных вариантах осуществления флуорофоры можно конъюгировать c гетеробифункциональной связывающей молекулой, такой как сульфо-SMCC. Подходящие способы конъюгации включают инкубацию белков терапевтических антител или их фрагментов с флуорофором в условиях, которые способствуют связыванию флуорофора с белком. См., например, Welch and Redvanly (2003) "Handbook of Radiopharmaceuticals: Radiochemistry and Applications", John Wiley and Sons (ISBN 0471495603).
Как описано выше, терапевтические антитела или их терапевтически активные фрагменты, описываемые в настоящем документе, обеспечивают содержащимся в них терапевтическим пептидам увеличенное время полужизни в сыворотке. Однако в определенных вариантах осуществления антитела или фрагменты можно модифицировать, например, группой, улучшающей стабильность и/или удержание самих антител в циркуляции, например, в крови, сыворотке или других тканях. Например, антитело или фрагмент можно пегилировать, как описано, например, в Lee et al. (1999) Bioconjug. Chem. 10(6): 973-8; Kinstler et al. (2002) Advanced Drug Deliveries Reviews 54:477-485; and Roberts et al. (2002) Advanced Drug Delivery Reviews 54:459-476. Стабилизирующая группа может улучшать стабильность или удержание антитела (или фрагмента) по меньшей мере в 1,5 (например, по меньшей мере 2, 5, 10, 15, 20, 25, 30, 40 или 50 или более) раза. Стабилизирующая группа может дополнительно улучшать стабильность или удержание терапевтического пептида (по сравнению со свободной формой терапевтического пептида) по меньшей мере в 1,5 (например, по меньшей мере 2, 5, 10, 15, 20, 25, 30, 40 или 50 или более) раза.
Анализ биологической активности терапевтических антител или фрагментов
Для анализа биологической активности терапевтического антитела или терапевтически активного фрагмента антитела, описываемых в настоящем документе, можно использовать ряд биологических анализов in vitro и in vivo. Способы могут изменяться в зависимости от активности конкретного терапевтического пептида, содержащегося в антителах. Например, сходную с тромбопоэтином активность описанных антител, фрагментов или конъюгатов с миметиками TPO можно анализировать, например, с использованием анализов образования колоний, анализов пролиферации, анализов фосфорилирования и/или основанных на транскрипции анализов. С помощью анализов формирования колоний определяют колонии мегакариоцитов формируемых из образца костного мозга, получаемого у индивидуума (см., например, набор Megacult® C из Stem Cell Technologies Inc., Vancouver BC, Canada). Анализы пролиферации можно использовать для определения пролиферации экспрессирующих рецептор c-Mpl клеток Ba/F3 в присутствии, антител, фрагментов или конъюгатов миметиками TPO, по сравнению с их отсутствием. См., например, Cwiria et al. (1997) Science 276:1696-1699 и de Sauvage et al. (1994) Nature 369:533. Увеличение пролиферации клеток, контактирующих с антителами с миметиками TPO (или фрагментами) по сравнению с уровнем пролиферации клеток в отсутствии антител с миметиками TPO (или фрагментов) представляет собой показатель того, что антитела с миметиками TPO (или фрагменты) обладают сходной TPO биологической активностью. Активацию рецептора c-Mpl в качестве меры активности антитела с миметиком TPO можно анализировать, определяя фосфорилирование JAK2 или Stat3 или Stat5, как описано, например, в Drachman et al. (1999) J. Biol. Chem. 274:13480-13484 и Miyakawa et al. (1996) Blood 87(2):439-46. Активность антитела с миметиком TPO или его терапевтически активного фрагмента можно измерять с использованием основанного на транскрипции анализа, как описано в публикации патентной заявки США № 20030049683. Например, клетку млекопитающего можно трансфицировать нуклеиновой кислотой, кодирующей полноразмерный рецептор c-Mpl и ген люциферазы, экспрессия которого находится под контролем промотора c-Fos. После обеспечения экспрессии рецептора c-Mpl клетки приводят в контакт с антителом с миметиком TPO или его терапевтически активным фрагментом в течение периода времени и в условиях, позволяющих связывание антитела с рецептором. Увеличение количества люциферазы, продуцируемой в клетках по сравнению с количеством люциферазы, продуцируемой в клетках, не контактировавших с антителом, является показателем того, что антитело с миметиком TPO обладает сходной с TPO активностью.
Кроме того, сходную с TPO активность антитела с миметиком TPO или его терапевтически активного фрагмента можно анализировать с использованием ряда способов in vivo, известных в данной области. Например, уровни продукции тромбоцитов можно измерять у мыши после введения антитела с миметиком TPO или его фрагмента. Повышение продукции тромбоцитов у обработанной мыши, по сравнению с мышью, не получавшей обработки, является указанием на то, что антитело с миметиком TPO или его фрагмент обладают сходной с TPO активностью. Иллюстративные анализы in vivo (например, измерение продукции тромбоцитов у животного и/или исследование действия антитела с миметиком TPO на жизнеспособность животного подвергаемого воздействию радиации) приведены в демонстрационных примерах.
Для терапевтических антител (или фрагментов), содержащих пептиды-миметики эритропоэтина (EPO) сходную с EPO активность антител или фрагментов можно анализировать с использованием анализа формирования эритроидных колоний в костном мозге (см., например, Wrighton et al. (1996) Science 273:458-463); анализа пролиферации клеток эритролейкоза человека (Kitamura et al. (1989) J. Cell Physiol. 140:323-334) и/или анализов фосфорилирования или активации транскрипции, как описано, например, в Witthuhn et al. (1993) Cell 74:227-236. Например, в одном подходящем анализе in vitro используют зависимую от EPO клеточную линию UT-7/EPO, полученную у пациента с острым мегакариобластным лейкозом (см., например, Komatsu et al. (1993) Blood 82(2):456-464). После удаления среды, дополненной rHuEPO, клетки UT-7/EPO претерпевают апоптоз. Однако клетки можно сохранить, если их обработать rHuEPO или агонистом EPO. Таким образом, терапевтическое антитело, содержащее EPO или его терапевтически активный фрагмент, можно приводить в контакт с испытывающими необходимость в компонентах среды клетками UT-7/EPO и можно определять жизнеспособность клеток. Увеличение жизнеспособности испытывающих необходимость в компонентах среды клеток, контактирующих с терапевтическим антителом, по сравнению с жизнеспособностью клеток в отсутствии терапевтического антитела является показателем того, что терапевтическое антитело обладает сходной с EPO активностью.
Фармацевтические композиции
Композиции, содержащие терапевтическое антитело (например, антитело с миметиком TPO) или его терапевтически активный фрагмент, описываемые в настоящем документе, можно получить в качестве фармацевтической композиции, например, для введения индивидууму для повышения продукции тромбоцитов. Фармацевтические композиции в основном включают фармацевтически приемлемый носитель. Как используют в настоящем документе, "фармацевтически приемлемый носитель" относится к любому и всем растворителям, диспергирующим средам, покрытиям, антибактериальным и противогрибковым средствам, средствам придания изотоничности и задерживающим всасывание средствам и т.п., которые физиологически совместимы, и включает их. Композиции могут включать фармацевтически приемлемую соль, например, соль присоединения кислоты или соль присоединения основания (см. например, Berge et al. (1977) J. Pharm. Set 66:1-19).
Композиции можно получить стандартными способами. Фармацевтический состав представляет собой общепринятую область и дополнительно описан, например, в Gennaro (2000) "Remington: The Science and Practice of Pharmacy", 20th Edition, Lippincott, Williams & Wilkins (ISBN: 0683306472); Ansel et al. (1999) "Pharmaceutical Dosage Forms and Drug Delivery Systems", 7th Edition, Lippincott Williams & Wilkins Publishers (ISBN: 0683305727); и Kibbe (2000) "Handbook of Pharmaceutical Excipients American Pharmaceutical Association", 3rd Edition (ISBN: 091733096X). В определенных вариантах осуществления композицию можно получить, например, в виде буферного раствора с подходящей концентрацией и подходящего для хранения при 2-8°C (например, 4°C). В определенных вариантах осуществления композицию можно формулировать для хранения при температуре ниже 0°C (например, -20°C или -80°C). В определенных вариантах осуществления композицию можно формулировать для хранения в течение срока до 2 лет (например, один месяц, два месяца, три месяца, четыре месяца, пять месяцев, шесть месяцев, семь месяцев, восемь месяцев, девять месяцев, 10 месяцев, 11 месяцев, 1 год, 1½ года или 2 года) при 2-8°C (например, 4°C). Таким образом, в определенных вариантах осуществления композиции, описываемые в настоящем документе, являются стабильными при хранении в течение по меньшей мере 1 года при 2-8°C (например, 4°C).
Фармацевтические композиции могут находиться в различных формах. Эти формы включают, например, жидкие, полужидкие и твердые лекарственные формы, такие как жидкие растворы (например, инъецируемые и инфузируемые растворы), дисперсии или суспензии, таблетки, пилюли, порошки, липосомы и суппозитории. Предпочтительная форма частично зависит от назначенного способа введения и терапевтического применения. Например, композиции, содержащие антитело или фрагмент, предназначенные для системной или локальной доставки, могут находиться в форме инъецируемых или инфузируемых растворов. Таким образом, композиции можно формулировать для введения парентеральным способом (например, посредством внутривенной, подкожной, внутрибрюшинной или внутримышечной инъекции). Как используют в настоящем документе, "парентеральное введение", "вводимый парентерально" и другие грамматически эквивалентные фразы относятся к способам введения, отличным от энтерального или местного введения, как правило, посредством инъекции и в качестве неограничивающих примеров включают внутривенную, интраназальную, интраокулярную, легочную, внутримышечную, внутриартериальную, интратекальную, внутрикапсулярную, интраорбитальную, интракардиальную, интрадермальную, внутрибрюшинно, транстрахеальную, подкожную, субкутикулярную, внутрисуставную, подкапсулярную, субарахноидальную, интраспинальную, эпидуральную, интрацеребральную, внутричерепную, внутрикаротидную и внутригрудинную инъекцию и инфузию (см. ниже).
Композиции могут быть получены в виде раствора, микроэмульсии, дисперсии, липосомы или другой упорядоченной структуры, подходящей для стабильного хранения при высокой концентрации. Стерильные инъецируемые растворы можно получать посредством введения антитела (или фрагмента антитела), описываемого в настоящем документе, в требуемом количестве в подходящий растворитель с одним или комбинацией ингредиентов, перечисленных выше, по мере надобности, с последующей стерилизацией фильтрованием. Как правило, дисперсии получают посредством введения антитела или фрагмента, описываемых в настоящем документе, в стерильный носитель, содержащий основную диспергирующую среду и другие необходимые ингредиенты из перечисленных выше. В случае стерильных порошков для получения стерильных инъецируемых растворов способы получения включают вакуумную сушку и лиофилизацию с выходом порошка терапевтического антитела (например, антитела с миметиком TPO) или его терапевтически активного фрагмента, описываемых в настоящем документе, с любым дополнительным желаемым ингредиентом (см. ниже) из его предварительно стерильно профильтрованного раствора. Надлежащую текучесть раствора можно поддерживать, например, посредством использования покрытия, такого как лецитин, посредством поддержания необходимого размера частиц в случае дисперсии и посредством использования поверхностно-активных веществ. Пролонгированное всасывание инъецируемых композиций можно обеспечивать включением в композицию реагента, который задерживает всасывание, например, моностеаратных солей и желатина.
В определенных вариантах осуществления терапевтическое антитело (например, антитело с миметиком TPO) или его терапевтически активный фрагмент могут быть получены с носителем, который будет защищать соединение от быстрого высвобождения, таким как состав с контролируемым высвобождением, включая имплантаты и микроинкапсулированные системы доставки. Можно использовать биологически разлагаемые, биологически совместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, сложные полиортоэфиры и полимолочная кислота. В данной области известно множество способов получения таких составов. См., например, J.R. Robinson (1978) "Sustained and Controlled Release Drug Delivery Systems", Marcel Dekker, Inc., New York.
Нуклеиновые кислоты, кодирующие терапевтические антитела (например, антитела с миметиками TPO) или их терапевтически активные фрагменты можно встраивать в генную конструкцию для применения в качестве составляющей части протокола генотерапии для доставки нуклеиновых кислот, которые можно использовать для экспрессии и продукции антигенов в клетке (см. ниже). Экспрессирующие конструкции таких компонентов можно вводить в любом терапевтически эффективном носителе, например в любом составе или композиции, способным к эффективной доставке составляющего гена в клетки in vivo. Подходы включают вставку рассматриваемого гена в вирусные векторы, включая рекомбинант ретровирусы, аденовирус, аденоассоциированный вирус, лентивирус и вирус простого герпеса-1 (HSV-1), или рекомбинантные бактериальные или эукариотические плазмиды. Вирусные векторы могут трансфицировать клетки напрямую; плазмидную ДНК можно доставлять при помощи, например, катионных липосом (липофектин) или дериватизированных (например, конъюгированных с антителом), конъюгатов с полилизином, грамицидина S, искусственных вирусных оболочек или других таких внутриклеточных носителей, а также прямой инъекции генной конструкции или осаждения CaPO4 (см., например, WO 04/060407), проводимых in vivo. (также см., "Ex vivo Approaches", ниже). Примеры подходящих ретровирусов включают pLJ, pZIP, pWE и pEM, которые известны специалистам в данной области (см., например, Eglitis et al. (1985) Science 230:1395-1398; Danos and Mulligan (1988) Proc. Natl. Acad. Sci. USA 85:6460-6464; Wilson et al. (1988) Proc. Natl. Acad. Sci. USA 85:3014-3018; Armentano et al. (1990) Proc. Natl. Acad. Sci. USA 87:6141-6145; Huber et al. (1991) Proc. Natl. Acad. Sci. USA 88:8039-8043; Ferry et al. (1991) Proc. Natl. Acad. Sci. USA 88:8377-8381; Chowdhury et al. (1991) Science 254:1802-1805; van BeuseChem. et al. (1992) Proc. Natl. Acad. Sci. USA 89:7640-7644; Kay et al. (1992) Human Gene Therapy 3:641-647; Dai et al. (1992) Proc. Natl. Acad. Sci. USA 89:10892-10895; Hwu et al. (1993) J. Immunol. 150:4104-4115; патенты США №№ 4868116 и 4980286; публикации PCT No. W0 89/07136, W0 89/02468, W0 89/05345 и W0 92/07573). В другой вирусной системе доставки генов используют получаемые из аденовирусов векторы (см., например, Berkner et al. (1988) Bio Techniques 6:616; Rosenfeld et al. (1991) Science 252:431-434; и Rosenfeld et al. (1992) Cell 68:143-155). Подходящие аденовирусные векторы, получаемые из штамма аденовируса Ad типа 5 d1324 или других штаммов аденовируса (например, Ad2, Ad3, Ad7 и т.д.), известны специалистам в данной области. Еще одна вирусная векторная система, пригодная для доставки рассматриваемого гена, представляет собой аденоассоциированный вирус (AAV). См., например, Flotte et al. (1992) Am. J. Respir. Cell Mol. Biol. 7:349-356; Samulski et al. (1989) J. Virol. 63:3822-3828; и McLaughlin et al. (1989) J. Virol. 62:1963-1973.
В определенных вариантах осуществления антитело с миметиком TPO или его терапевтически активный фрагмент, можно ввести в состав c одним или несколькими дополнительными активными средствами, подходящими для повышения продукции тромбоцитов у индивидуума. Дополнительные средства для повышения продукции тромбоцитов у индивидуума в качестве неограничивающих примеров включают промакту (Promacta®)/револад (Revolade®) (элтромбопаг; GlaxoSmithKline), энплат (Nplate™) (ромиплостим; Amgen, Inc.) и ньюмегу (Neumega®) (опрелвекин; rhIL-11, Genetics Institute, Inc.). В определенных вариантах осуществления антитело с миметиком TPO или его терапевтически активный фрагмент можно формулировать с одним или несколькими дополнительными активными средствами, подходящими для лечения анемии или нейтропении, включая, например, стимулирующее эритропоэз средство (ESA) или ньюласту (Neulasta™) (пэгфилграстим; Amgen, Inc.). ESA в качестве неограничивающих примеров включают, прокрит (Procrit®) (эпоэтин альфа; Ortho Biotech), эпоген (Epogen®) (эпоэтин альфа; Amgen, Inc.) и аранесп (Aranesp®) (дарбэпоэтин альфа; Amgen, Inc.).
В определенных вариантах осуществления антитело с миметиком TPO или его терапевтически активный фрагмент, можно формулировать с одним или несколькими дополнительными средствами, пригодными для лечения симптомов воздействия радиации. Например, антитело или фрагмент с миметиком TPO можно формулировать с антибиотиком, анестетиком, противорвотным средством, стероидом (например, андростендиолом, таким как 4-андростендиол или 5-андростендиол), хелатирующим средством, и стволовой клеткой. Подходящие противорвотные средства в качестве неограничивающих примеров включают, антагонист рецептора 5-HT3, антагонист дофамина и каннабиноиды. См., например, Donnerer j. (2003) "Antiemetic Therapy", Karger Publishers (ISBN 3805575475). Состав с хелатирующими средствами может быть пригоден в вариантах осуществления, где индивидуум, подвергаемый лечению, представляет собой индивидуума, на которого воздействуют таким радионуклидом, как цезий-137 или таллий-201. Подходящие хелатирующие средства включают, например, Ca-DTPA, Zn-DTPA, радиогардазу (Radiogardase™) (также обозначаемую как "прусская лазурь"), дефероксимин и пеницилламин. В определенных вариантах осуществления антитело с миметиком TPO или его фрагмент можно формулировать с замещающим радионуклиды средством, в качестве неограничивающих примеров, таким как йодид калия или кальциевая соль. В определенных вариантах осуществления антитело с миметиком TPO или его фрагмент можно формулировать со средством для стимуляции выделения радиоактивного изотопа у индивидуума. Например, антитело или фрагмент можно формулировать с диуретиком.
В определенных вариантах осуществления, например, где сниженное количество тромбоцитов у индивидуума является результатом инфекции (например, связанной с инфекцией тромботической тромбоцитопенической пурпуры или DIC), антитело или его фрагмент можно формулировать с одним или несколькими средствами для применения для лечения инфекции (например, бактериальной инфекции или инфекции вирусом, таким как ВИЧ). Например, антитело или фрагмент можно формулировать с антибиотиком или противовирусным средством. Антибиотик будет изменяться в зависимости от типа инфекции, но может включать, например, пенициллин, эритромицин, кларитромицин или доксициклин. Подобным образом, противовирусные средства будут изменяться в зависимости от типа инфекции. Например, противовирусные средства, пригодные для лечения инфекции ВИЧ, включают, например, ингибиторы протеазы ВИЧ, ингибиторы интегразы ВИЧ, ингибиторы обратной транскриптазы ВИЧ или средства, ингибирующие связывание и/или вхождение ВИЧ в клетку.
Если терапевтическое антитело (например, антитело с миметиком TPO) или его терапевтически активный фрагмент необходимо использовать в комбинации со вторым активным средством, средства можно формулировать раздельно или совместно. Например, соответствующие фармацевтические композиции можно смешивать, например, непосредственно перед введением и вводить совместно или каждую композицию можно вводить раздельно, например, в одно и то же или различные моменты времени (см. ниже).
Как описано выше, композицию можно получить так, чтобы она содержала терапевтически эффективное количество (например, увеличивающее продукцию тромбоцитов количество) терапевтического антитела или его терапевтически активного фрагмента, или композицию можно формулировать с включением субтерапевтического количества антитела и субтерапевтического количества одного или нескольких дополнительных активных средств так, чтобы компоненты в совокупности являлись терапевтически эффективными (например, терапевтически эффективными для лечения индивидуума от воздействия радиации или повышения продукции тромбоцитов у индивидуума). Например, композиция может содержать субтерапевтическое количество каждого из антитела с миметиком TPO и элтромбопага так, что количество обоих средств в совокупности является терапевтически эффективным для индивидуума. Способы определения терапевтически эффективной дозы известны в данной области, и они описаны в настоящем документе.
Способы лечения
В зависимости от конкретного терапевтического пептида описанные выше композиции в числе прочего могут использоваться в ряде способов лечения. Например, антитела с миметиками TPO пригодны в способах повышения продукции тромбоцитов у нуждающегося в этом индивидуума (например, человека). Композиции можно вводить индивидууму, например, человеку, рядом способов, которые частично зависят от пути введения. Путь может представлять собой, например, внутривенную инъекцию или инфузию (в/в), подкожную инъекцию (п/к), интраперитонеальную (и/п) или внутримышечную инъекцию.
Введение можно проводить, например, посредством местной инфузии, инъекции или посредством имплантата. Имплантат может представлять собой пористый или непористый или гелеобразный материал, включая мембраны, такие как сиаластовые мембраны или волокно. Имплантат можно конфигурировать для пролонгированного или периодического высвобождения композиции индивидууму. (см., например, патентную публикацию США № 20080241223; патенты США №№ 5501856; 4863457 и 3710795; EP 488401 и EP 430539, описания которых в полном объеме включены в настоящий документ в качестве ссылки). Композицию можно доставлять индивидууму посредством имплантируемого устройства, например, на основе диффузионных, эродируемых или конвекционных систем, например, осмотических насосов, биологически разлагаемых имплантатов, электродиффузионных систем, электроосмотических систем, насосов с паровым давлением, электролитических насосов, насосов с бурным выделением газа, пьезоэлектрических насосов, основанных на эрозии систем или электромеханических систем.
Подходящая доза терапевтического антитела (например, антитела с миметиком TPO) или его терапевтически активного фрагмента (например, доза, способна повысить продукцию тромбоцитов у индивидуума) может зависеть от ряда факторов, включая, например, возраст, пол и массу индивидуума, подвергаемого лечению, и конкретное используемое терапевтическое антитело. Например, для повышения продукции тромбоцитов у индивидуума может требоваться отличная доза антитела с миметиком TPO по сравнению с дозой фрагмента антитела с миметиком TPO, требуемой для лечения того же индивидуума. Другие факторы, влияющие на дозу антитела с миметиком TPO, вводимую индивидууму, включают, например, причину сниженных уровней тромбоцитов у индивидуума или тяжесть уменьшения количества тромбоцитов. Например, индивидууму с идиопатической тромбоцитопенической пурпурой (ITP) может требоваться введение отличной дозы антитела с миметиком TPO (или фрагмент), по сравнению с индивидуумом, страдающим от индуцированной радиацией тромбоцитопении. Другие факторы, влияющие на дозу конкретного терапевтического антитела (или фрагмента), могут включать, например, другие заболевания одновременно или ранее поражающие индивидуума, общее состояние здоровья индивидуума, генетическую предрасположенность индивидуума, диету, время введения, скорость выведения, комбинацию лекарственных средств и любые другие терапевтические средства, которые вводят индивидууму. Также следует понимать, что конкретная доза и схема лечения для любого конкретного индивидуума будет зависеть от решения лечащего практикующего медицинского работника (например, врача или медицинской сестры).
Терапевтическое антитело (например, антитело с миметиком TPO) или фрагмент можно вводить в виде фиксированной дозы или в дозе в виде микрограмм на килограмм (мкг/кг) или миллиграмм на килограмм (мг/кг). В определенных вариантах осуществления дозу можно выбирать для дальнейшего снижения или во избежание продукции антител или другого иммунного ответа хозяина на один или несколько активных средств в композиции. Хотя никоим образом не предназначаясь для ограничения, иллюстративные дозы антитела или его фрагмента, описываемых в настоящем документе, включают, например, 1-100 мкг/кг, 0,5-50 мкг/кг, 0,1-100 мкг/кг, 0,5-25 мкг/кг, 1-20 мкг/кг и 1-10 мкг/кг, 1-100 мг/кг, 0,5-50 мг/кг, 0,1-100 мг/кг, 0,5-25 мг/кг, 1-20 мг/кг и 1-10 мг/кг. Иллюстративные дозы терапевтического антитела (например, антитела с миметиком TPO) в качестве неограничивающих примеров включают, 0,1 мкг/кг, 0,5 мкг/кг, 1,0 мкг/кг, 2,0 мкг/кг, 4 мкг/кг и 8 мкг/кг, 0,1 мг/кг, 0,5 мг/кг, 1,0 мг/кг, 2,0 мг/кг, 4 мг/кг и 8 мг/кг.
Фармацевтическая композиция может содержать терапевтически эффективное количество терапевтического антитела (например, антитела с миметиком TPO) или его терапевтически активного фрагмента. Такие эффективные количества может легко определить специалист в данной области частично на основе действия введенного антитела (или фрагмента) или комбинаторного действия антитела и одного или нескольких дополнительных активных средств, если применяют более одного средства. Терапевтически эффективное количество терапевтического антитела (например, антитела с миметиком TPO) или его фрагмента также может изменяться в зависимости от таких факторов, как состояние болезни, возраст, пол и масса индивидуума и способности антител (и одного или нескольких дополнительных активных средств) вызывать желаемый ответ у индивидуума, например, повышение продукции тромбоцитов у индивидуума. Например, терапевтически эффективное количество антитела с миметиком TPO или его фрагмента может увеличивать продукцию тромбоцитов у индивидуума и, таким образом, может, например, препятствовать (снижать тяжесть или устранять возникновение) снижению и/или предотвращать снижение количества тромбоцитов после воздействия радиации или химиотерапии. Терапевтически эффективное количество терапевтического антитела также представляет собой количество, при котором любые токсические или неблагоприятные эффекты композиции перевешиваются терапевтически положительным воздействием.
Термины "терапевтически эффективное количество" или "терапевтически эффективная доза" или сходные термины, используемые в настоящем документе, предназначены для обозначения количества средства (например, терапевтического антитела или фрагмента, описываемых в настоящем документе), вызывающего желаемый биологический или медицинский ответ (например, повышение продукции тромбоцитов у индивидуума). В определенных вариантах осуществления композиция, описываемая в настоящем документе, содержит терапевтически эффективное количество терапевтического антитела (например, антитела с миметиком TPO) или его фрагмента. В определенных вариантах осуществления композиция содержит терапевтическое антитело (например, антитело с миметиком TPO) или его фрагмент, и один или несколько (например, три, четыре, пять, шесть, семь, восемь, девять, 10 или 11 или более) дополнительных терапевтических средств так, что композиция как целое является терапевтически эффективной. Например, композиция может содержать антитело с миметиком TPO и элтромбопаг, где каждое из антитела и низкомолекулярного соединения находятся в концентрациях, которые при комбинации являются терапевтически эффективными.
Токсичность и терапевтическую эффективность таких композиций можно определять известными фармацевтическими способами в клеточных культурах или у экспериментальных животных. Эти способы можно использовать, например, для определения LD50 (дозы, летальной для 50% группы) и ED50 (дозы, терапевтически эффективной у 50% группы). Отношение доз токсического и терапевтического эффектов представляет собой терапевтический индекс, и его можно выражать в виде отношения LD50/ED50. Композиции терапевтических антител (например, антител с миметиками TPO) или их терапевтически активных фрагментов, которые демонстрируют высокие терапевтические индексы, являются предпочтительными. Хотя можно использовать композиции, демонстрирующие побочные токсические эффекты, необходимо проявлять осторожность при разработке системы доставки, направляющей такие соединения к участку пораженной ткани, и для минимизации потенциального повреждения нормальных клеток и, таким образом, снижения побочных эффектов.
В данной области известны модели на животных, подходящие для анализа токсичности и/или терапевтической эффективности терапевтических антител или терапевтически активных фрагментов, описываемых в настоящем документе. Такие модели, конечно, изменяются частично на основе биологической активности конкретного терапевтического пептида, находящегося в антителе или фрагменте. Например, подходящие модели на животных (например, модели на мышах и не являющихся человеком приматах) для анализа терапевтической эффективности антитела с миметиком TPO или его терапевтически активного фрагмента, известны в данной области, как описано, например, в Thomas et al. (1996) Stem Cells 14:244; Winton et al. (1995) Experimental Hematology 23:486; Neelis et al. (1998) Blood 92(5):1586-1597; и Mouthon et al. (1999) Int. J. Radiat. Oncol. Biol. Phys. 43(4):867-875. Кроме того, модели на животных, подходящие для анализа токсичности и/или терапевтической эффективности антител с миметиками TPO проиллюстрированы в демонстрационных примерах.
Данные, полученные на основе анализов клеточных культур и исследований на животных можно использовать для формулирования диапазона доз для применения у людей. Подходящие модели на животных для применения в оценке композиций (например, антител с миметиками TPO или фрагментов, содержащихся в них) известны в данной области и проиллюстрированы в демонстрационных примерах. Доза таких терапевтических антител (например, антител с миметиками TPO) или фрагментов, как правило, находится в диапазоне циркулирующих концентраций антител, который включает ED50 с небольшой или отсутствующей токсичностью. В зависимости от применяемой лекарственной формы и используемого пути введения доза может изменяться в пределах этого диапазона. Для терапевтического антитела (например, антитела с миметиком TPO) или его терапевтически активного фрагмента, применяемых, как описано в настоящем документе (например, для повышения продукции тромбоцитов у индивидуума), терапевтически эффективную дозу начально можно оценить на основе анализов клеточных культур. Дозу можно формулировать в моделях на животных с достижением диапазона циркулирующих концентраций в плазме, включающего IC50 (т.е., концентрацию тестируемого соединения, достигающую половины максимального ингибирования симптомов), как определено в клеточной культуре. Такую информацию можно использовать для более точного определения пригодных доз у людей. Уровни в плазме можно определять, например, с помощью высокоэффективной жидкостной хроматографии. Подходящие дозы терапевтических антител для человека можно дополнительно оценивать, например, в исследованиях с увеличением дозы фазы I. См., например, van Gurp et al. (2008) Am. J. Transplantation 8(8):1711-1718; Hanouska et al. (2007) Clin. Cancer Res. 13(2, part 1):523-531; и Hetherington et al. (2006) Antimicrobial Agents and Chemotherapy 50(10): 3499-3500.
Как описано выше, необходимую дозу антитела с миметиком TPO или его терапевтически активного фрагмента можно определять частично на основе количества тромбоцитов в крови индивидуума. Например, индивидууму с меньшим количеством тромбоцитов может требоваться большая доза антитела с миметиком TPO, чем индивидууму с большим количеством тромбоцитов.
Любые из способов, описываемых в настоящем документе, которые включают использование антител с миметиками TPO или их терапевтически активных фрагментов, могут включать мониторинг количества тромбоцитов после введения композиции, содержащей антитело с миметиком TPO или его фрагмент. Когда композиция предназначена для введения в сочетании с химиотерапевтической или радиотерапевтической схемой лечения, мониторинг можно производить перед, во время и/или после применения химиотерапевтической или радиотерапевтической схемы лечения.
Способы определения количества тромбоцитов в полученном у индивидуума образце крови хорошо известны в области медицины и описаны, например, в Sallah et al. (1998) Postgraduate Medicine 103:209-210; Kottke-Marchant (1994) Hematol Oncol Clin North Am. 8:809-853; Redei et al. (1995) J. Crit Illn 10:133-137; Butkiewicz et al. (2006) Thrombosis Research 118(2):199-204; Tomita et al. (2000) Am J. Hematol 63(3): 131-135; и Schrezenmeier et al. (1998) Br J. Haematol 100(3):571-576.
Следует понимать, что практикующий медицинский работник на основе мониторинга уровней тромбоцитов у индивидуума в реальном времени может решить изменить количество дозы, частоты дозы или пути введения композиции.
Как используют в настоящем документе, "индивидуум" может представлять собой любое млекопитающее. Например, индивидуум может представлять собой человека, не являющегося человеком примата (например, мартышку, павиана или шимпанзе), лошадь, корову, свинью, овцу, козу, собаку, кошку, кролика, морскую свинку, песчанку, хомяка, крысу или мышь. В определенных вариантах осуществления индивидуум представляет собой ребенка (например, ребенка человека).
Как используют в настоящем документе, индивидуум "нуждающийся в предотвращении", "нуждающийся в лечении", или "нуждающегося в этом", относится к индивидууму, который по решению соответствующего практикующего медицинского работника (например, врача, медицинской сестры или фельдшера в случае людей; ветеринарного врача в случае не являющихся человеком млекопитающих), может обосновано получить пользу от назначаемого лечения (такого как лечение терапевтическим антителом, таким как антитело с миметиком TPO). Например, индивидуум с нарушением, связанным с недостаточными уровнями тромбоцитов (со связанным с тромбоцитопенией заболеванием) может представлять собой индивидуума, нуждающегося в лечении антителом с миметиком TPO или его фрагментом, описываемыми в настоящем документе.
Таким образом, антитело с миметиком TPO или его терапевтически активный фрагмент можно вводить индивидууму с нарушением, связанным с недостаточным количеством тромбоцитов (с тромбоцитопенией). Такие нарушения хорошо известны в области медицины и в качестве неограничивающих примеров включают синдром Бернара-Сулье, идиопатическую тромбоцитопеническую пурпуру (ITP), синдром Вискотта-Олдрича, спленомегалию, тромботические микроангиопатии, диссеминированное внутрисосудистое свертывание (DIC), апластическую анемию, гемолитический уремический синдром (HUS; типичный или атипичный), катастрофический антифосфолипидный синдром (CAPS), неонатальную аллоиммунную ITP, посттрансфузионную пурпуру, пароксизмальную ночную гемоглобинурию, уремию, болезнь фон Виллебранда, вариант болезни фон Виллебранда, тромбастению Гланцманна, TTP, волчанку и недостаток витаминов. Нарушения также включают индуцированную радиацией тромбоцитопению (см. ниже) и индуцированную лекарственными средствами тромбоцитопению (DIT; также обозначаемую как "индуцированная лекарственными средствами тромбоцитарная недостаточность"), в качестве неограничивающих примеров такую как тромбоцитопению, индуцированную гепарином, производными алкалоидами хинного дерева (хинином и хинидином), пенициллином, сульфаниламидами, нестероидными противовоспалительными лекарственными средствами (NSAID), противосудорожными средствами, антиревматическими и пероральными антидиабетическими лекарственными средствами, солями золота, диуретиками, рифампицином, интерфероном гамма, рибаварином и ранитидином. См., например, Chong et al. (1991) Blood 77:2190-2199; Curtis et al. (1994) Blood S4:176-183; Gentilini et al. (1998) Blood 92:2359-2365; Burgess et al. (2000) Blood 95:1988-1992; van de Bemt et al. (2004) Drug Saf. 27:1243-1252; Aster and Bougie (2007) New Ens. J. Med. 357(6):580-587; George et al. (1998) Ann. Intern. Med. 129(ll):886-890; и Li et al. (2007) Drug Saf. 30(2):185-186, описание каждого из которых в полном объеме включено в настоящий документ в качестве ссылки. DIT может быть результатом лечения ряда состояний, в качестве неограничивающих примеров, таких как, неоплазия, миелодиспластический синдром и определенные вирусные инфекции, такие как инфекции ВИЧ и вирусом гепатита. Например, ниже дополнительно подробно описана DIT, связанная с химиотерапевтическими схемами лечения.
Антитело с миметиком TPO или его фрагмент также можно вводить пациенту в сочетании с химиотерапевтической или радиотерапевтической схемой лечения. Вследствие миелосупрессивного действия химиотерапии или лучевой терапии у пациентов, получающих это лечение, могут развиться тяжелые нейтропения и тромбоцитопения, которые потенциально являются опасными для жизни вследствие риска кровотечения. Тромбоцитопения часто может ограничивать возможности практикующих медицинских работников (например, онкологов), например, для увеличения доз при химиотерапии и/или продолжения химиотерапевтической схемы лечения, что в свою очередь препятствует или снижает вероятность ремиссии злокачественной опухоли или лечению пациентов со злокачественной опухолью. См., например, Neelis et al. (1997) Blood 90(7):2565-2573; Allen et al. (2004) "Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems", Lippincott Williams & Wilkins (ISBN 0781746124); Beutler (1993) Blood 81:1411; и Niremburg (2003) Cancer Nurs. 26(6):32S-37S. Таким образом, антитела с миметиками TPO или их терапевтически активные фрагменты могут использовать практикующие медицинские работники для ускорения восстановления тромбоцитов в сочетании с радиотерапевтической схемой лечения или химиотерапевтической схемой лечения (см. ниже). Как описано выше и проиллюстрировано в демонстрационных примерах, антитела с миметиками TPO, описываемые в настоящем документе, являются высокоэффективными в повышении общих уровней тромбоцитов у животного. Антитела с миметиками TPO также эффективны в быстром восстановлении сниженных уровней тромбоцитов у животного. Таким образом, антитела с миметиками TPO или фрагменты, описываемые в настоящем документе, при введении индивидууму со злокачественной опухолью могут позволять практикующему медицинскому работнику вводить более мощную дозу или более частое дозирование индивидууму при химиотерапии или лучевой терапии, чем было бы безопасно в отсутствии антитела с миметиком TPO (или фрагмента). Как использовано в приведенном выше контексте, "безопасный" или "безопасно возможный" относится к определению практикующим медицинским работником уровня тромбоцитов у индивидуума, которого достаточно для начала применения терапевтически эффективной химиотерапевтической или радиотерапевтической схема лечения у индивидуума.
Таким образом, антитело или фрагмент с миметиком TPO можно вводить индивидууму перед, во время, и/или после проведения химиотерапевтической схемы лечения или радиотерапевтической схемы лечения. Как описано выше, индивидуумы, нуждающиеся в химиотерапевтической или радиотерапевтической схеме лечения, включают индивидуумов со злокачественной опухолью. Например, индивидуумы могут страдать злокачественной опухолью, выбранной из группы, состоящей из рака легких, рака молочной железы, рака толстого кишечника, рака поджелудочной железы, злокачественной опухоли почки, рака желудка, рака печени, злокачественной опухоли кости, гематологической злокачественной опухоли, злокачественной опухоли нервной ткани, меланомы, рака щитовидной железы, рака яичников, рака яичка, рака предстательной железы, рака шейки матки, рака влагалища и рака мочевого пузыря.
Индивидуумы, нуждающиеся в химиотерапевтической или радиотерапевтической схеме лечения, также включают индивидуумов с воспалительным или аутоиммунным нарушением, определенными неврологическими нарушениями или определенными вирусными или грибковыми инфекциями. Воспалительные нарушения могут включать, например, остеоартрит, ревматоидный артрит (RA), спондилоартропатии, синдром POEMS, воспалительные заболевания кишечника (например, болезнь Крона или язвенный колит), многоочаговую болезнь Кастлмана, системную красную волчанку (SLE), синдром Гудпасчера, рассеянный склероз (MS), ревматическую полимиалгию, миодистрофию (MD), полимиозит, дерматомиозит, воспалительные нейропатии, такие как синдром Гийена-Барре, васкулит, так как гранулематоз Вегенера, узелковый периартериит, ревматическую полимиалгию, височный артериит, синдром Шегрена, болезнь Бехчета, синдром Черджа-Строса или артериит Такаясу.
В качестве части химиотерапевтической схемы лечения можно включать различные цитотоксические лекарственные средства. Конкретное цитотоксическое средство или комбинация средств может зависить, например, от типа злокачественной опухоли и тяжести злокачественной опухоли, которую необходимо лечить. Например, индивидууму можно вводить одно или несколько из любых из ряда цитотоксических лекарственных средств, включая, без ограничения, циклофосфамид, таксол, метотрексат, азотистый иприт, азатиоприн, хлорамбуцил, фторурацил, цисплатин, нокодазол, гидроксимочевину, винкристин, винбластин, этопозид, доксорубицин, блеомицин, карбоплатин, гемцитабин, паклитаксел, топотекан, тиогуанин, терапевтический аналог любого из указанного выше и любые другие соединения, для которых известно, что они приводят к снижению количества тромбоцитов (или сниженной продукции тромбоцитов) у индивидуума.
Лучевая терапия может включать, например, наружную дистанционную лучевую терапию (EBRT или XBRT), близкофокусную лучевую терапию (или лучевая терапия с экранированным источником) и лучевую терапию с неэкранированным источником, где различием является положение источника радиации. "Дистанционная" относится к источнику терапевтической радиации, находящемуся вне организма, тогда как лучевая терапия с экранированным и неэкранированным источником включает радиоактивное вещество, вводимое индивидууму внутрь. Тип радиации может представлять собой, например, рентгеновское излучение или гамма-радиацию. В определенных вариантах осуществления лучевая терапия включает лучевую терапию пучком протонов. "Внутреннюю" лучевую терапию можно проводить индивидууму с помощью инфузии или приема внутрь. Например, для лечения нейробластомы можно использовать инфузию мета-йодобензилгуанидина (MIBG). Для лечения рака щитовидной железы или тиреотоксикоза можно перорально вводить йод-131. Для лечения нейроэндокринных опухолей можно использовать гормоны, конъюгированные с лютецием-177 или иттрием-90. Также с радионуклидами для использования в лучевой терапии можно конъюгировать терапевтические антитела. Например, неходжкинскую лимфому можно лечить с применением ибритумомаба тиуксетана (зевалина®), антитела против CD20, конъюгированного с иттрием-90 и тозитумомаба с йодом-131 (бексара®), антитела против CD20, конъюгированного с йодом-131.
В определенных вариантах осуществления антитело с миметиком TPO или его фрагмент можно вводить индивидууму, которому проводили или которому вскоре будет проведена трансплантация костного мозга, хирургическая операция и/или аутологичное переливание крови.
Антитело с миметиком TPO или его терапевтически активный фрагмент, описываемые в настоящем документе, можно использовать для лечения индивидуума от воздействия радиации. В определенных вариантах осуществления антитело с миметиком TPO или его фрагмент можно вводить индивидууму после воздействия радиации. В определенных вариантах осуществления антитело с миметиком TPO или его фрагмент можно вводить индивидууму, который вероятно будет подвергнут воздействию радиации. Как описано выше, индивидуум, который вероятно будет подвергнут воздействию радиации, может представлять собой, например: индивидуума, у которого диагностирована злокачественная опухоль и который вероятно будет подвергнут химиотерапии или лучевой терапии; индивидуума, которому вероятно проведут трансплантацию костного мозга; или индивидуума, которого вероятно подвергнут хирургической операции. Индивидуум, который вероятно будет подвергнут воздействию радиации, также может представлять собой индивидуума который работает на предприятии, где перерабатывают или используют радиоактивные вещества, или рядом с ним. Например, индивидуум может представлять собой индивидуума, работающего на атомной электростанции или на предприятии для хранения ядерных отходов или рядом с ними.
Также в данной области известны подходящие способы для определения количества радиации, воздействию которой подвергся индивидуум. Если индивидуум во время воздействия радиации носил монитор и/или если практикующий врач вводит известную терапевтически эффективную дозу радиации, расчеты воздействия в значительной степени упрощаются. В отсутствии монитора практикующим медицинским работникам может требоваться информация о воздействии, такая как интенсивность и тип радиации, длительность воздействия и расстояние от источника. Клинически для установления исходного гематологического уровня можно использовать немедленный клинический анализ крови с подсчетом форменных элементов. Изменения количеств лейкоцитов и тромбоцитов происходят в течение периода от нескольких суток до недель. Тяжесть этих изменений также можно использовать для приблизительного определения воздействия. Например, общее радиоактивное облучение организма более 100 Рад (1 Грей) может приводить к снижению уровня циркулирующих лимфоцитов. Это снижение можно наблюдать в первые 24 часа после воздействия. Так как степень снижения пропорциональна тяжести воздействия, лимфоциты можно использовать в качестве биологического дозиметра.
Принимая во внимание эффективность антител с миметиками TPO и терапевтически активных фрагментов, описываемых в настоящем документе, их можно вводить индивидууму в виде однократной дозы. (См. демонстрационные примеры). Эффективность терапии с однократной дозой с использованием пептидов-миметиков TPO у людей описана, например, в Wang et al. (2004) Clin Pharm Ther 76:628-638 и Kuter et al. (2009) Annu Rev Med 60:33.1I-33.14I (опубликованной онлайн перед печатью 31 октября 2008 года).
В определенных вариантах осуществления антитела с миметиками TPO или фрагменты можно вводить индивидууму в виде более одной (например, двух, трех, четырех, пятя, шести, семи, восьми, девяти, 10 или 15 или более) дозы. В вариантах осуществления с несколькими дозами, дозирование можно осуществлять, например, ежедневно, один раз каждые двое суток, дважды в неделю, раз в неделю, раз в две недели или раз в месяц. Например, индивидууму можно вводить антитело с миметиком TPO один раз в сутки в течение по меньшей мере пяти суток. В другом примере индивидууму можно вводить антитело с миметиком TPO один раз в сутки в течение тех суток. Как описано выше, введение можно осуществлять перед, во время и/или после воздействия снижающего количество тромбоцитов события, такого как воздействие радиации или химиотерапия. Например, в определенных вариантах осуществления индивидууму можно вводить однократную дозу миметика TPO или его фрагмента, приблизительно раз в сутки (например, приблизительно за 20 часов, приблизительно за 24 часа или приблизительно за 30 часов) до воздействия радиации или применения химиотерапевтической схемы лечения.
В определенных вариантах осуществления индивидууму можно вводить антитело с миметиком TPO или его терапевтически активный фрагмент менее одного (1) раза в сутки (например, менее чем за 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, девять, восемь, семь, шесть, пять, четыре, три, два, один или менее чем один час) до или после воздействия радиации (например, радиотерапевтической схемы лечения) или применения химиотерапевтической схемы лечения. Например, индивидууму можно вводить однократную дозу антитела с миметиком TPO или его терапевтически активного фрагмента за 6 или 12 часов до воздействия радиации. В другом примере, индивидууму можно вводить однократную дозу антитела с миметиком TPO или его терапевтически активного фрагмента через 6, 12 или 24 часа после воздействия радиации.
В определенных вариантах осуществления антитело с миметиком TPO или его терапевтически активный фрагмент, описываемые в настоящем документе, можно подкожно вводить человеку раз в неделю в течение шести (6) последовательных недель при дозе по меньшей мере 3 (например, по меньшей мере 4, 5, 6, 7, 8, 9 или 10) мкг/кг индивидуума. См., например, Bussel et al. (2006) N. Engl. J. Med. 355:1672-1681. В определенных вариантах осуществления антитело с миметиком TPO или его терапевтически активный фрагмент, описываемые в настоящем документе, можно подкожно вводить человеку раз в неделю в течение двух (2) последовательных недель при дозе по меньшей мере от 0,2 до 10 мкг/кг индивидуума (см., например, Wang et al. (2004), выше). В определенных вариантах осуществления антитело с миметиком TPO или терапевтически активный фрагмент, описываемые в настоящем документе, можно внутривенно вводить человеку при дозе приблизительно от 0,3 до 10 (например, приблизительно от 0,5 до 5, от 1,0 до 10, от 2,0 до 5, от 6 до 10, от 6 до 8, от 9 до 10, от 1 до 4, от 2 до 4, от 0,3 до 1,0, от 0,3 до 3, от 0,5 до 2 или от 0,7 до 7) мкг/кг индивидуума. См., например, Wang et al. (2004), выше.
Подобным образом любое терапевтическое антитело или его терапевтически активный фрагмент можно вводить в виде однократной дозы. В определенных вариантах осуществления терапевтические антитела или их фрагменты можно вводить индивидууму в виде более одной (например, двух, трех, четырех, пяти, шести, семи, восьми, девяти, 10 или 15 или более) дозы. В вариантах осуществления с несколькими дозами дозирование можно проводить, например, ежедневно, один раз каждые двое суток, дважды в неделю, раз в неделю, раз в две недели или раз в месяц.
В определенных вариантах осуществления конкретный режим дозирования можно изменять, например, если выявлено, что терапевтическое антитело вызывает иммунный ответ у индивидуума, получающего лечение. Фактически, врач, медицинская сестра или другой правомочный практикующий медицинский работник может проводить мониторинг у индивидуума, получающего лечение, на образование антител, которые специфически связываются с терапевтическим антителом и/или ингибируют его терапевтическую активность. В таком случае, практикующий медицинский работник может принять решение об остановке введения терапевтического антитела индивидууму и/или принять решение о введении индивидууму другого терапевтического антитела. Например, если выявлено, что у индивидуума, получающего лечение, образуются антитела, связывающиеся с конкретным пептидом-миметиком TPO в первом антителе с миметиком TPO, практикующий медицинский работник может принять решение (когда реагенты доступны) о введении индивидууму другого антитела с миметиком TPO, которое содержит другой миметик TPO, для которого не ожидают связывания антител индивидуума. В другом примере, если выявлено, что у индивидуума, получающего лечение, образуются антитела, связывающиеся с эпитопом конкретного поддерживающего антитела первого антитела с миметиком TPO, практикующий медицинский работник может принять решение (когда реагенты доступны) о введении индивидууму другого антитела с миметиком TPO, которое сконструировано на основе другого поддерживающего антитела, для которого не ожидают связывания антител индивидуума. Способы определения образования у индивидуума (например, человека) нейтрализующих антител, которые связывают терапевтическое антитело и ингибируют его активность, известны в данной области и описаны, например, в Welt et al. (2003) Clin. Cancer. Res. 9(4):1338-46; Szolar et al. J. Pharm. Biomed. Anal. 41(4):1347-1353; и Lofgren et al. (2007) J. Immunol. 178(11):7467-7472.
В определенных вариантах осуществления терапевтическое антитело (например, антитело с миметиком TPO) или его терапевтически активный фрагмент можно вводить индивидууму в виде монотерапии. Альтернативно, как описано выше, антитело или фрагмент можно вводить индивидууму в виде комбинированного лечения с другим лекарственным средством, например, другим лекарственным средством для повышения продукции тромбоцитов у индивидуума или для лечения индивидуума от воздействия радиации. Например, комбинированное лечение может включать введение индивидууму (например, пациенту-человеку) одного или нескольких дополнительных средств (например, элтромбопага, опрелвекина или ромиплостима), обеспечивающих индивидууму, при необходимости, терапевтическую пользу. В определенных вариантах осуществления терапевтическое антитело (например, антитело с миметиком TPO) или его терапевтически активный фрагмент и одно или несколько дополнительных активных средств вводят в одно и то же время. В других вариантах осуществления антитело или фрагмент вводят первыми по времени, а одно или несколько дополнительных активных средств вводят вторыми по времени. В определенных вариантах осуществления одно или несколько дополнительных активных средства вводят первыми по времени, и антитело или фрагмент вводят вторыми по времени.
Терапевтическое антитело (например, антитело с миметиком TPO) или его терапевтически активный фрагмент может заменять или дополнять ранее или на текущий момент проводимую терапию. Например, при лечении антителом с миметиком TPO или его терапевтически активным фрагментом введение одного или нескольких дополнительных активных средств (например, элтромбопага, опрелвекина или ромиплостима) можно прекращать или снижать, например, вводить на более низких уровнях. В определенных вариантах осуществления проведение предшествующей терапии сохраняют. В определенных вариантах осуществления предшествующую терапию сохраняют до того, как уровень терапевтического антитела или его терапевтически активного фрагмента достигнет уровня, достаточного для обеспечения терапевтического эффекта. Два вида терапии можно проводить в комбинации.
Как описано выше, в определенных вариантах осуществления у индивидуума после лечения можно проводить мониторинг повышения продукции тромбоцитов (или повышения уровней тромбоцитов). В определенных вариантах осуществления у индивидуума мониторинг улучшения можно проводить по одному или нескольким симптомам воздействия радиации после лечения антителом с миметиком TPO или его фрагментом. Такие симптомы изменяются в соответствии с типом радиации, воздействию которой подвергается индивидуум, дозы радиации и участка воздействия. Симптомы известны в данной области и включают, например, беспокойство, боль, боль в горле, желудочно-кишечные расстройства (рвоту и/или диарею), выпадение волос, потерю аппетита, ожоги и кровотечение. Как определено в настоящем документе, мониторинг улучшения при нарушении, связанном с недостаточными количествами тромбоцитов у индивидуума (например, у пациента-человека), означает оценку изменения в параметрах заболевания, например, улучшения по одному или нескольким симптомам нарушения, у индивидуума. Такие симптомы изменяются в зависимости от конкретного нарушения, но хорошо известны в области медицины. См., например, Harker and Zimmerman (1983) "Platelet Disorders", Saunders, 360 pages; и Gresele et al. (2002) "Platelets in Thrombotic and Non-thrombotic Disorders: Pathophysiology, Pharmacology and Therapeutics", Cambridge University Press (ISBN 052180261X).
В определенных вариантах осуществления оценку проводят по меньшей мере через 1 час, например, по меньшей мере через 2, 4, 6, 8, 12, 24 или 48 часов или по меньшей мере через 1 сутки, 2 суток, 4 суток, 10 суток, 13 суток, 20 суток или более или по меньшей мере через 1 неделю, 2 недели, 4 недели, 10 недель, 13 недель, 20 недель или более после введение. Индивидуума можно оценивать в один или несколько из следующих периодов: до начала лечения; во время лечения или после введения одного или нескольких компонентов лечения. Оценка может включать оценку необходимости дальнейшего лечения, например, оценку того, необходимо ли изменять дозу, частоту введения или длительность лечения. Она также может включать оценку необходимости добавления или отмены выбранного терапевтического способа, например, добавления или отмены любого из видов лечения от воздействия радиации или для повышения продукции тромбоцитов у индивидуума, как описано в настоящем документе.
Подходы ex vivo. Стратегия ex vivo для повышения продукции тромбоцитов у индивидуума может включать трансфекцию или трансдукцию одной или нескольких клеток, полученных у индивидуума полинуклеотидом, кодирующим терапевтическое антитело (например, антитело с миметиком TPO) или его терапевтически активный фрагмент, описываемые в настоящем документе. Например, клетки можно трансфицировать одним вектором, кодирующим тяжелую и легкую цепь антитела с миметиком TPO или клетки можно трансфицировать первым вектором, кодирующим тяжелую цепь, и вторым вектором, кодирующим легкую цепь антитела. В определенных вариантах осуществления вектор содержит индуцибельный промотор, который позволяет практикующему медицинскому работнику запускать или останавливать продукцию антитела с миметиком TPO (или фрагмента) у индивидуума. Например, практикующий медицинский работник может принять решение запустить экспрессию антитела с миметиком TPO, описываемого в настоящем документе, у пациента, у которого запланировано прохождение второго раунда радиотерапевтической схемы лечения. После применения схемы лечения и восстановления уровней тромбоцитов у индивидуума практикующий медицинский работник может принять решение об остановке экспрессии антитела у индивидуума.
Трансфицированные или трансдуцированные клетки затем возвращают индивидууму. Клетки могут представлять собой любой из широкого диапазона типов, включая без ограничения, кроветворные клетки (например, клетки костного мозга, макрофаги, моноциты, дендритные клетки, T-клетки или B-клетки), фибробласты, эпителиальные клетки, эндотелиальные клетки, кератиноциты или мышечные клетки. Такие клетки могут действовать в качестве источника (например, непрерывного или периодического источника) терапевтического антитела (например, антитела с миметиком TPO) или его терапевтически активного фрагмента до тех пор, пока они жизнеспособны у индивидуума. В определенных вариантах осуществления векторы и/или клетки можно конфигурировать для индуцируемой или репрессируемой экспрессии антитела (см., например, Schockett et al. (1996) Proc. Natl. Acad. Sci. USA 93:5173-5176 и патент США № 7056897).
Предпочтительно, клетки получают у индивидуума (аутологичного), но теоретически их можно получать у индивидуума того же вида, отличного от данного индивидуума (аллогенного).
Подходящие способы для получения клеток у индивидуума и трансдукции или трансфекции клеток известны в области молекулярной биологии. Например, стадию трансдукции можно проводить любыми стандартными способами, применяемыми для генотерапии ex vivo, включая фосфат кальция, липофекцию, электропорацию, вирусную инфекции (см. выше) и биолистический перенос генов. См., например, Sambrook et al. (выше) и Ausubel et al. (выше). Альтернативно можно использовать липосомы или полимерные микрочастицы. Успешно трансдуцированные клетки можно выбирать, например, по экспрессии кодирующей последовательности или гена устойчивости к лекарственному средству.
В определенных вариантах осуществления у индивидуума можно получать биологический образец, содержащий мегакариоциты, и приводить в контакт с антителом с миметиком TPO для стимуляции продукции тромбоцитов. Затем обработанный биологический образец можно обратно вводить индивидууму или другому индивидууму того же вида, что и индивидуум. Такие аутологичные или аллогенные способы трансплантации ex vivo могут быть пригодны для восстановления уровней тромбоцитов у индивидуума, подвергнутого или подвергаемого лучевой терапии или химиотерапии. В таких случаях биологический образец выделяют до проведения лучевой терапии или химиотерапии.
Наборы
Изобретение также относится к промышленным изделиям или наборам, которые включают контейнер с этикеткой и композицию, содержащую терапевтическое антитело (например, антитело с миметиком TPO) или его терапевтически активный фрагмент, описываемые в настоящем документе. Когда композиция содержит антитело с миметиком TPO или его терапевтически активный фрагмент, этикетка может указывать на то, что композиция предназначена для применения для повышения продукции тромбоцитов у индивидуума, при необходимости и/или для введения индивидууму (например, человеку) в сочетании с химиотерапией или лучевой терапией. Набор, необязательно, может содержать средства для введения композиции индивидууму. Например, наборы могут содержать один или несколько шприцов. Также наборы могут необязательно содержать инструкции для введения композиции индивидууму.
В определенных вариантах осуществления наборы могут дополнительно содержать одно или несколько дополнительных активных средств для повышения продукции тромбоцитов у индивидуума. Например, наборы могут содержать один или несколько из промакты (Promacta)®/револада (Revolade®) (элтромбопаг; GlaxoSmithKline), ньюмеги (Neumega®) (опрелвекин; rhIL-11, Genetics Institute, Inc.), энплата (Nplate™) (ромиплостим; Amgen, Inc.) и любых других активных средств, описываемых в настоящем документе. В определенных вариантах осуществления наборы могут содержать одно или несколько активных средств для лечения индивидуума от воздействия радиации. Например, наборы могут содержать один или несколько из антибиотика, анестетика, противорвотного средства, стероида (например, андростендиола, такого как 4-андростендиол или 5-андростендиол), хелатирующего средства, диуретика, замещающего радионуклид средства и стволовой клетки.
Набор необязательно может содержать один или несколько реагентов для определения уровней тромбоцитов в образце крови, получаемом у индивидуума. Также набор может содержать один или несколько реагентов для получения образца крови у индивидуума.
Приведенные ниже примеры предназначены для иллюстрации, а не ограничения изобретения.
Примеры
Пример 1. Реагенты
В описанных ниже экспериментах применяли следующие реагенты:
(1) рекомбинантный тромбопоэтин человека (далее в настоящем документе, обозначаемый как "rhTPO");
(2) композиция, содержащая поддерживающую структуру гуманизированного антитела к компоненту комплемента C5 (5G1.1), в котором CDR3 тяжелой цепи замещена пептидом-миметиком TPO (далее в настоящем документе, обозначаемого как "антитело CDR-TPO"); антитело больше не связывается с C5; константная область тяжелой цепи представляет собой слитую константную область G2/G4, как описано выше;
(3) композиция, содержащая гуманизированное антитело к компоненту комплемента C5 (5G1.1), не содержащая пептида-миметика TPO (далее в настоящем документе, обозначаемое как "контрольное антитело против C5"); константная область тяжелой цепи представляет собой слитую константную область G2/G4, как описано выше;
(4) композиция, содержащая F(ab')2-фрагмент антитела к столбнячному токсину, в котором CDR3 тяжелой цепи содержит пептид-миметик TPO, а CDR2 легкой цепи содержит пептид-миметик TPO (далее в настоящем документе, обозначаемый как "TPO-Fab");
(5) антитело с миметиком TPO с поддерживающей структурой антитела человека к сибирской язве, где полипептиды легких цепей на C-конце содержат миметик TPO (далее в настоящем документе, обозначаемое как "антитело LC-TPO"); константная область тяжелой цепи представляет собой слитую константную область G2/G4, как описано выше; а антиген-связывающие участки антитела связываются с антигеном pA83 Bacillus anthracis;
(6) антитело с миметиком TPO с поддерживающей структурой антитела человека к сибирской язве, где полипептиды тяжелых цепей содержат миметик TPO, встроенный немного ниже C-конца шарнирной области тяжелой цепи (далее в настоящем документе, обозначаемое как "антитело HC-TPO"), где миметик TPO встроен между 5 и 6 остатками части CH2 поддерживающей структуры антитела к сибирской язве; константная область тяжелой цепи представляет собой слитую константную область G2/G4, как описано выше; а антиген-связывающие участки антитела связываются с антигеном PA83 Bacillus anthracis;
(7) антитело с миметиком TPO с поддерживающей структурой антитела человека к сибирской язве, где полипептиды легких цепей содержат миметик TPO на C-конце, а полипептиды тяжелых цепей содержат миметик TPO, встроенный немного ниже C-конца шарнирной области тяжелой цепи (далее в настоящем документе, обозначаемое как "антитело HC+LC-TPO"); константная область тяжелой цепи представляет собой слитую константную область G2/G4, как описано выше; и антиген-связывающие участки антитела связываются с антигеном PA83 Bacillus anthracis;
(8) антитело человека к сибирской язве, не содержащее миметика TPO, и с константной областью, тяжелой цепи, содержащей слитую константную область G2/G4, как описано выше (далее в настоящем документе, обозначаемое как "контрольное антитело G2/G4 к сибирской язве"); а антиген-связывающие участки антитела связываются с антигеном PA83 Bacillus anthracis; и
(9) антитело человека к сибирской язве, не содержащее миметика TPO, где константная область тяжелой цепи представляет собой константную область G1 (далее в настоящем документе, обозначаемое как "контрольное антитело G1 к сибирской язве"), и где антиген-связывающие участки антитела связываются с антигеном PA83 Bacillus anthracis.
Пример 2. Получение и очистка антитела HC+LC-TPO
Стандартными способами молекулярной биологии получали плазмидный экспрессирующий вектор, который содержит нуклеиновую кислоту, кодирующую легкую цепь и тяжелую цепь антитела HC+LC-TPO, описанного выше. Вектор трансфицировали в клетки CHOK1SV, линия клеток китайского хомяка с помощью электропорации. Трансфицированные клетки подвергали скринингу на клоны, которые стабильно экспрессируют антитело. Клон выбирали и использовали для получения крупномасштабной культуры для получения и очистки терапевтического антитела.
Очистка
Антитело HC+LC-TPO очищали из супернатанта клеточной культуры (900 мл) с применением смолы с белком A (POROS®). Перед пропусканием супернатанта через колонку, колонку сначала уравновешивали восемью объемами колонки уравновешивающего буфера (250 мМ NaCl, 50 мМ глицин, pH 8). После уравновешивания колонки, супернатант наносили на колонку при скорости потока 9 мл/мин. После нанесения образца на колонку, колонку промывали уравновешивающим буфером до возвращения оптической плотности при УФ-излучении 280 нм к нулю. Антитело элюировали с колонки 150 мМ NaCl, 100 мМ глицином, pH 3,5 и пиковую фракцию собирали вручную. Пиковую фракцию нейтрализовали 1 M Tris pH 9, и подвергали диализу в фосфатно-солевой буфер. После диализа образец фильтровали через 0,22 мкм фильтр Sterivex (Millipore), и определяли концентрацию с помощью УФ-спектроскопии при длине волны 280 нм. Очищенное антитело тестировали на загрязнение эндотоксином с использованием набора для анализа развития окраски в конечной точке с использованием LAL QCL-1000 (Lonza).
Пример 3. Функциональная характеристика антитела HC+LC-TPO in vitro
Рекомбинантный рецептор TPO (R&D Systems®; Minneapolis, MN) биотинилировали в соотношении биотин:белок 1:1 с использованием биотина No-Weigh™ (Thermo Scientific/Pierce). Проводили связывание биотинилированного рецептора TPO (5 мкг/мл) со стрептавидиновым зондом в течение 15 минут. Зонд отмывали, а затем приводили в контакт с 25 нМ антитела HC+LC-TPO. Ассоциацию и диссоциацию антител с зондом контролировали с помощью Octet QK (Forte-Bio®; Menlo Park, CA) в течение 15 минут. Кинетику связывания двух белков определяли с использованием частичной аппроксимации с применением аналитического программного обеспечения Forte-Bio®. Определяли, что KD приблизительно составляла 2,32 нМ.
Сходный эксперимент также проводили с применением описанного выше биотинилированного рецептора TPO и стрептавидинового зонда, где зонд приводили в контакт с антителом HC+LC-TPO или rhTPO. В этом эксперименте для каждого из антител HC+LC-TPO и rhTPO, определяли, что KD составляла приблизительно 3 нМ. Эти результаты демонстрируют, что аффинность антитела с миметиком TPO к рецептору TPO являлась такой же, как аффинность rhTPO к рецептору.
Пример 4. Влияние миметика TPO на количества тромбоцитов у мышей
Мышей Balb/c в возрасте 13 недель обрабатывали rhTPO, TPO-Fab, антителом CDR-TPO или контрольным антителом против C5, как описано выше в примере 1. В каждой группе обрабатывали по пять мышей. Композиции мышам вводили подкожной инъекцией раз в сутки в течение пяти последовательных суток при дозе 2 мг/кг CDR-TPO или контрольного антитела, 13,3 мг/кг TPO-Fab или 110 мкг/кг rhTPO. На сутки 3, 5, 8, 10 и 12, где первую обработку проводили на сутки 1, у каждой мыши получали 100 мкл крови. Тромбоциты периферической крови измеряли с применением гематологического анализатора Cell-Dyn™ 3100 Hematology Analyzer (Abbott Diagnostics, Illinois).
Как показано на фиг. 1, уровни тромбоцитов у мышей, обрабатываемых rhTPO, антителом CDR-TPO и TPO-Fab, по сравнению с контрольным антителом значительно возрастали.
Пример 5. Влияние антитела с миметиком TPO на количества тромбоцитов у мышей
Мышей Balb/c в возрасте 13 недель обрабатывали антителом CDR-TPO, контрольным антителом G1 к сибирской язве, антителом HC-TPO, антителом LC-TPO или антителом HC+LC-TPO. Антитела описаны выше в примере 1.
Каждая обрабатываемая группа состояла из пяти мышей. Антитела вводили мышам подкожной инъекцией раз в сутки в течение пяти последовательных суток при дозе 2 мг/кг. У каждой мыши на сутки 0, 4, 7, 9, 11, 16 и 18, где первую обработку проводили на сутки 1, получали 100 мкл крови. Тромбоциты периферической крови в кровь измеряли, как описано выше.
Как показано на фиг. 2, уровни тромбоцитов у мышей, обрабатываемых любым из антител с миметиками TPO, по сравнению с контрольным антителом G1 к сибирской язве, возрастали. Кроме того, уровни тромбоцитов, получаемые у мышей, обрабатываемых антителом HC-TPO, антителом LC-TPO или антителом HC+LC-TPO, были значительно более высокими, чем уровни тромбоцитов, получаемые у мышей, обрабатываемых антителом CDR-TPO. Например, на сутки 11 уровни тромбоцитов, получаемые при применении антитела HC+LC-TPO (5375×106 тромбоциты/мл) были приблизительно в три раза выше, чем соответствующие уровни тромбоцитов у мышей, обрабатываемых антителом CDR-TPO (1802×106 тромбоциты/мл). Эти результаты демонстрируют, что антитела с миметиком TPO на C-конце легкой цепи и/или в шарнирной области тяжелой цепи неожиданно оказались еще более эффективными в повышении уровня тромбоцитов у животных, чем антитела, содержащие пептиды-миметики TPO в областях CDR.
Кроме того, уровни тромбоцитов у мышей, обрабатываемых, например, антителом LC-TPO и антителом HC+LC-TPO, по сравнению с антителом CDR-TPO возрастали более быстро (см. уровни тромбоцитов на сутки 4; фиг. 2).
Описанным выше способом на их способность стимулировать продукцию тромбоцитов у мышей тестировали несколько других конструкций CDR-миметик TPO. Антитела содержали два или четыре миметика TPO, которые встраивали в CDR вариабельных областей тяжелых цепей и/или легких цепей. Например, одно антитело содержало два полипептида тяжелых цепей, в которых CDR3 замещали миметиком TPO, и два полипептида легких цепей в которых CDR2 замещали миметиком TPO. Другое антитело содержало два полипептида тяжелых цепей, в которых CDR3 замещали миметиком TPO, и два полипептида легких цепей, в которых CDR1 замещали миметиком TPO. Ни одно из этих антител не было столь же эффективным в повышении уровней тромбоцитов у мыши, как антитело HC-TPO, антитело LC-TPO или антитело HC+LC-TPO.
В совокупности эти данные демонстрируют, что антитело HC-TPO, антитело LC-TPO и антитело HC+LC-TPO являются более эффективными в обеспечении более высокой общей продукции тромбоцитов, а также более быстрой продукции тромбоцитов у животного, чем молекулы аналогичного антитела CDR-TPO. Эти данные также позволяет предположить, что конкретное расположение пептидов-миметиков TPO в одном или обоих из C-конца легкой цепи (обеспечивая представление миметика в центральной щели антитела) и в шарнирной области тяжелой цепи или рядом с ней обеспечивает лучшую сходную с TPO биологическую активность антитела LC-TPO, антитела HC-TPO и антитела HC+LC-TPO.
Пример 6. Влияние обработки однократной дозой антитела с миметиком TPO на количества тромбоцитов у мышей
Мышей Balb/c в возрасте 14 недель обрабатывали контрольным антителом G1 к сибирской язве, антителом CDR-TPO, антителом LC-TPO, антителом HC+LC-TPO и контрольным антителом G2/G4 к сибирской язве. Каждая обрабатываемая группа состояла из трех (3) мышей. Антитела мышам вводили подкожной инъекцией один (1) раз при дозе 2 мг/кг. Кровь у каждой мыши собирали на сутки 0, 2, 4, 7, 9, 11, 15, 18 и 21 относительно обработки. Тромбоциты периферической крови анализировали, как описано выше. Как показано на фиг. 3, уровни тромбоцитов у мышей, обрабатываемых антителом LC-TPO или антителом HC+LC-TPO, по сравнению с уровнями тромбоцитов у мышей, обрабатываемых контрольными антителами к сибирской язве, возрастали. Эти данные снова демонстрируют, что уровни тромбоцитов, получаемые у мышей, обрабатываемых антителом LC-TPO или антителом HC+LC-TPO были значительно большими, чем уровни тромбоцитов, получаемые у мышей, обрабатываемых антителом CDR-TPO. Данные также демонстрируют, что антитело LC-TPO и антитело HC+LC-TPO являлись более способными к поддержанию повышенных уровней тромбоцитов в крови животных, по сравнению с антителом CDR-TPO. (см., например, сутки от 9 до 15, фиг. 3).
Кроме того, эти данные также демонстрируют, что однократная доза антитела LC-TPO или антитела HC+LC-TPO неожиданно была не только способна значительно увеличивать уровни тромбоцитов у мышей, но эта однократная доза была приблизительно также эффективна, как схема лечения с несколькими дозами (сравнить с фиг. 2).
Пример 7. Влияние антител с миметиками TPO на уровни тромбоцитов у обработанных MMC мышей
Мышам Balb/c в возрасте 14 недель внутривенно вводили митомицин C (MMC) в дозе 3 мг/мл. После обработки MMC мышам подкожной инъекцией один раз в сутки в течение пяти последовательных суток при дозе 600 мкг/кг также вводили описанные выше антитело CDR-TPO или контрольное антитело против C5. У обработанных мышей, а также у контрольных мышей с плацебо на сутки 8, 11, 15, 18, 21, 25 и 32 после обработки MMC (сутки 0) собирали кровь. Тромбоциты периферической крови измеряли, как описано выше.
Как показано на фиг. 4, уровни тромбоцитов у мышей, обрабатываемых антителом CDR-TPO, по сравнению с мышами, обрабатываемыми контрольным антителом против C5, возрастали. Эти результаты означают, что антитело CDR-TPO эффективно у животных для более быстрого восстановления уровней тромбоцитов после миелосупрессивной терапии по сравнению с отсутствием обработки средством, повышающим продукцию тромбоцитов.
На основе результатов описанных выше экспериментов с применением антитела LC-TPO, антитела HC-TPO и антитела HC+LC-TPO, ожидают, что эти антитела будут эффективны у животных для восстановления уровней тромбоцитов после миелосупрессивной терапии. Кроме того, предыдущие результаты также позволяет предположить, что антитело LC-TPO, антитело HC-TPO и антитело HC+LC-TPO могут быть эквивалентны антителу CDR-TPO в восстановлении тромбоцитов или более эффективны, чем оно.
Эксперимент для проверки этого предположения представляет собой следующее. Мышам Balb/c в возрасте 14 недель внутривенно вводят митомицин C (MMC) в дозе 3 мг/мл. После обработки MMC мышам подкожной инъекцией также вводят одно из следующих антител: антитело CDR-TPO, антитело LC-TPO, антитело HC-TPO, антитело HC+LC-TPO, контрольное антитело против C5, контрольное антитело G1 к сибирской язве и контрольное антитело G2/G4 к сибирской язве.
Антитела вводят раз в сутки в течение пяти последовательных суток в дозе 2 мг/кг. Кровь у каждой мыши собирают на сутки 0, 2, 4, 7, 9, 11, 15, 18 и 21 после обработки MMC (сутки 0). Тромбоциты периферической крови анализируют, как описано выше. Ожидают, что у мышей, обрабатываемых каждым из двух антител с миметиками TPO и антителом CDR-TPO, по сравнению с контрольными антителами уровни тромбоцитов будут возрастать. Эти данные будут означать, что антитело LC-TPO, антитело HC-TPO и антитело HC+LC-TPO эффективны у животных для восстановления уровни тромбоцитов после миелосупрессивной терапии. Кроме того, ожидают, что данные продемонстрируют, что антитело LC-TPO, антитело HC-TPO, или антитело HC+LC-TPO увеличат уровни тромбоцитов более быстро и поддержат уровни тромбоцитов у животных в течение более длительного периода, чем антитело CDR-TPO.
В другом эксперименте мышам Balb/c в возрасте 14 недель подкожной инъекцией вводят одно из следующих антител: антитело CDR-TPO, антитело LC-TPO, антитело HC-TPO, антитело HC+LC-TPO, контрольное антитело против C5, контрольное антитело G1 к сибирской язве и контрольное антитело G2/G4 к сибирской язве. Антитела вводят с помощью описанных далее схем дозирования. Первая схема лечения включает введение антитела мышам раз в сутки в течение пяти последовательных суток в дозе 600 мкг/кг. Через сутки после конечной дозы мышам внутривенно вводят митомицин C (MMC) в дозе 3 мг/мл. Вторая схема лечения включает введение мышам одной 600 мкг/кг дозы антитела за трое суток до обработки MMC. Третья схема лечения включает введение мышам одной 600 мкг/кг дозы антитела за сутки до обработки MMC. Ожидают, что у мышей, обрабатываемых антителом LC-TPO, антителом HC-TPO или антителом HC+LC-TPO по сравнению с уровнями тромбоцитов у мышей, которых обрабатывают контрольными антителами к сибирской язве или к C5, будут наблюдаться повышенные уровни тромбоцитов. Также ожидают, что однократная доза антитела LC-TPO, антитела HC-TPO или антитела HC+LC-TPO, вводимая мышам до обработки MMC, будет значительно повышать уровни тромбоцитов у мышей, которых впоследствии обрабатывали MMC.
В еще одном эксперименте мышам Balb/c в возрасте 14 недель подкожной инъекцией вводят одно из следующих антител: антитело CDR-TPO, антитело LC-TPO, антитело HC-TPO, антитело HC+LC-TPO, контрольное антитело против C5, контрольное антитело G1 к сибирской язве и контрольное антитело G2/G4 к сибирской язве. Антитела вводят с помощью описанных далее схем дозирования. Первая схема лечения включает введение антитела мышам раз в сутки в течение пяти последовательных суток в дозе 600 мкг/кг. За сутки перед первой дозой мышам внутривенно вводят митомицин C (MMC) в дозе 3 мг/мл. Вторая схема лечения включает введение мышам одной 600 мкг/кг дозы антитела через сутки после обработки MMC. Третья схема лечения включает введение мышам одной 600 мкг/кг дозы антитела через трое суток после обработки MMC. Ожидают, что у мышей, обрабатываемых антителом LC-TPO, антителом HC-TPO или антителом HC+LC-TPO по сравнению с уровнями тромбоцитов у мышей, которых обрабатывают контрольными антителами к сибирской язве или к C5, будут наблюдаться повышенные уровни тромбоцитов. Также ожидают, что однократная доза антитела LC-TPO, антитела HC-TPO или антитела HC+LC-TPO, вводимая мышам сразу после обработки MMC, будет значительно увеличивать уровни тромбоцитов у мышей, которых впоследствии обрабатывали MMC.
Совместно эти изыскания дополнительно поддерживают заключение, что конкретное расположение пептидов-миметиков TPO в одном или обоих из C-конца легкой цепи (обеспечивая представление миметика TPO в центральной щели антитела) и в шарнирной области тяжелой цепи или рядом с ней, обеспечивает лучшую сходную с TPO биологическую активность этих молекул антител с миметиком TPO.
Таким образом, ожидают, что антитело LC-TPO, антитело HC-TPO и антитело HC+LC-TPO будут пригодны для лечения животных, проходящих миелосупрессивную терапию.
Пример 8. Влияние антител с миметиками TPO на уровни тромбоцитов у подвергнутых гамма-излучению мышей (предварительная обработка)
Мышам C57BL6/J в возрасте 8-10 недель подкожной инъекцией вводят одно из следующих антител: антитело CDR-TPO, антитело LC-TPO, антитело HC-TPO, антитело HC+LC-TPO, контрольное антитело против C5, контрольное антитело G1 к сибирской язве и контрольное антитело G2/G4 к сибирской язве.
Антитела вводят с помощью трех схем лечения. Первая схема лечения включает введение мышам антитела раз в сутки в течение пяти последовательных суток в дозе 2 мг/кг. Через сутки после последней дозы мышей подвергают воздействию радиации в дозе 8,0 Грей (Гр) приблизительно при 0,90 Гр/минуту, как описано в Mouthon et al. (1999) Int. J. Radiation Oncology Biol. Phys 43(4):867-875. Вторая схема лечения включает введение мышам одной 2 мг/кг дозы антител за трое суток до облучения. Третья схема лечения включает введение мышам одной 2 мг/кг дозы антител за сутки перед облучением. Через 30 суток после облучения проводят мониторинг выживаемости обработанных мышей. Ожидают, что будет наблюдаться увеличенная выживаемость облученных мышей, обрабатываемых антителом LC-TPO, антителом HC-TPO или антителом HC+LC-TPO по сравнению с выживаемостью мышей, которых обрабатывают контрольными антителами к сибирской язве или к C5. Также ожидают, что однократная доза антитела LC-TPO, антитела HC-TPO или антитела HC+LC-TPO, вводимая мышам до облучения будет значительно увеличивать выживаемость облученных мышей.
Кроме того, ожидают, что антитело LC-TPO, антитело HC-TPO или антитело HC+LC-TPO будут более эффективным для увеличения выживаемости облученных мышей, чем антитела, которые содержат миметики TPO в области CDR.
Пример 9. Влияние антител с миметиками TPO на уровни тромбоцитов у подвергнутых гамма-излучению мышей (последующая обработка)
В другом эксперименте мышам C57BL6/J в возрасте 8-10 недель подкожной инъекцией вводят одно из следующих антител: антитело CDR-TPO, антитело LC-TPO, антитело HC-TPO, антитело HC+LC-TPO, контрольное антитело против C5, контрольное антитело G1 к сибирской язве и контрольное антитело G2/G4 к сибирской язве.
При одной схеме лечения антитела мышам вводят через 6 часов после воздействия радиации в дозе 8,0 Грей (Гр) приблизительно при 0,90 Гр/минуту, как описано в Mouthon et al. (1999), выше. Во второй схема лечения антитела мышам вводят через 6 часов и раз в сутки в течение четырех последовательных суток после облучения мышей. Через 30 суток после облучения проводят мониторинг выживаемости обработанных мышей. Ожидают, что будет наблюдаться увеличенная выживаемость облученных мышей, обрабатываемых антителом LC-TPO, антителом HC-TPO или антителом HC+LC-TPO по сравнению с выживаемостью мышей, которых обрабатывают контрольными антителами к сибирской язве или к C5. Также ожидают, что однократная доза антитела LC-TPO, антитела HC-TPO или антитела HC+LC-TPO, вводимая после облучения, будет значительно увеличивать выживаемость облученных мышей по сравнению с выживаемостью мышей, обрабатываемых контрольными антителами.
Кроме того, ожидают, что антитело LC-TPO, антитело HC-TPO или антитело HC+LC-TPO будут более эффективным для увеличения выживаемости облученных мышей, чем антитела, которые содержат миметики TPO в области CDR.
Хотя настоящее изобретение описано с указанием его конкретных вариантов осуществления, специалистам в данной области следует понимать, что можно проводить различные изменения и замещать различные эквиваленты без отклонения от истинной сущности и объема изобретения. Кроме того, можно осуществлять множество модификаций для адаптации конкретной ситуации, материала, химического соединения, способа, этапа или этапов к задаче, сущности и объему настоящего изобретения. Подразумевается, что все такие модификации находятся в объеме изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА ПРОТИВ КОМПЛЕКСА ANGPTL3/8 И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2019 |
|
RU2799796C2 |
| СПОСОБЫ И КОМПОЗИЦИЯ ДЛЯ СЕКРЕЦИИ ГЕТЕРОЛОГИЧНЫХ ПОЛИПЕПТИДОВ | 2010 |
|
RU2585488C2 |
| АНТИТЕЛА, СПОСОБНЫЕ СВЯЗЫВАТЬСЯ С ЧЕЛОВЕЧЕСКИМ КАННАБИНОИДНЫМ РЕЦЕПТОРОМ 1 (CB1) | 2016 |
|
RU2727018C1 |
| АНГИОПОЭТИН-2-СПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ АГЕНТЫ | 2005 |
|
RU2404992C2 |
| КОНСТРУКЦИИ, НАПРАВЛЕННЫЕ НА КОМПЛЕКСЫ ПЕПТИДА AFP/МНС, И ВИДЫ ИХ ИСПОЛЬЗОВАНИЯ | 2016 |
|
RU2754041C2 |
| АНТИТЕЛА, НАЦЕЛИВАЮЩИЕСЯ НА КОСТНУЮ ТКАНЬ | 2018 |
|
RU2801206C2 |
| АНТИ-CD79b АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2511410C2 |
| ОДНОЛИНКЕРНЫЕ АНТИТЕЛА FabFv И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2714159C2 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ АНТАГОНИСТОВ, СВЯЗЫВАЮЩИХСЯ С КОМПОНЕНТАМИ СИГНАЛЬНОГО ПУТИ PD-1, И ТАКСАНОВ | 2014 |
|
RU2719487C2 |
| АНТИ-CD79b АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2553566C2 |










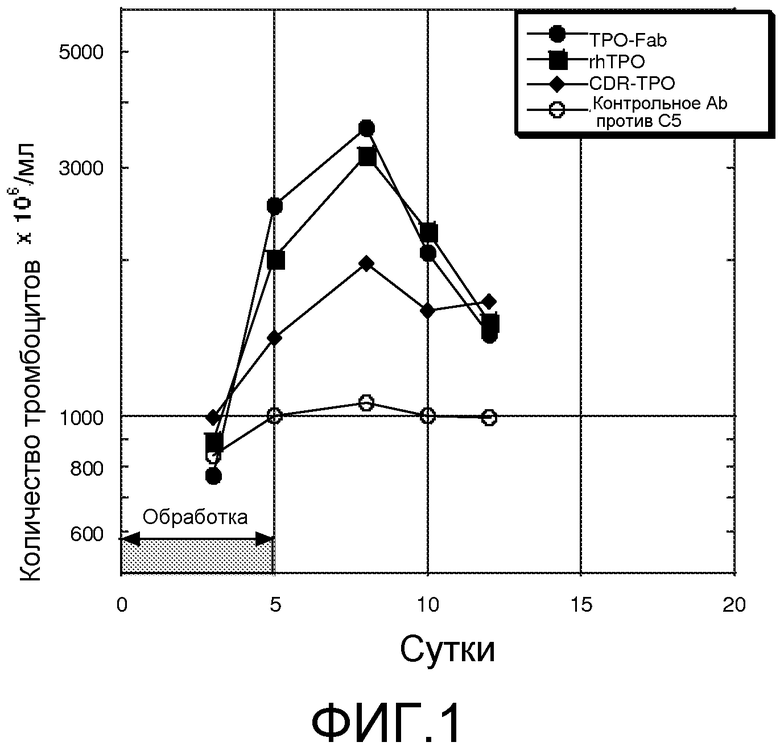
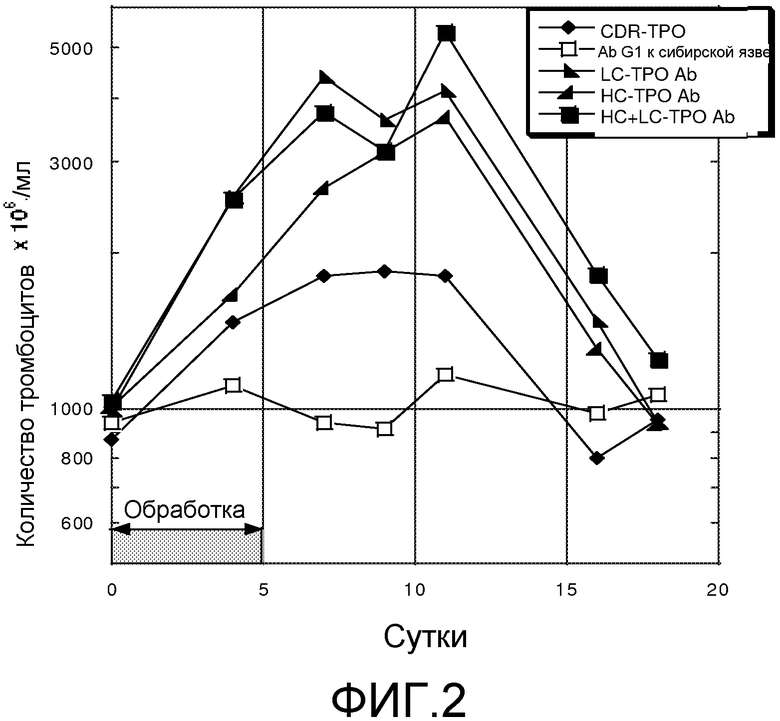
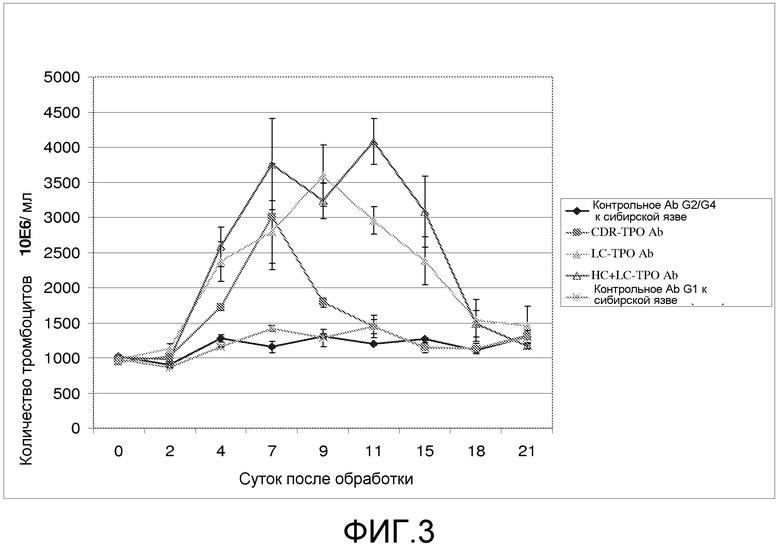
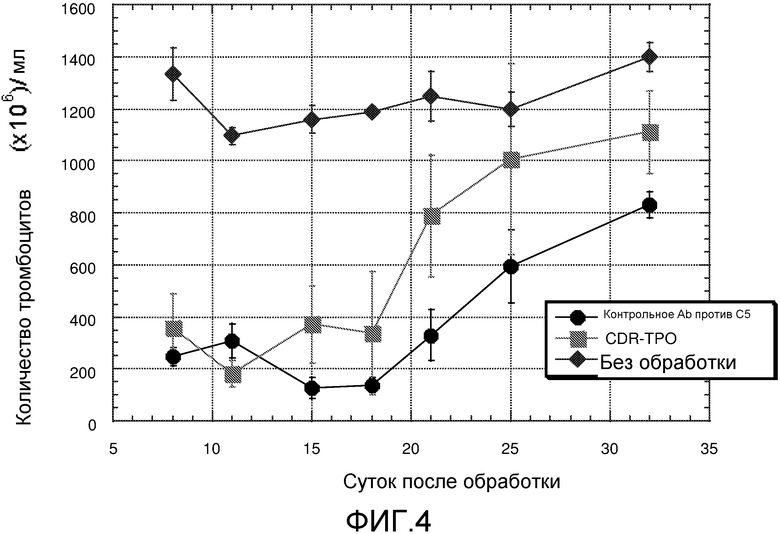
Настоящее изобретение относится к области биотехнологии. Предложено терапевтическое антитело и терапевтический фрагмент антитела для повышения продукции тромбоцитов, включающие пептид-миметик тромбопоэтина (ТРО), содержащий последовательность IEGPTLRQWLAARA и встроенный как дополнение к С-концу константной области легкой цепи и/или в положении менее 20 аминокислот ниже С-конца шарнирной области тяжелой цепи. Кроме того, рассмотрена композиция, содержащая антитело или его терапевтически активный фрагмент, и способ повышения продукции тромбоцитов у индивидуума, включающий введение такой композиции, а также нуклеиновая кислота, кодирующая полипептид антитела, содержащий пептид-миметик ТРО. Данное изобретение обеспечивает более высокую и быструю продукцию тромбоцитов по сравнению с известными конструкциями антитела, где пептид-миметик встроен вместо одного из CDR. 4 н. и 9 з.п. ф-лы, 4 ил., 9 пр.
1. Терапевтическое антитело или терапевтически активный фрагмент антитела для повышения продукции тромбоцитов, где антитело или фрагмент содержит:
a) пептид-миметик тромбопоэтина (ТРО), содержащий аминокислотную последовательность SEQ ID NO: 1, введенную в полипептид константной области легкой цепи антитела или фрагмента как дополнение к С-концу константой области, и/или
(b) пептид-миметик ТРО, содержащий аминокислотную последовательность SEQ ID NO: 1, введенную в полипептид тяжелой цепи антитела или фрагмента в положении менее 20 аминокислот ниже С-конца шарнирной области полипептида тяжелой цепи.
2. Терапевтическое антитело или его терапевтически активный фрагмент по п.1, дополнительно содержащий спейсерную аминокислотную последовательность на N-конце пептида-миметика ТРО или спейсерную аминокислотную последовательность на С-конце пептида-миметика ТРО.
3. Терапевтическое антитело или его терапевтически активный фрагмент по п.1 или 2, где антитело содержит:
(i) полипептид легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 10;
(ii) полипептид тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO: 12; или
(iii) полипептид легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 10, и полипептид тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO: 12.
4. Терапевтическое антитело или его терапевтически активный фрагмент по п.1 или 3, где антитело или его терапевтически активный фрагмент выбраны из группы, состоящей из моноклонального антитела, гуманизированного антитела, химеризованного антитела, химерного антитела, деиммунизированного антитела человека, полностью человеческого антитела и F(ab′)2-фрагмента.
5. Композиция для повышения продукции тромбоцитов, содержащая терапевтически эффективное количество терапевтического антитела или терапевтически активного фрагмента по любому из пп.1-4 и фармацевтически приемлемый носитель.
6. Способ повышения продукции тромбоцитов у индивидуума, где способ включает введение индивидууму, при необходимости, композиции, содержащей терапевтически эффективное количество терапевтического антитела или его терапевтически активного фрагмента по любому из пп.1-4.
7. Способ по п.6, где индивидуум страдает нарушением, связанным с недостаточным количеством тромбоцитов, или имеет злокачественную опухоль.
8. Способ по п.7, где нарушение выбрано из группы, состоящей из синдрома Бернара-Сулье, идиопатической тромбоцитопенической пурпуры, синдрома Вискотта-Олдрича, спленомегалии, тромботических микроангиопатий, диссеминированного внутрисосудистого свертывания, индуцированной гепарином тромбоцитопении (HIT), болезни фон Виллебранда, варианта болезни фон Виллебранда, тромбоцитопении, являющейся результатом инфекции ВИЧ, тромбоцитопении, являющейся результатом острого заболевания печени, индуцированной лекарственным средством тромбоцитарной недостаточности и тромбастении Гланцманна.
9. Способ по любому из пп.6-8, где индивидууму проводили или будут проводить химиотерапевтическую схему лечения или радиотерапевтическую схему лечения.
10. Способ по п.6, где индивидуум представляет собой человека.
11. Способ по п.9, где терапевтическое антитело или его терапевтически активный фрагмент вводят индивидууму:
(i) до и в течение или после химиотерапевтической или радиотерапевтической схемы лечения;
(ii) до химиотерапевтической или радиотерапевтической схемы лечения; или
(iii) в течение или после химиотерапевтической или радиотерапевтической схемы лечения.
12. Способ по любому из пп.9 или 11, где химиотерапевтическая или радиотерапевтическая схема лечения для индивидуума являются
(i) более мощными или
(ii) проводимыми с большей частотой, чем было бы безопасно возможно при отсутствии введения терапевтического антитела или его терапевтически активного фрагмента.
13. Выделенная нуклеиновая кислота, кодирующая выделенный терапевтический полипептид по п.3.
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| KUTER D.J | |||
| et al., "Efficacy of romiplostim in patients with chronic immune thrombocytopenic purpura: a double-blind randomised controlled trial" The Lancet, 2008; 371(9610): 395-403 | |||
| BUSSEL J.B | |||
| et al., "AMG 531, a thrombopoiesis-stimulating protein, for | |||
Авторы
Даты
2015-08-10—Публикация
2010-02-18—Подача