Изобретение относится к физической химии и электрохимии твердых электролитов и может быть использовано для определения химического коэффициента обмена и химического коэффициента диффузии кислорода в оксидных материалах со смешанной электронной и кислород-ионной проводимостью.
Известен способ определения химического коэффициента обмена и химического коэффициента диффузии кислорода в оксидных материалах со смешанной электронной и кислород-ионной проводимостью, включающий использование метода релаксации электропроводности оксида и расчет химического коэффициента обмена и химического коэффициента диффузии кислорода, который проводят по модели Крэнка (Crank J, The Mathematics of Diffusion; Oxford University Press, 1975) [1] с допущением, что общая проводимость образца исследуемого материала прямо пропорциональна содержанию кислорода в оксиде, как источника кислород-ионной проводимости (Охлупин Ю.С., Исследование обмена и диффузии кислорода в композиционных материалах La0.8Sr0.2Fe0.7Ni0.3O3-δ-Ce0.9Gd0.1O1.95 методом релаксации электропроводности; 2011) [2]. Согласно этому способу, исследуемый образец оксидного материала, находящийся в электрохимической измерительной ячейке, помещают в реактор, соединенный с газовым контуром, сообщающимся с атмосферой, и посредством регуляторов расхода газов продувают проточную систему «реактор - газовый контур» газовой смесью, содержащей кислород и какой-либо инертный газ, например гелий, аргон или азот. Исследуемый образец приводят в равновесие с газовой фазой оксида, производят смену потока газовой смеси с одной величины парциального давления кислорода над исследуемым образцом на другую, в результате происходит растворение кислорода в оксиде или выход кислорода из оксида, что влечет изменение его электропроводности. Величину парциального давления кислорода в кислородсодержащей смеси контролируют с помощью электрохимического датчика. При помощи четырехконтактной схемы или схемы Ван дер По записывают изменение во времени величины электропроводности оксида, и на основании зависимости электропроводности оксида от времени, полученной после смены парциального давления кислорода, производят расчет химического коэффициента обмена и химического коэффициента диффузии кислорода по модели Крэнка с допущением, что проводимость оксида пропорциональна содержанию в нем кислорода как источника кислород-ионной проводимости.
Время смены парциального давления кислорода в данном методе составляет 2÷5 с. Точность измерения и разделения процессов обмена и диффузии на кинетической кривой существенно зависят от быстроты смены давления кислорода.
Движение кислородсодержащей газовой смеси через проточную систему «реактор - газовый контур» обусловливает существование времени запаздывания, в течение которого происходит выход парциального давления кислорода на новое значение. При высоких температурах измерений это может привести к искаженным результатам зависимости электропроводности от времени при скачкообразном изменении парциального давления для высокоактивных оксидов по отношению к реакции восстановления кислорода. К таковым относятся оксиды с высокими значениями коэффициентов химического обмена и диффузии. При высоких значениях скорости обмена, что может наблюдаться как для активных образцов, так и для менее активных, но при высоких температурах, за счет времени запаздывания смены давления можно пропустить начальную кинетику и этим существенно занизить результаты измерения коэффициента химического обмена кислорода.
Кроме того, проточная система «реактор - газовый контур» требует большого расхода газов, особенно в длительных экспериментах, необходимых для малоактивных оксидов с низкими значениями коэффициентов химического обмена и диффузии. Применяемый в данном способе электрохимический датчик для записи значения парциального давления кислорода работает только при температурах выше 600°C.
Немаловажно и то, что при расчете коэффициента химического обмена и диффузии кислорода на основе данных, полученных методом релаксации электропроводности, предполагается, что проводимость оксида пропорциональна содержанию кислорода в каждый момент времени, однако в общем случае это условие не выполняется. То есть электропроводность оксида в данном случае лишь косвенно указывает на изменение количества в нем кислорода, что отрицательно сказывается на возможности применения модели Крэнка для определения коэффициента химического обмена и диффузии кислорода в оксидном материале.
Использование газовых смесей, особенно содержащих газы с высокой теплоемкостью, такие как гелий, может внести погрешность в эксперимент за счет возникающих при смене парциального давления слабо контролируемых тепловых потоков, которые могут привести к перегреву или охлаждению образца в начальный момент эксперимента (при смене парциального давления) относительно заданного значения температуры эксперимента и исказить начальный участок зависимости электропроводности от времени.
Известен способ определения химического коэффициента обмена и химического коэффициента диффузии кислорода в оксидных материалах методом релаксации массы (К. Yashiro etc., Mass transport properties of Ce0.9Gd0.1O2-δ at the surface and in the bulk; 2002) [3]. В этом способе исследуемый образец оксидного материала также помещают в реактор, соединенный с газовым контуром, сообщающимся с атмосферой, и посредством регуляторов расхода газов продувают проточную систему «реактор - газовый контур» газовой смесью кислорода с каким-либо инертным газом, чаще всего гелием, аргоном или азотом. Исследуемый образец приводят в равновесие с газовой фазой оксида, производят смену потока газовой смеси с одной величины парциального давления кислорода над исследуемым образцом на другую, в результате происходит растворение кислорода в оксиде или выход кислорода из оксида, что влечет за собой изменение массы образца. С помощью весов регистрируют изменение массы образца во времени, и на основании зависимости массы исследуемого образца от времени, полученной после смены величины парциального давления кислорода, производят расчет химического коэффициента обмена и химического коэффициента диффузии кислорода по модели Крэнка. Благодаря тому, что масса образца напрямую связана с содержанием кислорода в оксиде, для метода релаксации массы нет необходимости вводить еще какие-либо допущения, как это было сделано в методе релаксации электропроводности.
Как и в способе с использованием метода релаксации электропроводности, в способе с использованием метода релаксации массы применяют движение кислородсодержащей газовой смеси через проточную систему «реактор - газовый контур» со всеми, присущими этой системе, вышеописанными недостатками.
Как и в способе с использованием метода релаксации электропроводности, в данном способе для контроля значения парциального давления кислорода в кислородсодержащей смеси применяют электрохимический датчик, который эффективно работает только при температурах выше 600°C.
Время смены парциального давления кислорода в методе релаксации массы составляет не менее 3÷5 с и существенно зависит от геометрических размеров реактора, в котором находится образец. Точность измерения и разделения процессов обмена и диффузии на кинетической кривой также зависят от быстроты смены давления кислорода, однако точность определения коэффициента химического обмена и диффузии кислорода в оксидном материале будет выше, чем при использовании метода релаксации электропроводности, т.к. изменение массы образца напрямую указывает на изменение количества кислорода в исследуемом образце.
Задача настоящего изобретения заключается в расширении диапазона средств для определения химического коэффициента обмена и химического коэффициента диффузии кислорода в оксидных материалах, повышении точности измерения значения параметра оксида, указывающего на изменение количества в нем кислорода для образцов с различной степенью активности, снижении нижней температурной границы измерений, сокращении расхода кислорода.
Для решения поставленной задачи в способе определения химического коэффициента обмена и химического коэффициента диффузии кислорода в оксидных материалах исследуемый образец помещают в реактор, соединенный с газовым контуром, образец приводят в равновесие с газовой фазой, скачкообразно изменяют величину давления кислорода над образцом, регистрируют изменение во времени значения параметра оксида, напрямую связанного с изменением количества кислорода в оксиде, и на основании зависимости этого параметра от времени, полученной после смены величины давления кислорода, производят расчет химического коэффициента обмена и химического коэффициента диффузии кислорода по модели Крэнка, при этом в качестве параметра оксида, напрямую связанного с изменением количества кислорода в оксиде, используют значение давления кислорода над оксидом в замкнутом газовом контуре постоянного объема, для этого исследуемый образец помещают в реактор, вакуум-плотно соединенный с газовым контуром, изолированным от атмосферы, откачивают газовый контур на высокий вакуум, а для скачкообразного изменения величины давления кислорода над образцом перекрывают вакуум-плотное соединение реактора с газовым контуром, напускают в него или откачивают из него кислород высокой чистоты до значения давления, отличающегося от равновесного, после чего открывают вакуум-плотное соединение реактора с газовым контуром и регистрируют изменение значения давления кислорода над образцом во времени, расчет химического коэффициента обмена и химического коэффициента диффузии кислорода производят на основании зависимости относительного изменения давления кислорода над оксидом от времени, полученной после смены величины давления кислорода.
В отличие от способа по прототипу, где применяется метод релаксации массы, напрямую указывающей на изменение количества кислорода в оксиде, в заявленном способе в качестве такого параметра используется величина давления кислорода над образцом в замкнутом газовом контуре постоянного объема. Метод релаксации давления заключается в том, что вначале исследуемый образец приводят в состояние равновесия при одном значении давления кислорода, а затем производят резкую смену одной величины давления на другую. В результате резкой смены давления кислорода газовой фазы на более высокое или более низкое относительно первоначального равновесного за счет градиента химического потенциала в системе «газ - твердое тело» происходит проникновение из газовой фазы или высвобождение в газовую фазу кислорода.
Таким образом, с помощью метода релаксации давления кислорода фиксируется изменение давления кислорода над оксидом во времени, что напрямую свидетельствует об изменении количества кислорода в оксиде, так как образец находится в замкнутом газовом контуре постоянного объема. Однако в отличие от метода релаксации массы, где используют проточную систему для продувки кислородсодержащей газовой смеси, метод релаксации давления кислорода реализуют с использованием реактора, вакуум-плотно соединенного с газовым контуром, изолированным от атмосферы, в котором можно создать высокий вакуум и любое давление кислорода в диапазоне от 10-5 до 1 атм. Вакуум-плотно перекрывая сообщение реактора с газовым контуром, напуская в него или откачивая из него кислород высокой чистоты, достигают скачкообразного изменения величины давления кислорода над образцом. Таким образом, в газовом контуре посредством напуска или откачки кислорода создается давление, отличное от давления в реакторе. Для достижения давления кислорода в газовом контуре, значение которого выше, чем в реакторе, кислород в газовый контур напускают, а для того, чтобы достичь давления кислорода в газовом контуре, значение которого ниже, чем в реакторе, кислород из газового контура откачивают.
То, что скачкообразное изменение величины давления кислорода над образцом осуществляют открытием вакуум-плотного соединения реактора с газовым контуром, то есть практически мгновенно, исключает существование времени запаздывания, в течение которого происходит выход парциального давления кислорода на новое значение при смене давления кислорода. Это предотвращает искажение результатов измерений зависимости давления кислорода во времени, возможное для высокоактивных оксидов или менее активных оксидов при высоких температурах.
Использование чистого кислорода вместо кислородсодержащей смеси, применяемой в методах релаксации электропроводности и массы оксида, исключает необходимость использования для измерения парциального давления электрохимического датчика, работающего при температурах выше 600°C. В методе релаксации давления парциальное давление кислорода равно абсолютному, поэтому применим датчик общего давления, работающий с абсолютными давлениями при комнатной температуре. Использование для реализации метода релаксации замкнутого газового контура, изолированного от атмосферы с возможностью его откачивания на высокий вакуум, позволяет экономно расходовать кислород.
Таким образом, новый технический результат, достигаемый заявленным способом, заключается в создании возможности мгновенной смены давления кислорода, расширении рабочего диапазона температур для образцов с высокими значениями коэффициентов химического обмена и диффузии, сокращении расхода кислорода по сравнению с проточными системами, достижении высокой точности измерений давления в системе для оксидов с низкими значениями коэффициентов химического обмена и диффузии.
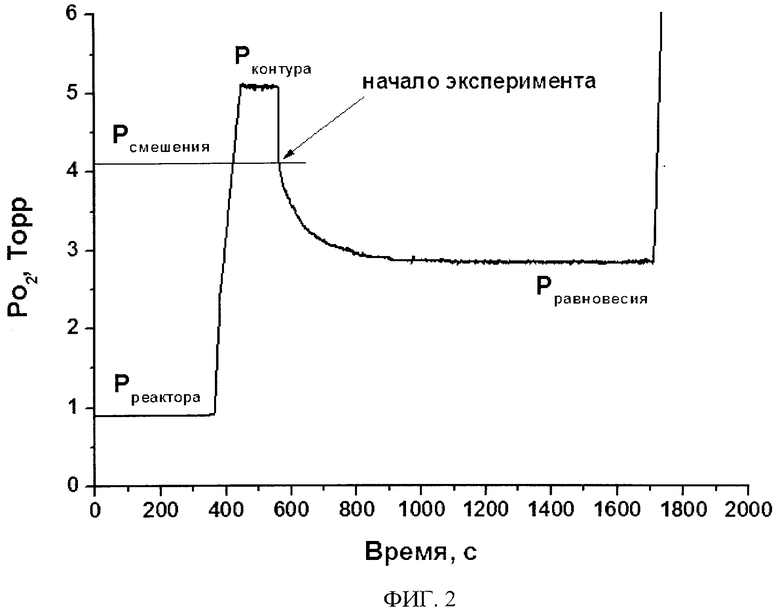
Изобретение иллюстрируется чертежами, где на фиг. 1 приведена принципиальная схема экспериментальной установки для реализации способа; на фиг. 2 приведена кривая зависимости давления от времени, иллюстрирующая метод релаксации давления. Экспериментальная установка состоит из двух частей: газовый контур 1, который посредством вакуумного крана 2 вакуум-плотно соединен с кварцевым реактором 3, в который помещают образец 4. Реактор помещен в печь (не показана). Газовый контур 1 имеет двухступенчатую систему откачки. Откачку на форвакуум осуществляют с помощью пластинчато-роторного насоса 5, остаточное давление при этом составляет порядка 10-2 Па. Вторую ступень откачки осуществляют высоковакуумным магниторазрядным насосом 6, при этом достигается остаточное давление порядка 10-8 Па. Установка содержит датчики давления Баярда-Альперта Пирани 7, систему напуска кислорода 8, баллон с кислородом высокой чистоты 9.
Давление газа в контуре 1 измеряли с помощью датчиков Баярда-Альперта Пирани 7, откалиброванных на диапазон давлений от 1 атм до 10-9 атм. Напуск кислорода в контур 1 осуществляли с помощью системы напуска 8 из баллона 9. Для вакуум-плотного соединения реактора с газовым контуром использовали вакуумные краны типа Ail-Metal UHV Valves с натеканием по гелию не более чем 10-9 атм·см3/с. Работу печи реактора 3 обеспечивали с помощью терморегулятора ВАРТА ТП403. Тип использованной термопары - ТПП.
В ходе эксперимента использовали кислород высокой чистоты. После размещения исследуемого образца в реакторе при комнатной температуре проводили откачку газового контура на высокий вакуум.
До начала эксперимента по реализации метода релаксации давления кислорода при заданной температуре и давлении кислорода образец приводят в равновесие с газовой фазой оксида, достигая постоянства давления в системе «образец - газовая фаза». После установления равновесия вакуум-плотное соединение между реактором 3 и газовым контуром 1 перекрывают, при этом температура и давление кислорода в реакторе остаются неизменными.
Далее в газовом контуре, изолированном от реактора с образцом, создают давление кислорода, отличающееся от равновесного в реакторе. Для достижения давления кислорода в газовом контуре, значение которого выше, чем в реакторе, кислород в газовый контур напускают, а для того, чтобы достичь давления кислорода в газовом контуре, значение которого ниже, чем в реакторе, кислород из газового контура откачивают.
После этого открывают вакуум-плотное соединение реактора 3 с газовым контуром 1 и регистрируют изменение значения давления кислорода над образцом во времени (см. фиг. 2). На основании зависимости относительного изменения давления кислорода над оксидом от времени, полученной после смены величины давления кислорода, по модели Крэнка производят расчет химического коэффициента обмена и химического коэффициента диффузии кислорода в оксиде с помощью программного обеспечения (свидетельство государственной регистрации программы для ЭВМ №2011614002 от 24.05.2011).
Заявленный способ позволяет расширить диапазон средств для определения химического коэффициента обмена и химического коэффициента диффузии кислорода в оксидных материалах, повысить точность измерения значения параметра оксида, указывающего на изменение количества в нем кислорода для образцов с различной степенью активности, сократить расход кислородсодержащего газа.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения кинетических и равновесных термодинамических параметров оксидов со смешанной проводимостью | 2024 |
|
RU2839288C1 |
| Способ определения кинетических параметров, характеризующих процесс обмена кислорода газовой фазы в смеси молекулярного кислорода и воды с оксидными материалами | 2023 |
|
RU2819452C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ ПРОТОНОВ В ПРОТОН-ПРОВОДЯЩИХ ОКСИДНЫХ МАТЕРИАЛАХ | 2014 |
|
RU2569172C1 |
| Способ исследования кинетики межфазного обмена в системе "газ-электрохимическая ячейка" с использованием изотопного обмена в условиях поляризации электродов | 2016 |
|
RU2627145C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КИНЕТИЧЕСКИХ ПАРАМЕТРОВ, ХАРАКТЕРИЗУЮЩИХ ПРОЦЕСС ОБМЕНА КИСЛОРОДА ГАЗОВОЙ ФАЗЫ С ОКСИДНЫМИ МАТЕРИАЛАМИ | 2015 |
|
RU2598701C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КОЭФФИЦИЕНТА ДИФФУЗИИ В ПОРОШКОВЫХ МАТЕРИАЛАХ И СПОСОБ ОПРЕДЕЛЕНИЯ ТОЛЩИНЫ И ПОКАЗАТЕЛЯ ЦЕЛОСТНОСТИ ПОКРЫТИЯ НА ЧАСТИЦАХ ПОРОШКОВЫХ МАТЕРИАЛОВ | 2012 |
|
RU2522757C1 |
| Устройство для определения электрофизических свойств | 1984 |
|
SU1226239A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПАРАМЕТРОВ МАТЕРИАЛОВ | 1995 |
|
RU2120613C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КОЭФФИЦИЕНТА ВЗАИМНОЙ ДИФФУЗИИ МОЛЕКУЛ ГАЗОВ | 2014 |
|
RU2581512C1 |
| ПИГМЕНТ ДЛЯ ТЕРМОРЕГУЛИРУЮЩИХ ПОКРЫТИЙ КОСМИЧЕСКИХ АППАРАТОВ | 2018 |
|
RU2691328C1 |
Изобретение относится к физической химии и электрохимии твердых электролитов и может быть использовано для определения химического коэффициента обмена и химического коэффициента диффузии кислорода в оксидных материалах со смешанной электронной и кислород-ионной проводимостью. Способ включает использование значения давления кислорода над оксидом в замкнутом газовом контуре постоянного объема в качестве параметра оксида, напрямую связанного с изменением количества кислорода в оксиде. Для этого исследуемый образец помещают в реактор, вакуум-плотно соединенный с газовым контуром, изолированным от атмосферы, откачивают газовый контур на высокий вакуум, а для скачкообразного изменения величины давления кислорода над образцом перекрывают вакуум-плотное соединение реактора с газовым контуром, напускают в него или откачивают из него кислород высокой чистоты до значения давления, отличающегося от равновесного, после чего открывают вакуум-плотное соединение реактора с газовым контуром и регистрируют изменение значения давления кислорода над образцом во времени, и расчет химического коэффициента обмена и химического коэффициента диффузии кислорода производят на основании зависимости относительного изменения давления кислорода над оксидом от времени, полученной после смены величины давления кислорода. Техническим результатом является создание возможности мгновенной смены давления кислорода, расширение рабочего диапазона температур для образцов с высокими значениями коэффициентов химического обмена и диффузии, сокращение расхода кислорода по сравнению с проточными системами, достижение высокой точности измерений давления в системе для оксидов с низкими значениями коэффициентов химического обмена и диффузии. 2 ил.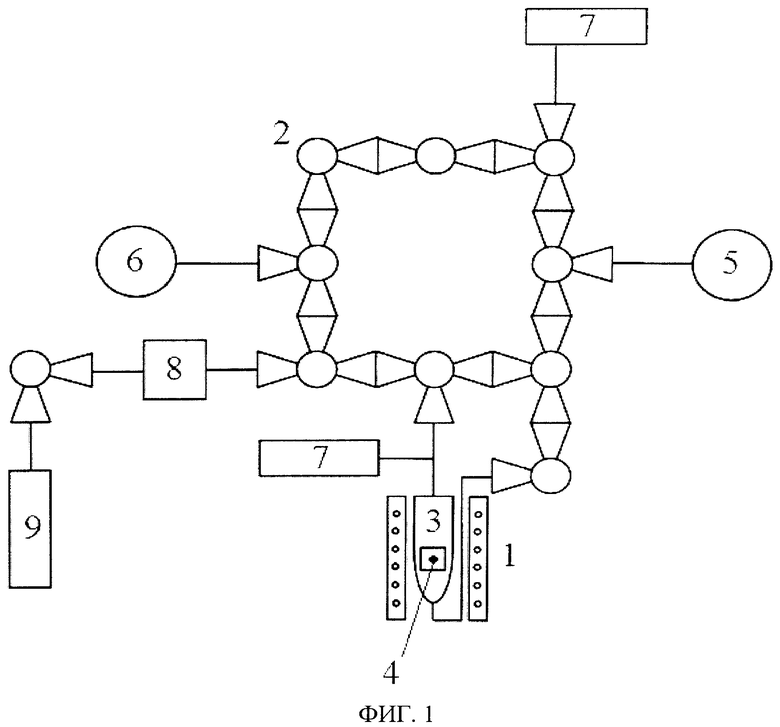
Способ определения химического коэффициента обмена и химического коэффициента диффузии кислорода в оксидных материалах, в котором исследуемый образец помещают в реактор, соединенный с газовым контуром, образец приводят в равновесие с газовой фазой, скачкообразно изменяют величину давления кислорода над образцом, регистрируют изменение во времени значения параметра оксида, напрямую связанного с изменением количества кислорода в оксиде, и на основании зависимости этого параметра от времени, полученной после смены величины давления кислорода, производят расчет химического коэффициента обмена и химического коэффициента диффузии кислорода по модели Крэнка, отличающийся тем, что в качестве параметра оксида, напрямую связанного с изменением количества кислорода в оксиде, используют значение давления кислорода над оксидом в замкнутом газовом контуре постоянного объема, для этого исследуемый образец помещают в реактор, вакуум-плотно соединенный с газовым контуром, изолированным от атмосферы, откачивают газовый контур на высокий вакуум, а для скачкообразного изменения величины давления кислорода над образцом перекрывают вакуум-плотное соединение реактора с газовым контуром, напускают в него или откачивают из него кислород высокой чистоты до значения давления, отличающегося от равновесного, после чего открывают вакуум-плотное соединение реактора с газовым контуром и регистрируют изменение значения давления кислорода над образцом во времени, и расчет химического коэффициента обмена и химического коэффициента диффузии кислорода производят на основании зависимости относительного изменения давления кислорода над оксидом от времени, полученной после смены величины давления кислорода.
| Охлупин Ю.С., Исследование обмена и диффузии кислорода в композиционных материалах методом релаксации электропроводности, 2011 | |||
| US 20040134258 A1 15.07.2004 | |||
| Способ определения окислительной активности углей и устройство для его осуществления | 1982 |
|
SU1060991A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ДИФФУЗИОННОЙ СПОСОБНОСТИ ЛЕГКИХ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1991 |
|
RU2029951C1 |
Авторы
Даты
2015-08-20—Публикация
2014-04-22—Подача