Изобретение относится к электрохимии твердых кислород - ионных электролитов и может быть использовано для исследования кинетики межфазного обмена в системе «газ – электрохимическая ячейка» с использованием метода изотопного обмена в условиях поляризации электродов, т.е. в условиях, приближенных к реальным условиям работы электрохимических устройств.
Наиболее близким к заявляемому способу является способ измерения скорости межфазного обмена кислорода, коэффициента диффузии кислорода и вкладов трех типов обмена кислорода, описанный в RU 144462, публ. 09.04.2014. В этом способе для исследования кинетики взаимодействия кислорода газовой фазы с исследуемыми оксидными материалами используют метод изотопного обмена кислорода с анализом газовой фазы. Важной особенностью данного способа является возможность изучения перераспределения неметалла в системе «твердое тело – газ» в условиях химического или адсорбционно – десорбционного равновесия. Исследуемый образец при комнатной температуре и давлении помещают в кварцевый реактор, через который осуществляют циркуляцию газа по газовому контуру, сообщающемуся с реактором с образованием общего газового пространства, газовый контур с реактором откачивают на высокий вакуум, открывают сообщение между масс-спектрометром и газовым контуром, посредством масс-спектрометра стабилизируют ионный ток массовых чисел 18, 28 или 32, задают температуру и давление, при которых необходимо провести измерения, исследуемый образец приводят в равновесие с газовой фазой, перекрывают сообщение реактора с газовым контуром, из газового контура откачивают кислород природного изотопного состава и напускают обогащенный изотопом кислород 18О, посредством масс-спектрометра записывают зависимости ионного тока для массовых чисел 32, 34, 36 от времени, устанавливают постоянный поток между газовым контуром и масс-спектрометром, после этого открывают реактор и начинают процесс исследований с помощью изотопного обмена.
Данный способ позволяет рассчитать значения скорости межфазного обмена кислорода (rH), коэффициента диффузии кислорода (D0) и вкладов трех типов обмена кислорода (r0, r1, r2), характеризующие кинетику взаимодействия кислорода газовой фазы с оксидными материалами. Данный метод позволяет исследовать электродные процессы в электрохимических ячейках на основе твердых кислород - ионных электролитов в условиях адсорбционно – десорбционного равновесия, однако, в реальных условиях использования электрохимических устройств в системе «электрод – электролит» возникает поляризация электродов, влияние которой может привести к изменению механизма электродного процесса.
Задача настоящего изобретения заключается в создании способа исследования кинетики межфазного обмена в системе «газ – электрохимическая ячейка» с использованием метода изотопного обмена в условиях, приближенных к реальным условиям работы электрохимических устройств.
Для этого предложен способ исследования кинетики межфазного обмена в системе «газ – электрохимическая ячейка» с использованием изотопного обмена в условиях поляризации электродов, в котором, как и в способе прототипе, исследуемый образец при комнатной температуре и давлении помещают в кварцевый реактор, через который осуществляют циркуляцию газа по газовому контуру, сообщающемуся с реактором с образованием общего газового пространства, газовый контур с реактором откачивают на высокий вакуум, посредством масс-спектрометра стабилизируют ионный ток массовых чисел 18, 28 или 32, задают температуру и давление, при которых необходимо провести измерения, исследуемый образец приводят в равновесие с газовой фазой, перекрывают сообщение реактора с газовым контуром, из газового контура откачивают кислород природного изотопного состава и напускают обогащенный изотопом кислород 18О, посредством масс-спектрометра записывают зависимости ионного тока для массовых чисел 32, 34, 36 от времени, открывают вакуумный кран между масс-спектрометром и газовым контуром, устанавливают постоянный поток между газовым контуром и масс-спектрометром, после этого открывают реактор и начинают процесс исследований с помощью изотопного обмена.
Заявленный способ отличается тем, что в качестве исследуемого образца в кварцевый реактор помещают электрохимическую ячейку, разделяющую общее газовое пространство на две части, и после установления равновесия электрохимической ячейки с газовой фазой, перекрывают сообщение реактора с одной из частей разделенного газового пространства, а из оставшейся его части откачивают кислород природного изотопного состава и напускают туда обогащенный изотопом кислород 18О, причем в момент открытия сообщения реактора с одной из частей разделенного газового пространства, на электроды электрохимической ячейки подают напряжение.
Способ также отличается тем, что электрохимическую ячейку помещают в кварцевый реактор посредством трубки из электролита, один из торцов которой имеет присоединительный металлический фланец, а к другому вакуумплотно присоединена электрохимическая ячейка в форме таблетки или трубки с электродами, симметрично нанесенными на ее противоположные стороны, при этом фланец размещают между реактором и газовым контуром таким образом, чтобы трубка с электрохимической ячейкой находилась внутри реактора, один из электродов электрохимической ячейки взаимодействовал с одной из частей разделенного газового пространства, другой – с его оставшейся частью, а напряжение на электроды подают через токоподводы, вакуумплотно выведенные через отверстия в присоединительном фланце трубки.
Заявленный способ позволяет исследовать кинетику межфазного обмена кислорода в системе «газ – электрохимическая ячейка» с использованием метода изотопного обмена при наложении разности потенциалов на электроды электрохимической ячейки, что дает возможность напрямую получать значения скорости межфазного обмена кислорода (rH), коэффициента диффузии кислорода (D0) и вкладов трех типов обмена кислорода (r0, r1, r2) в условиях поляризации электродов. Это есть новый технический результат, достигаемый заявленным изобретением.
Изобретение иллюстрируется рисунками, где на фиг. 1 изображена принципиальная схема реализации заявленного способа; на фиг. 2 – конструктивная схема размещения с помощью трубки из электролита электрохимической ячейки, разделяющей газовое пространство; на фиг. 3 – элемент присоединения электрохимической ячейки к торцу трубки из электролита; на фиг. 4 и 5 представлены характерные зависимости доли изотопа кислорода 18O и степени отклонения концентрации молекул 18O2 в газовой фазе от равновесной, показывающие различие в кинетике взаимодействия кислорода газовой фазы с электрохимической ячейкой O2, Pt | YSZ | Pt, O2 в зависимости от поляризации электродов.
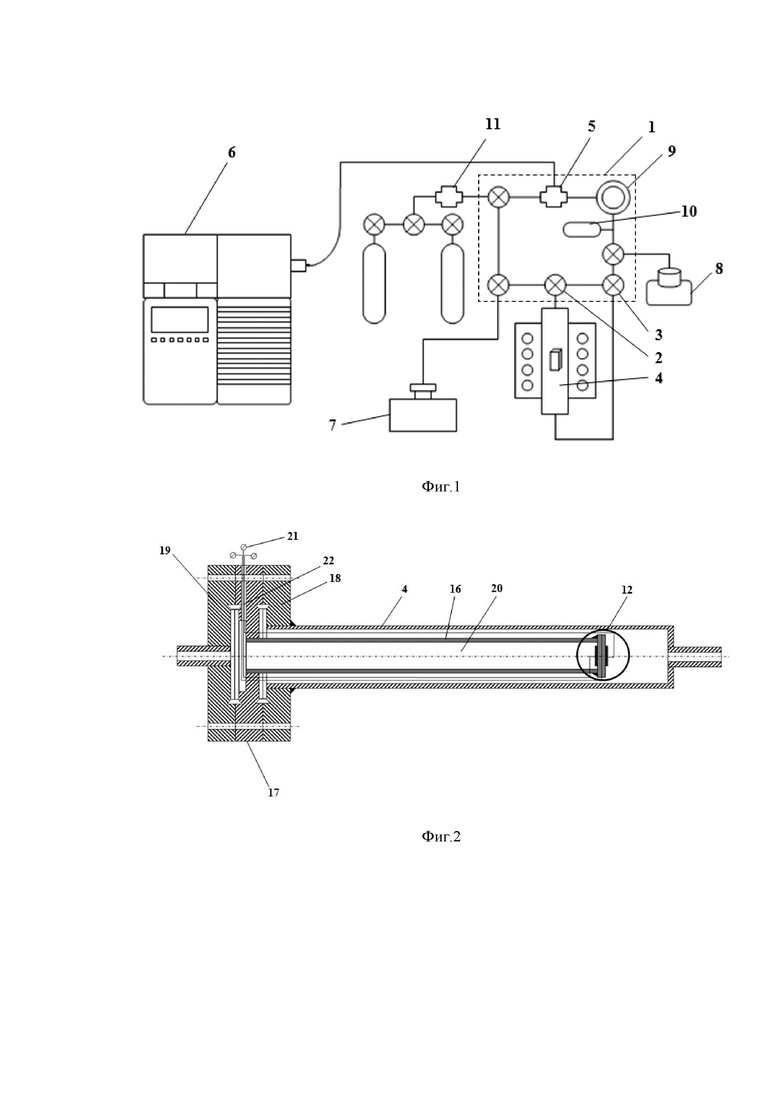
Изучение кинетики обмена кислорода заявленным способом проводили в статической циркуляционной установке. Установка содержит газовый контур объемом ~500 мл, по контуру циркулирует кислород, в котором в процессе эксперимента изменяется изотопный состав по трем компонентам: 16O2, 16O18O и 18O2.
Газовый контур 1 через трех-ходовые вакуумные краны 2,3 соединен с кварцевым реактором 4. Через этот реактор осуществляют циркуляцию газа по газовому контуру, сообщающемуся с реактором 4 с образованием общего с ним газового пространства (не показано). Кварцевый реактор 4 через вакуумный кран игольчатого типа 5 соединен с квадрупольным масс-спектрометром 6 марки Agilent 5973N. Вакуумные краны 2,3 и 5 могут перекрывать сообщение газового контура 1 с реактором 4 и с масс-спектрометром 6.
Циркуляционная установка снабжена трех-ступенчатой системой откачки. Откачка на форвакуум осуществляется с помощью вакуумного поста 7 марки MiniTask 2 (Agilent, США), состоящего из мембранного и турбомолекулярного насосов с датчиком на вакуум магнетронного типа. Вакуумный пост позволяет добиться остаточного давления ~10–5 мбар. Третья ступень откачки осуществляется высоко вакуумным магниторазрядным насосом 8 типа НМД 0.16-1, с помощью которого достигается остаточное давление порядка 10–8 мбар.
Для откачки вакуумной системы масс-спектрометра используется насос типа Edwards B2M1.5. Давление на фор-линии масс-спектрометра в рабочем состоянии установки достигает ~10–3 мбар. Для получения высокого вакуума в системе масс-спектрометра используется паромасляный диффузионный насос, достигаемое остаточное давление которого составляет порядка 10–6 мбар. Для ускорения перемешивания газа в контуре использовали циркуляционный насос 9. Давление измеряли с помощью комбинированного датчика 10 Баярда – Альперта – Пирани FRG-720 (Varian, США), позволяющего измерять давление в диапазоне от 10–10 мбар до 1 бар. Напуск газов в контур осуществляли из баллонов с помощью системы напуска 11 типа СНА-2.
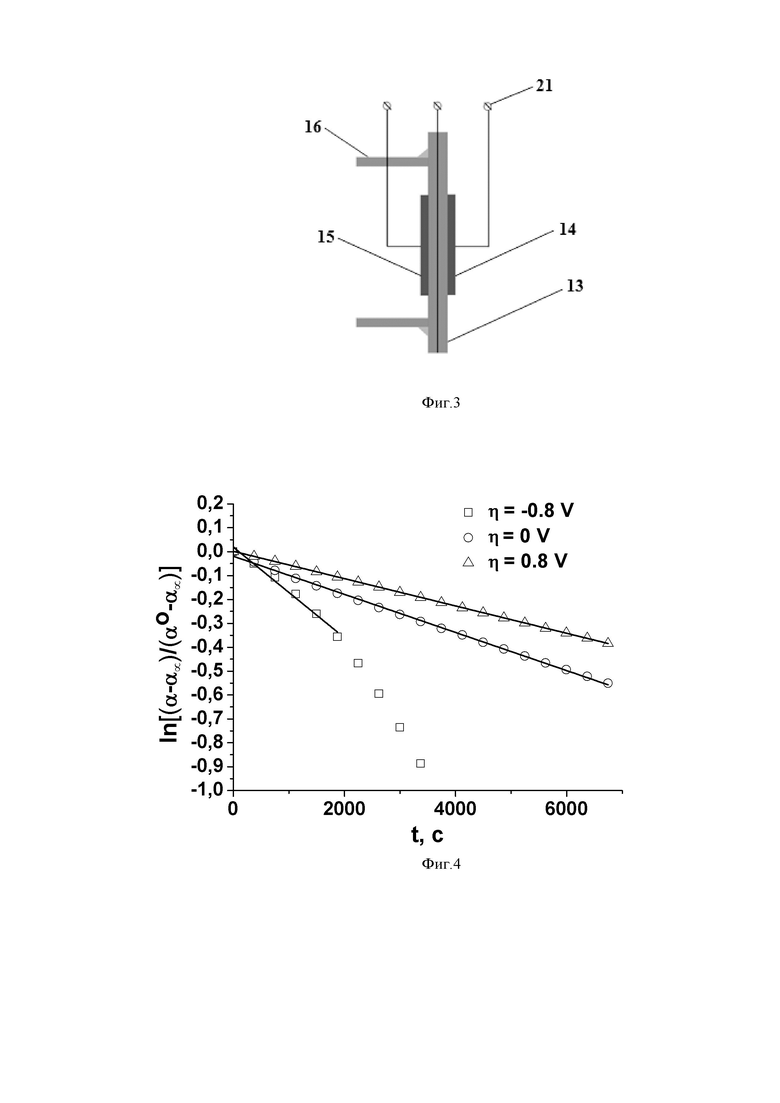
Электрохимическая ячейка 12 представляет собой электролит в форме круглой таблетки 13 с симметрично нанесенными на ее противоположные стороны электродами 14 и 15. Электрохимическую ячейку 12 с помощью высокотемпературного стекло-керамического герметика вакуумплотно приклеивали к торцу трубки 16 из электролита, на противоположном торце которой имеется фланец 17 из нержавеющей стали, предназначенный для размещения трубки из электролита 16 в реакторе 4. Фланец 17 размещали между фланцем 18 реактора 4 и фланцем 19 вакуумного крана 2 или 3 таким образом, чтобы трубка 16 с электрохимической ячейкой 12 находилась внутри реактора 4 и разделяла общее газовое пространство контура 1 и реактора 4, на две части, одна из которых образована с участием полости 20 трубки 16 из электролита. С внешней стороны трубки 16 размещены токоподводы 21, которые с целью электрической изоляции вакуумплотно выведены с помощью алундовой трубки через отверстия 22 во фланце 17, герметизированные с помощью эпоксидной смолы.
Трубку 16 с электрохимической ячейкой 12 помещали в реактор 4 при комнатной температуре, проводили откачку газового контура с реактором на высокий вакуум при его прогреве до температуры 100°C с включенным кожухом для исключения в контуре паров воды. После включения масс-спектрометра 6 проводили выдержку около 12 часов для того, чтобы ионный ток массовых чисел 18, 28, 32 стабилизировался.
До начала измерений при заданной температуре и давлении кислорода электрохимическую ячейку привели в равновесие с газовой фазой. Перед напуском в газовый контур изотопнообогащенной смеси при необходимом давлении и температуре эксперимента выдерживали реактор с электрохимической ячейкой в течение не менее 15 ч в атмосфере кислорода природного изотопного состава, в котором доля изотопа кислорода 18O равна 0.02 ат.%. Возможность установления равновесия является одним из основных преимуществ метода изотопного обмена с анализом газовой фазы. Основной критерий установившегося равновесия с газовой фазой — постоянство давления в системе.
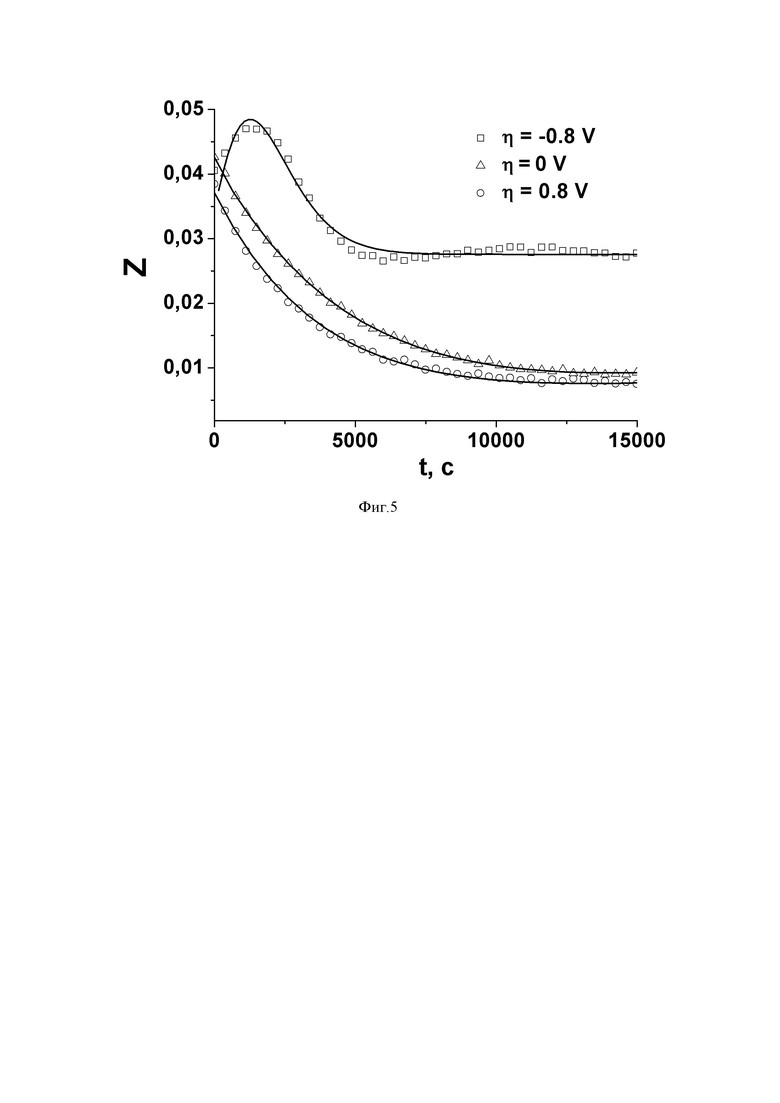
В данном примере после установления равновесия электрохимической ячейки 12 с газовой фазой с помощью вакуумного крана 2 перекрывали сообщение реактора 4 с частью разделенного газового пространства, образованного с участием полости 20 трубки 16, а из оставшейся части газового пространства откачивали кислород природного изотопного состава и напускали туда обогащенный изотопом кислород 18О. В момент открытия сообщения реактора 4 с частью разделенного газового пространства, на электроды 14,15 электрохимической ячейки 12 подавали напряжение и посредством масс-спектрометра 6 записывали зависимости ионного тока для массовых чисел 32, 34, 36 от времени. Характерные зависимости доли изотопа кислорода 18O и степени отклонения концентрации молекул 18O2 в газовой фазе от равновесной, показывающие различие в кинетики взаимодействия кислорода газовой фазы с электрохимической ячейкой O2, Pt | YSZ | Pt, O2 в зависимости от поляризации электродов, изображены на фиг. 4 и фиг. 5.
Экспериментально полученные зависимости концентрации 32, 34 и 36 массы (С32, С34, С36) и изменения содержания изотопа кислорода 18O в газовой фазе (α) от времени использовали для расчета значений скорости межфазного обмена кислорода (rH), коэффициента диффузии кислорода (D0) и вкладов трех типов обмена кислорода (r0, r1, r2) с помощью уравнений (1)–(4).
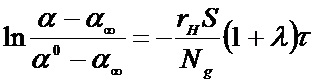
где rH – скорость межфазного обмена (или скорость гетерообмена), выраженная через количество атомов кислорода, обменивающихся в единицу времени на единице поверхности твердого тела; S – площадь поверхности твердого тела (в нашем случае, электрода); Ng – количество атомов кислорода в газовой фазе; α, α0 и α∞ – доля изотопа кислорода в газовой фазе в текущий, начальный момент времени и после достижения состояния равновесия, соответственно.
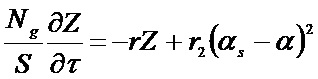
где Z – изменение концентрации молекулы кислорода 18O2 в текущий момент времени по сравнению с равновесной концентрацией, r – общая скорость обмена кислорода; r2 – скорость обмена кислорода по r2-типу (протекает с участием двух атомов кислорода с поверхности оксида); αs – доля изотопа кислорода на поверхности твердого тела.
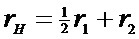
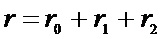
где r0 – скорость обмена кислорода по r0-типу (протекает без участия атомов кислорода с поверхности оксида), r1 – скорость обмена кислорода по r1-типу (протекает с участием одного атома кислорода с поверхности оксида).
Из фиг. 4 и фиг. 5 видно, что на вид и характер зависимостей доли изотопа кислорода 18O и степени отклонения концентрации молекул 18O2 в газовой фазе от равновесной оказывает влияние поляризация электродов. В случае с катодной поляризацией (η < 0) кинетика изотопного обмена в чистом виде соответствует одностадийному механизму обмена кислорода со стадией адсорбции кислорода по r1-типу. При (η ≥ 0) кинетика изотопного обмена соответствует механизму обмена кислорода, включающему стадию диссоциативной адсорбции по r0-типу, причем при отсутствии поляризации стадия диссоциативной адсорбции по r0-типу является скоростьопределяющей.
Таким образом, заявленный способ позволяет исследовать кинетику межфазного обмена в системе «газ – электрохимическая ячейка» с использованием метода изотопного обмена в условиях, приближенных к реальным условиям работы электрохимических устройств.
Изобретение относится к электрохимии твердых кислород - ионных электролитов. Способ согласно изобретению заключается в том, что исследуемый образец при комнатной температуре и давлении помещают в кварцевый реактор, через который осуществляют циркуляцию газа по газовому контуру, сообщающемуся с реактором с образованием общего газового пространства, газовый контур с реактором откачивают на высокий вакуум, открывают сообщение между масс-спектрометром и газовым контуром, посредством масс-спектрометра стабилизируют ионный ток массовых чисел 18, 28 или 32, задают температуру и давление, при которых необходимо провести измерения, исследуемый образец приводят в равновесие с газовой фазой, перекрывают сообщение реактора с газовым контуром, из газового контура откачивают кислород природного изотопного состава и напускают обогащенный изотопом кислород 18О, посредством масс-спектрометра записывают зависимости ионного тока для массовых чисел 32, 34, 36 от времени, устанавливают постоянный поток между газовым контуром и масс-спектрометром, после этого открывают реактор и начинают процесс исследований с помощью изотопного обмена. При этом в качестве исследуемого образца в кварцевый реактор помещают электрохимическую ячейку, разделяющую общее газовое пространство на две части, и после установления равновесия электрохимической ячейки с газовой фазой, перекрывают сообщение реактора с одной из частей разделенного газового пространства, а из оставшейся его части откачивают кислород природного изотопного состава и напускают туда обогащенный изотопом кислород 18О, причем в момент открытия сообщения реактора с одной из частей разделенного газового пространства, на электроды электрохимической ячейки подают напряжение. Изобретение направлено на исследование кинетики межфазного обмена в системе «газ – электрохимическая ячейка» с использованием метода изотопного обмена в условиях поляризации электродов. 1 з.п. ф-лы, 5 ил.
1. Способ исследования кинетики межфазного обмена в системе «газ – электрохимическая ячейка» с использованием изотопного обмена в условиях поляризации электродов, в котором исследуемый образец при комнатной температуре и давлении помещают в кварцевый реактор, через который осуществляют циркуляцию газа по газовому контуру, сообщающемуся с реактором с образованием общего газового пространства, газовый контур с реактором откачивают на высокий вакуум, открывают сообщение между масс-спектрометром и газовым контуром, посредством масс-спектрометра стабилизируют ионный ток массовых чисел 18, 28 или 32, задают температуру и давление, при которых необходимо провести измерения, исследуемый образец приводят в равновесие с газовой фазой, перекрывают сообщение реактора с газовым контуром, из газового контура откачивают кислород природного изотопного состава и напускают обогащенный изотопом кислород 18О, посредством масс-спектрометра записывают зависимости ионного тока для массовых чисел 32, 34, 36 от времени, устанавливают постоянный поток между газовым контуром и масс-спектрометром, после этого открывают реактор и начинают процесс исследований с помощью изотопного обмена, отличающийся тем, что в качестве исследуемого образца в кварцевый реактор помещают электрохимическую ячейку, разделяющую общее газовое пространство на две части, и после установления равновесия электрохимической ячейки с газовой фазой, перекрывают сообщение реактора с одной из частей разделенного газового пространства, а из оставшейся его части откачивают кислород природного изотопного состава и напускают туда обогащенный изотопом кислород 18О, причем в момент открытия сообщения реактора с одной из частей разделенного газового пространства, на электроды электрохимической ячейки подают напряжение.
2. Способ по п.1, отличающийся тем, что электрохимическую ячейку помещают в кварцевый реактор посредством трубки из электролита, один из торцов которой имеет присоединительный металлический фланец, а к другому вакуумплотно присоединена электрохимическая ячейка в форме таблетки или трубки с электродами, симметрично нанесенными на ее противоположные стороны, при этом фланец размещают между реактором и газовым контуром таким образом, чтобы трубка с электрохимической ячейкой находилась внутри реактора, один из электродов электрохимической ячейки взаимодействовал с одной из частей разделенного газового пространства, другой – с его оставшейся частью, а напряжение на электроды подают через токоподводы, вакуумплотно выведенные через отверстия в присоединительном фланце трубки.
| Устройство для непрерывной накатки ткани в рулоны | 1961 |
|
SU144462A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КИНЕТИЧЕСКИХ ПАРАМЕТРОВ, ХАРАКТЕРИЗУЮЩИХ ПРОЦЕСС ОБМЕНА КИСЛОРОДА ГАЗОВОЙ ФАЗЫ С ОКСИДНЫМИ МАТЕРИАЛАМИ | 2015 |
|
RU2598701C1 |
| WO 9961127 A1, 02.12.1999. | |||
Авторы
Даты
2017-08-03—Публикация
2016-11-18—Подача