ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области рекомбинантного получения белков и, более конкретно, к рекомбинантному получению белков шелка пауков (спидроинов). В настоящем изобретении предложен способ получения полимеров из выделенного белка шелка паука. Также предложены новые белки шелка пауков, способы и молекулы полинуклеиновых кислот для получения таких белков и их полимеров.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Шелка пауков представляют собой высокоэффективные природные полимеры, приобретающие исключительную упругость и растяжимость благодаря комбинации прочности на разрыв и эластичности. Пауки имеют вплоть до семи различных желез, которые продуцируют целый ряд типов шелка с различными механическими свойствами и функциями. Канатный шелк, продуцируемый большой ампуловидной железой, является самым прочным волокном, и на основе массы превосходит сделанные человеком материалы, такие как высокопрочная сталь. Свойства канатного шелка являются привлекательными при разработке новых материалов для медицинских или технических целей.
Канатный шелк состоит из двух основных полипептидов, в основном известных как спидроин большой ампуловидной железы (MaSp) 1 и 2, но, например, и как ADF-3 и ADF-4 у Araneus diadematus. Эти белки имеют молекулярные массы в диапазоне 200-720 кДа. Гены, кодирующие канатные белки Latrodectus hesperus, являются единственными генами, которые были полностью охарактеризованы, и гены MaSp1 и MaSp2 кодируют 3129 и 3379 аминокислот, соответственно (Ayoub NA et al. PLos ONE 2(6): e514, 2007). Свойства полипептидов канатного шелка обсуждаются в Huemmerich, D. et al., Curr. Biol. 14, 2070-2074 (2004).
Белки канатного шелка пауков, или MaSp, имеют трехкомпонентный состав: неповторяющийся N-концевой домен, центральную повторяющуюся область, состоящую из многих повторяющихся сегментов поли-Ala/Gly, и неповторяющийся C-концевой домен. Обычно считается, что данная повторяющаяся область образует межмолекулярные контакты в волокнах шелка, тогда как точные функции концевых доменов меньше ясны. Также считается, что в связи с образованием волокна повторяющаяся область претерпевает структурную конверсию из случайной спирали и α-спиральной конформации в β-складчатый слой. C-концевая область спидроинов обычно является консервативной среди видов пауков и типов шелка. N-концевой домен шелка пауков является наиболее консервативной областью, но его функция не понятна. В Rising, A. et al. Biomacromolecules 7, 3120-3124 (2006) охарактеризован 5'-конец гена MaSp1 Euprosthenops australis и выведена соответствующая аминокислотная последовательность. N-концевой домен белка MaSp1 рекомбинантно экспрессируют.
Белки шелка пауков и их фрагменты трудно получать рекомбинантно в растворимой форме. Большинство предыдущих попыток получить искусственные волокна шелка пауков включали стадии солюбилизации в нефизиологических растворителях. Несколько факторов затрудняют экспрессию белков канатного шелка. Благодаря чрезвычайно повторяющейся природе данных генов и сопутствующему ограниченному аминокислотному составу белков наблюдаются ошибки транскрипции и трансляции. Другой причиной может быть истощение пулов тРНК в микробных системах экспрессии с последующей прерывистой трансляцией, приводящей к преждевременному завершению синтеза белка. Другими обсуждавшимися причинами ограничения белкового синтеза являются образование вторичной структуры мРНК и рекомбинация генов. Было показано, что нативные гены MaSp более 2,5 т.п.н. являются нестабильными в бактериальных хозяевах. Кроме того, существуют трудности в поддержании рекомбинантных белков шелка в растворимой форме, поскольку и фрагменты канатного шелка природного происхождения, и сконструированные блок-сополимеры, особенно белки, происходящие из MaSp1/ADF-4, легко подвергаются самосборке в аморфные агрегаты, что приводит к осаждению и потере белка. См. Huemmerich, D. et al. Biochemistry 43, 13604-13612 (2004) и Lazaris, A. et al. Science 295, 472-476 (2002).
При попытках получить искусственные шелка пауков использовали природные или синтетические генные фрагменты, кодирующие белки канатного шелка. Рекомбинантные белки канатного шелка были экспрессированы в различных системах, включая бактерии, дрожжи, клетки млекопитающих, растения, клетки насекомых, трансгенных тутовых шелкопрядов и трансгенных коз. См., например, Lewis, R.V. et al. Protein Expr. Purif. 7, 400-406 (1996); Fahnestock, S. R. & Irwin, S. L. Appl. Microbiol. Biotechnol. 47, 23-32 (1997); Arcidiacono, S. et al. Appl. Microbiol. Biotechnol. 49, 31-38 (1998); Fahnestock, S. R. & Bedzyk, L. A. Appl. Microbiol. Biotechnol. 47, 33-39 (1997); и Lazaris, A. et al. Science 295, 472-476 (2002).
В Huemmerich, D. et al. Biochemistry 43, 13604-13612 (2004) описан синтетический ген "(AQ)12NR3", кодирующий повторяющиеся Ala-богатые и Gly/Gln-богатые фрагменты и неповторяющийся фрагмент, которые все происходят из ADF3 из Araneus. Этот ген экспрессируется в растворимый белок, который агрегирует, но не образует полимеры или волокна.
В WO 03/057727 описана экспрессия растворимых рекомбинантных полипептидов шелка в линиях клеток млекопитающих и животных. Полученные полипептиды шелка демонстрируют плохую растворимость в водных средах и/или образуют осадки. Поскольку полученные полипептиды шелка не полимеризуются спонтанно, требуется вытягивание нити для получения полимеров или волокон. Экспрессирующиеся полипептиды шелка содержат множество повторяющихся звеньев и неповторяющееся звено, происходящее из карбоксильной концевой области белков шелка пауков.
В WO 07/078239 и Stark, M. et al. Biomacromolecules 8, 1695-1701, (2007) описан миниатюрный белок шелка паука, состоящий из повторяющегося фрагмента с высоким содержанием Ala и Gly и C-концевого фрагмента белка, а также растворимые слитые белки, содержащие белок шелка паука. Волокна белка шелка паука получают спонтанно при освобождении белка шелка паука от его партнера по слиянию. Небольшое звено слияния является необходимым и достаточным для образования волокна.
В Hedhammar, M. et al. Biochemistry 47, 3407-3417, (2008) исследуются эффекты нагревания, рН и соли на структуру и агрегацию, и/или полимеризацию рекомбинантных N- и C-концевых доменов спидроина и повторяющегося домена спидроина, содержащего четыре поли-Ala и Gly-богатых соблоков. Описано, что вторичная и третичная структура N-концевого домена остается неизменной, независимо от рН, и только детектированные стабильные агрегаты, которые образуются N-концевым доменом, представляют собой димеры. Вместо этого предполагают, что C-концевой домен играет главную роль в сборке белков шелка пауков.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Цель настоящего изобретения состоит в том, чтобы предложить способ получения полимеров из белков шелка пауков, где контролируется растворимость и полимеризация белков шелка пауков.
Цель настоящего изобретения состоит также в том, чтобы предложить способ получения волокон из белков шелка пауков, где контролируется растворимость белков шелка пауков и образование волокон.
Другая цель настоящего изобретения состоит в том, чтобы предложить новый белок шелка паука, который может давать волокна, пленки, пены, сети и ячеистые структуры из шелка паука.
Одна цель настоящего изобретения состоит в том, чтобы предложить водорастворимый белок шелка паука, с которым можно легко обращаться для полимеризации в волокна, при желании. Это свойство позволяет осуществлять все следующие стадии при физиологических условиях, что снижает риск токсичности и денатурации белка.
Еще одна цель настоящего изобретения состоит в том, чтобы предложить волокна нового белка шелка паука.
Одна цель настоящего изобретения состоит в том, чтобы предложить белки шелка пауков в крупном масштабе, с которыми можно легко обращаться для полимеризации в волокна, при желании.
Цель изобретения также состоит в том, чтобы предложить способы получения белков шелка пауков и волокон из белков шелка пауков.
Для этих и других целей, которые будут очевидны из следующего описания, согласно первому аспекту настоящего изобретения предложен способ получения полимеров из выделенного белка шелка паука, включающий стадии, на которых:
(1) берут белок шелка паука, состоящий из 170-760 аминокислотных остатков и содержащий:
N-концевой фрагмент, состоящий по меньшей мере из одного фрагмента из 100-160 аминокислотных остатков, происходящих из N-концевого фрагмента белка шелка паука; и
повторяющийся фрагмент из 70-300 аминокислотных остатков, происходящих из повторяющегося фрагмента белка шелка паука; и возможно
C-концевой фрагмент из 70-120 аминокислотных остатков, который происходит из C-концевого фрагмента белка шелка паука;
(2) берут раствор указанного белка шелка паука в жидкой среде при рН 6,4 или выше и/или ионной композицией, которая предотвращает полимеризацию указанного белка шелка паука, возможно, включают удаление липополисахаридов и других пирогенов;
(3) корректируют свойства указанной жидкой среды до рН 6,3 или ниже и ионной композиции, которая обеспечивает полимеризацию указанного белка шелка паука;
(4) оставляют белок шелка паука для образования полимеров, предпочтительно твердых полимеров, в жидкой среде, имеющей рН 6,3 или ниже и ионную композицию, которая обеспечивает полимеризацию указанного белка шелка паука; и
(5) выделяют белок шелка паука из указанной жидкой среды.
В одном воплощении рН жидкой среды со стадий (3) и (4) составляет 6,2 или ниже, например 6,0 или ниже. В одном воплощении рН жидкой среды со стадий (3) и (4) составляет 3 или выше, например 4,2 или выше. В некоторых воплощениях ионная сила жидкой среды со стадий (3) и (4) находится в диапазоне от 1 до 250 мМ.
В одном воплощении рН жидкой среды со стадии (2) составляет 6,7 или выше, например 7,0 или выше. В одном воплощении рН жидкой среды со стадии (2) находится в диапазоне от 6,4 до 6,8.
Согласно другому аспекту в настоящем изобретении предложен полимер из белка шелка паука, состоящий из 170-760 аминокислотных остатков и содержащий:
N-концевой фрагмент, состоящий по меньшей мере из одного фрагмента из 100-160 аминокислотных остатков, происходящих из N-концевого фрагмента белка шелка паука; и
повторяющийся фрагмент из 70-300 аминокислотных остатков, происходящих из повторяющегося фрагмента белка шелка паука; и возможно
C-концевой фрагмент из 70-120 аминокислотных остатков, который происходит из C-концевого фрагмента белка шелка паука.
В некоторых воплощениях этих двух аспектов белок шелка паука состоит из 170-600 аминокислотных остатков и содержит одиночный N-концевой фрагмент из 100-160 аминокислотных остатков, происходящих из N-концевого фрагмента белка шелка паука. В некоторых других воплощениях этих двух аспектов N-концевой фрагмент белка шелка паука содержит по меньшей мере два фрагмента из 100-160 аминокислотных остатков, происходящих из N-концевого фрагмента белка шелка паука.
В предпочтительных воплощениях этих двух аспектов белок выбран из группы белков, определенных формулами NT2-REP-CT, NT-REP-CT, NT2-REP и NT-REP, где:
NT представляет собой белковый фрагмент, имеющий от 100 до 160 аминокислотных остатков, который представляет собой N-концевой фрагмент, происходящий из белка шелка паука.
REP представляет собой белковый фрагмент, имеющий от 70 до 300 аминокислотных остатков, где указанный фрагмент выбран из группы L(AG)nL, L(AG)nAL, L(GA)nL, L(GA)nGL, где:
n представляет собой целое число от 2 до 10;
каждый индивидуальный сегмент А представляет собой аминокислотную последовательность из 8-18 аминокислотных остатков, где от 0 до 3 аминокислотных остатков не являются Ala, а остальные аминокислотные остатки представляют собой Ala;
каждый индивидуальный сегмент G представляет собой аминокислотную последовательность из 12-30 аминокислотных остатков, где по меньшей мере 40% аминокислотных остатков представляют собой Gly; и
каждый индивидуальный сегмент L представляет собой линкерную аминокислотную последовательность из 0-20 аминокислотных остатков; и
СТ представляет собой белковый фрагмент, имеющий от 70 до 120 аминокислотных остатков, который представляет собой C-концевой фрагмент, происходящий из белка шелка паука.
В одном воплощении полимер состоит из полимеризованных димеров белка шелка паука.
В предпочтительных воплощениях содержание липополисахаридов и других пирогенов составляет 1 EU(эндотоксиновая единица)/мг выделенного белка или ниже.
В одном воплощении полимер представляет собой волокно, пленку, пену, сеть или ячеистую структуру. В предпочтительном воплощении полимер представляет собой волокно, имеющее диаметр более 0,1 мкм и длину более 5 мм.
Согласно одному аспекту в настоящем изобретении предложен способ получения димеров выделенного белка шелка паука, включающий стадии, на которых:
(1) берут белок шелка паука из 170-760 аминокислотных остатков, содержащий:
N-концевой фрагмент, состоящий по меньшей мере из одного фрагмента из 100-160 аминокислотных остатков, происходящих из N-концевого фрагмента белка шелка паука; и
повторяющийся фрагмент из 70-300 аминокислотных остатков, происходящих из повторяющегося фрагмента белка шелка паука; и возможно
C-концевой фрагмент из 70-120 аминокислотных остатков, который происходит из C-концевого фрагмента белка шелка паука;
(2) берут раствор димеров белка шелка паука в жидкой среде с рН 6,4 или выше и/или ионной композицией, которая предотвращает полимеризацию указанного белка шелка паука; и
(3) выделяют димеры, полученные на стадии (2), возможно включают удаление липополисахаридов и других пирогенов.
В одном воплощении рН жидкой среды со стадии (2) составляет 6,7 или выше, например 7,0 или выше. В одном воплощении рН жидкой среды со стадии (2) находится в диапазоне от 6,4 до 6,8.
В одном воплощении стадия (1), на которой берут белок шелка паука, включает подстадии, на которых:
(а) экспрессируют молекулу полинуклеиновой кислоты, которая кодирует указанный белок шелка паука в подходящем хозяине; и
(б) выделяют белок, полученный на подстадии (а), возможно включают удаление липополисахаридов и других пирогенов.
Согласно одному аспекту в настоящем изобретении предложен димер белка шелка паука, состоящий из 170-760 аминокислотных остатков и содержащий:
N-концевой фрагмент, состоящий по меньшей мере из одного фрагмента из 100-160 аминокислотных остатков, происходящих из N-концевого фрагмента белка шелка паука; и
повторяющийся фрагмент из 70-300 аминокислотных остатков, происходящих из повторяющегося фрагмента белка шелка паука; и возможно
C-концевой фрагмент из 70-120 аминокислотных остатков, который происходит из C-концевого фрагмента белка шелка паука.
В некоторых воплощениях этих двух аспектов белок шелка паука состоит из 170-600 аминокислотных остатков и содержит один N-концевой фрагмент из 100-160 аминокислотных остатков, происходящих из N-концевого фрагмента белка шелка паука. В некоторых других воплощениях этих двух аспектов N-концевой фрагмент белка шелка паука содержит по меньшей мере два фрагмента из 100-160 аминокислотных остатков, происходящих из N-концевого фрагмента белка шелка паука.
Согласно другому аспекту в настоящем изобретении предложен выделенный белок шелка паука, который состоит из 170-760 аминокислотных остатков и выбран из группы белков, определенных формулами NT2-REP-CT, NT-REP-CT, NT2-REP и NT-REP, где:
NT представляет собой белковый фрагмент, имеющий от 100 до 160 аминокислотных остатков, который представляет собой N-концевой фрагмент, происходящий из белка шелка паука.
REP представляет собой белковый фрагмент, имеющий от 70 до 300 аминокислотных остатков, где указанный фрагмент выбран из группы L(AG)nL, L(AG)nAL, L(GA)nL, L(GA)nGL, где:
n представляет собой целое число от 2 до 10;
каждый индивидуальный сегмент А представляет собой аминокислотную последовательность из 8-18 аминокислотных остатков, где от 0 до 3 аминокислотных остатков не являются Ala, а остальные аминокислотные остатки представляют собой Ala;
каждый индивидуальный сегмент G представляет собой аминокислотную последовательность из 12-30 аминокислотных остатков, где по меньшей мере 40% аминокислотных остатков представляют собой Gly; и каждый индивидуальный сегмент L представляет собой линкерную аминокислотную последовательность из 0-20 аминокислотных остатков; и
СТ представляет собой белковый фрагмент, имеющий от 70 до 120 аминокислотных остатков, который представляет собой C-концевой фрагмент, происходящий из белка шелка паука.
В одном воплощении белок шелка паука состоит из 170-600 аминокислотных остатков и выбран из группы белков, определенных формулами NT-REP-CT и NT-REP.
В некоторых воплощениях белок шелка паука выбран из группы, состоящей из SEQ ID NO:3-5, 17, 19-23, 25 и 31.
Согласно одному аспекту в настоящем изобретении предложено применение белков шелка пауков по изобретению для получения димеров белка шелка паука.
Согласно одному аспекту в настоящем изобретении предложено применение белков шелка пауков по изобретению для получения полимеров белка шелка паука.
Согласно одному аспекту в настоящем изобретении предложено применение димера белка шелка паука по изобретению для получения полимеров из выделенного белка шелка паука.
В предпочтительных воплощениях этих аспектов указанные полимеры получают в жидкой среде, имеющей рН 6,3 или ниже и ионную композицию, которая обеспечивает полимеризацию указанного белка шелка паука.
Согласно одному аспекту в настоящем изобретении предложена композиция, содержащая выделенный белок шелка паука по изобретению, растворенный в жидкой среде, имеющей рН 6,4 или выше и/или ионную композицию, которая предотвращает полимеризацию указанного белка шелка паука.
В одном воплощении рН жидкой среды составляет 7,0 или выше. В одном воплощении рН жидкой среды находится в диапазоне от 6,4 до 6,8.
В некоторых воплощениях содержание липополисахаридов и других пирогенов в композиции составляет 1 EU/мг выделенного белка или ниже.
Согласно другому аспекту в настоящем изобретении предложена выделенная молекула полинуклеиновой кислоты, содержащая последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO:14-16, 18 и 24; последовательности нуклеиновой кислоты, кодирующие SEQ ID NO:3-5, 17, 19-23, 25 и 31; последовательности нуклеиновой кислоты, которые кодируют белок шелка паука согласно изобретению; и их комплементарные последовательности нуклеиновых кислот.
Согласно еще одному другому аспекту в настоящем изобретении предложен способ получения белка шелка паука согласно изобретению, включающий стадии, на которых:
(1) экспрессируют молекулу полинуклеиновой кислоты, которая кодирует указанный белок шелка паука в подходящем хозяине; и
(2) выделяют белок, полученный на стадии (1), возможно включают удаление липополисахаридов и других пирогенов.
Более того, предложен способ обратимой сборки полимера или олигомера из молекул одного типа или молекул нескольких разных типов, включающий стадии, на которых:
(1) берут указанные молекулы, причем каждая молекула включает:
(а) по меньшей мере одну первую связывающую группировку из 100-160 аминокислотных остатков, которые происходят из N-концевого фрагмента белка шелка паука, и
(б) вторую группировку, которая индивидуально выбрана из белков, нуклеиновых кислот, углеводов и липидов;
(2) берут раствор указанных молекул в жидкой среде с рН 6,4 или выше и/или ионной композицией, которая предотвращает полимеризацию или олигомеризацию указанных(ой) молекул(ы) через указанные связывающие группировки;
(3) корректируют свойства указанной жидкой среды до рН 6,3 или ниже и ионной композиции, которая обеспечивает полимеризацию или олигомеризацию указанных молекул через указанные связывающие группировки;
(4) обеспечивают сборку указанных молекул в полимер или олигомер через указанные связывающие группировки в жидкой среде, имеющей рН 6,3 или ниже и ионную композицию, которая обеспечивает полимеризацию или олигомеризацию указанных молекул через указанные связывающие группировки.
В одном воплощении указанные молекулы со стадии (1) являются идентичными, и указанный полимер или олигомер со стадии (4) является гомополимером или гомоолигомером. В другом воплощении указанные молекулы со стадии (1) не являются идентичными, и указанный полимер или олигомер со стадии (4) является гетерополимером или гетероолигомером.
В предпочтительных воплощениях указанный полимер или олигомер со стадии (4) растворяют в указанной жидкой среде, имеющей рН 6,3 или ниже и ионную композицию, которая обеспечивает полимеризацию или олигомеризацию указанных молекул.
В одном воплощении рН жидкой среды со стадий (3) и (4) составляет 6,2 или ниже, например 6,0 или ниже, и/или рН жидкой среды со стадий (3) и (4) составляет 3 или выше, например 4,2 или выше.
В некоторых воплощениях ионная сила жидкой среды со стадии (4) находится в диапазоне от 1 до 250 мМ.
В одном воплощении рН жидкой среды со стадии (2) составляет 6,7 или выше, например 7,0 или выше. В одном воплощении рН жидкой среды со стадии (2) находится в диапазоне от 6,4 до 6,8.
В предпочтительном воплощении указанная вторая группировка представляет собой белок.
В одном воплощении способ дополнительно включает стадию, на которой:
(5) корректируют свойства указанной жидкой среды до рН 6,4 или выше и/или ионной композиции, которая предотвращает полимеризацию или олигомеризацию указанных молекул, для разборки указанного полимера или олигомера.
В одном воплощении рН жидкой среды со стадии (2) и/или стадии (5) составляет 6,7 или выше, например 7,0 или выше. В одном воплощении рН жидкой среды со стадии (2) и/или стадии (5) находится в диапазоне от 6,4 до 6,8.
В предпочтительном воплощении полимер или олигомер со стадии (4) используют в исследованиях взаимодействия, разделении, индуцировании активности ферментных комплексов или FRET-анализе (резонансный перенос энергии флуоресценции).
В одном воплощении по меньшей мере один тип молекулы со стадии (1) иммобилизован на твердой подложке или на матрице аффинной среды.
Также предложен способ детектирования взаимодействий связывания между поднабором молекул, содержащимся в наборе молекул, включающий стадии, на которых:
(1) берут указанный набор молекул, где каждая молекула содержит:
(а) по меньшей мере одну первую связывающую группировку из 100-160 аминокислотных остатков, которая происходит из N-концевого фрагмента белка шелка паука, и
(б) вторую группировку, которая индивидуально выбрана из белков, нуклеиновых кислот, углеводов и липидов;
(2) берут раствор указанного набора молекул в жидкой среде с рН 6,4 или выше и/или ионной композицией, которая предотвращает полимеризацию или олигомеризацию указанных молекул;
(3) корректируют свойства указанной жидкой среды до рН 6,3 или ниже и ионной композиции, которая обеспечивает полимеризацию или олигомеризацию указанных молекул;
(4) обеспечивают сборку указанных молекул в полимер или олигомер через указанные связывающие группировки в жидкой среде, имеющей рН 6,3 или ниже и ионную композицию, которая обеспечивает полимеризацию или олигомеризацию указанных молекул;
(5) корректируют свойства указанной жидкой среды до рН 6,4 или выше и/или ионной композиции, которая предотвращает полимеризацию или олигомеризацию указанных молекул, для разборки указанного полимера или олигомера; и
(6) определяют присутствие взаимодействий связывания, которые не опосредованы указанные связывающие группировки, между двумя или более чем двумя разными молекулами, которые образуют указанный поднабор молекул.
Также предложено новое применение одной или более молекул, каждая из которых содержит:
(а) по меньшей мере одну первую связывающую группировку из 100-160 аминокислотных остатков, которые происходят из N-концевого фрагмента белка шелка паука, и
(б) вторую группировку, которая индивидуально выбрана из белков, нуклеиновых кислот, углеводов и липидов;
для обратимой сборки полимера или олигомера из указанных молекул через указанные связывающие группировки в растворе с рН 6,3 или ниже и ионной композицией, которая обеспечивает полимеризацию или олигомеризацию указанных молекул.
В предпочтительном воплощении полимер или олигомер используют в исследованиях взаимодействия, разделении, индуцировании активности ферментных комплексов или FRET-анализе.
В другом аспекте в настоящем изобретении предложена аффинная среда, содержащая матрицу и лиганд для аффинных взаимодействий, связанный с указанной матрицей, который содержит по меньшей мере один фрагмент из 100-160 аминокислотных остатков, который происходит из N-концевого фрагмента белка шелка паука.
В предпочтительном воплощении матрица выбрана из группы, состоящей из частиц и фильтров.
Другие аспекты и воплощения изобретения будут очевидны из описания изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг.1 показано выравнивание последовательности N-концевых фрагментов спидроина.
На Фиг.2 показано выравнивание последовательности C-концевых фрагментов спидроина.
На Фиг.3 проиллюстрирована рН-индуцированная и солезависимая полимеризация NT4Rep, NT4RepCT, 4Rep и 4RepCT.
На Фиг.4 показана турбидиметрия NT и NT4Rep при разных рН.
На Фиг.5 показано динамическое рассеяние света NT при рН 6 и 7.
На Фиг.6 показано динамическое рассеяние света NT при рН 6,1-7,2 в разных ионных композициях.
На Фиг.7 схематично показана рН-зависимая сборка белков, слитых с NT.
На Фиг.8 показаны электрофорезные гели слитых белков.
Список прилагаемых последовательностей:
SEQ ID NO:
1 4Rep
2 4RepCT
3 NT4Rep
4 NT5Rep
5 NT4RepCTHis
6 NT
7 CT
8 консенсусная последовательность NT
9 консенсусная последовательность CT
10 повторяющаяся последовательность из MaSp1 Euprosthenops australis
11 консенсусная последовательность 1 сегмента G
12 консенсусная последовательность 2 сегмента G
13 консенсусная последовательность 3 сегмента G
14 NT4Rep (ДНК)
15 NT4RepCT (ДНК)
16 NT5Rep (ДНК)
17 NT4RepCTHis2
18 NT4RepCTHis2 (ДНК)
19 ZbasicNT4RepCT
20 NT4RepCT
21 HisTrxHisThrNT4RepCT
22 NT4RepCT 2
23 HisNTNT4RepCT
24 HisNTNT4RepCT (ДНК)
25 NTSRepCT
26 HisNTMetSP-C33Leu
27 HisNTMetSP-C33Leu (ДНК)
28 HisNTNTMetSP-C33Leu
29 HisNTNTMetSP-C33Leu (ДНК)
30 NTHis
31 NTNT8RepCT
32 NTNTBrichos
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение в общем основано на изобретательском представлении о том, что ранее малопонятный N-концевой неповторяющийся фрагмент белков шелка пауков вовлечен в полимеризацию этих белков и, в частности, что образование полимеров, включающих этот фрагмент, можно точно контролировать путем варьирования некоторых параметров. Это представление было развито в новый способ получения полимеров выделенного белка шелка паука. Хотя примеры в силу необходимости относятся к конкретным белкам, в данном случае к белкам, происходящим из спидроина 1 (MaSp1, major spidroin 1) большой ампуловидной железы из Euprosthenops australis, считается, что описанный в данной заявке способ применим к любому аналогичному белку с целью получения полимеров.
Это представление также привело к идентификации нового мотива белка шелка паука, который является достаточным для рекомбинантной продукции волокон шелка пауков. Отсюда следует, что новый мотив белка шелка паука является полезным в качестве отправной точки для конструирования новых белков и генов шелка пауков, таких как белки и гены, о которых сообщается в данной заявке. Полимеры, которые образуются из белков, возникающих из новых спидроинов, являются полезными благодаря их физическим свойствам, особенно полезной комбинации высокой прочности, эластичности и легкой массы. Они также являются полезными благодаря их способности поддерживать прикрепление и рост клеток. Свойства канатного шелка являются привлекательными при разработке новых материалов для медицинских или технических целей. В частности, шелка пауков согласно изобретению являются полезными в медицинских устройствах, таких как имплантаты, и медицинских продуктах, таких как системы для ушивания ран, пластыри, шовные материалы, повязки на раны и каркасы для тканевой инженерии и направленной регенерации клеток. Шелка пауков согласно изобретению также являются особенно полезными для применения в качестве текстильного материала или ткани, таких как в парашютах, пуленепробиваемой одежде, ремнях безопасности и т.д. При применении этого способа больше не требуется введение отщепляемого партнера слияния, который отщепляется с использованием отщепляющих агентов во время процесса, когда полимеризация является желательной. Это облегчает получение и выход белков шелка пауков и их полимеров и обеспечивает преимущество в способе промышленного производства.
Термин "волокно", используемый в данном описании, относится к полимерам, имеющим толщину по меньшей мере 0,1 мкм, предпочтительно макроскопическим полимерам, которые различимы человеческим глазом, т.е. имеющим толщину по меньшей мере 1 мкм, и имеют значительную протяженность в длину по сравнению с их толщиной, предпочтительно превышающую 5 мм. Термин "волокно" не охватывает неструктурированные агрегаты или осадки.
Термины "спидроины" и "белки шелка пауков" используются взаимозаменяемо во всем описании и охватывают все известные белки шелка пауков, включая белки шелка пауков из большой ампуловидной железы, которые обычно сокращают как "MaSp", или "ADF" в случае Araneus diadematus. Эти белки шелка пауков из большой ампуловидной железы обычно относятся к двум типам - 1 и 2. Кроме того, эти термины включают новые белки согласно изобретению, как определено в прилагаемой формуле изобретения и детализированных воплощениях, и другие неприродные белки с высокой степенью идентичности и/или сходства с известными белками шелка пауков.
Таким образом, в настоящем изобретении предложен способ получения полимеров из выделенного белка шелка паука. На первой стадии берут рекомбинантный белок шелка паука. Белок шелка паука типично состоит из 170-760 аминокислотных остатков, например, из 170-600 аминокислотных остатков, предпочтительно из 280-600 аминокислотных остатков, например, из 300-400 аминокислотных остатков, более предпочтительно из 340-380 аминокислотных остатков. Маленький размер является выгодным, поскольку более длинные белки шелка пауков имеют тенденцию к образованию аморфных агрегатов, для солюбилизации и полимеризации которых требуется применение жестких растворителей. Рекомбинантный белок шелка паука может содержать более 760 остатков, в частности, в тех случаях, когда белок шелка паука содержит более двух фрагментов, происходящих из N-концевой части белка шелка паука, белок шелка паука содержит N-концевой фрагмент, состоящий по меньшей мере из одного фрагмента (NT), происходящего из соответствующей части белка шелка паука, и повторяющийся фрагмент (REP), происходящий из соответствующего внутреннего фрагмента белка шелка паука. Возможно, белок шелка паука содержит C-концевой фрагмент (СТ), происходящий из соответствующего фрагмента белка шелка паука. Белок шелка паука типично содержит единичный фрагмент (NT), происходящий из N-концевой части белка шелка паука, но в предпочтительных воплощениях N-концевой фрагмент включает по меньшей мере два, например два фрагмента (NT), происходящих из N-концевой части белка шелка паука. Таким образом, спидроин схематично можно представить формулой NTm-REP и, альтернативно, NTm-REP-CT, где m представляет собой целое число, которое равно 1 или более, например 2 или более, предпочтительно в диапазонах 1-2, 1-4, 1-6, 2-4 или 2-6. Предпочтительные спидроины можно схематично представить формулами NT2-REP или NT-REP и, альтернативно, NT2-REP-CT или NT-REP-CT. Данные фрагменты белка связаны ковалентно, типично посредством пептидной связи. В одном воплощении белок шелка паука состоит из фрагмента(тов) NT, связанного(ых) с фрагментом REP, который возможно связан с фрагментом СТ.
Фрагмент NT имеет высокую степень сходства с N-концевой аминокислотной последовательностью белков шелка пауков. Как показано на Фиг.1, эта аминокислотная последовательность является весьма консервативной среди различных видов и белков шелка пауков, включая MaSp1 и MaSp2. На Фиг.1 выровнены следующие фрагменты NT спидроина, обозначенные входящими номерами GenBank, когда это применимо:
Для каждой последовательности показана только часть, соответствующая N-концевому фрагменту, исключая сигнальный пептид. Nc flag и Nlm flag транслируются и редактируются согласно Rising А. et al. Biomacromolecules 7, 3120-3124 (2006)).
Отмечают, что NT имеет очевидный дипольный момент, поскольку кислотные и основные остатки локализуются в кластерах на противоположных полюсах. Не желая ограничиваться этим, подразумевают, что наблюдаемая полимеризация NT может вовлекать образование линейных массивов димеров NT, сложенных полюс к полюсу с отрицательной поверхностью одной субъединицы, обращенной к положительной поверхности соседней субъединицы в следующем димере в данном массиве.
Не является критичным, какой конкретный фрагмент NT присутствует в белках шелка пауков согласно изобретению, пока фрагмент NT не отсутствует полностью. Таким образом, фрагмент NT согласно изобретению может быть выбран из любой из аминокислотных последовательностей, показанных на Фиг.1, или последовательностей с высокой степенью сходства. В белке шелка паука согласно изобретению можно использовать широкий спектр N-концевых последовательностей. На основе гомологичных последовательностей, представленных на Фиг.1, следующая последовательность составляет консенсусную аминокислотную последовательность NT:
QANTPWSSPNLADAFINSF(M/L)SA(A/I)SSSGAFSADQLDDMSTIG(D/N/Q)TLMSAMD(N/S/K)MGRSG(K/R)STKSKLQALNMAFASSMAEIAAAESGG(G/Q)SVGVKTNAISDALSSAFYQTTGSVNPQFV(N/S)EIRSLI(G/N)M(F/L)(A/S)QASANEV(SEQ ID NO:8).
Последовательность фрагмента NT согласно изобретению имеет по меньшей мере 50%-ную идентичность, предпочтительно по меньшей мере 60%-ную идентичность с консенсусной аминокислотной последовательностью SEQ ID NO:8, которая основана на аминокислотных последовательностях, представленных на Фиг.1. В предпочтительном воплощении последовательность фрагмента NT согласно изобретению имеет по меньшей мере 65%-ную идентичность, предпочтительно по меньшей мере 70%-ную идентичность с консенсусной аминокислотной последовательностью SEQ ID NO:8. В предпочтительных воплощениях фрагмент NT согласно изобретению, кроме того, имеет 70%-ное, предпочтительно 80%-ное сходство с консенсусной аминокислотной последовательностью SEQ ID NO:8.
Репрезентативный фрагмент NT согласно изобретению представляет собой последовательность SEQ ID NO:6 Euprosthenops australis. Согласно предпочтительному воплощению изобретения фрагмент NT имеет по меньшей мере 80%-ную идентичность с SEQ ID NO:6 или любой индивидуальной аминокислотной последовательностью на Фиг.1. В предпочтительных воплощениях изобретения фрагмент NT имеет по меньшей мере 90%-ную, например, по меньшей мере 95%-ную идентичность с SEQ ID NO:6 или любой индивидуальной аминокислотной последовательностью на Фиг.1. В предпочтительных воплощениях изобретения фрагмент NT идентичен SEQ ID NO:6 или любой индивидуальной аминокислотной последовательности на Фиг.1, конкретно Еа MaSp1.
Фрагмент NT содержит от 100 до 160 аминокислотных остатков. Предпочтительно, чтобы фрагмент NT содержал по меньшей мере 100 или более 110, предпочтительно более 120 аминокислотных остатков. Также предпочтительно, чтобы фрагмент NT содержал самое большее 160 или менее 140 аминокислотных остатков. Типичный фрагмент NT содержит приблизительно 130-140 аминокислотных остатков.
Когда N-концевой фрагмент белка шелка паука содержит два или более фрагментов (NT), происходящих из N-концевого фрагмента белка шелка паука, он также может содержать один или более линкерных пептидов. Линкерный(е) пептид(ы) может (могут) быть расположен(ы) между двумя фрагментами NT и давать спейсер.
Белковый фрагмент REP имеет повторяющийся характер с чередующимися аланин-богатыми отрезками и глицин-богатыми отрезками. Фрагмент REP обычно содержит более 70, например более 140, и менее 300, предпочтительно менее 240, например менее 200 аминокислотных остатков и сам может быть разделен на несколько L (линкерных) сегментов, А (аланин-богатых) сегментов и G (глицин-богатых) сегментов, как будет более подробно объяснено ниже. Типично, указанные линкерные сегменты, которые являются возможными, расположены на концах фрагмента REP, тогда как остальные сегменты, в свою очередь, являются аланин-богатыми и глицин-богатыми. Таким образом, фрагмент REP обычно может иметь любую из следующих структур, где n представляет собой целое число:
L(AG)nL, например LA1G1A2G2A3G3A4G4A5G5L;
L(AG)nAL, например LA1G1A2G2A3G3A4G4A5G5A6L;
L(GA)nL, например LG1A1G2A2G3A3G4A4G5A5L; или
L(GA)nGL, например LG1A1G2A2G3A3G4A4G5A5G6L.
Отсюда следует, что не критично, является ли аланин-богатый или глицин-богатый сегмент, смежным с N-концевым или C-концевым линкерными сегментами. Предпочтительно, n представляет собой целое число от 2 до 10, предпочтительно от 2 до 8, предпочтительно от 4 до 8, более предпочтительно от 4 до 6, т.е. n=4, n=5 или n=6.
В предпочтительных воплощениях содержание аланина в REP-фрагменте согласно изобретению составляет выше 20%, предпочтительно выше 25%, более предпочтительно выше 30% и ниже 50%, предпочтительно ниже 40%, более предпочтительно ниже 35%. Это является предпочтительным, поскольку ожидается, что более высокое содержание аланина дает более жесткое и/или прочное и/или менее растяжимое волокно.
В некоторых воплощениях REP-фрагмент лишен остатков пролина, т.е. в REP-фрагменте нет остатков Pro.
Обращаясь теперь к сегментам, которые составляют фрагмент REP согласно изобретению, следует подчеркнуть, что каждый сегмент является индивидуальным, т.е. любые два сегмента А, любые два сегмента G или любые два сегмента L конкретного фрагмента REP могут быть идентичными или могут быть не идентичными. Таким образом, общим признаком изобретения не является то, что каждый тип сегмента идентичен в пределах конкретного фрагмента REP. Скорее, следующее описание дает специалисту инструкции о том, как конструировать индивидуальные сегменты и собирать их в REP-фрагмент, который является частью функционального белка шелка паука согласно изобретению.
Каждый индивидуальный сегмент А представляет собой аминокислотную последовательность, имеющую от 8 до 18 аминокислотных остатков. Предпочтительно, чтобы каждый индивидуальный сегмент А содержал от 13 до 15 аминокислотных остатков. Также возможно, чтобы большинство или более чем два из сегментов А содержали от 13 до 15 аминокислотных остатков, и чтобы меньшинство, например один или два из сегментов А содержали от 8 до 18 аминокислотных остатков, например 8-12 или 16-18 аминокислотных остатков. Значительное большинство этих аминокислотных остатков представляют собой остатки аланина. Более конкретно, от 0 до 3 аминокислотных остатков не являются остатками аланина, а остальные аминокислотные остатки представляют собой остатки аланина. Таким образом, все аминокислотные остатки в каждом индивидуальном сегменте А являются остатками аланина, без исключения или за исключением одного, двух или трех аминокислотных остатков, которые могут быть любой аминокислотой. Предпочтительно, чтобы аминокислота(ы), заменяющая аланин, представляла(и) собой природную аминокислоту, предпочтительно индивидуально выбранную из группы серина, глутаминовой кислоты, цистеина и глицина, более предпочтительно серина. Конечно, возможно, что один или более чем один из сегментов А представляет собой сегмент, состоящий только из аланина, тогда как остальные сегменты А содержат 1-3 неаланиновых остатка, таких как серин, глутаминовая кислота, цистеин или глицин.
В предпочтительном воплощении каждый сегмент А содержит 13-15 аминокислотных остатков, включая 10-15 остатков аланина и 0-3 неаланиновых остатка, как описано выше. В более предпочтительном воплощении каждый сегмент А содержит 13-15 аминокислотных остатков, включая 12-15 остатков аланина и 0-1 неаланиновый остаток, как описано выше.
Предпочтительно, чтобы каждый индивидуальный сегмент А имел по меньшей мере 80%-ную, предпочтительно по меньшей мере 90%-ную, более предпочтительно 95%-ную, наиболее предпочтительно 100%-ную идентичность с аминокислотной последовательностью, выбранной из группы аминокислотных остатков 7-19, 43-56, 71-83, 107-120, 135-147, 171-183, 198-211, 235-248, 266-279, 294-306, 330-342, 357-370, 394-406, 421-434, 458-470, 489-502, 517-529, 553-566, 581-594, 618-630, 648-661, 676-688, 712-725, 740-752, 776-789, 804-816, 840-853, 868-880, 904-917, 932-945, 969-981, 999-1013, 1028-1042 и 1060-1073 SEQ ID NO:10. Каждая последовательность из этой группы соответствует сегменту встречающейся в природе последовательности белка MaSp1 Euprosthenops australis, которая выведена в результате клонирования соответствующей кДНК, см. WO 2007/078239. В качестве альтернативы, каждый индивидуальный сегмент А имеет по меньшей мере 80%-ную, предпочтительно по меньшей мере 90%-ную, более предпочтительно 95%-ную, наиболее предпочтительно 100%-ную идентичность с аминокислотной последовательностью, выбранной из группы аминокислотных остатков 143-152, 174-186, 204-218, 233-247 и 265-278 SEQ ID NO:3. Каждая последовательность этой группы соответствует сегменту экспрессируемых неприродных белков шелка пауков согласно изобретению, которые обладают способностью образовывать волокна шелка в подходящих условиях (см. Пример 2). Таким образом, в некоторых воплощениях согласно изобретению каждый индивидуальный сегмент А идентичен аминокислотной последовательности, выбранной из вышеупомянутых аминокислотных сегментов. Не желая быть связанными какой-либо конкретной теорией, считают, что сегменты А согласно изобретению образуют спиральные структуры или бета-слои.
Термин "% идентичности" в том виде, как он используется во всем описании изобретения и прилагаемой формуле изобретения, рассчитывается следующим образом. Запрашиваемую последовательность выравнивают с целевой последовательностью с использованием алгоритма CLUSTAL W (Thompson, J.D., Higgins, D.G. and Gibson, T.J., Nucleic Acids Research, 22: 4673-4680 (1994)). Сравнение делают по всему диапазону, соответствующему самой короткой из выровненных последовательностей. Сравнивают аминокислотные остатки в каждом положении, и процентную долю положений в запрашиваемой последовательности, которые имеют идентичные соответствия в целевой последовательности, представляют как % идентичности.
Термин "% сходства" в том виде, как он используется во всем описании изобретения и прилагаемой формуле изобретения, рассчитывают, как описано для "% идентичности", за исключением того, что гидрофобные остатки Ala, Val, Phe, Pro, Leu, Ile, Trp, Met и Cys являются сходными; основные остатки Lys, Arg и His являются сходными; кислотные остатки Glu и Asp являются сходными; и гидрофильные незаряженные остатки Gln, Asn, Ser, Thr и Tyr являются сходными. Оставшаяся природная аминокислота Gly не является сходной с какой-либо другой аминокислотой в этом контексте.
Во всем этом описании альтернативные воплощения согласно изобретению, вместо указанного процента идентичности, удовлетворяют соответствующему проценту сходства. Другие альтернативные воплощения удовлетворяют определенному проценту идентичности, а также другому, более высокому проценту сходства, выбранному из группы предпочтительных процентов идентичности для каждой последовательности. Например, последовательность может быть на 70% сходной с другой последовательностью; или она может быть на 70% идентичной другой последовательности; или она может быть на 70% идентичной и на 90% сходной с другой последовательностью.
Более того, из экспериментальных данных заключили, что каждый индивидуальный сегмент G представляет собой аминокислотную последовательность из 12-30 аминокислотных остатков. Предпочтительно, чтобы каждый индивидуальный сегмент G состоял из 14-23 аминокислотных остатков. По меньшей мере 40% аминокислотных остатков каждого сегмента G представляют собой остатки глицина. Типично, содержание глицина в каждом индивидуальном сегменте G находится в диапазоне 40-60%.
Предпочтительно, каждый индивидуальный сегмент G имеет по меньшей мере 80%-ную, предпочтительно по меньшей мере 90%-ную, более предпочтительно 95%-ную, наиболее предпочтительно 100%-ную идентичность с аминокислотной последовательностью, выбранной из группы аминокислотных остатков 20-42, 57-70, 84-106, 121-134, 148-170, 184-197, 212-234, 249-265, 280-293, 307-329, 343-356, 371-393, 407-420, 435-457, 471-488, 503-516, 530-552, 567-580, 595-617, 631-647, 662-675, 689-711, 726-739, 753-775, 790-803, 817-839, 854-867, 881-903, 918-931, 946-968, 982-998, 1014-1027, 1043-1059 и 1074-1092 SEQ ID NO:10. Каждая последовательность этой группы соответствует сегменту встречающейся в природе последовательности белка MaSp1 Euprosthenops australis, которая выведена в результате клонирования соответствующей кДНК, см. WO 2007/078239. В качестве альтернативы, каждый индивидуальный сегмент G имеет по меньшей мере 80%-ную, предпочтительно по меньшей мере 90%-ную, более предпочтительно 95%-ную, наиболее предпочтительно 100%-ную идентичность с аминокислотной последовательностью, выбранной из группы аминокислотных остатков 153-173, 187-203, 219-232, 248-264 и 279-296 SEQ ID NO:3. Каждая последовательность этой группы соответствует сегменту экспрессируемых неприродных белков шелка пауков согласно изобретению, которые обладают способностью образовывать волокна шелка в подходящих условиях (см. Пример 2). Таким образом, в некоторых воплощениях согласно изобретению каждый индивидуальный сегмент G идентичен аминокислотной последовательности, выбранной из вышеупомянутых аминокислотных сегментов.
В некоторых воплощениях первые два аминокислотных остатка каждого сегмента G согласно изобретению не представляют собой -Gln-Gln.
Имеются три подтипа сегмента G согласно изобретению. Эта классификация основана на тщательном анализе последовательности белка MaSp1 Euprosthenops australis (WO 2007/078239), и данную информацию использовали и проверяли при конструировании новых неприродных белков шелка пауков.
Первый подтип сегмента G согласно изобретению представляет собой однобуквенную консенсусную аминокислотную последовательность GQG(G/S)QGG(Q/Y)GG(L/Q)GQGGYGQGAGSS (SEQ ID NO:11). Этот первый и обычно самый длинный подтип сегмента G типично содержит 23 аминокислотных остатка, но может содержать только 17 аминокислотных остатков и не имеет заряженных остатков или содержит один заряженный остаток. Таким образом, предпочтительно, чтобы этот первый подтип сегмента G содержал 17-23 аминокислотных остатка, но предполагают, что он может содержать минимум 12 или вплоть до 30 аминокислотных остатков. Не желая быть связанными какой-либо конкретной теорией, предполагают, что этот подтип образует спиральные структуры или 31-спиральные структуры. Репрезентативные G-сегменты этого первого подтипа представляют собой аминокислотные остатки 20-42, 84-106, 148-170, 212-234, 307-329, 371-393, 435-457, 530-552, 595-617, 689-711, 753-775, 817-839, 881-903, 946-968, 1043-1059 и 1074-1092 SEQ ID NO:10. В некоторых воплощениях первые два аминокислотных остатка каждого сегмента G этого первого подтипа согласно изобретению не представляют собой -Gln-Gln.
Второй подтип сегмента G согласно изобретению представляет собой однобуквенную консенсусную аминокислотную последовательность GQGGQGQG(G/R)Y GQG(A/S)G(S/G)S (SEQ ID NO:12). Этот второй подтип сегмента G, обычно имеющий средний размер, типично содержит 17 аминокислотных остатков и не имеет заряженных остатков или содержит один заряженный остаток. Предпочтительно, чтобы этот второй подтип сегмента G содержал 14-20 аминокислотных остатков, но предполагают, что он может содержать минимум 12 или вплоть до 30 аминокислотных остатков. Не желая быть связанными какой-либо конкретной теорией, предполагают, что этот подтип образует спиральные сруктуры. Репрезентативные G-сегменты этого второго подтипа представляют собой аминокислотные остатки 249-265, 471-488, 631-647 и 982-998 SEQ ID NO:10; и аминокислотные остатки 187-203 SEQ ID NO:3.
Третий подтип сегмента G согласно изобретению представляет собой однобуквенную консенсусную аминокислотную последовательность G(R/Q)GQG(G/R)YGQG (A/S/V)GGN (SEQ ID NO:13). Этот третий подтип сегмента G обычно содержит 14 аминокислотных остатков и обычно является самым коротким из подтипов сегмента G согласно изобретению. Предпочтительно, чтобы этот третий подтип сегмента G содержал 12-17 аминокислотных остатков, но предполагают, что он может содержать вплоть до 23 аминокислотных остатков. Не желая быть связанными какой-либо конкретной теорией, предполагают, что этот подтип образует структуры изгибов. Репрезентативные сегменты G этого третьего подтипа представляют собой аминокислотные остатки 57-70, 121-134, 184-197, 280-293, 343-356, 407-420, 503-516, 567-580, 662-675, 726-739, 790-803, 854-867, 918-931, 1014-1027 SEQ ID NO:10; и аминокислотные остатки 219-232 SEQ ID NO:3.
Таким образом, в предпочтительных воплощениях каждый индивидуальный сегмент G имеет по меньшей мере 80%-ную, предпочтительно 90%-ную, более предпочтительно 95%-ную идентичность с аминокислотной последовательностью, выбранной из SEQ ID NO:11, SEQ ID NO:12 и SEQ ID NO:13.
В предпочтительном воплощении чередующейся последовательности сегментов А и G фрагмента REP каждый второй сегмент G принадлежит к первому подтипу, тогда как остальные сегменты G принадлежат к третьему подтипу, например, …А1GкороткийА2GдлинныйА3GкороткийА4GдлинныйА5Gкороткий… В другом предпочтительном воплощении фрагмента REP один сегмент G второго подтипа регулярно прерывает сегмент G через вставку, например, …А1GкороткийА2GдлинныйА3GсреднийА4GкороткийА5Gдлинный…
Каждый индивидуальный сегмент L представляет собой возможную линкерную аминокислотную последовательность, которая может содержать от 0 до 20 аминокислотных остатков, например от 0 до 10 аминокислотных остатков. Хотя этот сегмент является возможным и не является критичным с функциональной точки зрения для белка шелка паука, его присутствие все же обеспечивает полностью функциональные белки шелка пауков, образующие волокна шелка пауков согласно изобретению. Также имеется линкерная аминокислотная последовательность, присутствующая в повторяющейся части (SEQ ID NO:10) выведенной аминокислотной последовательности белка MaSp1 Euprosthenops australis. В частности, аминокислотная последовательность линкерного сегмента может иметь сходство с любым из описанных сегментов А и G, но обычно не достаточно удовлетворять их критериям, как в определено данной заявке.
Как показано в WO 2007/078239, линкерный сегмент, расположенный в C-концевой части фрагмента REP, может представлять собой однобуквенные консенсусные аминокислотные последовательности ASASAAASAA STVANSVS и ASAASAAA, которые богаты аланином. Фактически, вторую последовательность можно считать сегментом А согласно изобретению, тогда как первая последовательность имеет высокую степень сходства с сегментами А согласно изобретению. Другой пример линкерного сегмента согласно изобретению имеет однобуквенную аминокислотную последовательность GSAMGQGS, которая богата глицином и имеет высокую степень сходства с сегментами G согласно изобретению. Другим примером линкерного сегмента является SASAG.
Репрезентативные сегменты L представляют собой аминокислотные остатки 1-6 и 1093-1110 SEQ ID NO:10; и аминокислотные остатки 138-142 SEQ ID NO:3, но специалист в данной области легко поймет, что существует множество подходящих альтернативных аминокислотных последовательностей для этих сегментов. В одном воплощении фрагмента REP согласно изобретению один из сегментов L содержит 0 аминокислот, т.е. один из сегментов L является пропущенным. В другом воплощении фрагмента REP согласно изобретению оба сегмента L содержит 0 аминокислот, т.е. оба сегмента L являются пропущенными. Таким образом, эти воплощения фрагментов REP согласно изобретению могут быть схематично представлены следующим образом: (AG)nL, (AG)nAL, (GA)nL, (GA)nGL; L(AG)n, L(AG)nA, L(GA)n, L(GA)nG; и (AG)n, (AG)nA, (GA)n, (GA)nG. Любые из этих фрагментов REP являются подходящими для применения с любым фрагментом СТ, как определено ниже.
Возможный фрагмент СТ белка шелка паука согласно изобретению имеет высокую степень сходства с C-концевой аминокислотной последовательностью белков шелка пауков. Как показано в WO 2007/078239, эта аминокислотная последовательность является весьма консервативной среди разных видов и белков шелка пауков, включая MaSp1 и MaSp2. Консенсусная последовательность C-концевых областей MaSp1 и MaSp2 приведена как SEQ ID NO:9. На Фиг.2 выровнены следующие белки MaSp, обозначенные входящими номерами GenBank, когда это применимо:
Не является критичным, какой конкретно фрагмент СТ, если таковой имеется, присутствует в белках шелка пауков по изобретению. Таким образом, фрагмент СТ согласно изобретению можно выбрать из любой из аминокислотных последовательностей, показанных на Фиг.2 и в Таблице 2, или из последовательностей с высокой степенью сходства. В белке шелка паука согласно изобретению можно использовать широкий выбор С-концевых последовательностей.
Последовательность фрагмента СТ согласно изобретению имеет по меньшей мере 50%-ную идентичность, предпочтительно по меньшей мере 60%-ную, более предпочтительно по меньшей мере 65%-ную идентичность или даже по меньшей мере 70%-ную идентичность с консенсусной аминокислотной последовательностью SEQ ID NO:9, которая основана на аминокислотных последовательностях, представленных на Фиг.2.
Репрезентативный фрагмент СТ согласно изобретению представляет собой последовательность SEQ ID NO:7 Euprosthenops australis. Таким образом, согласно предпочтительному аспекту изобретения фрагмент СТ имеет по меньшей мере 80%-ную, предпочтительно по меньшей мере 90%-ную, например по меньшей мере 95%-ную идентичность с SEQ ID NO:7 или любой индивидуальной аминокислотной последовательностью Фиг.2 и Таблицы 2. В предпочтительных аспектах изобретения фрагмент СТ идентичен SEQ ID NO:7 или любой индивидуальной аминокислотной последовательности на Фиг.2 и Таблицы 2.
Фрагмент СТ типично состоит из 70-120 аминокислотных остатков. Предпочтительно, фрагмент СТ содержит по меньшей мере 70, или более 80, предпочтительно более 90 аминокислотных остатков. Также предпочтительно, фрагмент СТ содержит самое большее 120 или менее 110 аминокислотных остатков. Типичный фрагмент СТ содержит приблизительно 100 аминокислотных остатков.
В одном воплощении первая стадия способа получения полимеров из выделенного белка шелка паука включает экспрессию молекулы полинуклеиновой кислоты, которая кодирует белок шелка паука, в подходящем хозяине, таком как Escherichia coli. Полученный таким образом белок выделяют с использованием стандартных методик. Возможно, на этой стадии активно удаляют липополисахариды и другие пирогены.
На второй стадии способа получения полимеров из выделенного белка шелка паука берут раствор белка шелка паука в жидкой среде. Под терминами "растворимый" и "в растворе" подразумевают, что белок явно не агрегирует и не выпадает в осадок из растворителя при 60000xg. Жидкой средой может быть любая подходящая среда, такая как водная среда, предпочтительно физиологическая среда, типично забуференная водная среда, например 10-50 мМ Трис-HCl буфер или фосфатный буфер. Жидкая среда имеет рН 6,4 или выше и/или ионную композицию, которая предотвращает полимеризацию белка шелка паука. То есть, жидкая среда имеет либо рН 6,4 или выше, либо ионную композицию, которая предотвращает полимеризацию белка шелка паука, либо и то и другое.
Ионные композиции, которые предотвращают полимеризацию белка шелка паука, могут быть легко получены специалистом с использованием описанных в данной заявке способов. Предпочтительная ионная композиция, которая предотвращает полимеризацию белка шелка паука, имеет ионную силу более 300 мМ. Конкретные примеры ионных композиций, которые предотвращают полимеризацию белка шелка паука, включают более 300 мМ NaCl, 100 мМ фосфат и комбинации этих ионов, оказывающие желательный предотвращающий эффект на полимеризацию белка шелка паука, например, комбинацию 10 мМ фосфата и 300 мМ NaCl.
Неожиданно обнаружили, что присутствие фрагмента NT улучшает стабильность раствора и предотвращает образование полимера в этих условиях. Это может быть полезным в том случае, когда немедленная полимеризация может быть нежелательной, например, во время очистки белка, при получении больших партий, либо когда другие условия должны быть оптимизированы. Предпочтительно, чтобы рН жидкой среды корректировали до 6,7 или выше, например 7,0 или выше, или даже 8,0 или выше, например вплоть до 10,5 для достижения высокой растворимости белка шелка паука. Также может быть полезным, чтобы рН жидкой среды корректировали до диапазона 6,4-6,8, что придает белку шелка паука достаточную растворимость, но облегчает последующую корректировку рН до 6,3 или ниже.
На третьей стадии свойства жидкой среды корректируют до рН 6,3 или ниже и ионной композиции, которая обеспечивает полимеризацию. То есть, если жидкая среда, где растворен белок шелка паука, имеет рН 6,4 или выше, рН снижают до 6,3 или ниже. Квалифицированному специалисту хорошо знакомы разные способы достижения этого, типично включающие добавление сильной или слабой кислоты. Если жидкая среда, где растворен белок шелка паука, имеет ионную композицию, которая предотвращает полимеризацию, ионную композицию меняют для того, чтобы обеспечить полимеризацию. Квалифицированному специалисту хорошо знакомы разные способы достижения этого, например, разведение, диализ или гель-фильтрация. При необходимости, эта стадия включает как снижение рН жидкой среды до 6,3 или ниже, так и изменение ионной композиции с целью обеспечения полимеризации. Предпочтительно, чтобы рН жидкой среды корректировали до 6,2 или ниже, например 6,0 или ниже. В частности, с практической точки зрения может быть полезным ограничение падения рН от 6,4 или 6,4-6,8 на предшествующей стадии до 6,3 или 6,0-6,3, например 6,2, на этой стадии. В предпочтительном воплощении рН жидкой среды на этой стадии составляет 3 или выше, например 4,2 или выше. Полученный в результате диапазон рН, например 4,2-6,3, стимулирует быструю полимеризацию.
На четвертой стадии белок шелка паука оставляют полимеризоваться в жидкой среде, имеющей рН 6,3 или ниже и ионную композицию, которая обеспечивает полимеризацию белка шелка паука. Неожиданно обнаружили, что хотя присутствие фрагмента NT и улучшает растворимость белков шелка пауков при рН 6,4 или выше и/или ионной композиции, которая предотвращает полимеризацию белка шелка паука, он ускоряет образование полимеров при рН 6,3 или ниже, когда ионная композиция обеспечивает полимеризацию белка шелка паука. Полученные полимеры предпочтительно являются твердыми и макроскопическими, и они формируются в жидкой среде, имеющей рН 6,3 или ниже и ионную композицию, которая обеспечивает полимеризацию белка шелка паука. В предпочтительном воплощении рН жидкой среды этой стадии составляет 3 или выше, например 4,2 или выше. Полученный интревал рН, например 4,2-6,3, стимулирует быструю полимеризацию. Предпочтительные формы полимеров включают волокно, пленку, пену, сеть или ячеистую структуру. Предпочтительно, чтобы полимер представлял собой волокно, имеющее диаметр более 0,1 мкм, предпочтительно более 1 мкм, и длину более 5 мм.
Ионные композиции, которые обеспечивают полимеризацию белка шелка паука, могут быть легко получены специалистом с использованием описанных в данной заявке способов. Предпочтительная ионная композиция, которая обеспечивает полимеризацию белка шелка паука, имеет ионную силу менее 300 мМ. Конкретные примеры ионных композиций, которые обеспечивают полимеризацию белка шелка паука, включают 150 мМ NaCl, 10 мМ фосфат, 20 мМ фосфат и комбинации этих ионов, не имеющие предотвращающего эффекта на полимеризацию белка шелка паука, например, комбинацию 10 мМ фосфата или 20 мМ фосфата и 150 мМ NaCl. Предпочтительно, чтобы ионную силу этой жидкой среды корректировали до диапазона 1-250 мМ.
Не желая быть связанными какой-либо конкретной теорией, предполагают, что фрагменты NT имеют противоположно заряженные полюса и что изменения рН среды влияют на баланс зарядов на поверхности белка с последующей полимеризацией, тогда как соль ингибирует то же самое событие.
При нейтральном рН энергетическая цена избавления от избыточного отрицательного заряда кислотного полюса, как можно ожидать, будет предотвращать полимеризацию. Однако, по мере того как димер достигает своей изоэлектрической точки при более низком рН, электростатические силы притяжения в конечном счете станут доминирующими, что объясняет наблюдаемые соле- и рН-зависимые характеристики полимеризации NT и NT-содержащих миниспидроинов. Авторы данного изобретения предполагают, что рН-индуцированная полимеризация NT и повышенная эффективность сборки волокон из NT-миниспидроинов обусловлены изменениями поверхностного электростатического потенциала, и что кластеризация кислотных остатков на одном полюсе NT сдвигает его баланс зарядов так, что происходит переход к полимеризации при значениях рН 6,3 или ниже.
На пятой и последней стадии образующиеся, предпочтительно твердые полимеры белка шелка паука выделяют из указанной жидкой среды. Возможно, эта стадия включает активное удаление липополисахаридов и других пирогенов от полимеров спидроина.
Не желая ограничиваться какой-либо конкретной теорией, наблюдали, что образование полимеров спидроина идет через формирование водорастворимых димеров спидроина. Согласно настоящему изобретению, таким образом, также предложен способ получения димеров выделенного белка шелка паука, где первые две стадии способа являются такими, как описано выше. Белок шелка паука присутствует в виде димеров в жидкой среде при рН 6,4 или выше и/или ионной композиции, которая предотвращает полимеризацию указанного белка шелка паука. Третья стадия включает выделение димеров, полученных на второй стадии, и возможно удаление липополисахаридов и других пирогенов. В предпочтительном воплощении полимер белка шелка паука по изобретению состоит из полимеризованных белковых димеров. Согласно настоящему изобретению, таким образом, предложено новое применение белка шелка паука, предпочтительно белка, описанного в данной заявке, для получения димеров белка шелка паука.
Согласно другому аспекту в настоящем изобретении предложен полимер белка шелка паука, как описано в данной заявке. В предпочтительном воплощении полимер этого белка можно получить любым способом согласно данному изобретению. Таким образом, в настоящем изобретении предложено новое применение белка шелка паука, предпочтительно описанного в данной заявке белка, для получения полимеров белка шелка паука. Согласно одному воплощению в настоящем изобретении предложено новое применение димера белка шелка паука, предпочтительно описанного в данной заявке димера, для получения полимеров из выделенного белка шелка паука. В этих применениях предпочтительно, чтобы полимеры продуцировались в жидкой среде, имеющей рН 6,3 или ниже и ионную композицию, которая обеспечивает полимеризацию указанного белка шелка паука. В предпочтительном воплощении рН жидкой среды составляет 3 или выше, например 4,2 или выше. Полученный диапазон рН, например 4,2-6,3, стимулирует быструю полимеризацию.
Используя способ(бы) по настоящему изобретению, можно контролировать процесс полимеризации, и это обеспечивает оптимизацию параметров получения полимеров шелка с желательными свойствами и формами.
Предпочтительно, полимер белка спидроина согласно изобретению представляет собой волокно макроскопического размера, т.е. с диаметром более 0,1 мкм, предпочтительно более 1 мкм, и длиной более 5 мм. Предпочтительно, волокно имеет диаметр в диапазоне от 1 до 400 мкм, предпочтительно 60-120 мкм, и длину в диапазоне 0,5-300 см, предпочтительно 1-100 см. Другие предпочтительные диапазоны составляют 0,5-30 см и 1-20 см. Также предпочтительно, полимер, такой как волокно, белка спидроина согласно изобретению имеет прочность на разрыв более 1 МПа, предпочтительно более 2 МПа, более предпочтительно 10 МПа или более. Предпочтительно, полимер, такой как волокно, белка спидроина согласно изобретению имеет прочность на разрыв более 100 МПа, более предпочтительно 200 МПа или более. Данное волокно имеет способность оставаться интактным во время физической манипуляции, т.е. может быть использовано для прядения, плетения, скручивания, вязания и сходных процедур.
В других предпочтительных воплощениях полимер белка спидроина согласно изобретению образует пену, сеть, ячеистую структуру или пленку.
Согласно другому аспекту в настоящем изобретении предложена выделенная молекула полинуклеиновой кислоты, содержащая последовательность нуклеиновой кислоты, которая кодирует белок шелка паука согласно изобретению, или комплементарная ей последовательность нуклеиновой кислоты, такая как SEQ ID NO:14-16. Эти молекулы полинуклеиновой кислоты, а также молекулы полинуклеиновой кислоты, кодирующие различные белки, описанные в данной заявке (SEQ ID NO:1-7, 10-13), также могут быть полезными в дальнейших разработках неприродных белков-спидроинов или систем их получения.
Молекулы полинуклеиновой кислоты согласно изобретению могут представлять собой молекулы ДНК, включая молекулы кДНК, или молекулы РНК. Как хорошо известно специалисту, последовательность нуклеиновой кислоты также может быть описана ее комплементарной последовательностью нуклеиновой кислоты. Поэтому последовательности нуклеиновой кислоты, которые являются комплементарными последовательностям нуклеиновой кислоты согласно изобретению, также входят в объем защиты данного изобретения.
Согласно одному аспекту в настоящем изобретении предложен способ получения белка шелка паука согласно изобретению. На первой стадии молекулу полинуклеиновой кислоты, которая кодирует белок шелка паука согласно изобретению, экспрессируют в подходящем хозяине. На второй стадии выделяют полученный таким способом раствормый белок шелка паука, например, с использованием хроматографии и/или фильтрации. Возможно, указанная вторая стадия выделения растворимого белка шелка паука включает удаление ЛПС (липополисахарид) и других пирогенов.
Белок шелка паука согласно изобретению получают обычно рекомбинантным путем с использованием различных подходящих хозяев, таких как бактерии, дрожжи, клетки млекопитающих, растения, клетки насекомых и трансгенные животные. Предпочтительно, чтобы белок шелка паука согласно изобретению продуцировался в бактериях.
Для того чтобы получить белок с низким содержанием пирогенов, что является обязательным для применения в качестве биоматериала in vivo, разработали протокол очистки, оптимизированный для удаления липополисахаридов (ЛПС). Для того чтобы избежать загрязнения высвобожденным ЛПС, продуцирующие бактериальные клетки подвергают стадиям промывки с чередованием CaCl2 и EDTA (этилендиаминтетрауксусная кислота). После лизиса клеток все последующие стадии очистки проводят в буферах с низкой удельной электропроводностью с целью минимизации гидрофобных взаимодействий между целевым белком и ЛПС. Содержание ЛПС дополнительно минимизируют путем пропускания раствора белка через колонку Endotrap, которая содержит лиганд, который специфично поглощает ЛПС. Для того чтобы гарантировать постоянное низкое содержание ЛПС и других пирогенов, все партии анализируют с использованием теста на пирогены in vitro (IPT) и/или кинетического анализа с лизатом амебоцитов Limulus (LAL). Несмотря на продукцию в грамотрицательной бактерии-хозяине, рекомбинантные спидроиновые белки можно очистить так, что остаточные уровни ЛПС и других пирогенов будут находиться ниже пределов, требующихся для тестов с животными, т.е. ниже 25 EU(эндотоксиновая единица)/имплантат. В некоторых воплощениях согласно изобретению содержание ЛПС и других пирогенов в выделенном белке шелка паука составляет 1 EU/мг белка или ниже. В некоторых воплощениях согласно изобретению содержание ЛПС и других пирогенов в выделенном белке шелка паука составляет 1 EU/мг белка или ниже, предпочтительно 0,25 EU/мг белка или ниже.
Согласно одному аспекту в настоящем изобретении предложена композиция, содержащая выделенный белок шелка паука, предпочтительно описанный в данной заявке белок, растворенный в жидкой среде, имеющей рН 6,4 или выше и/или ионную композицию, которая предотвращает полимеризацию указанного белка шелка паука. Жидкая среда может представлять собой любую подходящую среду, такую как водная среда, предпочтительно физиологическая среда, типично забуференная водная среда, такая как 10-50 мМ Трис-HCl буфер или фосфатный буфер. Жидкая среда имеет рН 6,4 или выше и/или ионную композицию, которая предотвращает полимеризацию белка шелка паука. То есть, жидкая среда имеет либо рН 6,4 или выше, либо ионную композицию, которая предотвращает полимеризацию белка шелка паука, либо и то и другое. Предпочтительная ионная композиция, которая предотвращает полимеризацию белка шелка паука, имеет ионную силу более 300 мМ. Конкретные примеры ионных композиций, которые предотвращают полимеризацию белка шелка паука, включают более 300 мМ NaCl, 100 мМ фосфат и комбинации этих ионов, оказвающие желательный предотвращающий эффект на полимеризацию белка шелка паука, например, комбинацию 10 мМ фосфата и 300 мМ NaCl. Предпочтительно, рН жидкой среды составляет 6,7 или выше, например 7,0 или выше или даже 8,0 или выше, например вплоть до 10,5, для достижения высокой растворимости белка шелка паука. Также может быть полезным то, что рН жидкой среды находится в диапазоне от 6,4 до 6,8, что обеспечивает достаточную растворимость белков шелка пауков, но облегчает последующую корректировку рН до 6,3 или ниже. Предпочтительно, чтобы содержание липополисахаридов и других пирогенов в жидкой среде составляло 1 EU/мг выделенного белка или ниже.
Изобретательское представление, что N-концевой неповторяющийся фрагмент белков шелка пауков вовлечен в полимеризацию этих белков и что образование полимеров с участием этого фрагмента может точно контролироваться путем варьирования определенных параметров, также развилось в новый способ обратимой сборки полимера или олигомера из молекул, несущих по меньшей мере один фрагмент, происходящий из N-концевых неповторяющихся фрагментов спидроина. Хотя примеры в силу необходимости относятся к конкретным белкам, в данном случае содержащим N-концевые фрагменты белка, происходящие из спидроина 1 большой ампуловидной железы (MaSp1) из Euprosthenops australis, предполагают, что описанный в данной заявке способ применим к любому сходному белку с целью получения полимеров или олигомеров.
Согласно этому аспекту в настоящем изобретении предложен способ обратимой сборки полимера или олигомера из молекул одного типа или молекул нескольких разных типов. Первая стадия способа включает предоставление указанных молекул. Каждая молекула содержит (а) по меньшей мере одну первую связывающую группировку и (б) вторую группировку, которая несет биоактивность, подлежащую исследованию или применению. В предпочтительном воплощении молекула содержит одну связывающую группировку (а). В других предпочтительных воплощениях молекула содержит по меньшей мере две, например две, связывающие группировки (а). Каждая молекула типично содержит несколько связывающих группировок (а), выбранных из диапазонов 1-2, 1-4, 1-6, 2-4 и 2-6. Каждая связывающая группировка (а) состоит из 100-160 аминокислотных остатков, и она происходит из N-концевого (NT, N-terminal) фрагмента белка шелка паука. Фрагмент NT имеет высокую степень сходства с N-концевой аминокислотной последовательностью белков шелка пауков. Как показано в Таблице 1 и на Фиг.1, эта аминокислотная последовательность является весьма консервативной среди разных видов и белков шелка пауков, включая MaSp1 и MaSp2.
Отмечают, что NT имеет явный дипольный момент, поскольку кислотные и основные остатки локализуются в кластерах на противоположных полюсах. Не желая ограничиваться этим, предполагают, что наблюдаемая полимеризация NT может включать образование линейных массивов димеров NT, расположенных полюс к полюсу с отрицательной поверхностью одной субъединицы, обращенной к положительной поверхности соседней субъединицы в следующем димере в массиве.
Не является критичным, какой(ие) конкретный(е) фрагмент(ты) NT присутствует(ют) в типе(пах) молекулы согласно этому аспекту изобретения, пока фрагмент NT не отсутствует полностью. Таким образом, фрагмент(ты) NT согласно этому аспекту изобретения можно выбрать из любой из аминокислотных последовательностей, показанных в Таблице 1 или на Фиг.1, или последовательностей с высокой степенью сходства. В типе(пах) молекулы согласно этому аспекту изобретения можно использовать широкий спектр N-концевых последовательностей.
Последовательность фрагмента NT согласно изобретению имеет по меньшей мере 50%-ную идентичность, предпочтительно по меньшей мере 60%-ную идентичность с консенсусной аминокислотной последовательностью SEQ ID NO:8, которая основана на аминокислотных последовательностях, представленных на Фиг.1. В предпочтительном воплощении последовательность фрагмента NT согласно изобретению имеет по меньшей мере 65%-ную идентичность, предпочтительно по меньшей мере 70%-ную идентичность с консенсусной аминокислотной последовательностью SEQ ID NO:8. Кроме того, в предпочтительных воплощениях фрагмент NT согласно изобретению имеет 70%-ное, предпочтительно 80%-ное сходство с консенсусной аминокислотной последовательностью SEQ ID NO:8.
Репрезентативный фрагмент NT согласно изобретению представляет собой последовательность SEQ ID NO:6 Euprosthenops australis. Согласно предпочтительному воплощению изобретения фрагмент NT имеет по меньшей мере 80%-ную идентичность с SEQ ID NO:6 или любой индивидуальной аминокислотной последовательностью на Фиг.1. В предпочтительных воплощениях изобретения фрагмент NT имеет по меньшей мере 90%-ную, например по меньшей мере 95%-ную идентичность с SEQ ID NO:6 или любой индивидуальной аминокислотной последовательностью на Фиг.1. В предпочтительных воплощениях изобретения фрагмент NT идентичен SEQ ID NO:6 или любой индивидуальной аминокислотной последовательности на Фиг.1.
Фрагмент NT содержит от 100 до 160 аминокислотных остатков. Предпочтительно, фрагмент NT содержит по меньшей мере 100 или более 110, предпочтительно более 120 аминокислотных остатков. Также предпочтительно, фрагмент NT содержит самое большее 160 или менее 140 аминокислотных остатков. Типичный фрагмент NT содержит приблизительно 130-140 аминокислотных остатков.
Все молекулы конкретного способа типично имеют общую связывающую группировку (а), но также, возможно, имеют разные типы молекул, где различие проявляется в использовании разных группировок (а), пока они сохраняют свою способность связываться друг с другом при описанных в данной заявке условиях рН и ионной силы. В общем, вторая группировка (б) несет биоактивность, подлежащую исследованию или применению, и типично именно эта вторая группировка (б) отличается, когда способ включает более чем один тип молекулы. Вторая группировка (б) индивидуально выбрана из белков, нуклеиновых кислот, углеводов и липидов. Предпочтительно, вторая группировка (б) также представляет собой белок.
В предпочтительном воплощении молекулы с первой стадии являются идентичными, т.е. одного типа, и образующийся полимер (олигомер), таким образом, представляет собой гомополимер (гомоолигомер). В другом предпочтительном воплощении молекулы с первой стадии не являются идентичными, и образующийся полимер (олигомер), таким образом, представляет собой гетерополимер (гетероолигомер). Как обсуждалось выше, гетерогенность молекул может быть присуща связывающей группировке (а), группировке, обеспечивающей биоактивность (б), или им обеим.
На второй стадии способа берут раствор молекул в жидкой среде. Жидкая среда может быть любой подходящей средой, такой как водная среда, предпочтительно физиологическая среда, типично забуференная водная среда, такая как 10-50 мМ Трис-HCl буфер или фосфатный буфер. Жидкая среда имеет рН 6,4 или выше и/или ионную композицию, которая предотвращает полимеризацию или олигомеризацию молекул через связывающие группировки. То есть, жидкая среда имеет либо рН 6,4 или выше, либо ионную композицию, которая предотвращает полимеризацию или олигомеризацию молекул через связывающие группировки, либо и то и другое.
Ионные композиции, которые предотвращают полимеризацию или олигомеризацию молекул через связывающие группировки, могут быть легко получены специалистом с использованием описанных в данной заявке способов. Предпочтительная ионная композиция, которая предотвращает полимеризацию молекул через связывающие группировки, имеет ионную силу более 300 мМ. Конкретные примеры ионных композиций, которые предотвращают полимеризацию молекул через связывающие группировки, включают более 300 мМ NaCl, 100 мМ фосфат и комбинации этих ионов, оказывающие желательный предотвращающий эффект на полимеризацию молекул через связывающие группировки, например, комбинацию 10 мМ фосфата и 300 мМ NaCl.
Неожиданно обнаружили, что присутствие по меньшей мере одного фрагмента NT улучшает стабильность раствора и предотвращает образование полимера и олигомера в этих условиях. Это может быть полезным, когда немедленная полимеризация или олигомеризация может быть нежелательной, например, во время очистки белка, при получении больших партий или при необходимости оптимизации других условий. Предпочтительно, чтобы рН жидкой среды корректировали до 6,7 или выше, например 7,0 или выше, или даже до 8,0 или выше, например вплоть до 10,5, с достижением высокой растворимости молекул. Также может быть полезным, чтобы рН жидкой среды корректировали до диапазона 6,4-6,8, что обеспечивает достаточную растворимость молекул, но облегчает последующую корректировку рН до 6,3 или ниже.
На третьей стадии способа свойства указанной жидкой среды корректируют так, чтобы обеспечить полимеризацию или олигомеризацию молекул через связывающие группировки. Поэтому свойства жидкой среды корректируют до рН 6,3 или ниже и ионной композиции, которая обеспечивает полимеризацию или олигомеризацию. То есть, если жидкая среда, в которой растворяют молекулы, имеет рН 6,4 или выше, рН снижают до 6,3 или ниже. Специалист хорошо знаком с разными способами достижения этого, типично включающими добавление сильной или слабой кислоты. Если жидкая среда, в которой растворяют молекулы, имеет ионную композицию, которая предотвращает полимеризацию или олигомеризацию, ионную композицию меняют так, чтобы обеспечить полимеризацию или олигомеризацию молекул через связывающие группировки. Специалист хорошо знаком с разными способами достижения этого, например, разбавлением, диализом или гель-фильтрацией. При необходимости, эта стадия включает как снижение рН жидкой среды до 6,3 или ниже, так и изменение ионной композиции так, чтобы обеспечить полимеризацию или олигомеризацию. Предпочтительно, чтобы рН жидкой среды корректировали до 6,2 или ниже, например 6,0 или ниже. В частности, с практической точки зрения может быть полезным ограничение снижения рН от 6,4 или 6,4-6,8 на предыдущей стадии до 6,3 или 6,0-6,3, например 6,2, на данной стадии. В предпочтительном воплощении рН жидкой среды на данной стадии составляет 3 или выше, например 4,2 или выше. Полученный в результате диапазон рН, например 4,2-6,3, стимулирует быструю полимеризацию.
На четвертой стадии способа молекулы оставляют собираться в полимер или олигомер через связывающие группировки в жидкой среде. Жидкая среда имеет рН 6,3 или ниже и ионную композицию, которая обеспечивает полимеризацию или олигомеризацию молекул через связывающие группировки. Неожиданно обнаружили, что, хотя присутствие связывающей группировки и улучшает растворимость молекул при рН 6,4 или выше и/или ионной композиции, которая предотвращает полимеризацию или олигомеризацию данных молекул, она ускоряет образование полимера и олигомера при рН 6,3 или ниже, когда ионная композиция обеспечивает полимеризацию или олигомеризацию молекул. В предпочтительном воплощении рН жидкой среды на этой стадии составляет 3 или выше, например 4,2 или выше. Полученный в результате диапазон рН, например 4,2-6,3, стимулирует быструю полимеризацию. В предпочтительном воплощении данного способа полимер или олигомер, который получают на четвертой стадии, остается растворимым, т.е. он растворяется в жидкой среде, имеющей рН 6,3 или ниже, и ионную композицию, которая обеспечивает полимеризацию или олигомеризацию данных молекул.
Ионные композиции, которые обеспечивают полимеризацию или олигомеризацию молекул через связывающие группировки, могут быть легко получены специалистом с использованием способов, описанных в данной заявке. Предпочтительная ионная композиция, которая обеспечивает полимеризацию молекул через связывающие группировки, имеет ионную силу менее 300 мМ. Конкретные примеры ионных композиций, которые обеспечивают полимеризацию молекул через связывающие группировки, включают 150 мМ NaCl, 10 мМ фосфат, 20 мМ фосфат и комбинации этих ионов, не оказывающие предотвращающего эффекта на полимеризацию молекул через связывающие группировки, например, комбинацию 10 мМ фосфата или 20 мМ фосфата и 150 мМ NaCl. Предпочтительно, чтобы ионную силу данной жидкой среды корректировали до диапазона 1-250 мМ.
В предпочтительном воплощении способ согласно данному аспекту изобретения может включать пятую стадию обращения сборки полимера или олигомера. Эта стадия способа включает корректировку свойств жидкой среды до рН 6,4 или выше и/или ионной композиции, которая предотвращает полимеризацию или олигомеризацию указанных молекул. Это вызывает разборку и растворение в жидкой среде полимера или олигомера, который присутствует в данной жидкой среде. Жидкая среда с этой пятой стадии способа может иметь такую же композицию, как обсуждалось для жидкой среды со второй стадии способа. Например, предпочтительно, рН жидкой среды с пятой стадии способа составляет 6,7 или выше, например 7,0 или выше, или даже 8,0 или выше, например, вплоть до 10,5. В качестве альтернативы, рН жидкой среды с пятой стадии способа находится в диапазоне от 6,4 до 6,8.
Полимер или олигомер со стадии (4) можно предпочтительно использовать в исследованиях взаимодействия, разделении, индуцировании активности ферментных комплексов или FRET-анализе. В некоторых применениях по меньшей мере один тип молекулы с первой стадии способа иммобилизуют на твердой подложке или на матрице аффинной среды, как изложено ниже.
Согласно одному аспекту в настоящем изобретении также предложен способ детектирования взаимодействий связывания между поднабором молекул, содержащихся в наборе молекул. На первой стадии способа берут набор молекул. Каждая молекула этого набора сконструирована, как подробно описано выше, т.е. она содержит (а) по меньшей мере одну первую связывающую группировку и (б) вторую группировку, которая несет биоактивность, подлежущую исследованию или использованию. В предпочтительном воплощении молекула содержит одну связывающую группировку (а). В других предпочтительных воплощених молекула содержит по меньшей мере две, например две, связывающие группировки (а). Каждая молекула типично содержит целый ряд связывающих группировок (а), выбранных из диапазонов 1-2, 1-4, 1-6, 2-4 и 2-6. Каждая связывающая группировка (а) состоит из 100-160 аминокислотных остатков, и она происходит из N-концевого (NT) фрагмента белка шелка паука, как изложено выше. Каждая группировка, обеспечивающая биоактивность (б), индивидуально выбрана из белков, нуклеиновых кислот, углеводов и липидов, предпочтительно белков.
На второй стадии способа берут раствор указанного набора молекул в жидкой среде. Как изложено выше, жидкая среда имеет рН 6,4 или выше и/или ионную композицию, которая предотвращает полимеризацию или олигомеризацию указанных молекул. Предпочтительные композиции жидкой среды очевидны из предыдущего описания изобретения.
На третьей стадии способа свойства жидкой среды корректируют для обеспечения полимеризации или олигомеризации молекул. Как изложено выше, жидкая среда имеет рН 6,3 или ниже и ионную композицию, которая обеспечивает полимеризацию или олигомеризацию молекул. Предпочтительные композиции жидкой среды очевидны из предыдущего описания изобретения.
На четвертой стадии способа молекулы данного набора оставляют собираться в полимер или олигомер через указанные связывающие группировки в жидкой среде. Как изложено выше, жидкая среда имеет рН 6,3 или ниже и ионную композицию, которая обеспечивает полимеризацию или олигомеризацию молекул. Предпочтительные композиции жидкой среды очевидны из предыдущего описания изобретения.
На пятой стадии способа свойства жидкой среды корректирую с целью разборки полимера или олигомера. Как изложено выше, жидкая среда имеет рН 6,4 или выше и/или ионную композицию, которая предотвращает полимеризацию или олигомеризацию указанных молекул. Предпочтительные композиции жидкой среды очевидны из предыдущего описания изобретения. Это вызывает разборку полимера или олигомера путем предотвращения ассоциации через связывающие группировки, происходящие из NT.
На конечной и шестой стадии способа определяют присутствие взаимодействий связывания между двумя или более чем двумя разными молекулами, которые не опосредованы указанными связывающими группировками. Это идентифицирует взаимодействия связывания между поднабором молекул, которые не включают регулируемую рН/солью полимеризацию или олигомеризацию, которые опосредованы связывающими группировками, происходящими из NT.
Связанный с этим аспект изобретения основан на представлении о том, что фрагмент NT будет образовывать большие растворимые агрегаты при снижении рН от примерно 7 до 6 или, более конкретно, от значения выше 6,4 до значения ниже 6,3. Эта сборка идет более эффективно при рН выше 4,2, т.е. в диапазоне 4,2-6,3, например 4,2-6. Это свойство можно использовать для аффинной очистки, например, если NT иммобилизован на колонке. Этот подход обеспечивает высвобождение связанных белков путем сдвига рН в пределах физиологически релевантного диапазона, поскольку агрегат будет распадаться при увеличении рН от примерно 6 до 7.
В предпочтительном воплощении способов согласно изобретению стадия выделения белка шелка паука включает очистку белка шелка паука на аффинной среде, такой как аффинная колонка, с иммобилизованной группировкой NT. Очистку белка шелка паука на аффинной среде предпочтительно проводят в ассоциации с аффинной средой с иммобилизованной группировкой NT при рН 6,3 или ниже, предпочтительно в диапазоне 4,2-6,3, с последующей диссоциацией из аффинной среды с желательной средой диссоциации при рН 6,4 или выше и/или имеющей высокую ионную силу. Среда диссоциации, имеющая высокую ионную силу, типично имеет ионную силу более 300 мМ, например NaCl в концентрации выше 300 мМ.
В данных процедурах, основанных на аффинности, используются собственные свойства группировки NT согласно изобретению. Особый интерес представляет сильная тенденция фрагментов белка NT спидроина к ассоциации при рН ниже 6,3, конкретно в диапазоне 4,2-6,3. Это можно преимущественно использовать в качестве мощного инструмента аффинной очистки, обеспечивая одностадийную очистку белков шелка пауков согласно изобретению из сложных смесей. Хотя хроматография является предпочтительной, очевидно, что можно использовать способы очистки на основе аффинности, отличные от хроматографии, такие как магнитные шарики с функционализированными поверхностями или фильтры с функционализированными поверхностями.
Таким образом, способы получения белка шелка паука согласно изобретению могут включать очистку белка шелка паука на аффинной среде с иммобилизованной группировкой NT. Предпочтительно, очистку слитого белка на аффинной среде проводят посредством ассоциации с аффинной средой с иммобилизованной группировкой NT при рН 6,3 или ниже, с последующей диссоциацией из аффинной среды с желательной средой диссоциации при рН 6,4 или выше и/или имеющей высокую ионную силу. Очистка типично происходит в колонке, на магнитных шариках с функционализированными поверхностями или на фильтрах с функционализированными поверхностями.
В настоящем изобретении также предложена аффинная среда, содержащая матрицу и лиганд для аффинных взаимодействий, связанный с указанной матрицей, возможно через спейсерную группу. Лиганд содержит по меньшей мере один фрагмент из 100-160 аминокислотных остатков, который происходит из N-концевого фрагмента белка шелка паука, как изложено в данном описании изобретения. В предпочтительном воплощении лиганд содержит один фрагмент. В других предпочтительных воплощениях лиганд содержит по меньшей мере два таких фрагмента. Каждый лиганд типично содержит некоторое число фрагментов, выбранных из диапазонов 1-2, 1-4, 1-6, 2-4 и 2-6. Матрица типично выбрана из группы, состоящей из частиц, например, полисахаридных частиц и фильтров. Примеры частиц включают полисахаридные шарики, например, из агарозы, Sepharose и Superose, и магнитные шарики.
Согласно связанному с этим аспекту в настоящем изобретении предложено новое применение одной или более молекул. Как изложено выше, каждая молекула содержит (а) по меньшей мере одну первую связывающую группировку из 100-160 аминокислотных остатков, которые происходят из N-концевого фрагмента белка шелка паука, и (б) вторую группировку, которая индивидуально выбрана из белков, нуклеиновых кислот, углеводов и липидов. В предпочтительном воплощении молекула содержит одну связывающую группировку (а). В других предпочтительных воплощениях молекула содержит по меньшей мере две, например две, связывающие группировки (а). Каждая молекула типично содержит множество связывающих группировок (а), выбранных из диапазонов 1-2, 1-4, 1-6, 2-4 и 2-6. Эти молекулы используют для обратимой сборки полимера или олигомера из данных молекул через связывающие группировки в растворе при рН 6,3 или ниже и ионной композиции, которая обеспечивает полимеризацию или олигомеризацию указанных молекул. В предпочтительном воплощении рН раствора составляет 3 или выше, например 4,2 или выше. Полученный в результате диапазон рН, например 4,2-6,3 стимулирует быструю полимеризацию. Предпочтительно, образующийся полимер или олигомер используют в исследованиях взаимодействия, разделении, индуцировании активности ферментных комплексов или FRET-анализе.
Описанные в данной заявке результаты и выводы обеспечивают новые представления о сборке шелка пауков на молекулярном уровне. Не желая ограничиваться какой-либо конкретной теорией, полярное и несбалансированное распределение зарядов NT идеально подходит для получения полимеризуемого модуля, которое можно легко контролировать с помощью рН и концентрации соли. Это, в свою очередь, позволяет NT регулировать сборку шелка путем предотвращения преждевременной агрегации и запуска полимеризации, когда рН снижается, аналогично тому, что, как полагают, происходит вдоль канала пауков, выделяющего шелк.
Настоящее изобретение далее будет дополнительно проиллюстрировано следующими неограничивающими примерами.
Материалы и способы
Экспрессия и очистка белка
Конструировали экспрессирующие векторы для получения NT (SEQ ID NO:6), NTΔHis6, NT5Rep (SEQ ID NO:4), NT4Rep (SEQ ID NO:3) и 4RepCT (SEQ ID NO:2), соответственно, в виде C-концевых слияний с His6TrxHiS6, и NT4RepCT (SEQ ID NO:5) в виде N-концевого слияния с His6. Разные векторы использовали для трансформации клеток Escherichia coli BL21 (DE3) (Merck Biosciences), которые выращивали при 30°С в среде Лурия-Бертани, содержащей канамицин, до OD600 (оптическая плотность при 600 нм) примерно 1, индуцируя изопропил-β-тиогалактопиранозидом, и дополнительно инкубировали вплоть до 4 часов при комнатной температуре. Лизис, аффинную очистку на иммобилизованном металле и протеолитическое удаление His6TrxHis6-метки проводили, как описано в Hedhammar, M. et al. Biochemistry 47, 3407-3417, (2008).
Динамическое рассеяние света (DLS)
Эффект рН и ионной силы на гидродинамический диаметр NT и NTΔHis6 (для исключения того, что рН-зависимые эффекты вызваны His в положении 6) измеряли при 25±0,1°С в Zetasizer Nano S от Malvern Instruments (Worcestershire, Великобритания), оснащенном 633 нм лазером HeNe. Перед применением буферы фильтровали через нейлоновые фильтры. Использовали объем образца 50 мкл и низкие стеклянные кюветы ZEN2112. Положения затухания и измерения от стенки кюветы (4,65 мм) поддерживали на постоянном уровне для всех анализов. Для каждого образца проводили шесть сканирований. Все образцы анализировали в тройной повторности. Гидродинамический диаметр (dH) рассчитывали с использованием универсального (General Purpose) алгоритма в программном обеспечении Malvern для DLS анализа, который связывает коэффициент диффузии с гидродинамическим диаметром через уравнение Стокса-Эйнштейна:
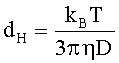
где kB представляет собой константу Больцмана, Т представляет собой температуру, η представляет собой вязкость, и D представляет собой коэффициент поступательной диффузии. Значения вязкости и индекса преломления растворителя получали из программного обеспечения Malvern. Для проверки результатов, полученных универсальным (General Purpose) способом, использовали алгоритм множества узких мод (Multiple Narrow Modes algorithm). Образцы NT и NTΔHis6 анализировали в концентрации 0,8 мг/мл.
Турбидиметрия
Мутность оценивали из кажущегося поглощения белков (0,8 мг/мл) при 340 нм при разных значениях рН при 25°С в спектрофлуориметре SLM 4800S, оснащенном электроникой и программным обеспечением OLIS (OLIS Inc. Bogart, GA). Анализировали NT, NT4Rep и NTΔHis6, (получая) по существу одинаковые результаты.
Образование волокна и сканирующая электронная микроскопия (SEM)
Условия для образования волокна были по существу такими, как описано в Stark, M. et al. Biomacromolecules 8, 1695-1701, (2007). Приблизительно 25 мкМ каждого белка инкубировали в 20 мМ Na-фосфатном буфере при рН 7 или 6 с 300 мМ NaCl или без него. В разные моменты времени образцы наносили на стержни (stubs) для SEM, где их сушили воздухом и покрывали золотом и палладием в вакууме. Образцы фотографировали на микроскопе LEO 1550 FEG (Carl Zeiss, Oberkochen, Германия), используя ускоряющее напряжение 5 кВ.
ПРИМЕРЫ
Пример 1 - экспрессия и очистка NT и миниспидроинов
Конструировали экспрессирующие векторы (SEQ ID NO:14-16 и другие) для получения NT (SEQ ID NO:6), NTΔHis6, NTSRep (SEQ ID NO:4), NT4Rep (SEQ ID NO:3) и 4RepCT (SEQ ID NO:2), соответственно, в виде C-концевых слияний с His6TrxHis6, и NT4RepCT (SEQ ID NO:5) в виде N-концевого слияния с His6. Разные векторы использовали для трансформации клеток Escherichia coli BL21 (DE3) (Merck Biosciences), которые выращивали при 30°С в среде Лурия-Бертани, содержащей канамицин, до OD600 примерно 1, индуцировали изопропил-β-D-тиогалактопиранозидом и дополнительно инкубировали вплоть до 4 часов при комнатной температуре. Затем клетки собирали и ресуспендировали в 20 мМ Трис-HCl (рН 8,0), дополненном лизоцимом и ДНКазой I. После полного лизиса 15000д супернатанты наносили на колонку, упакованную Ni-NTA Sepharose (GE Healthcare, Uppsala, Швеция). Колонку тщательно промывали перед элюцией связавшихся белков 300 мМ имидазолом. Фракции, содержащие целевые белки, объединяли и диализовали против 20 мМ Трис-HCl (рН 8,0). Белки MaSp1 освобождали от меток посредством протеолитического расщепления с использованием соотношения тромбин:слитый белок 1:1000 (масс./масс.) при комнатной температуре в течение 1-2 ч. Для удаления высвобожденной HisTrxHis метки расщепленную смесь наносили на вторую колонку Ni-NTA Sepharose, и собирали проходящую через колонку фракцию. Образцы белка разделяли посредством ПААГ-ДСН (электрофорез в полиакриламидном геле с додецилсульфатом натрия) и затем окрашивали Coomassie Brilliant Blue R-250. Белки концентрировали посредством ультрафильтрации с использованием целлюлозного фильтра с порогом отсечения молекулярной массы 5 кДа (Millipore).
Пример 2 - рН-зависимая полимеризация NT и миниспидроинов
Полимеризацию миниспидроинов с (NT4RepCT или NT4Rep) или без NT (4RepCT или 4Rep) проводили при рН 7 (Фиг.3, над шкалой времени) или при рН 6 (Фиг.3, под шкалой времени).
Миниатюрные спидроины, состоящие из повторяющихся областей с C-концевым фрагментом или без него, не демонстрируют чувствительность к изменениям среды, таким как колебания рН (4Rep и 4RepCT; Фиг.3). Для проверки гипотезы о том, что именно N-концевой фрагмент отвечает за рН-зависимую полимеризацию спидроина, использовали несколько конструкций, охватывающих N-концевой фрагмент спидроина (MaSp) 1 большой ампуловидной железы из Euprosthenops australis (NT, NT4Rep и NT4RepCT; Фиг.3) для получения очищенных рекомбинантных белков (Пример 1). Динамическое рассеяние света, турбидиметрию и сканирующую электронную микроскопию использовали для изучения эффекта рН и концентрации соли на растворимость и полимеризацию только NT, а также конструкций миниспидроина.
NT и NT4Rep исследовали методом турбидиметрии при разных значениях рН. На Фиг.4 показаны средние значения (±SD, n=3) NT4Rep (кружки) и NT (квадратики). Аналогичные результаты были получены для NT5Rep.
NT подвергали исследовали методом динамического рассеяния света при рН 6-7 и 0-300 мМ NaCl. Репрезентативные примеры из трех экспериментов показаны на Фиг.5. См. также Таблицу 3.
Сам по себе, NT образует замечательно растворимый (>210 мг/мл) димер при рН 7,0, но сразу же образует полимеры с гидродинамическим размером примерно 700 нм при рН ниже 6,4 (Фиг.4 и 5). Полимеризация NT легко обращается путем увеличения рН и блокируется высокими уровнями соли (Фиг.5 и 6). Эти свойства сохраняются у NTΔHis6 (турбидиметрия) и распространяются на миниспидроины, которые включают фрагмент NT (NT4RepCT, NT4Rep, NTTNT4RepCT и NT5Rep), которые посредством этого приобретают растворимость при рН 7, но быстро полимеризуются при рН 6 (Фиг.3).
Стрелки на Фиг.3 указывают, когда впервые были детектированы макроскопические образования, показывая, что присутствие NT при рН 7 задерживает полимеризацию, тогда как при рН 6 он ускоряет полимеризацию. Это происходит независимо от того, присутствует C-концевой фрагмент (закрашенный кружок) или нет (показано кружком со штриховкой). Более того, присутствие NT приводит к более упорядоченной полимеризации, проиллюстрированной примерами микрофотографий сканирующей электронной микроскопии на Фиг.3, которые представляют ранние полимеры для всех конструкций при рН 7 (над шкалой времени) или для NT4RepCT при рН 6 (под шкалой времени). Наблюдаемые эффекты рН и соли свидетельствуют о том, что полимеризация спидроина зависит от электростатических взаимодействий, вовлекающих NT.
Пример 3 - NT в качестве медиатора рН-зависимых и обратимых взаимодействий
N-концевой фрагмент (NT) большого ампуловидного спидроина 1 из канатного шелка Euprosthenops australis является высокорастворимым (>210 мг/мл) при рН 7, но полимеризуется через взаимодействия зарядов в примерно 700 нм полимеры при значениях рН ниже 6,4 (показано методами динамического рассеяния света и турбидиметрии). Полимеризация NT легко обращается путем увеличения рН и блокируется высокими уровнями соли. Эти свойства полимеризации распространяются на слитые белки, которые включают фрагмент NT (например NT-X и NT-Y), которые посредством этого приобретают растворимость при рН 7, но быстро полимеризуются при рН 6 (Фиг.7). Этот обратимый путь сборки двух разных белков можно использовать в исследованиях взаимодействий между белками, нуклеиновыми кислотами, углеводами или липидами, например, в анализах белок-белковых взаимодействий с использованием резонансного переноса энергии флуоресценции или в индуцировании активностей, например ферментных активностей, или для локализации или иммобилизации белков, нуклеиновых кислот, углеводов или липидов, или в анализе или разделении белков, нуклеиновых кислот, углеводов или липидов, например, с использованием чиповых методов.
Пример 4 - Получение слитого белка MetSP-C33Leu
Конструировали экспрессирующий вектор, содержащий ген, кодирующий NT-MetSP-C33Leu в виде слияния с Hiss (SEQ ID NO:26-27). Вектор использовали для трансформации клеток Escherichia coli BL21 (DE3) (Merck Biosciences), которые выращивали при 30°С в среде Лурия-Бертани, содержащей канамицин, до OD600 0,9-1, индуцировали изопропил-β-D-тиогалактопиранозидом (IPTG) и дополнительно инкубировали в течение 3 часов при 25°С. Клетки собирали центрифугированием и ресуспендировали в 20 мМ Трис-HCl, рН 8.
Добавляли лизоцим и инкубировали клетки в течение 30 мин на льду. Добавляли Tween до конечной концентрации 0,7%. Клетки на льду разрушали посредством ультразвука в течение 5 мин, чередуя 2-секундные включения и 2-секундные выключения. Клеточный лизат центрифугировали при 20000 × g в течение 30 мин. Супернатант наносили на Ni-NTA сефарозную колонку, уравновешенную 20 мМ Трис-HCl буфером, рН 8, содержащим 0,7% Tween. Колонку промывали 20 мМ Трис-HCl буфером, рН 8, содержащим 0,7% Tween, и связавшийся белок элюировали 20 мМ Трис-HCl буфером, рН 8, с 300 мМ имидазолом, содержащим 0,7% Tween.
Элюат подвергали ПААГ-ДСН на 12%-ном Трис-глициновом геле в восстанавливающих условиях. На Фиг.8А стрелкой показана основная полоса, соответствующая слитому белку. Выход определяли по мг очищенного белка из 1 литра культуры, выращенной до OD600 1 во встряхиваемой колбе. Выход составлял 64 мг/л. Заключили, что слитый белок, содержащий одну группировку NT, приводит к неожиданно высокому выходу при наличии детергента в клеточном лизате.
Пример 5 - получение слитого белка MetSP-C33Leu
Конструировали экспрессирующий вектор, содержащий ген, кодирующий NT2-MetSP-C33Leu (т.е. NTNT-MetSP-C33Leu) в виде слияния с Hise (SEQ ID NO:28-29). Вектор использовали для трансформации клеток Escherichia coli BL21 (DE3) (Merck Biosciences), которые выращивали при 30°С в среде Лурия-Бертани, содержащей канамицин, до OD600 0,9-1, индуцировали изопропил-β-D-тиогалактопиранозидом (IPTG) и дополнительно инкубировали в течение 3 часов при 25°С. Клетки собирали центрифугированием и ресуспендировали в 20 мМ Трис-HCl, рН 8.
Добавляли лизоцим и инкубировали клетки в течение 30 мин на льду. Tween либо не добавляли, либо добавляли до конечной концентрации 0,7%. Клетки на льду разрушали посредством ультразвука в течение 5 мин, чередуя 2-секундные включения и 2-секундные выключения. Клеточный лизат центрифугировали при 20000 × g в течение 30 мин. Супернатант наносили на Ni-NTA сефарозную колонку, уравновешенную 20 мМ Трис-HCl буфером, рН 8,±0,7% Tween. Колонку промывали 20 мМ Трис-HCl буфером, рН 8,±0,7% Tween, и связавшийся белок элюировали 20 мМ Трис-HCl буфером, рН 8, с 300 мМ имидазолом ±0,7% Tween.
Элюат подвергали ПААГ-ДСН на 12%-ном Трис-глициновом геле в восстанавливающих условиях. На Фиг.8Б основная полоса, соответствующая слитому белку на двух дорожках слева, показана стрелкой. Выход определяли по мг очищенного белка из 1 литра культуры, выращенной до OD600 1 во встряхиваемой колбе. Выход составлял 40 мг/л в отсутствие Tween и 68 мг/л в присутствии 0,7% Tween. Заключили, что слитый белок, содержащий две последовательные группировки NT, приводит к неожиданно высокому выходу в отсутствие детергента в клеточном лизате и даже к более высокому выходу в присутствии детергента в клеточном лизате.
Пример 6 - Получение NT-сефарозы
Конструкцию CysHis6NT использовали для трансформации клеток Escherichia coli BL21 (DE3) (Merck Biosciences). Клетки выращивали при 30°С в среде Лурия-Бертани, содержащей канамицин, до OD600 0,8-1, индуцировали изопропил-β-D-тиогалактопиранозидом (IPTG) и дополнительно инкубировали в течение вплоть до 4 часов при комнатной температуре. Затем клетки собирали и ресуспендировали в 20 мМ Трис-HCl, рН 8,0, дополненном лизоцимом и ДНКазой I. После полного лизиса 15000д супернатанты наносили на колонку, упакованную Ni сефарозой (GE Healthcare). Колонку тщательно промывали и связавшиеся белки затем элюировали 100-300 мМ имидазолом. Фракции, содержащие целевые белки, объединяли и диализовали против 20 мМ Трис-HCl, рН 8,0. Очищенный белок Cys-His6-NT связывают с активированной тиольной сефарозой с использованием стандартного протокола (GE Healthcare).
Пример 7 - Очистка слитых белков с использованием NT сефарозы
Клеточные лизаты из Примеров 4 и 5 наносят на колонку, упакованную NT сефарозой, предварительно уравновешенную 20 мМ фосфатом натрия, рН 6. Колонку тщательно промывают 20 мМ фосфатом натрия, рН 6, и связавшиеся белки затем элюируют 20 мМ фосфатом натрия, рН 7. Фракции, содержащие целевые белки, объединяют. Образцы белков разделяют на ПААГ-ДСН гелях и затем окрашивают Coomassie Brilliant Blue R-250. Содержание белка определяют из поглощения при 280 нм.
Пример 8 - Получение NT-REP4-CT
Конструировали экспрессирующий вектор для получения NT-REP4-CT в виде N-концевого слияния с Hiss (SEQ ID NO 17-18). Вектор использовали для трансформации клеток Escherichia coli BL21 (DE3) (Merck Biosciences), которые выращивали при 30°С в среде Лурия-Бертани, содержащей канамицин, до ODeoo примерно 1, индуцировали изопропил-β-D-тиогалактопиранозидом (IPTG) и дополнительно инкубировали в течение вплоть до 4 часов при комнатной температуре. Затем клетки собирали и ресуспендировали в 20 мМ Трис-HCl (рН 8,0), дополненном лизоцимом и ДНКазой I.
После полного лизиса 15000g супернатанты наносили на колонку, упакованную Sepharose (GE Healthcare, Uppsala, Швеция). Колонку тщательно промывали перед элюцией связавшихся белков 300 мМ имидазолом. Фракции, содержащие целевые белки, объединяли и диализовали против 20 мМ Трис-HCl (рН 8,0).
Образцы белка разделяли посредством ПААГ-ДСН и затем окрашивали Coomassie Brilliant Blue R-250. Полученный белок NT-REP4-CT концентрировали посредством ультрафильтрации с использованием целлюлозного фильтра с порогом отсечения молекулярной массы 5 кДа (Millipore).
Пример 9 - Получение NT-REP4-CT
Конструировали экспрессирующий вектор для получения NT-REP4-CT в виде C-концевого слияния с Zbasic (SEQ ID NO 19). Вектор использовали для трансформации клеток Escherichia coli BL21 (DE3) (Merck Biosciences), которые выращивали при 30°С в среде Лурия-Бертани, содержащей канамицин, до ODeoo примерно 1, индуцировали изопропил-β-D-тиогалактопиранозидом (IPTG) и дополнительно инкубировали в течение вплоть до 2-4 часов при комнатной температуре. Затем клетки собирали и ресуспендировали в 50 мМ фосфате Na (рН 7,5), дополненном лизоцимом и ДНКазой I.
После полного лизиса 15000g супернтанты наносили на катионообменник (HiTrap S, GE Healthcare, Uppsala, Швеция). Колонку тщательно промывали перед элюцией связавшихся белков градиентом против 500 мМ NaCl. Фракции, содержащие целевые белки, объединяли и диализовали против 50 мМ фосфата Na (рН 7,5). Белок NT-REP4-CT (SEQ ID NO: 20) освобождали от меток Zbasic посредством протеолитического расщепления с использованием соотношения протеаза 3С: слитый белок 1:50 (масс./масс.) при 4°C в течение ночи. Для удаления высвобожденной метки Zbasic расщепленную смесь наносили на второй катионообменник и собирали фракции, проходящие через колонку.
Пример 10 - Получение NT-REP4-CT
Конструировали экспрессирующий вектор для получения NT-REP4-CT в виде С-концевого слияния с HisTrxHis (SEQ ID NO 21). Вектор использовали для трансформации клеток Escherichia coli BL21 (DE3) (Merck Biosciences), которые выращивали при 30°C в среде Лурия-Бертани, содержащей канамицин, до OD600 примерно 1, индуцировали изопропил-β-D-тиогалактопиранозидом (IPTG) и дополнительно инкубировали в течение вплоть до 2-4 часов при комнатной температуре. Затем клетки собирали и ресуспендировали в 20 мМ Трис-HCl (рН 8,0), дополненном лизоцимом и ДНКазой I.
После полного лизиса 15000g супернатанты наносили на колонку, упакованную Ni-Sepharose (GE Healthcare, Uppsala, Швеция). Колонку тщательно промывали перед элюцией связавшихся белков градиентом против 500 мМ NaCl. Фракции, содержащие целевые белки, объединяли и диализовали против 20 мМ Трис-HCl (рН 8,0). Белок NT-REP4-CT (SEQ ID NO 22) освобождали от HisTrxHis меток посредством протеолитического расщепления с использованием соотношения тромбин: слитый белок 1:1000 (масс./масс.) при 4°C в течение ночи. Для удаления высвобожденной HisTrxHis, расщепленную смесь наносили во вторую Ni-Sepharose колонку и собирали проходящую через колонку фракцию.
Пример 11 - Получение NT2-REP4-CT
Конструировали экспрессирующий вектор, содержащий ген, кодирующий NT2-REP4-CT (т.е. NTNT-REP-CT) в виде слияния с His6 (SEQ ID NO: 23-24). Вектор использовали для трансформации клеток Escherichia coli BL21 (DE3) (Merck Biosciences), которые выращивали при 30°С в среде Лурия-Бертани, содержащей канамицин, до OD600 0,9-1, индуцировали изопропил-β-D-тиогалактопиранозидом (IPTG) и дополнительно инкубировали в течение 3 часов при 25°С. Клетки собирали центрифугированием и ресуспендировали в 20 мМ Трис-HCl, рН 8.
Добавляли лизоцим и ДНКазу, и клетки инкубировали в течение 30 мин на льду. Клеточный лизат центрифугировали при 20000 × g в течение 30 мин. Супернатанты наносили на Ni-NTA сефарозную колонку, уравновешенную 20 мМ Трис-HCl буфером, рН 8. Колонку промывали 20 мМ Трис-HCl буфером, рН 8, и связавшийся белок элюировали 20 мМ Трис-HCl буфером, рН 8, с 300 мМ имидазолом.
Элюат подвергали ПААГ-ДСН на 12%-ном Трис-глициновом геле в восстанавливающих условиях. На Фиг.8В основная полоса, соответствующая слитому белку на двух дорожках слева, показана стрелкой. Выход определяли по мг очищенного белка из 1 литра культуры, выращенной до OD600 1 во встряхиваемой колбе. Выход составлял 30 мг/л. Заключили, что миниатюрные спидроиновые белки можно успешно экспрессировать в виде слияний с двумя группировками NT.
Пример 12 - Получение NT-REP4-CT, NT2-REP4-CT и NT-REP8-CT
Конструировали экспрессирующие векторы, содержащие ген, кодирующий NT-REP4-CT (SEQ ID NO 20 и 22), NT2-REP4-CT (SEQ ID NO 23) и NT-REP8-CT (SEQ ID NO 25), соответственно. Векторы используют для трансформации клеток Escherichia coli BL21 (DE3) (Merck Biosciences), которые выращивают при 30°С в среде Лурия-Бертани, содержащей канамицин, до OD600 0,9-1, индуцируют изопропил-β-D-тиогалактопиранозидом (IPTG) и дополнительно инкубируют в течение 3 часов при 25°С. Клетки собирают центрифугированием и ресуспендируют в 20 мМ Трис-HCl, рН 8.
Добавляют лизоцим и клетки инкубируют в течение 30 мин на льду. Tween либо не добавляют, либо добавляют до конечной концентрации 0,7%. Клеточные лизаты центрифугируют при 20000 × g в течение 30 мин. Аффинную среду NT получают, как описано в Примере 6. Супернатант наносят на аффинную колонку NT согласно Примеру 7. Элюат из аффинной колонки NT подвергают гель-электрофорезу.
Пример 13 - Получение NTHis, NT2-REP8-CT и NT8-Brichos
A) NTHis
Конструировали экспрессирующий вектор для получения NT в виде N-концевого слияния с His6 (SEQ ID NO 30). Вектор использовали для трансформации клеток Escherichia coli BL21 (DE3) (Merck Biosciences), которые выращивали при 30°С в среде Лурия-Бертани, содержащей канамицин, до OD600 примерно 1, индуцировали изопропил-β-D-тиогалактопиранозидом (IPTG) и дополнительно инкубировали в течение вплоть до 4 часов при комнатной температуре. Затем клетки собирали и ресуспендировали в 20 мМ Трис-HCl (рН 8,0), дополненном лизоцимом и ДНКазой I.
После полного лизиса 15000g супернатанты наносили на колонку, упакованную Ni-Sepharose (GE Healthcare, Uppsala, Швеция). Колонку тщательно промывали перед элюцией связавшихся белков 300 мМ имидазолом. Фракции, содержащие целевые белки, объединяли и диализовали против 20 мМ Трис-HCl (рН 8,0). Образцы белка разделяли посредством ПААГ-ДСН и затем окрашивали Coomassie Brilliant Blue R-250. Полученный белок NT (SEQ ID NO 30) концентрировали посредством ультрафильтрации с использованием целлюлозного фильтра с порогом отсечения молекулярной массы 5 кДа (Millipore). Выход составлял 112 мг/литр культуры, выращенной до OD600 1 во встряхиваемой колбе.
Б) NT2-REP8-CT
Конструировали экспрессирующий вектор для получения NT2-REP8-CT (NTNT8REPCT) в виде N-концевого слияния с His6 (SEQ ID NO 31). Вектор использовали для трансформации клеток Escherichia coli BL21 (DE3) (Merck Biosciences), которые выращивали при 30°С в среде Лурия-Бертани, содержащей канамицин, до OD600 примерно 1, индуцировали изопропил-β-D-тиогалактопиранозидом (IPTG) и дополнительно инкубировали в течение вплоть до 4 часов при комнатной температуре. Затем клетки собирали и ресуспендировали в 20 мМ Трис-HCl (рН 8,0), дополненном лизоцимом и ДНКазой I. Образцы белка разделяли посредством ПААГ-ДСН и затем окрашивали Coomassie Brilliant Blue R-250 для подтверждения экспрессии белка.
После полного лизиса 15000д супернатанты наносили на колонку, упакованную Ni-Sepharose (GE Healthcare, Uppsala, Швеция). Колонку тщательно промывали перед элюцией связавшихся белков 300 мМ имидазолом. Фракции, содержащие целевые белки, объединяли и диализовали против 20 мМ Трис-HCl (рН 8,0). Образцы белка разделяли посредством ПААГ-ДСН и затем окрашивали Coomassie Brilliant Blue R-250.
В) NT2-Brichos
Конструировали экспрессирующий вектор для получения NT2-Brichos (NT-NT-Brichos) в виде N-концевого слияния с His6 (SEQ ID NO 32). Вектор использовали для трансформации клеток Escherichia coli BL21 (DE3) (Merck Biosciences), которые выращивали при 30°С в среде Лурия-Бертани, содержащей канамицин, до OD600 примерно 1, индуцировали изопропил-β-D-тиогалактопиранозидом (IPTG) и дополнительно инкубировали в течение вплоть до 4 часов при комнатной температуре. Затем клетки собирали и ресуспендировали в 20 мМ Трис-HCl (рН 8,0), дополненном лизоцимом и ДНКазой I. Клетки на льду дополнительно разрушали посредством ультразвука в течение 5 минут с 2-секундными включениями и 2-секундными выключениями.
После полного лизиса 15000g супернатанты наносили на колонку, упакованную Ni-Sepharose (GE Healthcare, Uppsala, Швеция). Колонку тщательно промывали перед элюцией связавшихся белков 300 мМ имидазолом. Фракции, содержащие целевые белки, объединяли и диализовали против 20 мМ Трис-HCl (рН 8,0). Образцы белка разделяли посредством ПААГ-ДСН и затем окрашивали Coomassie Brilliant Blue R-250. Полученный белок NT2-Brichos (SEQ ID NO 32) концентрировали посредством ультрафильтрации с использованием целлюлозного фильтра с порогом отсечения молекулярной массы 5 кДа (Millipore). Выход составлял 20 мг/литр (культуры), выращенной до OD600 1 во встряхиваемой колбе.
Пример 14 - NT для рН-зависимого обратимого захвата
Цель: применение ковалентно иммобилизованного NT (и NTNT) для обратимого захвата NT слитых белков.
Стратегия: исследовать рН-зависимую сборку NT (и NTNT) слитых белков с волокнами (и пленкой) с ковалентно связанным NT (и NTNT). Волокна и пленки без NT используют в качестве контроля.
А) Волокна
Волокна (длина примерно 0,5 см, примерно 50 мкг) NT-REP4-CT (SEQ ID NO 20), NT2-REP4-CT (SEQ ID NO 23) и REP4-CT (SEQ ID NO 2, контроль) погружали в 100 мкл раствора 5 мг/мл растворимого NTHis (SEQ ID NO 30) или NT2-Brichos (SEQ ID NO 32) при рН 8 на 10 минут. рН снижали путем добавления 400 мкл натрий-фосфатного буфера (NaP) до рН 6 и инкубировали в течение 10 минут для обеспечения сборки растворимого NT в волокно. Волокна переносили в 500 мкл NaP при рН 6 и дважды промывали. Наконец, волокна переносили в 500 мкл NaP при рН 7 и инкубировали 10 минут для обеспечения высвобождения растворимого NT. To же самое делали в присутствии 300 мМ NaCl во всех NaP буферах с рН 6. Образцы из разных растворов анализировали на ПААГ-ДСН.
При использовании волокон NT2-REP4-CT и NT-REP4-CT, как NTHis, так и NT2-Brichos захватывались при рН 6. При увеличении рН до 7 как NTHis, так и NT2-Brichos снова высвобождались и могли быть детектированы на ПААГ-ДСН. Добавление 300 мМ NaCl уменьшало захват при рН 6.
Б) Пленка:
Пленки NT-REP4-CT (SEQ ID NO 20) и REP4-CT (SEQ ID NO 2, контроль) получали, заливая 50 мкл раствора белка в концентрации 3 мг/мл в пластиковую лунку и оставляя сохнуть в течение ночи. На следующий день в лунки с пленкой добавляли 100 мкл раствора 5 мг/мл растворимого NTHis (SEQ ID NO 30) при рН 8 и оставляли на 10 минут. Затем снижали рН до 6 путем добавления 400 мкл NaP и инкубировали в течение 10 минут для обеспечения сборки растворимого NT в пленку. Пленки затем дважды промывали 500 мкл NaP с рН 6. Для высвобождения растворимого NTHis добавляли 500 мкл NaP с рН 7 и инкубировали в течение 10 минут. То же самое делали в присутствии 300 мМ NaCl во всех NaP буферах с рН 6. Образцы из разных растворов анализировали на ПААГ-ДСН.
Анализ на ПААГ-ДСН показал, что пленка NT-REP4-CT обеспечивала захват NTHis при рН 6 и повторное высвобождение при увеличении рН до 7.
Пример 15 - NT для рН-зависимой, обратимой сборки слитых белков
Цель: применение NT в качестве обратимой метки, которая обеспечивает анализ взаимодействия между белковыми группировками, например, анализ взаимодействия Brichos с мишенями с бета-складчатыми стуктурами, например, с поверхностно-активным белком С (SP-C).
NT2-Brichos (SEQ ID NO 32) смешивают либо с NT2-MetSP-C33Leu (SEQ ID NO 28), либо с NTHis (SEQ ID NO 30) до общего объема 100 мкл при рН 8. Добавляют NaP буфер (400 мкл) с получением конечного рН 6 и смесь инкубируют в течение 20 минут для обеспечения сборки NT. Затем вновь увеличивают рН до рН 7 для обеспечения обращения сборки NT. Образцы из разных растворов анализируют на нативном геле и посредством гель-фильтрации (SEC).











































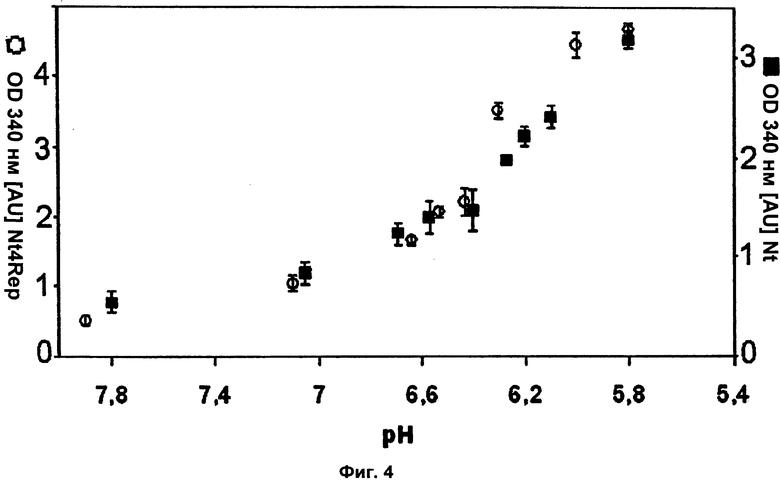
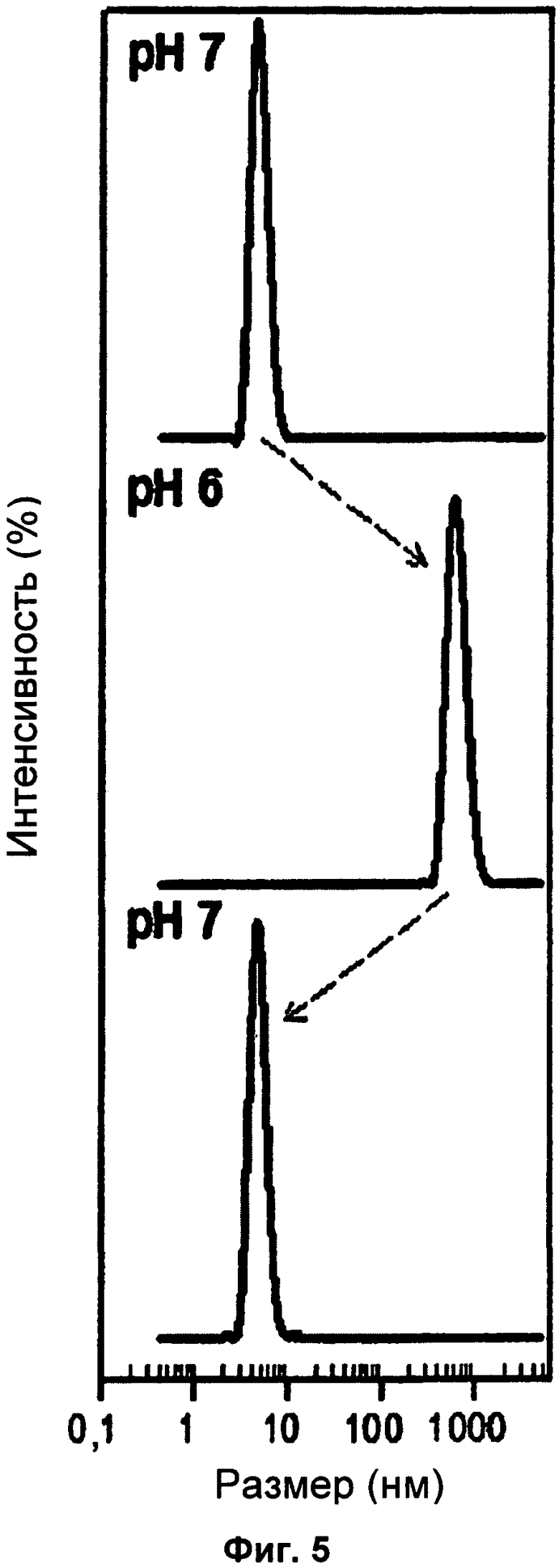
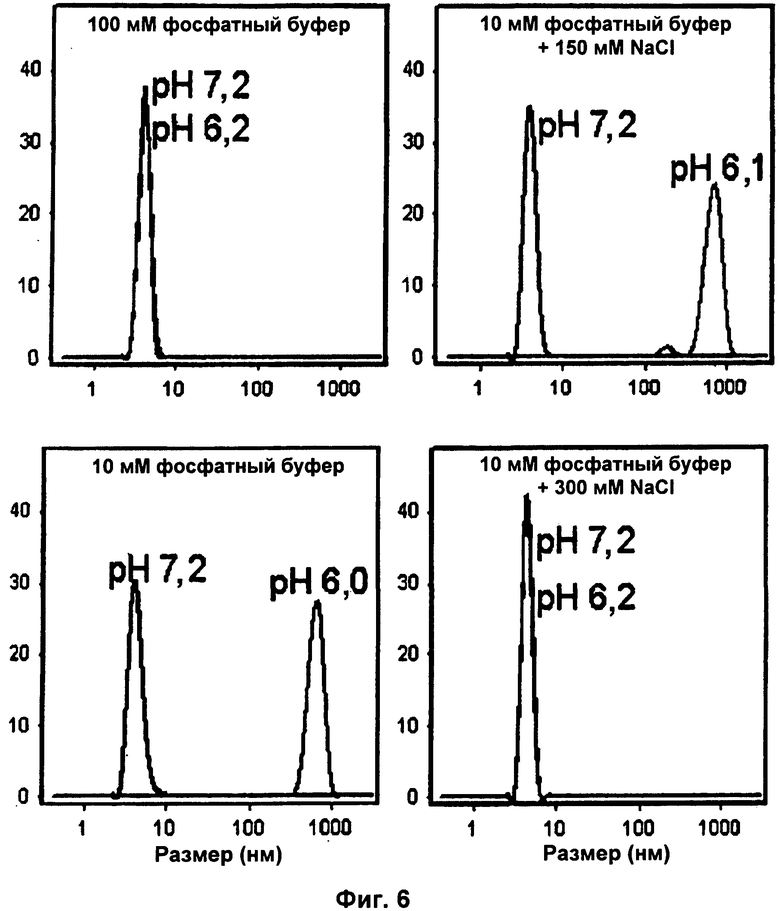
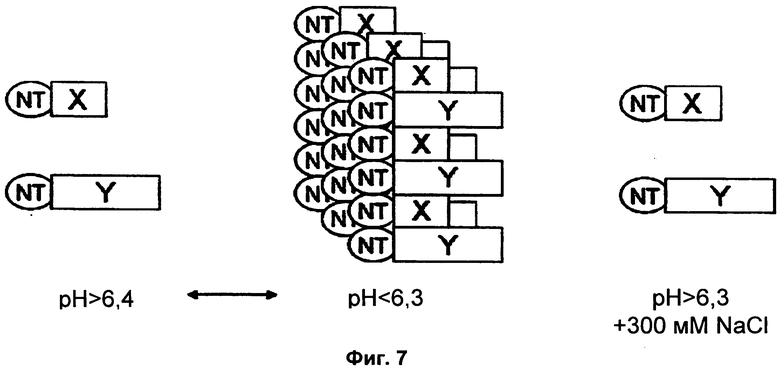
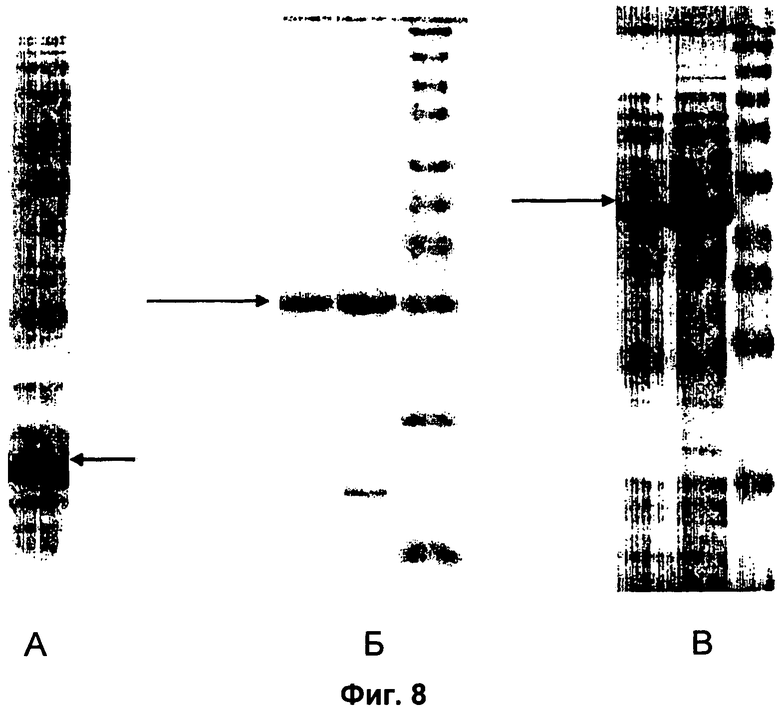
Изобретение относится к области биотехнологии и может быть использовано для получения полимеров из белка шелка паука. Получают белок шелка паука из 240-760 аминокислотных остатков, соответствующий формуле NT2-REP-CT или NT-REP-CT, где: NT - N-концевой фрагмент от 100 до 160 аминокислот, происходящий из белка шелка паука, с по меньшей мере 80% идентичностью с SEQ ID NO: 6; REP - белковый фрагмент от 70 до 300 аминокислот, выбранный из L(AG)nL, L(AG)nAL, L(GA)nL, L(GA)nGL, где: n - целое число от 2 до 10; А состоит из 8-18 аминокислот, где от 0 до 3 аминокислот не являются Ala, а остальные аминокислоты - Ala; G состоит из 12-30 аминокислот, где по меньшей мере 40% аминокислот - Gly; и L - линкер из 0-20 аминокислот; СТ - С-концевой фрагмент от 70 до 120 аминокислот, происходящий из белка шелка паука, с по меньшей мере 80% идентичностью с SEQ ID NO: 7. Способ включает растворение полученного белка шелка паука в жидкой среде с pH 6,4 или выше и/или ионной силой более 300 мМ для предотвращения полимеризации и увеличения растворимости белка шелка паука с возможным удалением липополисахаридов и других пирогенов. Далее корректируют свойства указанной жидкой среды до pH 6,3 или ниже и ионной силы менее 300 мМ для обеспечения полимеризации, после полимеризации выделяют полимеры белка шелка паука из жидкой среды. Изобретение позволяет контролировать сборку полимеров спидроина. 5 н. и 9 з.п. ф-лы, 8 ил., 3 табл., 15 пр.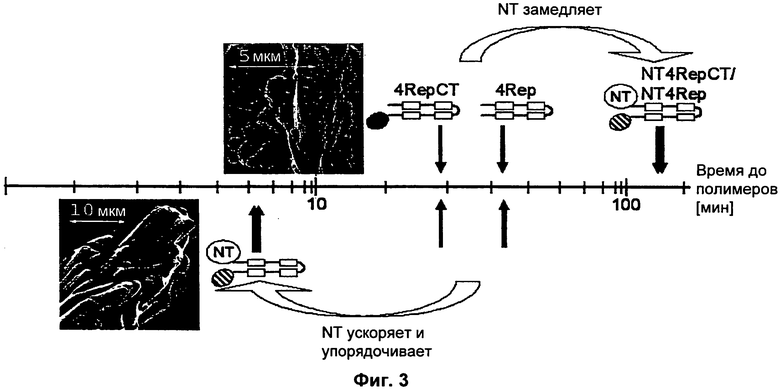
1. Способ получения полимеров выделенного белка шелка паука, включающий стадии, на которых:
(1) получают белок шелка паука, состоящий из 170-760 аминокислотных остатков и содержащий:
N-концевой фрагмент NT, состоящий по меньшей мере из одного фрагмента из 100-160 аминокислотных остатков, происходящих из N-концевого фрагмента белка шелка паука, где указанный фрагмент имеет по меньшей мере 80%-ную идентичность с SEQ ID NO: 6; и
повторяющийся фрагмент REP из 70-300 аминокислотных остатков, происходящих из повторяющегося фрагмента белка шелка паука, где указанный фрагмент выбран из группы L(AG)nL, L(AG)nAL, L(GA)nL, L(GA)nGL, где:
n представляет собой целое число от 2 до 10;
каждый индивидуальный сегмент А представляет собой аминокислотную последовательность из 8-18 аминокислотных остатков, где от 0 до 3 аминокислотных остатков не являются Ala, а остальные аминокислотные остатки представляют собой Ala;
каждый индивидуальный сегмент G представляет собой аминокислотную последовательность из 12-30 аминокислотных остатков, где по меньшей мере 40% аминокислотных остатков представляют собой Gly; и
каждый индивидуальный сегмент L представляет собой линкерную аминокислотную последовательность из 0-20 аминокислотных остатков; и возможно
С-концевой фрагмент СТ из 70-120 аминокислотных остатков, который происходит из С-концевого фрагмента белка шелка паука, где указанный фрагмент имеет по меньшей мере 80%-ную идентичность с SEQ ID NO: 7;
(2) растворяют указанный белок шелка паука в жидкой среде с pH 6,4 или выше и/или ионной силой более 300 мМ для предотвращения полимеризации и увеличения растворимости указанного белка шелка паука с возможным удалением липополисахаридов и других пирогенов;
(3) корректируют свойства указанной жидкой среды до pH 6,3 или ниже и ионной силы менее 300 мМ для обеспечения полимеризации указанного белка шелка паука;
(4) оставляют белок шелка паука для образования полимеров в жидкой среде, имеющей pH 6,3 или ниже и ионную силу менее 300 мМ для обеспечения полимеризации указанного белка шелка паука; и
(5) выделяют полимеры белка шелка паука из указанной жидкой среды.
2. Способ по п. 1, где pH жидкой среды со стадий (3) и (4) составляет 6,2 или ниже, например 6,0 или ниже, и/или где pH жидкой среды со стадий (3) и (4) составляет 3 или выше, например 4,2 или выше.
3. Способ по п. 1, где ионная сила жидкой среды со стадий (3) и (4) находится в диапазоне от 1 до 250 мМ.
4. Способ по п. 1, где pH жидкой среды со стадии (2) составляет 6,7 или выше, например 7,0 или выше.
5. Способ по п. 1, где pH жидкой среды со стадии (2) находится в диапазоне от 6,4 до 6,8.
6. Способ по п. 1, где указанный полимер представляет собой волокно, пленку, пену, сеть или ячеистую структуру.
7. Способ по любому из пп. 1-6, где указанный белок выбран из группы белков, определенных формулами NT2-REP-CT, NT-REP-CT, NT2-REP и NT-REP.
8. Способ по п. 7, где указанный белок выбран из группы белков, определенных формулами NT2-REP-CT и NT-REP-CT.
9. Выделенный белок шелка паука для использования в способе по п. 1, который состоит из 240-760 аминокислотных остатков и выбран из группы белков, определенных формулами NT2-REP-CT и NT-REP-CT, где:
NT представляет собой белковый фрагмент, имеющий от 100 до 160 аминокислотных остатков, который представляет собой N-концевой фрагмент, происходящий из белка шелка паука, где указанный фрагмент имеет по меньшей мере 80%-ную идентичность с SEQ ID NO: 6; и/или
REP представляет собой белковый фрагмент, имеющий от 70 до 300 аминокислотных остатков, где указанный фрагмент выбран из группы L(AG)nL, L(AG)nAL, L(GA)nL, L(GA)nGL, где:
n представляет собой целое число от 2 до 10;
каждый индивидуальный сегмент А представляет собой аминокислотную последовательность из 8-18 аминокислотных остатков, где от 0 до 3 аминокислотных остатков не являются Ala, а остальные аминокислотные остатки представляют собой Ala;
каждый индивидуальный сегмент G представляет собой аминокислотную последовательность из 12-30 аминокислотных остатков, где по меньшей мере 40% аминокислотных остатков представляют собой Gly; и
каждый индивидуальный сегмент L представляет собой линкерную аминокислотную последовательность из 0-20 аминокислотных остатков; и
СТ представляет собой белковый фрагмент, имеющий от 70 до 120 аминокислотных остатков, который представляет собой С-концевой фрагмент, происходящий из белка шелка паука, где указанный фрагмент имеет по меньшей мере 80%-ную идентичность с SEQ ID NO: 7.
10. Полимер из белка шелка паука, где указанный белок состоит из 240-760 аминокислотных остатков и выбран из группы белков, определенных формулами NT2-REP-CT и NT-REP-CT, где:
NT представляет собой белковый фрагмент из 100-160 аминокислотных остатков, происходящих из N-концевого фрагмента белка шелка паука, где указанный фрагмент имеет по меньшей мере 80%-ную идентичность с SEQ ID NO: 6;
REP представляет собой белковый фрагмент из 70-300 аминокислотных остатков, происходящих из повторяющегося фрагмента белка шелка паука, где указанный фрагмент выбран из группы L(AG)nL, L(AG)nAL, L(GA)nL, L(GA)nGL, где:
n представляет собой целое число от 2 до 10;
каждый индивидуальный сегмент А представляет собой аминокислотную последовательность из 8-18 аминокислотных остатков, где от 0 до 3 аминокислотных остатков не являются Ala, а остальные аминокислотные остатки представляют собой Ala;
каждый индивидуальный сегмент G представляет собой аминокислотную последовательность из 12-30 аминокислотных остатков, где по меньшей мере 40% аминокислотных остатков представляют собой Gly; и
каждый индивидуальный сегмент L представляет собой линкерную аминокислотную последовательность из 0-20 аминокислотных остатков; и СТ представляет собой белковый фрагмент из 70-120 аминокислотных остатков, который происходит из С-концевого фрагмента белка шелка паука, где указанный фрагмент имеет по меньшей мере 80%-ную идентичность с SEQ ID NO: 7.
11. Полимер из белка шелка паука по п. 10, представляющий собой волокно, пленку, пену, сеть или ячеистую структуру.
12. Полимер из белка шелка паука по п. 11, представляющий собой волокно, имеющее диаметр более 0,1 мкм и длину более 5 мм.
13. Композиция для использования на стадии (2) в способе по п. 1, содержащая выделенный белок шелка паука по п. 9, растворенный в жидкой среде, предотвращающей полимеризацию указанного белка шелка паука, имеющей pH 6,4 или выше и/или ионную силу более 300 мМ.
14. Выделенная молекула нуклеиновой кислоты, кодирующая белок шелка паука по п. 9, характеризующаяся последовательностью нуклеиновой кислоты, выбранной из группы, состоящей из последовательностей нуклеиновой кислоты, которые кодируют белок шелка паука по п. 9; и комплементарных им последовательностей нуклеиновых кислот.
| HEDHAMMAR M | |||
| et al, Structural properties of recombinant nonrepetitive and repetitive parts of major ampullate spidroin 1 from Euprosthenops australis: implications for fiber formation, Biochemistry, 2008, v | |||
| Способ очищения сернокислого глинозема от железа | 1920 |
|
SU47A1 |
| АППАРАТ ДЛЯ ПРОИЗВОДСТВА БУХГАЛТЕРСКИХ ОПЕРАЦИЙ | 1925 |
|
SU3407A1 |
| WO 2007078239 A2, 12.07.2007 | |||
| WO 2008154547 A2, 18.12.2008 | |||
| DB "UniprotKB", N Q05H60_9ARAC, 14.11.2006 | |||
| DB "EMBL-EBI", N AM259067, 06.10.2006 | |||
| RU 2007102846 A, 27.08.2008 | |||
Авторы
Даты
2015-08-20—Публикация
2010-04-21—Подача