Данное изобретение относится к способам количественного определения нуклеиновых кислот и, в частности, к улучшенному универсальному способу количественного определения нуклеиновых кислот для исследований генной экспрессии без необходимости нормализовать данные к конститутивному гену или к синтетическому гену интереса. Этот способ применим для диагностического, криминалистического и исследовательского применения, однако, следует понимать, что данное изобретение не ограничивается этими конкретными областями применения.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Любое обсуждение уровня техники в этом описании не должно ни в коем случае рассматриваться как признание того, что такой уровень техники является широко известным или образует часть общих знаний в данной области.
ПЦР технологии для количественного анализа генной экспрессии были улучшены посредством разработки быстрых термоциклеров и введения флюоресцентного мониторинга амплифицированных продуктов после каждого цикла (ПЦР в реальном времени). Количественный анализ генной экспрессии происходит посредством применения красителей, особенно флюоресцентных красителей, и обнаружения повышения флюоресценции во время экспотенциальной фазы ПЦР амплификации, пропорциональное количеству нуклеиновых кислот в образце в начале реакции. Количественный анализ основан на пороговом цикле, т.е. первом цикле с обнаруживаемой флюоресценцией, и может быть проведен абсолютным способом с внешними стандартами (обычно синтетическим геном) или относительным способом со сравнительным эталонным геном для нормализации, служащим в качестве внутреннего калибратора (т.е. конститутивного гена). Контрольные гены или конститутивные гены используются для нормализации уровней мРНК между различными образцами.
Ключевым является то, что выбранный эталонный ген не изменяется, поскольку даже незначительные изменения в генной экспрессии будет изменять относительный профиль количественного анализа целевого гена. Ошибки в дозировании из пипетки и разведении также изменяют уровень амплификации и, таким образом, изменяют профиль количественного анализа.
Гены, такие как глицеральдегид-3-фосфат дегидрогеназа (GAPDH), порфобилиноген дезаминаза (PBGD), бета2-микроглобин или бета-актин часто используются как внутренние калибраторы в ПЦР в реальном времени. Однако было показано, что упомянутые гены перемещаются в ответ на экспериментальные условия или обработки. Гены, которые экспрессируются в изобилии, такие как 18S, также не являются идеальными эталонными генами, так как условия ПЦР необходимо ограничить так, чтобы не переполнить реакцию.
Таким образом, подходящие конститутивный гены должны адекватно экспрессироваться в ткани интереса, и наиболее важно, демонстрировать минимальную вариабельность в экспрессии между образцами и при используемых экспериментальных условиях или обработках.
Многие из этих контрольных генов, однако, могут показывать неприемлемую изменчивость в экспрессии. Было показано, что уровень экспрессии таких генов может варьировать в пределах тканей или клеток, и может изменяться при определенных обстоятельствах, т.е. различных обработках. Таким образом, принципиальным является подтвердить правильность выбора конститутивных генов в любой новой экспериментальной системе. Найти конститутивный ген или эталонный ген, который является подходящим для применения в определенной экспериментальной системе часто является занимающей много времени и трудной задачей. В некоторых ситуациях это может быть невозможным.
Применение внешних стандартов (т.е. синтетической последовательности) в исследованиях генной экспрессии, как правило, требует, чтобы ген интереса был клонирован, чтобы обеспечить синтетический эталонный ген. В этом способе известные количества последовательности синтетического эталонного гена серийно разводят, затем подвергают амплификации для получения стандартной кривой. Продукция клонированной последовательности для этого способа является, как правило, занимающей много времени трудоемкой задачей, и ошибки разведения увеличиваются экспотенциально, что может привести к неправильной оценке уровней нуклеиновой кислоты. Стабильность и сохранность высоко разведенных клонированных последовательностей может также вызывать трудности.
Таким образом, сохраняется необходимость в быстром и эффективном универсальном способе количественного определения нуклеиновых кислот, который может быть применим к любой экспериментальной ситуации или условиям обработки, который не требует применения конститутивного гена или синтетического гена интереса для нормализации данных.
Целью настоящего изобретения является преодолеть или улучшить, по меньшей мере, один из недостатков уровня техники, или обеспечить полезную альтернативу.
КРАТКОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
В широком аспекте данное изобретение относится к способу количественного определения нуклеиновых кислот, который не требует применения конститутивного гена или синтетического эталонного гена для нормализации данных экспрессии нуклеиновой кислоты. Скорее способ настоящего изобретения использует универсальный эталонный олигонуклеотид (или может применять один или несколько таких олигонуклеотидов) в комбинации с подходящим красителем, что может использоваться для создания стандартной кривой, из которой абсолютный уровень амплифицированной целевой нуклеиновой кислоты в образце может быть рассчитан. Таким образом, способ настоящего изобретения может использовать один эталонный олигонуклеотид для подсчета различных нуклеиновых кислот интереса, либо отдельно, либо в смеси таких нуклеиновых кислот интереса.
Данное изобретение также относится к наборам для применения в способе настоящего изобретения.
В первом аспекте обеспечивается способ количественного определения целевой нуклеиновой кислоты, содержащий следующее:
a) мечение эталонного олигонуклеотида, имеющего заранее установленную длину, с помощью выявляемого маркера;
b) создание стандартной кривой, используя серийные разведения меченого эталонного олигонуклеотида, путем построения графика зависимости интенсивности выявляемого маркера от концентрации меченого эталонного олигонуклеотида;
c) амплификация целевой нуклеиновой кислоты в присутствии выявляемого маркера, который метит амплифицированную целевую нуклеиновую кислоту,
d) сравнение интенсивности выявляемого маркера, связанного с меченой амплифицированной целевой нуклеиновой кислотой, со стандартной кривой и определение количества амплифицированной целевой нуклеиновой кислоты, где указанная стандартная кривая не амплифицирована или совместно амплифицирована с целевой нуклеиновой кислотой.
Во втором аспекте обеспечивается способ количественного определения целевой нуклеиновой кислоты, содержащий следующее:
a) мечение эталонного олигонуклеотида, имеющего заранее установленную длину, с помощью выявляемого маркера;
b) создание стандартной кривой, используя серийные разведения меченого эталонного олигонуклеотида, путем построения графика зависимости интенсивности выявляемого маркера от концентрации меченого эталонного олигонуклеотида;
c) амплификация целевой нуклеиновой кислоты;
d) мечение амплифицированной целевой нуклеиновой кислоты с помощью выявляемого маркера;
e) сравнение интенсивности выявляемого маркера, связанного с меченой амплифицированной целевой нуклеиновой кислотой, со стандартной кривой и определение количества амплифицированной целевой нуклеиновой кислоты, где указанная стандартная кривая не амплифицирована или совместно амплифицирована с целевой нуклеиновой кислотой.
Нет необходимости, чтобы эталонная олигонуклеотидная последовательность имела какую-либо гомологию с целевой нуклеиновой кислотой или с последовательностью любого конститутивного гена. Однако из-за конкретного пути, в котором эталонный олигонуклеотид используется в способе настоящего изобретения (т.е. для получения стандартной кривой после серийного разведение эталонного олигонуклеотида) эталонная олигонуклеотидная последовательность может иметь степень гомологии или даже идентичности с целевой последовательностью нуклеиновой кислоты или конститутивным геном, или их меньших частей. Преимущество настоящего изобретения состоит в том, что способ может использовать один и тот же отдельный эталонный олигонуклеотид для подсчета различных целевых нуклеиновых кислот.На практике эталонный олигонуклеотид может быть универсальным олигонуклеотидом, с конкретной фиксированной длиной и GC содержанием, типично олигонуклеотидом с 100 п.н. и 50% GC содержанием.
Предпочтительно, амплификацию целевой нуклеиновой кислоты проводят с помощью способа полимеразной цепной реакции (ПЦР). Типично целевую нуклеиновую кислоту амплифицируют за 15 циклов, но это не является принципиальным для способа настоящего изобретения. Может также быть проведена одновременная амплификация множественных целевых нуклеиновых кислот интереса в одной реакции (т.е. мультиплексная ПЦР).
Эталонный олигонуклеотид может быть такой же или сходной длины с целевой последовательностью нуклеиновой кислоты, но это не обязательно должно быть так. Эталонный олигонуклеотид может быть длиннее или короче, чем целевая нуклеиновая кислота. Предпочтительно одну стандартную кривую получают с одним эталонным олигонуклеотидом и используют для множественных амплификации и количественных анализов целевой нуклеиновой кислоты. Каждая из множественных амплификации и количественных анализов целевой нуклеиновой кислоты может быть проведена различное количество раз при необходимости.
Предпочтительно обнаруживаемый маркер представляет собой краситель, который связывается с дцДНК (двухцепочечная ДНК), и он может быть интеркалирующим красителем. Предпочтительно, краситель представляет собой флюоресцентный краситель. Используемый краситель может быть выбран из любого из следующего: SYBR зеленый I, SYBR зеленый II, SYBR золотой, Evagreen, оксазол желтый, тиазол оранжевый, picogreen, ТОТО или ВЕВО, Deep Purple™, однако выбор красителя не является критически важным, так как другие подходящие красители могут также быть использованы и будут известны специалистам данной области техники. Предпочтительно стехиометрия красителя представляет собой один к одному, но может быть и выше.
В третьем аспекте обеспечивается набор для применения в способе первого или второго аспекта, содержащий один или несколько эталонных олигонуклеотидов и флюоресцентный краситель. Предпочтительно, только один эталонный олигонуклеотид присутствует в наборе. Если присутствует более чем один олигонуклеотид, то каждый может иметь одинаковую или разную длину.
В четвертом аспекте обеспечивается набор для применения в способе первого или второго аспекта, содержащий один или несколько эталонных олигонуклеотидов, меченых с помощью флюоресцентного красителя.
В пятом аспекте обеспечивается набор для применения в способе первого или второго аспекта, содержащий серийные разведения одного или нескольких эталонных олигонуклеотидов, меченых с помощью флюоресцентного красителя.
Эталонный олигонуклеотид будет предпочтительно иметь длину больше чем 60 п.н. и будет типично находится в диапазоне от около 60 п.н. и около 170 п.н. Наиболее предпочтительно эталонный олигонуклеотид будет иметь длину 100 п.н., что может использоваться для подсчета целевых нуклеиновых кислот, которые находятся обычно в диапазоне от около 60 до около 210 п.н. в длину. Верхняя граница длины эталонного олигонуклеотида не является критически важной и будет регулироваться практическими соображениями.
Желательно, чтобы GC содержание эталонного олигонуклеотида составляло 45% или выше. Типично, GC содержание эталонного олигонуклеотида может быть выбрано в диапазоне от около 45% до около 75% и наиболее предпочтительно оно составляет 50%. Верхняя граница GC содержания не является критически важной.
Эталонный олигонуклеотид может быть получен из биологического источника, естественного или иного, используя известные техники, или он может быть получен синтетически.
Если только контекст ясно не диктует обратное, во всем описании изобретения и формуле изобретения, слова "содержат", "содержащий" и т.п.должны рассматриваться во включающим смысле в отличие от исключающего или исчерпывающего смысла; то есть иными словами, в смысле "включая, без ограничения".
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МА ТЕРИАЛОВ
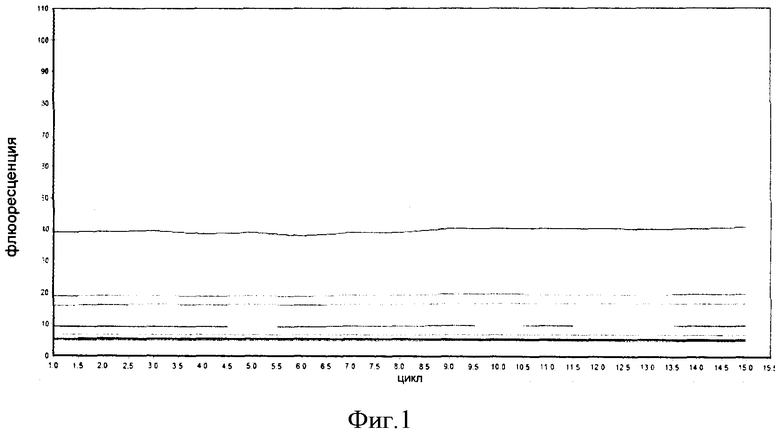
Фигура 1: Флюоресценция эталонного олигонуклеотидного стандарта при изменяющихся концентрациях за 15 циклов. Каждая горизонтальная линия представляет одну концентрацию. Отсутствие фермента в реакционной смеси обеспечивает то, что флюоресценция является неизменной в течение многочисленных циклов. График дополнительно показывает стабильность и воспроизводимость комплекса эталонного олигонуклеотида и красителя через повторяющиеся циклы денатурации и отжига.
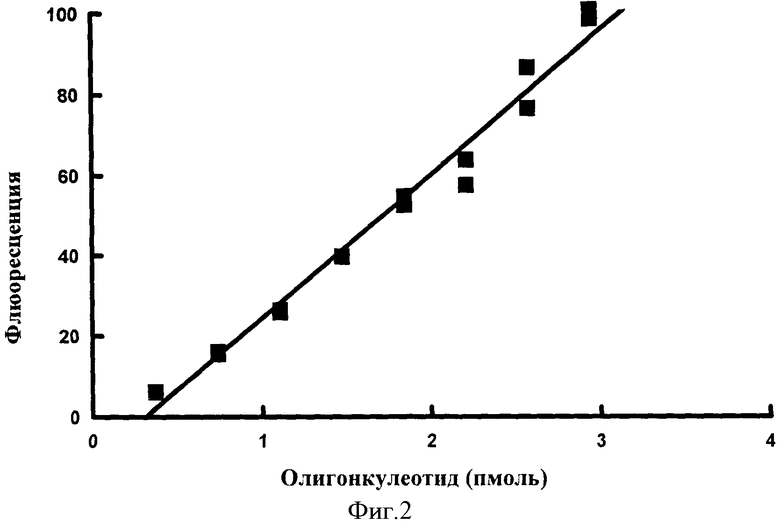
Фигура 2: Стандартная кривая, созданная из данных флюоресценции, показанных на Фигуре 1.
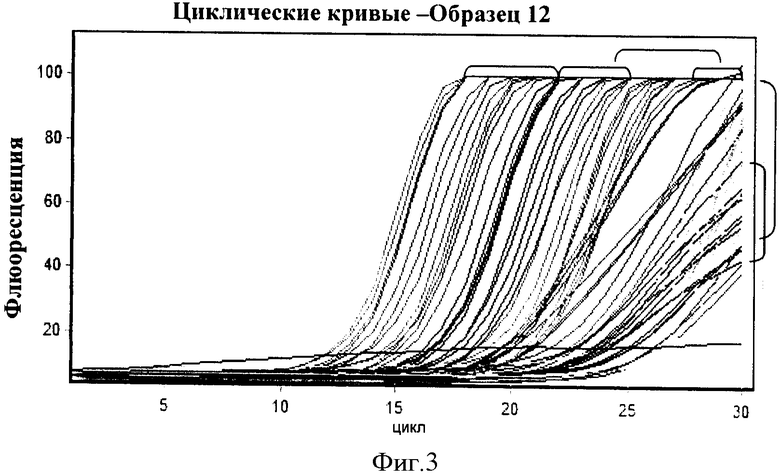
Фигура 3: Циклические кривые для шести генов (обозначенных скобками). Из этих данных получают циклы, требующие для каждого гена достижения трех данных уровней флюоресценции f1, f2, f3 (например 65, 60 и 55).
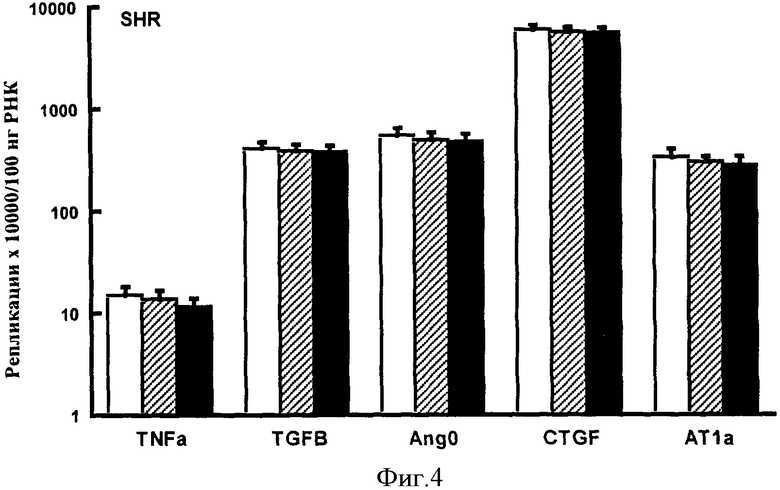
Фигура 4: Экспрессия пяти генов интереса в сердцах SHR крыс.Экспрессию каждого гена интереса рассчитывали, используя эталонный олигонуклеотид (незакрашенные столбики), эталонный олигонуклеотид плюс 20 пар оснований (заштрихованные столбики) и эталонный олигонуклеотид плюс 100 пар оснований (закрашенные столбики). Повышение длины эталонного олигонуклеотида не оказывало существенного влияния на расчет экспрессии гена интереса. TNFα р=0,3946; TGFβ р=0,7151; Ang0 р=0,6158; CTGF р=0,4955 и АТ1а р=0,5589, для эталонного олигонуклеотида в сравнении с показателем для эталонного олигонуклеотида плюс 20 и 100 пар оснований (ANOVA).
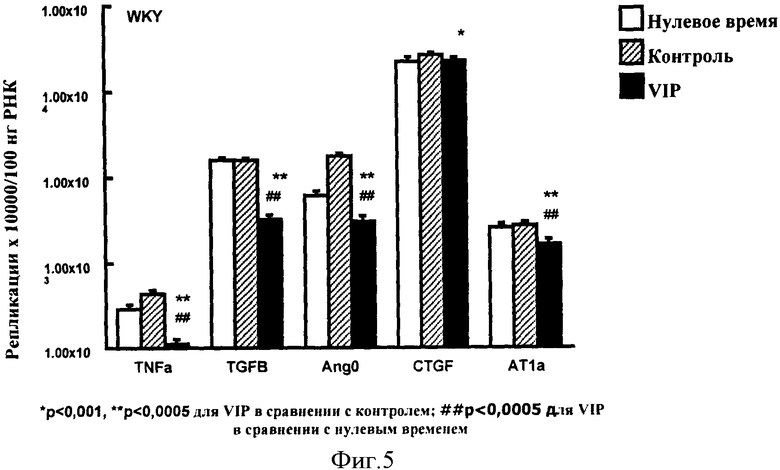
Фигура 5: Экспрессия пяти генов интереса в сердцах WKY крыс на высокосолевой диете в 3 экспериментальных группах - контроль нулевого времени (возраст 14 недель) незакрашенные столбики, через 4 недели после контрольной инфузии инертного носителя (возраст 18 недель) закрашенные столбики и через 4 недель обработки VIP (18 недель) закрашенные столбики.
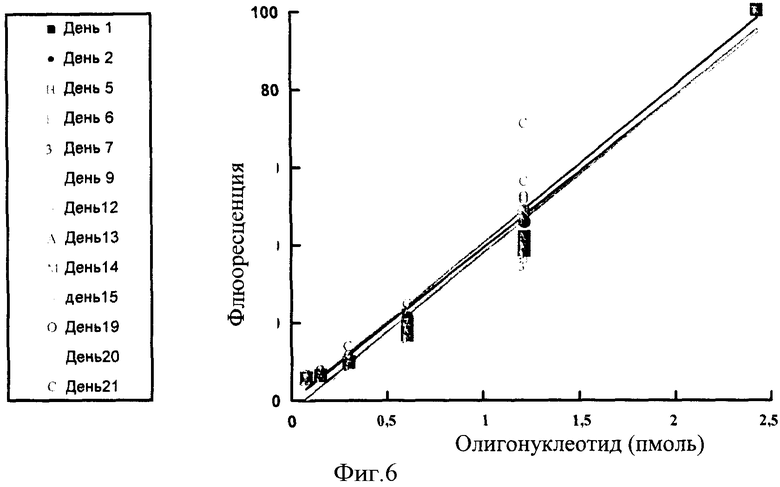
Фигура 6: Стандартные кривые, созданные через 3 недели. Реакционные смеси эталонного олигонуклеотида и красителя замораживали и хранили при -20°С между анализами, оттаивая для каждого анализа и снова замораживали. Как можно увидеть, созданные стандартные кривые являются стабильными с течением времени и повторяющегося замораживания и оттаивания.
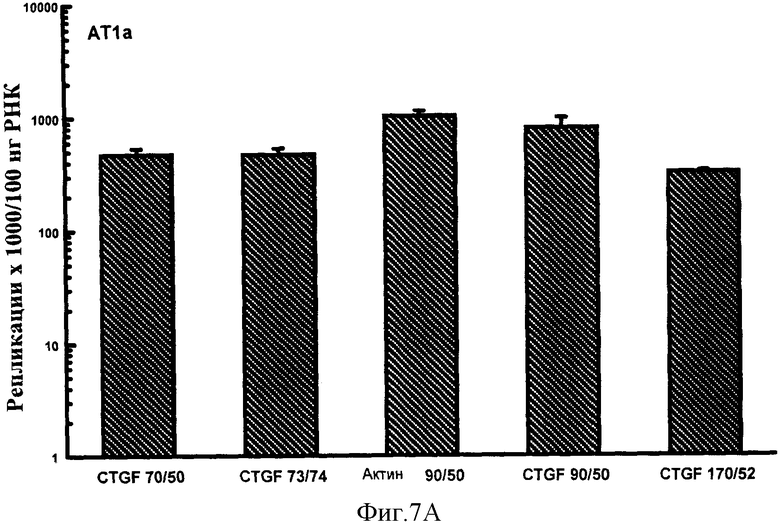
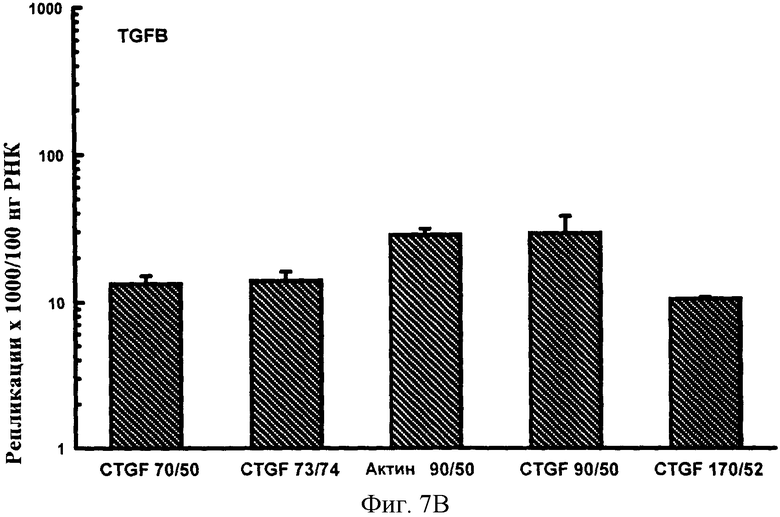
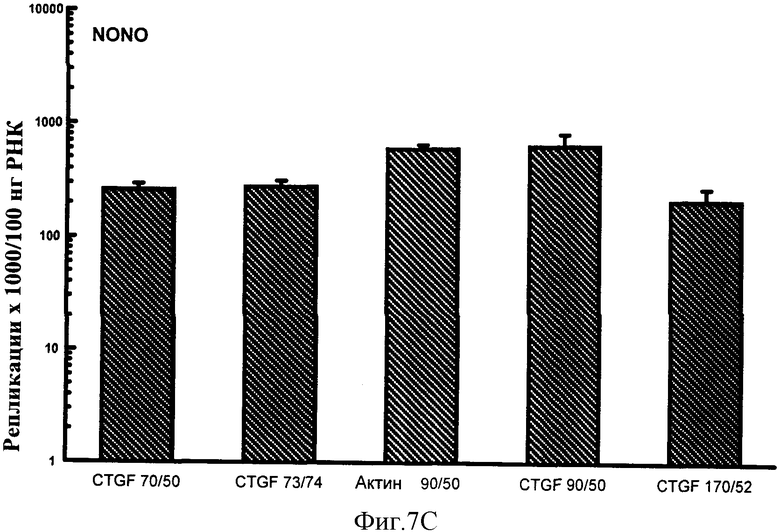
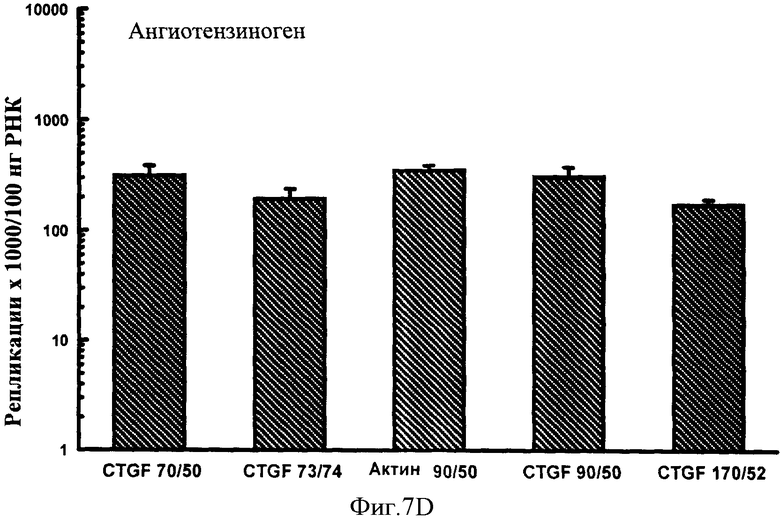
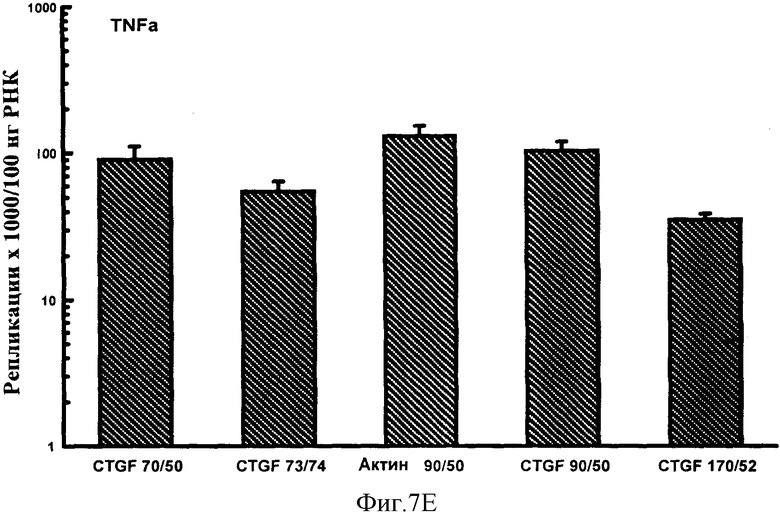
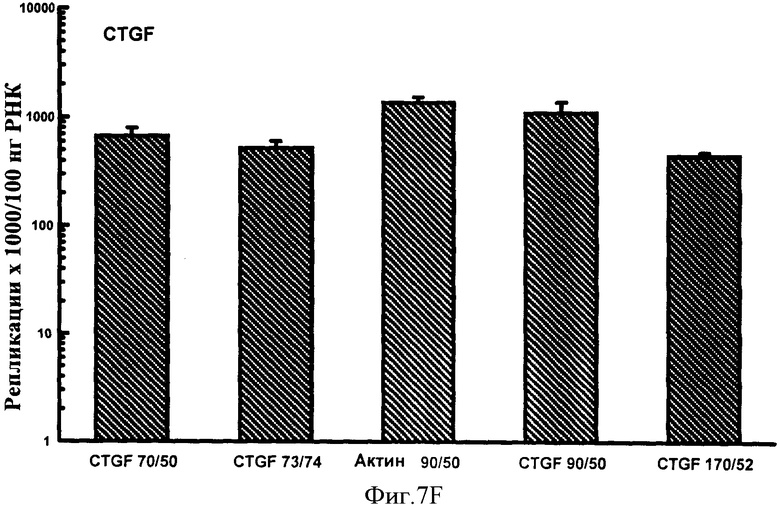
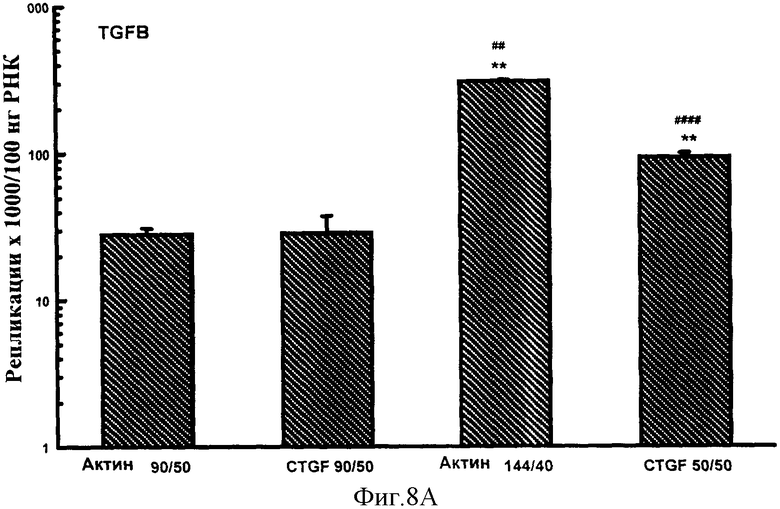
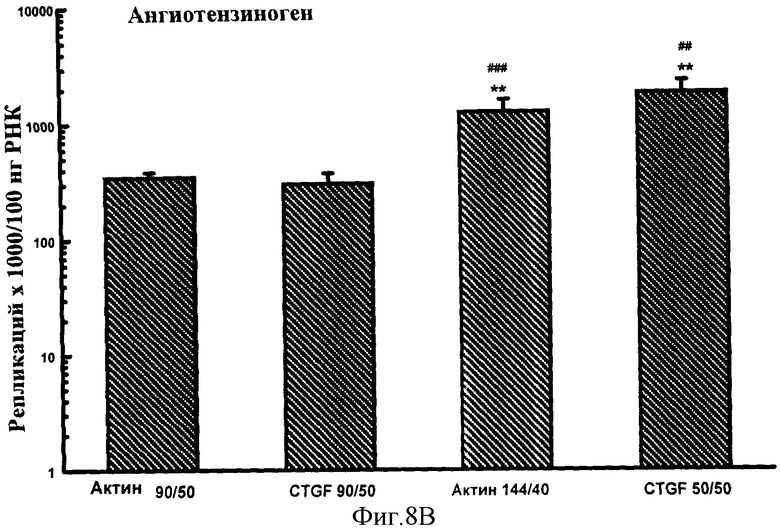
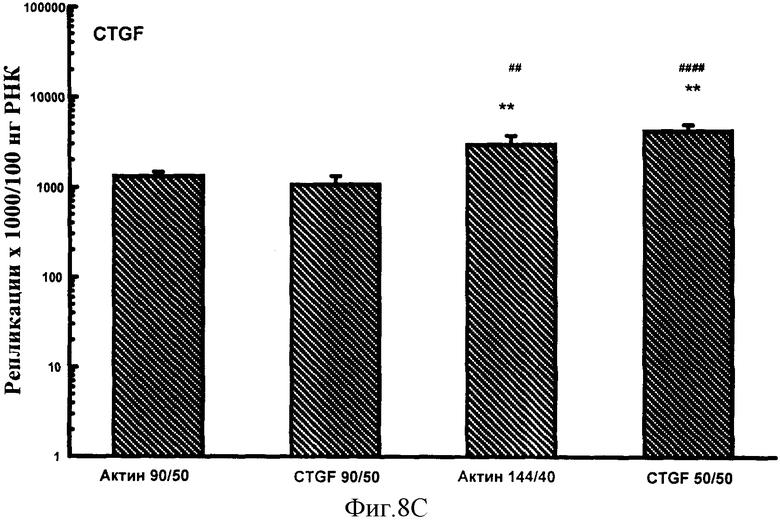
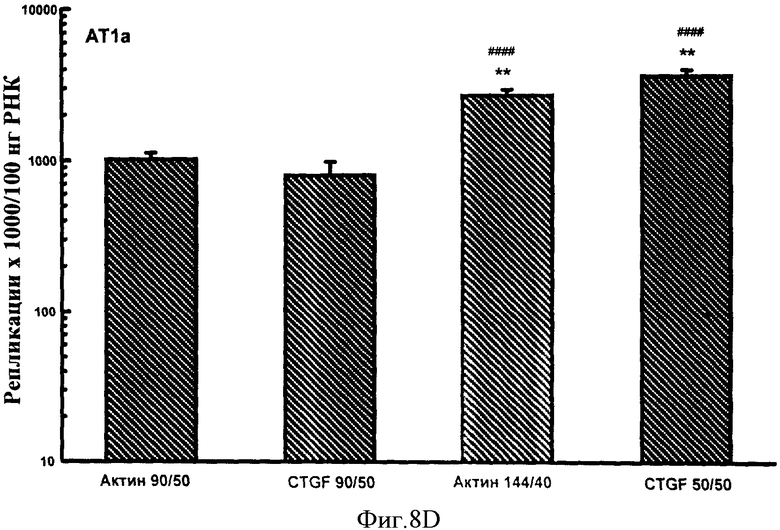
Фигуры 7A-F: Результаты количественного анализа для шести генов интереса (ангиотензиноген, TGFβ, TNFα, CTGF, At1a и NONO), используя 5 эталонных олигонуклеотидов, находящихся в диапазоне от 70 до 170 пар оснований в длину и варьирующих по GC содержанию от 50% до 74%. Эталонные олигонуклеотиды, показанные в этих примерах, представляют собой CTGF 70 пар оснований, 50% GC содержание (CTGF 70/50), CTGF 73 пар оснований, 74% GC содержание (CTGF 73/74), 3 Актин 90 пар оснований 50% GC содержание (Актин 90/50), CTGF 90 пар оснований 50%, GC содержание (CTGF 90/50) и CTGF 170 пар оснований 52%, GC содержание (CTGF 170/52).
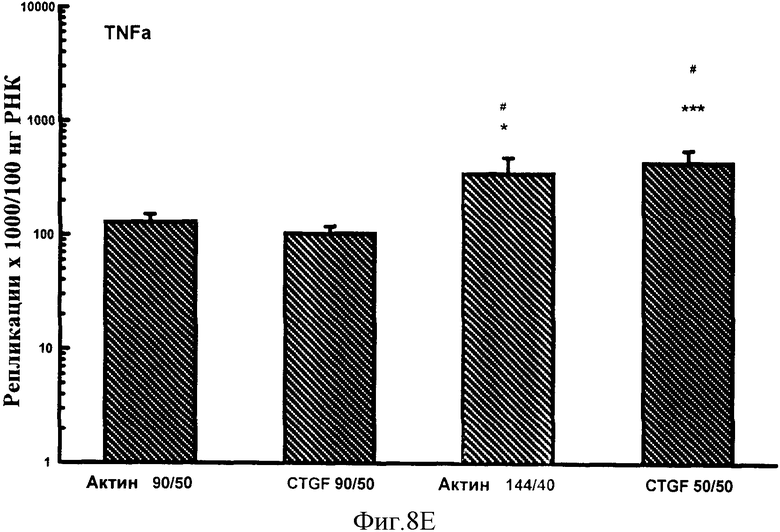
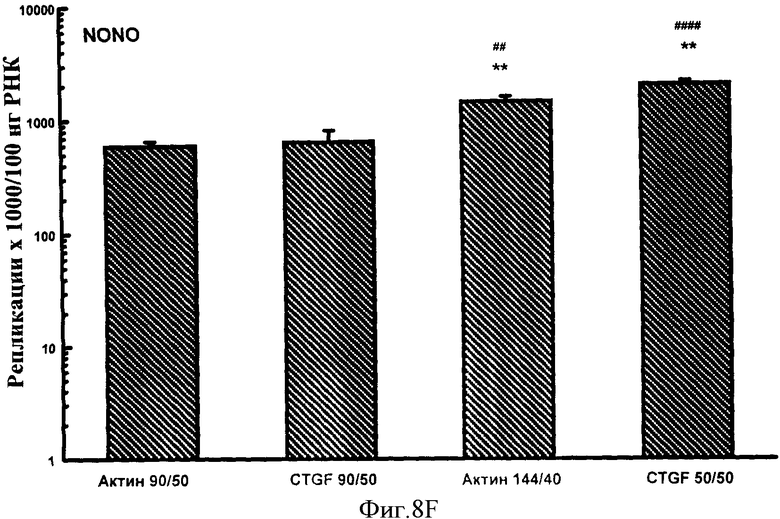
Фигуры 8A-F: Показывает результаты количественного анализа для шести генов интереса (ангиотензиноген, TGFβ, TNFα, CTGF, At1a и NONO), используя 4 эталонных олигонуклеотида, находящихся в диапазоне от 50 до 144 пар оснований в длину и варьирующих в GC содержании от 40% до 50%. Эталонные олигонуклеотиды, показанные в этих примерах, представляют собой Актин 144/40 (В Актин 144 пар оснований, 40% GC содержание), CTGF 50/50 (CTGF 50 пар оснований, 50% GC содержание), Актин 90/50 (В Актин 90 пар оснований, 50% GC содержание) и CTGF 90/50 (CTGF 90 пар оснований, 50% GC содержание). *р<0,005, **р<0,0005 в сравнении с Актином 90/50; #р<0,01, ##р<0,005, ###р<0,001 и ####р<0,0005 в сравнении с CTGF 90/50.
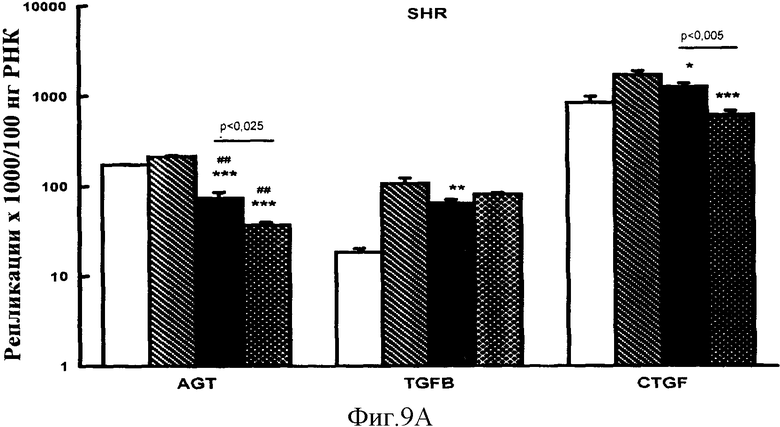
Фигура 9А: Эффекты обработки VIP или эналаприлом на экспрессию ангиотензиногена (AGT), TGFβ и CTGF у SHR, контроль нулевого времени (незакрашенные столбики), контроль инертного носителя (заштрихованные столбики), инфузия VIP (закрашенные столбики) и лечение эналаприлом (накрест заштрихованные столбики). *р<0,05, **р<0,025, ***р<0,0005 для VIP или эналаприла в сравнении с контролем инертного носителя. #р<0,001 ##р<0,0005 для VIP или эналаприла в сравнении с контролем нулевого времени.
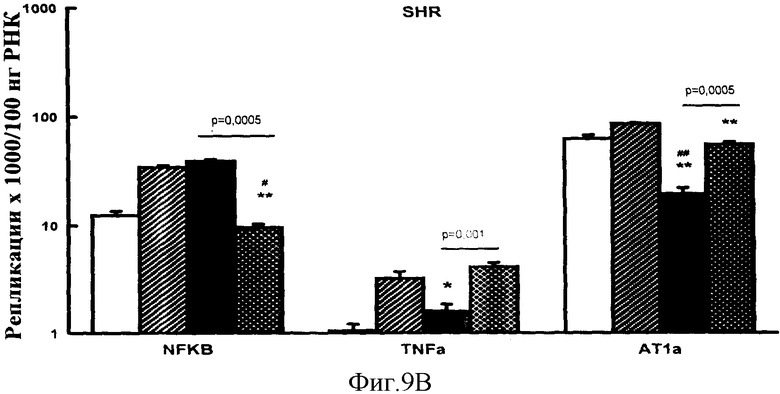
Фигура 9 В: Эффект обработки VIP или эналаприлом на экспрессию NF Каппа В, TNFα и АТ1а рецептора у SHR. *р<0,01 **р<0,0005 для VIP или эналаприла в сравнении с контролем интертного носителя; #р<0,05, ##р<0,0005 для VIP или эналаприла в сравнении с контролем нулевого времени.
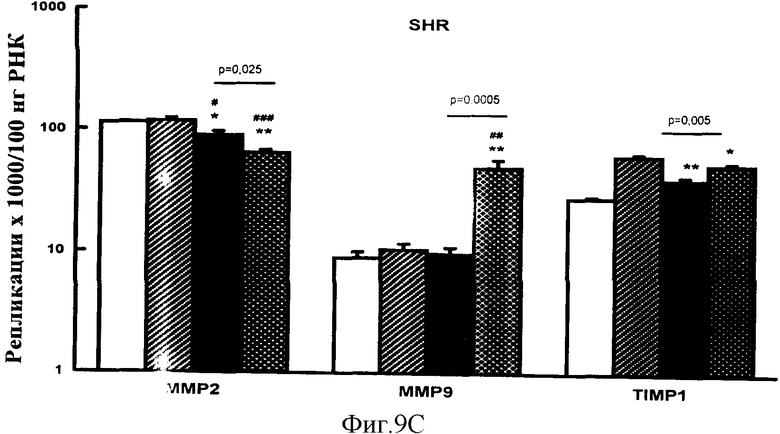
Фигура 9С: Эффект обработки VIP или эналаприлом на экспрессию металлопротеиназы и TIMP у SHR. *р<0,025, **р<0,0005 для VIР или эналаприла в сравнении с контролем инертного носителя; #р<0,01, ##р<0,001, ###р<0,0005 VIР или эналаприл в сравнении с контролем нулевого времени. Значения представляют собой среднее+sem (стандартная погрешность средней величины) для n=6 крыс.
ОПРЕДЕЛЕНИЯ
Выражение/фразы "ген" или "целевая нуклеиновая кислота" или "целевой ген" или "ген интереса" или "целевая последовательность интереса" или "целевая интереса" или "нуклеиновая кислота интереса", как используется в данном документе, были использованы взаимозаменяемо и относятся к одному принципу.
Выражение "нуклеиновая кислота" относится к молекулам, которые состоят из цепей мономерных нуклеотидов. Как используется в данном документе, подразумевается, что выражение включает ДНК, РНК и их варианты и производные.
"Ген", как используется в данном документе, может быть натуральным (например, геномным) или синтетическим геном, содержащим транскрипционные и/или трансляционные регуляторные последовательности и/или кодирующий участок и/или нетранслируемые последовательности (например, интроны, 5'- и 3'-нетранслируемые последовательности). Кодирующий участок гена может быть нуклеотидной последовательностью, кодирующей аминокислотную последовательность или функциональную РНК, такую как тРНК, рРНК, каталитическая РНК, миРНК (малая интерферирующая РНК), микроРНК или антисмысловая РНК. Выражение "ген" может также включать кДНК, соответствующую кодирующим участкам (например, экзонам), необязательно содержащую 5'- или 3'-нетранслируемые последовательности, связанные с ними. Ген может также быть амплифицированной молекулой нуклеиновой кислоты, полученной in vitro, содержащей весь или часть кодирующего участка и/или 5'- или 3'-нетранслируемые последовательности, связанные с ней.
"Амплификация" последовательностей нуклеиновых кислот может быть традиционно осуществлена с помощью полимеразной цепной реакцией (ПЦР), но может также быть осуществлена с помощью любого подходящего способа, такого как лигазная цепная реакция. В этом контексте данного описания выражения "полимеразная цепная реакция" и ее acronym "ПЦР" используются согласно их обычного значения, как понимается специалистами в данном уровне техники. Примеры способов ПЦР могут быть обнаружены в обычных учебниках по молекулярной биологии и справочниках, используемых в данном уровне техники. Например PCR Technology: Principles and Applications for DNA Amplification (1989) peg. H A Erlich. Stockton Press, New York. Для оптимизации ПЦР амплификации праймеры могут использоваться в различных концентрациях и соотношениях. Выбор этих и других переменных показателей будет понятен и может быть осуществлен специалистами в данной области техники.
"Ампликон" в контексте настоящего изобретения относится к кусочкам ДНК или продуктов нуклеиновой кислоты, которые образованы путем реакций амплификации, таких как те, которые проведены с помощью ПЦР или лигазных цепных реакций. В одном контексте ампликон может быть продуктом "целевой нуклеиновой кислоты" или "гена интереса" или "нуклеиновой кислоты интереса" и т.п.
"Праймер" может использоваться взаимозаменяемо с "олигонуклеотидом", и может быть натуральным, синтетическим или их модификацией и способен действовать как точка инициации синтеза нуклеотида, достаточно комплементарного специфичной нуклеотидной последовательности на молекуле матрицы.
"Эталонный олигонуклеотид" или "эталонная
последовательность нуклеиновой кислоты" или "универсальный эталонный олигонуклеотид", как используется в контексте настоящего изобретения, представляет собой нуклеиновую кислоту, предпочтительно двухцепочечную ДНК, и включает любую нуклеиновую кислоту приемлемого размера, пригодную для получения стандартной кривой, или иным образом подходящую для количественного анализа целевых нуклеиновых кислот интереса. Следовательно, эталонный олигонуклеотид может быть полинуклеотидом, но может также быть более короткой последовательностью. Характеристики подходящего эталонного олигонуклеотида описаны в данном документе.
Эталонный олигонуклеотид может быть полностью синтетическим или может быть получен из естественных источников ДНК, используя подходящий рестрикционный фермент для получения нуклеиновых кислот подходящего размера в качестве эталонного олигонуклеотида.
Для получения приемлемо больших количеств, эталонный олигонуклеотид может быть амплифицирован, используя реакцию амплификации (например, ПЦР или лигазная цепная реакция) или может быть экспрессирован рекомбинантно в микроорганизме и очищен до применения. Если размер эталонного олигонуклеотида позволяет, то он может также быть получен в большом количестве с помощью синтетического способа.
"Конститутивный ген" представляет собой типично конститутивный ген, который необходим для поддержания основной клеточной функции. Такие гены обнаружены во всех клетках. Некоторые конститутивные гены экспрессируются на относительно постоянных уровнях, однако другие конститутивные гены могут варьировать в экспрессии в зависимости от используемых экспериментальных условий.
"Стандартная кривая" представляет собой инструмент количественного исследования, способ построения графика данных анализа, который используется для определения абсолютной концентрации вещества, такого как ДНК и белки.
"Количественный анализ", как используется в контексте настоящего изобретения означает определение абсолютного количества вещества, в данном случае "целевого гена интереса".
"Серийное разведение" относится к любой форме разведения, необходимого для получения стандартной кривой, охватывающей диапазон концентраций вещества (например, нуклеиновой кислоты), из которой может быть рассчитано количество "целевой нуклеиновой кислоты".
В контексте настоящего изобретения "дцДНК" относится к двухцепочечной ДНК, "п.н." относится к парам оснований, "dNTP's" относится к дезоксинуклеотид трифосфату, "РНК" относится к рибонуклеиновой кислоте, " тРНК" относится к транспортной РНК, "рРНК" относится к рибосомальной РНК, "миРНК" относится к малой интерферирующей РНК, "микроРНК" относится к микроРНК, "мРНК" относится к матричной РНК и "кДНК" относится к комплементарной ДНК.
"GC содержание" последовательности нуклеиновой кислоты, такой как праймер, имеет влияние на различные свойства праймера, включая его температуру плавления (Тпл, или Тm).
ПРЕДПОЧТИТЕЛЬНЫЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Данное изобретение было обосновано недостатком точности и эффективного средства количественного определения экспрессии нуклеиновой кислоты в контрольных и получающих лечение группах животных/человека. Оно также было обосновано фактом того, что большинство из известных конститутивных генов, используемых в исследованиях генной экспрессии, изменяются в ответ на экспериментальные условия или обработки, таким образом, искажая результаты.
Преимущество настоящего изобретения состоит в том, что описанные способы освобождены от необходимости в конститутивных генах или синтетических эталонных генах, используемых для нормализации данных и подсчета генной экспрессии. Другое преимущество настоящего изобретения состоит в том, что амплификация целевой нуклеиновой кислоты, обычно с помощью ПЦР, но и другие способы могут быть использованы, может быть проведена в течение сокращенного числа циклов (например, 15 циклов), вместо обычных 30 циклов или около того, используемых для исследований генной экспрессии, таким образом, обеспечивая достаточное количество целевых нуклеиновых кислот для применения в количественном анализе при существенном сокращении времени и стоимости анализов.
В новом подходе, описанном в данном документе, краситель в комбинации с эталонным олигонуклеотидом заранее установленной длины, который преимущественно может быть не связанным с целевой нуклеиновой кислотой интереса, но может также быть сходным или идентичным гену интереса, используется для создания стандартной кривой. Стандартная кривая создается путем серийного разведения флюоресцентно меченого эталонного олигонуклеотида по настоящему изобретению и построения графика зависимости уровня интенсивности флюоресцентного красителя от концентрации меченого эталонного олигонуклеотида. Нет необходимости в амплификации эталонного олигонуклеотида для получения стандартной кривой. Это противоположно существующим методологиям для оценки генной экспрессии, тем самым и испытуемый образец, и конститутивный ген/синтетический эталонный ген амплифицируются либо примыкая друг к другу, либо комбинируясь в одной реакционной смеси.
Одна стандартная кривая, как только она получена, может использоваться много раз, если необходимо для количественного определения более чем одной целевой нуклеиновой кислоты интереса. Растворы разведенного эталонного олигонуклеотида, используемые для получения стандартной кривой, являются стабильными с течением времени, например, в течение периода времени около одного месяца, и повторяющегося замораживания и оттаивания растворов. Это обеспечивает получение и хранение растворов эталонного олигонуклеотида в преддверии любых экспериментальных требований.
Эталонный олигонуклеотид может быть полностью синтетической последовательностью, амплифицированной последовательностью (например, созданной ПЦР) или подходящего размера фрагментом рестрикции большей нуклеиновой кислоты, выделенной из естественного источника. Эталонный олигонуклеотид, используемый в способах настоящего изобретения, не является тем, что описывается как "конститутивный ген" или "синтетический эталонный ген", т.е. нет необходимости в том, чтобы он был амплифицирован вместе с геном интереса.
Может быть желательно сконструировать эталонные олигонуклеотиды различных длин для получения стандартных кривых для количественного определения целевых нуклеиновых кислот различных длин, но это не является критически важным для способа настоящего изобретения. Однако конкретным преимуществом настоящего изобретения является то, что один эталонный олигонуклеотид конкретной фиксированной длины может быть использован в стандартной кривой для количественного определения целевых нуклеиновых кислот, которые либо больше, либо короче, чем эталонный олигонуклеотид, а также имеют различные последовательности нуклеиновых кислот.
Эталонный олигонуклеотид будет желательно иметь длину больше чем 60 п.н. и будет типично находится в диапазоне от около 60 п.н. до около 170 п.н. (т.е. около 60, 70, 80, 90 100, 110, 120, 130, 140, 150, 160 или около 170 п.н.), что может использоваться для количественного определения целевых нуклеиновых кислот в диапазоне от около 80 до около 210 п.н. в длину, более типично в диапазоне от около 80 и около 150 п.н. в длину. Дополнительно, любой эталонный олигонуклеотид, имеющий длину в диапазоне, указанном выше, может использоваться для количественного определения любого одного или нескольких продуктов целевой нуклеиновой кислоты длиной, находящейся в диапазоне, указанном выше. Следует понимать, что длина целевой последовательности является несущественной для способа настоящего изобретения, так как она выбрана как нуклеиновая кислота интереса (или множественные нуклеиновые кислоты интереса) теми, кто использует способ.
Верхняя граница длины эталонного олигонуклеотида не является критически важной и будет регулироваться практическими соображениями. Таким образом, эталонный олигонуклеотид больше чем 170 п.н. может быть использован, при необходимости, в способе настоящего изобретения без неблагоприятных эффектов на количественный анализ целевой нуклеиновой кислоты (например, длины около 170-180, 180- 200, 200-220, 220-240, 240-260, 260-280, 280-300, 300-320, 320-340, 340-360, 360-380, 380-400 п.н. и т.п.).
Желательно, чтобы GC содержание эталонного олигонуклеотида составляло 45% или выше. Верхняя граница GC содержания не является критически важной. Таким образом, эталонные олигонуклеотиды с 75% GC содержанием давали результаты, сходные с эталонными олигонуклеотидами, имеющими более низкое GC содержание. Типично, GC содержание эталонного олигонуклеотида может быть выбрано в диапазоне от около 45% до около 75% (например, от около 45%, 50%, 55%, 55%, 60%, 65%, 70% или около 75%).
Нет необходимости, чтобы эталонная олигонуклеотидная последовательность имела какую-либо гомологию с целевой нуклеиновой кислотой или с последовательностью любого конститутивного гена. Однако из-за конкретного пути, в котором эталонный олигонуклеотид используется в способе настоящего изобретения (т.е. для построения стандартной кривой после серийного разведения эталонного олигонуклеотида) эталонная олигонуклеотидная последовательность может иметь степень гомологии или даже идентичности с целевой последовательностью нуклеиновой кислоты или конститутивным геном, или их меньших частей. Преимущество настоящего изобретения состоит в том, что способ может использовать одинаковый эталонный олигонуклеотид для количественного определения различных целевых нуклеиновых кислот. В практическом применении эталонный олигонуклеотид будет универсальным олигонуклеотидом с конкретной фиксированной длиной и GC содержанием, типично олигонуклеотид с 100 п.н. и 50% GC содержанием. Предусмотрено, что, по меньшей мере, три различных эталонных олигонуклеотида в диапазонах, описанных выше, включены в набор для того, чтобы обеспечить количественное определение полного диапазона размеров гена (нуклеиновой кислоты), которые будут обычно измерены.
Если эталонный олигонуклеотид получают из биологического источника, естественного или иного, используя рестрикционные ферменты для получения фрагмента подходящего размера, то GC содержание может быть определено, используя стандартные техники молекулярной биологии, хорошо известные специалистам данной области техники, и не требующие более чем простые аналитические процедуры для выбора и определения фрагмента подходящего размера (Sambrook et al. Molecular Cloning: A Laboratory Manual, 2nd ed. (1989) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.). Синтетические эталонные олигонуклеотиды могут также быть традиционно используемыми и могут быть полученными простым способом с помощью известных техник, таких как например те, которые описаны в Sambrook et al. Molecular Cloning: A Laboratory Manual, 2nd ed. (1989) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. и Roe et al. DNA Isolation and Sequencing (Essential Techniques Series) (1996) John Wiley & Sons, Inc., N.Y. Желательная длина и GC содержание синтетического эталонного олигонуклеотида может быть легко выбрана во время синтеза.
Способ настоящего изобретения является подходящим для применения с интеркалирующими красителями, а также флюоресцентными зондами (красителями). Для интеркалирующих красителей длина эталонного олигонуклеотида не влияет на интенсивность флюоресценции для данной концентрации эталонного олигонуклеотида, при условии, что длина эталонного олигонуклеотида составляет 60 п.н. или длиннее. Кажется, что нет верхней границы длины эталонного олигонуклеотида, которая влияет на интенсивность флюоресценции. Как следствие один эталонный олигонуклеотид является подходящим для применения в качестве эталонного стандарта для любого числа целевых последовательностей нуклеиновых кислот интереса, которые могут иметь различные длины, GC содержание и/или нуклеотидную последовательность. Для флюоресцентных зондов одинаковый эталонный олигонуклеотид может использоваться для многочисленных целевых нуклеиновых кислот, исследуемых серийно, обеспечивая то, что используется одинаковый флюорофор. Альтернативно, множественные стандартные кривые могут быть созданы, используя один эталонный олигонуклеотид, но отличные флюорофоры для обеспечения системы количественного анализа для продуктов мультиплексной РВ-ПЦР.
Таким образом, способ настоящего изобретения является преимущественным, так как он освобождает от необходимости амплифицировать конститутивный ген и постоянно проводить испытания для конститутивных генов или синтетических эталонных генов, чтобы нормализовать данные экспрессии нуклеиновой кислоты в пределах каждого эксперимента. Одна стандартная кривая может быть получена и использована в течение определенного периода времени для количественного определения более чем одной целевой нуклеиновой кислоты интереса, которые могут варьировать в размере и последовательности, таким образом, снижая стоимость и время по сравнению с традиционными исследованиями генной экспрессии.
Способы настоящего изобретения сами по себе пригодны для автоматизации, а также мониторинга амплификации и количественного анализа целевой нуклеиновой кислоты в реальном времени, путем сохранения информации со стандартной кривой эталонного олигонуклеотида в компьютеризированной системе перед началом амплификации целевой нуклеиновой кислоты интереса и либо беря образцы реакций амплификации в определенные периоды времени, либо отслеживая повышение флюоресценции с течением времени (реальное время) и соотнося информацию с сохраненной информацией стандартной кривой. При использовании способов таким образом, стандартная кривая может создаваться периодически, например, каждую неделю или каждый месяц, и эта информация хранится и используется для количественного определения целевых нуклеиновых кислот интереса в течение определенного периода времени без необходимости получать новые стандартные кривые.
Способ и набор настоящего изобретения могут быть преимущественно использованы для количественного определения генов (нуклеиновых кислот) интереса, имеющих продукты гена (нуклеиновой кислоты), с которыми обычно сталкиваются в аналитических и исследовательских лабораториях и они находятся обычно в диапазоне от 80 до 150 п.н. в длину и имеют от 30% до 60% GC содержание, используя один эталонный олигонуклеотид. Более конкретно, способ и набор настоящего изобретения пригоден в количественном определении продуктов нуклеиновой кислоты, которые превышают 60 п.н. в длину и 35% GC содержание, используя один эталонный олигонуклеотид, который предпочтительно составляет 100 п.н. в длину и имеет 50% GC содержание. Предпочтительный формат набора, таким образом, состоит из такого эталонного олигонуклеотида или его серийных разведений и красителя или другой подходящей обнаруживаемой метки, используемой в реакции для нуклеиновой кислоты интереса. Альтернативно, набор включает эталонный олигонуклеотид, меченый красителем или другим подходящим маркером, или серийные разведения такого меченого эталонного олигонуклеотида, и краситель или маркер, подлежащий использованию для мечения нуклеиновой кислоты интереса.
В качестве общего руководства для получения стандартной кривой, подлежащей использованию в способе настоящего изобретения, эталонный олигонуклеотид серийно разводят в двух повторностях, используя одинаковый реакционный буфер, как тот, что используется для гена интереса, для получения конечных количеств, например, в диапазоне от около 0,01 до около 10 пкмоль (диапазон может быть уже или шире) эталонного олигонуклеотида на реакционную пробирку, для обеспечения построения стандартной (эталонной) кривой, как описано в данном документе. Диапазон концентраций эталонного нуклеотида определяется путем простого испытания и погрешности, зависящих от требований. Обнаруживаемый маркер, такой как флюоресцентный краситель (такой же, как используемый для гена интереса и в таком же количестве, как используется для реакции с геном интереса) затем добавляют к каждой реакционной пробирке. Типично, реакционные пробирки подвергаются 15 циклам (может быть больше циклов при необходимости) в машине для ПЦР в реальном времени, при циклически повторяющихся условиях, отражающих те, которые используются для гена интереса. Таким образом, если начальные условия денатурации для гена интереса представляли собой, например, 94°С и 2 минуты, то пробирки, содержащие серийные разведения эталонного олигонуклеотида (используемые для построения стандартной кривой) подвергаются начальной денатурации при 94°С в течение 2 минут. Следующие 15 циклов затем являются параллельными тем, которые проводятся для гена интереса, так что, если циклически повторяющиеся условия для гена интереса включают, например, денатурацию при 95°С в течение 30 секунд с последующим отжигом при 60°С в течение 30 секунд, то пробирки, содержащие серийные разведения эталонного олигонуклеотида также подвергаются циклам при 95°С в течение 30 секунд (денатурация) и 60°С в течение 30 секунд (отжиг). Если флюоресцентный краситель используется как метка или маркер, флюоресценция может быть получена во время каждой фазы отжига, как показано на Фигурах 1 и 2. Стандартная (эталонная) кривая зависимости флюоресценции от количества нуклеиновой кислоты (например, ДНК) затем строится, как описано в данном документе.
Хотя данное изобретение было описано в качестве примера, следует понимать, что изменения и модификации могут быть произведены, не отклоняясь от объема настоящего изобретения.
Кроме того, если существуют известные эквиваленты для определенных признаков, то такие эквиваленты включены так, как если бы на них отдельно ссылались в данном описании.
ПРИМЕРЫ
Пример 1 Расчеты
В РВ-ПЦР после заранее установленного числа циклов (с) количество присутствующего гена интереса (R) соотносится с количеством этого гена, присутствующего в начале ПЦР амплификации (n) воспроизводимым образом, если эффективность репликации составляет 100% и при каждом цикле каждая копия гена реплицируется.
R=n×2c
n=повторности, присутствующие во время 0
с=число циклов при заранее установленной флюоресценции
R=повторности, присутствующие после с циклов Если эффективность составляет менее чем 100%: и не все копии гена реплицируются в каждом цикле и уравнение модифицируют так, чтобы принять во внимание это уменьшение эффективности репликации, тогда
R=n×ес
е=эффективность репликации
с=число циклов при заранее установленной флюоресценции
R=повторности, присутствующие после с циклов Пример 2
Получение эталонных олигонуклеотидов
Хотя цитируемый пример использует РНК для фактора роста соединительной ткани (CTGF) для создания эталонных олигонуклеотидов, следует понимать, что эталонные олигонуклеотиды для применения в качестве стандартов могут быть созданы из РНК для любого гена или для кодирующей или некодирующей ДНК. Эталонные олигонуклеотиды 70, 90 и 170 пар оснований в длину были получены путем амплификации сегментов CTGF гена из ткани сердца крыс со спонтанной гипертензией (SHR) следующим образом:
1) Экстракция РНК
Ткани собирали от SHR животных для экстракции общей РНК с помощью фенола и гуанидин изотиоцианата (Chomczynski and Sacchi 1987) с модификацией. Замороженные в жидком азоте SHR сердца гомогенизировали с помощью Mixer Mill ММ300 (дробилка-смеситель) (Retsch GmbH, Германия). Криогенные образцы, каждый по 100 мг, добавляли к 1 мл реагента Тризол (Invitrogen) в 1,5 мл микропробирку для исследования Safe-Lock (Eppendorf Biopur, Гамбург, Германия) с 3 мм вольфрам-карбидными шариками (Qiagen) и размалывали при частоте 30 Гц. РНК экстрагировали затем согласно рекомендациям производителя (Invitrogen). После того, как образцы были разрушены до РНК, проводили разделение фаз, при этом добавляли 200 мл хлороформа(Lab-Scan Analytical Sciences, Lomb Scientific, Taren Point, NSW, Австралия), и образец тщательно встряхивали вручную в течение 15 секунд и затем инкубировали при комнатной температуре (23-30°С) в течение 5 минут до центрифугирования при 12000 об/мин (13201 g) в течение 20 минут при 4°С (тормоз выключен), используя Sigma 1-15РК центрифугу (John Morris Scientific, Chatswood, NSW, Австралия). 300 мл верхней водной фазы собирали в свежую 1,5 мл пробирку Эппендорфа и добавляли 500 мл предварительно охлажденного пропан-2-ола (изопропанола) (Lab-Scan Analytical Sciences, Lomb Scientific, Taren Point, NSW, Австралия) и переворачивали вручную несколько раз образец для перемешивания. Смесь инкубировали при комнатной температуре в течение 10 минут для осаждения РНК. Осадок формировали путем центрифугирования при 12000 об/мин в течение 20 минут при 4°С (John Morris Scientific, Chatswood, NSW, Австралия). Супернатант удаляли, и осадок затем отмывали с 1 мл 75% (объем/объем) абсолютного этанола молекулярной степени чистоты (Lab-Scan Analytical Sciences, Lomb Scientific, Taren Point, NSW, Австралия), разведенного в диэтил пирокарбонате (DEPC) (Sigma-Aldrich, Castle Hill, NSW, Австралия) и откручивали при 10000 об/мин в течение 10 минут при 4°С (John Morris Scientific, Chatswood, NSW, Австралия). Осадок собирали и высушивали на воздухе в течение нескольких минут в вытяжном шкафу и затем растворяли в DEPC-обработанной Milli-Q воде и хранили при -80°С. Общую РНК концентрацию определяли с помощью поглощения спектрофотометра, используя Nanodrop 1000 (Nd-1000, Thermo Scientific) при 260 нм (А260); и чистота РНК рассматривалась как удовлетворительная, если соотношение А260:А280 было около 2,0.
2) Обработка дезоксирибонуклеазой 1 (ДНаза-1)
РНК образцы обрабатывали с помощью ДНазы-1 (Invitrogen) до полимеразной цепной реакции с обратной транскрипцией (РВ-ПЦР) для устранения двух- и одноцепочечной ДНК. В 0,5 мл пробирках Эппендорфа без ДНазы и РНазы, до 1 мкг РНК обрабатывали 1 единица/мкл ДНазы-1 и 1 мкл 10Х ДНаза-1 реакционного буфера в общем объеме 10 мкл с DEPC-обработанной водой. Образцы инкубировали в течение 15 минут при комнатной температуре до инактивации ДНазы-1 с помощью хелатирования ионами кальция и магния с 1 мкл 25 мМ EDTA в смеси раствора и нагревая при 65°С в течение 10 минут. Образцы охлаждали на льду и хранили при -80°С. Все компоненты смеси были поставлены в ДНаза-1 наборе (Invitrogen).
3) Оценка количества и концентрации РНК
Обработанные ДНазой-1 РНК образцы анализировали на автоматизированном приборе для электрофореза с микрочипом МСЕ-202 MultiNA (Shimadzu Biotech, Rydalmere, NSW, Австралия) в отношении чистоты, размера и концентрации 18S и 28S субъединиц рибосомальной РНК (рРНК). Все этапы проводили согласно рекомендации производителя, с небольшими модификациями. Вкратце, 3 мкл каждого образца смешивали с равным объемом внутреннего маркера РНК (Shimadzu Biotech, Rydalmere, NSW, Австралия) в 96-лунковом планшете и герметично закрывали с помощью адгезивной алюминиевой фольги для ПЦР (Thermo Scientific, Integrated Sciences, NSW, Австралия). РНК вместе с внутренними стандартными маркерами известной концентрации и размера, (маркеры с меньшим и большим молекулярным размером) автоматически исправляли результаты электрофореза для автоматического предсказания размера и количественного определения РНК образцов. РНК-6000 лэддер (Applied Biosystems, Victoria, Австралия) разводили DEPC-обработанной водой в соотношении 1:5 (объем/объем); растворенную смесь затем перемешивали с раствором РНК маркера при 1:1 (объем/объем). Оба, образцы и смеси маркеров, подвергали тепловой денатурации при 65°С в течение 5 минут и немедленно охлаждали на льду в течение 5 минут.Разделения по диапазонам размеров проводили на микрочипах MultiNA (Shimadzu Biotech, Rydalmere, NSW, Австралия) в РНК разделяющем буфере (Shimadzu Biotech, Rydalmere, NSW, Австралия), содержащем 10000Х флюоресцентного интеркалирующего красителя SYBR Зеленого II (Invitrogen), разведенного 1:99 с помощью ТЕ (10 мМ Tris-HCl, 1 мМ динатрия EDTA, рН 8,0) (Sigma-Aldrich), и 20% (объем/объем) формамида (Invitrogen).
4) Обратная транскрипция
Первую цепь комплементарной ДНК (кДНК) синтезировали из одноцепочечной РНК матрицы, используя обратную транскриптазу вируса мышиного лейкоза Молони (M-MLV RT) из набора Superscript III First-Strand Synthesis SuperMix (Invitrogen) согласно инструкциям производителя. Все реакции проводили в 0,2 мл тонкостенных пробирках Эппендорфа; и все этапы инкубации проводили на Rotor-Gene 6000 (Corbett Research, Сидней, Австралия; Qiagen). До 5 мкг общей РНК подвергали тепловой денатурации при 65°С в течение 5 минут с 1 мкл 50 мкМ олиго (dT)20 и 1 мкл буфера для отжига в общем объеме 8 мкл с DEPC-обработанной водой. Образцы охлаждали на льду в течение, по меньшей мере, 1 минуты перед добавлением к 10 мкл 2Х реакционной смеси первой цепи (First-Strand Reaction Mix) и 2 мкл Superscript HI/RNaseOUT ферментной смеси. Образец непродолжительно перемешивали на вортексе для перемешивания, и затем собирали путем импульсного центрифугирования, затем инкубировали при 50°С в течение 50 минут для синтеза кДНК. Фермент RT денатурировали для остановки реакции при 85°С в течение 5 минут, и образец немедленно охлаждали на льду и хранили при -20°С. Образцы отрицательного контроля без RT фермента или РНК инкубировали для подтверждения отсутствия загрязнения ДНК.
5) Праймеры
Пары праймеров, создающие длины ПЦР продукта 70 п.н., 90 п.н. и 170 п.н., были разработаны на основе последовательностей, опубликованных NCBI GenBank для крысиной мРНК фактора роста соединительной ткани (CTGF) (Инвентарный номер АВ023068). Последовательности праймеров (сами последовательности праймеров составляют 21-24 оснований в длину) выводили из синтеза (Invitrogen) как обессоленные лиофилизированные продукты. Праймеры восстанавливали до концентрации 50 мкМ с помощью ТЕ (10 мМ Tris-HCI, рН 8, 0, 1 мМ EDTA) (Invitrogen) и хранили при -20°С.
(п.н.)
Таблица 1: Последовательности праймеров для крысиного CTGF
6) ПЦР
ПЦР проводили на сердцах SHR, с каждым набором праймеров для определения различной концентрации дцДНК, связывающейся с фиксированным количеством EvaGreen. Все реагенты, используемые в этой ПЦР, покупали у Invitrogen, либо они поставлялись в наборе, либо как отдельные продукты. Один микролитр кДНК амплифицировали в 50 мкл реакционной смеси, содержащей 5 мкл 10Х ПЦР буфера, 1 мкл 10 мМ dNTP смеси, 1,5 мкл 50 мМ MgCI2, 2 мкл каждой смеси пар праймеров (10 мкМ каждой), 0,2 мкл платина Taq ДНК полимеразы и 39,3 мкл DEPC-обработанной воды. ПЦР проводили с помощью Rotor-Gene 6000 (Corbett Research, Сидней, Австралия; Qiagen). Условия для амплификации были следующими: начальная денатурация при 94°С, 2 минуты; 30-35 циклов денатурации при 95°С, 10 секунд; отжиг при 60°С, 20 секунд и синтез при 72°С в течение 20 секунд. Отрицательный контроль без кДНК инкубировали во всех анализах.
7) Концентрация ПЦР продуктов
До 4 мкл собранного вместе ПЦР продукта добавляли к фильтровальной единице ЗОК Amicon Ultra-4 (Millipore, North Ryde, NSW, Австралия), целлюлозная мембрана для концентрирования ДНК и центрифугировали на Sigma 2-16РК бакет-роторе (John Morris Scientific, Chatswood, NSW, Австралия) при 22°C, 5000 об/мин (4025 g) в течение 10 минут. Концентрированный раствор собирали на дне фильтровальной единицы и хранили при -20°С для последующей ПЦР.
8) Подтверждение размера ДНК и количественное определение
Концентрированные ПЦР продукты анализировали на автоматизированном приборе для электрофореза с микрочипом МСЕ-202 MultiNA (Shimadzu Biotech, Rydalmere, NSW, Австралия) для подтверждения размера полос и концентрации. Все этапы проводили согласно инструкций производителя с небольшой модификацией. Вкратце, 6 мкл 1/10 разведения (объем/объем) концентрированных ПЦР продуктов (разведенных в DEPC-обработанной воде) добавляли к каждой лунке 96-лункового планшета и закрывали герметично адгезивной алюминиевой фольгой для ПЦР (Thermo Scientific, Integrated Sciences, NSW, Австралия), буфер разделения ДНК-500 (Shimadzu Biotech, Rydalmere, NSW, Австралия), содержащий 10000X SYBR Золотого (Invitrogen), разведенный при 1/100 разведении в ТЕ (10 мМ Tris-HCI, 1 мМ динатрия EDTA, рН 8,0) (Sigma-Aldrich), затем использовали для разделения ДНК образцов посредством микрочипов (Shimadzu Biotech, Rydalmere, NSW, Австралия). Размеры полос ДНК и концентрацию анализировали совместно с 25 п.н. ДНК лэддером (Invitrogen), разведенным 1:49 в ТЕ (10 мМ Tris-HCl, 1 мМ динатрия EDTA, рН 8,0) (Sigma-Aldrich), и внутренним маркером ДНК-500 (Shimadzu Biotech, Rydalmere, NSW, Австралия), соответственно.
Ссылки
Chomczynski, P., and Sacchi, N. (1987) Anal. Biochem. 162, 156.
Пример 3
i) Получение стандартной кривой
Семь микролитров концентрированных ДНК образцов (т.е. 70, 90 или 170 п.н. продуктов), в двух повторностях, серийно разводили в 1:1 (объем/объем) ТЕ (10 мМ Tris-HCl, рН 8,0, 1 мМ EDTA) (Invitrogen), в диапазоне от чистого до 1/32 разведения, и 1,25 мкМ красителя EvaGreen (Biotium Inc, Hayward, CA; Jomar Biosciences, SA, Австралия) в 0,2 мл пробирках для ПЦР, содержащих реакционный объем 50 мкл ТЕ (10 мМ Tris-HCl, рН 8,0, 1 мМ EDTA) (Invitrogen). Титрование проводили в Rotor- Gene 6000 (Corbett Research, Сидней, Австралия; Qiagen). Условия для проведения циклов были следующими: начальная денатурация при 94°С, 2 минуты; 15 циклов денатурации при 95°С, 30 секунд; и флюоресцентные сигналы получали во время каждого этапа отжига при 60°С в течение 30 секунд. Два отрицательных контроля включали в анализ каждой стандартной кривой - нематричный контроль и олигонуклеотид в самой высокой концентрации без красителя Evagreen. Смеси ДНК хранили при -20°С для последующего повторного флюоресцентного измерения.
Получали флюоресценцию для каждой концентрации эталонного олигонуклеотида (смотри Фигуру 1). Данные затем переносили на график как зависимость флюоресценции (Y ось) от присутствующего эталонного олигонуклеотида в пикомолях (X ось) (смотри Фигуру 2), кривую наилучшего совпадения создавали с помощью линейной регрессии наименьших квадратов и создавали уравнение стандартной кривой.
Из уравнения стандартной кривой, рассчитывают пикомолярные эквиваленты для 3 уровней флюоресценции f1,f2 f3 (т.е. выбирают 3 пороговые величины) смотри Фигуру 3.
Из РВ-ПЦР испытуемого/целевого образца получают:
- эффективность для гена интереса (е)
- циклы (c1, c2, с3) для каждого из 3 уровней флюоресценции ()
- создают пикомоли гена интереса, присутствующего в образце [ДНК(пкмоль)'|], соответствующие f1,f2,f3, используя уравнение стандартной кривой.
Рассчитывают n (пкмоли гена интереса, присутствующего при
начале реакции) из
- ДНК(пкмоль)i=nj×eci
- т.е. nj=DNAj/eci
Среднее nj для получения молей гена интереса, присутствующего в образце.
Корректируют по отношению к общей РНК, присутствующей в каждой реакции и выражают ni как пкмоли /100 нг общей РНК. Умножение на число Авогадро позволяет альтернативно выразить его как репликаций /100 нг РНК (смотри Фигуру 4).
Пример 4
Таким образом, Фигура 1 показывает флюоресценцию для каждой концентрации эталонного олигонуклеотида, проведенной в двух повторностях. Данные, нанесенные на график как зависимость флюоресценции (у ось) от присутствующего эталонного олигонуклеотида, выраженного в пкмоль (х ось) на Фигуре 2 позволяет рассчитать, с помощью регрессии наименьших квадратов, уравнение, определяющее это взаимоотношение. Замещение f1, f2, f3 (полученного из каждого графика зависимости флюоресценции для каждого гена интереса от номера цикла смотри Фигуру 3) в уравнении стандартной кривой дает в результате рассчитанные пкмоли гена интереса (DNAj), присутствующего в циклах с1, с2, с3. Пкмоли гена интереса, присутствующего в нулевом времени могут затем быть рассчитаны, как описано выше, и скорректированы для общей РНК и выражены как репликации после умножения на число Авогадро.
Сравнение эталонных олигонуклеотидов различной длины в качестве стандартов для расчета n. Три олигонуклеотида, отличающиеся в длину на 20 и 100 пар оснований, использовали для создания трех стандартных кривых, как описано в разделе i) способа получения стандартной кривой. Затем пять генов интереса были независимо оценены количественно, используя в свою очередь каждую стандартную кривую, как описано в разделе ii) расчетов. Результаты, полученные для каждого гена с помощью трех кривых, сравнивали с помощью ANOVA, статистическое различие выставляли на уровне 0,05 (смотри Фигуру 4). Экспрессия генов интереса не отличалась существенно между тремя группами. Таким образом, изменения в длине эталонного олигонуклеотида до 100 пар оснований не влияло на расчет гена интереса.
Применение к экспериментальным ситуациям (смотри Фигуру 5).
Пять генов интереса измеряли в сердцах WKY крыс в 3 экспериментальных группах - Контроль нулевого времени (незакрашенные столбики), Контроль инертного носителя (заштрихованные столбики) и после обработки с VIP (закрашенные столбики), используя способ, описанный выше.
Стабильность и воспроизводимость стандартных кривых
В пробирках, содержащих различные концентрации эталонного олигонуклеотида и красителя EvaGreen была измерена их флюоресценция после повторного замораживания-оттаивания с трехнедельным периодом. Уровни флюоресценции были стабильными для каждой концентрации. Таким образом, один стандарт может быть использован как стандарт для количественного анализа большего числа РВ-ПЦР анализов, обеспечивая то, что одинаковая партия красителя была использована и что концентрация красителя не изменялась между анализами (смотри Фигуру 6).
Пример 5
Эталонные олигонуклеотиды, варьирующие по длине от 50 до 170 пар оснований и в GC содержании от 40 до 75%, были составлены из различных частей CTGF, αАктина и β Актина. Эталонные олигонуклеотиды были получены, как описано в Примере 2 и стандартные кривые получали, как описано в Примере 3. Праймеры, создающие эталонные олигонуклеотиды (50-170 п.н.), были разработаны на основе последовательностей, опубликованных NCBI Genbank для крысиной мРНК для CTGF (Инвентарный номер №АВ023068) и крысиной мРНК для аАктина и ВАктина (Инвентарный номер №NM_019183 и ВС063166, соответственно), смотри Таблицу 2.
Шесть генов интереса (АТ1а, Ангиотензин, TGFp, TNFa, NONO и CTGF) анализировали количественно независимо, используя каждую стандартную кривую в свою очередь, как описано в разделе ii) расчетов. Результаты, полученные для каждого гена с помощью трех кривых, сравнивали с помощью ANOVA.
Результаты показаны на фигурах 7A-F и Фигурах 8A-F. В этих экспериментах на количественный анализ генов интереса воздействовал только (приводя к существенно более высоким значениям повторностей гена интереса) эталонный олигонуклеотид, имеющий длину 50 п.н. и GC содержание 40%. Эталонные олигонуклеотиды большей длины и с более высоким содержанием GC, все без видимого ограничения в отношении верхней границы любого параметра, все обеспечивали точный количественный анализ гена интереса. Из этих экспериментов можно сделать вывод, что нижняя граница длины эталонного олигонуклеотида, пригодного в способе настоящего изобретения, составляет 60 п.н. и GC содержание 45%. Эти значения могут представлять нижние границы пригодного диапазона этих значений. Верхние границы могут быть установлены в зависимости от требований. Если используется один универсальный эталонный олигонуклеотид, для удобства длина может быть установлена на 100 п.н. и содержание GC на 50%. Из данных, обеспеченных в данном документе, любая альтернативная подходящая длина и GC содержание для эталонного олигонуклеотида могут также быть выбраны.
Пример 6
Каждый из этих эталонных олигонуклеотидов использовали в свою очередь для количественного определения девяти генов интереса (ангиотензиноген, TNFa, TGF3, CTGF, NONO ММР2, ММР9 и TIMP1), чьи генные продукты варьировали от 80 до 120 пар оснований (Смотри Таблицу 3 для последовательностей ампликона).
Девять генов интереса были измерены в сердцах SHR крыс (n=6) в 4 экспериментальных группах - Контроль нулевого времени (незакрашенные столбики), Контроль инертного носителя (заштрихованные столбики) и после обработки с VIР (закрашенные столбики) и обработки эналаприлом (накрест заштрихованные столбики), используя способ, описанный выше.
Результаты показаны на фигурах 9А-С.Эти результаты демонстрируют способность способа эталонного олигонуклеотида точно рассчитывать количество продуктов нуклеиновой кислоты и, таким образом, точно выявлять изменения в генной экспрессии, обусловленные лечением гипертензивных крыс соединениями, такими как VIP и эналаприл. Способ обеспечивает чувствительность к определению статистически достоверных отличий между получившими лечение и контрольными животными, а также эффективности различных лечений по отношению к регуляции генной экспрессии различными лечениями. Поскольку конкретные исследования на животных были использованы как удобный пример того, как способ выполняется в конкретной экспериментальной ситуации, такие же принципы количественного анализа и способ применимы для любой такой ситуации, в которой необходим точный количественный анализ продуктов нуклеиновой кислоты, на который не повлияли нежелательные изменения в конститутивных генах и т.п.
Сходные эксперименты провели, используя красители SYBR зеленый I, SYBR зеленый II, CYBR золотой, Evagreen, оксазол желтый, тиазол оранжевый, picogreen, ТОTO и ВЕВО, и протоколы, описанные выше, получив сходные результаты.
Следует понимать, что проиллюстрированный способ обеспечивает улучшенный способ количественного определения продуктов генной экспрессии без нормализации по отношению к конститутивному гену или синтетическому гену, или необходимости коамплифицировать конститутивные/синтетические эталонные гены с целевой последовательностью.
Хотя данное изобретение было описано со ссылкой на специфические примеры, специалистам в данной области техники ясно, что данное изобретение может быть осуществлено во многих других формах.
Изобретение относится к биотехнологии, а именно к способу количественного определения нуклеиновых кислот. Способ включает мечение универсального эталонного олигонуклеотида флуоресцентным маркером. Создают стандартную кривую, используя серийные разведения меченого универсального эталонного олигонуклеотида, путем построения графика зависимости интенсивности флуоресцентного маркера от концентрации меченого эталонного олигонуклеотида. Амплифицируют целевую нуклеиновую кислоту в присутствии флуоресцентного маркера, который метит амплифицированную целевую нуклеиновую кислоту, при этом универсальный эталонный олигонуклеотид не амплифицируют или совместно не амплифицируют с целевой нуклеиновой кислотой. Сравнивают в реальном времени интенсивность флуоресцентного маркера, связанного с меченой амплифицированной целевой нуклеиновой кислотой, со стандартной кривой. Определяют количество амплифицированной целевой нуклеиновой кислоты. Предложенное изобретение позволяет количественно определять нуклеиновые кислоты для исследования генной экспрессии без необходимости нормализовать данные к конститутивному гену или к синтетическому гену интереса. 14 з.п. ф-лы, 21 ил., 3 табл., 6 пр.
1. Способ количественного определения нуклеиновых кислот, содержащий этапы, на которых:
a) метят универсальный эталонный олигонуклеотид флуоресцентным маркером;
b) создают стандартную кривую, используя серийные разведения меченого универсального эталонного олигонуклеотида, путем построения графика зависимости интенсивности флуоресцентного маркера от концентрации меченого эталонного олигонуклеотида;
c) амплифицируют целевую нуклеиновую кислоту в присутствии флуоресцентного маркера, который метит амплифицированную целевую нуклеиновую кислоту;
d) сравнивают в реальном времени интенсивность флуоресцентного маркера, связанного с меченой амплифицированной целевой нуклеиновой кислотой, со стандартной кривой и определяют количество амплифицированной целевой нуклеиновой кислоты,
при этом указанный универсальный эталонный олигонуклеотид не амплифицируют или совместно не амплифицируют с целевой нуклеиновой кислотой.
2. Способ по п. 1, где флуоресцентный маркер представляет собой флуоресцентный краситель.
3. Способ по п. 2, где флуоресцентный краситель связывается с дцДНК.
4. Способ по п. 3, где флуоресцентный краситель представляет собой интеркалирующий краситель.
5. Способ по п. 4, где флуоресцентный краситель выбран из любого одного из: SYBR зеленого I, SYBR зеленого II, SYBR золотого, EvaGreen, оксазола желтого, тиазола оранжевого, PicoGreen, ТОТО, ВЕВО или Deep Purple.
6. Способ по п. 1, где универсальный эталонный олигонуклеотид имеет длину около 60 п.н. или больше.
7. Способ по п. 1, где универсальный эталонный олигонуклеотид имеет содержание GC 45% или больше.
8. Способ по п. 6, где универсальный эталонный олигонуклеотид имеет длину от около 60 п.н. до около 170 п.н.
9. Способ по п. 7 или 8, где универсальный эталонный олигонуклеотид имеет содержание GC от около 45% до около 75%.
10. Способ по п. 1, где универсальный эталонный олигонуклеотид имеет длину около 100 п.н. и содержание GC около 50%.
11. Способ по п. 1, где универсальный эталонный олигонуклеотид длиннее или короче, чем целевая нуклеиновая кислота.
12. Способ по п. 1, где амплификацию целевой нуклеиновой кислоты проводят с помощью способа полимеразной цепной реакции (ПЦР).
13. Способ по п. 1, где одну стандартную кривую используют для многократных амплификаций и количественных анализов целевой нуклеиновой кислоты.
14. Способ по п. 13, где каждую из многократных амплификаций и количественных анализов целевой нуклеиновой кислоты проводят за разное время.
15. Способ по любому из пп. 12-14, где целевую нуклеиновую кислоту амплифицируют в течение 15 циклов.
| SHEARER P.L | |||
| ET AL., A quantitative, real-time polymerase chain reaction assay for beak and feather disease virus, JOURNAL OF VIROLOGICAL METHODS, 2009, v | |||
| Катодное реле | 1918 |
|
SU159A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| US 20070122818 A1, 31.05.2007 | |||
| US 20050042639 A1, 24.02.2005 | |||
| Пишущее устройство для записи перемещений бабы копра | 1928 |
|
SU8742A1 |
Авторы
Даты
2015-09-10—Публикация
2010-09-02—Подача