Изобретение относится к способу введения рекомбинантных нуклеиновых кислот в эукариотические клетки in vitro и может быть использовано для получения генетически модифицированных клеток в биологии, биотехнологии, медицине и ветеринарии.
Известен способ генетической модификации эукариотических клеток методом кальций-фосфатной преципитации, при котором нуклеиновая кислота образует с фосфатами комплекс, который затем поглощается клеткой. Кальций-фосфатный метод характеризуется простотой применения и низкой стоимостью, однако эффективность этого способа зависит от образования комплексов нуклеиновых кислот с фосфатом, которые чувствительны к значению pH растворов [1].
Известен способ повышения эффективности кальций-фосфатного метода трансфекции путем использования 2x буфера BBS pH 6,9. Способ повышает эффективность трансфекции от 10 до 50% [2].
Известны способы повышения эффективности кальций-фосфатного метода трансфекции путем физического воздействия на клетки-мишени, например ультразвуком [3]. Ограничение использования физических методов обусловлено наличием специального оборудования.
К физическим методам доставки нуклеиновых относят также микроинъекции[4,5]. Микроинъекция является простым, экономичным, эффективным, воспроизводимым и нетоксичным методом, который подходит для доставки больших по размеру нуклеиновых кислот. Неудобством использования микроинъекций является необходимость манипулирования с каждой отдельной клеткой.
Наиболее близким по сути изобретения является способ доставки рекомбинантных нуклеиновых кислот методом кальций-фосфатной преципитации с добавлением биоразлагаемого полимера поли(лактид-со-гликолида)[6]. Однако применение биоразлагаемых полимеров в генетической инженерии в настоящее время находится на стадии разработки и требует дополнительных исследований.
Цель изобретения - создание эффективного способа генетической модификации эукариотических клеток, не требующего специального оборудования.
Предложенный нами способ позволяет существенно повысить эффективность кальций-фосфатного метода трансфекции и избежать недостатков аналогов.
Технический результат достигается тем, что трансфекцию эукариотических клеток кальций-фосфатным методом проводят в присутствии гистона в эффективном количестве.
Под определением «гистонный белок (гистон)» подразумевают гистоны различных типов (коровые гистоны Н2А, Н2 В, Н3, Н4 и линкерный гистон H1), включая N-бисметионин-гистона человека Н1.3
Эффективное количество может быть определено специалистом эксперементально, например путем определения соотношений плДНК/ гистон, при которых образуемый комплекс не меняет электрофоретическую подвижность.
Краткое описание рисунков.
Рис. 1. Комплексообразование гистонов/плазмидной ДНК в 150 мМ растворе NaCl. Длительная экспозиция при фотографировании геля, окрашенного бромистым этидием. Диапазон исследуемых количеств гистона Н1.3 (при количестве пазмидной ДНК 1 мкг): от 0,125 до 3,0 мкг. Плазмидная ДНК - pEGFP-N2 (BD Biosciences Clontech, Германия). А - кольцевая релаксированная ДНК, Б - линейная ДНК, В - суперскрученная ДНК, Г - денатурированная ДНК. М - маркер Gene Ruller 1Kb DNA Lader (Thermo Fisher Scientific Inc., США), лунки 1-15 - комплексы с разными соотношениями плазмидной ДНК и гистона Н1.3 (w:w): лунка 1 - 1:3, лунка 2 - 1:2,5, лунка 3 - 1:2, лунка 4 - 1:1,75, лунка 5 - 1:1,5, лунка 6 - 1:1,25, лунка 7 - 1:1, лунка 8 - 1:0,875, лунка 9 - 1:0,75, лунка 10 - 1:0,625, лунка 11 - 1:0,5, лунка 12 - 1:0,375, лунка 13 - 1:0,25, лунка 14 - 1:0,125, лунка 15 - 1:0.
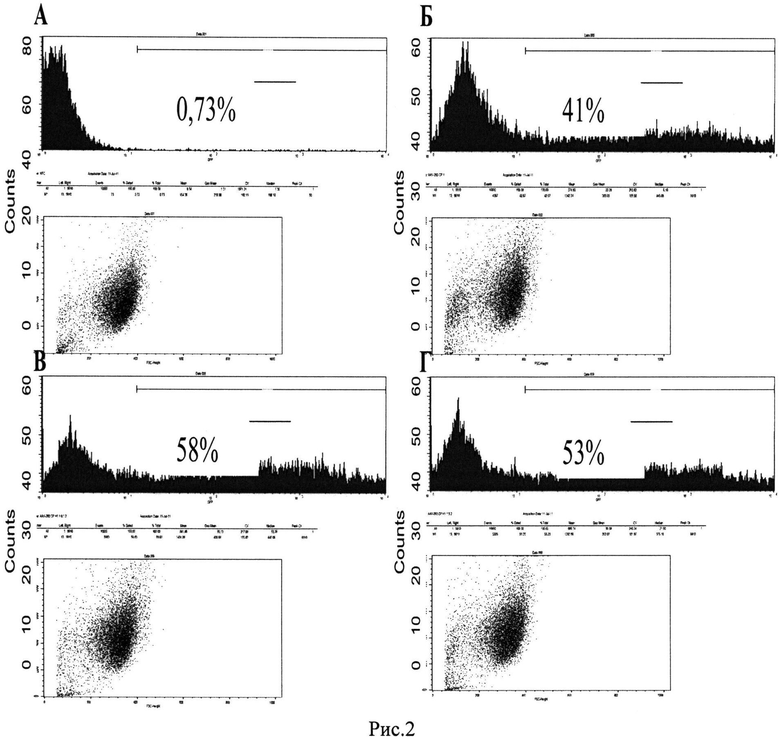
Рис. 2. Проточная цитофлуориметрия клеток НЕК293Т, трансфицированных с помощью кальций-фосфатного метода в комбинации с гистонофекцией. 48 часов после трансфекции. Клетки трансфицировали плДНК pEGFP-N2. Фоновый уровень флуоресценции составил 0,73% (А). Б - трансфекция с помощью кальций-фосфатного метода. В - трансфекция клеток с помощью комбинированного метода: гистонофекции, соотношение плДНК/Н1.3 - 1:0,1 (w:w), и кальций-фосфата. Г - трансфекция клеток с помощью комбинированного метода: гистонофекции, соотношение плДНК/Н1.3 - 1:3 (w:w), и кальций-фосфата.
Рис. 3. Трансфекция клеток НЕК293Т с помощью кальций-фосфатного метода в комбинации с гистонофекцией. Клетки трансфицировали плДНК pEGFP-N2. Процент EGFP-позитивных клеток подсчитывали через 2 дня после трансфекции с помощью проточной цитофлуориметрии. Фоновый уровень флуоресценции составил 0,73%. Са-Р - трансфекция с помощью кальций-фосфатного метода. Са-Р+плДНК/Н1.3 1:0,1 - трансфекция клеток с помощью комбинированного метода: гистонофекции, соотношение
плДНК/Н1.3 - 1:0,1 (w:w), и кальций-фосфата. Са-Р+плДНК/Н1.3 1:3-трансфекция клеток с помощью комбинированного метода: гистонофекции, соотношение плДНК/Н1.3 - 1:3 (w:w), и кальций-фосфата. Результаты представлены в виде среднего значения±стандартное отклонение (n=3). * - образцы, которые статистически значимо отличались от Са-Р (значение р<0,05).
Рис. 4. Трансфекция клеточной культуры hTGSC комплексами плазмидной ДНК/гистона Н1.3. А, В - флуоресцентная микроскопия, Б, Г - фазово-контрастная световая микроскопия. 24 часа инкубации после трансфекции. Трансфекция с помощью трансфекционного агента TransFast (А, Б) или комплексами плазмидной ДНК/гистона Н1.3 (Б, Г) в соотношении 1:125 (w:w).
Рис. 5. Трансфекция фибробластов человека комплексами плазмидной ДНК/гистона Н 1.3. А, В - флуоресцентная микроскопия, Б, Г - фазово-контрастная световая микроскопия. 24 часа инкубации после трансфекции. Трансфекция с помощью трансфекционного агента TransFast (А, Б) или комплексами плазмидной ДНК/гистона Н1.3 (Б, Г) в соотношении 1:125 (w:w).
Рис. 6. Трансфекция клеточной культуры HeLa комплексами плазмидной ДНК/гистона Н 1.3. А, В - флуоресцентная микроскопия, Б, Г - фазово-контрастная световая микроскопия. 24 часа инкубации после трансфекции. Трансфекция с помощью трансфекционного агента TransFast (А, Б) или комплексами плазмидной ДНК/гистона Н1.3 (Б, Г) в соотношении 1:125 (w:w).
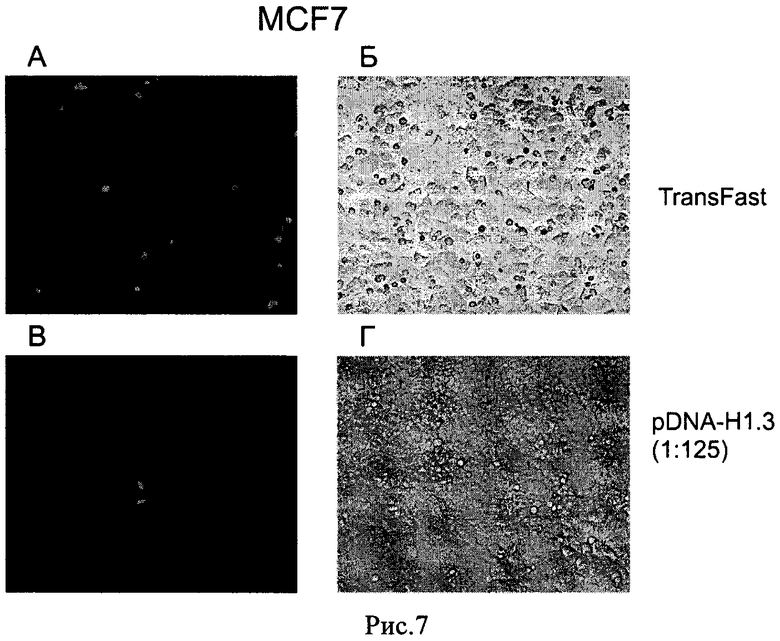
Рис. 7. Трансфекция клеточной культуры MCF7 комплексами плазмидной ДНК/гистона Н 1.3. А, В - флуоресцентная микроскопия, Б, Г - фазово-контрастная световая микроскопия. 24 часа инкубации после трансфекции. Трансфекция с помощью трансфекционного агента TransFast (А, Б) или комплексами плазмидной ДНК/гистона Н1.3 (Б, Г) в соотношении 1:125 (w:w).
Рис. 8. Проточная цитофлуориметрия клеток hTGSC, трансфецированных плазмидной ДНК. Гистограмма распределение флуоресцентности GFP в клеточной популяции. А - нетрансфицированный контроль (0,19% GFP-позитивных клеток - фон флуоресценции); Б - комплексы плазмидной ДНК/гистона Н 1.3 в соотношении 1:125 (w:w) (0,96% GFP-позитивных клеток); В - трансфекционный агент TransFast (11,57% GFP-позитивных клеток - положительный контроль).
Рис. 9. Проточная цитофлуориметрия клеток hTGSC, трансфецированных плазмидной ДНК. Точечная диаграмма размера клеток (англ. forward scatter, прямое рассеивание, FSC) по отношению к их гранулированности (англ. side scatter, боковое рассеивание, SSC). А - нетрансфицированный контроль; Б - комплексы плазмидной ДНК/гистона Н 1.3 в соотношении 1:125 (w:w); В - трансфекционный агент TransFast (положительный контроль). Физические параметры клеток (FSC и SSC) не изменились под действием трансфекционного агента TransFast и комплексов плазмидной ДНК/гистона Н 1.3 по сравнению с нетрансфицированными клетками.
Способ производят последовательно, например, в три этапа.
Первый этап. Культивирование клеток.
Все работы с культурой клеток проводят в стерильном ламинарном боксе согласно общепринятым правилам работы в лаборатории 2-го класса биобезопасности.
Эмбриональные клетки почки человека НЕК-293Т (АТСС, CRL-11268) культивируют в среде среде DMEM (англ. Dulbecco′s modified Eagle′s medium) с добавлением 10% сыворотки крови плодов коровы (англ. Fetal Bovine Serum, FBS), 2 мМ L-глутамина и 1× смеси антибиотиков пенициллина и стрептомицина (фирма-производитель - ПанЭко, Россия). Клетки инкубируют при плюс 37°C, во влажной атмосфере, содержащей 5% СО2- Пересев клеток проводят при плотности клеточного монослоя 90% с применением 0,25% раствора трипсина-ЭДТА (фирма-производитель - Sigma-Aldrich, США).
Таким путем завершают получение клеточных культур НЕК293А и HeLa и приступают ко второму этапу.
Второй этап. Приготовление раствора рекомбинантного гистона Н1.3.
Для приготовления рекомбинантного гистона Н1.3 (гистонного белка) делают навеску гистона Н1.3 «Онкогист» (фирма-производитель - ИБХ РАН, Россия), растворяют в стерильной воде MilliQ до концентрации 50 мкг/мкл. Рабочий раствор гистона Н1.3 хранят при плюс 4°C.
Третий этап. Трансфекция клеток НЕК293Т методом кальций-фосфатной преципитации.
Трансфекцию клеток НЕК293Т проводят комплексами плДНК pEGFP-N2 и гистона Н1.3 в различных комбинациях (соотношения плДНК/Н1.3 (w:w) - 1:0, 1:0,1, 1:3). Плазмидный вектор pEGFP-N2 (фирма-производитель - BD Biosciences Clontech, Германия) кодирует ген улучшенного зеленого флуоресцентного белка EGFP.
Комбинации были выбраны на основе экспериментов по задержке в агарозном геле комплексов плДНК/Н1.3. При соотношении 1:2-1:3 происходило связывание плДНК с гистоном, приводившее к полной потере мобильности комплексов при гель-электрофорезе. Соответственно соотношение 1:0,1 было выбрано как заведомо меньшее, при котором комплекс плДНК/Н1.3 не менял электрофоретической активности (Рис. 1).
Эффективным соотношением в данном случае является массовое соотношение плДНК/Н1.3. 1: (0,1-3).
Клетки НЕК293Т культивируют в 24-луночном планшете до плотности клеточного монослоя 60-70%. Трансфекционную смесь для каждого соотношения готовят в 1,5 мл пробирке: к 50 мкл 0,5 М CaCl2 добавляют 1 мкг плДНК и необходимое количество гистона Н1.3. Смесь перемешивали на вортексе, осаждали и инкубировали в течение 30 мин при комнатной температуре. После инкубации смесь по каплям добавляли в 15 мл пробирку, содержащую 50 мкл 2× раствора HBS, одновременно перемешивая содержимое на вортексе. Смесь инкубируют в течение 15 мин при комнатной температуре и добавляют к клеткам (100 мкл на лунку). Через 6-8 часов после трансфекции меняют культуральную среду на свежую.
В качестве контроля проводят трансфекцию клеток НЕК293Т кальций-фосфатным методом без добавления гистона Н1.3.
Эффективность трансфекции определяют по экспрессии репортерного гена egfp (плазмида pEGFP-N2) методом проточной цитофлуориметрии. В связи с тем, что популяция клеток обладает естественной гетерогенностью по уровню автофлуоресценции, пороговое значение флуоресценции было выбрано таким образом, что 99,27% клеток считались не флуоресцирующими, а 0,73% клеток, соответственно, считались ложно-положительными по флуоресценции (Рис. 2А).
Было показано, что добавление гистона Н1.3 в соотношении с плДНК 1:0,1 (w:w) к трансфекционной смеси повысило эффективность трансфекции на 41% (58% EGFP-позитивных клеток) (Рис. 2 В) по сравнению с клетками, трансфицированными кальций-фосфатным методом без добавления гистона H1 (41% EGFP-позитивных клеток) (Рис. 2Б). Добавление гистона H1.3 в соотношении с плДНК 1:3 (w:w) к трансфекционной смеси повысило эффективность трансфекции на 29% (53%) EGFP-позитивных клеток по сравнению с клетками, трансфицированными кальций-фосфатным методом без добавления гистона Н1.3 (Рис. 2Г).
Стоит отметить, что максимальная эффективность достигалась при добавлении небольшой концентрации гистона, что не приводило к полному связыванию плДНК, таким образом, ДНК продолжала нести суммарный отрицательный заряд (соотношение плДНК/Н1.3 (w:w) 1:0,1), необходимый для комплексообразования с фосфатом. В то же время наличие единичных молекул гистона Н1.3 на плДНК, возможно, повышало эффективность ядерного транспорта после проникновения комплексов в клетку.
Обобщенные результаты исследования приведены на рисунке 3.
Поскольку с помощью кальций фосфатного метода эффективно трасфицируется широкий спектр клеток млекомпитающих, включая (но не ограничено) СНО, 293, COS, HeLa и др[1], а механизм комплексообразования плДНК/H1.3 и плДНК/Н1.3 с фосфатами является универсальным, то предложенный способ введения нуклеиновых с применением гистона будет также эффективен для трансфекции других культур клеток.
Определение эффективности трансфекции клеток-мишеней HeLa, MCF7, hTGSC (МСК) и фибробластов человека с помощью комплексов плазмидной ДНК/гистона Н1.3.
В качестве репортерного применялся ген gfp, экспрессирующий зеленый флуоресцентный белок GFP (плазмида pEGFP-N2). Анализ экспрессии GFP проводился с помощью стандартных методов флуоресцентной микроскопии и проточной цитофлуориметрии.
Трансфекция культур клеток HeLa, MCF7, hTGSC (МСК) и фибробластов человека проводили комплексами плазмидной ДНК/гистона Н 1.3 в различных комбинациях. В качестве положительного контроля использовали трансфекционный агент TransFast (Promega, США) согласно рекомендациям фирмы-производителя.
Приготовление комплексов плазмидной ДНК/гистона Н1.3 для трансфекции.
Комплексы плазмидной ДНК и гистона Н 1.3 готовили в 150 мМ физрастворе. Для этого в пробирку, содержащую 1 мкг плазмидной ДНК (pEGFP-N2) в 95 мкл физраствора, добавляли 5 мкл раствора гистона H1.3 (в разных концентрациях). Смесь перемешивали на вортексе, осаждали и инкубировали в течение 30 минут при комнатной температуре, после чего использовали для трансфекции культур клеток.
Трансфекция культур клеток HeLa, MCF7, hTGSC (МСК) и фибробластов человека комплексами плазмидной ДНК/гистона Н1.3.
Для трансфекции применяли 24-луночные культуральные планшеты. Использовалась культура клеток с плотностью монослоя 60-70%.
В лунках культурального планшета меняли среду на свежую DMEM (500 мл на лунку), содержащую 10% FBS и 1% смеси антибиотиков пенициллина и стрептомицина. К среде добавляли по 100 мкл комплексов плазмидной ДНК/гистона Н 1.3. Анализ экспрессии проводили через 24 часа после трансфекции.
Трансфекция клеточных культур с помощью трансфекционного агента TransFast.
TransFast (Promega, США) трансфекционный агент - представитель липосомного метода трансфекции, при котором молекулы плазмидной ДНК упаковываются в липидные визикулы [7-8]. При контакте ДНК-содержащих липосом с клеточной мембраной происходит слияние липидных слоев и внедрение генетического материала внутрь клетки.
Для трансфекции применяли 24-луночные культуральные планшеты. Использовалась культура клеток с плотностью монослоя 60-70%.
К 200 мкл культуральной среды без сыворотки DMEM добавляли 6 мкл трансфекционного агента TransFast, смесь тщательно перемешали на вортексе. В смесь добавляли 1 мкг плазмидной ДНК, смесь тщательно перемешивали, осаждали и инкубировали при комнатной температуре в течение 15 минут. Затем культуральную среду удаляли с клеток аспирированием и трансфекционную смесь наносили на клетки. Планшеты инкубировали 1 час в инкубаторе при 37°C во влажной атмосфере, содержащей 5% СО2, после чего в каждую лунку добавляли 1 мл полноценной культуральной среды DMEM, содержащую 10% FBS и 1% смеси антибиотиков пенициллина и стрептомицина. Анализ экспрессии проводили через 24 часа после трансфекции.
Эффективность трансфекции с помощью гистоновых и других ядерных белков зависит от типа белка и условий трансфекции. Например, было показано, что экстракт гистонов из тимуса теленка и из куриных эритроцитов способен связывать ДНК и трансфицировать различные культуры клеток. Однако исследователи наблюдали лишь незначительную экспрессию репортерных генов (Schneeweiss, Buyens et al.). В экспериментах in vitro гистоны H1 и H2A показали низкую эффективность трансфекции как первичных, так и трансформированных культур клеток (Tomita, Higaki et al. 1992; Demirhan, Hasselmayer et al. 1998). Weng с соавторами показали, что гистон из Pyrococcus horikoshii не эффективен для доставки рекомбинантного генетического материала в культуры клеток различных линий (NIH 3Т3, НЕК293, HL-7702, HepG2, COS7, HeLa и др.), даже в присутствии Са2+ (Weng, Liu et al. 2004). Аналогичные результаты получила группа Lucius с соавторами и Balicki с соавторами при трансфекции клеток с помощью гистона H1 без ко-фактора и в присутствии Са2+ (Balicki and Beutler 1997; Lucius, Haberland et al. 2001). Из описанных экспериментальных данных можно сделать вывод, что эффективность трансфекции зависит от типа гистонового белка, не все гистоны способны эффективно опосредовать трансфекцию клеток. Другие ядерные и гистоноподобные белки также могут быть низкоэффективными для трансфекции клеток как in vitro, так и invivo (Bottger, Vogel et al. 1988; Sawa, Suzuki et al. 1995; Namiki, Takahashi et al. 1998; Haberland, Dalluge et al. 1999).
Результаты эффективности трансфекции клеток-мишеней HeLa, MCF7, hTGSC (МСК) и фибробластов человека с помощью комплексов плазмидной ДНК/гистона Н1.3.
Для исследования эффективности трансфекции с помощью гистона Н1.3 в качестве репортерного применяли ген gfp, экспрессирующий зеленый флуоресцентный белок GFP (плазмида pEGFP-N2, 1 мкг на лунку). Анализ экспрессии белка GFP проводили с помощью стандартных методов флуоресцентной микроскопии и проточной цитофлуориметрии. Трансфекцию культур клеток HeLa, MCF7, hTGSC (МСК) и фибробластов человека проводили комплексами плазмидной ДНК/гистон Н1.3 в различных соотношениях - 1:2,5, 1:25, 1:125 и 1:250 (w:w). В качестве положительного контроля использовали реагент TransFast (Promega, США). Через 24 часа после инкубации с комплексами плазмидной ДНК/гистона Н 1.3 оценивали степень зеленой флуоресценции клеток-мишеней. Зеленую флуоресценцию наблюдали только при использовании для трансфекции комплексов плазмидной ДНК/гистона Н 1.3 при соотношении 1:125 (Рис. 4, Рис. 5, Рис. 6, Рис. 7,). По сравнению с трансфекционным агентом TransFast, эффективность трансфекции гистоном Н1.3 всех исследуемых клеточных культур была значительно ниже. Проточная цитофлуометрия трансфицированных клеточных культур подтвердила низкую эффективность трансфекции с помощью гистона Н1.3: при трансфекции культуры клеток hTGSC гистоном Н1:3 процент GFP-позитивных клеток составил 0,96% при фоновом уровне флуоресценции 0,19% (Рис. 8, Таблица 1). Для трансфекционного агента TransFast (положительный контроль) процент GFP-позитивных клеток составил 11,57% (Рис. 8). При трансфекции как с помощью гистона Н1.3, так и агента TransFast, физические параметры клеточной культуры не изменились (Рис. 9).
Приведенные примеры показывают полезность изобретения для генетической инженерии, в частности, для введения рекомбинантных нуклеиновых кислот в эукариотические клетки in vitro. Способ введения рекомбинантных нуклеиновых кислот в эукариотические клетки может найти применение в получении генетически модифицированных клеток в биологии, биотехнологии, медицине и ветеринарии.
Источники информации
1. Jordan, М., A. Schallhorn, et al. (1996). "Transfecting mammalian cells: optimization of critical parameters affecting calcium-phosphate precipitate formation." Nucleic Acids Res 24(4):596-601.
2. Chen, C. and H. Okayama (1987). "High-efficiency transformation of mammalian cells by plasmid DNA." Mol Cell Biol 7(8):2745-2752.
3. Hassan, M.A., I.S. Ahmed, et al. (2012). "Enhanced gene transfection using calcium phosphate co-precipitates and low-intensity pulsed ultrasound." Eur J Pharm Sci 47(4):768-773.
4. Wolf, D.P., J.A. Thomson, et al. (1990). "In vitro fertilization-embryo transfer in nonhuman primates: the technique and its applications." Mol Reprod Dev 27(3):261-280.
5. Davis, H.L., R.G. Whalen, et al. (1993). "Direct gene transfer into skeletal muscle in vivo: factors affecting efficiency of transfer and stability of expression." Hum Gene Ther 4(2):151-159.
6. Kofron, M.D. and С.T. Laurencin (2004). "Development of a calcium phosphate co-precipitate/poly(lactide-co-glycolide) DNA delivery system: release kinetics and cellular transfection studies." Biomaterials 25(13):2637-2643.
7. Balicki, D. and E. Beutler (1997). "Histone H2A significantly enhances in vitro DNA transfection." Mol Med 3(11):782-787.
8. Bottger, M., F. Vogel, et al. (1988). "Condensation of vector DNA by the chromosomal protein HMG1 results in efficient transfection." Biochim Biophys Acta 950(2):221-228.
9. Demirhan, I., O. Hasselmayer, et al. (1998). "Histone-mediated transfer and expression of the HIV- tat gene in Jurkat cells." J Hum Virol 1(7):430-440.
10. Haberland, A., R. Dalluge, et al. (1999). "Ligand-histone H1 conjugates: increased solubility of DNA complexes, but no enhanced transfection activity." Somat Cell Mol Genet 25(4):237-245.
11. Lucius, H., A. Haberland, et al. (2001). "Structure of transfection-active histone Hl/DNA complexes." Mol Biol Rep 28(3):157-165.
12. Namiki, Y., T. Takahashi, et al. (1998). "Gene transduction for disseminated intraperitoneal tumor using cationic liposomes containing non-histone chromatin proteins: cationic liposomal gene therapy of carcinomatosa." Gene Ther 5(2):240-246.
13. Sawa, Y., K. Suzuki, et al. (1995). "Efficiency of in vivo gene transfection into transplanted rat heart by coronary infusion of HVJ liposome." Circulation 92(9 Suppl):11479-482
14. Schneeweiss, A., K. Buyens, et al. "Synergistic effects between natural histone mixtures and polyethylenimine in non-viral gene delivery in vitro." Int J Pharm 400(1-2):86-95.
15. Tomita, N., J. Higaki, et al. (1992). "Direct in vivo gene introduction into rat kidney." Biochem Biophys Res Commun 186(1):129-134.
16. Weng, L., D. Liu, et al. (2004). "An archaeal histone-like protein as an efficient DNA carrier in gene transfer." Biochim Biophys Acta 1702(2):209-216.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ ГИСТОННОГО БЕЛКА В КАЧЕСТВЕ ИНГИБИТОРА АДЕНОВИРУСНОЙ ТРАНСДУКЦИИ | 2014 |
|
RU2555553C1 |
| Гистоны и биодеградируемые липиды как средство для доставки нуклеиновых кислот в клетки эукариот | 2015 |
|
RU2637371C2 |
| Лекарственная комбинация для ген-иммунной терапии | 2022 |
|
RU2792683C1 |
| ПРОИЗВОДНЫЕ АЛКИЛАММОНИЙНОГО ГЕМИНАЛЬНОГО ПОВЕРХНОСТНО-АКТИВНОГО ВЕЩЕСТВА, ОБЕСПЕЧИВАЮЩИЕ ЭФФЕКТИВНУЮ ДОСТАВКУ ДНК В КЛЕТКИ | 2012 |
|
RU2513726C2 |
| Способ получения плазмидной ДНК в составе полимерных наносфер для доставки | 2022 |
|
RU2817116C1 |
| Способ получения рекомбинантного вируса везикулярного стоматита | 2022 |
|
RU2807751C1 |
| СПОСОБ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ВИРУСНОЙ ТРАНСДУКЦИИ | 2011 |
|
RU2478711C1 |
| Генотерапевтический препарат FCU1-BsFm/PP для лечения солидных опухолей | 2023 |
|
RU2824977C1 |
| ВЕКТОР ЭКСПРЕССИИ ДЛЯ ТРАНСГЕННОГО ВВЕДЕНИЯ В КЛЕТКИ И ТКАНИ МЛЕКОПИТАЮЩИХ С РЕГУЛИРУЕМЫМ НЕВИРУСНЫМ ПРОМОТОРОМ | 2011 |
|
RU2495128C2 |
| Незаряженный липид, композиция на его основе с поликатионным амфифилом и нейтральным фосфолипидом и способ ее получения для доставки нуклеиновых кислот in vitro | 2020 |
|
RU2747559C1 |







Изобретение относится к биотехнологии, в частности к генетической инженерии. Предложен способ доставки нуклеиновых кислот в эукариотические клетки, предусматривающий трансфекцию методом кальций-фосфатной преципитации в присутствии гистона Н1.3 в эффективном количестве. Способ повышает эффективность трансфекции. 9 ил.
Способ доставки нуклеиновых кислот в эукариотические клетки, предусматривающий трансфекцию методом кальций-фосфатной преципитации в присутствии гистона Н1.3 в эффективном количестве.
| ВАКЦИНА ВЕЗИКУЛ НАРУЖНЫХ МЕМБРАН (OMV), СОДЕРЖАЩАЯ БЕЛКИ НАРУЖНОЙ МЕБРАНЫ N.Meningitidis СЕРОЛОГИЧЕСКОЙ ГРУППЫ В | 2001 |
|
RU2279889C2 |
| АНТИГЕННЫЕ ПЕПТИДЫ NEISSERIA | 2000 |
|
RU2281956C2 |
| Способ контроля профилей зубьев зубчатых колес | 1990 |
|
SU1739179A1 |
| US 0006835812 B1, 28.12.2004 | |||
Авторы
Даты
2015-09-20—Публикация
2014-05-30—Подача