Настоящее изобретение относится к области биотехнологии и молекулярной биологии и представляет собой средство для доставки нуклеиновых кислот или их производных в клетки эукариот, в частности, для доставки геннотерапевтических препаратов для медицинских целей.
Предшествующий уровень техники
Одной из основных проблем при использовании геннотерапевтических препаратов в медицине остается доставка таких препаратов в клетки целевых органов. Используемые в практике и эксперименте способы доставки генетического материала можно разделить на вирусные и невирусные. В настоящее время в более чем в 70% случаев испытания геннотерапевтических препаратов проводят с использованием вирусных способов доставки. Достоинством вирусных систем является их высокая эффективность. Недостатками - иммуногенность и, в ряде случаев (аденоассоциированные вирусы), малая емкость для введения генетической информации. Высокая опасность встраивания вирусных векторов в геном клеток может приводить к возникновению рака и различных мутаций. Кроме того, выращивание вирусов довольно трудоемко и весьма дорого (Wang et al. Curr Pharm Biotechnol, 2013, 14: 46-60. Mah et al. 2002. Clin Pharmacokinet, 2002, 41: 901-911. Giacca and Zacchigna. J Control Release, 2012, 161: 377-388. Balicki and Beutler. Medicine (Baltimore), 2002, 81: 69-86. Kovesdi et al. Curr Opin Biotechnol, 1997, 8: 583-589). Невирусные методы доставки генов имеют ряд преимуществ. Токсичность, патогенность или иммуногенность невирусных векторов ниже в сравнении с вирусными векторами. Использование невирусных методов характеризуется меньшей стоимостью, препараты на их основе проще изготовить и/или модифицировать определенным образом для достижения высокой специфичности. Главный недостаток невирусных способов доставки - меньшая эффективность трансфекции (Medina-Kauwe et al. Gene Ther, 2005, 12: 1734-1751). Поэтому основная цель, которая стоит перед разработчиками невирусных методов - сохранив перечисленные достоинства, приблизиться по эффективности к вирусным методам доставки.
Для эффективной невирусной доставки вектор должен обладать способностью конденсировать ДНК в более компактное состояние, обеспечивать эффективное прохождение через клеточные и ядерные мембраны, защищать транспортируемые нуклеиновые кислоты от действия нуклеаз и при этом не ингибировать транскрипцию ДНК. В качестве нуклеиновых кислот могут использоваться плазмиды. В отличие от рекомбинантных вирусов, плазмиды довольно просто конструировать и нарабатывать в больших количествах (Williams and Kingston. Cardiovasc Res, 2011, 91: 565-576). Существует две большие группы соединений, способных образовывать стабильные комплексы с нуклеиновыми кислотами - катионные липиды и катионные полимеры. Комплексы в обоих случаях образуются за счет электростатических взаимодействий между отрицательно заряженной ДНК и положительно заряженным носителем, в результате получаются компактные частицы, которые могут поглощаться клеткой, чаще всего путем эндоцитоза (Wagstaff and Jans. Biochem J, 2007, 406: 185-202. Wang et al. Сurr Pharm Biotechnol, 2013, 14: 46-60). Использование катионных полимеров или липидов сопряжено с меньшей опасностью для организма и слабой иммуногенностью, комплексы на их основе проще и дешевле изготовить. Одним из основных недостатков этой группы веществ является то, что эффективные системы, как правило, высокотоксичны, а при снижении токсичности снижается и эффективность. Чем выше молекулярная масса полимера, тем компактнее комплекс и эффективнее трансфекция клеток, но при этом ниже биоразлагаемость, а следовательно, тем больше токсичность (Wang et al. Curr Pharm Biotechnol, 2013, 14: 46-60; Jin et al. Theranostics, 2014, 4: 240-255). В ряде случаев совместное использование катионных липидов и полимеров позволяет уменьшить размер всего комплекса и увеличить поглощение препарата клеткой (Wang et al. Curr Pharm Biotechnol, 2013, 14: 46-60). Для доставки нуклеиновых кислот в клетку могут использоваться некоторые природные полимеры или их фрагменты, в частности белки и пептиды. Достоинствами природных полимеров является их биосовместимость и биоразлагаемость, низкая токсичность и иммуногенность, возможность химических модификаций по аминным и гидроксильным группам, также невысока стоимость получения таких соединений. В последние годы все больше внимания уделяется использованию для доставки ДНК в клетки природных заряженных белков и пептидов, в частности, так называемых, пептидов, проникающих в клетки (Cell-penetrating peptides - СРР). Полагают, что СРР проникают в клетки и в ядра энергонезависимым путем без участия поверхностных клеточных рецепторов (Wagstaff and Jans. Curr Med Chem, 2006, 13: 1371-1387; Gupta et al. Adv Drug Deliv Rev, 2005, 57: 637-651; Morris et al. Curr Opin Biotechnol, 2000, 11: 461-466; Wagstaff and Jans. Biochem J, 2007, 406: 185-202; Wagstaff et al. FASEB J, 2008, 22: 2232-2242). Эти пептиды/белки при образовании комплекса с ДНК обеспечивают прямую трансдукцию в ядра клеток. Было показано, что СРР не обладают выраженными антигенными свойствами и их использование может значительно повысить эффективность доставки невирусных векторов (Balicki et al. Proc Natl Acad Sci, 2002, 99: 7467-74717; Wagstaff et al. FASEB J, 2008, 22: 2232-2242). Процесс проникновения белков через клеточные мембраны обеспечивается специальными белок-трансдуцирующие домены (БТД) размером 10-30 остатков, обогащенными основными аминокислотами. СРР может связываться с доставляемой молекулой ковалентно или нековалетно - за счет электростатических взаимодействий (Vasconcelos et al. Ther Deliv, 2013, 4: 573-591). Нековалентное связывание является более выгодным так как такую конструкцию намного легче синтезировать и она более универсальна для доставки в клетки разных типов нуклеиновых кислот (Alhakamy et al. Ther Deliv, 2013, 4: 741-757). СРР при использовании их для доставки нуклеиновых кислот характеризуются высокой эффективностью трансфекции, невысокими токсичностью и иммуногенностью (Vasconcelos et al. Ther Deliv, 2013, 4: 573-591). Особое место в группе БТД белков занимают гистоны, роль которых в клетке заключается в связывании и компактизации ДНК. Гистоны представляют собой основные белки небольшого размера, представленные в ядрах эукариотических клеток в виде комплекса с геномной ДНК, которая благодаря гистонам упаковывается в специальные структурные образования - нуклеосомы. В состав нуклеосомы стандартно входят 4 гистона Н2А, Н2В, Н3 и Н4. Нуклеосомы соединены между собой линкерной ДНК, с которой связан линкерный гистон H1. Было показано, что все четыре коровых гистона (Н2А, Н2В, Н3 и Н4), имеющие в своей структуре сигналы ядерной локализации, способны к прямой клеточной трансдукции и могут быть использованы как векторы для эффективной доставки ДНК в ядра клеток (Wagstaff and Jans. Biochem J, 2007, 406: 185-202; Wagstaff et al. FASEB J, 2008, 22: 2232-2242). Хотя гистон H1 не содержит сайта ядерной локализации, предполагается, что за его транспорт в ядро ответственна последовательность из нескольких положительно заряженных аминокислот. В исследованных случаях использование гистонов для доставки ДНК в клетки было эффективнее, чем у ряда других известных невирусных систем (Balicki et al. Proc Natl Acad Sci, 2002, 99: 7467-7471; Wagstaff et al. Mol Ther, 2007, 15: 721-731). По имеющимся данным, наилучшей эффективностью в доставке плазмидной ДНК и обеспечении синтеза кодируемого ею продукта обладают гистоны Н2А и Н2В (Wagstaff and Jans. Biochem J, 2007, 406: 185-202; Wagstaff et al. Mol Ther, 2007, 15: 721-731; Kaouass et al. J Control Release, 2006, 113: 245-254). В большинстве работ для доставки ДНК в ядра используют гистоны, выделенные из тимуса теленка или других доступных тканей животных (Balicki et al. Proc Natl Acad Sci, 2000, 97: 11500-11504). Одним из путей развития данного направления является создание рекомбинантных гистонов, содержащих модификации, улучшающие их векторные свойства. Описано получение рекомбинантных гистонов Н2А и Н2В, каждый из которых представляет химерную молекулу гистона с зеленым флуоресцентным белком (GFP) и дополнительными сайтами ядерной локализации (Wagstaff et al. Mol Ther, 2007, 15: 721-731). В работах данной группы показано, что такие белки способны проникать в клетки и переносить в клетки плазмидную ДНК, также показано, что сигнал ядерной локализации, присутствующий в структуре гистонов, слабее некоторых вирусных сигналов ядерной локализации (Wagstaff et al. Mol Ther, 2007, 15: 721-731). Механизм переноса генетического материала в клетки с помощью гистонов и СРР до конца не изучен. Было показано, что гистон Н2А содержит в своем составе сигнал ядерной локализации (NLS), что обеспечивает его трафик из цитоплазмы в ядро, кроме того, он обладает достаточно низкой иммуногенностью (Balicki et al. Proc Natl Acad Sci, 2002, 99: 7467-7471). Определено, что N-концевая последовательность гистона Н2А, соответствующая первым 37 аминокислотным остаткам, способна конденсировать ДНК и обеспечивать трансфекцию клеток млекопитающих (Balicki et al. Proc Natl Acad Sci, 2002, 99: 7467-71). Описано использование различных фрагментов гистона Н2А, полученного из тимуса теленка или синтезированных, для трансфекции клеток in vivo и in vitro для антираковой генной терапии (Pat. US 20040102606 A1). Было предложено для трансфекции клеток использовать гистоны Н3 и Н4 и их производные, выделенных из разных тканей животных, из культур клеток, а также рекомбинантных белки (Pat. WO 1999019502 A1). Гистоны, полученные разными способами, демонстрируют сходные результаты при трансфекции клеток. В патенте WO 2000015825 A1 в качестве трансфицирующего агента использовали выделенный из тканей суммарный гистон (смесь гистонов H1, Н2, Н3, Н4) или только гистон Н4. В патенте US 6180784 В1 описывается использование как выделенного из тканей, так и рекомбинантного гистона H1 для трансфекции клеток. В этом же патенте использовались и полученные из тканей гистоны Н2А, Н2В, Н3 и Н4. Кроме того, показано, что добавление гистонов, преимущественно H1, к известным липидам, используемым для липофекции, значительно повышает уровень трансфекции нуклеиновых кислот.
В настоящее время системы доставки с использованием гистонов в качестве векторов только начинают разрабатываться. Одним из путей развития данного направления является создание рекомбинантных гистонов, содержащих модификации, улучшающие их векторные свойства. Большим преимуществом гистонов перед другими системами доставки генов является их низкая токсичность. Получение и использование рекомбинантных гистонов, в отличие от выделенных из тканей животных, позволяет стандартизовать процесс получения таких белков, а также дает широкие возможности для получения различных модифицированных форм гистонов. В частности, получение химерных белков, представляющих собой гистон и фрагмент другого СРР-пептида - ТАТ-белка. Пептид ТАТ, представляющий фрагмент регуляторного белка вируса иммунодифицита ВИЧ-1, исследован лучше других из негистоновых СРР (Green et al., Cell, 1988, 55: 1179-1188; Torchilin. Adv Drug Deliv Rev, 2008, 60: 548-558; Sawant and Torchilin, 2010, 6: 628-640). Фрагмент ТАТ-пептида, состоящий из 10-15 аминокислотных остатков, в настоящее время используется при создании комплексов ДНК с поликатионами (полиплексов) и вводят в состав липидных векторов (Kleemann et al. J Control. Release 2005, 109: 299-316). Показано, что введение TAT-пептида в состав полиплекса значительно увеличивает эффективность трансфекции (Morris et al. Nat Biotechnology 2001, 19: 1173-1176).
Как указано выше, использования катионных липидов совместно с ССР позволяет повысить стабильность образуемого комплекса, а также увеличивает эффективность трансфекций в случае невирусных конструкций. Например, комбинация катионного липосомального реагента DOSPER и гистона H1 повышает эффективность трансфекции кардиомиоцитов (Kott et al. Somatic Cell and Molecular Genetics, 1998, 24: 257-261). Однако подобные липосомальные реагенты являются чужеродными для организма и обычно высокотоксичны.
Приведенные данные указывают на определенные недостатки использования существующих соединений для трансфекции клеток. Требуется разработка новых более безопасных препаратов, сочетающих эффективные ДНК-связывающие свойства природных пистонов и стабилизирующих свойств биодеградируемых природных липидов.
Краткое изложение сущности изобретения
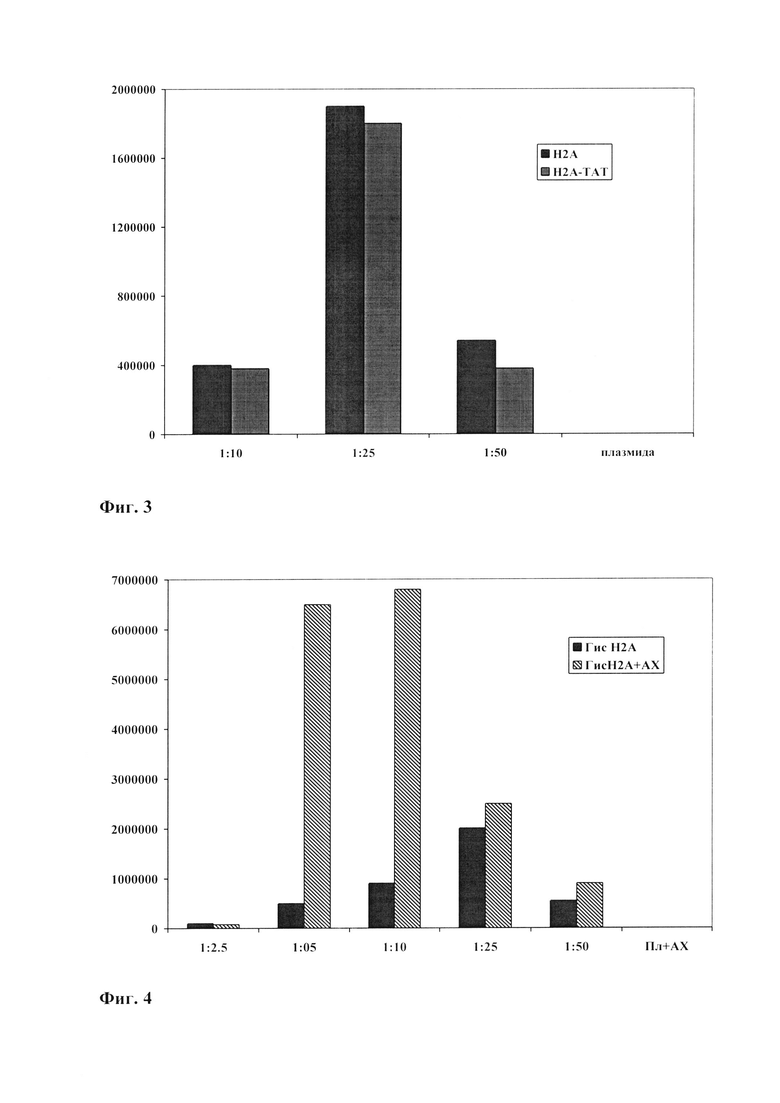
Данное изобретение решает задачу расширения номенклатуры конструкций для доставки терапевтически значимых нуклеиновых кислот в клетки эукариот. Поставленная задача решается путем получения рекомбинантного гистона Н2А и химерного гистона Н2А-ТАТ, представляющего собой слитно экспрессирующийся белок, содержащий гистон Н2А и ТАТ-пептид, и холинового эфира жирной кислоты для их конденсирования с ДНК с последующей доставкой образовавшихся комплексов в клетки эукариот. Это достигается путем конструирования экспрессионных плазмидных векторов, содержащих последовательности генов Н2А и Н2А-ТАТ человека, полученные с набором специфических праймеров, трансформации этими плазмидами клеток E.coli, экспрессии кодируемых белков, наработки рекомбинантных белков и их очистки. Липидный компонент представляет собой холиновый эфир жирной кислоты с длиной углеродной цепи от 16 до 22 атомов и включающих от 0 до 6 двойных связей. После совместной инкубации ДНК с рекомбинантным гистоном Н2А или химерным белком Н2А-ТАТ, а также с рекомбинантным гистоном Н2А или химерным белком Н2А-ТАТ в присутствии липида проводится трансфекция эукариотических клеток.
Технический результат изобретения
Техническим результатом, обеспечиваемым настоящим изобретением, является эффективная доставка ДНК в клетки эукариот с помощью биодеградируемых рекомбинантных белков и липидов. В соответствии с изобретением в эукариотические клетки с помощью рекомбинантного гистона Н2А и химерного белка Н2А-ТАТ или в присутствии этих белков при добавлении холинового эфира жирной кислоты попадает ДНК и наблюдается синтез белков, гены которых входят в состав доставляемой ДНК.
Список нуклеотидных и аминокислотных последовательностей
1. Набор праймеров, используемых для клонирования гистона Н2А (SEQ ID NO: 1 и SEQ ID NO: 2); химерного белка Н2А-ТАТ (SEQ ID NO: 3 и SEQ ID NO: 4).
2. Аминокислотные последовательности белков гистонов Н2А - SEQ ID NO: 5 и H2A-TAT - SEQ ID NO: 6.
Изобретение иллюстрируют следующие фигуры
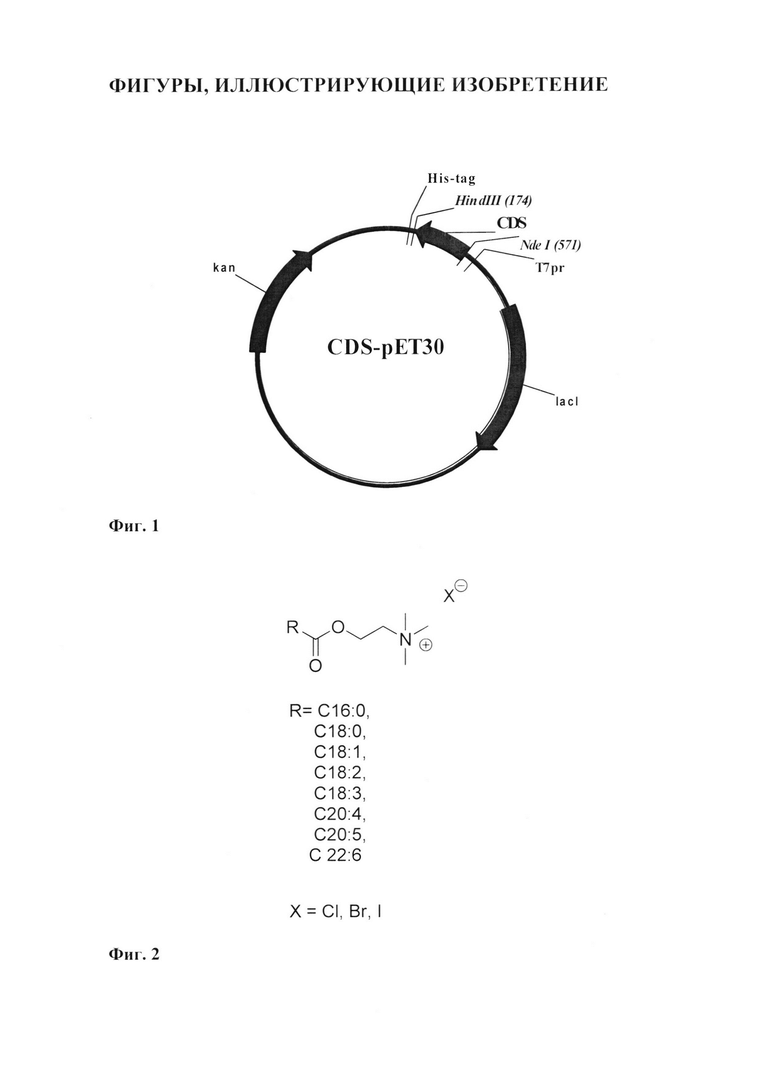
Фиг. 1. Схематическое изображение экспрессионных конструкций. CDS - фрагменты, соответствующие генам, кодирующим белки гистона Н2А или Н2А-ТАТ.
Фиг. 2. Формулы холиновых эфиров жирных кислот.
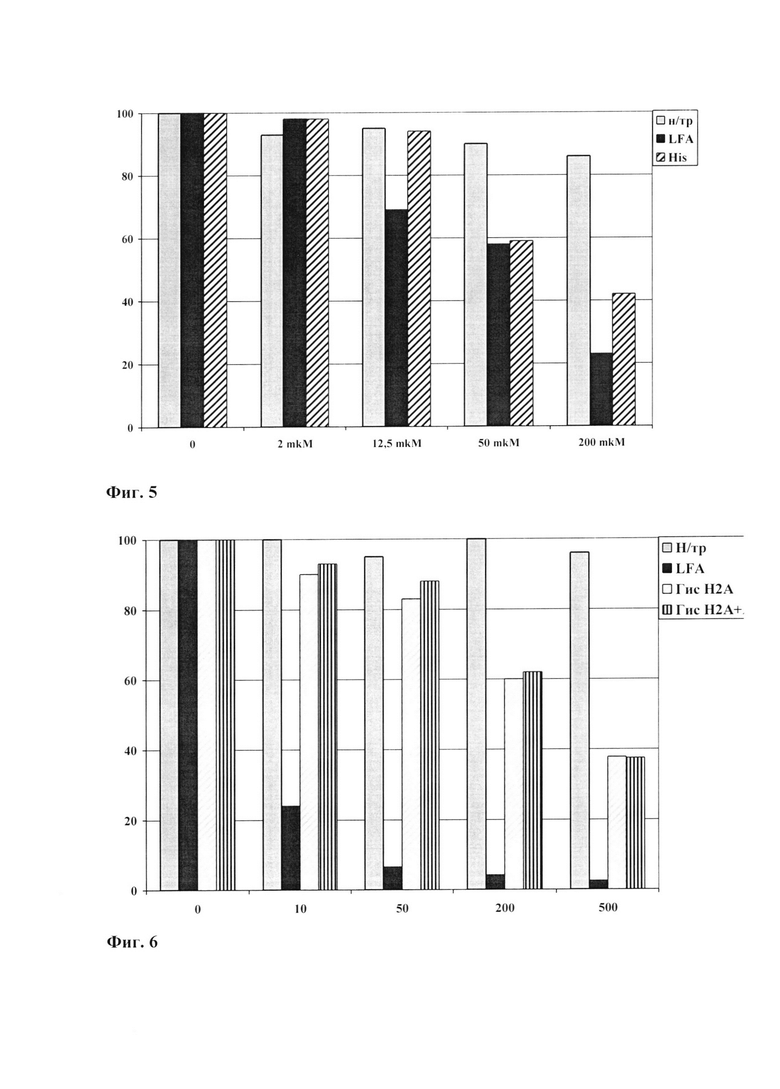
Фиг. 3. Активность люциферазы после трансфекции клеток линии НТ1080 плазмидой pCMV-Luc с рекомбинантными гистонами Н2А и Н2А-ТАТ.
По оси ординат приведены значения люминесценции в условных единицах. По оси абсцисс обозначены весовые соотношения плазмиды и конденсирующего белка, используемого для образования комплекса при трансфекции. Гис Н2А – клетки, трансфицированные с помощью белка гистона Н2А, Н2А-ТАТ – клетки, трансфицированные с помощью химерного белка Н2А-ТАТ. Плазмида - трансфекция с помощью «голой» плазмиды.
Фиг. 4. Активность люциферазы после трансфекции клеток линии HT1080 плазмидой pCMV-Luc с рекомбинантным гистоном Н2А в присутствии арахидоноилхолина (АХ). По оси ординат приведены значения люминесценции в условных единицах. По оси абсцисс обозначены весовые соотношения плазмиды и конденсирующего белка, используемого для образования комплекса при трансфекции. Гис Н2А – клетки, трансфицированные только с помощью белка гистона Н2А, Гис Н2А+АХ – клетки, трансфицированные с помощью белка гистона Н2А и араходоноилхолина. Пл+АХ – клетки, трансфицированные только с помощью араходоноилхолина.
Фиг. 5. Результаты теста на цитотоксичность HSVtk в присутствии ганцикловира. Плазмида CMV-HSVtk-mGMCSF-pGL3. Клетки линии НТ1080, трансфекция с помощью гистона Н2А. По оси ординат приведен процент выживших клеток. По оси абсцисс обозначены концентрации ганцикловира (GCV). HSVtk - тимидинкиназа вируса простого герпеса (Herpes Simplex Virus timidine kinase). Н/тр - нетрансфицированные контрольные клетки. LFA – клетки, трансфицированные с помощью Липофектамина 2000 (Invitrogen, США). Гис Н2А – клетки, трансфицированные с помощью гистона Н2А.
Фиг. 6. Результаты теста на цитотоксичность FCU1 в присутствии 5-FC. Плазмида CMV -FCY11-FUR1-pGL3. Клетки линии HT1080, трансфекция с помощью гистона Н2А и липида. По оси ординат приведен процент выживших клеток. По оси абсцисс обозначены концентрации 5-фторцитозина в мкМ (5-FC). FCUI - цитозин дезаминаза. Н/тр - нетрансфицированные контрольные клетки. LFA – клетки, трансфицированные с помощью Липофектамина 2000 (Invitrogen, США). Гис Н2А – клетки, трансфицированные с помощью гистона Н2А. Гис Н2А+АХ – клетки, трансфицированные с помощью гистона Н2А в присутствии араходоноилхолина (АХ).
Изобретение иллюстрируют, но не исчерпывают примеры.
Пример 1. Создание конструкции, содержащей фрагмент гистона Н2А человека
Фрагмент кДНК получен ПЦР-амплификацией с использованием набора праймеров SEQ ID NO: 1 и SEQ ID NO: 2, несущих последовательности, комплиментарные сайтам рестрикции NdeI и HindIII - H2Afor (SEQ ID NO: 1; GTTAGCATATGTCGGGACGTGGCAAGC) и H2Arev (SEQ ID NO: 2; ACTAAGCTTC TACTTGCCCTTGG CCTTGT). В качестве матрицы используют кДНК из лимфоцитов человека. Фрагмент длиной 393 п.о. очищают методом электрофореза в агарозном геле и клонируют в экспрессионную плазмиду рЕТ-30а(+) (Novagen, США, il.biochem.uhttp:// siowa.edu/vectors/pET/pET-30a_map.pdf), гидролизованную эндонуклеазами NdeI и HindIII. Полученную конструкцию Н2А-рЕТ секвенируют для исключения ошибок работы Taq-полимеразы (ЗАО «Евроген», Россия). Полученная конструкция на основе вектора рЕТ-30а(+) несет фрагмент гена гистона Н2А человека (Н2А) под контролем раннего промотора фага Т7. Участок 5'-концевой части плазмиды, кодирующий синтез гексагистидинового пептида, тромбина и энтерокиназы удаляют при клонировании (Фиг. 1).
Пример 2. Создание конструкции, содержащей фрагмент гистона Н2А человека и фрагмент регуляторного белка ТАТ вируса иммунодифицита ВИЧ-1
Фрагмент гистона Н2А амплифицируют с помощью набора праймеров, несущих последовательности, комплиментарные сайтам рестрикции NdeI и HindIII - SEQ ID NO: 3 и SEQ ID NO: 4, один праймер комплиментарен последовательности гистона и обратный праймер комплиментарен последовательности ТАТ-фрагмента и 3'-области гистона Н2А - TATfor (SEQ ID NO: 3; TATACATATGTCGGGACGTGGCAAG) и TATrev - (SEQ ID NO: 4; ACTAAGCTTCTAACGGCGACGCTGGCGACGTTTCTTACGACCGTACTTGCCCTTGGCCTTGTGG). В качестве матрицы используют конструкцию, описанную в примере 1. Фрагмент длиной 435 п.о. очищают методом электрофореза в агарозном геле и клонируют в экспрессионную плазмиду рЕТ-30а(+). Определение нуклеотидной последовательности подтверждает структуру химерного гена Н2А-ТАТ.
Пример 3. Культивирование клеток и очистка рекомбинантного гистона Н2А
Плазмидой Н2А-рЕТ трансформируют клетки штамма E.coli BL21(DE3) (Novagen, США). Выросшие на селективной агаризованной среде LB с канамицином (30 мг/мл) колонии переносят в жидкую питательную среду LB с канамицином и культивируют при 37°С до оптической плотности OD600-0,3-0,5. Затем к культуре добавляют индуктор экспрессии изопропил-β,D-галактотиопиранозид (IPTG) до концентрации 1 мМ и культивируют бактерии при 37°С в течение 3 часов. После этого клетки собирают центрифугированием, ресуспендируют в лизирующем буфере (50 мМ трис HCl, рН 9,0, 5 мМ ЭДТА, 1 мМ PMSF) и разрушают при помощи ультразвукового дезинтегратора (Labsonic Ρ, Sartorius, США, цикл 0,5 сек, амплитуда - 50%) в течение 20 мин при 4°С. Лизат центрифугируют 12 минут при 12000 g. Полученный после разрушения клеток супернатант разбавляют в 2 раза водой, доводят значение рН до 9,0 и фильтруют через фильтры с размером пор 0,45 мкм (HAWP04700, Millipore, США). Для очистки рекомбинантного гистона Н2А используют хроматографию на колонке ХK 16/20 (GE Healthcare, США) с 25 мл катионнообменного сорбента SP Sepharose HP (GE Healthcare, США). Элюцию очищенного белка проводят буфером 50 мМ трис HCl, рН 9,0, 5 мМ ЭДТА, содержащим 500 мМ NaCl. На следующей стадии очистку белка осуществляют с помощью ОФ ВЭЖХ на колонке Диасорб-130-С16Т 7 мкм, 16×250 мм (БиоХимМак, Россия). К 70 мл белкового раствора, полученного после ионообменной хроматографии, добавляют 7 мл ацетонитрила и 80 мкл 100% TFA и наносят на колонку. Хроматографию осуществляют в градиенте 80% ацетонитрила (от 10 до 60%) в 0.1% TFA. Фракции, содержащие целевой белок с чистотой более 99%, объединяют и лиофильно высушивают на центробежном концентраторе CentriVap Acid-Resistant System (Labconco Corp, США). Очищенный рекомбинантный гистон анализируют с помощью ОФ ВЭЖХ на колонке Prosphere С-18 300 Α 5μ, 150×4.6 мм в градиенте 80% ацетонитрила (8-64%), 0.1% ТФУ при скорости потока 0.75 мл/мин с помощью жидкостного хроматографа Agilent 1200 с времяпролетным масс-спектрометрическим детектором ESI-TOF (LS/MS) Agilent 6224. Для рекомбинантного гистона Н2А была определена молекулярная масса 13976,5 Да. Аминокислотная последовательность полученного белка - SEQ ID NO: 5. Чистоту препарата определяют методом денатурирующего электрофореза в 15% полиакриламидном геле с последующим окрашиванием Кумасси G250.
Пример 4. Культивирование клеток и очистка химерного белка Н2А-ТАТ
Культивирование клеток, трансформированных плазмидой Н2А-ТАТ-рЕТ, синтез химерного белка Н2А-ТАТ, очистку и анализ полученного продукта проводят так же, как в примере 3. Аминокислотная последовательность белка Н2А-ТАТ - SEQ ID NO: 6).
Пример 5. Синтезы липидов
Синтез арахидоноилхолин иодида
Синтез арахидоноилдиметиламиноэтанола (AA-DMAE) проводят следующим образом.
К раствору арахидоновой кислоты (80.4 мг, 0.26 ммоль) в 1.5 мл перегнанного над Р2О5 хлороформа, прибавляют 45 мкл диизопропилкарбодиимида (0.28 ммоль), 32 мг диметиламинопиридина (0.28 ммоль) и 29 мкл диметиламиноэтанола (0.28 ммоль). Колбу с реакционной смесью перемешивают при 0°С 3 часа и затем оставляют на 17 часов под аргоном. Кристаллический осадок отфильтровывают. Органический слой упаривают на роторном испарителе, остаток растворяют в этилацетате и проводят экстракцию, добавляя 3 мл NaHSO4, в первую водную промывку. Далее проводят хроматографическую очистку целевого продукта, используя систему В. Собрали 57.9 мг (50% от теор.) AA-DMAE. Rf=0.34 (бензол : этил ацетат, 6:1).
1Н-ЯМР (CDCl3; м.д., J, Гц) 0.87 (3Н, т, J6.8, Н20), 1.28 (4Н, м, Н18; Н19), 1.33 (2Н, м, Н17), 1.66 (2Н, квинт, J7.5, Н3), 2.01 (2Н, дт, J 6.4; 7.6, Н16), 2.08 (2Н, дт, J 6.5; 6.8, Н4), 2.21 (2Н, с, Н3`), 2.26 (2Н, т, J7.6; Н2), 2.48 (2Н, т, J6.2; H2`), 2.75 (6Н, м, Н7, Н10, Н13), 4.09 (2Н, т, J6; Н1`), 5.29 (8Н, м, Н5, Н6, Н8, Н9, Н11, Н12, Н14, Н15).
Масс-спектр: C24H41NO2 [М]+ 375.3137 (вычислено), 376.3299 [М+Н]+
Синтез арахидоноилхолина
К раствору 46 мг (0.12 ммоль) AA-DMAE в 500 мкл ацетона, перегнанного над Р2О5, прибавляют избыток метил иодида (30 мкл) (по 3 экв. на каждую группу) и оставляют на 40 мин под аргоном, затем упаривают на роторном испарителе и высушивают в вакууме масляного насоса. Собрали 54.4 мг (94% от теор.) арахидоноилхолина. Rf=0.28 (хлороформ: метанол, 5:1).
1Н-ЯМР (CDCl3; м.д., J, Гц) 0.84 (3Н, т, J6.7, Н20), 1.25 (4Н, м, H18; H19), 1.31 (2Н, м, H17), 1.66 (2Н, квинт, J7.5, Н3), 2.01 (2Н, дт, J7.0;7.8, Н16), 2.07 (2Н, дт, J68;7.6, Н4), 2.36 (2Н, т, J7.6; Н2), 2.76 (6Н, м, Н7, Н10, Н13), 3.51 (2Н, с, Н3`), 4.07 (2Н, т, м, Н2`), 4.55 (2Н, т., Н1`), 5.32 (8Н, м, Н5, Н6, Н8, Н9, H11, Н12, Н14, Н15).
Замену иодида на хлорид или бромид осуществляют стандартным ионным обменом с избытком желаемого иона с использованием растворов хлорида или бромида натрия.
Синтез докозагексаноилхолин иодида
Синтез докозагексаеноилхолина (DHA-CLH) осуществляют как описано для арахидоноилхолина. В реакцию берут 50 мг (0.15 ммоль) докозагексаеновой кислоты.
Выход DHA-DMAE составляет 30 мг (49.3%).
Масс-спектр: C26H41NO2 [М]+ 399.314 (вычислено), 400.329 [М+Н]+ (измерено)
Выход DHA-CLN 25.3 мг (62.2%).
Синтез олеоилхолин иодида
Синтез олеоилхолина (Ol-CHL) осуществляют как описано для арахидоноилхолина. В реакцию берут 127 мг (0.45 ммоль) олеиновой кислоты. Выход Ol-DMAE составляет 93 мг (46.8% от теоретического). Масс-спектр: C22H43NO2 [М]+ 353.329 (вычислено), 354.318 [М+Н]+ (измерено). Выход Ol-CLN - 70%.
Синтез пальмитоилхолин иодида
Синтез пальмитоилхолина (Pt-CHL) осуществляют как описано для арахидоноилхолина. В реакцию берут 150 мг (0.58 ммоль) пальмитиновой кислоты. Выход Pt -DMAE составляет 104 мг (54.3% от теоретического).
Масс-спектр: C20H41NO2 [М]+ 327.314 (вычислено), 328.299 [М+Н]+ (измерено).
Выход Pt-CHL 75%.
Синтез стеароилхолин иодида
Синтез стеароилхолина (St-CHL) осуществляют как описано для арахидоноилхолина. В реакцию берут 150 мг (0.52 ммоль) стеариновой кислоты. Выход St-DMAE составляет 109 мг (58.1% от теоретического).
Масс-спектр: C22H45NO2 [М]+ 355.345 (вычислено), 356.338 [М+Н]+ (измерено)
Выход St-CHL 80%
Синтез линолеоилхолин иодида
Синтез линолеоилхолина (Ln-CHL) осуществляют как описано для арахидоноилхолина. В реакцию берут 150 мг (0.54 ммоль) линолевой кислоты. Выход Ln -DMAE составляет 87 мг (46.2% от теоретического).
Масс-спектр: C22H41NO2 [М]+ 351.314 (вычислено), 352.319 [М+Н]+ (измерено)
Выход Ln-CHL 65%.
Синтез линоленоилхолин иодида
Синтез линоленоилхолина (Lnn-CHL) осуществляют как описано для арахидоноилхолина. В реакцию берут 150 мг (0.54 ммоль) линоленовой кислоты. Выход Lnn -DMAE составляет 101 мг (53.6% от теоретического).
Масс-спектр: C22H39NO2 [М]+ 349.298 (вычислено), 350.312 [М+Н]+ (измерено)
Выход Lnn-CHL 63%.
Синтез эйкозапенаеноилхолин иодида
Синтез эйкозапенаеноилхолина (EPA-CHL) осуществляют как описано для арахидоноилхолина. В реакцию берут 150 мг (0.49 ммоль) эйкозапентаеновой кислоты.
Выход EPA-DMAE составляет 87 мг (42.6% от теоретического).
Масс-спектр: C24H39NO2 [М]+ 373. 298 (вычислено), 374.322 [М+Н]+ (измерено)
Выход EPA-CHL 60%
Пример 6. Трансфекция клеток комплексом плазмидной ДНК с различными вариантами положительно заряженных белков (гистоны Н2А, Н2А-ТАТ)
Трансфекцию проводят в 24-луночной плашке. Используют смесь плазмид pCMV-Luc/ pRL-TK в соотношении 9:1, несущих гены люциферазы Photinus pyralis под контролем раннего промотора цитомегаловируса и люциферазы Renilla reniformis под контролем промотора тимидин киназы вируса простого герпеса (Promega, США). Клетки линии НТ1080 (фибросаркома человека) (АТСС, CCL-121, США) рассевают по 100000 в лунку в среде ДМЕМ (Dulbecco's modified Eagle's medium) без антибиотика, инкубируют 24 часа при 37°С в 5% СО2. В пробирке смешивают 1 мкг плазмиды с 10 мкг (или 25 мкг, 50 мкг) гистона и добавляют до 100 мкл PBS. Исходная концентрация гистона и плазмиды в PBS составляет соответственно 2 мкг/мкл и 1 мкг/мл. Смесь гистона и плазмиды инкубируют 30 минут при комнатной температуре. Затем добавляют 100 мкл среды OPTI-MEM, перемешивают и переносят смесь в лунки планшета. Инкубируют 3 часа при 37°С в 5% СО2, отбирают трансфекционную смесь и добавляют 0,5 мл ростовой среды ДМЕМ без антибиотика. Через 48 часов проводят анализ люциферазной активности с помощью набора "Dual-Luciferase Reporter Assay System" (Promega, США). Полученные результаты представлены на Фиг. 3. Люциферазная активность при трансфекции плазмиды pCMV-Luc с рекомбинантными белками Н2А и Н2А-ТАТ одинакова, и значительно превышает трансфекцию плазмидой без гистона («голой» плазмидой).
Пример 7. Трансфекция клеток комплексом плазмидной ДНК с рекомбинантным гистоном Н2А в присутствии липида арахидоноилхолина
Трансфекцию проводят в 24-луночной плашке как описано в п. 6. При приготовлении комплекса ДНК-гистон одновременно добавляют арахидоноилхолин, конечная концентрация которого составляла от 1 мкМ до 10 мкМ, что соответствовало соотношению по заряду липида к плазмиде от 1:1 до 10:1. Добавление липида демонстрирует увеличение активности люциферазы, причем наибольший эффект достигается при низких концентрациях гистона (Фиг. 4). Использование одного липида без белков не приводит к заметной трансфекции клеток различными плазмидами.
Добавление арахидоноилхолина при увеличении количества гистонов не приводит к сильному увеличению люциферазной активности.
Добавление арахидоноилхолина одновременно с гистоном к плазмидной ДНК приводит к увеличению трансфекции более чем в 10 раз и снижению количества используемого гистона.
Пример 8. Эффективность трансфекции клеток линии HT1080 плазмидой pEGFP-N1 с помощью рекомбинантного гистона Н2А и липида арахидоноилхолина
Трансфекцию проводят в 6 луночной плашке. Используют плазмидный вектор pEGFP-N1 (Clontech, США), несущий в своем составе ген репортерного зеленого флуоресцентного белка под контролем раннего промотора цитомегаловируса (CMV). Образование комплексов плазмиды и гистонов в присутствии или отсутствии арахидоноилхолина, проводят аналогично описанному в пп. 6 и 7. В каждую ячейку вносят комплекс, состоящий из 4 мкг плазмиды pEGFP-N1, смешанной в описанных выше соотношениях с конденсирующим белком и липидом. Через 48 часов клетки фотографируют, затем клетки собирают, промывают PBS и анализируют на проточном флуориметре. Результаты были аналогичны эффектам, полученным с плазмидами pCMV-Luc/ pRL-TK. Уровень трансфекции при использовании рекомбинантных белков Н2А и Н2А-ТАТ составляет 7-15%. Уровень трансфекции значительно увеличивается при добавлении липида арахидоноилхолина.
Пример 9. Тест на цитотоксичность HSVtk в присутствии ганцикловира после трансфекции клеток линии OSA плазмидной ДНК в комплексе с рекомбинантным гистоном Н2А
Клетки линии OSA (остеосаркома человека) трансфицируют с помощью рекомбинантного гистона Н2А плазмидой CMV-HSVtk-mGMCSF-pGL3, несущей гены тимидинкиназы вируса простого герпеса (HSVtk) и гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF) мыши под контролем раннего промотора цитомегаловируса, в шестилуночных планшетах. В качестве положительного контроля клетки той же лиинии трансфицируют плазмидой CMV-HSVtk- mGM-CSF-pGL3 с помощью широко применяемого трансфекционного агента - Липофектамина 2000 (Invitrogen, США). Спустя 48 часов после трансфекции к клеткам добавляют раствор ганцикловира («Cymeven, Roche», Швейцария) в среде DMEM/F12 (1:1) с антибиотиками в концентрации 0, 12,5, 50 и 200 мкМ. Через 216 часов после добавления ганцикловира проводят MTS -тест с целью определения количества живых клеток (Promega, США). Результаты проведенного эксперимента приведены на Фиг. 5. Использовании клеток линии OSA показывает, что выживаемость контрольной группы клеток (нетрансфицированные клетки) при концентрации ганцикловира от 0 до 200 мкМ около 100%, выживаемость клеток, трансфицированных комплексом плазмиды CMV-HSVtk-mGM-CSF-pGL3 и гистона Н2А снижается при концентрации ганцикловира выше 12,5 мкМ.
Данный эксперимент свидетельствует о возможности использования рекомбинантных гистонов для доставки в клетки терапевтических конструкций, содержащих суицидальные гены.
Пример 10. Тест на цитотоксичность FCU1 в присутствии 5-FC после трансфекции клеток HT1080 плазмидной ДНК в комплексе с рекомбинантным гистоном Н2А и липидом арахидоноилхолином
Клетки линии HT1080 (фибросаркома человека) трансфицируют в шестилуночных планшетах плазмидой CMV-FCY11-FUR1-pGL3, несущей химерную конструкцию FCY11-FUR1, под контролем раннего промотора цитомегаловируса, с помощью рекомбинантного гистона Н2А и рекомбинантного гистона Н2А в присутствии липида арахидоноилхолина. В качестве контроля используют нетрансфицированные клетки той же линии и клетки, трансфицированные с помощью липофектамина. Спустя 48 часов после трансфекции к клеткам добавляют раствор 5-фторцитозина («Sigma-Aldrich», США) в среде DMEM/F12 с антибиотиками в концентрации 0, 10, 50, 200 и 500 мкМ. Через 216 часов после добавления 5-фторцитозина проводят MTS -тест. Результаты проведенного эксперимента приведены на Фиг. 6. Было показано, что выживаемость контрольной группы клеток (нетрансфицированные клетки) при концентрации 5-фторцитозина от 0 до 500 мкМ была около 100%, выживаемость клеток, трансфицированных комплексами плазмиды CMV -FCY11-FUR1-pGL3 с гистоном Н2А или с гистоном Н2А и араходоноилхолином, снижается на 40% при концентрации 5-фторцитозина выше 200 мкм. Добавление арахидоноилхолина не влияло на процент выживаемости клеток. Данный эксперимент подтверждает возможность использования гистонов и природных липидов для доставки терапевтических конструкций, содержащих суицидальные гены.

SEQUENCE LISTING
<110> Федеральное государственное бюджетное учреждение науки
Институт биоорганической химии им. М.А. Шемякина и Ю.А.
Овчинникова Российской академии наук
Federal'noe gosudarstvennoe byudzhetnoe uchrezhdenie nauki
Institut bioorganicheskoi chemii Rossiiskoi akademii nauk
<120> ГИСТОНЫ И БИОДЕГРАДИРУЕМЫЕ ЛИПИДЫ КАК СРЕДСТВО ДЛЯ
ДОСТАВКИ НУКЛЕИНОВЫХ КИСЛОТ В КЛЕТКИ ЭУКАРИОТ
<130> IBOC
<160> 7
<170> PatentIn version 3.5
<210> 1
<211> 27
<212> DNA
<213> Homo sapiens
<220>
<221> misc_feature
<223> Primer H2A forward
<400> 1
GTTAGCATAT GTCGGGACGT GGCAAGC 27
<210> 2
<211> 29
<212> DNA
<213> Homo sapiens
<220>
<221> misc_feature
<223> Primer H2A revers
<400> 2
ACTAAGCTTC TACTTGCCCT TGGCCTTGT 29
<210> 3
<211> 25
<212> DNA
<213> Homo sapiens
<220>
<221> misc_feature
<223> Primer H2A-TAT forward
<400> 3
TATACATATG TCGGGACGTG GCAAG 25
<210> 4
<211> 64
<212> DNA
<213> Artificial Sequence
<220>
<221> misc_feature
<223> Primer H2A-TAT forward
<400> 4
ACTAAGCTTC TAACGGCGAC GCTGGCGACG TTTCTTACGA CCGTACTTGC CCTTGGCCTT 60
GTGG 64
<210> 5
<211> 129
<212> Protein
<213> Homo sapiens
<220>
<223> Recombinant histone H2A
<400> 5
SGRGKQGGKA RAKAKSRSSR AGLQFPVGRV HRLLRKGNYA ERVGAGAPVY AAVLEYLTA 60
EILELAGNAA RDNKKTRIIP RHLQLAIRND EELNKLLGRV TIAQGGVLPN QAVLLPKKT 120
ESHHKAKGK 129
<210> 6
<211> 140
<212> Protein
<213> Artificial Sequence
<220>
<223> Recombinant protein H2A-TAT
<400> 6
SGRGKQGGKA RAKAKSRSSR AGLQFPVGRV HRLLRKGNYA ERVGAGAPVY AAVLEYLTA 60
EILELAGNAA RDNKKTRIIP RHLQLAIRND EELNKLLGRV TIAQGGVLPN QAVLLPKKT 120
ESHHKAKGKY GRKKRRQRRR 140
| название | год | авторы | номер документа |
|---|---|---|---|
| УНИВЕРСАЛЬНЫЕ РАКОВОСПЕЦИФИЧНЫЕ ПРОМОТОРЫ И ИХ ИСПОЛЬЗОВАНИЕ В ПРОТИВООПУХОЛЕВОЙ ТЕРАПИИ | 2013 |
|
RU2539764C2 |
| Способ получения плазмидной ДНК в составе полимерных наносфер для доставки | 2022 |
|
RU2817116C1 |
| ВЫДЕЛЕННАЯ НУКЛЕИНОВАЯ КИСЛОТА, КОДИРУЮЩАЯ БЕЛОК KillerRed (ВАРИАНТЫ), ВЫДЕЛЕННЫЙ БЕЛОК (ВАРИАНТЫ), КАССЕТА ЭКСПРЕССИИ, КЛЕТКА, СОДЕРЖАЩАЯ КАССЕТУ ЭКСПРЕССИИ | 2011 |
|
RU2458129C1 |
| МНОГОПРОФИЛЬНЫЙ ПРОМОТОР, ЭКСПРЕССИРУЮЩИЙ ВЕКТОР И СПОСОБ ИЗБИРАТЕЛЬНОГО УБИЙСТВА РАКОВЫХ КЛЕТОК С ИХ ИСПОЛЬЗОВАНИЕМ | 2012 |
|
RU2476596C1 |
| ВЫДЕЛЕННАЯ НУКЛЕИНОВАЯ КИСЛОТА, КОДИРУЮЩАЯ ОПЕРАТИВНО СЛИТЫЙ ИНТРАМОЛЕКУЛЯРНЫЙ ДИМЕР БЕЛКА KillerRed, КАССЕТА ЭКСПРЕССИИ, КЛЕТКА, ПРОДУЦИРУЮЩАЯ ХИМЕРНЫЙ БЕЛОК И СОДЕРЖАЩАЯ КАССЕТУ ЭКСПРЕССИИ, ВЫДЕЛЕННЫЙ ХИМЕРНЫЙ БЕЛОК | 2011 |
|
RU2491342C1 |
| Генотерапевтический препарат FCU1-BsFm/PP для лечения солидных опухолей | 2023 |
|
RU2824977C1 |
| Лекарственная комбинация для ген-иммунной терапии | 2022 |
|
RU2792683C1 |
| СПОСОБ ДОСТАВКИ НУКЛЕИНОВЫХ КИСЛОТ В ЭУКАРИОТИЧЕСКИЕ КЛЕТКИ | 2014 |
|
RU2563804C1 |
| ИММОРТАЛИЗОВАННАЯ КЛЕТОЧНАЯ ЛИНИЯ ПТИЦ | 2008 |
|
RU2475536C2 |
| ФАРМАКОЛОГИЧЕСКАЯ КОМБИНАЦИЯ ПОЛИКАТИОННОГО НОСИТЕЛЯ ПЭГ-ПЭИ-ТАТ С ЗАКЛЮЧЕННОЙ В НЕМ ПЛАЗМИДОЙ, НЕСУЩЕЙ ТЕРАПЕВТИЧЕСКИЕ ГЕНЫ HSVtk И GM-CSF ДЛЯ ЦЕЛЕЙ ГЕНОТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2575077C2 |
Изобретение относится к области биотехнологии и молекулярной биологии, конкретно к способу внутриклеточной доставки активных веществ, и может быть использовано в медицине. Доставку генетического материала в эукариотические клетки осуществляют при помощи связывания в комплекс плазмидной ДНК с рекомбинантным гистоном Н2А или Н2А-ТАТ в присутствии биодеградируемого липида, представленного холиновым эфиром жирной кислоты. В сравнении с невирусными аналогами изобретение позволяет с большей эффективностью доставлять генетический материал в представляющие интерес клетки эукариот. 11 з.п. ф-лы, 6 ил., 10 пр.
1. Способ доставки плазмидной ДНК в эукариотические клетки, включающий смешивание плазмидной ДНК с рекомбинантным гистоном и холиновым эфиром жирной кислоты с длиной углеродной цепи от 16 до 22 атомов, включающих от 0 до 6 двойных связей, и инкубирование эукариотических клеток с полученной смесью.
2. Способ по п. 1, где в качестве рекомбинантного гистона используют гистон Н2А, смешанный с холиновым эфиром жирной кислоты в заданном соотношении.
3. Способ по п. 1, где в качестве рекомбинантного гистона используют химерный гистон Н2А-ТАТ, смешанный с холиновым эфиром жирной кислоты.
4. Способ по пп. 2 и 3, где в качестве холинового эфира жирной кислоты используют арахидоноилхолин иодид.
5. Способ по пп. 2 и 3, где в качестве холинового эфира жирной кислоты используют арахидоноилхолин.
6. Способ по пп. 2 и 3, где в качестве холинового эфира жирной кислоты используют докозагексаноилхолин иодид.
7. Способ по пп. 2 и 3, где в качестве холинового эфира жирной кислоты используют олеоилхолин иодид.
8. Способ по пп. 2 и 3, где в качестве холинового эфира жирной кислоты используют пальмитоилхолин иодид.
9. Способ по пп. 2 и 3, где в качестве холинового эфира жирной кислоты используют стеароилхолин иодид.
10. Способ по пп. 2 и 3, где в качестве холинового эфира жирной кислоты используют линолеоилхолин иодид.
11. Способ по пп. 2 и 3, где в качестве холинового эфира жирной кислоты используют линоленоилхолин иодид.
12. Способ по пп. 2 и 3, где в качестве холинового эфира жирной кислоты используют эйкозапентаеноилхолин иодид.
| KOTT М | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Пишущая машина для тюркско-арабского шрифта | 1922 |
|
SU24A1 |
| Аппарат для нагревания окружающей его воды | 1920 |
|
SU257A1 |
| Наконечник к шлангу для налива невязких жидкостей | 1948 |
|
SU81370A1 |
| US 20060008464 A1, 12.01.2006 | |||
| MORRIS М | |||
| et al | |||
| A peptide carrier for the delivery of biologically active proteins into mammalian cells, Nat | |||
| Biotechnol, 2001, n.19, p | |||
| Двухпроводная автоматическая тормозная система с сжатым воздухом | 1924 |
|
SU1173A1 |
| WO 1999019502 A1, 22.04.1999 | |||
| КОМПЛЕКС ПРИРОДНЫХ КАТИОННЫХ БЕЛКОВ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1996 |
|
RU2176517C2 |
Авторы
Даты
2017-12-04—Публикация
2015-11-17—Подача