В настоящей заявке испрашивается приоритет предварительной заявки на патент США рег. № 61/182368, поданной 29 мая 2009 г., и предварительной заявки на патент США рег. № 61/260608, поданной 12 ноября 2009 г., каждая из которых полностью включена в настоящее описание посредством ссылки.
Настоящее изобретение было создано при финансовой поддержке правительства, выдавшего грант № N01-HV28185 Национальному институту заболеваний сердца, легких и крови, и грант № DP10D00066301 Национальному институту здравоохранения. Правительство имеет определенные права на данное изобретение.
Предшествующий уровень техники
1. Область, к которой относится изобретение
Настоящее изобретение главным образом относится к области молекулярной биологии, иммунологии и медицины. Более конкретно, настоящее изобретение относится к идентификации пептоидов, распознаваемых аутоиммунными Т-клетками. Такие пептоиды могут быть использованы для идентификации индивидуумов, страдающих аутоиммунным заболеванием или подверженных риску развития аутоиммунного заболевания, а также для нацеливания на клетки-мишени в целях их удаления, ингибирования или разрушения.
2. Описание предшествующего уровня техники
Этиология многих аутоиммунных заболеваний на молекулярном уровне пока неясна. Из-за отсутствия достаточной информации о таких заболеваниях на молекулярном уровне, существующая ситуация в отношении разработки диагностических средств и эффективной терапии аутоиммунных заболеваний далека от оптимальной. Так, например, в настоящее время еще не найдены маркеры сывороточного белка, которые позволяли бы с высокой степенью надежности диагностировать большинство аутоиммунных заболеваний. Почти без исключения все лекарственные средства, используемые для лечения таких состояний, либо подавляют результат самого аутоиммунного ответа, такой как воспаление, либо направлены на неселективную модуляцию или супрессию всей иммунной системы (Hemmer & Hartung, 2007) со значительными нежелательными побочными эффектами. Для диагностики и терапии было бы идеально получить молекулы, которые будут нацелены на аутореактивные В-клетки (и на антитела, которые они продуцируют) и непосредственно на Т-клетки, но не на В- и Т-клетки, которые распознают чужеродные антигены. Такие молекулы могли бы быть использованы в качестве диагностических средств и аналитических инструментов для детектирования и обогащения аутоиммунных антител, В-клеток и Т-клеток. Кроме того, эти молекулы могли бы служить в качестве фундамента для разработки новой программы по поиску лекарственных средств, направленных на уничтожение этих аутореактивных клеток, но не влияющих на нужные функции иммунной системы.
Таким образом, для диагностики указанных заболеваний необходимо разработать способы, которые были бы (i) точными и объективными, (ii) простыми и воспроизводимыми и (iii) эффективными для использования, как на ранней, так и на поздней стадии заболевания.
Описание сущности изобретения
Настоящее изобретение относится к способам применения синтетических молекул, то есть лигандов, которые связываются с лиганд-связывающими молекулами, такими как белки, нуклеиновые кислоты, углеводы или н-адгезивные клетки, присутствующие в сложных биологических смесях, в качестве биомаркеров для оценки конкретного(ых) физиологического(их) состояния(й). В некоторых аспектах изобретения лигандом является пептоид.
Таким образом, настоящее изобретение относится к способу идентификации лиганда или пептоида, которые специфически распознаются аутоиммунными Т-клетками, включающему: (a) получение первой популяции Т-клеток от здорового индивидуума, где указанную популяцию метят первой детектируемой меткой; (b) получение второй популяции Т-клеток от индивидуума с аутоиммунным заболеванием, где указанную популяцию метят второй детектируемой меткой; (c) контактирование указанных первой и второй Т-клеточных популяций с множеством указанных пептоидов-кандидатов; и (d) оценку связывания указанных первой и второй Т-клеточных популяций с указанным пептоидом-кандидатом, где, в случае, если указанный пептоид связывается с указанной второй Т-клеточной популяцией, но не с указанной первой Т-клеточной популяцией, указанный пептоид распознается аутоиммунными клетками, но не распознается нормальными Т-клетками.
Аутоиммунным заболеванием может быть рассеянный склероз или ревматоидный артрит. Лигандом или пептоидом может быть 3-мер, 4-мер, 5-мер, 6-мер, 7-мер, 8-мер, 9-мер или 10-мер. Первая и вторая метки могут быть флуоресцентными или хемилюминесцентными, либо они могут представлять собой квантовые точки. Пептоид может быть связан с носителем, таким как гранула, чип, фильтр, тест-полоска, мембрана, полимерная матрица или лунка. Стадия контактирования может включать приведение указанного носителя в контакт с указанными первой и второй Т-клеточными популяциями одновременно. T-клеточная популяция может включать CD4+-T-клетки. Индивидуумами могут быть человек или мышь.
В другом своем варианте настоящее изобретение относится к способу взятия аутоиммунных T-клеток у индивидуума, страдающего аутоиммунным заболеванием, включающему: (a) получение лиганда или пептоида, который специфически связывается с аутоиммунными Т-клетками, где указанный лиганд или пептоид связан с носителем; (b) контактирование образца, содержащего Т-клетки и взятого у указанного индивидуума, с указанным пептоидом, связанным с носителем, в течение периода времени, достаточного для связывания аутоиммунных Т-клеток с указанным лигандом или пептоидом, связанным с носителем; и (c) отделение указанного носителя от указанного образца. Этот способ может дополнительно включать возращение образца со стадии (c) указанному индивидууму. Аутоиммунным заболеванием может быть рассеянный склероз или ревматоидный артрит.
Лигандом или пептоидом может быть 3-мер, 4-мер, 5-мер, 6-мер, 7-мер, 8-мер, 9-мер или 10-мер. Носителем может быть гранула, чип, фильтр, тест-полоска, мембрана, полимерная матрица или лунка. Образцом может быть кровь, цереброспинальная жидкость или сперма. Если образцом является кровь, то она может быть взята у указанного индивидуума, обработана ex vivo и возвращена указанному индивидууму, после чего эта кровь может быть пропущена через связанный с носителем лиганд или пептоид и возвращена индивидууму по замкнутой цепи кровообращения. Указанный способ может дополнительно включать получение указанного образца от указанного индивидуума. Указанным индивидуумом может быть человек или мышь.
В другом своем варианте настоящее изобретение относится к способу уничтожения аутоиммунных Т-клеток, полученных от индивидуума, страдающего аутоиммунным заболеванием, где указанный способ включает: (a) получение лиганда или пептоида, который специфически связывается с аутоиммунными Т-клетками, где указанный лиганд или пептоид конъюгирован с токсином; и (b) контактирование образца, содержащего Т-клетки и взятого у указанного индивидуума, с указанным конъюгатом в течение периода времени, достаточного для связывания по меньшей мере одной аутоиммунной Т-клетки с указанным конъюгатом, где указанный конъюгат вызывает гибель указанных аутоиммунных Т-клеток. Образец может быть обработан ex vivo, а указанный способ может дополнительно включать возвращение данного образца указанному индивидууму. Указанным аутоиммунным заболеванием может быть рассеянный склероз или ревматоидный артрит.
Лигандом или пептоидом может быть 3-мер, 4-мер, 5-мер, 6-мер, 7-мер, 8-мер, 9-мер или 10-мер. Токсином может быть рицин, дифтерийный токсин или холерный токсин. Альтернативно, токсином может быть фотоактивируемый токсин, такой как трис-бипептидил-рутений(II), а стадия (b) может дополнительно включать облучение указанного образца видимым светом. Образцом может быть кровь, цереброспинальная жидкость или сперма. Указанный способ может дополнительно включать получение указанного образца от указанного индивидуума. Указанным индивидуумом может быть человек или мышь.
В другом своем варианте настоящее изобретение относится к способу уничтожения аутоиммунных Т-клеток, полученных от индивидуума, страдающего аутоиммунным заболеванием, где указанный способ включает: (a) получение лиганда или пептоида, который специфически связывается с аутоиммунными Т-клетками, где указанный лиганд или пептоид конъюгирован с Fc-содержащими молекулами IgG; и (b) контактирование популяции аутоиммунных Т-клеток с указанным конъюгатом в течение периода времени, достаточного для связывания по меньшей мере одной аутоиммунной Т-клетки с указанным конъюгатом, где указанный конъюгат индуцирует приток иммунных эффекторов в указанную популяцию аутоиммунных Т-клеток, что приводит к их гибели. Популяция аутоиммунных Т-клеток может быть обработана ex vivo, а указанный способ может дополнительно включать возвращение данного образца, полученного в стадии (b), указанному индивидууму. Указанным аутоиммунным заболеванием может быть рассеянный склероз или ревматоидный артрит.
Лигандом или пептоидом может быть 3-мер, 4-мер, 5-мер, 6-мер, 7-мер, 8-мер, 9-мер или 10-мер. Fc-содержащей молекулой IgG может быть антитело, одноцепочечное антитело или Fc-фрагмент, например, антитела или одноцепочечного антитела, где указанный лиганд или пептоид присоединяют к антигенсвязывающему сайту указанного антитела или его Fc-фрагмента, не содержащего вариабельных областей IgG, и где указанный лиганд или пептоид присоединяют к карбокси-концу указанного Fc-фрагмента. Образцом может быть кровь, цереброспинальная жидкость или сперма. Указанный способ может дополнительно включать получение указанного образца от указанного индивидуума. Указанным индивидуумом может быть человек или мышь.
В некоторых вариантах изобретения соединение согласно изобретению имеет нижеследующие формулы, включая их фармацевтически приемлемые соли:
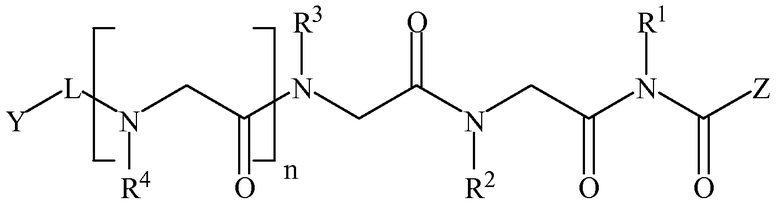
Формула I
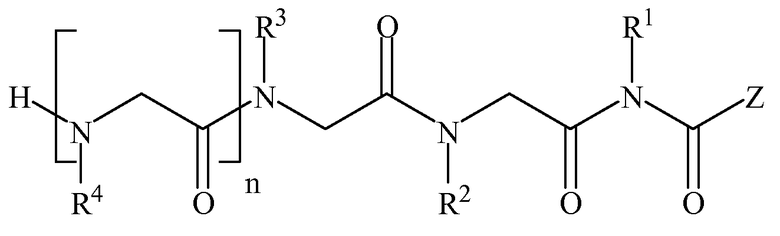 ,
,
Формула II
где n равно 0-8; L представляет собой линкер; Y представляет собой токсин или фрагменты антител; Z представляет собой NH2, N(C1-C6алкил)2, OH или O(C1-C6алкил)); а Rl, R2, R3, R4, R5, R6, R7, R8 (где к формуле I или формуле II с каждым значением n больше 4 добавляется следующая группа R в порядке нумерации), могут представлять собой водород; алкил; аллил; метил; этил; н-пропил; изопропил; н-бутил; изобутил; втор-бутил; трет-бутил; пентил; гексил; изопентил; арил; гетероарил; фуранил; индолил; тиофенил; тиазолил; имидазолил; изоксазоил; оксазоил; пиперонил; пиразоил; пирролил; пиразинил; пиридил; пиримидил; пиримидинил; пуринил; циннолинил; бензофуранил; бензотиенил; бензотриазолил; бензоксазолил; хинолин; изоксазолил; изохинолин-циклоалкил; алкенил; циклоалкенил; фенил; пиридил; метоксиэтил; (R)-метилбензил; C1-C6алкил, который является незамещенным или замещен группами NH2, OH, SH, N(C1-C6алкил)2, О(C1-C6алкил) или S(C1-C6алкил); C2-C6алкинил, который является незамещенным или замещен группами NH2, OH, SH, N(C1-C6алкил)2, O(C1-C6алкил) или S(C1-C6алкил); C2-C6алкенил, который является незамещенным или замещен группами NH2, OH, SH, N(C1-C6алкил)2, O(C1-C6алкил) или S(C1-C6алкил).
В некоторых аспектах изобретения Rl, R2 и/или R3 может независимо представлять собой C1-C6алкил, который является незамещенным или замещен группами NH2, OH, SH, N(C1-C6алкил)2, O(C1-C6алкил), или S(C1-C6алкил); C2-C6алкинил, который является незамещенным или замещен группами NH2, OH, SH, N(C1-C6алкил)2, O(C1-C6алкил) или S(C1-C6алкил); C2-C6алкенил, который является незамещенным или замещен группами NH2, OH, SH, N(C1-C6алкил)2, O(C1-C6алкил) или S(C1-C6алкил).
В некоторых аспектах изобретения R1 представляет собой C1-C6алкил, замещенный по концу группой NH2, а в частности, 4-аминобутан.
В других аспектах изобретения R2 представляет собой C1-C6алкил, замещенный по концу группой NH2, а в частности, 4-аминобутан.
В других аспектах изобретения R3 представляет собой C1-C6алкил, C2-C6алкинил или C2-C6алкенил. В некоторых аспектах изобретения R3 представляет собой изобутил.
В некоторых аспектах изобретения R4 представляет собой C1-C6алкил, замещенный по концу группой NH2, а в частности, 4-аминобутан.
В других аспектах изобретения R5 представляет собой (R)-метилбензил.
В других аспектах изобретения R6 представляет собой фуранил.
В некоторых аспектах изобретения R7 представляет собой C1-C6алкил, замещенный по концу группой NH2, а в частности, 4-аминобутан.
В других аспектах изобретения R8 представляет собой C1-C6алкил, а в частности изобутил.
В некоторых своих вариантах настоящее изобретение включает 8-мер, где Rl, R2, R4 и R7 представляют собой 4-аминобутан; R3 и R8 представляют собой изобутил; R5 представляет собой (R)-метилбензил, а R6 представляет собой фуранил (соединение AG12A). AG12A может содержать на своем конце лизильную группу (4-аминобутан), гидроксильную группу или карбоксильную группу.
В других аспектах изобретения концевая группа R заканчивается лизильной, карбоксильной или гидроксильной группой.
Следует отметить, что любой описанный здесь способ или любая описанная здесь композиция могут быть применены с использованием любого другого описанного здесь способа или любой другой описанной здесь композиции.
Употребление существительного единственного числа в сочетании со словом «включающий», используемым в формуле изобретения и/или в описании настоящей заявки, может означать какой-либо «один» элемент, а также «один или более» элементов, «по меньшей мере один» элемент и «один либо более чем один» элемент.
При этом подразумевается, что любой вариант, обсуждаемый в настоящем описании, может быть осуществлен с применением любого способа или любой композиции согласно изобретению и наоборот. Кроме того, композиции и наборы согласно изобретению могут быть использованы для осуществления способов согласно изобретению.
Термин «примерно», употребляемый в настоящем описании, относится к величине, включающей присущую этой величине дисперсию ошибок, а именно, инструментальных ошибок, ошибок метода, применяемого для определения этой величины, или вариабельность, существующая между обследуемыми индивидуумами.
Краткое описание графического материала
Описанный ниже графический материал составляет часть настоящего описания и приводится для дополнительной иллюстрации некоторых аспектов настоящего изобретения. Для лучшего понимания настоящего изобретения оно проиллюстрировано ниже со ссылками на одну или несколько фигур в комбинации с подробным описанием представленных здесь конкретных вариантов.
Фиг. 1A-D: Идентификация пептоидов, связывающихся с аутореактивными Т-клетками, в соответствии с протоколом скрининга с использованием двухцветных гранул. (Фиг. 1A) Схематическое представление протокола скрининга пептоидов. (Фиг. 1B) Изображения, полученные на флуоресцентном микроскопе для пептоидных гранул после скрининга и промывки (100х увеличение; DAPI-фильтр); (i) и (ii): две гранулы, которые были выбраны как «наилучшие» и которые, как наблюдалось, связываются только с клетками, окрашенными красным красителем; (iii): гранулы, связывающиеся с CD4+-T-клетками, взятыми у здоровых мышей и у мышей с EAE. (Фиг. 1C) Химические структуры двух «наилучших» величин, идентифицированных в этом скрининге. (Фиг. 1D) Изображения, полученные на флуоресцентном микроскопе для гранул Tentagel, на которых представлен AG12A, связанный с аутореактивными T-клетками; (i): CD4+-T-клетки, которые были взяты у контрольных B10.PL-мышей дикого типа и которые не связываются с пептоидными гранулами AG12A; (i)i: CD4+-T-клетки, которые были взяты у Vα2.3/Vβ8.2 MBP Ас-1-11 TCR-трансгенных мышей и которые связываются с пептоидными гранулами AG12A.
Фиг. 2A-C: AG12A связывается с MBP Acl-11-специфическими T-клетками со средней микромолярной аффинностью и с высокой специфичностью. (Фиг. 2A) Проточный цитометрический анализ CD4+-T-клеток, взятых у Vα2.3/Vβ8.2 MBP Ac1-11 TCR-трансгенных мышей и мышей B10.PL дикого типа в присутствии возрастающих концентраций биотин-DOPA-AG12A. Клетки предварительно инкубировали с концентрациями 1 мкM, 10 мкM, 100 мкM, 250 мкM или 500 мкM биотин-DOPA-AG12A, подвергали перекрестному связыванию и окрашивали анти-CD4-PerCP-Cy5.5 антителом и антителом против стрептавидина-аллофикоцианина (APC). Двухцветную проточную цитометрию проводили для определения аффинности связывания биотинилированного AG12A с аутореактивными CD4+-T-клетками. Результаты представлены в виде перекрывающихся гистограмм, где зеленая линия соответствует Vα2.3/Vβ8.2 MBР Ac1-11 TCR-трансгенным T-клеткам, а синяя линия соответствует CD4+-T-клеткам дикого типа B10.PL. Красная линия и соответствует непептоидному негативному контролю. Среднюю интенсивность флуоресценции (MFI) определяли для каждой концентрации пептоида, тестируемого с помощью компьютерной программы Flowjo. Было обнаружено, что только Vα2.3/Vβ8.2 MBP Ac1-11 TCR-трансгенные T-клетки связываются с AG12A. Полученные результаты были репрезентативными для трех независимых экспериментов. (Фиг. 2B) Изотерму связывания AG12F c Vα2.3/Vβ8.2 MBP Ac1-11 TCR-трансгенными T-клетками оценивали с помощью проточной цитометрии. Строили график зависимости MFI от концентрации каждого тестируемого пептоида для TCR-трансгенных T-клеток + AG12A, Т-клеток дикого типа + AG12A, TCR-трансгенных T-клеток + контрольный пептоид, и Т-клеток дикого типа + контрольный пептоид. Величину Kd вычисляли с помощью компьютерной программы Graphard Prism, и эта величина составляла приблизительно 40 мкM. (Фиг. 2C) После индуцированного периодатом перекрестного связывания биотин-DOPA-AG12A с Vα2.3/Vβ8.2 MBP Ac1-11-TCR-трансгенными T-клетками и последующего электрофореза в ДСН-геле и вестерн-блот-анализа, проводимого с использованием нейтравидина-ПХ (НА-ПХ), получали главный перекрестно-связанный продукт с молекулярной массой приблизительно 45 кДа (правая сторона). Этот продукт не наблюдался при использовании CD4+-T-клеток, взятых у мышей дикого типа или CD4-негативных спленоцитов, взятых у TCR-трансгенных мышей. Дорожка 1: CD4+-T-клетки дикого типа, дорожка 2: Vα2.3/Vβ8.2 трансгенные Т-клетки, дорожка 3: CD4-негативные спленоциты. Правая сторона: аналогична левой стороне, за исключением того, что блот зондировали анти-Vα2 TCR антителом. Полученные результаты являются репрезентативными для двух независимых экспериментов.
Фиг. 3A-C: AG12A ингибирует пролиферацию аутореактивных T-клеток в зависимости от дозы. (Фиг. 3A) СD4+ MBP Ac1-11-специфичные мышиные TCR-трансгенные T-клетки выделяли, метили CFSE и инкубировали с возрастающими концентрациями пептоида AG12A или контрольного пептоида. Клетки разводили антигенпрезентирующими клетками, выделенными из селезенки мышей B10.PL дикого типа, и стимулировали пептидом MBP Ac1-11 в конечной концентрации 10 мкг/мл. Клетки окрашивали анти-CD4+-PerCP-CY5.5 антителом и анализировали с помощью проточной цитометрии для определения процента делящихся клеток. Результаты представлены в виде линейной кривой, где на оси X отложена концентрация пептоида, а на оси Y отложен процент деления клеток. Клетки, обработанные пептоидом AG12A, обозначены квадратами, а клетки, обработанные контрольным пептоидом, обозначены треугольниками. (Фиг. 3B) B-клетки выделяли у мышей B10.PL дикого типа и обрабатывали, как описано на фиг. 3A. Клетки стимулировали LPS и осуществляли проточную цитометрию, описанную выше. (Фиг. 3C) CD4+-T-клетки, полученные от MOG 35-55 TCR-трансгенных мышей, выделяли и обрабатывали, как описано выше, за исключением того, что указанные клетки стимулировали пептидом MOG 35-55 в присутствии антигенпрезентирующих клеток. Все результаты являются репрезентативными для трех независимых экспериментов.
Фиг. 4A-D: Добавление радиоактивного рутения приводит к повышению активности AG12A и к предупреждению адоптивной передачи EAE. (Фиг. 4A) График иллюстрирует фотокаталитическую деструкцию аутореактивного TCR. AG12A был химически связан с Ru2+. После инкубирования с комплексом «рутений-пептоид», клетки облучали видимым светом (<380 нм). Облучение приводило к образованию синглетного кислорода, который инактивирует рецептор-мишень. (Фиг. 4B) CD4+-MBP Ac1-11-специфические мышиные TCR-трансгенные T-клетки выделяли у мышей B10.PL и инкубировали с AG12A-Ru2+, контрольным Ru2+-пептоидом в концентрациях 1 мкM или 100 нM, или только с растворителями (PBS или ДМСО). Клетки либо облучали при <380 нм в течение 10 минут (заштрихованные столбцы), либо не облучали (черные столбцы). Культуры разводили антигенпрезентирующими клетками, выделенными из селезенки мышей дикого типа B10.PL, и стимулировали пептидом MBP Ac1-11 в конечной концентрации 10 мкг/мл. Пролиферацию определяли путем добавления [3H]тимидина к клеткам в течение последних 16 часов культивирования. Фоновые уровни пролиферации клеток, которые не были стимулированы антигеном, вычитали из полученных результатов. (Фиг. 4C) Панель, аналогичная панели B, за исключением того, что используемые CD4+-T-клетки выделяли у MOG 35-55-специфических TCR-трансгенных мышей. AG12A-Ru2+ не оказывал негативного влияния на пролиферацию этих клеток. (Фиг. 4D) Обработка пептоидом AG12A-Ru2+ приводит к предупреждению адоптивной передачи EAE. CD4+-T-клетки выделяли у MBP Ac1-11-специфических TCR-трансгенных мышей, инкубировали со 100 нМ пептоида AG12A-Ru2+ или контрольного Ru2+-пептоида, а затем облучали. После этого клетки стимулировали антигенпрезентирующими клетками и 10 мкг/мл пептида MBP Ac1-11 в течение 72 часов, и переносили путем i.р.-инъекции мышам B10.PL, которые ранее не подвергались обработке. Мышей ежедневно обследовали на клинические признаки EAE, и полученные средние клинические оценки использовали для построения графика для групп, обработанных AG12A-Ru2+ (незаштрихованные кружки), контрольным Ru2+-пептоидом (незаштрихованные квадраты), только антигеном (незаштрихованные треугольники), и не обработанных антигеном (звездочки). Все результаты являются репрезентативными для 2 независимых экспериментов.
Фиг. 5A-B: Средние клинические оценки, полученные у мышей с EAE, используемых в целях скрининга и структурной иллюстрации пептоидной библиотеки, применяемой в этом скрининге. (Фиг. 5A) Мышей B10.PL иммунизировали 50 мкг пептида MBP Ac1-11, эмульгированного в полном адъюванте Фрейнда (CFA) для индуцирования EAE. Мышей ежедневно обследовали на клинические признаки заболевания и присваивали клиническую оценку исходя из стандартных критериев. Контрольных мышей иммунизовали только CFA, и у этих мышей не развивался EAE. Когда заболевание достигало своего пика, мышей умерщвляли, и у этих мышей выделяли CD4+-T-клетки, которые затем использовали для скрининга пептоидной библиотеки. Оценки для мышей с EAE (квадраты) и контрольных мышей (треугольники) представлены на графике. (Фиг. 5B) Проиллюстрирована пептоидная библиотека, используемая для скрининга. Верхняя часть: общая химическая структура соединений в библиотеке. Три остатка у С-конца оставались неизменными, а остальные 6 остатков варьировались. В рамке: амины, используемые для создания библиотеки.
Фиг. 6: Структуры контрольного пептоида и контрольного Ru 2+ -пептоида. На данной фигуре представлены химические структуры контрольных пептоидов, используемых для этих исследований.
Описание репрезентативных вариантов осуществления настоящего изобретения
Авторами настоящего изобретения описаны способы идентификации синтетических молекул, которые связываются с аутореактивными CD4+-T-клетками с высокой специфичностью. Для осуществления протокола исследования, проводимого авторами на животных с экспериментальным аутоиммунным энцефаломиелитом (EAE) и на животных с моделью человеческого рассеянного склероза (MS), не требовалось каких-либо предварительных знаний о природе нативного(ых) антигена(ов). Вместо этого была разработана стратегия конкурентного связывания, в которой проводили одновременную оценку способности каждого соединения библиотеки связываться с аутореактивными Т-клетками и нормальными Т-клетками в нативной популяции. В качестве «наилучших соединений» были выбраны только те соединения, которые обладали высокой специфичностью к аутореактивным Т-клеткам. Подробная характеризация одного «наилучшего соединения» в скрининге EAE позволяет предположить, что он связывается с T-клеточным рецептором (TCR). Кроме того, было обнаружено, что это соединение является антагонистом индуцируемой антигеном пролиферации T-клеток in vitro. И наконец, в случае конъюгирования этого соединения с рутениевым комплексом, способным опосредовать окислительное разрушение молекулы с образованием родственных белков при ее фотолизе (Lee et al., 2008), такой конъюгат будет ингибировать способность аутореактивных T-клеток опосредовать развитие заболевания в эксперименте по адоптивной передаче заболевания. В целом, полученные данные подтверждают возможность применения данного метода для идентификации синтетических соединений, обладающих способностью связываться с антиген-специфическими аутореактивными T-клетками и ингибировать эти клетки.
I. Аутоиммунные заболевания
Как обсуждалось выше, настоящее изобретение относится к идентификации молекул, которые могут связываться с аутоиммунными Т-клетками, взятыми у пациентов с различными патологическими состояниями. Хотя примеры описаны для EAE, на моделях животных с MS, однако, настоящее изобретение может быть применено к различным аутоиммунным заболеваниям, некоторые из которых обсуждаются ниже. В некоторых аспектах изобретения такими патологическими состояниями являются, но не ограничиваются ими, острый диссеминированный энцефаломиелит (ADEM), острый некрозирующий геморрагический лейкоэнцефалит, болезнь Аддисона, агаммаглобулинемия, аллергическая астма, аллергический ринит, гнездная аллопеция, амилоидоз, анкилозирующий спондилит, нефрит, вызываемый анти-GBM/анти-TBM антителами, антифосфолипидный синдром (APS), аутоиммунная апластическая анемия, аутоиммунная диссинергия, аутоиммунный гепатит, аутоиммунная гиперлипидемия, аутоиммунный иммунодефицит, аутоиммунное заболевание внутреннего уха (AIED), аутоиммунный миокардит, аутоиммунный панкреатит, аутоиммунная ретинопатия, аутоиммунная тромбоцитопеническая пурпура (АTP), аутоиммунное заболевание щитовидной железы, невропатии аксонов и нервных тканей, болезнь Бало, болезнь Бехчета, буллезный пемфигоид, кардиомиопатия, болезнь Кастлемана, кишечная спру (не трофическая), болезнь Шагаса, синдром хронической усталости, хроническая воспалительная демиелинизирующая полиневропатия (CIDP), хронический рецидивирующий мультифокальный остеомиелит (CRMO), синдром Черга-Штраусса, рубцующийся пемфигоид/доброкачественный пемфигоид слизистой, болезнь Крона, синдром Когана, болезнь холодовых агглютининов, застойная сердечная недостаточность, миокардит Коксаки, болезнь CREST, эссенциальная смешанная криоглобулинемия, демиелинизирующие невропатии, дерматомиозит, болезнь Девика (нейромиелит зрительного нерва), дискоидная волчанка, синдром Дресслера, эндометриоз, эозинофильный фасцит, нодозная эритема, экспериментальный аллергический энцефаломиелит, синдром Эванса, фибромиалгия, фиброзирующий альвеолит, гигантоклеточный артериит (височный артериит), гломерулонефрит, синдром Гудпасчера, болезнь Грейвса, синдром Гийена-Барре, энцефалит Хашимото, тиреоидит Хашимото, гемолитическая анемия, пурпура Геноха-Шенлейна, герпес беременных, гипогаммаглобулинемия, идиопатическая тромбоцитопеническая пурпура (ITP), IgA-нефропатия, заболевание, вызываемое иммунорегуляторными липопротеинами, миозит, вызываемый тельцами включения, инсулинозависимый диабет (типа 1), кишечный цистит, юношеский артрит, юношеский диабет, синдром Кавазаки, синдром Ламберта-Итона, лейкоцитокластический васкулит, плоский лишай, склеротический лишай, фиброзный конъюнктивит, болезнь линейных цепей IgA (LAD), волчанка (SLE), болезнь Лайма, болезнь Меньера, микроскопический полиангит, смешанная болезнь соединительных тканей (MCTD), язва Мурена, болезнь Мухи-Хабермана, рассеянный склероз, тяжелая миастения, миозит, нарколепсия, нейромиелит зрительного нерва (болезнь Девика), нейтропения, рубцующийся пемфигоид зрачка, нейрит зрительного нерва, палиндромный ревматизм, PANDAS (детские аутоиммунные нервно-психические расстройства, вызываемые стрептококками), паранеопластическая дегенерация мозжечка, пароксизмальная ночная гемоглобинурия (PNH), синдром Парри-Ромберга, синдром Персонейджа-Тернера, заболевание ресничного кружка (периферический увеит), пемфигоид, периферическая нейропатия, околовенозный энцефаломиелит, пернициозная анемия, синдром POEMS, нодозный полиартериит, аутоиммунные полигландулярные синдромы типа I, II и III, ревматический полимиалгит, полимиозит, постинфарктный синдром, посткардиомиотомный синдром, дерматит, вызываемый прогестероном, первичный билиарный цирроз, первичный склерозирующий холангит, псориаз, псориатический артрит, идиопатический фиброз легких, гангренозная пиодермия, истинная эритроцитарная аплазия, болезнь Рейно, рефлекторная симпатетическая дистрофия, синдром Рейтера, рецидивирующий полихондрит, синдром «усталых ног», ретроперитонеальный фиброз, ревматическая лихорадка, ревматоидный артрит, саркоидоз, синдром Шмидта, склерит, склеродермия, синдром Сьегрена, аутоиммунная реакция, направленная на аутоантигены спермы и яичек, синдром «негнущегося человека», подострый бактериальный эндокардит (SBE), симпатический иридоциклит, артериит Такаясу, височный артериит/гигантоклеточный артериит, тромбоцитопеническая пурпура (TPP), синдром Толосы-Ханта, поперечный миелит, язвенный колит, недифференцированное заболевание соединительной ткани (UCTD), увеит, васкулит, везикулобуллезный дерматоз, витилиго или гранулематоз Вегенера, или хронический активный гепатит, первичный билиарный цирроз, сердечная кардиомиопатия, миокардит, аутоиммунный полиэндокринный синдром типа I (APS-I), фиброзно-кистозный васкулит, приобретенный гипопаратиреоидит, ишемическая болезнь сердца, листовидная пузырчатка, вульгарная пузырчатка, энцефалит Расмуссена, аутоиммунный гастрит, синдром инсулиновой гипогликемии (болезнь Хираты), инсулинорезистентность типа B, акантоз, системная красная волчанка (SLE), пернициозная анемия, резистентный к лечению артрит Лайма, полиневропатия, демиелинизирующие заболевания, атопический дерматит, аутоиммунный гипотиреоидит, витилиго, офтальмопатия, ассоциированная с заболеванием щитовидной железы, аутоиммунная глютеновая болезнь, заболевание, вызываемое дефицитом ACTH, дерматомиозит, синдром Сьегрена, системный склероз, прогрессирующий системный склероз, кольцевидная склеродермия, первичный антифосфолипидный синдром, хроническая идиопатическая крапивница, синдромы соединительных тканей, некрозирующий и серповидный гломерулонефрит (NCGN), системный васкулит, синдром Рейно, хроническое заболевание печени, висцеральный лейшманиоз, заболевание, вызываемое дефицитом аутоиммунных анти-Cl антител, мембранозный пролиферирующий гломерулонефрит (MPGN), заболевание, вызываемое замедленным свертыванием крови, иммунодефицит, атеросклероз, нейронопатия, паранеопластическая пузырчатка, паранеопластический синдром «негнущегося человека», паранеопластический энцефаломиелит, подострая вегетативная невропатия, ассоциированная с раком ретинопатия, паранеопластическая атаксия, а именно, синдром «пляшущих глаз», синдром поражения нижних двигательных нейронов и миастения Ламберта-Итона.
A. Анкилозирующий спондилит
AS представляет собой подгруппу заболеваний, входящих в более широкую группу заболеваний, классифицированную как спондилоартропатия. У пациентов, страдающих спондилоартропатией различных типов, этиология этого заболевания часто варьируется в очень широких пределах, от бактериальных инфекций до врожденного заболевания. Но, в конечном счете, у всех этих индивидуумов, развивается аксиальный артрит. Несмотря на ранние клинические различия этих заболеваний, проявляющиеся у различных групп пациентов, исход многих этих заболеваний, протекающих в течение 10-20 лет, почти идентичен. Недавно проведенные исследования позволяют предположить, что средний период времени от начала заболевания до клинической диагностики анкилозирующего спондилита составляет 7,5 лет (Khan, 1998). Эти же самые исследования позволяют предположить, что симптомы спондилоартропатии могут быть очень похожими на симптомы ревматоидного артрита (Feldtkeller et al., 2003; Doran et al., 2003).
AS представляет собой хроническое системное воспалительное ревматическое расстройство осевого скелета с наличием или отсутствием внескелетных проявлений. При этом, главным образом, поражаются крестцово-подвздошные суставы и позвоночник, но могут быть также поражены бедра и плечи, а в меньшей степени, периферические суставы или некоторые внесуставные структуры, такие как глаза, мускулатура, нервная система и желудочно-кишечный тракт. Этиология данного заболевания пока еще абсолютно не ясна (Wordsworth, 1995; Calin and Taurog, 1998). Это заболевание тесно ассоциируется с аллелем HLA-B27 главного комплекса гистосовместимости класса I (МНС I) (Calin and Taurog, 1998). AS развивается у индивидуумов в начале жизни и представляет опасность из-за возможного возникновения хронических болей и необратимого поражения сухожилий, связок, суставов и костей (Brewerton et al., 1973; Brewerton et al., 1973; Schlosstein et al., 1973). AS возникает независимо или в сочетании с другими формами спондилоартропатии, такими как реактивный артрит, псориаз, псориатический артрит, энтезит, язвенный колит, синдром раздраженного кишечника или болезнь Крона, и в этом случае он классифицируется как вторичный AS.
Обычно поражаемыми участками являются дисковертебральные суставы, апофизарные суставы, ребернопозвоночные суставы и суставы ребер с поперечными отростками позвонков, а также паравертебральные структуры связок. При этом заболевании также явно выражено воспаление энтезисов, которые являются участками сухожильномышечной системы и местом прикрепления связок к кости (Calin and Taurog, 1998). Известно, что на участке энтезиса наблюдается инфильтрация клеток плазмы, лимфоцитов и полиморфонуклеарных клеток. Такой процесс воспаления часто приводит к постепенному развитию фиброзного и костного анкилозита (Ball, 1971; Khan, 1990).
Это заболевание диагностируется поздно, поскольку его симптомы часто ассоциируются с более часто встречающимися заболеваниями в области спины. Ранним признаком AS является потеря гибкости в поясничном отделе позвоночника. Другими распространенными симптомами являются хронические боли и скованность в области поясницы, которые обычно возникают в области соединения поясницы и таза, или в области ребер.
Хотя большинство симптомов возникают в поясничной и в крестцово-подвздошных областях, однако, они могут также наблюдаться и в области шеи и верхнего отдела позвоночника. Артрит может также возникать в области плеч, бедер и ступней. У некоторых пациентов наблюдается воспаление глаз, а в более тяжелых случаях может возникать поражение сердечного клапана.
Наиболее часто встречающимся проявлением являются боли в спине, но заболевание может начинаться атипически в периферических суставах, особенно у детей и у женщин, а в более редких случаях оно может сопровождаться острым иритом (передним увеитом). Другими ранними симптомами и признаками являются патологическое расширение грудной клетки в результате диффузного поражения реберно-позвоночного отдела, субфебрильная температура, усталость, анорексия, снижение массы тела и анемия. Возможными жалобами являются рецидивирующие боли в спине, часто возникающие ночью и варьирующиеся по своей интенсивности, поскольку утренняя скованность обычно сменяется активностью. Боли в спине и параспинальные мышечные спазмы облегчаются при согнутом или сгорбленном положении, а поэтому, при отсутствии лечения, у пациентов часто наблюдается определенная степень кифоза.
Системные проявления наблюдаются у 1/3 пациентов. Рецидивирующий, обычно самокупирующийся, острый ирит (передний увеит) является достаточно затяжным и тяжелым заболеванием и приводит к ухудшению зрения. Неврологические признаки могут иногда возникать из-за присоединившегося радикулита или ишалгии, перелома позвоночника или неполного вывиха и синдрома «конского хвоста» (который проявляется импотенцией, ночным недержанием мочи, слабым мочевым пузырем, ощущением прямой кишки и отсутствием ахиллова рефлекса). Сердечно-сосудистые проявления могут включать недостаточность клапана аорты, стенокардию, перикардит и аномалии, наблюдаемые на ЭКГ. Редко встречающимся легочным симптомом является фиброз верхней доли, который иногда сопровождается образованием полости, ошибочно принимаемой за туберкулез (TB), и может осложняться инфекцией, вызываемой Aspergillus.
AS характеризуется слабыми или умеренными вспышками активного спондилита, чередующимися с периодами почти или полностью неактивного воспаления. У большинства пациентов правильное лечение позволяет минимизировать или избежать потери трудоспособности и вернуться к полноценной жизни, несмотря на скованность в спине. Иногда, течение этого заболевания бывает тяжелым и прогрессирующим и приводит к явно выраженным деформациям, приводящим к потере трудоспособности. Для пациентов с неподдающимся лечению иритом, а в редких случаях у пациентов с вторичным амилоидозом, прогноз заболевания является плохим.
ESR и другие реагенты острой фазы заболевания (например, уровни C-реактивного белка и сывороточного Ig) являются слегка повышенными у большинства пациентов с активным AS. Тесты на ревматоидный фактор IgM и антиядерные антитела являются отрицательными. Тест на HLA-B27 является обычно положительным, но непостоянным и неспецифическим (для исключения AS, при диагностике этого заболевания, отрицательный тест является более полезным, чем положительный). Этот тест не является необходимым для пациентов с типичным заболеванием.
Диагноз должен быть подтвержден рентгенографическим анализом. Патологии, возникающие на самой ранней стадии (псевдорасширение в результате эрозии, склероза или последующего сужения субхондральной зоны), наблюдаются в крестцово-подвздошных суставах. Ранними изменениями в области позвоночника являются увеличение площади и деминерализация верхнего пояснично-позвоночного отдела, неоднородный кальциноз связок и сращение позвонков (синдесмофиты), наблюдающиеся в одном или в двух участках позвоночника. Классическая картина «бамбукового» позвоночника с явно выраженными синдесмофитами и диффузным параспинальным кальцинозом связок не является характерной для ранней диагностики; и такие изменения проявляются у небольшого числа пациентов за период, в среднем, 10 лет.
Тяжесть поражения суставов и тяжесть системных симптомов значительно варьирует у различных индивидуумов. Точный диагноз и правильное лечение на ранней стадии заболевания могут минимизировать продолжительность болей, длящихся годами, и нетрудоспособность.
Дискомфорт в суставах может быть устранен путем приема лекарственных средств. Лечение, проводимое по определенной схеме, обычно позволяет предотвращать, замедлять или исправлять деформации, и необходимо для психосоциальной адаптации и реабилитации. Для придания правильной осанки и улучшения двигательной функции суставов, ежедневные физические упражнения и другие вспомогательные меры (например, тренировка для улучения осанки, лечебная физкультура) являются жизненно необходимыми для укрепления групп мышц, которые действуют в направлении, препятствующем потенциальной деформации (то есть, для укрепления групп мышц-удлинителей, но не мышц-сгибателей). Чтение в лежачем положении и, таким образом, растягивание шеи может способствовать сохранению гибкости спины.
NSAID облегчают выполнение упражнений и применение других вспомогательных мер посредством снижения воспаления суставов, болей и мышечных спазмов. Было подтверждено, что NSAID являются эффективными для лечения АS, однако, при выборе лекарственного средства необходимо учитывать скорее его переносимость и токсичность, а не маргинальные измерения его эффективности. Пациенты должны пройти обследование на наличие возможных побочных реакций и должны быть предупреждены о возможности их появления. Ежедневная доза NSAID должна быть низкой насколько это возможно, однако, в активной фазе заболевания могут потребоваться максимальные дозы лекарственного средства, такого как индометацин. После снижения системных и суставных признаков активной фазы заболевания в течение нескольких месяцев, необходима отмена приема лекарственного средства, однако, это должно быть сделано постепенно. Несколько новых NSAID, называемых лекарственными средствами COX-2, благодаря их способности ингибировать циклооксигеназу-2, обладают такой же эффективностью, как и лекарственные средства, ингибирующие COX-1, но, при этом, с меньшим риском возникновения побочного действия на слизистую желудка и агрегации тромбоцитов.
Кортикостероиды находят ограниченное терапевтическое применение, поскольку их длительное использование ассоциируется с возникновением многих серьезных побочных эффектов, включая остеопороз ригидного позвоночника. При остром ирите местное применение кортикостероидов (и мидриатических средств) дает адекватный эффект; тогда как пероральное введение кортикостероидов показано в редких случаях. Внутрисуставные кортикостероиды могут оказывать благоприятное действие, особенно в том случае, когда более воспаленными являются лишь один или два периферических сустава, которые препятствуют выполнению физических упражнений и ухудшают возможность реабилитации.
Большинство лекарственных средств замедленного действия (ремиттирующих лекарственных средств) для лечения RA (например, золотосодержащие средства, называемые IM) либо еще не изучены, либо являются неэффективными для лечения AS. В этих целях может быть использован сульфасалазин, в частности, в случае поражения периферических суставов. Начальная доза может составлять 500 мг/день и через интервалы времени в 1 неделю может быть увеличена до 1 г и вводиться два раза в день (см. также «Ревматоидный артрит» в главе 50). Наиболее частым побочным эффектом является тошнота, которая имеет, в основном, центральное действие, а поэтому пациентами лучше переносятся таблетки с энтеросолюбильным покрытием. Может также оказаться эффективным снижение дозы.
Наркотические средства, другие сильные аналгетики и мышечные релаксанты не обладают противовоспалительными свойствами и должны назначаться для приема только в течение короткого промежутка времени в качестве вспомогательных лекарственных средств для снижения сильных болей в спине и спазмов. Лучевая терапия позвоночника, хотя и является эффективной, рекомендуется только как крайняя мера, поскольку она в десять раз повышает риск развития острого миелогенного лейкоза.
Реабилитационная терапия имеет важное значение. Хороший сон и прогулки вместе с физическими упражнениями для мышц брюшного пресса и упражнениями для укрепления мышц спины способствуют улучшению осанки. Эти упражнения помогают сохранить гибкость суставов. Дыхательная гимнастика повышает емкость легких, а плаванье служит в качестве ритмической гимнастики. Даже при оптимальном лечении, у некоторых людей развивается ригидность или «анкилоз» позвоночника, но все же такой позвоночник может сохранять свои функции, если ригидность ощущается в вертикальном положении. При этом решающее значение имеет поддерживающая терапия. AS влияет на продолжительность жизни, и люди, у которых наблюдается патологическая потеря осанки и потеря подвижности, часто не могут продолжать лечение.
B. Псориатический артрит
Псориаз представляет собой воспалительное и пролиферативное кожное заболевание, которым страдают 1,5-3% людей. Приблизительно у 20% пациентов с псориазом развивается характерная форма артрита, которая имеет несколько признаков (Gladman, 1992; Jones et al., 1994; Gladman et al., 1995). У некоторых индивидуумов сначала наблюдаются симптомы поражения суставов, однако, у большинства индивидуумов сначала появляется псориаз кожи. Примерно у одной трети пациентов наблюдается одновременное обострение кожного заболевания и заболевания суставов (Gladman et al., 1987), и при этом наблюдается топографическая взаимосвязь между поражениями ногтей и поражением дистальных суставов между фалангами (Jones et al., 1994; Wright, 1956). Хотя воспалительные процессы, которые ассоциируются с кожными болезнями, болезнями ногтей и заболеваниями суставов, остаются слабовыраженными, однако, они осложняют иммуно-опосредуемые патологии.
Псориатический артрит (PsA) представляет собой хроническую воспалительную артропатию, характеризующуюся наличием артрита и псориаза, и в 1964 году оно было классифицировано как патологическое состояние, отличающееся от ревматоидного артрита (RA) (Blumberg et al., 1964). Последующие исследования показали, что PsA имеет генетические, патогенные и клинические признаки, аналогичные признакам других спондилоартропатий (SpA), то есть он принадлежит к группе заболеваний, которые включают анкилозирующий спондилит, реактивный артрит и энтеропатический артрит (Wright, 1979). Следует отметить, что тот факт, что PsA принадлежит к группе SpA, недавно получил новое подтверждение по результатам исследования, которое продемонстрировало, что при этих заболеваниях, включая PsA, наблюдается обширный энтезит, который не наблюдается при RA (McGonagle et al., 1999; McGonagle et al., 1998). Более конкретно, было высказано предположение, что энтезит представляет собой один из самых ранних симптомов, наблюдаемых при SpA и приводящих к ремоделированию кости и к анкилозу позвоночника, а также к синовиту суставов, в том случае, если воспаленный энтез находится рядом с периферическими суставами. Однако взаимосвязь между энтезитом и клиническими проявлениями PsA, в основном, остается неясной, поскольку при PsA могут наблюдаться едва заметные гетерогенные признаки воспаления суставов с различной степенью тяжести (Marsal et al., 1999; Salvarani et al., 1998). Таким образом, другие факторы должны быть оценены с учетом различных признаков PsA, лишь немногие из которых были идентифицированы (такие как экспрессия молекулы HLA-B27, которая в значительной степени ассоциируется с заболеванием позвоночника). А поэтому, идентификация проявлений заболевания, соответствующих конкретным механизмам патогенеза, представляет определенные трудности, а это означает, что лечение такого состояния остается, главным образом, эмпирическим.
Изучение семейного анамнеза позволяет предположить о генетическом вкладе в развитие PsA (Moll & Wright, 1973). Считается, что другие хронические воспалительные формы артрита, такие как анкилозирующий спондилит и ревматоидный артрит, имеет сложную генетическую природу. Однако генетический компонент PsA трудно поддается оценке по ряду причин. Имеются очевидные данные о генетической предрасположенности к самому псориазу, которая может маскировать генетические факторы, играющие важную роль в развитии PsA. Хотя большинство специалистов приписывают PsA к отдельной группе заболеваний, однако, при этом существует мнение о его фенотипическом перекрывании с ревматоидным артритом и анкилозирующим спондилитом. Кроме того, сам PsA не является гомогенным состоянием и, как предполагается, он может быть подразделен на различные подгруппы. И хотя не все эти сопутствующие факторы были идентифицированы в современных исследованиях, однако авторы настоящего изобретения сконцентрировали свое внимание на исследовании генов-кандидатов у трех широких категорий пациентов с PsA, которые представляют весь спектр данного заболевания.
Полиморфизм в промоторной области TNF-α представляет особый интерес, поскольку он может влиять на уровни секреции TNF-α (Jacob et al., 1990; Bendzen et al., 1988). В литературе имеются сообщения о присутствии повышенных количеств TNF-α в коже, пораженной псориазом (Ettehadi et al., 1994), и в синовиальной жидкости (Partsch et al., 1997).
Недавно проведенные испытания указывали на положительный эффект лечения PsA (Mease et al., 2000) и анкилозирующего спондилита (Brandt et al., 2000) анти-TNF антителами. Кроме того, локус для TNF-α остается в области МНС класса III, а поэтому можно говорить о более тесной взаимосвязи PsA с этой областью, чем с фланкирующими областями класса I и класса II. Причем у всех групп пациентов с PsA согласно изобретению наблюдалась относительно слабая взаимосвязь с аллелями TNF-α. Частота встречаемости редкого аллеля TNF-α-238А была выше у группы пациентов с периферическим полиартритом, а у пациентов со спондилитом такой аллель отсутствовал, хотя это можно объяснить неравновесием по сцеплению HLA-Cw*0602. При этом неясно, ассоциируются ли функциональные осложнения с полиморфизмом в аллеле TNF-α-238А или нет (Pociot et al., 1995). Тем не менее, возможно, что характер артрита, который развивается у пациентов с псориазом, может быть прямо или опосредованно ассоциирован с этим конкретным аллелем.
Hohler et al. (1997) обнаружили увеличение частоты встречаемости аллеля TNF-α-238А у пациентов с PsA, а также у юношей, у которых наблюдается начальная стадия развития псориаза. Взаимосвязь аллеля TNF-α-238А с началом развития псориаза и PsA у юношей была более высокой, чем взаимосвязь этих заболеваний с HLA-Cw6. Аналогичным образом, в исследовании, проведенном авторами настоящего изобретения, была обнаружена тесная взаимосвязь между развитием юношеского псориаза и наличием обоих аллелей HLA-Cw*0602 и TNF-α-238А, хотя, в данном случае, какая-либо взаимосвязь между наличием этих аллелей и возрастом, в котором происходит развитие псориаза, не наблюдалась. В исследованиях, проведенных авторами настоящего изобретения, все пациенты с PsA, которые имели по меньшей мере один аллель TNF-α-238А, были HLA-Cw6-позитивными, что еще раз подчеркивает тесную взаимосвязь между этими аллелями при PsA. Однако в противоположность исследованиям, которые были проведены Hohler и сотрудниками (1997), и которые объясняют тесное сцепление с аллелем HLA-Cw*0602, встречаемость аллеля TNF-α-238А была повышенной у пациентов с периферическим артритом. Также интересно отметить, что в отдельном исследовании анкилозирующего спондилита, у той же самой группы, у которой были обнаружены редкие аллели TNF-α-308А и -238А, наблюдался протективный эффект в отношении развития спондилита (Hohler et al., 1998).
C. Реактивный артрит
При реактивном артрите (ReA), механизм поражения суставов пока неясен, но возможно, что решающую роль в таком поражении играют цитокины. Как сообщалось в литературе, преобладающим профилем Th1 являются высокие уровни интерферона-гамма (IFN-γ) и низкие уровни интерлейкина-4 (IL-4) (Lahesmaa et al., 1992; Schlaak et al., 1992; Simon et al., 1993; Schlaak et al., 1996; Kotake et al., 1999; Ribbens et al., 2000), но некоторые исследования показали, что у пациентов с реактивным артритом по сравнению с пациентами, страдающим ревматоидным артритом (RA), наблюдается относительное преобладание IL-4 и IL-10 и относительно низкий уровень IFN-γ и фактора некроза опухоли альфа (TNF-α) в синовиальной оболочке (Simon et al., 1994; Yin et al., 1999) и в синовиальной жидкости (СЖ) (Yin et al., 1999; Yin et al., 1997). Также сообщалось, что у пациентов с реактивным артритом, по сравнению с пациентами с RA, наблюдается более низкий уровень секреции TNF-α после ex vivo стимуляции мононуклеарных клеток периферической крови (PBMS) (Braun et al., 1999).
Было подтверждено, что для клиренса бактерий, ассоциированных с реактивным артритом, требуется продуцирование соответствующих уровней IFN-γ и TNF-α, тогда как IL-10 действует по механизму подавления этих ответов (Autenrieth et al., 1994; Sieper & Braun, 1995). IL-10 представляет собой регуляторный цитокин, который ингибирует синтез IL-12 и IFN-γ, активированный макрофагами (de Waal et al., 1991; Hart et al., 1995; Chomarat et al., 1995), и синтез IFN-γ, активированный T-клетками (Macatonia et al., 1993).
D. Энтеропатический артрит
Энтеропатический артрит (EA) развивается вместе воспалительным заболеванием кишечника (IBD), таким как болезнь Крона или язвенный колит. Он также негативно влияет на суставы позвоночника и суставы крестцово-подвздошной области. Энтеропатический артрит поражает периферические суставы, а обычно, нижние конечности, такие как колени или лодыжки. Энтеропатический артрит обычно поражает только несколько или ограниченное число суставов и может сопутствовать заболеванию кишечника. Это наблюдается приблизительно у 11% пациентов с язвенным колитом и у 21% пациентов с болезнью Крона. Синовит обычно является самокупирующимся и недеформирующим.
Энтеропатические артропатии включают ряд ревматологических состояний, которые ассоциируются с патологиями ЖКТ. Такими состояниями являются реактивный (то есть, ассоциированный с инфекцией) артрит, вызываемый бактериями (например, Shigella, Salmonella, Campylobacter, видами Yersinia, Clostridium difficile), паразитами (например, Strongyloides stercoralis, Taenia saginata, Giardia lamblia, Ascaris lumbricoides, видами Cryptosporidium), и спондилоартропатии, ассоциированные с воспалительными заболеваниями кишечника (IBD). Другими состояниями и расстройствами являются подвздошно-тощекишечный обходной анастомоз (на тощей кишке), артриты, глютеновая болезнь, болезнь Уиппла и коллагенозный колит.
Этиология энтеропатических артропатий пока неясна. Воспаление желудочно-кишечного тракта может приводить к повышению его проницаемости и, тем самым, к абсорбции антигенного материала, включая бактериальные антигены. Эти артрогенные антигены могут затем локализоваться в скелетно-мышечных тканях (включая энтезис и синовий), что может приводить к вырабатыванию воспалительного ответа. Альтернативно, аутоиммунный ответ может индуцироваться посредством молекулярной мимикрии, при которой факторы, продуцирующиеся в результате иммунного ответа хозяина на эти антигены, перекрестно реагируют с аутоантигенами в синовии.
Особый интерес представляет тесная взаимосвязь между реактивным артритом и HLA-B27, то есть молекулой HLA класса I. Потенциально артрогенный и происходящий от бактерий антигенный пептид может входить в антигенпрезентирующую бороздку молекулы B27, что приводит к вырабатыванию CD8+-Т-клеточного ответа. У HLA-B27-трансгенных крыс развиваются признаки энтеропатической артропатии, ассоциированной с артритом и воспалением кишечника.
E. Язвенный колит
Язвенный колит представляет собой заболевание, вызывающее воспаление и повреждение тканей, называемые язвами, в выстилке толстого кишечника. Воспаление обычно возникает в прямой кишке и в нижнем отделе толстой кишки, но может также поражаться вся толстая кишка. Язвенный колит редко поражает тонкий кишечник, за исключением ее конечного участка, называемого терминальным отделом подвздошной кишки. Язвенный колит может также называться колитом или проктитом. Воспаление кишечника приводит к его частому опорожнению, называемому диареей. Язвы обычно образуются на участках, где воспаление приводит к уничтожению клеток, выстилающих толстую кишку, а поэтому язвы кровоточат и образуют гной.
Язвенный колит представляет собой воспалительное заболевание кишечника (IBD), которое является общим названием заболеваний, вызывающих воспаление тонкой и толстой кишки. Язвенный колит трудно диагностируется, поскольку его симптомы совпадают с симптомами других расстройств кишечника и IBD другого типа, например, болезни Крона. Болезнь Крона отличается от язвенного колита тем, что она вызывает воспаление в более глубоком отделе стенок тонкой кишки. Кроме того, болезнь Крона обычно наблюдается в тонком кишечнике, хотя она может также поражать ротовую полость, пищевод, желудок, двенадцатиперстную кишку, толстый кишечник, аппендикс и задний проход.
Язвенный колит может наблюдаться у людей любого возраста, но преимущественно, он встречается у людей в возрасте от 15 до 30 лет или, но менее часто, в возрасте от 50 до 70 лет. Такое заболевание иногда развивается у детей и юношей. Язвенный колит в равной степени поражает мужчин и женщин и часто наблюдается у членов одной и той же семьи. Существует множество теорий о причинах возникновения язвенного колита, но ни одна из них не нашла своего подтверждения. Самая распространенная гипотеза состоит в том, что иммунная система организма реагирует на вирус или бактерию путем индуцирования воспалительной реакции в стенках тонкого кишечника. У людей с язвенным колитом наблюдаются патологии иммунной системы, но врачи не знают, являются ли такие патологии причиной или следствием. Язвенный колит не вызывается эмоциональным дистрессом или чувствительностью к пище или к некоторым пищевым продуктам, но у некоторых людей эти факторы могут инициировать развитие таких симптомов.
Наиболее распространенными симптомами язвенного колита являются боли в брюшной полости и кровянистая диарея. Пациенты могут также ощущать усталость, и у них может наблюдаться похудание, потеря аппетита, кровотечение из прямой кишки, потеря физиологических жидкостей и снижение уровня микроэлементов. Почти у половины пациентов эти симптомы слабо выражены. У других пациентов часто наблюдается повышенная температура, кровянистая диарея, тошнота и сильные судороги в брюшной полости. Язвенный колит может также вызывать такие заболевания, как артрит, воспаление глаз, болезнь печени (гепатит, цирроз и первичный склерозирующий холангит), остеопороз, покраснение кожи и анемия. Однако никто не может с уверенностью сказать, почему указанные осложнения возникают на участках, расположенных далеко за пределами толстой кишки. Ученые считают, что такие осложнения могут возникать в том случае, когда иммунная система индуцирует воспаление в других частях организма. Некоторые из этих осложнений исчезают при излечивании колита.
Для диагностики язвенного колита может потребоваться тщательное физическое обследование и проведение ряда анализов. С помощью анализа крови можно выявить анемию, которая часто указывает на наличие кровотечения в толстой или в прямой кишке. С помощью анализа крови можно также выявить большое число лейкоцитов в крови, что является признаком воспалительного процесса в каком-либо участке организма. Путем анализа кала, врач может установить наличие кровотечения или инфицирования в толстой или прямой кишке. Врач может провести колоноскопию или сигмоидоскопию. Для проведения любого теста, врач вставляет эндоскоп, то есть длинную гибкую и освещаемую трубку, соединенную с компьютером и ТВ-монитором, в анальное отверстие для осмотра внутренней части толстой и прямой кишки. Таким образом, врач может увидеть любое воспаление, кровотечение или язвы на стенках толстой кишки. Во время обследования врач может сделать биопсию, которая заключается во взятии образца ткани из выстилки толстой кишки для его последующего наблюдения под микроскопом. При этом может также потребоваться рентгенография толстой кишки с использованием бариевой клизмы. Эта процедура заключается в заполнении толстой кишки барием, белым меловым раствором. Барий дает белый цвет на рентгеновской пленке, что позволяет врачу получить ясную картину толстой кишки, включая наличие каких-либо язв или других патологий, которые могут присутствовать в толстой кишке.
Успех лечения язвенного колита зависит от тяжести заболевания. Большинству людей назначают медикаментозное лечение. В тяжелых случаях пациенту может быть проведена хирургическая операция по удалению пораженной толстой кишки. Хирургическая операция является единственным средством лечения язвенного колита. У некоторых людей, у которых появление симптомов вызывается приемом пищи определенного типа, эти симптомы могут быть устранены путем отказа от приема пищи, которая негативно воздействует на тонкий кишечник, а именно, исключительно сезонной пищи, сырых фруктов и овощей или молочного сахара (лактозы). У людей могут наблюдаться различные симптомы язвенного колита, а поэтому лечение каждого человека должно быть индивидуальным. Важную роль играют эмоциональные и психологические факторы. У некоторых людей наблюдаются ремиссии, то есть периоды исчезновения симптомов, продолжающиеся в течение нескольких месяцев или даже лет. Однако у большинства пациентов такие симптомы возникают снова. При изменении картины заболевания не всегда можно сказать, помогло данное лечение или нет. Некоторым людям с язвенным колитом может быть проведено медикаментозное лечение в течение определенного периода времени, при этом врач должен регулярно навещать больного для наблюдения за его состоянием.
Целью терапии является индуцирование и поддержание состояния пациента в период ремиссии, а также улучшение качества жизни людей, страдающих язвенным колитом. При этом могут применяться лекарственные средства нескольких типов:
- Аминосалицилаты - лекарственные средства, которые содержат 5-аминосалициловую кислоту (5-ASA) и ослабляют воспаление. Сульфасалазин представляет собой комбинацию сульфапиридина и 5-ASA и применяется для индуцирования и поддержания ремиссии. Компонент сульфапиридин обеспечивает доставку противовоспалительного 5-ASA в тонкий кишечник. Однако сульфапиридин может вызывать побочные эффекты, такие как тошнота, рвота, изжога, диарея и головная боль. Другие 5-ASA-содержащие агенты, такие как олсалазин, мезаламин и балсалазид, имеют различные носители, дают более слабые побочные эффекты и могут назначаться людям, которые не могут принимать сульфасалазин. 5-ASA принимают перорально, либо вводят через клизму или в виде суппозиториев, в зависимости от участка воспаления толстой кишки. Лечение этими лекарственными средствами первого ряда назначают большинству людей с язвенным колитом слабой или умеренной тяжести.
- Контикостероиды, такие как преднизон и гидрокортизон, также снижают степень воспаления. Эти средства могут быть назначены людям, страдающим умеренным или тяжелым язвенным колитом, или людям, у которых не вырабатывается ответ на лечение лекарственными средствами 5-ASA. Кортикостероиды, также известные как стероиды, могут быть введены перорально, внутривенно, через клизму или в виде суппозиториев, в зависимости от участка воспаления. Такие лекарственные средства могут вызвать побочные эффекты, такие как увеличение массы тела, акнэ, появление волос на лице, гипертензия, изменение настроения и повышенный риск инфекционного заражения. По этой причине они не рекомендуются для длительного применения.
- Иммуномодуляторы, такие как азатиоприн и 6-меркаптопурин (6-MP), способствуют ослаблению воспаления посредством их воздействия на иммунную систему. Они могут быть назначены пациентам, у которых не вырабатывается ответ на 5-ASA или на кортикостероиды, или пациентам, у которых вырабатывается зависимость от кортикостероидов. Однако иммуномодуляторы обладают медленным действием, и может пройти 6 месяцев до получения нужного эффекта. Пациентов, принимающих такие лекарственные средства, обследуют на наличие осложнений, включая панкреатит и гепатит, на снижение числа лейкоцитов и на повышенный риск инфекционного заражения. Циклоспорин А может быть использован в комбинации с 6-MP или с азатиоприном для лечения активного тяжелого язвенного колита у людей, у которых не вырабатывается ответ на внутривенно вводимые кортикостероиды.
Для снятия напряжения у пациента или для ослабления болей, снижения степени диареи или устранения инфекций, этому пациенту могут быть назначены и другие лекарственные средства.
В некоторых случаях, когда симптомы являются достаточно тяжелыми, пациент должен быть госпитализирован. Так, например, у индивидуума может наблюдаться сильное кровотечение или сильная диарея, которые могут вызывать обезвоживание. В таких случаях врач может попытаться устранить диарею, а также потерю крови, физиологической жидкости и минеральных солей. Данный пациент может нуждаться в специальной диете, во введении питательных веществ через вену, в медикаментозном лечении, а иногда, в хирургической операции.
Примерно 25-40% пациентов с язвенным колитом должны быть, в конечном счете, подвергнуты удалению толстой кишки по причине сильного кровотечения, тяжести состояния, разрыва толстой кишки или риска развития рака. Иногда врач может рекомендовать удаление толстой кишки в случае, если медикаментозное лечение не дает результатов, или если побочные эффекты, вызываемые кортикостероидами или другими лекарственными средствами, представляют угрозу для здоровья пациента. Хирургическую операцию по удалению толстой и прямой кишки, известную как проктоколэктомия, проводят в соответствии с одной из нижеследующих процедур:
- Илеостомия, при которой хирург создает небольшое отверстие в брюшной полости, называемое стомой, и подсоединяет к нему конец тонкого кишечника, называемого подвздошной кишкой. Экскременты будут проходить через тонкую кишку и выходить из организма через стому. Эта стома имеет примерно размер монеты в 25 центов и обычно локализована в нижней правой части брюшины возле талии. Поверх этого отверстия надевают мешочек для сбора экскрементов, который опустошается самим пациентом по мере необходимости.
- Илеоанальный анастомоз или операция низведения подвздошной кишки, которая позволяет сохранить нормальную перистальтику кишечника у пациента благодаря сохранению у него части заднего прохода. При этой операции хирург удаляет пораженную часть толстой кишки и внутреннюю часть прямой кишки, но оставляет внешние мышцы прямой кишки. Затем хирург соединяет подвздошную кишку с внутренней частью прямой кишки и заднего прохода с созданием кармана. Экскременты собираются в этом кармане и проходят через задний проход обычным способом. Выделения из кишечника могут быть более частыми и более водянистыми, чем это наблюдалось до операции. Возможным осложнением может быть воспаление кармана (pouchitis).
Не каждая операция может быть показана любому пациенту. Выбор хирургической операции зависит от тяжести заболевания и от потребностей пациента, прогноза и стиля жизни пациента. Люди, решающиеся на такую операцию, должны получить как можно больше информации от своего лечащего врача, от медсестер, ухаживающих за пациентами после хирургической операции по удалению толстой кишки (специалистов по энтеростомии), и от других пациентов, подвергавшихся такой хирургической операции. Организация по защите интересов пациентов может направить данного пациента в группу поддержки и обеспечить ему доступ к другим источникам информации.
Большинство пациентов с язвенным колитом не нуждаются в хирургической операции. Однако, если такая операция все же необходима, то некоторые люди находят утешение в уверенности в том, что после проведения хирургической операции они смогут излечиться от колита и вернуться к нормальной активной жизни.
F. Болезнь Крона
Другим расстройством, для лечения которого требуется подавление иммунной системы, является болезнь Крона. Симптомами болезни Крона является воспаление тонкого кишечника, развитие стеноза тонкого кишечника и появление свищей, а также невропатия, которая часто сопровождается этими симптомами. В таких случаях обычно назначают противовоспалительные лекарственные средства, такие как 5-аминосалицилаты (например, мезаламин) или кортикостероиды, но такие средства не всегда являются эффективными (см. публикацию Botoman et al., 1998). Подавление иммунной системы под действием циклоспорина иногда может иногда давать благоприятный эффект у пациентов, у которых наблюдается резистентность или невосприимчивость к кортикостероидам (Brynskov et al., 1989).
Тем не менее, в конечном счете, 90% пациентам назначают соответствующую хирургическую операцию, а 50% пациентов назначают операцию по резекции толстой кишки (Leiper et al., 1998; Makowiec et al., 1998). После операции часто возникают рецидивы, причем 50% пациентов также нуждаются в повторном проведении операции через 5 лет (Leiper et al., 1998; Besnard et al., 1998).
Одной из гипотез относительно этиологии болезни Крона является недостаточность барьерного слоя слизистой тонкой кишки, которая возникает, возможно, из-за генетической нагрузки и внешних факторов (например, курения); и недостаточность воздействия иммунной системы на антигены, присутствующие в просвете тонкого кишечника, включая бактериальные и пищевые антигены (например, Soderholm et al., 1999; Hollander et al., 1986; Hollander, 1992). Другая гипотеза заключается в том, что персистентное инфицирование тонкого кишечника патогенами, такими как Mycobacterium paratuberculosis, Listeria monocytogenes, модифицированная Escherichia coli или парамиксовирус, стимулирует иммунный ответ; или альтернативно, симптомы этого заболевания возникают в результате нарушения регуляции иммунного ответа на повсеместно встречающиеся антигены, такие как обычная микрофлора тонкого кишечника, а также метаболиты и токсины, которые она продуцирует (Sartor, 1997). Было обнаружено, что присутствие в сыворотке антител, а именно, IgA и IgG, направленных против Saccharomyces cerevisiae (ASCA), позволяет с высокой степенью вероятности диагностировать болезнь Крона у детей (Ruemmele et al., 1998; Hoffenberg et al., 1999).
При болезни Крона нарушение регуляции иммунного ответа смещается в сторону клеточно-опосредуемой иммунной патологии (Murch, 1998). Однако применение иммунодепрессантов, таких как циклоспорин, такролимус и мезаламин для лечения случаев резистентной к кортикостероидам болезни Крона, не всегда давало успех (Brynskov et al., 1989; Fellerman et al., 1998).
Предпринятые недавно усилия по разработке диагностических и терапевтических средств для лечения болезни Крона были сосредоточены на центральной роли цитокинов в развитии такого заболевания (Schreiber, 1998; van Hogezand & Verspaget, 1998). Цитокины представляют собой небольшие секретируемые белки или факторы (5-20 кДа), которые обладают специфическим действием на межклеточные взаимодействия, внутриклеточные взаимодействия или на поведение других клеток. Цитокины продуцируются лимфоцитами, а в частности, TH1- и TH2-лимфоцитами, моноцитами, макрофагами тонкого кишечника, гранулоцитами, эпителиальными клетками и фибробластами (см. обзор Rogler & Andus, 1998; Galley & Webster, 1996). Некоторые цитокины обладают провоспалительным действием (например, TNF-α, IL-1(α и β), IL-6, IL-8, IL-12 или лейкоз-ингибирующий фактор или LIF); а другие цитокины обладают противовоспалительным действием (например, антагонист рецептора IL-1, IL-4, IL-10, IL-11 и TGF-β). Однако, при некоторых воспалительных состояниях, действие этих цитокинов может быть перекрывающимся и функционально избыточным.
При активных формах болезни Крона, повышенные концентрации TNF-α и IL-6 секретируются в кровоток, а TNF-α, IL-1, IL-6 и IL-8 продуцируются локально в избыточном количестве клетками слизистой оболочки (id.; Funakoshi et al., 1998). Такие цитокины могут обладать очень широким спектром действия на физиологические системы, включая остеогенез, гемопоэз, а также функции печени, щитовидной железы и нейропсихические функции. Кроме того, у пациентов с болезнью Крона наблюдается дисбаланс отношений IL-lβ/IL-lra в пользу провоспалительных цитокинов IL-lβ (см. Rogler & Andus, 1998; Saiki et al., 1998; Dionne et al., 1998; Kuboyama, 1998). Одно из проведенных исследований позволяет предположить, что профили цитокинов в образцах кала могут служить ценным диагностическим средством для лечения болезни Крона (Saiki et al., 1998).
Предложенным методом лечения болезни Крона является применение различных антагонистов цитокинов (например, IL-1ra), ингибиторов (например, IL-lβ-конвертирующих ферментов и антиоксидантов) и антител против цитокинов (Rogler and Andus, 1998; van Hogezand & Verspaget, 1998; Reimund et al., 1998; Lugering et al., 1998; McAlindon et al., 1998). В частности, определенный успех в лечении болезни Крона был достигнут при применении моноклональных антител против TNF-α (Targan et al., 1997; Stack et al., 1997; van Dullemen et al., 1995).
Другой подход к разработке способа лечения болезни Крона был сконцентрирован по меньшей мере на частичном удалении бактериального сообщества, которое может стимулировать воспалительный ответ, и на замене такого сообщества сообществом непатогенных бактерий. Так, например, в патенте США 5599795 описан способ предупреждения и лечения пациентов с болезнью Крона. Этот способ направлен на стерилизацию кишечного тракта по меньшей мере одним антибиотиком и по меньшей мере одним противогрибковым средством в целях уничтожения имеющейся флоры и ее замены другими выбранными и хорошо охарактеризованными бактериями, взятыми у здоровых людей. В публикации Borody описан метод лечения болезни Крона путем по меньшей мере частичного удаления существующей микрофлоры тонкого кишечника посредством лаважа и замены имеющейся микрофлоры новым бактериальным сообществом, вводимым с использованием фекального инокулята, взятого у донора, обследованного на наличие заболевания, или с использованием композиции, содержащей Bacteroides и некоторые виды Escherichia coli (патент США 5443826). Однако причина возникновения болезни Крона, которая должна быть диагностирована и подвергнута лечению, пока не ясна.
G. Ревматоидный артрит
Этиология RA пока точно не известна, и первые признаки поражения суставов появляются в синовий-выстилающем слое, где происходит пролиферация синовиальных фибробластов и их присоединение к поверхности сустава в его краевой части (Lipsky, 1998). Впоследствии, макрофаги, Т-клетки и другие воспалительные клетки мигрируют в сустав, где они продуцируют ряд медиаторов, включая цитокины, такие как интерлейкин-1 (IL-1), которые вносят свой вклад в хронические осложнения, приводящие к деструкции кости и хряща; и фактор некроза опухоли (TNF-α), который играет определенную роль в воспалении (Dinarello, 1998; Arend & Dayer, 1995; van den Berg, 2001). У пациентов с RA, концентрации IL-1 в плазме значительно выше, чем у здоровых индивидуумов, а это указывает на то, что уровни IL-1 в плазме коррелируют с активностью RA (Eastgate et al., 1988). Кроме того, уровни IL-1 в синовиальной жидкости коррелируют с различными радиографическими и гистологическими признаками RA (Kahle et al., 1992; Rooney et al., 1990).
В нормальных суставах действие этих и других провоспалительных цитокинов уравновешивается действием различных противовоспалительных цитокинов и регуляторных факторов (Burger & Dayer, 1995). Важное значение такого баланса цитокинов становится очевидным на примере пациентов с юношеским RA, у которых наблюдается периодическое повышение температуры в течение одного дня (Prieur et al., 1987). После каждого пика повышения температуры, в сыворотке и в моче этих пациентов обнаруживается фактор, блокирующий действие IL-1. Этот фактор был выделен, клонирован и идентифицирован как антагонист рецептора IL-1 (IL-lra), то есть член семейства генов IL-1 (Hannum et al., 1990). IL-lra, в соответствии со своим названием, представляет собой природный антагонист рецептора, который конкурирует с IL-1 за связывание с рецепторами IL-1 типа 1, что приводит к блокированию действия IL-1 (Arend et al., 1998). 10-100-кратный избыток IL-1ra может оказаться необходимым для эффективного блокирования IL-1, однако синовиальные клетки, выделенные у пациентов с RA, не продуцируют IL-lra в количестве, достаточном для блокирования действия IL-1 (Firestein et al., 1994; Fujikawa et al., 1995).
H. Системная красная волчанка
Этиология аутоиммунных заболеваний, таких как системная красная волчанка пока также не ясна. Системная красная волчанка (SLE) представляет собой аутоиммунное ревматическое заболевание, характеризующееся отложением в тканях аутоантител и иммунных комплексов, приводящих к поражению ткани (Kotzin, 1996). В отличие от аутоиммунных заболеваний, таких как MS и сахарный диабет типа 1, SLE может непосредственно поражать множество системных органов, а ее клинические проявления являются разнообразными и изменчивыми (см. обзор Kotzin & O'Dell, 1995). Так, например, у некоторых пациентов может наблюдаться, главным образом, покраснение кожи и боль в суставах, при этом могут возникать спонтанные ремиссии, при которых требуется лишь незначительное медикаментозное лечение. В других крайних случаях широкого спектра этого заболевания, у пациентов наблюдается тяжелое и прогрессирующее поражение почек, которое требует проведение лечения высокими дозами стероидов и цитотоксических лекарственных средств, таких как циклофосфамид (Kotzin, 1996).
Серологическим признаком SLE и первичным диагностически доступным критерием является повышение сывороточных уровней антител IgG против компонентов клеточного ядра, таких как двухцепочечная ДНК (дцДНК), одноцепочечная ДНК (оцДНК) и хроматин. Из этих аутоантител антитела IgG против дцДНК играют главную роль в развитии волчаночного гломерулонефрита (GN) (Hahn & Tsao, 1993; Ohnishi et al., 1994). Гломерулонефрит представляет собой тяжелое состояние, при котором капиллярные стенки клеток почечной крови, очищающие клубочки, становятся утолщенными в результате разрастания со стороны эпителия гломерулярной базальной мембраны. Такое заболевание часто является хроническим и прогрессирующим и, в конечном счете, может приводить к почечной недостаточности.
Механизм, посредством которого индуцируются аутоантитела при этих аутоиммунных заболеваниях, остается пока неясным. Если причина системной красной волчанки (SLE), которая должна быть диагностирована и/или подвергнута лечению, не известна, то лечение может быть направлено лишь на подавление иммунных ответов, например, с использованием макролидных антибиотиков, а не на причину, лежащую в основе этого заболевания (см., например, патент США 4843092).
I. Синдром раздраженного кишечника
Синдром раздраженного кишечника (IBS) представляет собой функциональное расстройство, характеризующееся болями в области брюшины и нарушением работы кишечника. Этот синдром может проявляться в молодости и может ассоциироваться со значительным снижением работоспособности. Такой синдром не является однородным расстройством. Точнее, существуют подтипы IBS, которые были описаны по их преобладающим симптомам: диареи, запорам или болям. При отсутствии «тревожных» симптомов, таких как повышенная температура, похудание и кровотечение в области желудочно-кишечного тракта, необходимо ограниченное обследование больного. После установления диагноза IBS может быть назначено комплексное лечение, которое может эффективно ослаблять тяжесть симптомов. IBS представляет собой широко распространенное расстройство, хотя частота его возникновения варьирует. В общих чертах, в США заболеванием IBS страдает примерно 15% взрослого населения, и у женщин такое заболевание возникает примерно в три раза чаще, чем у мужчин (Jailwala et al., 2000).
Каждый год врачами регистрируется от 2,4 миллиона до 3,5 миллионов визитов к врачу пациентов с IBS. Это заболевание является не только самым распространенным состоянием, регистрируемым гастроэнтерологами, но также одним из самых распространенных желудочно-кишечных заболеваний, регистрируемых врачами общей практики (Everhart et al., 1991; Sandler, 1990).
IBS также представляет собой расстройство, приносящее значительные экономические убытки. По сравнению с индивидуумами, у которых отсутствуют симптомы расстройства кишечника, индивидуумы с IBS имеют в три раза меньше рабочих дней и, по имеющимся данным, часто не в состоянии работать. (Drossman et al., 1993; Drossman et al., 1997). Кроме того, пациенты с IBS расходуют на медикаменты на сотни долларов больше, чем индивидуумы, не страдающие расстройствами кишечника (Talley et al., 1995).
У пациентов с IBS не наблюдается каких-либо конкретных патологий, связанных с обострениями, проявляющимися абдоминальными болями и нарушениями дефекации, и последующими ремиссиями. Была высказана теория, которая позволяет предположить, что в основе IBS лежит нарушение регуляции оси «головной мозг-кишечник» на различных уровнях. Такое заболевание осложняется нарушением моторики, висцеральной гиперчувствительностью, аномальной модуляцией центральной нервной системы (ЦНС) и инфекцией. Кроме того, важную модицифирующую роль играют психосоциальные факторы. Нарушение моторики тонкого кишечника долгое время рассматривалось как фактор, участвующий в патогенезе IBS. Было показано, что у пациентов с IBS, при котором преобладает диарея, время прохождения пищи через тонкий кишечник после ее употребления меньше, чем у пациентов, у которых преобладают запоры или боли (Cann et al., 1983).
Обследование тонкого кишечника в период голодания показало, что у пациентов с IBS наблюдаются дискретные групповые сокращения и пролонгированные интенсивные сокращения кишечника (Kellow & Phillips, 1987). У таких пациентов чаще возникают боли, связанные с нерегулярными сокращениями, чем у здоровых индивидуумов (Kellow & Phillips, 1987; Horwitz & Fisher, 2001)
Такие нарушения моторики не являются составляющими полного комплекса симптомов у пациентов с IBS, и у большинства таких пациентов, фактически, не наблюдается рассматриваемых патологий (Rothstein, 2000). Пациенты с IBS обладают повышенной чувствительностью к висцеральной боли. Исследования, включающие баллонное расширение ректосигмовидной толстой кишки, показали, что у пациентов с IBS боли и метеоризм, при увеличении давления и объема, были гораздо ниже, чем у контрольных индивидуумов (Whitehead et al., 1990). У таких пациентов сохраняется обычное ощущение соматических раздражителей.
Для объяснения этого феномена было предложено множество теорий. Так, например, рецепторы во внутренних органах могут иметь повышенную чувствительность в ответ на расширение или на содержимое внутреннего просвета органа. Нейроны в заднем роге спинного мозга могут иметь повышенную возбудимость. Кроме того, могут возникать изменения в ЦНС, ответственной за вырабатывание определенны ощущений (Drossman et al., 1997). Функциональные исследования, проводимые недавно путем визуализации методом магнитного резонанса, показали, что у пациентов с IBS, по сравнению с контрольными индивидуумами, наблюдается повышение активации коры головного мозга в области переднего пояса, то есть важного болевого центра, в ответ на болезненные раздражители прямой кишки (Mertz et al., 2000).
Появляется все больше данных, которые позволяют предположить о наличии взаимосвязи между инфекционным энтеритом и последующим развитием IBS. Определенную роль в этом процессе могут играть воспалительные цитокины. При обследовании пациентов, в анамнезе которых имеется подтвержденный бактериальный гастроэнтерит (Neal et al., 1997), было выявлено, что у 25% пациентов наблюдается персистентное нарушение дефекации. Персистентность этих симптомов может быть обусловлена психологическим стрессом во время острой инфекции (Gwee et al., 1999).
Недавно полученные данные позволяют предположить, что избыточное размножение бактерий в тонком кишечнике может играть определенную роль в развитии симптомов IBS. В одном из исследований (Pimentel et al., 2000), 157 человек (78%) из 202 пациентов с IBS, которым был проведен тест на поглощение водорода, обнаруживали положительный результат на размножение бактерий. Из 47 индивидуумов, которым было проведено общее обследование, 25 человек (53%) обнаруживали ослабление симптомов (то есть, ослабление абдоминальных болей и диареи) после лечения антибиотиками.
IBS может проявляться рядом симптомов. Однако абдоминальные боли и нарушение дефекации остаются главными признаками IBS. Дискомфорт в области брюшины часто описывается, фактически как судороги, и ощущается в левом нижнем квадранте брюшины, хотя тяжесть и локализация такого ощущения могут сильно варьировать. У пациентов может наблюдаться диарея, запор или чередующиеся эпизоды диареи и запора. Диарея обычно описывается как необильный жидкий стул, который иногда сопровождается выделением слизи. Пациент может также жаловаться на вздутие живота, частые позывы к дефекации, неполное опорожнение кишечника и метеоризм. Могут также наблюдаться симптомы в верхнем отделе желудочно-кишечного тракта, такие как гастроэзофагальный рефлюкс, диспепсия или тошнота (Lynn & Friedman, 1993).
Персистентность симптомов не является показанием для проведения дополнительных анализов, то есть она является характерным признаком IBS и сама представляет собой ожидаемый симптом данного синдрома. Более обширное диагностическое обследование показано пациентам с ухудшением или изменением симптомов. Показаниями для дополнительного проведения анализов также являются наличие тревожных симптомов, начало появления симптомов после 50 лет и наличие в анамнезе рака толстой кишки. Обследование может включать колоноскопию, компьютерную томографию брюшной полости и таза, и исследование тонкой или толстой кишки с использованием бария.
J. Ювенильный ревматоидный артрит
Термин «ювенильный ревматоидный артрит» (JRA) означает наиболее распространенную форму артрита у детей, которую относят к семейству заболеваний, характеризующихся хроническим воспалением и гипертрофией синовиальных оболочек. Этот термин совпадает с термином «семейство заболеваний, называемых ювенильным хроническим артритом и/или ювенильным идиопатическим артритом, и распространенных в Европе», но не является его полным синонимом.
Jarvis (1998) и сотрудниками (Arend, 2001) было высказано предположение, что в патогенезе ревматоидного заболевания у взрослых и детей участвуют сложные взаимодействия между природной и адаптивной иммунными системами. Такие сложные взаимодействия создают значительные трудности в выявлении патогенеза данного заболевания.
Природная и адаптивная иммунные системы осуществляют свои функции благодаря действию клеток множества типов, обширному массиву клеточной поверхности и секретируемых белков, и взаимосвязанных сетей положительной и отрицательной обратной связи (Lo et al., 1999). Кроме того, существует независимое мнение, что природная и адаптивная ветви иммунной системы функционально пересекаются (Fearon & Locksley, 1996), а поэтому патологические события, возникающие в этих точках пересечения, вероятно, имеют важное значение для понимания патогенеза некоторых форм хронического артрита у взрослых и детей (Warrington, et al., 2001).
Полиартрит JRA представляет собой другой клинический подтип заболевания, характеризующийся воспалением и синовиальной пролиферацией во множестве суставов (четырех или более), включая мелкие суставы рук (Jarvis, 2002). JRA этого подтипа может иметь тяжелое течение, что обусловлено вовлечением в патологический процесс множества суставов и быстрым прогрессированием этого процесса. По своим клиническим признакам полиартрит JRA не является однородным, и у пациентов с JRA наблюдаются различия в симптомах, а также в таких факторах как возраст, при котором наблюдается начало заболевания, прогноз и терапевтический эффект. Такие различия, по всей вероятности, отражают спектр разнообразия природы иммунной и воспалительной атак, которые могут иметь место при этом заболевании (Jarvis, 1998).
K. Синдром Сьегрена
Первичным синдромом Сьегрена (SS) является хроническое медленно прогрессирующее системное аутоиммунное заболевание, которое встречается, главным образом, у женщин средних лет (отношение заболеваемости у женщин и мужчин составляет 9:1), хотя оно может наблюдаться у людей любого возраста, включая подростков (Jonsson et al., 2002). Это заболевание характеризуется инфильтрацией лимфоцитов и деструкцией экзокринных желез, которые инфильтрируются мононуклеарными клетками, включая CD4+-, CD8+-лимфоциты и B-клетки (Jonsson et al., 2002). Кроме того, у трети пациентов наблюдаются экстрагландулярные (системные) проявления (Jonsson et al., 2001).
Гландулярная инфильтрация лимфоцитов представляет собой прогрессирующий процесс (Jonsson et al., 1993), который, если он является интенсивным, может охватывать обширные участки органов. Интересно отметить, что гландулярные инфильтраты у некоторых пациентов очень напоминают эктопические лимфоидные микроструктуры в слюнных железах (называемые эктопическими зародышевыми центрами) (Salomonsson et al., 2002; Xanthou & Polihronis, 2001). При SS эктопические зародышевые центры (ЗЦ) определяют как T- и В-клеточные агрегаты пролиферирующих клеток с образованием сети фолликулярных дендритных клеток и активированных эндотелиальных клеток. Такие ЗЦ-подобные структуры, образующиеся в ткани-мишени, также обладают функциональными свойствами, заключающимися в продуцировании аутоантител (анти-Ro/SSA и анти-La/SSB аутоантител)(Salomonsson &, Jonsson, 2003).
При других системных аутоиммунных заболеваниях, таких как RA, были идентифицированы факторы, играющие важную роль в образовании эктопических ЗЦ. Было показано, что ревматоидные синовиальные ткани, содержащие ЗЦ, продуцируют хемокины CXCLl3, CCL21 и лимфотоксин (LT)-β (детектируемые на В-клетках фолликулярного центра и зоны коры головного мозга). Мультидисперсный регрессионный анализ этих аналитов позволил идентифицировать CXCL13 и LT-β как одиночные цитокины, что дало возможность сделать предположение о наличии ЗЦ при ревматоидном синовите (Weyand & Goronzy, 2003). Недавно было показано, что CXCLl3 и CXCR5 в слюнных железах играют важную роль в воспалительном процессе посредством рекрутинга B- и T-клеток и, тем самым, вносят определенный вклад в лимфоидный неогенез и образование эктопических ЗЦ при SS (Salomonsson & Larsson, 2002).
L. Артрит на начальной стадии
На ранней стадии течения заболевания клинические проявления различных воспалительных артропатий являются одинаковыми. Поэтому часто бывает трудно дифференцировать пациентов с риском развития тяжелого и персистентного синовита, приводящего к эрозивному повреждению суставов, от пациентов с артритом, который носит более самокупирующийся характер. Такая дифференциация имеет важное значение для назначения соответствующей целевой терапии, для лечения прогрессирующего заболевания с эрозивными повреждениями и для предотвращения необязательно возникающей токсичности у пациентов с заболеванием, имеющим большую тенденцию к самокупированию. Современные клинические критерии для диагностики эрозивных артропатий, таких как ревматоидный артрит (RA), являются менее эффективными на ранней стадии заболевания, и традиционные показатели активности заболевания, такие как число суставов, вовлеченных в данный процесс, и ответ в период острой фазы заболевания, пока не позволяют адекватно идентифицировать пациентов с точки зрения плохого прогноза (Harrison & Symmons et al., 1998). Параметры, отражающие патологические процессы, протекающие в синовии, имеют, по всей вероятности, очень важное прогностическое значение.
Предпринятые недавно попытки идентифицировать прогностические факторы плохого исхода заболевания при воспалительном артрите на ранней стадии выявили присутствие RA-специфических аутоантител, а в частности антител, направленных против цитрулин-содержащих пептидов и ассоциирующихся с эрозивным и персистентным заболеванием у групп пациентов с воспалительным артритом на ранней стадии. Исходя из этих данных, для облегчения идентификации анти-ССР антител в сыворотке пациента, был получен циклический цитрулин-содержащий пептид (CCP). При таком подходе было обнаружено, что по присутствию анти-ССР антител, которые являются специфичными и восприимчивыми к RA, можно дифференцировать RA от других артропатий и можно предсказать наличие персистентного эрозивного синовита еще до появления клинических симптомов заболевания (Schellekens et al., 2000). Важно отметить, что анти-ССР антитела часто детектируются в сыворотке за много лет до появления клинических симптомов, что дает основание предположить, что такие антитела могут служить показателем субклинических иммунных ответов (Nielen et al., 2004; Rantapaa-Dahlqvist et al., 2003).
На ранней стадии течения заболевания, клинические проявления различных воспалительных артропатий являются одинаковыми. Поэтому, часто бывает трудно дифференцировать пациентов с риском развития тяжелого и персистентного синовита, который приводит к эрозивному повреждению суставов от пациентов с заболеванием, которое имеет большую тенденцию к самокупированию. Такая дифференциация имеет важное значение для назначения соответствующей целевой терапии, для лечения прогрессирующего заболевания с эрозивными повреждениями и для предотвращения необязательно возникающей токсичности у пациентов с заболеванием, которое имеет большую тенденцию к самокупированию. Современные клинические критерии для диагностики эрозивных артропатий, таких как ревматоидный артрит (RA), являются менее эффективными на ранней стадии развития заболевания, и традиционные показатели активности заболевания, такие как число суставов, вовлеченных в данный патологический процесс, а также ответ на острой фазе заболевания, пока не позволяют адекватно идентифицировать пациентов с точки зрения плохого прогноза (Harrison et al., 1998). Параметры, отражающие патологические процессы, протекающие в синовии, имеют, по всей вероятности, очень важное прогностическое значение.
Предпринятые недавно попытки идентифицировать прогностические факторы плохого исхода заболевания при воспалительном артрите на ранней стадии выявили присутствие RA -специфических аутоантител, а в частности антител, направленных против цитрулин-содержащих пептидов и ассоциирующихся с эрозивным и персистентным заболеванием у групп пациентов с воспалительным артритом на ранней стадии. Исходя из этих данных, для облегчения идентификации анти-ССР антител в сыворотке пациента, был получен циклический цитрулин-содержащий пептид (CCP). При таком подходе было обнаружено, что по присутствию анти-ССР антител, которые являются специфичными и восприимчивыми к RA, можно дифференцировать RA от других артропатий и можно предсказать наличие персистентного эрозивного синовита еще до появления клинических симптомов заболевания. Важно отметить, что анти-ССР антитела часто детектируются в сыворотке за много лет до появляния клинических симптомов, что дает основание предположить, что такие антитела могут служить показателем субклинических иммунных ответов (Nielen et al., 2004; Rantapaa-Dahlqvist et al., 2003).
M. Псориаз
Псориаз представляет собой хроническое кожное заболевание, которое характеризуется шелушением и воспалением кожи, и которым страдает 2-2,6 процента населения или 5,8-7,5 миллионов людей, проживающих в Соединенных Штатах. Хотя такое заболевание наблюдается у людей всех возрастных групп, однако, он, главным образом, встречается у взрослых людей. Это заболевание в равной степени встречается как у мужчин, так и у женщин. Псориаз возникает в случае, когда клетки кожи быстро выходят из области их образования под поверхностью кожи и скапливаются на поверхности еще до своего созревания. Обычно такая миграция (также называемая функциональным циклом) происходит примерно в течение месяца, но при псориазе этот процесс может протекать всего за несколько дней. В своей типичной форме псориаз приводит к образованию пятен в виде толстой красной (воспаленной) кожи, покрытой серебристыми чешуйками. Эти пятна, которые иногда называются бляшками, обычно вызывают зуд или болезненное ощущение. Псориаз чаще всего поражает локти, колени, другие части ног, волосистую часть головы, поясницу, лицо, ладони и подошвы стопы, но он может также поражать кожу в любой части организма. Такое заболевание может также поражать ногти пальцев рук, ногти пальцев ног, мягкие ткани гениталий и внутреннюю часть ротовой полости. Обычно наблюдается растрескивание кожи вокруг пораженных суставов, и приблизительно у 1 миллиона человек, страдающих псориазом, наблюдается воспаление суставов, которое приводит к появлению симптомов артрита. Такое состояние называется псориатическим артритом.
Псориаз представляет собой кожное заболевание, индуцированное иммунной системой, а в частности лейкоцитами определенного типа, называемыми Т-клетками. Обычно Т-клетки защищают организм от инфекций и заболеваний. В случае псориаза, Т-клетки начинают действовать по несвойственному им механизму и становятся настолько активными, что они запускают другие иммунные ответы, что приводит к воспалению и ускорению функционального цикла клеток кожи. Примерно в одной трети случаев, псориаз является наследственным заболеванием. Специалистами было проведено обследование большого числа семей, члены которых страдают псориазом, и у них были идентифицированы гены, ассоциированные с таким заболеванием. Люди, страдающие псориазом, могут отметить, что, временами, состояние их кожи то ухудшается, то улучшается. Состояниями, которые могут вызывать обострение заболевания, являются инфекции, стресс и изменение климата, которые вызывает сухость кожи. Кроме того, некоторые медицинские препараты, включая литий и бета-блокаторы, которые назначают для снижения повышенного кровяного давления, могут вызывать обострение или ухудшение заболевания.
N. Рассеянный склероз
Рассеянный склероз (сокращенно обозначаемый MS, а также известный как диссеминированный склероз или диссеминированный энцефаломиелит) представляет собой аутоиммунное состояние, при котором иммунная система атакует центральную нервную систему, что приводит к демиелинизации. Это заболевание обычно начинает развиваться у молодых людей, а чаще всего у женщин. Данное заболевание встречается примерно у 2-150 человек на 100000. MS был впервые описан в 1868 году Жан-Мартеном Шарко.
При MS подавляется способность нервных клеток головного и спинного мозга взаимодействовать друг с другом. Взаимодействия нервных клеток происходят путем подачи электрических сигналов, называемых потенциалами действия, на длинные волокна, называемые аксонами, которые покрыты изолирующим веществом, называемым миелином. При MS собственная иммунная система организма атакует и разрушает миелин. При потере миелина эти аксоны не могут больше эффективно проводить сигналы. Название «рассеянный склероз» происходит от слова «рубцы» (scars) (слово «склероз» (scleroses) больше известно как бляшки или поражения), присутствующие в белом веществе головного и спинного мозга, где указанное вещество, главным образом, состоит из миелина. Хотя в настоящее время имеется много информации о механизмах, участвующих в данном патологическом процессе, однако причина возникновения такого заболевания до сих пор остается неизвестной. Согласно теории, в основе такого заболевания лежат генетические факторы или инфекции. Были также выявлены различные факторы риска, связанные с изменением окружающей среды.
Данное заболевание может ассоциироваться почти с любыми неврологическими симптомами и, в большинстве случаев, оно прогрессирует, что приводит к соматическим и психическим нарушениям. MS имеет несколько форм, при которых появляются новые симптомы, проявляющиеся в виде дискретных атак (рецидивирующие формы), или медленно накапливающиеся симптомы (прогрессирующие формы). Между атаками эти симптомы могут полностью исчезать, но в большинстве случаев остаются перманентные неврологические расстройства, а в частности осложнения заболевания.
Какого-либо известного метода лечения MS не существует. Были предприняты попытки восстановления функции нервной системы после атаки, а также предупреждения новых атак и предотвращения потери трудоспособности (см. подробное обсуждение, приведенное ниже). Лекарственные препараты для лечения MS могут давать побочные эффекты, либо они могут плохо переноситься пациентами, и многим пациентам назначают альтернативное лечение, несмотря на отсутствие подтверждающего его научного исследования. Прогноз данного заболевания трудно предсказать, то есть он зависит от подтипа заболевания, признаков заболевания у данного индивидуума, начальных симптомов этого заболевания и степени потери трудоспособности индивидуума по мере прогрессирования заболевания. Вероятная продолжительность жизни у этих пациентов почти аналогична продолжительности жизни здорового населения.
Симптомы MS обычно появляются периодически в острые периоды обострения заболевания (рецидивы, обострения, приступы или кризы) при постепенно прогрессирующем ухудшении неврологической функции, или во время всех вместе взятых периодов обострений.
Наиболее частыми проявлениями MS является клинически изолированный синдром (КИС). При КИС у пациента наблюдается приступ, напоминающий событие демиелинизации, но этот приступ не удовлетворяет критериям диагностики рассеянного склероза. Только у 30-70% пациентов с КИС в дальнейшем развивается MS. Это заболевание обычно проявляется симптомами сенсорной недостаточности (46% случаев), ухудшением зрения (33%), нарушением мозжечковой функции (30%) и нарушением двигательной функции (26%). В литературе также описано множество редко встречающихся ранних симптомов, включая афазию, психоз и эпилепсию. У пациентов, впервые обращающихся за медицинской консультацией, обычно наблюдается множество симптомов. Первые признаки и симптомы MS часто являются преходящими, слабыми и самокупирующимися. Пациент с такими признаками и симптомами часто не обращается к врачу, а иногда эти признаки могут быть идентифицированы лишь ретроспективно после установления диагноза MS. Заболевание MS иногда случайно обнаруживается во время обследования у невропатолога, к которому пациент обращается по другому поводу. Такие заболевания называются субклиническим MS.
У пациента с MS могут наблюдаться почти все неврологические симптомы или признаки, включая изменения ощущений (гипестезия и парестезия), слабость в мышцах, мышечные спазмы или нарушение двигательной способности; нарушения координации и равновесия (атаксия); расстройство речи (дизартрия) или затруднения глотания (дисфагия), проблемы со зрением (нистагм, нейрит зрительного нерва или диплопия), усталость, острые или хронические боли, и расстройство мочеиспускания и кишечника. Распространенными симптомами также являются нарушение познавательной способности различной степени и психических расстройств типа депрессии или смены настроения. Главным клиническим критерием прогрессирования потери работоспособности и тяжести симптомов является Расширенная шкала статуса инвалидности или EDSS.
Рецидивы рассеянного склероза часто являются непредсказуемыми и возникают спонтанно и без видимых причинных факторов. Однако некоторые приступы вызываются общеизвестными провоцирующими факторами. Чаще всего рецидивы возникают весной и летом. Факторами, повышающими риск возникновения рецидивов, являются инфекции, такие как насморк, грипп или гастроэнтерит. Приступ может быть также вызван стрессом. Беременность может подавлять восприимчивость к рецидиву и обеспечивать защиту, например, в последний ее триместр. Однако, в первые несколько месяцев после родов, риск появления рецидивов возрастает. В целом, очевидно, что беременность не оказывает какого-либо влияния на продолжительность потери трудоспособности. Были исследованы многие провоцирующие факторы, и было обнаружено, что они не влияют на частоту рецидивов MS. Также отсутствуют какие-либо данные о том, что вакцинация против гриппа, гепатита В, опоясывающего лишая, столбняка или туберкулеза повышает риск возникновения рецидива. Физические травмы также не вызывают рецидивов. Воздействие температур, превышающих температуру окружающей среды, может приводить к обострению уже имеющихся симптомов, и это действие известно как феномен Утхоффа. Однако феномен Утхоффа не является установленным фактором, вызывающим рецидив.
Было описано несколько подтипов или профилей прогрессирования данного заболевания. При установлении этих подтипов учитывалось предшествующее течение заболевания в попытке предсказания дальнейшего течения заболевания. Это имеет важное значение не только с прогностической точки зрения, но также и для назначения лечения. В 1996 году специалистами Национального комитета по изучению рассеянного склероза в Соединенных Штатах было стандартизировано определение четырех подтипов заболевания: рецидивирующее ремиттирующее, вторичное прогрессирующее, первичное прогрессирующее и прогрессирующее рецидивирующее заболевание.
Заболевание рецидивирующего-ремиттирующего подтипа характерируется непредсказуемыми рецидивами с последующими относительно «тихими» периодами (ремиссиями), которые продолжаются от нескольких месяцев до нескольких лет, и во время которых каких-либо новых признаков активности заболевания не наблюдается. При этом какие-либо расстройства, возникающие во время приступов, либо исчезают, либо сохраняются в виде остаточных явлений. Описанное начало течения заболевания характерно для 85-90% индивидуумов с MS. Если в период между приступами симптомы всегда исчезают, то такое заболевание иногда называют доброкачественным MS.
Вторичный прогрессирующий MS описывают как начальную стадию рецидивирующего-ремиттирующего MS, при котором между острыми атаками возникает прогрессирующее неврологическое расстройство с отсутствием каких-либо определенных периодов ремиссии. При этом могут наблюдаться спонтанные рецидивы и кратковременные ремиссии. Средняя продолжительность периода между началом заболевания и его переходом из рецидивирующей ремиттирующей стадии во вторичный прогрессирующий MS составляет 19 лет.
MS первичного прогрессирующего подтипа наблюдается приблизительно у 10-15% индивидуумов, у которых никогда не наступает ремиссии после появления первых симптомов MS. Такое заболевание характеризуется прогрессированием нетрудоспособности с самого начала заболевания с отсутствием или лишь со случайным и непродолжительным появлением ремиссий и улучшением состояния. Признаки заболевания первичного прогрессирующего подтипа появляются в более позднем возрасте, чем это наблюдается в случае заболеваний других подтипов.
Прогрессирующий рецидивирующий MS наблюдается у индивидуумов, у которых с самого начала заболевания наблюдается устойчивое нарушение неврологических функций, а также появление четко выраженных повторных атак. Эти признаки являются по меньшей мере типичными для заболеваний всех подтипов.
Были также описаны случаи нестандартного течения заболевания. Эти случаи иногда называют пограничными формами рассеянного склероза, и такими формами являются болезнь Девика, концентрический склероз Бало, диффузный склероз Шильдера и рассеянный склероз Марбурга. У детей рассеянный склероз также протекает по-разному. В настоящее время ведутся обсуждения по поводу того, является ли это заболевание атипичными вариантами MS, или другим заболеванием.
Рассеянный склероз трудно поддается диагностике, поскольку его признаки и симптомы могут быть сходны с признаками и симптомами многих других патологических состояний. Медицинские организации разрабатывают диагностические критерии для облегчения и стандартизации способов диагностики для практических врачей. В прошлом, популярностью пользовались критерии Шумахера и Позера. В настоящее время используется критерий МакДональда, который основан на получении клинических, лабораторных и радиологических данных распространения патологического процесса MS по его длительности и степени поражения органов. Диагноз не может быть поставлен до тех пор, пока не будут исключены другие возможные состояния, и пока не будут получены данные, свидетельствующие о событиях демиелинизации, разделенных как анатомически, так и во времени.
Отдельные клинические данные могут быть достаточными для установления диагноза MS, если у индивидуума наблюдаются отдельные эпизоды обострения неврологических симптомов, характерных для MS. Поскольку некоторые люди обращаются к врачу только после первого приступа, то для ускорения и облегчения установления диагноза могут быть проведены и другие анализы. Наиболее распространенными способами диагностики являются нейровизуализация, анализ цереброспинальной жидкости и вызванных потенциалов. Магнитно-резонансная томография головного и спинного мозга позволяет определить площадь демиелинизации (поражений или бляшек). Для выявления активных бляшек, в качестве контрастирующего агента может быть внутривенно введен гадолиний, и по его элиминации может быть определено наличие поражений, которые в прошлом не признавались как поражения, ассоциированные с симптомами, имеющимися в момент проведения анализа. Анализ цереброспинальной жидкости, взятой путем люмбальной пункции, может дать информацию о хроническом воспалении центральной нервной системы. Цереброспинальную жидкость анализируют на присутствие олигоклональных зон, которые являются маркерами воспаления, обнаруживаемыми у 75-85% людей с MS. Нервная система индивидуума с MS часто менее активно отвечает на стимуляцию зрительного нерва и чувствительного нерва, что обусловлено демиелинизацией таких путей. Такие реакции в головном мозге могут быть оценены с использованием вызванных потенциалов в органах зрения и органах чувств.
В настоящее время MS считается иммуноопосредованным расстройством, вызываемым провоцирующим фактором, который может иметь вирусную природу, хотя такая концепция обсуждается уже много лет, и у нее все еще имеются противники. Считается, что данное заболевание вызывается собственной иммунной системой пациента. Иммунная система атакует нервную систему, вероятно, в результате воздействия молекул, имеющих структуру, аналогичную структуре полной из молекул, присутствующей в организме.
Поражения MS часто охватывают области белого вещества, расположенные рядом с желудочками мозжечка, со стволом головного мозга, со спинномозговыми узлами и со спинным мозгом, а также рядом со зрительным нервом. Функция клеток белого вещества заключается в передаче сигналов между участками серого вещества, где происходит их обработка, и остальными участками организма. При этом периферическая нервная система затрагивается редко.
Более конкретно, при MS разрушаются олигодендроциты, то есть клетки, ответственные за создание и сохранение жирного слоя, известного как миелиновая оболочка, которая способствует передаче электрических сигналов нейронами. MS приводит к истончению или к полной потере миелинового слоя, а по мере прогрессирования заболевания, к разрыву (рассечению) нейронных отростков или аксонов. При потере миелина нейрон больше не способен эффективно проводить электрические сигналы. Процесс репарации, называемый ремиелинизацией, происходит на ранних стадиях заболевания, но олигодендроциты уже не способны полностью восстановить миелиновую оболочку клеток. Повторные атаки приводят к последующей, но менее эффективной, ремиелинизации, до тех пор, пока вокруг пораженных аксонов не будут образовываться рубцевидные бляшки. В литературе описаны четыре различных характера поражения.
Помимо демиелинизации, другим характерным патологическим признаком заболевания является воспаление. В соответствии со строго иммунологическим объяснением MS, воспалительный процесс вызывается Т-клетками, то есть клетками типа лимфоцитов. Лимфоциты представляют собой клетки, которые играют важную роль в защите организма. При MS T-клетки начинают проникать в головной мозг через гематоэнцефалический барьер, то есть капиллярную систему, которая должна предотвращать поступление Т-клеток в нервную систему. Гематоэнцефалический барьер обычно является непроницаемым для клеток такого типа, если только они не индуцируются инфекциями или вирусами, которые нарушают целостность плотных контактов, образующих этот барьер. Если гематоэнцефалический барьер снова приобретает свою целостность, что обычно происходит после устранения инфекции или удаления вирусов, то T-клетки остаются внутри головного мозга. Эти Т-клетки распознают миелин как чужеродное вещество и атакуют его так, как если бы он представлял собой инвазивный вирус. Это приводит к запуску воспалительных процессов, а следовательно и к стимуляции образования других иммунных клеток и растворимых факторов, таких как цитокины и антитела. В гематоэнцефалическом барьере происходят утечки, которые, в свою очередь, приводят к ряду других поражений, таких как набухание и активация макрофагов, а также дополнительная активация цитокинов и других деструктивных белков.
Хотя способ лечения рассеянного склероза пока не известен, однако, было предложено несколько полезных способов терапии. Терапией первого ряда является восстановление функции органов после атаки, предотвращение новых атак и предупреждение наступления нетрудоспособности. Что касается любого медикаментозного лечения, то медицинские препараты, используемые для лечения MS, дают несколько побочных эффектов. Некоторым пациентам назначают альтернативное лечение, несмотря на отсутствие подтверждающего, сравнительного и повторного научного исследования.
Во время симптоматических атак внутривенное введение высоких доз кортикостероидов, таких как метилпреднизолон, представляет собой рутинный метод лечения острых рецидивов заболевания. Целью проведения лечения такого типа является более быстрое прекращение атаки и сведение до минимума степени прогрессирования данного заболевания у пациента. Хотя лечение кортикостероидами является, в основном, эффективным для кратковременного ослабления симптомов, однако, очевидно, что такое лечение не дает длительного эффекта. Возможными побочными эффектами являются остеопороз и потеря памяти, которая затем может восстанавливаться.
Заболевание-модифицирующее лечение является дорогостоящим и, в большинстве случаев, требует частого (почти ежедневного) введения инъекций. Другие способы лечения требуют i.v. вливания с интервалами в 1-3 месяца. Самыми ранними клиническими проявлениями рецидивирующего-ремиттирующего MS (RRMS) является клинически изолированный синдром (КИС). Некоторые исследования показали, что лечение интерферонами во время начальных атак может снижать риск развития у пациента клинического MS.
В 2007 году Регуляторными органами различных стран было дано разрешение на шесть способов проведения заболевание-модифицирующего лечения RRMS. Три способа предусматривают использование интерферонов: двух препаратов интерферона βla (торговые знаки Avonex, CinnoVex, ReciGen и Rebif) и одного препарата интерферона βlb (торговый знак Betaseron в США, и Betaferon в Европе и Японии). Четвертым медицинским препаратом является ацетат глатирамера (Copaxone). Пятый медицинский препарат, митоксантрон, представляет собой иммунодепрессант, также используемый для противораковой химиотерапии, который был разрешен только в США и который предназначен, главным образом, для лечения вторичного прогрессирующего MS. Шестым препаратом является натализумаб (имеющийся в продаже под торговым знаком Tysabri). Все эти шесть лекарственных препаратов дают умеренный эффект с точки зрения снижения частоты атак и замедления прогрессирования заболевания до наступления нетрудоспособности, хотя степень их эффективности варьирует, а исследования продолжительности этих эффектов пока не проводились. Сравнение различных иммуномодуляторов (всех, за исключением митоксантрона) показало, что наиболее эффективным является натализумаб, как с точки зрения снижения частоты рецидивов, так и с точки зрения прекращения прогрессирования заболевания, приводящего к инвалидности; и было также показано, что эти препараты снижают тяжесть MS. Из всех этих препаратов наиболее эффективным может быть митоксантрон, однако, обычно он не рассматривается, как препарат, подходящий для длительной терапии, поскольку его применение ограничивается из-за его сильного кардиотоксического действия.
Интерфероны и ацетат глатирамера вводят в виде частых инъекций, частота которых варьирует от одного раза в день для ацетата глатирамера до одного раза в неделю (но внутримышечно) для препарата Avonex. Натализумаб и митоксантрон вводят путем внутривенного (i.v.) вливания с интервалами в несколько месяцев.
Лечение прогрессирующего MS является более трудным, чем лечение рецидивирующего-ремиттирующего MS. Митоксантрон дает положительные эффекты у пациентов с вторичным прогрессирующим заболеванием и прогрессирующим рецидивирующим заболеванием. При кратковременном обследовании было установлено, что такое лечение дает умеренный эффект в отношении снижения прогрессирования заболевания и снижения частоты рецидивов у пациентов. Какого-либо лечения, оказывающего воздействие на течение первичного прогрессирующего заболевания, пока не существует.
Как и при любом медикаментозном лечении, эти способы лечения дают несколько побочных эффектов. Одним из наиболее распространенных побочных эффектов является раздражение в месте инъекции ацетата глатирамера и введения интерферона. Со временем, на участке инъекции могут появляться видимые выступы на коже, вызываемые локальной деструкцией ткани, известной как липоатрофия. Интерфероны продуцируют симптомы, аналогичные симптомам гриппа; при этом у некоторых пациентов, которым вводят глатирамер, наблюдаются постинъекционные реакции, проявляющиеся в виде резкого покраснения, стеснения в груди, учащенного сердцебиения, одышки и тревожных состояний, которые обычно длятся не менее чем тридцать минут. Более опасными побочными эффектами являются поражение печени, вызываемое интерферонами и митоксантроном, и иммунодепрессивное воздействие и кардиотоксичность; при этом было высказано предположение о взаимосвязи между натализумабом и некоторыми случаями прогрессирующей мультифокальной лейкоэнцефалопатии.
Заболевание-модифицирующее лечение приводит к снижению степени прогрессирования заболевания, но не к его прекращению. По мере прогрессирования рассеянного склероза его симптоматика имеет тенденцию к усилению. Такое заболевание ассоциируется с рядом симптомов и функциональных нарушений, которые приводят к прогрессированию заболевания и к потере трудоспособности. Поэтому, лечение таких заболеваний имеет очень важное значение. Было показано, что терапия лекарственными средствами и восстановление нервной системы ослабляют тяжесть некоторых симптомов, хотя и не оказывает никакого влияния на прогрессирование заболевания. Как и для любого пациента с нарушением неврологических функций, междисциплинарный подход является ключевым фактором в ограничении и в предотвращении нетрудоспособности, однако, существуют определенные проблемы в идентификации «основной группы», поскольку индивидуумы с MS могут нуждаться в помощи врача почти любой медицинской специальности или медицинской службы в любом регионе. Аналогичным образом, каждый симптом требует различных способов лечения. Поэтому такое лечение должно быть индивидуальным и зависит от особенностей пациента и от квалификации врача.
При большинстве хронических заболеваний, некоторым пациентам назначают альтернативное лечение, несмотря на отсутствие подтверждающего, сравнительного и повторного научного исследования. Примерами такого лечения являются соблюдение режима питания, лечение лекарственными растениями, включая использование медицинской конопли для облегчения симптомов и оксибаротерапия. Считается, что снятие усталости может быть достигнуто благодаря терапевтическому применению военного искусства, такого как тай-ши, методов релаксации, таких как йога, или выполнению общих упражнений, но эти методы не влияют на познавательную функцию.
II. Диагностика аутоиммунных заболеваний
В одном из своих аспектов настоящее изобретение относится к диагностике аутоиммунных заболеваний, таких как заболевания, обсуждаемые выше. Такие методы диагностики позволяют врачам дифференцировать различные заболевания с рядом перекрывающихся симптомов и, тем самым, правильно установить физиологическую причину, лежащую в основе возникновения симптомов у пациента, а также открывают возможность раннего вмешательства в процесс развития заболевания и его лечения. Действительно, поскольку многие способы лечения аутоиммунных заболеваний замедляют их прогрессирование и направлены на подавление симптомов, но не способны предупреждать или излечивать данное заболевание, то возможность осуществления ранней диагностики этих заболеваний будет играть решающую роль в замедлении развития более тяжелых симптомов. Кроме того, возможность назначения пациентам соответствующих лекарственных средств для ослабления таких симптомов, не прибегая, при этом, к методу «проб и ошибок», который иногда применяют из-за неправильного диагноза, позволит в значительной степени снизить стоимость лечения и избежать ощущения у пациента дискомфорта и возможного появления у него побочных эффектов.
Все эти анализы проводят путем взятия у пациента образцов, содержащих Т-клетки. Наиболее часто используемыми биологическими образцами могут быть кровь или сыворотка, что обусловлено преобладанием в них Т-клеток. Однако могут быть использованы и другие образцы, такие как слезы, слюна, мокрота, цереброспинальная жидкость, сперма или моча.
В анализах на присутствие аутореактивных Т-клеток у индивидуума, наблюдаемые профили реактивности могут сравниваться со стандартом. Стандарт может быть выбран на основе известных профилей связывания с пептоидом, установленных для индивидуумов с заболеванием и у здоровых индивидуумов, что позволяет избежать необходимости использования какого-либо другого способа кроме реакционного контроля, то есть контроля, указывающего на то, что данные реагенты и состояния являются необходимыми для прохождения положительной реакции. Альтернативно, может быть выбран способ осуществления фактического контроля, который включает взятие аналогичного образца у конкретного индивидуума, о котором известно, что он является здоровым или имеет диагностированное заболевание. Кроме того, у одного и того же пациента может быть взята серия образцов в течение определенного периода времени для того, чтобы выявить тенденцию к увеличению аутореактивных Т-клеток, которое является показателем прогрессирования заболевания.
Существуют различные методы детектирования аутореактивных Т-клеток согласно изобретению. Анализ одного типа может представлять собой анализ с использованием антител, включая такие его формы, как твердофазный иммуноферментный анализ (ELISA), радиоиммуноанализ (РИА), иммунорадиометрический анализ, флуоресцентный иммуноанализ, хемилюминесцентный анализ, биолюминесцентный анализ, FACS, FRET, вестерн-блот-анализ, и другие анализы, либо такие анализы могут быть смоделированы на основе вышеупомянутых анализов. Стадии различных методов иммунодетектирования были описаны в научной литературе, например, в публикации Doolittle & Ben-Zeev (1999), Gulbis & Galand (1993), De Jager et al. (1993) и Nakamura et al. (1987). В основном, такие анализы проводят с использованием пептоида, нанесенного на носитель. Пептоид может быть предварительно идентифицирован как релевантный лиганд для популяции аутореактивных Т-клеток, либо, вместо этого, он может представлять собой часть массива неохарактеризованных пептоидов, которые имеют общий профиль связывания с Т-клетками, характерный для предсказания наличия заболевания или его отсутствия.
Твердый носитель может быть получен в форме колоночной матрицы, гранул, фильтра, мембраны, полоски, планшета или лунки, и на этот носитель с иммобилизованным на нем пептоидом может быть нанесен образец. После контактирования этого пептоида с образцом, нежелательные (неспецифически связанные) компоненты вымывают из носителя и оставляют только Т-клетки, которые образуют комплекс с пептоидом, после чего эти клетки детектируют различными методами, такими как последовательное добавление антител, которые распознают поверхностные маркеры на Т-клетках (например, CD4, CD8), связанных с носителем, или меченый(ые) пептоид(ы).
Контактирование выбранного биологического образца с пептоидом в соответствующих условиях и в течение периода времени, достаточного для образования комплексов «пептоид-Т-клетка», в общих чертах, представляет собой простой метод контактирования образца с пептоидом и инкубирования смеси в течение определенного периода времени, достаточного для связывания Т-клеток с пептоидами. По истечении этого времени, композицию «образец-пептоид», такую как планшет, фильтр или блот, обычно промывают для удаления каких-либо неспецифически связанных клеток или дебриса, и оставляют только те клетки, которые специфически связывались с детектируемым иммобилизованным пептоидом.
В целом, детектирование образования биологического комплекса хорошо известно специалистам и может быть достигнуто с применением различных методов. Такие методы, в основном, основаны на детектировании меток или маркеров, таких как любые радиоактивные, флуоресцентные, биологические и ферментативные метки. Патентами, в которых описано использование таких меток, являются патенты США 3817837, 3850752, 3939350, 3996345, 4277437, 4275149 и 4366241. Совершенно очевидно, что использование вторичных связывающих лигандов, таких как «второе» антитело и/или комплекс, связывающийся с лигандами биотин/авидин, хорошо известно специалистам.
Рассматриваются также анализы, проводимые в других форматах, и такие анализы хорошо известны специалистам. Ниже обсуждаются три конкретных анализа, которые рассматриваются как анализы, подходящие для их применения в настоящем изобретении.
A. Анализы ELISA
Самыми простыми и прямыми иммуноанализами являются анализы на связывание. Некоторыми иммуноанализами, которые могут быть применены в настоящем изобретении, являются различные твердофазные иммуноферментные анализы (ELISA) и радиоиммуноанализы (РИА), известные специалистам.
В одном репрезентативном анализе ELISA, пептоиды согласно изобретению иммобилизуют на выбранной поверхности, такой как лунка в полистироловом микротитрационном планшете. Затем тестируемую композицию, предположительно содержащую Т-клетки, добавляют в лунки. После связывания и промывки для удаления неспецифически связанных комплексов, связанные Т-клетки могут быть детектированы. Детектирование может быть осуществлено путем добавления другого пептоида, связанного с детектируемой меткой. Анализ такого типа аналогичен простому анализу «сэндвич»-ELISA, за исключением того, что связывание меченого агента осуществляется непосредственно в антиген-связывающей части Т-клеточного рецептора. Детектирование может быть также осуществлено путем добавления меченого антитела, связывающегося с любым поверхностным антигеном, специфичным к Т-клеткам, который, например, распознает структуру, уникальную для Т-клеток в целом или Т-клеток конкретного класса. Или, но необязательно, указанное антитело может быть немеченым, и к нему затем добавляют «второе» антитело, которое обладает аффинностью связывания с первым антителом (Fc), причем указанное «второе» антитело связано с детектируемой меткой.
В другом репрезентативном ELISA, образцы, предположительно содержащие Т-клетки, иммобилизуют на поверхности лунки, а затем подвергают контактированию с мечеными пептоидами согласно изобретению. После связывания и промывки для удаления неспецифически связанных иммунных комплексов, связанные меченые пептоиды детектируют.
Анализы ELISA, независимо от используемого формата, имеют некоторые общие признаки, такие как нанесение покрытий, инкубирование и связывание, промывка для удаления неспецифически связанных молекул и детектирование связанных иммунных комплексов. Благодаря простоте и предсказуемости химической структуры пептоидов, они могут быть связаны с носителем посредством специфической химической реакции.
Термин «в условиях, эффективных для образования иммунных комплексов» означает, что такие условия предпочтительно включают разведение Т-клеток растворами, такими как BSA, бычий γ-глобулин (BGG) или забуференный фосфатом физиологический раствор (PBS)/твин. Такие добавленные агенты также способствуют снижению неспецифического фона. Термин «подходящие» условия также означает, что инкубирование осуществляют при температуре или в течение периода времени, достаточных для эффективного связывания. Стадии инкубирования обычно проводят в течение примерно 1, 2 или 4 часов или т.п. или при температуре предпочтительно 25°C-27°C, либо они могут быть проведены в течение ночи примерно при 4°C или т.п.
После проведения всех стадий инкубирования в ELISA, контактируемую поверхность промывают для удаления материала, не образующего комплекс. Предпочтительная процедура промывки включает промывку раствором, таким как PBS/твин, или боратным буфером. После образования специфических иммунных комплексов между тест-образцом и исходным связанным материалом и после промывки может быть определено присутствие даже минимальных количеств иммунных комплексов.
При детектировании может быть использован фермент, который дает окраску после инкубирования с соответствующим хромогенным субстратом. Так, например, контактирование или инкубирование иммунных комплексов с антителом или пептоидом, конъюгированным с уреазой, глюкозооксидазой, щелочной фосфатазой или с пероксидазой хрена, желательно осуществлять в течение определенного периода времени и в условиях, способствующих образованию такого иммунного комплекса (например, инкубирование желательно осуществлять в течение 2 часов при комнатной температуре в PBS-содержащем растворе, таком как PBS-твин).
После инкубирования с меченым антителом или пептоидом и после промывки для удаления несвязанного материала, количество метки, например, в случае использования пероксидазы в качестве ферментной метки, определяют путем инкубирования с хромогенным субстратом, таким как мочевина или бромкрезоловый пурпурный, или с 2,2'-азино-ди-(3-этил-бензтиазолин-6-сульфоновой кислотой (ABTS) или с H2O2. Затем проводят количественную оценку путем измерения степени образования окраски, например, на спектрофотометре, работающем в режиме видимого спектра.
B. Квантовые точки
Как обсуждается ниже, в некоторых аспектах настоящего изобретения, для мечения клеточных популяций предпочтительно использовать квантовые точки. Квантовая точка представляет собой полупроводник, экситоны которого имеют ограниченную пространственную локализацию. В результате этого, они имеют свойства, которые присущи легированным полупроводникам и дискретным молекулам. Они были открыты Льюисом Брюсом, который затем работал в лаборатории Белла. Учеными были исследованы квантовые точки в транзисторах, в солнечных батареях, в светодиодах (СИД) и в диодных лазерах. Ученые исследовали квантовые точки как средства для осуществления клинической визуализации в надежде, что их можно будет использовать в качестве квантовых битов.
Для получения квантовых точек существует несколько способов. В общих чертах, с применением усовершенствованных эпитаксиальных методов, квантовые нити, квантовые ямы и квантовые точки могут быть получены в нанокристаллах, продуцируемых химическими методами или путем имплантации ионов, или в наноаппаратах, изготовленных методами литографии, известными специалистам.
Коллоидальные полупроводниковые нанокристаллы синтезируют из соединений-предшественников, растворенных в растворах, почти так же, как это осуществляется с применением традиционных химических методов. Синтез коллоидальных квантовых точек осуществляют на основе трехкомпонентной системы, состоящей из предшественников, органических поверхностно-активных веществ и растворителей. При нагревании реакционной среды до достаточно высокой температуры, соединения-предшественники подвергаются химическому превращению в мономеры. После достижения мономерами достаточно высокого уровня сверхнасыщения, рост нанокристаллов начинается с процесса зародышеобразования. Температура в процессе такого роста является одним из главных факторов при определении оптимальных условий для роста нанокристаллов. Такая температура должна быть достаточно высокой для перегруппировки и сопряжения атомов в процессе синтеза, и достаточно низкой для стимуляции роста кристаллов. Другим решающим фактором, который должен строго регулироваться в процессе роста нанокристаллов, является концентрация мономера. Процесс роста нанокристаллов может проходить в двух различных режимах, таких как «фокусирование» и «дефокусирование». При высоких концентрациях мономеров критический размер (размер, при котором нанокристаллы не растут и не сжимаются) является относительно небольшим, что обеспечивает рост почти всех частиц. В этом режиме более мелкие частицы растут быстрее, чем крупные (поскольку более крупным кристаллам для их роста требуется больше атомов, чем мелким кристаллам), что приводит к «фокусированию» их распределения по размеру, в результате чего образуются почти монодисперсиные частицы. «Фокусирование» размера является оптимальным, если концентрация мономеров поддерживается такой, чтобы средний размер нанокристалла всегда был несколько больше его критического размера. При снижении концентрации мономеров в процессе роста, критический размер становится больше, чем средний размер, и такое распределение «дефокусируется» в результате созревания по Освальду.
Для получения множества различных полупроводников применяются коллоидальные методы, включая методы с использованием селенида кадмия, сульфида кадмия, арсенида индия и фосфида индия. Такие квантовые точки могут содержать по меньшей мере 100-100000 атомов по объему квантовой точки, а диаметр этих квантовых точек составляет от 10 до 50 атомов. Это соответствует примерно 2-10 нанометрам, и диаметру 10 нм, при этом почти 3 миллиона квантовых точек должны быть вытянуты в одну плотную линию, ширина которой соответствует ширине большого пальца человека.
Большие количества квантовых точек могут быть синтезированы посредством коллоидального синтеза. В настоящее время коллоидальный синтез является самым дешевым методом синтеза, а его преимущество состоит в том, что он может быть проведен в лабораторных условиях. Также известно, что из всех существующих методов синтеза, этот метод является наименее токсичным.
Размер самособирающихся квантовых точек обычно составляет 10-50 нм. Квантовые точки, сформированные с помощью литографически профилированных управляющих электродов или путем травления двухмерными электронными газами в полупроводниковых гетероструктурах, могут иметь поперечные размеры, превышающие 100 нм.
Некоторые квантовые точки имеют небольшие области, где один материал скрыт другим материалом с большей шириной запрещенной зоны. Эти области могут также называться структурами «ядро в оболочке», например, CdSe в ядре и ZnS в оболочке, или они могут быть получены из специально приготовленных форм двуокиси кремния, известных под названием ормосил.
Иногда квантовые точки образуются спонтанно в структурах, называемых квантовыми ямами, что обусловлено флуктуациями монослоев в толщине этой квантовой ямы.
В определенных условиях самособирающиеся квантовые точки спонтанно образуют зародыш кристаллизации в процессе молекулярно-лучевой эпитаксии (MBE) и металлоорганической газофазной эпитаксии (MOVPE), в том случае, если материал выращивают на субстрате, кристаллическая решетка которого не соответствует этому материалу. Образующаяся в результате деформация продуцирует когерентно деформированные островки поверх двухмерного «смачивающего слоя». Такой тип роста известен как рост по методу Странского-Крастанова. Эти островки могут быть затем скрыты с образованием квантовой точки. Такой метод изготовления может быть использован в квантовой криптографии (то есть, на основе однофотонных источников) и в квантовых вычислениях. Главными ограничениями этого метода являются его высокая стоимость и отсутствие контроля за позиционированием отдельных точек.
Отдельные квантовые точки могут быть созданы из двумерных электронных или дырочных газов, присутствующих в дистанционно легированных квантовых ямах или в полупроводниковых гетероструктурах, называемых побочными квантовыми точками. Поверхность образца покрывают тонким слоем резиста. Затем в этом резисте определяют боковой профиль посредством электронно-лучевой литографии. Этот профиль может быть затем перенесен на электронный или дырочный газ путем травления или путем осаждения на металлических электродах (методом обратной литографии), что позволяет подавать внешнее напряжение между электронным газом и электродами. Такие квантовые точки представляют интерес, главным образом, для проведения экспериментов и применения методов, в которых используются электронные или дырочные переходы, то есть электрический ток.
Энергетический спектр квантовой точки может быть сконструирован путем регуляции геометрического размера, формы и величины удерживающего потенциала. Кроме того, в отличие от атомов, квантовые точки посредством туннельных переходов относительно легко присоединяются к проводящим элементам, что позволяет применять методы туннельной спектроскопии для исследования. Удерживание квантовых точек может также обеспечиваться электростатическим потенциалом (создаваемым внешними электродами, легированием, деформацией или примесями).
Высокоупорядоченные массивы квантовых точек могут быть также самособирающимися при применении электрохимических методов. Матрица может быть создана путем индуцирования ионной реакции на поверхности раздела «электролит-металл», которая приводит к спонтанной сборке наноструктур, включая квантовые точки, на металле, после чего эту структуру используют в качестве маски для мезатравления этих наноструктур на выбранном субстрате.
Обычно лабораторное изготовление квантовых точек основано на способе, называемом «двойной инжекцией при высокой температуре», который не применяется в промышленном производстве, поскольку он требует больших количеств квантовых точек. Воспроизводимый метод создания большего количества соответствующих высококачественных квантовых точек включает генерирование наночастиц из химических соединений-предшественников в присутствии соединений молекулярных кластеров в условиях, которые благоприятствуют сохранению целостности молекулярного кластера, и действует как предварительно полученная затравочная матрица. Отдельные молекулы кластерного соединения действуют как затравки или как зародыши кристаллизации, из которых начинается рост наночастиц. В этом методе стадия образования зародышей кристаллизации, проводимая при высоких температурах, необязательно должна инициировать рост наночастиц, поскольку подходящие участки образования зародыша кристаллизации уже были образованы в данной системе посредством молекулярных кластеров. Значительным преимуществом этого метода является его высокая масштабируемость.
В современных биологических анализах используются различные виды органических красителей. Однако с каждым годом становится очевидной потребность в красителях, обладающих большей адаптируемостью, и традиционные красители часто уже не удовлетворяют нужным требованиям. Для этой цели квантовые точки, по нескольким своим свойствам, обладают явно превосходящими свойствами традиционных органических красителей, быстро заняли свою нишу, где такими наиболее явно выраженными свойствами являются их яркость (обусловленная высоким квантовым выходом), а также их стабильность (дающая гораздо меньшую степень фотоотбеливания). Было установлено, что квантовые точки имеют в 20 раз большую яркость и в 100 раз большую стабильность, чем традиционные флуоресцентные репортеры. Для слежения одной частицы, небольшим недостатком квантовых точек является их неоднородное мерцание.
Очевидно, что применение квантовых точек для высокочувствительной визуализации клеток имеет большие преимущества по сравнению с методом, применяемым в последнем десятилетии. Повышенная фотостабильность квантовых точек, например, позволяет получить множества последовательных изображений в плоском фокусе, которые затем могут быть преобразованы в трехмерное изображение с высоким разрешением. Другим применением, при котором используется экстраординарная фотостабильность зондов квантовых точек, является слежение за молекулами и клетками в реальном времени, проводимое в течение длительных периодов времени. Исследователи могут наблюдать квантовые точки в лимфоузлах мышей в течение более 4 месяцев.
Полупроводниковые квантовые точки также были использованы для in vitro визуализации предварительно помеченных клеток. При этом ожидается, что возможность прослеживать миграцию одной клетки в реальном времени будет играть важную роль в некоторых исследованиях в различных областях науки, например, в исследованиях по эмбриогенезу, по выявлению метастазов рака, в терапии с использованием стволовых клеток и в лимфоцитарной иммунологии.
C. Наборы для детектирования
В других своих вариантах настоящее изобретение относится к наборам для детектирования, которые могут быть использованы в описанных выше методах. Этот набор включает пептоиды согласно изобретению. Таким образом, эти наборы будут содержать, в соответствующих упаковках, один или несколько пептоидов, которые связываются с аутореактивными Т-клетками, присоединенными, но необязательно, к детектирующему реагенту и/или к носителю.
В некоторых вариантах изобретения, в которых пептоид был предварительно связан с твердым носителем, полученный носитель может представлять собой колоночную матрицу, гранулы, полоску или лунку микротитрационного планшета. Иммунодетектирующие реагенты данного набора могут быть также получены в различных формах, включая детектируемые метки, ассоциированные или связанные с данным пептоидом или антителом. Репрезентативными антителами являются антитела, обладающие аффинностью связывания с поверхностными антигенами на Т-клеточных рецепторах.
Упаковки наборов обычно представляют собой по меньшей мере один сосуд, одну тест-пробирку, одну колбу, одну бутыль, один шприц или один другой контейнер, в которые может быть помещен пептоид, или которые предпочтительно предназначены для взятия аликвот. Наборы согласно изобретению могут также включать контейнеры для хранения пептоида и антитела, и контейнеры для любых других реагентов, где указанные контейнеры, перед их поступлением в продажу, должны быть герметично упакованы. Такие контейнеры могут включать инъекции или пластиковые упаковки, сформованные путем выдувания, в которых хранятся нужные сосуды.
III. Терапия
В настоящем изобретении также рассматривается применение пептоидов, специфически связывающихся с аутореактивными Т-клетками, в целях терапии. При аутоиммунном заболевании иммунный ответ организма направлен против собственных антигенов. Чаще всего, такой процесс инициируется некоторыми Т-клетками, которые становятся восприимчивыми к антигену собственного организма, и такой процесс не происходит у здоровых индивидуумов. Если количество этих аутореактивных Т-клеток будет селективно снижаться или если они будут элиминироваться и при этом не будут элиминироваться другие Т-клетки, необходимые для нормального иммунного надзора и нормальной активности, то симптомы аутоиммунного заболевания должны быть если не совсем устранены, то по меньшей мере ослаблены.
A. Методы элиминации Т-клеток, основанные на адгезии
В одном из вариантов изобретения было высказано предположение, что носители, покрытые пептоидами, имеющими подтвержденную специфичность к аутореактивным Т-клеткам, могут быть использованы для «сортировки» клеток крови, взятых у индивидуумов, страдающих аутоиммунным заболеванием. В этом методе должны быть использованы такие же параметры и такое же оборудование для лейкафереза, которые применяются в других методах, таких как лечение рака или сбор стволовых клеток.
В общих чертах, лейкаферез представляет собой лабораторную процедуру, при которой лейкоциты выделяют из пробы крови. Это может быть осуществлено для снижения очень большого числа лейкоцитов у индивидуумов с раковой опухолью (лейкозом) или в целях удаления лейкоцитов для переливания крови. Альтернативно, удалены могут быть только гранулоциты, макрофаги и моноциты, а лимфоциты, в основном, должны быть оставлены без изменения. Указанный метод применяется для лечения аутоиммунных заболеваний, таких как язвенный колит и ревматоидный артрит, при которых указанные клетки принимают активное участие в воспалительном процессе.
Пептоид может быть связан с носителем, через который может проходить кровь, что позволяет аутореактивным Т-клеткам связываться с носителем, в результате чего они могут быть удалены из образца перед возвращением пациенту. В противоположность этому, Т-клетки, не связывающиеся с пептоидом, не будут связанными и они должны быть возвращены пациенту. Забор крови у пациента осуществляют внутривенно и возвращают тем же способом, обычно в другую руку. Кровь обычно подают через носитель с помощью насоса. Такую процедуру обычно осуществляют в течение 3-4 часов.
B. Терапия с применением токсинов и иммуноконъюгатов
В другом варианте изобретения, пептоиды согласно изобретению используют в качестве нацеливающих агентов для доставки нужного вещества, специфичного для Т-клеток, с которыми оно связывается. В одном из вариантов изобретения нужным веществом может быть токсин, который может быть связан с пептоидами стандартными химическими методами перекрестного связывания. Токсин имеет различные формы и обладает широким спектром действия, как подробно обсуждается ниже. Другим вариантом является связывание иммунного эффектора с пептоидом для нацеливания на Т-клетки. Одним из таких иммунных эффекторов является Fc-содержащая молекула IgG. Обсуждение Fc-содержащих молекул также приводится ниже.
Для связывания пептоидов могут быть использованы линкеры широкого ряда. Обычно некоторые линкеры являются более предпочтительными по сравнению с другими линкерами, что обусловлено различием их фармакологических свойств и активностей, но, в основном, для объединения пептоидов согласно изобретению с токсинами могут быть использованы любые линкерные/связывающие агенты, известные специалистам, такие как авидин-биотиновые связи; амидные связи; сложноэфирные связи; связи, образуемые сложными тиоэфирами, эфирные связи; связи, образуемые простыми тиоэфирами; фосфоэфирные связи; фосфорамидные связи; ангидридные связи; дисульфидные связи; ионные связи и гидрофобные связи.
- Способность к перекрестному связыванию с последующим отщеплением
- Растворимость в воде
- Конъюгирование фермента с антителом
- Конъюгирование гаптена с белком-носителем
- Растворимость в воде
- Конъюгирование фермента с антителом
- Конъюгирование гаптена с белком-носителем
- Конъюгирование фермента с антителом
- Растворимость в воде
Репрезентативный гетеробифункциональный перекрестно-связывающий линкер содержит две реакционноспособных группы: одну группу, которая реагирует с первичной аминогруппой (например, N-гидроксисукцинимид), и другую группу, которая реагирует с тиоловой группой (например, пиридилдисульфид, малеимиды, галогены и т.п.). Посредством первичной реакционноспособной аминогруппы перекрестно-связывающий линкер может реагировать с лизиновым(ми) остатком(ами) белка (например, выбранного антитела или его фрагмента), а посредством реакционноспособной тиоловой группы перекрестно-связывающий линкер, уже связанный с первым белком, реагирует с цистеиновым остатком (свободной сульфгидрильной группой) другого белка (например, селективного агента).
В частности, может быть использован перекрестно-связывающий линкер, обладающий подходящей стабильностью в крови. Специалистам известно множество типов линкеров, содержащих дисульфидную связь, которые с успехом могут быть использованы для конъюгирования нацеливающих агентов и терапевтических/профилактических средств. Линкеры, содержащие дисульфидную связь, которая является стерически затрудненной, может обладать большей стабильностью in vivo, что обеспечивает предотвращение высвобождения нацеливающего пептида еще до достижения им активного сайта. Таким образом, указанные линкеры входят в одну из групп связывающих агентов.
Другим перекрестно-связывающим реагентом является SMPT, который представляет собой бифункциональный перекрестно-связывающий линкер, содержащий дисульфидную связь, которая является «стерически затрудненной» из-за присутствия смежного бензольного конца и метильных групп. Очевидно, что стерическое затруднение дисульфидной связи обеспечивает защиту такой связи от атаки тиолатных анионов, таких как глутатион, которые могут присутствовать в тканях и в крови, и, тем самым, предупреждает нарушение взаимодействия конъюгата перед доставкой связанного агента в сайт-мишень.
Перекрестно-связывающий реагент SMPT, как и многие другие известные перекрестно-связывающие реагенты, обладает способностью к перекрестному связыванию с функциональными группами, такими SH цистеина или первичных аминов (например, эпсилон-аминогруппа лизина). Другие возможные типы перекрестно-связывающих линкеров включают гетеро-бифункциональные фотореактивные фенилазиды, содержащие расщепляемую дисульфидную связь, такие как сульфосукцинимидил-2-(п-азидосалициламидо)этил-l,3'-дитиопропионат. N-гидрокси-сукцинимидильная группа реагирует с первичными аминогруппами, а фенилазид (после фотолиза) неспецифически реагирует с любым аминокислотным остатком.
В настоящем изобретении, помимо стерически затрудненных перекрестно-связывающих линкеров, могут быть также использованы стерически незатрудненные линкеры. Другими подходящими перекрестно-связывающими линкерами, которые, как считается, не содержат или не образуют защищенного дисульфида, являются SATA, SPDP и 2-иминотиолан (Wawrzynczak & Thorpe, 1986). Использование таких перекрестно-связывающих линкеров хорошо известно специалистам. Другой вариант включает использование гибких линкеров.
В патенте США 4680338 описаны бифункциональные линкеры, используемые для получения конъюгатов лигандов с амин-содержащими полимерами и/или белками, а в частности для получения конъюгатов антител с хелатообразующими агентами, ферментами, детектируемыми метками и т.п. В патентах США 5141648 и 5563250 описаны расщепляемые конъюгаты, содержащие лабильные связи, которые расщепляются в различных условиях умеренной жесткости. Особая ценность такого линкера заключается в том, что представляющий интерес агент может быть связан непосредственно с этим линкером, а его расщепление приводит к высвобождению активного агента. Предпочтительно, такое применение включает присоединение свободной аминогруппы или свободной сульфгидрильной группы к белку, такому как антитело, или к лекарственному средству.
В патенте США 5856456 описаны пептидные линкеры, используемые для связывания полипептидных компонентов, с получением гибридных белков, например, одноцепочечных антител. Линкер имеет длину примерно 50 аминокислот, содержит по меньшей мере одну заряженную аминокислоту (предпочтительно, аргинин или лизин), за которой следует пролин, и характеризуется более высокой стабильностью и пониженной способностью к образованию агрегатов. В патенте США 5880270 описаны аминоокси-содержащие линкеры, которые могут быть использованы в различных методах иммунодиагностики и разделения.
В настоящем изобретении также рассматриваются пептидные линкеры, включающие сайт расщепления для фермента, который преимущественно находится в клеточной среде или является активным в этой среде. Репрезентативными формами таких пептидных линкеров являются пептидные линкеры, расщепляемые урокиназой, плазмином, тромбином, фактором IXa, фактором Xa или металлопротеиназой, такой как коллагеназа, желатиназа или стромелизин.
Однако, по сравнению с пептидами и белками, пептоиды, полученные посредством синтеза, кроме того, дают уникальную возможность для более простого и более эффективного введения положений присоединения.
1. Токсины
В настоящем изобретении могут быть использованы различные биологические токсины. Используемый здесь термин «биотоксин» означает токсин биологического происхождения. Токсины, продуцируемые микроорганизмами, представляют собой ценные детерминанты вирулентности, ответственные за микробную патогенность и/или «ускользание» от «надзора» иммунной системы хозяина. Биотоксины широко варьируют по своему действию и механизмам этого действия и могут представлять собой белок с очень сложной структурой (яд колпачковидных улиток содержит дюжину небольших белков, каждый из которых нацелен на конкретный нервный канал или рецептор), или относительно небольшой белок. Биотоксины по своей природе обладают двумя главными функциями, а именно, поражающими (у пауков, змей, скорпионов, медуз, ос) и защитными (у пчел, муравьев, термитов, медоносных пчел, ос, лягушек-древолазов). Из множества биотоксинов хорошо известных типов, некоторые типы биотоксинов включают цианотоксины (продуцируемые цианобактериями), гемотоксины (направленные на эритроциты и разрушающие их; у гремучих змей, таких как гремучники), некротоксины (вызывающие некроз; у коричневого отшельника и у африканской гадюки - Bitis arietans), нейротоксины (у паука черная вдова, у скорпионов, у кубомедуз).
В соответствии с настоящим изобретением, особый интерес представляют цитотоксины, такие как рицин, получаемый из клещевины. Могут быть также использованы и бактериальные токсины, включая токсины Clostridium: tetani (тетаноспазмин), perfringens (альфа-токсин, энтеротоксин), difficile (A, B), botulinum (ботокс), Staphylococcus (альфа/бета/дельта S. aureus, эксфолиатин, токсин синдрома токсического шока, SEB), а также токсин сибирской язвы, листериолизин O, стрептолизин, лейкоцидин (лейкоцидин Пэнтона-Валентина), фактор спинного мозга, дифтерийный токсин, токсин, вызывающий шигеллез, веротоксин/токсин, подобный шигеллез-индуцирующему токсину (E. coli), термостабильный энтеротоксин E. coli/энтеротоксин, холерный токсин, коклюшный токсин, экзотоксин Pseudomonas, внеклеточная аденилатциклаза типа I (суперантиген), типа II (порообразующие токсины), типа III (AB-токсин/AB5), липополисахарид (липид A), дельта-эндотоксин Bacillus thuringiensis, фактор свертывания крови А, и белок А, связывающийся с фибронектином.
Инактивация белков под действием излучения, испускаемого хромофорами (CALI), включает генерирование в высокой степени реакционноспособных молекул (часто синглетного кислорода) из хромофора (радиоактивного вещества, используемого в боеголовках) под действием света. Реакционноспособные молекулы разрушают белок-мишень путем инактивации его биологической функции. Эти молекулы могут быть использованы для блокирования функций белка.
Эксперименты, проведенные авторами настоящего изобретения, показали, что хромофор на основе рутения является эффективной радиоактивной меткой. Эти эксперименты продемонстрировали, что хромофор на основе рутения может проникать в клетки и инактивировать мишень, что позволяет осуществлять CALI-обработку живых клеток in vivo и ex vivo.
2. Fc-содержащие молекулы
Двухвалентные антитела состоят из четырех полипептидных цепей, то есть из двух коротких фрагментов, имеющих вариабельные области, и двух более длинных фрагментов, имеющих вариабельные и константные области. Длинные и короткие цепи взаимодействуют посредством дисульфидной связи и образуют половину обычной молекулы антитела, причем вариабельная область ответственна за связывание с антигеном (Fv или вариабельный фрагмент). Две половины антитела взаимодействуют посредством отдельных дисульфидных связей и образуют Fc-часть (кристаллизующийся фрагмент).
Fc-часть играет важную роль в модуляции активности клеток иммунной системы, а именно, в связывании с различными клеточными рецепторами и иммунными молекулами, такими как белки комплемента. Благодаря этому механизму она опосредует различные физиологические эффекты, включая опсонизацию, лизис клеток и дегрануляцию тучных клеток, базофилов и эозинофилов. В частности, такая молекула может служить маркером деструкции клеток другими иммунными компонентами. Настоящее изобретение относится к применению антител или их Fc-содержащих фрагментов для нацеливания на T-клетки с последующей их деструкцией.
Один конкретный метод, который может применяться для этих целей, описан Popkov и сотрудниками (2009). Авторами настоящего изобретения были сконструированы антитела, содержащие лиганды-адаптеры интегрина α(v)β(3) и α(v)β(5), которые, в случае их самосборки, могут вырабатывать постоянный химически программируемый поликлональный ответ против имплантируемых опухолей, содержащих эти мишени. Значительный терапевтический ответ наблюдается без применения вспомогательной терапии. Химически программируемые иммунные ответы запускаются антителозависимой клеточной цитотоксичностью и комплемент-опосредуемой цитотоксичностью. Это свидетельствует о способности небольших молекул-лигандов «захватывать» антитела путем перенацеливания их специфичности связывания.
C. Комбинированная терапия
Обсуждаемая выше терапия может быть осуществлена в комбинации с другим агентом, используемым для лечения аутоиммунного заболевания. При объединении этих агентов может быть достигнут аддитивный эффект без повышения токсичности (если она присутствует), ассоциированной с монотерапией. Кроме того, может наблюдаться эффект, превышающий аддитивный эффект (синергия). Таким образом, комбинированная терапия является широко распространенным способом применения новых терапевтических схем лечения.
Лечение пептоидами может быть осуществлено до, одновременно и/или после введения другого(их) агента(ов) через интервалы времени, составляющие от нескольких минут до нескольких недель. В некоторых вариантах изобретения, в которых предусматривается лечение пептоидами вместе с введением другого(их) агента(ов), обычно необходимо, чтобы период времени между каждой доставкой не был слишком большим, и чтобы лечение пептоидом и другим(ими) агентом(ами) еще оказывало преимущественно комбинированное действие на индивидуума. Так, например, в таких случаях предусматривается, что вместе с введением пептоидов могут быть, в основном, одновременно введены два, три, четыре или более лекарственных средства (то есть, примерно менее чем через минуту). В других аспектах изобретения один или несколько агентов могут быть введены, в основном, одновременно или в определенный промежуток времени до или после введения пептоида, где указанный промежуток времени составляет примерно 1 минуту, примерно 5 минут, примерно 10 минут, примерно 20 минут, примерно 30 минут, примерно 45 минут, примерно 60 минут, примерно 2 часа, примерно 3 часа, примерно 4 часа, примерно 5 часов, примерно 6 часов, примерно 7 часов, примерно 8 часов, примерно 9 часов, примерно 10 часов, примерно 11 часов, примерно 12 часов, примерно 13 часов, примерно 14 часов, примерно 15 часов, примерно 16 часов, примерно 17 часов, примерно 18 часов, примерно 19 часов, примерно 20 часов, примерно 21 час, примерно 22 часа, примерно 23 часа, примерно 24 часа, примерно 25 часов, примерно 26 часов, примерно 27 часов, примерно 28 часов, примерно 29 часов, примерно 30 часов, примерно 31 час, примерно 32 часа, примерно 33 часа, примерно 34 часа, примерно 35 часов, примерно 36 часов, примерно 37 часов, примерно 38 часов, примерно 39 часов, примерно 40 часов, примерно 41 час, примерно 42 часа, примерно 43 часа, примерно 44 часа, примерно 45 часов, примерно 46 часов, примерно 47 часов, примерно 48 часов, примерно 1 день, примерно 2 дня, примерно 3 дня, примерно 4 дня, примерно 5 дней, примерно 6 дней, примерно 7 дней, примерно 8 дней, примерно 9 дней, примерно 10 дней, примерно 11 дней, примерно 12 дней, примерно 13 дней, примерно 14 дней, примерно 15 дней, примерно 16 дней, примерно 17 дней, примерно 18 дней, примерно 19 дней, примерно 20 дней, примерно 21 день, примерно 1, примерно 2, примерно 3, примерно 4, примерно 5, примерно 6, примерно 7 или примерно 8 недель или более, и любой другой промежуток времени в указанных интервалах.
В настоящем изобретении могут быть использованы различные комбинированные схемы лечения пептоидом и одним или несколькими агентами. Неограничивающие примеры таких комбинаций представлены ниже, где лечение пептоидом обозначается «А», а лечение другим средством обозначается «В»:
A/B/A B/A/B B/B/A A/A/B A/B/B B/A/A A/B/B/B B/A/B/B
B/B/B/A B/B/A/B A/A/B/B A/B/A/B A/B/B/A B/B/A/A
B/A/B/A B/A/A/B A/A/A/B B/A/A/A A/B/A/A A/A/B/A
Таким образом, пептоидная терапия согласно изобретению может быть проведена в комбинации с другими терапиями, применяемыми для лечения обсуждаемых выше расстройств, но она также включает терапию различными противовоспалительными средствами и иммунодепрессантами.
IV. Примеры
Нижеследующие примеры приводятся для иллюстрации предпочтительных вариантов настоящего изобретения. Специалистам в данной области очевидно, что способы, описанные в примерах и разработанные авторами настоящего изобретения для практического осуществления изобретения, представляют собой репрезентативные способы, а поэтому эти способы рассматриваются как предпочтительные варианты его осуществления. Однако, исходя из настоящего описания, очевидно, что в конкретные варианты может быть внесено множество изменений, которые будут давать аналогичные или подобные результаты, не выходящие за рамки существа и объема изобретения.
ПРИМЕР 1 - Методы
Синтез пептоидной библиотеки. Подробное описание конструирования пептоидной библиотеки было опубликовано ранее в литературе (Udugamasooriya et al., 2008). Вкратце, библиотеку синтезировали на макрогранулах TentaGel (диаметр 140-170 мкM; реагент для замены: 0,48 ммол/г смолы; Rapp Polymere). Синтез библиотеки осуществляли с использованием восьми различных аминов с получением теоретического разнообразия из 262144 соединений. 9-мерную библиотеку синтезировали в соответствии с протоколом синтеза в микроволновой печи (1000 Ватт) и методом разделения и объединения (Olivos et al., 2002). По окончании синтеза библиотеки, гранулы обрабатывали 95% TFA, 2,5% триизопропилсилана и 2,5% водной смеси в течение 2 часов для удаления защитных групп боковой цепи, а затем нейтрализовали 10% диизопропилэтиламином в ДМФ. Гранулы промывали дихлорметаном, сушили и хранили при 4°C вплоть до их использования.
Повторный синтез растворимых пептоидов. Повторный синтез пептоидных лигандов и скрэмблированных контрольных пептидов проводили на амидной смоле MBHA Knorr (Novabiochem) в соответствии со стандартным протоколом синтеза в микроволновой печи (Olivos et al., 2002) (микроволнолновая печь 1000 ватт, 10% мощность, подаваемая 2×15 секунд с быстрым перемешиванием между подачами). Для получения биотинилированных пептоидов и биотин-DOPA-пептоидов, Fmoc-Glu(биотинил-ПЭГ)-OH (Novabiochem) и Fmoc-DOPA (Novabiochem) последовательно присоединяли к амидной смоле MBHA Knorr в соответствии со стандартным протоколом пептидного синтеза с применением химического Fmoc-метода (Udugamasooriya et al., 2008). Для создания пептоидной части молекул, описанных выше, применяли стандартный протокол синтеза, проводимого в микроволновой печи. Пептоиды отщепляли от смолы добавлением 95% TFA, 2,5% триизопропилсилана и 2,5% воды в течение 2 часов, а затем очищали с использованием ВЭЖХ-системы Waters Breeze. Массу пептоидов определяли на масс-спектрометре MALDI-Voyager DE Pro.
Мыши. Самок мышей B10.PL и 2D2 MOG-TCR-трансгенных мышей 35-55 закупали в лаборатории Jackson Laboratories (Bar Harbor, ME) и содержали в условиях, одобренных Федеральными регуляторными органами, в лаборатории Юго-западного Медицинского центра при Университете штата Техас (Даллас, Техас) в соответствии с инструкциями Комитета по содержанию и использованию экспериментальных животных. Vα2.3Vβ8.2-TCR-трансгенные мыши B10.PL были любезно предоставлены Dr. Olaf Stuve (Юго-западный Медицинский центр при Техасском университете, Даллас, Техас), а затем их размножали и содержали в описанных выше условиях содержания. При осуществлении экспериментов возраст всех мышей составлял от 7 до 10 недель.
Индуцирование EAE. EAE индуцировали у мышей B10.PL дикого типа путем введения в бок в 4 участка подкожной инъекции 50 мкг пептида основного миелинового белка MBP Ac1-11, эмульгированного в полном адъюванте Фрейнда. Коклюшный токсин вводили во время иммунизации и через 48 часов путем i.р. инъекции. Мышей ежедневно наблюдали на клинические признаки EAE, и им присваивали клиничекую оценку по следующим критериям: 0 = заболевание отсутствует, 1 = обвислый хвост, 2 = нарушение функции задних конечностей, 3 = сильное нарушение функции задних конечностей/частичный паралич, 4 = паралич задних конечностей, 5 = предсмертное состояние, и 6 = гибель от EAE (Racke, 2001).
Выделение CD4 + -T-клеток. У мышей с EAE, у мышей дикого типа или у TCR-трансгенных мышей выделяли селезенку и лимфоузлы, а затем получали моноклеточные суспензии путем пропускания через нейлоновый 70 мкм-фильтр для клеток (BD Biosciences). Затем CD4+-T-клетки выделяли путем негативного отбора с использованием набора для обогащения CD4+-T-клетками (BD Biosciences) в соответствии с инструкциями производителей. Вкратце, к клеточной суспензии добавляли коктейль, обогащенный биотинилированными мышиными CD4+-T-лимфоцитами. Добавление этого коктейля позволяло осуществлять мечение эритроцитов и лейкоцитов, но не CD4+-T-клеток. После промывки к суспензии добавляли магнитные частицы со стрептавидином, и все помеченные клетки переносили на магнит, а немеченые CD4+-T-клетки оставляли в суспензии. CD4+-T-клетки сохраняли, а все остальные клетки отбрасывали. После выделения клетки промывали, подсчитывали и ресуспендировали в полной среде RPMI 1640 для последующего применения.
Анализ на связывание с помощью проточной цитометрии. После выделения CD4+-T-клеток у TCR-трансгенных мышей и у контрольных мышей дикого типа, клетки промывали и ресуспендировали в 0,1% PBS/BSA (FACS-буфер). Клетки инкубировали с возрастающими концентрациями (1 мкМ, 10 мкМ, 100 мкМ, 250 мкМ или 500 мкМ) либо биотин-DOPA-AG12A-пептоида, либо контрольного биотин-DOPA-пептоида и инкубировали в течение 30 минут при 37°C. После этого к клеткам быстро добавляли 5 мM периодата натрия для перекрестного связывания пептоида с рецептором-мишенью. Эту реакцию гасили DTT, и клетки два раза промывали 0,1% PBS/BSA. Затем к клеткам добавляли Fc-блок (BD Biosciences) и оставляли на 15 минут на льду в целях снижения уровня неспецифического связывания с Fc-рецепторами. Клетки окрашивали 1 мкг анти-CD4-PerCp Cy5.5 антитела и 0,02 мкг антитела против стрептавидина-АПК (BD Biosciences) в течение 15 минут на льду. После окрашивания проводили 2 промывки 0,1% PBS/BSA, и клетки помещали на проточный цитометр FACS Calibur для оценки связывания с пептоидом. Данные анализировали с помощью компьютерной программы Flowjo (Treestar) для определения средней интенсивности флуоресценции, и результаты представляли в виде гистограмм. Затем строили график зависимости величин средней интенсивности флуоресценции (MFI) с использованием компьютерной программы Graphpad Prism для оценки величины Kd, и полученные результаты представляли в виде линейной кривой.
Химическое перекрестное связывание. CD4+-T-клетки выделяли у Vα2.3/Vβ8.2-TCR-трансгенных мышей и у мышей дикого типа, описанных выше. Кроме того, спленоциты, отделенные от CD4+-T-клеток, также использовали в качестве негативного контроля. Реакции перекрестного связывания проводили в ½ буфере для экстрации клеточных ядер (NEB), как было описано ранее (Lim et al., 2007). Приблизительно 10×106 клеток для каждого эксперимента инкубировали с 5 мкМ биотин-DOPA-AG12A-пептоида в течение 30 минут при комнатной температуре. После инкубирования добавляли 5 мM NaIО4 для перекрестного связывания пептоида с рецептором-мишенью. После быстрого инкубирования реакцию гасили 6X загрузочным буфером, содержащим 100 мM DTT. Затем осуществляли стандартный электрофорез в ДСН-ПААГ и проводили иммуноблот-анализ с использованием ПХ-конъюгированных антител против нейтравидина и анти-Vα2 TCR антител (eBioscience).
Анализ на пролиферацию с использованием CFSE. После выделения CD4+-T-клеток, Vα2.3Vβ8.2-TCR-трансгенные Т-клетки, В-клетки или MOG-35-55-TCR-трансгенные Т-клетки метили CFSE (молекулярные зонды) в соответствии с инструкциями производителей. Вкратце, клетки ресуспендировали в концентрации 1×106 на мл в PBS и инкубировали с 0,5 мкM CFSE при 37°C в течение 10 минут. Реакцию окрашивания гасили добавлением 5 объемов культуральной среды, содержащей 10% FBS. Клетки центрифугировали, промывали и ресуспендировали в полной среде RPMI 1640. Затем клетки высевали при плотности 1×106 на мл и инкубировали с возрастающими концентрациями либо пептоида AG12A, либо контрольного пептоида (1 мкМ, 10 мкМ, 20 мкМ, 40 мкМ, 60 мкМ, 80 мкМ, 100 мкМ, 200 мкМ или 500 мкМ) в течение 30 минут при 37°C. Антигенпрезентирующие клетки выделяли из селезенки мышей дикого типа B10.PL, а затем к культуре добавляли 10 мкг/мл MBP Ac1-11, MOG 35-55 или LPS для стимуляции клеток. Клетки оставляли в культуре на 5 дней, окрашивали анти-CD4-PerCp антителом (BD Biosciences) и помещали на проточный цитометр FACS Calibur для оценки деления клеток. Данные анализировали с использованием платформы для выполнения компьютерных программ Flowjo (Treestar) по пролиферации для определения процента делящихся клеток. Затем с использованием компьютерной программы Graphpad Prism строили график по данным процента деления клеток, и этот график представляли в виде линейной кривой.
Получение конъюгатов «рутений-пептоид». Бис(2,2'-бипиридин)-4'-метил-4-карбоксибипиридин-рутений-бис(гексафторфосфат), диизопропилкарбодиимид и HOBt растворяли в ДМФ и подвергали реакции с ранее полученными деблокированными пептоидами в течение 2 часов при комнатной температуре (Lee et al., 2008). Соединения промывали, отщепляли от смолы, как описано выше, и очищали с помощью ВЭЖХ. Массу каждого пептоида определяли с помощью масс-спектрометра MALDI-Voyager DE Pro.
Анализ на пролиферацию путем включения меченного тритием тимидина. У Vα2.3/Vβ8.2-TCR-трансгенных мышей, ранее не подвергавшихся обработке, или у 2D2 MOG 35-55 TCR-трансгенных мышей брали селезенку и получали моноклеточные суспензии путем пропускания под давлением через 70 мкм-фильтр для клеток (BD Biosciences). CD4+-T-клетки выделяли, как описано выше, и ресуспендировали в полной среде RPMI, не содержащей фенолового красного. 1×105 клеток на лунку высевали в 96-луночный планшет и инкубировали с 1 мкМ- или 100 нМ-концентрациями AG12A-Ru2+, контрольного пептида-Ru2+, ДМСО или PBS с четырьмя повторностями. Затем клетки облучали в течение 10 минут под ксеноновой дуговой лампой 150 ватт (Oriel, Stamford, CT), как описано в литературе (Lee et al., 2008). После облучения Т-клетки активировали 10 мкг/мл MBP Ac1-11 и 3×105 антигенпрезентирующих клеток на лунку. Культуры выдерживали в 96-луночных плоскодонных планшетах в течение 96 часов при 37°C в условиях повышенной влажности в атмосфере 5% CO2/воздуха. На лунки подавали импульс 0,5 мкКи/лунку [метил-3Н]тимидина в течение последних 16 часов культивирования. Клетки собирали на стеклянных фильтрах и включение [метил-3Н]тимидина измеряли на счетчике Betaplate (PerkinElmer Wallac, Gaithersburg, MD). Фоновые уровни пролиферации клеток, которые не были стимулированы антигеном, вычитали для определения процента максимальной пролиферации для каждого условия. Результаты определяли как среднее для культур с четырьмя повторностями, и представляли как ср. ст. ош.
Адоптивный перенос. У Vα2.3/Vβ8.2-TCR-трансгенных мышей, ранее не подвергавшихся обработке, брали селезенку и получали моноклеточные суспензии путем пропускания под давлением через 70 мкм-фильтр для клеток (BD Biosciences). CD4+-T-клетки выделяли, обрабатывали AG12A-Ru2+ или контрольным пептоидом-Ru2+, облучали и активировали пептидом MBP Ac1-11, как описано выше. Через 72 часа клетки промывали PBS, и 10×106 клеток i.р. инъецировали мышам B10.PL, ранее не подвергавшимся обработке. Затем мышей ежедневно наблюдали на выявление клинических признаков EAE, как описано в литературе (Racke, 2001).
Скрининг-анализ гранул методом Bicolor. Приблизительно 300000 гранул подвергали набуханию в ДМФ, промывали PBS и уравновешивали в полной среде RPMI 1640, содержащей 3% BSA. CD4+-T-клетки, выделенные у мышей с EAE или у мышей дикого типа, ресуспендировали в RPMI и метили с использованием квантовых точек (Invitrogen) в соответствии с инструкциями производителей. CD4+-T-клетки, выделенные у мышей с EAE, метили красителем Qtracker 655 (красным), а CD4+-T-клетки, выделенные у мышей дикого типа, метили красителем Qtracker 565 (зеленым). Меченые клетки смешивали в отношении 1:1 с клетками каждого типа при плотности приблизительно 10×106. Затем клетки инкубировали с библиотекой пептоидных гранул в течение ночи в инкубаторе при 37°C с 5% CO2 при легком встряхивании. Гранулы осторожно промывали 2 раза средой RPMI, а затем визуализировали под флуоресцентным микроскопом (Olympus BX-51) с возбуждением 340-380 нм с использованием фильтра DAPI (с полным увеличением 100X). Гранулы, связывающиеся только с клетками, меченными красным, отбирали вручную с помощью 20-мкл пипетки. Затем «наилучшие» гранулы промывали, кипятили с 1% ДСН в течение 30 минут и подвергали автоматическому секвенированию по Эдману.
ПРИМЕР 2 - Результаты
Скрининг на специфические аутореактивные Т-клеточные лиганды при EAE. Заболевание EAE, подобное рассеянному склерозу (MS) (Noseworthy et al., 2000), индуцировали у генетически восприимчивых видов грызунов путем иммунизации миелиновыми белками или пептидами, или путем пассивного переноса миелин-специфических CD4+-T-клеток (Zamvil and Steinman, 1990). Исследования EAE показали, что миелин-специфические CD4+-T-клетки, которые активируются в периферических органах и продуцируют провоспалительные цитокины, играют важную роль в патогенезе MS (Zamvil and Steinman, 1990). Кроме того, эти Т-клетки экспрессируют Т-клеточные рецепторы, которые, очевидно, преимущественно распознают миелиновый основный белок в центральной нервной системе индивидуумов с заболеванием, что приводит к деструкции миелиновой оболочки и, в конечном счете, к нарушению неврологической функции (Zamvil and Steinman, 1990). Поэтому терапевтическая стратегия, которая специфически направлена только на аутореактивные Т-клетки, представляет интерес для исследования MS, а также других заболеваний, опосредуемых Т-клетками. Как и в первой стадии исследования, авторы настоящего изобретения сосредоточили свое внимание на получении синтетических соединений, обладающих способностью к высокоспецифическому связыванию с аутореактивными Т-клетками при EAE.
Для этих целей авторами настоящего изобретения была адаптирована стратегия скрининга, разработанная ранее в их лаборатории, для выделения пептоидов (Simon et al., 1992), которые обладают высокой специфичностью связывания с интегральными мембранными рецепторами (Udugamasooriya et al., 2008). В этом протоколе клетки, которые экспрессируют или не экспрессируют рецептор-мишень, но которые, предположительно, являются идентичными друг другу, метят красными и зелеными квантовыми точками, соответственно. Затем клетки этих двух типов смешивают и инкубируют с тысячами гидрофильных гранул, каждая из которых представляет уникальный пептоид. После этого гранулы, которые связываются только с клетками, меченными красным красителем, но не с зелеными клетками, собирают, при этом предполагается, что эти клетки обладают высокой специфичностью связывания с рецептором-мишенью, поскольку пептоид не должен распознавать все другие молекулы на клеточной поверхности, что позволяет исключить клетки, окрашенные зеленым, и выявить только «нужные» клетки (фиг. 1A).
Для применения такой технологии двухцветного скрининга в целях решения рассматриваемой проблемы, EAE индуцировали у мышей B10.PL путем иммунизации пептидом основного миелинового белка Ac1-11 (MBP Ac1-11). Иммунизация этим миелиновым пептидом приводит к активации и размножению CD4+-T-клеток, экспрессирующих MBP Ac1-11-специфичный Vα2.3/Vβ8.2 TCR (Ando et al., 1989). Мышей с EAE и здоровых контрольных мышей умерщвляли после развития у них клинически подтвержденного EAE (фиг. 5A), и выделяли CD4+-T-клетки. CD4+-T-клетки, выделенные у мышей с EAE, метили квантовыми точками, излучающими в красном диапазоне спектра, а Т-клетки, взятые у контрольных мышей, метили квантовыми точками, излучающими в зеленом диапазоне спектра. Затем клетки смешивали в отношении 1:1 и инкубировали с представленной на гранулах пептоидной библиотекой, содержащей приблизительно 300000 пептоидов (фиг. 5B). Гипотеза, высказанная авторами настоящего изобретения, заключается в том, что миллионы различных Т-клеток во всех популяциях должны присутствовать на низких уровнях, и что эти две популяции могут присутствовать, до некоторой степени, в одинаковых количествах. Основным исключением должно быть возрастающее количество MBP Ac1-11-специфичных аутореактивных Т-клеток, которые размножаются в ответ на иммунизацию мышей с EAE указанным аутоантигеном. Это позволяет предположить, что, если гранулы связываются только с красными клетками, то такие клетки, по всей вероятности, будут представлять собой аутореактивные Т-клетки (фиг. 1A).
После инкубирования с пептоидными гранулами, авторами настоящего изобретения были идентифицированы два предполагаемых наилучших пептоида, которые, как наблюдалось, специфически связываются с CD4+-T-клетками, выделенными у мышей с EAE, но не с Т-клетками, выделенными у здоровых контрольных мышей (фиг. 1B, панели i и ii). Представлена другая фотография, на которой изображены пептоидные гранулы, неспецифически связывающиеся с CD4+-T-клетками, выделенными у мышей с EAE и у здоровых контрольных мышей (фиг. 1B, панель iii). Пептоиды на двух гранулах, оцененных как наилучшие, секвенировали путем деградации по Эдману (Alluri et al., 2003), и их выведенные структуры проиллюстрированы на фиг. 1C. Было обнаружено, что последовательности двух «наилучших» пептоидов имеют некоторое сходство. Авторы настоящего изобретения сосредоточили свое внимание на более подробной характеризации одного из пептоидов (AG12A).
Пептоид AG12A представляет собой лиганд для аутореактивных Т-клеток при EAE. Для того чтобы определить, связывается ли AG12A с аутореактивным TCR, авторами настоящего изобретения были использованы трансгенные мыши, у которых подавляющее большинство CD4+-T-клеток экспрессируют MBP Ac1-11-специфический TCR (Vα2.3/Vβ8.2 TCR) (Goverman et al., 1993). У этих мышей выделяли CD4+-T-клетки и тестировали на связывание с AG12A. Эту процедуру проводили несколькими способами. Сначала, AG12A повторно синтезировали на гранулах, поскольку такой пептоид представляет собой контрольный пептоид, который не был выбран в качестве Т-клеточного лиганда (фиг. 6). Затем гранулы инкубировали с Т-клетками, меченными квантовыми точками, излучающими в красном диапазоне спектра. Как показано на фиг. ID, CD4+-T-клетки, взятые от MBP-Ac1-11-TCR-трансгенных мышей, связывались с пептоидом AG12A, представленным на гранулах, а CD4+-T-клетки дикого типа не связывались с этим пептоидом (фиг. 1D).
Для дополнительного зондирования связывания AG12A с MBP- Ac1-11-специфическими Т-клетками, авторами настоящего изобретения был проведен эксперимент по химическому перекрестному связыванию, который включает окисление дигидроксифенилаланина (DOPA), присоединенного к пептоиду, с образованием промежуточного соединения ортохинона. Это промежуточное соединение может перекрестно связываться с расположенными рядом нуклеофильными остатками на белке рецептора-мишени (Burdine et al., 2004; Liu et al., 2006; Lim et al., 2007). При этом перекрестное связывание должно наблюдаться только в том случае, если DOPA-AG12A и рецептор-мишень находятся в непосредственной близости друг от друга, поскольку крупномасштабные контрольные эксперименты показали, что такой химический метод не может быть применен для связывания молекул, если только они не составляют комплекс (Liu et al., 2006). CD4+-T-клетки, взятые у Vα2.3/Vβ8.2-TCR-трансгенных мышей, инкубировали с возрастающими концентрациями меченного биотином DOPA-AG12A или контрольного DOPA-пептоида, меченного биотином. После обработки периодатом натрия, клетки окрашивали стрептавидином, конъюгированным с флуорохромом, и анти-CD4+ антителом, конъюгированным с другим флуорохромом. Пептоиды, связывающиеся с Т-клетками, оценивали путем вычисления средней интенсивности флуоресценции CD4+/стрептавидин+-клеток. Было обнаружено, что AG12A связывается с MBP Ac1-11-специфичными Т-клетками с KD, равным приблизительно 40 мкМ (фиг. 2A-B). Однако какого-либо взаимодействия между биотинилированным AG12A и Т-клетками, взятыми у мышей дикого типа, и между биотинилированным контрольным пептоидом, связанным с Vα2.3/Vβ8.2-TCR-трансгенными Т-клетками, не детектировалось (фиг. 2B).
Взаимодействие «пептоид-клетка» также анализировали с помощью электрофореза в ДСН-ПААГ и вестерн-блоттинга, проводимого с использованием нейтравидина, связанного с пероксидазой хрена (НА-ПХ). Биотин-содержащий продукт с кажущейся массой 45 кДа детектировался при инкубировании биотин-DOPA-AG12A с TCR-трансгенными Т-клетками, но не с CD4--клетками или CD4+-T-клетками, взятыми у мышей дикого типа (фиг. 2C). Молекулярная масса α- и β-цепей TCR составляет приблизительно 45 и 40 кДа, соответственно (Zamvil and Steinman, 1990), что позволяет предположить о наличии перекрестного связывания AG12A с TCR. Кроме того, при зондировании блота анти-α-Vα2 TCR антителом наблюдался продукт, который имел массу приблизительно 45 кДа и который перекрывался с полосой, детектируемой с использованием НА-ПХ, что также дает основание предположить, что AG12A перекрестно связывается с MBP Ac1-11-специфическим TCR (фиг. 2C).
AG12A представляет собой специфический антагонист опосредуемой антигеном пролиферации аутореактивных Т-клеток. Для того чтобы определить, может ли связывание пептоида с TCR подавлять антигенспецифическую пролиферацию Т-клеток, CD4+-T-клетки, взятые у MBP-Ac1-11-TCR-трансгенных мышей, инкубировали с возрастающими концентрациями AG12A или контрольного пептоида, метили сукцинимидоэфиром диацетата карбоксифлуоресцеина (CFSE) и стимулировали пептидом MBP Ac-11 и антигенпрезентирующими клетками. CSFE способен проникать в клетки в форме сложного эфира, но эти группы, после проникновения соединения в клетку, гидролизуются, что делает клетку непроницаемой. Таким образом, деление клеток приводит к снижению внутриклеточной концентрации флуорофора. После инкубирования в течение 5 дней, деление клеток оценивали с помощью проточной цитометрии. Было обнаружено, что AG12A ингибирует пролиферацию аутореактивных MBP Ac1-11-специфических Т-клеток в зависимости от дозы, где IC50 составляет приблизительно 60-80 мкM (фиг. 3A). Такое снижение пролиферации не наблюдается в случае стимуляции трансгенных Т-клеток в присутствии контрольного пептоида (фиг. 3A), и AG12A не ингибирует пролиферацию В-клеток (фиг. 3B). Особенно важно отметить, что AG12A также не ингибирует стимулированную антигеном пролиферацию TCR-трансгенных Т-клеток, специфичных к миелиновому олигодендроцитарному гликопротеину (MOG) 35-55 (фиг. 3C). Этот эксперимент со всей очевидностью продемонстрировал, что AG12A является специфичным к Т-клеткам, которые распознают антиген MBP Ac1-11, и такое распознавание не связано с какой-либо общей аффинностью по отношению к любым активированным Т-клеткам.
Ex vivo инактивация аутореактивных Т-клеток с использованием конъюгата «рутений-пептоид». Антагонист AG12A (наилучший антагонист в первичном скрининге (Kodadek et al., 2004)), обладающий активностью, превышающей активность при IC50=40 мкМ, может оказаться желательным для его практического применения. Для этой цели AG12A конъюгировали с комплексом трис-бипиридил-рутения(II), который представляет собой эффективный катализатор для получения синглетного кислорода при облучении этого комплекса видимым светом (Lee et al., 2008). Синглетный кислород представляет собой в высокой степени реакционноспособную молекулу, которая может модифицировать и инактивировать большинство белков, но которая имеет ограниченный радиус рассеяния, составляющий только 40-80 Å. Таким образом инактивируются только те белки, которые расположены в непосредственной близости от радиоактивного рутения. При нацеливании на белки-мишени посредством пептоидного лиганда может быть достигнута в высокой степени специфическая инактивация белка, стимулированного облучением (Lee et al., работа находится на стадии подготовки к печати). MBP-Ac1-11-специфичные TCR-трансгенные Т-клетки инкубировали с возрастающими концентрациями конъюгата AG12A-рутений (фиг. 4A) или конъюгата контрольный пептид-рутений (фиг. 6), а затем клетки облучали видимым светом (фильтр с отсечкой <380 нм). После облучения в течение десяти минут, Т-клетки активировали аутоантигеном MBP Ac1-11 в присутствии антигенпрезентирующих клеток. Пролиферацию клеток оценивали с помощью анализа с использованием меченного тритием тимидина. Как показано на фиг. 4B, конъюгат AG12A-рутений ингибировал пролиферацию MBP Ac1-11-специфических аутореактивных Т-клеток на достаточно высоком уровне при концентрации 100 нM (фиг. 4B). Активность этого конъюгата приблизительно в 700 раз превышала активность отдельно взятого пептоида. Ингибирования не наблюдалось в случае использования CD4+-T-клеток, взятых у MOG-35-55-TCR-трансгенных мышей (фиг. 4C), что также указывало на специфичность AG12A к MBP Ac1-11-специфичным аутореактивным Т-клеткам.
Была проведена терапия методом фотофореза, при которой клетки удаляли, обрабатывали фотореактивным лекарственным средством, облучали УФ-светом и снова вводили пациенту путем вливания (Rostami et al., 1999; Besnier et al., 2002; Cavaletti et al., 2006). Таким образом, хотя синий цвет, необходимый для запуска продуцирования синглетного кислорода, катализируемого трис-бипиридилрутением, не может проникать в живой организм, однако, ex vivo инактивация аутоиммунных Т-клеток посредством конъюгата «пептоид-рутений» вполне осуществима, как показали уже ранее проведенные исследования. Для проверки этой теории и для подтверждения того факта, что аутореактивные Т-клетки становятся невосприимчивыми после их обработки конъюгатом «пептоид-рутений» и облучения светом, авторами настоящего изобретения была использована модель адоптивной передачи EAE. CD4+-T-клетки выделяли у MBP-Ac1-11-TCR-трансгенных мышей, обрабатывали конъюгатом «AG12A-рутений» или конъюгатом «контрольный пептоид-рутений», облучали, стимулировали пептидом MBP Ac1-11 в присутствии антигенпрезентирующих клеток и снова инъецировали реципиентам, которые ранее не участвовали в экспериментах. Затем этих животных обследовали на клинические признаки EAE. Как и предполагалось, у животных, которым были инъецированы стимулированные антигеном аутореактивные Т-клетки, обработанные конъюгатом «контрольный пептоид-рутений» или вообще не обработанные пептоидом, развивался EAE (фиг. 4D). Если Т-клетки не были стимулированы ни антигеном, ни пептоидом, то адоптивный перенос не приводил к развитию EAE, как и ожидалось. Удивительно то, что MBP Ac1-11 специфические CD4+-T-клетки, стимулированные антигеном и обработанные конъюгатом «AG12A-рутений», не индуцировали развитие EAE у животных-реципиентов (фиг. 4D). Этот эксперимент продемонстрировал возможность применения конъюгатов «рутений-пептоид», нацеленных на аутореактивные Т-клетки, в качестве эффективных фотоактивированных ингибиторов активации аутоиммунных Т-клеток ex vivo.
ПРИМЕР 3 - Обсуждение
Авторами настоящего изобретения был представлен протокол скрининга комбинаторной библиотеки, который может быть использован для получения синтетических молекул, обладающих высокой специфичностью связывания с антигенспецифическими аутоиммунными Т-клетками. В этом исследовании CD4+-T-клетки, взятые у мышей с EAE, и CD4+-T-клетки, взятые у здоровых контрольных мышей, метили различным образом окрашенными квантовыми точками, смешивали и инкубировали с библиотекой, состоящей приблизительно из 300000 пептоидов, представленных на гидрофильных гранулах (фиг. 1A). Библиотеку создавали методом разделения и объединения так, чтобы каждая гранула представляла уникальный пептоид. Затем выделяли две гранулы, которые, как было обнаружено, связывались с Т-клетками, помеченными красным красителем, но не с T-клетками, помеченными зеленым красителем. Гипотеза, высказанная авторами настоящего изобретения, состоит в том, что две популяции могут отличаться главным образом тем, что в них присутствуют или отсутствуют высокие уровни аутореактивных T-клеток, которые запускают EAE, и, таким образом, пептоиды, которые являются предпочтительными для клеток, происходящих от мышей с EAE, аналогичным образом могут представлять собой лиганды для этих аутореактивных T-клеток. Кроме того, авторами настоящего изобретения было высказано предположение, заключающееся в том, что наиболее вероятным механизмом, посредством которого пептоид может дифференцировать различные Т-клетки, является прямое связывание с Т-клеточным рецептором (TCR).
Один из пептоидов, выявленных в результате этого скрининга, представляет собой AG12A (фиг. 1C), который был подробно охарактеризован, и полученные данные подтвердили вышеуказанные предположения. Было показано, что AG12A представляет собой высокоспецифичный лиганд для MBP Ac1-11-специфичных аутореактивных Т-клеток, которые инициируют развитие заболевания у данной модели. Было показано, что повторно синтезированный пептоид связывается с трансгенными MBP Ac1-11-реактивными Vα2.3/Vβ8.2 TCR-содержащими Т-клетками, но не с нормальными Т-клетками, если указанный пептоид присутствовал на гранулах (фиг. 1D). Специфическое связывание также наблюдалось в анализе, проводимом методом проточной цитометрии, в том случае, если флуоресцентно меченный растворимый пептоид был инкубирован с аутоиммунными Т-клетками (фиг. 2A-B). Было подтверждено, что AG12A, по своей функции, представляет собой антагонист антиген-зависимой пролиферации MBP Ac1-11-специфичных Т-клеток. Важно отметить, что этот пептоид не оказывал воздействия на миелин-специфические Т-клетки, которые распознавали другой антиген (фиг. 3C), и это также указывало на высокую специфичность связывания с MBP Ac1-11-специфическими Т-клетками. И наконец, данные по перекрестному связыванию показали, что этот пептоид непосредственно связывается с TCR этих клеток (фиг. 2C), хотя полученные данные не могут абсолютно исключать возможности перекрестного связывания пептоида с другим белком, масса которого аналогична массе одной из цепей TCR, и который присутствует только на MBP Ac1-11-специфических клетках. Однако это кажется совсем маловероятным.
Насколько известно авторам настоящего изобретения, описанный пример является первым примером синтетических неприродных молекул, способных специфически связываться с антигенспецифическими Т-клетками без требований MHC-презентации. В предыдущих попытках осуществления нацеливания на аутореактивные Т-клетки были, в частности, использованы пептидные антигены, которые, как известно или как предполагается, ассоциируются с развитием заболевания, и была проведена вакцинация этими молекулами или их слегка модифицированными производными, например, путем введения D-аминокислот (Vandenbark et al., 1989; Howell et al., 1989; Wraith et al., 1989). Этот подход очень отличался от описанного здесь подхода. Кроме того, использование таких модифицированных пептидных лигандов в испытаниях с участием человека не дали положительных результатов, а точнее результатов в отношении обострения заболеваний (Bielekova et al., 2000; de Haan et al., 2005), что еще раз подчеркивает трудности, связанные с рациональной разработкой терапевтических средств, нацеленных на аутореактивные Т-клетки. Важной особенностью технологии скрининга, с помощью которой были идентифицированы эти молекулы, является то, что в данном случае не требуется каких-либо знаний о нативном антигене, распознаваемом T-клетками. Стоит признать, что при исследовании EAE, проведенном для подтверждения эффективности AG1A, авторами настоящего изобретения были использованы аутореактивные Т-клетки, природа которых уже хорошо охарактеризована, но сам по себе простой скрининг включал идентификацию представленных на гранулах соединений, связывающихся с клетками, которые являются более распространенными в одной популяции, чем в другой. Поэтому такая технология, в общих чертах, представляет собой эффективное средство для выделения комплексов «пептоид-аутоиммунные клетки».
Так, например, очевидно, что описанный здесь подход может быть применен для обследования пациентов и пациентов соответствующей контрольной группы в целях идентификации пептоидов, которые связываются с высокоамплифицированными Т-клетками у человека. Также вероятно, что тот же подход должен оказаться эффективным для выделения пептоидов, связывающихся с антигенспецифичными В-клетками. Совершенно очевидно, что природа иммунного ответа у человека с аутоиммунным заболеванием должна быть более поликлональной, чем это наблюдалось у используемых здесь мышей с простой моделью EAE. Это должно способствовать идентификации нескольких пептоидов, имитирующих связывание различных антигенов с другими Т-клетками. Тем не менее, несмотря на избыточность уровня поликлональности, применяемый здесь подход такого же типа должен оказаться эффективным для идентификации пептоидов, распознающих по меньшей мере большинство встречающихся антигенспецифичных аутоиммунных клеток.
Авторами настоящего изобретения было высказано предположение, что такая технология будет представлять собой ценный инструмент, который может быть применен в общей и прикладной иммунологии. Эксперимент, проводимый методом проточной цитометрии и проиллюстрированный на фиг. 2B, показал, что эти пептоиды могут быть использованы для обогащения популяции аутореактивными Т-клетками, что позволит проводить более тщательное их исследование. Было также подтверждено, что протокол этого типа может представлять собой эффективную процедуру диагностики аутоиммунных заболеваний, таких как MS, для которого пока не существует подходящего молекулярного анализа. И наконец, возможно, что такие пептоиды, связывающиеся с аутореактивными Т-клетками, могут быть с успехом использованы в способе терапии. Эксперимент, подробно проиллюстрированный на фиг. 4, показал, что конъюгат «трис-бипиридилрутений-пептоид» может инактивировать аутореактивные T-клетки ex vivo при его облучении видимым светом, что позволяет предположить о возможности применения такого конъюгата в терапии типа фотофереза. Альтернативно, возможно, что такой пептоид может быть использован для сообщения токсической нагрузки определенного типа Т-клеткам-мишеням. Совершенно очевидно, что преимущество такого подхода состоит в том, что в данном случае разрушаются только те аутореактивные Т-клетки, на которые нацелен данный пептоид, а функция Т-клеток со специфичностью к другим антигенам остается неизменной. Все современные методы лечения, направленные на блокирование или модуляцию функций иммунной системы при аутоиммунных заболеваниях, не могут идентифицировать «хорошие» Т-клетки от «плохих» Т-клеток, а дают скорее общий ответ, вызывающий серьезные побочные эффекты (Hauser, 2008; Hemmer and Hartung, 2007; Stuve, 2008; Schneider, 2008; Coles et al., 2008).
Все описанные и заявленные здесь композиции и способы могут быть применены в соответствии с настоящим описанием без излишнего экспериментирования. Хотя композиции и способы согласно изобретению описаны на предпочтительных вариантах его осуществления, однако, для специалистов в данной области очевидно, что в указанные композиции и способы, а также в стадии или порядок проведения стадий описанного здесь способа могут быть внесены изменения, не выходящие за рамки концепции, существа и объема изобретения. В частности, очевидно, что описанные здесь агенты могут быть заменены некоторыми другими агентами, которые являются химически и физиологически родственными, но могут давать те же самые или аналогичные результаты. Все эти аналогичные замены и модификации, очевидные для специалиста в данной области, не должны выходить за рамки существа, объема и концепции настоящего изобретения, определенных в прилагаемой формуле изобретения.
V. Библиография
Нижеследующие публикации, в той степени, в которой они относятся к описанным здесь процедурам или другим подробно описанным объектам изобретения, помимо тех публикаций, на которые авторы уже ссылались при описании изобретения, конкретно вводятся в настоящее описание посредством ссылки.
Патент США 3817837
Патент США 3850752
Патент США 3939350
Патент США 3996345
Патент США 4275149
Патент США 4277437
Патент США 4366241
Патент США 4680338
Патент США 4843092
Патент США 5141648
Патент США 5443826
Патент США 5563250
Патент США 5599795
Патент США 5856456
Патент США 5880270
Alluri et al., J. Am. Chem. Soc. 125:13995-4004, 2003.
Ando et al., Cell Immunol., 124:132-43, 1989.
Arend & Dayer, Arthritis Rheum., 38:151-60, 1995.
Arend et al., Annu. Rev. Immunol., 16:27-55, 1998.
Arend, Arthritis Rheum., 44:2224-2234, 2001.
Autenrieth et al., Infect. Immun., 62:2590-9, 1994.
Ball, Ann. Rheum. Dis., 30:213-223, 1971.
Bendzen et al., Scand. J. Rheumatol., 28:599-606, 1988.
Besnard et al., Gut, 43(5):634-38, 1998.
Besnier et al., Photodermatol. Photoimmunol. Photomed., 18:36-41, 2002.
Bielekova et al., Nat. Med., 6:1167-75, 2000.
Blumberg et al., Arthritis Rheum., 7:93-7, 1964.
Botoman et al., Am. Fam. Physician, 57(1):57-68, 1998.
Brandt et al., Arthritis Rheum., 43:1346-52, 2000.
Braun et al., Arthritis Rheum., 42:2039-44, 1999.
Brewerton et al., Lancet, 1:904-907, 1973a.
Brewerton et al., Lancet, 1:956-957, 1973b.
Brynskov et al., N. Engl. J. Med., 321(13):845-50, 1989.
Burdine et al., J. Amer. Chem. Soc., 126:11442-11443, 2004.
Burger & Dayer, Neurology, 45(6 Suppl. 6):S39-43, 1995.
Calin et al., In: The Spondylarthritides, Calin et al. (Eds.), Oxford, UK. Oxford University Press, 179, 1998.
Cann et al., Gut, 24(5):405-11, 1983.
Cavaletti et al., Neurol. Sci., 27:24-32, 2006.
Chomarat et al., Arthritis Rheum., 38:1046-54, 1995.
Coles et al., N. Engl. J. Med., 359:1786-801, 2008.
de Haan et al., Mol. Immunol., 42:365-73, 2005.
De Jager et al., Semin. Nucl. Med., 23(2):165-179, 1993.
de Waal et al., J. Exp. Med., 174:1209-20, 1991.
Dinarello, Int. Rev. Immunol., 16:457-99, 1998.
Dionne et al., Clin. Exp. Imunol., 112(3):435-42, 1998.
Doolittle and Ben-Zeev, Methods Mol Biol, 109:215-237, 1999.
Doran et al., J. Rheumatol. 30(2):316-20, 2003.
Drossman et al., Dig Dis Sci., 38(9):1569-80, 1999.
Drossman et al., Gastroenterology, 112(6):2120-37, 1997.
Drossman et al., Gastroenterology, 112(6):2120-37, 1997.
Eastgate et al., Lancet, 2:706-9, 1988.
Ettehadi et al., Clin. Exp. Immunol., 96:146-51, 1994.
Everhart and Renault, Gastroenterology, 100(4):998-1005, 1991.
Fearon and Locksley, Science, 72:50-53, 1996.
Feldtkeller et al., Rheumatol. Int. 23(2):61-66, 2003.
Fellerman et al., Am. J. Gastroenterol., 93(10):1860-66, 1998.
Firestein et al., Arthritis Rheum., 37:644-52, 1994.
Fujikawa et al., Ann. Rheum. Dis., 54:318-20, 1995.
Funakoshi et al., Digestion, 59(1):73-78, 1998.
Galley & Webster, Br. J. Anaesth., 77:11-16, 1996.
Gladman et al., J. Rheumatol., 22:675-9, 1995.
Gladman et al., Q. J. Med., 62:127-141, 1987.
Gladman, Rheum Dis Clin North Am, 18:247-56, 1992.
Goverman et al., Cell, 72:551-60, 1993.
Gulbis and Galand, Hum. Pathol., 24(12):1271-1285, 1993.
Gwee et al., Gut, 44(3):400-6, 1999.
Hahn & Tsao, In: Dubois' Lupus Erythematosus, 4th Ed., Wallace & Hahn (Eds.), Lea and Febiger, Philadelphia, 195-201, 1993.
Hannum et al., Nature, 343:336-40, 1990.
Harrison et al., J Rheumatol., 25(12):2324-2330, 1998.
Harrison et al., J Rheumatol., 25(12):2324-2330, 1998.
Hart et al., Clin. Exp. Immunol., 99(3):331-337, 1995.
Hart et al., Immunology, 84:536-42, 1995.
Hauser, N. Eng. J. Med., 359:1838-1841, 2008.
Hemmer and Hartung, Ann. Neurol., 62:314-26, 2007.
Hoffenberg et al., J. Pediatr., 134(4):447-52, 1999.
Hohler et al. J. Invest. Dermatol., 109(4):562-5, 1997.
Hollander et al., Ann. Intern. Med., 105:883-85, 1986.
Hollander, Scand. J. Gastroenterol. 27:721-26, 1992.
Horwitz and Fisher, N. Engl. J. Med., 344(24):1846-50, 2001.
Howell et al., Science, 246:668-70, 1989.
Jacob et al., Proc. Natl. Acad. Sci. USA, 87:1233-7, 1990.
Jailwala et al., Ann. Intern. Med., 133(2):136-47, 2000.
Jarvis, Curr Opin Rheumatol., 10:459-467, 1998.
Jarvis, Curr Opin Rheumatol., 10:459-467, 1998.
Jarvis, Pediatr Ann., 31:437-446, 2002.
Jones et al., Br. J. Rheumatol., 33:834-9, 1994.
Jonsson and Brokstad, In: A Textbook of Rheumatology, 6th Ed., Philadelphia: Lippincott Williams & Wilkins, 495-504, 2001.
Jonsson et al., Br J Rheumatol., 32: 578-81, 1993.
Jonsson et al., Oral Dis., 8:130-140, 2002.
Kahle et al., Ann. Rheum. Dis., 51:731-4, 1992.
Kellow and Phillips, Gastroenterology, 92(6):1885-93, 1987.
Khan, Clin. Exp. Rheumatol. 20(6):6-10, 1998.
Khan, In: Ankylosing spondylitis and related spondyloarthropathies, Spine, State of the Art Reviews, 1990.
Kodadek et al., Acc. Chem. Res., 37:711-718, 2004.
Kotake et al., Infect. Immun., 67:2682-6, 1999.
Kotzin & O'Dell, In: Samler's Immunologic Diseases, 5th Ed., Frank et al. (Eds.), Little Brown & Co., Boston, 667-97, 1995.
Kotzin, Cell, 85:303-06, 1996.
Kuboyama, Kurume Med. J., 45(1):33-37, 1998.
Lahesmaa et al., J. Immunol., 148:3079-85, 1992.
Lee et al., Mol. Biosyst., 4:59-65, 2008.
Lee et al., Mol. Biosyst., 4:59-65, 2008.
Leiper et al., Baillieres Clin. Gastroenterol., 12(1):179-99, 1998.
Lim et al., J. Amer. Chem. Soc., 129:12936-12937, 2007.
Lim et al., J. Amer. Chem. Soc., 129:12936-12937, 2007.
Lipsky, In: Harrison's principles of internal medicine, Fauci et al. (Eds.), 14th Ed., NY, McGraw-Hill, 1880-1888, 1998.
Liu et al., J. Amer. Chem. Soc., 128:15228-15235, 2006.
Lo et al., Immunol Rev., 169:225-239, 1999.
Lugering et al., Ital. J. Gastroenterol. Hepatol., 30(3):338-44, 1998.
Lynn and Friedman, N. Engl. J. Med., 329(26):1940-5, 1993.
Macatonia et al., J. Immunol., 150:3755-65, 1993.
Makowiec et al., Z. Gastroenterol., 36(8):619-24, 1998.
Marsal et al., Rheumatology, 38:332-7, 1999.
McAlindon et al., Gut, 42(2):214-19, 1998.
McGonagle et al., Arthritis Rheum., 41:694-700, 1998.
McGonagle et al., Curr. Opin. Rheumatol., 11:244-50, 1999.
Mertz et al., Gastroenterology, 118(5):842-8, 2000.
Moll & Wright, Ann. Rheum. Dis., 32:181-201, 1973.
Moll & Wright, Semin. Arthritis Rheum., 3:55-78, 1973.
Murch, Nutrition, 14:780-83, 1998.
Nakamura et al., In: Handbook of Experimental Immunology (4th Ed.), Weir et al. (Eds), 1:27, Blackwell Scientific Publ., Oxford, 1987.
Neal et al., BMJ, 314(7083):779-82, 1997.
Nielen et al., Arthritis Rheum., 50(2):380-386, 2004.
Noseworthy et al., N. Engl. J. Med., 343:938-52, 2000.
Ohnishi et al., Int. Immunol., 6:817-30, 1994.
Olivos et al., Org. Lett., 4:4057-4059, 2002.
Partsch et al., Br. J. Rheumatol., 24:518-23, 1997.
Pimentel et al., Am. J. Gastroenterol., 95(12):3503-6, 2000.
Pociot et al., Scand. J. Immunol., 42:501-4, 1995.
Popkov et al., Nat. Proc. Acad. Sci. USA, 106(11):4378-83, 2009.
Prieur et al., Lancet, 2:1240-2, 1987.
Racke, Curr. Protoc. Neurosci., Chapter 9:Unit 97, 2001.
Rantapaa-Dahlqvist et al., Arthritis Rheum., 48(10):2741-2749, 2003.
Reimund et al., Eur. J. Clin. Invest., 28(2):145-50, 1998.
Ribbens et al., Eur. Cytokine Netw., 11:669-76, 2000.
Rogler &. Andus, World J. Surg., 22(4):382-89, 1998.
Rooney et al., Rheumatol. Int., 10:217-9, 1990.
Rostami et al., Mult. Scler., 5:198-203, 1999.
Rothstein, Med. Clin. North Am., 84(5):1247-57, 2000.
Ruemmele et al., Gastroenterol., 115(4):822-29, 1998.
Saiki et al., Scand. J. Gastroenterol., 33(6):616-22, 1998.
Salomonsson et al., Arthritis Rheum., 48:3187-201, 2003.
Salomonsson et al., Scand. J. Immunol., 55:336-42, 2002.
Salvarani et al., Curr. Opin. Rheumatol., 10:299-305, 1998.
Sandler, Gastroenterology, 99(2):409-15, 1990.
Sartor, Am. J. Gastroenterol., 92(12):5S-11S, 1997.
Schellekens et al., Arthritis Rheum., 43(1):155-163, 2000.
Schlaak et al., Clin. Exp. Rheumatol., 14:155-62, 1996.
Schlaak et al., Eur. J. Immunol., 22:2771-6, 1992.
Schlosstein et al., NE J. Medicine, 288:704-706, 1973.
Schneider, Curr. Pharm. Biotechnol., 9:431-8, 2008.
Schreiber, Neth. J. Med., 53(6):S24-31, 1998.
Sieper & Braun, Arthritis Rheum., 38:1547-54, 1995.
Simon et al., Clin. Exp. Immunol., 94:122-6, 1993.
Simon et al., Proc. Natl. Acad. Sci. USA, 89:9367-71, 1992.
Simon et al., Proc. Natl. Acad. Sci. USA, 91:8562-6, 1994.
Soderholm et al., Gastroenterol., 117:65-72, 1999.
Stack et al., Lancet, 349(9051):521-24, 1997.
Stuve, J. Neurol. Sci., 274:39-41, 2008.
Talley et al., Gastroenterology, 109(6):1736-41, 1995.
Targan et al., N. Engl. J. Med., 337(15):1029-35, 1997.
Udugamasooriya et al., J. Amer. Chem. Soc., 130:5744-5752, 2008.
van den Berg, Semin Arthritis Rheum., 30(5 Suppl.2):7-16, 2001.
van Dullemen et al., Gastroenterol., 109(1):129-35, 1995.
van Hogezand & Verspaget, Drugs, 56(3):299-305, 1998.
Vandenbark et al., Nature, 341:541-4, 1989.
Warrington et al., Arthritis Rheum., 44:13-20, 2001.
Wawrzynczak and Thorpe, FEBS Lett., 207(2):213-216, 1986.
Weyand and Goronzy, Ann. NY Acad. Sci., 987:140-9, 2003.
Whitehead et al., Gastroenterology, 98(5 Pt 1):1187-92, 2000.
Wordsworth, In: Genes and Arthritis, Brit. Medical Bulletin, 51:249-266, 1995.
Wraith et al., Cell, 57:709-15, 1989.
Wright, Ann. Rheum. Dis., 15:348-56, 1956.
Wright, Clin. Orthop. Related Res., 143:8-14, 1979.
Xanthou et al., Arthritis Rheum., 44: 408-18, 2001.
Yin et al., Arthritis Rheum., 40:1788-97, 1997.
Yin et al., Rheumatology, 38:1058-67, 1999.
Zamvil and Steinman, Annu. Rev. Immunol., 8:579-621, 1990.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ НЕВРОЛОГИЧЕСКИХ НАРУШЕНИЙ | 2005 |
|
RU2387453C2 |
| ЛИГАНД GITR И СВЯЗАННЫЕ С ЛИГАНДОМ GITR МОЛЕКУЛЫ И АНТИТЕЛА И ВАРИАНТЫ ИХ ПРИМЕНЕНИЯ | 2004 |
|
RU2369636C2 |
| КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ РАССЕЯННОГО СКЛЕРОЗА | 2008 |
|
RU2492234C2 |
| РНК ДЛЯ ЛЕЧЕНИЯ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ | 2018 |
|
RU2790447C2 |
| СПОСОБЫ EX VIVO ЭКСПАНСИИ ЕСТЕСТВЕННЫХ КЛЕТОК-КИЛЛЕРОВ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2814083C2 |
| ВЫДЕЛЕНИЕ И ИДЕНТИФИКАЦИЯ Т-КЛЕТОК | 2003 |
|
RU2327487C2 |
| СПОСОБЫ ИММУНОТЕРАПИИ | 2017 |
|
RU2756276C2 |
| Т-КЛЕТОЧНАЯ ВАКЦИНА ДЛЯ ЛЕЧЕНИЯ РАССЕЯННОГО СКЛЕРОЗА | 1998 |
|
RU2209633C2 |
| СПОСОБ ЛЕЧЕНИЯ АУТОИММУННОГО ЗАБОЛЕВАНИЯ С ИСПОЛЬЗОВАНИЕМ БИОСОВМЕСТИМЫХ БИОАБСОРБИРУЕМЫХ НАНОСФЕР | 2011 |
|
RU2635537C2 |
| СПОСОБ ЛЕЧЕНИЯ АУТОИММУННОГО ЗАБОЛЕВАНИЯ (ВАРИАНТЫ) | 2009 |
|
RU2539110C2 |
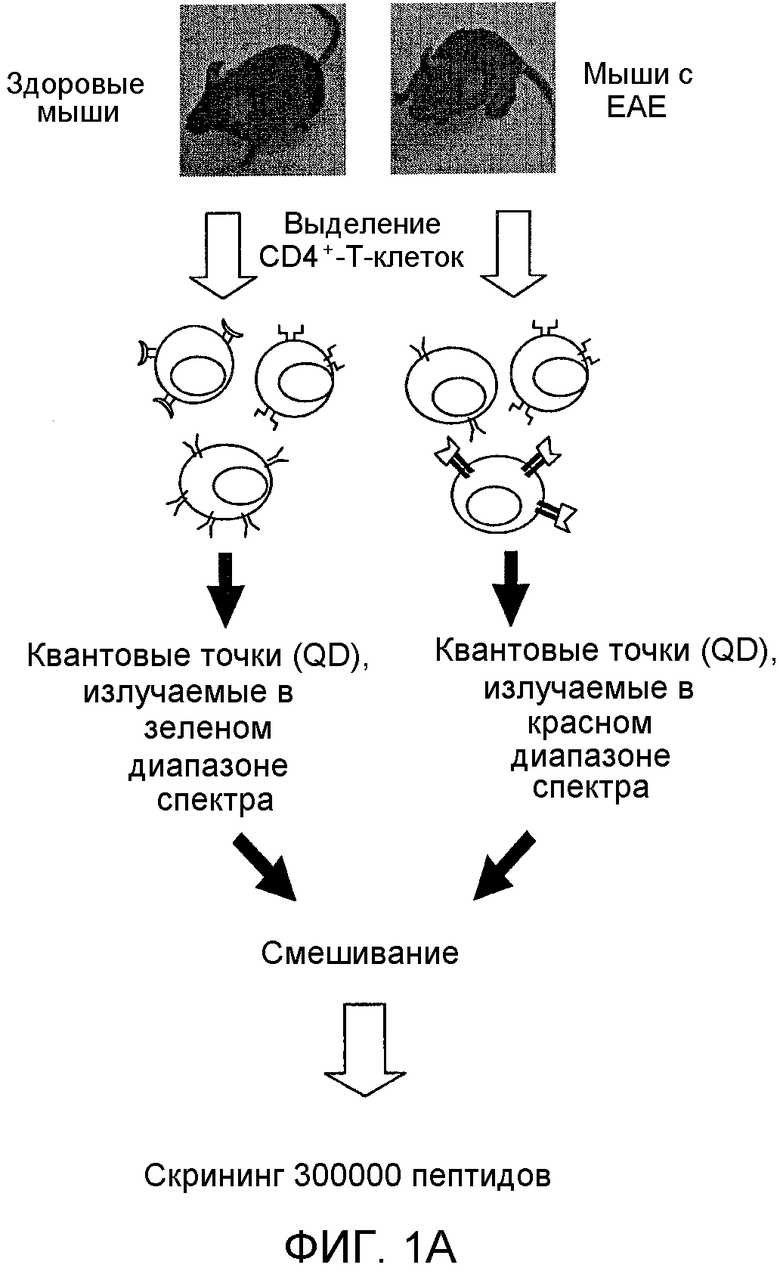
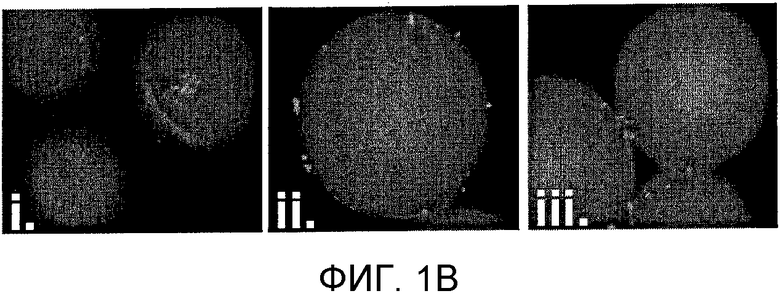
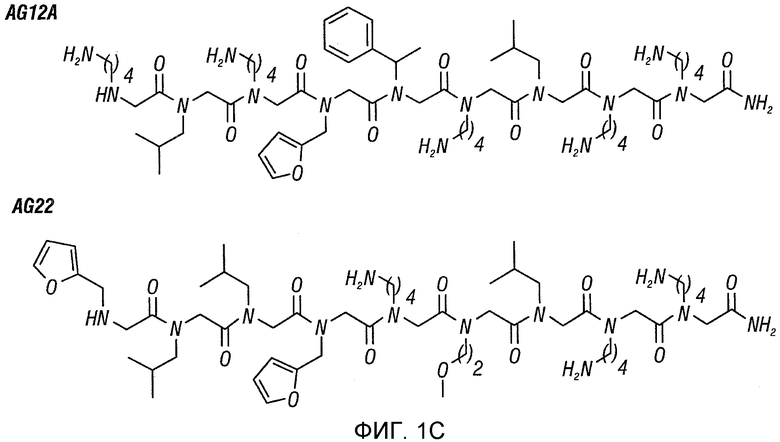
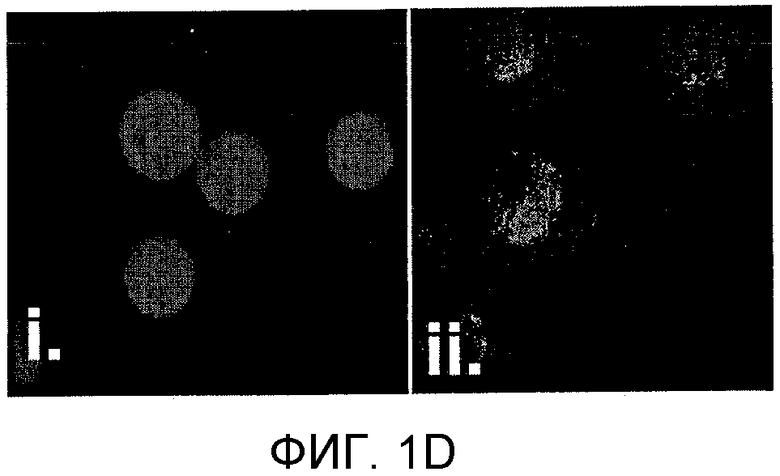
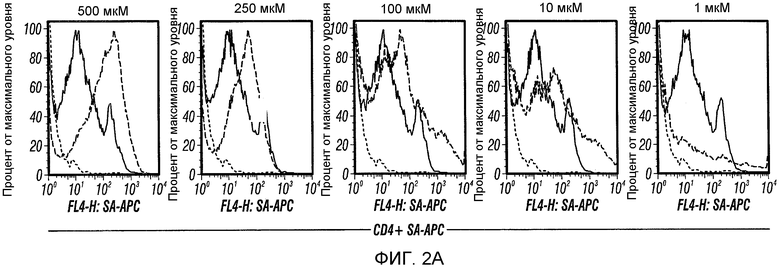
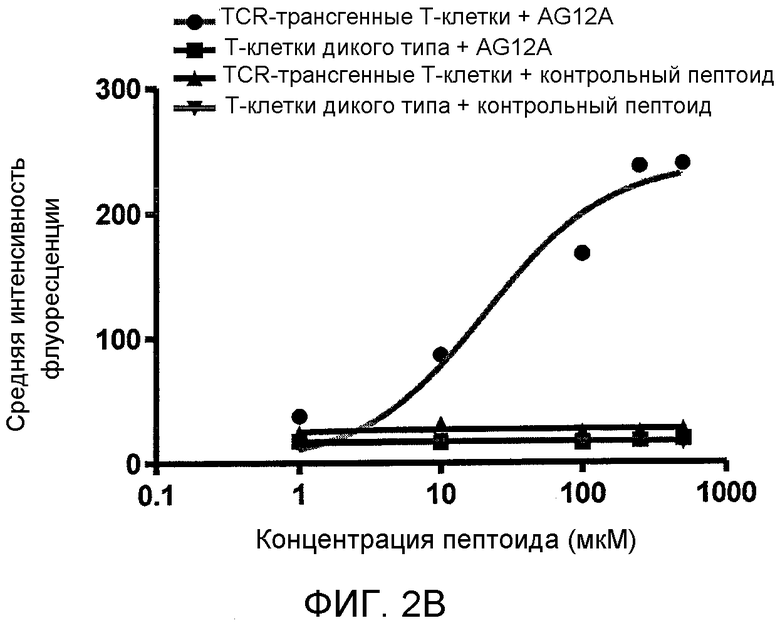
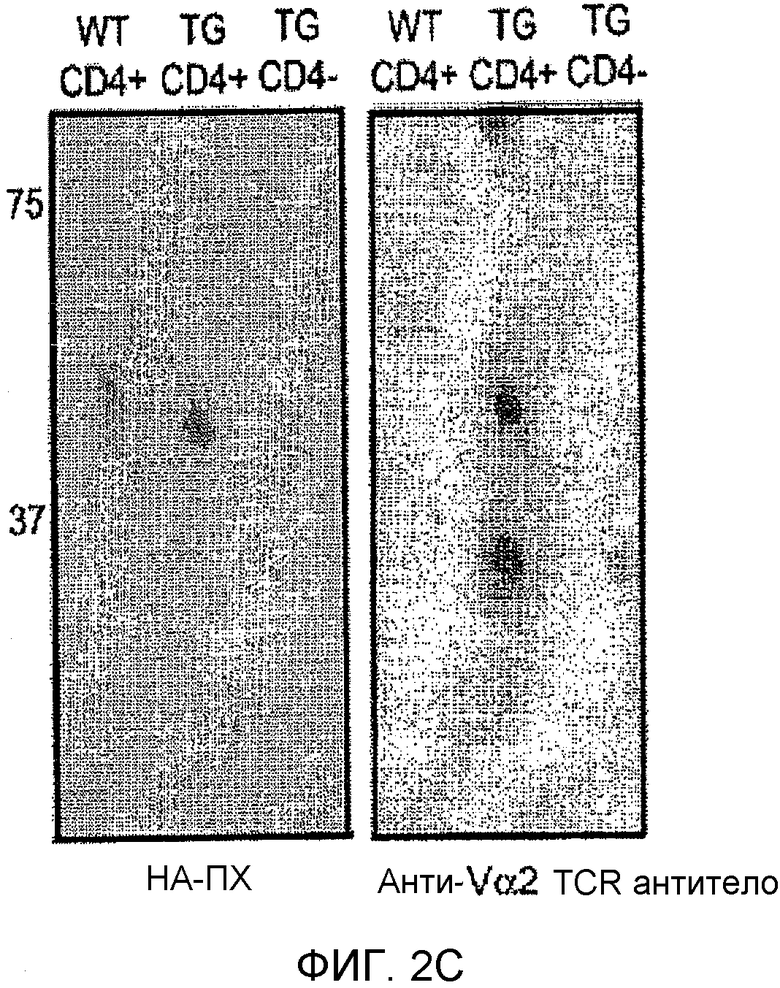
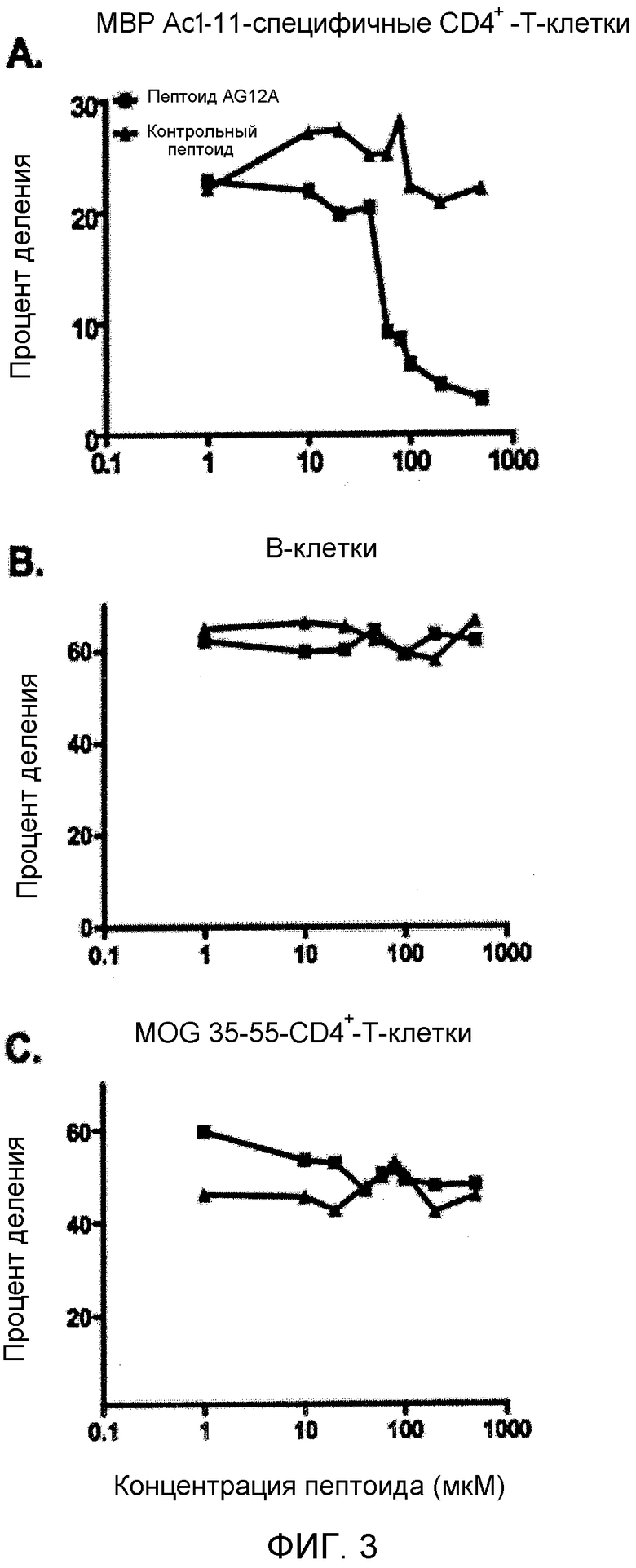
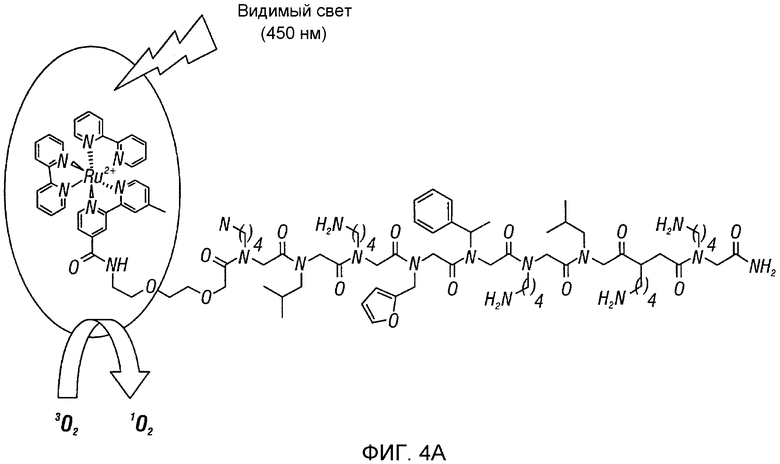
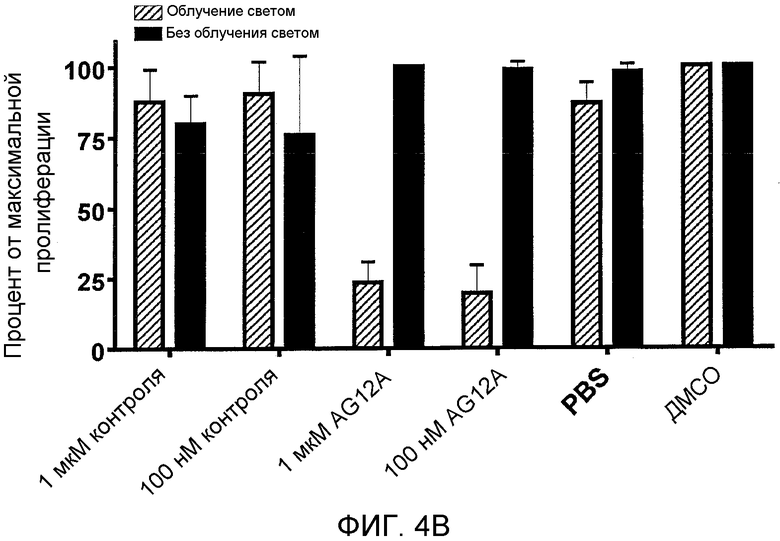
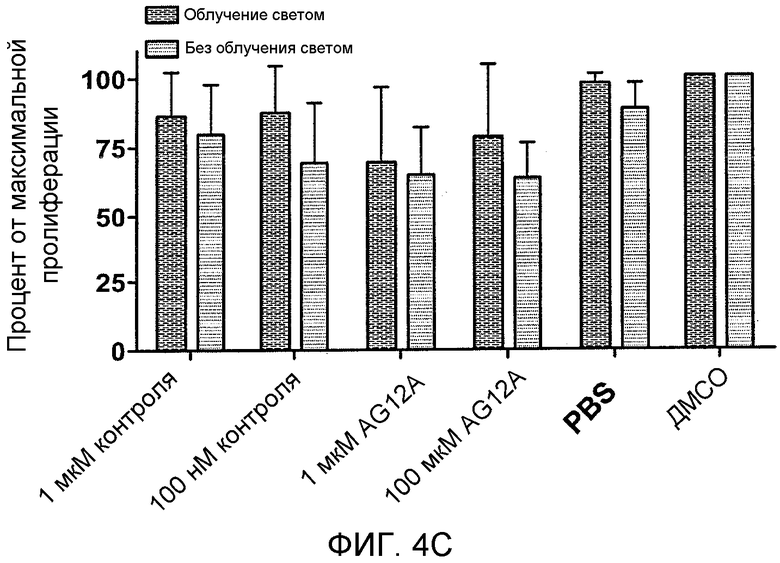
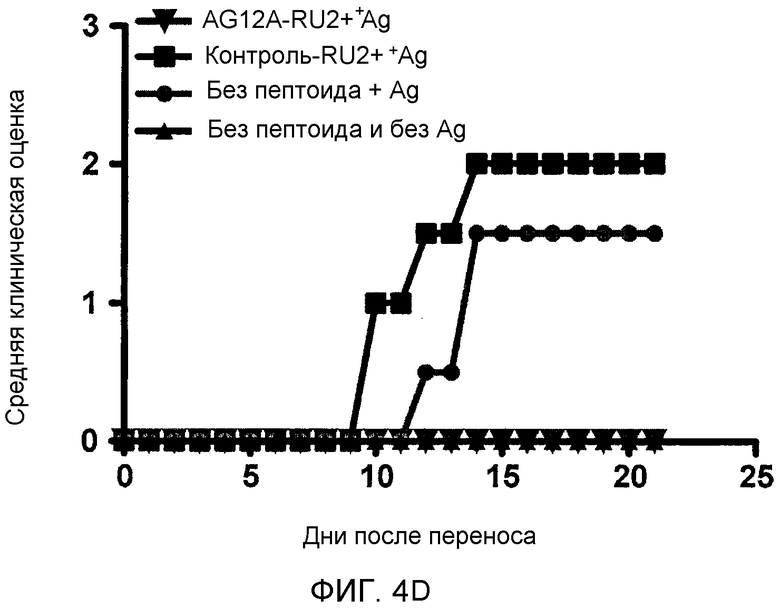
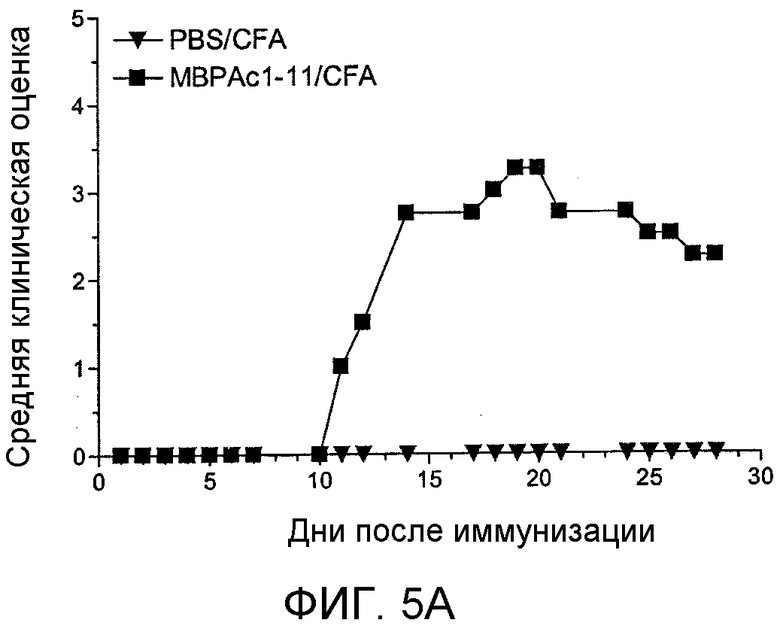
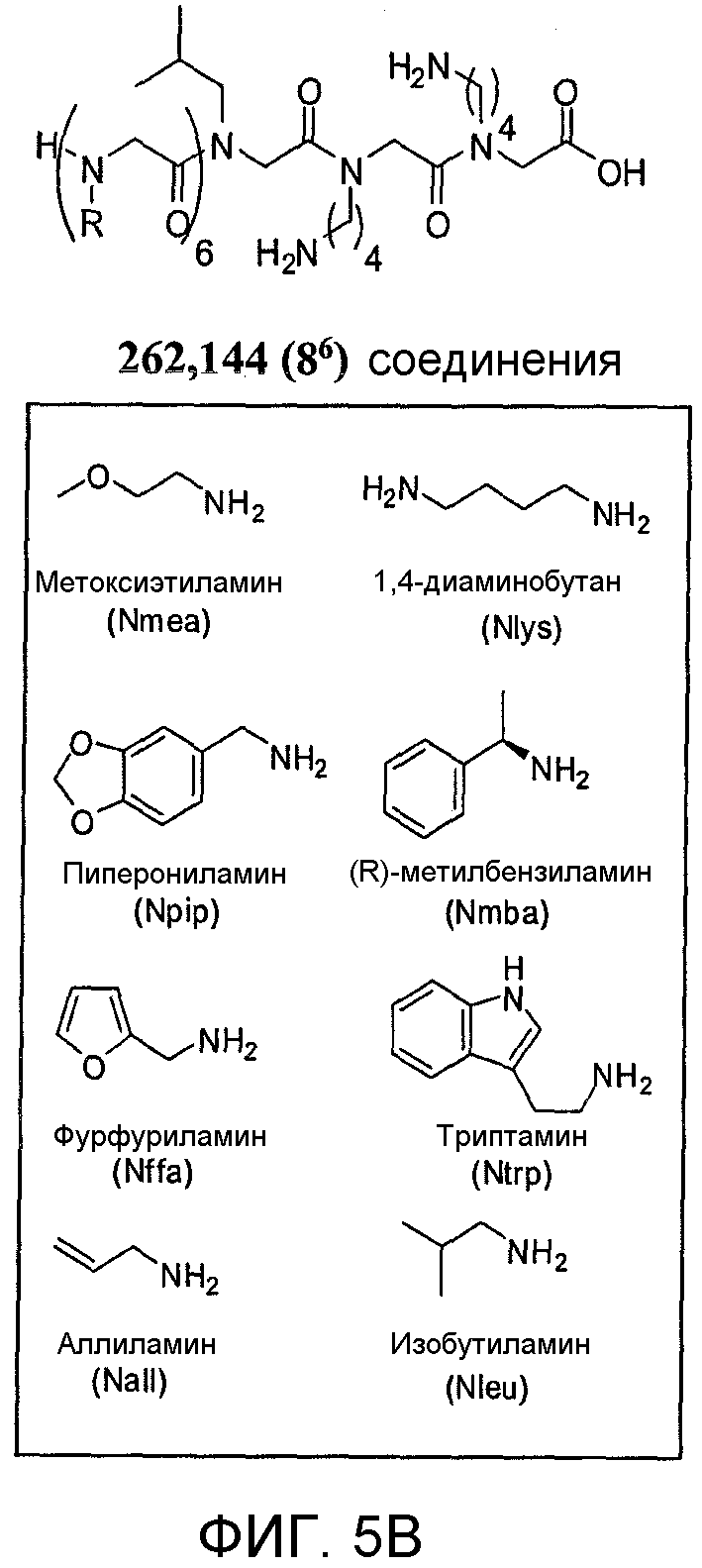
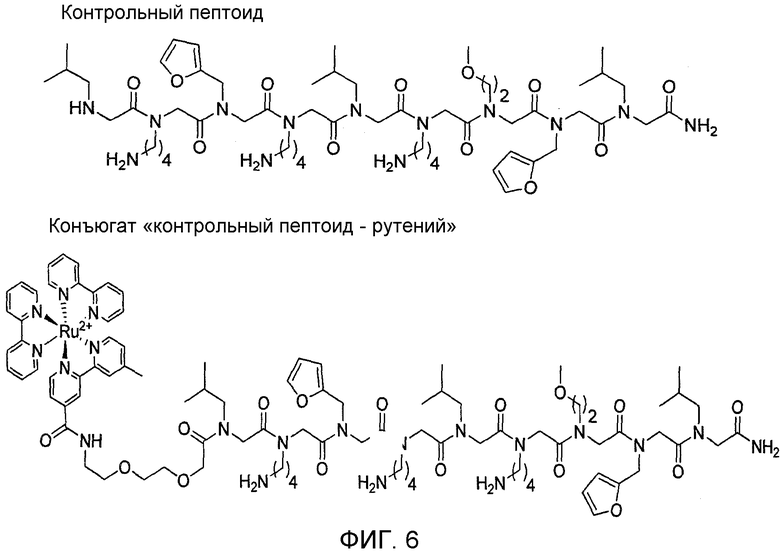
Группа изобретений относится к области молекулярной биологии, иммунологии и медицины и предназначена для идентификации популяций аутореактивных Т-клеток у индивидуумов с аутоиммунными заболеваниями. Для взятия аутоиммунных Т-клеток у индивидуума, страдающего аутоиммунным заболеванием, получают пептоид, который специфически связывается с аутоиммунными Т-клетками. Указанный пептоид связан с носителем. Выполняют контактирование образца, взятого от указанного индивидуума, с указанным пептоидом, связанным с носителем, в течение периода времени, достаточного для связывания аутоиммунных Т-клеток с указанным пептоидом, связанным с носителем. Затем отделяют указанный носитель от указанного образца. В других воплощениях обеспечиваются способы уничтожения аутоиммунных Т-клеток, взятых у индивидуума, страдающего аутоиммунным заболеванием. Использование группы изобретений обеспечивает более эффективную идентификацию аутоиммунных заболеваний различного типа и проведение терапии, направленной против таких популяций. 4 н. и 46 з.п. ф-лы, 15 ил., 1 табл., 3 пр.
1. Пептоид, имеющий формулу:
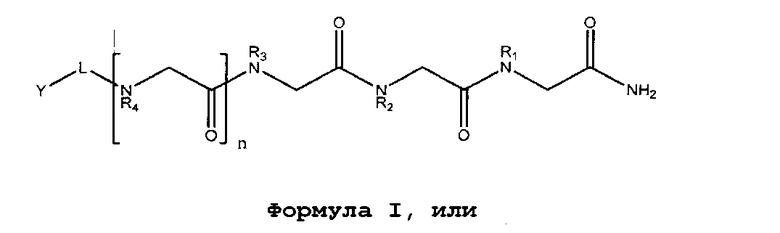

где n равно 0-8; L представляет собой линкер; Y представляет собой токсин или фрагменты антител; a R1, R2, R3, R4, R5, R6, R7, R8 (где к формуле I или формуле II с каждым значением n выше 4 добавляется следующая группа R в порядке нумерации) независимо представляют собой водород; алкил; аллил; метил; этил; н-пропил; изопропил; н-бутил; изобутил; втор-бутил; трет-бутил; пентил; гексил; изопентил; арил; гетероарил; фуранил; индолил; тиофенил; тиазолил; имидазолил; изоксазоил; оксазоил; пиперонил; пиразоил; пирролил; пиразинил; пиридил; пиримидил; пиримидинил; пуринил; циннолинил; бензофуранил; бензотиенил; бензотриазолил; бензоксазолил; хинолин; изоксазолил; изохинолин-циклоалкил; алкенил; циклоалкенил; фенил; метоксиэтил; (R)-метилбензил; С1-С6алкил, который является незамещенным или замещен группами NH2, ОН, SH, N(С1-С6алкил)2, О(С1-С6алкил) или S(С1-С6алкил); С2-С6алкинил, который является незамещенным или замещен группами NH2, ОН, SH, N(С1-С6алкил)2, О(С1-С6алкил) или S(C1-С6алкил); С2-С6алкенил, который является незамещенным или замещен группами NH2, ОН, SH, N(С1-С6алкил)2, О(С1-С6алкил) или S(С1-С6алкил).
2. Пептоид по п. 1, где n равно 5.
3. Пептоид по п. 1, где R1 представляет собой С1-С6алкил, который является незамещенным или замещен группами NH2, ОН, SH, N(С1-С6алкил)2, О(С1-С6алкил) или S(С1-С6алкил); С2-С6алкинил, который является незамещенным или замещен группами NH2, ОН, SH, N(С1-С6алкил)2, О(С1-С6алкил) или S(С1-С6алкил);
С2-С6алкенил, который является незамещенным или замещен группами NH2, ОН, SH, N(С1-С6алкил)2, О(С1-С6алкил) или S(С1-С6алкил).
4. Пептоид по п. 1, где R1 представляет собой С1-С6алкил, замещенный по концу группой NH2.
5. Пептоид по п. 1, где R1 представляет собой 4-аминобутан.
6. Пептоид по п. 1, где R2 представляет собой С1-С6алкил, который является незамещенным или замещен группами NH2, ОН, SH, N(С1-С6алкил)2, О(С1-С6алкил) или S(С1-С6алкил); С2-С6алкинил, который является незамещенным или замещен группами NH2, ОН, SH, N(С1-С6алкил)2, О(С1-С6алкил) или S(С1-С6алкил); С2-С6алкенил, который является незамещенным или замещен группами NH2, ОН, SH, N(С1-С6алкил)2, О(С1-С6алкил) или S(С1-С6алкил).
7. Пептоид по п. 1, где R2 представляет собой С1-С6алкил, замещенный по концу группой NH2.
8. Пептоид по п. 7, где R1 представляет собой 4-аминобутан.
9. Пептоид по п. 1, где R3 представляет собой С1-С6алкил, С2-С6алкинил или С2-С6алкенил.
10. Пептоид по п. 9, где R3 представляет собой изобутил.
11. Пептоид по п. 1, где R4 представляет собой С1-С6алкил, замещенный по концу группой NH2.
12. Пептоид по п. 11, где R4 представляет собой 4-аминобутановую группу.
13. Пептоид по п. 1, где R5 представляет собой (R)-метилбензильную группу.
14. Пептоид по п. 1, где R6 представляет собой фуранильную группу.
15. Пептоид по п. 1, где R7 представляет собой С1-С6алкил, замещенный по концу группой NH2.
16. Пептоид по п. 15, где R7 представляет собой 4-аминобутановую группу.
17. Пептоид по п. 1, где R8 представляет собой С1-С6алкил.
18. Пептоид по п. 17, где R8 представляет собой изобутильную группу.
19. Пептоид по п. 1, где R1, R2, R4 и R7 представляют собой 4-аминобутановые группы; R3 и R8 представляют собой изобутильные группы; R5 представляет собой (R)-метилбензильную группу, a R6 представляет собой фуранильную группу.
20. Пептоид по п. 19, где R8 содержит на своем конце лизильную, гидроксильную или карбоксильную группу.
21. Способ взятия аутоиммунных Т-клеток у индивидуума, страдающего аутоиммунным заболеванием, включающий:
(a) получение пептоида по пп. 1-20, который специфически связывается с аутоиммунными Т-клетками, где указанный пептоид связан с носителем;
(b) контактирование образца, содержащего Т-клетки и взятого от указанного индивидуума, с указанным пептоидом, связанным с носителем, в течение периода времени, достаточного для связывания аутоиммунных Т-клеток с указанным пептоидом, связанным с носителем; и
(с) отделение указанного носителя от указанного образца.
22. Способ по п. 21, дополнительно включающий возращение образца со стадии (с) указанному индивидууму.
23. Способ по п. 21, где указанным аутоиммунным заболеванием является рассеянный склероз или ревматоидный артрит.
24. Способ по п. 21, в котором указанным пептоидом является 3-мер, 4-мер, 5-мер, 6-мер, 7-мер, 8-мер, 9-мер или 10-мер.
25. Способ по п. 21, в котором указанным носителем являются гранула, чип, фильтр, тест-полоска, мембрана, полимерная матрица или лунка.
26. Способ по п. 21, в котором указанным образцом является кровь, цереброспинальная жидкость или сперма.
27. Способ по п. 26, в котором указанным образцом является кровь, и указанную кровь берут у указанного индивидуума, обрабатывают ex vivo и возвращают указанному индивидууму.
28. Способ по п. 27, в котором указанную кровь пропускают через указанный лиганд, связанный с носителем, и возвращают указанному индивидууму по замкнутой цепи кровообращения.
29. Способ по п. 21, дополнительно включающий взятие указанного образца у указанного индивидуума.
30. Способ по п. 21, где указанным индивидуумом является человек или мышь.
31. Способ уничтожения аутоиммунных Т-клеток, взятых у индивидуума, страдающего аутоиммунным заболеванием, включающий:
(a) получение пептоида по пп. 1-20, который специфически связывается с аутоиммунными Т-клетками, где указанный пептоид конъюгирован с токсином; и
(b) контактирование образца, содержащего Т-клетки и взятого у указанного индивидуума, с указанным конъюгатом в течение периода времени, достаточного для связывания по меньшей мере одной аутоиммунной Т-клетки с указанным конъюгатом,
где указанный конъюгат вызывает гибель указанной аутоиммунной Т-клетки.
32. Способ по п. 31, в котором указанный образец обрабатывают ex vivo и где указанный способ дополнительно включает возвращение образца указанному индивидууму.
33. Способ по п. 31, где указанным аутоиммунным заболеванием является рассеянный склероз или ревматоидный артрит.
34. Способ по п. 31, в котором указанным пептоидом является 3-мер, 4-мер, 5-мер, 6-мер, 7-мер, 8-мер, 9-мер или 10-мер.
35. Способ по п. 31, в котором указанным токсином является рицин, дифтерийный токсин или холерный токсин.
36. Способ по п. 31, в котором указанным токсином является фотоактивируемый токсин.
37. Способ по п. 31, в котором указанным фотоактивируемым токсином является трис-бипиридил-рутений (II), а стадия (b) дополнительно включает облучение указанного образца видимым светом.
38. Способ по п. 31, в котором указанным образцом является кровь, цереброспинальная жидкость или сперма.
39. Способ по п. 31, дополнительно включающий взятие указанного образца у указанного индивидуума.
40. Способ по п. 31, где указанный индивидуумом является человек или мышь.
41. Способ уничтожения аутоиммунных Т-клеток, взятых у индивидуума, страдающего аутоиммунным заболеванием, или находящихся у него, включающий:
(a) получение пептоида по пп. 1-20, который специфически связывается с аутоиммунными Т-клетками, где указанный пептоид конъюгирован с молекулой, содержащей Fc IgG; и
(b) контактирование популяции аутоиммунных Т-клеток с указанным конъюгатом в течение периода времени, достаточного для связывания по меньшей мере одной аутоиммунной Т-клетки с указанным конъюгатом,
где указанный конъюгат индуцирует приток иммунных эффекторов к указанным аутоиммунным Т-клеткам, что приводит к их гибели.
42. Способ по п. 41, в котором указанную популяцию аутоиммунных Т-клеток обрабатывают ex vivo, и где указанный способ дополнительно включает возвращение образца со стадии (b) указанному индивидууму.
43. Способ по п. 41, где указанным аутоиммунным заболеванием является рассеянный склероз или ревматоидный артрит.
44. Способ по п. 41, в котором указанным пептоидом является 3-мер, 4-мер, 5-мер, 6-мер, 7-мер, 8-мер, 9-мер или 10-мер.
45. Способ по п. 41, в котором указанной молекулой, содержащей Fc IgG, является антитело, одноцепочечное антитело или Fc-фрагмент.
46. Способ по п. 45, в котором указанной молекулой, содержащей Fc IgG, является антитело или одноцепочечное антитело и указанный пептоид присоединен к антигенсвязывающему сайту указанного антитела.
47. Способ по п. 46, в котором указанной молекулой, содержащей Fc IgG, является Fc-фрагмент, не содержащий вариабельных областей IgG, и указанный пептоид присоединен к карбоксиконцу указанного Fc-фрагмента.
48. Способ по п. 41, в котором указанным образцом является кровь, цереброспинальная жидкость или сперма.
49. Способ по п. 41, дополнительно включающий взятие указанного образца у указанного индивидуума.
50. Способ по п. 41, в котором указанным индивидуумом является человек или мышь.
| US 2004253632 A1, 16.12.2004 | |||
| SIMON RJ et al | |||
| Peptoids: a modular approach to drug discovery | |||
| Proc Natl Acad Sci U S A., 1992, 89(20), p.9367-9371 | |||
| ALLURI PG et al | |||
| Isolation of protein ligands from large peptoid libraries | |||
| J Am Chem Soc., 2003, 125(46), p.13995-4004 |
Авторы
Даты
2015-09-20—Публикация
2010-05-28—Подача