Изобретение относится к области медицины и тканевой инженерии, а именно к сосудистой хирургии, и может быть использовано при изготовлении протезов сосудов малого диаметра (до 6 мм), предназначенных для хирургической реконструкции периферических кровеносных сосудов.
В настоящее время в качестве протезов кровеносных сосудов используют алло-, ауто-, ксенотрансплантаты, однако их применение ограничено анатомически, проблемой аллодонорства и недостатками ксенотрансплантатов (иммунный ответ, недостаточная биосовместимость, неудовлетворительные механические свойства, а именно их склонность к формированию аневризм или стенозов). Большинство используемых тканных, плетеных или вязаных протезов сосудов из синтетических материалов, таких как лавсан или политетрафторэтилен, имеют ряд серьезных недостатков, в частности недостаточную эластичность и биосовместимость. Это приводит к образованию слоя неоинтимы, инициации процессов, приводящих к уменьшению и закупориванию просвета протеза, и необходимости повторного оперативного вмешательства для замены протеза или для устранения возникших дефектов (A.Lafont, L.A.Guzman, P.L.Whitlow et al., Circulation Research, 1995).
Известен способ обработки протезов сосудов, заключающийся в том, что последние обрабатывают базовым раствором эпоксисоединений при рН 3,0-11,0 и при температуре 4-45°С в течение 2-21 суток, промывают, обрабатывают раствором хлоргексидина с концентрацией не менее 1% при рН 3,0-8,0 и температуре 15-45°С в течение 2-16 ч, а затем снова промывают и повторно обрабатывают базовым раствором. Повторную обработку базовым раствором осуществляют в течение 1-3 суток, в качестве базового могут быть также использованы 2-5% раствор диглицидилового эфира этиленгликоля или 2-5% раствор смесей эпоксисоединений различного состава (патент RU 2196424 C1, оп. 20.01.2003). Способ позволяет предупредить бактериальную контаминацию биологической поверхности протеза и использовать обработанные протезы в условиях локального или генерализованного инфекционного процесса.
Недостатками известного способа являются длительность и невозможность упрочнения протезов.
Известен способ обработки протезов сосудов, заключающийся в том, что синтетические протезы, например лавсановые вязаные, погружают в насыщенный раствор спирторастворимого антибиотика на 24-72 ч, перед использованием извлекают и помещают в 1%-ный раствор клея «Сульфакрилат» (патент RU 2141280 C1, оп. 20.11.1999). Способ позволяет повысить эластичность протезов и увеличить их антимикробные свойства.
Однако известный способ не обеспечивает упрочнения стенок протезов сосудов, а внутренняя поверхность протеза, обработанного данным способом, может обладать сниженными свойствами гемосовместимости материала за счет присутствия на поверхности сульфакрильных групп.
Наиболее близким к заявляемому способу - прототипом - является способ обработки протезов сосудов малого диаметра, полученных методом электроспиннинга из поликапролактона, включающий обработку протезов водным раствором, содержащим 20% водорастворимого сополимера "Pluronic F127" (EG99PG65EG99, молярная масса 12500 г/моль) при температуре от 54-60°С в течение 30 минут с последующей отмывкой обработанных протезов водой в течение 48 часов при температуре 4°С и сушкой (S.J.Lee et al. Biomaterials. 2008, N. 29, P. 1422-1430). Способ позволяет увеличить прочность протезов сосудов в 1,6-1,8 раза.
Недостатками прототипа являются ограниченные функциональные возможности, поскольку такой способ обработки подходит только для одного типа полимера - поликапролактона, а также низкое качество обработанных протезов, так как в результате такого метода обработки происходит спекание волокон материала между собой, после чего нарушается волокнистая структура, и уменьшается величина пор матрикса, и, следовательно, изменяются механические характеристики, такие как эластичность. Кроме того, такой способ обработки не позволяет сформировать упругие (гибкие) элементы, поскольку обрабатывается целиком весь протез.
Задачей изобретения является создание способа обработки протезов сосудов малого диаметра, позволяющего увеличить прочность протезов, а именно прочность в области упругой деформации, прочность на разрыв, прочность на радиальный разрыв и прорыв ниткой, а также устойчивость к перегибам, передавливанию, разлохмачиванию краев.
Технический результат: улучшение механических свойств протезов сосудов, особенно в области упругой деформации, увеличение прочности на прорыв ниткой, прочности на сжатие и увеличение гибкости.
Поставленная задача достигается предлагаемым способом, заключающимся в следующем:
Готовые протезы сосудов малого диаметра, представляющие собой трубки из микроволокнистого материала, изготовленные методом электроспиннинга из биодеградируемого полимера, облучают пучком быстрых электронов с дозой облучения 100-400 кГр, генерируемых стационарным ускорителем электронов типа ИЛУ-6 или ИЛУ-10. При этом для увеличения гибкости протезов облучение может быть осуществлено через шаблон, преимущественно прямоугольной формы, выполненный из материала, эффективно поглощающего излучение, и имеющий поперечные сквозные отверстия (пазы) с шириной, равной 0,5-2 диаметрам облучаемого протеза, и с расстоянием между отверстиями (толщиной перегородок), равным 0,5-3 диаметра облучаемого протеза, которые задают профиль рисунка на поверхности облучаемого протеза. Биодеградируемый полимер выбирают преимущественно из группы: поликапролактон, полибутилентерефталат, или их смеси с белками или гликозаминогликанами. Материал для изготовления шаблона выбирают из группы: сталь, дюралюминий, латунь, титан.
Предлагаемый способ позволяет быстро и без дополнительных материальных затрат увеличить прочность протезов сосудов, упакованных в герметично закрытую упаковку, в 1,5÷2 раза. Кроме того, используемая доза облучения одновременно обеспечивает стерилизацию протезов сосудов.
Определяющими отличительными признаками предлагаемого способа, по сравнению с прототипом, являются:
1. Обработку протезов сосудов малого диаметра, изготовленных методом электроспиннинга из биодеградируемых полимеров (преимущественно из поликапролактона или полибутилентерефталата), осуществляют путем облучения последних ионизирующим излучением (пучком быстрых электронов), генерируемым стационарным ускорителем электронов типа ИЛУ-6 или ИЛУ-10, с дозой облучения 100-400 кГр, что позволяет увеличить прочность стенок протезов сосудов в 1,5÷2 раза.
2. Для дополнительного увеличения гибкости протезов сосудов путем формирования периодичных ребер жесткости в процессе облучения используют шаблон, преимущественно прямоугольной формы, выполненный из материала, эффективно поглощающего излучение, и имеющий поперечные сквозные отверстия с шириной, равной 0,5-2 диаметрам облучаемого протеза, и с расстоянием между отверстиями, равным 0,5-3 диаметра облучаемого протеза, которые задают профиль рисунка на поверхности облучаемого протеза, что позволяет повысить устойчивость к перетиранию волокон протеза в процессе многократного изменения линейных размеров под действием периодической гидравлической нагрузки на сосуд в кровяном русле.
Поликапролактон (ПКЛ) - медленно биодеградирующий полимер, разрешенный для применения в хирургической практике. В цитологических исследованиях было показано, что этот полимер не вызывает цитотоксической реакции, материалы из ПКЛ могут выполнять роль трехмерного матрикса, к которому прикрепляются и пролиферируют первичные клетки (J.L.Lowery, N.Datta, G.C.Rutledge, Biomaterials, 2010).
Полибутилентерефталат - полимер, разрешенный для применения в хирургической практике (ближайший аналог полиэтилентерефталата - лавсан или дакрона), а также его смеси с белками, полисахаридами, протеогликанами, гликопротеинами или смесью перечисленных полимеров.
Изобретение иллюстрируется следующими примерами конкретного выполнения способа.
Пример 1.
Готовые протезы сосудов, представляющие собой трубки из поликапролактона с толщиной стенки 150-200 мкм (внутренний диаметр 1,7 мм) и длиной 60-80 мм, изготовленные методом электроспиннинга (Н.Wu, J.Fan, С.Chu, J.Wu, J Mater Sci: Mater Med, 2010), помещали на конвейер, перемещающийся со скоростью 6,7 см/с относительно источника излучения, и облучали пучком быстрых электронов, генерируемым ускорителем электронов ИЛУ-6 (2,2 МэВ, 400 мА, 10 Гц) с дозой от 50 до 150 кГр.
Для сравнения прочностных характеристик протезов сосудов до и после облучения были проведены механические испытания образцов.
Механические свойства облученных материалов, изучали, как описано в ГОСТ 51556-2000, с использованием универсальной разрывной машины для испытания материалов Zwick/Roell Z100 (Германия) при постоянной скорости приложения силы 10 мм/мин. (Ширина измеряемого образца составляла 1 см, длина исследуемого протеза 50-60 мм).
Для сравнения прочностных характеристик обработанных протезов была определена прочность в области упругой деформации при динамической и статической нагрузках, а также усилия на прорыв ниткой. Прочность в области упругой деформации характеризует нагрузку, при которой линейные размеры материала не изменяются после снятия нагрузки, что принципиально для протезов сосудов, которые работают в условиях постоянно изменяющейся гидравлической нагрузки. Прочность в области упругой деформации в условиях статической нагрузки измерили варьируя прикладываемое усилие с шагом 10 г. Для измерения остаточной деформации после статической нагрузки использовали оптический микроскоп МИР-2 (×15), который позволяет измерять остаточную деформацию образца материала с точностью 70 микрон.
Прочность протеза сосуда на прорыв ниткой измеряли, как описано в (Schaner P.J., et al., Journal of vascular surgery, 2004). Для этого один край протеза фиксировали, второй край на расстоянии 2 мм от конца протеза прошивали ниткой и к петле прикладывали увеличивающееся усилие (с шагом 10 г). Протез прошивали монофиламентной полипропиленовой нитью №5, диаметр нити 15 микрон, диаметр иглы 170 микрон. Прочностью считали максимальную нагрузку, при которой еще не наблюдается деформация/прорыв протеза. Прочность на прорыв для протезов из поликапролактона составляла в 160±20 грамм силы.
Прочность на передавливание измеряли по сдавливанию участка протеза сосуда длиной 1 см между двумя плоскими параллельными поверхностями с оптическим контролем просвета сосуда (до контакта стенок протеза, при помощи оптического микроскопа МИР-2×15); нагрузку увеличивали с шагом 2 г.
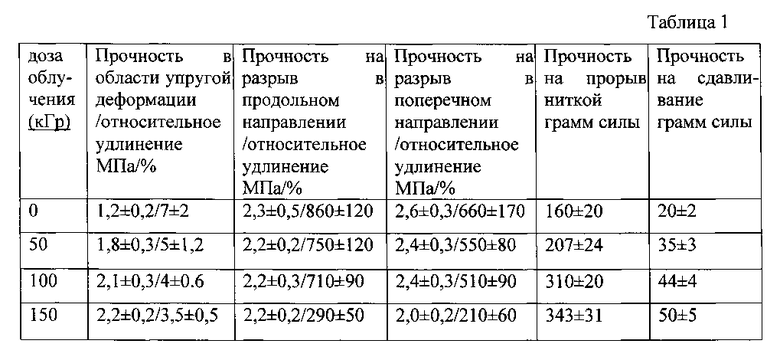
В таблице 1 представлена зависимость механических характеристик протезов сосудов, изготовленных из поликапролактона, от дозы облучения.
Из табл. 1 следует, что оптимальной дозой облучения протезов сосудов из поликапролактона является доза 100-150 кГр, позволяющая увеличить прочность протезов в области упругой деформации и прочность на передавливание в 1,5-2 раза.
Пример 2.
В качестве готовых протезов сосудов были использованы трубки из полибутилентерефталата, длиной 60-80 мм, с толщиной стенки 150-200 мкм и внутренним диаметром 1,7 мм, изготовленные методом электроспиннинга, с внешним диаметром 1,7 мм.
Готовые протезы сосудов помещали на конвейер, перемещающийся со скоростью 6,7 см/с относительно источника излучения, и облучали пучком быстрых электронов, генерируемым импульсным ускорителем электронов ИЛУ-10 (мощность до 5 МэВ, ток электронного пучка до 10 мА) с дозой от 200 до 400 кГр.
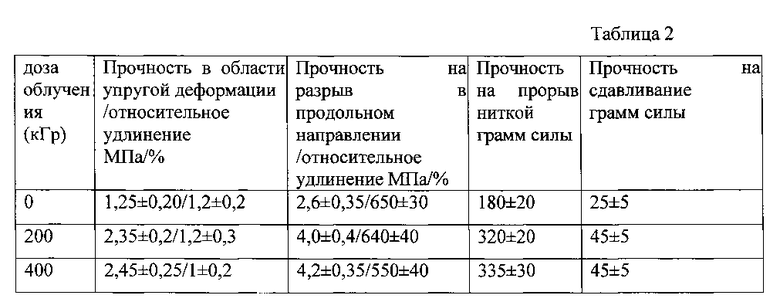
Процедуры по исследованию прочностных характеристик протезов сосудов до и после облучения осуществляли аналогично примеру 1. Зависимость механических характеристик сосудистых протезов, изготовленных из полибутилентерефталата, от дозы облучения, приведена в таблице 2.
Из таблицы 2 видно, что при облучении протезов пучком быстрых электронов с дозой 200-400 кГр механические свойства последних увеличиваются в 1,8-1,9 раз, что демонстрирует эффективность предложенного способа для упрочнения протезов сосудов. Полученные результаты позволяют изготавливать протезы сосудов с более тонкой стенкой, более эластичные и более механически совместимые со стенкой сосуда.
Пример 3.
Для изготовления протезов сосудов, содержащих в своем составе биополимеры (желатин или гепарин), были использованы трубки с толщиной стенки 150-200 мкм (внутренний диаметр 1,7 мм) и длиной 60-80 мм, изготовленные методом электроспиннинга, с внешним диаметром 1,7 мм. Толщину материала измеряли при помощи механического микрометра, как описано ранее.
Готовые протезы сосудов помещали на конвейер, перемещающийся со скоростью 6,7 см/с относительно источника излучения, и облучали пучком быстрых электронов, генерируемым ускорителем электронов ИЛУ-6 (2,2 МэВ, 400 мA, 10 Гц) с дозой 100 кГр.
Механические свойства облученных материалов, прочность материалов на разрыв и на передавливание изучали, как описано ранее в примере 1.
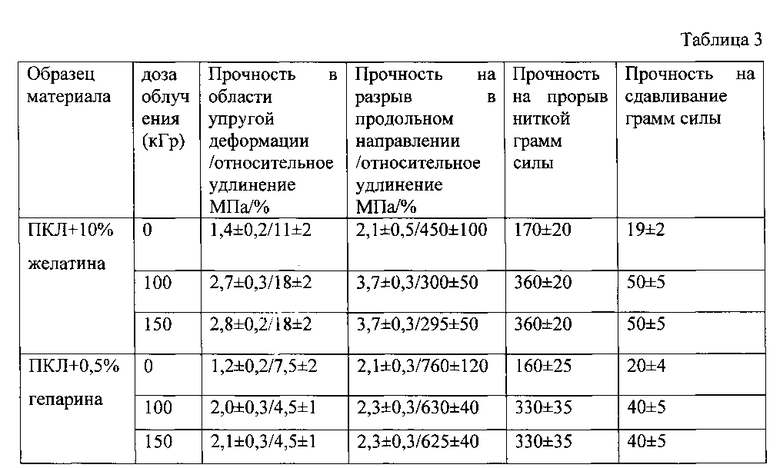
В таблице 3 представлена зависимость механических характеристик протезов сосудов, изготовленных из поликапролактона (ПКЛ) с содержанием 10% желатина и из поликапролактона с содержанием 10% гепарина при облучении пучком быстрых электронов с дозой 100 кГр.
Из таблицы 3 видно, что при облучении протезов из ПКЛ с добавками желатины или гепарина механические свойства последних повышаются так же, как и для протезов из ПКЛ без добавок (или немного выше, как в случае протезов из ПКЛ с 10% желатином), что демонстрирует эффективность предложенного способа для упрочнения протезов сосудов, изготовленных из химически синтезированных полимеров с дополнительно введенными биологическими полимерами.
Пример 4.
Для изготовления протезов сосудов, содержащих в своем составе биополимеры (желатин или гепарин), были использованы трубки с толщиной стенки 150-200 мкм (внутренний диаметр 1,7 мм) и длиной 60-80 мм, изготовленные методом электроспиннинга. Толщину материала измеряли при помощи механического микрометра, как описано ранее.
Готовые протезы сосудов помещали на конвейер, перемещающийся со скоростью 6,7 см/с относительно источника излучения, и облучали пучком быстрых электронов, генерируемым ускорителем электронов ИЛУ-6 (2,2 МэВ, 400 мA, 10 Гц) с дозой 150 кГр.
Механические свойства облученных материалов, прочность материалов на разрыв и на передавливание изучали, как описано ранее в примере 1.
Результаты испытаний представлены в таблице 3.
Из таблицы 3 видно, что при облучении протезов из ПКЛ с добавками желатины или гепарина пучком быстрых электронов с дозой 150 кГр механические свойства последних повышаются так же, как и для протезов из ПКЛ без добавок.
Пример 5.
Для обработки протезов сосудов, содержащих в своем составе биополимеры (желатин или гепарин), были использованы трубки, изготовленные из полибутилентерефталата (ПБТ) с добавлением 10% желатина и из ПБТ с добавлением 0,5% гепарина с толщиной стенки 150-200 мкм (внутренний диаметр 1,7 мм) и длиной 60-80 мм, изготовленные методом электроспиннинга, с внешним диаметром 1,7 мм. Толщину материала измеряли при помощи механического микрометра, как описано ранее в примере 1.
Готовые протезы сосудов помещали на конвейер, перемещающийся со скоростью 6,7 см/с относительно источника излучения, и облучали пучком быстрых электронов, генерируемым ускорителем электронов ИЛУ-6 (2,2 МэВ, 400 мA, 10 Гц) с дозами 200 и 400 кГр.
Механические свойства облученных материалов, прочность материалов на разрыв и на передавливание изучали, как описано в примере 1.
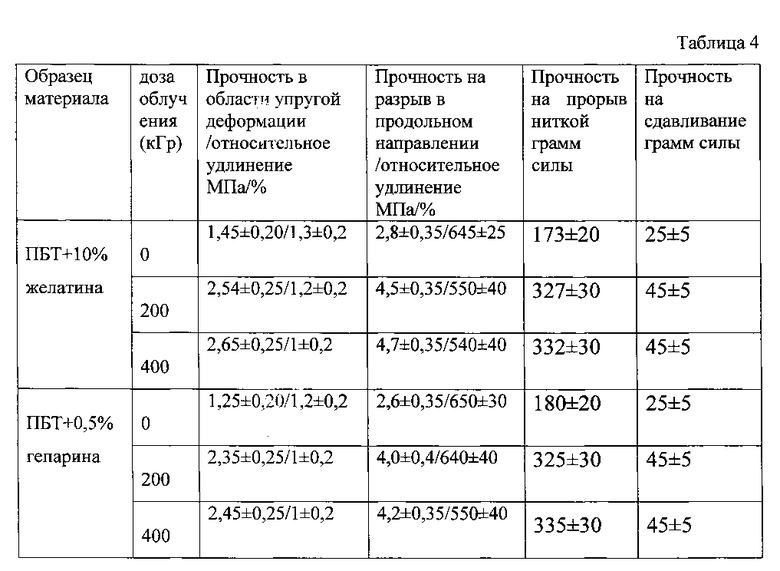
В таблице 4 представлена зависимость механических характеристик протезов сосудов, изготовленных из ПБТ с содержанием 10% желатина и из ПБТ с содержанием 0,5% гепарина при облучении пучком быстрых электронов с дозой 200 и 400 кГр.
Из таблицы 4 видно, что при облучении протезов из ПБТ с добавками желатины или гепарина пучком быстрых электронов с дозой облучения 200 и 400 кГр механические свойства последних повышаются (так же, как и для протезов из ПБТ без добавок).
Пример 6.
Готовые протезы сосудов из поликапролактона с толщиной стенки 150 мкм (внутренний диаметр 1,7 мм) и длиной 60 мм, изготовленные методом электроспиннинга, помещали в шаблон прямоугольной формы, выполненный из дюралюминия, имеющего толщину 2 мм с отфрезерованными чередующимися пазами шириной 2 мм и толщиной перегородок 1,5 мм, и облучали пучком быстрых электронов, генерируемым ускорителем электронов ИЛУ-6 (2,2 МэВ, 400 мA, 10 Гц) с дозой 100 кГр.
После облучения протезы сосудов вымачивали в растворе флуоресцентно меченного альбумина и визуализировали облученные и необлученные зоны.
На фиг. 1А изображен шаблон из дюралюминия для формирования чередующихся областей облучения на протезе сосуда из поликапролактона (вид снизу и сбоку). На фиг. 1Б видны облученные и необлученные зоны протеза (светлые - облученные, темные - необлученные).
Прочность протезов измеряли аналогично примеру 1. Было показано, что обработанные протезы обладают прочностью в области упругой деформации 1,9 МПа при относительном удлинении 6,5±1,5%; прочность на разрыв в продольном направлении составляет 2,3±0,3 при относительном удлинении 820±80%; прочность на разрыв в поперечном направлении составляет 2,5±0,35 при относительном удлинении 610±70%; прочность на прорыв ниткой составляет 270±20 грамм силы; прочность на сдавливание составляет 40±5 грамм силы. Полученная прочность практически вдвое превышает прочность исходных протезов сосудов. При этом чередование облученных и не облученных зон позволяет уменьшить радиус перегиба (для протеза на фиг. 1 он на 33% меньше, чем для исходного протеза из поликапролактона и составляет 30 мм).
Пример 7.
Готовые протезы сосудов из поликапролактона с толщиной стенки 200 мкм (внутренний диаметр 1,7 мм) и длиной 80 мм, изготовленные методом электроспиннинга, помещали в шаблон прямоугольной формы, выполненный из стали Х18Н9Т, имеющей толщину 1,5 мм с отфрезерованными чередующимися пазами шириной 2,5 мм и толщиной перегородок 3 мм, и облучали пучком быстрых электронов, генерируемым ускорителем электронов ИЛУ-6 (2,2 МэВ, 400 мA, 10 Гц) с дозой 150 кГр.
Прочность протезов измеряли аналогично примеру 1. Было показано, что обработанные протезы обладают прочностью в области упругой деформации 1,95 МПа при относительном удлинении 6,3±1,5%.
Было исследовано влияние длительной периодической гидравлической нагрузки на облученный протез сосуда. Для этого исследования была использована установка, включающая в себя гидравлический блок и блок электронного управления клапанами, имитирующая функционирование сосуда в организме.
106 циклов при перепаде давления 0/200 мм рт. ст. не влияет на структуру протеза, в нем не формируется участков деформированной структуры в переходных областях (облученных/необлученных), т.е. зональное упрочнение протеза не влияет на его устойчивость к периодической нагрузке.
Использование предлагаемого способа позволит в 1,5-2 раза увеличить прочность протезов, а именно прочность в области упругой деформации, прочность на разрыв, прочность на радиальный разрыв и прорыв ниткой, а также устойчивость к перегибам, передавливанию, разлохмачиванию краев
Способ позволяет надежно и воспроизводимо получать упрочненные микроволокнистые протезы сосудов для использования в медицинской практике.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИЗГОТОВЛЕНИЯ ПРОТЕЗОВ СОСУДОВ МАЛОГО ДИАМЕТРА С НИЗКОЙ ПОРИСТОСТЬЮ(ВАРИАНТЫ) | 2014 |
|
RU2572333C1 |
| Способ изготовления протезов кровеносных сосудов малого диаметра путем электроспиннинга и устройство для его осуществления | 2018 |
|
RU2704314C1 |
| Способ изготовления функционально активной полимерной заплаты для артериальной реконструкции, устойчивой к аневризмообразованию | 2024 |
|
RU2835436C1 |
| Способ изготовления протезов кровеносных сосудов малого диаметра путем электроспиннинга и устройство для его осуществления | 2023 |
|
RU2805590C1 |
| Технология изготовления функционально активных биодеградируемых сосудистых протезов малого диаметра с лекарственным покрытием | 2019 |
|
RU2702239C1 |
| БИОТРАНСПЛАНТАТ ДЛЯ ВОССТАНОВЛЕНИЯ ДЕФЕКТОВ ХРЯЩЕВОЙ ТКАНИ СУСТАВОВ | 2015 |
|
RU2593011C1 |
| Способ изготовления in vitro персонифицированного клеточнозаселенного сосудистого протеза | 2021 |
|
RU2764051C1 |
| Способ получения микроволокнистого материала, высвобождающего лекарственные средства | 2017 |
|
RU2669344C1 |
| ПРОТЕЗНЫЕ УСТРОЙСТВА ИЗ ПОЛИЭТИЛЕНА СВЕРХВЫСОКОЙ МОЛЕКУЛЯРНОЙ МАССЫ, ОБРАБОТАННОГО ОБЛУЧЕНИЕМ И ПЛАВЛЕНИЕМ | 1997 |
|
RU2211008C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИОРЕЗОРБИРУЕМОГО СОСУДИСТОГО ПРОТЕЗА МАЛОГО ДИАМЕТРА | 2019 |
|
RU2709621C1 |

Изобретение относится к области медицины, точнее к сосудистой хирургии, и может быть использовано при изготовлении протезов сосудов малого диаметра. Способ обработки протезов сосудов малого диаметра, изготовленных методом электроспиннинга из биодеградируемых полимеров, заключается в их облучении напрямую или через шаблон пучком быстрых электронов, генерируемых ускорителем электронов, с дозой облучения 100-400 кГр. Изобретение позволяет увеличить прочность протеза или отдельных участков протеза в 1,5-2 раза, улучшить механические свойства протезов сосудов, особенно в области упругой деформации, увеличить прочность на прорыв ниткой, прочность на сжатие и уменьшить радиус перегиба. 6 з.п. ф-лы, 1 ил., 4 табл., 7 пр.
1. Способ обработки протезов сосудов малого диаметра, изготовленных методом электроспиннинга из биодеградируемого полимера, отличающийся тем, что протезы сосудов облучают напрямую или через шаблон пучком быстрых электронов с дозой облучения 100-400 кГр, генерируемых ускорителем электронов.
2. Способ по п.1, отличающийся тем, что биодеградируемый полимер выбирают из группы: поликапролактон, полибутилентерефталат, или их смеси с белками или гликозаминогликанами.
3. Способ по п.1, отличающийся тем, что протезы сосудов, выполненные из поликапролактона или его смеси с белками или гликозаминогликанами облучают напрямую или через шаблон пучком быстрых электронов с дозой облучения 100-150 кГр.
4. Способ по п.1, отличающийся тем, что протезы сосудов, выполненные из полибутилентерефталата или его смеси с белками или гликозаминогликанами облучают напрямую или через шаблон пучком быстрых электронов с дозой облучения 200-400 кГр.
5. Способ по п.1, отличающийся тем, что при облучении используют шаблон, преимущественно прямоугольной формы, выполненный из материала, эффективно поглощающего излучение, и имеющий поперечные сквозные отверстия с шириной, равной 0,5-2 диаметрам облучаемого протеза, и с расстоянием между отверстиями, равным 0,5-3 диаметра облучаемого протеза.
6. Способ по п.3, отличающийся тем, что материал для изготовления шаблона выбирают из группы: сталь, дюралюминий, латунь или титан.
7. Способ по п.1, отличающийся тем, что для облучения используют ускоритель электронов ИЛУ-6 или ИЛУ-10.
| S.J | |||
| Lee et al | |||
| "The use of thermal treatments to enhance the mechanical properties of electrospun poly(epsilon-caprolactone) scaffolds", Biomaterials, 2008 Apr, N29(10), р.1422-1430 | |||
| J.P | |||
| Theron et al | |||
| "Modification, crosslinking and reactive electrospinning of a thermoplastic medical polyurethane for vascular graft applications", Acta |
Авторы
Даты
2015-09-27—Публикация
2014-07-09—Подача