Область техники, к которой относится изобретение
Настоящее изобретение относится к новым применениям 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина и его фармацевтически приемлемых солей в лечении заболеваний ЦНС.
Уровень техники изобретения
1-[2-(2,4-Диметилфенилсульфанил)фенил]пиперазин является мультимодальным антидепрессантом, эффект которого, как полагают, осуществляется за счет двух фармакологических механизмов действия: ингибирование обратного захвата и рецепторная активность. В исследованиях in vitro показано, что 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазин является антагонистом 5-HT3- и 5-HT7-рецепторов, частичным агонистом 5-HT1B-рецептора, агонистом 5-HT1A=рецептора и ингибитором 5-HT-транспортера. В доклинических исследованиях in vivo показано, что 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазин повышает уровни нейромедиаторов серотонина, норадреналина, дофамина, ацетилхолина и гистамина в определенных областях головного мозга. Считается, что все эти виды активности являются клинически значимыми и возможно вовлечены в механизм действия данного химического соединения.
1-[2-(2,4-Диметилфенилсульфанил)фенил]пиперазин и его применение для лечения заболеваний центральной нервной системы (ЦНС) были впервые описаны в международной патентной заявке, опубликованной под номером WO02/029232. В более поздних патентных заявках (WO2007/144005; WO2008/113359; WO2009/062517) были раскрыты кристаллические соли этого химического соединения, способы получения и дополнительные терапевтические применения этого химического соединения. На стенде P.2.c.040, представленном на 22-м Конгрессе Европейской коллегии по нейропсихофармакологии, 12-16 сентября 2009, Стамбул, Турция, и на стенде NR4-024, представленном на 162-м Ежегодном собрании Американской ассоциации психиатров, 16-21 мая 2009, Сан-Франциско, США, были раскрыты результаты предварительного исследования оценки клинической эффективности и переносимости данного химического соединения у пациентов, страдающих большим депрессивным расстройством (БДР). Результаты этого шестинедельного рандомизированного плацебоконтролируемого исследования, в котором принимало участие приблизительно 100 пациентов в каждой группе, показали, что действие 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина значимо отличается от плацебо при лечении депрессивных и тревожных симптомов у пациентов с БДР. Эти стенды также содержали информацию о том, что никакие клинически значимые изменения не были отмечены в результатах клинико-лабораторных анализов, на основных физиологических показателях, массе тела или ЭКГ-параметрах. Полный текст статьи, описывающей вышеупомянутое предварительное исследование клинической эффективности, авторов Alvares et al. стал доступен на сайте журнала Int. J. Neuropsychopharm 18 июля 2011 года.
Увеличение массы тела является обычно наблюдаемым нежелательным побочным эффектом при лечении психотропными лекарственными средствами. Наиболее выраженным наблюдаемым эффектом возможно является увеличение массы тела, связанное с антипсихотическими средствами, такими как клозапин и оланзапин, но клинически значимое увеличение массы тела также наблюдается при приеме антидепрессантов [Exp. Opin. Pharmacother., 1, 377-389, 2000].
В издании J. Clin. Psychpharm., 8, 323-330, 1988, сообщается, что лечение трициклическими антидепрессантами (ТЦА) амитриптилином, нортриптилином, имипрамином и дезипрамином давало дозозависимое увеличение массы тела на 0,57-1,37 кг в месяц. Аналогично, в издании J. Affective. Disord. 7, 133-138, 1984, сообщается, что у пациентов, получавших лечение ТЦА амитриптилином, нортриптилином или имипрамином, наблюдалось увеличение массы тела на 1,3-2,9 фунтов в месяц (0,58-1,31 кг в месяц). Более того, половина пациентов выбыла из исследования по причине избыточного увеличения массы тела.
В издании J. Clin. Psychiatry, 65, 1365-1371, 2004, описывается проходившее в течение 2,5 лет исследование, в котором проводилось сравнение увеличения массы тела у пациентов с обсессивно-компульсивным расстройством (ОКР), получавших различные антидепрессанты. В этом исследовании (как и во многих других) увеличение массы тела считалось потенциально клинически значимым (ПКЗ), если оно составляло 7% или более по сравнению с исходным уровнем. В конце периода исследования были получены следующие процентные значения пациентов, имеющих ПКЗ увеличение массы тела: кломипрамин (34,8%), циталопрам (14,3%), флуоксетин (8,7%), флувоксамин (10,7%), пароксетин (14,3%) и сертралин (4,5%).
В издании Int. Clin. Psychpharm., 13, 63-73, 1998, сообщается об исследовании профилактики рецидива, в котором проводилось сравнение долгосрочного (до двух лет) действия антидепрессантов миртазапина и амитриптилина. Доля пациентов с ПКЗ увеличением массы тела составила 22% в случае амитриптилина, 12,7% в случае миртазапина и 3,6% при приеме плацебо.
В издании J. Clin. Psychiatry, 61, 863-867, 2000, сообщается о долгосрочном исследовании (26-32 недели), в котором проводилось сравнение влияния антидепрессантов флуоксетина, сертралина и пароксетина на массу тела. Доля пациентов с ПКЗ увеличением массы тела составила 25,5% в случае пароксетина, 4,2% в случае сертралина и 6,6% в случае флуоксетина. Эти наблюдения подтверждаются единичными сообщениями [J. Clin. Psychiatry 60 (suppl 21), 16-19, 1999] о том, что 25-33% пациентов при поддерживающем (т.е. долгосрочном) лечении ингибиторами обратного захвата серотонина (СИОЗС) имело существенное увеличение массы и что пароксетин с большей вероятностью, чем другие лекарственные средства этого класса, может вызывать увеличение массы тела.
С другой стороны, ряд краткосрочных исследований с пароксетином показал отсутствие увеличения массы тела или даже потерю веса. В издании Acta Psychiatr. Scand. 80 (suppl 350), 117-123, 1989, сообщается, что никакого увеличения массы тела не было отмечено в ходе шестинедельного исследования с применением пароксетина. В издании Am. J. Psychiatry, 160, 749-756, 2003, сообщается о небольшой потере веса у 566 пациентов в ходе восьминедельного исследования с применением пароксетина. В издании J Clin. Psychiatry, 62, 350-536, 2001, сообщается об отсутствии какого-либо существенного влияния пароксетина на массу тела у 324 пациентов в ходе восьминедельного исследования.
В издании Am. J. Psychiatry, 156, 1170-1176, 1999, сообщается о долгосрочном (один год) исследовании влияния флуоксетина на массу тела. В то время как в острой фазе флуоксетин вызывает незначительное уменьшение веса, его долгосрочное влияние на массу тела аналогично плацебо.
Наконец, в издании Clin. Therapeutics, 24, 662-672, 2002, сообщается о долгосрочном (52 недели) влиянии бупропиона на массу тела. Бупропион вызывает умеренное, но значимое уменьшение массы тела.
Приведенные выше литературные источники показывают, что трудно прогнозировать влияние на массу тела лечения антидепрессантами. Для многих антидепрессантов нежелательным побочным действием является увеличение массы тела, для других - нет. Кроме того, по-видимому, трудно предсказать влияние на массу тела, связанное с долгосрочным лечением антидепрессантом, на основании результатов, полученных в ходе краткосрочных исследований. Эта непредсказуемость, вероятно, может быть объяснена, по меньшей мере, двумя факторами. Во-первых, несмотря на значительное увеличение массы тела, связанное с лечением антидепрессантами, как правило, оно меньше, чем при лечении антипсихотическими средствами. Таким образом, может потребоваться больше времени для того, чтобы любые изменения массы тела возникли и стали очевидны. Во-вторых, уменьшение или увеличение массы тела само по себе может быть симптомом депрессии. Поэтому, возникшее в результате лечения увеличение массы тела (т.е. увеличение массы тела, связанное с химическим соединением как таковым) может быть искажено изменениями массы тела, происходящими в результате лечения заболевания; таким образом, может потребоваться больше времени для разделения этих двух эффектов. Эти наблюдения, по-видимому, подтверждаются недавно опубликованным метаанализом 116 клинических исследований по изучению влияния антидепрессантов на массу тела [J. Clin. Psych. 71, 1259-1272, 2010].
Учитывая серьезность последствий, к которым может привести у пациентов возникающее при лечении увеличение массы тела, важным является обеспечить лечение такими антидепрессантами, у которых отсутствуют или только незначительно выражены нежелательные побочные эффекты, связанные с массой тела.
Сущность изобретения
Авторами настоящего изобретения было обнаружено, что долгосрочное лечение 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазином и его фармацевтически приемлемыми солями (Соединение I) не связано с увеличением массы тела. Таким образом, в одном варианте осуществления настоящее изобретение относится к Соединению I для применения в лечении заболевания ЦНС у пациента, который ранее получал (или все еще продолжает получать) медикаментозное лечение указанного заболевания, и это медикаментозное лечение было прекращено или уменьшено (или должно быть прекращено или уменьшено) из-за нежелательных побочных эффектов, связанных с массой тела.
В одном варианте осуществления настоящее изобретение относится к Соединению I для применения в лечении заболевания ЦНС у пациента, который обладает избыточной массой тела.
В одном варианте осуществления настоящее изобретение относится к Соединению I для применения в лечении заболевания ЦНС у пациента, который страдает дополнительным заболеванием, при котором необходимо избегать увеличения массы тела.
В одном варианте осуществления настоящее изобретение относится к способу лечения заболевания ЦНС у пациента, который ранее получал (или все еще продолжает получать) медикаментозное лечение указанного заболевания, и это медикаментозное лечение было прекращено или уменьшено (или должно быть прекращено или уменьшено) из-за нежелательных побочных эффектов, связанных с массой тела. Данный способ включает в себя введение терапевтически эффективного количества Соединения I нуждающемуся в этом пациенту.
В одном варианте осуществления настоящее изобретение относится к способу лечения заболевания ЦНС у пациента, который обладает избыточной массой тела Данный способ включает в себя введение терапевтически эффективного количества Соединения I нуждающемуся в этом пациенту.
В одном варианте осуществления настоящее изобретение относится к способу лечения заболевания ЦНС у пациента, который страдает дополнительным заболеванием, при котором необходимо избегать увеличения массы тела, данный способ включает в себя введение терапевтически эффективного количества Соединения I нуждающемуся в этом пациенту.
В одном варианте осуществления настоящее изобретение относится к Соединению I для применения в получении лекарственного средства для лечения заболевания ЦНС у пациента, который ранее получал (или все еще продолжает получать) медикаментозное лечение указанного заболевания, и это медикаментозное лечение было прекращено или уменьшено (или должно быть прекращено или уменьшено) из-за нежелательных побочных эффектов, связанных с массой тела.
В одном варианте осуществления настоящее изобретение относится к Соединению I для применения в получении лекарственного средства для лечения заболевания ЦНС у пациента, который обладает избыточной массой тела.
В одном варианте осуществления настоящее изобретение относится к Соединению I для применения в получении лекарственного средства для лечения заболевания ЦНС у пациента, который страдает дополнительным заболеванием, при котором необходимо избегать увеличения массы тела.
Подробное описание изобретения
Молекулярная структура 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина
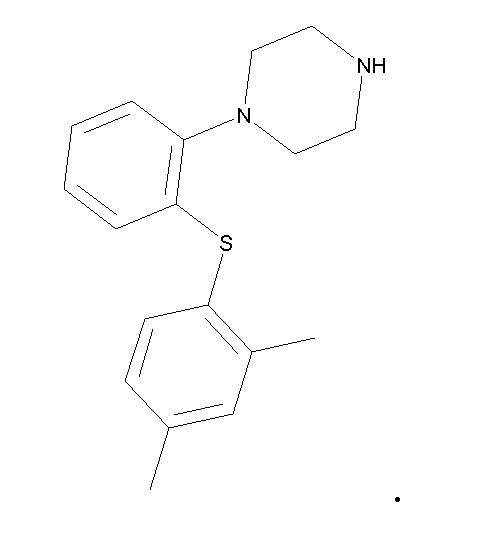
В данном контексте 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазин и его фармацевтически приемлемые соли именуются как Соединение I. Конкретная соль, например бромисто-водородная соль, именуется как Соединение I HBr.
В одном варианте осуществления изобретения указанные фармацевтически приемлемые соли являются кислотно-аддитивными солями кислот, которые являются нетоксичными. Указанные соли включают в себя соли органических кислот, таких как малеиновая, фумаровая, бензойная, аскорбиновая, янтарная, щавелевая, бис-метиленсалициловая, метансульфоновая, этандисульфоновая, уксусная, пропионовая, винная, салициловая, лимонная, глюконовая, молочная, яблочная, миндальная, коричная, цитраконовая, аспарагиновая, стеариновая, пальмитиновая, итаконовая, гликолевая, п-аминобензойная, глютаминовая, бензолсульфоновая, теофиллинуксусная кислоты, а также 8-галотеофиллины, например 8-бромтеофиллин. Указанные соли можно также получать из неорганических солей, таких как соли соляной, бромисто-водородной, серной, сульфаминовой, фосфорной и азотной кислот. Особо упоминаются соли метансульфоновой кислоты, малеиновой кислоты, фумаровой кислоты, мезовинной кислоты, (+)-винной кислоты, (-)-винной кислоты, соляной кислоты, бромисто-водородной кислоты, серной кислоты, фосфористой кислоты и азотной кислоты. Отдельное упоминание сделано для бромисто-водородной соли.
Пациенты и практикующие врачи часто отдают предпочтение лекарственным формам для перорального применения благодаря простоте их введения и, как следствие, лучшему соблюдению режима терапии. Для таблеток предпочтительным является, чтобы активные ингредиенты находились в кристаллической форме. В одном варианте осуществления настоящее изобретение относится к Соединению I в кристаллической форме. Кристалличность Соединения I подтверждается пиками порошковой рентгеновской дифрактограммы (XRDP) приведенной, например в международной заявке WO2007/144005.
Как свидетельствуют данные, приведенные в заявке WO2007/144005 (см. пример 4a-f) бромисто-водородная соль 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина (Соединение I HBr) может существовать в нескольких формах, т.е. она является полиморфной. Полиморфные формы имеют различные свойства. Бета-форма Соединения I HBr (как определено в WO2007/144005) является более стабильной, о чем свидетельствуют более высокая точка плавления по данным дифференциальной сканирующей калориметрии (ДСК) и более низкая растворимость. Кроме того, бета-форма обладает привлекательным сочетанием низкой гигроскопичности и растворимости, что делает это химическое соединение особенно подходящим для изготовления таблеток. Таким образом, в одном варианте осуществления настоящее изобретение относится к применению бромисто-водородной соли 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина с пиками XRDP приблизительно в области 6,89, 9,73, 13,78 и 14,62 (°2θ) (±0,1), такими как приблизительно 6,89, 8,48, 9,73, 13,78, 14,62 и 24,73 (°2θ) (±0,1).
В другом случае, если Соединение I представляет собой лекарственную форму для перорального применения в виде капель, то предпочтительными могут оказаться другие соли, характеризующиеся более высокой растворимостью. Когда химическое соединение вводится как лекарственная форма для перорального применения в виде капель, то несколько капель концентрированного жидкого средства указанной лекарственной формы отмеряется и добавляется в стакан воды, сока или тому подобного, который пациент выпивает. В качестве примера, антидепрессант ципрамил выпускается в виде лекарственной формы для перорального применения в виде капель с концентрацией 40 мг/мл. Было обнаружено, что DL-молочнокислая соль Соединения I обладает высокой растворимостью и поэтому является особенно подходящей для лекарственных форм для перорального применения в виде капель. Таким образом, в одном варианте осуществления настоящее изобретение относится к применению DL-молочнокислой соли 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина.
Существует множество причин, по которым следует избегать увеличения массы тела вообще и, в частности, в связи с лечением заболеваний ЦНС. Ожирение и избыточная масса тела связаны с серьезными заболеваниями, такими как сахарный диабет второго типа, гипертония и ишемическая болезнь сердца. У человека, который в зрелом возрасте дополнительно набирает 5-7,9 кг веса, сахарный диабет второго типа развивается с вероятностью в 1,9 раза большей, чем у человека, который сохраняет стабильную массу тела после достижения возраста 18 лет [J. Clin. Psych., 1999, 60 (suppl 21), 5-9, 1999]. Таким образом, первоначальным мероприятием в лечении таких заболеваний, как сахарный диабет второго типа, гипертония и ишемическая болезнь сердца, является изменение рациона питания таким образом, чтобы вызвать уменьшение массы тела у пациента. В более общем плане увеличение массы тела связано с нарушенным физическим функционированием, пониженным качеством жизни и плохим психическим здоровьем. Соблюдение режима лечения является дополнительным аспектом, который нужно учитывать. В связи с физическим дискомфортом, пониженной самооценкой и обсуждаемым выше риском для здоровья, связанными с увеличением массы тела, многие пациенты, у которых в процессе лечения происходит увеличение массы тела, отказываются принимать лекарственное средство в соответствии с предписаниями, что в итоге приводит к неудовлетворительному результату лечения. Таким образом, увеличение массы тела, связанное с лечением заболеваний ЦНС, является существенным фактором, и важно иметь возможность предложить такое лечение заболеваний ЦНС, при котором отсутствуют или только незначительно выражены нежелательные побочные эффекты, связанные с массой тела.
Как показано в Примерах, Соединение I не вызывает увеличение массы тела при долгосрочном лечении. Таким образом, Соединение I особенно хорошо подходит для долгосрочного лечения, лечения пациентов, которые не могут принимать другие лекарственные средства из-за нежелательных побочных эффектов, связанных с массой тела (т.е. как терапия второй линии), для пациентов, которые кроме своего заболевания ЦНС страдают другим заболеванием, при котором важно избегать увеличения массы тела, и для пациентов с избыточной массой тела.
Предполагается, что в данном контексте термин «долгосрочный» включает в себя поддерживающее лечение, и он относится к периоду лечения свыше 12 недель, например свыше 24 недель, например свыше 48 недель, например свыше 72 недель. Долгосрочное лечение включает в себя хроническое лечение, такое как лечение в течение всей жизни.
В одном варианте осуществления настоящее изобретение относится к Соединению I для применения в лечении заболевания ЦНС у пациента, где указанное лечение связано с незначительным увеличением массы тела или полным его отсутствием. В частности, указанное лечение является долгосрочным.
В одном варианте осуществления настоящее изобретение относится к Соединению I для применения в лечении заболевания ЦНС у пациента, при котором указанный пациент теряет вес. В частности, указанный пациент ранее получал другое медикаментозное лечение указанного заболевания, где указанное другое медикаментозное лечение связано с увеличением массы тела.
В одном варианте осуществления настоящее изобретение относится к Соединению I для применения в лечении заболевания ЦНС у пациента, который ранее получал (или все еще продолжает получать) медикаментозное лечение указанного заболевания, и это медикаментозное лечение было прекращено (или должно быть прекращено) из-за нежелательных побочных эффектов, связанных с массой тела. Нежелательные побочные эффекты, связанные с увеличением массы тела, включают в себя гипертонию, повышенный уровень сахара в крови и пониженную самооценку или качество жизни. В частности, указанным нежелательным побочным эффектом является увеличение массы тела. Ранее получаемое медикаментозное лечение, как правило, представляет собой психотропное средство, такое как антипсихотическое средство или антидепрессант.
В одном варианте осуществления настоящее изобретение относится к Соединению I для применения в лечении заболевания ЦНС у пациента, который обладает избыточной массой тела. В данном контексте «избыточная масса тела» может быть определена в единицах индекса массы тела (ИМТ). В одном варианте осуществления изобретения указанный пациент имеет ИМТ более 25, например более 30. ИМТ определяют путем деления массы в килограммах на рост в метрах в квадрате.
В одном варианте осуществления настоящее изобретение относится к Соединению I для применения в лечении заболевания ЦНС у пациента, который страдает (дополнительным) заболеванием, при котором необходимо избегать увеличения массы тела. Как обсуждалось выше, такое дополнительное заболевание включает в себя сахарный диабет второго типа, гипертонию и ишемическую болезнь сердца. Кроме того, оно может включать в себя состояния, такие как никотиновый абстинентный синдром, например отказ от курения. В частности, указанное лечение является долгосрочным.
Ожидается, что благодаря своему уникальному фармакологическому профилю, Соединение I является пригодным для лечения различных заболеваний ЦНС. В международных патентных заявках, опубликованных под номерами WO03/029232, WO2007/144005, WO2008/113359 и WO2009/062517, раскрыты примеры таких заболеваний ЦНС. В частности, термин «заболевание ЦНС» в данном контексте обозначает заболевание, выбранное из депрессивных расстройств, тревожных расстройств, хронической боли и зависимости.
Депрессивные расстройства включают в себя большое депрессивное расстройство, дистимическое расстройство, депрессию, связанную с биполярным расстройством, и депрессию с признаками тревожности (тревожная депрессия). Тревожные расстройства включают в себя генерализованное тревожное расстройство, панические атаки, фобии, обсессивно-компульсивное расстройство и посттравматическое стрессовое расстройство. Хроническая боль включает в себя фантомные боли в ампутированных конечностях, невропатическую боль, диабетическую невропатию, постгерпетическую невралгию, туннельный синдром запястья, ВИЧ- невропатию, мигрень, головную боль напряжения и синдром фибромиалгии. Зависимость включает в себя пристрастие к или злоупотребление алкоголем, наркотиками и лекарственными средствами.
В одном варианте осуществления настоящее изобретение относится к способу долгосрочного лечения заболевания ЦНС, включающему в себя введение терапевтически эффективного количества Соединения I нуждающемуся в этом пациенту, где указанное введение не связано с увеличением массы тела.
В одном варианте осуществления настоящее изобретение относится к способу лечения заболевания ЦНС, включающему в себя введение терапевтически эффективного количества Соединения I нуждающемуся в этом пациенту, где указанное введение связано с уменьшением массы тела. В частности, указанный пациент ранее получал другое медикаментозное лечение указанного заболевания, где указанное другое медикаментозное лечение связано с увеличением массы тела.
В одном варианте осуществления настоящее изобретение относится к способу лечения заболевания ЦНС у пациента, который ранее получал (или все еще продолжает получать) медикаментозное лечение указанного заболевания, и это медикаментозное лечение было прекращено (или должно быть прекращено) из-за нежелательных побочных эффектов, связанных с массой тела. Данный способ включает в себя введение терапевтически эффективного количества Соединения I нуждающемуся в этом пациенту. Нежелательные побочные эффекты, связанные с увеличением массы тела, включают в себя гипертонию, повышенный уровень сахара в крови и пониженную самооценку или качество жизни. В частности, указанным нежелательным побочным эффектом является увеличение массы тела. Ранее получаемое медикаментозное лечение, как правило, представляет собой психотропное средство, такое как антипсихотическое средство или антидепрессант.
В одном варианте осуществления настоящее изобретение относится к способу лечения заболевания ЦНС у пациента, который обладает избыточной массой тела, данный способ включает в себя введение терапевтически эффективного количества Соединения I нуждающемуся в этом пациенту. В одном варианте осуществления изобретения указанный пациент имеет ИМТ более 25, например более 30.
В одном варианте осуществления настоящее изобретение относится к способу лечения заболевания ЦНС у нуждающегося в этом пациента, данный способ включает в себя этапы a) определения ИМТ указанного пациента и b) введения терапевтически эффективного количества Соединения I указанному пациенту, если ИМТ составляет более 25, например более 30.
В одном варианте осуществления настоящее изобретение относится к способу лечения заболевания ЦНС у нуждающегося в этом пациента, где указанный пациент страдает дополнительным заболеванием, при котором необходимо избегать увеличения массы тела. Данный способ включает в себя введение терапевтически эффективного количества Соединения I указанному пациенту. В одном варианте осуществления изобретения указанное дополнительное заболевание выбрано из сахарного диабета второго типа, гипертонии, ишемической болезни сердца, или пациент воздерживается от никотина. В частности, указанное лечение является долгосрочным.
В одном варианте осуществления настоящее изобретение относится к способу лечения заболевания ЦНС у нуждающегося в этом пациента Данный способ включает в себя этапы a) диагностики того, страдает ли указанный пациент заболеванием, при котором необходимо избегать увеличения массы тела; и b) введения терапевтически эффективного количества Соединения I указанному пациенту, если указанная диагностика показала, что указанный пациент страдает заболеванием, при котором необходимо избегать увеличения массы тела. В частности, такое заболевание, при котором необходимо избегать увеличения массы тела, включает в себя сахарный диабет второго типа, гипертонию и ишемическую болезнь сердца. Кроме того, оно может включать в себя состояния, такие как никотиновый абстинентный синдром, например отказ от курения. В частности, указанное лечение является долгосрочным.
В одном варианте осуществления изобретения способ относится к способу стимулирования продаж Соединения I, указанный способ включает в себя публичное распространение информации о том, что введение Соединения I пациентам не является неблагоприятно связанным с увеличением массы тела, или о том, что введение Соединения I пациентам совсем не связано или связано в ограниченной степени с увеличением массы тела.
В одном варианте осуществления изобретения распространение указанной информации осуществляется способом, выбранным из группы, состоящей из речевой коммуникации, распространения брошюр, печатных носителей, аудиолент, магнитных носителей, цифровых носителей, аудиовизуальных средств массовой информации, рекламных щитов, рекламы, газет, журналов, прямых почтовых рассылок, радио, телевидения, электронной почты, брайлевской печати, электронных средств массовой информации, рекламных баннеров, волоконной оптики и лазерных световых шоу.
В одном варианте осуществления настоящее изобретение относится к применению Соединения I для получения лекарственного средства для долгосрочного лечения заболевания ЦНС, где указанное лечение связано с незначительным увеличением массы тела или полным его отсутствием.
В одном варианте осуществления настоящее изобретение относится к применению Соединения I для получения лекарственного средства для лечения заболевания ЦНС у пациента, при котором указанный пациент теряет вес. В частности, указанный пациент ранее получал другое медикаментозное лечение указанного заболевания, где указанное другое медикаментозное лечение связано с увеличением массы тела.
В одном варианте осуществления настоящее изобретение относится к применению Соединения I для получения лекарственного средства для лечения заболевания ЦНС у пациента, который ранее получал (или все еще продолжает получать) медикаментозное лечение указанного заболевания, и это медикаментозное лечение было прекращено (или должно быть прекращено) из-за нежелательных побочных эффектов, связанных с массой тела. Нежелательные побочные эффекты, связанные с увеличением массы тела, включают в себя гипертонию, повышенный уровень сахара в крови и пониженную самооценку или качество жизни. В частности, указанным нежелательным побочным эффектом является увеличение массы тела. Ранее получаемое медикаментозное лечение, как правило, представляет собой психотропное средство, такое как антипсихотическое средство или антидепрессант.
В одном варианте осуществления настоящее изобретение относится к применению Соединения I для получения лекарственного средства для лечения заболевания ЦНС у пациента, который обладает избыточной массой тела. В одном варианте осуществления изобретения указанный пациент имеет ИМТ более 25, например более 30.
В одном варианте осуществления настоящее изобретение относится к применению Соединения I для получения лекарственного средства для лечения заболевания ЦНС у пациента, который страдает дополнительным заболеванием, при котором необходимо избегать увеличения массы тела. Как обсуждалось выше, такое дополнительное заболевание включает в себя сахарный диабет второго типа, гипертонию и ишемическую болезнь сердца. Кроме того, оно может включать в себя состояния, такие как никотиновый абстинентный синдром, например отказ от курения. В частности, указанное лечение является долгосрочным.
Используемый в настоящем изобретении термин «терапевтически эффективное количество» химического соединения означает количество, достаточное для излечения, облегчения или частичного купирования клинических проявлений данного заболевания и его осложнений при терапевтическом воздействии, включающем в себя введение указанного химического соединения. Количество, достаточное для достижения этой цели, определяется как «терапевтически эффективное количество». Эффективное количество для каждой цели будет зависеть от тяжести заболевания или повреждения, а также от веса и общего состояния субъекта. Следует понимать, что определение подходящей дозы может быть достигнуто при помощи стандартных экспериментов, путем построения матрицы значений и испытания различных точек этой матрицы, это все находится в рамках стандартного уровня компетентности квалифицированного врача.
Используемые в настоящем изобретении термины «лечение» и «терапия» означают обращение с пациентом и уход за ним с целью противодействия состоянию, такому как заболевание или расстройство. Предполагается, что эти термины включают в себя полный спектр мероприятий по лечению данного состояния, от которого страдает пациент, таких как введение активного химического соединения с целью облегчения симптомов или осложнений, замедления прогрессирования заболевания, расстройства или состояния, ослабления или облегчения симптомов и осложнений, и/или излечения или устранения заболевания, расстройства или состояния, а также предупреждения состояния, где предупреждение следует понимать как обращение с пациентом и уход за ним с целью противодействия заболеванию, состоянию или расстройству, включающих в себя введение активного химического соединения с целью предотвращения возникновения симптомов или осложнений. Тем не менее профилактическое (превентивное) и терапевтическое (лечебное) лечение являются двумя отдельными аспектами настоящего изобретения. Пациент, подлежащий лечению, предпочтительно является млекопитающим, в частности человеком.
Соединение I, как правило, вводится в суточных дозах от 1 до 100 мг, например от 2 до 40 мг, например 2, 5, 10, 15, 20, 5, 30, 35 мг. Суточная доза может включать в себя однократную суточную дозу или может состоять из двух или более разовых доз в сутки.
Соединение I удобно вводить в виде фармацевтической композиции, которая может быть приготовлена обычными способами, известными из уровня техники. Особое упоминание сделано для таблеток, которые могут быть изготовлены путем смешивания активного ингредиента со стандартными адъювантами и/или разбавителями с последующим прессованием смеси в обычной таблетировочной машине. Примеры адъювантов и разбавителей включают в себя: безводный вторичный кислый фосфат кальция, ПВП, ПВП-ВС-сополимеры, микрокристаллическую целлюлозу, натрия крахмалгликолят, кукурузный крахмал, маннит, картофельный крахмал, тальк, стеарат магния, желатин, лактозу, камеди и тому подобное. Любые другие адъюванты или разбавители, обычно используемые для этих целей, такие как красители, ароматизаторы, консерванты и т.д., могут быть использованы при условии, что они являются совместимыми с активными ингредиентами.
Растворы для инъекций могут быть приготовлены путем растворения активного ингредиента и возможных добавок в части растворителя для инъекции, предпочтительно в стерильной воде, доведения раствора до желаемого объема, стерилизации раствора и заполнения им подходящих ампул или флаконов. Любые подходящие добавки, традиционно используемые в данной области техники, могут быть добавлены, например вещества, регулирующие тоничность, консерванты, антиоксиданты и т.д.
Препараты для перорального применения в виде капель, как правило, включают в себя кроме активного ингредиента наполнители, выбранные из растворителя, буфера, поверхностно-активного вещества, модификатора поверхностного натяжения, модификатора вязкости, консерванта, антиоксиданта, красителей, маскера вкуса и ароматизатора.
Фармацевтические композиции, которые могут быть использованы в настоящем изобретении, могут быть введены любым подходящим способом, например перорально в виде таблеток, капсул, порошков, сиропов, жидкостей или парентерально в виде растворов для инъекции. Для приготовления таких композиций могут быть использованы способы, хорошо известные из уровня техники, и любые фармацевтически приемлемые носители, разбавители, наполнители или другие добавки, обычно используемые в данной области техники, могут быть использованы.
В целях удобства, Соединение I вводится стандартной лекарственной формы, содержащей указанное химическое соединение в количестве от примерно 1 до 50 мг, например 5, 10, 15 или 20 мг. Таблетки, содержащие Соединение I, могут быть легко получены путем влажного гранулирования. При использовании этого метода сухие твердые вещества (активные ингредиенты, наполнители, связующие вещества и т.д.) смешивают и увлажняют водой или другим увлажняющим агентом (например спиртом), и из увлажненных твердых веществ формируют агломераты или гранулы. Грануляцию влажной массы продолжают до достижения желаемого однородного размера части, после чего гранулированный продукт сушат. Соединение I, как правило, смешивают с моногидратом лактозы, кукурузным крахмалом и коповидоном в смесителе с большими сдвиговыми усилиями вместе с водой. После образования гранул эти гранулы могут быть просеяны через сито с подходящим размером ячеек и высушены. Полученные в результате высушенные гранулы затем смешивают с микрокристаллической целлюлозой, кроскармеллозой натрия и стеаратом магния с последующим прессованием в таблетки. В другом варианте влажное гранулирование Соединения I можно осуществлять с использованием маннита, кукурузного крахмала и коповидона, полученные гранулы перед прессованием в таблетки смешивают с микрокристаллической целлюлозой, натрия крахмалгликолятом и стеаратом магния. В другом варианте влажное гранулирование Соединения I можно осуществлять с использованием безводного вторичного кислого фосфата кальция, кукурузного крахмала и коповидона, полученные гранулы перед прессованием в таблетки смешивают с микрокристаллической целлюлозой, натрия крахмалгликолятом (тип A), тальком и стеаратом магния. Коповидон представляет собой ПВП-ВС-сополимер. В другом варианте таблетки, содержащие Соединение I, могут быть получены путем смешивания Соединения I, маннита и микрокристаллической целлюлозы в грануляционной сушилке с псевдоожиженным слоем, на эту смесь распыляют водный раствор гидроксипропилцеллюлозы для получения гранулированного порошка. Полученные гранулы затем смешивают с микрокристаллической целлюлозой, натрия крахмалгликолятом и стеаратом магния. Полученная смесь может быть впоследствии спрессована в таблетки. Как правило, таблетки покрывают подходящим покрывающим материалом.
Все библиографические источники, включая публикации, патентные заявки и патенты, упомянутые в настоящем изобретении, включены в него путем ссылки полностью и в той же степени, как если бы для каждого источника было индивидуально и конкретно указано, что он включен в настоящее изобретение путем ссылки и изложен в нем во всей своей полноте (в максимальной степени, разрешенной законодательством), независимо от любого отдельного указания о включении конкретных документов, сделанного где-либо еще в настоящем описании.
Употребление терминов в единственном числе в контексте описания настоящего изобретения следует рассматривать как относящееся как к единственному, так и к множественному числу, если иное не указано или явно противоречит контексту. Например термин «химическое соединение» следует понимать как относящийся к различным химическим соединениям, используемым в настоящем изобретении или конкретном описываемом его аспекте, если не указано иное.
Если не указано иное, то все точные значения, приведенные в настоящем описании, являются представлением соответствующих приближенных значений (например все точные иллюстративные значения, приведенные для конкретного фактора или измерения, можно рассматривать как относящиеся к соответствующим приближенным измерениям, модифицированным словом «примерно», там, где это уместно).
Предполагается, что приведенное здесь описание любого аспекта или аспектов настоящего изобретения с использованием терминов, таких как «включающий», «имеющий», «включающий в себя» или «содержащий», по отношению к элементу или элементам обеспечивает основание для аналогичного аспекта или аспекта настоящего изобретения, который «состоит из», «в основном состоит из» или «в основном включает в себя» этот конкретный элемент или элементы, если иное не указано или явно противоречит контексту (например композицию, описанную здесь как включающую в себя конкретный элемент, следует рассматривать также как описание композиции, состоящей из этого элемента, если иное не указано или явно противоречит контексту).
Примеры
Пример 1. Долгосрочное влияние на массу тела у пациентов с БДР
Влияние на массу тела, связанное с лечением, 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазин HBr изучали в исследовании профилактики рецидива у пациентов с большим депрессивным расстройством. Приблизительно 600 пациентов были включены в открытое исследование, в ходе которого они получали 5 или 10 мг Соединения I HBr (в пересчете на свободное основание). После 12 недель пациенты с выраженным клиническим ответом на терапию (N~400) были случайным образом разделены на две группы: получавших плацебо или 5/10 мг Соединения I HBr в течение 24 недель двойного слепого плацебоконтролируемого исследования. Отбор пациентов происходил в течение определенного времени, и поэтому окончание исследования определяли по последнему пациенту, завершившему 24 недели исследования, некоторые пациенты получали лечение в течение двойного слепого плацебоконтролируемого исследования длительностью до 64 недель. Это исследование было также представлено на стенде NR4-14 на 164-м Ежегодном собрании Американской ассоциации психиатров, 14-18 мая 2009, Гонолулу, Гавайи, США.
В приведенных таблицах 1 и 2 показана средняя разность в массе тела по сравнению с началом открытого периода и временем случайного отбора и доля пациентов, у которых во время исследования масса тела увеличилась на 7% или более, т.е. произошло потенциально клинически значимое увеличение.
Различие в массе тела по сравнению с началом открытого периода исследования (t=0)
Различие в массе тела по сравнению со временем случайного отбора (t=12 недель)
Оценивая данные в Таблице 1, следует иметь в виду, что пациенты в группе плацебо получали активное лечение в течение первых 12 недель. Тем не менее, данные, представленные в Таблицах 1 и 2 явно свидетельствуют о том, что даже после долгосрочного лечения отсутствуют значительные различия между плацебо и 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазин HBr, по крайней мере, в том, что касается увеличения массы тела.
Пример 2. Долгосрочное влияние на массу тела у пациентов с ГТР
Влияние на массу тела, связанное с лечением 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазин HBr, изучали в исследовании профилактики рецидива у пациентов с генерализованным тревожным расстройством (ГТР). 687 пациентов были включены в открытое исследование, в ходе которого они получали 5 или 10 мг Соединения I HBr (в пересчете на свободное основание). После 20 недель пациенты с выраженным клиническим ответом на терапию (N=459) были случайным образом разделены на две группы: получавших плацебо или 5/10 мг Соединения I HBr в течение 24-56 недель двойного слепого плацебоконтролируемого исследования. Отбор пациентов происходил в течение определенного времени, и поэтому окончание исследования определяли по последнему пациенту, завершившему 24 недели исследования, некоторые пациенты получали лечение в течение двойного слепого плацебоконтролируемого исследования длительностью до 56 недель.
В приведенных таблицах 3 и 4 показана средняя разность в массе тела по сравнению с началом открытого периода и временем случайного отбора и доля пациентов, у которых во время исследования масса тела увеличилась на 7% или более, т.е. произошло потенциально клинически значимое увеличение.
Различие в массе тела по сравнению с началом открытого периода исследования (t=0)
Различие в массе тела по сравнению со временем случайного отбора (t=20 недель)
Оценивая данные в Таблице 3, следует иметь в виду, что пациенты в группе плацебо получали активное лечение в течение первых 20 недель. Объединенные данные, представленные в Таблицах 1-4 показывают, что даже после долгосрочного лечения отсутствуют значительные различия между плацебо и 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазин HBr, по крайней мере, в том, что касается увеличения массы тела.
Группа изобретений относится к медицине, и может быть использована для долгосрочного лечения депрессии или тревоги в течение периода свыше 12 недель у пациента, который ранее получал медикаментозное лечение. При этом лечение было прекращено из-за нежелательных побочных эффектов, связанных с массой тела. Для этого применяют 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазин и/или его фармацевтически приемлемые соли. Также предложены способ долгосрочного лечения депрессии или тревоги и применение 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина и/или его фармацевтически приемлемых солей для получения лекарственного средства. Группа изобретений обеспечивает снижение побочных эффектов, связанных с изменением массы тела у пациента при долгосрочном лечении. 3 н. и 12 з. п. ф-лы,4 табл., 2 пр.
1. Применение 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина и/или его фармацевтически приемлемых солей для долгосрочного лечения депрессии или тревоги в течение периода свыше 12 недель у пациента, который ранее получал медикаментозное лечение указанного заболевания и это медикаментозное лечение было прекращено из-за нежелательных побочных эффектов, связанных массой тела.
2. Применение по п. 1, где лечение проводят в течение периода свыше 24 недель.
3. Применение по п. 1, где лечение проводят в течение периода свыше 48 недель.
4. Применение по п. 1, где лечение проводят в течение периода свыше 72 недель.
5. Применение по п. 1, где указанная фармацевтически приемлемая соль является бромистоводородной солью.
6. Способ долгосрочного лечения депрессии или тревоги в течение периода свыше 12 недель у нуждающегося в этом пациента, который ранее получал медикаментозное лечение указанного заболевания и это медикаментозное лечение было прекращено из-за нежелательных побочных эффектов, связанных массой тела, где способ включает введение терапевтически эффективного количества 1-[2-(2,4-диметилфенилсульфанил)-фенил]пиперазина и/или его фармацевтически приемлемых солей указанному пациенту.
7. Способ по п. 6, где лечение проводят в течение периода свыше 24 недель.
8. Способ по п. 6, где лечение проводят в течение периода свыше 48 недель.
9. Способ по п. 6, где лечение проводят в течение периода свыше 72 недель.
10. Способ по п. 6, где указанная фармацевтически приемлемая соль является бромистоводородной солью.
11. Применение 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина и/или его фармацевтически приемлемых солей для получения лекарственного средства для долгосрочного лечения депрессии или тревоги в течение периода свыше 12 недель у пациента, который ранее получал медикаментозное лечение указанного заболевания и это медикаментозное лечение было прекращено из-за нежелательных побочных эффектов, связанных массой тела.
12. Применение по п. 11, где лечение проводят в течение периода свыше 24 недель.
13. Применение по п. 11, где лечение проводят в течение периода свыше 48 недель.
14. Применение по п. 11, где лечение проводят в течение периода свыше 72 недель.
15. Применение по п. 11, где указанная фармацевтически приемлемая соль является бромистоводородной солью.
| WO 2009062517 A1, 22.05.2009 | |||
| WO 2008153632 A2, 18.12.2008 | |||
| LAM D.D | |||
| et al., Distribution and neurochemical characterization of neurons within the nucleus of the solitary tract responsive to serotonin agonist-induced hypophagia, Behav Brain Res | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Найдено из Интернета на сайте: | |||
Авторы
Даты
2015-10-10—Публикация
2011-08-22—Подача