Настоящее изобретение относится к новым производным 4-фенокси-никотинамида или 4-фенокси-пиримидин-5-карбоксамида, их изготовлению, фармацевтическим композициям, содержащим их, и их применению в качестве лекарственных средств.
А именно, настоящее изобретение относится к соединениям формулы
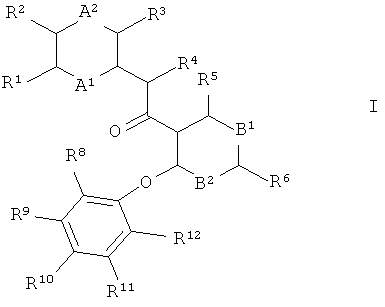
где А1 представляет собой CR13 или N;
А2 представляет собой CR14 или N;
R1 и R2 независимо друг от друга выбраны из группы, состоящей из водорода, С1-7алкила, галогена, галоген-С1-7-алкила, циано и C1-7-алкокси;
R13 и R14 независимо друг от друга выбраны из группы, состоящей из водорода, C1-7-алкила, галогена, галоген-С1-7-алкила, циано, С1-7-алкокси, амино и C1-7-алкилсульфанила;
R3 выбран из группы, состоящей из водорода, С1-7-алкила, галогена, галоген-С1-7-алкила, С1-7-алкокси, циано, С3-7-циклоалкила, N-гетероциклила, пятичленного гетероарила, фенила и -NR15R16, где R15 и R16 независимо друг от друга выбраны из водорода, С1-7-алкила и С3-7-циклоалкила;
R4 выбран из группы, состоящей из водорода, С1-7-алкила, галоген-С1-7-алкила и С3-7-циклоалкила; или
R3 и R4 или R3 и R14 вместе представляют собой -X-(CR17R18)n- и образуют часть кольца, где
Х выбран из группы, состоящей из -CR19R20-, О, S, С=O и NR21;
R17 и R18 независимо друг от друга выбраны из водорода или С1-7-алкила;
R19 и R20 независимо друг от друга выбраны из группы, состоящей из водорода, С1-7-алкила, С1-7-алкоксикарбонила, незамещенного гетероциклила и гетероциклила, замещенного одной или двумя группами, выбранными из С1-7-алкила или галогена,
или R19 и R20 вместе с атомом С, к которому они присоединены, образуют кольцо циклопропила или оксетанила или вместе образуют группу=СН2 или=CF2;
R21 выбран из группы, состоящей из водорода, С1-7-алкила, галоген-С1-7-алкила,
С3-7-циклоалкила или С3-7-циклоалкил-С1-7-алкила, где С3-7-циклоалкил не замещен или замещен карбоксил-С1-7алкилом или C1-7-алкоксикарбонилом,
гетероциклила, гетроциклил-С1-7-алкила,
гетероарила, гетероарил-С1-7-алкила,
карбоксил-С1-7-алкила, С1-7-алкоксикарбонил-С1-7-алкила,
С1-7-алкилкарбонилокси-С1-7-алкила,
С1-7-алкилсульфонила,
фенила, где фенил не замещен или замещен карбоксил-С1-7-алкилом
или С1-7-алкоксикарбонилом,
фенилкарбонила, где фенил не замещен или замещен карбоксил-С1-7-алкилом или С1-7-алкоксикарбонилом, и
фенилсульфонила, где фенил не замещен или замещен карбоксил-С1-7-алкилом или С1-7-алкоксикарбонилом,
или R21 и R17 вместе представляют собой -(CH2)3- и образуют часть кольца, или R21 вместе с парой R17 и R18 представляют собой
-СН=СН-СН=и образуют часть кольца;
и n представляет собой 1, 2 или 3;
B1 представляет собой N или N^O";
B2 представляет собой CR7 или N;
R5, R6 и R7 независимо друг от друга выбраны из группы, состоящей из водорода, галогена, С1-7-алкила, С1-7-алкокси, галоген-С1-7-алкила, галоген-С1-7-алкокси и циано;
и R8, R9, R10, R11 и R12 независимо друг от друга выбраны из группы, состоящей из
водорода, С1-7-алкила, С2-7-алкенила, С2-7-алкинила, галогена, галоген-С1-7-алкила,
С1-7-алкокси, галоген-С1-7-алкокси,
гидрокси, гидрокси-С1-7-алкокси,
гидрокси-С1-7-алкила, гидрокси-С3-7-алкенила, гидрокси-С3-7-алкинила,
циано, карбоксила, С1-7-алкоксикарбонила, аминокарбонила,
карбоксил-С1-7-алкила, карбоксил-С2-7-алкенила, карбоксил-С2-7-алкинила,
С1-7-алкоксикарбонил-С1-7-алкила, С1-7-алкоксикарбонил-С2-7-алкенила,
С1-7-алкоксикарбонил-С2-7-алкинила,
карбоксил-С1-7-алкокси, С1-7-алкоксикарбонил-С1-7-алкокси,
карбоксил-С1-7-алкил-аминокарбонила, карбоксил-С1-7-алкил-(С1-7-алкиламино)-карбонила,
С1-7-алкоксикарбонил-С1-7-алкил-аминокарбонила, С1-7-алкоксикарбонил-С1-7-алкил-(С1-7-алкиламино)-карбонила,
карбоксил-С1-7-алкил-аминокарбонил-С1-7-алкила,
карбоксил-С1-7-алкил-(С1-7-алкиламино)-карбонил-С1-7-алкила,
С1-7-алкокси карбонил-С1-7-алкил-аминокарбонил-С1-7-алкила,
С1-7-алкоксикарбонил-С1-7-алкил-(С1-7-алкиламино)-карбонил-С1-7-алкила,
гидрокси-С1-7-алкил-аминокарбонила, ди-(гидрокси-С1-7-алкил)аминокарбонила,
аминокарбонил-С1-7-алкил-аминокарбонила,
гидроксисульфонил-С1-7-алкил-аминокарбонила, гидроксисульфонил-С1-7-алкил-(С1-7-алкил-амино)-карбонила,
ди-(С1-7-алкоксикарбонил-С1-7-алкил)-метиламинокарбонила,
фенила, где фенил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или С1-7-алкоксикарбонила,
фенил-карбонила, где фенил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или С1-7-алкоксикарбонила,
фенил-аминокарбонила, где фенил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или С1-7-алкоксикарбонила,
фенил-С1-7-алкила, где фенил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или С1-7-алкоксикарбонила,
фенил-С2-7-алкинила, где фенил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или C1-7-алкоксикарбонила,
гетероарила, где гетероарил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или C1-7-алкоксикарбонила,
гетероарил-карбонила, где гетероарил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или С1-7-алкоксикарбонила,
гетероарил-аминокарбонила, где гетероарил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или С1-7-алкоксикарбонила,
гетероарил-С1-7-алкила, где гетероарил не замещен или замещен одной -тремя группами, выбранными из галогена, С1-7-алкила, С1-7-алкокси, карбоксила или С^-алкоксикарбонила,
гетероарил-С1-7-алкил-аминокарбонила, где гетероарил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или С1-7-алкоксикарбонила, и
гетероарил-карбонил-С1-7-алкила, где гетероарил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или С1-7-алкоксикарбонила;
или их фармацевтически приемлемым солям.
Соединения формулы 1 обладают фармацевтической активностью, а именно они представляют собой модуляторы или лиганды рецептора GPBAR1. В частности, соединения представляют собой эффективные агонисты GPBAR1.
Сахарный диабет представляет собой все возрастающую угрозу для здоровья человека. Например, в Соединенных Штатах Америки текущие оценки утверждают, что около 16 миллионов человек страдают от сахарного диабета. Диабет II типа, также известный как инсулинонезависимый сахарный диабет, составляет приблизительно 90 - 95% случаев диабета, убивающих около 193 ООО жителей США каждый год. Диабет II типа является седьмой из основных причин всех смертей. В западных странах в настоящее время от диабета II типа страдает 6% взрослого населения, предполагается, что частота заболеваний по всему миру растет на 6% в год. Хотя существуют определенные наследственные признаки, которые могут спровоцировать развитие диабета II типа у конкретных лиц, движущей силой, обуславливающей текущее увеличение заболеваемости, является увеличение сидячего образа жизни, диеты и ожирение, которые в настоящее время распространены в развитых странах. Около 80% больных диабетом II типа имеют значительный избыточный вес.Также все у большего числа молодых людей развивается данное заболевание. Диабет II типа в настоящее время на международном уровне признан одной из главных угроз для здоровья человека в 21 веке.
Диабет II типа проявляется как неспособность в достаточной мере регулировать уровень глюкозы в крови и может характеризоваться недостатком секреции инсулина или резистентностью к инсулину. То есть те, кто страдает диабетом II типа, имеют слишком мало инсулина или не в состоянии эффективно использовать инсулин. Резистентность к инсулину означает неспособность тканей организма должным образом реагировать на эндогенный инсулин. Резистентность к инсулину развивается вследствие множественных факторов, включая генетику, ожирение, увеличение возраста, и наличие повышенного содержания сахара в крови в течение длительных периодов времени. Диабет II типа, иногда называемый диабет взрослого типа у молодых (mature on set), может развиться в любом возрасте, но чаще всего проявляется в период полового созревания. Однако распространенность диабета II типа у детей увеличивается. У больных диабетом глюкоза накапливается в крови и моче, вызывая обильное мочеиспускание, жажду, голод и проблемы с жировым и белковым обменом веществ. В случае отсутствия лечения сахарный диабет может вызвать опасные для жизни осложнения, включая слепоту, почечную недостаточность и болезнь сердца.
В настоящее время диабет II типа лечат на нескольких уровнях. Первый уровень лечения заключается в соблюдении диеты и/или выполнении физических упражнений как отдельно, так и в сочетании с лекарственными средствами. Такие средства могут включать инсулин или фармацевтические препараты, которые снижают уровень глюкозы в крови. Около 49% людей с диабетом II типа требуются пероральные лекарственные средства, около 40% нуждается в инъекциях инсулина или сочетании инъекций инсулина и пероральных лекарственных средств, и 10% использует лишь диету и физические упражнения.
Современные методы лечения включают: стимуляторы секреции инсулина, такие как сульфонилмочевины, которые увеличивают выработку инсулина из В-клеток поджелудочной железы; снижающие уровень глюкозы эффекторы, такие как метформин, которые сокращают выработку глюкозы из печени; активаторы рецептора, активируемого пролифератором пероксисом ((PPARγ), такие как тиазолидинедионы, которые усиливают действие инсулина; и ингибиторы α-глюкозидазы, которые препятствуют выработке глюкозы в кишечнике. Однако существуют недостатки, связанные с существующими методами лечения. Например, сульфонилмочевины и инъекции инсулина могут быть связаны с гипогликемическими приступами и увеличением веса. Кроме того, пациенты со временем часто теряют чувствительность к сульфонилмочевинам. Метформин и ингибиторы α-глюкозидазы часто вызывают желудочно-кишечные заболевания, и агонисты PPARy вызывают увеличенное повышение веса и отеки.
Желчные кислоты (ВА от bile acids) представляют собой амфипатические молекулы, которые синтезируются в печени из холестерина и хранятся в желчном пузыре до выделения в двенадцатиперстную кишку и кишечник, что играет важную роль в растворении и абсорбции жиров и жирорастворимых витаминов, поступающих с пищей. Около 99% ВА всасывается снова в ходе пассивной диффузии и активного переноса в концевой отдел подвздошной кишки и переносится обратно в печень через воротную вену (кишечно-печеночная циркуляция). В печени ВА сокращают свой собственный биосинтез из холестерина посредством активации фарнезоидного Х-рецептора альфа (FXRα) и малого гетеродимерного партнера (SHP от small heterodimer partner), что приводит к транскрипционной репрессии холестерин-7α-гидроксилазы, скорость-лимитирующей стадии биосинтеза ВА из холестерина.
GPBAR1, в литературе называемый также TGR5, M-BAR или BG37, недавно был определен как сопряженный с G-белком рецептор (GPCR), реагирующий с ВА (Kawamata et al., J. б/о/. Chem. 2003, 278, 9435-9440; Maruyama et al., Biochem. Biophys. Res. Commun. 2002, 298, 714-719). GPBAR1 представляет собой G(aльфa)s-coпpяжeнный GPCR, и стимуляция в ходе связывания лигандов вызывает активацию аденилатциклазы, что приводит к повышению внутриклеточного цАМФ и последующей активации сигнальных путей в прямом направлении. Рецептор человека имеет 86, 90, 82 и 83% аминокислотное родство с рецептором быка, кролика, крысы и мыши, соответственно. GPBAR1 достаточно экспрессирован в кишечном тракте, моноцитах и макрофагах, легких, селезенки, плаценте (Kawamata et al., J. б/о/. Chem. 2003, 278, 9435-9440). ВА вызывали интернализацию рецепторов, выработку внутриклеточного цАМФ и активацию киназы, регулируемой внеклеточными сигналами, в GPBAR1-экспрессирующих клетках НЕК293 и СНО.
Было установлено, что GPBAR1 значительно экспрессирован в моноцитах/макрофагах людей и кроликов (Kawamata et al., J. б/о/. Chem. 2003, 278, 9435-9440), и обработка ВА подавляла ЛПС-вызванную выработку цитокинов в альвеолярных макрофагах кролика и ТНР-1 клетках человека, экспрессирующих GPBAR1. Эти данные показывают, что желчные кислоты могут подавлять функцию макрофагов посредством активации GPBAR1. В печени функциональный GPBAR1 входит в состав клеточных мембран клеток Купфера, опосредуя ингибирование ЛПС-индуцированной экспрессии цитокинов (Keitel, Biochem. Biophys. Res. Commun. 2008, 372, 78-84), и синусоидальных эндотелиальных клеток, где соли желчных кислот приводят к увеличению внутриклеточного цАМФ и активации и повышенной экспрессии эндотелиальной синтазы оксида азота (NO) (Keitel, Hepatology 2007, 45, 695-704). Кроме того, GPBAR1 был обнаружен в холангиоцитах печени крыс (Keitel, Biochem. Biophys. Res. Commun. 2008, 372, 78-84). Гидрофобные желчные кислоты, такие как тауролитохолевая кислота, увеличивают цАМФ в холангиоцитах, указывая тем самым на то, что GPBAR1 может модулировать секрецию протоков и выделение желчи. Действительно, окрашивание GPBAR1 колокализировано с регулируемым циклическим аденозинмонофосфатом каналом ионов хлора трансмембранным регулятором муковисцидоза (CFTR) и апикальным натрийзависимым переносчиком обратного захвата солей желчных кислот (ASBT). Функциональная связь GPBAR1 с секрецией хлорида и выделением желчи была установлена при использовании агонистов GPBAR1 (Keitel et al., Hepatology 2009 50, 861-870; Pellicciari et al., J Med Chem 2009, 52(24), 7958-7961). Таким образом, агонисты GPBAR1 могут инициировать как защитный, так и лечебный механизм при холестатическом заболевании печени.
GPBAR1 экспрессирован в кишечных энтероэндокринных клеточных линиях человеческого (NCI-H716) и мышиного (STC-1, GLUTag) происхождения (Maruyama et al., Biochem. Biophys. Res. Commun. 2002, 298, 714-719). Стимуляция GPBAR1 под действием ВА вызывала выработку цАМФ в клетках NCI-H716. Внутриклеточные увеличения в цАМФ указывали на то, что ВА может вызывать секрецию глюкагоноподобного пептида-1 (ГПП-1 или GLP-1). Действительно, активация GPBAR1 под действием ВА вызывала секрецию ГПП-1 в клетках STC-1 (Katsuma et al., Biochem. Biophys. Res. Commun. 2005, 329, 386-390). Рецептор-специфичность была продемонстрирована в ходе экспериментов по РНК-интерференции, которые показали, что пониженная экспрессия GPBAR1 приводила к уменьшенному выделению ГПП-1. Существует убедительное доказательство того, что GPBAR1-опоредованный ГПП-1 и PYY высвобождаются из L-клеток кишечника, перенесенных in vivo. Было показано, что в выделенной васкулярно перфузируемой толстой кишке крысы ВА вызывали секрецию ГПП-1 (Plaisancie et al., J. Endocrin. 1995, 145, 521-526). При использовании сочетания фармакологических и генетических исследований in vivo, сопровождающихся активацией или потерей функции, было показано, что передача сигнала GPBAR1 вызывает высвобождение ГПП-1, приводя к улучшенной функции печени и поджелудочной железы и повышенной толерантности к глюкозе у тучных мышей (Thomas et al., Cell Metabolism, 2009, 10, 167-177). У людей внутритолстокишечное введение дезоксихолата показало значительное увеличение в плазме уровней ГПП-1 и совместно секретируемого PYY (Adrian etal., Gut 1993, 34, 1219-1224).
Было показано, что ГПП-1, представляющий собой пептид, выделенный из энтероэндокринных L клеток, стимулирует высвобождение инсулина глюкозозависимым образом у людей (Kreymann et al., Lancet 1987, 2, 1300-1304), и исследования на экспериментальных животных показали, что этот инкретиновый гормон необходим для нормального гомеостаза глюкозы. Кроме того, ГПП-1 может оказывать некоторые положительные воздействия на диабет и ожирение, включая 1) повышенное удаление глюкозы, 2) подавление выработки глюкозы, 3) уменьшенное опорожнение желудка, 4) снижение потребления пищи и 5) потеря веса. В последнее время много исследований направлено на применение ГПП-1 при лечении состояний и заболеваний, таких как сахарный диабет, стресс, ожирение, регулирование аппетита и чувство сытости, болезнь Альцгеймера, воспаление и заболевания центральной нервной системы (см, например, Bojanowska et al., Med. Sci. Monit. 2005, 8, RA271-8; Perry et al., Current Alzheimer Res. 2005, 3, 377-385; and Meier et al., Diabetes Metab. Res. Rev. 2005, 2, 91-117). Однако применение пептида при клиническом лечении ограничено трудным введением и in vivo стабильностью. Следовательно, малая молекула, которая либо имитирует эффекты ГПП-1 непосредственно, либо усиливает секрецию ГПП-1, может быть полезна при лечении различных состояний или заболеваний, описанных выше, а именно сахарного диабета.
PYY совместно секретируется с ГПП-1 из L-клеток кишечника после еды. Продукт расщепления дипептидилпептидазы-IV (DPP4) PYY представляет собой PYY[3-36] (Eberlein et al. Peptides 1989, 10, 797-803) (Grandt et al. Regul Pept 1994, 51, 151-159). Этот фрагмент составляет приблизительно 40% от общей PYY-подобной иммунореактивности в кишечных экстрактах человека и собаки и около 36% от общей иммунореактивности PYY в плазме натощак до немного более 50% после еды. По имеющимся данным PYY[3-36] представляет собой селективный лиганд на Y2 и Y5 рецепторах. Сообщается, что периферийное введение PYY сокращает выделение желудочного сока, перистальтику желудка, экзокринную секрецию поджелудочной железы (Yoshinaga et al. Am J Physiol 1992, 263, G695-701), сокращение желчного пузыря и перистальтику кишечника (Savage et al. Gut 1987, 28, 166-170). Было показано, что инъекция в дуговые артерии (1C от intra-arcuate) или интраперитонеальная (ИП) инъекция PYY3-36 уменьшала питание у крыс и в качестве длительного лечения снижала увеличение массы тела. Внутривенная (ВВ) инфузия PYY3-36 (0,8 пмоль/кг/мин) в течение 90 минут уменьшала потребление пищи у тучных и нормальных людей на 33% в течение 24 часов. Это открытие указывает на то, что PYY система может быть терапевтической мишенью для лечения ожирения (Bloom et. al. Nature 2002, 418, 650-654).
Кроме того, активация GPBAR1 может быть полезна при лечении ожирения и метаболического синдрома. Мыши, которым давали пищу с высоким содержанием жиров (HFD от high fat diet), содержащую 0,5% холевой кислоты, набирали меньше веса, чем контрольные мыши только с HFD независимо от приема пищи (Watanabe et al., Nature 2006, 439, 484-489). Эти эффекты не зависят от FXR-альфа и вероятно являются следствием связывания ВА с GPBAR1. Предлагаемый GPBAR1-опосредованный механизм приводит к последующей индукции цАМФ-зависимого гормона щитовидной железы, активируя фермент типа 2 (D2), который превращает неактивный ТЗ в активный Т4, что приводит к стимуляции рецептора тиреоидного гормона и ускорению расхода энергии. Мыши, не имеющие гена D2, были устойчивы к потере веса, вызванной холевой кислотой. Как у грызунов, так и у людей на наиболее термогенно важные ткани (бурый жир и скелетные мышца) этот механизм особенно воздействует, так как они совместно экспрессируют D2 и GPBAR1. Следовательно, путь передачи сигнала BA-GPBAR1-L(AMO-D2 является решающим механизмом для точного регулирования энергетического гомеостаза, который может быть направлен на улучшение регуляции обмена.
Следовательно, предметом настоящего изобретения являются селективные непосредственно действующие агонисты GPBAR1. Такие агонисты полезны в качестве терапевтически активных веществ, особенно при лечении и/или предотвращении заболеваний, которые связаны с активацией GPBAR1.
Новые соединения по настоящему изобретению превосходят соединения, известные в данной области техники, поскольку они представляют собой небольшие молекулы, и они связываются и очень эффективно избирательно активируют GPBAR1. Предполагается, что они обладают улучшенным терапевтическим потенциалом по сравнению с соединениями, уже известными в данной области техники, и могут использоваться для лечения диабета, ожирения, метаболического синдрома, гиперхолестеринемии, дислипидемии и большого числа острых и хронических воспалительных заболеваний.
Если не указано иное, то следующие определения приведены для иллюстрации и определения значения и объема различных терминов, используемых для описания изобретения.
Термин «галоген» относится к фтору, хлору, брому и йоду, предпочтительными являются фтор, хлор и бром, и наиболее предпочтительными являются фтор и хлор.
Термин «алкил», отдельно или в сочетании с другими группами, относится к разветвленному или неразветвленному одновалентному насыщенному алифатическому углеводородному радикалу от одного до двадцати атомов углерода, предпочтительно от одного до шестнадцати атомов углерода, наиболее предпочтительно от одного до десяти атомов углерода. Термин «C1-10-алкил» относится к разветвленному или неразветвленному одновалентному насыщенному алифатическому углеводородному радикалу от одного до десяти атомов углерода, такому как, например метил, этил, н-пропил, изопропил, н-бутил, emop-бутил, трет-бутил, пентил, 1,1,3,3-тетраметил-бутил и подобным. Низшие алкильные группы, как описано ниже, также являются предпочтительными алкильными группами.
Термин «низший алкил» или «С1-7-алкил», отдельно или в сочетании, означает неразветвленную или разветвленную алкильную группу с 1 до 7 атомов углерода, предпочтительно неразветвленную или разветвленную алкильную группу с 1 до 6 атомов углерода и наиболее предпочтительно неразветвленную или разветвленную алкильную группу с 1 до 4 атомов углерода. Примерами неразветвленных и разветвленных С1-7-алкильных групп являются метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, изомерные пентилы, изомерные гексилы и изомерные гептилы, предпочтительно метил и этил, и наиболее предпочтительно метил.
Термин «низший алкенил» или «С2-7-алкенил» означает неразветвленный или разветвленный углеводородный фрагмент, включающий двойную связь и от 2 до 7, предпочтительно от 3 до 6, особенно предпочтительно от 3 до 4 атомов углерода. Примерами алкенильных групп являются этенил, 1-пропенил, 2- пропенил, изопропенил, 1-бутенил, 2-бутенил, 3-бутенил и изобутенил. Предпочтительным примером является 2-пропенил (аллил).
Термин «низший алкинил» или «С2-7-алкинил» означает неразветвленный или разветвленный углеводородный фрагмент, включающий тройную связь и от 2 до 7, предпочтительно от 3 до 7, особенно предпочтительно от 3 до 4 атомов углерода. Предпочтительными алкинильными группами являются этинил и 1-пропинил (-С≡С-СН2).
Термин «циклоалкил» или «С3-7-циклоалкил» обозначает насыщенную карбоциклическую группу, содержащую от 3 до 7 атомов углерода, такую как циклопропил, циклобутил, циклопентил, циклогексил или циклогептил. Особенно предпочтителен циклопропил.
Термин «низший циклоалкилалкил» или «С3-7-Циклоалкил-С1-7-алкил» относится к низшим алкильным группам, как определено выше, где по меньшей мере один из атомов водорода низшей алкильной группы замещен циклоалкильной группой. К предпочтительным низшим циклоалкилалкильным группам относится циклопропилметил.
Термин «низший алкокси» или «С1-7-алкокси» относится к группе R'-O-, где R' представляет собой низший алкил, и термин «низший алкил» имеет ранее приведенное значение. Примерами низших алкокси групп являются метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, emop-бутокси и трет-бутокси, предпочтительно метокси.
Термин «низший алкилсульфанил» или «С1-7-алкилсульфанил» определяет группу -S-R, где R представляет собой низший алкил, и термин «низший алкил» имеет ранее приведенное значение. Примерами низших алкилсульфанильных групп являются метилсульфанил (-SСН3) или этилсульфанил (-SС2Н5).
Термин «низший алкоксикарбонил» или «С1-7-алкоксикарбонил» относится к группе -CO-OR', где R' представляет собой низший алкил, и термин «низший алкил» имеет ранее приведенное значение. Предпочтительными низшими алкоксикарбонильными группами являются метоксикарбонил или этоксикарбонил.
Термин «низший алкоксикарбонилалкил» или «С1-7-алкоксикарбонил-С1-7-алкил» означает низшие алкильные группы, как определено выше, где один из атомов водорода низшей алкильной группы замещен С1-7-алкоксикарбонилом. Предпочтительной низшей алкоксикарбонилалкильной группой является -CH2-СООСН3.
Термин «низший алкоксикарбонилалкенил» или «С1-7-алкоксикарбонил-С3-7-алкенил» относится к низшим алкенильным группам, как определено выше, но имеющим по меньшей мере 3 атома углерода, где по меньшей мере один из атомов водорода низшей алкенильной группы замещен С1-7-алкоксикарбонилом.
Термин «низший алкоксикарбонилалкинил» или «С1-7-алкоксикарбонил-С3-7-алкинил» относится к низшим алкинильным группам, как определено выше, но имеющим по меньшей мере 3 атома углерода, где по меньшей мере один из атомов водорода низшей алкинильной группы замещен С1-7-алкоксикарбонилом.
Термин «низший алкоксикарбонилалкиламинокарбонил» или «C1-7-алкоксикарбонил-С1-7-алкиламинокарбонил» относится к аминокарбонилу, как определено выше, где один из атомов водорода аминогруппы замещен C1-7-алкоксикарбонил-С1-7-алкилом. Предпочтительная низшая карбоксилалкиламинокарбонильная группа представляет собой -СО-NН-СН2-СООСН3.
Термин «С1-7-алкоксикарбонил-С1-7-алкил-(С1-7-алкиламино)-карбонил» относится к С1-7-алкиламинокарбонильной группе (-CO-NR-, где R представляет собой С1-7-алкил), где один из атомов водорода аминогруппы замещен С1-7-алкоксикарбонил-С1-7-алкилом.
Термин «низший алкоксикарбонилалкиламинокарбонилалкил» или «C1-7-алкоксикарбонил-С1-7-алкиламино-карбонил-С1-7-алкил» относится к низшей алкильной группе, где один из атомов водорода низшей алкильной группы замещен «С1-7-алкоксикарбонил-С1-7-алкиламинокарбонилом», как определено выше. Предпочтительная низшая алкоксикарбонилалкиламинокарбонилалкильная группа представляет собой -СH2-СО-NН-СН2-СООСН3.
Термин «С1-7-алкоксикарбонил-С1-7-алкил-(С1-7-алкиламино)-карбонил-С1-7-алкил» относится к низшей алкильной группе, где один из атомов водорода низшей алкильной группы замещен «С1-7-алкоксикарбонил-С1-7-алкил-(С1-7-алкиламино)-карбонилом». Предпочтительная группа представляет собой -СН2-СО-NСН3-СH2-СООСНз.
Термин «низший галогеналкил» или «галоген-С1-7-алкил» относится к низшим алкильным группам, как определено выше, где по меньшей мере один из атомов водорода низшей алкильной группы замещен атомом галогена, предпочтительно фтором или хлором, наиболее предпочтительно фтором. Одними из предпочтительных галогенированных низших алкильных групп являются трифторметил, дифторметил, трифторэтил, 2,2-дифторэтил, фторметил и хлорметил, особенно предпочтительны трифторметил или дифторметил.
Термин «низший галогеналкокси» или «галоген-С1-7-алкокси» относится к низшим алкокси группам, как определено выше, где по меньшей мере один из атомов водорода низшей алкокси группы замещен атомом галогена, предпочтительно фтором или хлором, наиболее предпочтительно фтором. Одними из предпочтительных галогенированных низших алкокси групп являются трифторметокси, дифторметокси, фторметокси и хлорметокси, особенно предпочтителен трифторметокси.
Термин гидрокси означает группу -ОН.
Термин «низший гидроксиалкил» или «гидрокси-С1-7-алкил» относится к низшим алкильным группам, как определено выше, где по меньшей мере один из атомов водорода низшей алкильной группы замещен гидроксигруппой. Одними из предпочтительных низших гидроксиалкильных групп являются гидроксиметил или гидроксиэтил.
Термин «низший гидроксиалкенил» или «гидрокси-С3-7-алкенил» относится к низшим алкенильным группам, как определено выше, но имеющим по меньшей мере 3 атома углерода, где по меньшей мере один из атомов водорода низшей алкенильной группы замещен гидроксигруппой. Гидроксиаллил является одной из предпочтительных низших гидроксиалкенильных групп.
Термин «низший гидроксиалкинил» или «гидрокси-С3-7-алкинил» относится к низшим алкинильным группам, как определено выше, но имеющим по меньшей мере 3 атома углерода, где по меньшей мере один из атомов водорода низшей алкинильной группы замещен гидроксигруппой. Одной из предпочтительных низших гидроксиалкинильных групп является -С=С-СН2OН.
Термин «низший гидроксиалкокси» или «гидрокси-С1-7-алкокси» относится к низшим алкокси группам, как определено выше, где по меньшей мере один из атомов водорода низшей алкокси группы замещен гидроксигруппой. Предпочтительной низшей гидроксиалкокси группой является 2-гидроксиэтокси.
«Амино» относится к группе -NH2. Термин «С1-7-алкиламино» означает группу -NHR, где R представляет собой низший алкил и термин «низший алкил» имеет ранее приведенное значение.
Термин «аминокарбонил» относится к группе -CO-NH2.
Термин «карбоксил» означает группу -СООН.
Термин «низший карбоксилалкил» или «карбоксил-С1-7-алкил» относится к низшим алкильным группам, как определено выше, где по меньшей мере один из атомов водорода низшей алкильной группы замещен карбоксильной группой. Одними из предпочтительных низших карбоксил алкильных групп являются карбоксилметил (-СН2-СООН) и карбоксилэтил (-СН2-СН2-СООН), особенно предпочтителен карбоксилметил.
Термин «низший карбоксилалкенил» или «карбоксил-С2-7-алкенил» означает низшие алкенильные группы, как определено здесь выше, где один из атомов водорода низшей алкенильной группы замещен карбоксилом. Предпочтительной низшей карбоксилалкенильной группой является -СН=СН-СН2-СООН.
Термин «низший карбоксилалкинил» или «карбоксил-С2-7-алкинил» означает низшую алкинильную группу, как определено здесь выше, где один из атомов водорода низшей алкинильной группы замещен карбоксилом. Предпочтительной низшей карбоксилалкинильной группой является -C≡C-CH2-COOH.
Термин «низший карбоксилалкокси» или «карбоксил-С1-7-алкокси» относится к низшим алкокси группам, как определено выше, где по меньшей мере один из атомов водорода низшей алкокси группы замещен карбоксильной группой. Одной из предпочтительных низших карбоксилалкокси групп является 2-карбоксил-2-метилэтокси (-O-С(СН3)2-СООН).
Термин «низший карбоксилалкиламинокарбонил» или «карбоксил-С1-7-алкиламинокарбонил» относится к аминокарбонилу, как определено выше, где один из атомов водорода аминогруппы замещен карбоксил-С1-7-алкилом. Предпочтительной низшей карбоксилалкиламинокарбонильной группой является -CO-NH-CH2-COOH.
Термин «низший карбоксилалкил(алкиламино)карбонил» или «карбоксил-С1-7-алкил-(С1-7-алкиламино)-карбонил» относится к С1-7-алкиламинокарбонилу, как определено выше, где атом водорода алкиламиногруппы замещен карбоксил-C1-7-алкилом. Предпочтительной низшей карбоксилалкил(алкиламино)карбонильной группой является -СО-N(СН3)-СН2-СООН.
Термин «низший карбоксилалкиламинокарбонилалкил» или «карбоксил-С1-7-алкиламино-карбонил-С1-7-алкил» относится к низшей алкильной группе, где один из атомов водорода низшей алкильной группы замещен «карбоксил-С1-7-алкиламинокарбонилом», как определено выше. Предпочтительной низшей карбоксилалкиламинокарбонилалкильной группой является -CH2-CO-NH-CH2-СООН.
Термин «карбоксил-С1-7-алкил-(С1-7-алкиламино)-карбонил-С1-7-алкил» относится к низшей алкильной группе, где один из атомов водорода низшей алкильной группы замещен «карбоксил-С1-7-алкил-(С1-7-алкиламино)-карбонилом», например группа формулы -CH2-CO-NR-CH2-COOH, где R представляет собой низший алкил.
Термин «низший гидроксиалкиламинокарбонил» или «гидрокси-С1-7-алкиламинокарбонил» относится к аминокарбонилу, как определено выше, где один из атомов водорода аминогруппы замещен гидрокси-С1-7-алкилом. Предпочтительными низшими гидроксиалкиламинокарбонильными группами являются -CO-NH-CH2-CH2-OH или -CO-NH-CH-(CH2-OH)2.
Термин «ди-(гидрокси-С1-7-алкил)аминокарбонил» относится к аминокарбонилу, как определено выше, где оба атома водорода аминогруппы замещены гидрокси-С1-7-алкилом. Предпочтительной ди-(гидрокси-С1-7-алкил)аминокарбонильной группой является -СО-N(СН2-СН2-ОН)2.
Термин «низший аминокарбонилалкиламинокарбонил» или «аминокарбонил-С1-7-алкиламинокарбонил» относится к аминокарбонилу, как определено выше, где один из атомов водорода аминогруппы замещен аминокарбонил-С1-7-алкилом. Предпочтительной аминокарбонил-С14-7-алкиламинокарбонильной группой является -CO-NH-CH2-CH2-CO-NH2.
Термин «гидроксисульфонил» означает группу -SO2-OH.
Термин «низший гидроксисульфонилалкиламинокарбонил» или «гидроксисульфонил-С1-7-алкиламинокарбонил» относится к аминокарбонилу, как определено выше, где один из атомов водорода аминогруппы замещен гидроксисульфонил-С1-7-алкилом. Предпочтительной гидроксисульфонил-С1-7-алкиламинокарбонильной группой является -CO-NH-CH2-CH2-SO2-OH.
Термин «низший гидроксисульфонилалкил(алкиламино)карбонил» или «гидроксисульфонил-С1-7-алкил-(С1-7-алкиламино)-карбонил» относится к C1-7-алкиламинокарбонилу, где атом водорода аминогруппы замещен гидроксисульфонил-С1-7-алкилом.
Предпочтительной «ди-(С1-7-алкоксикарбонил-С1-7-алкил)-метиламинокарбонильной» группой является-СО-NН-СН(-СН2-СН2-СО-ОСН3)2.
Термин «фенилкарбонил» относится к группе -CO-R', где R' представляет собой фенил.
Термин «фениламинокарбонил» относится к группе -CO-NHR', где R' представляет собой фенил.
Термин «низший фенилалкил» или «фенил-С1-7-алкил» означает низшие алкильные группы, как определено выше, где один из атомов водорода низшей алкильной группы замещен возможно замещенной фенильной группой.
Термин «низший фенилалкинил» или «фенил-С2-7-алкенил» относится к низшим алкинильным группам, как определено выше, где по меньшей мере один из атомов водорода низшей алкинильной группы замещен возможно замещенным фенилом.
Термин «гетероциклил» в общем относится к насыщенному или частично ненасыщенному 3-, 4-, 5-, 6- или 7-членному кольцу, которое может содержать один, два или три атома, выбранных из азота, кислорода и/или серы. Примеры гетероциклильных колец включают азиринил, азетидинил, оксетанил, пиперидинил, пиперазинил, азепинил, пирролидинил, пиразолидинил, имидазолинил, имидазолидинил, пиридинил, пиридазинил, пиримидинил, оксазолидинил, изоксазолидинил, морфолинил, тиазолидинил, изотиазолидинил, тиадиазолилидинил, дигидрофурил, тетрагидрофурил, дигидропиранил, тетрагидропиранил и тиаморфолинил. Предпочтительной гетероциклильной группой является оксетанил.
Термин «низший гетероциклилалкил» или «гетероциклил-С1-7-алкил» относится к низшим алкильным группам, как определено выше, где по меньшей мере один из атомов водорода низшей алкильной группы замещен гетероциклильной группой, как определено выше.
«N-гетероциклил» означает 3-, 4-, 5-, 6- или 7-членное насыщенное гетероциклическое кольцо, содержащее атом азота («N») и возможно содержащее дополнительный гетероатом, выбранный из азота, кислорода или серы. Предпочтительно N-гетероциклильное кольцо связано через атом азота с атомом углерода кольца, к которому оно прикреплено. Предпочтительные N-гетероциклильные кольца выбраны из группы, состоящей из азиринила, азетидинила, пирролидинила, имидазолидинила, пиразолидинила, оксазолидинила, изоксазолидинила, тиазолидинила, изотиазолидинила, пиперидинила, пиперазинила, морфолинила, тиоморфолинила и азепанила.
Термин «гетероарил» в общем относится к ароматическому 5- или 6-членному кольцу, которое содержит один, два или три атома, выбранных из азота, кислорода и/или серы, такому как пиридил, пиразинил, пиримидинил, пиридазинил, 2-оксо-1,2-дигидропиридинил, оксазолил, оксадиазолил, изоксазолил, тиадиазолил, тетразолил, пиразолил, имидазолил, фурил, тиазолил и тиенил. Термин «гетероарил» дополнительно относится к бициклическим ароматическим группам, включающим два 5- или 6-членных кольца, в которых одно или оба кольца могут содержать один, два или три атома, выбранных из азота, кислорода или серы, таким как хинолинил, изохинолинил, циннолинил, пиразоло[1,5-а]пиридил, имидазо[1,2-а]пиридил, хиноксалинил, бензотиазолил, бензотриазолил, индолил и индазолил. Предпочтительной гетероарильной группой является фурил.
Термин «низший гетероарилалкил» или «гетероарил-С1-7-алкил» относится к низшим алкильным группам, как определено выше, где по меньшей мере один из атомов водорода низшей алкильной группы замещен гетероарильной группой, как определено выше.
Термин «гетероарилкарбонил» относится к группе -CO-R", где R" представляет собой гетероарил, как определено выше.
Термин «низший гетероарилкарбонилалкил» или «гетероарилкарбонил-С1-7-алкил» относится к низшим алкильным группам, как определено выше, где по меньшей мере один из атомом водорода низшей алкильной группы замещен гетероарилкарбонильной группой, как определено выше.
Термин «гетероариламинокарбонил» относится к группе -CO-NH-R", где R" представляет собой гетероарил, как определено выше.
Термин «низший гетероарилалкиламинокарбонил» или «гетероарил-С1-7-алкиламинокарбонил» относится к группе -CO-NH-Rx, где Rx представляет собой гетероарил-С1-7-алкил, как определено выше.
Термин «пятичленный гетероарил» относится к ароматическому 5-членому кольцу, которое включает по меньшей мере один атом азота и может, кроме того, содержать от одного до трех атомов, выбранных из азота, кислорода и/или серы. Предпочтительные пятичленные гетероарильные кольца выбраны из группы, состоящей из пирролила, пиразолила, имидазолила, триазолила, тетразолила, оксазолила, оксадиазолила, изоксазолила, тиадиазолила и тиазолила. Предпочтительно пятичленное гетероарильное кольцо связано через атом азота с атомом углерода кольца, к которому оно прикреплено. Наиболее предпочтительно пятичленная гетероарильная группа представляет собой пирролил.
Соединения формулы I могут образовывать фармацевтически приемлемые соли. Термин «фармацевтически приемлемые соли» относится к тем солям, которые сохраняют биологическую эффективность и свойства свободных оснований или свободных кислот, которые не являются ни биологически или иным образом нежелательными. Например, соли представляют собой кислотно-аддитивные соли соединений формулы I с физиологически совместимыми неорганическими кислотами, такими как соляная кислота, серная кислота, сернистая кислота или фосфорная кислота, или с органическими кислотами, такими как метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, молочная кислота, трифторуксусная кислота, лимонная кислота, фумаровая кислота, малеиновая кислота, малоновая кислота, винная кислота, бензойная кислота, коричная кислота, миндальная кислота, янтарная кислота или салициловая кислота. Кроме того, фармацевтически приемлемые соли могут быть получены при добавлении неорганического основания или органического основания к свободной кислоте. Соли, полученные из неорганических оснований, включают, но не ограничиваются этим, соли натрия, калия, лития, аммония, кальция, магния и подобные. Соли, полученные из органических оснований, включают, но не ограничиваются этим, соли первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклических аминов и основные ионообменные смолы, такие как смолы на основе изопропиламина, триметиламина, диэтиламина, триэтиламина, трипропиламина, этаноламина, лизина, аргинина, N-этилпиперидина, пиперидина, полимина и подобные. Также соединение формулы 1 может находиться в форме цвиттерионов. Особенно предпочтительными фармацевтически приемлемыми солями соединений формулы 1 являются гидрохлориды.
Соединения формулы 1 также могут быть сольватированы, например гидратированы. Сольватация может быть осуществлена в ходе производственного процесса или может происходить, например, в результате гигроскопичности первоначально безводного соединения формулы 1 (гидратация). Термин «фармацевтически приемлемые соли» также включает физиологически приемлемые сольваты.
«Изомерами» являются соединения, которые имеют одинаковую молекулярную формулу, но которые отличаются по характеру или последовательности связывания их атомов или по расположению их атомов в пространстве. Изомеры, которые различаются по расположению их атомов в пространстве, носят название «стереоизомеры». Стереоизомеры, которые не являются зеркальным изображением друг друга, называются «диастереоизомеры», и стереоизомеры, которые представляют собой неналагающиеся зеркальные изображения, называются «энантиомерами», или иногда оптическими изомерами. Атом углерода, связанный с четырьмя неодинаковыми заместителями, носит название «хиральный центр».
Подробно настоящее изобретение относится к соединениям формулы

где А1 представляет собой CR13 или N;
А2 представляет собой CR14 или N;
R1 и R2 независимо друг от друга выбраны из группы, состоящей из водорода, C1-7-алкила, галогена, галоген-С1-7-алкила, циано и С1-7-алкокси;
R13 и R14 независимо друг от друга выбраны из группы, состоящей из водорода, С1-7-алкила, галогена, галоген-С1-7-алкила, циано, С1-7-алкокси, амино и C1-7-алкилсульфанила;
R3 выбран из группы, состоящей из водорода, С1-7-алкила, галогена, галоген-С1-7-алкила, С1-7-алкокси, циано, С3-7-циклоалкила, N-гетероциклила, пятичленного гетероарила, фенила и -NR15R16, где R15 и R16 независимо друг от друга выбраны из водорода, С1-7-алкила и С3-7-циклоалкила;
R4 выбран из группы, состоящей из водорода, С1-7-алкила, галоген-С1-7-алкила и С3-7-циклоалкила; или
R3 и R4 или R3 и R14 вместе представляют собой -X(CR17R18)n- и образуют часть кольца, где
Х выбран из группы, состоящей из -CR19R20-, О, S, С=O и NR21;
R17 и R18 независимо друг от друга выбраны из водорода или С1-7-алкила;
R19 и R20 независимо друг от друга выбраны из группы, состоящей из водорода, С1-7-алкила, С1-7-алкоксикарбонила, незамещенного гетероциклила и гетероциклила, замещенного одной или двумя группами, выбранными из С1-7-алкила или галогена, или R19 и R20 вместе с атомом С, к которому они присоединены, образуют кольцо циклопропила или оксетанила или вместе образуют группу=СН2 или=CF2;
R21 выбран из группы, состоящей из водорода, С1-7-алкила,
галоген-С1-7-алкила,
С3-7-циклоалкила или С3-7-Циклоалкил-С1-7-алкила, где С3-7-циклоалкил не замещен или замещен карбоксил-С1-7-алкилом или C1-7 алкоксикарбонилом,
гетероциклила, гетроциклил-С1-7-алкила,
гетероарила, гетероарил-С1-7-алкила,
карбоксил-С1-7-алкила, С1-7-алкоксикарбонил-С1-7-алкила,
С1-7-алкилкарбонилокси-С1-7-алкила,
С1-7-алкилсульфонила,
фенила, где фенил не замещен или замещен карбоксил-С1-7-алкилом
или С1-7-алкоксикарбонилом,
фенилкарбонила, где фенил не замещен или замещен карбоксил-С1-7-алкилом или С1-7-алкоксикарбонилом, и
фенилсульфонила, где фенил не замещен или замещен карбоксил-С1-7-алкилом или С1-7-алкоксикарбонилом,
или R21 и R17 вместе представляют собой -(СH2)3- и образуют часть кольца, или R21 вместе с парой R17 и R18 представляют собой
-СН=СН-СН=и образуют часть кольца;
и n представляет собой 1, 2 или 3;
B1 представляет собой N или N+-O-;
B2 представляет собой CR7 или N;
R5, R6 и R7 независимо друг от друга выбраны из группы, состоящей из водорода, галогена, С1-7-алкила, С1-7-алкокси, галоген-С1-7-алкила, галоген-С1-7-алкокси и циано;
и R8, R9, R10, R11 и R12 независимо друг от друга выбраны из группы, состоящей из
водорода, С1-7-алкила, С2-7-алкенила, С2-7-алкинила, галогена, галоген-С1-7-алкила,
С1-7-алкокси, галоген-С1-7-алкокси,
гидрокси, гидрокси-С1-7-алкокси,
гидрокси-С1-7-алкила, гидрокси-С3-7-алкенила, гидрокси-С3-7-алкинила,
циано, карбоксила, С1-7-алкоксикарбонила, аминокарбонила,
карбоксил-С1-7-алкила, карбоксил-С2-7-алкенила, карбоксил-С2-7-алкинила,
С1-7-алкоксикарбонил-С1-7-алкила, С1-7-алкоксикарбонил-С2-7-алкенила,
С1-7-ал коксикарбонил-С2-7-алкинила,
карбоксил-С1-7-алкокси, С1-7-алкоксикарбонил-С1-7-алкокси,
карбоксил-С1-7-алкил-аминокарбонила, карбоксил-С1-7-алкил-(С1-7-алкиламино)-карбонила,
С1-7-алкоксикарбонил-С1-7-алкил-аминокарбонила, С1-7-алкоксикарбонил-С1-7-алкил-(С1-7-алкиламино)-карбонила,
карбоксил-С1-7-алкил-аминокарбонил-С1-7-алкила,
карбоксил-С1-7-алкил-(С1-7-алкиламино)-карбонил-С1-7-алкила,
С1-7-алкоксикарбонил-С1-7-алкил-аминокарбонил-С1-7-алкила,
С1-7-алкоксикарбонил-С1-7-алкил-(С1-7-алкиламино)-карбонил-С1-7-алкила,
гидрокси-С1-7-алкил-аминокарбонила, ди-(гидрокси-С1-7-алкил)аминокарбонила,
аминокарбонил-С1-7-алкил-аминокарбонила,
гидроксисульфонил-С1-7-алкил-аминокарбонила, гидроксисульфонил-С1-7-алкил-(С1-7-алкил-амино)-карбонила,
ди-(С1-7-алкоксикарбонил-С1-7-алкил)-метиламинокарбонила,
фенила, где фенил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или C1-7-алкоксикарбонила,
фенил-карбонила, где фенил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или C1-7-алкоксикарбонила,
фенил-аминокарбонила, где фенил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или С1-7-алкоксикарбонила,
фенил-С1-7-алкила, где фенил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или С1-7-алкоксикарбонила,
фенил-С1-7-алкинила, где фенил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или C1-7-алкоксикарбонила,
гетероарила, где гетероарил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или С1-7-алкоксикарбонила,
гетероарил-карбонила, где гетероарил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или C1-7-алкоксикарбонила,
гетероарил-аминокарбонила, где гетероарил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или С1-7-алкоксикарбонила,
гетероарил-С1-7-алкила, где гетероарил не замещен или замещен одной -тремя группами, выбранными из галогена, С1-7-алкила, С1-7-алкокси, карбоксила или C1-7-алкоксикарбонила,
гетероарил-С1-7-алкил-аминокарбонила, где гетероарил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или С1-7-алкоксикарбонила, и
гетероарил-карбонил-С1-7-алкила, где гетероарил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или С1-7-алкоксикарбонила;
или их фармацевтически приемлемым солям.
Соединения формулы 1 по настоящему изобретению включают те, где А1 представляет собой CR13 и А2 представляет собой CR14, или где А1 представляет собой CR13 и А2 представляет собой N, причем R13 и R14 независимо друг от друга выбраны из группы, состоящей из водорода, С1-7-алкила, галогена, галоген-С1-7-алкила, циано, С1-7-алкокси, амино и С1-7-алкилсульфанила.
Предпочтительными являются те соединения формулы 1 по настоящему изобретению, где А1 представляет собой CR13 и А2 представляет собой CR14, и где R13 и R14 независимо друг от друга выбраны из группы, состоящей из водорода, галогена, галоген-С1-7-алкила и С1-7-алкокси. Это соединения формулы
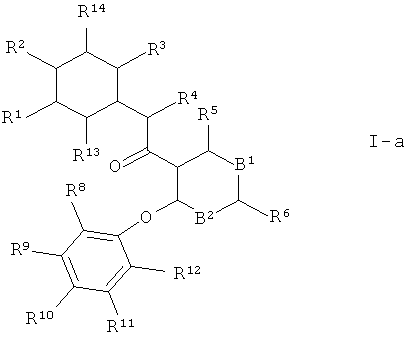
Кроме того, предпочтительны соединения формулы I, где А1 представляет собой CR13 и А2 представляет собой N, причем R13 независимо друг от друга выбраны из группы, состоящей из водорода, галогена, галоген-С^-алкила -и C1-7-алкокси. Это соединения формулы
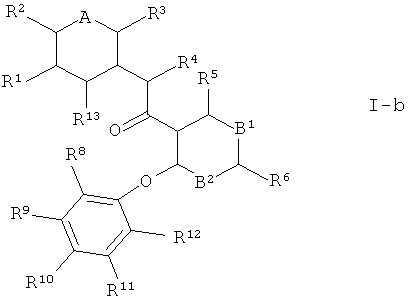
Кроме того, предпочтительными являются соединения формулы I, где R1 и R2 независимо друг от друга выбраны из группы, состоящей из водорода, галогена и галоген-С1-7-алкила.
Кроме того, предпочтительны соединения формулы I, где R3 и R4 вместе представляют собой -X(CR17R18)n- и образуют часть кольца, где
Х выбран из группы, состоящей из -CR19R20- и -NR21-;
R17 и R18 независимо друг от друга выбраны из водорода или С1-7-алкила;
R19 и R20 независимо друг от друга выбраны из группы, состоящей из водорода, С1-7-алкила, С1-7-алкоксикарбонила, незамещенного гетероциклила и гетероциклила, замещенного одной или двумя группами, выбранными из С1-7-алкила или галогена, или R19 и R20 вместе с атомом С, к которому они присоединены, образуют кольцо циклопропила или оксетанила или вместе образуют группу=СН2 или=CF2;
R21 выбран из группы, состоящей из водорода, С1-7-алкила, галоген-С1-7-алкила,
С3-7-циклоалкила или С3-7-циклоалкил-С1-7-алкила, где С3-7-циклоалкил не замещен или замещен карбоксил-С1-7-алкилом или С1-7-алкоксикарбонилом,
гетероциклила, гетроциклил-С1-7-алкила,
гетероарила, гетероарил-С1-7-алкила,
карбоксил-С1-7-алкила, С1-7-алкоксикарбонил-С1-7-алкила,
С1-7-алкилкарбонилокси-С1-7-алкила,
С1-7-алкилсульфонила,
фенила, где фенил не замещен или замещен карбоксил-С1-7-алкилом или С1-7-алкоксикарбонилом,
фенилкарбонила, где фенил не замещен или замещен карбоксил-С1-7-алкилом или С1-7-алкоксикарбонилом, и
фенилсульфонила, где фенил не замещен или замещен карбоксил-С1-7-алкилом или С1-7-алкоксикарбонилом,
или R21 и R17 вместе представляют собой -(СН2)3- и образуют часть кольца, или R21 вместе с парой R17 и R18 представляют собой -СН=СН-СН=и образуют часть кольца;
и т представляет собой 1, 2 или 3.
В пределах этой группы предпочтительными являются соединения, где Х представляет собой -NR21-,
R21 выбран из группы, состоящей из водорода, С1-7-алкила, С3-7-циклоалкила или С3-7-2циклоалкил-С1-7-алкила, где С3-7-циклоалкил не замещен или замещен карбоксил-С1-7-алкилом или С1-7-алкоксикарбонилом, и С1-7-алкилсульфонила,
R17 и R18 представляют собой водород, и n представляет собой 2. Это соединения, имеющие формулу
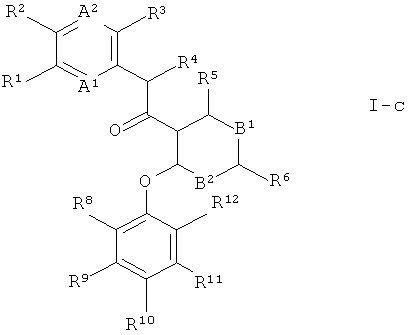
Кроме того, особенно предпочтительны соединения формулы I, где Х представляет собой -СН2-, R17 и R18 представляют собой водород, и n представляет собой 2. Это соединения формулы
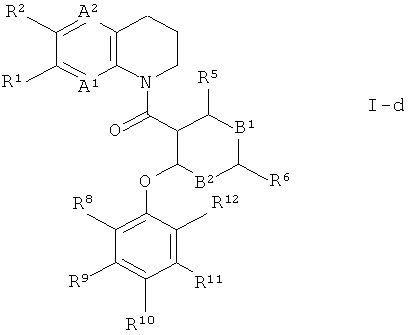
Кроме того, предпочтительны соединения формулы 1 по изобретению, где R3 и R14 вместе представляют собой -X-(CR17R18)n- и образуют часть кольца; где Х представляет собой -NR21-, R21 выбран из группы, состоящей из водорода, C1-7-алкила и С3-7-циклоалкила, R17 и R18 представляют собой водород, и n представляет собой 2. Это соединения формулы
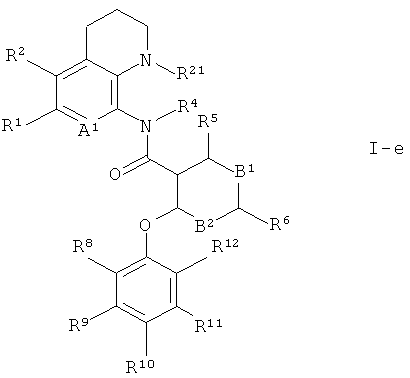
Предпочтительно R4 представляет собой водород или С1-7-алкил. Более предпочтительно R4 представляет собой метил.
Дополнительными предпочтительными соединениями формулы 1 по настоящему изобретению являются те, где R3 выбран из группы, состоящей из водорода, С1-7-алкила, С1-7-алкокси, N-гетероциклила и -NR15R16, где R15 и R16 независимо друг от друга выбраны из водорода, С1-7-алкила и С3-7-циклоалкила, и R4 представляет собой водород или метил, более предпочтительно метил.
Кроме того, предпочтительными являются соединения формулы I, где В1 представляет собой N или N+-O- и В2 представляет собой CR7, причем R7 выбран из группы, состоящей из водорода, галогена и С1-7-алкила. Более предпочтительно В1 представляет собой N. Это соединения формулы
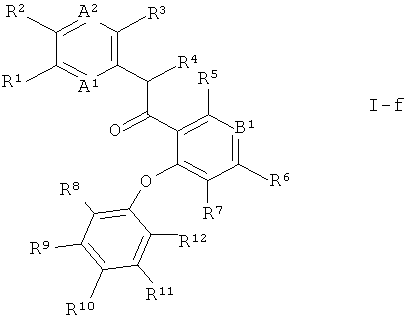
Также предпочтительными являются соединения формулы I по настоящему изобретению, где В1 представляет собой N и В2 представляет собой N. Это соединения формулы
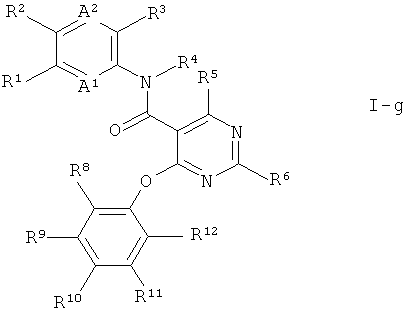
R5 и R6 независимо друг от друга выбраны из группы, состоящей из водорода, галогена, С1-7-алкила, С1-7-алкокси, галоген-С1-7-алкила, галоген-С1-7-алкокси и циано. Предпочтительны соединения формулы I, где R5 и R6 независимо друг от друга выбраны из группы, состоящей из водорода, галогена и С1-7-алкила.
Кроме того, предпочтительны соединения по настоящему изобретению, где по меньшей мере один или, если R4 представляет собой водород или С1-7-алкил, по меньшей мере два из R8, R9, R10, R11 и R12 выбраны из группы, состоящей из С1-7-алкила, С2-7-алкенила, С2-7-алкинила, галогена, галоген-С1-7-алкила, C1-7-алкокси,
галоген-С1-7-алкокси, гидрокси, гидрокси-С1-7-алкокси,
гидрокси-С1-7-алкила, гидрокси-С3-7-алкенила, гидрокси-С3-7-алкинила,
циано, карбоксила, С1-7-алкоксикарбонила, аминокарбонила,
карбоксил-С1-7-алкила, карбоксил-С2-7-алкенила, карбоксил-С2-7-алкинила,
С1-7-алкоксикарбонил-С1-7-алкила, С1-7-алкоксикарбонил-С2-7-алкенила,
С1-7-алкоксикарбонил-С2-7-алкинила,
карбоксил-С1-7-алкокси, С1-7-алкоксикарбонил-С1-7-алкокси,
карбоксил-С1-7-алкил-аминокарбонила, карбоксил-С1-7-алкил-(С1-7-алкиламино)-карбонила,
С1-7-алкоксикарбонил-С1-7-алкил-аминокарбонила, С1-7-алкоксикарбонил-С1-7-алкил-
(С1-7-алкиламино)-карбонила,
карбоксил-С1-7-алкил-аминокарбонил-С1-7-алкила,
карбоксил-С1-7-алкил-(С1-7-алкиламино)-карбонил-С1-7-алкила,
С1-7-алкоксикарбонил-С1-7-алкил-аминокарбонил-С1-7-алкила,
С1-7-алкоксикарбонил-С1-7-алкил-(С1-7-алкиламино)-карбонил-С1-7-алкила,
гидрокси-С1-7-алкил-аминокарбонила, ди-(гидрокси-С1-7-алкил)аминокарбонила,
аминокарбонил-С1-7-алкил-аминокарбонила,
гидроксисульфонил-С1-7-алкил-аминокарбонила, гидроксисульфонил-С1-7-алкил-
(С1-7-алкил-амино)-карбонила,
ди-(С1-7-алкоксикарбонил-С1-7-алкил)-метиламинокарбонила,
фенила, где фенил не замещен или замещен одной - тремя группами, выбранными
из галогена, С1-7-алкокси, карбоксила или С1-7-алкоксикарбонила,
фенил-карбонила, где фенил не замещен или замещен одной - тремя группами,
выбранными из галогена, С1-7-алкокси, карбоксила или С1-7-алкоксикарбонила,
фенил-аминокарбонила, где фенил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или С1-7-алкоксикарбонила, фенил-С1-7-алкила, где фенил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или С1-7-алкоксикарбонила,
фенил-С2-7-алкинила, где фенил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или С1-7-алкоксикарбонила, гетероарила, где гетероарил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или С1-7-алкоксикарбонила, гетероарил-карбонила, где гетероарил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или C1-7-алкоксикарбонила,
гетероарил-аминокарбонила, где гетероарил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или C1-7-алкоксикарбонила,
гетероарил-С1-7-алкила, где гетероарил не замещен или замещен одной - тремя группами, выбранными из галогена, Ci.y-алкила, С1-7-алкокси, карбоксила или C1-7-алкоксикарбонила,
гетероарил-С1-7-алкил-аминокарбонила, где гетероарил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или С1-7-алкоксикарбонила, и
гетероарил-карбонил-С1-7-алкила, где гетероарил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или C1-7-алкоксикарбонила,
и другие R8, R9, R10, R11 и R12 представляют собой водород.
Более предпочтительно соединениями формулы I являются те, где по меньшей мере два из R8, R9, R10, R11 и R12 выбраны из группы, состоящей из галогена, гидрокси, гидрокси-С1-7-алкокси, гидрокси-С1-7-алкила, циано, карбоксила, С1-7-алкоксикарбонила, аминокарбонила, карбоксил-С1-7-алкокси, С1-7-алкоксикарбонил-С1-7-алкокси, карбоксил-С1-7-алкил-аминокарбонила, карбоксил-С1-7-алкил-(С1-7-алкиламино)-карбонила,
С1-7-алкоксикарбонил-С1-7-алкил-аминокарбонила, гидрокси-С1-7-алкил-аминокарбонила, ди-(гидрокси-С1-7-алкил)аминокарбонила, аминокарбонил-С1-7-алкил-аминокарбонила,
гидроксисульфонил-С1-7-алкил-аминокарбонила, гидроксисульфонил-С1-7-алкил-(С1-7-алкил-амино)-карбонила,
ди-(С1-7-алкоксикарбонил-С1-7-алкил)-метиламинокарбонила, фенил-аминокарбонила, где фенил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или С1-7-алкоксикарбонила,
гетероарил-аминокарбонила, где гетероарил не замещен или замещен одной -тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или С1-7-алкоксикарбонила,
гетероарил-С1-7-алкила, где гетероарил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкила, С1-7-алкокси, карбоксила или C1-7-алкоксикарбонила,
гетероарил-С1-7-алкил-аминокарбонила, где гетероарил не замещен или замещен одной - тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или С1-7-алкоксикарбонила, и
гетероарил-карбонил-С1-7-алкила, где гетероарил не замещен или замещен одной -тремя группами, выбранными из галогена, С1-7-алкокси, карбоксила или С1-7-алкоксикарбонила, и другие R8, R9, R10, R11 и R12 представляют собой водород.
Особенно предпочтительны, соединения формулы I, где R8 и R11 представляют собой галоген и R9, R10 и R12 представляют собой водород.
Примеры предпочтительных соединений формулы I являются следующими:
[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-(3,4-дигидро-2H-хинолин-1-ил)-метанон,
[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-(6,7-дифтор-3,4-дигидро-2Н-хинолин-1-ил)-метанон,
[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-(3,4-дигидро-2Н-хиноксалин-1-ил)-метанон,
[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-(4-метил-3,4-дигидро-2H-хиноксалин-1-ил)-метанон,
этиловый эфир 2-{4-[4-(2,5-дихлор-фенокси)-пиридин-3-карбонил]-3,4-дигидро-2H-хиноксалин-1-илметил}-циклопропанкарбоновой кислоты,
(4-циклопропилметил-3,4-дигидро-2Н-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-метанон,
[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-(4-метансульфонил-3,4-дигидро-2H-хиноксалин-1-ил)-метанон,
(4-цикпопропил-3,4-дигидро-2H-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-метанон,
(6-хлор-4-циклопропил-7-фтор-3,4-дигидро-2H-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-метанон,
[4-(2,5-дихлор-фенокси)-1-окси-пиридин-3-ил]-(3,4-дигидро-2H-хинолин-1-ил)-метанон,
(6-хлор-4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-метанон,
4-(2,5-дихлор-фенокси)-N-(5-фтор-2-метокси-фенил)-N-метил-никотинамид,
4-(2,5-дихлор-фенокси)-N-метил-N-о-толил-никотинамид,
4-(2,5-дихлор-фенокси)-N-(2-метокси-фенил)-N-метил-никотинамид,
4-(2,5-дихлор-фенокси)-N-(2-метокси-пиридин-3-ил)-N-метил-никотинамид,
4-(2,5-дихлор-фенокси)-N-(2-диметиламино-фенил)-N-метил-никотинамид,
4-(2,5-дихлор-фенокси)-N-метил-N-(2-пиперидин-1-ил-фенил)-никотинамид,
N-(3,5-бис-трифторметил-фенил)-4-(2,5-дихлор-фенокси)-N-метил-никотинамид,
4-(2,5-дихлор-фенокси)-N-(4,5-дифтор-2-метокси-фенил)-N-метил-никотинамид,
N-(5-хлор-2-диметиламино-фенил)-4-(2,5-дихлор-фенокси)-N-метил-никотинамид,
4-(2,5-дихлор-фенокси)-N-(4,5-дифтор-2-метиламино-фенил)-N-метил-никотинамид,
4-(2,5-дихлор-фенокси)-N-(1,2,3,4-тетрагидро-хинолин-8-ил)-никотинамид,
4-(2,5-дихлор-фенокси)-N-(2-диметиламино-пиридин-3-ил)-N-метил-никотинамид,
4-(2,5-дихлор-фенокси)-N-метил-N-(1,2,3,4-тетрагидро-хинолин-8-ил)-никотинамид,
N-[4-хлор-2-(циклопропил-метил-амино)-5-фтор-фенил]-4-(2,5-дихлор-фенокси)-N-метил-никотинамид,
[4-(4-бром-2,5-дихлор-фенокси)-пиридин-3-ил]-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-ил)-метанон,
метиловый эфир 2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензойной кислоты,
диметиловый эфир 4-хлор-5-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-фталевой кислоты,
метиловый эфир {2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-уксусной кислоты,
{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-уксусная кислота,
метиловый эфир ({2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоил}-метил-амино)-уксусной кислоты,
({2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоил}-метил-амино)-уксусная кислота,
этиловый эфир 3-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-пропионовой кислоты,
3-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-пропионовая кислота,
2-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-этансульфоновая кислота,
2-({2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоил}-метил-амино)-этансульфоновая кислота,
3-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-пропан-1-сульфоновая кислота,
2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-N-(1H-тетразол-5-ил)-бензамид,
2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-
илокси]-N-(1H-тетразол-5-илметил)-бензамид,
4-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-масляная кислота,
метиловый эфир 4-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-1-метил-1H-пиррол-2-карбоновой кислоты,
4-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-1-метил-1Н-пиррол-2-карбоновая кислота,
метиловый эфир 4-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-бензойной кислоты,
4-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-бензойная кислота,
этиловый эфир 2-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-4-метил-тиазол-5-карбоновой кислоты,
2-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-4-метил-тиазол-5-карбоновая кислота,
этиловый эфир 5-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-[1,3,4]тиадиазол-2-карбоновой кислоты,
2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-N-[1,3,4]тиадиазол-2-ил-бензамид,
2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-N-(2-гидрокси-этил)-бензамид,
2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-N,N-бис-(2-гидрокси-этил)-бензамид,
2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-N-(2-гидрокси-1-гидроксиметил-этил)-бензамид,
2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензамид,
N-(2-карбамоил-этил)-2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензамид,
диметиловый эфир 4-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-гептандиовой кислоты,
(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-ил)-[4-(2,5-дихлор-4-гидроксиметил-фенокси)-пиридин-3-ил]-метанон,
2,5-дихлор-4-[3-(4-цикпопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензонитрил,
(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-ил)-[4-(2,5-дихлор-4-гидрокси-фенокси)-пиридин-3-ил]-метанон,
этиловый эфир {2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-фенокси}-уксусной кислоты,
{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-фенокси}-уксусная кислота,
этиловый эфир 2-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-фенокси}-2-метил-пропионовой кислоты,
2-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-фенокси}-2-метил-пропионовая кислота,
(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-ил)-{4-[2,5-дихлор-4-(2-гидрокси-этокси)-фенокси]-пиридин-3-ил}-метанон,
(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-6-метил-пиридин-3-ил]-метанон,
[4-(4-бром-2,5-дихлор-фенокси)-6-метил-пиридин-3-ил]-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-ил)-метанон,
метиловый эфир 2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-бензойной кислоты,
2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-бензойная кислота,
этиловый эфир 3-{2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-бензоиламино}-пропионовой кислоты,
3-{2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-бензоиламино}-пропионовая кислота,
метиловый эфир {2,5-дихлор-4-[5-(4-цикпопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-бензоиламино}-уксусной кислоты,
{2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-бензоиламино}-уксусная кислота,
2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-N-(1H-тетразол-5-ил)-бензамид,
2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-N-(1Н-тетразол-5-илметил)-бензамид,
[2-хлор-4-(2,5-дихлор-фенокси)-6-метил-пиридин-3-ил]-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-ил)-метанон,
[6-хлор-4-(2,5-дихлор-фенокси)-пиридин-3-ил]-(3,4-дигидро-2H-хинолин-1-ил)-метанон,
(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-1-окси-пиридин-3-ил]-метанон,
[4-(2,5-дихлор-фенокси)-пиримидин-5-ил]-(3,4-дигидро-2Н-хинолин-1-ил)-метанон,
[4-(2,5-дихлор-фенокси)-пиримидин-5-ил]-(6-фтор-3,4-дигидро-2Н-хинолин-1-ил)-метанон,
[4-(2,5-дихлор-фенокси)-пиримидин-5-ил]-(3,4-дигидро-2Н-хиноксалин-1-ил)-метанон,
[4-(2,5-дихлор-фенокси)-пиримидин-5-ил]-(4-метил-3,4-дигидро-2H-хиноксалин-1-ил)-метанон,
(2-метокси-пиридин-3-ил)-метил-амид 4-(2,5-дихлор-фенокси)-пиримидин-5-карбоновой кислоты
или их фармацевтически приемлемые соли.
Особенно полезными соединениями формулы I по настоящему изобретению являются следующие:
[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-(4-метил-3,4-дигидро-2Н-хиноксалин-1-ил)-метанон,
(4-циклопропилметил-3,4-дигидро-2Н-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-метанон,
(4-цикпопропил-3,4-дигидро-2Н-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-метанон,
(6-хлор-4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-метанон,
[4-(4-бром-2,5-дихлор-фенокси)-пиридин-3-ил]-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-ил)-метанон,
{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-уксусная кислота,
3-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-пропионовая кислота,
2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-N-(1Н-тетразол-5-ил)-бензамид,
2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-N-(1H-тетразол-5-илметил)-бензамид,
4-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-1-метил-1Н-пиррол-2-карбоновая кислота,
4-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-бензойная кислота,
2-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2/^-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-4-метил-тиазол-5-карбоновая кислота,
2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензонитрил,
(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-6-метил-пиридин-3-ил]-метанон,
3-{2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-бензоиламино}-пропионовая кислота,
2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-N-(1H-тетразол-5-ил)-бензамид,
(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-1-окси-пиридин-3-ил]-метанон,
[4-(2,5-дихлор-фенокси)-пиримидин-5-ил]-(4-метил-3,4-дигидро-2Н-хиноксалин-1-ил)-метанон,
или их фармацевтически приемлемые соли.
Также фармацевтически приемлемые соли соединений формулы I по отдельности представляют собой полезные соединения по настоящему изобретению.
Соединения формулы I могут иметь один или более асимметрических атомов углерода и могут находиться в виде оптически чистых энантиомеров, смесей энантиомеров, таких как, например рацематы, оптически чистых диастереоизомеров, смесей диастереоизомеров, диастереоизомерных рацематов или смесей диастереоизомерных рацематов. Оптически активные формы могут быть получены, например путем растворения рацематов, в ходе асимметрического синтеза или асимметричной хроматографии (хроматография с хиральными адсорбентами или элюентом). Изобретение охватывает все эти формы.
Следует понимать, что соединения общей формулы I по данному изобретению могут быть преобразованы по функциональным группам, что дает производные, которые способны возвращаться обратно в исходное соединение in vivo. Физиологически приемлемые и метаболически подвижные производные, которые способны образовывать исходные соединения общей формулы I in vivo, также входят в объем данного изобретения.
Дополнительным аспектом настоящего изобретения является способ изготовления соединений формулы I, как определено выше, согласно которому
а) подвергают взаимодействию карбоновую кислоту формулы II
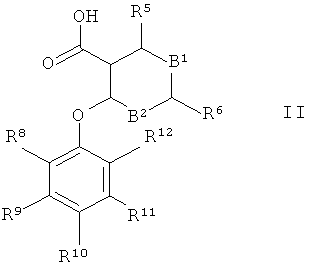
где В1, В2 и R5 до R12 являются такими, как определено выше, с амином формулы III
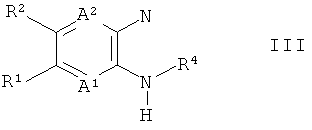
где А1, А2 и R1 до R4 являются такими, как определено выше, в присутствии связующего реагента при основных условиях, чтобы получить соединение формулы I

где А1, А2, В1, В2 и R1 до R12 являются такими, как определено выше, и при желании переводят полученное соединение в фармацевтически приемлемую соль, или, альтернативно, b) связывают соединение формулы IV

где А1, А2, В1, В2 и R1 до R6 являются такими, как определено выше, и Х означает атом галогена или сульфоната, с фенолом формулы V
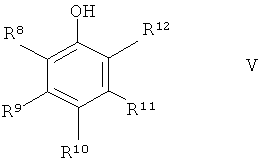
где R8 до R12 являются такими, как определено выше, в присутствии источника меди (I), чтобы получить соединение формулы I

где А1, А2, В1, В2 и R1 до R12 являются такими, как определено выше, и при желании переводят полученное соединение в фармацевтически приемлемую соль.
Подходящими связующими агентами являются например N,N'-карбонилдиимидазол (CDI), N,N'-дициклогексилкарбодиимид (DCC), N'-(3-диметиламинопропил)-N'-этил-карбодиимид-гидрохлорид (EDCI), 0-(бензотриазол- 1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TBTU), 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний-3-оксида гексафторфосфат (HATU), 1-гидрокси-1,2,3-бензотриазол (НОВТ), 2-хлор-1-метилпиридиния иодид или бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат (ВОР). «При основных условиях» означает присутствие основания, такого как диизопропилэтиламин, триэтиламин, N-метилморфолин или 4-(диметиламино)-пиридин. Реакцию проводят в подходящем растворителе, таком как например N,N-Диметилформамид (ДМФА), диметилацетамид (ДМАц), дихлорметан или диоксан, при температуре между 0°С и температурой окружающей среды.
Источник меди (I) означает соль меди (I), такую как бромид меди (I) или иодид меди (I), или комплексы меди (I), такие как тетракис(ацетонитрил)меди (I) гексафторфосфат.Связывание предпочтительно проводят при нагревании или нагреве микроволновым излучением (обычно при температуре между 100 и 200°С, или до температуры кипения растворителя) в апротонном растворителе, таком как N,N-диметилформамид (ДМФА), диметилацетамид (ДМАц), N-метилпирролидон (NMP), этиленгликоль, ацетонитрил и ТГФ, или их смесях. Также возможно присутствует третичный амин, такой как триэтиламин, N-этил диизопропиламин (основание Хунига) или пиридин.
Кроме того, изобретение относится к соединениям формулы I, как определено ранее, полученным согласно способу, как определено выше.
Более подробно соединения формулы I по настоящему изобретению могут быть получены способами и процедурами, приведенными ниже. Типичная процедура получения соединений формулы I показана на Схеме 1.
Схема 1
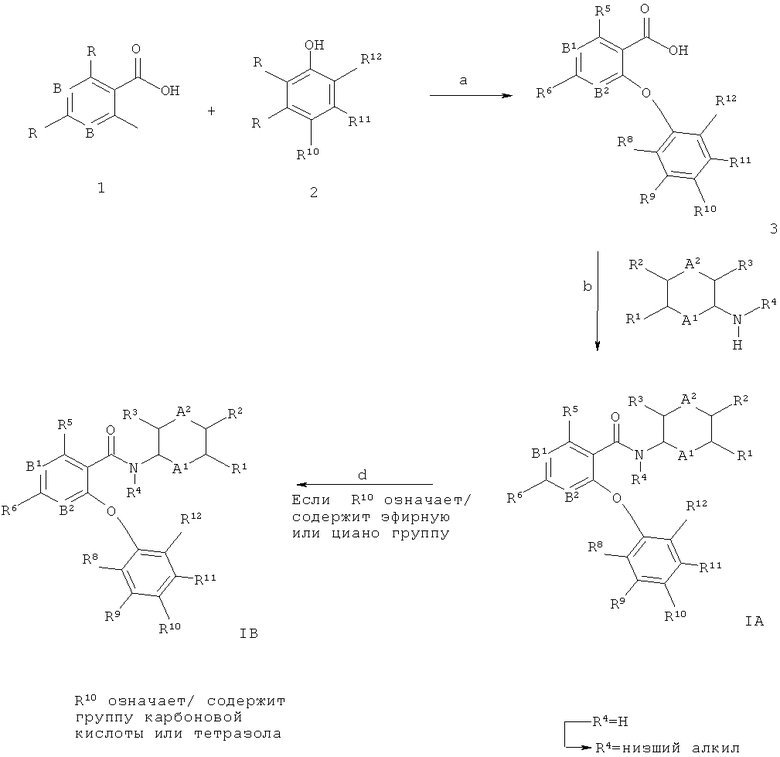
Соединения общей формул 1А и 1 В могут быть получены, например как изображено на схеме 1, в ходе взаимодействия никотиновых кислот общей структуры 1, в которой Х обычно означает галоген, такой как йод, бром или хлор, с фенолами 2, что дает биарильные эфиры 3 (стадия а). Для увеличения скорости превращения может быть применено нагревание, при этом обычное нагревание или нагрев микроволновым излучением могут быть применены с использованием подходящего устройства микроволнового излучения. Кроме того, реакцию можно проводить в присутствии или отсутствии растворителя (обычно апротонного полярного растворителя, такого как ДМФА (N,N-диметилформамид), ДМАц (диметилацетамид), NMP (N-метилпирролидон), этиленгликоль, ацетонитрил и ТГФ, или их смеси; также в некоторых случаях может подойти менее полярный растворитель, такой как толуол), и в присутствии или отсутствии третичного амина такого как триэтиламин, N,N-диизопропилэтиламин (основание Хунига) или пиридин, и в присутствии или отсутствии источника меди (I), такого как бромид меди (I) или иодид меди (I). В некоторых случаях может быть целесообразно проводить реакцию в присутствии комплексов меди (I) с более высокой растворимостью, таких как тетракис(ацетонитрил)меди (I) гексафторфосфат (например, US 06/028 7297 А1 (Johnson & Johnson)). Указанную реакцию можно проводить в присутствии или отсутствии металлической меди (например, нанопорошок меди (0)). Альтернативно, медно-опосредованная реакция связывания С(арил)-O может быть выполнена при основных условиях с использованием карбоната калия или цезия, гидроксида калия, метилата натрия, трет-бутилата калия или гидрида натрия (реакция типа нуклеофильного замещения в ароматическое ядро), где Х является подходящей уходящей группой, такой как хлор, бром, йод, OSO2алкил, OSO2фторалкил, ОЗОгарил, мезилат (метансульфонат) или трифлат (трифторметансульфонат). Исходные соединения общей структуры 1 (например, 4-хлор- or 4-бром-никотиновые кислоты) являются известными соединениями и имеются в продаже, или могут быть получены многочисленными способами при использовании обычных реакционных процедур, широко известных в данной области техники. Например, карбоксильная функциональная группа в пиридиновых производных 1 может быть получена из соответствующих бензонитрилов или из соответствующих эфиров карбоновых кислот при применении стандартных реакционных условий, используемых для такого типа преобразований, известных квалифицированному специалисту в данной области техники, таких как, например катализируемый кислотой гидролиз (например, серной кислотой или соляной кислотой), или перемешивание со щелочными гидроксидами (например, гидроксидом лития, гидроксидом натрия, гидроксидом калия) в смешанном растворителе, состоящем обычно из тетрагидрофурана и воды, возможно в присутствии спиртов, таких как метанол или этанол, при этом можно применять обычное нагревание или нагревание под действием микроволнового излучения. Эти реакции могут протекать в широком диапазоне температур, изменяющемся от температуры окружающей среды до температуры кипения используемого растворителя. Фенолы формулы 2 также являются известными соединениями и имеются в продаже, или могут быть получены многочисленными способами при использовании обычных реакционных процедур, широко известных в данной области техники.
Амидное связывание промежуточных соединений биарильного эфира 3 с возможно замещенными арил- или гетероарил-аминами 4 (либо имеются в продаже, либо доступны в ходе способов, описанных в ссылках, или в ходе способов, известных в данной области техники) дает целевые структуры общей структуры 1А (стадия b). Амидное связывание этого типа широко описано в литературе (например, Comprehensive Organic Transformations: A Guide to Functional Group Preparations, 2nd Edition, Richard C. Larock, John Wiley & Sons, New York, NY. 1999) и может быть выполнено путем применения связующих реагентов, таких как, например N,N-карбонилдиимидазол (CDI), N,N-дициклогексилкарбодиимид (DCC), 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (EDCI), 1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-Ь]пиридиний-3-оксида гексафторфосфат (HATU), 1-гид рокси-1,2,3-бензотриазол (НОВТ), 0-бензотриазол-1-ил-N,N,N,N-тетраметилурония тетрафторборат (TBTU) или 2-хлор-1-метилпиридиния иодид (Mukaiyama reagent; Е. Bald, К. Saigo and T. Mukaiyama Chem. Lett. 1975, 4, 1163-1166), в подходящем растворителе, подобном, например N,N-диметилформамиду (ДМФА), диметилацетамиду (ДМАц), дихлорметану или диоксану, возможно в присутствии основания (например триэтиламина, N,N-диизопропилэтиламина (основание Хунига) или 4-(диметиламино)пиридина). Альтернативно, целевые структуры IA могут быть получены в ходе перевода промежуточных соединений 3 в их хлорангидриды при обработке, например, с тионилхлоридом, без примесей или возможно в растворителе, таком как, например дихлорметан, и реакции хлорангидрида с аминами 4 в подходящем растворителе, таком как, например дихлорметан или ДМФА (N,N-диметилформамид), и основании, таком как, например триэтиламин, N,N-диизопропилэтиламин (основание Хунига), пиридин диизопропилэтиламин, 4-(диметиламино)пиридин или бис(триметилсилил)амид лития, причем эти реакции могут протекать в широком диапазоне температур, изменяющемся от температуры окружающей среды до температуры кипения используемого растворителя.
В случаях, когда анилин 4 представляет собой первичный амин (R4=Н), приводящий к вторичным амидам, алкилирование (например метилирование, R4=Me) амидной связи может быть выполнено в ходе реакции с алкилгалогенидами (например метилиодидом или метилбромидом) в присутствии основания, такого как, например гидрид натрия или трет-бутилат калия, в подходящем растворителе, подобном ДМФА (N,N-диметилформамиду), ТГФ, или их смеси, при комнатной температуре до повышенной температуры (стадия с).
Альтернативно, соединения 1А, в которых R4 обозначает низшую алкильную группу, могут быть получены в ходе амидного связывания промежуточных соединений 3 с вторичными арил- или гетероарил-аминами 4 (R4, как определен ранее) при описанных выше условиях. Амины этого типа либо имеются в продаже, либо могут быть получены способами, описанными в литературе.
В тех случаях, когда заместитель R10 в соединениях формулы 1А обозначает или содержит функциональную группу эфира карбоновой кислоты (например алкиловый эфир, такой как, например метил, этил или трет-бутил), эфирную функциональную группу можно расщепить при основных (например метиловый или этиловый эфиры с гидроксидом лития или натрия в полярных растворителях таких как, например метанол, вода или тетрагидрофуран, или смесях указанных растворителей) или при кислотных условиях (например трет-бутиловый эфир при использовании концентрированной соляной кислоты в тетрагидрофуране или муравьиной кислоты в подходящем растворителе, таком как спирты, подобные, например изопропанолу), что даст соединения 1 В (стадия d). Дополнительные эфиры включают, но не ограничиваются этим, например аллиловые или бензиловые эфиры, которые можно расщепить способами, известными квалифицированному специалисту в данной области техники, и как описано например в «Protective Groups in Organic Chemistry» by T.W. Greene and P.G.M. Wutts, 2nd Ed., 1991, Wiley N.Y.). Возможно, заместитель R10 в соединениях формулы IA может означать или содержать цианогруппу, которая может быть либо гидролизована до карбоновой кислоты при основных (например с водным гидроксидом натрия или лития) или при кислотных условиях (например соляная или серная кислота), либо может быть превращена в соответствующий тетразол при использовании стандартных процедур, таких как, например обработка с азидом натрия в присутствии кислоты Льюиса (например бромид цинка (II)) или хлорида аммония в воде или органических растворителях, подобных дихлорметану или N,N-диметилформамиду, при температурах между 0°С и точкой кипения растворителя, что дает соединения IB (стадия d). Соединения IB, в которых R10 несет тетразольную группу, также могут быть получены в ходе амидного связывания промежуточных соединений 3 с амино- или амино-алкил-замещенными тетразолами, которые либо имеются в продаже, либо могут быть получены способами из литературы. Тетразольная группа в амино- или амино-алкил-замещенных тетразолах может быть дополнительно защищена, например с трифенилметильной (тритильной) защитной группой, которую можно отщепить после стадии реакции, применяя способы, известные квалифицированному специалисту в данной области техники, и как описано в литературе.
Схема 2
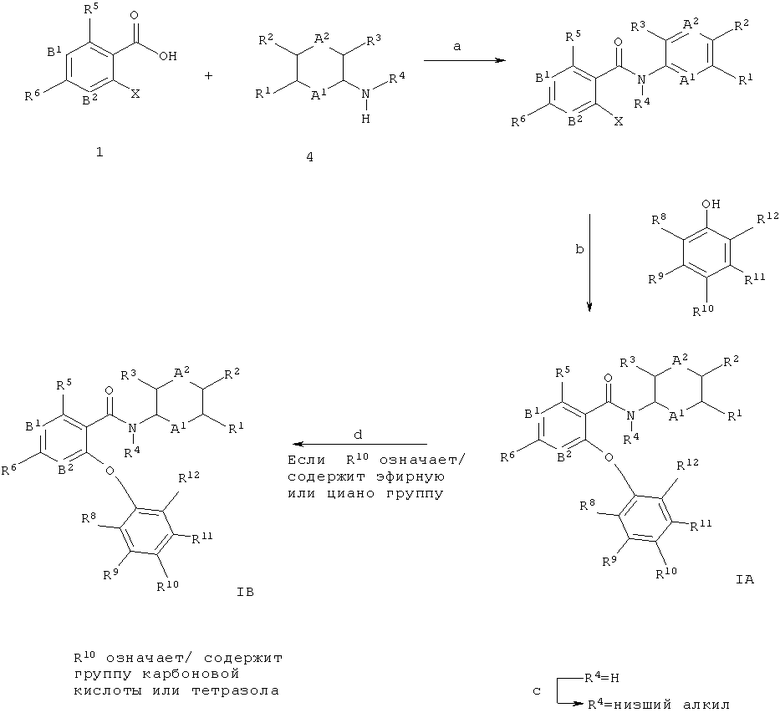
Синтез структур формул 1А и 1 В также можно выполнить, как указано на Схеме 2, используя обратную последовательность реакций, а именно сначала образуя амидную связь между пиридил-карбоновыми кислотами 1 и арил- или гетероарил-аминами 4 (стадия а), с последующим медно-опосредованным С(пиридил)-O связыванием полученных в результате промежуточных соединений 5 с фенолами 2 (стадия b). Это дает целевые структуры IA, которые в случае вторичного амида (если были использованы первичные амины 4), можно дополнительно алкилировать, применяя методы, описанные ранее (стадия с). В случаях, когда аминная группировка является желательной группой для изменения, алгоритм, приведенный на Схеме 1, представляет особый интерес.Наоборот, алгоритм, изображенный на Схеме 2, позволяет фенольную часть структуры изменять быстрым и параллельным образом. Как описано под Схемой 1, соединения формулы IA можно дополнительно преобразовывать в структуры IB, применяя методы, приведенные ранее.
Схема 3
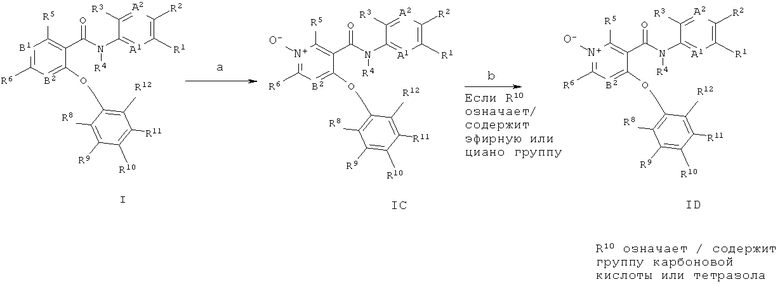
Соединения общей структуры 1C и 1D, в которой В2 означает CR7, погут быть получены в соответствии со Схемами 3 и 4. Синтез пиридин N-оксидов посредством окисления соответствующих пиридинов широко описан в литературе и может быть выполнен различными способами. Например, при использовании водных растворов пероксида водорода в уксусной кислоте или при использовании диметил-диоксирана или мета-хлорнадбензойной кислоты в подходящем растворителе, таком как, например дихлорметан.
В тех случаях, когда соединения 1 содержат другие функциональные группы, которые являются реакционноспособными или могут окисляться при используемых реакционных условиях, может быть предпочтительно выполнять окисление промежуточных соединений никотиновой кислоты 1 в качестве первой стадии синтеза (Схема 4, стадия а) с последующим амидным связыванием полученных в результате промежуточных соединений N-оксида 6 с арил- или гетероарил-аминами 4 (стадия b) и подвергать взаимодействию полученные в результате промежуточные соединения 7 с фенолами 2 при условиях, приведенных ранее, что дает соединения IC. Соединения формулы IC могут быть дополнительно преобразованы в структуры ID при использовании способов, описанных выше.
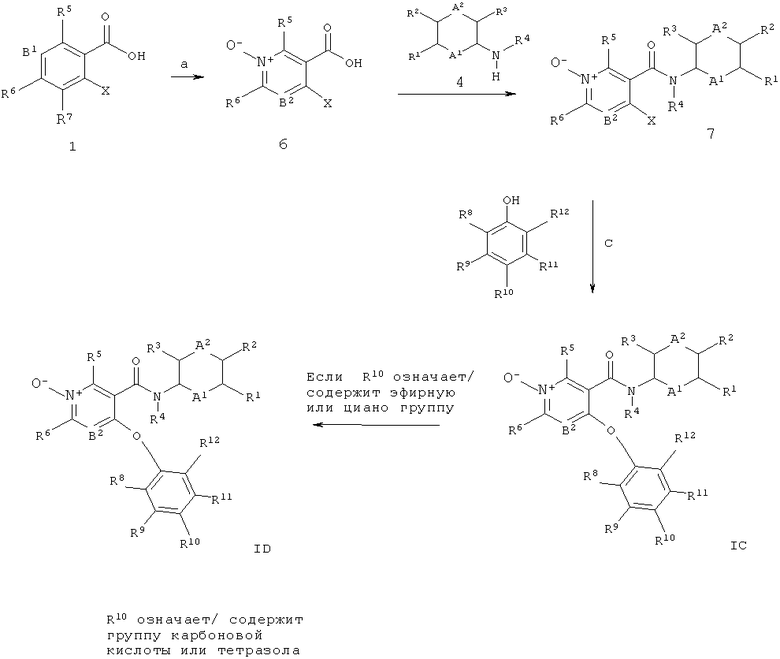
R10 означает / содержит группу карбоновой кислоты или тетразола
При желании или необходимости функциональные группы, присутствующие в I (такие как -СO2алкил, аминогруппы, цианогруппы и другие), могут быть преобразованы в другие функциональные группы при использовании обычных стандартных процедур, известных квалифицированному специалисту в данной области техники (например, восстановление -СO2алкила до -CH2OH с LiAlH4, гидролиз -СO2алкила до CO2H и последующее необязательное превращение в амид, ацилирование аминогрупп и подобные).
Как описано выше, соединения формулы I по настоящему изобретению можно применять в качестве лекарственных средств для лечения заболеваний, которые связаны с модуляцией активности GPBAR1.
Поскольку соединения формулы 1 по изобретению представляют собой агонисты рецептора GPBAR1, то соединения будут полезны для снижения уровней глюкозы, липидов и резистентности к инсулину у пациентов, страдающих диабетом, и не страдающих диабетом пациентов, которые имеют нарушение толерантности к глюкозе или которые находятся в преддиабетическом состоянии. Соединения формулы I, кроме того, полезны для улучшения гиперинсулинемии, которая часто встречается у больных диабетом или предрасположенных к диабету пациентов, в ходе регулирования колебаний в уровнях глюкозы в сыворотке, что часто встречается у этих пациентов. Также соединения формулы I применяются при снижении рисков, связанных с метаболическим синдромом, при снижении риска развития атеросклероза или замедления появления атеросклероза, и уменьшении риска стенокардии, хромоты, сердечного приступа, инсульта и коронарно-артериального заболевания. При контроле над гипергликемией соединения полезны для замедления или для предотвращения рестеноза сосудов и диабетической ретинопатии.
Соединения формулы I по настоящему изобретению являются полезными при улучшении или восстановлении функции В-клеток, так что они могут быть полезны при лечении диабета 1-го типа или при замедлении или предотвращении у пациента с диабетом 2-го типа необходимости в инсулинотерапии. Соединения могут быть полезны для снижения аппетита и массы тела у страдающих ожирением людей и, следовательно, могут применяться для снижения риска сопутствующих заболеваний, связанных с ожирением, таких как гипертония, атеросклероз, диабет и дислипидемия. Повышая уровни активного ГПП-1 in vivo, соединения применяются при лечении неврологических нарушений, таких как болезнь Альцгеймера, рассеянный склероз и шизофрения.
Таким образом, выражение «заболевания, которые связаны с модуляцией активности GPBAR1» означает такие заболевания, как метаболические, сердечнососудистые и воспалительные заболевания, например сахарный диабет, особенно диабет 2-го типа или гестационный диабет, нарушенная гликемия натощак, нарушение толерантности к глюкозе, резистентность к инсулину, гипергликемия, ожирение, метаболический синдром, ишемия, инфаркт миокарда, ретинопатия, рестеноз сосудов, гиперхолестеринемия, гипертриглицеридемия, дислипидемия или гиперлипидемия, расстройства липидного обмена, такие как низкие уровни холестерина ЛПВП или высокие уровни холестерина ЛПНП, высокое кровяное давление, стенокардия, коронарно-артериальное заболевание, атеросклероз, гипертрофия сердца, ревматоидный артрит, астма, хроническое обструктивное заболевание легких (ХОЗЛ), псориаз, язвенный колит, болезнь Крона, заболевания, связанные с парентеральным питанием, особенно во время синдрома короткой кишки, синдрома раздраженного кишечника (СРК), аллергические заболевания, жирная печень, неалкогольная жировая болезнь печени (НАЖБП), фиброз печени, неалкогольный стеатогепатит (НАСГ), первичный склерозирующий холангит (ПСХ), цирроз печени, первичный биллиарный цирроз (ПБЦ), фиброз почек, нервная анорексия, нейрогенная булимия и неврологические нарушения, такие как болезнь Альцгеймера, рассеянный склероз, шизофрения и нарушение когнитивной деятельности.
В предпочтительном аспекте выражение «заболевания, которые связаны с модуляцией активности GPBAR1» относится к сахарному диабету, особенно диабету II типа, нарушенной гликемии натощак, нарушению толерантности к глюкозе, гипергликемии, метаболическому синдрому, ожирению, гиперхолестеринемии и дислипидемии.
Также изобретение относится к фармацевтическим композициям, включающим соединение, как определено выше, и фармацевтически приемлемый носитель и/или адъювант.А именно, изобретение относится к фармацевтическим композициям, пригодным для лечения заболеваний, которые связаны с модуляцией активности GPBAR1.
Кроме того, изобретение относится к соединениям формулы I, как определено выше, для применения в качестве терапевтически активных веществ, особенно в качестве терапевтически активных веществ для лечения заболеваний, которые связаны с модуляцией активности GPBAR1. Особенно предпочтительны соединения формулы I для применения при сахарном диабете, предпочтительно диабете II типа, или гипергликемии.
В другом аспекте изобретение относится к способу лечения заболеваний, которые связаны с модуляцией активности GPBAR1, согласно которому вводят терапевтически активное количество соединения формулы I человеку или животному. Предпочтителен способ лечения сахарного диабета, предпочтительно диабета II типа, или гипергликемии.
Кроме того, изобретение относится к применению соединений формулы I, как определено выше, для лечения заболеваний, которые связаны с модуляцией активности GPBAR1.
Кроме того, изобретение относится к применению соединений формулы I, как определено выше, для изготовления лекарственных средств для лечения заболеваний, которые связаны с модуляцией активности GPBAR1. Особенно предпочтительно применение соединений формулы I, как определено выше, для изготовления лекарственных средств для лечения сахарного диабета, предпочтительно диабета II типа, или гипергликемии.
Также предусмотрена настоящим изобретением комбинированная терапия с применением одного или более соединений формулы 1 или композиций по настоящему изобретению, или их фармацевтически приемлемых солей, в сочетании с одним или более другими фармацевтически активными соединениями, независимо выбранными из группы, состоящей из следующих:
(a) агонисты гамма-рецептора, активируемого пролифератором пероксисом, (PPAR) человека (например тиазолидиндионы и глитазоны, например росиглитазон, троглитазон, пиоглитазон, энглитазон, балаглитазон и нетоглитазон),
(b) бигуаниды, такие как метформин, метформин гидрохлорид, буформин и фенформин,
(c) ингибиторы дипептидилпептидазы IV (ДПП-4), такие как ситаглиптин, ситаглиптин фосфат, саксаглиптин, вилдаглиптин, алоглиптин, кармеглиптин, денаглиптин ситаглиптин, саксаглиптин и SYR-322,
(d) инкретины, такие как агонисты рецептора глюкагоноподобного пептида-1 (ГПП-1) (например эксенатид (Byetta™), NN2211 (лираглутид), ГПП-1(7-36) амид и его аналоги, ГПП-1(7-37) и его аналоги, AVE-0010 (ZP-10), R1583 (таспоглютид), GSK-716155 (албиглутид, GSK/Human Genome Sciences), BRX-0585 (Pfizer/Biorexis) и CJC-1134-PC (эксендин-4:РС-ОАС™) или глюкозозависимый инсулинотропный пептид (ГИП),
(e) инсулин или аналоги инсулина, такие как LysPro инсулин или ингаляционные препараты, содержащие инсулин,
(f) сульфонилмочевины, такие как толазамид, хлорпропамид, глипизид, глимепирид, глибурид, глибенкламид, толбутамид, ацетогексамид или глизипид (glypizide),
(g) ингибиторы α-глюкозидазы, такие как миглитол, акарбоза, эпалрестат или воглибоза,
(П) ингибиторы биосинтеза холестерина, такие как ингибиторы HMG-CoA редуктазы, например ловастатин, симвастатин, правастатин, флувастатин, аторвастатин, церивастатин, итавастатин, нисвастатин и ривастатин, или ингибиторы сквален-эпоксидазы, например тербинафин,
(i) агенты, повышающие уровень ЛПВП в плазме, такие как ингибиторы БПХЭ
(белка переноса холестеринового эфира), например анацетрапиб, торцетрапиб и далцетрапиб, или агонисты PPAR-альфа, например гемфиброзил, клофибрат, фенофибрат и безафибрат,
(j) двойные альфа/гамма агонисты PPAR, такие как мураглитазар, навеглитазар, алеглитазар, тезаглитазар, пелиглитазар, фарглитазар и JT-501,
(k) секвестранты желчных кислот, например анионообменные смолы, или четвертичные амины (например холестирамин или колестипол), или ингибиторы переноса желчных кислот в подвздошной кишке (BATi),
(I) никотиниловый спирт, никотиновая кислота, ниацинамид или их соли,
(m) ингибиторы абсорбции холестерина, такие как эзетимиб, или ингибиторы ацил-кофермент-А-холестерин-O-ацил трансферазы (АСАТ), такие как авазимиб,
(n) селективные модуляторы рецепторов эстрогена, такие как ралоксифен или тамоксифен, или альфа или бета агонисты, антагонисты или частичные агонисты LXR (печеночного Х рецептора) (например 22(Р)-гидроксихолестерин, 24(S)-гидроксихолестерин, Т0901317 или GW3965),
(о) ингибиторы микросомального белка передачи триглицеридов (МТР), альфа2-антигонисты и имидазолины (например мидаглизол, изаглидол, дериглидол, идазоксан, эфароксан, флупароксан),
(р) стимуляторы секреции инсулина, такие как линоглирид, натеглинид, репаглинид, митиглинид кальция гидрат или меглитинид,
(q) ингибиторы SGLT-2 (натрий зависимого переносчика глюкозы) (например дапаглифлозин, серглифлозин и AVE 2268),
(s) активаторы глюкокиназы, такие как соединения, раскрытые, например, в WO 00/58293 А1,
(t) ингибиторы протеинтирозинфосфатазы-1 В (РТР-1 В),
(u) ингибиторы рецептора глюкагона,
(v) агенты против ожирения, такие как фенфлурамин, дексфенфлурамин, фентирамин, сибутрамин, орлистат, антагонисты нейропептида Y1 или Y5, агонисты нейропептида Y2, агонисты MC4R (рецептора меланокортина-4), антагонисты / обратные агонисты каннабиноидного рецептора 1 (СВ-1), и агонисты В3-адренергических рецепторов (например GW-320659), агонист фактора роста нервов (например аксокайн), агонисты гормона роста (например AOD-9604), ингибиторы обратного захвата / переносчика 5-НТ (серотонина) (например Прозак), ингибиторы обратного захвата DA (дофамина) (например Бупропион), блокаторы обратного захвата 5-НТ, NA и DA, стероидные растительные экстракты (например Р57), агонисты ХЦК-А (холецистокинина-А), антагонисты / обратные агонисты GHSRIa (рецептора, усиливающего секрецию гормона роста), антитела к грелину, антагонисты MCH1R (меланиноконцентрирующего гормона 1R) (например SNAP 7941), агонисты / антагонисты MCH2R (меланиноконцентрирующего гормона 2R), обратные агонисты или антагонисты Н3 (гистаминового рецептора 3), агонисты Н1 (гистаминового рецептора 1), ингибиторы FAS (синтазы жирных кислот), ингибиторы АСС-2 (ацетил-СоА-карбоксилазы-1), ингибиторы DGAT-2 (диацилглицерол-ацилтрансферазы 2), ингибиторы DGAT-1 (диацилглицерол-ацилтрансферазы 1), агонисты КРФ (кортикотропин-рилизинг фактора), антагонисты галанина, UCP-1 (разобщающий белок 1), 2 или 3 активаторы, лептин или производные лептина, опиоидные антагонисты, антагонисты орексина, агонисты BRS3, агонисты ГПП-1 (глюкагоноподобного пептида 1), агонисты IL-6 (интерлейкина-6), агонисты a-MSH (альфа-меланоцит-стимулирующего гормона), антагонисты AgRP (агути-связанного пептида), агонисты BRS3 (рецепторов бомбезина подтипа 3), агонисты 5-НТ1 В, антагонисты РОМС (проопиомеланокортина), CNTF (цилиарный нейротрофический фактор или производное CNTF), NN2211, Топирамат, глюкокортикоидный антагонист, агонисты Эксендина-4, агонисты 6-НТ2C (серотонинового рецептора 2С) (например Лоркасерин), ингибиторы ФДЭ (фосфодиэстеразы), ингибиторы переносчика жирных кислот, ингибиторы переносчика дикарбоксилата, ингибиторы переносчика глюкозы,
(w) противовоспалительные агенты, такие как ингибиторы циклооксигеназы-2 (СОХ-2) (например рофекоксиб и целекоксиб), глюкокортикоиды, азулфидин, ингибиторы тромбина (например гепарин, аргатробан, мелагатран, дабигатран), ингибиторы агрегации тромбоцитов (например антагонисты рецептора гликопротеинов IIb/IIIa фибриногена или аспирин), и урсодезоксихолевая кислота (УДХК) и норурсодезоксихолевая кислота (норУДХК), и
(у) антигипертензивные средства, такие как бета-блокаторы, например антагонисты рецептора ангиотензина II, такие как лозартан, эпросартан, ирбесартан, тасосартан, телмисартан или валсартан; ингибиторы ангиотензинпревращающего фермента, такие как эналаприл, каптоприл, цилазаприл, рамиприл, зофеноприл, лизиноприл и фозиноприл; блокаторы кальциевых каналов, такие как нифедипин и дилтиазем, и антагонисты эндотелина.
Другие подобные фармацевтически активные соединения можно вводить в обычно используемом количестве одновременно или последовательно с соединением формулы I или его фармацевтически приемлемой солью. При лечении пациентов с сахарным диабетом 2 типа, резистентностью к инсулину, ожирением, метаболическим синдромом, неврологическими расстройствами и сопутствующими заболеваниями, которые сопровождают эти заболевания, обычно вводят более одного фармацевтически активного соединения. Соединения формулы 1 по этому изобретению, как правило, можно вводить пациенту, который уже принимает один или более чем один другой лекарственный препарат при этих состояниях. Когда соединение формулы 1 используется одновременно с одним или более другими фармацевтически активными соединениями, предпочтительной является фармацевтическая композиция в стандартной лекарственной форме, содержащей другие подобные фармацевтически активные соединения и соединение формулы I. Таким образом, изобретение также относится к фармацевтической композиции, содержащей соединение формулы 1 в сочетании с одним или более другими фармацевтически активными соединениями, как определено выше. При использовании в сочетании с одним или более другими активными ингредиентами соединение формулы 1 по настоящему изобретению и другие фармацевтически активные соединения могут применяться в меньших дозах, чем когда каждый используется по отдельности. Эти виды фармацевтических композиций также включены в изобретение.
Однако комбинированная терапия также включает лечения, при которых соединение формулы 1 и одно или более чем одно другое фармацевтически активное соединение вводят в разных лекарственных формах, но с перекрывающимися режимами. Таким образом, изобретение также относится к способу лечения заболеваний, которые связаны с модуляцией активности GPBAR1, согласно которому вводят терапевтически активное количество соединения формулы I в сочетании с одним или более другими фармацевтически активными соединениями человеку или животному.
Следующее исследование проводили с целью определения активности соединений формулы I:
кДНК рецептора GPBAR1 человека (Genbank: NM_170699 за исключением скрытой C:G мутации в положении 339 от инициирующего кодона) была расширена с помощью полимеразной цепной реакции (ПЦР) из кДНК человека и включена в pCineo (Promega) стандартными методами (Current Protocols in Molecular Biology, Wiley Press, ed. Ausubel et а/.). Конечный клон был проверен с помощью анализа последовательности ДНК. Плазмиду трансфицировали в клетки СНО, лишенные активности дигидрофолатредуктазы (СНО-дгфр-), используя Липофектамин плюс (Invitrogen). Клоны выделяли в условиях ограниченного разбавления и определяли по активностям в ходе анализа цАМФ, используя литохолевую кислоту в качестве агониста. Клональную клеточную линию, проявляющуюся по наибольшей активности при увеличениях цАМФ, выделяли и определяли, как дающую последовательно хорошие отклики в течение по меньшей мере 20 пассажей.
Анализ цАМФ
СНО-дгфр(дефицитные) клетки, экспрессирующие рецепторы GPBAR1 человека, высеивали 17-24 часа перед экспериментом 50000 клеток на лунку на черном 96-луночном планшете с плоским прозрачным дном (Corning Costar # 3904) в DMEM (Invitrogen №31331), 1 х НТ добавка, с 10% эмбриональной телячьей сывороткой и инкубировали при 5% СО2 и 37°С во влажной камере. Питательную среду заменяли бикарбонатным буфером Кребса-Рингера с 1 мМ ИБМК (изобутил-метил-ксантином) и инкубировали при 30°С в течение 30 минут.Соединения добавляли к конечному аналитическому объему 100 мкл и инкубировали в течение 30 минут при 30°С.Анализ останавливали, добавляя 50 мкл лизирующего реагента (Tris, NaCl, 1,5% Тритон Х100, 2,5% NP40, 10% NaNs) и 50 мкл растворов для обнаружения (20 мкМ мАт А1еха700-цАМФ 1:1, и 48 мкМ рутений-2-АНА-цАМФ), и встряхивали в течение 2 часов при комнатной температуре. Передачу энергии с временным разрешением измеряют с помощью планшет-ридера TRF (Evotec Technologies GmbH, Hamburg Germany), оснащенного ND:YAG лазером в качестве источника возбуждения. Планшет измеряют дважды с возбуждением при 355 нм и при эмиссии с задержкой 100 не и пропуском 100 не, время общего облучения 10 с при 730 (ширина полосы 30 нм) или 645 нм (ширина полосы 75 нм), соответственно. Измеренный сигнал при 730 нм следует скорректировать на фоновый сигнал рутения, прямое возбуждение Alexa и буфер управления. Сигнал РПЭФ (резонансного переноса энергии флуоресценции) рассчитывают следующим образом: РПЭФ=Т730-А1еха730-Р(Т645-В645) с Р=Ru730-B730/Ru645-B645, где Т730 является тест-лункой, измеренной при 730 нм, Т645 является тест-лункой, измеренной при 645 нм, В730 и В645 представляют собой буферы управления при 730 нм и 645 нм, соответственно. Содержание цАМФ определяют из функции калибровочной кривой, проходящей от 10 мкМ до 0,13 нМ цАМФ.
Значения ЕС5о определяли, используя анализ Activity Base (ID Business Solution, Limited). Значения ЕСбо для большого числа желчных кислот, полученные в ходе этого анализа, совпадали со значениями, опубликованными в научной литературе. Специфичность по отношению к GPBAR1 исследовали на нетрансфицированных клетках СНО в ходе такого же анализа, как указано выше.
Соединения по формуле I имели активность согласно приведенному выше анализу (ЕС50) предпочтительно 0,5 нМ до 10 мкМ, более предпочтительно 0,5 нМ до 1 мкМ и наиболее предпочтительно 0,5 нМ до 100 нМ.
Например, следующие соединения показали следующие значения EC50 человека в функциональном анализе цАМФ, описанном выше:
Соединения формулы I, а также их фармацевтически приемлемые соли можно применять в качестве лекарств, например, в форме фармацевтических препаратов для энтерального, парентерального или местного введения. Их можно вводить, например перорально, например в форме таблеток, таблеток, покрытых оболочкой, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий, ректально, например в форме суппозиториев, парентерально, например в форме инъекционных растворов или суспензий, или инфузионных растворов, или местно, например в форме мазей, кремов или масел. Предпочтительным является оральное введение.
Изготовление фармацевтических препаратов можно осуществлять способом, который хорошо знаком любому квалифицированному специалисту в данной области, внося описанные соединения формулы I и их фармацевтически приемлемые соли, возможно в сочетании с другими терапевтически ценными веществами, в галеновую лекарственную форму вместе с подходящими, нетоксичными, инертными, терапевтически совместимыми твердыми или жидкими носителями, и, если требуется, обычными фармацевтическими адъювантами.
Подходящими носителями являются не только неорганические носители, но также и органические носители. Таким образом, например лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли можно использовать в качестве носителей для таблеток, таблеток, покрытых оболочкой, драже и твердых желатиновых капсул. Подходящими носителями для мягких желатиновых капсул являются, например растительные масла, воски, жиры и полутвердые и жидкие полиолы (однако в зависимости от природы активного вещества в случае мягких желатиновых капсул носители обычно не требуются). Подходящими носителями для получения растворов и сиропов являются, например вода, полиолы, сахароза, инвертный сахар и подобные. Подходящими носителями для инъекционных растворов являются, например вода, спирты, полиолы, глицерин и растительные масла. Подходящими носителями для суппозиториев являются, например природные или отвержденные масла, воски, жиры и полужидкие или жидкие полиолы. Подходящими носителями для препаратов местного применения являются глицериды, полусинтетические и синтетические глицериды, гидрогенизированные масла, жидкие воски, жидкие парафины, жидкие жирные спирты, стерины, полиэтиленгликоли и производные целлюлозы.
Обычные стабилизаторы, консерванты, смачивающие и эмульгирующие агенты, улучшающие консистенцию агенты, улучшающие вкус агенты, соли для регулирования осмотического давления, буферные вещества, солюбилизаторы, красители и маскирующие агенты и антиоксиданты рассматриваются в качестве фармацевтических адъювантов.
Дозировка соединений формулы 1 может изменяться в широких пределах в зависимости от контролируемого заболевания, возраста и индивидуального состояния пациента и способа введения, и будет, конечно, подбираться по индивидуальным требованиям в каждом отдельном случае. Для взрослых пациентов рассматривается суточная доза приблизительно от 1 до 1000 мг, особенно приблизительно от 1 до 300 мг. В зависимости от тяжести заболевания и точности фармакокинетического профиля соединение может вводиться одной или несколькими суточными дозированными единицами, например 1-3 дозированными единицами.
Фармацевтические препараты обычно содержат около 1-500 мг, предпочтительно 1-100 мг соединения формулы I.
Следующие примеры служат для более подробной иллюстрации настоящего изобретения. Однако подразумевается, что они не ограничивают его объем никаким образом.
Примеры
Аббревиатуры:
CAS RN=регистрационный номер Химической реферативной службы, ДМАц=диметилацетамид, ДМАП=4-диметиламинопиридин, ДМФА=N,N-диметилформамид, ДМСО=диметилсульфоксид, Е1=электронный удар, ESI=ионизация электрораспылением, ч=час, HATU=1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-й]пиридиний-3-оксид гексафторфосфат, HCI=хлороводород, ВЭЖХ=высокоэффективная жидкостная хроматография, ISP=распыление положительных ионов (режим), ISN=распыление отрицательных ионов (режим), мин=минуты, LiOH=гидроксид лития, Мд804=сульфат магния, СДЖХ=жидкостная хроматография среднего давления, MS=масс-спектр, NаНСО3=гидрокарбонат натрия, NaOH=гидроксид натрия, Na2SO4=сульфат натрия, NH4Cl=хлорид аммония, ЯМР=ядерно-магнитный резонанс, КОН=гидроксид калия, Р=защитная группа, R=любая группа, Тком=комнатная температура, SiO2=силикагель, ТГФ=тетрагидрофуран, Х=галоген.
Пример 1
[4-(2,5-Дихлор-фенокси)-пиридин-3-ил]-(3,4-дигидро-2Н-хинолин-1-ил)-метанон
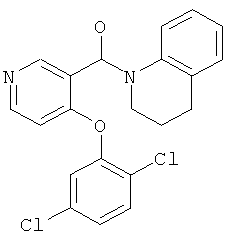
К раствору 0,16 г (0,56 ммоль) 4-(2,5-дихлор-фенокси)-никотиновой кислоты в 3 мл N,N-диметилформамида добавляли 0,225 г (0,59 ммоль) O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата (HATU, имеется в продаже, CAS RN 148893-10-1) и 0,29 мл (1,69 ммоль) N,N-диизопропилэтиламина. К светло-желтому раствору добавляли 0,07 мл (0,59 ммоль) 1,2,3,4-тетрагидрохинолина (имеется в продаже; CAS RN 635-46-1) и полученный в результате светло-желтый раствор перемешивали при комнатной температуре в течение 23 часов. Реакционную смесь выливали в воду и экстрагировали три раза этилацетатом. Объединенные органические слои промывали водой и солевым раствором, высушивали над сульфатом магния, фильтровали, обрабатывали с силикагелем и выпаривали. Полученный в результате порошок очищали с помощью хроматографии на силикагеле, используя систему СДЖХ (20 г силикагелевая колонка, CombiFlash Companion, Isco Inc.), элюируя градиентом н-гептан: этилацетат (100: 0 до 50: 50). Содержащие продукт фракции объединяли и выпаривали, что давало 165 мг (73%) требуемого соединения в виде светло-коричневого твердого вещества. MS (ESI): m/z=399,06 [М+Н]+.
Промежуточное соединение
4-(2,5-Дихлор-фенокси)-никотиновая кислота
К суспензии 10 г (63,47 ммоль) 4-хлорникотиновой кислоты (имеется в продаже; CAS RN 10177-29-4) и 11,38 г (69,81 ммоль) 2,5-дихлорфенола (имеется в продаже CAS RN 583-78-8) в 50 мл безводного N,N-диметилформамида добавляли 17,55 г (126,94 ммоль) карбоната калия, 1,21 г (6,35 ммоль) иодида меди (I) и 1,21 г (19,04 ммоль) нанопорошка меди. Зеленую суспензию перемешивали при 120°С (температура масляной бани) в течение 3 часов и затем охлаждали до 80°С.При этой температуре добавляли 400 мл воды, суспензию перемешивали при 80°С в течение 5 мин, фильтровали через Dicalite® speed plus (Acros) и осадок на фильтре дважды промывали 50 мл воды. Полученный в результате фильтрат экстрагировали три раза этилацетатом и затем рН доводили до 4-5, используя 140 мл 1 М водной соляной кислоты. Полученный в результате зеленый мутный раствор обрабатывали этилацетатом, перемешивали в течение 5 мин и фильтровали. Образующееся синее твердое вещество отфильтровывали и слои фильтрата разделяли. В водный слой добавляли твердый хлорид натрия и экстрагировали три раза этилацетатом. Объединенные органические слои промывали солевым раствором, высушивали над сульфатом магния, фильтровали и выпаривали. К полученному в результате твердом веществу добавляли 200 мл насыщенного водного раствора карбоната калия и 200 мл этилацетата. Водный слой экстрагировали дважды 200 мл этилацетата и рН доводили до 4, используя 25% водную соляную кислоту. Полученную в результате суспензию экстрагировали три раза этилацетатом. Объединенные органические слои промывали три раза водой и один раз солевым раствором, высушивали с сульфатом магния, фильтровали и выпаривали, что давало требуемое соединение в виде светло-коричневого твердого вещества (7,29 г, 40%). MS (ESI): m/z=281,8 [М+Н]+.
Пример 2
[4-(2,5-Дихлор-фенокси)-пиридин-3-ил]-(б,7-дифтор-3,4-дигидро-2H-хинолин-1-ил)-метанон
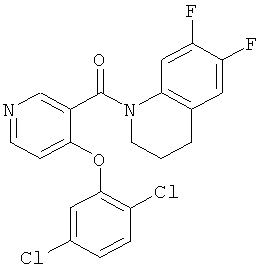
Указанное в заголовке соединение получали по аналогии с Примером 1 из 6,7-дифтор-1,2,3,4-тетрагидро-хинолина (имеется в продаже; CAS RN 953717-64-1) и 4-(2,5-дихлор-фенокси)-никотиновой кислоты (Пример 1, промежуточное соединение). Светло-коричневая смола (28%). MS (ESI): m/z=435,04 [M+H]+.
Пример 3 [4-(2,5-Дихлор-фенокси)-пиридин-3-ил]-(3,4-дигидро-2H-хиноксалин-1-ил)-метанон
Указанное в заголовке соединение получали по аналогии с Примером 1 из 1,2,3,4-тетрагидро-хиноксалина (имеется в продаже; CAS RN 3476-89-9) и 4-(2,5-дихлор-фенокси)-никотиновой кислоты (Пример 1, промежуточное соединение). Светло-желтая пена (99%). MS (ESI): m/z=400,06 [M+H]+.
Пример 4
[4-(2,5-Дихлор-фенокси)-пиридин-3-ил]-(4-метил-3,4-дигидро-2H-хиноксалин-1-ил)-метанон
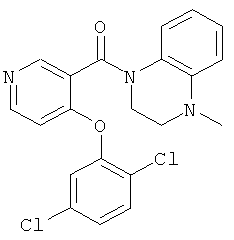
Раствор 0,12 г (0,30 ммоль) [4-(2,5-дихлор-фенокси)-пиридин-3-ил]-(3,4-дигидро-2Н-хиноксалин-1-ил)-метанона (Пример 3) в 1 мл N,N-диметилформамида обрабатывали 0,014 г (0,32 ммоль) гидрида натрия (60% суспензия в минеральном масле), после чего начиналось выделение газа и происходило изменение цвета. После перемешивания в течение 30 мин, добавляли 0,022 мл (0,36 ммоль) йодметана. После перемешивания в течение 7 часов при комнатной температуре реакционную смесь выливали в воду и экстрагировали три раза этилацетатом. Объединенные органические слои промывали водой и солевым раствором, высушивали над сульфатом магния, фильтровали, обрабатывали с силикагелем и выпаривали досуха. Полученный в результате порошок очищали с помощью хроматографии на силикагеле, используя систему СДЖХ (20 г силикагелевая колонка, CombiFlash Companion, Isco Inc.), элюируя градиентом н-гептан: этилацетат (100: 0 до 50: 50), что давало требуемое соединение в виде оранжевого твердого вещества (32 мг, 26%). MS (ESI): m/z=414,077 [M+H]+.
Пример 5
Этиловый эфир2-{4-[4-(2,5-дихлор-фенокси)-пиридин-3-карбонил]-3,4-дигидро-2Н-хиноксалин-1 -илметил}-циклопропанкарбоновой кислоты
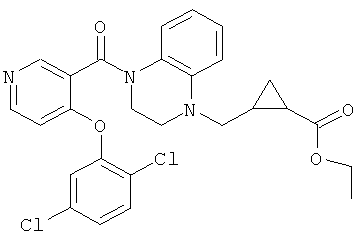
К раствору 0,10 г (0,25 ммоль) [4-(2,5-дихлор-фенокси)-пиридин-3-ил]-(3,4-дигидро-2Н-хиноксалин-1-ил)-метанона (Пример 3) добавляли 0,036 г (0,25 ммоль) этил 2-формил-1-циклопропан-карбоксилата (имеется в продаже, CAS RN 20417-61-2), 0,008 г (0,026 ммоль) дибутилолово дихлорида и 0,06 мл (0,50 ммоль) фенилсилана. Полученный в результате раствор нагревали в течение 10 мин в микроволновой печи при 150°С.Светло-желтый раствор выпаривали и растворяли в ацетонитриле, содержащем несколько капель N,N-диметилформамида. Суспензию фильтровали, используя шприцевой микрофильтр, и очищали с помощью системы препаративной ВЭЖХ (колонка Phenomenex Gemini), используя градиент ацетонитрил: вода (содержащая 0,05% муравьиной кислоты) (10: 90 до 98: 2), что давало 60 мг (46%) требуемого соединения в виде светло-коричневой пены. MS (ESI): m/z=526,13 [М+Н]'.
Пример 6
(4-Циклопропилметил-3,4-дигидро-2Н-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-метанон
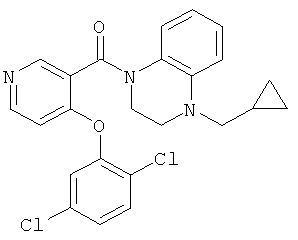
Указанное в заголовке соединение получали по аналогии с Примером 5 из [4-(2,5-дихлор-фенокси)-пиридин-3-ил]-(3,4-дигидро-2Н-хиноксалин-1-ил)-метанона (Пример 3), циклопропанкарбоксальдегида (имеется в продаже; CAS RN 1489-69-6), дибутилолово дихлорида и фенилсилана. Светло-коричневое твердое вещество (53%). MS (ESI): m/z=454,109 [М+Н]+.
Пример 7
[4-(2,5-Дихлор-фенокси)-пиридин-3-ил]-(4-метансульфонил-3,4-дигидро-2H-хиноксалин-1-ил)-метанон
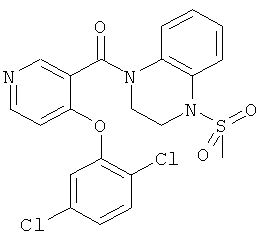
К раствору 0,10 г (0,25 ммоль) [4-(2,5-дихлор-фенокси)-пиридин-3-ил]-(3,4-дигидро-2H-хиноксалин-1-ил)-метанона (Пример 3) в 2 мл дихлорметана добавляли 0,08 мл (0,50 ммоль) N,N-диизопропилэтиламина, затем по каплям добавляли 0,02 мл (0,27 ммоль) метансульфонилхлорида. Через 16 часов добавляли еще 0,08 мл (0,50 ммоль) N,N-диизопропилэтиламина и 0,02 мл (0,27 ммоль) метансульфонилхлорида. Реакционную смесь выливали в воду и экстрагировали три раза дихлорметаном. Объединенные органические слои промывали солевым раствором, высушивали над сульфатом магния, фильтровали, обрабатывали с силикагелем и выпаривали. Полученный в результате порошок очищали с помощью хроматографии на силикагеле, используя систему СДЖХ (10 г силикагелевая колонка, CombiFlash Companion, Isco Inc.), элюируя градиентом н-гептан: этилацетат (100: 0 до 50: 50), затем с помощью повторной хроматографии на 10 г силикагелевой колонке, используя градиент н-гептан: трет-бутилметиловый эфир (100: 0 до 25: 75), что давало 31 мг (26%) требуемого соединения в виде светло-коричневой пены. MS (ESI): m/ z=478,039 [М+Н]+.
Пример 8
(4-Циклопропил-3,4-дигидро-2Н-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-метанон
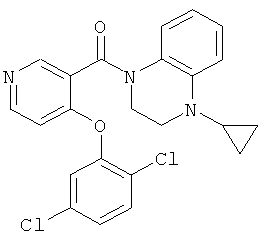
Указанное в заголовке соединение получали по аналогии с Примером 1 из 4-(2,5-дихлор-фенокси)-никотиновой кислоты (Пример 1, промежуточное соединение) и 1-циклопропил-1,2,3,4-тетрагидро-хиноксалина. Светло-желтая пена (72%). MS (ESI): m/z=440,092 [M+H]+.
Промежуточные соединения
а) 1 -Циклопропил-1,2.3.4-тетрагидро-хиноксалин
К перемешиваемой суспензии 1-циклопропил-1,4-дигидро-хиноксалин-2,3-диона (10,0 г, 49,45 ммоль, 1,0 эквив.) в тетрагидрофуране (500 мл) добавляли по каплям 1 М раствор комплекса боран-тетрагидрофуран (108,8 мл, 108,8 ммоль, 2,2 эквив.; [CAS RN 14044-65-6]) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворитель удаляли выпариванием при пониженном давлении и неочищенную реакционную смесь экстрагировали из насыщенного водного раствора гидрокарбоната натрия (100 мл) этилацетатом (три раза 100 мл). Объединенные органические фазы высушивали над сульфатом натрия и очищали с помощью колоночной хроматографии на силикагеле, используя систему СДЖХ (CombiFlash Companion, Isco Inc.), элюируя градиентом н-гептан: этилацетат, что давало 4,2 г (49%) указанного в заголовке соединения в виде светло-желтого твердого вещества. MS (ISP): m/z=175,4 [М+Н]+.
b) 1-Циклопропил-1,4-дигидро-хиноксалин-2.3-дион
К раствору 1-циклопропил-4-гидрокси-1,4-дигидро-хиноксалин-2,3-диона (31,0 г, 0,14 моль, 1,0 эквив.) в N,N-диметилформамиде (250 мл) добавляли трифенилфосфин (55,9 г, 0,21 моль, 1,5 эквив.; [CAS RN 603-35-0]) и реакционную смесь перемешивали при 135°С в течение 4 часов. Реакционную смесь охлаждали до 0°С и добавляли дихлорметан (400 мл). Суспензию перемешивали в течение 30 мин, фильтровали и промывали дихлорметаном (200 мл), получая 23,8 г (83%) указанного в заголовке соединения в виде белого твердого вещества. MS (ISN): m/z=203,1 [М+Н]+.
c) 1-Циклопропил-4-гидрокси-1,4-дигидро-хиноксалин-2.3-дион К раствору метилового эфира Л/-циклопропил-N-(2-нитро-фенил)-щавелевой кислоты (45,0 г, 0,17 моль, 1,0 эквив.) в метаноле (400 мл) добавляли палладий на угле (4,52 г, 0,0043 моль, 0,025 эквив.; 10% Pd/C; [CAS RN 7440-05-3]) и реакционную смесь перемешивали в атмосфере водорода (1,2 бар) при комнатной температуре в течение 2 часов. Реакционную смесь разбавляли этилацетатом (400 мл), фильтровали через Celite® и смесь растворителей удаляли выпариванием при пониженном давлении, что давало 31,2 г (84%) указанного в заголовке соединения в виде светло-желтого твердого вещества. MS (ISN): m/z=219,1 [М+Н]+.
d) Метиловый эфир N-циклопропил-N-(2-нитро-фенил)-щавелевой кислоты К раствору циклопропил-(2-нитро-фенил)-амина (32,0 г, 0,18 моль, 1,0 эквив.) в дихлорметане (320 мл) медленно добавляли триэтиламин (18,2 г, 25,0 мл, 0,18 моль, 1,0 эквив.; [CAS RN 121-44-8]) и метилоксалилхлорид (22,0 г, 16,5 мл, 0,18 моль, 1,0 эквив.; [CAS RN 5781-53-3]) при 0°С.После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 72 часов. Реакционную смесь экстрагировали из насыщенного водного раствора гидрокарбоната натрия (300 мл) дихлорметаном (три раза 200 мл) и объединенные органические фазы высушивали над сульфатом магния. Очистка с помощью колоночной хроматографии на силикагеле с использованием системы СДЖХ (CombiFlash Companion, Isco Inc.) при элюировании смесью н-гептан: этилацетат (2:1) давала 45,2 г (95%) указанного в заголовке соединения в виде белого твердого вещества. MS (ISP): m/z=265,1 [М+Н]+.
e) Циклопропил-(2-нитро-фенил)-амин
К циклопропиламину (27,3 г, 33,1 мл, 0,48 моль, 2,25 эквив.; [CAS RN 765-30-0]) добавляли по каплям 2-фторнитробензол (30,0 г, 0,21 моль, 1,0 эквив.; [CAS RN 1493-27-2]) в течение 1 часа при 30°С и продолжали перемешивать реакционную смесь при комнатной температуре в течение 18 часов. Реакционную смесь экстрагировали из насыщенного водного раствора гидрокарбоната натрия (500 мл) этилацетатом (три раза 300 мл) и объединенные органические фазы высушивали над сульфатом магния. Очистка с помощью колоночной хроматографии на силикагеле с использованием системы СДЖХ (CombiFlash Companion, Isco Inc.) при элюировании смесью м-гептан: этилацетат (9:1) давала 32,4 г (86%) указанного в заголовке соединения в виде желтого масла. MS (ISP): m/z=178,0 [М+Н]+.
Пример 9
(6-Хлор-4-циклопропил-7-фтор-3,4-дигидро-2H-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-метанон
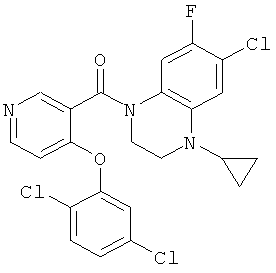
Указанное в заголовке соединение получали по аналогии с Примером 1 из 4-(2,5-дихлор-фенокси)-никотиновой кислоты (Пример 1, промежуточное соединение) и 7-хлор-1-циклопропил-6-фтор-1,2,3,4-тетрагидро-хиноксалина, используя градиент н-гептан: этилацетат (100: 0 до 0: 100) для хроматографической очистки. Светло-желтое твердое вещество (19%). MS (ESI): m/z=494,041 [M+H]+.
Промежуточные соединения
а) 7-хлор-1-циклопропил-6-фтор-1,2.3.4-тетрагидро-хиноксалин К суспензии 390 мг (1,532 ммоль) 7-хлор-1-циклопропил-6-фтор-1,4-дигидро-хиноксалин-2,3-диона в 20 мл тетрагидрофурана добавляли 3,37 мл (3,369 ммоль) 1 М комплекса боран-тетрагидрофуран. Реакционную смесь перемешивали в течение 6 часов при комнатной температуре. Реакционную смесь выливали в 30 мл 10% водного раствора гидрокарбоната натрия и 30 мл этилацетата. Смесь перемешивали в течение 30 мин при комнатной температуре и слои разделяли. Водный слой экстрагировали второй раз 30 мл этилацетата. Органические слои промывали 30 мл солевого раствора, высушивали над сульфатом магния, фильтровали и концентрировали в вакууме. Соединение очищали с помощью хроматографии на силикагеле, используя систему СДЖХ (CombiFlash Companion, Isco Inc.), элюируя градиентом н-гептан: этилацетат (100: 0 до 40: 60), что давало 211 мг (61%) требуемого соединения в виде белого твердого вещества. MS (ESI): m/z=225,0 [М+Н]+.
b) 7-Хлор-1-циклопропил-6-фтор-1,4-дигидро-хиноксалин-2.3-дион К раствору 685 мг (2,531 ммоль) 6-хлор-4-циклопропил-7-фтор-1-гидрокси-1,4-дигидро-хиноксалин-2,3-диона в 10 мл N,N-диметилформамида добавляли 996 мг (3,796 ммоль) трифенилфосфина. Реакционную смесь перемешивали в течение 4 часов при 135°С.Реакционную смесь концентрировали в вакууме (15 мбар / 55°С). Остаток суспендировали в 20 мл дихлорметана. Суспензию перемешивали в течение 30 мин при 0°С, фильтровали и промывали 20 мл дихлорметана. Белое твердое вещество (63%). MS (ESI): m/z=255,034 [М+Н]+.
c) 6-Хлор-4-циклопропил-7-фтор-1-гидрокси-1,4-дигидро-хиноксалин-2,3-дион
К раствору 1,2 г (3,789 ммоль) метилового эфира N-(5-хлор-4-фтор-2-нитро-фенил)-N-циклопропил-щавелевой кислоты в 15 мл МеОН добавляли 120 мг 10% Pd(C) на угле. Реакционную смесь перемешивали в течение 2 часов в атмосфере водорода при 1,2 бар при комнатной температуре. Добавляли 30 мл этилацетата и реакционную смесь фильтровали через Dicalite® speed plus (Acros) и концентрировали в вакууме. Светло-желтое твердое вещество (68%). MS (ESI): m/z=269,014 [М+Н]+.
d) Метиловый эфир N-(5-хлор-4-фтор-2-нитро-Фенил)-N-циклопропил-щавелевой кислоты
К раствору 1,0 г (4,336 ммоль) (5-хлор-4-фтор-2-нитро-фенил)-циклопропил-амина (J. Med. Chem. 1992, 35(8), 1385) в 15 мл дихлорметана добавляли 439 мг (4,336 ммоль) триэтиламина и 531 мг (4,336 ммоль) монометилоксалилхлорида при 0°С.Реакционную смесь перемешивали в течение 72 часов при комнатной температуре. Реакционную смесь выливали в 30 мл 10% гидрокарбоната натрия в воде и 30 мл дихлорметана. Слои разделяли. Водный слой экстрагировали второй раз 30 мл дихлорметана. Органические слои промывали 30 мл солевого раствора, высушивали над сульфатом магния, фильтровали и концентрировали в вакууме. Остаток очищали с помощью хроматографии на силикагеле, используя систему СДЖХ (CombiFlash Companion, Isco Inc.), элюируя градиентом н-гептан: этилацетат (100: 0 до 40: 60), что давало соединение в виде светло-желтого твердого вещества (90%). MS (ESI): m/z=316,0 [М+Н]+.
Пример 10
[4-(2,5-Дихлор-фенокси)-1-окси-пиридин-3-ил]-(3,4-дигидро-2H-хинолин-1-ил)-метанон
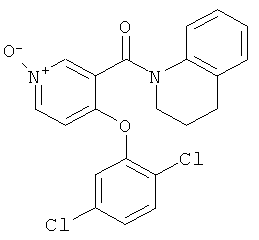
К ледяному раствору 0,27 г (0,68 ммоль) [4-(2,5-дихлор-фенокси)-пиридин-3-ил]-(3,4-дигидро-2Н-хинолин-1-ил)-метанона (Пример 1) в 3 мл дихлорметана добавляли 0,189 г (0,84 ммоль) м-хлорнадбензойной кислоты (Aldrich, CAS RN 937-14-4). Светло-желтый раствор перемешивали при комнатной температуре в течение 2,75 часа и затем выливали в насыщенный водный раствор гидрокарбоната натрия и экстрагировали три раза дихлорметаном. Объединенные органические слои промывали солевым раствором, высушивали над сульфатом магния, фильтровали, обрабатывали с силикагелем и выпаривали. Полученный в результате порошок очищали с помощью хроматографии на силикагеле, используя систему СДЖХ (CombiFlash Companion, Isco Inc.), элюируя градиентом н-гептан:
этилацетат: метанол (100: 0: 0 до 0: 100: 0 до 0: 0: 100), что давало 279 мг (99%) требуемого соединения в виде светло-коричневой пены. MS (ESI): m/z=415,061 [М+Н]+.
Пример 11
(6-Хлор-4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-метанон
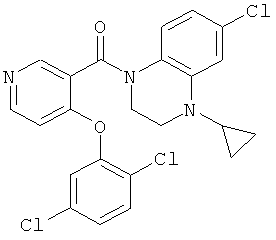
К ледяной суспензии 0,61 г (1,39 ммоль) (4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-метанона (Пример 8) в 3 мл дихлорметана добавляли 0,388 г (1,73 ммоль) м-хлорнадбензойной кислоты (Aldrich, CAS RN 937-14-4). Охлаждающую баню удаляли, реакционную смесь перемешивали при комнатной температуре в течение 45 мин, выливали в насыщенный раствор водного гидрокарбоната натрия и экстрагировали три раза дихлорметаном. Органические слои промывали насыщенным раствором водного гидрокарбоната натрия и солевым раствором, высушивали над сульфатом магния, фильтровали, обрабатывали с силикагелем и выпаривали. Полученный в результате порошок очищали с помощью хроматографии на силикагеле, используя систему СДЖХ (20 г силикагелевая колонка, CombiFlash Companion, Isco Inc.) с градиентом н-гептан: этилацетат: метанол (100: 0: 0 до 0: 100: 0 до 0: 0: 100). Из полученной в результате светло-коричневой пены (0,51 г; MS (ESI): m/z=456,087 [М+НЦ 0,20 г (0,44 ммоль) растворяли в 8 мл тетрагидрофурана и добавляли 0,09 мл (0,44 ммоль) гексаметилдисилазана и 0,08 мл (1,1 ммоль) метилхлорформиата. Полученный в результате коричневый мутный раствор перемешивали в течение 1,5 часов при комнатной температуре, выливали в насыщенный водный раствор гидрокарбоната натрия и экстрагировали три раза этилацетатом. Органические слои промывали солевым раствором, высушивали над сульфатом магния, фильтровали, обрабатывали с силикагелем и выпаривали. Полученный в результате порошок очищали с помощью хроматографии на силикагеле, используя систему СДЖХ (10 г силикагелевая колонка, CombiFlash Companion, Isco Inc.), элюируя градиентом н-гептан: этилацетат (100: 0 до 25: 75). Полученное в результате оранжевое твердое вещество (0,13 г) растворяли в ацетонитриле и нескольких каплях N,N-диметилформамида, фильтровали, используя шприцевой микрофильтр и очищали два раза с помощью системы препаративной ВЭЖХ (колонка Phenomenex Gemini), используя градиент ацетонитрил: вода (содержащая 0,05% муравьиной кислоты) (10: 90 до 98: 2), что давало 65 мг (31%) указанного в заголовке соединения в виде светло-коричневой пены. MS (ESI): m/z=474,054 [М+Н]+.
Пример 12 4-(2,5-Дихлор-фенокси)-N-(5-фтор-2-метокси-фенил)-N-метил-никотинамид
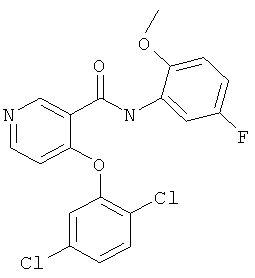
К ледяной суспензии 0,07 г (0,17 ммоль) 4-(2,5-дихлор-фенокси)-N-(5-фтор-2-метокси-фенил)-никотинамида в 1 мл тетрагидрофурана добавляли 0,019 г (0,17 ммоль) трет-бутилата калия, затем 10 мкл (0,18 ммоль) йодметана. Суспензию перемешивали при комнатной температуре в течение 16 часов, выливали в 10% водный раствор лимонной кислоты и экстрагировали три раза этилацетатом. Объединенные органические слои промывали солевым раствором, высушивали над сульфатом магния, фильтровали, обрабатывали с силикагелем и выпаривали досуха. Полученный в результате порошок очищали с помощью хроматографии на силикагеле, используя систему СДЖХ (CombiFlash Companion, Isco Inc.), элюируя градиентом н-гептан: этилацетат (100: 0 до 50: 50), что давало 32 мг (44%) указанного в заголовке соединения в виде белого твердого вещества. MS (ESI): m/z=421,052[M+H]+.
Промежуточное соединение
4-(2.5-Дихлор-фенокси)-N-(5-фтор-2-метокси-фенил)-никотинамид Указанное в заголовке соединение получали по аналогии с Примером 1 из 4-(2,5-дихлор-фенокси)-никотиновой кислоты (Пример 1, промежуточное соединение) и 5-фтор-2-метокси-фениламина (имеется в продаже; CAS RN 1978-39-8). Белое твердое вещество (74%). MS (ESI): m/z=407,036 [M+H]+.
Пример 13 4-(2,5-Дихлор-фенокси)-N-метил-N-о-толил-никотинамид
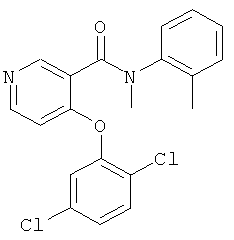
Указанное в заголовке соединение получали по аналогии с Примером 1 из 4-(2,5-дихлор-фенокси)-никотиновой кислоты (Пример 1, промежуточное соединение) и N-метил-о-толуидина (имеется в продаже; CAS RN 611-21-2), используя градиент н-гептан: этилацетат (100:0 до 40:60). Соединение дополнительно очищали в ходе повторной препаративной ВЭЖХ (колонка Phenomenex Gemini), используя градиент ацетонитрил: вода (содержащая 0,05% муравьиной кислоты) (10:90 до 98:2). Белое твердое вещество (35%). MS (ESI): m/z=387,066 [М+Н]+.
Пример 14 4-(2,5-Дихлор-фенокси)-N-(2-метокси-фенил)-N-метил-никотинамид
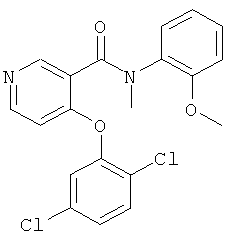
Указанное в заголовке соединение получали по аналогии с Примером 1 из 4-(2,5-дихлор-фенокси)-никотиновой кислоты (Пример 1, промежуточное соединение) и 2-метокси-N-метиланилина (имеется в продаже; CAS RN 10541-78-3), используя градиент н-гептан: этилацетат (100: 0 до 40: 60). Соединение дополнительно очищали в ходе повторной препаративной ВЭЖХ (колонка Phenomenex Gemini), используя градиент ацетонитрил: вода (содержащая 0,05% муравьиной кислоты) (50: 50 до 95: 5). Белое твердое вещество (57%). MS (ESI): m/z=403,062 [M+H]+.
Пример 15 4-(2,5-Дихлор-фенокси)-N-(2-метокси-пиридин-3-ил)-N-метил-никотинамид
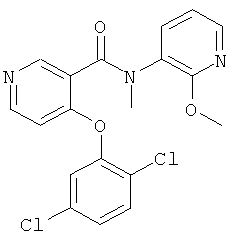
Указанное в заголовке соединение получали по аналогии с Примером 12 из 4-(2,5-дихлор-фенокси)-N-(2-метокси-пиридин-3-ил)-никотинамида. Соединение очищали с помощью препаративной ВЭЖХ (колонка Phenomenex Gemini), используя градиент ацетонитрил: вода (50: 50 до 95: 5). Светло-желтое твердое вещество (37%). MS (ESI): m/z=404,057 [М+Н]+.
Промежуточное соединение
4-(2.5-Дихлор-фенокси)-N-(2-метокси-пиридин-3-ил)-никотинамид Указанное в заголовке соединение получали по аналогии с Примером 1 из 4-(2,5-дихлор-фенокси)-никотиновой кислоты (Пример 1, промежуточное соединение) и 3-амино-2-метоксипиридина (имеется в продаже, CAS RN 20265-38-7). Соединение очищали с помощью препаративной ВЭЖХ (колонка Phenomenex Gemini), используя градиент ацетонитрил: вода (10: 90 до 95: 5). Светло-коричневое твердое вещество (28%). MS (ESI): m/z=390,040 [M+H]+.
Пример 16 4-(2,5-Дихлор-фенокси)-N-(2-диметиламино-фенил)-N-метил-никотинамид
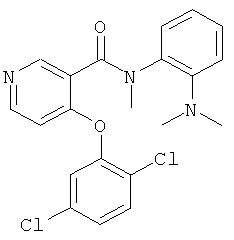
Указанное в заголовке соединение получали по аналогии с Примером 12 из 4-(2,5-дихлор-фенокси)-N-(2-диметиламино-фенил)-никотинамида. Соединение очищали с помощью хроматографии на силикагеле, используя систему СДЖХ (CombiFlash Companion, Isco Inc.), элюируя градиентом н-гептан: этилацетат (100:0 до 50:50), затем с помощью повторной хроматографии на системе препаративной ВЭЖХ (колонка Phenomenex Gemini), элюируя градиентом ацетонитрил: вода (содержащая 0,05% муравьиной кислоты) (10: 90 до 98: 2). Бесцветное масло (47%). MS (ESI): m/z=416,092 [M+H]+.
Промежуточное соединение
4-(2.5-Дихлор-фенокси)-N-(2-диметиламино-фенил)-никотинамид Указанное в заголовке соединение получали по аналогии с Примером 1 из 4-(2,5-дихлор-фенокси)-никотиновой кислоты (Пример 1, промежуточное соединение) и N,N-диметилбензол-1,2-диамина (имеется в продаже, CAS RN 2836-03-5).
Соединение очищали с помощью препаративной ВЭЖХ (колонка Phenomenex Gemini), используя градиент ацетонитрил: вода (содержащая 0,05% муравьиной кислоты) (10: 90 до 98: 2). Светло-коричневая пена (71%). MS (ESI): m/z=402,078 [М+НГ.
Пример 17 4-(2,5-Дихлор-фенокси)-А/-метил-N-(2-пиперидин-1-ил-фенил)-никотинамид
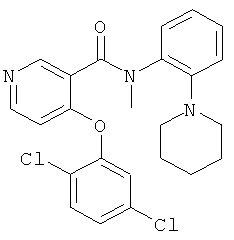
Указанное в заголовке соединение получали по аналогии с Примером 12 из 4-(2,5-дихлор-фенокси)-N-(2-пиперидин-1-ил-фенил)-никотинамида. Соединение очищали с помощью препаративной ВЭЖХ (колонка Phenomenex Gemini), используя градиент ацетонитрил: вода (содержащая 0,05% муравьиной кислоты) (10: 90 до 98: 2). Белая пена (88%). MS (ESI): m/z=456,125 [M+H]+.
Промежуточное соединение
4-(2.5-Дихлор-фенокси)-N-(2-пиперидин-1-ил-фенил)-никотинамид Указанное в заголовке соединение получали по аналогии с Примером 1 из 4-(2,5-дихлор-фенокси)-никотиновой кислоты (Пример 1, промежуточное соединение) и 2-пиперидин-1-ил-фениламина (имеется в продаже, CAS RN 39643-31-7). Белая пена (90%). MS (ESI): m/z=442,108 [M+H]+.
Пример 18 N-(3,5-Бис-трифторметил-фенил)-4-(2,5-дихлор-фенокси)-N-метил-никотинамид
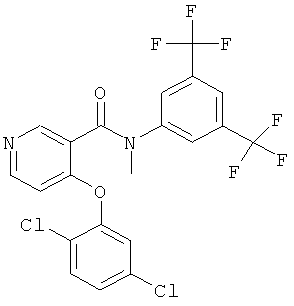
Указанное в заголовке соединение получали по аналогии с Примером 12 из N-(3,5-бис-трифторметил-фенил)-4-(2,5-дихлор-фенокси)-никотинамида. Соединение очищали с помощью препаративной ВЭЖХ (колонка Phenomenex Gemini), используя градиент ацетонитрил: вода (содержащая 0,05% муравьиной кислоты) (10:90 до 98:2). Белая пена (35%). MS (ESI): m/z=509,025 [M+H]+.
Промежуточное соединение
Л/-(3.5-Бис-трифторметил-фенил)-4-(2.5-дихлор-фенокси)-никотинамид Указанное в заголовке соединение получали по аналогии с Примером 1 из 4-(2,5-дихлор-фенокси)-никотиновой кислоты (Пример 1, промежуточное соединение) и 3,5-бис(трифторметил)анилина (имеется в продаже; CAS RN 328-74-5), используя градиент н-гептан: этилацетат (100: 0 до 40: 60) для хроматографической очистки. Светло-желтая пена (44%). MS (ESI): m/z=495,010 [M+H]+.
Пример 19 4-(2,5-Дихлор-фенокси)-N-(4,5-дифтор-2-метокси-фенил)-N-метил-никотинамид
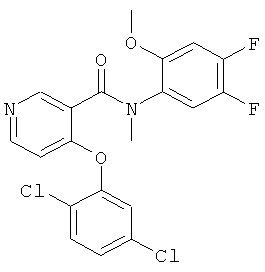
Указанное в заголовке соединение получали по аналогии с Примером 12 из 4-(2,5-дихлор-фенокси)-N-(4,5-дифтор-2-метокси-фенил)-никотинамида. Остаток очищали с помощью препаративной ВЭЖХ (колонка Phenomenex Gemini), используя градиент ацетонитрил: вода (содержащая 0,05% муравьиной кислоты) (10:90 до 98:2). Белое твердое вещество (51%). MS (ESI): m/z=439,042 [M+H]+.
Промежуточное соединение
4-(2,5-Дихлор-фенокси)-N-(4,5-дифтор-2-метокси-Фенил)-никотинамид
Указанное в заголовке соединение получали по аналогии с Примером 1 из 4-(2,5-дихлор-фенокси)-никотиновой кислоты (Пример 1, промежуточное соединение) и 4,5-дифтор-2-метоксианилина (имеется в продаже; CAS RN 1017779-71-3), используя градиент н-гептан: этилацетат (100:0 до 40:60) для хроматографической очистки. Белое твердое вещество (80%). MS (ESI): m/z=425,027 [M+H]+.
Пример 20
N-(5-Хлор-2-диметиламино-фенил)-4-(2,5-дихлор-фенокси)-N-метил-никотинамид
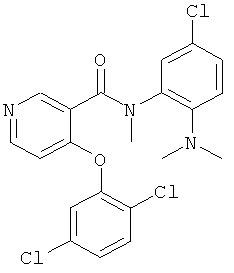
Указанное в заголовке соединение получали по аналогии с Примером 12 из N-(5-хлор-2-диметиламино-фенил)-4-(2,5-дихлор-фенокси)-никотинамида. Белая пена (85%). MS (ESI): m/z=450,054 [M+H]+.
Промежуточное соединение
N-(5-Хлор-2-диметиламино-фенил)-4-(2.5-дихлор-фенокси)-никотинамид Указанное в заголовке соединение получали по аналогии с Примером 1 из 4-(2,5-дихлор-фенокси)-никотиновой кислоты (Пример 1, промежуточное соединение), (2-амино-4-хлорфенил)диметиламина дигидрохлорида (имеется в продаже, CAS RN 183251-88-9), используя 5 молярных эквивалентов основания и используя градиент н-гептан: этилацетат (100: 0 до 50: 50) для хроматографической очистки. Белое твердое вещество (72%). MS (ESI): m/z=436,038 [М+Н]+.
Пример 21 4-(2,5-Дихлор-фенокси)-N-(4,5-дифтор-2-метиламино-фенил)-N-метил-никотинамид
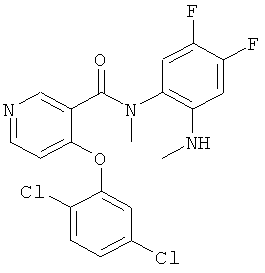
Раствор 100 мг (0,186 ммоль) трет-бутилового эфира (2-{[4-(2,5-дихлор-фенокси)-пиридин-3-карбонил]-метил-амино}-4,5-дифтор-фенил)-метил-карбаминовой кислоты в 1,5 мл 1 М водной соляной кислоты перемешивали в течение 4 часов при 90°С.Реакционную смесь охлаждали до комнатной температуры и добавляли 2 мл 1 М водного раствора гидроксида натрия и 1 мл ацетонитрила. Светло-желтый раствор сразу очищали с помощью препаративной ВЭЖХ (колонка Phenomenex Gemini) с градиентом ацетонитрил: вода (содержащая 0,05% муравьиной кислоты) (10:90 до 98:2), что давало 18 мг (22%) указанного в заголовке соединения в виде бесцветного твердого вещества. MS (ESI): m/z=438,058 [М+Н]+.
Промежуточные соединения
a) трет-Бутиловый эфир (2-{[4-(2.5-дихлор-сренокси)-пиридин-3-карбонил1-метил-амино}-4.5-дифтор-фенил)-метил-карбаминовой кислоты
Указанное в заголовке соединение получали по аналогии с Примером 12 из трет-бутилового эфира (2-{[4-(2,5-дихлор-фенокси)-пиридин-3-карбонил]-амино}-4,5-дифтор-фенил)-карбаминовой кислоты, используя градиент н-гептан:
этилацетат (100: 0 до 0: 100) для хроматографической очистки. Бесцветная пена (63%). MS (ESI): m/z=538,111 [M+H]+.
b) трет-Бутиловый эфир (2-{Г4-(2.5-дихлор-фенокси)-пиридин-3-карбонил]-амино}-4,5-дифтор-фенил)-карбаминовой кислоты
Указанное в заголовке соединение получали по аналогии с Примером 1 из 4-(2,5-дихлор-фенокси)-никотиновой кислоты (Пример 1, промежуточное соединение) и трет-бутилового эфира (2-амино-4,5-дифтор-фенил)-карбаминовой кислоты (W02008000643A1), используя градиент н-гептан: этилацетат (100: 0 до 40: 60) для хроматографической очистки. Светло-желтое твердое вещество (73%). MS (ESI): m/z=510,080 [М+Н]+.
Пример 22
4-(2,5-Дихлор-фенокси)-N-(1,2,3,4-тетрагидро-хинолин-8-ил)-никотинамид
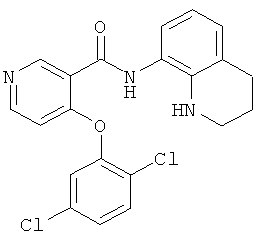
Указанное в заголовке соединение получали по аналогии с Примером 1 из 4-(2,5-дихлор-фенокси)-никотиновой кислоты (Пример 1, промежуточное соединение) и 1,2,3,4-тетрагидро-хинолин-6-иламина (имеется в продаже; CAS RN 54012-92-9), используя градиент н-гептан: этилацетат (100: 0 до 0: 100) для хроматографической очистки. Светло-желтое твердое вещество (88%). MS (ESI): m/z=414,077 [М+Н]+.
Пример 23
4-(2,5-Дихлор-фенокси)-N-(2-диметиламино-пиридин-3-ил)-N-метил-никотинамид
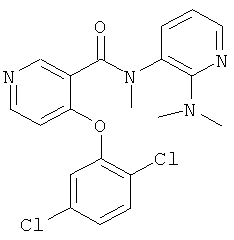
Указанное в заголовке соединение получали по аналогии с Примером 12 из 4-(2,5-дихлор-фенокси)-N-(2-диметиламино-пиридин-3-ил)-никотинамида, используя градиент н-гептан: этилацетат (100:0 до 0:100) для хроматографической очистки. Бесцветное масло (67%). MS (ESI): m/z=417,088 [М+Н]+.
Промежуточное соединение
4-(2.5-Дихлор-фенокси)-N-(2-диметиламино-пиридин-3-ил)-никотинамид
Указанное в заголовке соединение получали по аналогии с Примером 1 из 4-(2,5-дихлор-фенокси)-никотиновой кислоты (Пример 1, промежуточное соединение), 3-амино-2-(диметиламино)пиридина (имеется в продаже, CAS RN 5028-25-1), используя градиент н-гептан: этилацетат (100:0 до 0:100) для хроматографической очистки. Светло-желтое твердое вещество (73%). MS (ESI): m/z=403,072 [М+Н]+.
Пример 24
4-(2,5-Дихлор-фенокси)-N-метил-N-(1,2,3,4-тетрагидро-хинолин-8-ил)-никотинамид
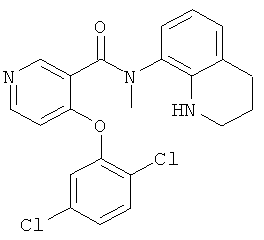
Указанное в заголовке соединение получали по аналогии с Примером 12 из 4-(2,5-дихлор-фенокси)-N-(1,2,3,4-тетрагидро-хинолин-8-ил)-никотинамида (Пример 22), используя градиент н-гептан: этилацетат (100: 0 до 0: 100) для хроматографической очистки. Бесцветная пена (42%). MS (ESI): m/z=428,092 [М+Н]+.
Пример 25
N-[4-Хлор-2-(циклопропил-метил-амино)-5-фтор-фенил]-4-(2,5-дихлор-фенокси)-N-метил-никотинамид
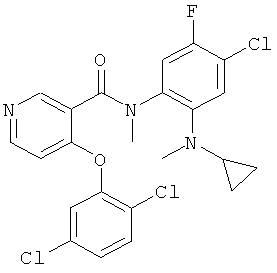
Указанное в заголовке соединение получали по аналогии с Примером 12 из N-[4-хлор-2-(циклопропил-метил-амино)-5-фтор-фенил]-4-(2,5-дихлор-фенокси)-никотинамида, используя градиент н-гептан: этилацетат (100: 0 до 0: 100) для хроматографической очистки. Бесцветное твердое вещество (79%). MS (ESI): m/z=496,058 [M+H]+.
Промежуточные соединения
а) N-[4-Хлор-2-(циклопропил-метил-амино)-5-фтор-фенил1-4-(2,5-дихлор-фенокси)-никотинамид
Указанное в заголовке соединение получали по аналогии с Примером 1 из 4-(2,5-дихлор-фенокси)-никотиновой кислоты (Пример 1, промежуточное соединение) и 4-хлор-N2-циклопропил-5-фтор-N2-метил-бензол-1,2-диамина, используя градиент н-гептан: этилацетат (100:0 до 30:70) для хроматографической очистки. Бесцветное твердое вещество (70%). MS (ESI): m/z=446,083 [M+H]+.
b) 4-Хлор-N2-циклопропил-5-фтор-N2-метил-бензол-1,2-диамин
К раствору 400 мг (16,35 ммоль) (5-хлор-4-фтор-2-нитро-фенил)-циклопропил-метил-амина в 4 мл метанола добавляли 40 мг 10% палладия на активированном угле (Fluka). Реакционную смесь перемешивали при комнатной температуре в атмосфере водорода при 1,7 бар в течение двух часов. Добавляли этилацетат (10 мл) и реакционную смесь фильтровали через Dicalite® speed plus (Acros) и концентрировали в вакууме. Остаток очищали с помощью хроматографии на силикагеле, используя систему СДЖХ (CombiFlash Companion, Isco Inc.), элюируя градиентом н-гептан: этилацетат (100: 0 до 60: 40), что давало 240 мг (68%) указанного в заголовке соединения в виде коричневой жидкости. MS (ESI): m/z=215,075 [М+Н]+.
c) (5-Хлор-4-фтор-2-нитро-фенил)-циклопропил-метил-амин
К раствору 500 мг (2,17 ммоль) (5-хлор-4-фтор-2-нитро-фенил)-циклопропил-амина (J. Med. Chem. 1992, 35(8), 1385) в 5 мл N,N-диметилформамида добавляли 104 мг (2,385 ммоль) гидрида натрия (60% дисперсия в минеральном масле) и 339 мг (2,385 ммоль) метилиодида. Реакционную смесь перемешивали в течение 6 часов при комнатной температуре и затем выливали в 30 мл 10% водного раствора гидрокарбоната натрия и 30 мл этилацетата. Слои разделяли и водный слой экстрагировали второй раз 30 мл этилацетата. Органические слои промывали 30 мл солевого раствора, высушивали над сульфатом магния, фильтровали и концентрировали в вакууме. Остаток очищали с помощью хроматографии на силикагеле, используя систему СДЖХ (CombiFlash Companion, Isco Inc.), элюируя градиентом н-гептан: этилацетат (100: 0 до 80: 20), что давало 433 мг (82%) требуемого соединения в виде желтого масла. MS (ESI): m/z=245,049 [М+Н]+.
Пример 26
[4-(4-Бром-2,5-дихлор-фенокси)-пиридин-3-ил]-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-ил)-метанон
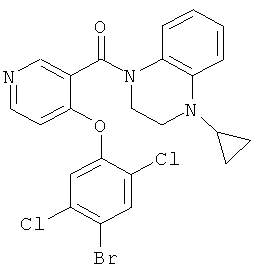
К суспензии 5,0 г (13,77 ммоль) 4-(4-бром-2,5-дихлор-фенокси)-никотиновой кислоты в 30 мл N,N-диметилформамида добавляли 5,50 г (14,46 ммоль) 0-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата (HATU, имеется в продаже, CAS RN 148893-10-1) и 7,03 мл (41,32 ммоль) N,N-диизопропилэтиламина. К этому коричневому раствору добавляли 2,52 г (14,46 ммоль) 1-циклопропил-1,2,3,4-тетрагидро-хиноксалина (Пример 8, промежуточное соединение а), полученный в результате прозрачный коричневый раствор перемешивали при комнатной температуре в течение 17 часов и затем выливали в 120 мл воды и 120 мл этилацетата. Полученную в результате смесь фильтровали, осадок на фильтре тщательно промывали водой и очень малым количеством этилацетата, что давало после сушки 6,55 г (92%) указанного в заголовке соединения в виде коричневого твердого вещества. MS (ESI): m/z=520,1 [M+H]+.
Промежуточное соединение
4-(4-Бром-2.5-дихлор-фенокси)-никотиновая кислота
К перемешиваемой суспензии 6,0 г (38,08 ммоль) 4-хлорникотиновой кислоты (имеется в продаже; CAS RN 10177-29-4) в 200 мл о-ксилола добавляли 10,13 г (41,89 ммоль) 4-бром-2,5-дихлорфенола (имеется в продаже; CAS RN 1940-42-7) и 2,84 г (7,62 ммоль) гексафторфосфата тетракис-(ацетонитрил)-меди (имеется в продаже; CAS RN 64443-05-6). Затем добавляли 31,31 г (95,20 ммоль) карбоната цезия и полученную в результате темно-коричневую суспензию нагревали при 120°С в течение 16 часов. После охлаждения до комнатной температуры растворитель выпаривали, остаток растворяли в 1,25 л воды, экстрагировали четыре раза 250 мл этилацетата и фильтровали. рН зеленого фильтрата доводили до 6, используя 25% водную соляную кислоту. Образующийся осадок отфильтровывали, что давало первую порцию требуемого соединения. рН фильтрата доводил до 3, используя 25% водную соляную кислоту, суспензию перемешивали в течение 0,25 часа при комнатной температуре и затем держали в холодильной камере в течение 64 часов. Суспензию фильтровали и промывали водой, что давало другую порцию соединения. Коричневое твердое вещество (общий выход 5,63 г (41%)). MS (ESI): m/z=363,9 [М+Н]+.
Примеры 27 и 28
Метиловый эфир2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензойной кислоты и Диметиловый эфир 4-хлор-5-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-фталевой кислоты
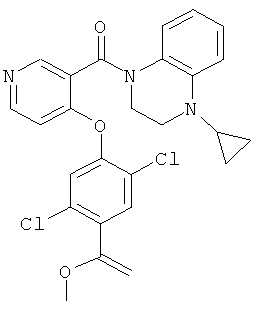 и
и 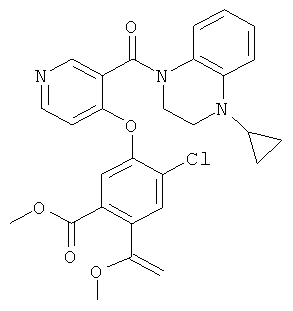
К раствору 1,0 г (1,93 ммоль) [4-(4-бром-2,5-дихлор-фенокси)-пиридин-3-ил]-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-ил)-метанона в 25 мл метанола и 25 мл этилацетата добавляли 0,40 мл (2,89 ммоль) триэтиламина и 0,094 г (0,12 ммоль) аддукта 1,1'-бис(дифенилфосфин)ферроцен-палладия (II) дихлорид дихлорметан (имеется в продаже, CAS RN 851232-71-8). Затем размещали в атмосфере 70 бар монооксида углерода и реакционную смесь перемешивали при 120°С в течение 20 часов. После охлаждения реакционную смесь фильтровали, фильтрат обрабатывали с силикагелем и выпаривали. Полученный в результате порошок затем очищали с помощью хроматографии на силикагеле, используя систему СДЖХ (50 г силикагелевая колонка, CombiFlash Companion, Isco Inc.), элюируя градиентом н-гептан: этилацетат (100: 0 до 50: 50), что давало первую порцию каждого соединения. Оставшиеся фракции, содержащие примеси, объединяли и снова подвергали хроматографии (20 г силикагелевая колонка, CombiFlash Companion, Isco Inc.), используя градиент н-гептан: этилацетат (100: О до 40: 60), что давало вторую порцию требуемых соединений.
Метиловый эфир 2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензойной кислоты (Пример 27): 0,413 г (43%) светло-коричневой пены. MS (ESI): m/z=498,3 [М+Н]+.
Диметиловый эфир 4-хлор-5-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-фталевой кислоты (Пример 28): 0,278 г (27%) светло-коричневой пены. MS (ESI): m/z=522,142 [М+Н]+.
Пример 29
Метиловый эфир {2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-уксусной кислоты
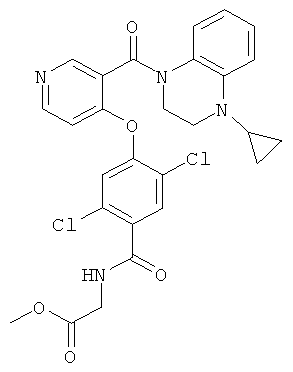
К раствору 0,18 г (0,37 ммоль) 2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензойной кислоты в 2 мл N,N-диметилформамида добавляли 0,148 г (0,39 ммоль) 0-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата (HATU, имеется в продаже, CAS RN 148893-10-1) и 0,25 мл (1,49 ммоль) N,N-диизопропилэтиламина. К светло-коричневому раствору добавляли 0,049 г (0,39 ммоль) метилового эфира глицина гидрохлорида (имеется в продаже, CAS RN 5680-79-5) и раствор перемешивали при комнатной температуре в течение 2,5 часов. Раствор выливали в воду и экстрагировали три раза этилацетатом. Объединенные органические слои промывали дважды водой и солевым раствором, высушивали над сульфатом магния, фильтровали, обрабатывали с силикагелем и выпаривали. Полученный в результате порошок очищали с помощью хроматографии на силикагеле, используя систему СДЖХ (10 г силикагелевая колонка, CombiFlash Companion, Isco Inc.) с градиентом н-гептан: этилацетат (100: 0 до 0: 100), что давало 0,169 г (82%) требуемого соединения в виде светло-коричневого твердого вещества. MS (ESI): m/z=555,12[M+H]+.
Промежуточное соединение
2.5-Дихлор-4-Г3-(4-циклопропил-3.4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси1-бензойная кислота
К суспензии 3,68 г (7,38 ммоль) метилового эфира 2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензойной кислоты (Пример 27) в 40 мл диоксана и 40 мл воды добавляли 0,387 г (9,22 ммоль) моногидрата гидроксида лития. Реакционную смесь перемешивали 1,5 часа при комнатной температуре до образования желтого раствора. Диоксан удаляли выпариванием и полученную в результате суспензию разбавляли 50 мл воды, и рН доводили до 1, используя 10 мл 25% водной соляной кислоты. Полученную в результате суспензию перемешивали в течение приблизительно 2 часов при комнатной температуре, фильтровали, промывали водой и высушивали в высоком вакууме, что давало 3,49 г (97%) требуемого соединения в виде светло-коричневого твердого вещества. MS (ESI): m/z=484,3 [М+Н]+.
Пример 30
{2,5-Дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-уксусная кислота
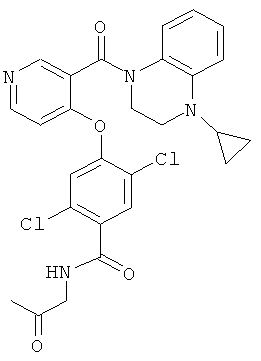
К суспензии 0,148 г (0,27 ммоль) метилового эфира {2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-уксусной кислоты (Пример 29) в 1,5 мл диоксана и 1,5 мл воды добавляли 0,014 г (0,33 ммоль) моногидрата гидроксида лития. После 2 часов перемешивания при комнатной температуре органический растворитель выпаривали. рН полученного в результате желтого раствора доводили до 1 с 1 М водной соляной кислотой и раствор экстрагировали три раза этилацетатом. Объединенные органические слои промывали солевым раствором, высушивали над сульфатом магния, фильтровали и выпаривали, что давало 0,091 г (63%) указанного в заголовке соединения в виде желтой пены. MS (ESI): m/z=541,104 [М+Н]+.
Пример 31
Метиловый эфир({2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоил}-метил-амино)-уксусной кислоты
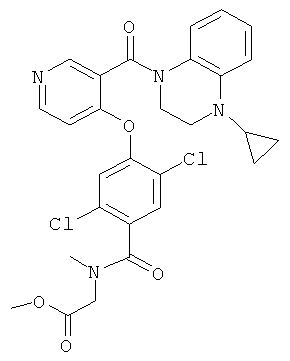
Указанное в заголовке соединение получали по аналогии с Примером 29 из 2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензойной кислоты (Пример 29, промежуточное соединение) и метилового эфира саркозина гидрохлорида (имеется в продаже, CAS RN 945218-53-1), используя градиент н-гептан: этилацетат (100: 0 до 0: 100) в качестве элюента. Светло-коричневая пена (33%). MS (ESI): m/z=569,135 [М+Н]+.
Пример 32
({2,5-Дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоил}-метил-амино)-уксусная кислота
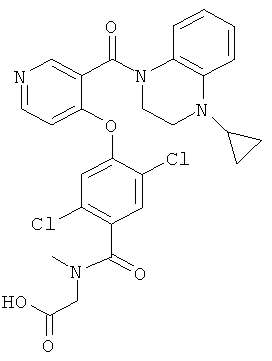
К раствору 0,057 г (0,10 ммоль) метилового эфира ({2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоил}-метил-амино)-уксусной кислоты (Пример 31) в 1 мл диоксана и 1 мл воды добавляли 0,005 г (0,12 ммоль) моногидрата гидроксида лития. После перемешивания при комнатной температуре в течение 2 часов диоксан удаляли выпариванием. рН образующегося желтого раствора доводили до 1 с 1 М водной соляной кислотой. Водный раствор насыщали твердым хлоридом натрия и экстрагировали три раза этилацетатом. Объединенные органические слои промывали солевым раствором, высушивали над сульфатом магния, фильтровали и выпаривали, что давало 0,053 г (95%) указанного в заголовке соединения в виде желтого твердого вещества. MS (ESI): m/z=555,12 [М+Н]^
Пример 33
Этиловый эфир 3-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-пропионовой кислоты
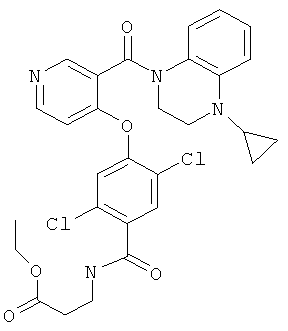
К раствору 0,18 г (0,37 ммоль) 2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензойной кислоты (Пример 29, промежуточное соединение) в 2 мл N,N-диметилформамида добавляли 0,148 г (0,39 ммоль) 0-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата (HATU, имеется в продаже, CAS RN 148893-10-1) и 0,25 мл (1,49 ммоль) N,N-диизопропилэтиламина. К светло-коричневому раствору добавляли 0,060 г (0,39 ммоль) этилового эфира бета-аланина гидрохлорида (имеется в продаже, CAS RN 4244-84-2) и раствор перемешивали при комнатной температуре в течение 3,5 часов. Раствор выливали в воду и экстрагировали три раза этилацетатом. Объединенные органические слои промывали дважды водой и солевым раствором, высушивали над сульфатом магния, фильтровали, обрабатывали с силикагелем и выпаривали. Полученный в результате порошок очищали с помощью хроматографии на силикагеле, используя систему СДЖХ (10 г силикагелевая колонка, CombiFlash Companion, Isco Inc.) с градиентом н-гептан:
этилацетат (100: 0 до 0: 100), что давало 0,185 г (85%) указанного в заголовке соединения в виде светло-коричневой пены. MS (ESI): m/z=583,15 [М+Н]+.
Пример 34
3-{2,5-Дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-пропионовая кислота
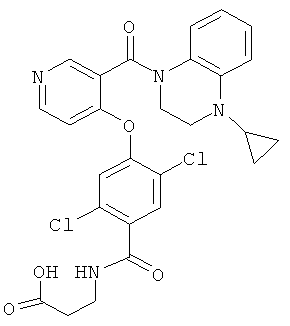
К раствору 0,85 г (1,46 ммоль) этилового эфира 3-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-
бензоиламино}-пропионовой кислоты (Пример 33) в 7,5 мл диоксана добавляли 7,5 мл воды и 0,076 г (1,81 ммоль) моногидрата гидроксида лития. Полученную в результате суспензию перемешивали в течение 2,25 часа при комнатной температуре и диоксан удаляли выпариванием. рН раствора доводили до 2,5, добавляя 1,9 мл 1 М водной соляной кислоты, и суспензию перемешивали в течение 2 часов при комнатной температуре. Суспензию фильтровали, осадок на фильтре промывали водой и сушили в высоком вакууме, что давало 0,70 г (86%) требуемого соединения в виде твердого вещества белого оттенка. MS (ESI): m/z=555,12 [М+Н]+.
Пример 35
2-{2,5-Дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-этансульфоновая кислота
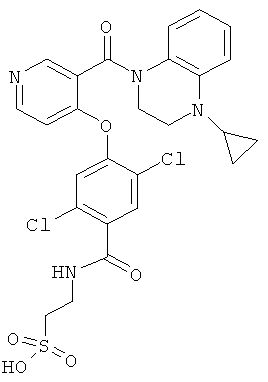
К раствору 0,127 г (0,26 ммоль) 2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензойной кислоты (Пример 29, промежуточное соединение) в 1,5 мл N,N-диметилформамида добавляли 0,10 г (0,26 ммоль) 0-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата (HATU, имеется в продаже, CAS RN 148893-10-1) и 0,13 мл (0,79 ммоль) N,N-диизопропилэтиламина. К желтому раствору добавляли 0,036 г (0,29 ммоль) таурина (имеется в продаже, CAS RN 107-35-7) и реакционную смесь перемешивали при комнатной температуре в течение 4,5 часов. Раствор фильтровали, используя шприцевой микрофильтр, и очищали с помощью системы препаративной ВЭЖХ (колонка Phenomenex Gemini) с градиентом ацетонитрил: вода (содержащая 0,05% муравьиной кислоты) (10: 90 до 98: 2), что давало 0,092 г (59%) указанного в заголовке соединения в виде коричневого твердого вещества. MS (ESI): m/z=591,086 [М+Н]+.
Пример 36
2-({2,5-Дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоил}-метил-амино)-этансульфоновая кислота
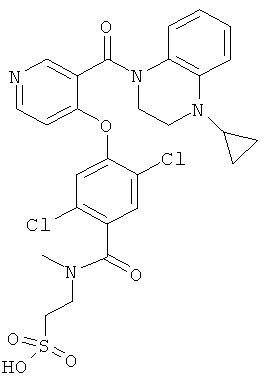
Указанное в заголовке соединение получали по аналогии с Примером 35 из 2,5-дихлор-4-[3-(4-цикпопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензойной кислоты (Пример 29, промежуточное соединение) и N-метил-таурина (имеется в продаже, CAS RN 107-68-6). Коричневое твердое вещество (27%). MS (ESI): m/z=605,2 [M+H]+.
Пример 37
3-{2,5-Дихлор-4-[3-(4-цикпопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-пропан-1 -сульфоновая кислота
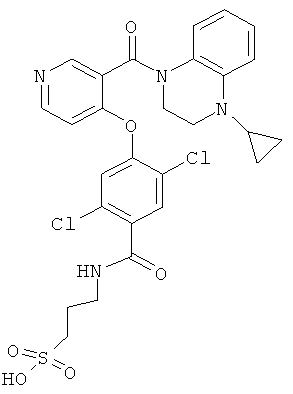
Указанное в заголовке соединение получали по аналогии с Примером 35 из 2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензойной кислоты (Пример 29, промежуточное соединение) и 3-амино-1-пропансульфоновой кислоты (имеется в продаже, CAS RN 3687-18-1). Коричневое твердое вещество (18%). MS (ESI): m/z=605,102 [M+H]+.
Пример 38
2,5-Дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-N-(1H-тетразол-5-ил)-бензамид
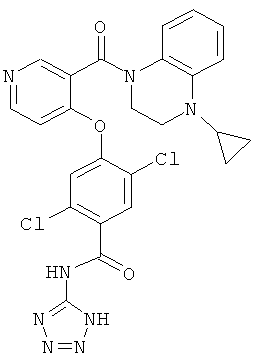
К раствору 0,20 г (0,41 ммоль) 2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензойной кислоты (Пример 29, промежуточное соединение) в 2 мл N,N-диметилформамида добавляли 0,165 г (0,43 ммоль) 0-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата (HATU, имеется в продаже, CAS RN 148893-10-1) и 0,21 мл (1,24 ммоль) N,N-диизопропилэтиламина. К желтому раствору добавляли 0,037 г (0,43 ммоль) 5-амино-Ш-тетразола (имеется в продаже, CAS RN 4418-61-5) и раствор перемешивали при комнатной температуре в течение 3,25 часа. Затем раствор нагревали до 60°С и перемешивали при этой температуре в течение 88 часов. После фильтрации через шприцевой микрофильтр реакционную смесь очищали с помощью препаративной ВЭЖХ (колонка Phenomenex Gemini) с градиентом ацетонитрил: вода (содержащая 0,05% муравьиной кислоты) (10: 90 до 98: 2), что давало требуемое соединение в виде светло-коричневого твердого вещества (0,051 г, 22%). MS (ESI): m/z=551,11 [M+H]+.
Пример 39
2,5-Дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-N-(1H-тетразол-5-илметил)-бензамид
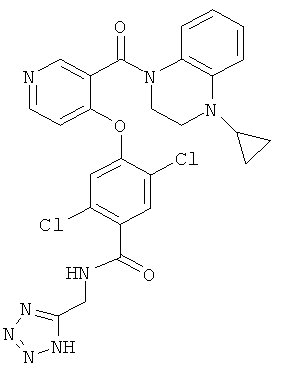
Указанное в заголовке соединение получали по аналогии с Примером 38 из 2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензойной кислоты (Пример 29, промежуточное соединение) и 5-(аминометил)-тетразола (имеется в продаже, CAS RN 31602-63-8), что давало 0,078 г (58%) указанного в заголовке соединения в виде светло-желтого твердого вещества. MS (ESI): m/z=565,126 [М+H]+.
Пример 40
4-{2,5-Дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-масляная кислота
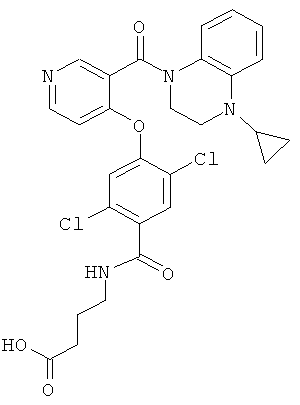
Указанное в заголовке соединение получали по аналогии с Примером 30 из метилового эфира 4-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-масляной кислоты. Светло-коричневое твердое вещество (62%). MS (ESI): m/z=569,136 [M+H]+.
Промежуточное соединение
Метиловый эфир 4-{2,5-дихлор-4-Г3-(4-циклопропил-3.4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси1-бензоиламино}-масляной кислоты
Указанное в заголовке соединение получали по аналогии с Примером 1 из 2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензойной кислоты (Пример 29, промежуточное соединение) и метил 4-аминобутирата (имеется в продаже, CAS RN 3251-07-8), используя градиент н-гептан: этилацетат (100: 0 до 0: 100) для хроматографической очистки. Светло-коричневая пена (42%). MS (ESI): m/z=583,150 [M+H]+.
Пример 41
Метиловый эфир 4-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-1-метил-1H-пиррол-2-карбоновой кислоты
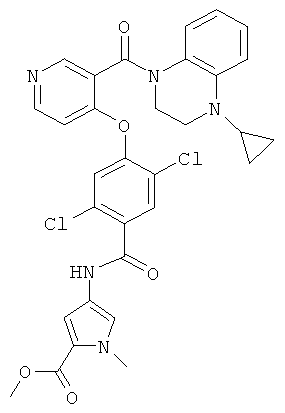
Указанное в заголовке соединение получали по аналогии с Примером 1 из 2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензойной кислоты (Пример 29, промежуточное соединение) и метилового эфира 4-амино-1-метил-1Н-пиррол-2-карбоновой кислоты (имеется в продаже, CAS RN 180258-45-1), используя градиент н-гептан: этилацетат (100: 0 до 0: 100) для хроматографической очистки. Светло-коричневая пена (70%). MS (ESI): m/z=620,147 [М+Н]+.
Пример 42
4-{2,5-Дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-1-метил-1Н-пиррол-2-карбоновая кислота
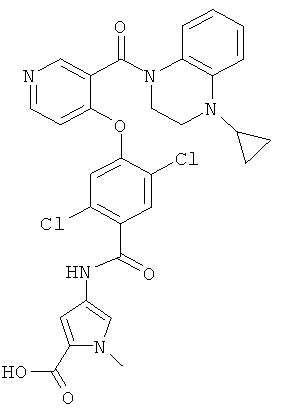
К раствору 0,10 г (0,16 ммоль) метилового эфира 4-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-1-метил-1H-пиррол-2-карбоновой кислоты (Пример 41) в 1 мл диоксана добавляли 1 мл воды и 0,008 г (0,19 ммоль) моногидрата гидроксида лития. Полученную в результате суспензию перемешивали в течение 2 часов при комнатной температуре, затем нагревали до 80°С в течение 5,5 часов. Добавляли еще 0,001 г (0,024 ммоль) моногидрата гидроксида лития и реакционную смесь нагревали в течение еще 1,5 часов при 80°С. После перемешивания при комнатной температуре в течение 64 часов реакционную смесь выливали в 1 М водную соляную кислоту и этилацетат и слои разделяли. Водный слой экстрагировали три раза этилацетатом. Объединенные органические слои промывали солевым раствором, высушивали над сульфатом магния, фильтровали и выпаривали. Остаток растворяли в N,N-диметилформамиде, фильтровали через шприцевой микрофильтр и очищали с помощью препаративной ВЭЖХ (колонка Phenomenex Gemini) с градиентом ацетонитрил: вода (содержащая 0,05% муравьиной кислоты) (10: 90 до 98: 2), что давало указанное в заголовке соединение в виде светло-коричневого твердого вещества (0,034 г, 35%). MS (ESI): m/z=606,13 [M+H]+.
Пример 43
Метиловый эфир 4-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-бензойной кислоты
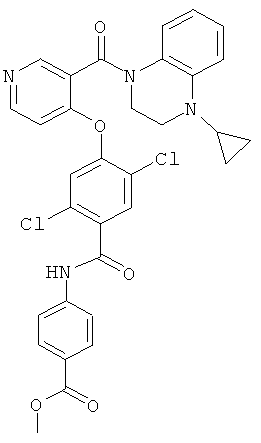
Указанное в заголовке соединение получали по аналогии с Примером 1 из 2,5-дихлор-4-[3-(4-цикпопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензойной кислоты (Пример 29, промежуточное соединение) и метилового эфира 4-амино-бензойной кислоты (имеется в продаже, CAS RN 619-45-4), используя градиент н-гептан: этилацетат (100:0 до 0:100) для хроматографической очистки. Светло-коричневая пена (29%). MS (ESI): m/z=617,136 [М+Н]+.
Пример 44
4-{2,5-Дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-бензойная кислота
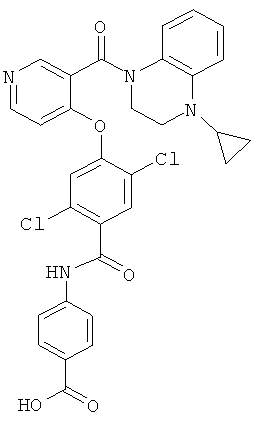
К раствору 0,040 г (0,065 ммоль) метилового эфира 4-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2М-хиноксалин-1-карбонил)-пиридин-4-илокси]- бензоиламино}-бензойной кислоты (Пример 43) в 0,5 мл диоксана добавляли 0,5 мл воды и 0,003 г (0,071 ммоль) моногидрата гидроксида лития. Полученную в результате суспензию перемешивали при комнатной температуре в течение 2 часов, затем нагревали до 80°С в течение 1 часа. Органический растворитель удаляли выпариванием и рН полученного в результате раствора доводили до 1-2, используя 1 М водную соляную кислоту. Суспензию перемешивали в течение 2 часов при комнатной температуре, фильтровали и промывали водой, что давало требуемое соединение в виде светло-коричневого твердого вещества (0,020 г, 51%). MS (ESI): m/z=603,12 [M+H]+.
Пример 45
Этиловый эфир2-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-4-метил-тиазол-5-карбоновой кислоты
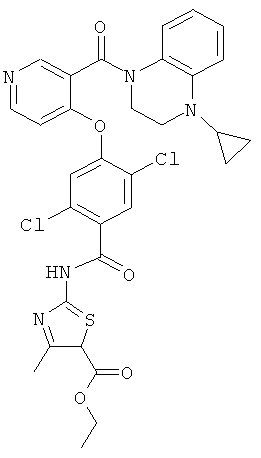
Указанное в заголовке соединение получали по аналогии с Примером 1 из 2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензойной кислоты (Пример 29, промежуточное соединение) и этилового эфира 2-амино-4-метил-тиазол-5-карбоновой кислоты (имеется в продаже, CAS RN 7210-76-6), используя градиент н-гептан: этилацетат (100: 0 до 0: 100) для хроматографической очистки. Желтое твердое вещество (0,182 г; 67%). MS (ESI): m/z=652,12 [М+Н]+.
Пример 46
2-{2,5-Дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-4-метил-тиазол-5-карбоновая кислота
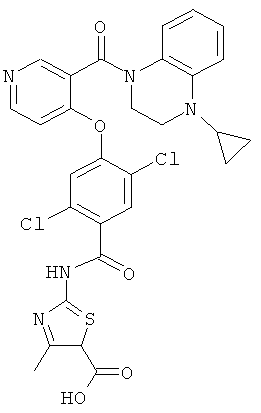
К раствору 0,16 г (0,25 ммоль) этилового эфира 2-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-4-метил-тиазол-5-карбоновой кислоты (Пример 45) в 2 мл диоксана добавляли 2 мл воды и 0,013 г (0,31 ммоль) моногидрата гидроксида лития. Полученную в результате суспензию перемешивали при комнатной температуре в течение 2 часов и затем перемешивали при нагревании с обратным холодильником в течение 5,5 часов. Добавляли еще 0,013 г (0,31 ммоль) моногидрата гидроксида лития и продолжали нагревать в течение дополнительных 8 часов. Масляную баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение ночи. После выпаривания органического растворителя рН полученного в результате раствора доводили до 2 - 3, используя 1 М водную соляную кислоту, и раствор экстрагировали три раза этилацетатом. Объединенные органические слои промывали солевым раствором, высушивали над сульфатом магния, фильтровали и выпаривали. Продукт очищали с помощью препаративной ВЭЖХ (колонка Phenomenex Gemini) с градиентом ацетонитрил:
вода (содержащая 0,05% муравьиной кислоты) (10:90 до 98:2), что давало 0,058 г (37%) указанного в заголовке соединения в виде светло-коричневого твердого вещества. MS (ESI): m/z=624,1 [М+Н]+.
Пример 47
Этиловый эфир 5-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-[1,3,4]тиадиазол-2-карбоновой кислоты
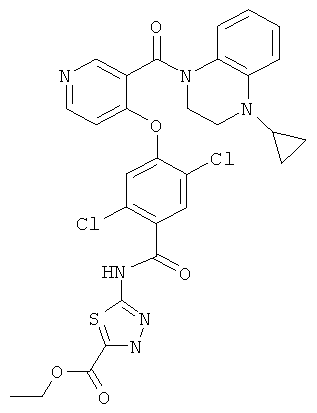
Указанное в заголовке соединение получали по аналогии с Примером 1 из 2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензойной кислоты (Пример 29, промежуточное соединение) и этилового эфира 5-амино-[1,3,4]тиадиазол-2-карбоновой кислоты (имеется в продаже, CAS RN 64837-53-2), используя градиент н-гептан: этилацетат (100:0 до 0:100) для хроматографической очистки. Желтое твердое вещество (67%). MS (ESI): m/z=652,12 [М+Н]+.
Пример 48
2,5-Дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-N-[1,3,4]тиадиазол-2-ил-бензамид
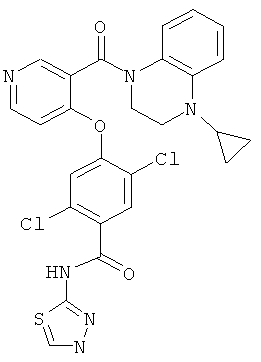
К раствору 0,10 г (0,16 ммоль) этилового эфира 5-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-[1,3,4]тиадиазол-2-карбоновой кислоты (Пример 47) в 1 мл диоксана добавляли 1 мл воды и 0,008 г (0,19 ммоль) моногидрата гидроксида лития. Полученную в результате суспензию перемешивали в течение 2 часов при комнатной температуре и затем при 80°С в течение 5,5 часов. Добавляли еще 0,001 г (0,024 ммоль) моногидрата гидроксида лития и реакционную смесь нагревали в течение еще 1,5 часов при 80°С.После перемешивания при комнатной температуре в течение 64 часов реакционную смесь выливали в 1 М водную соляную кислоту и этилацетат и слои разделяли. Водный слой экстрагировали три раза этилацетатом. Объединенные органические слои промывали солевым раствором, высушивали над сульфатом магния, фильтровали и выпаривали. Остаток растворяли в N,N-диметилформамиде, фильтровали через шприцевой микрофильтр и очищали с помощью препаративной ВЭЖХ (колонка Phenomenex Gemini) с градиентом ацетонитрил: вода (содержащая 0,05% муравьиной кислоты) (10:90 до 98:2), что давало 0,030 г (33%) продукта в виде светло-желтого твердого вещества. MS (ESI): m/z=567,08 [М+Н]+.
Пример 49
2,5-Дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-N-(2-гидрокси-этил)-бензамид
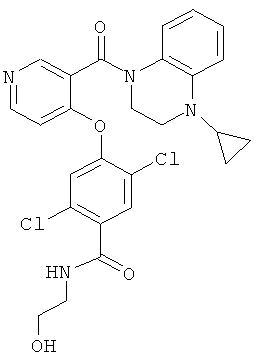
Указанное в заголовке соединение получали по аналогии с Примером 1 из 2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензойной кислоты (Пример 29, промежуточное соединение) и 2-амино-этанола (имеется в продаже, CAS RN 141-43-5). Продукт очищали с помощью системы препаративной ВЭЖХ (колонка Phenomenex Gemini), используя градиент ацетонитрил: вода (содержащая 0,05% муравьиной кислоты) (10: 90 до 98: 2), что давало требуемое соединение в виде светло-коричневой пены (60%). MS (ESI): m/z=527,124 [М+Н]+.
Пример 50
2,5-Дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-N,N-бис-(2-гидрокси-этил)-бензамид
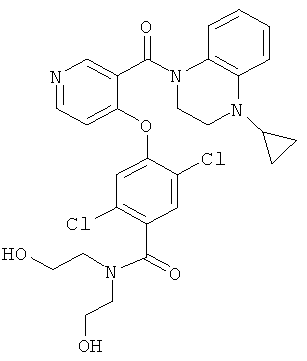
Указанное в заголовке соединение получали по аналогии с Примером 1 из 2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензойной кислоты (Пример 29, промежуточное соединение) и 2-(2-гидрокси-этиламино)-этанола (имеется в продаже, CAS RN 111-42-2). Продукт очищали с помощью системы препаративной ВЭЖХ (колонка Phenomenex Gemini), используя градиент ацетонитрил: вода (содержащая 0,05% муравьиной кислоты) (10:90 до 98:2), что давало требуемое соединение в виде светло-коричневого твердого вещества (71%). MS (ESI): m/z=571,150 [М+Н]+.
Пример 51
2,5-Дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-N-(2-гидрокси-1-гидроксиметил-этил)-бензамид
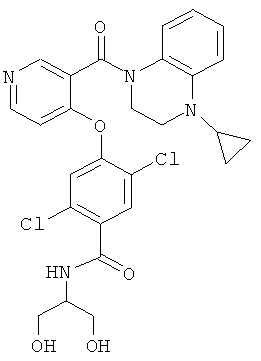
Указанное в заголовке соединение получали по аналогии с Примером 1 из 2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензойной кислоты (Пример 29, промежуточное соединение) и 2-амино- пропан-1,3-диола (имеется в продаже, CAS RN 534-03-2). Продукт очищали с помощью системы препаративной ВЭЖХ (колонка Phenomenex Gemini), используя градиент ацетонитрил: вода (содержащая 0,05% муравьиной кислоты) (10: 90 до 98: 2), что давало требуемое соединение в виде светло-коричневой пены (72%). MS (ESI): m/z=559,2 [M+H]+.
Пример 52
2,5-Дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензамид
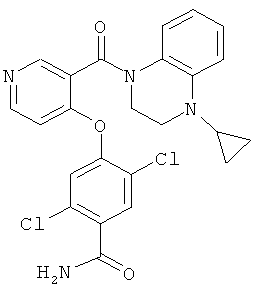
К раствору 0,10 г (0,21 ммоль) 2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензойной кислоты (Пример 29, промежуточное соединение) в 1 мл N,N-диметилформамида добавляли 0,022 г (0,41 ммоль) хлорида аммония, 0,028 г (0,21 ммоль) 1-гидроксибензотриазола, 0,07 мл N,N-диизопропилэтиламина и 0,040 г (0,21 ммоль) Л/-(3-диметиламинопропил)-N'-этил-карбодиимида гидрохлорида. Полученную в результате смесь перемешивали при комнатной температуре в течение ночи, фильтровали через шприцевой микрофильтр и очищали с помощью системы препаративной ВЭЖХ (колонка Phenomenex Gemini), используя градиент ацетонитрил: вода (содержащая 0,05% муравьиной кислоты) (10:90 до 98:2), что давало 80 мг (80%) требуемого соединения в виде светло-коричневого твердого вещества. MS (ESI): m/z=483,098 [М+Н]+.
Пример 53
N-(2-Карбамоил-этил)-2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензамид
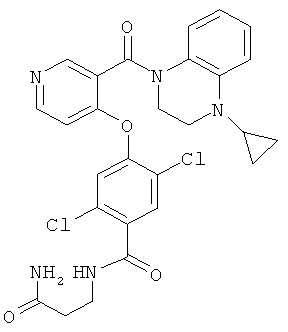
Указанное в заголовке соединение получали по аналогии с Примером 52 из 3-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-пропионовой кислоты (Пример 34) и 3-амино-пропионамида (имеется в продаже, CAS RN 4726-85-6). Светло-коричневая пена (74%). MS (ESI): m/z=554,136 [M+H]+.
Пример 54
Диметиловый эфир4-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-гептандиовой кислоты
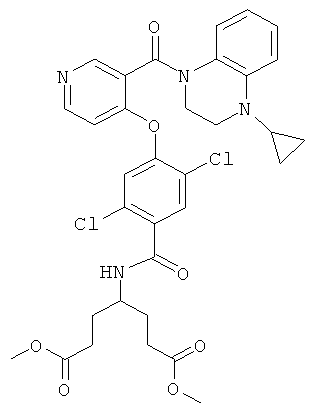
Указанное в заголовке соединение получали по аналогии с Примером 1 из 2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензойной кислоты (Пример 29, промежуточное соединение) и диметилового эфира 4-амино-гептандиовой кислоты (J. Am. Chem. Soc. 2005, 127 (50), 17877-17887), используя градиент н-гептан: этилацетат (100:0 до 0:100) для хроматографической очистки. Светло-коричневая пена (69%). MS (ESI): m/z=669,19 [М+Н]+.
Пример 55
(4-Циклопропил-3,4-дигидро-2H-хиноксалин-1-ил)-[4-(2,5-дихлор-4-гидроксиметил-фенокси)-пиридин-3-ил]-метанон
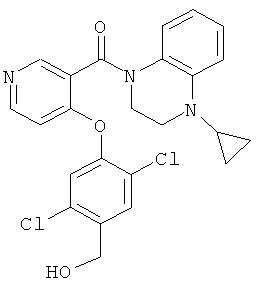
К раствору 0,10 г (0,20 ммоль) метилового эфира 2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензойной кислоты (Пример 27) в 1 мл тетрагидрофурана добавляли 0,008 г (0,21 ммоль) алюмогидрида лития. Полученную в результате суспензию перемешивали при комнатной температуре в течение 2,5 часов, выливали в водный насыщенный раствор гидрокарбоната натрия и экстрагировали три раза этилацетатом. Объединенные органические слои промывали солевым раствором, высушивали над сульфатом магния, фильтровали, обрабатывали с силикагелем и выпаривали досуха. Полученный в результате порошок очищали с помощью хроматографии на силикагеле, используя систему СДЖХ (10 г силикагелевая колонка, CombiFlash Companion, Isco Inc.) с градиентом н-гептан: этилацетат (100: 0 до 50: 50), что давало 0,025 г (26%) требуемого соединения в виде светло-коричневого масла. MS (ESI): m/z=470,103 [М+Н]+.
Пример 56
2,5-Дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензонитрил
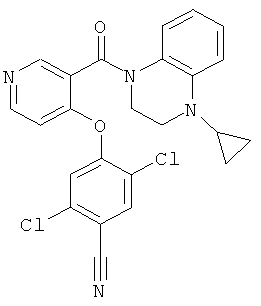
К суспензии 0,20 г (0,43 ммоль) [4-(4-бром-2,5-дихлор-фенокси)-пиридин-3-ил]-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-ил)-метанона (Пример 26) в 0,2 мл N,N-диметилформамида добавляли 0,044 г (0,38 ммоль) L-пролина (имеется в продаже, CAS RN 147-85-3), затем добавляли 0,068 г (0,76 ммоль) цианида меди (I). Полученную в результате темно-коричневую суспензию перемешивали при 120°С в течение 17 часов. Затем еще добавляли 0,2 мл N,N-диметилформамида и продолжали перемешивать в течение еще 7 часов при 120°С.Реакционную смесь охлаждали до комнатной температуры, перемешивали в течение еще 64 часов и затем разделяли между водой и этилацетатом. Полученную в результате мутную смесь фильтровали и промывали этилацетатом. Слои фильтрата разделяли и водный слой экстрагировали дважды этилацетатом. Объединенные органические слои промывали солевым раствором, высушивали над сульфатом магния, фильтровали и выпаривали досуха. Оставшееся светло-коричневое масло растворяли в дихлорметане, обрабатывали с силикагелем и затем выпаривали. Полученный в результате порошок очищали с помощью хроматографии на силикагеле, используя систему СДЖХ (10 г силикагелевая колонка, CombiFlash Companion, Isco Inc.) с градиентом н-гептан: этилацетат (100: 0 до 40: 60), что давало 0,045 г (25%) указанного в заголовке соединения в виде коричневого твердого вещества. MS (ESI): m/z=465,1 [М+Н]+.
Пример 57
(4-Циклопропил-3,4-дигидро-2Н-хиноксалин-1-ил)-[4-(2,5-дихлор-4-гидрокси-фенокси)-пиридин-3-ил]-метанон
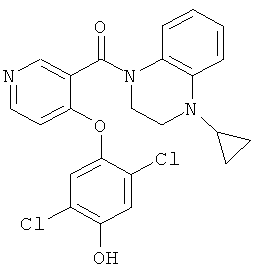
К раствору 1,0 г (1,93 ммоль) [4-(4-бром-2,5-дихлор-фенокси)-пиридин-3-ил]-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-ил)-метанона (Пример 26) в 20 мл безводного тетрагидрофурана добавляли 0,85 мл (3,72 ммоль) триизопропилбората (имеется в продаже, CAS RN 5419-55-6). Раствор охлаждали до -75°С, используя баню с сухим льдом, и добавляли к реакционной смеси 1,50 мл (2,4 ммоль) раствора н-бутиллития (1,6 М в н-гексане) в течение 3 мин. Перемешивать продолжали в течение еще 1,5 часов. Баню с сухим льдом заменяли на ледяную баню и добавляли 0,98 г (8,17 ммоль) уксусной кислоты (50% раствор в воде) и 0,28 г (2,89 ммоль) пероксида водорода (35% раствор в воде). Реакционную смесь перемешивали при 0°С в течение 1 часа, охлажденную порцию удаляли и продолжали перемешивать при комнатной температуре в течение 20 часов. Раствор выливали в 10% водный раствор тиосульфата натрия и экстрагировали три раза этилацетатом. Объединенные органические слои промывали солевым раствором, высушивали над сульфатом магния, фильтровали, обрабатывали с силикагелем и выпаривали досуха. Полученный в результате порошок очищали с помощью хроматографии на силикагеле, используя систему СДЖХ (20 г силикагелевая колонка, CombiFlash Companion, Isco Inc.) с градиентом н-гептан: этилацетат (100: 0 до 40: 60), что давало 0,575 г (65%) указанного в заголовке соединения в виде светло-коричневого твердого вещества. MS (ESI): m/z=456,2 [M+H]+.
Пример 58
Этиловый эфир {2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-фенокси}-уксусной кислоты
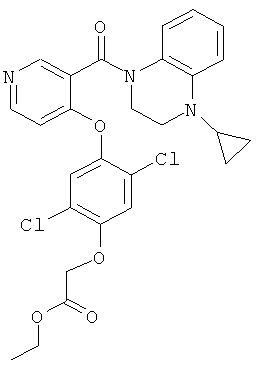
К раствору 0,15 г (0,33 ммоль) (4-циклопропил-3,4-дигидро-2H-хиноксалин-1-ил)-[4-(2,5-дихлор-4-гидрокси-фенокси)-пиридин-3-ил]-метанона (Пример 57) в 2 мл N,N-диметилформамида добавляли 0,016 г (0,37 ммоль) гидрида натрия (60% дисперсия в минеральном масле, Aldrich, CAS RN 7646-69-7). Реакционную смесь перемешивали в течение 15 мин при комнатной температуре перед добавлением 0,04 мл (0,36 ммоль) этил бромацетата (имеется в продаже, CAS RN 105-36-2). После перемешивания при комнатной температуре в течение 3 часов раствор выливали в воду и экстрагировали три раза этилацетатом. Объединенные органические слои промывали водой и солевым раствором, высушивали над сульфатом магния, фильтровали, обрабатывали с силикагелем и выпаривали. Полученный в результате порошок очищали с помощью хроматографии на силикагеле, используя систему СДЖХ (10 г силикагелевая колонка, CombiFlash Companion, Isco Inc.), элюируя градиентом н-гептан: этилацетат (100: 0 до 30: 70), что давало 0,144 г (81%) требуемого соединения в виде светло-желтой пены. MS (ESI):m/z=542,123 [М+Н]+.
Пример 59
{2,5-Дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-фенокси}-уксусная кислота
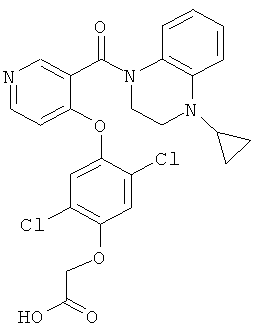
Указанное в заголовке соединение получали по аналогии с Примером 30 из этилового эфира {2,5-дихлор-4-[3-(4-цикпопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-фенокси}-уксусной кислоты после 4 часов протекания реакции при комнатной температуре и перемешивания суспензии, полученной после подкисления, в течение 2 часов при комнатной температуре. Светло-коричневое твердое вещество (72%). MS (ESI): m/z=514,092 [М+Н]+.
Пример 60
Этиловый эфир 2-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-фенокси}-2-метил-пропионовой кислоты
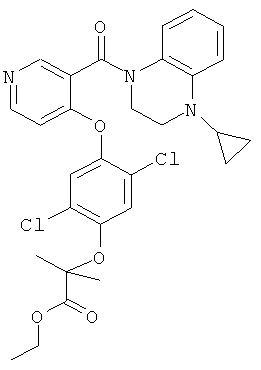
Указанное в заголовке соединение получали по аналогии с Примером 58 из (4-циклопропил-3,4-дигидро-2H-хиноксалин-1-ил)-[4-(2,5-дихлор-4-гидрокси-фенокси)-пиридин-3-ил]-метанона (Пример 57) и этилового эфира 2-бром-2-метил-пропионовой кислоты (имеется в продаже, CAS RN 600-00-0) после 23 часов протекания реакции при комнатной температуре, используя градиент н-гептан:
этилацетат (100: 0 до 40: 60) для хроматографической очистки. Светло-коричневая пена (30%). MS (ESI): m/z=570,156 [M+H]+.
Пример 61
2-{2,5-Дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-фенокси}-2-метил-пропионовая кислота
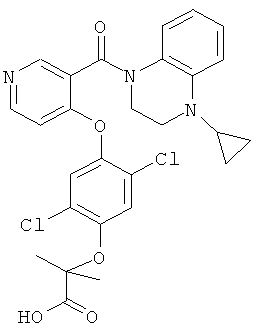
Указанное в заголовке соединение получали по аналогии с Примером 30 из этилового эфира 2-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-пиридин-4-илокси]-фенокси}-2-метил-пропионовой кислоты. Светло-коричневое твердое вещество (61%). MS (ESI): m/z=542,124 [M+H]+.
(4-Циклопропил-3,4-дигидро-2H-хиноксалин-1-ил)-{4-[2,5-дихлор-4-(2-гидрокси-этокси)-фенокси]-пиридин-3-ил}-метанон
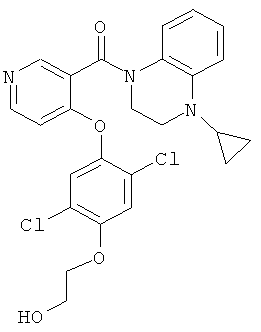
К раствору 0,15 г (0,33 ммоль) (4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-ил)-[4-(2,5-дихлор-4-гидрокси-фенокси)-пиридин-3-ил]-метанона (Пример 57) в 2 мл N,N-диметилформамида добавляли 0,016 г (0,37 ммоль) гидрида натрия (60% дисперсия в минеральном масле, Aldrich). Реакционную смесь перемешивали в течение 15 мин при комнатной температуре перед добавлением 0,03 мл (0,36 ммоль) 2-бромэтанола (имеется в продаже, CAS RN 540-51-2). После перемешивания в течение 3 часов при комнатной температуре еще добавляли 0,03 мл (0,36 ммоль) 2-бромэтанола. Через 72 часа реакционную смесь выливали в воду и экстрагировали три раза этилацетатом. Органические слои промывали водой и солевым раствором, высушивали над сульфатом магния, фильтровали, обрабатывали с силикагелем и выпаривали. Полученный в результате порошок очищали с помощью хроматографии на силикагеле, используя систему СДЖХ (20 г силикагелевая колонка, CombiFlash Companion, Isco Inc.) с градиентом н-гептан: этилацетат (100: 0 до 25: 75), что давало 0,075 г (46%) указанного в заголовке соединения в виде светло-коричневой пены. MS (ESI): m/z=500,113 [M+H]+.
Пример 63
(4-Циклопропил-3,4-дигидро-2H-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-6-метил-пиридин-3-ил]-метанон
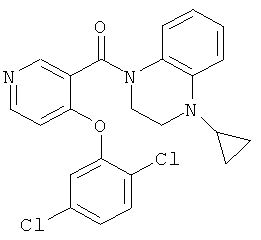
К раствору 420 мг (1,381 ммоль) 4-(2,5-дихлор-фенокси)-6-метил-никотината лития в 6 мл безводного N,N-диметилформамида добавляли 1,17 мл (6,907 ммоль) N-этилдиизопропиламина и 635 мг (1,658 ммоль) 0-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата (HATU, имеется в продаже, CAS RN 148893-10-1) и 289 мг (1,658 ммоль) 1-циклопропил-1,2,3,4-тетрагидро-хиноксалина (Пример 8, промежуточное соединение а). Реакционную смесь перемешивали в течение 18 часов при комнатной температуре и затем выливали в 30 мл 10% водного раствора гидрокарбоната натрия и 30 мл этилацетата. Слои разделяли и водный слой экстрагировали второй раз 30 мл этилацетата. Органические слои промывали 30 мл солевого раствора, высушивали над сульфатом магния, фильтровали и концентрировали в вакууме. Остаток очищали с помощью хроматографии на силикагеле, используя систему СДЖХ (20 г силикагелевая колонка, CombiFlash Companion, Isco Inc.) с градиентом н-гептан: этилацетат (100:0 до 0:100), что давало 375 мг (60%) казанного в заголовке соединения в виде светло-желтого твердого вещества. MS (ESI): m/z=454,108 [М+Н]+.
Промежуточные соединения
a) 4-(2.5-Дихлор-фенокси)-6-метил-никотинат лития
К раствору 420 мг (1,345 ммоль) метилового эфира 4-(2,5-дихлор-фенокси)-6-метил-никотиновой кислоты в 5 мл диоксана добавляли 5 мл воды и 85 мг (2,018 ммоль) моногидрата гидроксида лития. Реакционную смесь перемешивали в течение 2 часов при комнатной температуре и затем концентрировали в вакууме. Таким образом полученное светло-желтое твердое вещество было достаточно чистым для использования на следующей стадии без дополнительной очистки. MS (ESI): m/z=298,004 [М+Н]+.
b) Метиловый эфир 4-(2.5-дихлор-фенокси)-6-метил-никотиновой кислоты
К раствору 0,53 г (2,855 ммоль) метилового эфира 4-хлор-6-метил-никотиновой кислоты (имеется в продаже, CAS RN 886372-05-0) в 7,5 мл безводного N,N-диметилформамида добавляли 489 мг (2,998 ммоль) 2,5-дихлорфенола, 789 мг (5,711 ммоль) карбоната калия, 54 мг (0,286 ммоль) иодида меди (I) и 54 мг (0,857 ммоль) медного нанопорошка (средний размер частиц 100 нм). Реакционную смесь перемешивали при 120°С в течение 3 часов и затем выливали в 30 мл 1 М водной соляной кислоты и 30 мл этилацетата. Слои разделяли и водный слой экстрагировали 30 мл этилацетата. Объединенные органические слои промывали 30 мл солевого раствора, высушивали над сульфатом магния, фильтровали и концентрировали в вакууме. Остаток очищали с помощью хроматографии на силикагеле, используя систему СДЖХ (20 г силикагелевая колонка, CombiFlash Companion, Isco Inc.) с градиентом н-гептан: этилацетат (100: 0 до 0: 100), что давало 432 мг (48%) соединения в виде светло-желтого твердого вещества. MS (ESI): m/z=312,019 [M+H]+.
Пример 64
[4-(4-Бром-2,5-дихлор-фенокси)-6-метил-пиридин-3-ил]-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-ил)-метанон
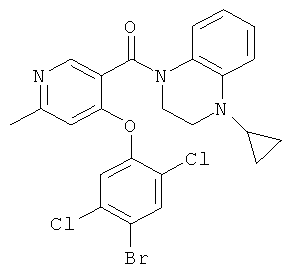
К раствору 0,17 г (0,451 ммоль) 4-(4-бром-2,5-дихлор-фенокси)-6-метил-никотиновой кислоты в 3 мл безводного N,N-диметилформамида добавляли 0,38 мл (2,225 ммоль) Л/-этилдиизопропиламина и 207 мг (0,541 ммоль) 0-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата (HATU, имеется в продаже, CAS RN 148893-10-1) и 94 мг (0,541 ммоль) 1-циклопропил-1,2,3,4-тетрагидро-хиноксалина (Пример 8, промежуточное соединение а). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов и затем выливали в 30 мл 10% водного раствора гидрокарбоната натрия и 30 мл этилацетата. Слои разделяли. Водный слой экстрагировали 30 мл этилацетата и объединенные органические слои промывали 30 мл солевого раствора, высушивали над сульфатом магния, фильтровали и концентрировали в вакууме. Остаток очищали с помощью хроматографии на силикагеле, используя систему СДЖХ (20 г силикагелевая колонка, CombiFlash Companion, Isco Inc.) с градиентом н-гептан: этилацетат (100: 0 до 40: 60), что давало 55 мг (23%) указанного в заголовке соединения в виде светло-желтого твердого вещества. MS (ESI): m/z=534,018 [М+Н]+.
Промежуточное соединение
а) 4-(4-Бром-2.5-дихлор-фенокси)-6-метил-никотиновая кислота
К раствору 185 мг (0,473 ммоль) метилового эфира 4-(4-бром-2,5-дихлор-фенокси)-6-метил-никотиновой кислоты в 3 мл диоксана добавляли 3 мл воды и 30 мг (0,710 ммоль) моногидрата гидроксида лития. Реакционную смесь перемешивали в течение 4 часов при комнатной температуре, выливали в 30 мл 1 М водной соляной кислоты и 30 мл дихлорметана и слои разделяли. Водный слой экстрагировали 30 мл дихлорметана и объединенные органические слои промывали 30 мл солевого раствора, высушивали над сульфатом магния, фильтровали и концентрировали в вакууме, что давало 178 мг (100%) указанного в заголовке соединения в виде бесцветного твердого вещества. MS (ESI): m/z=377,912 [М+Н]+.
b) Метиловый эфир 4-(4-бром-2.5-дихлор-фенокси)-6-метил-никотиновой кислоты
К раствору 1,25 г (6,734 ммоль) метилового эфира 4-хлор-6-метил-никотиновой кислоты (имеется в продаже, CAS RN 886372-05-0) в 30 мл о-ксилола добавляли 1,792 г (7,408 ммоль) 4-бром-2,5-дихлорфенола (имеется в продаже, CAS RN 1940-42-7), 0,502 г (1,347 ммоль) гексафторфосфата тетракис(ацетонитрил)меди (I) (имеется в продаже, CAS RN 64443-05-6) и 5,536 г (16,836 ммоль) карбоната цезия. Реакционную смесь перемешивали при 120°С в течение 20 часов и затем охлаждали до комнатной температуры. Добавляли этилацетат (50 мл) и воду (50 мл) и продолжали перемешивать в течение еще 10 минут.Реакционную смесь фильтровали через Dicalite® speed plus (Acros) и слои разделяли. Водный слой экстрагировали 200 мл этилацетата и объединенные органические слои промывали 200 мл солевого раствора, высушивали над сульфатом магния, фильтровали и концентрировали в вакууме. Остаток очищали с помощью хроматографии на силикагеле, используя систему СДЖХ (50 г силикагелевая колонка, CombiFlash Companion, Isco Inc.) с градиентом н-гептан:
этилацетат (100: 0 до 40: 60), что давало 200 мг (8%) указанного в заголовке соединения в виде светло-желтого твердого вещества. MS (Turbo Spray): m/z=391,9 [M+H]+.
Пример 65
Метиловый эфир2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-бензойной кислоты
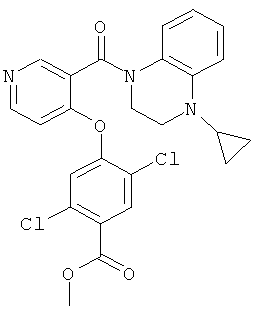
К раствору 0,23 г (0,431 ммоль) [4-(4-бром-2,5-дихлор-фенокси)-6-метил-пиридин-3-ил]-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-ил)-метанона (Пример 64) в 5 мл метанола и 5 мл этилацетата добавляли 23 мг (0,028 ммоль) комплекса 1,1'-бис(дифенилфосфин)ферроцен-палладия (II) дихлорида дихлорметана (имеется в продаже, CAS RN 851232-71-8) и 90 мг (0,647 ммоль) триэтиламина. Раствор карбонилировали с монооксидом углерода при 100°С при 90 бар. Реакционную смесь очищали с помощью хроматографии на силикагеле, используя систему СДЖХ (CombiFlash Companion, Isco Inc.), элюируя градиентом н-гептан: этилацетат (100: 0 до 0: 100), что давало требуемое соединение в виде светло-желтого твердого вещества (142 мг, 64,3%). MS (ESI): m/z=512,114 [M+H]+.
Пример 66
2,5-Дихлор-4-[5-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-бензойная кислота
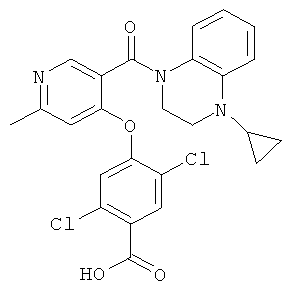 К раствору 130 мг (0,254 ммоль) метилового эфира 2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-бензойной кислоты (Пример 65) в 2 мл диоксана добавляли 2 мл воды и 13 мг (0,317 ммоль) моногидрата гидроксида лития. Реакционную смесь перемешивали при комнатной температуре в течение 4 часов и затем выливали в 20 мл 1 н водной соляной кислоты и 20 мл этилацетата. Слои разделяли и водный слой экстрагировали 20 мл этилацетата. Объединенные органические слои промывали 30 мл солевого раствора, высушивали над сульфатом магния, фильтровали и концентрировали в вакууме, что давало 125 мг (98,9%) указанного в заголовке соединения в виде светло-желтого твердого вещетва. MS (ESI): m/z=498,098 5 [M+H]+.
К раствору 130 мг (0,254 ммоль) метилового эфира 2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-бензойной кислоты (Пример 65) в 2 мл диоксана добавляли 2 мл воды и 13 мг (0,317 ммоль) моногидрата гидроксида лития. Реакционную смесь перемешивали при комнатной температуре в течение 4 часов и затем выливали в 20 мл 1 н водной соляной кислоты и 20 мл этилацетата. Слои разделяли и водный слой экстрагировали 20 мл этилацетата. Объединенные органические слои промывали 30 мл солевого раствора, высушивали над сульфатом магния, фильтровали и концентрировали в вакууме, что давало 125 мг (98,9%) указанного в заголовке соединения в виде светло-желтого твердого вещетва. MS (ESI): m/z=498,098 5 [M+H]+.
Пример 67
Этиловый эфир 3-{2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-бензоиламино}-пропионовой кислоты
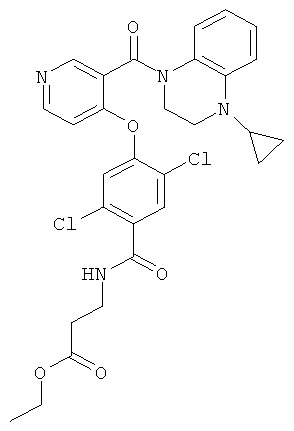
Указанное в заголовке соединение получали по аналогии с Примером 29 из 2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-бензойной кислоты и гидрохлорида этилового эфира бета-аланина (имеется в продаже, CAS RN 4244-84-2). Бесцветная пена (73%). MS (ESI): m/z=597,169 [М+Н]+.
Пример 68
3-{2,5-Дихлор-4-[5-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-бензоиламино}-пропионовая кислота
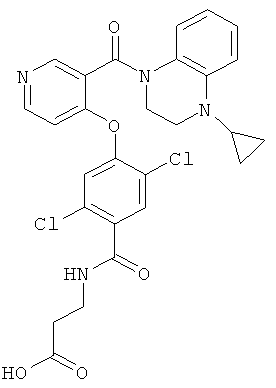
К раствору 83 мг (0,139 ммоль) этилового эфира 3-{2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-бензоиламино}-пропионовой кислоты в 2 мл диоксана добавляли 2 мл воды и 7 мг (0,174 ммоль) моногидрата гидроксида лития. Реакционную смесь перемешивали в течение 4 часов при комнатной температуре. Реакционную смесь выливали в 20 мл 1 н водной соляной кислоты и 20 мл этилацетата и слои разделяли. Водный слой экстрагировали 20 мл этилацетата и органические слои промывали 30 мл солевого раствора, высушивали над сульфатом магния, фильтровали и концентрировали в вакууме, что давало указанное в заголовке соединение в виде светло-желтого твердого вещества (100%). MS (ESI): m/z=569,136 [M+H]+.
Пример 69
Метиловый эфир {2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-бензоиламино}-уксусной кислоты
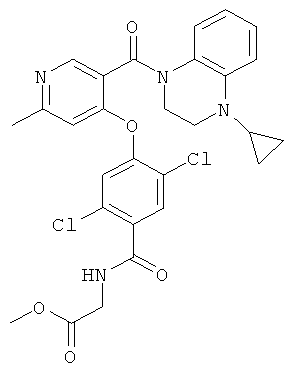
Указанное в заголовке соединение получали по аналогии с Примером 29 из 2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-2-метил- пиридин-4-илокси]-бензойной кислоты и гидрохлорида метилового эфира глицина (имеется в продаже, CAS RN 5680-79-5). Соединение очищали с помощью системы препаративной ВЭЖХ (колонка Phenomenex Gemini) с градиентом ацетонитрил: вода (содержащая 0,05% муравьиной кислоты) (50: 50 до 95: 5), что давало 44 мг (39%) указанного в заголовке соединения в виде светло-желтого твердого вещества. MS (ESI): m/z=569,136 [М+Н]+.
Пример 70
{2,5-Дихлор-4-[5-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-бензоиламино}-уксусная кислота
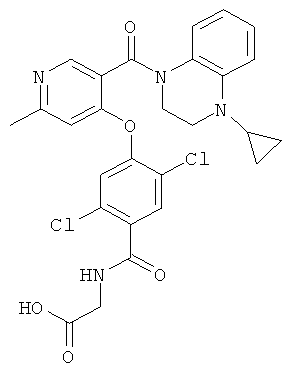
К раствору 38 мг (0,067 ммоль) метилового эфира {2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-бензоиламино}-уксусной кислоты (Пример 69) в 2 мл диоксана добавляли 2 мл воды и 4 мг (0,083 ммоль) моногидрата гидроксида лития. Реакционную смесь перемешивали при комнатной температуре в течение 4 часов и затем выливали в 20 мл 1 н водной соляной кислоты и 20 мл этилацетата. Слои разделяли и водный слой экстрагировали второй раз 20 мл этилацетата. Объединенные органические слои промывали 30 мл солевого раствора, высушивали над сульфатом магния, фильтровали и концентрировали в вакууме, что давало 10 мг (27%) требуемого соединения в виде светло-желтого твердого вещества. MS (ESI): m/z=555,119 [М+Н]+.
Пример 71
2,5-Дихлор-4-[5-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-N-(1Н-тетразол-5-ил)-бензамид
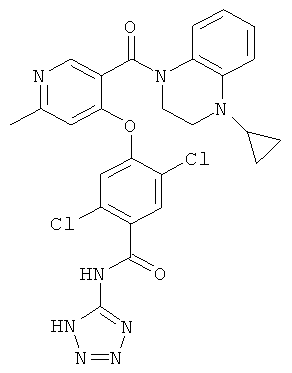
Указанное в заголовке соединение получали по аналогии с Примером 39 из 2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-бензойной кислоты (Пример 66) и 5-амино-Ч Н-тетразола (имеется в продаже, CAS RN 4418-61-5). Соединение очищали дважды с помощью препаративной ВЭЖХ (колонка Phenomenex Gemini) с градиентом ацетонитрил:
вода (содержащая 0,05% муравьиной кислоты) (50:50 до 95:5), что давало 17 мг (15%) указанного в заголовке соединения в виде белого твердого вещества. MS (ESI):m/z=563,109 [М+Н]+.
Пример 72
2,5-Дихлор-4-[5-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-N-(1Н-тетразол-5-илметил)-бензамид
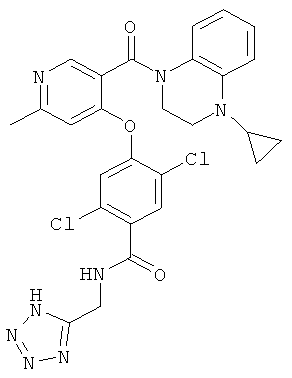
Указанное в заголовке соединение получали по аналогии с Примером 38 из 2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-бензойной кислоты (Пример 66) и 5-(аминометил)-тетразола (имеется в продаже, CAS RN 31602-63-8), что давало 47 мг (40%) указанного в заголовке соединения в виде светло-желтого твердого вещества. MS (ESI): m/z 579,142 [М+Н]+.
Пример 73
[2-Хлор-4-(2,5-дихлор-фенокси)-6-метил-пиридин-3-ил]-(4-циклопропил-3,4-дигидро-2Н-хиноксалин-1-ил)-метанон
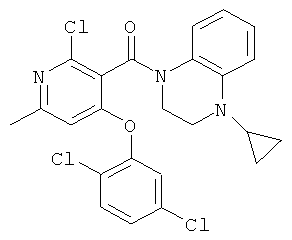
К раствору 120 мг (0,355 ммоль) 2-хлор-4-(2,5-дихлор-фенокси)-6-метил-никотината лития в 3 мл безводного N,N-диметилформамида добавляли 0,30 мл (1,773 ммоль) /V-этилдиизопропиламина и 163 мг (0,425 ммоль) 0-(7-азабензотриазол-1-ил)-Л/,Л/,Л/',Л/'-тетраметилурония гексафторфосфата (HATU, имеется в продаже, CAS RN 148893-10-1) и 74 мг (0,425 ммоль) 1-циклопропил-1,2,3,4-тетрагидро-хиноксалина (Пример 8, промежуточное соединение а). Реакционную смесь перемешивали в течение 18 часов при комнатной температуре и выпаривали. Остаток очищали с помощью системы препаративной ВЭЖХ (колонка Phenomenex Gemini), используя градиент ацетонитрил: вода (содержащая 0,05% муравьиной кислоты) (50: 50 до 100: 0), что давало 45 мг (26%) указанного в заголовке соединения в виде светло-желтой пены (30%). MS (ESI): m/z=488,07 [M+H]+.
Промежуточные соединения
а) 2-Хлор-4-(2.5-дихлор-фенокси)-6-метил-никотинат лития К раствору 130 мг (0,36 ммоль) этилового эфира 2-хлор-4-(2,5-дихлор-фенокси)-6-метил-никотиновой кислоты в 2 мл диоксана добавляли 2 мл воды и 23 мг (0,541 ммоль) моногидрата гидроксида лития. Реакционную смесь перемешивали при 100°С в течение 4 часов. Реакционную смеь охлаждали до комнатной температуры и концентрировали в высоком вакууме. Таким образом полученное светло-желтое твердое вещество было достаточно чистым для использования на следующей стадии без дополнительной очистки. MS (ESI): m/z=331,965[М+Н]+.
b) Этиловый эфир 2-хлор-4-(2.5-дихлор-(Ьенокси)-6-метил-никотиновой кислоты
К раствору 500 мг (2,136 ммоль) этил 2,4-дихлор-6-метилпиридин-3-карбоксилата (имеется в продаже, CAS RN 86129-63-7) в 7,5 мл безводного N,N-диметилформамида добавляли 366 мг (2,243 ммоль) 2,5-дихлорфенола и 590 мг (4,272 ммоль) карбоната калия, и 41 мг (0,214 ммоль) иодида меди (I), и 41 мг (0,641 ммоль) медного нанопорошка (средний размер частиц 100 нм). Реакционную смесь перемешивали при 120°С в течение 18 часов и затем выливали в 30 мл 1 н водной соляной кислоты и 30 мл этилацетата. Слои разделяли и водный слой экстрагировали второй раз 30 мл этилацетата. Объединенные органические слои промывали 30 мл солевого раствора, высушивали над сульфатом магния, фильтровали и концентрировали в вакууме. Остаток очищали с помощью препаративной ВЭЖХ (колонка Phenomenex Gemini) с градиентом ацетонитрил: вода (50: 50 до 100: 0), что давало 35 мг (18%) указанного в заголовке соединения в виде светло-желтого масла. MS (ESI): m/z=359,995 [М+Н]+.
Пример 74
[6-Хлор-4-(2,5-дихлор-фенокси)-пиридин-3-ил]-(3,4-дигидро-2H-хинолин-1-ил)-метанон
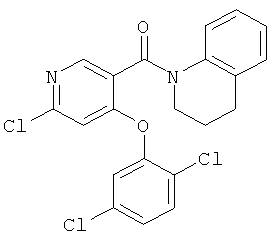
К раствору 0,12 г (0,29 ммоль) [4-(2,5-дихлор-фенокси)-1-окси-пиридин-3-ил]-(3,4-дигидро-2H-хинолин-1-ил)-метанона (Пример 10) в 1 мл толуола добавляли 0,11 мл (1,15 ммоль) оксихлорида фосфора и полученную в результате суспензию нагревали до 100°С. Быстро образующийся раствор перемешивали при этой температуре в течение 2,5 часов, после чего добавляли еще 0,11 мл (1,15 ммоль) оксихлорида фосфора. После перемешивания в течение еще 2,5 часов реакционную смесь охлаждали до комнатной температуры, выливали в насыщенный водный раствор гидрокарбоната натрия и экстрагировали три раза этилацетатом. Органические слои промывали солевым раствором, высушивали над сульфатом магния, фильтровали, обрабатывали с силикагелем и выпаривали досуха. Полученный в результате порошок очищали с помощью хроматографии на силикагеле, используя систему СДЖХ (10 г силикагелевая колонка, CombiFlash Companion, Isco Inc.), элюируя градиентом н-гептан: этилацетат (100: 0 до 50: 50), получая светло-кричневое твердое вещество, содержащее смесь 2- и 4-хлор-замещенного соединения. Два изомера разделяли с помощью препаративной ВЭЖХ (колонка Chiralpak AD), используя смесь этанол: н-гептан в качестве элюента (30: 70), требуемый продукт элюировался вторым. Белое твердое вещество (0,026 г, 82%). MS (ESI): m/z=433,03 [М+Н]+.
Пример 75
(4-Циклопропил-3,4-дигидро-2Н-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-1-окси-пиридин-3-ил]-метанон
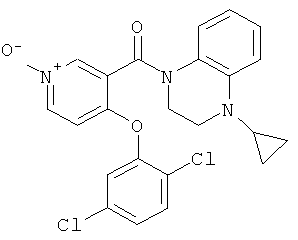
К раствору 230 мг (0,766 ммоль) 4-(2,5-дихлор-фенокси)-1-окси-никотиновой кислоты в 3 мл безводного N,N-Диметилформамида добавляли 0,65 мл (3,832 ммоль) N-этилдиизопропиламина и 352 мг (0,920 ммоль) O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата (HATU, имеется в продаже, CAS RN 148893-10-1) и 160 мг (0,920 ммоль) 1-циклопропил-1,2,3,4-тетрагидро-хиноксалина (Пример 8, промежуточное соединение а). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов и затем выливали в 30 мл 10% водного раствора гидрокарбоната натрия и 30 мл этилацетата. Слои разделяли и водный слой экстрагировали 30 мл этилацетата. Объединенные органические слои промывали 30 мл солевого раствора, высушивали над сульфатом магния, фильтровали и концентрировали в вакууме. Остаток очищали с помощью препаративной ВЭЖХ (колонка Phenomenex Gemini) с градиентом ацетонитрил: вода (содержащая 0,05% муравьиной кислоты) (10:90 до 98:2). MS (ESI): m/z=456,087 [M+H]+.
Промежуточное соединение 4-(2.5-Дихлор-фенокси)-1 -окси-никотиновая кислота
К суспензии 0,5 г (1,760 ммоль) 4-(2,5-дихлор-фенокси)-никотиновой кислоты (Пример 1, промежуточное соединение) в 7,5 мл дихлорметана добавляли 0,542 г (2,200 ммоль) м-хлорнадбензойной кислоты (Aldrich, CAS RN 937-14-4) при 0°С.Реакционную смесь перемешивали в течение 3 часов при комнатной температуре. Белую суспензию фильтровали и промывали 10 мл дихлорметана, что давало 492 мг (86%) требуемого соединения в виде белого твердого вещества. MS (ESI): m/z=299,983 [М+Н]+.
Пример 76 [4-(2,5-Дихлор-фенокси)-пиримидин-5-ил]-(3,4-дигидро-2H-хинолин-1-ил)-метанон
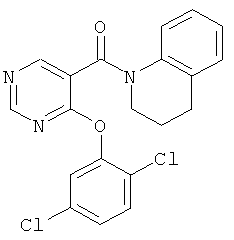
К раствору 200 мг (0,7 ммоль) 4-(2,5-дихлор-фенокси)-пиримидин-5-карбоновой кислоты в 2 мл дихлорметана добавляли 197 мг (0,77 ммоль) 2-хлор-1-метилпиридиния иодида (имеется в продаже, CAS RN 14338-32-0), 0,2 мл (1,4 ммоль) триэтиламина и 103 мг (0,77 ммоль) 1,2,3,4-тетрагидрохинолина (имеется в продаже, CAS RN 635-46-1). Раствор перемешивали 2 часа при комнатной температуре. Реакционную смесь выливали в насыщенный водный раствор гидрокарбоната натрия и экстрагировали три раза дихлорметаном. Объединенные органические слои высушивали над сульфатом магния и концентрировали в вакууме. Остаток очищали с помощью препаративной ВЭЖХ (колонка Phenomenex Gemini), используя градиент ацетонитрил: вода (содержащая 0,05% муравьиной кислоты) (10: 90 до 98: 2), что давало 5,6 мг (2%) требуемого соединения. MS (ESI): m/z=400,2 [М+Н]+.
Промежуточные соединения
а) 4-(2.5-Дихлор-фенокси)-пиримидин-5-карбоновая кислота К раствору 515 мг (1,64 ммоль) этилового эфира 4-(2,5-дихлор-фенокси)-пиримидин-5-карбоновой кислоты в 10 мл тетрагидрофурана / воды (2/1 об/об) добавляли 3,29 мл (3,28 ммоль) 1 М водного раствора гидроксида натрия и полученный в результате раствор нагревали под действием микроволнового излучения (Emrys Optimizer, Personal Chemistry) 30 минут при 80°С.Растворители выпаривали в вакууме и остаток экстрагировали три раза этилацетатом и 1 М водной соляной кислотой. Объединенные органические слои высушивали над сульфатом магния, фильтровали и выпаривали, что давало 385 мг (57%) требуемого соединения в виде порошка белого оттенка. MS (ESI): m/z=238,8 [М-Н]-.
b) Этиловый эфир 4-(2.5-дихлор-фенокси)-пиримидин-5-карбоновой кислоты
К раствору 420 мг (2,25 ммоль) этилового эфира 4-хлорпиримидин-5-карбоновой кислоты (имеется в продаже, CAS RN 41103-17-7) и 440 мг (2,7 ммоль) 2,5-дихлорфенола (имеется в продаже, CAS RN 583-78-8) в 2,5 мл толуола добавляли 688 мг (5,17 ммоль) карбоната цезия и 168 мг (0,45 ммоль) гексафторфосфата тетракис(ацетонитрил)меди (I) (имеется в продаже, CAS RN 64443-05-6). Реакционную смесь нагревали с обратным холодильником в течение 2,5 часов. Растворитель выпаривали и неочищенный продукт реакции экстрагировали этилацетатом из водного насыщенного раствора гидрокарбоната натрия. Органический слой высушивали над сульфатом магния, фильтровали и выпаривали. Полученный в результате продукт очищали с помощью хроматографии на силикагеле, используя систему СДЖХ (силикагелевая колонка, CombiFlash Companion, Isco Inc.), элюируя градиентом н-гептан: этилацетат, получая 620 мг (88%) требуемого соединения в виде светло-желтого вязкого масла. MS (ESI): m/z=313,1 [М+Н]+.
Пример 77
[4-(2,5-Дихлор-фенокси)-пиримидин-5-ил]-(6-фтор-3,4-дигидро-2H-хинолин-1-ил)-метанон
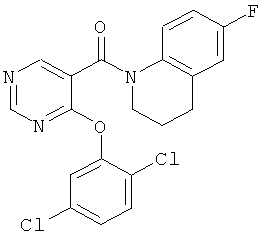
К раствору 57 мг (0,2 ммоль) 4-(2,5-дихлор-фенокси)-пиримидин-5-карбоновой кислоты (Пример 76, промежуточное соединение) в 1,5 мл N,N-диметилформамида добавляли 91 мг (0,24 ммоль) 0-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата (HATU, имеется в продаже, CAS RN 148893-10-1) и 0,102 мл (0,6 ммоль) N,N-диизопропилэтиламина. Раствор перемешивали 15 минут при 45°С, затем добавляли 36 мг (0,22 ммоль) 6-фтор-1,2,3,4-тетрагидрохинолина (имеется в продаже, CAS RN 59611-52-8). Реакционную смесь перемешивали при 45°С в течение ночи и очищали с помощью системы препаративной ВЭЖХ (колонка Phenomenex Gemini), используя градиент ацетонитрил: вода (содержащая 0,05% муравьиной кислоты) (10: 90 до 98: 2), что давало 2,5 мг (3%) требуемого соединения. MS (ESI): m/z=418,1 [М+Н]+.
Пример 78
[4-(2,5-Дихлор-фенокси)-пиримидин-5-ил]-(3,4-дигидро-2H-хиноксалин-1-ил)-метанон
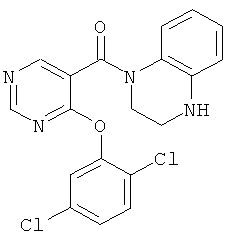
Указанное в заголовке соединение получали по аналогии с Примером 77 из 4-(2,5-дихлор-сренокси)-пиримидин-5-карбоновой кислоты (Пример 76, промежуточное соединение а) и 1,2,3,4-тетрагидрохиноксалина (имеется в продаже, CAS RN 3476-89-9). Соединение очищали с помощью препаративной ВЭЖХ (колонка Phenomenex Gemini), используя градиент ацетонитрил: вода (10: 90 до 98: 2), что давало 16 мг (20%) требуемого соединения. MS (ESI): m/z=401,0 [M+H]+.
Пример 79
[4-(2,5-Дихлор-фенокси)-пиримидин-5-ил]-(4-метил-3,4-дигидро-2Н-хиноксалин-1-ил)-метанон
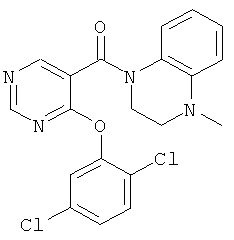
Указанное в заголовке соединение получали по аналогии с Примером 77 из 4-(2,5-дихлор-фенокси)-пиримидин-5-карбоновой кислоты и 1 -метил-1,2,3,4-тетрагидрохиноксалина (имеется в продаже, Metina, номер по каталогу М-636). Соединение очищали с помощью препаративной ВЭЖХ (колонка Phenomenex Gemini), используя градиент ацетонитрил: вода (10: 90 до 98: 2), что давало 6,5 мг (8%) требуемого соединения. MS (ESI): m/z=415,1 [M+H]+.
Пример 80
(2-Метокси-пиридин-3-ил)-метил-амид4-(2,5-дихлор-фенокси)-пиримидин-5-карбоновой кислоты
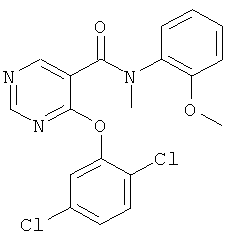
К раствору 50 мг (0,17 ммоль) 4-(2,5-дихлор-фенокси)-пиримидин-5-карбоновой кислоты (Пример 76, промежуточное соединение а) в 1,5 мл дихлорметана добавляли 0,05 мл (0,34 ммоль) триэтиламина и 49 мг (0,19 ммоль) 2-хлор-1-метилпиридиния иодида. После перемешивания при комнатной температуре в течение 20 минут добавляли 24 мг (0,19 ммоль) 2-метоксипиридин-3-амина (имеется в продаже, CAS RN 20265-38-7). Через 2 часа реакционную смесь выливали в воду и экстрагировали дихлорметаном. Органический слой высушивали над сульфатом магния, фильтровали и выпаривали. Неочищенный продукт растворяли в 1 мл N,N-диметилформамида и добавляли 14 мг (0,35 ммоль) гидрида натрия (60% суспензия в минеральном масле), затем 0,02 мл (0,35 ммоль) метилиодида. Реакционную смесь перемешивали при 50°С в течение 2 часов. Суспензию фильтровали, используя шприцевой микрофильтр, и очищали с помощью системы препаративной ВЭЖХ (колонка Phenomenex Gemini), используя градиент ацетонитрил: вода (содержащая 0,05% муравьиной кислоты) (10:90 до 98:2), что давало 28 мг (39%) требуемого соединения в виде светло-коричневого твердого вещества. MS (ESI): m/z=405,0 [М+Н]+.
Пример А
Покрытые пленочной оболочкой таблетки, содержащие следующие ингредиенты, могут быть изготовлены обычным способом:
Активный ингредиент просеивают и смешивают с микрокристаллической целлюлозой и смесь гранулируют с раствором поливинилпирролидона в воде. Гранулят смешивают с натрия крахмала гликолятом и стеаратом магния и сжимают, что дает ядра 120 или 350 мг соответственно. Ядра лакируют водным раствором / суспензией вышеупомянутой пленочной оболочки.
Пример В
Капсулы, содержащие следующие ингредиенты, могут быть изготовлены обычным способом:
Компоненты просеивают, смешивают и заполняют капсулы размером 2.
Пример С
Растворы для инъекций могут иметь следующий состав:
Активный ингредиент растворяют в смеси полиэтиленгликоля 400 и воды для инъекции (часть). Доводят рН до 5,0 с уксусной кислотой. Доводят объем до 1,0 мл, добавляя оставшееся количество воды. Раствор фильтруют, заполняют им ампулы, используя допустимый избыток, и стерилизуют.
Пример D
Мягкие желатиновые капсулы, содержащие следующие ингредиенты, могут быть изготовлены обычным способом:
Активный ингредиент растворяют в теплой расплавленной массе других ингредиентов и смесью заполняют мягкие желатиновые капсулы соответствующего размера. Заполненные мягкие желатиновые капсулы обрабатывают в соответствии с обычными процедурами.
Пример Е
Пакетики, содержащие следующие ингредиенты, могут быть изготовлены обычным способом;
Активный ингредиент смешивают с лактозой, микрокристаллической целлюлозой и карбоксиметилцеллюлозой натрия и гранулируют со смесью поливинилпирролидона в воде. Гранулят смешивают со стеаратом магния и вкусовыми добавками и заполняют пакетики.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ ФЕНИЛАМИДНЫЕ ИЛИ ПИРИДИЛАМИДНЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АГОНИСТОВ GPBAR1 | 2009 |
|
RU2533887C2 |
| ПРОИЗВОДНЫЕ 1,1,1-ТРИФТОР-2-ГИДРОКСИ-3-ФЕНИЛПРОПАНА | 2008 |
|
RU2481333C2 |
| АМИДЫ КОНДЕНСИРОВАННОГО ПИПЕРИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ ИОННЫХ КАНАЛОВ | 2014 |
|
RU2741810C2 |
| 1-ГИДРОКСИИМИНО-3-ФЕНИЛ-ПРОПАНЫ | 2011 |
|
RU2579114C9 |
| НОВЫЕ ПИРИДИНОНЫ И ПИРИДАЗИНОНЫ | 2009 |
|
RU2505538C2 |
| ПРОИЗВОДНЫЕ БЕНЗОТИАЗИНОВ, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВ | 2010 |
|
RU2523791C2 |
| АМИНОТЕТРАЛИНОВЫЕ ПРОИЗВОДНЫЕ, СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ | 2010 |
|
RU2546649C2 |
| ФЕНОКСИМЕТИЛЬНЫЕ ПРОИЗВОДНЫЕ | 2016 |
|
RU2746481C1 |
| Гетероциклические соединения в качестве ингибиторов PAD | 2018 |
|
RU2764243C2 |
| ИНГИБИТОРЫ ТИРОЗИНКИНАЗЫ БРУТОНА | 2010 |
|
RU2542585C2 |
Изобретение относится к соединениям формулы I, где А1 представляет собой CR13; А2 представляет собой CR14 или N; R1 и R2 независимо друг от друга выбраны из водорода, галогена, и галоген-C1-7-алкила; R13 и R14 независимо друг от друга выбраны из водорода, C1-7-алкила, галогена, галоген-C1-7-алкила и C1-7-алкокси; R3 выбран из водорода, C1-7-алкила, галогена, C1-7-алкокси, пиперидинила и -NR15R16, где R15 и R16 независимо друг от друга выбраны из водорода, C1-7-алкила и C3-7-циклоалкила; R4 выбран из водорода и C1-7-алкила; или R3 и R4 или R3 и R14 вместе представляют собой -X-(CR17R18)n- и образуют часть кольца, где X выбран из -CR19R20- и -NR21-; R17, R18, R19, R20 являются водородом; R21 выбран из водорода, C1-7-алкила, C3-7-циклоалкила или С3-7-циклоалкил-C1-7-алкила, где C3-7-циклоалкил не замещен или замещен C1-7-алкоксикарбонилом, и C1-7-алкилсульфонила; и n представляет собой 1, 2 или 3; B1 представляет собой N или N+-O-; B2 представляет собой CR7 или N; R5, R6 и R7 независимо друг от друга выбраны из водорода, галогена и C1-7-алкила; и R8, R9, R10, R11 и R12 являются такими, как указано в формуле изобретения. Также соединение относится к фармацевтически приемлемым солям соединений формулы I и к фармацевтическим композициям, обладающим агонистической активностью в отношении рецептора GPBAR1. Технический результат - соединения формулы I в качестве агонистов GPBAR1. 2 н. и 18 з.п. ф-лы, 85 пр.
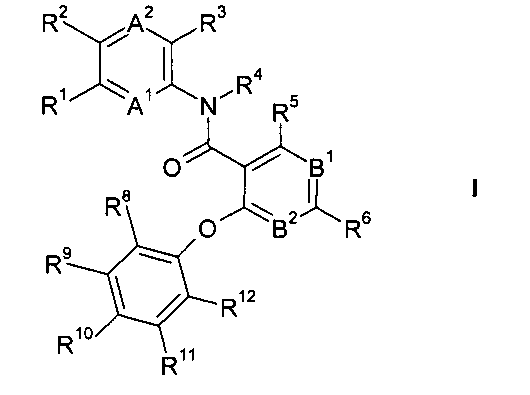
1. Соединения формулы

где
А1 представляет собой CR13;
А2 представляет собой CR14 или N;
R1 и R2 независимо друг от друга выбраны из группы, состоящей из водорода, галогена и галоген-C1-7-алкила;
R13 и R14 независимо друг от друга выбраны из группы, состоящей из водорода, C1-7-алкила, галогена, галоген-C1-7-алкила и C1-7-алкокси;
R3 выбран из группы, состоящей из водорода, C1-7-алкила, галогена, C1-7-алкокси, пиперидинила и -NR15R16, где R15 и R16 независимо друг от друга выбраны из водорода, C1-7-алкила и C3-7-циклоалкила;
R4 выбран из группы, состоящей из водорода и C1-7-алкила; или
R3 и R4 или R3 и R14 вместе представляют собой -X-(CR17R18)n- и образуют часть кольца, где
X выбран из группы, состоящей из -CR19R20- и -NR21-;
R17 и R18 являются водородом;
R19 и R20 являются водородом;
R21 выбран из группы, состоящей из водорода, C1-7-алкила, C3-7-циклоалкила или С3-7-циклоалкил-C1-7-алкила, где C3-7-циклоалкил не замещен или замещен C1-7-алкоксикарбонилом, и C1-7-алкилсульфонила;
и n представляет собой 1, 2 или 3;
B1 представляет собой N или N+-O-;
B2 представляет собой CR7 или N;
R5, R6 и R7 независимо друг от друга выбраны из группы, состоящей из водорода, галогена и C1-7-алкила;
и R8, R9, R10, R11 и R12 независимо друг от друга выбраны из группы, состоящей из
водорода, галогена, гидрокси, гидрокси-C1-7-алкокси,
гидрокси-C1-7-алкила,
циано, карбоксила, C1-7-алкоксикарбонила, аминокарбонила,
карбоксил-C1-7-алкокси, C1-7-алкоксикарбонил-C1-7-алкокси,
карбоксил-C1-7-алкил-аминокарбонила, карбоксил-C1-7-алкил-(C1-7-алкиламино)-карбонила,
C1-7-алкоксикарбонил-C1-7-алкил-аминокарбонила, C1-7-алкоксикарбонил-C1-7-алкил-(C1-7-алкиламино)-карбонила,
гидрокси-C1-7-алкил-аминокарбонила, ди-(гидрокси-C1-7-алкил)аминокарбонила,
аминокарбонил-C1-7-алкил-аминокарбонила,
гидроксисульфонил-C1-7-алкил-аминокарбонила, гидроксисульфонил-C1-7-алкил-(C1-7-алкил-амино)-карбонила,
ди-(C1-7-алкоксикарбонил-C1-7-алкил)-метиламинокарбонила,
фенил-аминокарбонила, где фенил не замещен или замещен одной - тремя группами, выбранными из карбоксила или C1-7-алкоксикарбонила,
гетероарил-аминокарбонила, где гетероарил является 5-членным и выбран из пирролила, тиадиазолила, тетразолила и тиазолила и где гетероарил не замещен или замещен одной - тремя группами, выбранными из C1-7-алкила, карбоксила или C1-7-алкоксикарбонила,
гетероарил-C1-7-алкил-аминокарбонила, где гетероарил является тетразолилом;
или их фармацевтически приемлемые соли,
при условии, что соединения, выбранные из группы, состоящей из
2-хлор-4-(3-хлорфенокси)-N-(2,6-диметилфенил)-5-пиримидинкарбоксамида,
2-хлор-N-(2,6-дихлорфенил)-4-(2-метоксифенокси)-5-пиримидинкарбоксамида,
4-[3-(2,2,2-трифторэтил)фенокси]-2-(трифторметил)-N-[3-(трифторметил)фенил]-5-пиримидинкарбоксамида,
N-(4-фторфенил)-4-[3-(2,2,2-трифторэтил)фенокси]-2-(трифторметил)-5-пиримидинкарбоксамида,
N-(2,4-дифторфенил)-2-(трифторметил)-4-[3-(трифторметил)фенокси]-5-пиримидинкарбоксамида и
N-(2,4-дихлорфенил)-2-(трифторметил)-4-[3-(трифторметил)фенокси]-5-пиримидинкарбоксамида, исключены.
2. Соединения формулы I по п. 1, где А1 представляет собой CR13 и А2 представляет собой CR14 и где R13 и R14 независимо друг от друга выбраны из группы, состоящей из водорода, галогена, галоген-C1-7-алкила и C1-7-алкокси.
3. Соединения формулы I по п. 1, где А1 представляет собой CR13 и А2 представляет собой N, причем R13 и R14 независимо друг от друга выбраны из группы, состоящей из водорода, галогена, галоген-C1-7-алкила и C1-7-алкокси.
4. Соединения формулы I по п. 1, где R1 и R2 независимо друг от друга выбраны из группы, состоящей из водорода, галогена и галоген-C1-7-алкила.
5. Соединения формулы I по п. 1, где R3 и R4 вместе представляют собой -X-(CR17R18)n- и образуют часть кольца, где
X выбран из группы, состоящей из -CR19R20- и -NR21-;
R17 и R18 являются водородом;
R19 и R20 являются водородом;
R21 выбран из группы, состоящей из водорода, C1-7-алкила, C3-7-циклоалкила или C3-7-циклоалкил-C1-7-алкила, где C3-7-циклоалкил не замещен или замещен C1-7-алкоксикарбонилом, C1-7-алкилсульфонила;
и n представляет собой 1, 2 или 3.
6. Соединения формулы I по п. 5, где X представляет собой -NR21-,
R21 выбран из группы, состоящей из водорода, C1-7-алкила,
C3-7-циклоалкила или C3-7-циклоалкил-C1-7-алкила, где C3-7-циклоалкил не замещен или замещен C1-7-алкоксикарбонилом, и C1-7-алкилсульфонила,
R17 и R18 являются водородом и n представляет собой 2.
7. Соединения формулы I по п. 5, где X представляет собой -СН2-, R17 и R18 являются водородом и n представляет собой 2.
8. Соединения формулы I по п. 1, где R3 и R14 вместе представляют собой -X-(CR17R18)n- и образуют часть кольца; где X представляет собой -NR21-, R21 выбран из группы, состоящей из водорода, C1-7-алкила и C3-7-циклоалкила, R17 и R18 являются водородом и n представляет собой 2.
9. Соединения формулы I по п. 1, где R3 выбран из группы, состоящей из водорода, C1-7-алкила, C1-7-алкокси, пиперидинила и -NR15R16, где R15 и R16 независимо друг от друга выбраны из водорода, C1-7-алкила и C3-7-циклоалкила, и R4 представляет собой водород или метил.
10. Соединения формулы I по п. 1, где В1 представляет собой N или N+-O- и В2 представляет собой CR7, причем R7 выбран из группы, состоящей из водорода, галогена и C1-7-алкила.
11. Соединения формулы I по п. 1, где В1 представляет собой N и В2 представляет собой N.
12. Соединения формулы I по п. 1, где R5 и R6 независимо друг от друга представляют собой водород, галоген и C1-7-алкил.
13. Соединения формулы I по п. 1, где по меньшей мере два из R8, R9, R10, R11 и R12 выбраны из группы, состоящей из
галогена, гидрокси, гидрокси-C1-7-алкокси,
гидрокси-C1-7-алкила,
циано, карбоксила, C1-7-алкоксикарбонила, аминокарбонила,
карбоксил-C1-7-алкокси, C1-7-алкоксикарбонил-C1-7-алкокси,
карбоксил-C1-7-алкил-аминокарбонила, карбоксил-C1-7-алкил-(C1-7-алкиламино)-карбонила,
C1-7-алкоксикарбонил-C1-7-алкил-аминокарбонила, C1-7-алкоксикарбонил-C1-7-алкил-(C1-7-алкиламино)-карбонила,
гидрокси-C1-7-алкил-аминокарбонила, ди-(гидрокси-C1-7-алкил)аминокарбонила, аминокарбонил-C1-7-алкил-аминокарбонила,
гидроксисульфонил-C1-7-алкил-аминокарбонила, гидроксисульфонил-С1-7-алкил-(C1-7-алкил-амино)-карбонила,
ди-(C1-7-алкоксикарбонил-C1-7-алкил)-метиламинокарбонила,
фенил-аминокарбонила, где фенил не замещен или замещен одной - тремя группами, выбранными из карбоксила или C1-7-алкоксикарбонила,
гетероарил-аминокарбонила, где гетероарил является 5-членным и выбран из пирролила, тиадиазолила, тетразолила и тиазолила и где гетероарил не замещен или замещен одной - тремя группами, выбранными из C1-7-алкила, карбоксила или C1-7-алкоксикарбонила,
гетероарил-C1-7-алкил-аминокарбонила, где гетероарил является тетразолилом, и другие R8, R9, R10, R11 и R12 представляют собой водород.
14. Соединения формулы I по п. 1, где по меньшей мере два из R8, R9, R10, R11 и R12 выбраны из группы, состоящей из
галогена, гидрокси, гидрокси-C1-7-алкокси, гидрокси-C1-7-алкила, циано, карбоксила, C1-7-алкоксикарбонила, аминокарбонила,
карбоксил-C1-7-алкокси, C1-7-алкоксикарбонил-C1-7-алкокси,
карбоксил-C1-7-алкил-аминокарбонила, карбоксил-C1-7-алкил-(C1-7-алкиламино)-карбонила,
C1-7-алкоксикарбонил-C1-7-алкил-аминокарбонила,
гидрокси-C1-7-алкил-аминокарбонила, ди-(гидрокси-C1-7-алкил)аминокарбонила, аминокарбонил-C1-7-алкил-аминокарбонила,
гидроксисульфонил-C1-7-алкил-аминокарбонила, гидроксисульфонил-C1-7-алкил-(C1-7-алкил-амино)-карбонила,
ди-(C1-7-алкоксикарбонил-C1-7-алкил)-метиламинокарбонила,
фенил-аминокарбонила, где фенил не замещен или замещен одной - тремя группами, выбранными из карбоксила или C1-7-алкоксикарбонила,
гетероарил-аминокарбонила, где гетероарил является 5-членным и выбран из пирролила, тиадиазолила, тетразолила и тиазолила и где гетероарил не замещен или замещен одной - тремя группами, выбранными из C1-7-алкила, карбоксила и C1-7-алкоксикарбонила,
гетероарил-C1-7-алкил-аминокарбонила, где гетероарил является тетразолилом, и другие R8, R9, R10, R11 и R12 представляют собой водород.
15. Соединения формулы I по п. 1, где R8 и R11 представляют собой галоген и R9, R10 и R12 представляют собой водород.
16. Соединения формулы I по п. 1, выбранные из группы, состоящей из
[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-(3,4-дигидро-2H-хинолин-1-ил)-метанона,
[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-(6,7-дифтор-3,4-дигидро-2H-хинолин-1-ил)-метанона,
[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-(3,4-дигидро-2H-хиноксалин-1-ил)-метанона,
[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-(4-метил-3,4-дигидро-2H-хиноксалин-1-ил)-метанона,
этилового эфира 2-{4-[4-(2,5-дихлор-фенокси)-пиридин-3-карбонил]-3,4-дигидро-2H-хиноксалин-1-илметил}-циклопропанкарбоновой кислоты,
(4-циклопропилметил-3,4-дигидро-2H-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-метанона,
[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-(4-метансульфонил-3,4-дигидро-2H-хиноксалин-1-ил)-метанона,
(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-метанона,
(6-хлор-4-циклопропил-7-фтор-3,4-дигидро-2H-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-метанона,
[4-(2,5-дихлор-фенокси)-1-окси-пиридин-3-ил]-(3,4-дигидро-2H-хинолин-1-ил)-метанона,
(6-хлор-4-циклопропил-3,4-дигидро-2H-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-метанона,
4-(2,5-дихлор-фенокси)-N-(5-фтор-2-метокси-фенил)-N-метил-никотинамида,
4-(2,5-дихлор-фенокси)-N-метил-N-о-толил-никотинамида,
4-(2,5-дихлор-фенокси)-N-(2-метокси-фенил)-N-метил-никотинамида,
4-(2,5-дихлор-фенокси)-N-(2-метокси-пиридин-3-ил)-N-метил-никотинамида,
4-(2,5-дихлор-фенокси)-N-(2-диметиламино-фенил)-N-метил-никотинамида,
4-(2,5-дихлор-фенокси)-N-метил-N-(2-пиперидин-1-ил-фенил)-никотинамида,
N-(3,5-бис-трифторметил-фенил)-4-(2,5-дихлор-фенокси)-N-метил-никотинамида,
4-(2,5-дихлор-фенокси)-N-(4,5-дифтор-2-метокси-фенил)-N-метил-никотинамида,
N-(5-хлор-2-диметиламино-фенил)-4-(2,5-дихлор-фенокси)-N-метил-никотинамида,
4-(2,5-дихлор-фенокси)-N-(4,5-дифтор-2-метиламино-фенил)-N-метил-никотинамида,
4-(2,5-дихлор-фенокси)-N-(1,2,3,4-тетрагидро-хинолин-8-ил)-никотинамида,
4-(2,5-дихлор-фенокси)-N-(2-диметиламино-пиридин-3-ил)-N-метил-никотинамида,
4-(2,5-дихлор-фенокси)-N-метил-N-(1,2,3,4-тетрагидро-хинолин-8-ил)-никотинамида,
N-[4-хлор-2-(циклопропил-метил-амино)-5-фтор-фенил]-4-(2,5-дихлор-фенокси)-N-метил-никотинамида,
[4-(4-бром-2,5-дихлор-фенокси)-пиридин-3-ил]-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-ил)-метанона,
метилового эфира 2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензойной кислоты,
диметилового эфира 4-хлор-5-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-фталевой кислоты,
метилового эфира {2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-уксусной кислоты,
{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-уксусной кислоты,
метилового эфира ({2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоил}-метил-амино)-уксусной кислоты,
({2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоил}-метил-амино)-уксусной кислоты,
этилового эфира 3-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-пропионовой кислоты,
3-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-пропионовой кислоты,
2-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-этансульфоновой кислоты,
2-({2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоил}-метил-амино)-этансульфоновой кислоты,
3-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-пропан-1-сульфоновой кислоты,
2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-N-(1H-тетразол-5-ил)-бензамида,
2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-N-(1H-тетразол-5-илметил)-бензамида,
4-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-масляной кислоты,
метилового эфира 4-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-1-метил-1H-пиррол-2-карбоновой кислоты,
4-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-1-метил-1H-пиррол-2-карбоновой кислоты,
метилового эфира 4-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-бензойной кислоты,
4-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-бензойной кислоты,
этилового эфира 2-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-4-метил-тиазол-5-карбоновой кислоты,
2-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-4-метил-тиазол-5-карбоновой кислоты,
этилового эфира 5-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-[1,3,4]тиадиазол-2-карбоновой кислоты,
2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-N-[1,3,4]тиадиазол-2-ил-бензамида,
2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-N-(2-гидрокси-этил)-бензамида,
2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-N,N-бис-(2-гидрокси-этил)-бензамида,
2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-N-(2-гидрокси-1-гидроксиметил-этил)-бензамида,
2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензамида,
N-(2-карбамоил-этил)-2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензамида,
диметилового эфира 4-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-гептандиовой кислоты,
(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-ил)-[4-(2,5-дихлор-4-гидроксиметил-фенокси)-пиридин-3-ил]-метанона,
2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензонитрила,
(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-ил)-[4-(2,5-дихлор-4-гидрокси-фенокси)-пиридин-3-ил]-метанона,
этилового эфира {2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-фенокси}-уксусной кислоты,
{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-фенокси}-уксусной кислоты,
этилового эфира 2-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-фенокси}-2-метил-пропионовой кислоты,
2-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-фенокси}-2-метил-пропионовой кислоты,
(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-ил)-{4-[2,5-дихлор-4-(2-гидрокси-этокси)-фенокси]-пиридин-3-ил}-метанона,
(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-6-метил-пиридин-3-ил]-метанона,
[4-(4-бром-2,5-дихлор-фенокси)-6-метил-пиридин-3-ил]-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-ил)-метанона,
метилового эфира 2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-бензойной кислоты,
2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-бензойной кислоты,
этилового эфира 3-{2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-бензоиламино}-пропионовой кислоты,
3-{2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-бензоиламино}-пропионовой кислоты,
метилового эфира {2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-бензоиламино}-уксусной кислоты,
{2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-бензоиламино}-уксусной кислоты,
2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-N-(1H-тетразол-5-ил)-бензамида,
2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-N-(1H-тетразол-5-илметил)-бензамида,
[2-хлор-4-(2,5-дихлор-фенокси)-6-метил-пиридин-3-ил]-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-ил)-метанона,
[6-хлор-4-(2,5-дихлор-фенокси)-пиридин-3-ил]-(3,4-дигидро-2H-хинолин-1-ил)-метанона,
(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-1-окси-пиридин-3-ил]-метанона,
[4-(2,5-дихлор-фенокси)-пиримидин-5-ил]-(3,4-дигидро-2H-хинолин-1-ил)-метанона,
[4-(2,5-дихлор-фенокси)-пиримидин-5-ил]-(6-фтор-3,4-дигидро-2H-хинолин-1-ил)-метанона,
[4-(2,5-дихлор-фенокси)-пиримидин-5-ил]-(3,4-дигидро-2H-хиноксалин-1-ил)-метанона,
[4-(2,5-дихлор-фенокси)-пиримидин-5-ил]-(4-метил-3,4-дигидро-2H-хиноксалин-1-ил)-метанона,
(2-метокси-пиридин-3-ил)-метил-амида 4-(2,5-дихлор-фенокси)-пиримидин-5-карбоновой кислоты,
или их фармацевтически приемлемые соли.
17. Соединения формулы I по п. 1, выбранные из группы, состоящей из
[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-(4-метил-3,4-дигидро-2H-хиноксалин-1-ил)-метанона,
(4-цикпопропилметил-3,4-дигидро-2H-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-метанона,
(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-метанона,
(6-хлор-4-циклопропил-3,4-дигидро-2H-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-пиридин-3-ил]-метанона,
[4-(4-бром-2,5-дихлор-фенокси)-пиридин-3-ил]-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-ил)-метанона,
{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-уксусной кислоты,
3-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-пропионовой кислоты,
2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-N-(1H-тетразол-5-ил)-бензамида,
2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-N-(1H-тетразол-5-илметил)-бензамида,
4-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-1-метил-1H-пиррол-2-карбоновой кислоты,
4-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-бензойной кислоты,
2-{2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензоиламино}-4-метил-тиазол-5-карбоновой кислоты,
2,5-дихлор-4-[3-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-пиридин-4-илокси]-бензонитрила,
(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-6-метил-пиридин-3-ил]-метанона,
3-{2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-бензоиламино}-пропионовой кислоты,
2,5-дихлор-4-[5-(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-карбонил)-2-метил-пиридин-4-илокси]-N-(1H-тетразол-5-ил)-бензамида,
(4-циклопропил-3,4-дигидро-2H-хиноксалин-1-ил)-[4-(2,5-дихлор-фенокси)-1-окси-пиридин-3-ил]-метанона,
[4-(2,5-дихлор-фенокси)-пиримидин-5-ил]-(4-метил-3,4-дигидро-2H-хиноксалин-1-ил)-метанона,
или их фармацевтически приемлемые соли.
18. Соединения формулы I по любому из пп. 1-17 для применения в качестве агонистов рецептора GPBAR1.
19. Соединения формулы I по любому из пп. 1-17 для применения для производства лекарственного средства для лечения нарушений, при которых агонисты GPBAR1 являются полезными.
20. Фармацевтические композиции, обладающие агонистической активностью в отношении рецептора GPBAR1, включающие терапевтически эффективное количество соединения формулы I по любому из пп. 1-17 и фармацевтически приемлемый носитель и/или адъювант.
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Электромагнитный вибратор | 1979 |
|
SU829202A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| Электрический световой сигнальный аппарат для автомобилей | 1927 |
|
SU9201A1 |
| 2,3-ДИЗАМЕЩЕННОЕ ПРОИЗВОДНОЕ ПИРИДИНА, СПОСОБЫ ЕГО ПОЛУЧЕНИЯ, СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРОМЕЖУТОЧНЫЙ ПРОДУКТ ДЛЯ ЕГО ПОЛУЧЕНИЯ | 1999 |
|
RU2235095C2 |
Авторы
Даты
2015-10-20—Публикация
2011-01-18—Подача