ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет предварительной заявки на патент США №60/638366, поданной 21 декабря 2004 года, и предварительной заявки на патент США №60/671796, поданной 15 апреля 2005 года, которые включены в настоящее описание в качестве ссылок в полном объеме.
Настоящее изобретение было выполнено при поддержке правительства в рамках гранта, присужденного RO-1 HL56728, National Institutes of Heath. В этой связи, правительство имеет определенные права на настоящее изобретение.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Практически каждому ребенку известно, что если ящерица потеряет хвост, то у нее постепенно отрастет другой. Кроме того, дети и подростки, изучающие такие явления, знают, что многие низшие животные способны к регенерации достаточно сложных структур, включая целые конечности и органы, после их повреждения. Например, рыба способна отращивать сердце после того, как значительная часть старого сердца рыбы была отсечена (Poss et al., 2002). Это удивительный результат в свете известного факта, насколько важным является сердце для ежеминутного выживания большинства животных.
Однако регенерация тканей, конечностей и органов после повреждения у людей не столь проста, как у рыб. Хотя ткани человека, пораженные механическим воздействием, болезнью и другими факторами, способны к заживлению, сложная тканевая структура и функции редко, если вообще, восстанавливаются. Напротив, восстановление практически всех тканей у человека и других высших позвоночных животных при их повреждении сопровождается преимущественным образованием фиброзной ткани. Наиболее подходящим иллюстрирующим примером будет образование обесцвеченных фиброзных рубцов, которые остаются после заживления пореза кожи или разрыва. Менее известен тот факт, что образование глиальной фиброзной ткани после повреждения мозга или позвоночника является одним из основных препятствий для восстановления нейрональных функций после повреждения центральной нервной системы (Silver and Miller JH, 2004). В настоящее время отсутствуют способы лечения или профилактики таких процессов рубцевания и усиления регенерации сложной тканевой структуры и функций после повреждений.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Предлагается выделенный полипептид, содержащий карбокси-концевую аминокислотную последовательность альфа-коннексина (называемого также как карбокси-концевой полипептид альфа-коннексина (АСТ)), или его консервативный вариант.
Предлагается также способ ускорения заживления раны после повреждения ткани у индивидуума, включающий введение указанному индивидууму одной или нескольких описываемых композиций (например, полипептидов, нуклеиновых кислот или векторов) вместе с фармацевтически приемлемым носителем.
Дополнительные преимущества описанного способа и композиций частично отмечены в приведенном ниже описании и будут очевидны из описания заявки и могут быть выявлены при практическом осуществлении приведенного в описании способа на основе композиций по настоящему изобретению. Преимущества раскрываемых способа и композиций могут быть поняты и реализованы на основе тех элементов и сочетаний, которые конкретно указаны в приведенной формуле изобретения. Следует понимать также, что и приведенное ниже общее описание и далее подробное описание даны лишь в качестве примеров и приведены лишь для пояснения, но не с целью ограничения области изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Прилагаемые для рассмотрения чертежи, включенные в текст описания и составляющие его часть, иллюстрируют несколько вариантов осуществления настоящего изобретения, применительно к раскрываемым способу и композициям, и в сочетании с описанием служат для пояснения принципов предлагаемых способа и композиций.
На фиг.1 показано, что карбокси-концевой полипептид альфа-коннексина (АСТ) усиливает степень закрытия бреши Cx43 в культуре неонатальных миоцитов. Миоциты из сердец новорожденных крыс растят до образования почти сливающегося монослоя клеток на чашке с тканевой культурой по стандартным процедурам. Далее культуры растят в течение еще 5 дней в культуральной среде, содержащей: (а) 30 мкМ АСТ 1 пептида (SEQ ID NO: 2); (b) 30 мкМ неактивного контрольного пептида (SEQ ID NO: 55); или (с) фосфатно-буферного раствора (PBS), не содержащего АСТ или контрольный пептид. Культуральные среды с добавленными пептидами или носителями-контролями меняют каждые 24 часа в ходе эксперимента. На чертеже (а) показано, что АСТ-пептид заметно повышает степень закрытия бреши Cx43 (пунктиры и линии указаны стрелками) между миоцитами, в сравнении с контрольными условиями (b) и (с). Указанное повышение степени закрытия бреши Cx43 в ответ на введение АСТ-пептида свойственно множеству клеточных типов, экспрессирующих Cx43.
На фиг.2 показано, что АСТ-пептид ингибирует пролиферацию и миграцию трансформированных фибробластов (NIH-3T3 клеток) при повреждении их царапиной. Монослой NIH-3T3 клеток подвергают предварительной обработке ACT-пептидом (SEQ ID NO: 2) в течение 24 часов и наносят кончиком пипетки p200 «повреждение царапиной». «Повреждение царапиной» далее подвергают «заживлению» в течение 24 часов в присутствии (a, b) 30 мкМ ACT 1 пептида (SEQ ID NO: 2), (c, d) 30 мкМ неактивного контрольного пептида (SEQ ID NO: 55) или (e, f) контрольного раствора носителя, не содержащего ACT-пептид или контрольный пептид. Клетки, обработанные ACT-пептидом после нанесения «повреждения царапиной», остаются относительно незаживленными в течение 24 часов (а), при этом отмечается лишь несколько клеток (крупные стрелки), повторно заселивших зону, находящуюся в пределах границ исходного «повреждения царапиной» (то есть в пределах зоны, обозначенной на чертеже маленькими черными стрелками-указателями). И, наоборот, в контрольных условиях (с) и (е) большое число клеток (крупные стрелки) повторно заселяют зону внутри исходного «повреждения царапиной». Повторное заселение в зоне «повреждения царапиной» происходит частично за счет миграции трансформированных клеток в зону «повреждения царапиной». На фиг.(b), (d) и (f) показан результат иммунологического мечения клеток в зоне «повреждения царапиной» или на краях повреждения ядерным антигеном пролиферирующих клеток (PCNA). Клетки, обработанные АСТ-пептидом (b), демонстрируют лишь низкую люминесценцию, соответствующую фоновому уровню, и отсутствие пролиферации. Только в двух контрольных условиях, показанных на (d) и (f), отмечаются ярко меченые пролиферирующие клетки (белые стрелки). Это указывает на то, что АСТ-пептид также снижает пролиферацию трансформированных клеток.
На фиг.3 показаны результаты количественной оценки ингибирования или миграции АСТ-пептидов на экспериментальной клеточной модели после нанесения повреждения. NIH-3T3 фибробласты подвергают «повреждению царапиной» и далее выдерживают при непрерывном наличии 30 мкМ ACT 1 пептида (SEQ ID NO: 2) в течение 24 часов или выдерживают в контрольных условиях, как показано на фиг.2. На фиг.(а) показан поврежденный конец клеток, обработанных АСТ-пептидом и обработанных неактивным пептидом контрольных клеток в течение 24-часового периода. Клетки метили флуоресцентным фаллоидином для целей визуализации. Клетки, обработанные АСТ-пептидом, демонстрируют низкие уровни репопуляции зоны «повреждения царапиной» (белые двойные стрелки-указатели). На фиг.(b) показана диаграмма, демонстрирующая процент площади с клетками, которые повторно заселили зону повреждения царапиной, через 24 часа. Снижение клеток в зоне повреждения в присутствии АСТ-пептида является очень резким, со значением p<0,000001.
На фиг.4 показано, что экспрессия полинуклеотида, кодирующего АСТ-пептид, который функционально связан с промотором в эпителиальных клетках WB-F344, ингибирует миграцию после повреждения царапиной на экспериментальной клеточной модели. Клетки WB-F344 представляют собой клеточную линию трансформированных эпителиальных клеток крысы, полученную путем обработки выделенных клеток печени крысы агентом, вызывающим рак (Tsao et al., 1984; Hayashi et al., 1997; Hayashi et al., 1998; Hayashi et al., 2001).
Клетки WB-F344 трансфицируют конструкцией плазмиды экспрессии кДНК и проводят отбор с использованием антибиотика по стандартному протоколу, применяемому для получения клеточных линий, которые стабильно экспрессируют полинуклеотид, кодирующий ACT-пептид (SEQ ID NO: 6), функционально связанный с промоторной последовательностью, или полинуклеотид, кодирующий зеленый флуоресцентный белок (GFP), функционально связанный с промоторной последовательностью, в качестве контроля. Полинуклеотид, кодирующий АСТ-пептид, также кодирует GFP. В качестве таковой, экспрессия АСТ-пептида может быть выявлена в рамках стандартной процедуры оценки флуоресценции GFP с использованием светового микроскопа. На фиг.(a) и (b) показаны изображения, полученные при высоком увеличении, флуоресценции GFP в клеточных линиях WB-F344, экспрессирующих GFP плюс карбокси-концевую последовательность ACT-пептида (a), или один GFP (b). Практически сливающиеся монослои клеток из клеточной линии WB-F344 подвергают «повреждению царапиной» и оставляют «для заживления» на 24 часа. Аналогично контрольным вариантам клеток NIH-3T3, обработанных носителем или неактивным контрольным пептидом, контрольная линия эпителиальных клеток, экспрессирующих GFP, повторно заселяет зону «повреждения царапиной» (d). Однако в эпителиальной клеточной линии, которая стабильно экспрессирует полинуклеотид, кодирующий ACT-пептид, функционально связанный с промоторной последовательностью, отмечается ингибирование репопуляции зоны повреждения царапиной (c).
На фиг.5 показано, что АСТ-пептид снижает воспаление, улучшает заживление и снижает образование рубца после повреждения кожи разрезом у новорожденных мышей. Новорожденных мышей десенсибилизируют с использованием гипотермии. С помощью скальпеля делают разрез кожи длиной 4 мм по всей толщине кожи (вниз до уровня нижележащей мышцы) на средней линии спины между лопатками. В полученный разрез вносят 30 мкл раствора 20% геля плуроника (pluronic) (F-127), не содержащего (контроль) или содержащего растворенный АСТ 1 пептид (SEQ ID NO: 2) в концентрации 60 мкМ. Гель, содержащий АСТ-пептид или контрольный пептид, вносят через 24 часа после исходного нанесения. После второго нанесения больше не добавляют гели ни с контрольным, ни с АСТ-пептидом. Через 48 часов повреждение, обработанное АСТ-пептидом (а), значительно больше затягивается, в меньшей степени воспалено и набухает (отмечаются выступы на конце раны) и в основном выглядит более заживленным, чем контрольное повреждение, в которое не вносили АСТ-пептид (b). Указанные различия в степени воспаления, набухания и заживления между контролем и повреждением, обработанным АСТ-пептидом и контрольным пептидом, продолжается до 72 (c, d) и 96 (e, f) часов. К 7 дню рана, обработанная АСТ-пептидом (g), выглядит более гладкой и менее зарубцевавшейся, чем повреждение, обработанное контрольным пептидом (h). Следует отметить, что на чертеже показаны изображения одного и того же повреждения у одного и того же животного в разные временные точки в ходе процесса заживления.
На фиг.6 показано, что АСТ-пептид снижает воспаление, улучшает заживление и снижает рубцевание после крупного повреждения разрезом кожи у взрослых мышей. Взрослым мышам под анестезией делают круговые разрезы кожи шириной 8 мм хирургическими ножницами, вниз по направлению к нижележащей мышце в середине спины между лопатками (например, как показано на фиг.(a) и (b)). Границы повреждения маркируют круговой полосой из пластика шириной 8 мм. В разрез вносят 100 мкл раствора 30% геля плуроника, не содержащего (контроль) или содержащего растворенный АСТ 1 пептид (SEQ ID NO: 2) в концентрации 100 мкМ. Позже, через 24 часа после нанесения, вносят контрольный гель или гель, содержащий АСТ-пептид. После второго нанесения больше не добавляют ни контрольный гель, ни гель, содержащий АСТ-пептид. Крупное повреждение разрезом, на которое был нанесен АСТ-пептид (a, c, e, g, i) закрывается быстрее, меньше воспаляется по виду, быстрее заживает и в меньше степени рубцуется, чем контрольное повреждение, в которое не добавляли АСТ-пептид (b, d, g, h, j), в течение 14-дневного курса. Фактически, контрольное повреждение на 14 день все еще демонстрирует частичное наличие корки, указывающее на то, что острое заживление повреждения было не полным (j). Следует отметить, что на чертеже приведены изображения одного и того же повреждения у одного и того же животного в разные временные точки в ходе периода заживления.
На фиг.7 показано, что АСТ-пептид снижает плотность воспалительных клеток после разреза кожи у взрослых мышей. Материал биопсии кожи из всего участка раны отбирают от нескольких мышей через 24 часа после нанесения разреза, в соответствии с процедурой эксперимента, описанного на фиг.6. На фиг.(a) и (b) показан при низком увеличении вид разрезов, взятых из областей рядом с центром раны у контрольных животных и у животных с повреждениями после лечения АСТ-пептидом. В обоих случаях заметен край раны (обозначенный малыми стрелками), окруженный кожей нормального гистологического вида. Черный прямоугольник помещен над изображениями (a) и (b) в левой части края раны. Гистологические структуры в пределах двух указанных прямоугольников показаны при более высоком увеличении на фиг.(c) и (d) для тканей, обработанных контрольным и АСТ-пептидом. Наибольший интерес представляет собой «воротникообразная» ткань объединенного фиброзного материала (показана стрелками), выступающая из базальных частей повреждения в направлении к краю раны и к наружной поверхности раны. Объединенный фиброзный субстрат имеет вид более организованный в контрольном повреждении (d), чем в поврежденной ткани после лечения АСТ-пептидом (с). Кроме того, отмечается сниженная плотность воспалительных клеток, заполняющих фиброзный субстрат в ткани, обработанной АСТ-пептидом. Это подтверждается на (e) и (f), где участки гистологического среза внутри черных прямоугольников, показанных на (c) и (d), соответственно, показаны при большем увеличении. Воспалительные клетки в фиброзном субстрате включают тучные клетки, нейтрофилы и макрофаги. Указанные воспалительные клетки характеризуются значительно большей плотностью в контрольном повреждении, чем в поврежденной ткани, обработанной АСТ-пептидом.
На фиг.8 показано, что АСТ-пептид ускоряет заживление, снижает рубцевание и ускоряет регенерацию сложной тканевой структуры после нанесения повреждения разрезом у взрослых мышей. К концу 14-дневного периода в эксперименте, показанном на фиг.6, отбирают биопсийный материал кожи из полного места разреза и проводят гистохимическое окрашивание (H&E) гистологических срезов из этих образцов. На фиг.(a) и (b) показаны при низком увеличении виды срезов из мест, расположенных рядом с центром повреждения, относящиеся к ACT и к контролю, соответственно. В обоих случаях виден край раны (указан маленькими стрелками), окруженный кожей нормального гистологического вида. В изображениях на фиг.(a) и (b), рядом с центром каждого повреждения, помещен черный треугольник. Показаны гистологические структуры внутри указанных двух прямоугольников при большем увеличении на фиг.(c) и (d) для ткани, обработанной АСТ-пептидом, и контрольной ткани, соответственно. Видно, что ткань в локусе повреждения, обработанном АСТ-пептидом, характеризуется значительно большей сложностью структуры. На наружной поверхности, обработанной ACT, отмечается непрерывный слой эпителиальных клеток, указывающих на полную повторную эпителизацию поврежденной поверхности, хотя эпителий еще относительно тонкий возле центра раны (с). Регенерация волосяных фолликул также отмечается уже в состоянии дифференцировки de novo из стволовых клеток в новом эпителии, покрывающем заживленное повреждение (с, малые стрелки). При сравнении, в эпителии контрольного повреждения (d) повторная эпителизация поверхности повреждения происходит не полностью, и отсутствуют признаки регенерации волосяных фолликул. Под реформированным эпителием кожи в повреждении, обработанном АСТ-пептидом, отмечается выраженное восстановление нормальной сложности структуры с наличием гландулярных структур, фиброзной и соединительной ткани, сосудистых тканей, мышечных и жировых клеток (а, с). Аналогично, волосяные фолликулы, в контексте тканевой структурированности, регенерируют при дифференцировке стволовых клеток. И наоборот, в контрольном повреждении ткань раны характеризуется полным доминированием однородной крупной массы фиброзной рубцевой ткани (b, d), тогда как другие признаки сложности тканевой структуры не выявляются в пределах указанной ткани.
На фиг.9 показано, что ACT-пептиды снижают воспаление, улучшают заживление и снижают рубцевание при нанесении взрослым мышам повреждения разрезом. Взрослым мышам под анестезией наносят ранение в виде двух маленьких разрезов (диаметр 5 мм) тонкими хирургическими ножницами на шее и на спине (в верхней части). Границы повреждений маркируют круговой лентой шириной 5 мм из пластика. В разрезы вносят 50-60 мкл раствора 20% геля плуроника, который не содержит (контроль) или содержит один из АСТ-пептидов (АСТ 2 - SEQ ID NO: 1, АСТ 1 - SEQ ID NO: 2, АСТ 3 - SEQ ID NO: 3, АСТ 4 - SEQ ID NO: 4, АСТ 5 - SEQ ID NO: 5), растворенных в концентрации 100 мкМ. Гель, содержащий контрольный или ACT-пептид, наносят позже, через 24 часа после первого нанесения. После второго нанесения не вносят ни контрольный гель, ни гель, содержащий АСТ-пептид. Видно, что в случае внесения ACT 1 (e-h), ACT 2 (i-l), ACT 3 (m-p) и ACT 5 (u-x) пептидов повреждения разрезом закрываются быстрее, значительно менее воспалены по виду, гораздо быстрее заживают и меньше рубцуются, чем контрольные повреждения, в которые не вносили АСТ-пептид (a-d), в течение 240-часового времени исследования (10 дней). ACT 4 пептид (q-t) также демонстрирует умеренное улучшение заживления, в сравнении с контролем в ходе обследования, хотя в меньшей степени, чем другие пептиды. Следует отметить, что показана одна и та же рана на одном и том же животном в разные временные точки в ходе процесса заживления.
На фиг.10 показано, что АСТ-пептид снижает количество и плотность астроцитов, формирующих глиальный рубец, после проникающего повреждения мозга у взрослых крыс. На фиг.(b) и (c) показан, при малом увеличении, вид срезов мозговой ткани (коркового вещества), окруженной имплантатами вогнутой фиброзной мембраны (HFM), заполненной АСТ-пептидом (100 мкМ) плюс гель-носитель (b) или один гель с коллагеновым носителем, в качестве контроля (c). В контрольной ткани (с) отмечается высокая плотность иммунологически меченых астроцитов, позитивных по GFAP, возле места повреждения, вызванная HFM. Плотность указанных клеток, как видно, несколько снижается при удалении от повреждения. И наоборот, наблюдается значительно меньшая плотность GFAP-позитивных астроцитов рядом с HFM, заполненной ACT-пептидом (b). Фактически, уровни GFAP-позитивных клеток не очень отличаются от того, что наблюдается в нормальной не поврежденной ткани мозга. Участки ткани внутри белых прямоугольников на фиг.(b) и (c) показаны при большем увеличении для (d) и (e), соответственно. В ткани поврежденного мозга, обработанной АСТ-пептидом (d), видно, что GFAP-позитивные астроциты не только менее многочисленны, но также меньше по размеру, чем клетки, отмечаемые в контрольном повреждении (e).
На фиг.11 показано, что АСТ-пептид способствует поддержанию числа и регенерации нейронов после проникающего повреждения мозга у взрослых крыс. На фиг.(a) и (b) показаны при малом увеличении изображения срезов мозговой ткани (коркового вещества), окруженной имплантатами HFM (имплантат или граница повреждения показаны стрелками), заполненными коллагеном, как контрольным гелем-носителем, или АСТ-пептидом плюс гель-носитель, через 1 неделю после проникающего повреждения мозга. В контрольной ткани (b) отмечается высокая плотность иммунологически меченых GFAP-позитивных астроцитов и низкая плотность нейронов, иммунологически меченых по NeuN, возле места повреждения, вызванного HFM. Плотность указанных клеток, как видно, снижается и возрастает, соответственно, дистально относительно HFM. И наоборот, отмечается значительно сниженная плотность GFAP-позитивных астроцитов и большее число нейронов, иммунологически меченых по NeuN, проксимально (а также дистально) к HFM, заполненной АСТ-пептидом (а). Площади на (a) и (b), проксимально к HFN, показаны при высоком увеличении на (с) и (b), соответственно. И снова, в контрольной ткани (d) отмечается поразительное повышение плотности GFAP-позитивных астроцитов и сниженная плотность NeuN-позитивных нейронов в сравнении с тканью, обработанной АСТ-пептидом (c). Комплементарная картина наблюдается возле HFM, содержащей АСТ-пептид, при доминировании NeuN-позитивных нейронов над астроцитами (c). Интересно отметить, что изображение при высоком увеличении, показанное на (c), выявляет высокую частоту нейронов в процессе деления, в сравнении с контролем (d).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Раскрываемые в описании способ и композиции будут легко понятны из прилагаемого описания конкретных вариантов осуществления изобретения и соответствующих примеров, а также чертежей и относящихся к ним описаний.
Предлагается выделенный полипептид, содержащий карбокси-концевую аминокислотную последовательность альфа-коннексина (также называемого как карбокси-концевой полипептид альфа-коннексина (ACT)), или его консервативный вариант. В одном из аспектов осуществления изобретения предлагаемый полипептид АСТ после повреждения ткани снижает воспаление, ускоряет заживление, снижает рубцевание, повышает прочность на разрыв и усиливает регенерацию сложной ткани. В другом аспекте настоящего изобретения предлагаемый полипептид повышает протяженность затягивающих брешь канальных агрегатов, образованных из коннексина.
Следует понимать, что раскрываемые в описании композиции и способы не ограничиваются специфическими методами синтеза, конкретными аналитическими методиками или конкретными реактивами, если особо не указано иное, и в качестве таковых могут варьировать. Следует также понимать, что используемая в описании терминология дана только лишь для целей описания конкретных вариантов и не направлена на их ограничение.
В описании описаны материалы, композиции и компоненты, которые могут использоваться как таковые или в сочетании для достижения определенной цели, или в качестве продуктов, образуемых при осуществлении описываемых методов на основе данных композиций. В настоящем описании приводятся указанные и другие материалы и следует понимать, что когда описывается сочетание, подмножество, взаимодействие, группы и т.п. указанных материалов, то в случае отсутствия явно выраженной конкретной ссылки на каждое из различных индивидуальных и коллективных сочетаний и перестановок данных соединений, каждое из них конкретно включается и рассматривается в настоящем изобретении. Например, если описывается и обсуждается вектор и множество векторных компонентов, включающих промоторы, то каждый из них и любое сочетание и перестановка промоторов и других векторных компонентов и модификаций, которые возможны, специфически рассматривается, если особо не указано иное. Таким образом, если рассматриваются молекулы класса A, B и C, а также молекулы класса D, E и F и описывается пример сочетания молекул A-D, то даже если по отдельности не каждый из них указан, рассматривается также каждый индивидуально и в сочетании. Таким образом, в данном примере каждое из сочетаний A-E, A-F, B-D, B-E, B-F, C-D, C-E и C-F конкретно рассматривается и следует понимать как вытекающее из описания A, B и C; D, E и F, а также примера сочетания A-D. Аналогично, любое подмножество или сочетание их также конкретно рассматривается и описывается. Таким образом, например, подгруппа A-E, B-F и C-E конкретно включается и должна рассматриваться как вытекающая из описания A, B, и C; D, E и F, а также примера сочетания A-D. Данная концепция относится ко всем аспектам настоящей заявки, включая, без ограничения, стадии способов получения и применения описываемых композиций. Таким образом, если имеется множество дополнительных стадий, которые могут быть выполнены, то следует понимать, что каждая из указанных дополнительных стадий может выполняться в рамках конкретного варианта или сочетания вариантов раскрываемых способов и что каждое такое сочетание конкретно включается и должно рассматриваться как описанное.
В настоящем описании приводится множество последовательностей и указанные последовательности и другие могут быть найдены в Genbank на странице www.pubmed.gov. Для специалистов в данной области понятно, как разрешить вопрос несоответствия последовательностей и их различий и как применить композиции и способы, относящиеся к конкретной последовательности, на другие родственные последовательности. На основе информации, приведенной в настоящем описании и известной в данной области, могут быть разработаны праймеры и/или зонды для любой последовательности.
Приводимый в описании полипептид может быть любым полипептидом, включающим большую часть аминокислот на карбокси-конце альфа-коннексина, где указанный полипептид не включает белок альфа-коннексина полной длины. Таким образом, в одном аспекте описываемый полипептид не включает цитоплазматический N-концевой домен альфа-коннексина. В другом аспекте описываемый полипептид не включает два внеклеточных домена альфа-коннексина. В другом аспекте предлагаемый полипептид не включает четыре трансмембранных домена альфа-коннексина. В еще одном аспекте описываемый полипептид не включает цитоплазматический петлевой домен альфа-коннексина. В еще одном аспекте описываемый полипептид не включает ту часть последовательности цитоплазматического домена альфа-коннексина на карбоксильном конце, которая локализована проксимально к четвертому трансмембранному домену. Имеется консервативный пролиновый или глициновый остаток в альфа-коннексине, локализованные постоянно на расстоянии 17-30 аминокислот от наиболее близкой к карбокси-концу аминокислоте (Таблица 2). Например, в случае человеческого Сх43 пролиновый остаток аминокислоты 363 расположен на 19 аминокислот в сторону от ближайшей к карбоксильному концу аминокислоты изолейцина. В другом примере пролиновый остаток куриного Сх43 в положении аминокислоты 362 локализован на 18 аминокислот в сторону от самой близкой к карбокси-концу аминокислоты изолейцина. В другом примере, в человеческом Сх45 глициновый остаток в положении аминокислоты 377 локализован на 19 аминокислот в сторону от самой близкой к карбокси-концу аминокислоты изолейцина. В другом примере в крысином Сх33 пролиновый остаток аминокислоты 258 локализован на 28 аминокислот в сторону от самой близкой к карбокси-концу аминокислоты изолейцина. Таким образом, в другом аспекте предлагаемый полипептид не включает аминокислоты, проксимальные к указанному консервативному пролиновому или глициновому остатку альфа-коннексина. Таким образом, предлагаемый полипептид может включать наиболее близкие к С-концу 4-30 аминокислот альфа-коннексина, включая самые близкие к С-концу 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 аминокислот альфа-коннексина.
Самые близкие к карбокси-концу аминокислоты альфа-коннексина в предлагаемых пептидах могут быть фланкированы аминокислотами, отличными от альфа-коннексина, или аминокислотами, отличными от АСТ коннексина. В настоящем описании приведены примеры фланкирующих аминокислот, отличных от альфа-коннексина, и аминокислот, отличных от АСТ коннексина. Примеры аминокислот, отличных от АСТ коннексина, включают карбокси-концевые 20-120 аминокислот человеческого Сх43 (SEQ ID NO: 72). Другим примером могут быть карбокси-концевые 20-120 аминокислот куриного Сх43 (SEQ ID NO: 73). Другим примером могут быть карбокси-концевые 20-120 аминокислот человеческого Сх45 (SEQ ID NO: 74). Другим примером могут быть карбокси-концевые 20-120 аминокислот куриного Сх45 (SEQ ID NO: 75). Другим примером могут быть карбокси-концевые 20-120 аминокислот человеческого Сх37 (SEQ ID NO: 76). Другим примером могут быть карбокси-концевые 20-120 аминокислот крысиного Сх33 (SEQ ID NO: 77).
Было показано, на одном из примеров коннексина, отличного от альфа-коннексина, что он представляет собой последовательность из 239 аминокислот более активного зеленого флуоресцентного белка (АСТ 1 функционально слит с GFP, как показано фиг.4; SEQ ID NO: 78). В другом аспекте, ввиду того, что АСТ 1, как было показано, становится функциональным при слиянии с карбокси-концом последовательности из 239 аминокислот с GFP (фиг.4), АСТ-пептиды, как ожидается, будут сохранять свою функцию при фланкировании полипептидами, отличными от коннексина и содержащими по меньшей мере до 239 аминокислот. Фактически, пока АСТ-последовательность поддерживается в виде свободного карбокси-конца данного полипептида, АСТ-пептид способен достигать своих мишеней.
Таким образом, кроме АСТ-пептида, полипептиды, превышающие в длину 239 аминокислот, могут также функционировать в направлении снижения воспаления, ускорения заживления, повышения прочности на разрыв, снижения рубцевания и ускорения регенерации ткани после повреждения.
Коннексины представляют собой субъединичный белок в канале соединения двунитевого разрыва, который ответственен за межмолекулярную коммуникацию (Goodenough and Paul, 2003). На основании результатов оценки картины консервации нуклеотидной последовательности гены, кодирующие белки коннексина, были разделены на два семейства, обозначенные как гены альфа и бета коннексина. Самые удаленные к карбокси-концу аминокислотные последовательности альфа-коннексинов характеризуются различными отличительными и устойчивыми к изменению особенностями (см. таблицу 2). Указанная консервация в организации согласуется со способностью АСТ-пептидов образовывать отличительные 3D структуры, взаимодействовать с множеством соответствующих белков-партнеров, вовлекаться во взаимодействие с липидами и мембранами, взаимодействовать с нуклеиновыми кислотами, включая ДНК, участвовать в переносе по мембранным каналам и/или в блокировании мембранных каналов и обеспечивать образование консенсусных мотивов для протеолитического расщепления, сшивание белков, АДФ-рибозилирования, гликозилирования и фосфорилирования. Таким образом, рассматриваемый полипептид взаимодействует с доменом белка, который в норме вовлекается в связывание указанного белка с карбокси-концом альфа-коннексина. Например, белок, который подвергается суперэкспрессии нефрабластомой (NOV), взаимодействует с С-концевым доменом Сх43 (Fu et al., J. Biol. Chem. 2004, 279(35): 36943-50). Считается, что этот и другие белки взаимодействуют с карбокси-концом альфа-коннексина и также взаимодействуют с другими белками, формирующими макромолекулярный комплекс. Таким образом, рассматриваемый полипептид может ингибировать функционирование молекулярной машины, такой как, например, механизм, вовлекаемый в регуляцию агрегации каналов связи разрывов в Сх43.
В контексте настоящего описания термины «ингибируют», «ингибирующий» и «ингибирование» и связанные с ними формы используются для обозначения снижения активности, ответа, состояния, заболевания или другого биологического параметра. Данный термин может также включать, без ограничения, полную потерю активности, ответа, характерного состояния или заболевания. Данный термин может также включать, например, 10% снижение активности, ответа, характерного состояния или заболевания, в сравнении с нативным или контрольным уровнем. Таким образом, снижение может составлять 10, 20, 30, 40, 50, 60, 70, 80, 90, 100% или характеризоваться любым уровнем снижения между указанными значениями, в сравнении с нативным или контрольным уровнями.
АСТ-последовательность рассматриваемого полипептида может быть взята из любого альфа-коннексина. Таким образом, компонент альфа-коннексина в данном полипептиде может быть получен из человеческого, мышиного, бычьего коннексина, коннексина монотрена, коннексина сумчатых, приматов, грызунов, китовых, млекопитающих, птиц, рептилий, амфибий, рыб, хордовых животных, протохордовых или из другого альфа-коннексина.
Таким образом, предлагаемый полипептид может включать АСТ коннексина, выбранного из группы, состоящей из мышиного коннексина 47, человеческого коннексина 47, человеческого коннексина 46.6, коровьего коннексина 46.6, мышиного коннексина 30.2, крысиного коннексина 30.2, человеческого коннексина 31.9, собачьего коннексина 31.9, овечьего коннексина 44, коровьего коннексина 44, крысиного коннексина 33, мышиного коннексина 33, человеческого коннексина 36, мышиного коннексина 36, крысиного коннексина 36, собачьего коннексина 36, куриного коннексина 36, коннексина перцины 36, коннексина 35 морона, коннексина 35 морона, коннексина 35 Cynops, коннексина 36 Tetraodon, человеческого коннексина 37, коннексина 37 шимпанзе, коннексина 37 собаки, коннексина 37 Cricetulus, коннексина 37 мыши, коннексина 37 Mesocricetus, коннексина 37 крысы, коннексина 39 мыши, коннексина 39 крысы, человеческого коннексина 40.1, коннексина 38 Xenopus, коннексина 39.9 перцины, человеческого коннексина 40, коннексина 40 шимпанзе, коннексина 40 собаки, коннексина 40 коровы, коннексина 40 мыши, коннексина 40 крысы, коннексина 40 Cricetulus, куриного коннексина 40, человеческого коннексина 43, коннексина 43 Cercopithecus, коннексина 43 Oryctolagus, коннексина 43 Spermophilus, коннексина 43 Cricetulus, коннексина 43 Phodopus, крысиного коннексина 43, коннексина 43 Sus, коннексина 43 Mesocricetus, мышиного коннексина 43, коннексина 43 Cavia, коннексина 43 коровы, коннексина 43 Erinaceus, куриного коннексина 43, коннексина 43 Xenopus, коннексина 43 Oryctolagus, коннексина 43 Cyprinus, коннексина 43 перцины, коннексина 43 Danio aequipinnatus, коннексина 43.4 перцины, коннексина 44.2 перцины, коннексина 44.1 перцины, человеческого коннексина 45, коннексина 45 шимпанзе, коннексина 45 собаки, коннексина 45 мыши, коннексина 45 коровы, коннексина 45 крысы, куриного коннексина 45, коннексина 45 Tetraodon, куриного коннексина 45, человеческого коннексина 46, коннексина 46 шимпанзе, коннексина 46 мыши, коннексина 46 собаки, коннексина 46 крысы, коннексина 46 Mesocricetus, коннексина 46 Cricetulus коннексина 46, куриного коннексина 56, коннексина 39.9 перцины, коровьего коннексина 49, человеческого коннексина 50, коннексина 50 шимпанзе, крысиного коннексина 50, коннексина 50 мыши, коннексина 50 собаки, коннексина 49 овцы, коннексина 50 Mesocricetus, коннексина 50 Cricetulus, куриного коннексина 50, человеческого коннексина 59 или другого альфа-коннексина. Аминокислотные последовательности алфа-коннексина известны в данной области и приведены в таблице 1 под номером доступа.
Альфа-коннексины
Таким образом, рассматриваемый полипептид может включать аминокислотную последовательность SEQ ID NO: 1, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 43, SEQ ID NO: 90 или SEQ ID NO: 91 или их консервативные варианты или фрагменты.
Последовательность альфа-коннексинов из 20-30 аминокислотных карбокси-концевых последовательностей характеризуется отчетливой и консервативной организацией. Такая отчетливая и консервативная организация включает PDZ-связывающий мотив типа II (Φ-х-Φ, где х = любая аминокислота, и Φ = гидрофобная аминокислота; например, как указано в таблице 2, путем выделения жирным шрифтом) и проксимальный к данному мотиву пролиновый (P) и/или глициновый (G) шарнирные остатки; высокую частоту встречаемости фосфосериновых (S) и/или фосфотреониновых (T) остатков; и высокую частоту встречаемости положительно заряженного аргинина (R), лизина (K) и отрицательно заряженных аминокислот аспарагиновой кислоты (D) или глютаминовой кислоты (E). В случае многих альфа-коннексинов P и G остатки встречаются в составе кластерных мотивов (см., например, в Таблице 2, выделенные курсивом участки), проксимальных к карбокси-концевому PDZ-связывающему мотиву типа II. S и T аминокислоты в большинстве альфа-коннексинов также в типичном случае организованы в виде кластеров с мотивами типа повторов (см. в Таблице 2, подчеркнутые участки). Такая организация особенно выражена в случае Cx43, где 90% из 20 самых близких к карбоксильному концу аминокислот включают указанные семь аминокислот. Другим примером высокой консервации последовательности является организация АСТ-пептида в Cx43, которая характеризуется высокой консервативностью, от человека до рыбы (например, в Таблице 2 проиллюстрированы результаты сравнения АСТ-последовательностей Cx43 у человека и перцины). В другом примере организация АСТ-пептида в Cx43 характеризуется высокой консервативностью от людей до птиц (например, в таблице 2 проиллюстрированы результаты сравнения АСТ-последовательностей Cx45 для человека и курицы). В другом примере организация АСТ-пептида в Cx36 характеризуется высокой консервативностью от приматов до рыб (например, в таблице 2 проиллюстрированы результаты сравнения АСТ-последовательностей Cx36 для шимпанзе и перцины).
Таким образом, в одном аспекте настоящего изобретения предлагаемый полипептид включает один, два, три или все аминокислотные мотивы, выбранные из группы, состоящей из: 1) PDZ-связывающего мотива типа II; 2) пролинового (Р) и/или глицинового (G) шарнирных остатков; 3) кластеров из фосфосеринового (S) и/или фосфотреонинового (Т) остатков; и 4) положительно заряженные аргинин (R), лизин (К) и отрицательно заряженные аспарагиновая кислота (D) и/или глютаминовая (E) кислота с высокой частотой встречаемости. В другом аспекте настоящего изобретения предлагаемый полипептид включает PDZ-связывающий мотив типа II на карбокси-конце, пролиновый (Р) и/или глициновый (G) шарнирные остатки, проксимальные к PDZ-связывающему мотиву, и положительно заряженные остатки (K, R, D, E), проксимальные к шарнирным остаткам.
PDZ-домены первоначально были идентифицированы как консервативные элементы последовательности в составе пост-синаптических белков высокой плотности PSD95/SAP90, опухолевого супрессора Drosophila dlg-А, и белка ZO-1 с прочной соединяющей способностью. Хотя исходно рассматривались мотивы GLGF или DHR, в настоящее время известно, что под данным термином закодированы указанные первые три PDZ-содержащих белка (PSD95/DLG/ZO-1). Указанные последовательности из 80-90 аминокислот были идентифицированы в более чем 75 белках, которые характеризуются экспрессией в виде множественных копий одного белка. Таким образом, в одном аспекте настоящего изобретения предлагаемый полипептид может ингибировать связывание альфа-коннексина с белком, включающим PDZ-домен. PDZ-домен представляет собой модуль специфического типа, определяющий взаимодействие с белком, который характеризуется наличием структурно определенного некого «кармана» для взаимодействия, который может заполняться PDZ-связывающим мотивом, обозначаемым в настоящем описании как «PDZ-мотив». PDZ-мотивы представляют собой консенсусные последовательности, которые в норме, но не всегда, локализованы на самом ближнем к карбоксильному концу внутриклеточном участке. В настоящее время описано четыре типа PDZ-мотивов: тип I (S/T-x-Ф), тип II (Ф-х-Ф), тип III (ψ-x-Φ) и тип IV (D-x-V), где х обозначает любую аминокислоту, Φ обозначает гидрофобный остаток (V, I, L, A, G, W, C, M, F), и ψ обозначает основной гидрофобный остаток (H, R, K) (Songyang, Z., et al., 1997, Science 275, 73-77). Таким образом, в одном аспекте настоящего изобретения предлагаемый полипептид включает PDZ-связывающий мотив типа II.
Следует отметить, что последовательность из 18 аминокислот, находящаяся ближе всего к карбокси-концу альфа-Cx37, представляет собой исключительную вариацию в АСТ-пептиде. АСТ-подобные последовательности Cx37 представляют собой GQKPPSRPSSSASKKQ*YV (SEQ ID NO: 43). Таким образом, четыре карбокси-концевые аминокислоты в Сх37 составляют только часть PDZ-домена типа II. Вместо классического PDZ-связывающего домена типа II, Cx37 содержит нейтральный Q* в положении 2, где может ожидаться наличие гидрофобной аминокислоты. В качестве такового Cx37 включает последовательность, которую можно рассматривать как похожую на PDZ-связывающий домен типа II. Тем не менее, Cx37 четко поддерживает все другие аспекты организации АСТ-пептида, включая кластерные сериновые остатки, частую встречаемость R и K остатков и Р-обогащенную последовательность, расположенную проксимально к последовательности, подобной PDZ-связывающему домену. При том, что общий уровень консервации АСТ-подобной организации соответствует другим перечисленным выше более 70 альфа-коннексинам, следует понимать, что АСТ-подобная карбокси-концевая структура в Сх37 функционирует с заданной способностью.
В таблице 2 показан для сравнения бета-коннексин Сх26. Сх26 не содержит PDZ-связывающего мотива типа II на карбоксильном конце, менее 30% самых близких к карбоксильному концу аминокислот включают S, T, R, D или E остатки; при этом не выявляются мотивы, проксимально к PDZ-связывающему мотиву типа II или участку, подобному PDZ-связывающему мотиву, содержащему кластеры P и G шарнирных остатков; и не выявляется кластерных мотивов, подобных повторяющимся единицам серин- и треонин-фосфоаминокислот. Cx26 содержит три лизиновых (K) остатка, собранных друг за другом в кластер около карбоксильного конца последовательности. Однако более чем в 70 альфа-коннексинах, перечисленных выше, не выявляется альфа-коннексин, который бы демонстрировал указанную особенность, определяемую наличием трех доменов с повторяющимися остатками (К) на карбокси-конце (Сх26 представляет собой бета-коннексин, и поэтому, по определению, не должен иметь АСТ-домен).
В контексте настоящего описания уникальная функциональная характеристика указанного относительно короткого тяжа аминокислот включает его неожиданную роль в снижении воспаления, ускорении заживления, снижении рубцевания, повышении прочности на разрыв и ускорении регенерации сложных тканевых структур и функций после разных повреждений ткани кожи и мозга. Таким образом, в одном аспекте предлагаемый полипептид включает PDZ-связывающий мотив типа II (Φ-х-Φ; где х = любая аминокислота и Φ = гидрофобная аминокислота). В другом аспекте более чем 50%, 60%, 70%, 80%, 90% аминокислот в рассматриваемом АСТ-полипептиде включают один или несколько пролиновых (P), глициновых (G), фосфосериновых (S), фосфотреониновых (T), аргининовых (R), лизиновых (K), аспарагиновых (D) или глютаминовых (E) аминокислотных остатков.
Аминокислоты пролин (P), глицин (G), аргинин (R), лизин (K), аспарагиновая кислота (D) и глютаминовая кислота (E) являются необходимыми детерминантами структуры и функции белка. Пролиновые и глициновые остатки обеспечивают прочные изгибы в 3D структуре белков, позволяя образовывать складчатые конформации полипептида, необходимые для его функционирования. Заряженные аминокислоты зачастую расположены на поверхности складчатых белков и необходимы для осуществления химических взаимодействий, опосредованных полипептидами, включая белок-белковые взаимодействия, белок-липидные взаимодействия, фермент-субстратные взаимодействия и взаимодействия типа белок-нуклеиновая кислота. Таким образом, в другом аспекте участки, обогащенные пролином (P) и глицином (G), лизином (K), аспарагиновой кислотой (D) или глютаминовой кислотой (E), проксимальные к PDZ-связывающему мотиву типа II, обеспечивают свойства, необходимые для соответствующей активности АСТ-пептидов. В другом аспекте предлагаемый в настоящем изобретении полипептид включает участки, обогащенные пролином (P), глицином (G), лизином (K), аспарагиновой кислотой (D) и/или глютаминовой кислотой (E), проксимальные к PDZ-связывающему мотиву типа II.
Фосфорилирование представляет собой наиболее частую пост-трансляционную модификацию белков и является важнейшим фактором для модуляции или модификации структуры и функции белка. Те аспекты структуры и функции белка, которые подвергаются модификации при фосфорилировании, включают конформацию белка, белок-белковые взаимодействия, белок-липидные взаимодействия, взаимодействия типа белок-нуклеиновая кислота, функции открытия-закрытия каналов, перенос белка и метаболизм белка. Таким образом, в одном аспекте настоящего изобретения последовательности, обогащенные фосфосерином (S) и/или фосфотреонином (T), необходимы для модификации функции АСТ-пептидов, повышения или снижения эффективности полипептидов в указанных действиях. В другом аспекте предлагаемый полипептид включает последовательности или мотивы, обогащенные серином (S) и/или фосфотреонином (Т).
В другом примере, относящемся к определению АСТ-пептида, весьма вероятно, в свете высокого уровня потенциала регенерации ткани/органа у низших животных, таких как рыбы, что метионин встречается около амино-конца АСТ-последовательности Сх43 перцины (Таблица 2). Кроме функции кодирования метионина, метиониновый триплет оснований представляет собой альтернативный сайт старта трансляции. Если трансляция начинается от указанного метионина, то должна создаваться последовательность SSRARPDDLDV (SEQ ID NO: 90). Такой продукт трансляции поддерживает все консервативные и отличительные особенности канонического АСТ-пептида. Конкретно, данный пептид включает PDZ-связывающий домен типа II на карбокси-конце и содержит домен, обогащенный P, R и D остатками, проксимально PDZ-связывающему домену. Кроме того, указанная последовательность включает кластерный S мотив, обладающий потенциалом к модуляции функции АСТ-пептида на амино-конце. Это поднимает интересный вопрос относительно того, что животные с высоким потенциалом регенерации ткани/органа, такие как рыбы, могут непосредственно осуществлять трансляцию последовательностей АСТ-пептидов.
Таким образом, предлагаемый в настоящем изобретении полипептид может включать С-концевую последовательность человеческого Сх43. Соответственно, предлагаемый полипептид может включать аминокислотную последовательность SEQ ID NO: 1 или SEQ ID NO: 2. Полипептид может включать 9 аминокислот на карбокси-конце человеческого Сх40. Таким образом, указанный полипептид может включать аминокислотную последовательность SEQ ID NO: 5.
В том случае, когда в настоящем описании рассматриваются специфические белки, описание относится, соответственно, к их вариантам, производным и фрагментам. Варианты и производные белков хорошо известны специалистам в данной области и могут включать модификации аминокислотной последовательности. Например, модификации аминокислотной последовательности в типичном случае попадают в один или более классов из числа следующих трех классов: варианты по замещению, вставке и делеции. Вставки включают слияние с амино- и/или карбоксильным концом, а также вставки внутри последовательности одной или нескольких аминокислотных остатков. Вставки обычно представляют собой меньшие по размеру вставки, чем соответствующие вставки, вводимые в случае слияния с амино- или карбоксильным концом, отличаясь, например, на порядок от одного до четырех остатков. Делеции характеризуются удалением одного или нескольких аминокислотных остатков из белковой последовательности. Указанные варианты обычно получают путем сайт-специфического мутагенеза нуклеотидов в ДНК, кодирующей белок, что приводит в получению ДНК, кодирующей вариант, с последующей экспрессией ДНК в культуре рекомбинантной клетки. Методики получения мутантов по замещению в заданных сайтах ДНК, обладающих известной последовательностью, хорошо известны и включают, например, мутагенез с использованием праймера М13 и ПЦР-мутагенез. Замещения аминокислот в типичном случае включают один остаток, но могут производиться одновременно во множестве разных сайтов; вставки обычно включают примерно от 1 до 10 аминокислот. Делеции или вставки предпочтительно осуществляют в соседних парах, например, делецию двух остатков или вставку двух остатков. Замещения, делеции, вставки или любое их сочетание могут быть объединены для получения окончательной конструкции. Мутации не должны выводить последовательность из рамки считывания и предпочтительно не должны создавать комплементарные участки, которые могут образовывать вторичную структуру мРНК, если только такое изменение во вторичной структуре мРНК не является желательным. Варианты по замещению включают такие варианты, в которых по меньшей мере одни остаток был удален, а другой остаток встроен на его место. Такие замещения в основном осуществляются в соответствии приведенной таблицей 3 и называются консервативными замещениями.
Аминокислотные замещения


Например, замещение аминокислотного остатка другим, который биологически и/или химически ему близок, известно специалистам в данной области как консервативное замещение. Например, консервативным замещением будет замена одного гидрофобного остатка на другой гидрофобный остаток или одного полярного остатка на другой полярный остаток. Указанные замещения включают сочетания, показанные в таблице 3. Консервативно замещенные варианты такой явно раскрытой последовательности включаются в полипептиды согласно настоящему описанию.
В типичном случае консервативное замещение оказывает незначительное или вообще не оказывает влияние на биологическую активность полученного полипептида. В конкретном примере консервативное замещение представляет собой такое замещение аминокислот в пептиде, которое по существу не оказывает влияния на биологическую функцию пептида. Пептид может включать одно или несколько аминокислотных замещений, например, 2-10 консервативных замещений, 2-5 консервативных замещений, 4-9 консервативных замещений, таких как 2, 5 или 10 консервативных замещений.
Полипептид может быть получен таким образом, что он будет содержать одно или несколько консервативных замещений за счет манипуляции нуклеотидной последовательностью, которая кодирует данный полипептид, с использованием, например, стандартных процедур, таких как сайт-направленный мутагенез или ПРЦ. Альтернативно, полипептид может быть получен таким образом, что он будет содержать одно или несколько консервативных замещений за счет использования стандартных методик белкового синтеза. Может использоваться аланиновое сканирование для идентификации того, какой из аминокислотных остатков в белке может быть толерантен к аминокислотному замещению. В одном примере биологическая активность белка не снижается более чем на 25%, например, снижается не более чем на 20%, например, не более чем на 10%, когда аланином или другой консервативной аминокислотой (такой как в приведенном ниже перечне) замещают одну или несколько нативных аминокислот.
Больше информации о консервативном замещении можно найти, в числе других, в следующих работах: Ben-Bassat et al., (J. Bacteriol. 169: 751-7, 1987), O'Regan et al., (Gene 77: 237-51, 1989), Sahin-Toth et al., (Protein Sci. 3: 240-7, 1994), Hochuli et al., (Bio/Technology 6: 1321-5, 1988) и в стандартных руководствах по генетике и молекулярной биологии.
Мутагенез путем замещения или делеционный мутагенез может использоваться для встраивания сайтов для N-гликозилирования (Asn-X-Thr/Ser) или O-гликозилирования (Ser или THr). Могут быть также желательны делеции цистеина или других лабильных остатков. Делеции или замещения потенциальных сайтов протеолиза, например Arg, вводятся, например, путем делеции одного или нескольких основных остатков или путем замещения такого остатка глютаминильным или гистидильным остатками.
Некоторые пост-трансляционные дериватизации являются результатом действия рекомбинантных клеток на экспрессированный полипептид. Глютаминильные и аспарагинильные остатки зачастую подвергаются пост-трансляционному дезамидированию до соответствующих глютамильных и аспартильных остатков. Альтернативно, указанные остатки подвергают дезамидированию в мягких кислотных условиях. Другие пост-трансляционные модификации включают гидроксилирование пролина и лизина, фосфорилирование гидроксильных групп серильных или треонильных остатков, метилирование О-аминогрупп боковых цепей лизина, аргинина и гистидина (T.E. Creighton, Proteins: Structure and Molecular Properties, W. H. Freeman & Co., San Francisco, p.79-86 [1983]), ацетилирование N-концевого амина и в некоторых случаях амидирование C-концевого карбоксила.
Следует понимать, что имеется множество аминокислотных и пептидных аналогов, которые могут быть включены в описываемые композиции. Например, имеется множество D-аминокислот или аминокислот, которые включают различные функциональные заместители, отличные от аминокислот, приведенных в таблице 3. В их числе описываются противоположные стероизомеры природных пептидов, а также стереоизомеры пептидных аналогов. Указанные аминокислоты могут быть легко встроены в полипептидные цепи путем подсоединения выбранных аминокислот к молекулам тРНК с последующим созданием генетических конструкций, которые используют, например, амбер-кодоны, для вставки аналога аминокислоты в пептидную цепь сайт-специфическим образом (Thorson et al., Method in Molec. Biol. 77: 43-73 (1991), Zoller, Current Opinion in Biotechnology 3: 348-354 (1992); Ibba, Biotechnology & Genetic Enginerring Reviews 13: 197-216 (1995); Cahill et al., TIBS, 14(10): 400-403 (1989); Benner, TIB Tech, 12: 158-163 (1994); Ibba and Hennecke, Bio/technology, 12: 678-682 (1994), где все работы включены в качестве ссылки по меньшей мере в части, относящейся к аминокислотным аналогам).
Могут быть получены молекулы, которые близки к полипептидам, но которые не содержат природных пептидных связей. Например, связи в аминокислотах или аминокислотных аналогах могут включать: CH2NH--, --CH2S--, --CH2--CH2--, --CH=CH- (цис и транс), --COCH2--, --CH(OH)CH2-- и -CHH2SO- (указанные и другие соединения описаны в работе Spatola, A. F. in Chemistry and Biochemistry of Amino Acids, Peptides and Proteins, B. Weinstein, eds., Marcel Dekker, New York, p.267 (1983); Spatola, A. F., Vega Data (March 1983), Vol.1, Issue 3, Peptide Backbone Modifications (general review); Morley, Trends Pharm Sci (1980) p.463-468; Hudson, D. et al., Int J Pept Prot Res 14: 177-185 (1979) (--CH2NH--, CH2CH2--); Spatola et al, Life Sci 38: 1243-1249 (1986) (--CH H2--S); Hann J. Chem. Soc Perkin Trans. I 307-314 (1982) (--CH--CH--, cis и trans); Almquist et al., J. Met. Chem. 23: 1392-1298 (1980) (--COCH2--); Jennings-White et al., Tetrahedron Lett 23: 2533 (1982) (--COCH2--); Szelke et al., European Appln, EP 45665 CA (1982); 97: 39405 (1982) (--CH(OH)CH2--); Holladay et al., Tetrahedron Lett 24: 4401-4404 (1983) (--C(OH)CH2--); и Hruby Life Sci 31: 189-199 (1982) (--CH2--S--); где каждая из указанных работ приведена в настоящем описании в качестве ссылки. Следует понимать, что пептидные аналоги могут включать более одного атома между связываемыми атомами, такие как в случае b-аланина, g-аминомасляной кислоты и т.п.
Аминокислотные аналоги и пептидные аналоги зачастую обладают усиленными или просто желательными свойствами, такими как более экономичные условия их продукции, повышенная химическая стабильность, улучшенные фармакологические свойства (период полувыведения, абсорбция, эффективность), измененная специфичность (например, широкий спектр биологической активности), сниженная антигенность, повышенная способность проходить через биологические барьеры (например, через стенку кишки, кровеносных сосудов, гематоэнцефалический барьер) и другие.
D-аминокислоты могут использоваться для получения более стабильных пептидов, поскольку D-аминокислоты не распознаются пептидазами и аналогичными ферментами. Систематическое замещение одной или нескольких аминокислот в консенсусной последовательности D-аминокислотой того же типа (например, вводить D-лизин вместо L-лизина) может использоваться для получения более стабильных пептидов. Цистеиновые остатки могут использоваться для циклизации или для объединения двух или более пептидов вместе. Это может быть благоприятно для целей удержания белков в определенных конформациях (Rizo and Gierasch Ann. Rev. Biochem. 61: 387 (1992), данная работа включена в настоящее описание в качестве ссылки).
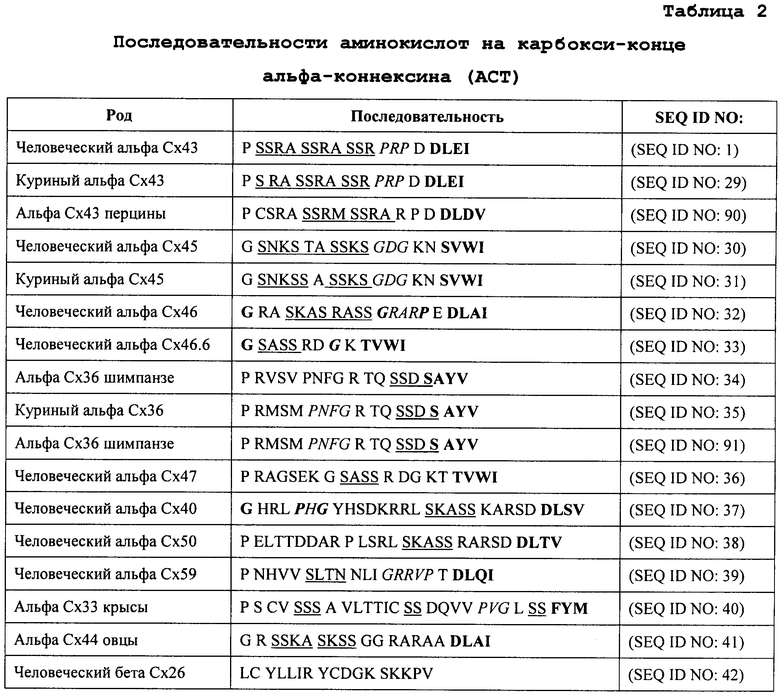
Таким образом, рассматриваемый полипептид может включать консервативный вариант с-конца альфа-коннексина (АСТ). Как видно из таблицы 4, единичное консервативное замещение в последовательности SEQ ID NO: 2 дано на примере последовательности SEQ ID NO: 3. Пример трех консервативных замещений в составе последовательности SEQ ID NO: 2 дан в последовательности SEQ ID NO: 4. Таким образом, предлагаемый полипептид может включать аминокислотную последовательность SEQ ID NO: 3 или SEQ ID NO: 4.
Варианты АСТ-полипептида

Следует понимать, что один из способов определения любых вариантов, модификаций или производных раскрываемых генов и белков лежит через определение вариантов, модификаций и производных применительно к идентичности последовательности (также называемой в настоящем описании как гомология) известных специфических последовательностей. Конкретно раскрываются варианты нуклеиновых кислот и полипептидов, которые обладают по меньшей мере на 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 процентов идентичностью по последовательности к указанной или известной последовательности. Специалистам в данной области хорошо известно, как определить идентичность по последовательности для двух белков или нуклеиновых кислот. Например, идентичность по последовательности может быть рассчитана после сопоставления двух последовательностей, так чтобы идентичность по последовательности была на наивысшем уровне.
Другим способом расчета идентичности по последовательности является использование известных и опубликованных алгоритмов. Оптимальность сопоставления последовательностей с целью сравнения может быть проведена с помощью алгоритма определения идентичности к локальной последовательности Смита и Ватермана (Smith and Waterman Adv. Appl. Math. 2: 482 (1981)), по алгоритму сопоставления для определения идентичности по последовательности Нидлмана и Вунша (Needlman and Wunsh, J. Mol. Biol. 48: 443 (1970)), при поиске по методу оценки сходства Пирсона и Липмана (Pearson and Lipman, Proc. Natl. Acad. Sci. USA 85: 2444 (1988)) с применением комьютеризированных инсталляций указанных алгоритмов (GAP, BESTFIT, FASTA и TFASTA в рамках пакета прикладных программ Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Ds., Madison, WI) или при осмотре. Указанные материалы включены в настоящее описание в качестве ссылок полностью, в том, что касается методик расчета идентичности по последовательности.
Аналогичного рода определение идентичности по последовательности может быть проведено для нуклеиновых кислот, например, с использованием известных алгоритмов, описанных в литературе (Zuker, M. Science 244: 48-52, 1989, Jaeger et al., Proc. Natl. Acad. Sci. USA 86: 7706-7710, 1989, Jaeger et al., Methods Enzymol. 183: 281-306, 1989), где указанные работы включены в настоящее описание в качестве ссылок, по меньшей мере в части материала, касающегося сопоставления нуклеиновых кислот.
Таким образом, рассматриваемый полипептид может включать аминокислотную последовательность, характеризующуюся наличием по меньшей мере 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 процентов идентичности по последовательности с с-концом альфа-коннексина (АСТ). Таким образом, в одном аспекте рассматриваемый полипептид включает аминокислотную последовательность, обладающую по меньшей мере на 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 процентов идентичностью по последовательности с SEQ ID NO: 1, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 90 или SEQ ID NO: 91. В качестве примера предлагается полипептид (SEQ ID NO: 4), обладающий 66% идентичностью по последовательности с тем самым тяжом из 9 аминокислот, который находится на карбокси-конце человеческого Сх43 (SEQ ID NO: 2).
Рассматриваемые в настоящем описании полипептиды могут быть введены непосредственно в повреждение ткани у индивидуума. Однако эффективность цитоплазматической локализации предлагаемого полипептида повышается путем присоединения переносчика клеточной интернализации в цис- или транс-положении к полипептиду. Эффективность переносчика клеточной интернализации повышается также под действием света или при совместной трансдукции клеток пептидом Tat-HA.
Таким образом, предлагаемый полипептид может включать переносчик клеточной интернализации или соответствующую последовательность. Последовательность клеточной интернализации может представлять собой последовательность интернализации, известную или недавно обнаруженную в данной области, или ее консервативные варианты. Не ограничивающие примеры переносчиков клеточной интернализации и соответствующих последовательностей включают последовательности Antennapedia, TAT, HIV-Tat, Penetratin, Antp-3A (мутант Antp), Buforin II, Transportan, MAP (модельный амфипатический пепетид), K-FGF, Ku70, Prion, pVEC, Pep-1, SynB1, Pep-7, HN-1, BGSC (бис-гуанидиний-спермидин-холестерин) и BGTC (бис-гуанидиний-трен-холестерин) (см. Таблицу 5).
Переносчики клеточной интернализации

Таким образом, предлагаемый полипептид может также включать аминокислотную последовательность SEQ ID NO: 7, SEQ ID NO: 14 (Bucci, M. et al., 2000. Nat. Med. 6, 1362-1367), SEQ ID NO: 15 (Derossi, D., et al., 1994, Biol. Chem. 269, 10444-10450), SEQ ID NO: 16 (Fischer, P. M., et al., 2000. J. Pept. Res. 55, 163-172), SEQ ID NO: 17 (Frankel, A. D. & Pabo, C. O. 1988. Cell 55, 1189-1193; Green, M. & Loewenstein, P. M. 1988. Cell 55, 1179-1188), SEQ ID NO: 18 (Park, C. B., et al., 2000. Proc. Natl. Acad. Sci. USA, 97, 8245-8250), SEQ ID NO: 19 (Pooga, M., et al., 1998. FASEB J. 12, 67-77), SEQ ID NO: 20 (Oehlke, J. et al., 1998. Biochim. Biophys. Acta. 1414, 127-139), SEQ ID NO: 21 (Lin, Y. Z., et al., 1995. J. Biol. Chem. 270, 14255-14258), SEQ ID NO: 22 (Sawada, M., et al., 2003. Nature Cell Biol. 5, 352-357), SEQ ID NO: 23 (Lundberg, P., et al., 2002. Biochem. Biophys. Res. Commun. 299, 85-90), SEQ ID NO: 24 (Elmquist, A., et al., 2001. Exp. Cell Res. 269, 237-244), SEQ ID NO: 25 (Morris, M. C., et al., 2001. Nature Biotechnol. 19, 1173-1176), SEQ ID NO: 26 (Rousselle, C., et al., 2000. Mol. Pharmacol. 57, 679-686), SEQ ID NO: 27 (Gao, C., et al., 2002. Bioorg. Med. Chem. 10, 4057-4065) или SEQ ID NO: 28 (Hong, F. D & Clayman, G. L., 2000. Cancer Res. 60, 6551-6556). Предлагаемый полипептид может также включать BGSC (бис-гуанидиний-спермидин-холестерин) или BGTC (бис-гуанидиний-трен-холестерин) (Vigneron, J. P., et al., 1998 Proc. Natl. Acad. Sci. USA, 93, 9682-9686). Указанные выше материалы включены в настоящее описание в качестве ссылок полностью, применительно к описанию векторов и последовательностей для клеточной интернализации. Любые другие последовательности интернализации, уже известные или которые будут позже идентифицированы, могут быть объединены с пептидом согласно настоящему изобретению.
Предлагаемый полипептид может включать любую АСТ-последовательность (то есть любой из АСТ-пептидов, приведенных в настоящем описании) в сочетании с любой из описанных здесь последовательностей для клеточной интернализации. Примеры указанных сочетаний приведены в таблице 6. Таким образом, предлагаемый полипептид может включать последовательность Antennapedia, содержащую аминокислотную последовательность SEQ ID NO: 7. Таким образом, предлагаемый полипептид может также включать аминокислотную последовательность SEQ ID NO: 8 SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11 или SEQ ID NO: 12.
АСТ-полипептиды с последовательностями клеточной интернализации (CIS)


Также предлагаются выделенные нуклеиновые кислоты, кодирующие полипептиды согласно настоящему изобретению. Описанные нуклеиновые кислоты состоят, например, из нуклеотидов, нуклеотидных аналогов или замещенных нуклеотидов. Не ограничивающие примеры указанных и других молекул обсуждаются в настоящем описании. Следует понимать, что, например, в том случае, когда вектор экспрессируется в клетке, экспрессированная мРНК будет в типичном случае составлена из A, C, G и U.
Термин «выделенная нуклеиновая кислота» или «очищенная нуклеиновая кислота» обозначает ДНК, которая свободна от генов, которые в природном геноме организма, из которого ДНК согласно настоящему изобретению была получена, фланкируют ген. В этой связи, данный термин, включает, например, рекомбинантную ДНК, которая встроена в вектор, такой как автономно реплицирующаяся плазмида или вирус; или встроена в геномную ДНК прокариот или эукариот (например, трансген), или которая существует в виде отдельной молекулы (например, кДНК или геномная ДНК, или фрагмент кДНК, получаемый методом ПЦР, путем расщепления рестрикционными эндонуклеазами, или в результате химического синтеза или синтеза in vitro). Данный термин также включает рекомбинантную ДНК, которая является частью гибридного гена, кодирующего дополнительную полипептидную последовательность. Термин «выделенная нуклеиновая кислота» также относится к РНК, например, к молекуле мРНК, которая кодируется выделенной молекулой ДНК или которая была химически синтезирована, или которая отделена или по существу не содержит по меньшей мере некоторые клеточные компоненты, например, другие типы молекул РНК или полипептидных молекул.
Таким образом, предлагается выделенная нуклеиновая кислота, кодирующая полипептид, включающий аминокислотную последовательность SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11 или SEQ ID NO: 12.
Таким образом, предлагаемая нуклеиновая кислота может включать последовательность нуклеиновой кислоты SEQ ID NO: 79, SEQ ID NO: 80, SEQ ID NO: 81, SEQ ID NO: 82, SEQ ID NO: 83, SEQ ID NO: 84, SEQ ID NO: 85, SEQ ID NO: 86, SEQ ID NO: 87, SEQ ID NO: 88 или SEQ ID NO: 89.
Нуклеиновая кислота согласно настоящему изобретению может быть функционально связана с последовательностью контроля экспрессии. Также описывается вектор, включающий одну или несколько нуклеиновых кислот согласно настоящему изобретению, где указанная нуклеиновая кислота функционально связана с последовательностью контроля экспрессии. Имеется множество композиций и способов, которые могут использоваться для доставки нуклеиновых кислот в клетки, либо in vitro, либо in vivo. Указанные способы и композиции могут быть в основном распределены по двум классам: системы доставки, основанные на вирусах, и системы доставки, основанные не на вирусах. Например, нуклеиновые кислоты могут быть доставлены с помощью различных систем непосредственной доставки, таких как электропорация, липофекция, осаждение фосфатом кальция, плазмиды, вирусные векторы, вирусные нуклеиновые кислоты, фаговые нуклеиновые кислоты, фаги, космиды, или с помощью переносчика генетического материала в клетки или с использованием носителей, таких как катионные липосомы. Соответствующие методы для осуществления трансфекции, включающие вирусные векторы, химические трансфектанты или физико-механические процедуры, такие как электропорация или прямая диффузия ДНК, описаны, например, в работе Волффа с соавт. (Wolff, J. A., et al., Science, 247, 1465-1468 (1990); и Wolff, J. A., Nature, 352, 815-818 (1991)). Такие способы хорошо известны в данной области и могут быть легко адаптированы для использования в сочетании с композициями и способами согласно настоящему изобретению. В некоторых случаях указанные способы могут быть модифицированы применительно к конкретному варианту использования, включающему крупные молекулы ДНК. Кроме того, указанные способы могут использоваться для целевого воздействия на некоторые заболевания и клеточные популяции посредством целевого направления носителя.
Транспортирующие векторы могут представлять собой любую нуклеотидную конструкцию, используемую для доставки генов в клетки (например, плазмиду), или представлять собой часть конструкции, функционирующей в процедурах основной стратегии доставки генов, например, в виде части рекомбинантного ретровируса или аденовиуса (Ram et al., Cancer Res. 53: 83-88 (1993)).
В контексте настоящего описания используемые плазмидные или вирусные векторы представляют собой агенты, которые переносят описываемые нуклеиновые кислоты, такие как SEQ ID NO: 6, в клетку без деградации, и включают промотор, способствующий экспрессии гена в тех клетках, в которые осуществляется доставка. В некоторых вариантах промоторы получают из вируса или ретровируса. Вирусные векторы включают, например, аденовирус, аденоассоциированный вирус, вирус герпеса, вирус осповакцины, полиовирус, вирус СПИДа, нейротропный вирус, вирус Синдбис и другие РНК-вирусы, включая вирусы с ВИЧ-скелетом. Описываются также любые вирусные семейства, которые имеют общие свойства с указанными вирусами и которые делают их подходящими для использования в качестве векторов. Ретровирусы включают вирус мышиного лейкоза Малони, MMLV и ретровирусы, которые экспрессируют желательные свойства MMLV, в качестве вектора. Ретровирусные векторы способны переносить более крупные генетические структуры, например, трансген или маркерный ген, чем другие вирусные векторы, и по это причине представляют собой наиболее часто используемые векторы. Однако они не используются в случае непролиферирующих клеток. Аденовирусные векторы представляют собой в основном стабильные и удобные для манипуляций векторы, имеют высокие титры, могут доставляться в виде аэрозольных композиций и способны трансфицировать не делящиеся клетки. Векторы на основе вируса оспы являются крупными и обладают несколькими сайтами для встраивания генов, они термостибильны и могут храниться при комнатной температуре. Описывается также вирусный вектор, который был получен методом генетической инженерии, с тем чтобы подавлять иммунный ответ хозяйского организма, за счет проявления вирусных антигенов. Векторы данного типа могут переносить кодирующие участки для интерлейкина 8 или 10.
Вирусные векторы могут обладать более высокой способностью к транзакции (способностью вводить гены), чем это свойственно химическим или физическим способам встраивания генов в клетки. В типичном случае вирусные векторы содержат неструктурные ранние гены, структурные поздние гены, транскрипт РНК-полимеразы III, инвертированные концевые повторы, необходимые для репликации и инкапсидирования, и промоторы для контроля транскрипции и репликации вирусного генома. Вирусы, в случае их получения генноинженерными методами в качестве векторов, содержат в типичном случае один или несколько удаленных ранее генов и ген или генную/промоторную кассету, вставленную в вирусный геном вместо удаленной вирусной ДНК. Конструкции данного типа могут переносить примерно 8 килобайт чужеродного генетического материала. Необходимая функция удаленных ранее генов в типичном случае выполняется клеточными линиями, которые были созданы генноинженерными методами для целей экспрессии генных продуктов ранних генов в трансформе.
Ретровирус представляет собой вирус животных, принадлежащий к вирусному семейству Retroviridae, включающему любые типы подсемейств, роды или тропизмы. Ретровирусные векторы в основном описаны в работе Верма (Verma, I.M., Retroviral vectors for gene transfer. In Microbiology-1985, American Society for Microbiology, p.229-232, Washington, (1985)), которая включена в настоящее описание в качестве ссылки. Примеры способов, используемых применительно к ретровирусным векторам для проведения генной терапии, описаны в патентах США №№4868116 и 4980286; в PCT заявках WO 90/02806 и WO 89/07136; и Mulligan (Science 260: 926-932 (1993)), которые включены в настоящее описание в качестве ссылок.
Ретровирус представляет собой по существу упаковку, которая содержит введенную в нее нуклеиновую кислоту. Указанная нуклеиновая кислота несет в себе упаковочный сигнал, гарантирующий, что реплицированные дочерние молекулы будут эффективно упакованы внутри оболочки. Кроме упаковочного сигнала, имеется множество молекул, которые необходимы в цис-форме, например, для репликации и упаковки реплицированного вируса. В типичном случае ретровирусный геном содержит gag, pol и env гены, которые вовлекаются в образование белковой оболочки. Это те самые gag, pol и env гены, которые в типичном случае замещаются чужеродной ДНК, предназначенной для переноса в целевую клетку. Ретровирусные векторы в типичном случае содержат упаковочный сигнал для включения в оболочку, последовательность, которая дает сигнал для старта единицы транскрипции gag, элементы, необходимые для обратной транскрипции, включая сайт связывания праймера для связывания праймера тРНК для обратной транскрипции, последовательности терминирующих повторов, которые направляют переключение нитей РНК в ходе синтеза ДНК, обогащенную пуринами последовательность от 5' до 3' LTR, которые служат в качестве сайта примирования в синтезе второй цепи в синтезе ДНК, и специфические последовательности в районе концов LTR, которые позволяют осуществлять встраивание ДНК-ретровируса, для введения ее в хозяйский геном. Удаление gag, pol и env генов позволяет встроить в вирусный геном примерно 8 килобайт чужеродной последовательности, которая подвергается обратной транскрипции и после репликации упаковывается с образованием новых ретровирусных частиц. Указанное количество нуклеиновой кислоты достаточно для доставки одного или множества генов, в зависимости от размера каждого транскрипта.
Поскольку механизм репликации и упаковки белков в большинстве ретровирусных векторов удален (gag, pol и env), векторы получают в типичном случае путем помещения их в линию упаковочных клеток. Линия упаковочных клеток представляет собой такую клеточную линию, которая была трансфицирована или трансформированы ретровирусом, содержащим механизм репликации и упаковки, но не содержащим какого-либо сигнала для упаковки. В том случае, когда вектор, несущий выбранную ДНК, трансфицируют в указанные клеточные линии, вектор, содержащий интересующий ген, реплицируется и упаковывается с получением новых ретровирусных частиц под действием механизма хелперной клетки, представленного в цис-форме. Геномы для такого механизма не входят в состав упаковки, поскольку они не содержат необходимых сигналов.
Конструирование дефектных по репликации аденовирусов было описано в литературе (Berkner et al., J. Virology 61: 1213-1220 (1987); Massie et al., Mol. Cell. Biol. 6: 2872-2883 (1986); Haj-Ahmad et al., J. Virology 57: 265-274 (1986); Davidson et. al., J. Virology 61: 1226-1239 (1987); Zhang «Generation and identification of recombinant adenovirus by liposome-mediated transfection and PCR analysis» BioTechniques 15: 868-872 (1993)). Преимущество использования указанных вирусов в качестве векторов заключается в том, что они ограничены в степени распространения на другие клеточные типы, поскольку могут реплицироваться внутри исходной инфицированной клетки, но не способны образовывать новые инфекционные вирусные частицы. Было показано, что рекомбинантные аденовирусы достигают высокой эффективности по генному переносу после направленной доставки in vivo в эпителий дыхательных путей, гепатоциты, сосудистый эндотелий, паренхиму ЦНС и множество других тканевых сайтов (Morsy, J. Clin. Invest. 92: 1580-1586 (1993); Kirshenbaum, J. Clin. Invest. 92:381-387 (1993); Roessler, J. Clin. Invest. 92: 1085-1092 (1993): Moullier, Nature Genetics 4: 154-159 (1993); La Salle, Science 259: 988-990 (1993); Gomes-Foix, J. Biol. Chem. 267: 25129-25134 (1992); Rich, Human Gene Therapy 4: 461-476 (1993); Zabner, Nature Genetics 6: 75-83 (1994); Guzman, Circulation Research 73: 1201-1207 (1993); Bout, Human Gene Therapy 5: 3-10 (1994); Zabner, Cell 75: 207-216 (1993); Caillaud, Eur J. Neuroscience 5: 1287-1291 (1993) и Ragot, J. Gen. Virology 74: 501-507 (1993)). Рекомбинантные вирусы осуществляют генную трансдукцию путем связывания со специфическими рецепторами на клеточной поверхности, после чего вирус подвергается интернализации по механизму эндоцитоза, опосредованного рецептором, таким же образом, что и аденовирус дикого типа или аденовирус, дефектный по репликации (Chardonnet and Dales, Virology 40: 462-477 (1970); Brown and Burlingham, J. Virology 12: 386-396 (1973); Svensson and Persson, J. Virology 55: 442-449 (1985); Seth et al., J. Virol. 51: 650-655 (1984); Seth et al., Mol. Cell. Biol. 4: 1528-1533 (1984); Varga et al., J. Virology 65: 6061-6070 (1991); Wickham et al., Cell 73: 309-319 (1993)).
Вирусным вектором может быть такой вектор, который основан на аденовирусе с удаленным геном Е1, где указанные вирионы получают в клеточной линии, такой как линия клеток человека 293. В одном аспекте и Е1, и гены Е3 удаляют из генома аденовируса.
Другой тип вирусного вектора основан на аденоассоциированном вирусе (AAV). Указанный дефектный парвовирус может инфицировать клетки любого типа, и он не патогенен для человека. Вирусы AAV типа могут транспортировать от 4 до 5 килобайт и известно, что AAV дикого типа стабильно встраиваются в хромосому 19. В качестве примера можно отметить, что указанный вектор может представлять собой вектор P4.1 C, производимый компанией Avigen, San Francisco, CA, который может содержать хелперный ген тимидинкиназы вируса простого герпеса, HSV-tk и/или маркерный ген, такой как ген, кодирующий зеленый флуоресцентный белок, GFP.
В случае другого типа AAV вируса, указанный AAV содержит пару инвертированных концевых повторов (ITR), которые фланкируют по меньшей мере одну кассету, содержащую промотор, направляющий специфичную для клетки экспрессию, который функционально связан с гетерологичным геном. Термин «гетерологичный» в данном контексте относится к любой нуклеотидной последовательности или гену, которые не являются нативными для AAV или B19 парвовируса.
В типичном случае кодирующие участки AAV и В19 делетируют, что приводит к получению безопасного не цитотоксичного вектора. ITR AAV или их модификации придают инфекционность и возможность сайт-специфической интеграции, но не цитотоксичность, а промотор направляет экспрессию, специфичную для клетки. В настоящее изобретение включен патент США №6261834 в качестве ссылки, в части, относящейся к AAV-вектору.
Таким образом, описываемые векторы обеспечивают наличие молекул ДНК, способных к интеграции в хромосому млекопитающих без заметной токсичности.
Встроенные гены в вирусных и ретровирусных системах обычно содержат промоторы и/или энхансеры, помогающие контролировать экспрессию желательного генного продукта. В основном промотор представляет собой одну или несколько последовательностей ДНК, которые функционируют в том случае, когда они находятся в относительно фиксированном положении от сайта старта транскрипции. Промотор содержит ядерные элементы, необходимые для базисного взаимодействия РНК-полимеразы и факторов транскрипции, и может содержать элементы и отвечающие элементы, расположенные против направления считывания информации.
Молекулярно-генетические эксперименты с использованием крупных вирусов герпеса человека позволили разработать механизм, посредством которого крупные гетерологичные фрагменты ДНК могут быть клонированы, размножены и установлены в клетках, чувствительных к инфекции вирусами герпеса (Sun et al., Nature genetics 8: 33-41, 1994; Cotter and Robertson, Curr Opin Mol Ther. 5: 633-644, 1999). Указанные крупные ДНК вирусов (вируса простого герпеса (HSV) и вируса Эпштейна-Барра (EBV)) обладают способностью к доставке фрагментов человеческой гетерологичной ДНК размером >150 килобайт в специфические клетки. Рекомбинантные EBV могут поддерживать существование крупных частей ДНК в инфицированных B-клетках в виде эписомальной ДНК. Индивидуальные клоны несут вставки человеческого генома до размером 330 кбайт, будучи, по всей видимости, генетически стабильными. Поддержание указанных эписом требует наличия специфического ядерного белка EBV, EBNA1, который конститутивно экспрессируется в ходе инфекции EBV. Дополнительно, указанные векторы могут использоваться для трансфекции, входе которой временно может генерироваться in vitro большое количество белка. Системы с ампликоном вируса герпеса также используются для целей упаковки частей ДНК размером >220 кбайт и инфекции клеток, которые могут стабильно поддерживать ДНК в виде эписом.
Другие полезные системы включают, например, векторы на основе вируса осповакцины, реплицирующиеся и ограниченные по хозяйскому организму.
Описываемые композиции могут доставляться в целевые клетки с помощью множества способов. Например, указанные композиции могут доставляться с помощью электропорации или с помощью липофекции, или по методу осаждения фосфатом кальция. Выбранный механизм доставки зависит частично от типа целевой клетки и от того, как будет осуществляться доставка, например, in vivo или in vitro.
Таким образом, рассматриваемые композиции могут включать, в дополнение к описываемым полипептидам, нуклеиновые кислоты или векторы, например, липиды, такие как липосомы, такие как катионные липосомы (например, DOTMA, DOPE, DC-холестерин) или анионные липосомы. Липосомы могут также включать белки для облегчения доставки в конкретную клетку, при желании. Введение композиции, включающей указанное соединение и катионную липосому, может осуществляться в кровь, афферентно к целевому органу, или путем ингаляции в дыхательные пути в направлении к целевым клеткам дыхательных путей. Информация по липосомам приведена, например, в следующих работах: Brighman et al., Am. J. Resp. Cell. Mol. Biol. 1: 95-100 (1989); Felgner et al., Proc. Natl. Acad. Sci. USA 84: 7413-7417 (1987); патент США №4897355. Кроме того, указанное соединение может вводиться в качестве компонента микрокапсулы, которая может направляться к клеткам специфических типов, таким как макрофаги, или в тех случаях, когда диффузия соединения или доставка соединения из микрокапсулы должна осуществляться с определенной скоростью или с достижением определенной дозировки.
В описанных выше способах, которые включают введение и поглощение экзогенной ДНК в клетки индивидуума (например, путем генной трансдукции или трансфекции), доставка композиции в клетки может осуществляться с помощью множества механизмов. В качестве одного примера можно отметить, что доставка может осуществляться с помощью липосомы при использовании коммерчески доступных липосомных препаратов, таких как LIPOFECTIN, LIPOFECTAMINE (GIBCO-BRL, Inc., Gaithersburg, MD), SUPERFECT (Qiagen, Inc. Hilden, Germany) и TRANSFECTAM (Promega Biotec, Inc., Madison, WI), а также с использованием других липосом, разработанных в соответствии с процедурами, стандартными для данной области. Кроме того, описываемые нуклеиновая кислота или вектор могут доставляться in vivo путем электропорации, методика проведения которой доступна от компании Genetronics, Inc. (San Diego, CA), а также с помощью устройства для сонопорации SONOPORATION (ImaRx Pharmaceutical Corp., Tucson, AZ).
Нуклеиновые кислоты, которые доставляются в клетки, где они должны интегрироваться в геном хозяйской клетки, в типичном случае содержат последовательности для интеграции. Указанные последовательности зачастую являются последовательностями, близкими к вирусным, в частности, в том случае, когда используют системы на основе вирусов. Указанные системы вирусной интеграции могут быть также включены в нуклеиновые кислоты, которые подлежат доставке с использованием системы, основанной не на нуклеиновой кислоте, такой как липосома, так что нуклеиновая кислота, содержащаяся в системе доставки, может быть интегрирована в хозяйский геном.
Другие основные методики интеграции в хозяйский геном включают, например, систему, разработанную для усиления гомологичной рекомбинации с хозяйским геномом. Указанная система в типичном случае основана на последовательности расположенной по обе стороны подлежащей экспрессии нуклеиновой кислоты, которая обладает достаточной гомологией с целевой последовательностью в геноме хозяйской клетки, так что происходит рекомбинация между нуклеиновой кислотой вектора и целевой нуклеиновой кислотой, приводящая к интеграции доставляемой нуклеиновой кислоты в хозяйский геном. Указанные системы и способы, необходимые для усиления гомологичной рекомбинации, известны специалистам в данной области.
Композиции могут доставляться в клетки индивидуума in vivo и/или ex vivo с использованием множества механизмов, известных в данной области (например, поглощение оголенной ДНК, слияние липосом, внутримышечная инъекция ДНК с помощью генной пушки, эндоцитоз и т.п.).
Если используются методы ex vivo, клетки или ткани могут быть отобраны и далее поддерживаться за пределами организма по стандартным протоколам, известным в данной области. Композиции могут быть введены внутрь клеток посредством любого механизма генного переноса, такого как, например, генная доставка с использованием фосфата кальция, электропорация, микроинъекция или использование протеолипосом. Трансдуцированные клетки далее подвергают инфузии (например, в фармацевтически приемлемом носителе) или в гомотропном варианте трансплантируют назад в организм индивидуума с использованием стандартных методик, подходящих для данного типа клетки или ткани. В данной области известны стандартные методики, подходящие для трансплантации или инфузии различных клеток в организм индивидуума.
Нуклеиновые кислоты, которые доставляются в клетки, в типичном случае содержат системы контроля экспрессии. Например, встроенные гены в вирусных и ретровирусных системах обычно содержат промоторы и/или энхансеры, помогающие контролировать экспрессию желательного генного продукта. Промотов представляет собой, в основном, одну или несколько последовательностей ДНК, которые функционируют, находясь в относительно фиксированном положении от сайта старта транскрипции. Промотор содержит ядерные элементы, необходимые для базисного взаимодействия РНК-полимеразы и факторов транскрипции, и может содержать элементы и отвечающие элементы против направления считывания информации.
Промоторы, контролирующие транскрипцию из векторов в хозяйских клетках млекопитающих, могут быть получены из различных источников, например, из геномов вирусов, таких как вирус полиомы, обезьяний вирус 40 (SV40), аденовирус, ретровирусы, вирус гепатита B, цитомегаловирус, или могут быть получены из гетерологичных промоторов млекопитаюшщих, например, из промотора бета-актина. Ранние и поздние промоторы вируса SV40 могут быть легко получены в виде фрагмента рестрикции SV40, который также содержит ориджин репликации SV40 (Fiers et al., Nature, 273: 113 (1978)). Очень ранний промотор человеческого мегаловируса может быть получен в виде фрагмента рестрикции HindIII E (Greenway, P.J. et al., Gene 18: 355-360 (1982)). И разумеется, промоторы из хозяйской клетки или родственного вида также могут использоваться в данном контексте.
Энхансеры в основном относятся к последовательности ДНК, которые функционируют на расстоянии от сайта старта транскрипции, которое не фиксировано, и могут быть либо в 5'- (Laimins. P.J. et al., Proc. Natl. Acad. Sci. USA 78: 993 (1981)), либо в 3'- (Lusky, M.L., et al., Mol. Cell. Biol. 3: 1108 (1983) положении относительно единицы транскрипции. Кроме того, энхансеры могут находиться в составе интрона (Banerji, J. L. et al., Cell 33: 729 (1983)), а также в составе самой кодирующей последовательности (Osborn, T.F., et al., Mol. Cell. Biol. 4: 1293 (1984)). Они обычно включают от 10 до 300 пн в длину и функционируют в цис-положении. Функция энхансеров заключается в повышении транскрипции от близлежащих промотеров. Энхансеры также зачастую содержат отвечающие элементы, которые вовлекаются в регуляцию транскрипции. Промоторы могут также содержать отвечающие элементы, которые вовлекаются в регуляцию транскрипции. Энхансеры зачастую определяют регуляцию экспрессии гена. Хотя в настоящее время известно множество энхансерных последовательностей в генах млекопитающих (глобина, эластазы, альбумина, α-фетопротеина и инсулина), в типичном случае для основной экспрессии используют энхансер из вируса эукариотической клетки. Соответствующие примеры включают энхансер SV40 на поздней стороне ориджина репликации (100-270 пн), энхансер раннего промотора цитомегаловируса, энхансер вируса полиомы на поздней стороне ориджина репликации и энхансеры аденовируса.
Промотор и/или энхансер могут быть специфически активированы либо светом, либо специфическими химическими факторами, которые запускают данную функцию. Системы могут подвергаться регуляции реагентами, такими как тетрациклин и дексаметазон. Имеется несколько путей повышения экспрессии гена вирусного вектора, таких как воздействие облучением, таким как гамма-облучение, или с помощью алкилирующих химиотерапевтических препаратов.
В некоторых вариантах осуществления настоящего изобретения промоторный и/или энхансерный участки могут действовать как конститутивный промотор и/или энхансер в направлении максимизации экспрессии участка единицы транскрипции, подвергаемого транскрибции. В некоторых конструкциях промоторный и/или энхансерный участки будут активны во всех типах эукариотических клеток, даже если они экспрессируются только в конкретном типе клетки в конкретное время. К промотору данного типа относится промотор CMV (650 оснований). Другие такие промоторы включают промоторы SV40, цитомегаловируса (промотор полной длины) и промотор ретровирусного вектора LTR.
Было показано, что все специфические регуляторные элементы могут быть клонированы и использованы для конструирования векторов экспрессии, которые селективно экспрессируются в клетках конкретных клеточных типов, таких как клетки меланомы. Промотор глиального фибриллярного уксусного белка (GFAP) использовался для селективной экспрессии генов в клетках глиального происхождения.
Векторы экспрессии, используемые в эуакариотических хозяйских клетках (дрожжи, грибы, насекомые, растение, животное, человек или ядерные клетки), могут также содержать последовательности, необходимые для терминации транскрипции, которые могут влиять на экспрессию мРНК. Указанные участки транскрибируются в виде полиаденилированных сегментов в нетранслируемой части мРНК, кодирующей тканевой белковый фактор. 3'-нетранслируемые участки также включают сайты терминации транскрипции. Единица транскрипции может также содержать участок полиаденилирования. Одним преимуществом такого участка является тот факт, что он повышает вероятность того, что транскрибируемая единица будет далее процессирована и транспортирована как мРНК. Идентификация и использование сигналов полиаденилирования в конструкциях экспрессии хорошо известны. Гомологичные сигналы полиаденилирования могут использоваться в трансгенных конструкциях. В некоторых единицах транскрипции участок полиаденилирования происходит из раннего сигнала полиаденилирования SV40 и состоит примерно из 400 оснований. Транскрибированные единицы содержат другие стандартные последовательности, сами по себе или в сочетании с указанными выше последовательностями, для повышения экспрессии или стабильности конструкции.
Вирусные векторы могут включать последовательность нуклеиновой кислоты, кодирующую маркерный продукт. Указанный маркерный продукт используют для определения того, был ли ген доставлен в клетку и, при доставке, был ли он экспрессирован. Примеры маркерных генов включают lacZ-ген E.coli, который кодирует β-галактозидазу, а также зеленый флуоресцентный белок.
В некоторых вариантах осуществления изобретения маркер может представлять собой селективный маркер. Примеры подходящих селектируемых маркеров для использования в клетках млекопитающих, включают дигидрофолятредуктазу (DHFR), тимидинкиназу, неомицин, аналог неомицина G418, гидромицини пуромицин. В том случае, когда такие селектируемые маркеры успешно переносятся в клетку хозяина-млекопитающего, указанная трансформированная хозяйская клетка может выжить, если она помещена в условия селективного давления. Имеется две широко используемые различные группы режимов селекции. Первая категория определяется клеточным метаболизмом и основана на использовании мутантной клеточной линии, которая потеряла способность расти без добавок среды. Два других примера включают DHFR-клетки яичника китайского хомяка (CHO) и мышиные LTK-клетки. Указанные клетки потеряли способность расти без добавления таких питательных компонентов, как тимидин или гипоксантин. Поскольку указанные клетки потеряли определенные гены, необходимые для осуществления полного пути синтеза нуклеотидов, они не могут выживать, если отсутствуют соответствующие нуклеотиды в виде добавок к среде. Альтернативой использования добавок к среде является встраивание интактного DHFR-гена или TK-гена в клетки, потерявшие соответствующие гены, что изменяет их ростовые потребности. Индивидуальные клетки, которые не были трансформированы DHFR или TK-генами, будут не способны выживать в средах без добавок.
Вторая категория представляет собой доминантную селекцию, которая относится к схеме селекции, используемой в любом типе клеток и которая не требует наличия мутантной клеточной линии. Указанные схемы в типичном случае основаны на применении лекарственного препарата, останавливающего рост хозяйской клетки. Те клетки, которые содержат новый ген, будут экспрессировать белок, придающий лекарственную резистентность, и будут выживать в ходе селекции. Примеры такой доминантной селекции включают использование препаратов неомицина (Southern P. and Berg, P., J. Molec. Appl. Genet. 1: 327 (1982)), микофеноловой кислоты (Mulligan, R. C. and Berg P. Science 209: 1422 (1980)) или гидромицина (Sugden, B. et al., Mol. Cell. Biol. 5: 410-413 (1985)). Три примера относятся к использованию бактериального гена, функционирующего под контролем эукариотических клеток и придающего резистентность к соответствующему препарату G418 или неомицину (генетицин), xgpt (микофеноловая кислота) или гигромицину, соответственно. Другие включают неомициновый аналог G418 и пуромицин.
Настоящее изобретение также относится к клетке, включающей один или несколько описываемых векторов. В контексте настоящего описания термины «клетка», «клеточная линия» и «клеточная культура» могут использоваться взаимозаменяемо, и все такие обозначения включают потомство данных клеток. Описываемая клетка может быть любой клеткой, используемой для клонирования или размножения векторов согласно настоящему описанию. Таким образом, клетка может относиться к первичной клеточной культуре или к установленной клеточной линии. Указанный метод применим к любой клетке, включая прокариотическую или эукариотическую клетку, такую как бактериальная клетка, клетка растения, животного и т.п. Тип клетки может быть выбран специалистом в данной области с учетом выбранного вектора и желательного направления использования.
Настоящее изобретение также относится к животным, получаемым по способу трансфекции клетки животного любыми молекулами нуклеиновой кислоты или векторами согласно настоящему описанию. Настоящее описание относится к животным, получаемым в результате трансфекции клетки животного любыми молекулами нуклеиновой кислоты или векторами согласно настоящему описанию, где указанное животное представляет собой млекопитающее. Изобретение также относится к животным, получаемым по способу трансфекции клетки животного любыми молекулами нуклеиновой кислоты или векторами согласно настоящему описанию, где указанное животное представляет собой мышь, крысу, кролика, корову, овцу, свинью или примата.
Предлагается композиция, включающая один или несколько полипептидов, нуклеиновых кислот или векторов согласно настоящему описанию в фармацевтически приемлемом носителе. Таким образом, предлагается композиция, включающая сочетание двух или более любых приведенных в настоящем описании АСТ-полипептидов в фармацевтически приемлемом носителе. Например, предлагается композиция, включающая SEQ ID NO: 1 и SEQ ID NO: 5 в фармацевтически приемлемом носителе.
Термин «фармацевтически приемлемый» относится к материалу, который не является биологически или в ином плане нежелательным, то есть к материалу, вводимому в организм индивидуума вместе с нуклеиновой кислотой или вектором и который не будет вызывать какие-либо нежелательные биологические эффекты или вредные взаимодействия с любыми другими компонентами фармацевтической композиции, в составе которой он находится. Носитель обычно выбирают таким образом, чтобы достичь минимизации любой возможной деградации активного ингредиента, а также с целью минимизации любых возможных побочных эффектов у индивидуума, в соответствии с методиками, известными специалистам в данной области.
Композиция согласно настоящему описанию может также включать любое известное или заново открытое вещество, которое может вводиться в рану, повреждение ткани, сайт воспаления или сайт рака. Например, композиция согласно настоящему изобретению может также включать один или несколько классов антибиотиков (например, аминогликозиды, цефалоспорины, хлорамфеникол, клиндамицин, эритромицины, фторхинолоны, макролиды, азолиды, метронидазол, пенициллины, тетрациклины, триметоприм-сульфаметоксазол, ванкомицин), стероидов (например, андраны (например, тестостерон), холестаны (например, холестерин), холевые кислоты (например, холевая кислота), кортикостероиды (например, дексаметазон), эстраены (например, эстрадиол), прегнаны (например, прогестерон), наркотических и не наркотических анальгетиков (например, морфин, кодеин, героин, гидроморфон, леворфанол, меперидин, метадон, оксидон, пропоксифен, фентанил, метадон, налоксон, бупренорфин, буторфанол, налбуфин, пентазоцин), хемотерапевтических агентов (например, противораковые препараты, включающие, без ограничения, альтретамин, аспарагиназу, блеомицин, бусульфан, карбоплатин, кармустин, хлорамбуцил, цисплатин, кладрибин, циклофосфамид, цитарабин, дакарбазин, диэтилстилбестрол, этинилэстрадиол, этопозид, флоксуридин, флударабин, фторурацил, флутамид, гозерелин, гидроксимочевину, идарубицин, ифосфамид, леупролид, левамизол, ломустин, меклоретамин, медроксипрогестерон, мегестрол, мелфалан, меркаптопурин, метотрексат, митомицин, митотан, митоксантрон, паклитаксел, пентастатин, пипоброман, пликамицин, преднизон, прокарбазин, стрептозоцин, тамоксифен, тенипозид, винбластин, винкристин), противовоспалительных средств (например, алклофенак, дипропионат алклометазона, ацетонид алгестона, альфа-амилаза, амцинафал, амцинафид, амфенак-натрий, гидрохлорид амиприлоза, анакинра, аниролак, анитразафен, апазон, балсалазид-динатрий, бендазак, беноксапрофен, гидрохлорид бензидамина, бромелаины, броперамол, будезонид, карпрофен, циклопрофен, цинтазон, клипрофен, пропионат клобетазола, бутират клобетазона, клопирак, пропионат клотиказона, ацетат корметазона, деканоат кортодоксона, дефлазакорт, делатестрил, депо-тестостерон, дезонид, дезоксиметазон, дипропионат дексаметазона, диклофенак-калий, диклофенак-натрий, диацетат дифлоразона, дифлумидон-натрий, дифлунизал, дифлупреднат, дифталон, диметилсульфоксид, дроцинонид, эндризон, энлимомаб, эноликам-натрий, эпиризол, этодолак, этофенамат, фелбинак, фенамол, фенбуфен, фенклофенак, фенклорак, фендозал, фенпипалон, фентиазак, флазалон, флуазакорт, флуфенамовая кислота, флумизол, ацетат флунизолида, флуниксин, флуниксин-меглумин, флуокортинбутил, ацетат фторметанола, флуквазон, флурбипрофен, флуретофен, пропионат флутиказона, фурапрофен, фуробуфен, галцинонид, пропионат галобетазола, ацетат галопредона, ибуфенак, ибупрофен, ибупрофен-алюминий, ибупрофен-пиконол, илонидап, индометацин, индометацин-натрий, индопрофен, индоксол, интразол, ацетат изофлупредона, изоксепак, изоксикам, кетопрофен, гидрохлорид лофемизола, ломоксикам, этабонат лотепреднола, меклофенамат-натрий, меклофенамовая кислота, дибутират меклоризона, мефенамовая кислота, мезаламин, мезеклазон, местеролон, метандростенолон, метенолон, ацетат метенолона, сулептанат метилпреднизолона, момифлумат, набуметон, нандролон, напроксен, напроксен-натрий, напроксол, нимазон, олсалазин-натрий, орготеин, орпаноксин, оксандролан, оксапрозин, оксифенбутазон, оксиметолон, гидрохлорид параналина, полисульфат пентозан-натрия, глицерат фенбутазон-натрия, пирфенидон, пироксикам, циннамат пироксикама, пироксикам-оламин, пирпрофен, предназат, прифелон, продолиновая кислота, проквазон, проксазол, цитрат проксазола, римексолон, ромазарит, салколекс, салнацедин, салзалат, хлорид сангинариума, секлазон, серметацин, станозолол, судоксикам, сулиндак, супрофен, талметацин, талнифлумат, талозалат, тебуфелон, тенидап, тенидап-натрий, теноксикам, тезикам, тезимид, тестостерон, тестостероновая смесь, тетридамин, тиопинак, пивалат тиксокортола, толметин, толметин-натрий, триклонид, трифлумидат, зидометацин, зомепирак-натрий) или антигистаминных средств (например, этаноламины (типа дифенгидраминкарбоноксамина), этилендиамин (типа трипеленнаминпириламина), алкиламин (типа хлорфенирамина, дексхлорфенирамина, бромфенирамина, трипролидина) и другие антигистаминные препараты, такие как астемизол, лоратадин, фексофенадин, бромфенирамин, клемастин, ацетаминофен, псевдоэфедрин, трипролидин).
Указанные композиции могут вводиться местно, перорально или парентерально. Например, композиции могут вводиться экстракорпорально, интракраниально, интравагинально, интраанально, подкожно, внутрикожно, интракардиально, внутрижелудочно, внутривенно, внутримышечно, путем внутрибрюшинной инъекции, трансдермально, интраназально или путем ингаляции. В контексте настоящего описания термин «интракраниальное введение» обозначает прямую доставку веществ в мозг, включая, например, интратекальную, интрецистеральную, внутрижелудочковую или транс-сфеноидальную доставку с помощью катетера или иглы.
Парентеральное введение композиции, в случае его использования, в основном проводится путем инъекции. Инъецируемее средства могут быть изготовлены в виде традиционных форм, имеющих вид либо жидких растворов, либо суспензий, а также твердых форм, приемлемых для получения раствора или суспензий в жидкости непосредственно перед инъекцией, или в виде эмульсии. В недавно разработанной новой стратегии парентерального введения используется система замедленного высвобождения или пролонгированного высвобождения веществ, так что поддерживается постоянная дозировка. См., например, патент США №3610795, который включен в настоящее описание в качестве ссылки.
В контексте настоящего описание термин «местное интраназальное введение» обозначает доставку композиции в нос и носовые пути через одну или обе ноздри и может включать доставку с использованием распыляющего устройства или путем капельного введения, или с помощью аэрозольных форм нуклеиновой кислоты или вектора. Введение композиции ингаляцией может быть осуществлено через нос или рот путем распыления или капельного нанесения. Доставка может также осуществляться на любую область дыхательной системы (например, в легкие) путем интубации.
Точное количество необходимых композиций будет варьировать от индивидуума к индивидууму и зависит от вида, возраста, веса, общего состояния здоровья индивидуума, тяжести аллергического расстройства, подлежащего лечению, конкретного вида используемых нуклеиновой кислоты или вектора, способа введения и т.п. Таким образом, невозможно определить точное количество для каждой композиции. Однако соответствующие количества могут быть определены специалистом в данной области с использованием лишь несложных стандартных экспериментов, приведенных в настоящем описании.
Вводимые материалы могут находиться в растворе или суспензии (например, включенные в состав микрочастиц, липосом или клеток). Они могут быть направлены на доставку к определенному типу клеток посредством антител, рецепторов или лигандов рецептора. Приведенные ниже ссылки описывают примеры использования методики доставки специфических белков в опухолевую ткань (Senter, et al., Bioconjugate Chem., 2: 447-451 (1991); Bagshawe, K. D., Br. J. Cancer, 60: 275-281 (1989); Bagshawe, et al., Br. J. Cancer, 58: 700-703, (1988); Senter, et al., Bioconjugate Chem., 4: 3-9 (1993); Battelli, et al., Cancer Immunol. Immunother., 35: 421-425, (1992); Pietersz and McKenzie, Immunolog. Reviews, 129: 57-80 (1992); и Roffler, et al., Biochem. Pharmacol, 42: 2062-2065 (1991)). Используются носители, такие как «stealth», и другие липосомы, конъюгированные с антителом (включая липидные средства доставки в клетки карциномы ободочной кишки), опосредованная рецептором доставка ДНК через специфические клеточные лиганды, лимфоцитарные средства доставки к опухолевой ткани и высокоспецифичные терапевтические ретровирусные системы доставки мышиных клеток глиомы in vivo. Приведенные ниже ссылки относятся к примерам использования данной технологии для целевой доставки специфических белков в опухолевую ткань (Hughes et al., Cancer Research, 49: 6214-6220 (1989); и Litzinger and Huang, Biochimica et Biophysica Acta, 1104: 179-187 (1992)). В основном, рецепторы вовлекаются в способах эндоцитоза, либо конститутивного, либо индуцированного лигандами. Указанные рецепторы собираются в кластер в покрытых клатрином впадинах, входят в клетку через везикулу, покрытую клатрином, проходят через окисленную эндосому, в которой рецепторы сортируются, и затем либо возвращаются в рецикл на клеточную поверхность и хранятся внутриклеточно, либо подвергаются деградации в лизосомах. Пути интернализации служат для достижения множества функций, таких как поглощение питательных компонентов, удаление активированных белков, выведение макромолекул, факультативное поступление вирусов и токсинов, диссоциация и деградация лиганда и регуляция на уровне рецептора. Многие рецепторы участвуют более чем в одном внутриклеточном пути, в зависимости от типа клетки, концентрации рецептора, типа лиганда, валентности лиганда и концентрации лиганда. Молекулярные клеточные механизмы опосредованного рецепторами эндоцитоза описаны в обзоре Брауна и Грина (Brown and Green, DNA and Cell Biology 10: 6, 399-409 (1991)).
Подходящие носители и их композиции описаны в руководстве Ремингтона (Remington: The Science and Practice of Pharmacy (19th ed.) ed. A.R. Gennaro, Mack Publishung Company, Easton, PA 1995). В типичном случае используют подходящее количество фармацевтически приемлемой соли в композиции, с тем, чтобы придать композиции изотоничность. Примеры фармацевтически приемлемого носителя включают, без ограничения, солевой раствор, раствор Рингера и раствор декстрозы. Величина pH раствора может составлять от примерно 5 до примерно 8, от примерно 7 до примерно 7,5. Другие носители включают препараты с пролонгированным высвобождением, такие как полупроницаемые матрицы твердых гидрофобных полимеров, содержащих антитело, где указанные матрицы могут иметь вид изделия определенной формы, например, могут представлять собой пленки, липосомы или микрочастицы. Для специалистов в данной области очевидно, что определенные носители могут быть более предпочтительными, что определяется, например, способом введения и концентрацией вводимой композиции.
Фармацевтические носители известны специалистам в данной области. Большая часть из них в типичном случае представляет собой стандартные носители для введения препаратов человеку, включающие растворы, такие как стерильная вода, солевой раствор и буферные растворы со значением рН в физиологическом диапазоне. Композиции могут вводиться внутримышечно или подкожно. Другие соединения также могут вводиться в соответствии со стандартными процедурами, используемыми специалистами в данной области.
Фармацевтические композиции могут, кроме выбранной молекулы, включать также носители, загустители, разбавители, буферы, консерванты, поверхностно-активные вещества и аналогичные агенты. Фармацевтические композиции могут включать один или несколько активных ингредиентов, таких как антимикробные средства, противовоспалительные средства, анестетики и т.п.
Фармацевтическая композиция может вводиться различными способами, в зависимости от того, какое введение желательно: местное или системное, и от зоны, подлежащей лечению. Введение может осуществляться местно (например, через глаза, вагинально, ректально, интраназально), перорально, путем ингаляции или парентерально, например, путем внутривенного прокапывания, подкожной, внутрибрюшинной или внутримышечной инъекцией.
Препараты для парентерального введения включают стерильные водные или неводные растворы, суспензии и эмульсии. Примеры неводных растворителей включают пропиленгликоль, полиэтиленгликоль, растительное масло, такое как оливковое масло, и инъецируемые сложные органические эфиры, такие как этилолеат. Водные носителя включают воду, спиртовые/водные растворы, эмульсии или суспензии, включая солевой раствор и забуференные среды. Парентеральные наполнители включают раствор хлорида натрия, раствор декстрозы Рингера, декстрозу и хлорид натрия, лактат-содержащий раствор Рингера или жирные масла. Носители для внутривенного введения включают жидкости и восполнители питательных компонентов, восполнители электролитных компонентов (такие как растворы на основе раствора декстрозы Рингера) и т.п. Могут также быть внесены консерванты и другие добавки, такие как, например, антимикробные агенты, антиоксиданты, хелатирующие агенты, инертные газы и т.п.
Композиции для местного введения включают мази, лосьоны, кремы, гели (например, гель полоксамера), капли, суппозитории, распыляемые препараты, жидкости и порошки. Могут быть необходимы или желательны традиционные фармацевтические носители, водные, порошковые или масляные основы, загустители и т.п. Описываемые композиции могут вводиться, например, в составе микроволокнистого продукта, полимера (например, коллагена), наносферы, аэрозоля, лосьона, крема, ткани, пластика, ткани, имеющей складчатую структуру, созданную по генно-инженерной технологии, матричного материала, таблетки, имплантируемого контейнера, порошка, масла, смолы, повязки на рану, шарика, микрошарика, шарика с замедленным высвобождением, капсулы, инъецируемых агентов, средств для внутривенного прокапывания, насосного устройства, силиконовых имплантатов или с помощью любых материалов, изготовленных методами биологический инженерии.
В одном аспекте предлагаемый фармацевтически приемлемый носитель представляет собой полоксамер. Полоксамеры, имеющие торговое название Pluronics®, представляют собой неионные поверхностно-активные вещества, которые образуют явные термообратимые гели в воде. Полоксамеры представляют собой три-блок-сополимеры полиэтиленоксида, полипропиленоксида и полиэтиленоксида (ПЭО-ППО-ПЭО). Две полиэтиленоксидных цепи являются гидрофильными, тогда как полипропиленовая цепь имеет гидрофобную природу. Указанные гидрофобные и гидрофильные характеристики оказывают свое воздействие, когда полимер вводят в водный раствор. ПЭО-ППО-ПЭО цепи принимают форму небольших цепочек, в которых гидрофобные центры объединяются с образованием мицелл. Мицеллы постепенно приобретают желирующие характеристики, поскольку они объединяются в группы с образованием твердых веществ (гелей), где вода присутствует лишь в незначительном количестве возле гидрофильных концов. При охлаждении мицелла становится жидкой и затвердевает при нагревании. Указанные свойства делают данный полимер полезным в фармацевтике при создании композиций, поскольку такая композиция может быть введена в шприц с возможностью точного отмеривания дозы в холодном состоянии. При нагревании до температуры тела (при нанесении на кожу) такая композиция затвердевает до нужной консистенции (особенно в случае объединения с соевым лецитином/изопропилпальмитатом) для облегчения втирания и адгезии. Pluronic® F127 (F127) широко используется, поскольку он может быть легко получен и, в этой связи, используется в такого рода фармацевтическом применении. F127 характеризуется соотношением ЭО:ПО:ЭО, равным 100:65:100, и весовым соотношением ПЭО:ППО, равным 2:1. Гель плуроника представляет собой водный раствор, который в типичном случае содержит 20-30% F127. Таким образом, предлагаемая композиция может вводиться в F127.
Композиции для перорального введения включают порошки или гранулы, суспензии или растворы в воде или в неводных средах, капсулы, пакетики или таблетки. Могут быть также желательны загустители, вкусовые вещества, разбавители, эмульгаторы, средства, способствующие диспергированию, или связующие вещества.
Некоторые композиции могут вводиться в виде фармацевтически приемлемой соли кислоты или основания, образуемой при реакции с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, хлорная кислота, азотная кислота, тиоциановая кислота, серная кислота и фосфорная кислота, и с органическими кислотами, такими как муравьиная кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, молочная кислота, пировиноградная кислота, щавелевая кислота, малоновая кислота, янтарная кислота, малеиновая кислота и фумаровая кислота, или в результате реакции с неорганическим основанием, таким как гидроксид натрия, гидроксид аммония, гидроксид калия, и органическими основаниями, такими как моно-, ди-, три-алкил- и ариламины и замещенные этаноламины.
Эффективные дозировки и режимы введения композиций могут быть определены эмпирически и выполнение таких определений доступно любому специалисту со средним уровнем знаний в данной области. Диапазон дозировок, подходящих для введения композиции, достаточно большой и определяется созданием желательного эффекта в отношении симптомов расстройства. Дозировка не должна быть слишком большой, с тем чтобы не вызвать неблагоприятных побочных реакций, таких как нежелательные перекрестные реакции, анафилактические реакции и т.п. В основном дозировка варьирует в зависимости от возраста пациента, состояния его здоровья, пола и тяжести заболевания, способа введения и от того, включены ли другие лекарственные препараты в курс лечения, и может быть определена любым специалистом со средним уровнем знаний в данной области. Дозировка может быть откорректирована лечащим врачом, в случае наличия каких-либо противопоказаний. Дозировка может варьировать и может вводиться однократно или в виде нескольких доз ежедневно, в течение одного или нескольких дней. Соответствующее руководство по подбору подходящих дозировок для конкретных классов фармацевтических продуктов можно найти в литературе. Диапазон дозировок в основном зависит от направления применения данной композиции, тяжести состояния пациента и способа введения композиции.
Например, при использовании в качестве лабораторного инструмента для исследований, композиции АСТ-пептида могут вводиться в таких низких дозах, как 0,01% (вес/объем). Дозировка может быть столь низкой, как 0,02% (вес/объем) и, возможно, столь высокой, как 2% (вес/объем), при местном нанесении на кожную рану. Значительно более высокие концентрации композиций, сами по себе или в сочетании с другими соединениями, могут использоваться в таких направлениях применения, как лечение рака/опухоли или в случае введения концентрированного болюса сразу после острого повреждения ткани. Таким образом, верхние границы предлагаемых полипептидов могут составлять 2-5% (вес/объем или объем/объем), в случае проведения первоначальной доставки болюсом, например, непосредственно в массу опухоли. Рекомендуемые верхние границы дозировки при парентеральном введении, например, при внутримышечном, интрацеребральном, интракардиальном и интраспинальном введении, могут состоять 1% (вес/объем или объем/объем), в зависимости от тяжести повреждения. Указанная верхняя граница дозировки может варьировать, в зависимости от композиции и определяется, например, тем, каким образом один или несколько указанных полипептидов объединяют с другими агентами, которые усиливают их действие или которые действуют в сочетании с указанными одним или несколькими полипептидами.
Для целей непрерывной доставки рассматриваемых полипептидов, например, в сочетании с внутривенным прокапыванием, верхние границы до 0,01 г/кг веса тела в течение курса лечения определяются лечащим врачом с учетом данных по улучшении состояния. В другом примере верхние границы концентрации предлагаемых нуклеиновых кислот при их местной доставке, например в рану на коже, составляют 5-10 мкг/см2 поверхности раны в зависимости, например, от того, как объединяют нуклеиновые кислоты с другими агентами, усиливающими их действие или действующими в сочетании с нуклеиновыми кислотами. При этом может осуществляться повторное введение с частотой, определяемой лечащим врачом на основании данных об улучшении состояния. В другом примере верхние границы концентрации предлагаемых нуклеиновых кислот, доставляемых в организм, например, путем внутримышечного, интрацеребрального, интракардиального и интраспинального введения, составляют 50-100 мкг/мл раствора. И также частота введения определяется лечащим врачом на основании данных об улучшении состояния.
Также раскрываются способы предварительной обработки соответствующей зоны предлагаемыми полипептидами перед хирургическим вмешательством. Концентрация полипептидов может составлять 10-200 мкМ в смеси с 10-30% гелем плуроника или с любым таким носителем, который способствует проникновению одного или нескольких пептидов в нужный сайт в течение периода времени, равного по меньшей мере 3-6 часов, до хирургического вмешательства. Такая предварительная обработка может улучшить последующее заживление после хирургии, включая сниженную воспалительную реакцию.
Вирусные векторы остаются широко используемыми экпериментальными инструментами, которые тем не менее демонстрируют значительный потенциал в плане их клинического применения. В этом случае следует соблюдать осторожность при расчете ожидаемых режимов дозировки для вирусных векторов, которые будут зависеть в основном от типа используемого вектора. Например, ретровирусные векторы эффективно инфицируют делящиеся клетки, такие как раковые клетки, путем интеркаляции в геном хозяйской клетки и непрерывной экспрессии кодируемых белков с неопределенными параметрами. Типичные дозировки ретровирусов на установленной модели животных составляют порядка 107-109 инфицирующих единиц на мл. И наоборот, аденовирусы наиболее эффективно действуют на постмитотические клетки, но клетки быстро устраняются иммунной системой хозяина, или вирус постепенно теряется, если инфицированные клетки вновь продолжают пролиферацию и впоследствии разбавляют эписомальную ДНК вируса. Фактически, такой временный курс инфекции может использоваться для кратковременной доставки композиции согласно настоящему изобретению в ряде клинических ситуаций, например, для облегчения состояния при небольшом повреждении. На экспериментальных моделях животных используют в типичном случае концентрации 108-1011 инфицирующих единиц на мл аденовируса. Диапазон дозировок вируса, определяемый на основании данных, полученных на моделях животных, должен быть тщательно изучен с целью их возможной адаптации в клинических учреждениях при разработке одной или нескольких фармацевтически приемлемых композиций.
Два местных нанесения АСТ-композиции в концентрациях 0,02% (вес/объем): где одна наносится в острой фазе, а вторая наносится через 24 часа, оказываются достаточными для снижения воспаления, ускорения заживления, снижения рубцевания, повышения прочности на разрыв и усиления регенерации ткани. При этом в клинических учреждениях рекомендуется повышенная частота введения, до 3 введений в день местно в концентрации до 5%, до достижения существенного улучшения, определяемого лечащим врачом. При введении внутрь организма, например, внутримышечно, внутривенно, интрацеребрально, интракардиально и интраспинально также рекомендуется повышенная частота введения, до 3 дозировок 1% (вес/объем или объем/объем) в день до достижения существенного улучшения, по оценке лечащего врача.
После введения описываемой композиции, такой как полипептид, для целей ускорения заживления раны, эффективность терапевтической композиции может быть оценена различными способами, известными специалистам в данной области. Например, для специалиста в данной области очевидно, что композиция, такая как полипептид согласно настоящему изобретению, будет считаться эффективной с точки зрения ускорения заживления раны у индивидуума, если данная композиция снижает рубцевание, снижает образование фиброзной ткани, улучшает регенерацию ткани или снижает воспаление у индивидуума после повреждения ткани. Способы измерения данных критериев известны специалистам в данной области и обсуждаются в настоящем описании.
В изобретении также предлагаются материалы, включающие описанные композиции (например, полипептиды, нуклеиновые кислоты или векторы). Например, предлагается материал, используемый для лечения ран, где указанные материалы покрывают АСТ-полипептидом. Неограничивающие примеры материалов, используемых для лечения ран, включают бандажи, стерильные полоски, кетгуты, сшивки, или трансплантаты (например, трансплантаты кожи).
Например, указанный материалы (в частности, бандаж, стерильная полоска, кетгут, сшивка, трансплантат) может быть погружен в данный полипептид с концентрацией от 10 до 200 мкМ. Далее материал может быть высушен и запечатан в стерильном контейнере. Материал может быть также погружен в жидкость, содержащую 10-30% геля плуроника при температуре 4°С, который содержит полипептид в концентрации 10-200 мкМ. Указанный материал затем может быть перенесен в комнату с температурой, которая примерно соответствует температуре полимеризации геля, при этом создается покрытие из геля, пропитанного полипептидом, окружающее материал, и далее указанный материал может быть введен в стерильный контейнер. Данный полипептид может быть также включен в систему сшитого гидрогеля, такого как поли(молочная-ко-гликолевая кислота) (PLGA) или полиуретан, который может быть изготовлен с получением соответствующих материалов для лечения ран (например, бандажа, стерильной полоски, кетгута, сшивки, трансплантата). Таким образом, предлагаются композитные гидрогель-пептидные материалы.
Описываются также медицинские имплантаты, которые покрывают данным полипептидом перед имплантацией индивидууму. Например, общей проблемой в таких направлениях имплантационной хирургии является образование сократимой капсулы вокруг имплантата в результате образования рубцовой ткани, которая ведет к нежелательному затвердеванию, сокращению и изменению формы интересующей ткани. Использование полипептида согласно настоящему изобретению в имплантатах или на имплантатах может снизить или предупредить такое изменение формы. Неограничивающие примеры медицинских имплантатов включают протезы конечности, имплантаты молочной железы, имплантаты полового члена, имплантаты яичек, искусственные глаза, имплантаты для лица, искусственнее суставы, протезы сердечного клапана, протезы сосудов, зубные протезы, лицевые протезы, скашивание дискового клапана, изолирование шарового клапана, ушные протезы, протезы носа, водители ритма, улитковые имплантаты и замещающие кожные имплантаты (например, свиной гетеротрансплантат/свиная кожа, BIOBRANE, культура кератиноцитов).
А. Способы
Ниже описывается способ ускорения заживления раны после повреждения ткани у индивидуума, включающий введение указанному индивидууму одной или нескольких композиций согласно настоящему изобретению (например, полипептидов, нуклеиновых кислот или векторов) в фармацевтически приемлемом носителе. Далее описывается способ лечения индивидуума с повреждением ткани, включающий введение указанному индивидууму одной или нескольких композиций согласно настоящему изобретению (например, полипептидов, нуклеиновых кислот или векторов) в фармацевтически приемлемом носителе.
Термины «ускорять», «ускорение» и «усиление» относятся к повышению активности, ответа, отзывчивости, выраженности состояния, заболевания или другого биологического параметра. Указанное явление может включать, без ограничения, инициацию активности, ответа, состояния или заболевания. Указанное явление может включать, например, 10% повышение активности, ответа, выраженности состояния или заболевания, в сравнении с нативным или контрольным уровнем. Таким образом, повышение может составлять 10, 20, 30, 40, 50, 60, 70, 80, 90, 100% или может описываться любым показателем повышения между указанными значениями, в сравнении с нативным или контрольным уровнями.
Под термином «лечить» или «лечение» понимают способ снижения эффектов заболевания или состояния. Лечение может также относиться к способу снижения причины заболевания или состояния, а не просто симптомов. Лечение может представлять собой снижение относительно нативных уровней и может представлять собой, без ограничения, полное устранение заболевания, состояния или симптомов заболевания или состояния. Например, описываемый способ ускорения заживления раны может рассматриваться как лечение, если отмечается 10% снижение одного или нескольких симптомов заболевания у индивидуума с данным заболеванием, при сравнении с нативными уровнями у того же индивидуума или у контрольных индивидуумов. Таким образом, снижение может составлять 10, 20, 30, 40, 50, 60, 70, 80, 90, 100% или может описываться любым показателем повышения между указанными значениями, в сравнении с нативным или контрольным уровнями.
Термин «индивидуум» в контексте настоящего описания относится, без ограничения, к животным, растениям, бактериям, вирусам, паразитам и любому другому организму или существу, которое содержит нуклеиновую кислоту. Индивидуум может представлять собой позвоночный индивидуум, более конкретно, млекопитающее (например, это может быть человек, лошадь, свинья, кролик, собака, овца, коза, примат, отличный от человека, корова, кошка, морская свинка или представитель грызунов), рыбы, птицы или пресмыкающееся или земноводное. Индивидуум может представлять собой беспозвоночное животное, например членистоногих (например, это могут быть насекомые и ракообразные). Данный термин не используется для обозначения конкретного возраста или пола. Таким образом, взрослый или новорожденный индивидуум, а также их плод, независимо от того, мужского или женского рода, охватывается данным термином. Пациентом может быть индивидуум, пораженный заболеванием или расстройством. Термин «пациент» включает человека и ветеринарных индивидуумов.
Предлагаемый способ может включать снижение образования рубцовой ткани у индивидуума после повреждения ткани. Термин «рубцовая ткань» обозначает фиброзную (фибротическую) соединительную ткань, которая образуется в месте повреждения или поражения заболеванием в любой ткани организма, в результате избыточной продукции коллагена и других белков соединительной ткани, которые действуют в направлении разрушения ткани. Рубцовая ткань может замещать поврежденную ткань и лежащие ниже мышцы, повреждая сердечную мышцу или поврежденные заболеванием зоны внутренних органов, таких как печень. Будучи плотной и толстой, она обычно более бледная, чем окружающая ткань, поскольку хуже снабжается кровью и, хотя структурно замещает разрушенную ткань, не может выполнять функции удаленной ткани. Она состоит в основном из коллагеновых волокон, которые часто ограничивают нормальную эластичность вовлеченной ткани. В этой связи, рубцовая ткань ограничивает диапазон мышечного движения или препятствует соответствующей циркуляции жидкости, поражая лимфатическую или кровеносную систему. Наличие глиальной рубцовой ткани после повреждения в мозге или позвоночнике представляет собой одну из основных проблем восстановления нейрональных функций после повреждения центральной нервной системы. Снижение образования рубцовой ткани может быть идентифицировано при оценке популяций клеточных типов в сайте повреждения. Например, снижение глиальной рубцовой ткани может быть оценено по увеличению соотношения нейронов к астроцитам. Снижение уровня образования рубцовой ткани может быть определено прямым измерением размера рубца, например, ширины или площади рубцовой ткани (Wilgus et al., 2003). Кроме того, может быть проведен гистологический анализ для оценки степени восстановления структурной сложности в пределах заживляемой ткани в сравнении с нормальной тканью.
Кроме использования в направлении снижения образования фиброзной ткани у индивидуума после повреждения ткани, описываемые композиции и способы могут также использоваться для лечений расстройств, ассоциированных с патологическим усилением образования фиброзной ткани у индивидуума, например, в случае псориаза, кожного и системного мастоцитоза, астмы, экземы, синусита, атеросклероза, ревматоидного артрита, воспалительной болезни кишечника, рассеянного склероза, легочного фиброза и кистозного фиброза. Снижение образования фиброзной ткани у индивидуума может быть определено по клиническим показателям лечащим врачом при оценке успешности воссоздания нормальной структуры и функции рассматриваемой ткани и/или органа у индивидуума после лечения. В качестве примера можно отметить, что в случае псориаза лечащий врач оценивает кожу у индивидуума для определения, имеется ли снижение числа пятен выступающей красной кожи, покрытой белыми чешуйками. Некоторые виды псориаза характеризуются наличием узелков (пустулярный псориаз) или выглядят как обожженные участки (эритодермный вариант). В таких случаях лечащий врач оценивает, привело ли проводимое лечение к снижению указанных симптомов. В тех случаях, когда лечащий врач делает вывод, что для данного индивидуума отбор биопсии ткани или органа клинически доступен и/или необходим, или этот вывод относится к модели заболевания человека на животном, получают фрагменты ткани для биопсии и гистологическую структуру исследует специалист в области клинической патологии и/или опытный гистопатолог для определения, имеется ли снижение образования фиброзной ткани и восстановление нормальной структуры и функции ткани. Участок фиброза, замещающий нормальную ткань, также оценивают в количественных показателях при исследовании таких гистологических препаратов.
Предлагаемый способ также позволяет восстановить нормальные механический свойства ткани, такие как прочность на разрыв, после повреждения ткани у индивидуума. Термин «прочность на разрыв» относится к уровню стресса или натяжения, необходимого для разрыва ткани или раны.
Прочность на разрыв ран после проведения лечения может составлять 60, 65, 70, 75, 80, 85, 90, 95, 100% относительно неповрежденной ткани в первые 3 месяца после лечения. Таким образом, предлагается способ восстановления механических свойств ткани, в том числе повышения прочности на разрыв заживленной ткани, приближающейся или достигающей соответствующего уровня у нормальной неповрежденной ткани у индивидуума, включающий введение индивидууму одной или нескольких композиций согласно настоящему изобретению (например, полипептидов, нуклеиновых кислот или векторов) в фармацевтически приемлемом носителе.
Тип ран, для которых может быть важен показатель прочности на разрыв-растяжимость, включает повреждение скелетно-мышечных структур/тканей и кожи, покрывающей указанные структуры. Например, предлагаемые способы могут повышать прочность на разрыв соединяющих суставов, кости, хряща, сухожилий или связок. Предлагаемые способы могут также повышать прочность на разрыв кожи при повышенном уровне стресса/напряжения, например, в случае кожи, покрывающей локоть, колено или ступню. Наиболее частые проблемы, ассоциированные с заживлением повреждения суставов, связаны с тем, что повышенное рубцевание на данных участках ведет к сокращению и нерастяжимости заживленного участка сустава. Это вызывает серьезные косметические и психологические последствия. Свойства данных пептидов позволяют модулировать и снижать образование такой рубцовой ткани, что сказывается на большей подвижности сустава.
Предлагаемый способ может повышать регенерацию ткани после повреждения ткани у индивидуума. Термин «регенерация» обозначает обновление, рост заново или восстановление организма или части тела, ткани или вещества после повреждения или в ходе нормального процесса, идущего в организме. В отличие от рубцевания, регенерация ткани приводит к восстановлению ткани до ее исходного структурного, функционального и физиологического состояния. В настоящем описании этот процесс обозначается термином «сложность». Восстановление может быть частичным или полным и составлять 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100% восстановления, или может описываться любым показателем восстановления между указанными значениями, в сравнении с нативным или контрольным уровнями. В качестве примера можно отметить, что при повреждении кожи регенерация ткани может вовлекать восстановление волосяных фолликул, гландулярных структур, кровеносных сосудов, мышц или жировой ткани. В случае повреждения мозга тканевая регенерация может вовлекать поддержание или восстановление нейронов. В качестве примера можно отметить, что в случае повреждения кожи улучшение регенерации ткани может быть оценено на основании показателя соотношения объемов фиброзной рубцовой ткани и нормальной регенерированной ткани. В качестве примера можно отметить, что подсчет может быть проведен на дискретных регенерирующих структурах, таких как регенерирующая кожа желез, при нормализации до объема пораженной зоны.
В одном аспекте регенерация ткани вовлекает рекрутмент и дифференцировку стволовых клеток для замещения поврежденных клеток. В контексте настоящего описания термин «стволовая клетка» обозначает недифференцированную клетку, выявляемую среди дифференцированных клеток в ткани и органе, или вводимую из внешнего источника, например, в случае эмбриональных стволовых клеток, стволовых клеток костного мозга взрослого организма, которая может обновляться сама и дифференцироваться с образованием множества специализированных клеточных типов ткани или органа. Основная роль стволовых клеток в живом организме состоит в поддержании и восстановлении тканей, в которых они находятся. Под дифференцировкой стволовых клеток понимают процесс, посредством которого неспециализированная клетка (то есть стволовая клетка) приобретает свойства специализированной клетки, такой как кожа, невральная клетка, клетка сердца, печени или мышечная клетка. В качестве примера можно отметить, что в случае повреждения кожи регенерация ткани может вовлекать дифференцировку стволовых клеток, присутствующих в эпителии, до образования волосяных фолликул (Alonso and Fuchs, 2003). В случае повреждения мозга тканевая регенерация может вовлекать дифференцировку стволовых клеток до нейронов. Предлагаемый способ может повышать степень дифференцировки стволовой клетки после повреждения ткани у индивидуума. Повышенная дифференцировка стволовых клеток может быть определена при проведении клинически доступного генетического или другого теста, связанного с маркированием эндогенных или пересаженных стволовых клеток и определением частоты дифференцировки и включения маркированных стволовых клеток в нормальные тканевые структуры. В качестве другого примера можно отметить, что некоторые структуры, такие как волосяные фолликулы, как это известно, регенерируют из эндогенных стволовых клеток после повреждения ткани. При этом подсчет волосяных фолликул, при нормализации до площади повреждения ткани, будет служить мерой количественной оценки дифференцировки стволовых клеток.
Предлагаемый способ может снижать воспаление у индивидуума. Термины «воспаление», «воспалительный ответ» или «иммунный ответ» обозначают реакцию живых тканей на повреждение или раздражение, характеризующуюся покраснением, нагреванием, набуханием, болью и потерей функции, возникающими в результате повышенного кровотока и притока иммунных клеток и секретов. Воспаление представляет собой реакцию организма на внедряющиеся инфицирующиеся микроорганизмы и приводит к повышению кровотока в поврежденную зону, высвобождению химических веществ, которые притягивают лейкоциты, повышению потока плазмы и поступления моноцитов (или астроцитов в случае мозга) для очистки от осколков клеток. Все, что стимулирует воспалительный ответ, можно описать термином «воспалительный». Таким образом, кроме снижения воспаления у индивидуума в ответ на повреждение ткани, предлагаемые композиции и способы могут также использоваться для лечения расстройств, ассоциированных с патологическим повышение уровня воспалительных клеток, включая, например, астму, экзему, синусит, атеросклероз, ревматоидный артрит, воспалительную болезнь кишечника, кожный и системный мастоцитоз, псориаз и рассеянный склероз. Лечение с использованием описываемого полипептида может также снижать зуд, например, в случае заживающих ран. В основном, зуд представляет собой результат высвобождения гистамина тучными клетками. Предлагаемый полипептид может снижать дегрануляцию тучных клеток и высвобождение гистамина. Таким образом, предлагаемый полипептид может использоваться для лечения состояний, вовлекающих высвобождение гистамина, которые включают, без ограничения, зуд, расчесывание, раздражение синусов, аллергический кашель, покраснение глаз, астму и экзему.
Снижение воспаления может быть идентифицировано путем оценки снижения плотности воспалительных клеток таких типов, как, например, моноциты и астроциты. Снижение воспаления может быть также определено как снижение плотности воспалительных клеток таких типов, как нейтрофилы, тучные клетки, базофилы и моноциты. Снижение воспаления может быть подсчитано путем определения in vivo активности нейтрофилов (Jones et al, 1994). Кроме того, для определения снижения воспаления могут быть использованы такие факторы, как частота дегрануляции тучных клеток или уровни гистамина или уровни реакционноспособных видов кислорода. Степень воспаления может быть определена при оценке уровня транскрипции некоторых генов по методу qRT-PCR, например, для таких генов, как интерферон-альфа, -бета или -гамма, фактор некроза опухолевой ткани-альфа, интерлейкин 1 бета, -2, -4, -5, -6, -8, -12, -18, -23, -27, CD4, CD28, CD80, CD86, MHCII и iNOS. Измерение уровней провоспалительных цитокинов тканей или в жидкостях организма у индивидуума, включая плазму, может использоваться для оценки снижения уровня воспаления. Следует отметить, что механизм действия АСТ-пептидов может представлять собой ингибирование миграции воспалительных клеток и/или ингибирование провоспалительных химических компонентов (гистидина, реакционноспособных видов кислорода) и провоспалительных цитокинов, таких как интерлейкин (IL-1, IL-6, IL-8) и фактор некроза опухолевой ткани (TNF).
Описываемый способ может использоваться для ингибирования пролиферации трансформированной клетки у индивидуума (см. фиг.2). Трансформированная клетка в контексте настоящего описания обозначает клетку неоплазмы, рака или опухоли, которая делится или репродуцируется аномально в ходе неконтролируемого роста. Таким образом, ингибирование пролиферации (то есть гиперплазии) указанной трансформированной клетки проводит к снижению роста и, вследствие этого, снижению злокачественного перерождения при раке. Репрезентативный, но не ограничивающий перечень видов рака, для лечения которых могут использоваться описанные композиции и способы, включают следующие виды: глиому, лимфому, В-клеточную лимфому, Т-клеточную лимфому, фунгоидную гранулему, болезнь Ходжкина, миелоидный лейкоз, рак мочевого пузыря, рак головного мозга, рак нервной системы, рак головы и шеи, мелкоклеточную карциному головы и шеи, рак почки, рак легкого, такой как мелкоклеточный рак легкого и не мелкоклеточный рак легкого, нейробластому, глиобластому, рак яичника, рак поджелудочной железы, рак предстательной железы, рак кожи, рак печени, меланому, мелкоклеточную карциному ротовой полости, горла, гортани и легкого, рак ободочной кишки, цервикальный рак, цервикальную карциному, рак молочной железы, эпителиальный рак, рак почки, рак мочеполового тракта, рак легкого, карциному пищевода, карциному головы и шеи, рак толстой кишки, виды гематопоэтического рака, рак яичка, рак ободочной и прямой кишки, рак простаты или рак поджелудочной железы. Таким образом, предлагаемые способы могут использоваться для лечения рака у индивидуума. Например, предлагаемый способ может использоваться для лечения глиомы у индивидуума.
Ингибирование пролиферации трансформированной клетки может быть определено с использованием множества маркеров пролиферации клеток и наборов, например, набора Ki67/MIB-1 для иммунологического окрашивания, меченого тритием тимидина или меченого бромдезоксиуридина, фракции S-фазы ДНК, экспрессии ядерного антигена пролиферирующей клетки, показателя времени потенциального удвоения, а также при проведении анализа белков, ассоциированных с нуклеолярным организующим участком (AgNORs). Поскольку пролиферативная активность опухоли зависит и от пропорции клеток, поступающих в цикл (фракция роста), и от скорости протекания клеточного цикла, истинная пролиферативная активность опухоли может быть определена по уравнению [PA=Ki67 или показатель MIB-1 × AgNORs] (Pich et al., 2004). В другом примере проводится оценка образцов биопсии опытным гистопатологом с использованием простых качественных и количественных митотических показателей для оценки пролиферации в популяциях трансформированных клеток.
Были разработаны различные модели с использованием мышей для исследования рака. Имеются специфические модели мышей для изучения конкретных видов рака. Например, к ним относятся: рак мочевого пузыря, цервикальный рак, рак эндометрия, рак желудочно-кишечного тракта, рак мочеполового тракта, рак головы и шеи, гематопоэтический рак, рак почки, рак легкого, рак молочной железы, меланома, миелома, рак нервной системы, рак ротовой полости, рак яичника, рак поджелудочной железы, рак предстательной железы, саркома, рак кожи. Указаны модели широко описаны и используются. Благоприятные эффекты полипептидов, нуклеиновых кислот или векторов согласно настоящему описанию могут быть исследованы на любой из указанных моделей. Например, модель мыши с раком кожи может легко использоваться для целей демонстрации. Рак может культивироваться на модели с ксенотрансплантатом растущей раковой ткани человека с использованием специфической, беспатогенной homo-инбредной мыши (nude) (Yoo, 2004). Полипептиды, нуклеиновые кислоты или векторы согласно настоящему описанию могут вводиться в местном режиме с использованием материалов, полученных методами генной инженерии, таких как полые волокнистые мембраны (Orlandini and Margaria, 1993; Ming Chu et al., 1998) и микроволокна, шарики с замедленным высвобождением, гиподермные иглы, вставляемые катетеры, которые могут вводиться локально в сайт ракового роста или могут вводиться системно для достижения своей мишени, например, путем внутривенной инфузии, внутримышечной или внутрибрюшинной инъекции. Данное лечение может проводиться само по себе или в сочетании с другими терапевтическими соединениями, например, в сочетании с химиотерапевтическими агентами.
Предлагаемый способ позволяет ингибировать метастазирование трансформированной клетки у индивидуума. Термин «метастазирование» обозначает перенос раковых клеток из исходного сайта в один или несколько сайтов по всему телу, обычно посредством кровеносных сосудов или лимфатических сосудов. Метастазы могут быть разрушены в результате серии явлений. Во-первых, миграция раковых клеток начинается с процесса, посредством которого опухолевые клетки покидают сайт первичного роста, зачастую проникая через базальную мембрану и двигаясь в направлении локальной сосудистой сетки. Интравазация представляет собой процесс, посредством которого раковая клетка поступает в сосудистую клетку и распределяется по отдаленным сайтам. Экстравазация относится к процессу выхода раковой клетки из сосудистой сетки. И наконец, пролиферация раковых клеток в удаленном сайте в заметной степени определяется доступностью локализованного ростового фактора, влиянием стромальных клеток и окружающей внеклеточной матрицы (так называемой «почвы»), а также зависит от доступности питательных компонентов и факторов, поставляемых образуемой сосудистой сеткой растущей опухоли. Таким образом, предлагаемые композиции и способы могут ингибировать матастазирование трансформированных клеток у индивидуума посредством ингибирования миграции (то есть метастазной миграции) указанной клетки. Опухолегенез представляет собой результат разбалансировки клеточного цикла, что ведет к неконтролируемой клеточной пролиферации. При этом отсутствует регуляция специфических клеточных процессов-механизмов, которые контролируют прогрессирование клеточного цикла и контрольные точки пресечения через интермитозные фазы. В норме указанные события являются высококонсервативными, в связи с существованием консервирующих механизмов и молекул, таких как гены клеточного цикла и их продукты. Ингибирование метастазной миграции может быть измерено по уровню таких генов клеточного цикла и их продуктов, как, например, циклины, циклин-зависимые киназы (Cdk), ингибиторы Cdk (CKI) и внеклеточные факторы (например, факторы роста). В настоящее время стали доступны поистине революционные методики, на основе использования лазерной цитометрии и коммерческого программного обеспечения, для изучения и количественной оценки процессов клеточного цикла и клеточного роста. Результаты определения фракции S-фазы, в том числе показателей плоидности, с использованием гистограмм и оценки таких показателей, как митотический индекс и показатель времени удвоения опухоли, обеспечивают получение адекватной информации для клинических специалистов, позволяющей оценить агрессивность опухоли.
В контексте настоящего описания повреждение ткани может стать результатом соскоба, пореза, рваной раны, раны при ударе, раны при сжатии, повреждение при растяжении, раны при укусе, разрыва в результате удара, пулевого ранения, повреждения при взрыве, прокола тела, колотой раны, ожога потоком воздуха, солнечного ожога, ожога химическими веществами, хирургической раны, хирургического вмешательства, медицинского вмешательства, реакции отторжения хозяйского организма после трансплантации клетки, ткани или органа, фармацевтического эффекта, фармацевтической побочной реакции, пролежня, радиационного повреждения, косметической раны на коже, повреждения внутреннего органа, болезненного процесса (например, астмы, рака), инфекции, инфекционного агента, процесса развития, процесса нагноения (например, акне), генетической аномалии, аномалии развития, токсина из окружающей среды, аллергена, повреждения скальпа, повреждения лица, повреждения челюсти, повреждения ног, повреждения пальца ноги, повреждения пальца руки, повреждения кости, повреждения полового органа, повреждения сустава, повреждения выделительного органа, повреждения глаза, повреждения роговицы, повреждения мышцы, повреждения жировой ткани, повреждения легкого, повреждения дыхательных путей, грыжи, повреждения ануса, наличия геморроидальных узлов, повреждения уха, повреждения сетчатки, повреждения кожи, повреждения брюшной полости, повреждения руки, повреждения ноги, спортивного повреждения, повреждения спины, повреждения при рождении, повреждения при преждевременных родах, токсического укуса, укуса, повреждения сухожилия, повреждения связки, повреждения сердца, повреждения сердечного клапана, повреждения сосудистой системы, повреждения хряща, повреждения лимфатической системы, краниоцеребральной травмы, смещения, прободения пищевода, свища, повреждения ногтя, наличия инородного тела, перелома, отморожения, повреждения руки, повреждения при тепловом стрессе, рваной раны, повреждения шеи, членовредительства, шока, травматического повреждения мягкой ткани, повреждения спинного мозга, повреждения позвоночника, растяжения, деформации при напряжении, повреждения сухожилия, повреждения связки, повреждения хряща, повреждения грудной клетки, повреждения зуба, травмы, повреждения нервной системы, старения, аневризмы, апоплексического удара, повреждения пищеварительного тракта, инфаркта или ишемического повреждения.
В. Способы получения композиций
Композиции согласно настоящему изобретению и композиции, необходимые для осуществления описанных способов, могут быть изготовлены с использованием любого способа, известного специалистам в данной области, применительно к конкретному реагенту или соединению, если особо не указано иное.
Например, описываемые нуклеиновые кислоты могут быть получены с использованием стандартных методов химического синтеза или могут быть получены с использованием энзиматических методов или любого другого известного способа. Такие методы могут варьировать от стандартного энзиматического расщепления с последующим выделением нуклеотидного фрагмента (см., например, Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd Edition (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989, Chapters 5, 6) до полностью синтетических методов, например, в рамках цианоэтилфосфорамидатного метода с использованием системы синтезатора ДНК Milligen или Beckman System 1 Plus DNA (например, с использованием автоматизированного синтезатора модели 8700 Milligen-Biosearch, Burlington, MA или ABI Model 380B). Методы синтеза, используемые для получения олигонуклеотидов, также описаны Ikuta et al., Ann. Rev. Biochem. 53: 323-356 (1984) (фосфотриэфирный и фосфит-триэфирный методы) и Narang et al., Methods Enzymol., 65: 610-620 (1980) (фосфотриэфирный метод). Молекулы нуклеиновых кислот для соответствующих белков могут быть получены с использованием известных методик, таких как, например, методы, описанные в работе Нильсена с соавт. (Nielsen et al., Bioconjug. Chem. 5: 3-7 (1994)).
Один метод получения описываемых полипептидов, таких как SEQ ID NO: 2, состоит в объединении двух или более пептидов или полипептидов в соответствии с методами белковой химии. Например, пептиды или полипептиды могут быть химически синтезированы с использованием доступного в настоящее время лабораторного оборудования по процедурам методов Fmoc (9-флуоренилметилоксикарбонил) или Boc (трет-бутилоксикарбонил) химии (Applied Biosystems, Inc., Foster City, CA). Любому специалисту в данной области понятно, что пептид или полипептид, например, соответствующий описываемым белкам, может быть синтезирован в рамках стандартных химических реакций. Например, пептид или полипептид может быть синтезирован и не выщеплен из соответствующей смолы, применяемой для синтеза, тогда как другой фрагмент пептида или белка может быть синтезирован и впоследствии выщеплен из смолы, и тем самым обнажается конечная группа, которая функционально блокирована на другом фрагменте. В рамках реакций конденсации пептидов, два указанных фрагмента могут быть ковалентно соединены через пептидную связь по карбоксильному концу или аминоконцу, соответственно, с образованием белка или его фрагмента (Грант GA (1992) Synthetic Peptides: A User guide. W.H. Freemen and Co., N.Y. (1992); Bodansky M. and Trost B., Ed. (1993) Principles of Peptide Synthesis, Springer-Verlag Inc., NY (указанные работы включены в настоящее описание в качестве ссылок, по меньшей мере, в части материала, касающегося пептидного синтеза). Альтернативно, пептид или полипептид синтезируют независимо in vivo, как приведено в настоящем описании. Будучи выделенными, указанные независимые пептиды или полипептиды могут быть соединены с образованием пептида или его фрагмента, с использованием аналогичных реакций пептидной конденсации.
Например, энзиматическое лигирование клонированных или синтезированных пептидных сегментов позволяет соединить относительно короткие пептидные фрагменты с получением более крупных пептидных фрагментов, полипептидов или целых белковых доменов (Abrahmsen L et al., Biochemistry, 30: 4151 (1991)). Альтернативно, может быть использовано нативное химическое лигирование синтетических пептидов для конструирования путем синтеза крупных пептидов и полипептидов из более коротких пептидных фрагментов. Данный метод представляет собой двустадийную химическую реакцию (Dawson et al., Synthesis of Proteins by Native Chemical Ligation. Science, 266: 776-779 (1994)). Первая стадия представляет собой селективную реакцию незащищенного синтетического пептид-триэфира с другим незащищенным пептидным фрагментом, содержащим аминоконцевой Cys-остаток, с образованием промежуточного продукта с тиоэфирной связью, в качестве первичного ковалентного продукта. Без изменения условий реакции, указанный промежуточный продукт подвергается спонтанной быстрой внутримолекулярной реакции с образованием нативной пептидной связи в сайте лигирования (Baggiolini M et al., (1992) FEBS Lett. 307: 97-101; Clark-Lewis I et al., J. Biol. Chem., 269: 16075 (1994); Clark-Lewis I et al., Biochemistry, 30: 3128 (1991); Rajarathnam K et al., Biochemistry 33: 6623-30 (1994)).
Альтернативно, незащищенные пептидные фрагменты подвергают химическому связыванию, при этом связь, образуемая между пептидными сегментами в результате химического лигирования, представляет собой не природную (не пептидную) связь (Schnolzer, M et al., Science, 256: 221 (1992)). Указанная методика была использована для синтеза аналогов белковых доменов, а также больших количеств относительно чистых белков с полной биологической активностью (deLisle Milton RC et al., Techniques in Protein Chemistry IV. Academic Press, New York, pp.257-267 (1992)).
Описываются способы получения соединений, а также промежуточных продуктов на пути создания композиций. Имеется множество методик, которые могут быть использованы для изготовления таких композиций, такие как методы химического синтеза и стандартные методы молекулярной биологии. Разумеется, что способы изготовления данных и других рассматриваемых композиций конкретно описываются. Описываются молекулы нуклеиновых кислот, получаемые в ходе процесса, включающего объединение в оперативном режиме нуклеиновой кислоты, кодирующей полипептид согласно настоящему описанию, и последовательности, контролирующей экспрессию нуклеиновой кислоты. Описываются клетки, получаемые путем трансформации клетки животного молекулами любой нуклеиновой кислотой согласно настоящему описанию. Описываются любые пептиды согласно настоящему изобретению, получаемые по способу экспрессии любой из описываемых нуклеиновых кислот. Описываются животные, которых получают с использованием способа трансфекции клетки животного молекулами любой нуклеиновой кислоты согласно настоящему описанию. Описываются животные, которых получают с использованием способа трансфекции клетки животного молекулами любой нуклеиновой кислоты согласно настоящему описанию, где указанное животное представляет собой млекопитающее. Также описываются животные, которых получают с использованием способа трансфекции клетки животного молекулами любой нуклеиновой кислоты согласно настоящему описанию, где указанное млекопитающее представляет собой мышь, крысу, кролика, корову, овцу, свинью или примата. Также описываются животные, которых получают по способу добавления к указанному животному любой из клеток, приведенных в настоящем описании.
С. Наборы
Описанные выше материалы, а также другие материалы могут быть упакованы вместе в любом подходящем сочетании в виде набора, используемого для проведения описываемого способа или в качестве вспомогательного средства для его проведения. Будет полезно, если компоненты набора в данном наборе будут разработаны и адаптированы для использования в рамках описанного способа. Например, описываются наборы для ускорения заживления раны, где указанный набор включает один или несколько полипептидов, нуклеиновых кислот или векторов согласно настоящему описанию в фармацевтически приемлемом носителе. Такие наборы могут включать гели, бандажи, ленты Millipore, пропитанные лекарственными препаратами Q-tips, распыляемые средства, капли, сиропы, жидкости, одноразовые пробирки или пакетики. Наборы могут также содержать инструкции с описанием соответствующего варианта их применения и информацию по безопасности относительно продукта или композиции. Наборы могут содержать информацию о дозировке, применительно к определенному направлению использования и способу введения, определяемому лечащим врачом.
D. Направления использования
Описываемые способы и композиции применимы к различным направлениям использования, включая, без ограничения, инструменты лабораторных исследований. Указанные композиции выполняют регуляторные роли в ряде клеточных процессов, например, в клеточной пролиферации и миграции клеток. Указанные композиции могут быть использованы в лабораторных модельных системах для исследования in vitro и in vivo различных клеточных процессов, регуляции клеточного цикла, клеточной реакции, ответов органов, клеток или тканей на исследуемые соединения и т.п. Композиции могут поставляться сами по себе или в сочетании с другими соединениями или как часть набора, такого как набор для оценки клеточной пролиферации. Данный набор может содержать композиции, указанные выше, сами по себе или в сочетании с другими соединениями. Такой набор будет включать инструкции, облегчающие проведение эксперимента. Описываются также другие варианты использования, очевидные из приведенного описания, и/или те, которые будут понятны специалистам в данной области.
Примеры
Пример 1: Повреждение царапиной in vitro
Миоциты из сердец новорожденных крыс растят до образования почти слившегося монослоя на чашке с культурой ткани, в соответствии со стандартными протоколами. Далее культуры выращивают в течение еще 5 дней в культуральной среде, содержащей 30 мкМ АСТ 1 пептида (SEQ ID NO: 2), 30 мкМ неактивного контрольного пептида (SEQ ID NO: 55) или фосфатно-буферного раствора (PBS), содержащего не АСТ-пептид, или контрольный пептид. Неактивный контрольный пептид включает полипептид с карбоксильным концом, в котором последовательность АСТ-пептида изменена на обратную. Оба амино-конца в АСТ и контрольном пептидах биотинилированы, что позволяет выявлять (например, в тесте) пептиды в клеточной цитоплазме с использованием стандартных методов микроскопии или биохимических методов на основе высокоафинного связывания стрептавидина с биотином.
Культуральные среды с добавленными пептидами или контрольным носителем меняют каждые 24 часа в ходе эксперимента. На фиг.1а показано, что АСТ-пептид в значительной мере повышает уровень образования затягивающей зоны в бреши Cx43 между миоцитами, относительно контрольных условий (фиг.1b и 1с). Как показано на фиг.4, данное повышение образования затягивающей зоны в бреши Cx43 в ответ на АСТ-пептид свойственно множеству клеточных типов, экспрессирующих Cx43.
Клетки NIH-3T3 растят в течение 2-3 дней до образования почти сливающегося монослоя на чашке для культуры тканей, в соответствии со стандартными протоколами, и затем монослой подвергают предварительной обработке ACT-пептидом (SEQ ID NO: 2) в течение 24 часов, после чего кончиком пипетки p200 наносят «повреждение царапиной». Указанное «повреждение царапиной» затем оставляют для размножения в течение 24 часов в присутствии 30 мкМ ACT 1 пептида (SEQ ID NO: 2), растворенного в культуральной среде (фиг.2а, b), или в присутствии двух контрольных вариантов (фиг.2с-f). В первом варианте контрольных условий клетки с нанесенной «царапиной» оставляют для размножения в течение 24 часов в присутствии неактивного контрольного пептида (как показано на фиг.1), в виде раствора в культуральной среде с концентрацией 30 мкМ (фиг.2с, d). Во втором варианте контрольных условий к культуральной среде добавляют фосфатно-буферный раствор (PBS) и клетки, «поврежденные царапиной», оставляют для заселения зоны в присутствии указанного контрольного раствора носителя, содержащего не АСТ-пептид, или контрольный пептид (фиг.2e, f). «Повреждение царапиной» в клетках, обработанных АСТ-пептидом, остается относительно не заселенным по прошествии 24 часов (фиг.2a), и лишь несколько клеток (на чертеже показаны крупными стрелками) заселяют зону внутри исходных краев «повреждения царапиной» (то есть в пределах зоны, маркированной маленькими черными стрелками на чертеже). И наоборот, в контрольных условиях (фиг.2с, e) большое число клеток (крупные стрелки) заселили зону внутри исходного «повреждения царапиной». Заселение указанной зоны «повреждения царапиной» происходит частично за счет миграции трансформированных клеток, продвигающихся в зону «повреждения царапиной». На чертеже (фиг.2b, d и f) показан результат иммунологического мечения клеток ядерным антигеном пролиферирующих клеток (PCNA) в такой зоне «повреждения царапиной» или по краям повреждения. Клетки, обработанные АСТ-пептидом (фиг.2b), демонстрируют лишь низкую люминесценцию, соответствующую фоновому значению и отсутствию пролиферации. Только в двух контрольных условиях, показанных на чертежах (фиг.2d, f), отмечаются ярко меченые пролиферирующие клетки (белые стрелки). Это указывает на то, что АСТ-пептид также снизил пролиферацию трансформированных клеток на данной экспериментальной клеточной модели.
На фиг.3а показан край повреждения клеток, обработанных АСТ-пептидом, и контрольных клеток, обработанных неактивным пептидом, в конце 24-часового периода. Клетки метят флуоресцентным фаллоидином для визуализации. Клетки, обработанные АСТ-пептидом, демонстрируют низкий уровень заселения клетками зоны «повреждения царапиной» (белые двойные стрелки). На фиг.3b показана диаграмма, демонстрирующая % зоны «повреждения царапиной», заселенной клетками через 24 часа. Снижение числа клеток в зоне повреждения в присутствии АСТ-пептида является резким, со значением p меньше, чем 0,000001.
Клетки WB-F344 представляют собой трансформированную линию эпителиальных клеток крысы, полученную путем обработки выделенных клеток печени крысы агентом, вызывающим рак (Tsao et al., 1984; Hayashi et al., 1997; Hayashi et al., 1998; Hayashi et al., 2001). Клетки WB-F34 трансфицируют конструкцией плазмиды экспрессии кДНК и проводят селекцию с антибиотиком при использовании стандартных процедур получения клеточных линий, которые стабильно экспрессируют полинуклеотид, кодирующий АСТ-пептид (SEQ ID NO: 6), функционально связанный с промоторной последовательностью, или полинуклеотид, кодирующий зеленый флуоресцентный белок (GFP), функционально связанный с промоторной последовательностью, в качестве контроля. Полинуклеотид, кодирующий АСТ-пептид, также кодирует GFP. Экспрессию АСТ-пептида можно оценить по стандартной методике на основе флуоресценции GFP под световым микроскопом. На фиг.4a, b показано изображение при высоком увеличении флуоресценции GFP в клеточных линиях WB-F344, экспрессирующих только GFP (фиг.4а) или GFP плюс карбокси-концевую последовательность АСТ-пептида (фиг.4а) или один GFP (фиг.4b). Почти сливающиеся монослои клеточной линии WB-F344 «повреждают царапиной» и оставляют для размножения на 24 часа. Аналогично контрольным вариантам клеток NIH-3T3, которые обрабатывали носителем или неактивным контрольным пептидом, контрольная линия эпителиальных клеток, экспрессирующая GFP, заселяет зону «повреждения царапиной» (фиг.4с). Однако в линии эпителиальных клеток, которые стабильно экспрессируют полинуклеотид, кодирующий АСТ-пептид, функционально связанный с промоторной последовательностью, наблюдается ингибирование заселения зоны «повреждения царапиной» (фиг.4d). В дополнение к клеточным линиям WB-F344 были получены клеточные линии NIH-3T3 клеток, которые стабильно экспрессируют полинуклеотид, кодирующий ACT-пептид, функционально связанный с промотором.
Пример 2: Заживление раны in vivo
Новорожденных мышей десенсибилизируют с использованием гипотермии. Скальпелем наносят повреждение в виде длинного разреза в 4 мм по всей толщине кожи (вниз на уровень нижележащей мышцы) по средней линии спины между лопатками. Затем в разрез вносят 30 мкл раствора 20% геля плуроника (F-127), либо не содержащего (контроль), либо содержащего растворенный ACT 1 пептид (SEQ ID NO: 2) в концентрации 60 мкМ. Гель плуроника обладает мягкими поверхностно-активными свойствами, которые могут способствовать равномерному распределению ACT-пептида в мицеллах. Более важно то, что 20% гель плуроника остается жидким при температурах ниже 15°С, но полимеризуется при температуре тела (37°С). Указанные свойства геля плуроника, по всей видимости, способствуют контролируемому высвобождению пептида в ткань в сайте «повреждения царапиной», защищая пептид от разрушения окружением раны, обогащенным протеазами, и также способствует поддержанию активных концентраций пептида в течение длительного периода времени. Гель, содержащий контрольный пептид или АСТ-пептид, наносят на 24 часа после нанесения разреза. После второго нанесения не вносят ни контрольный гель, ни гель, содержащий АСТ-пептид. К 48 часам видно, что повреждение, обработанное ACT-пептидом (фиг.5а), значительно больше затягивается, меньше набухает (видны выступы на краю раны) и в основном выглядит как более заживленное, чем контрольное повреждение, в которое не вносили ACT-пептид (фиг.5b). Указанные различия в воспалении, набухании и заживлении между повреждением, обработанным контрольным пептидом и АСТ-пептидом, а также между контрольным повреждением держатся в точке 72 часа (фиг.5с, d) и 96 часов (фиг.5e, f). К 7 дню рана, обработанная ACT-пептидом (фиг.5g), имеет более ровный и менее бугристый вид, чем повреждение, обработанное контрольным пептидом (фиг.5h). Следует отметить, что приведены изображения одного и то же повреждения у одного и того же животного в разные временные точки в ходе периода заживления.
Взрослым мышам под анестезией делают круговое повреждение путем иссечения ткани шириной 8 мм тонкими хирургическими ножницами вниз, к нижележащей мышце, по средней линии спины между лопатками (фиг.6a, b). Края повреждения маркируют пластиковой полосой шириной 8 мм. В повреждение путем иссечения ткани вносят 100 мкл раствора 30% геля плуроника, либо не содержащего (контроль), либо содержащего растворенный АСТ 1 пептид (SEQ ID NO: 2) в концентрации 100 мкМ. Гель, содержащий контрольный пептид или АСТ-пептид, наносят на 24 часа после исходного нанесения. После второго нанесения больше не наносят ни гель с контрольным пептидом, ни гель, содержащий ACT-пептид. Крупное повреждение путем иссечения ткани, обработанное ACT-пептидом (фиг.6a, c, e, g, i), затягивается быстрее, менее воспалено по виду, быстрее заживляется и меньше рубцуется, чем контрольное повреждение, в которое не вносили ACT-пептид (фиг.6b, d, f, h, j), в течение 14-дневного периода лечения. Фактически, контрольное повреждение к 14 дню демонстрирует частичное отслоение, указывая на то, что острое заживление повреждения было не полным (фиг.6j).
Отбирают биопсию кожи из всего места повреждения через 24 часа после нанесения повреждения путем иссечения ткани. Указанные образцы кожи фиксируют в 2% параформальдегиде, погружают в парафин, делают срезы и окрашивают гистохимически гематоксилином и эозином (H&E) по стандартным процедурам. На фиг.7a и 7b приведены изображения при низком увеличении срезов, взятых радом с центром раны, обработанной ACT-пептидом, и контрольной раны, соответственно. Край раны (маркированный маленькими стрелками) граничит с кожей нормального гистологического вида, как видно в обоих случаях. Черный прямоугольник помещен над изображением на фиг.7a и 7b в левой части края раны. Гистологические структуры внутри черного прямоугольника, помещенного над левой частью краев повреждения на фиг.7a и 7b, показаны при большем увеличении на фиг.7с и 7d для тканей, обработанных ACT-пептидом, и после контрольной обработки, соответственно. Представляет интерес «воротникообразная» ткань фиброзного материала (указанного стрелками), простирающегося от базальных частей повреждения в направлении к краю раны и к наружной поверхности повреждения. Фиброзный материал служит в качестве субстрата для миграции воспалительных клеток, движущихся к поверхности повреждения (Elder et al., 1997). Интересно отметить, что рассматриваемый фиброзный субстрат имеет вид значительно более организованный в контрольном повреждении (фиг.7d), чем в повреждении, обработанном ACT-пептидом (фиг.7с). Кроме того, отмечается значительно сниженная плотность воспалительных клеток, заполняющих фиброзный субстрат в ткани, обработанной ACT-пептидом. Этот результат подтверждается на фиг.7f и 7e, где участки гистологического среза внутри черных прямоугольников, приведенные на чертежах (фиг.7d и фиг.7с), показаны при большем увеличении, соответственно. Воспалительные клетки, заполняющие фиброзный субстрат, включают тучные клетки, нейтрофилы и макрофаги. Указанные воспалительные клетки встречаются со значительно большей плотностью в контрольном повреждении, чем в повреждении, обработанном ACT-пептидом.
К концу 14-дневного периода отбирают биопсийные образцы кожи и всей зоны повреждения путем иссечения ткани, и гистологические срезы из образцов кожи окрашивают для гистохимического анализа H&E. На фиг.8a и 8b показаны при низком увеличении изображения поперечных срезов, взятых из области рядом с центром повреждения, обработанного ACT-пептидом и контролем, соответственно. В обоих случаях отмечается край раны (маркированный небольшими стрелками), граничащий с кожей нормального гистологического вида. Черный прямоугольник помещен над изображениями на фиг.8а и 8b около центра каждого повреждения. Гистологические структуры внутри каждого из указанных двух прямоугольников показаны при более высоком увеличении на фиг.8c и 8d для тканей, обработанных ACT-пептидом и контролем, соответственно. Видно, что ткань из места повреждения, обработанного ACT-пептидом, выглядит как структурно значительно более сложная. На наружной поверхности раны, обработанной ACT-пептидом, отмечается непрерывный слой эпителиальных клеток, указывающий на полную реэпителизацию поврежденной поверхности, хотя эпителий все еще относительно тонкий возле центра раны (фиг.8с). Необычно то, что регенерирующие волосяные фолликулы уже отмечаются в состоянии дифференцировки de novo из стволовых клеток в новом эпителии, покрывающем заживленное повреждение (фиг.8с, малые стрелки). И для сравнения, в эпителии контрольного повреждения отмечается неполная реэпителизация поверхности повреждения, без признаков регенерации волосяных фолликул. Под реформированным эпителием поврежденной кожи, обработанной ACT-пептидом, отмечается существенное восстановление нормальной структурной сложности, с наличием гландулярных структур, фиброзной и соединительной ткани, сосудистой ткани, мышечных и жировых клеток (фиг.8а, с). Как и в случае волосяных фолликул, сложность указанной ткани восстанавливается через дифференцировку стволовых клеток. И наоборот, в ткани раны в контрольном повреждении отмечается полное доминирование однородной и крупной массы фиброзной ткани рубца (фиг.8b, d), тогда как другие признаки сложности тканевой структуры не отмечаются в пределах рубцовой ткани.
Взрослым мышам под анестезией наносят две (диаметром 5 мм) раны путем иссечения кожи мелкими хирургическими ножницами на шеи (в верхней части) и спине. Границы повреждений отмечают круговой полосой пластика шириной 5 мм. В повреждение вносят 50-60 мкл раствора 30% геля плуроника, либо не содержащего (контроль), либо содержащего один из ACT-пептидов (АСТ 2 - SEQ ID NO: 1; АСТ 1 - SEQ ID NO: 2; АСТ 3 - SEQ ID NO: 3; АСТ 4 - SEQ ID NO: 4; АСТ 5 - SEQ ID NO: 5), растворенный в концентрации 100 мкМ. Гели, содержащие контрольный или АСТ-пептид, вносят через 24 часа после исходного нанесения. После второго нанесения не добавляют гель ни с контролем, ни ACT-пептидом. В случае АСТ 1 (фиг.9e-h), ACT (фиг.9i-l), ACT 3 (фиг.9m-p) и ACT 5 (фиг.9u-x) пептидов видно, что повреждения путем иссечения ткани затягиваются быстрее, менее воспалены по виду, заживают быстрее и в меньшей степени рубцуются, чем контрольное повреждение, на которое не наносили АСТ-пептид (фиг.9a-d), в течение 240-часового периода (10 дней). ACT 4 пептид (фиг.9q-t) демонстрирует, по всей видимости, небольшое улучшение в заживлении в сравнении с контролем в ходе периода наблюдения. Следует отметить, что показана одна и та же рана, на одном и том же животном в разные временные точки в ходе периода заживления.
Площадь открытой раны измеряют в ходе периода исследования с использованием стандартных процедур на множестве взрослых мышей (примерно по 5 мышей для контроля и экспериментальных условий). Указанные отдельные результаты измерения площади далее нормализуют (например, путем деления) до средней площади, измеряемой в контрольных повреждениях в данной временной точке, умножают на 100 с получением процента незакрытых ран относительно контроля и затем строят график зависимости от времени. Используют U-тест Манна-Уитни для статистической оценки эффектов ACT-пептидов в течение времени. Пептиды АСТ 1, АСТ 2, АСТ 3 и АСТ 5 существенно улучшали скорость затягивания ран после повреждения путем иссечения ткани. Указанные варианты лечения давали результаты с наиболее значимыми показателями p. АСТ 1 и АСТ 3 демонстрировали количественно наиболее выраженное улучшение в сравнении с контролем. Более слабое, хотя неизменное улучшение наблюдалось также для АТС 4 пептида, при его сравнении с контролем.
Взрослых крыс под анестезией помещают в стереотаксический аппарат. Делают срединный разрез по скальпу для обнажения черепа. Стереотаксическое сверло располагают в 2 мм назад от брегмы и сверлят два отверстия сферической формы по 1 мм каждое, на расстоянии 2,5 мм вправо и влево от брегмы и на расстоянии 3,5 мм ниже мозговой оболочки. Делают церебральное повреждение, вставляя иглу 18 размера. Координаты определяют по атласу Паксиноса и Уотсона (Paxinos and Watson (1986)). В отверстие вставляют полую волокнистую мембрану (HFM) и накладывают внешние кожные швы, покрывающие прокол. ACT-пептид растворяют в концентрации 100 мкМ в 2% растворе носителя-коллагена, содержавшемся внутри HFM. Исследование выделенных HFM указывает на то, что данная биоинженерная конструкция способна замедлять высвобождение выявляемых уровней ACT-пептида (по данным теста на основе реакции биотин-стрептавидин) в водных растворах в течение периода времени, равного по меньшей мере 7 дней. Реактивный астроцитоз, ассоциированный с воспалением и последующим образованием глиального рубца, следует известному временному режиму, характерному для модели грызунов после повреждения мозга (Norenberg, 1994; Fawcett and Asher, 1999). В типичном случае астроцитарный ответ в мозге крыс достигает пика через неделю, в сочетании с потерей нейронов и других аспектов сложности мозговой ткани. Впоследствии, с появлением глиальной рубцовой ткани плотность GFAP-позитивных астроцитов снижается. На фиг.10b и 10c при низком увеличении показаны изображения срезов из тканей мозга (коры), окружающие HFM имплантаты, заполненные ACT-пептидом плюс гель-носитель или контрольным гелем с коллагеновым носителем, или АСТ-пептидом плюс гель-носитель, через неделю после проникающего повреждения мозга. В контрольной ткани (фиг.10с) наблюдается высокая плотность иммунологически меченых GFAP-позитивных астроцитов возле сайта повреждения, вызванного HFM. Плотность указанных клеток, по всей видимости, несколько снижается при удалении в стороны от повреждения. И наоборот, наблюдается значительно меньшая плотность GFAP-позитивных астроцитов рядом с HFM, заполненной ACT-пептидом (фиг.10b). Фактически, уровни GFAP-позитивных клеток не отличаются от значений, наблюдаемых в нормальной неповрежденной ткани мозга. Участки ткани внутри белых прямоугольников на фиг.10b и 10c показаны при большем увеличении на фиг.10d и 10e, соответственно. В повреждении мозга, обработанном ACT-пептидом (фиг.10d), можно видеть, что GFAP-позитивные астроциты не только менее многочислены, но также меньше по размеру, чем астроциты, отмечаемые в контрольном повреждении (фиг.10e).
На фиг.11а и 11b показаны при низком увеличении изображения срезов ткани мозга (коры), окружающей HFM имплантаты (имплантат или граница повреждения показаны стрелками), заполненные контрольным гелем коллагенового носителя (фиг.11b) или ACT-пептидом плюс гель-носитель (фиг.11а) через 1 неделю после проникающего повреждения мозга. В контрольной ткани (фиг.11b) отмечается высокая плотность иммунологически меченых GFAP-позитивных астроцитов и низкая плотность иммунологически меченых по NeuN нейронов возле сайта повреждения, вызванного HFM. Плотность указанных клеток, как видно, снижается и повышается дистально от HFM, соответственно. И наоборот, отмечается значительно меньшая плотность GFAP-позитивных астроцитов и большее число иммунологически меченых по NeuN нейронов проксимально (а также дистально) к HFM, заполненной ACT-пептидом (фиг.11а). Участки из фиг.11а и 11b, расположенные проксимально к HFM, показаны при высоком увеличении на 11c и 11d, соответственно. И снова, в контрольной ткани (фиг.11d) отмечается сильное повышение плотности GFAP-позитивных астроцитов и сниженная плотность NeuN-позитивных нейронов, в сравнении с тканью, обработанной ACT-пептидом (фиг.11с). Комплементарная картина наблюдается возле HFM, содержащей ACT-пептид, где NeuN-позитивные нейроны доминируют надо астроцитами (фиг.11с). Интересно отметить, что приведенное при высоком увеличении изображение на фиг.11d демонстрирует высокую частоту делящихся нейронов относительно контроля (фиг.11с). Это позволяет полагать, что высокая плотность нейронов, ассоциированная с лечением ACT-пептидом, может быть результатом образования новых нейронов. ACT-пептид также может частично повышать плотность нейронов за счет спаривания нейронов из погибших клеток после повреждения мозга.
Пример 3: Лечение острого повреждения спинного мозга
Индивидуумы с острым повреждением спинного мозга представляют собой очень сложную проблемную группу, в случае которых даже небольшое восстановление неврологическое функции может оказать большое влияние на последующее развитие процесса. В одном примере индивидууму с острым повреждением спинного мозга проводят инфузию болюсом 0,02%-0,1% раствора ACT-пептида (например, SEQ ID NO: 1) в течение 15 минут в ходе 8-часового периода непосредственно в сайт острого повреждения спинного мозга и затем через 45 минут инфузию 0,01% раствора ACT-пептида в течение последующих 23-48 часов. В другом примере ACT-пептид используют для нанесения покрытия на наночастицы с медленным высвобождением, вводимые в течение 8 часов непосредственно в сайт острого повреждения спинного мозга или в ткань со складчатой структурой, созданной биоинженерными методами, с тем чтобы ускорить образование новых невральных связей в зоне острого повреждения спинного мозга. Наличие улучшения функции оценивает лечащий врач в определенные интервалы времени (например, через 6, 12, 16 и 52 недели) после начала лечения, по результатам неврологического тестирования, включающего оценку моторной активности, кожной чувствительности на укол и восстановления тактильных ощущений.
Пример 4: Количественная оценка затягивания раны, регенерации ткани и прочности на разрыв в ранах с иссечением кожи
По описанной выше методике взрослым мышам наносят рану иссечением кожи диаметром 5 мм и делят на две группы: группу введения ACT-пептида (n=12) и контрольную группу (n=8). Количественные оценки скорости затягивания раны, числа регенерированных волосяных фолликул и измерения прочности на разрыв проводят на пораженной коже в определенных временных точках до 90 дней после исходного повреждения. В сравнении с контрольными ранами, затягивание существенно повышается в течение 24 часов после пептидной обработки. Аналогично, к 10 дням, когда большая часть ран практически полностью затягивается, сохраняется высоко значимое различие, а именно: раны, обработанные ACT-пептидом, становятся в среднем на 43% меньше по размерам, чем контрольные раны. К 10 дням раны, обработанные ACT-пептидом, демонстрируют значительное, в 3,2 раза повышение числа регенерированных волосяных фолликул на единицу площади заживленной раны относительно контрольных ран.
Проводят исследование механических свойств заживленных ран, полученных иссечением кожи диаметром 5 мм через 1 месяц и 3 месяца после повреждения. Для определения механических свойств отбирают образцы кожи у умерщвленного животного и оценивают показатели с использованием системы MTS 858 Mini Bionix (MTS Systems Corporation, MN, USA), снабженный клеткой весом 5 кг. В ходе измерения образец кожи растягивают до момента разрыва со скоростью 0,5 мм/сек. Силу и растяжение измеряют при разрыве. Прочность на разрыв (стресс) и растяжение до разрыва (деформация при напряжении) оценивают следующим образом: Прочность на разрыв (N/мм2) = сила при разрыве (N)/площадь поперечного сечения образца (мм2). Деформация при напряжении (%) = [повышение длины при разрыве (мм)/исходная длина (мм)] × 100. Расчеты прочности на разрыв и деформации при напряжении для каждого пораженного образца кожи нормализуют до нормального образца кожи из близлежащей зоны, отобранного у того же животного.
Через 1 месяц усилие (то есть нормализованная сила), необходимое для разрыва пораженной кожи, аналогично таковому значению для контрольной пораженной кожи. К 3 месяцу нормализованное усилие для разрыва пораженной кожи, обработанной пептидом, в среднем превышает в два раза соответствующее значение для контрольной пораженной кожи, хотя высокие вариации в экспериментальной группе не позволяют значимо отделить среднее значение от контроля. Полученный результат показывает, что раны, обработанные пептидом, имеют такую же или большую прочность на разрыв, что и необработанные раны. Кроме того, выявлено существенное повышение растяжимости ран, обработанных пептидом. Величина деформации (то есть растяжимость), требуемая для разрыва ран, обработанных пептидом, несколько повышена в сравнении с контрольными ранами через 1 месяц. К 3 месяцу раны, обработанные пептидом, демонстрируют более выраженное повышение, примерно до 90% относительно нормальной не поврежденной кожи. Тогда как контрольные раны к 3 месяцу демонстрируют лишь 60% уровень растяжимости относительно нормальной кожи.
Пример 5. Эффективность ниэкомолекулярных пептидов с карбоксиконцевой последовательностью альфа-коннексина
1. Для проверки эффективности различных пептидов с карбоксиконцевой последовательностью альфа-коннексина (ACT) в для ускорения заживления после повреждения тканей, на модели раны у мышей, вызванной разрезом кожи, использованы три различных пептида (ACT 1, ACT 7 и ACT 9). Последовательности каждого пептида ACT соответствовали:
ACT 1: RPRPDDLEI (9 карбокси-концевых аминокислот Сх43; идентичны SEQ ID NO;2, раскрытой в описании)
ACT 7: PRPDDLEI (8 карбокси-концевых аминокислот Сх43)
ACT 9: RQPKIWFPNRRKPWKKDDLEI (последовательность Antennapedia (SEQ ID NO: 7, раскрыта в описании), слитая на аминоконце пептида, содержащего 5 карбокси-концевых аминокислот Сх43).
Взрослым мышам под наркозом производили разрез кожи размером 5 мм в диаметре с помощью хирургических ножниц в области спины до основных мышц по дорзальной линии между лопатками. Решение. Раствор (60 мкл) 30% плюрониевого геля, не содержащего (контроль), либо содержащего один из трех пептидов (ACT 1, ACT 7 или ACT 9), растворенных в количестве 60 мкМ, наносили на рану. Рану визуально оценивали на 1, 4, 7 и 10 день и анализировали различные параметры заживления раны, в том числе покраснение, размер раны и общий вид. Мышей забивали на 10-й день, и брали пробы тканей. В каждой из четырех исследуемых групп было восемь мышей.
Макроскопическая визуализация ран в лечебных группах была оценена «вслепую» по балльной системе оценки раны, в которой два независимых наблюдателя визуально оценивали раны, полученные разрезом кожи, на покраснение и отек. Каждая рана была оценена по 0-5 баллам каждым наблюдателем. Окончательный результат для каждой раны усредняли по данным двух наблюдателей. Меньший балл при оценке покраснения, соответствующий уменьшению, предполагало начальный уровень воспаления. Для оценка общего вида/рубца, раны оценивали на степень обесцвечивания и гладкость. Больший балл был присвоен ране с максимальной относительной степенью обесцвечивания и повышенной гладкостью. Гистограммы, показанные на фигуре 1, изображают средний балл покраснения и внешнего вида раны, обработанной пептидом, и контролем на модели раны у мышей на 1, 4 и 7 день. Звездочки обозначают значение р<0,05 для плюрониевого геля контрольной группы по оценки теста Манна-Уитни. Закрытие раны оценивали количественно по фотографии. Область измерения каждой раны на фото определяли с помощью программного обеспечения ImageJ. Эти измерения были сделаны лицами, имеющими информацию о том, какая из групп является группой, получавшей лечение. На фигуре 10 показана средняя область раны в случае обработки пептидом и контролем в 1, 4 и 7 день. Звездочки указывают значение р<0,05 для плюрониевого геля контрольной группы по оценке критерия Стьюдента.
4. Как показано на фиг.9, раны, обработанные пептидом ACT, демонстрировали меньшее покраснение и улучшенный внешний вид по сравнению с ранами, обработанными только плюрониевым гелем. На фиг.10 показано, что раны, обработанные ACT пептидом, в среднем закрываются быстрее, чем раны, обработанные только плюрониевым гелем, на что указывают меньшие области раны в группах, обработанных пептидом. Результаты этого анализа показывают, что низкомолекулярные пептиды с карбоксиконцевой последовательностью альфа-коннексина, способствуют заживлению после повреждения тканей.
Следует понимать, что описанные способы и композиции приведены не с целью ограничения изобретения конкретной методологией, процедурами и реагентами, которые могут варьировать. Следует также понимать, что используемая терминология дана для целей описания только конкретных вариантов и никоим образом не ограничивает область настоящего изобретения, которое ограничено лишь прилагаемой формулой изобретения.
Следует отметить, что форма единственного числа, используемая в тексте и в прилагаемой формуле изобретения, включает также множественные варианты, если из контекста явно не следует иное. Так, например, ссылка на полипептид означает множество таких полипептидов, ссылка на конкретный полипептид является ссылкой на один или несколько полипептидов и их эквивалентов, известных специалистам в данной области, и т.п.
Термины «необязательный» или «необязательно» означают, что описанные далее событие, условие или материал могут или не могут иметь место или присутствовать, и что описание включает случаи, когда явление, условие или материал имеет место или присутствует, и случаи, когда они не имеют места или не присутствуют.
Диапазоны могут быть выражены с использованием термина «примерно» для одного конкретного значения и/или «примерно» другого конкретного значения. Когда имеет место такой диапазон, также конкретно включается и рассматривается весь диапазон от одного конкретного значения и/или до другого конкретного значения, если из контекста явно не следует иное. Аналогично, когда показатели выражают в виде приблизительных значений, используя для этого определение «примерно», следует понимать, что данное конкретное значение формирует другой, конкретно рассматриваемый вариант, и он также считается включенным, если из контекста явно не следует иное. Следует также понимать, что конечные точки каждого из таких диапазонов значимы как в отношении другой конечной точки, так и независимо от другой конечной точки, если из контекста явно не следует иное. И наконец, следует понимать, что все индивидуальные значения и поддиапазоны значений, содержащихся внутри явно указанного диапазона, также конкретно включаются и следует их рассматривать включенными в него, если из контекста явно не следует иное. Приведенное выше справедливо, независимо от того, описаны ли в конкретных случаях в очевидной форме некоторые или все из указанных вариантов.
Если особо не указано иное, все технические и научные термины, используемые в данном описании, имеют общепринятые значения, известные специалистам в данной области, к которой относятся приведенный метод и композиции. Несмотря на то, что любые способы и материалы, аналогичные или эквивалентные приведенным в настоящем описании, могут использоваться в практике осуществления способов или композиций согласно настоящему изобретения или тестирования в соответствии с ними, были описаны особенно полезные способы, устройства и материалы. Цитированные публикации и материал, к которым они относятся, включены в качестве ссылок. Ничто из приведенного в настоящем описании не следует рассматривать, как допущение того, что настоящее изобретение не предшествует такому подходу, как более раннее изобретение. Ни одно из сделанных допущений не является ссылкой на достигнутый уровень техники. Обсуждение ссылок указывает только на то, что авторам известно, и заявители сохраняют за собой право оспаривать точность и уместность цитированных документов. Следует также явно понимать, что хотя множество публикаций приведено в качестве ссылок, каждую такую ссылку не следует рассматривать как констатацию того, что любой из указанных документов составляет часть общего основного знания, имеющегося в данной области.
Приведенное в тексте всего описания и формулы изобретения слово «включает» и его вариации, такие как «включающие» и другие, означает «включающий, но не ограничивающийся» и не исключает, например, другие добавки, компоненты, целые числа или стадии.
Специалисты в данной области понимают или способны на основе не более чем рутинных экспериментов, убедиться, что существует множество эквивалентов конкретных вариантов осуществления способов и композиций, приведенных в настоящем описании. Такие эквиваленты охватываются прилагаемой формулой изобретения.
Е. Список цитируемой литературы




Последовательности
SEQ ID NO:1 (ACT 2)

SEQ ID NO:2 (ACT 1)

SEQ ID NO:3 (ACT 3)

SEQ ID NO:4 (ACT 4)

SEQ ID NO:5 (ACT 5)
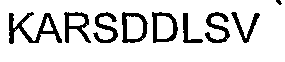
SEQ ID NO:6

SEQ ID NO:7 (Antp)

SEQ ID NO:8 (Antp/ACT 2)

SEQ ID NO:9 (Antp/ACT1)

SEQ ID NO:10 (Antp/ACT 3)
SEQ ID NO:11 (Antp/ACT 4)

SEQ ID NO:12 (Antp/ACT 5)

SEQ ID NO:13 (кодурует полипептид SEQ ID NO: 9)
SEQ ID NO:14 (HIV-Tat)

SEQ ID NO:15 (Penetratin)

SEQ ID NO:16 (Antp-3A)

SEQ ID NO:17 (Tat)

SEQ ID NO:18 (Buforin II)

SEQ ID NO:19 (Transportan)
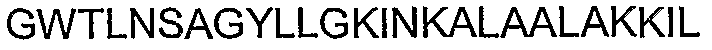
SEQ ID NO:20 (модельный амфипатический пептид)

SEQ ID NO:21 (K-FGF)

SEQ ID NO:22 (Ku70)
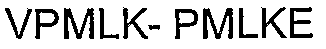
SEQ ID NO:23 (Prion)

SEQ ID NO:24 (pVEC)

SEQ ID NO:25(Pep-1)

SEQ ID NO:26 (SynB1)

SEQ ID NO:27 (Pep-7)

SEQIDNO:28 (HN-1)
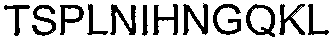
SEQ ID NO:29 (Куриный альфа Cx43 ACT)

SEQ ID NO:30 (Человеческий альфа Cx45)

SEQ ID NO:31 (Куриный альфа Cx45)

SEQ ID NO: 32 (Человеческий альфа Cx46)

SEQ ID NO: 33 (Человеческий альфа Cx46.6)

SEQ ID NO:34 (Альфа Cx36 шимпанзе)

SEQ ID NO:35 (Куриный альфа Cx36)

SEQ ID NO:36 (Человеческий альфа Cx47)

SEQ ID NO:37 (Человеческий альфа Cx40)

SEQ ID NO:38 (Человеческий альфа Cx50)

SEQ ID NO:39 (Человеческий альфа Cx59)

SEQ ID NO:40 (Альфа Cx33 крысы)
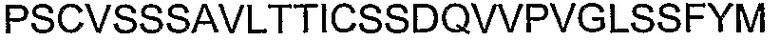
SEQ ID NO:41 (Альфа Cx44 овцы)
SEQ ID NO:42 (Человеческий бета Cx26)

SEQ ID: 43 (Человеческий альфа Cx37)

SEQ ID 44: (Консервативный вариант Сх43)

SEQ ID 45: (Консервативный вариант Сх43)
SEQ ID 46: (Консервативный вариант Сх43)

SEQ ID 47: (Консервативный вариант Сх43)

SEQ ID 48: (Консервативный вариант Сх43)

SEQ ID 49: (Консервативный вариант Сх43)

SEQ ID 50: (Консервативный вариант Сх43)

SEQ ID 51: (Консервативный вариант Сх43)

SEQ ID 52: (Консервативный вариант Сх45)

SEQ ID 53: (Консервативный вариант Сх45)

SEQ ID 54: (Консервативный вариант Сх37)

SEQ ID NO: 55 (Неактивный контрольный пептид)

SEQ ID NO:56 (HIV-Tat/ACT 1)

SEQ ID NO:57 (Penetratin/ACT 1)

SEQ ID NO:58 (Antp-3A/ACT 1)

SEQ ID NO:59 (Tat/ACT 1)

SEQ ID NO:60 (Buforin II/ACT 1)

SEQ ID NO:61 (Transportan/ACT 1)

SEQ ID NO:62 (MAP/ACT 1)

SEQ ID NO:63 (K-FGF/ACT 1)
SEQ ID NO:64 (Ku70/ACT 1)
SEQ ID NO:65(Prion/ACT 1)

SEQ ID NO:66 (pVEC/ACT 1)

SEQ ID NO:67 (Pep-1/ACT 1)
SEQ ID NO:68 (SynB1/ACT 1)

SEQ ID NO:69 (Pep-7/ACT 1)
SEQ ID NO:70 (HN-1/ACT 1)
SEQ ID NO: 72 (остатки 20-120, фланкирующие аминокислоту 363 в человеческом Сх43)

SEQ ID NO: 73 (остатки 20-120, фланкирующие аминокислоту 362 в курином Сх43)

SEQ ID NO: 74 (остатки 20-120, фланкирующие аминокислоту 377 в человеческом Сх45)

SEQ ID NO: 75 (остатки 20-120, фланкирующие аминокислоту 375 в курином Сх45)

SEQ ID NO: 76 (остатки 20-120, фланкирующие аминокислоту 313 в человеческом Сх37)

SEQ ID NO: 77 (остатки 20-120, фланкирующие аминокислоту 258 в Сх33 крысы)

SEQ ID NO: 78 (более активный зеленый флуоресцентный белок)

SEQ ID NO:79 (ACT 2)
SEQ ID NO:80 (ACT 1)

SEQ ID NO:81 (ACT 3)

SEQ ID NO:82 (ACT 4)

SEQ ID NO:83 (ACT 5)


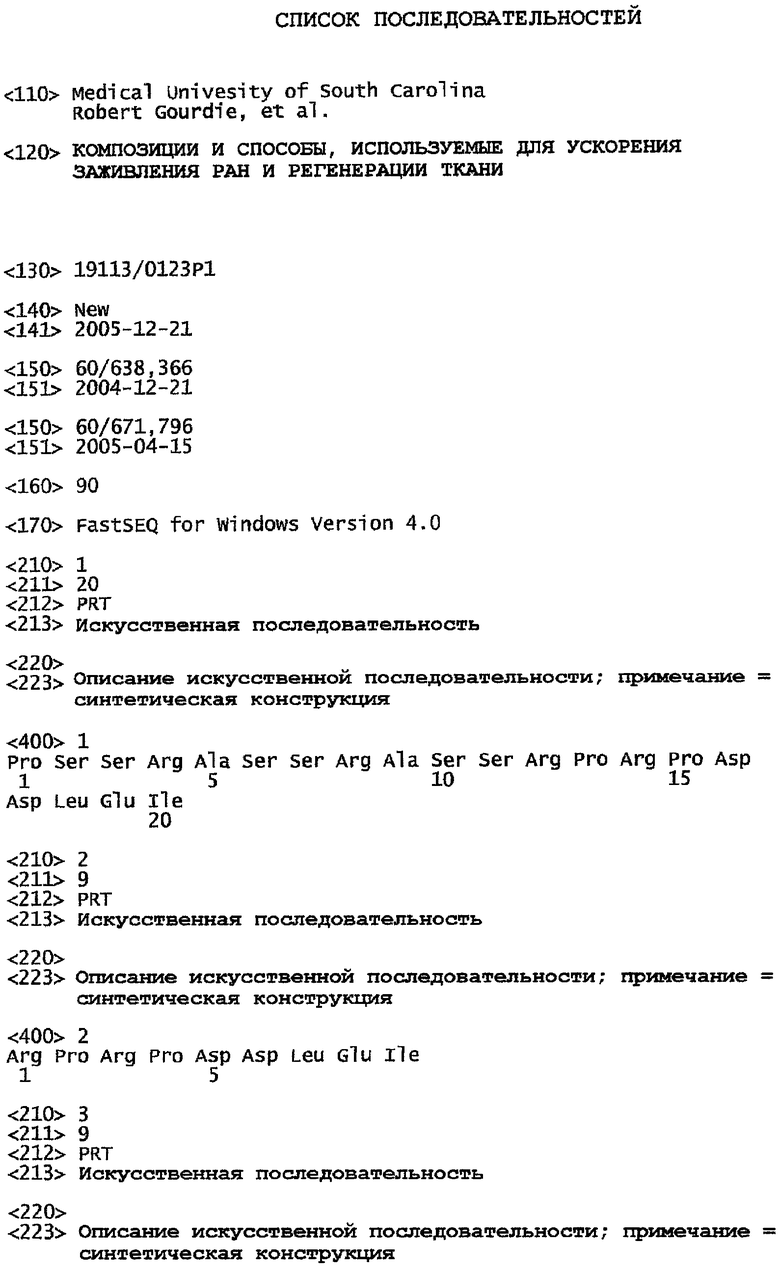






















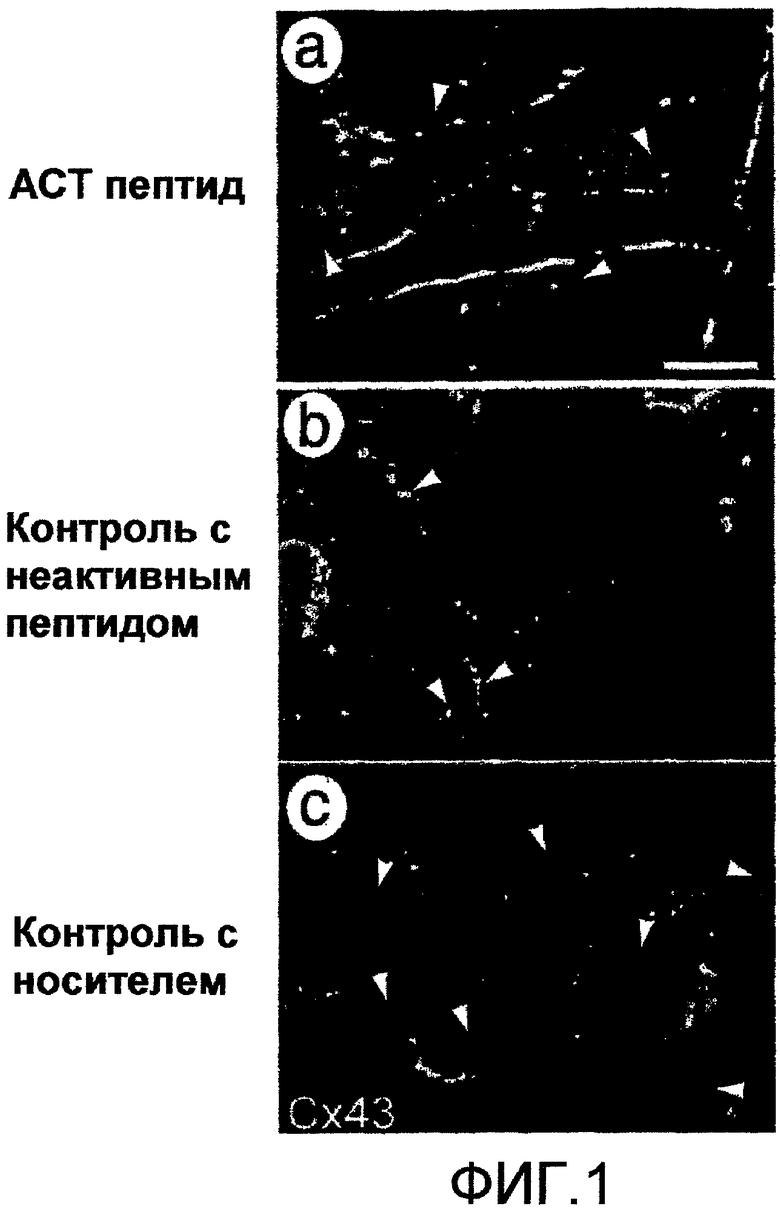
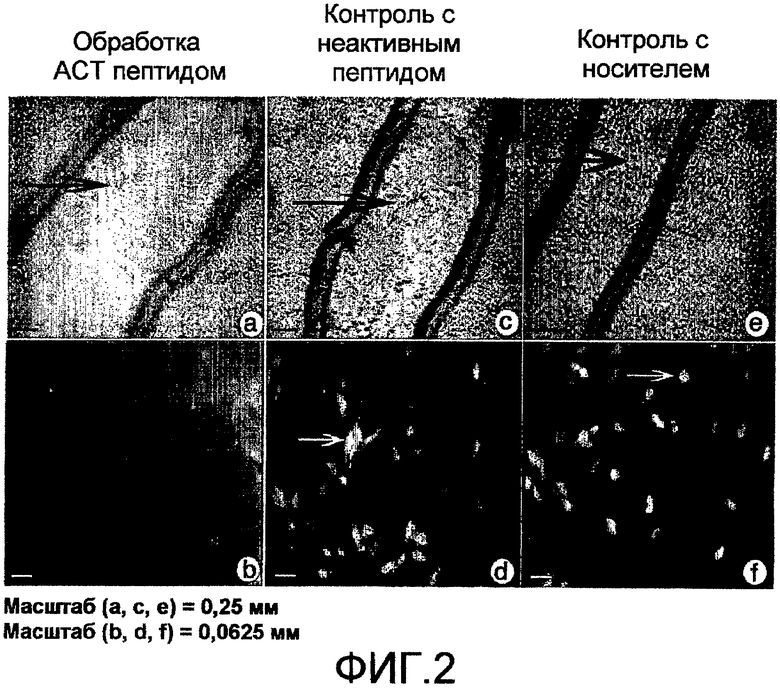
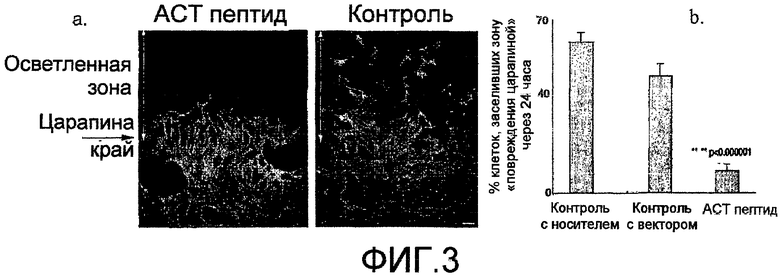
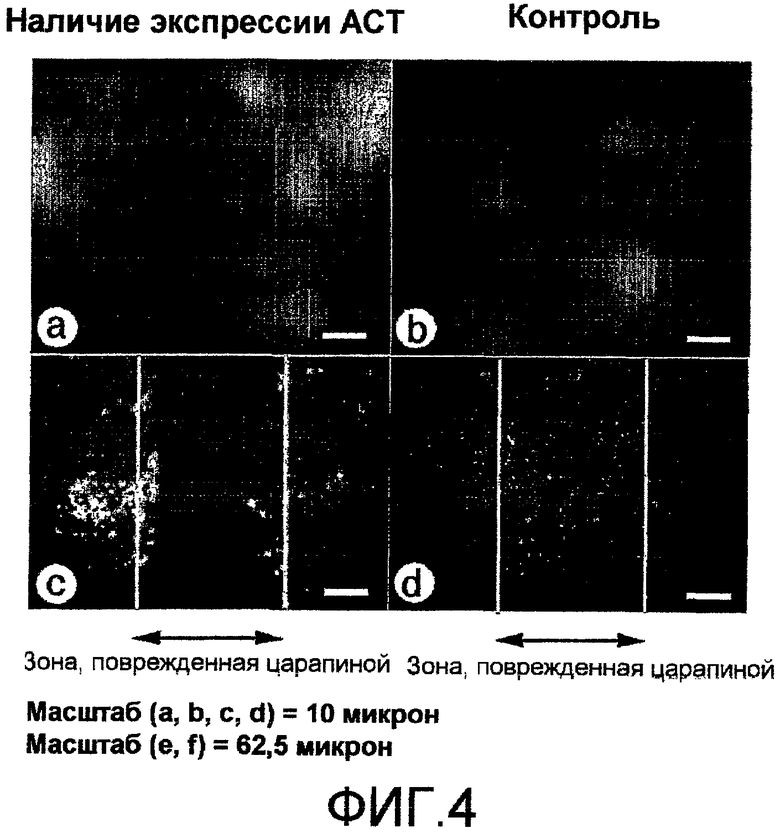
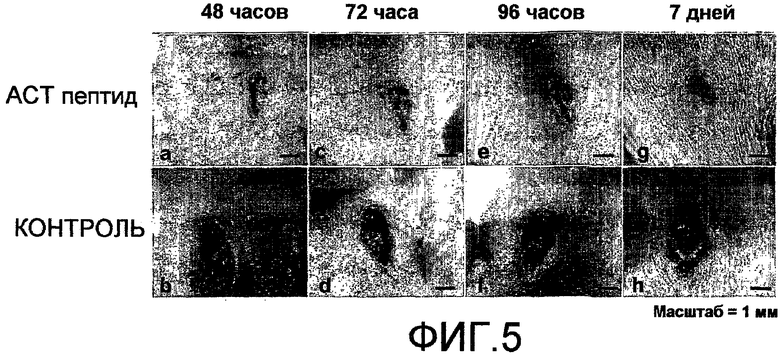
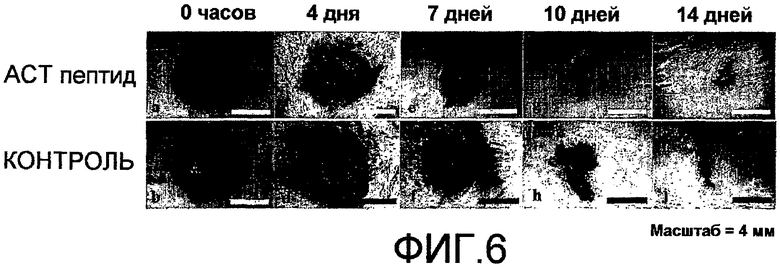
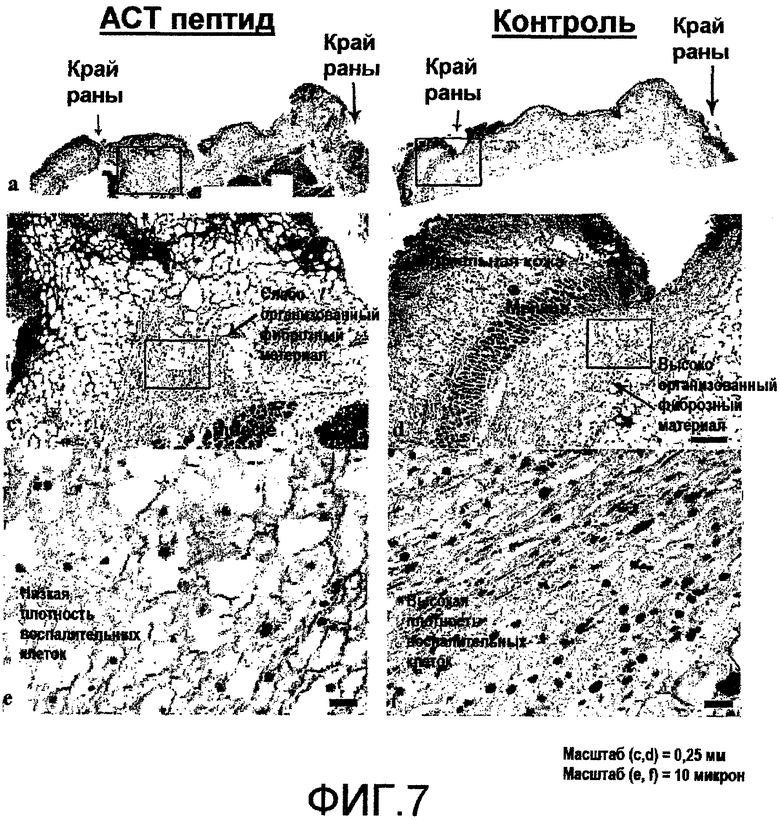
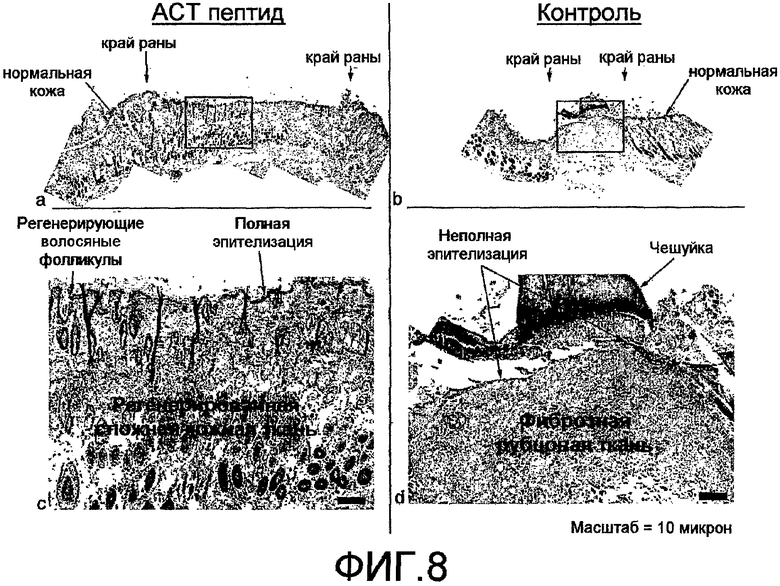
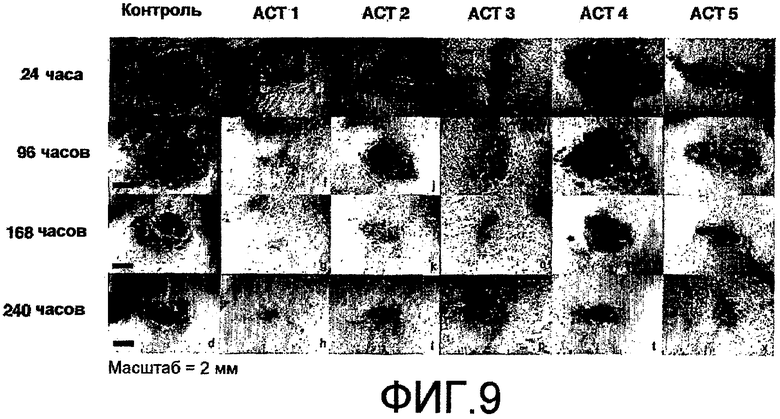
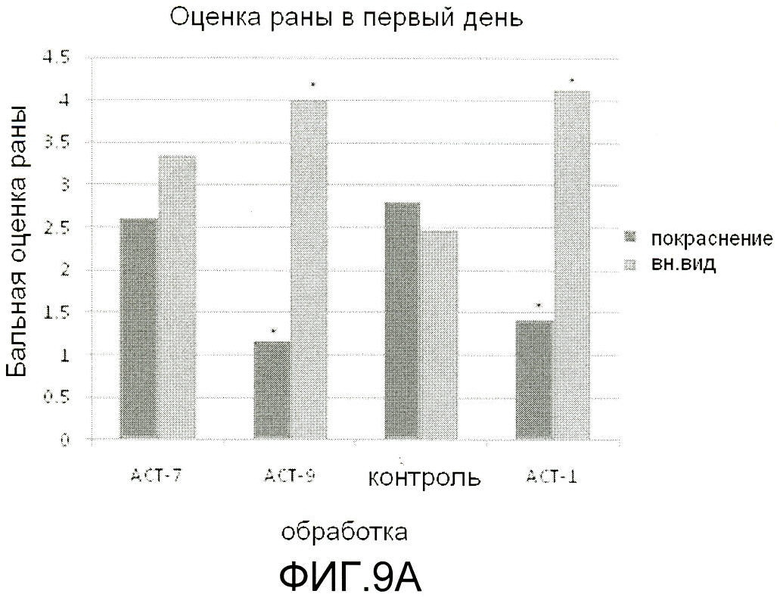
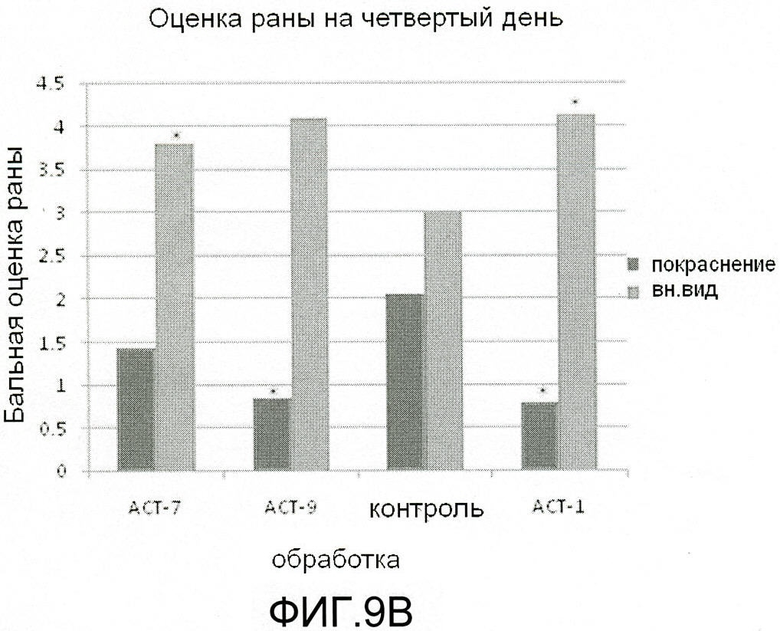
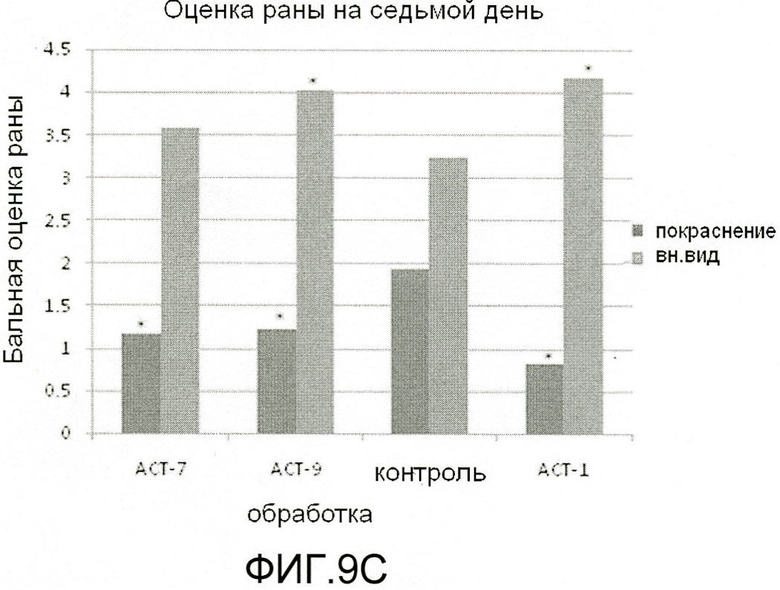
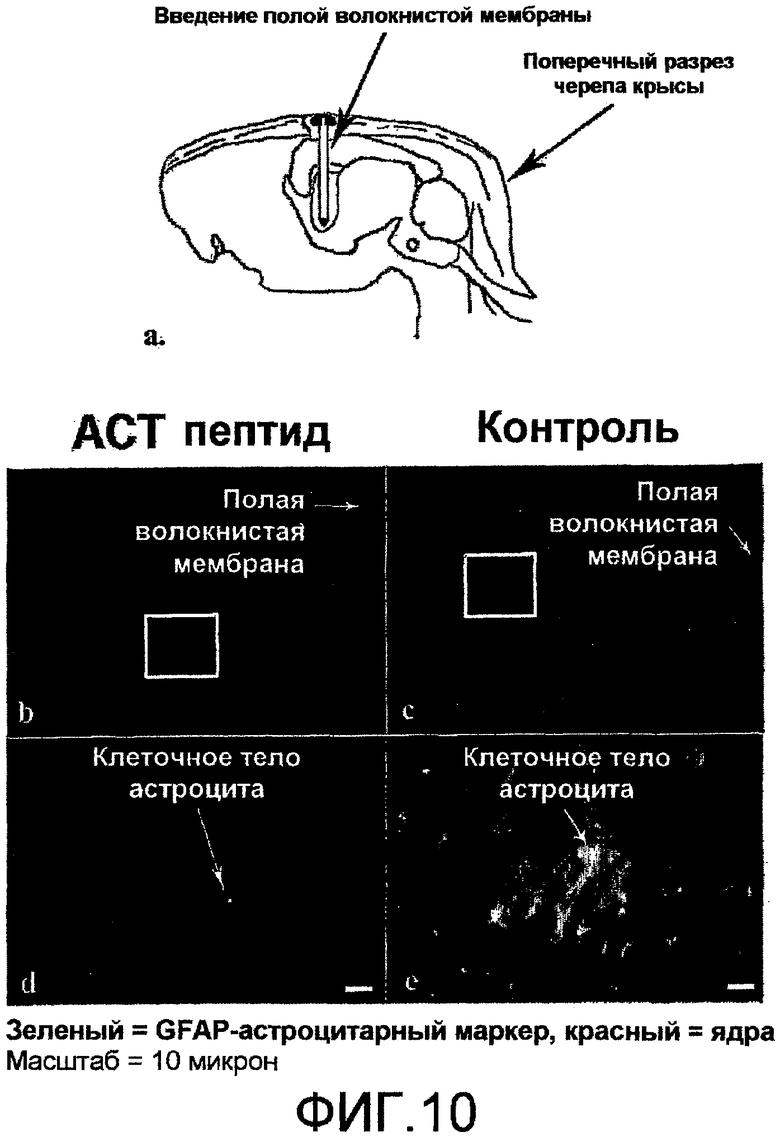
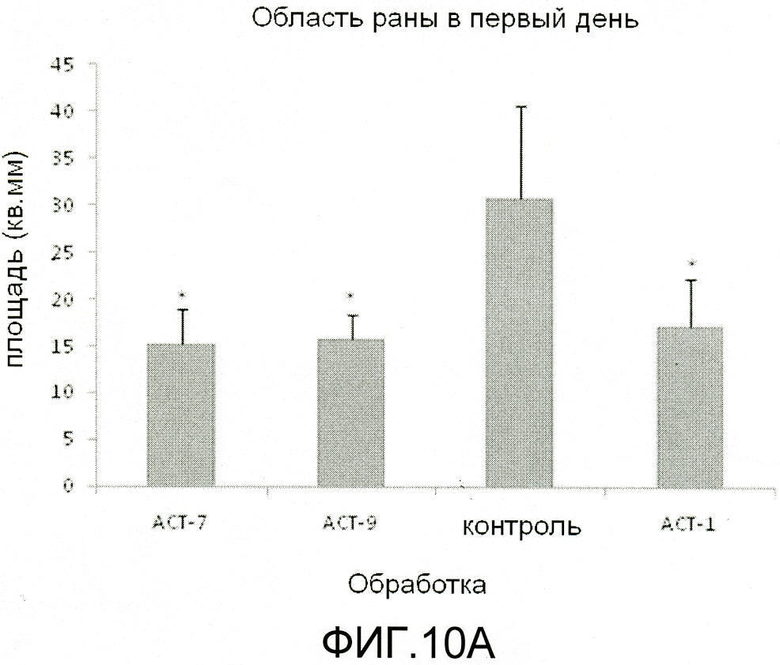
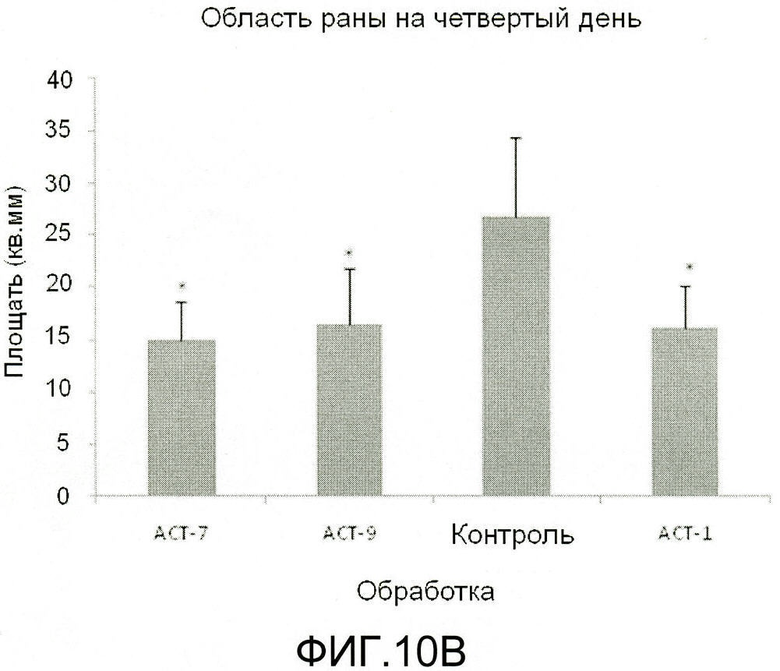
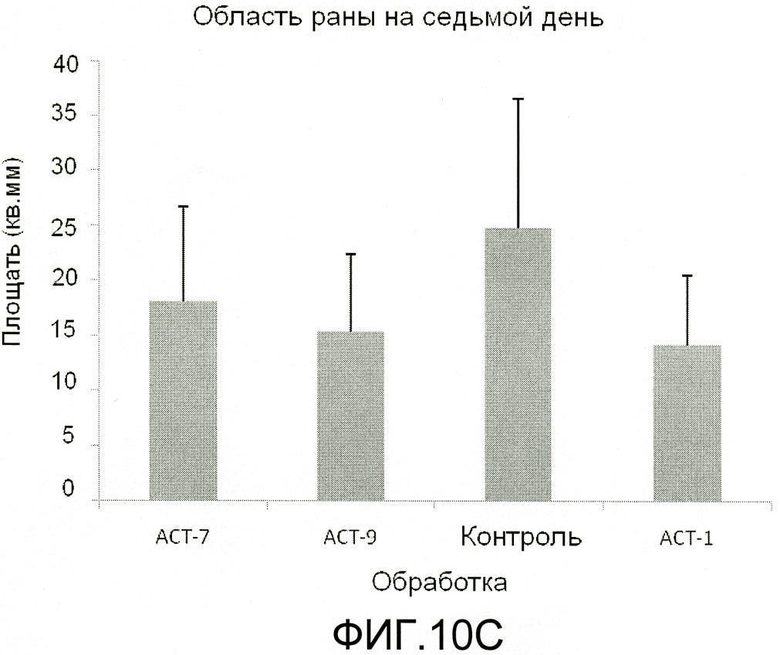
Группа изобретений относится к области медицины и касается разработки лекарственных средств для ускорения заживления ран и регенерации тканей после повреждения ткани у индивидуума. Предлагается композиция для ускорения заживления тканей, содержащая по меньшей мере один полипептид, состоящий из 4-30 последовательных аминокислот карбокси-конца белка альфа-коннексина или его консервативного варианта, где указанный по меньшей мере один полипептид альфа-коннексин связан на амино-конце с переносчиком клеточной интернализации. Предлагаются также композиция для ускорения заживления тканей, составленная для местного применения, содержащая полипептид, состоящий из 4-30 последовательных аминокислот карбокси-конца белка альфа-коннексина или его консервативного варианта, и материал для лечения ран для ускорения заживления тканей, покрытый таким полипептидом. Набор для ускорения заживления тканей может содержать вышеуказанные композиции или материал для лечения ран и инструкцию по их применению. Предлагается также применение вышеуказанных композиций или материала для получения лекарственного средства, ускоряющего заживление тканей. Использование полипептида, состоящего из 4-30 последовательных аминокислот карбокси-конца белка альфа-коннексина или его консервативного варианта, обеспечивает снижение воспаления после повреждения ткани, ускорение заживления, снижение рубцевания, усиление регенерации сложной ткани. 5 н. и 26 з.п. ф-лы, 6 табл., 17 ил.
1. Композиция для ускорения заживления тканей, содержащая по меньшей мере один полипептид, состоящий из 4-30 последовательных аминокислот карбокси-конца белка альфа-коннексина или его консервативного варианта, где указанный по меньшей мере один полипептид альфа-коннексин связан на амино-конце с переносчиком клеточной интернализации.
2. Композиция по п.1, отличающаяся тем, что указанный переносчик клеточной интернализации представляет собой последовательность Antennapedia, Penetratin или Antp-3А.
3. Композиция по п.2, отличающаяся тем, что последовательность Antennapedia представляет собой SEQ ID NO: 7.
4. Композиция по п.1, отличающаяся тем, что белок альфа-коннексин представляет собой коннексин 37, коннексин 40, коннексин 43 или коннексин 45.
5. Композиция по п.1, отличающаяся тем, что по меньшей мере один полипептид состоит из 5-19 последовательных аминокислот карбокси-конца белка альфа-коннексина.
6. Композиция по п.1, отличающаяся тем, что полипептид альфа-коннексина состоит из 9 последовательных аминокислот карбокси-конца белка альфа-коннексина.
7. Композиция по п.1, отличающаяся тем, что полипептид альфа-коннексина состоит из 8 последовательных аминокислот карбокси-конца белка альфа-коннексина.
8. Композиция по п.1, отличающаяся тем, что полипептид альфа-коннексина состоит из 5 последовательных аминокислот карбокси-конца белка альфа-коннексина.
9. Композиция по п.1, отличающаяся тем, что полипептид альфа-коннексина имеет последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 43.
10. Композиция для ускорения заживления тканей, составленная для местного применения, содержащая полипептид, состоящий из 4-30 последовательных аминокислот карбокси-конца белка альфа-коннексина или его консервативного варианта.
11. Композиция по п.10, отличающаяся тем, что белок альфа-коннексин представляет собой коннексин 37, коннексин 40, коннексин 43 или коннексин 45.
12. Композиция по п.10, отличающаяся тем, что полипептид альфа-коннексин имеет последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 43.
13. Композиция по п.12, отличающаяся тем, что полипептид альфа-коннексин связан на амино-конце с переносчиком клеточной интернализации.
14. Композиция по п.13, отличающаяся тем, что переносчик клеточной интернализации представляет собой последовательность Antennapedia, Penetratin или Antp-3А.
15. Композиция по п.14, отличающаяся тем, что последовательность Antennapedia представляет собой SEQ ID NO: 7.
16. Композиция по п.13, отличающаяся тем, что белок альфа-коннексин вместе с переносчиком клеточной интернализации содержат SEQ ID NO: 9.
17. Композиция по п.10, отличающаяся тем, что указанная композиция для местного применения представляет собой мазь, лосьон, спрей, крем или гель.
18. Композиция по п.17, отличающаяся тем, что гель представляет собой гель плуроника.
19. Композиция по п.17, отличающаяся тем, что гель представляет собой гидрогель.
20. Композиция по п.17, отличающаяся тем, что гель представляет собой гель полоксамер.
21. Композиция по п.10, отличающаяся тем, что гель представляет собой коллагеновый полимер.
22. Композиция по п.10, дополнительно содержащая антибиотик, стероидное, анальгетическое, противовоспалительное средство, антигистаминное средство, химиотерапевтическое средство или их сочетание.
23. Композиция по п.10, отличающаяся тем, что указанная композиция содержит от 0,01% вес./об. до 2-5% вес./об. или об./об. пептида альфа-коннексина.
24. Композиция по п.10, отличающаяся тем, что указанная композиция содержит от около 10 до 200 мкМ пептида альфа-коннексина.
25. Материал для лечения ран для ускорения заживления тканей, покрытый полипептидом, состоящим из 4-30 последовательных аминокислот карбокси-конца белка альфа-коннексина или его консервативного варианта.
26. Материал по п.25, отличающийся тем, что указанный материал выбран из группы, состоящей из бандажа, стерильной полоски, кетгута, шовного материала и трансплантата.
27. Материал по п.25, отличающийся тем, что материал представляет собой медицинский имплант.
28. Материал по п.25, отличающийся тем, что материал представляет собой материал, полученный биоинженерными методами.
29. Материал по п.25, отличающийся тем, что указанный материал представляет собой ткань со складчатой структурой.
30. Набор для ускорения заживления тканей, содержащий композицию по п.1 или 10 и фармацевтически приемлемый носитель или материал для лечения ран по п.25 и инструкцию по их применению.
31. Применение композиции по пп.1 и 10 или материала для лечения ран по п.25 для получения лекарственного средства, ускоряющего заживление тканей.
| ОЛИГОПЕПТИД, ОБЛАДАЮЩИЙ АКТИВНОСТЬЮ В ПРИКРЕПЛЕНИИ, РАСПЛАСТЫВАНИИ И ОТКРЕПЛЕНИИ КЛЕТОК, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2000 |
|
RU2241005C2 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| WO 03014303 A2, 20.02.2003 | |||
| Кардная гарнитура | 1945 |
|
SU69896A1 |
| DANG XITONG et al | |||
| Зубчатое колесо со сменным зубчатым ободом | 1922 |
|
SU43A1 |
| Molecular and Cellular Biochemistry, vol.242, N1-2, Jan | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| HUNTER ANDREW W | |||
| et al | |||
| Fusion of GFP to the carboxyl Terminus of | |||
Авторы
Даты
2012-01-10—Публикация
2005-12-20—Подача