ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к замещенным 4-(ариламино)селенофенопиримидиновым соединениям, способам их получения, способам лечения или ингибирования, или контролирования рака, и способам получения фармацевтических композиций для лечения или ингибирования, или контролирования рака.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Рак представляет собой болезнь, которая является результатом аномального роста ткани. Некоторые виды рака обладают возможностью поражать локальные ткани, а также метастазировать отдаленные органы. Это заболевание может развиться во многих различных органах, тканях и клеточных типах. Таким образом, термин "рак" относится к совокупности более чем из тысячи различных заболеваний. Более 4,4 млн. человек во всем мире были диагностированы с раком груди, толстой кишки, яичников, легких или раком предстательной железы, и более 2,5 млн. человек умерли от этих тяжелых заболеваний. Только в одних Соединенных Штатах Америки в 2005 году имели место более 1,25 млн. новых случаев заболевания, а также имело место более 500000 случаев смерти от рака. Большинство новых случаев относятся к раку толстой кишки (~100000), раку легких (~170000), раку молочной железы (~210000) и раку предстательной железы (~230000). По прогнозам, в течение следующих десяти лет заболеваемость и распространенность рака увеличится примерно на 15%, что отражает средний темп роста 1,4%.
Лечение рака бывает двух основных типов: лечебное или паллиативное. Основными лечебными терапиями рака являются хирургическое вмешательство и радиационное лечение. Эти варианты лечения, как правило, являются успешными только в случае, если рак обнаружен на ранней стадии локализации. Как только заболевание развилась до локально-распространенной или метастатической формы рака, эти методы лечения менее эффективны и цель терапии направлена на временное облегчение симптомов и поддержания хорошего качества жизни. Наиболее распространенные протоколы для любого режима лечения включают комбинацию хирургического вмешательства, лучевой терапии и/или химиотерапии.
Цитотоксические лекарственные средства (также известные как циторедуктивные средства) используются при лечении рака в рамках лекарственной терапии или с целью продления жизни или паллиативного лечения симптомов. Цитотоксические лекарственные средства могут быть объединены с лучевой терапией и/или с хирургическим вмешательством, представляя, в частности, нео-адъювантную терапию (химиотерапия первой линии, направленная на сокращение опухоли, делая, тем самым, местную терапию, такую как хирургическая операция и лучевая терапия, более эффективной) или адъювантную химиотерапию (используемую в комбинации вместе с хирургической операцией и/или местной терапией, или после них). Комбинации различных препаратов являются зачастую более эффективными, чем отдельные препараты: они могут обеспечить преимущество при определенных опухолях в виде усиления реакции, снижения развития устойчивости к лекарственным средствам, и/или они могут обеспечить повышенную выживаемость. По этим причинам использование комбинированных цитотоксических препаратов при лечении многих видов рака является весьма распространенным явлением. Применяемые в настоящее время цитотоксические лекарственные средства реализуют различные механизмы, чтобы блокировать пролиферацию и индуцировать гибель клеток. В целом, в зависимости от механизма действия, они могут быть разделены на следующие группы: модуляторы микротрубочки, которые мешают полимеризации или деполимеризации микротрубочек (например, доцетаксел, паклитаксел, винбластин, винорелбин), антиметаболиты, в том числе нуклеозидные аналоги и другие ингибиторы ключевых метаболических путей клеток (например, капецитабин, гемцитабин, метотрексат); агенты, которые взаимодействуют непосредственно с ДНК (например, карбоплатин, циклофосфамид), антрациклиновые ДНК интеркаляторы, которые влияют на ДНК-полимеразы и топо-изомеразы II (например, доксорубицин, эпирубицин) и неантрациклиновые ингибиторы топоизомеразной активности (например, топотекан, иринотекан и этопозид). Хотя различные цитостатические препараты действуют через различные механизмы действия, каждый из них, как правило, приводит, по меньшей мере, к транзиентному сокращению опухолей. Цитотоксические лекарственные средства продолжают представлять собой важный компонент в арсенале средств, применяемых онкологами, для борьбы с раком. В настоящее время большинство лекарственных средств, проходящих клинические испытания на заключительной фазе II и фазе III, ориентированы на известные механизмы действия (средства, связывающие тубулин, антиметаболиты, средства, воздействующие на ДНК), и на постепенные улучшения препаратов известных классов (например таксаны или камптотецины). В последнее время появилось небольшое количество цитотоксических лекарственных средств на основе новых механизмов. Механизмы действия этих цитотоксических лекарственных средств включают ингибирование ферментов, участвующих в модификации ДНК (например, гистондеацетилазы (HDAC)), ингибирование белков, участвующих в движении микротрубочек и развитии клеточного цикла (например, кинезины, киназа Аврора), и новые индукторы апоптоза (например, ингибиторы Bcl-2).
Несмотря на то, что цитостатики остаются в авангарде приемов в лечении пациентов с солидными опухолями, их ограниченная эффективность и узкий терапевтический индекс приводит к значительным побочным эффектам. Кроме того, фундаментальные исследования в области рака привели к исследованию менее токсичных терапий на основе конкретных механизмов, центральных для прогрессии опухолей. Такие исследования могут привести к эффективной терапии с улучшением качества жизни больных раком. Таким образом, возник новый класс терапевтических агентов, называемый цитостатическими лекарственными средствами (цитостатиками). Цитостатики направляют свое действие на стабилизацию опухолей и, как правило, они ассоциированы с более ограниченным и менее тяжелым профилем побочных эффектов. Развитие цитостатических лекарственных средств стало результатом идентификации специфических генетических изменений, которые происходят в ходе развития рака, и понимания роли активации белков, таких как тирозинкиназы и серин/треонин-киназы, при развитии рака.
В эпителиальных злокачественных новообразованиях человека часто встречается экспрессированный EGFR, и его активация играет значительную роль в развитии и прогрессировании рака у человека, так как сигнальные пути EGFR связаны с клеточной пролиферацией, промотированием выживания клеток и ингибированием апоптоза. Таким образом, EGFR представляет собой весьма привлекательную молекулярную мишень для терапии рака. За последние 20 лет были успешно разработаны многочисленные низкомолекулярные ингибиторы и моноклональные антитела, нацеленные на EGFR.
Два селективных ингибитора EGFR, иресса (гефитиниб) и тарцева (эрлотиниб (Фиг.1), представляющие собой производные 4-анилинохиназолина, были соответственно утверждены FDA в 2003 и 2004 годах для терапии локально-распространенной или метастатической формы немелкоклеточного рака легкого (НМРЛ). Клинические данные показывают, что 10-20% всех больных с НМРЛ частично реагируют на эти два ингибитора EGFR, но только эрлотиниб увеличивает выживаемость пациентов с рецидивирующим НМРЛ. Более того, у большинства пациентов, которые ответили на начальное лечение, в конечном счете развивалась устойчивость к ингибиторам EGFR. Таким образом, существует настоятельная неудовлетворенная медицинская необходимость в разработке и создании новых более мощных противоопухолевых активных соединений с широким терапевтическим индексом.
Химическая структура препаратов иресса и тарцева является следующей.
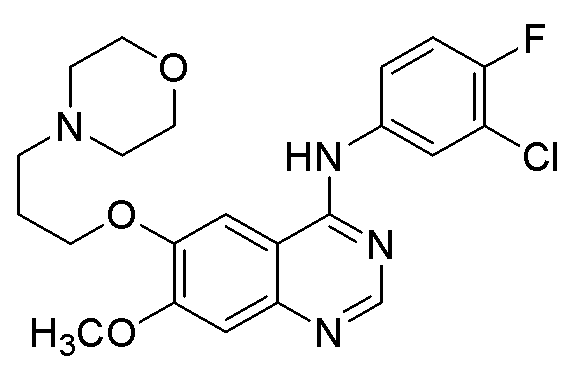
Таким образом, техническая проблема, которая должна быть решена в соответствии с настоящим изобретением, может быть представлена как предоставление альтернативного соединения, которое обладает хорошей противораковой активностью или ингибирующей активностью в отношении EGFR тирозинкиназ или других киназ, предлагая, таким образом, новые терапевтические варианты для лечения заболеваний, в частности рака и других пролиферативных заболеваний.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к замещенным 4-(ариламино)селенофенопиримидиновым соединениям формулы (I) и их фармацевтически приемлемым солям.
В другом аспекте данное изобретение относится к геометрическим изомерам/оптическим изомерам/диастереомерам, гидратам и сольватам соединений формулы (I).
В другом своем аспекте, настоящее изобретение относится к способу получения соединений формулы (I).
В другом аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим по меньшей мере одно 4-(ариламино)селенофенопиримидиновое соединение, выбранное из соединений вышеуказанной формулы (I) и их производных, в комбинации с по меньшей мере одним фармацевтически приемлемым эксципиентом/носителем/разбавителем.
В другом аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим по меньшей мере одно 4-(ариламино)селенофенопиримидиновое соединение, выбранное из соединений вышеуказанной формулы (I) и их производных, в комбинации с по меньшей мере одним фармацевтически приемлемым эксципиентом/носителем/разбавителем, и, необязательно, с по меньшей мере одним противоопухолевым агентом.
В другом своем аспекте, настоящее изобретение относится к способу лечения или ингибирования, или контролирования клеточного пролиферативного нарушения, в частности рака, у пациента, нуждающегося в таком лечении, где способ включает введение пациенту эффективного количества соединения формулы (I) или композиции на его основе, как определено выше.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Далее изобретение будет подробно описано в связи с определенными предпочтительными и частными вариантами осуществления, так чтобы различные аспекты его были более ясны и понятны.
Настоящее изобретение использует селенофен вместо бензольного кольца в 4-(фениламино)хиназолине в качестве основы для значительного увеличения его активности для возможного лечения в случае ранней диагностики рака, и для значительного увеличения эффективности лечения на поздних стадиях рака. Причина, по которой система селенофенового кольца была выбрана вместо ароматической системы фенильного кольца, состоит в том, что это кольцо может напоминать фенильное кольцо по форме, размеру и в пространстве, и оно соответствует структуре фенильного кольца, поскольку селен является большим атомом в пятичленном кольце. Рецепторы, участвующие в распознании 4-(фениламино)хиназолина, например в гефитинибе, также могут распознавать 4-(ариламино)селенофенопиримидин для биологического ответа. Кроме того, селен, как металлоорганическое соединение, обладает противораковыми свойствами. Селен является хорошо известным из незаменимых микроэлементов для человека, который необходим для поддержания здоровой диеты у людей в дозах 55-90 мкг (Aumann, K.M.; Scammells, P. J.; White, J. M.; Schiesser, C. H. Org. Biomol. Chem., 2007, 5, 1276-1281). Следовательно, селен может быть включен как металлоорганическое соединение через ароматическую систему селенофенового кольца, заменяющего ароматическую систему фенильного кольца, со значительно более высокой эффективностью.
Предлагаемые новые аналоги будут иметь конформацию, которая подходит к рецепторам на мембране опухолевой клетки в специфическом конформационном состоянии (SCP), обеспечивая получение физиологического ответа. С помощью этой новой конструкции все молекулы, находящиеся в заранее подготовленной специфической конформации, будут связываться во времени с рецепторами на сто процентов, в то время как препарат иресса, представленный на рынке, может, из-за его неспецифического конформационного состояния (NSCP), иметь относительно низкую вероятность связывания на сто процентов во времени, тем самым не приводя к ни к какому физиологическому ответу, и, следовательно, он будет иметь сниженную активность.
Это, в свою очередь, обеспечит высокую специфичность с большим окном терапевтического индекса (TI). В целом, больший терапевтический индекс является предпочтительным для лечения онкологических больных. Это связано с тем, что было бы желательным начинать терапевтический режим с очень высокой максимально переносимой дозы (МПД), так, чтобы раковые клетки сильно пострадали при первом курсе химиотерапии. В противном случае, выжившие раковые клетки будут восстанавливать повреждения в ДНК, а затем метастазировать в другие органы. Кроме того, раковые клетки, которые выжили после первого курса, станут устойчивыми ко второму курсу химиотерапии, если он будет необходим. И, кроме того, из-за ослабленности иммунной системы от первого курса химиотерапии, во втором курсе, из-за проблем с токсичностью, будет назначена субоптимальная доза.
Как часть разработки новых противораковых соединений, были получены и испытаны, в части их эффективности по отношению различных линий раковых клеток, несколько 4-(ариламино)селенофенопиримидиновых соединений общей формулы (I). Было обнаружено, что эти 4-(ариламино)селенофенопиримидиновые соединения общей формулы (I) показали in vitro хорошее ингибирование пролиферации клеток карциномы человека, таких как клеток А549 карциномы легкого, клеток НТ29 колоректальной карциномы, клеток DU145 карциномы предстательной железы, клеток MDA-MB-231 карциномы молочной железы (отрицательной по эстрогеновым рецепторам), клеток HepG2 гепатоцеллюлярной карциномы и клеток HeLa карциномы шейки матки. Авторы неожиданно обнаружили, что в сравнении с гефитинибом (ирессой), аналог 4-(ариламино)селенофенопиримидина (соединение 33) общей формулы (I) показал лучшую эффективность в ингибировании пролиферации различных опухолевых клеток человека in vitro (см. Таблицу 1 и Таблицу 2). Величины IC50 соединения 33 равны 28,38, 29,47, 13,11, 20,45, 10,41 и 23,09 мкΜ для клеток А549, DU145, НТ29, MDA-MB-231, HepG2 и HeLa, соответственно. В отличие от этого, значения IC50 гефитиниба (ирессы) составили 57,1, 31,47, 46,9, 45,40, 35,53 и 50,12 мкМ для клеток А549, DU145, НТ29, MDA-MB-231, HepG2 и HeLa, соответственно. Наблюдения показывают, что соединение 33 является более мощным ингибитором (на 101%, 6,8%, 257,8%, 122%, 241% и 117%), чем гефитиниб (иресса) при ингибировании пролиферации in vitro опухолевых клеток А549, DU145, НТ29, MDA-MB-231, HepG2 и HeLa, соответственно. Таким образом, новый аналог (соединение 33) является значительно лучшим, чем представленный на рынке препарат гефитиниб (иресса), принимая во внимание его эффективность in vitro и результаты, обобщенные в Таблицах 1 и 2.
Несмотря на то что для демонстрации настоящего изобретения были использованы отдельные соединения, настоящее изобретение охватывает все соединения формулы (I) и их производные.
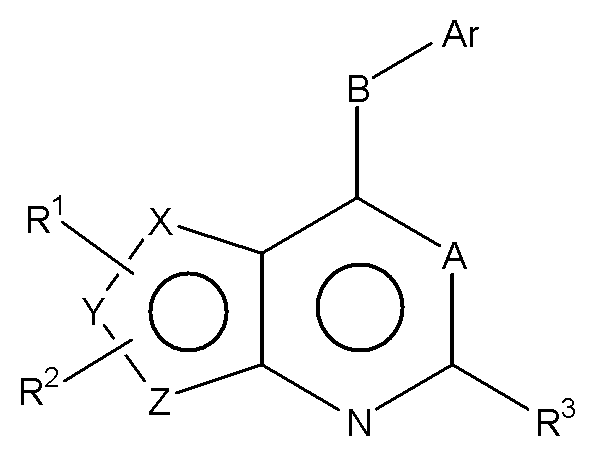
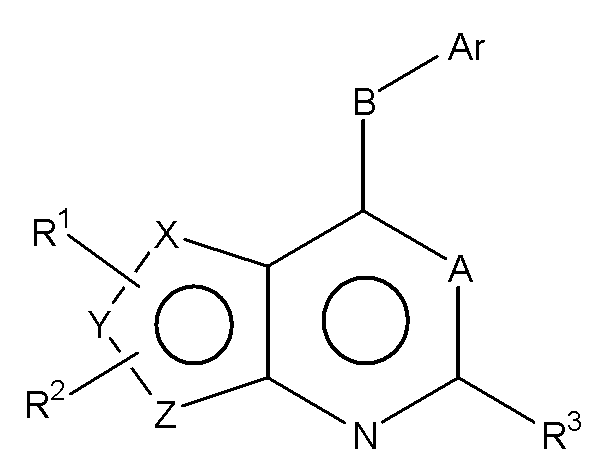
Соответственно, изобретение относится к замещенным 4-(ариламино)селенофенопиримидиновым соединениям, представленным следующей формулой (I), и к их фармацевтически приемлемым солям;
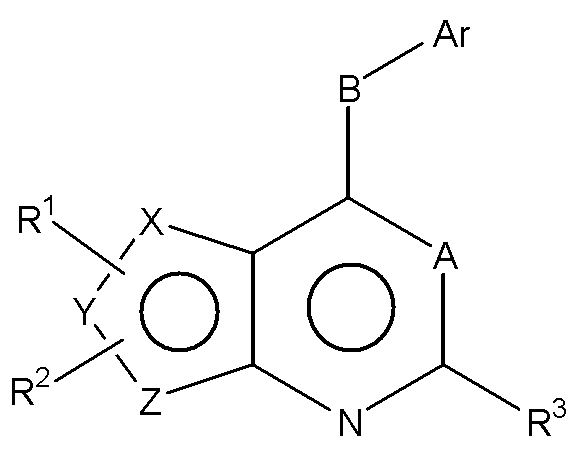
Формула (I)
где
Х представляет собой селен, Y и Z представляют собой атомы углерода;
или
Y представляет собой селен, Х и Z представляют собой атомы углерода;
или
Z представляет собой селен, X и Y представляют собой атомы углерода;
A представляет собой N или C-R4, где R4 выбирается из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалометила, сульфонамида, C1-6алкила, вторичного C1-6алкила, третичного C1-6алкила, C2-6алкенила, C2-6алкинила, C1-4алкилкарбонила, C1-4алкоксикарбонила, аминокарбонила, C1-6алкиламинокарбонила, ди(C1-6алкил)аминокарбонила, галоС1-6алкила, гидроксиС1-6алкила, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкила, C3-7циклоалкокси, C1-6алкиламино, ди(C1-6алкил)амино, аминоС1-6алкила, аминоС1-6алкокси, C1-6алкиламиноС1-6алкила, ди(C1-6алкил)аминоС1-6алкила, C1-6алкилсульфинила и C1-6алкилсульфонила;
В выбирается из S, S(O), S(О2) или NR5, где R5 выбирается из водорода, алкила, алкокси или галоалкила;
Ar представляет собой арильное или гетероарильное кольцо; арил представляет собой бензольное или нафталиновое кольцо, а гетероарил представляет собой 6-членное ароматическое кольцо, содержащее один, два или три атома азота; или гетероарил представляет собой 5-членное ароматическое кольцо, содержащее один или несколько гетероатомов, выбранных из серы, кислорода и азота, при условии, что присутствует не более чем один атом кислорода или серы; при этом такие кольца включают пиридин, пиридазин, пиразин, пиримидин, тиофен, фуран, пиррол, пиразол, имидазол, оксазол, изоксазол, тиазол и изотиазол;
Ar представляет собой кольцо, необязательно замещенное одним, двумя или несколькими группами, независимо выбранными из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалометила, сульфонамида, C1-6алкила, вторичного C1-6алкила, третичного C1-6алкила, C2-6алкенила, C2-6алкинила, C1-4алкилкарбонила, C1-4алкоксикарбонила, аминокарбонила, C1-6алкиламинокарбонила, ди(C1-6алкил)аминокарбонила, галоС1-6алкила, гидроксиС1-6алкила, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкила, C3-7циклоалкокси, C1-6алкиламино, ди(C1-6алкил)амино, аминоС1-6алкила, аминоС1-6алкокси, C1-6алкиламиноС1-6алкила, ди(C1-6алкил)аминоС1-6алкила, C1-6алкилсульфинила, C1-6алкилсульфонила, и представляет собой арильное, гетероарильное и гетероциклоалкильное кольцо; при этом арильное, гетероарильное и гетероциклоалкильное кольцо необязательно замещено галогеном, гидрокси, формилом, карбоновой кислотой, амино, нитро, циано, сульфоновой кислотой, тиолом, тригалометилом, сульфонамидом, C1-6алкилом, C2-6алкенилом, C2-6алкинилом, C1-4алкилкарбонилом, C1-4алкоксикарбонилом, аминокарбонилом, C1-6алкиламинокарбонилом, ди(C1-6алкил)аминокарбонилом, галоС1-6алкилом, гидроксиС1-6алкилом, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкилом, C3-7циклоалкокси, C1-6алкиламином, ди(C1-6алкил)амином, аминоС1-6алкилом, аминоС1-6алкокси, C1-6алкиламиноС1-6алкилом, ди(C1-6алкил)аминоС1-6алкилом, C1-6алкилсульфинилом, C1-6алкилсульфонилом;
R1, R2 и R3 независимо выбираются из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалометила, сульфонамида, C1-6алкила, вторичного C1-6алкила, третичного C1-6алкила, C2-6алкенила, C2-6алкинила, C1-4алкилкарбонила, C1-4алкоксикарбонила, аминокарбонила, C1-6алкиламинокарбонила, ди(C1-6алкил)аминокарбонила, галоС1-6алкила, гидроксиС1-6алкила, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкила, C3-7циклоалкокси, C1-6алкиламино, ди(C1-6алкил)амино, аминоС1-6алкила, аминоС1-6алкокси, C1-6алкиламиноС1-6алкила, ди(C1-6алкил)аминоС1-6алкила, C1-6алкилсульфинила, C1-6алкилсульфонила, и арильного, гетероарильного и гетероциклоалкильного кольца; при этом арильное, гетероарильное или гетероциклоалкильное кольцо необязательно замещено галогеном, гидрокси, формилом, карбоновой кислотой, амино, нитро, циано, сульфоновой кислотой, тиолом, тригалометилом, сульфонамидом, C1-6алкилом, C2-6алкенилом, C2-6алкинилом, C1-4алкилкарбонилом, C1-4алкоксикарбонилом, аминокарбонилом, C1-6алкиламинокарбонилом, ди(C1-6алкил)аминокарбонилом, галоС1-6алкилом, гидроксиС1-6алкилом, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкилом, C3-7циклоалкокси, C1-6алкиламином, ди(C1-6алкил)амином, аминоС1-6алкилом, аминоС1-6алкокси, C1-6алкиламиноС1-6алкилом, ди(C1-6алкил)аминоС1-6алкилом, C1-6алкилсульфинилом, C1-6алкилсульфонилом; или
R1 и R2 независимо выбираются из соединений следующей формулы:
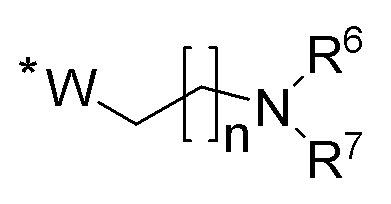
где n представляет собой целое число, выбранное из 0 и из чисел от 1 до 5, при этом n предпочтительно равно 2; * обозначает место присоединения к селенофеновому кольцу в формуле I; W выбирается из CH2, O, S или NH;
R6 и R7 независимо выбираются из водорода, амино, тригалометила, C1-6алкила, вторичного C1-6алкила, третичного C1-6алкила, C2-6алкенила, C2-6алкинила, C1-4алкилкарбонила, C1-4алкоксикарбонила, аминокарбонила, C1-6алкиламинокарбонила, ди(C1-6алкил)аминокарбонила, галоС1-6алкила, гидроксиС1-6алкила, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкила, C3-7циклоалкокси, C1-6алкиламино, ди(C1-6алкил)амино, аминоС1-6алкила, аминоС1-6алкокси, C1-6алкиламиноС1-6алкила, ди(C1-6алкил)аминоС1-6алкила;
или
R1 и R2 соединены, и вместе с атомами, к которым они присоединены, они образуют 5-7-членное необязательно замещенное карбоциклическое или пергидрогетероциклическое кольцо, выбранное из соединений формулы:
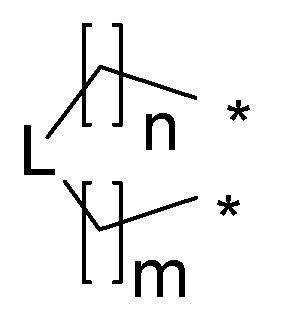
где n представляет собой целое число, выбранное из чисел от 0 до 4; m представляет собой целое число, выбранное из чисел от 0 до 4; * обозначает место присоединения к R1 и R2 в формуле I; L выбирается из CH2, O, S и NR8, где R8 выбирается из водорода, амино, тригалометила, C1-6алкила, вторичного C1-6алкила, третичного C1-6алкила, C2-6алкенила, C2-6алкинила, C1-4алкилкарбонила, C1-4алкоксикарбонила, аминокарбонила, C1-6алкиламинокарбонила, ди(C1-6алкил)аминокарбонила, галоС1-6алкила, гидроксиС1-6алкила, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкила, C3-7циклоалкокси, C1-6алкиламино, ди(C1-6алкил)амино, аминоС1-6алкила, аминоС1-6алкокси, C1-6алкиламиноС1-6алкила, ди(C1-6алкил)аминоС1-6алкила;
или
R8 выбирается из соединений следующей формулы:
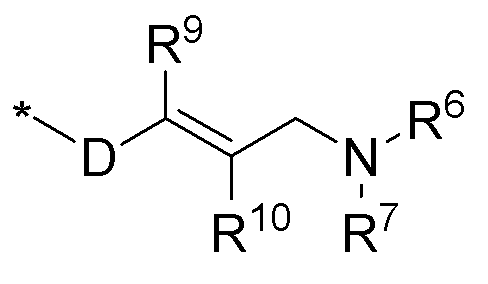
* обозначает место присоединения к N в NR8; где D выбирается из C1-6алкила, -C(=O), -S(=O), -S(=O)2; R9 и R10 выбираются из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалометила, сульфонамида, C1-6алкила, вторичного C1-6алкила, третичного C1-6алкила, C2-6алкенила, C2-6алкинила, C1-4алкилкарбонила, C1-4алкоксикарбонила, аминокарбонила, C1-6алкиламинокарбонила, ди(C1-6алкил)аминокарбонила, галоС1-6алкила, гидроксиС1-6алкила, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкила, C3-7циклоалкокси, C1-6алкиламино, ди(C1-6лкил)амино, аминоС1-6алкила, аминоС1-6алкокси, C1-6алкиламиноС1-6алкила, ди(C1-6алкил)аминоС1-6алкила, C1-6алкилсульфинила, C1-6алкилсульфонила; или
R6 и R7 соединены, и вместе с атомами, к которым они присоединены, они образуют 5-7-членное необязательно замещенное циклоалкильное или циклогетероалкильное кольцо; или
R1 и R2 соединены, и вместе с атомами, к которым они присоединены, они образуют необязательно замещенное арильное или необязательно замещенное гетероарильное кольцо, слитое с селенофеном; при этом арил представляет собой бензольное кольцо, и гетероарил представляет собой 6-членное ароматическое кольцо, содержащее один, два или три атома азота; или гетероарил представляет собой 5-членное ароматическое кольцо, содержащее один или несколько гетероатомов, выбранных из серы, кислорода и азота, при условии, что присутствует не более чем один атом кислорода или серы, при этом такие кольца включают пиридин, пиридазин, пиразин, пиримидин, тиофен, фуран, пиррол, пиразол, имидазол, оксазол, изоксазол, тиазол и изотиазол.
В предпочтительном варианте выполнения, настоящее изобретение относится к замещенным 4-(ариламино)селенофенопиримидиновым соединениям, представленным следующей формулой (I),
Формула (I)
где
X представляет собой селен, когда Y и Z являются атомами углерода; или
Y представляет собой селен, когда Х и Z являются атомами углерода; или
Z представляет собой селен, когда X и Y являются атомами углерода;
и соединение выбирается из следующих соединений:
 .
.
В другом варианте выполнения, настоящее изобретение относится к замещенным 4-(ариламино)селенофенопиримидиновым соединениям, представленным формулой (I), где А представляет собой N; В представляет собой NR5; и Ar представляет собой арильное или гетероарильное кольцо; при этом арильное кольцо представляет собой замещенный или незамещенный бензол, как показано ниже:
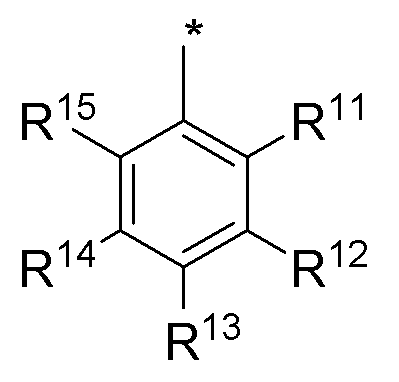
где
* обозначает место присоединения к B в формуле (I);
и соединение выбирается из следующих соединений:
R11, R12, R13, R14 и R15 независимо выбираются из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалометила, сульфонамида, C1-6алкила, вторичного C1-6алкила, третичного C1-6алкила, C2-6алкенила, C2-6алкинила, C1-4алкилкарбонила, C1-4алкоксикарбонила, аминокарбонила, C1-6алкиламинокарбонила, ди(C1-6алкил)аминокарбонила, галоС1-6алкила, гидроксиС1-6алкила, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкила, C3-7циклоалкокси, C1-6алкиламино, ди(C1-6алкил)амино, аминоС1-6алкила, аминоС1-6алкокси, C1-6алкиламиноС1-6алкила, ди(C1-6алкил)аминоС1-6алкила, C1-6алкилсульфинила, C1-6алкилсульфонила, и фенильного, бензильного, 5-членного гетероароматического кольца, содержащего один или несколько гетероатомов, выбранных из серы, кислорода, азота и селена, при условии, что присутствует не более чем один атом кислорода, серы или селена; при этом фенильное или 5-членное гетероароматическое кольцо необязательно замещено галогеном, гидрокси, формилом, карбоновой кислотой, амино, нитро, циано, сульфоновой кислотой, тиолом, тригалометилом, сульфонамидом, C1-6алкилом, C2-6алкенилом, C2-6алкинилом, C1-4алкилкарбонилом, C1-4алкоксикарбонилом, аминокарбонилом, C1-6алкиламинокарбонилом, ди(C1-6алкил)аминокарбонилом, галоС1-6алкилом, гидроксиС1-6алкилом, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкилом, C3-7циклоалкокси, C1-6алкиламином, ди(C1-6алкил)амином, аминоС1-6алкилом, аминоС1-6алкокси, C1-6алкиламиноС1-6алкилом, ди(C1-6алкил)аминоС1-6алкилом, C1-6алкилсульфинилом, C1-6алкилсульфонилом.
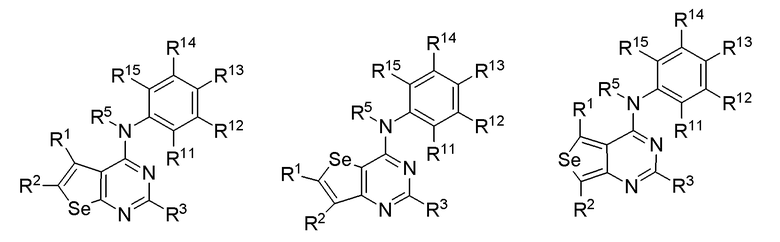
В предпочтительном варианте выполнения, настоящее изобретение относится к замещенным 4-(ариламино)селенофенопиримидиновым соединениям, представленным формулой (I), где А представляет собой N; В представляет NR5; и Ar представляет собой гетероарильное кольцо; при этом гетероарил представляет собой 6-членное или 5-членное гетероароматическое кольцо; 6-членное гетероароматическое кольцо включает пиридин, пиридазин, пиримидин и пиразин. 6-членное гетероароматическое кольцо выбирается из:
(а) необязательно замещенного пиридина:
 или
или  или
или 
где
* обозначает место присоединения к B формулы (I), и соединение выбирается из следующих соединений:
R1, R2, R3, R5, R11, R12, R13 и R14 независимо выбираются из групп, указанных выше;
(b) необязательно замещенного пиридазина:
 или
или 
где:
* обозначает место присоединения к B формулы (I), и соединение выбирается из следующих соединений:
R1, R2, R3, R5, R11, R12 и R13 независимо выбираются из групп, указанных выше;
(c) необязательно замещенного пиримидина:
 или
или  или
или 
где:
* обозначает место присоединения к B формулы (I), и соединение выбирается из следующих соединений:
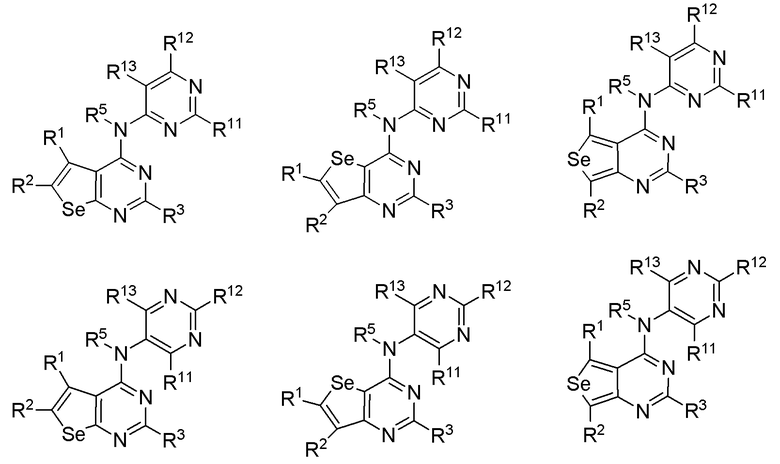
R1, R2, R3, R5, R11, R12 и R13 независимо выбираются из групп, указанных выше;
(d) необязательно замещенного пиразина:
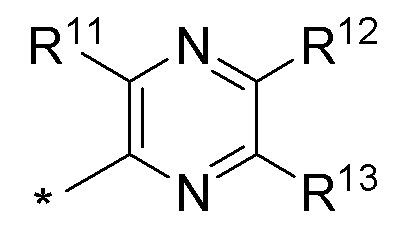
где:
* обозначает место присоединения к B формулы (I), и соединение выбирается из следующих соединений:
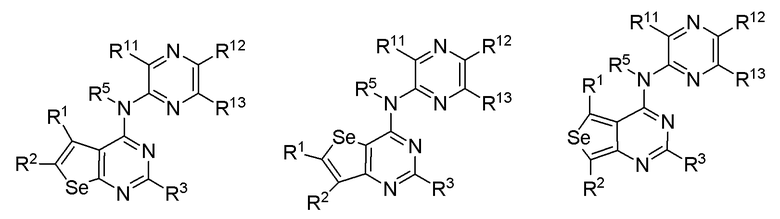
R1, R2, R3, R5, R11, R12 и R13 независимо выбираются из групп, указанных выше.
В другом варианте осуществления, настоящее изобретение относится к замещенным 4-(ариламино)селенофенопиримидиновым соединениям, представленным формулой (I), где Ar представляет собой 5-членное гетероароматическое кольцо, содержащее один или несколько гетероатомов, выбранных из серы, кислорода и азота; при этом такие кольца включают тиофен, фуран, пиррол, пиразол, имидазол, оксазол, изоксазол, тиазол и изотиазол. 5-членное ароматическое кольцо выбирается из:
(а) необязательно замещенного тиофена:
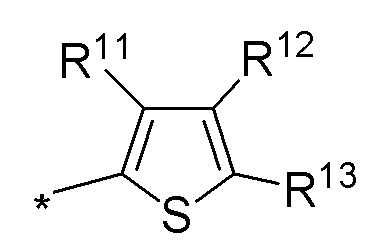 или
или 
где:
* обозначает место присоединения к B формулы (I), и соединение выбирается из следующих соединений:
R1, R2, R3, R5, R11, R12 и R13 независимо выбираются из групп, указанных выше;
(b) необязательно замещенного фурана:
 или
или 
где:
* обозначает место присоединения к B формулы (I), и соединение выбирается из следующих соединений:
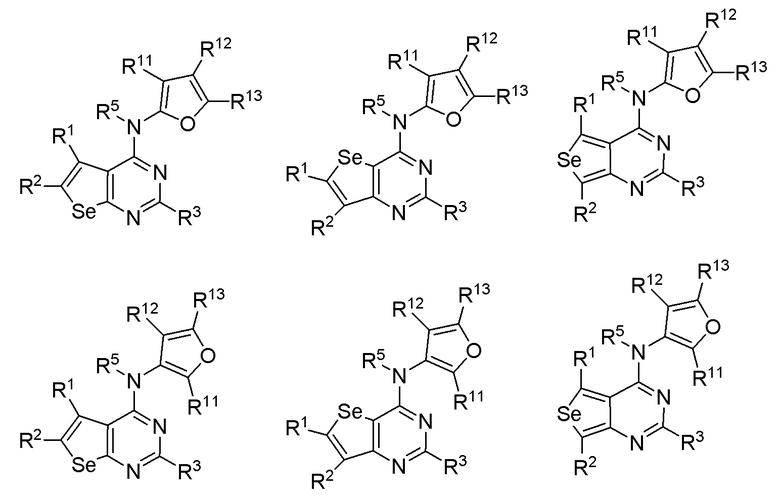
R1, R2, R3, R5, R11, R12 и R13 независимо выбираются из групп, указанных выше;
(с) необязательно замещенного пиррола:
 или
или 
где:
* обозначает место присоединения к B формулы (I), и соединение выбирается из следующих соединений:
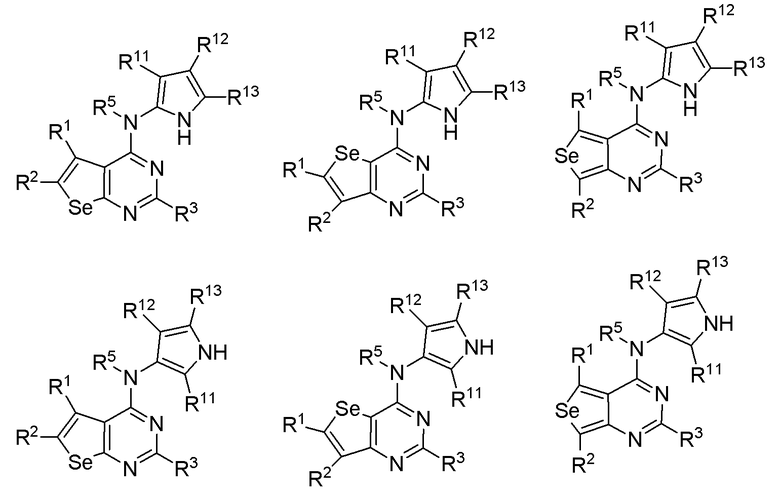
R1, R2, R3, R5, R11, R12 и R13 независимо выбираются из групп, указанных выше;
(d) необязательно замещенного пиразола:
 или
или 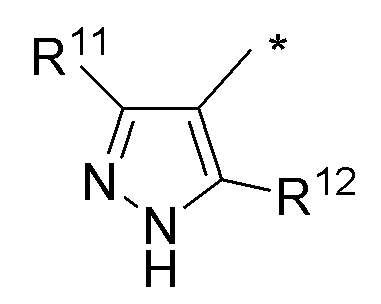
где:
* обозначает место присоединения к B формулы (I), и соединение выбирается из следующих соединений:
R1, R2, R3, R5, R11 и R12 независимо выбираются из групп, указанных выше;
(е) необязательно замещенного имидазола:
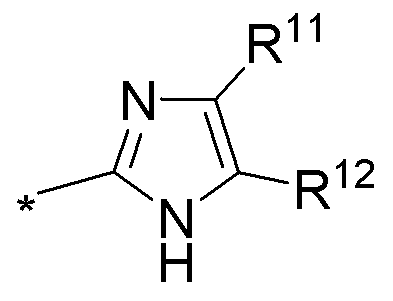 или
или 
где:
* обозначает место присоединения к B формулы (I), и соединение выбирается из следующих соединений:
R1, R2, R3, R5, R11 и R12 независимо выбираются из групп, указанных выше;
(f) необязательно замещенного оксазола:
 или
или  или
или 
где:
* обозначает место присоединения к B формулы (I), и соединение выбирается из следующих соединений:
R1, R2, R3, R5, R11 и R12 независимо выбираются из групп, указанных выше;
(g) необязательно замещенного изоксазола:
 или
или  или
или 
где:
* обозначает место присоединения к B формулы (I), и соединение выбирается из следующих соединений:
R1, R2, R3, R5, R11 и R12 независимо выбираются из групп, указанных выше;
(h) необязательно замещенного тиазола:
 или
или  или
или 
где:
* обозначает место присоединения к B формулы (I), и соединение выбирается из следующих соединений:
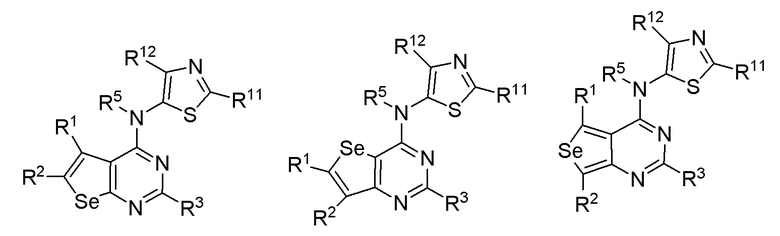
R1, R2, R3, R5, R11 и R12 независимо выбираются из групп, указанных выше;
(i) необязательно замещенного изотиазола:
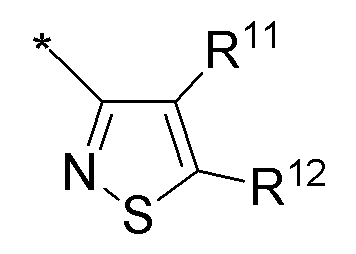 или
или 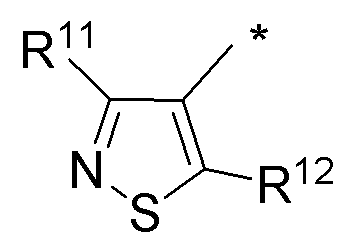 или
или 
где:
* обозначает место присоединения к B формулы (I), и соединение выбирается из следующих соединений:

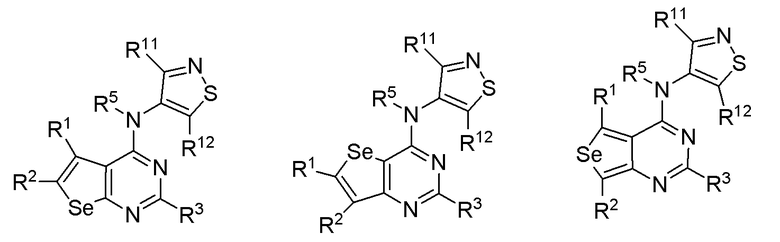
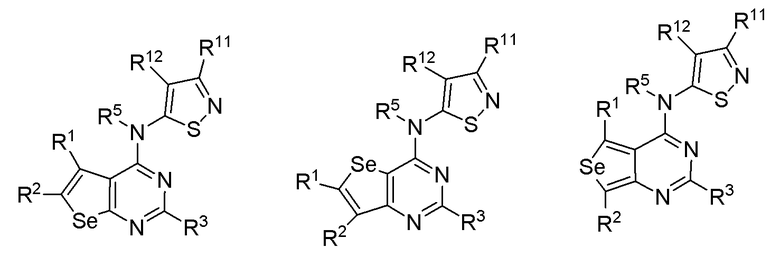
R1, R2, R3, R5, R11 и R12 независимо выбираются из групп, указанных выше.
В другом предпочтительном варианте осуществления, изобретение относится к замещенным 4-(ариламино)селенофенопиримидиновым соединениям, представленным следующей формулой (I),
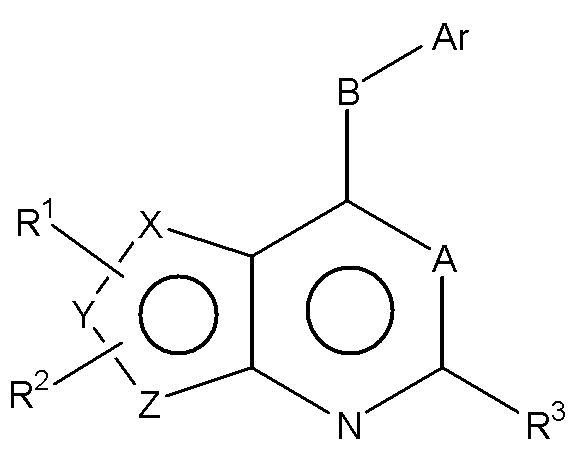
Формула (I)
где:
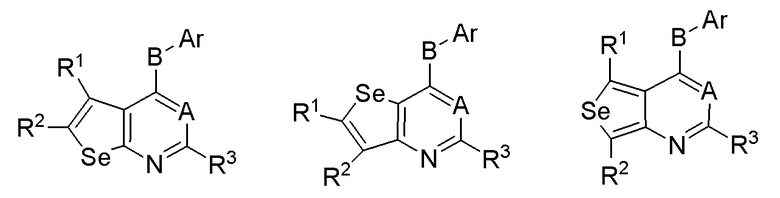
R1 и R2 соединены, и вместе с атомами, к которым они присоединены, образуют необязательно замещенное арильное или необязательно замещенное гетероарильное кольцо, слитое с селенофеном, выбранное из соединений:
(а) необязательно замещенного слитого арила:
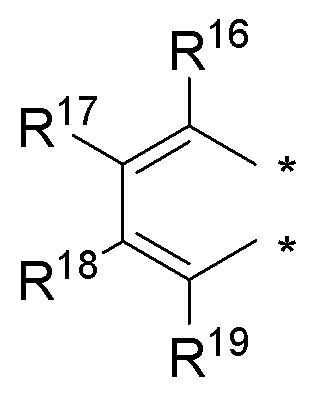
где:
* обозначает место присоединения к R1 и R2 формулы (I), и соединение выбирается из следующих соединений:
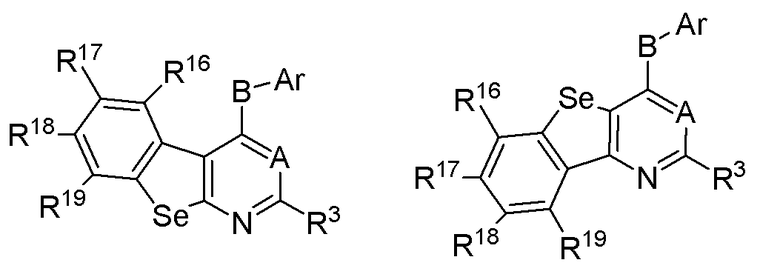
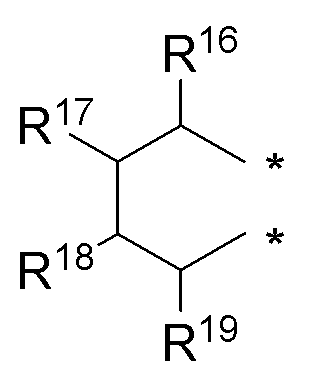
R16, R17, R18 и R19 независимо выбираются из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалометила, сульфонамида, C1-6алкила, вторичного C1-6алкила, третичного C1-6алкила, C2-6алкенила, C2-6алкинила, C1-4алкилкарбонила, C1-4алкоксикарбонила, аминокарбонила, C1-6алкиламинокарбонила, ди(C1-6алкил)аминокарбонила, галоС1-6алкила, гидроксиС1-6алкила, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкила, C3-7циклоалкокси, C1-6алкиламино, ди(C1-6алкил)амино, аминоС1-6алкила, аминоС1-6алкокси, C1-6алкиламиноС1-6алкила, ди(C1-6алкил)аминоС1-6алкила, C1-6алкилсульфинила, C1-6алкилсульфонила и фенильного, бензильного, 5-членного гетероароматического кольца, содержащего один или несколько гетероатомов, выбранных из серы, кислорода, азота и селена, при условии, что присутствует не более чем один атом кислорода, серы или селена; при этом фенильное или 5-членное гетероароматическое кольцо необязательно замещено галогеном, гидрокси, формилом, карбоновой кислотой, амино, нитро, циано, сульфоновой кислотой, тиолом, тригалометилом, сульфонамидом, C1-6алкилом, C2-6алкенилом, C2-6алкинилом, C1-4алкилкарбонилом, C1-4алкоксикарбонилом, аминокарбонилом, C1-6алкиламинокарбонилом, ди(C1-6алкил)аминокарбонилом, галоС1-6алкилом, гидроксиС1-6алкилом, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкилом, C3-7циклоалкокси, C1-6алкиламином, ди(C1-6алкил)амином, аминоС1-6алкилом, аминоС1-6алкокси, C1-6алкиламиноС1-6алкилом, ди(C1-6алкил)аминоС1-6алкилом, C1-6алкилсульфинилом, C1-6алкилсульфонилом;
(b) необязательно замещенного слитого пиридина:
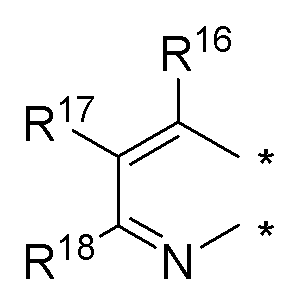 или
или 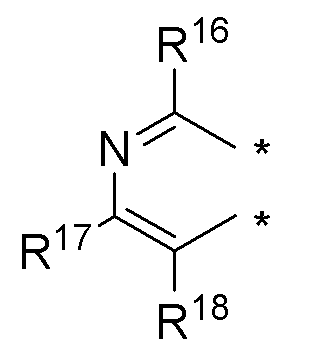
где:
* обозначает место присоединения к R1 и R2 формулы (I), и соединение выбирается из следующих соединений:
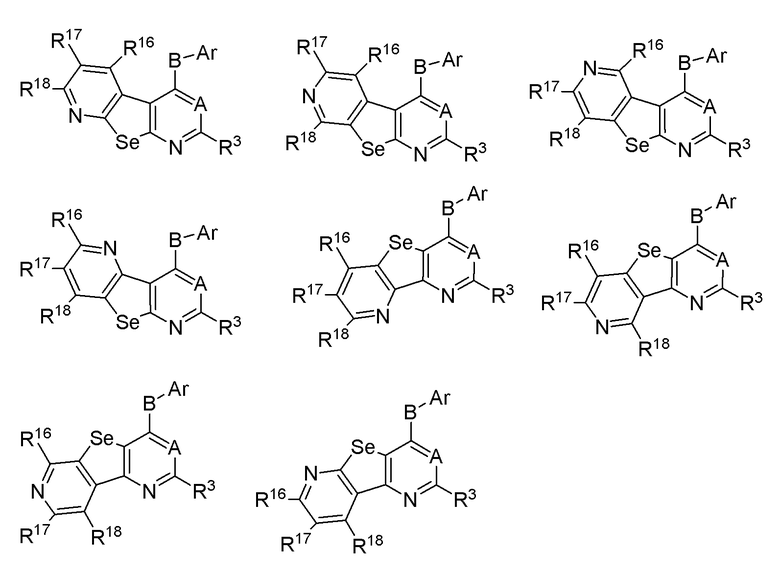
R3, R16, R17 и R18 независимо выбираются из групп, указанных выше;
(с) необязательно замещенного слитого фурана:
 или
или 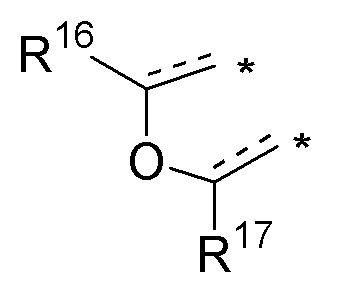
где:
* обозначает место присоединения к R1 и R2 формулы (I), и соединение выбирается из следующих соединений:
R3, R16 и R17 независимо выбираются из групп, указанных выше;
(d) необязательно замещенного слитого тиофена:
 или
или 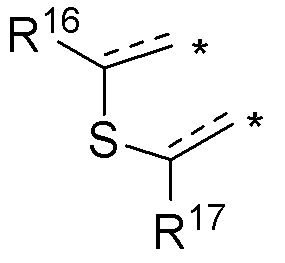
где:
* обозначает место присоединения к R1 и R2 формулы (I), и соединение выбирается из следующих соединений:
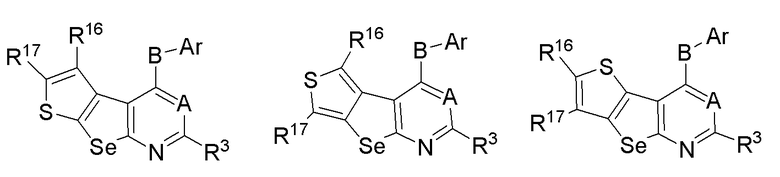
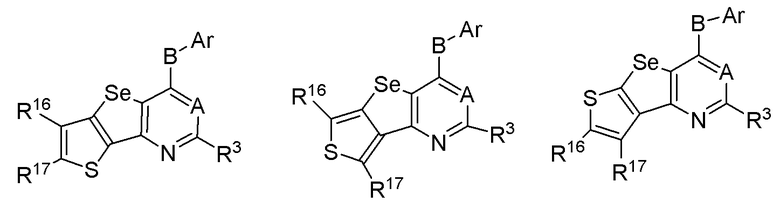
R3, R16 и R17 независимо выбираются из групп, указанных выше;
(е) необязательно замещенного слитого селенофена:
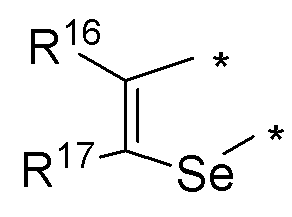 или
или 
где:
* обозначает место присоединения к R1 и R2 формулы (I), и соединение выбирается из следующих соединений:

R3, R16 и R17 независимо выбираются из групп, указанных выше;
(f) необязательно замещенного слитого пиррола:
 или
или 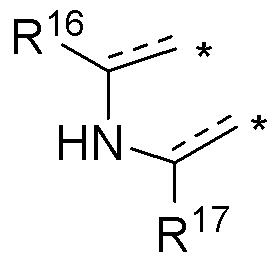
где:
* обозначает место присоединения к R1 и R2 формулы (I), и соединение выбирается из следующих соединений:
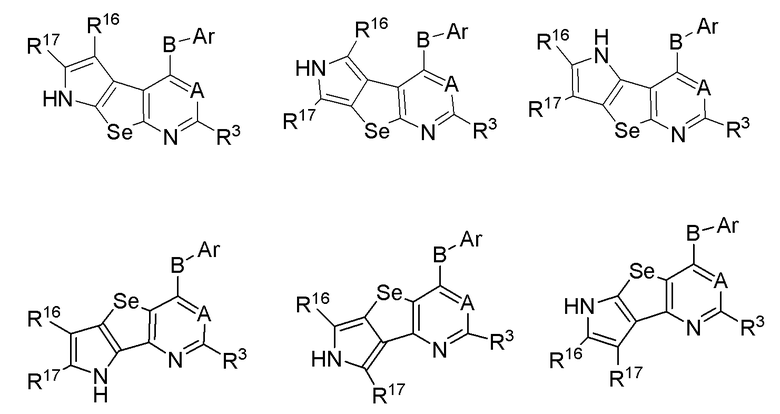
R3, R16 и R17 независимо выбираются из групп, указанных выше.
В другом предпочтительном варианте осуществления изобретение относится к замещенным 4-(ариламино)селенофенопиримидиновым соединениям, представленным следующей формулой (I),
Формула (I)
где
R1 и R2 соединены, и вместе с атомами, к которым они присоединены, образуют необязательно замещенный циклоалкил или необязательно замещенное гетероциклоалкильное кольцо, слитое с селенофеном, выбранное из соединений:
(а) необязательно замещенного 6-членного слитого циклоалкила:
где:
* обозначает место присоединения к R1 и R2 формулы (I), и соединение выбирается из следующих соединений:
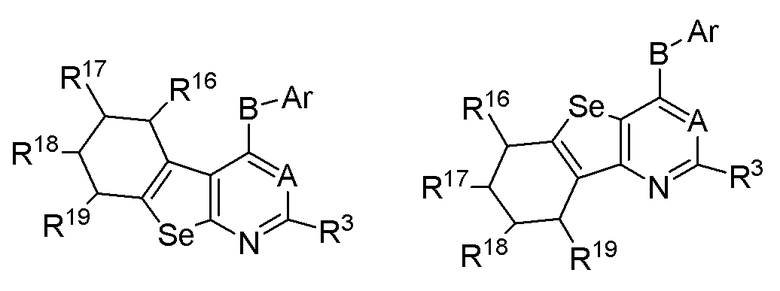
R3, R16, R17, R18 и R19 независимо выбираются из групп, указанных выше;
(b) необязательно замещенного 5-членного слитого циклоалкила:
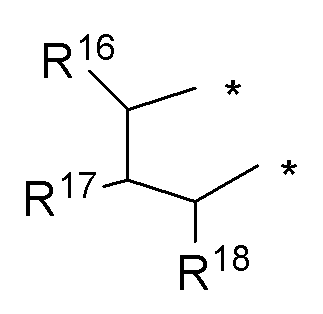
где:
* обозначает место присоединения к R1 и R2 формулы (I), и соединение выбирается из следующих соединений:
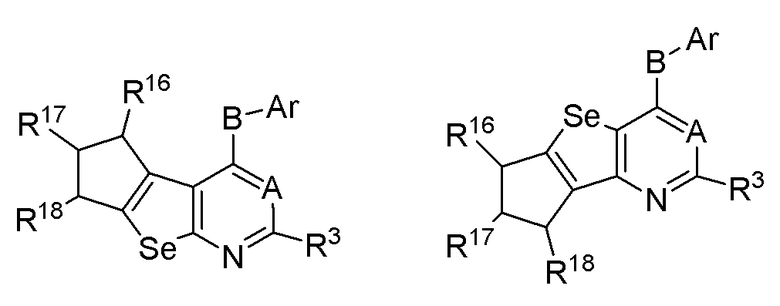
R3, R16, R17 и R18 независимо выбираются из групп, указанных выше.
(с) необязательно замещенного 6-членного слитого гетероциклоалкила:
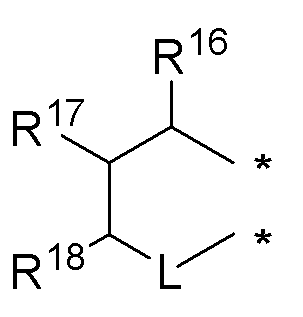 или
или 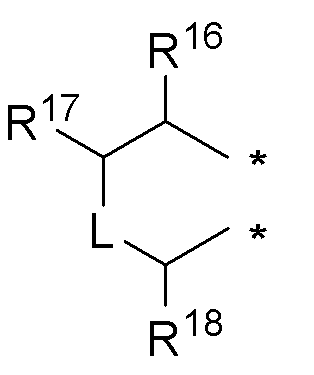
где:
* обозначает место присоединения к R1 и R2 формулы (I), L выбирается из NR8; R16, R17, R18 и R8 независимо выбираются из групп, указанных выше;
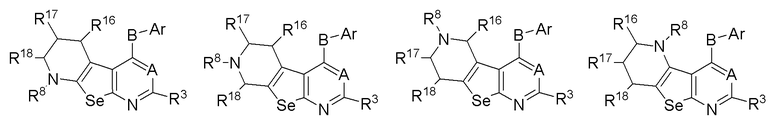
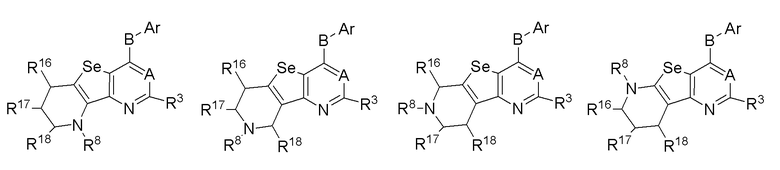
R3, R8, R16, R17 и R18 независимо выбираются из групп, указанных выше.
(d) необязательно замещенного 5-членного слитого гетероциклоалкила:
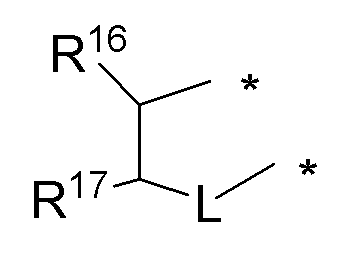 или
или 
где:
* обозначает место присоединения к R1 и R2 формулы (I), L выбирается из NR8; и R16, R17 и R8 независимо выбираются из групп, указанных выше;
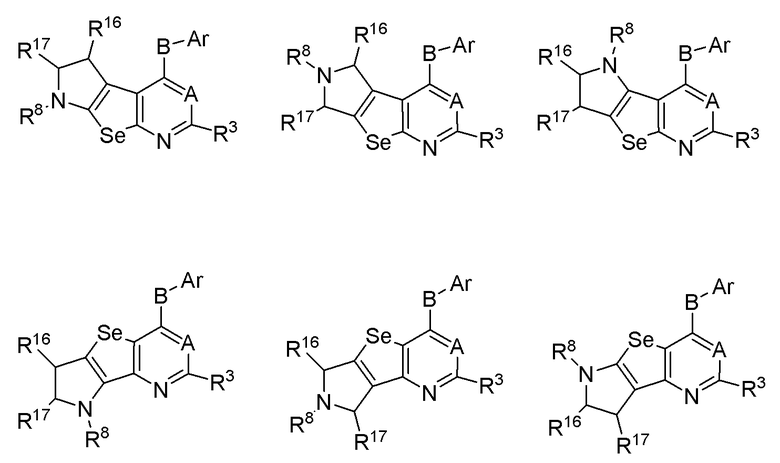
R3, R8, R16 и R17 независимо выбираются из групп, указанных выше.
Если не указано иное, то в настоящем описании и формуле изобретения применяются следующие определения для используемых заместителей и остатков.
Термин "алкил", используемый здесь, относится, в общем, к нормальному алкилу, вторичному алкилу или третичному алкилу, имеющему от 1 до 6 атомов углерода. Неограничивающие примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, гексил, изогексил. То же самое относится к радикалам, таким как алкилкарбонил, алкокси, алкиламино, диалкиламино, алкилсульфонил, галогеналкил и т.п.
Термин "алкенил", используемый здесь, относится, в общем, к линейному или разветвленному ненасыщенному углеводородному радикалу, имеющему от 2 до 6 атомов углерода и одну двойную углерод-углеродную связь. Неограничивающие примеры включают -CH=CH2, -CH=CHCH3, -C(CH3)=CH2, -CH2CH=CH2, -CH=C(CH3)2, -C(CH3)=CHCH3, -CH2CH=CHCH3, -CH2C(CH3)=CH2, -CH2CH2CH=CH2, -CH2CH=CHCH2CH3, -CH2CH2CH=CHCH3, -CH2CH=C(CH3)2, -CH2CH2C(CH3)=CH2, -CH=CHCH2CH2CH3 и т.п.
Термин "алкинил", используемый здесь, относится, в общем, к линейному или разветвленному ненасыщенному углеводородному радикалу, имеющему от 2 до 6 атомов углерода и одну углерод-углеродную тройную связь. Неограничивающие примеры включают -C≡CH, -C≡CCH3, -CH2C≡CH, -C≡CCH2CH3, -CH2CH2C≡CH, -CH2C≡CCH3 и т.п.
Термин "алкокси", используемый здесь иллюстративно, предпочтительно относится к метокси, этокси, н-пропокси, изо-пропокси, н-бутокси и трет-бутокси и т.д.
"Алкилкарбонил", используемый здесь, относится, в общем, к линейному или разветвленному алкильному радикалу, имеющему от 1 до 6 атомов углерода, который связан посредством карбонильной группы с остальной частью молекулы. Неограничивающие примеры включают ацетил, н-пропионил, н-бутирил, изобутирил и пивалоил.
"Алкоксикарбонил", используемый здесь иллюстративно, предпочтительно представляет собой метоксикарбонил, этоксикарбонил, н-пропоксикарбонил, изо-пропоксикарбонил, н-бутоксикарбонил, изо-бутоксикарбонил, трет-бутоксикарбонил и т.п.
"Алкилсульфонил", используемый здесь, относится, в общем, к линейному или разветвленному алкильному радикалу, имеющему от 1 до 6 атомов углерода, который связан посредством сульфонильной (-SO2-) группы с остальной частью молекулы. Неограничивающие примеры включают метилсульфонил, этилсульфонил, н-пропилсульфонил, изо-пропилсульфонил, н-бутилсульфонил, изо-бутилсульфонил и трет-бутилсульфонил и т.п.
"Моноалкиламино", используемый здесь, относится, в общем, к радикалу с аминогруппой, имеющему один алкильный остаток, присоединенный к атому азота. Неограничивающие примеры включают метиламино, этиламино, н-пропиламино, изопропиламино, н-бутиламино, изо-бутиламино и трет-бутиламино. То же самое касается радикалов, таких как моноалкиламинокарбонил и т.п.
"Диалкиламино", используемый здесь, относится, в общем, к радикалу с аминогруппой, имеющему два независимо выбранных алкильных остатка, присоединенных к атому азота. Неограничивающие примеры включают Ν,Ν-диметиламино, N,N-диэтиламино, Ν,Ν-диизопропиламино, N-этил-N-метиламино, N-метил-N-н-пропиламино, N-изопропил-N-н-пропиламино, N-втор-бутил-N-н-метиламино и N-трет-бутил-N-метиламино. То же относится к радикалам, таким как диалкиламинокарбонил и т.п.
"Моноалкиламинокарбонил", используемый здесь иллюстративно, предпочтительно представляет собой метиламинокарбонил, этиламинокарбонил, н-пропиламинокарбонил, изопропиламинокарбонил, н-бутиламинокарбонил, втор-бутиламинокарбонил, третбутиламинокарбонил и т.д.
"Диалкиламинокарбонил", используемый здесь иллюстративно, предпочтительно представляет собой N,N-диметиламинокарбонил, N,N-диэтиламинокарбонил, Ν,Ν-диизопропиламинокарбонил, N-этил-N-метиламинокарбонил, N-метил-N-н-пропиламинокарбонил, N-изопропил-N-н-пропиламинокарбонил, N-бутил-N-н-пропиламинокарбонил, N-изо-бутил-N-н-пропиламинокарбонил, N-метил-N-н-бутиламинокарбонил, N-метил-N-изо-бутиламинокарбонил, N-метил-N-трет-бутиламинокарбонил и N-трет-бутил-N-метил-аминокарбонил и т.п.
"Алкилкарбониламино", используемый здесь, в общем, представляет собой линейный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, который связан посредством карбониламино (-CO-NH-) группы с остальной частью молекулы, и который присоединен к углеродному атому этой группы. Неограничивающие примеры включают ацетиламино, н-пропиониламино, н-бутириламино, изо-бутириламино, трет-бутириламино пивалоиламино и т.п.
"Алкоксикарбониламино", используемый здесь иллюстративно, предпочтительно представляет собой метоксикарбониламино, этоксикарбониламино н-пропоксикарбониламино, изопропоксикарбониламино, н-бутоксикарбониламино, изобутоксикарбониламино, трет-бутоксикарбониламино и т.п.
"Циклоалкил", как используется здесь, в общем представляет собой моно-, би- или трициклический насыщенный углеводородный радикал, имеющий от 3 до 7 атомов углерода. Предпочтение отдается моноциклическим циклоалкильным радикалам, имеющим от 3 до 7 атомов углерода. Неограничивающие примеры включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, бицикло[2.2.1]гептил, адамантил и т.п.
"Гетероциклоалкил", используемый здесь, в общем представляет собой моно- или бициклический, насыщенный гетероциклический радикал, имеющий в общей сложности от 3 до 10 атомов углерода и до 2 гетероатомов и/или гетеро-групп, независимо выбранных из группы, состоящей из N, О, S, SO и SO2, где кольцевая система может быть присоединенной через атом углерода или, если возможно, через атом азота в кольце. Неограничивающие примеры включают азиридинил, азетидинил, оксетанил, тиетанил, пирролидинил, пиразолидинил, тетрагидрофуранил, тиоланил, сульфоланил, 1,3-диоксоланил, 1,3-оксазолидинил, 1,3-тиазолидинил, пиперидинил, пиперазинил, тетрагидропиранил, тетрагидротиопиранил, 1,3-диоксанил, 1,4-диоксанил, морфолинил, тиоморфолинил, 1,1-диоксидотиоморфолинил, пергидроазепинил, пергидро-1,4-диазепинил, пергидро-1,4-оксазепинил, пергидроазоцинил, октагидропирроло[3,4-b]пирролил, октагидроизоиндолил, октагидропирроло[3,4-b]пиридил, октагидропирроло[1,2-а]пиразинил, декагидроизохинолинил, 7-азабицикло[2.2.1]гептил, 3-азабицикло[3.2.0]гептил, 7-азабицикло[4.1.0]гептил, 2,5-диазабицикло[2.2.1]гептил, 2-окса-5-азабицикло[2.2.1]гептил, 2-азабицикло[2.2.2]октил, 3-азабицикло[3.2.1]октил, 8-азабицикло[3.2.1]октил, 8-окса-3-азабицикло[3.2.1]октил, 3-окса-9-азабицикло[3.3.1]нонил. Особое предпочтение отдается 5-7-членным моноциклическим гетероциклоалкильным радикалам, имеющим до 2 гетероатомов, выбранных из группы, состоящей из N, O и S, в частности, в качестве иллюстрации предпочтительны тетрагидрофуранил, 1,3-диоксоланил, пирролидинил, тетрагидропиранил, 1,4-диоксанил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, пергидроазепинил, пергидро-1,4-диазепинил и пергидро-1,4-оксазепинил.
"Гетероарил", как используется здесь, в общем представляет собой моноциклический ароматический гетероциклический радикал, имеющий 5 или 6 кольцевых атомов, в том числе до 3 гетероатомов, независимо выбранных из группы, состоящей из N, О, S и Se, где кольцевая система может быть соединена с помощью атом углерода в кольце, или, если возможно, через атом азота в кольце. Предпочтительны 6-членные гетероарильные радикалы, содержащие вплоть до 2 атомов азота, такие как пиридил, пиримидил, пиридазинил и пиразинил, и 5-членные гетероарильные радикалы, имеющие до 3 гетероатомов, выбранных из группы, состоящей из N, О, S и Se, в частности, в качестве иллюстрации предпочтительны тиенил, фурил, пирролил, селенофенил, тиазолил, оксазолил, изотиазолил, изоксазолил, пиразолил, имидазолил, оксадиазолил, тиадиазолил и триазолил.
Термин "галоген", используемый здесь, означает фтор, хлор, бром и йод.
Соединения согласно настоящему изобретению могут также присутствовать в форме их солей, гидратов и/или сольватов.
Соли, для целей настоящего изобретения, предпочтительно являются фармацевтически приемлемыми солями соединений по изобретению.
Фармацевтически приемлемые соли включают кислотно-аддитивные соли минеральных кислот, карбоновых кислот и сульфоновых кислот, например, соли соляной кислоты, бромистоводородной кислоты, азотной кислоты, серной кислоты, фосфорной кислоты, метансульфоновой кислоты, этансульфоновой кислоты, толуолсульфоновой кислоты, бензолсульфоновой кислоты, формамидинсулфоновой кислоты, нафталинсульфоновой кислоты, муравьиной кислоты, уксусной кислоты, пропионовой кислоты, молочной кислоты, винной кислоты, яблочной кислоты, лимонной кислоты, фумаровой кислоты, малеиновой кислоты, бензойной кислоты, малоновой кислоты, щавелевой кислоты и янтарной кислоты.
Фармацевтически приемлемые соли также включают соли обычных оснований, предпочтительно таких, как, например, соли щелочных металлов (например, натрия и калия), соли щелочноземельных металлов (например, кальция и магния), а также аммонийные соли, представляющие собой производные аммиака или органических аминов, иллюстративно таких как алкиламинов, и, в общем, предпочтительно таких, как этиламин, диэтиламин, триэтиламин, этилдиизопропиламин, моноэтаноламин, диэтаноламин, триэтаноламин, дициклогексиламин, диметиламиноэтанол, дибензиламин, N-метилморфолин, N-метилпиперидин, дигидроабиетиламин, аргинин, лизин, этилендиамин, и полиамины, в частности, такие как путресцин и кадаверин.
Гидраты соединений по изобретению или их соли представляют собой стехиометрические композиции соединений с водой, такие, как например, геми-, моно- или дигидраты. Сольваты соединений по настоящему изобретению или их соли представляют собой стехиометрические композиции соединений с органическими растворителями.
Соединения по настоящему изобретению могут из-за асимметричных центров или ограниченного вращения присутствовать в форме изомеров (энантиомеров, диастереомеров). Соединение может быть представлено в виде любого изомера, в котором асимметричный центр находится в (R)-, (S)- или (R,S)-конфигурации.
Следует также иметь в виду, что когда в качестве примера структуры в соединениях по изобретению присутствуют два или более асимметрических центров, часто будет возможно существование нескольких диастереомеров и энантиомеров, но чистые диастереомеры и чистые энантиомеры представляют предпочтительные варианты осуществления. Предполагается, что чистые стереоизомеры, чистые диастереомеры, чистые энантиомеры и их смеси входят в объем притязаний настоящего изобретения.
Геометрические изомеры, из-за природы заместителей относительно двойной связи или кольца, могут присутствовать как в цис (=Z-), так и в транс (=E-) формах, и обе изомерные формы включены в объем притязаний настоящего изобретения.
Все изомеры, независимо от того, являются ли они разделенными, чистыми, частично чистыми, либо в форме рацемической смеси соединений по настоящему изобретению, включены в объем притязаний настоящего изобретения. Очистка указанных изомеров и разделение указанной смеси изомеров могут быть осуществлены стандартными способами, известными в данной области. Например, диастереомерные смеси могут быть разделены на индивидуальные изомеры путем хроматографии или селективной кристаллизацией, а рацематы могут быть разделены на соответствующие энантиомеры путем хроматографии на хиральных фазах или путем растворения.
Кроме того, все возможные таутомерные формы описанных выше соединений по изобретению включены в объем притязаний настоящего изобретения.
Некоторые примеры соединений формулы (I), применяемые для лечения или ингибирования, или контролирования нарушения клеточной пролиферации, такого как рак, представляют собой следующие:
(3-хлор-4-фторфенил)-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламин (соединение № 1);
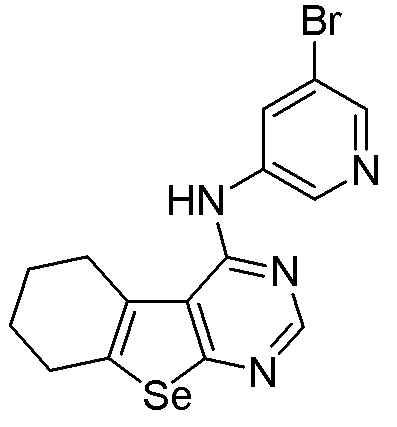
(5-бром(3-пиридил))-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламин (соединение № 2);
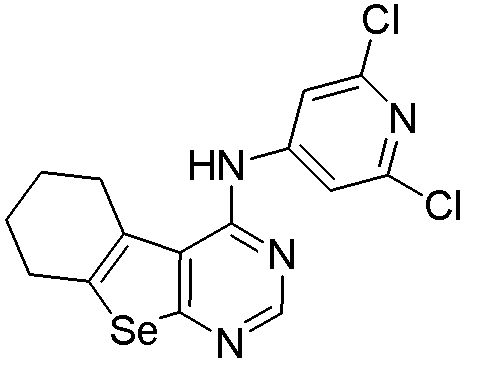
(2,6-дихлорпиридин-4-ил)-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламин (соединение № 3);
(2,6-дихлорпиримидин-4-ил)-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламин (соединение № 4);
пиразин-2-ил-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламин (соединение № 5);
(2,5-дибром(3-тиенил)-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламин (соединение № 6);
(5-трет-бутил)-3-(5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламино)тиофен-2-карбоксамид (соединение № 7);
5-(трет-бутил)-2-(5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламино)фуран-3-карбонитрил (соединение № 8);
5-фенил-2-(5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламино)фуран-3-карбонитрил (соединение № 9);
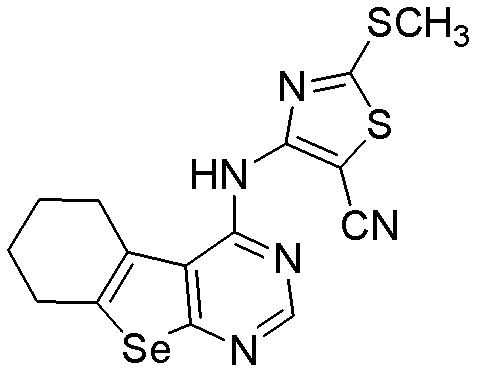
2-метилтио-4-(5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламино)-1,3-тиазол-5-карбонитрил (соединение № 10);
(2-метилтио-5-нитро(1,3-тиазол-4-ил))-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламин (соединение № 11);
4-(5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламино)бензол-сульфонамид (соединение № 12);
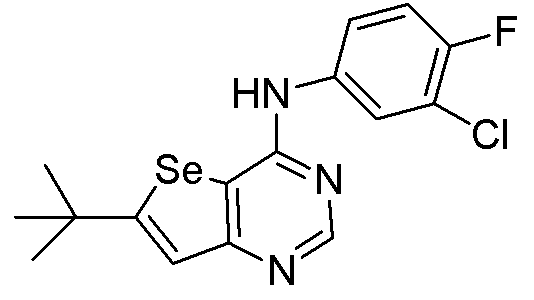
[5-(трет-бутил)селенофено[3,2-e]пиримидин-4-ил](3-хлор-4-фторфенил)амин (соединение № 13);
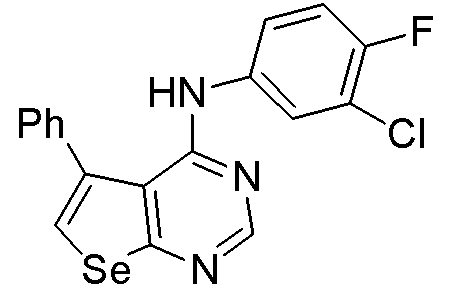
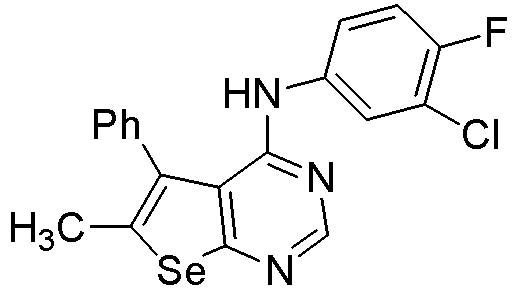
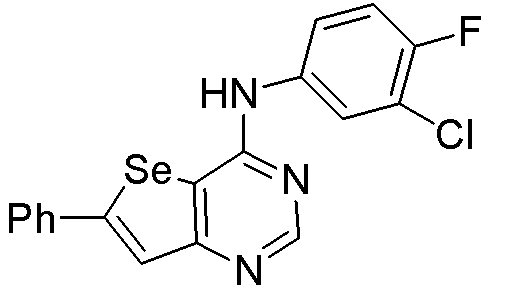
(3-хлор-4-фторфенил)(5-фенилселенофено[3,2-e]пиримидин-4-ил]амин (соединение № 14);
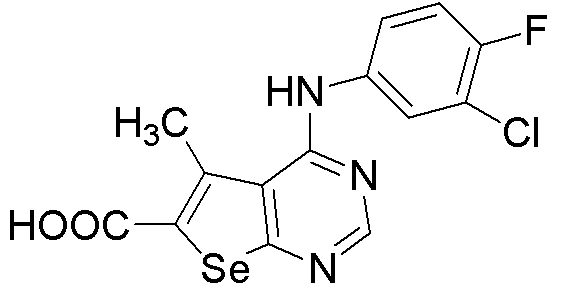
4-[(3-хлор-4-фторфенил)амино]-5-метилселенофено[2,3-d]пиримидин-6-карбоновая кислота (соединение № 15);
[(3-хлор-4-фторфенил)(6-метил-5-фенилселенофено[3,2-e]пиримидин-4-ил]амин (соединение № 16);
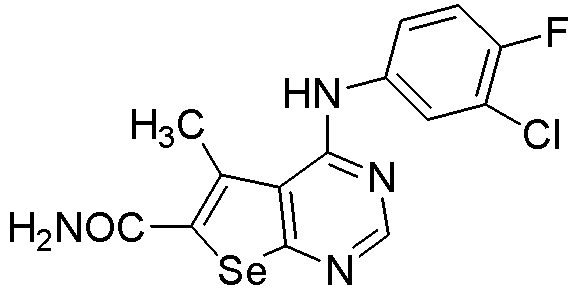
4-[(3-хлор-4-фторфенил)амино]-5-метилселенофено[2,3-d]пиримидин-6-карбоксамид (соединение № 17);
(3-хлор-4-фторфенил)-5,6,7,8-тетрагидропиримидино[5',6'-5,4]селенофено[2,3-c]пиридин-4-иламин (соединение № 18);
4-[(3-хлор-4-фторфенил)амино]-7-(метилсульфонил)-5,6,7,8-тетрагидропиримидино[5',4'-5,4]селенофено[2,3-c]пиридин (соединение № 19);
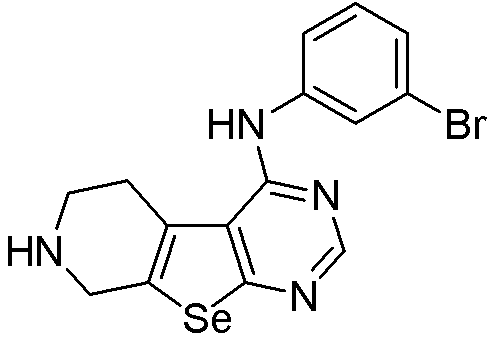
(3-бромфенил)-5,6,7,8-тетрагидропиримидино[5',6'-5,4]селенофено[2,3-c]пиридин-4-иламин (соединение № 20);
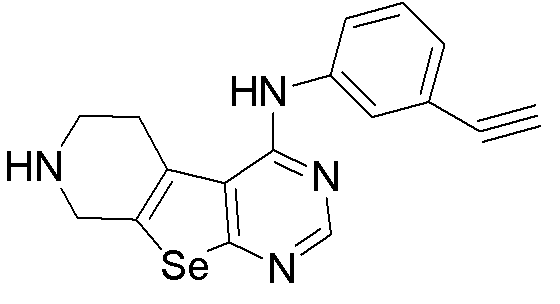
(3-этинилфенил)-5,6,7,8-тетрагидропиримидино[5',6'-5,4]селенофено[2,3-c]пиридин-4-иламин (соединение № 21);
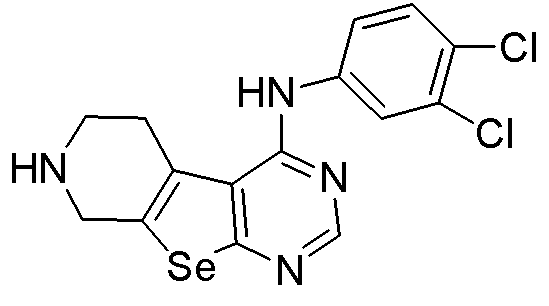
(3,4-дихлорфенил)-5,6,7,8-тетрагидропиримидино[5',6'-5,4]селенофено[2,3-c]пиридин-4-иламин (соединение № 22);
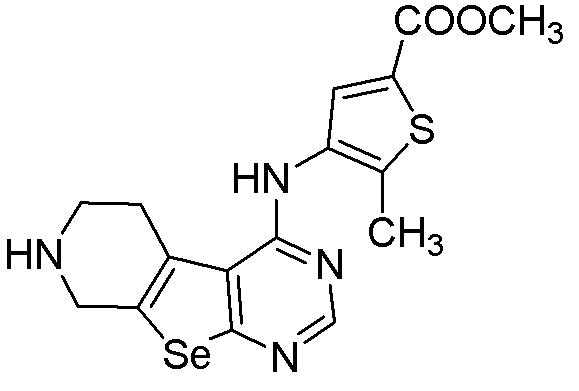
метил-5-метил-4-(5,6,7,8-тетрагидропиримидино[5',6'-5,4]селенофено[2,3-c]пиридин-4-иламино)тиофен-2-карбоксилат (соединение № 23);
{4-[3-хлор-4-фторфенил)амино]-5-метилселенофено[2,3-d]пиримидин-6-ил}-N-(2-гидроксиэтил)карбоксамид (соединение № 24);
N-(2-хлорэтил){4-[3-хлор-4-фторфенил)амино]-5-метилселенофено[2,3-d]пиримидин-6-ил}карбоксамид (соединение № 25);
4-[(3-хлор-4-фторфенил)амино]-5,6,8-тригидробензо[2,1-b]пиримидино[5,4-d]селенофен-7-он (соединение № 26);
(3-хлор-4-фторфенил)-6,7,8,9-тетрагидробензо[1,2-d]пиримидино[5,6-b]селенофен-4-иламин (соединение № 27);
[6-(трет-бутил)селенофено[2,3-e]пиримидин-4-ил](3-хлор-4-фторфенил)амин (соединение № 28);
(3-хлор-4-фторфенил)(6-фенилселенофено[2,3-e]пиримидин-4-ил)амин (соединение № 29);
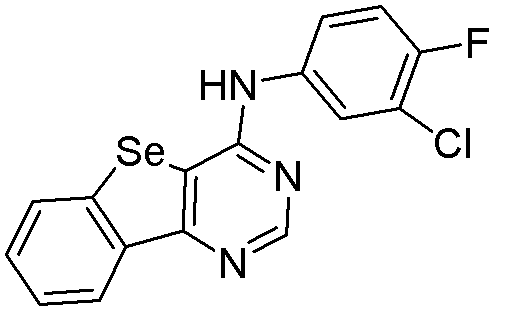
бензо[d]пиримидино[5,6-b]селенофен-4-ил(3-хлор-4-фторфенил)амин (соединение № 30);
(3-хлор-4-фторфенил)пиримидино[4',5'-5,4]селенофено[2,3-b]пиридин-4-иламин (соединение № 31);
этил-4-[(3-хлор-4-фторфенил)амино]-5-метилтиоселенофено[3,4-d]пиримидин-7-карбоксилат (соединение № 32);
(4-хлорфенил)метил-5,6,7,8-тетрагидропиримидино[5',6'-5,4]селенофено[2,3-c]пиридин-4-иламин (соединение № 33);
(3-хлор-4-фторфенил)(2-метил(5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-ил)амин (соединение № 34).
Синтез 4-(ариламино)селенофенопиримидина
Настоящее изобретение также относится к способу получения соединений формулы (I), в котором все группы являются такими, как они определены ранее.
Соединения формулы (I), где один из X, Y и Z является селеном, а другие представляют собой углерод, что в результате приводит к селенофеновому слитому кольцу, где А представляет собой N, и В представляет собой NR5, могут быть получены, как показано на схеме А:
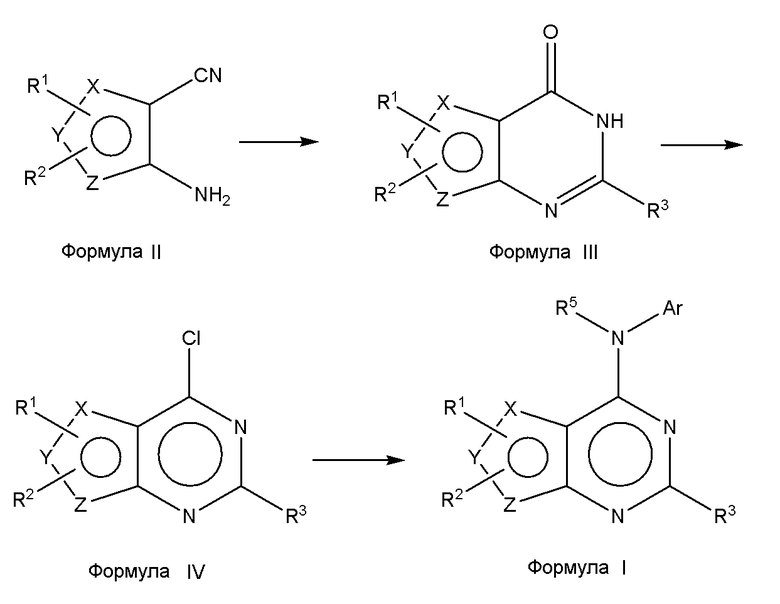
Схема А
Как показано на схеме А, аминоселенофенокарбонитрил формулы II или его эквивалент (Aumann, K.M.; Scammells, P. J.; White, J. M.; Schiesser, C. H. Org. Biomol. Chem., 2007, 5, 1276-1281; Abdel-Hafez, Sh.H. Russian J. Org. Chem., 2005, 41, 396-401; Thomae, D.; Kirsch, G.; Seck, P. Synthesis, 2008, 1600-1606) подвергают взаимодействию со смесью муравьиной кислоты и серной кислоты для получения пиримидинселенофенона формулы III. Соединение формулы III подвергают дальнейшему взаимодействию с хлорирующими агентами, такими как тионилхлорид или оксихлорид фосфора в присутствии DMF или основания, получая хлорпиримидинселенофен формулы IV. Соединение формулы IV подвергают взаимодействию с незамещенными или замещенными ароматическими аминосоединениями в протонном растворителе, таком как изопропиловый спирт, этанол, DMF (диметилформамид), и, необязательно, в присутствии основания, с получением соединения формулы I. Основанием может быть органическое или неорганическое основание, такое как пиридин, триэтиламин, гидроксид натрия и т.п.
Альтернативно, соединения формулы (I), где один из X или Y, или Z является селеном, а другие представляют собой углерод, что в результате приводит к селенофеновому слитому кольцу, где А представляет собой N, и В представляет собой NR5, могут быть получены, как показано на схеме B:
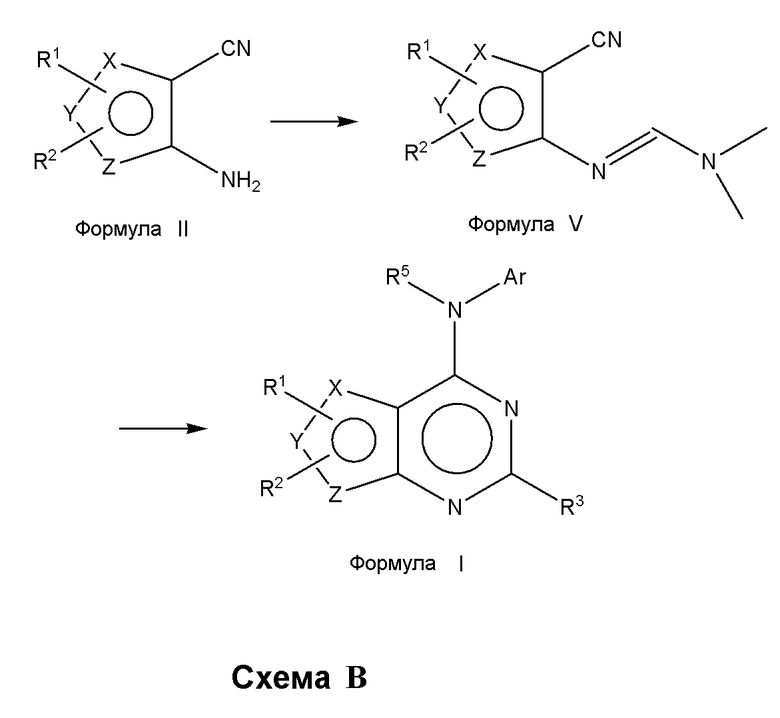
В качестве альтернативы процедуры, изображенной на схеме А, аминоселенофенокарбонитрил формулы II подвергают взаимодействию с диметилформамид-диметилацеталем (Chandregowda, V.; Rao, G. V.; Reddy, G.C.; Org. Proc. Res. Dev., 2007, 11, 813-816), с получением [(диметиламино)метилиден]амино-замещенного соединения формулы V, которое затем циклизуют с помощью необязательно замещенных ароматических аминосоединений в растворителе, таком как толуол, ацетонитрил, уксусная кислота или их смеси, с получением соединения формулы I, как показано на схеме B.
Альтернативно, соединения формулы (I), где один из X или Y, или Z является селеном, а другие представляют собой углерод, что в результате приводит к селенофеновому слитому кольцу, и А представляет собой N; В представляет собой NR5, могут быть получены, как показано на схеме C:
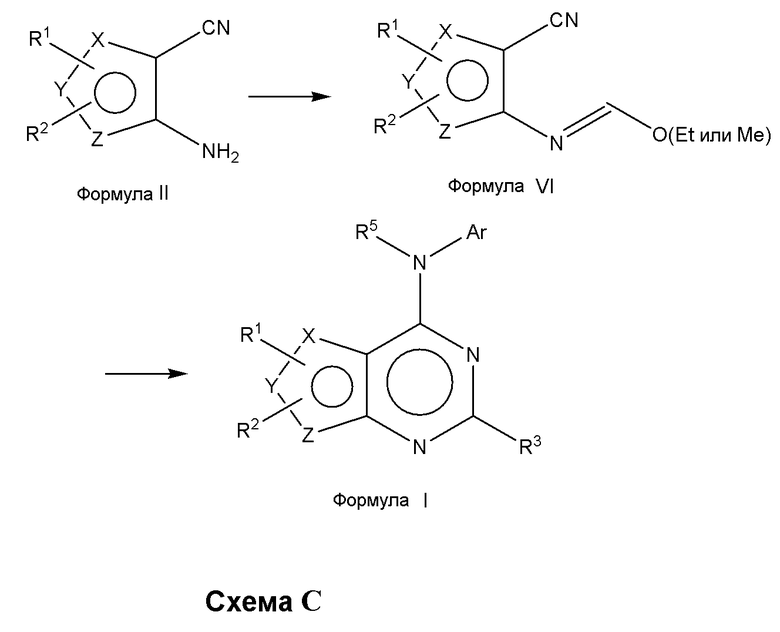
В качестве альтернативы процедур, представленных на схемах А и В, аминоселенофенокарбонитрил формулы II подвергают взаимодействию с триэтилортоформиатом (или триметилортоформиатом) для получения соединения формулы VI, которое затем циклизуют с помощью необязательно замещенных ароматических аминосоединений в растворителе, таком как толуол, ацетонитрил, уксусная кислота или их смеси, с получением соединения формулы I, как показано на схеме C.
Процесс синтеза некоторых соединений формулы (I) продемонстрирован, как показано ниже.
Синтез 4-(ариламино)селенофенопиримидиновых соединений формулы (I), в частности, синтез (3-хлор-4-фторфенил)-6,7,8,9-тетрагидробензо[1,2-d]пиримидино[5,6-b]селенофениламина выполняется с помощью стадий, показанных на схеме D.
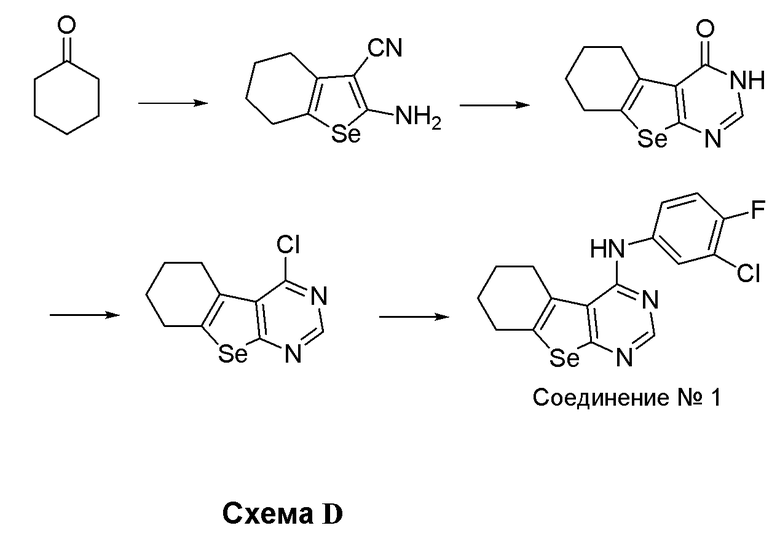
Как показано на схеме D, циклогексанон подвергают взаимодействию с малононитрилом и селеном в виде порошка в присутствии диэтиламина с получением 2-амино-4,5,6,7-тетрагидробензо-[1,2-b]селенофен-3-карбонитрила (Abdel-Hafez, Sh. H. Russian J. Org. Chem., 2005, 41, 396-401), который при циклизации с использованием муравьиной кислоты/серной кислоты приводит к получению 3,5,6,7,8-пентагидробензо-[1,2-b]пиримидино-[5,4-d]селенофен-4-она. Обработка этого соединения тионилхлоридом в присутствии каталитического количества DMF приводит к получению 4-хлорпроизводного. Это 4-хлорпроизводное, реагируя с 3-хлор-4-фторанилином, приводит к получению соединения № 1.
Синтез 4-(ариламино)селенофенопиримидиновых соединений формулы (I), в частности, синтез соединений № 2-11, выполняется с помощью стадий, показанных на схеме E.
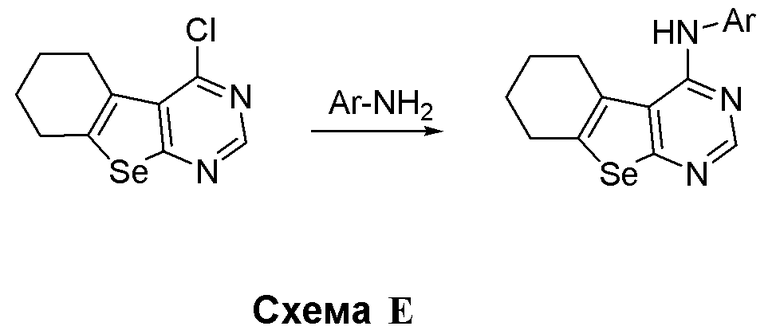
Соответственно, 4-хлорпроизводное (см. схему D) взаимодействует с гетероариламинами (Matsuda, T.; Yamagata, K.; Tomioka, Y.; Yamazaki, M. Chem. Pharm. Bull., 1985, 33, 937-943; Thomae, D.; Perspicace, E.; Hesse, S.; Kirsch, G.; Seck, P. Tetrahedron, 2008, 64, 9309-9314; DellErba, C.; Spinelli, D. Tetrahedron, 1965, 21, 1061-1066) в присутствии растворителя, с получением соединений № 2-11. С помощью этого процесса были синтезированы следующие соединения.
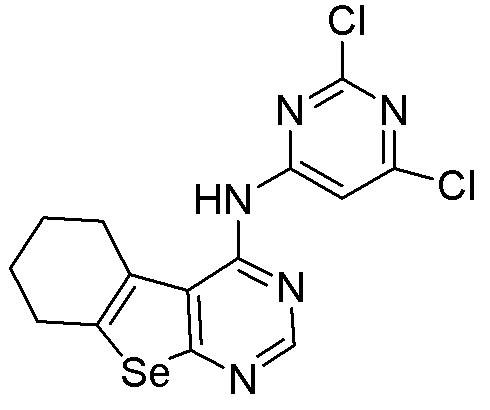
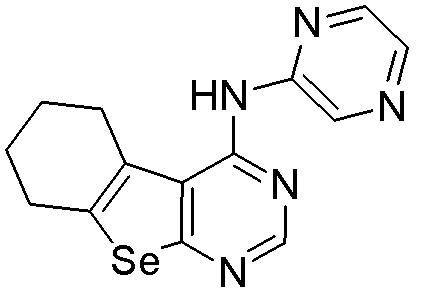
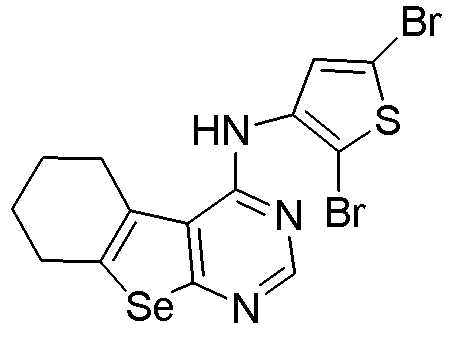


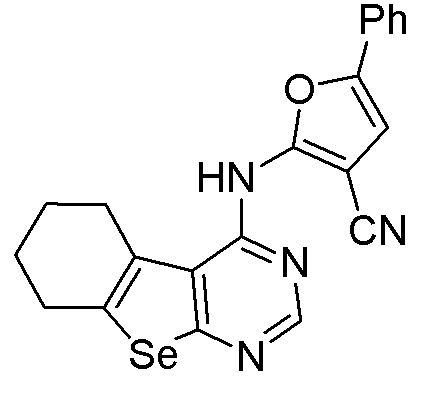

Синтез 4-(ариламино)селенофенопиримидиновых соединений формулы (I), в частности синтез соединения № 12, выполняется с помощью стадий, показанных на схеме F.
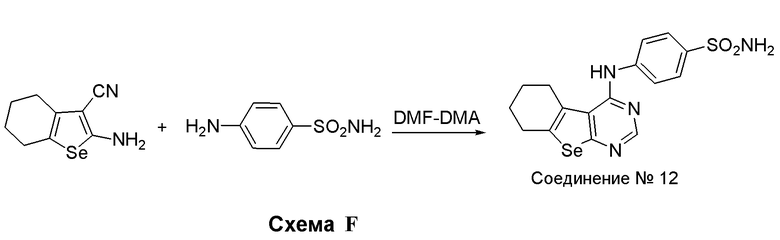
Как показано на схеме F, 2-амино-4,5,6,7-тетрагидробензо[b]селенофен-3-карбонитрил (см. схему D) подвергают взаимодействию с диметилформамид-диметилацеталем (DMF-DMA) в присутствии уксусной кислоты, а затем подвергают взаимодействию с сульфонамидом, получая соединения № 12.
Синтез 4-(ариламино)селенофенопиримидиновых соединений формулы (I), в частности синтез соединений № 13-17, выполняется с помощью стадий, показанных на схеме G.
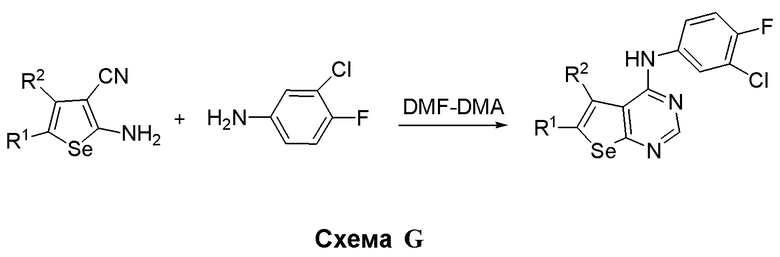
Как показано на схеме G, 2-аминоселенфен-3-карбонитрил подвергают взаимодействию с диметилформамид-диметилацеталем (DMF-DMA) в присутствии уксусной кислоты, а затем подвергают взаимодействию с 3-хлор-4-фторанилином, получая соединения № 13-17. С помощью этого процесса были синтезированы следующие соединения.

Синтез 4-(ариламино)селенофенопиримидиновых соединений формулы (I), в частности синтез соединения № 18 и соединения № 19, выполняется за счет стадий, показанных на схеме Н.

Как показано на схеме H, обработка моногидрата гидрохлорида 4-пиперидинона ВОС-ангидридом приводит к получению ВОС-защищенного соединения (Wang, X. -S.; Wu, J. -R.; Zhou, J.; Tu, S. -J. J. Comb. Chem., 2009, 11, 1011-1022), которое в реакции с малононитрилом и селеном в виде порошка в присутствии диэтиламина приводит к получению с хорошим выходом ВОС-защищенного 2-амино-4,5,6,7-тетрагидроселенофено[2,3-с]пиридин-3-карбонитрила. Это селенофеновое соединение подвергают взаимодействию с диметилформамид-диметилацеталем в присутствии уксусной кислоты с последующей реакцией с 3-хлор-4-фторанилином, что приводит к получению соединения № 18. Обработка соединения № 18 метансульфонилхлоридом в присутствии основания дает соединение № 19.
Синтез 4-(ариламино)селенофенопиримидиновых соединений формулы (I), более конкретно, синтез соединений № 20-23 выполняется с помощью стадий, показанных на схеме I.
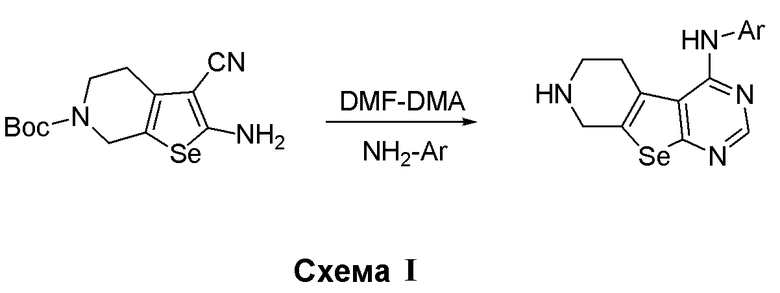
Как показано на схеме I, обработка ВОС-защищенного 2-амино-4,5,6,7-тетрагидроселенофено[2,3-с]пиридин-3-карбонитрила (см. схему H) диметилформамид-диметилацеталем в присутствии уксусной кислоты с последующей реакцией с ариламинами (Tsubou, S.; Mimura, S.; Ono, S. -I.; Watanabe, K.; Takeda, A. Bull. Chem. Soc. Jpn., 1987, 60, 1807-1812) приводит к получению соединений № 20-23. С помощью этого процесса были синтезированы следующие соединения.
Синтез 4-(ариламино)селенофенопиримидиновых соединений формулы (I), более конкретно, синтез соединений № 24-25, выполняется с помощью стадий, показанных на схеме J.
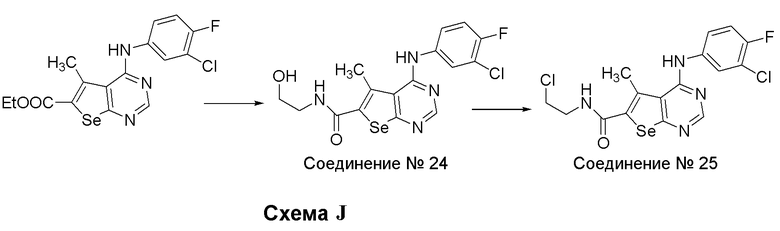
Как показано на схеме J, обработка этил-4-[3-хлор-4-фторфенил)амино]-5-метилселенофено[2,3-d]пиримидин-6-карбоксилата (этиловый эфир соединения № 15) этаноламином приводит к получению соединения № 24 с хорошим выходом. Соединение № 24 подвергают взаимодействию с тионилхлоридом, получая соединение № 25.
Синтез 4-(ариламино)селенофенопиримидиновых соединений формулы (I), в частности синтез соединения № 26 выполняется с помощью стадий, показанных на схеме К.
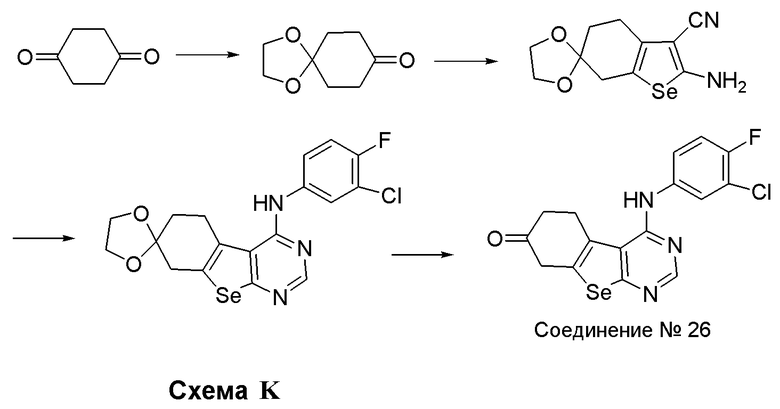
Как показано на схеме К, циклогексан-1,4-дион является соединением, монозащищенным этандиолом в присутствии п-толуолсульфоновой кислоты (доступный от Sigma-Aldrich), которое взаимодействует с малононитрилом и селеном в виде порошка, в присутствии диэтиламина, с получением 7-аминоспиро[1,3-диоксолан-2,6'-4,5,6,7-тетрагидробензо[2,1-b]селенофен]-8-карбонитрила. Это селенофеновое соединение подвергают взаимодействию с DMF-DMA в присутствии уксусной кислоты, с последующей реакцией с 3-хлор-4-фторанилином; последующий кислотный гидролиз дает соединение № 26.
Синтез 4-(ариламино)селенофенопиримидиновых соединений формулы (I), в частности синтез соединения № 27, выполняется с помощью стадий, показанных на схеме L.
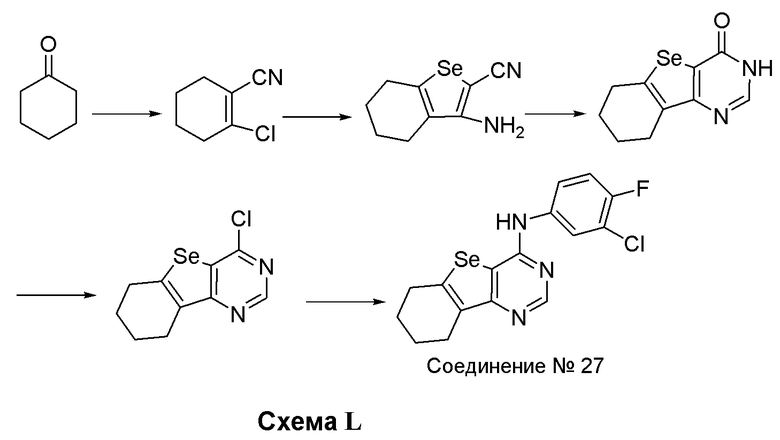
Как показано на схеме L, реакция циклогексанона с диметилформамид-оксихлоридом фосфора и последующая реакция с гидрохлоридом гидроксиламина приводит к получению 2-хлорциклогекс-1-енкарбонитрила (Gunes, Y.; Polat, M. F.; Sahin, E.; Fleming, F. F.; Altundas, R. J. Org. Chem., 2010, 75, 7092-7098), который далее взаимодействует с селенидом натрия/хлорацетонитрилом и метоксидом натрия, с получением 3-амино-4,5,6,7-тетрагидробензо[1,2-b]-селенофен-2-карбонитрила. Циклизация этого селенофенового соединения с муравьиной кислотой/серной кислотой с последующей реакцией с тионилхлоридом приводит к получению 4-хлор-6,7,8,9-тетрагидробензо[1,2-d]пиримидино[5,4-b]селенофена. Реакция 4-хлорселенофенового соединения с 3-хлор-4-фторанилином в присутствии изопропанола дает соединение № 27.
Синтез 4-(ариламино)селенофенопиримидиновых соединений формулы (I), более конкретно, синтез соединений № 28-29, выполняется с помощью стадий, показанных на схеме М.
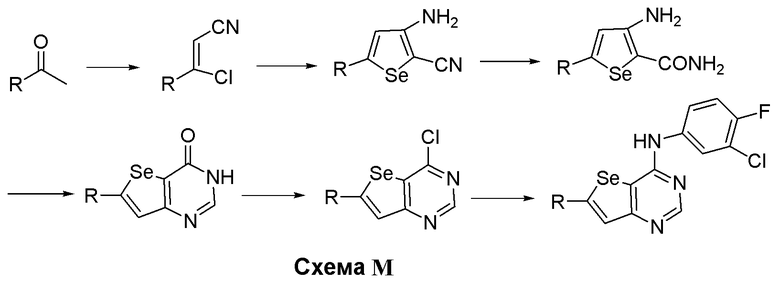
Как показано на схеме М, реакцией карбонильного соединения с диметилформамид-оксихлоридом фосфора, и последующей реакцией с гидрохлоридом гидроксиламина, получали 3-хлор-3-замещенное карбонитрильное производное (Ohta, H.; Ishizaka, T.; Tatsuzuki, M.; Yoshinaga, M.; Iida, I.; Yamaguchi, T.; Tomishima, Y.; Futaki, N.; Toda, Y.; Saito, S. Bioorg. Med. Chem., 2008, 16, 1111-1124), которое далее реагирует с селенидом натрия/хлорацетонитрилом и метоксидом натрия, получают 3-аминоселенофен-2-карбонитрил (Thomae, D.; Kirsch, G.; Seck, P. Synthesis, 2008, 1600-1606). Циклизация этого селенофенового соединения с муравьиной кислотой/серной кислотой с последующей реакцией с тионилхлоридом приводит к получению 4-хлорселенофенопиримидинового производного (Hesse, S.; Chenet, C.; Thomae, D.; Kirsch, G. Synthesis, 2009, 1204-1208). Реакция 4-хлорселенофенового соединения с 3-хлор-4-фторанилином в присутствии изопропанола приводит к получению соединений № 28-29. С помощью этого процесса были синтезированы следующие соединения.
Синтез 4-(ариламино)селенофенопиримидиновых соединений формулы (I), более конкретно, синтез соединений № 30-31, выполняется с помощью стадий, показанных на схеме N.
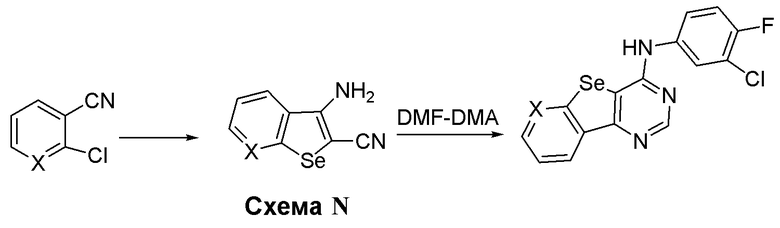
Как показано на схеме N, реакция 2-хлорбензонитрила (X=CH) или 2-хлорпиридин-3-карбонитрила (X=N) с селенидом натрия/хлорацетонитрилом и метоксидом натрия приводит к получению 3-аминоселенофен-2-карбонитрила. Эти селенофеновые производные подвергают взаимодействию с диметилформамид-диметилацеталем в присутствии уксусной кислоты и затем подвергают взаимодействию с 3-хлор-4-фторанилином с получением соединения № 30-31. С помощью этого процесса были синтезированы следующие соединения.
Синтез 4-(ариламино)селенофенопиримидиновых соединений формулы (I), в частности синтез соединения № 32, выполняется с помощью стадий, показанных на схеме О.

Как показано на схеме O, реакцией малононитрила с сероуглеродом в присутствии гидроксида натрия и последующей реакцией с диметилсульфатом получали (бисметилтиометилен)малононитрил (Baraldi, P. G.; Fruttarolo, F.; Tabrizi, M. A.; Preti, D.; Romagnoli, R.; El-Kashef, H.; Moorman, A.; Varani, K.; Gessi, S.; Merighi, S.; Borea, P. A. J. Med. Chem., 2003, 46, 1229-1241; Thomae, D.; Perspicace, E.; Henryon, D.; Xu, Z.; Schneider, S.; Hesse, S.; Kirsch, G.; Seck, P. Tetrahedron, 2009, 65, 10453-10458). Дикарбонитрил взаимодействует с селенидом натрия/этилхлорацетатом, с получением этил-3-амино-4-циано-5-метилтиоселенофен-2-карбоксилата. Это селенофеновое производное подвергают реакции с диметилформамид-диметилацеталем в присутствии уксусной кислоты и затем подвергают взаимодействию с 3-хлор-4-фторанилином с получением соединения № 32.
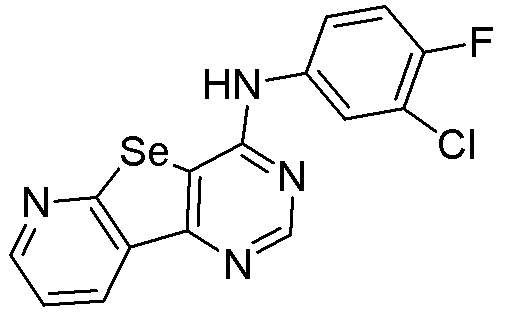
Синтез 4-(ариламино)селенофенопиримидиновых соединений формулы (I), в частности синтеза соединения № 33, выполняется с помощью стадий, показанных на схеме P.
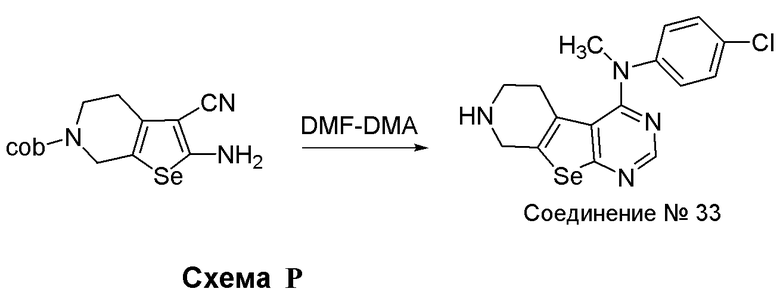
Как показано на схеме P, N-Вос-2-амино-4,5,6,7-тетрагидроселенофено[2,3-с]пиридин-3-карбонитрил (см. схему H) подвергают взаимодействию с диметилформамид-диметилацеталем в присутствии уксусной кислоты и затем подвергают взаимодействию с 4-хлор-N-метиланилином с получением соединения № 33.
Синтез 2-замещенных соединений: Синтез 4-(ариламино)селенофенопиримидиновых соединений формулы (I), в частности синтеза соединения № 34, выполняется с помощью стадий, показанных на схеме Q.
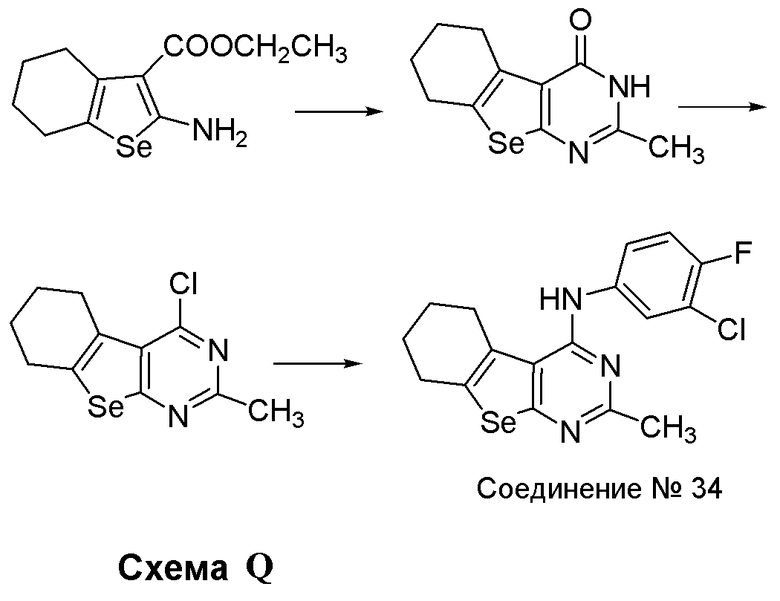
Как показано на схеме Q, реакция этил-2-амино-4,5,6,7-тетрагидробензо[1,2-b]селенофен-3-карбоксилата (Aumann, K.M.; Scammells, P. J.; White, J. M.; Schiesser, C. H. Org. Biomol. Chem., 2007, 5, 1276-1281) с ацетонитрилом в присутствии HCl приводит к получению циклизованного продукта, и в дальнейшей реакции с хлорокисью фосфора получают 4-хлорпроизводное соединение. Это 4-хлорпроизводное соединение нагревают с обратным холодильником с 3-хлор-4-фторанилином в изопропиловом спирте с получением (3-хлор-4-фторфенил)(2-метил(5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-ил)амина.
Для простоты изложения в настоящем документе, предпочтение отдано использованию единственного числа, по сравнению с множественным числом, но это, как правило, подразумевает также включение форм во множественном числе, если не указано иное. Например, выражение "способ лечения заболевания у пациента, включающий введение пациенту эффективного количества соединения формулы (I)" означает одновременное лечение более чем одного заболевания, а также введение более чем одного соединения формулы (I).
Композиции
Настоящее изобретение, в другом аспекте, относится к фармацевтическим композициям, содержащим соединение формулы (I)
Формула (I),
где все группы являются такими, как они определены ранее,
или его фармацевтически приемлемую соль или сольваты, или гидраты, или их стереоизомеры в комбинации с фармацевтически приемлемым эксципиентом(ами) или носителем(ями), или разбавителем(ями).
Фармацевтические композиции, содержащие соединение общей формулы (I) или его фармацевтически приемлемую соль или сольваты, или гидраты, или их стереоизомеры в комбинации с фармацевтически приемлемым эксципиентом(ами) или, носителем(ями), или разбавителем(ями), содержат соединение общей формулы (I) в концентрации, которая находится в диапазоне от 0,01% до 99%.
Фармацевтические композиции содержат соединение общей формулы (I) или его фармацевтически приемлемую соль или сольваты, или гидраты, или их стереоизомеры в комбинации с фармацевтически приемлемым эксципиентом(ами) или носителем(ями), или разбавителем(ями), при этом предпочтительные примеры указанные твердых носителей, разбавителей или эксципиентов включают, но без ограничения, глюкозу, фруктозу, сахарозу, мальтозу, желтый декстрин, белый декстрин, аэросил, микрокристаллическую целлюлозу, стеарат кальция, стеарат магния, сорбит, стевиозид, кукурузный сироп, лактозу, лимонную кислоту, винную кислоту, яблочную кислоту, янтарную кислоту, молочную кислоту, L-аскорбиновую кислоту, dl-альфа-токоферол, глицерин, пропиленгликоль, сложный жирный эфир глицерина, сложный жирный эфир полиглицерина, сложный жирный эфир сахарозы, сложный эфир сорбита, сложный жирный эфир пропиленгликоля, аравийскую камедь, каррагенан, казеин, желатин, пектин, агар, витамины группы В, никотинамид, пантотенат кальция, аминокислоты, соли кальция, красители, ароматизаторы и консерванты; и предпочтительные примеры жидких носителей или разбавителей, или наполнителей включают, но без ограничения, дистиллированную воду, физиологический раствор, водный раствор глюкозы, спирт (например, этанол), пропиленгликоль и полиэтиленгликоль; и жирные носители, такие как различные масла животного и растительного происхождения, белый мягкий парафин, парафин и воск.
Когда соединения по настоящему изобретению вводят в виде фармацевтических препаратов, предназначенных для людей и животных, они могут быть введены per se или в виде фармацевтической композиции, содержащей, например, от 0,01 до 99% соединения формулы (I) в комбинации с фармацевтически приемлемым носителем или разбавителем.
В еще одном аспекте настоящее изобретение относится к способу получения фармацевтической композиции. Способ включает стадию, включающую объединение, по меньшей мере, одного соединения формулы (I), как оно определено выше, с по меньшей мере одним фармацевтически приемлемым носителем или разбавителем, с дальнейшим получением из комбинации подходящей для введения формы.
В другом аспекте фармацевтические композиции по настоящему изобретению могут быть в любой форме, которая обеспечивает введение композиции субъекту. Например, композиция может быть в форме твердого вещества, в форме жидкости или в газообразной форме (аэрозоля). Типичные способы введения включают, но без ограничения, местное введение, парентеральное введение, подъязычное введение, внутрибрюшинное введение (IP), внутривенное введение (IV), оральное введение (PO), внутримышечное введение (IM), внутрикожное введение (IC), интрадермальное (ID), внутриматочное введение и интраректальное введение. Термин "парентеральный", как он использован здесь, включает подкожные инъекции, внутривенные инъекции, внутримышечные инъекции, внутригрудинные инъекции или инфузии. Фармацевтические композиции по изобретению изготавливают таким образом, чтобы при введении композиции пациенту обеспечить биодоступность активных ингредиентов, содержащихся в них. Композиции, которые вводят в форме одной или нескольких дозированных единиц, например, в виде таблетки, могут быть в виде единичной дозированной формы, и могут быть представлены в виде контейнера с соединением формулы (I) в форме для местного применения, где контейнер может содержать множество доз, а также в виде наночастиц различных размеров в составе эмульсии для применения для теплокровного животного, нуждающегося в этом.
Для специалистов в данной области очевидно, что оптимальная доза активного ингредиента(ингредиентов) в фармацевтической композиции будет зависеть от множества факторов. Соответствующие факторы включают, но без ограничения, тип субъекта (например, человека), конкретную форму активного ингредиента, способ введения и состав используемой композиции.
В другом аспекте данное изобретение относится к фармацевтическим композициям, содержащим, по меньшей мере, одно соединение формулы (I)

Формула (I)
где все группы являются такими, как они определены ранее,
или его фармацевтически приемлемую соль или сольваты, или гидраты, или их стереоизомеры, и, по меньшей мере, один ингредиент, выбранный из фармацевтически приемлемого эксципиента, фармацевтически приемлемого разбавителя и фармацевтически приемлемого носителя, и, необязательно, композиции могут дополнительно содержать, по меньшей мере, один противоопухолевый агент.
Противоопухолевый агент выбирается из группы, состоящей из алкилирующих агентов, антиметаболитов, агентов для гормональной терапии, цитотоксических агентов, ингибиторов топоизомеразы, антиангиогенных соединений, антител, ингибиторов VEGF, ингибиторов EGFR (HER1), ингибиторов HER2, ингибиторов CDK, ингибиторов протеасом, ингибиторов серин/треонин-киназ (ингибиторы Raf), ингибиторов тирозинкиназ, антагонистов андрогенных рецепторов и ингибиторов ароматазы. В связи с этим, ниже представлен неограничивающий иллюстративный список вторичных агентов, которые могут быть использованы в комбинации с соединениями по настоящему изобретению.
Алкилирующие агенты включают, но без ограничения, N-оксид азотистого иприта, циклофосфамид, ифосфамид, тиотепу, ранимустин, нимустин, темозоломид, алтретамин, апазиквон, бросталлицин, бендамустин, кармустин, эстрамустин, фотемустин, глюфосфамид, мафосфамид, бендамустин, митолактол, цисплатин, карбоплатин, эптаплатин, лобаплатин, недаплатин, оксалиплатин и сатраплатин.
Антиметаболиты включают, но без ограничения, метотрексат, 6-меркаптопуринрибозид, меркаптопурин, 5-фторурацил, тегафур, доксифлуридин, кармофур, цитарабин, окфосфат цитарабина, эноцитабин, гемцитабин, флударабин, 5-азацитидин, капецитабин, кладрибин, клофарабин, децитабин, эфлорнитин, этинилцитидин, цитозинарабинозид, гидроксимочевину, мельфалан, неларабин, нолатрексед, окфосфат, динатриевую соль пеметрекседома, пентостатин пелитрексол, ралтитрексед, триапин, триметрексат, видарабин, винкристин и винорелбин.
Агенты для гормональной терапии включают, но без ограничения, экземестан, лупрон, анастрозол, доксеркальциферол, фадрозол, форместан, ацетат абиратерона, финастерид, эпристерид, тамоксифена цитрат, фулвестрант, трелстар, торемифен, ралоксифен, лазофоксифен, летрозол, сагопилон, иксабепилон, эпотилон B, винбластин, винфлунин, доцетаксел и паклитаксел.
Цитотоксические агенты, ингибирующие топоизомеразу, включают, но без ограничения, акларубицин, доксорубицин, амонафид, белотекан, камптотецин, 10-гидроксикамптотецин, 9-аминокамптотецин, дифломотекан, иринотекан, топотекан, эдотекарин, эпимбицин, этопозид, эксатекан, гиматекан, луртотекан, митоксантрон, пирамбицин, пиксантрон, рубитекан, собузоксан, тафлупозид.
Антиангиогенные соединения включают, но без ограничения, ацитретин, афлиберцепт, ангиостатин, аплидин, асентар, акситиниб, рецентин, бевацизумаб, бриваниб аланинат, циленгитид, комбретастатин, DAST, эндостатин, фенретинид, галофугинон, пазопаниб, ранибизумаб, ребимастат, ремоваб, ревлимид, сорафениб, ваталаниб, скваламин, сунитиниб, телатиниб, талидомид, украин и витаксин.
Антитела включают, но без ограничения, трастузумаб, цетуксимаб, бевацизумаб, ритуксимаб, тицилимумаб, ипилимумаб, лумиликсимаб, катумаксомаб, атацицепт, ореговомаб и алемтузумаб.
Ингибитор VEGF выбирают из сорафениба, DAST, бевацизумаба, сунитиниба, рецентина, акситиниба, афлиберцепта, телатиниба, бриваниба аланината, ваталаниба, пазопаниба и ранибизумаба.
Ингибитор EGFR (HER1) выбирают из цетуксимаба, панитумумаба, вектибикса, гефитиниба, эрлотиниба и зактима.
Ингибитор HER2 выбирают из лапатиниба, трастузумаба и пертузумаба.
Ингибитор CDK выбирают из росковитина и флавопиридола.
Ингибитор протеасом выбирают из бортезомиба и карфилзомиба.
Ингибитор серин/треонин-киназы включает ингибиторы МЕК и ингибиторы Raf, такие как сорафениб.
Ингибитор тирозинкиназы выбирают из дазатиниба, нилотиниба, DAST, босутиниба, сорафениба, бевацизумаба, сунитиниба, AZD2171, акситиниба, афлиберцепта, телатиниба, иматиниба мезилата, бриваниба аланината, пазопаниба, ранибизумаба, ваталаниба, цетуксимаба, панитумумаба, вектибикса, гефитиниба, эрлотиниба, лапатиниба, тратузумаба и пертузумаба.
Антагонист андрогенных рецепторов выбирают из нандролона деканоата, флуоксиместерона, андроида, простатида, андромустина, бикалутамида, флутамида, апо-ципротерона, апофлутамида, хлормадинона ацетата, андрокура, таби, ципротерона ацетата и нилутамида.
Ингибитор ароматазы выбирают из анастрозола, летрозола, тестолактона экземестана, аминоглютетимида и форместана.
Другие противораковые агенты включают, например, алитретиноин, амплиген, атрасентан бексаротен, бортезомиб, бозентан, кальцитриол, эксисулинд, фотемустин, ибандроновую кислоту, милтефозин, митоксантрон, i-аспарагиназу, прокарбазин, дакарбазин, гидроксикарбамид, пегаспаргазу, пентостатин, тазаротен, велкейду, нитрат галлия, канфосфамид, даринапарсин и третиноин. В предпочтительном варианте осуществления изобретения, соединения по настоящему изобретению могут быть использованы в комбинации со средствами для химиотерапии (т.е. с цитотоксическими агентами), со средствами для антигормональной терапии и/или со средствами для мишенной терапии, такими как другие ингибиторы киназы, ингибиторы mTOR и ингибиторы ангиогенеза.
Соединения по настоящему изобретению также могут быть использованы при лечении рака в комбинации с лучевой терапией и/или с хирургическим вмешательством. Кроме того, соединения формулы (I) могут быть использованы как таковые или в составе композиции при исследованиях и диагностике, или в качестве референсных стандартов и т.п., как хорошо известно в уровне техники для данной области.
В еще одном аспекте настоящее изобретение относится к применению соединения формулы (I), как оно определено выше, для получения фармацевтической композиции для лечения, ингибирования или контролирования клеточного пролиферативного нарушения. В некоторых вариантах осуществления клеточное пролиферативное нарушение представляет собой рак.
Вне зависимости от выбранного пути введения, соединения по изобретению, которые могут быть использованы в соответствующей гидратированной форме и/или в виде фармацевтических композиций по настоящему изобретению, готовят в виде фармацевтически приемлемых дозированных форм обычными способами, известными специалистам из уровня техники для данной области.
Фактические уровни доз и курс введения активных ингредиентов во времени для фармацевтических композиций по изобретению можно варьировать так, чтобы обеспечить получение количества активного ингредиента, которое эффективно для достижения желаемого терапевтического ответа у конкретного пациента, при этом композиции и способ введения не будут токсичны для пациента. Примерный диапазон доз составляет от 0,01 до 100 мг/кг в день или от 0,1 до 150 мг/кг в день.
В некоторых вариантах осуществления изобретения, соединения по настоящему изобретению могут быть использованы в комбинированной терапии, где применяются обычные средства для химиотерапии рака. Обычные средства и схемы лечения лейкемии и других опухолей включают радиацию, лекарственные средства или их комбинации.
Способы применения
Соединения по настоящему изобретению могут быть использованы для ингибирования активности тирозинкиназ, в частности, в том числе для ингибирования HER1 (EGFR), HER2 и VEGF, или для киллинга раковых клеток. Таким образом, как ожидается, соединения формулы (I) будут ценными в качестве терапевтических агентов. Соответственно, настоящее изобретение относится к способу лечения или ингибирования, или контролирования клеточного пролиферативного нарушения у пациента, нуждающегося в таком лечении, где способ включает введение пациенту эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли или изомеров, или их гидратов, или сольватов, где соединения формулы (I) представляет собой следующее.
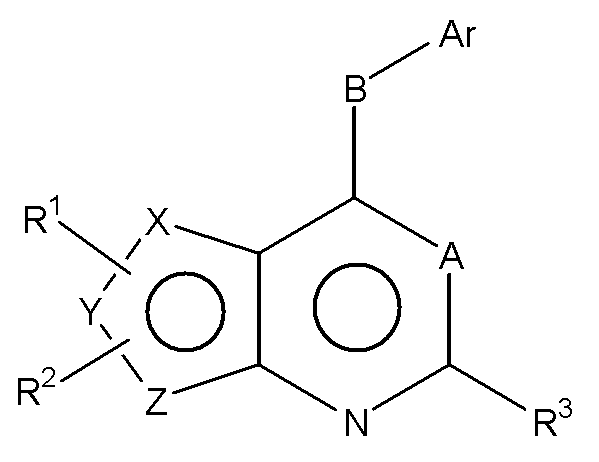
Формула (I)
где
Х представляет собой селен, Y и Z являются атомами углерода;
или
Y представляет собой селен, Х и Z являются атомами углерода;
или
Z представляет собой селен, X и Y являются атомами углерода;
A представляет собой N или C-R4, где R4 выбирается из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалометила, сульфонамида, C1-6алкила, вторичного C1-6алкила, третичного C1-6алкила, C2-6алкенила, C2-6алкинила, C1-4алкилкарбонила, C1-4алкоксикарбонила, аминокарбонила, C1-6алкиламинокарбонила, ди(C1-6алкил)аминокарбонила, галоС1-6алкила, гидроксиС1-6алкила, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкила, C3-7циклоалкокси, C1-6алкиламино, ди(C1-6алкил)амино, аминоС1-6алкила, аминоС1-6алкокси, C1-6алкиламиноС1-6алкила, ди(C1-6алкил)аминоС1-6алкила, C1-6алкилсульфинила и C1-6алкилсульфонила;
В выбирается из S, S(O), S(О2) или NR5, где R5 выбирается из водорода, алкила, алкокси или галоалкила;
Ar представляет собой арильное или гетероарильное кольцо; арил представляет собой бензольное или нафталиновое кольцо, а гетероарил представляет собой 6-членное ароматическое кольцо, содержащее один, два или три атома азота; или гетероарил представляет собой 5-членное ароматическое кольцо, содержащее один или несколько гетероатомов, выбранных из серы, кислорода и азота, при условии, что присутствует не более чем один атом кислорода или серы; при этом такие кольца включают пиридин, пиридазин, пиразин, пиримидин, тиофен, фуран, пиррол, пиразол, имидазол, оксазол, изоксазол, тиазол и изотиазол;
Ar представляет собой кольцо, необязательно замещенное одним, двумя или несколькими группами, независимо выбранными из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалометила, сульфонамида, C1-6алкила, вторичного C1-6алкила, третичного C1-6алкила, C2-6алкенила, C2-6алкинила, C1-4алкилкарбонила, C1-4алкоксикарбонила, аминокарбонила, C1-6алкиламинокарбонила, ди(C1-6алкил)аминокарбонила, галоС1-6алкила, гидроксиС1-6алкила, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкила, C3-7циклоалкокси, C1-6алкиламино, ди(C1-6алкил)амино, аминоС1-6алкила, аминоС1-6алкокси, C1-6алкиламиноС1-6алкила, ди(C1-6алкил)аминоС1-6алкила, C1-6алкилсульфинила, C1-6алкилсульфонила, и представляет собой арильное, гетероарильное и гетероциклоалкильное кольцо; при этом арильное, гетероарильное и гетероциклоалкильное кольцо необязательно замещено галогеном, гидрокси, формилом, карбоновой кислотой, амино, нитро, циано, сульфоновой кислотой, тиолом, тригалометилом, сульфонамидом, C1-6алкилом, C2-6алкенилом, C2-6алкинилом, C1-4алкилкарбонилом, C1-4алкоксикарбонилом, аминокарбонилом, C1-6алкиламинокарбонилом, ди(C1-6алкил)аминокарбонилом, галоС1-6алкилом, гидроксиС1-6алкилом, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкилом, C3-7циклоалкокси, C1-6алкиламином, ди(C1-6алкил)амином, аминоС1-6алкилом, аминоС1-6алкокси, C1-6алкиламиноС1-6алкилом, ди(C1-6алкил)аминоС1-6алкилом, C1-6алкилсульфинилом, C1-6алкилсульфонилом;
R1, R2 и R3 независимо выбираются из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалометила, сульфонамида, C1-6алкила, вторичного C1-6алкила, третичного C1-6алкила, C2-6алкенила, C2-6алкинила, C1-4алкилкарбонила, C1-4алкоксикарбонила, аминокарбонила, C1-6алкиламинокарбонила, ди(C1-6алкил)аминокарбонила, галоС1-6алкила, гидроксиС1-6алкила, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкила, C3-7циклоалкокси, C1-6алкиламино, ди(C1-6алкил)амино, аминоС1-6алкила, аминоС1-6алкокси, C1-6алкиламиноС1-6алкила, ди(C1-6алкил)аминоС1-6алкила, C1-6алкилсульфинила, C1-6алкилсульфонила, и арильного, гетероарильного и гетероциклоалкильного кольца; при этом арильное, гетероарильное или гетероциклоалкильное кольцо необязательно замещено галогеном, гидрокси, формилом, карбоновой кислотой, амино, нитро, циано, сульфоновой кислотой, тиолом, тригалометилом, сульфонамидом, C1-6алкилом, C2-6алкенилом, C2-6алкинилом, C1-4алкилкарбонилом, C1-4алкоксикарбонилом, аминокарбонилом, C1-6алкиламинокарбонилом, ди(C1-6алкил)аминокарбонилом, галоС1-6алкилом, гидроксиС1-6алкилом, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкилом, C3-7циклоалкокси, C1-6алкиламином, ди(C1-6алкил)амином, аминоС1-6алкилом, аминоС1-6алкокси, C1-6алкиламиноС1-6алкилом, ди(C1-6алкил)аминоС1-6алкилом, C1-6алкилсульфинилом, C1-6алкилсульфонилом; или
R1 и R2 независимо выбираются из соединений следующей формулы:
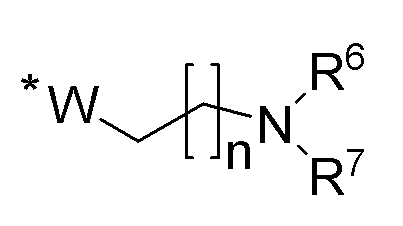
где n представляет собой целое число, выбранное из 0 и из чисел от 1 до 5, при этом n предпочтительно равно 2; * обозначает место присоединения к селенофеновому кольцу в формуле I; W выбирается из CH2, O, S и NH; R6 и R7 независимо выбираются из водорода, амино, тригалометила, C1-6алкила, вторичного C1-6алкила, третичного C1-6алкила, C2-6алкенила, C2-6алкинила, C1-4алкилкарбонила, C1-4алкоксикарбонила, аминокарбонила, C1-6алкиламинокарбонила, ди(C1-6алкил)аминокарбонила, галоС1-6алкила, гидроксиС1-6алкила, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкила, C3-7циклоалкокси, C1-6алкиламино, ди(C1-6алкил)амино, аминоС1-6алкила, аминоС1-6алкокси, C1-6алкиламиноС1-6алкила, ди(C1-6алкил)аминоС1-6алкила;
или
R1 и R2 соединены, и вместе с атомами, к которым они присоединены, они образуют 5-7-членное необязательно замещенное карбоциклическое или пергидрогетероциклическое кольцо, выбранное из соединений формулы:

где n представляет собой целое число, выбранное из чисел от 0 до 4; m представляет собой целое число, выбранное из чисел от 0 до 4; * обозначает место присоединения к R1 и R2 в формуле I; L выбирается из CH2, O, S и NR8, где R8 выбирается из водорода, амино, тригалометила, C1-6алкила, вторичного C1-6алкила, третичного C1-6алкила, C2-6алкенила, C2-6алкинила, C1-4алкилкарбонила, C1-4алкоксикарбонила, аминокарбонила, C1-6алкиламинокарбонила, ди(C1-6алкил)аминокарбонила, галоС1-6алкила, гидроксиС1-6алкила, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкила, C3-7циклоалкокси, C1-6алкиламино, ди(C1-6алкил)амино, аминоС1-6алкила, аминоС1-6алкокси, C1-6алкиламиноС1-6алкила, ди(C1-6алкил)аминоС1-6алкила;
или
R8 выбирается из соединений следующей формулы:
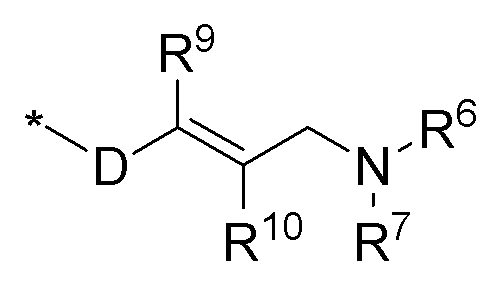
* обозначает место присоединения к N в NR8; где D выбирается из C1-6алкила, -C(=O), -S(=O), -S(=O)2; R9 и R10 выбираются из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалометила, сульфонамида, C1-6алкила, вторичного C1-6алкила, третичного C1-6алкила, C2-6алкенила, C2-6алкинила, C1-4алкилкарбонила, C1-4алкоксикарбонила, аминокарбонила, C1-6алкиламинокарбонила, ди(C1-6алкил)аминокарбонила, галоС1-6алкила, гидроксиС1-6алкила, C1-6алкокси, галоС1-6алкокси, гидроксиС1-6алкокси, C3-7циклоалкила, C3-7циклоалкокси, C1-6алкиламино, ди(C1-6алкил)амино, аминоС1-6алкила, аминоС1-6алкокси, C1-6алкиламиноС1-6алкила, ди(C1-6алкил)аминоС1-6алкила, C1-6алкилсульфинила, C1-6алкилсульфонила; или R6 и R7 соединены, и вместе с атомами, к которым они присоединены, они образуют 5-7-членное необязательно замещенное циклоалкильное или циклогетероалкильное кольцо;
или
R1 и R2 соединены, и вместе с атомами, к которым они присоединены, они образуют необязательно замещенное арильное или необязательно замещенное гетероарильное кольцо, слитое с селенофеном; при этом арил представляет собой бензольное кольцо, и гетероарил представляет собой 6-членное ароматическое кольцо, содержащее один, два или три атома азота; или гетероарил представляет собой 5-членное ароматическое кольцо, содержащее один или несколько гетероатомов, выбранных из серы, кислорода и азота, при условии, что присутствует не более чем один атом кислорода или серы, при этом такие кольца включают пиридин, пиридазин, пиразин, пиримидин, тиофен, фуран, пиррол, пиразол, имидазол, оксазол, изоксазол, тиазол и изотиазол.
Другой аспект настоящего изобретения относится к способу лечения или ингибирования, или контролирования клеточного пролиферативного нарушения у пациента, нуждающегося в таком лечении, включающий введение пациенту эффективного количества композиции, содержащей по меньшей мере одно соединение селенофена формулы (I) или его фармацевтически приемлемой соли, или изомеры, или их гидраты, или сольваты; и по меньшей мере один, выбранный из фармацевтически приемлемого эксципиента, фармацевтически приемлемого разбавителя и фармацевтически приемлемого носителя.
Другой аспект настоящего изобретения относится к способу лечения или ингибирования, или контролирования клеточного пролиферативного нарушения у пациента, нуждающегося в таком лечении, где способ включает введение пациенту эффективного количества композиции, содержащей, по меньшей мере, одно селенофеновое соединение формулы (I) или его фармацевтически приемлемую соль, или его изомеры, или гидраты, или сольваты, и, по меньшей мере, один ингредиент, выбранный из фармацевтически приемлемого эксципиента, фармацевтически приемлемого разбавителя и фармацевтически приемлемого носителя, и композиция необязательно дополнительно содержит по меньшей мере один противоопухолевый агент, выбранный из группы, состоящей из алкилирующих агентов, антиметаболитов, агентов для гормональной терапии, цитотоксических агентов, ингибиторов топоизомеразы, антиангиогенных соединений, антител, ингибиторов VEGF, ингибиторов EGFR (HER1), ингибиторов HER2, ингибиторов CDK, ингибиторов протеасом, ингибиторов серин/треонин-киназы (ингибиторы Raf), ингибиторов тирозинкиназы, ингибиторов андрогенных рецепторов и ингибиторов ароматазы.
В способе лечения или ингибирования, или контролирования клеточного пролиферативного нарушения указанное введение включает пути введения, выбранные из группы, состоящей из внутрибрюшинного введения (IP), внутривенно введения (IV), орального введения (PO), внутримышечного введения (IM), внутрикожного введения (IC), интрадермального введения (ID), внутриматочного введения, внутриопухолевого введения и интраректального введения.
В некоторых вариантах осуществления изобретения, клеточное пролиферативное нарушение представляет собой рак. Термин "лечение", как указано в настоящем документе, используется в обычном смысле, например, для управления состоянием у субъекта или для ухода за субъектом с целью борьбы с заболеванием, облегчения, уменьшения, ослабления симптоматики и улучшение состояния пациента при заболевании или расстройстве, таком, как карцинома или злокачественная опухоль.
Термин "субъект" или "пациент" включает организмы, которые подвержены клеточному пролиферативному нарушению, или которые могут извлечь выгоду от введения соединения по изобретению, такие как люди или животные, не являющиеся человеком. Предпочтительные субъекты включают пациентов-людей, страдающих от клеточного пролиферативного нарушения или связанного с ним патологического состояния, как описано здесь, или склонных к нему. Термин "животные, не являющиеся человеком" включает позвоночных, например, млекопитающих, таких как приматы, исключая человека, овцы, коровы, собаки, кошки и грызуны, например, мыши, и не млекопитающих, таких как кур, амфибий, рептилий и т.п.
Термин "клеточно-пролиферативное расстройство" включает расстройства, связанные с нежелательной или неконтролируемой пролиферацией клеток. Соединения по настоящему изобретению могут быть использованы для предупреждения, ингибирования, блокирования, снижения, уменьшения, контроля (и тому подобного) пролиферации клеток и/или клеточного деления, и/или апоптоза. Этот способ включает введение субъекту, нуждающемуся в этом, в том числе млекопитающему, включая человека, соединения настоящего изобретения или его фармацевтически приемлемой соли, изомера, полиморфа, метаболита, гидрата или сольвата, в количестве, которое является эффективным для лечения или предотвращения нарушения. В контексте данного изобретения клеточно-пролиферативные или гиперпролиферативные нарушения включают, но без ограничения, например, псориаз, келоиды и другие гиперплазии, влияющие на кожу, эндометриоз, скелетные нарушения, ангиогенные нарушения или пролиферативные нарушения кровеносных сосудов, легочную гипертензию, фиброзные нарушения, пролиферативные нарушения мезангиальных клеток, полипы толстой кишки, поликистоз почек, доброкачественную гиперплазию предстательной железы (BHP) и солидные опухоли, такие как рак молочной железы, рак дыхательных путей, рак мозга, рак репродуктивных органов, рак желудочно-кишечного тракта, рак мочевого тракта, рак глаз, рак печени, рак кожи, рак головы и шеи, рак щитовидной железы, рак паращитовидных желез, и их отдаленные метастазы. Эти расстройства также включают лимфомы, саркомы и лейкемии.
Примеры рака молочной железы включают, но без ограничения, инвазивную карциному протоков, инвазивную лобулярную карциному, карциному протоков in situ и лобулярную карциному in situ.
Примеры рака дыхательных путей включают, но без ограничения, мелкоклеточную и немелкоклеточную карциному легких, а также бронхиальную аденому и плевропульмонарную бластому.
Примеры рака мозга включают, но без ограничения, глиому ствола мозга и гипофтальмическую глиому, астроцитому мозжечка и церебральную астроцитому, глиобластому, медуллобластому, эпендимому, а также нейроэктодермальную опухоль и опухоль шишковидного тела. Опухоли мужских репродуктивных органов включают, но без ограничения, рак предстательной железы и рак яичка. Опухоли женских репродуктивных органов включают, но без ограничения, рак эндометрия, рак шейки матки, рак яичников, вагинальный рак и рак вульвы, а также саркому матки.
Опухоли желудочно-кишечного тракта включают, но без ограничения, анальный рак, рак толстой кишки, рак прямой кишки, рак пищевода, рак желчного пузыря, рак желудка, рак поджелудочной железы, ректальный рак, рак тонкого кишечника и рак слюнной железы.
Опухоли мочевых путей включают, но без ограничения, рак мочевого пузыря, рак полового члена, рак почек, рак почечной лоханки, рак мочеточника, рак уретры и папиллярный рака почки человека. Глазные раки включают, но без ограничения, внутриглазную меланому и ретинобластому. Примеры рака печени включают, но без ограничения, гепатоцеллюлярную карциному (карциномы клеток печени с фиброламеллярным вариантом или без него), холангиокарциному (карциному внутрипеченочных желчных протоков) и смешанную гепатоцеллюлярную холангиокарциному.
Раки кожи включают, но без ограничения, плоскоклеточную карциному, саркому Капоши, злокачественную меланому, рак клеток Меркеля кожи и немеланомный рак кожи.
Раки головы и шеи включают, но без ограничения, рак гортани, рак гортаноглотки, рак носоглотки, рак ротоглотки, рак губы и полости рта, и плоскоклеточный рак.
Лимфомы включают, но без ограничения, связанную со СПИДом лимфому, неходжкинскую лимфому, Т-клеточную кожную лимфому, лимфому Беркитта, болезнь Ходжкина и лимфому центральной нервной системы.
Саркомы включают, но без ограничения, саркомы мягких тканей, остеосаркому, злокачественную фиброзную гистиоцитому, лимфосаркому и рабдомиосаркому.
Лейкемии включают, но без ограничения, острую миелобластную лейкемию, острую лимфобластную лейкемию, хроническую лимфоцитарную лейкемию, хронический миелолейкоз и лейкоз ворсистых клеток.
Фиброзные пролиферативные нарушения, т.е. аномальное образование внеклеточного матрикса, которые можно лечить с помощью соединений и способов по настоящему изобретению, включают атеросклероз, рестеноз, цирроз печени, и нарушения, связанные с пролиферацией мезангиальных клеток, в том числе заболевания почек, таких как гломерулонефрит, диабетическую нефропатию, злокачественный нефросклероз, синдромы тромботической микроангиопатии, отторжение трансплантата и гломерулопатии.
Другие патологические состояния у людей или других млекопитающих, которые можно лечить путем введения соединения по настоящему изобретению, включают рост опухоли, ретинопатию, включая диабетическую ретинопатию, ишемическую окклюзию вены сетчатки глаза, ретинопатию недоношенных и возрастную макулярную дегенерацию, ревматоидный артрит, псориаз, и буллезные расстройства, связанные с формированием субэпидермальных волдырей, в том числе буллезный пемфигоид, мультиформную эритему и герпетиформный дерматит.
Соединения по настоящему изобретению также могут быть использованы для профилактики и лечения заболеваний дыхательных путей и легких, заболеваний желудочно-кишечного тракта, а также заболеваний мочевого пузыря и желчных протоков.
Расстройства, упомянутые выше, были хорошо охарактеризованы в случае заболеваний человека, но с аналогичной этиологией они также имеют место у других животных, включая млекопитающих, и их можно лечить путем введения соединения формулы (I) или их фармацевтическими композициями по настоящему изобретению.
Настоящее изобретение содержит приведенные ниже примеры, которые приведены только в качестве иллюстрации и не должны рассматриваться как ограничивающие объем притязаний изобретения. Вариации и изменения, которые являются очевидными для специалистов в данной области техники, находятся в пределах объема и сущности изобретения, которые определены прилагаемой формулой изобретения.
ПРИМЕРЫ
Пример 1
Синтез (3-хлор-4-фторфенил)-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламина (соединение № 1)
Стадия (а):
3,5,6,7,8-пентагидробензо[1,2-b]пиримидино[5,4-d]селенофен-4-он: К раствору 2-амино-4,5,6,7-тетрагидробензо[1,2-b]селенофена-3-карбонитрила (5,4 г), (Abdel-Hafez, Sh.H. Russian J. Org. Chem., 2005, 41, 396-401) в муравьиной кислоте (50 мл) добавляли по каплям в течение 15 мин концентрированную серную кислоту (20 мл). Реакционную смесь перемешивали при температуре 80-90°С в течение 2 часов и оставляли до достижения комнатной температуры. Реакционную смесь выливали в охлажденную льдом воду и перемешивали в течение 15 мин. Выпавшее в осадок твердое вещество отфильтровывали, промывали водой и высушивали, с получением продукта в виде твердого вещества светло-коричневого цвета (4,5 г, 75%), т.пл. 250-260°С. 1H-ЯМР (400 МГц, DMSO-d6): δ 12,32 (1H, с), 7,97 (1H, с), 2,89 (2H, м), 2,82 (2H, м), 1,77 (4H, м); ЖХ-МС (режим отрицательных ионов): m/z 251, 253 (M-H)-.
Стадия (b):
4-хлор-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,4-d]селенофен: Смесь, содержащую соединение (500 мг) со стадии (а), тионилхлорид (5 мл) и каталитическое количество DMF (0,5 мл) кипятили с обратным холодильником в течение 3 часов. Растворители удаляли в вакууме и смесь разбавляли ледяной водой. Раствор экстрагировали хлороформом (3 × 100 мл) и объединенный хлороформный слой промывали водой, бикарбонатом натрия, насыщенным солевым раствором и высушивали над сульфатом натрия. Раствор фильтровали и растворитель выпаривали. Остаток подвергали хроматографии на колонке с силикагелем, используя в качестве элюента смесь гексан-этилацетат (98:2), с получением продукта в виде твердого вещества не совсем белого цвета (450 мг, 84%), т.пл. 100-102°C. 1H-ЯМР (400 МГц, CDCl3): δ 8,65 (1H, с), 3,09-3,12 (2H, м), 2,94-2,98 (2H, м), 1,88-1,94 (4H, м).
Стадия (с):
(3-хлор-4-фторфенил)-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламин: К раствору, содержащему соединение (300 мг, 1,10 ммоль) со стадии (b) в изопропиловом спирте (10 мл) был добавлен 3-хлор-4-фторанилин (640 мг, 4,4 ммоль) при комнатной температуре и смесь нагревали с обратным холодильником в течение 7 часов. Смесь оставляли до достижения комнатной температуры и, затем ее выливали в ледяную воду. Раствор был экстрагирован хлороформом (3 × 100 мл), и объединенный слой хлороформа промывали водой, насыщенным солевым раствором и высушивали над сульфатом натрия. Раствор фильтровали и растворитель выспаривали. Остаток подвергали хроматографии на колонке с силикагелем, используя в качестве элюента смесь гексан-этилацетат (95:5), с получением продукта (370 мг, 88%). Сырой продукт затем перекристаллизовывали из смеси гексан-хлороформ, с получением чистого продукта в виде твердого вещества светло-розового цвета, т.пл. 146-148°C. ИК (чистое вещество) νмакс 3458, 2931, 1605, 1564, 1254, 1195, 1121, 1041, 965 см-1; 1H-ЯМР (400 МГц, DMSO-d6): δ 8,36 (1H, с), 8,20 (1H, с), 7,89 (1H, дд, J=6,8, 2,8 Гц), 7,58-7,62 (1H, м), 7,39 (1H, т, J=9,0 Гц), 3,10 (2H, ушир. с), 2,91 (2H, ушир. с), 1,84 (4H, ушир. с); ЖХ-МС (режим отрицательных ионов): m/z 380, 382 (M-H)-.
Стадия (d):
HCl соль: К раствору, содержащему соединение (100 мг) со стадии (c) в диоксане (5 мл), при комнатной температуре добавляли HCl в диоксане (0,1 мл) до достижения красной окраски бумажного индикатора рН. Раствор перемешивали в течение 15 мин и выделившуюся соль отфильтровывали, промывали диоксаном и высушивали с получением продукта в виде твердого вещества не совсем белого цвета (100 мг). ЖХ-МС (режим отрицательных ионов): m/z 378, 380, 381 (M-HCl+H)-.
Пример 2
Синтез (5-бром(3-пиридил))-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламина (соединение № 2)
Стадия (а):
(5-бром(3-пиридил))-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламин: К раствору 4-хлор-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,4-d]селенофена (500 мг, 1,84 ммоль, со стадии (b) Примера 1) в DMF (10 мл) при комнатной температуре последовательно добавляли 3-амино-5-бромпиридин (380 мг, 2,19 ммоль) и порошкообразный NaOH (220 мг, 5,5 ммоль), и смесь перемешивали при комнатной температуре в течение 36 часов. Смесь выливали в охлажденную льдом воду и перемешивали в течение 10 мин. Выпавший осадок отфильтровывали, промывали водой и высушивали. Неочищенное твердое вещество подвергали хроматографии на колонке с силикагелем, используя в качестве элюента смесь гексан-EtOAc (70:30), с получением продукта в виде твердого вещества не совсем белого цвета (500 мг, 67%), который перекристаллизовывли из ацетонитрила, т.пл. 170-172°C. 1H-ЯМР (400 МГц, CDCl3): δ 8,66 (1H, т, J=2,0 Гц), 8,56 (1H, д, J=2,4 Гц), 8,49 (1H, с), 8,39 (1H, д, J=1,6 Гц), 7,24 (1H, с, взаимообм. D2O), 3,08 (2H, т, J=6,2 Гц), 2,96 (2H, т, J=6,0 Гц), 2,00-2,06 (2H, м), 1,92-1,98 (2H, м); 13C-ЯМР (100 МГц, CDCl3): δ 171,7, 154,7, 151,6, 145,3, 140,8, 140,0, 136,4, 130,3, 126,4, 120,5, 120,0, 28,4, 28,1, 22,7, 22,3; ЖХ-МС (режим положительных ионов): m/z 407, 409, 411 (M+H)+.
Стадия (b):
HCl соль: К раствору, содержащему соединение (100 мг) со стадии (а) в диоксане (10 мл), добавляли HCl в диоксане, как описано в Примере 1, и получали продукт в виде твердого вещества не совсем белого цвета, т.пл. 254-256°С. ЖХ-МС (режим отрицательных ионов): m/z 405, 407, 409 (M-HCl-H)-.
Пример 3
Синтез (2,6-дихлорпиридин-4-ил)-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламина (соединение № 3)
Стадия (a):
(2,6-дихлорпиридин-4-ил)-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламин: К раствору 4-хлор-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,4-d]селенофена (470 мг, 1,72 ммоль, со стадии (b) Примера 1) в DMF (10 мл) при комнатной температуре последовательно добавляли 4-амино-2,6-дихлорпиридин (420 мг, 2,58 ммоль) и порошкообразный NaOH (210 мг, 5,16 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. В результате обработки смеси, как описано в Примере 2, получали продукт в виде твердого вещества бледно-желтого цвета (500 мг, 73%), т.пл. 238-242°С. 1H ЯМР (400 МГц, DMSO-d6): δ 9,00 (1H, с, взаимообм. D2O), 8,62 (1H, с), 7,76 (2H, с), 3,07 (2H, ушир.с), 2,94 (2H, ушир.с), 1,84 (4H, ушир.с); 13C-ЯМР (100 МГц, DMSO-d6): δ 172,3, 153,1, 151,3, 151,0, 149,2, 140,5, 128,3, 122,3, 112,1, 27,7, 26,7, 22,6, 21,9; ЖХ-МС (режим отрицательных ионов): m/z 395, 397, 399 (M-H)-.
Стадия (b):
HCl соль: К раствору, содержащему соединение (90 мг) со стадии (а) в диоксане (10 мл), добавляли HCl в диоксане и проводили обработку, как описано в Примере 1, с получением продукта в виде твердого вещества бледно-желтого цвета, т.пл. 286-290°C. ЖХ-МС (режим отрицательных ионов): m/z 395, 397, 399, 401 (M-HCl-H)-.
Пример 4
Синтез (2,6-дихлорпиримидин-4-ил)-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламина (соединение № 4)
Стадия (а):
(2,6-дихлорпиримидин-4-ил)-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламин: К раствору, содержащему 4-хлор-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,4-d]селенофен (500 мг, 1,83 ммоль, со стадии (b) Примера 1) в DMF (10 мл), при комнатной температуре последовательно добавляли 4-амино-2,6-дихлорпиримидин (450 мг, 2,75 ммоль) и порошкообразный NaOH (220 мг, 5,50 ммоль). В результате обработки смеси, как описано в Примере 2, получали продукт в виде твердого вещества не совсем белого цвета (500 мг, 68%), т.пл. 268-270°С. 1H-ЯМР (400 МГц, CDCl3): δ 8,67 (1H, с), 8,64 (1H, с), 8,23 (1H, с, взаимообм. D2O), 3,11 (2H, т, J=6,1 Гц), 2,97 (2H, т, J=6,1 Гц), 2,01-2,06 (2H, м), 1,92-1,98 (2H, м); 13C-ЯМР (100 МГц, CDCl3): δ 172,9, 162,7, 160,0, 159,2, 152,4, 151,0, 142,7, 126,3, 121,3, 107,8, 28,3, 28,2, 22,7, 22,4; ЖХ-МС (режим отрицательных ионов): m/z 396, 398, 400, 402 (M-H)-.
Стадия (b):
HCl соль: К раствору, содержащему соединение (90 мг) со стадии (а) в диоксане (20 мл), добавляли HCl в диоксане, и проводили обработку, как описано в Примере 1, получая продукт в виде твердого вещества белого цвета, т.пл. 282-284°C. ЖХ-МС (режим отрицательных ионов): m/z 396, 398, 400, 402 (M-HCl-H)-.
Пример 5
Синтез пиразин-2-ил-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламина (соединение № 5)
Стадия (a):
Пиразин-2-ил-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламин: К раствору, содержащему 4-хлор-5,6,7,8-тетрагидробензо[1,2-b] пиримидино[5,4-d] селенофен (600 мг, 2,20 ммоль, со стадии (b) Примера 1) в DMF (10 мл), при комнатной температуре последовательно добавляли 4-аминопиразин (310 мг, 3,30 ммоль) и порошкообразный NaOH (260 мг, 6,60 ммоль). В результате обработки, как описано в Примере 2, получали продукт в виде твердого вещества светло-желтого цвета (470 мг, 65%), т.пл. 192-194ºC. 1H-ЯМР (400 МГц, CDCl3): δ 9,94 (1H, с), 8,56 (1H, с), 8,29 (1H, с), 8,23 (1H, с), 7,93 (1H, с, взаимообм. D2O), 3,14 (2H, с), 2,96 (2H, с), 2,01 (2H, с), 1,95 (2H, с); 13C-ЯМР (100 МГц, CDCl3): δ 171,9, 153,4, 151,5, 149,1, 141,9, 138,8, 137,7, 126,7, 120,1, 28,2, 28,1, 22,7, 22,5; ЖХ-МС (режим отрицательных ионов): m/z 328, 330 (M-H)-.
Стадия (b):
HCl соль: К раствору, содержащему соединение (70 мг) со стадии (а) в хлороформе (5 мл), добавляли HCl в диоксане, и проводили обработку, как описано в Примере 1, получая продукт в виде твердого вещества не совсем белого цвета (70 мг, 91%), т.пл. 222-224°С. ЖХ-МС (режим положительных ионов): m/z 330, 332 (M-HCl+H)+.
Пример 6
Синтез (2,5-дибром(3-тиенил)-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламина (соединение № 6)
Стадия (a):
N-(2,5-дибромтиофен-3-ил)ацетамид: К охлажденному льдом раствору, содержащему 2,5-дибром-3-нитротиофен (5,0 г, 17,4 ммоль; DellErba, C.; Spinelli, D. Tetrahedron, 1965, 21, 1061-1066) в уксусной кислоте/уксусном ангидриде (1:1, 50 мл), медленно добавляли порошок железа (5,8 г, 104,5 ммоль) в течение 15 мин и перемешивали при комнатной температуре в течение 4 часов. После завершения реакции, реакционную смесь выливали в ледяную воду (500 мл) и перемешивали в течение 15 мин. Выпавший осадок отфильтровывали, промывали водой и высушивали. Неочищенный продукт подвергали хроматографии на колонке с силикагелем с использованием в качестве элюента смеси гексан-этилацетат (95:5), с получением продукта в виде твердого вещества белого цвета (3,0 г, 58%), т.пл. 114-116ºС. 1H-ЯМР (400 МГц, CDCl3): δ 7,78 (1H, с), 7,21 (1H, с), 2,20 (3H, с).
Стадия (b):
2,5-дибромтиофен-3-амин гидрохлорид: Смесь, содержащую соединение (3,0 г) со стадии (а) и HCl в метаноле (2н, 30 мл), перемешивали при комнатной температуре в течение 3 часов. Отделившийся твердый осадок отфильтровывали, промывали метанолом и высушивали с получением продукта в виде твердого вещества белого цвета (2,0 г, 67%), т.пл. 150-160°С. 1H-ЯМР (400 МГц, DMSO-d6): δ 8,32 (1H, с), 6,76-7,17 (3H, м); ЖХ-МС (режим положительных ионов): m/z 256, 258, 260 (M-HCl+H)+.
Стадия (с):
(2,5-дибром(3-тиенил)-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламин: К раствору, содержащему 4-хлор-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,4-d]селенофен (500 мг, 1,82 ммоль, со стадии (b) Примера 1) в DMF (10 мл), при комнатной температуре последовательно добавляли 2,5-дибромтиофен-3-амин (700 мг, 2,75 ммоль, указанная выше соль, полученная на стадии (b) после подщелачивания) и порошкообразный NaOH (220 мг, 5,5 ммоль). Обработкой этой смеси, как описано в Примере 2, получали продукт в виде твердого вещества коричневого цвета, т.пл. 184-186°С. 1H-ЯМР (400 МГц, CDCl3): δ 8,45 (1H, с), 8,09 (1H, с), 7,49 (1H, с, взаимообм. D2O), 3,14 (2H, т, J=6,0 Гц), 2,94 (2H, т, J=6,0 Гц), 1,98-2,04 (2H, м), 1,90-1,96 (2H, м); 13C-ЯМР (100 МГц, CDCl3): δ 171,5, 154,0, 151,8, 140,0, 136,4, 126,8, 126,7, 119,6, 110,4, 94,8, 28,5, 28,1, 22,7, 22,7; ЖХ-МС (режим положительных ионов): m/z 490, 492, 494, 496 (M+H)+.
Стадия (d):
Соль HCl: К раствору, содержащему соединение (80 мг) со стадии (с) в диоксане (10 мл), добавляли HCl в диоксане и проводили обработку, как описано в Примере 1, с получением продукта в виде твердого вещества коричневого цвета (80 мг), т.пл. 240°C. ЖХ-МС (режим положительных ионов): m/z 490, 492, 494, 496 (M-HCl+H)+.
Пример 7
Синтез (5-трет-бутил)-3-(5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламино)тиофен-2-карбоксамида (соединение № 7)
Стадия (а):
5-трет-бутил-3-аминотиофен-2-карбонитрил: К суспензии сульфида натрия (3,26 г, 41,8 ммоль) в DMF (42 мл) добавляли раствор 3-хлор-4,4-диметилпент-2-еннитрила (6,0 г, 41,8 ммоль, Ohta, H.; Ishizaka, T.; Tatsuzuki, M.; Yoshinaga, M.; Iida, I.; Yamaguchi, T.; Tomishima, Y.; Futaki, N.; Toda, Y.; Saito, S. Bioorg. Med. Chem., 2008, 16, 1111-1124) в DMF (21 мл) при комнатной температуре в течение 5 мин и смесь перемешивали при 70-80ºС в течение 2 часов. Затем к реакционной смеси добавляли по каплям хлорацетонитрил (5,3 мл, 83,6 ммоль) и снова перемешивали при 70-80ºС в течение 2 часов. Затем добавляли по каплям раствор метоксида натрия (2,26 г, 41,8 ммоль) в безводном метаноле (42 мл) и перемешивание продолжали в течение 2 часов при той же температуре. Смесь оставляли охлаждаться до комнатной температуры, выливали в холодную воду и перемешивали в течение 30 мин. Раствор экстрагировали хлороформом (3 × 100 мл) и объединенные хлороформные слои промывали водой, насыщенным солевым раствором и высушивали над сульфатом натрия. Раствор фильтровали и растворитель выпаривали. Остаток подвергали хроматографии на колонке с силикагелем с использованием в качестве элюента смеси гексан-этилацетат (90:10) с получением продукта в виде твердого вещества светло-коричневого цвета (4,9 г, 65%), т.пл. 118-122ºС. 1H-ЯМР (400 МГц, CDCl3): δ 6,32 (1H, с), 4,37 (2H, ушир. с), 1,33 (9H, с); ЖХ-МС (режим отрицательных ионов): m/z 179 (M-H)-.
Стадия (b):
5-трет-бутил-3-аминотиофен-2-карбоксамид: К раствору, содержащему соединение (3,8 г) со стадии (а) в этаноле (100 мл), добавляли водный раствор гидроксида натрия (38 мл, 10%) и смесь кипятили с обратным холодильником в течение 1 часа. Этанол отгоняли в вакууме, смесь выливали в ледяную воду и перемешивали в течение 15 мин. Выпавшие кристаллы отфильтровывали, промывали холодной водой и высушивали с получением продукта в виде твердого вещества бледно-желтого цвета (3,2 г, 77%), т.пл. 152-156°С. 1H-ЯМР (400 МГц, DMSO-d6): δ 6,67 (2H, с), 6,38 (1H, с), 6,32 (2H, с), 1,28 (9H, с); ЖХ-МС (режим положительных ионов): m/z 199 (M+H)+.
Стадия (c):
(5-трет-бутил)-3-(5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламино)тиофен-2-карбоксамид: К раствору 4-хлор-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,4-d]селенофена (700 мг, 2,57 ммоль, со стадии (b) Примера 1) в DMF (10 мл) были последовательно добавлены 5-трет-бутил-3-аминотиофен-2-карбоксамид (700 мг, 3,6 ммоль) и порошкообразный NaOH (310 мг, 7,7 ммоль) при комнатной температуре. Смесь подвергали обработке, как описано в Примере 2, с получением продукта в виде твердого вещества желтого цвета, т.пл. 240-244ºC. 1H-ЯМР (400 МГц, DMSO-d6): δ 11,38 (1H, с, взаимообм. D2O), 8,45 (1H, с), 8,27 (1H, с), 7,53 (2H, с, взаимообм. D2O), 3,15 (2H, ушир. с), 2,90 (2H, ушир. с), 1,84-1,85 (4H, м), 1,39 (9H, с); 13C-ЯМР (100 МГц, DMSO-d6): δ 170,9, 166,1, 158,0, 153,1, 151,4, 143,4, 138,2, 128,2, 119,5, 119,2, 109,2, 34,5, 31,7, 27,7, 27,4, 22,4, 22,1; ЖХ-МС (режим положительных ионов): m/z 433, 435 (M+H)+.
Пример 8
Синтез 5-(трет-бутил)-2-(5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламино)фуран-3-карбонитрила (соединение № 8)
К раствору, содержащему 4-хлор-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,4-d]селенофен (500 мг, 1,83 ммоль, со стадии (b) Примера 1) в DMF (15 мл), при комнатной температуре последовательно добавляли 2-амино-5-трет-бутилфуран-3-карбонитрил (300 мг, 1,83 ммоль) и порошкообразный NaOH (210 мг, 5,49 ммоль). В результате обработки, как описано в Примере 2, получали продукт в виде твердого вещества желтого цвета (400 мг, 55%), т.пл. 230-232°С. 1H-ЯМР (400 МГц, CDCl3): δ 9,78 (1H, с, H-2), 6,94 (1H, ушир. с, взаимообм. D2O, -NH), 6,35 (1H, с, H-4'), 3,30-3,31 (2H, м, H-8), 2,95 (2H, ушир. с, H-5), 1,90-1,92 (4H, м, H-6,7), 1,38 (9H, с, трет-бутил); 13C-ЯМР (100 МГц, CDCl3): δ 163,2, 161,7, 158,0, 154,0, 144,7, 142,9, 137,1, 133,8, 125,9, 101,4, 97,8, 33,0, 29,0, 28,8, 28,4, 23,1, 22,5; ЖХ-МС (режим положительных ионов): m/z 399, 401 (M+H)+.
Пример 9
Синтез 5-фенил-2-(5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламино)фуран-3-карбонитрила (соединение № 9)
К раствору, содержащему 4-хлор-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,4-d]селенофен (250 мг, 0,917 ммоль, со стадии (b) Примера 1) в DMF (10 мл), при комнатной температуре последовательно добавляли 2-амино-5-фенилфуран-3-карбонитрил (160 мг, 0,917 ммоль, Matsuda, T.; Yamagata, K.; Tomioka, Y.; Yamazaki, M. Chem. Pharm. Bull., 1985, 33, 937-943) и порошкообразный NaOH (110 мг, 2,751 ммоль). В результате обработки, как описано в Примере 2, получали продукт в виде твердого вещества желтого цвета (300 мг, 78%), т.пл. 252-256ºС (с разложением). 1H-ЯМР (400 МГц, CDCl3): δ 9,82 (1H, с, H-2), 7,78-7,81 (2H, м, фенол), 7,41-7,45 (2H, м, фенол), 7,31-7,35 (1H, м, фенол), 7,16 (1H, ушир. с, взаимообм. D2O, -NH), 7,01 (1H, с, H-4'), 3,35 (2H, ушир. с, H-8), 2,98 (2H, ушир. с, H-5), 1,93-1,95 (4H, м, H-6,7); 13C-ЯМР (100 МГц, CDCl3): δ 162,3, 158,6, 153,7, 151,9, 145,3, 143,3, 137,0, 133,9, 129,5, 128,9, 128,4, 126,1, 124,3, 102,7, 100,1, 29,1, 28,4, 23,1, 22,5; ЖХ-МС (режим положительных ионов): m/z 419, 421 (M+H)+.
Пример 10
Синтез 2-метилтио-4-(5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламино)-1,3-тиазол-5-карбонитрила (соединение № 10)
Стадия (а):
2-метилтио-4-(5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламино)-1,3-тиазол-5-карбонитрил: К раствору, содержащему 4-хлор-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,4-d]селенофен (250 мг, 0,917 ммоль) в DMF (8 мл), при комнатной температуре последовательно добавляли 4-амино-2-метилтио-тиазол-5-карбонитрил (235 мг, 1,376 ммоль; Thomae, D.; Perspicace, E.; Hesse, S.; Kirsch, G.; Seck, P. Tetrahedron, 2008, 64, 9309-9314) и порошкообразный NaOH (110 мг, 2,751 ммоль). В результате обработки, как описано в Примере 2, получали продукт в виде твердого вещества желтого цвета (300 мг, 81%), т.пл. 264-266ºС (с разложением). 1H-ЯМР (400 МГц, CDCl3): δ 9,72 (1H, с, H-2), 6,75 (1H, с, взаимообм. D2O, -NH), 3,38 (2H, ушир. с, H-8), 2,98 (2H, ушир. с, H-5), 2,82 (3H, с,-SCH3), 1,91 (4H, ушир. с, H-6,7); ЖХ-МС (режим положительных ионов): m/z 406, 408 (M+H)+.
Стадия (b):
Соль HCl: К раствору, содержащему соединение (80 мг) со стадии (а) в диоксане (20 мл), добавляли HCl в диоксане и проводили обработку, как описано в Примере 1, с получением продукта в виде твердого вещества бледно-желтого цвета (60 мг), т.пл. >340ºС. ЖХ-МС (режим положительных ионов): m/z 406, 408 (M-HCl+H)+.
Пример 11
Синтез (2-метилтио-5-нитро-(1,3-тиазол-4-ил))-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламина (соединение № 11)
К раствору, содержащему 4-хлор-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,4-d]селенофен (420 мг, 1,57 ммоль) в DMF (8 мл), при комнатной температуре последовательно добавляли 2-(метилтио)-5-нитротиазол-4-амин (300 мг, 1,57 ммоль) и порошкообразный NaOH (180 мг, 4,71 ммоль). В результате обработки, как описано в Примере 2, получали продукт в виде твердого вещества желтого цвета, т.пл. 204-206ºС. 1H-ЯМР (400 МГц, CDCl3): δ 10,52 (1H, с, взаимообм. D2O,-NH), 8,73 (1H, с, H-2), 3,11 (2H, т, J=5,2 Гц, H-8), 2,98 (2H, т, J=5,0 Гц, H-5), 2,75 (3H, с, -SCH3), 1,92-1,98 (4H, м, H-6,7); 13C-ЯМР (100 МГц, CDCl3): δ 176,9, 173,7, 152,2, 151,6, 151,1, 150,9, 142,7, 127,4, 124,1, 28,4, 28,0, 22,8, 22,5, 16,1; ЖХ-МС (режим положительных ионов): m/z 426, 428 (M+H)+.
Пример 12
Синтез 4-(5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламино)бензолсульфонамида (соединение № 12)
К раствору, содержащему 2-амино-4,5,6,7-тетрагидробензо[b]селенофена-3-карбонитрил (1,5 г, 6,637 ммоль; Abdel-Hafez, Sh.H. Russian J. Org. Chem., 2005, 41, 396-401) в толуоле (20 мл), последовательно добавляли уксусную кислоту (0,1 мл) и диметилформамид-диметилацеталь (DMF-DMA) (1,65 г, 13,93 ммоль). Реакционную смесь перемешивали при 105°С в течение 3 часов. При перемешивании удаляли метанол с использованием насадки Дина-Старка. Толуол выпаривали под вакуумом, получая коричневую жидкость. Остаток растворяли в уксусной кислоте (15 мл) и сульфонамиде (1,14 г, 6,637 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 6 часов. Реакционную смесь охлаждали до комнатной температуры. Образовавшийся твердый осадок отфильтровывали, промывали водой и высушивали с получением продукта в виде твердого вещества не совсем белого цвета (1,8 г, 66%), т.пл. 298-302ºС. 1H-ЯМР (400 МГц, DMSO-d6): δ 8,46 (1H, с, взаимообм. D2O), 8,42 (1H, с), 7,78 (4H, с), 7,23 (2H, с, взаимообм. D2O), 3,12 (2H, с), 2,92 (2H, с), 1,85 (4H, м); 13C-ЯМР (100 МГц, CDCl3): δ 171,2, 154,8, 151,3, 142,7, 138,7, 137,7, 128,6, 126,3, 120,8, 120,5, 27,8, 27,0, 22,6, 22,0; ЖХ-МС (режим отрицательных ионов): m/z 405, 407 (M-H)-.
Пример 13
Синтез [5-(трет-бутил)селенофено[3,2-e]пиримидин-4-ил](3-хлор-4-фторфенил)амина (соединение № 13)
Стадия (а):
2-амино-4-(трет-бутил)селенофен-3-карбонитрил: К раствору, содержащему 2-циано-3,4,4-триметил-2-пентеннитрил (2 г, 13,5 ммоль; Prout, F. S. J. Org. Chem., 1953, 18, 928-933) в THF (20 мл), при комнатной температуре последовательно добавляли селен (1,06 г, 13,5 ммоль) в виде порошка и диэтиламин (14 мл, 135 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 6 часов и давали охладиться до комнатной температуры. Реакционную смесь выливали в ледяную воду и перемешивали в течение 15 мин. Раствор экстрагировали хлороформом (3 × 100 мл) и объединенные органические слои промывали водой, насыщенным солевым раствором и высушивали над сульфатом натрия. Раствор отфильтровывали и растворитель выпаривали. Остаток подвергали хроматографии на колонке с силикагелем с использованием в качестве элюента смеси гексан:этилацетат (90:10) с получением продукта в виде твердого вещества не совсем белого цвета (1,5 г, 50%), т.пл. 90-94°С. 1H-ЯМР (400 МГц, CDCl3): δ 6,50 (1H, с), 5,11 (2H, ушир. с), 1,35 (9H, с).
Стадия (b):
[5-(трет-бутил)селенофено[3,2-e]пиримидин-4-ил](3-хлор-4-фторфелил)амин: К раствору, содержащему соединение (1,0 г, 4,4 ммоль) со стадии (а) в толуоле (20 мл), добавляли последовательно уксусную кислоту (0,1 мл) и DMF-DMA (1,16 мл, 8,8 ммоль). Реакционную смесь перемешивали при 105°С в течение 3 часов и обрабатывали 3-хлор-4-фторанилином. В результате обработки этой реакционной смеси, как описано в Примере 12, получали продукт в виде твердого вещества не совсем белого цвета, т.пл. 170-172°С. ИК (KBr) νмакс 3477, 2965, 1558, 1490, 1250, 1189, 1128, 1041, 965, 888, 784 см-1; 1H-ЯМР (400 МГц, CDCl3): δ 8,51 (1H, с), 7,86 (1H, дд, J=6,6, 2,6 Гц), 7,75 (1H, с), 7,44-7,48 (2H, м), 7,16 (1H, т, J=8,8 Гц), 1,65 (9H, с); 13C-ЯМР (100 МГц, CDCl3): δ 175,4, 155,0, 154,8 (д, J=245 Гц), 151,8, 145,1, 135,1 (д, J=3,0 Гц), 123,8, 118,5, 116,7 (д, J=22 Гц), 121,2 (д, J=18 Гц), 121,2 (д, J=7 Гц), 121,2, 35,2, 32,1; ЖХ-МС (режим положительных ионов): m/z 382, 384, 386 (M+H)+.
Стадия (с):
HCl соль: К раствору, содержащему соединение (100 мг) со стадии (b) в диоксане (5 мл), добавляли HCl в диоксане и проводили обработку, как описано в Примере 1, с получением продукта в виде твердого вещества не совсем белого цвета (80 мг), т.пл. 256-260ºС; ЖХ-МС (режим отрицательных ионов): m/z 380, 382, 383 (M-H-HCl)-.
Пример 14
Синтез (3-хлор-4-фторфенил)(5-селенофено[3,2-e]пиримидин-4-ил]амина (соединение № 14)
Стадия (a):
2-амино-4-фенилселенофен-3-карбонитрил: К раствору, содержащему 2-[1-(фенил)этилиден]малононитрил (1 г, 5,95 ммоль; Barnes, D. M.; Haight, A. R.; Hameury, T.; McLaughlin, M. A.; Mei, J.; Tedrow, J. S.; Toma, J. D. R. Tetrahedron, 2006, 62, 11311-11319) в THF (20 мл), при комнатной температуре последовательно добавляли порошкообразный селен (0,47 г, 5,95 ммоль) и диэтиламин (6,2 мл, 59,5 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 3 часов и давали охладиться до комнатной температуры. В результате обработки этой реакционной смеси, как описано в Примере 13, получали продукт в виде твердого вещества красного цвета (700 мг, 47%). 1H-ЯМР (400 МГц, CDCl3): δ 7,53-7,55 (2H, м), 7,33-7,42 (3H, м), 6,86 (1H, с), 5,26 (2H, ушир. с); 13C-ЯМР (100 МГц, CDCl3): δ 168,0, 141,7, 135,8, 128,6, 128,1, 127,5, 116,6, 109,6.
Стадия (b):
(3-хлор-4-фторфенил)(5-фенилселенофено[3,2-е]пиримидин-4-иламин: К раствору, содержащему соединение (0,5 г, 2,02 ммоль) со стадии (а) в толуоле (20 мл), последовательно добавляли уксусную кислоту (0,1 мл) и DMF-DMA (0,6 мл, 4,23 ммоль). Реакционную смесь перемешивали при 105°С в течение 2 часов и обрабатывали 3-хлор-4-фторанилином (351 мг, 2,45 ммоль), как описано в Примере 12, с получением продукта в виде твердого вещества не совсем белого цвета, т.пл. 198-200ºС. ИК (KBr) νмакс 3480, 3381, 3058, 1609, 1495, 1427, 1254, 1193, 1129, 966 см-1; 1H-ЯМР (400 МГц, CDCl3): δ 8,57 (1H, с), 7,76 (1H, с), 7,64 (1H, дд, J=6,6, 2,6 Гц), 7,57-7,60 (3H, м), 7,51-7,53 (2H, м), 6,98 (1H, т, J=8,8 Гц), 6,87-6,91 (1H, м), 6,71 (1H, ушир. с); 13C-ЯМР (100 МГц, CDCl3): δ 172,6, 155,5, 154,2 (д, J=244 Гц), 152,8, 137,5, 136,5, 135,1 (д, J=3,0 Гц), 129,5, 129,3, 129,2, 125,6, 122,2, 120,9 (д, J=18 Гц), 119,6 (д, J=7 Гц), 117,2, 116,4 (д, J=22 Гц); ЖХ-МС (режим положительных ионов): m/z 402, 404, 406 (M+H)+.
Пример 15
Синтез 4-[(3-хлор-4-фторфенил)амино-5-метилселенофено[2,3-d]пиримидин-6-карбоновой кислоты (соединение № 15)
Стадия (а):
Этил-5-амино-4-циано-3-метилселенофен-2-карбоксилат: К раствору, содержащему этиловый эфир ацетоуксусной кислоты (5 г, 38,46 ммоль) в этаноле (100 мл), при комнатной температуре последовательно добавляли малононитрил (2,53 г, 38,46 ммоль), селен (3,07 г, 38,46 ммоль) в виде порошка и диэтиламин (28 мл, 384 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 4 часов и проводили обработку, как описано в Примере 1, с получением продукта в виде твердого вещества бледно-желтого цвета, т.пл. 208-210ºС. ИК (KBr) νмакс 3381, 3203, 2203, 1666, 1643, 1489, 1382, 1263, 1182, 1100 см-1; 1H-ЯМР (400 МГц, CDCl3): δ 5,47 (2H, ушир. с), 4,26 (2H, кв., J=7,1 Гц), 2,49 (3H, с), 1,33 (3H, т, J=7,1 Гц); ЖХ-МС (режим отрицательных ионов): m/z 255, 257 (M-H)-.
Стадия (b):
Этил-4-[(3-хлор-4-фторфенил)амино]-5-метилселенофено[2,3-d]пиримидин-6-карбоксилат: К раствору, содержащему соединение (2,0 г, 7,75 ммоль) со стадии (а) в толуоле (200 мл), последовательно добавляли уксусную кислоту (0,3 мл) и DMF-DMA (1,93 г, 16,27 ммоль). Реакционную смесь перемешивали при 105°С в течение 2 часов и обрабатывали 3-хлор-4-фторанилином (2,3 г, 15,5 ммоль), как описано в Примере 12, с получением продукта в виде твердого вещества не совсем белого цвета (2,1 г, 65%), т.пл. 152-154ºС. 1H-ЯМР (400 МГц, CDCl3): δ 8,53 (1H, с), 7,82 (1H, дд, J=6,4, 2,8 Гц), 7,41-7,45 (2H, м), 7,17 (1H, т, J=8,6 Гц), 4,37 (2H, кв., J=7,2 Гц), 3,09 (3H, с), 1,41 (3H, т, J=7,2 Гц); ЖХ-МС (режим отрицательных ионов): m/z 410, 412, 414 (M-H)-.
Стадия (с):
4-[(3-хлор-4-фторфенил)амино]-5-метилселенофено[2,3-d]пиримидин-6-карбоновая кислота: К раствору, содержащему соединение (1,0 г, 2,42 ммоль) со стадии (b) в метаноле (100 мл), добавляли раствор гидроксида натрия (200 мг, 4,84 ммоль) в воде (10 мл) и перемешивали при комнатной температуре в течение 16 часов. Смесь выливали в ледяную воду и экстрагировали хлороформом (3 × 50 мл) для удаления примесей. Водный раствор подкисляли разбавленной HCl и перемешивали в течение 15 мин. Выпавший осадок отфильтровывали, промывали водой и высушивали с получением продукта в виде твердого вещества не совсем белого цвета (670 мг, 73%), т.пл. 300-302°С. ИК (KBr) νмакс 3433, 2360, 1680, 1603, 1555, 1494, 1446, 1260, 1173, 1056, 996, 818, 745 см-1; 1H-ЯМР (400 МГц, DMSO-d6): δ 13,55 (1H, ушир. с), 8,67 (1H, с), 8,49 (1H, с), 7,90-7,92 (1H, м), 7,62-7,64 (1H, м), 7,45 (1H, т, J=9,0 Гц), 3,02 (3H, с); 13C-ЯМР (100 МГц, DMSO-d6): δ 171,9, 164,9, 157,5, 153,9, 153,8 (д, J=242,0 Гц), 140,9, 135,9 (д, J=3,0 Гц), 127,6, 124,7, 123,6 (д, J=7,0 Гц), 121,0, 118,9 (д, J=18,0 Гц), 116,5 (д, J=22,0 Гц), 16,8; ЖХ-МС (режим отрицательных ионов): m/z 382, 384, 386 (M-H)-.
Стадия (d):
Натриевая соль: К раствору, содержащему соединение (50 мг, 0,125 ммоль) со стадии (с), в смеси THF-метанол (4 мл, 1:1) добавляли при комнатной температуре метанольный раствор гидроксида натрия (6 мг, 0,155 ммоль в метаноле, 0,6 мл) и перемешивали в течение 30 мин. Раствор выпаривали при пониженном давлении и высушивали в высоком вакууме с получением продукта в виде твердого вещества бледно-желтого цвета (46 мг), т.пл. 350-352°С. ЖХ-МС (режим отрицательных ионов): m/z 382, 384, 386 (M-Na)-.
Пример 16
Синтез (3-хлор-4-фторфенил)(6-метил-5-фенилселенофено[3,2-e]пиримидин-4-ил]амина (соединение № 16)
Стадия (а):
2-амино-5-метил-4-фенилселенофен-3-карбонитрил: К раствору, содержащему 2-(1-фенилпропилиден)малононитрил (5,0 г, 27,47 ммоль; Karlsen, H.; Songe, P. H.; Sunsby, L. K.; Hagen, L. C.; Kolsaker, P.; Romming, C. J. Chem. Soc., Perkin Trans. 1, 2001, 497-507) в THF (160 мл), при комнатной температуре последовательно добавляли порошкообразный селен (2,19 г, 27,47 ммоль) и диэтиламин (28,64 мл, 274,72 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 8 часов и давали охладиться до комнатной температуры. В результате обработки этой реакционной смеси, как описано в Примере 13, получали продукт (3,0 г, 41%). ИК (KBr) νмакс 3403, 3323, 2972, 2194, 1611, 1511, 1439, 1365, 1302, 1122, 906, 770 см-1; 1H-ЯМР (400 МГц, CDCl3): δ 7,40-7,44 (2H, м), 7,31-7,37 (3H, м), 4,99 (2H, ушир. с), 2,30 (3H, с); ЖХ-МС (режим отрицательных ионов): m/z 261 (M-H)-.
Стадия (b):
(3-хлор-4-фторфенил)(6-метил-5-фенилселенофено[3,2-e]пиримидин-4-ил]амин: К раствору, содержащему 2-амино-5-метил-4-фенилселенофен-3-карбонитрил (1,0 г, 3,81 ммоль) в толуоле (30 мл), последовательно добавляли уксусную кислоту (0,2 мл) и DMF-DMA (1,14 мл, 8,01 ммоль). Реакционную смесь перемешивали при 105°С в течение 2 часов и обрабатывали 3-хлор-4-фторанилином (670 мг, 4,57 ммоль), как описано в Примере 12, с получением продукта в виде твердого вещества не совсем белого цвета, т.пл. 166-168ºС. ИК (KBr) νмакс 3397, 3020, 1614, 1563, 1498, 1433, 1263, 1196, 1145, 967, 904, 868, 774 см-1; 1H-ЯМР (400 МГц, CDCl3): δ 8,51 (1H, с), 7,59-7,62 (3H, м), 7,55 (1H, дд, J=6,4, 2,8 Гц), 7,42-7,45 (2H, м), 6,94 (1H, т, J=8,8 Гц), 6,76-6,96 (1H, м), 6,45 (1H, ушир. с), 2,40 (3H, с); 13C-ЯМР (100 МГц, CDCl3): δ 170,2, 154,4, 154,0 (д, J=244,0 Гц), 152,0, 139,4, 136,4 (д, J=3,0 Гц), 131,9, 130,0, 130,0, 129,6, 129,2, 121,8, 120,8 (д, J=18,0 Гц), 119,3 (д, J=7,0 Гц), 118,9, 116,3 (д, J=22,0 Гц), 16,3; ЖХ-МС (режим положительных ионов): m/z 416, 418, 420 (M+H)+.
Стадия (с):
HCl соль: К раствору, содержащему соединение (100 мг) со стадии (b) в диоксане (10 мл), добавляли HCl в диоксане и проводили обработку, как описано в Примере 1, с получением продукта в виде твердого вещества не совсем белого цвета (80 мг), т.пл. 248-250°С. ЖХ-МС (режим положительных ионов): m/z 416, 418, 420 (M−HCl +H)+.
Пример 17
Синтез 4-[(3-хлор-4-фторфенил)амино]-5-метилселенофено[2,3-d]пиримидин-6-карбоксамида (соединение № 17)
К охлажденному льдом (0-5°С) раствору гидроксида аммония (20 мл) в течение 5 мин добавляли раствор этил-4-[3-хлор-4-фторфенил)амино]-5-метилселенофено[2,3-d]пиримидин-6-карбоксилата (1,0 г, полученного на стадии (b) Примера 15) в THF (10 мл), затем при комнатной температуре добавляли каталитическое количество ПЭГ-400 и перемешивали в течение 48 часов. Раствор выливали в охлажденную льдом воду и экстрагировали этилацетатом (3 × 100 мл). Объединенный органический слой промывали водой, насыщенным солевым раствором и высушивали над сульфатом натрия. Раствор отфильтровали и растворитель выпаривали. Остаток подвергали хроматографии на колонке с силикагелем с использованием в качестве элюента смеси хлороформ-метанол (95:5) с получением непрореагировавшего исходного вещества (600 мг). Дальнейшее элюирование с колонки этой же системой растворителей привело к получению продукта в виде твердого вещества не совсем белого цвета (600 мг, 65%), т.пл. 276-278°С. ИК (KBr) νмакс 3440, 3378, 3161, 1655, 1556, 1499, 1384, 1339, 1260, 1214 см-1; 1H-ЯМР (400 МГц, DMSO-d6): δ 8,57 (1H, с, взаимообм. D2O), 8,45 (1H, с), 7,89 (1H, дд, J=6,4, 2,0 Гц), 7,71 (2H, ушир. с, взаимообм. D2O), 7,59-7,62 (1H, м), 7,42 (1H, т, J=9,2 Гц), 2,84 (3H, с); 13C-ЯМР (100 МГц, DMSO-d6): δ 171,2, 165,4, 157,1, 153,7 (д, J=241,0 Гц), 153,1, 136,1 (д, J=3,0 Гц), 133,4, 133,3, 124,7, 123,6 (д, J=7,0 Гц), 120,5, 118,8 (д, J=18,0 Гц), 116,4 (д, J=22,0 Гц), 17,3; ЖХ-МС (режим отрицательных ионов): m/z 381, 383, 385 (M-H)-.
Пример 18
Синтез (3-хлор-4-фторфенил)-5,6,7,8-тетрагидропиримидино[5',6'-5,4]селенофено[2,3-c]пиридин-4-иламина (соединение № 18)
Стадия (а):
Трет-бутил-2-амино-3-циано-4,5,6,7-тетрагидроселенофено[2,3-c]пиридин-6-карбоксилат: К раствору, содержащему трет-бутил-4-(дицианометилен)пиперидинкарбоксилат (10 г, 40,48 ммоль; Wang, X. -S.; Wu, J. -R.; Zhou, J.; Tu, S. -J. J. Comb. Chem., 2009, 11, 1011-1022) в THF (500 мл), при комнатной температуре последовательно добавляли селен (3,23 г, 40,48 ммоль) в виде порошка и диэтиламин (42,2 мл, 404,8 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 7 часов и давали охладиться до комнатной температуры. В результате обработки этой реакционной смеси, как описано в Примере 13, получали продукт в виде твердого вещества желтого цвета (5,93 г, 45%), т.пл. 190-192°С. 1H-ЯМР (400 МГц, CDCl3): δ 5,05 (2H, с), 4,41 (2H, ушир. с), 3,66 (2H, т, J=5,6 Гц), 2,58 (2H, ушир. с), 1,48 (9H, с); ЖХ-МС (режим отрицательных ионов): m/z 326 (M-H)-.
Стадия (b):
Трет-бутил-4-[(3-хлор-4-фторфенил)амино]-5,6,7,8-тетрагидропиримидино[5',4'-5,4]селенофено[2,3-c]пиридин-7-карбоксилат: К раствору, содержащему соединение (1,0 г, 3,05 ммоль) со стадии (а) в толуоле (30 мл), при комнатной температуре последовательно добавляли уксусную кислоту (0,3 мл) и DMF-DMA (0,92 мл, 6,422 ммоль). Реакционную смесь перемешивали при 100°С в течение 2 часов и обрабатывали 3-хлор-4-фторанилином (0,98 г, 6,116 ммоль), как описано в Примере 12, с получением продукта в виде твердого вещества белого цвета, т.пл. 202-204°C. 1H-ЯМР (400 МГц, CDCl3): δ 8,46 (1H, с), 7,80 (1H, ушир. с), 7,41 (1H, ушир. с), 7,15 (1H, т, J=8,6 Гц), 6,94 (1H, ушир. с, взаимообм. D2O), 4,75 (2H, ушир. с), 3,84 (2H, т, J=5,6 Гц), 3,13 (2H, м), 1,51 (9H, с); ЖХ-МС (режим отрицательных ионов): m/z 479, 481, 483 (M-H)-.
Стадия (с):
(3-хлор-4-фторфенил)-5,6,7,8-тетрагидропиримидино[5',6'-5,4]селенофено[2,3-c]пиридин-4-иламин: К раствору, содержащему соединение (500 мг) со стадии (b) в метаноле (10 мл), при комнатной температуре добавляли концентрированную HCl (8 мл) и смесь перемешивали в течение 30 мин. Смесь выливали в ледяную воду и подщелачивали раствором гидроксида аммония. Осажденное твердое вещество отфильтровывали, промывали ледяной водой и высушивали с получением неочищенного продукта (250 мг, 65%). Неочищенный продукт перекристаллизовывали из смеси гексан-хлороформ, получая продукт в виде твердого вещества белого цвета, т.пл. 188-190°С. ИК (KBr) νмакс 3449, 1605, 1562, 1494, 1425, 1264, 1206, 1106, 988, 961, 796 см-1; 1H-ЯМР (400 МГц, CDCl3): δ 8,45 (1H, с), 7,80 (1H, дд, J=6,6, 2,6 Гц), 7,40-7,44 (1H, м), 7,14 (1H, т, J=8,8 Гц), 7,02 (1H, ушир. с), 4,17-4,18 (2H, м), 3,31 (2H, т, J=5,6 Гц), 3,06-3,09 (2H, м); 13C-ЯМР (100 МГц, CDCl3): δ 171,5, 155,5, 154,5 (д, J=188 Гц), 152,0, 139,1, 135,1, 125,5, 123,8, 121,3 (д, J=6,0 Гц), 121,2 (д, J=19,0 Гц), 119,4, 116,6 (д, J=22,0 Гц), 47,3, 43,0, 29,5; ЖХ-МС (режим отрицательных ионов): m/z 379, 381, 383 (M-H)-.
Стадия (d):
Соль HCl: К раствору, содержащему соединение (100 мг) со стадии (с) в диоксане, добавляли HCl в диоксане и проводили обработку, как описано в Примере 1, с получением продукта в виде твердого вещества не совсем белого цвета, т.пл. 340°С. ЖХ-МС (режим отрицательных ионов): m/z 379, 381, 383 (M-H-HCl)-.
Пример 19
Синтез 4-[(3-хлор-4-фторфенил)амино]-7-(метилсульфонил)-5,6,7,8-тетрагидропиримидино[5',4'-5,4]селенофено[2,3-c]пиридина (соединение № 19)
Стадия (а):
4-[(3-хлор-4-фторфенил)амино]-7-(метилсульфонил)-5,6,7,8-тетрагидропиримидино[5',4'-5,4]селенофено[2,3-c]пиридин: К охлажденной на льду суспензии (3-хлор-4-фторфенил)-5,6,7,8-тетрагидропиримидино[5',6'-5,4]селенофено[2,3-c]пиридин-4-иламина (100 мг, 0,26 ммоль, получен в Примере 18) в дихлорэтане (10 мл) добавляли карбонат калия (70 мг, 0,52 ммоль), затем в течение 10 мин добавляли метансульфонилхлорид (0,04 г, 0,314 ммоль) и перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь выливали в воду со льдом и перемешивали в течение 15 мин. Отделяли слой EDC, и водный слой экстрагировали хлороформом (2 × 100 мл), затем объединенные органические слои промывали водой, насыщенным солевым раствором и высушивали над сульфатом натрия. Раствор отфильтровали и растворитель выпаривали. Остаток перекристаллизовывали из смеси метанол-хлороформ-гексан с получением продукта в виде твердого вещества не совсем белого цвета (50 мг, 41%), т.пл. 220-222°С. ИК (KBr) νмакс 3435, 1607, 1563, 1494, 1429, 1331, 1260, 1156, 964, 928, 778 см-1; 1H-ЯМР (400 МГц, DMSO-d6): δ 8,42 (1H, с), 8,28 (1H, ушир. с, взаимообм. D2O), 7,89 (1H, дд, J=6,6, 2,6 Гц), 7,61-7,64 (1H, м), 7,41 (1H, т, J=9,0 Гц), 4,61 (3H, с), 3,55-3,57 (2H, м), 3,35 (2H, ушир. с), 3,02 (2H, ушир. с); 13C-ЯМР (100 МГц, CDCl3): δ 171,5, 155,4, 153,3 (д, J=241 Гц), 151,9, 136,5 (д, J=3,0 Гц), 132,6, 127,2, 123,6, 122,5 (д, J=7,0 Гц), 119,2, 118,7 (д, J=18,0 Гц), 116,4 (д, J=21,0 Гц), 46,7, 42,4, 36,0, 27,2; ЖХ-МС (режим отрицательных ионов): m/z 457, 459, 461 (M-H)-.
Стадия (b):
HCl соль: К раствору, содержащему соединение (50 мг) со стадии (а) в диоксане (3 мл), добавляли HCl в диоксане и проводили обработку, как описано в Примере 1, с получением продукта в виде твердого вещества не совсем белого цвета (40 мг), т.пл. 260-262°С. ЖХ-МС (режим отрицательных ионов): m/z 457, 459, 461 (M−HCl-H)-.
Пример 20
Синтез (3-бромфенил)-5,6,7,8-тетрагидропиримидино[5',6'-5,4]селенофено[2,3-c]пиридин-4-иламина (соединение № 20)
Стадия (а):
(3-бромфенил)-5,6,7,8-тетрагидропиримидино[5',6'-5,4]селенофено[2,3-c]пиридин-4-иламин: К раствору, содержащему N-Boc-2-амино-4,5,6,7-тетрагидроселенофено-[2,3-с]пиридин-3-карбонитрил (1,5 г, 4,587 ммоль, получен на стадии (а) Примера 18) в толуоле (30 мл), последовательно добавляли уксусную кислоту (0,1 мл) и DMF-DMA (1,3 мл, 9,63 ммоль). Реакционную смесь перемешивали при 105°С в течение 3 часов и обрабатывали 3-броманилином (780 мг, 4,587 ммоль), как описано в Примере 12, с получением продукта в виде твердого вещества коричневого цвета, т.пл. 148-150°С. 1H-ЯМР (400 МГц, CDCl3): δ 8,47 (1H, с), 7,91 (1H, с), 7,54 (1H, д, J=6,8 Гц), 7,20-7,26 (2H, м), 7,09 (1H, с, взаимообм. D2O), 4,16 (2H, с), 3,31 (2H, т, J=5,7 Гц), 3,07 (2H, т, J=5,7 Гц); 13C-ЯМР (100 МГц, CDCl3): δ 171,4, 155,3, 152,0, 139,9, 139,0, 130,3, 126,8, 125,5, 123,9, 122,7, 119,6, 119,5, 47,3, 42,9, 29,4; ЖХ-МС (режим положительных ионов): m/z 407, 409, 411 (M+H)+.
Стадия (b):
Соль HCl: К раствору, содержащему соединение (150 мг) со стадии (а) в диоксане (10 мл), добавляли HCl в диоксане и проводили обработку, как описано в Примере 1, с получением продукта в виде твердого вещества не совсем белого цвета (140 мг, 86%), т.пл. 308-310°С. ЖХ-МС (режим отрицательных ионов): m/z 405, 407, 409 (M-H)-.
Пример 21
Синтез (3-этинилфенил)-5,6,7,8-тетрагидропиримидино[5',6'-5,4]селенофено[2,3-c]пиридин-4-иламина (соединение № 21)
Стадия (a):
(3-этинилфенил)-5,6,7,8-тетрагидропиримидино[5',6'-5,4]селенофено[2,3-c]пиридин-4-иламин: К раствору, содержащему N-Boc-2-амино-4,5,6,7-тетрагидроселенофено-[2,3-с]пиридин-3-карбонитрил (2,0 г, 6,13 ммоль, получен на стадии (а) Примера 18) в толуоле (40 мл), последовательно добавляли уксусную кислоту (0,2 мл) и DMF-DMA (1,0 мл, 7,35 ммоль). Реакционную смесь перемешивали при 105°С в течение 3 часов и обрабатывали 3-этиниланилином (0,8 мл, 7,3 ммоль), как описано в Примере 12, с получением продукта в виде твердого вещества коричневого цвета, т.пл. 164-166°С. 1H-ЯМР (400 МГц, CDCl3): δ 8,46 (1H, с), 7,74 (1H, с), 7,68 (1H, дд, J=8,0, 1,2 Гц), 7,32 (1H, т, J=7,8 Гц), 7,24 (1H, ушир. с), 7,09 (1H, с, взаимообм. D2O), 4,16 (2H, с), 3,30 (2H, т, J=5,7 Гц), 3,10 (1H, с), 3,06 (2H, т, J=5,7 Гц); 13C-ЯМР (100 МГц, CDCl3): δ 170,9, 155,2, 151,4, 139,6, 138,2, 128,9, 127,6, 126,3, 124,6, 122,5, 121,8, 120,0, 83,4, 80,4, 46,8, 42,4, 28,4; ЖХ-МС (режим положительных ионов): m/z 353, 355 (M+H)+.
Стадия (b):
Соль HCl: К раствору, содержащему соединение (50 мг) со стадии (а) в диоксане (5 мл), добавляли HCl в диоксане и проводили обработку, как описано в Примере 1, с получением продукта в виде твердого вещества бледно-коричневого цвета (50 мг), т.пл. 306-310°С. ЖХ-МС (режим положительных ионов): m/z 353, 355 (M-HCl+H)+.
Пример 22
Синтез (3,4-дихлорфенил)-5,6,7,8-тетрагидропиримидино[5',6'-5,4]селенофено[2,3-c]пиридин-4-иламина (соединение № 22)
Стадия (а):
(3,4-дихлорфенил)-5,6,7,8-тетрагидропиримидино[5',6'-5,4]селенофено[2,3-c]пиридин-4-иламин: К раствору, содержащему N-Boc-2-амино-4,5,6,7-тетрагидроселенофено-[2,3-с]пиридин-3-карбонитрил (1,5 г, 4,6 ммоль, получен на стадии (а) Примера 18) в толуоле (40 мл), последовательно добавляли уксусную кислоту (0,2 мл) и DMF-DMA (1,43 мл, 9,66 ммоль). Реакционную смесь перемешивали при 105°С в течение 3 часов и обрабатывали 3,4-дихлоранилином (0,89 мл, 5,52 ммоль), как описано в Примере 12, с получением продукта в виде твердого вещества желтого цвета, т.пл. 192-194°С. 1H-ЯМР (400 МГц, CDCl3): δ 8,47 (1H, с), 7,91 (1H, с), 7,39-7,46 (2H, м), 7,08 (1H, с), 4,17 (2H, с), 3,31 (2H, с), 3,06 (2H, с); 13C-ЯМР (100 МГц, CDCl3): δ 171,6, 155,1, 151,9, 139,3, 138,1, 132,8, 130,5, 127,1, 125,4, 122,7, 120,4, 119,6, 47,3, 42,9, 29,4; ЖХ-МС (режим отрицательных ионов): m/z 395, 397, 399, 401 (M-H)-.
Стадия (b):
Соль HCl: К раствору, содержащему соединение (100 мг) со стадии (а) в хлороформе (10 мл), добавляли HCl в диоксане и проводили обработку, как описано в Примере 1, с получением продукта в виде твердого вещества не совсем белого цвета (100 мг, 92%), т.пл. 308-310°С. ЖХ-МС (режим отрицательных ионов): m/z 395, 397, 399, 401 (M-HCl-H)-.
Пример 23
Синтез метил-5-метил-4-(5,6,7,8-тетрагидропиримидино[5',6'-5,4]селенофено[2,3-c]пиридин-4-иламино)тиофен-2-карбоксилата (соединение № 23)
Стадия (а):
Метил-5-метил-4-(5,6,7,8-тетрагидропиримидино[5',6'-5,4]селенофено[2,3-c]пиридин-4-иламино)тиофен-2-карбоксилат: К раствору, содержащему N-Boc-2-амино-4,5,6,7-тетрагидроселенофено-[2,3-с]пиридин-3-карбонитрил (2,0 г, 6,13 ммоль, получен на стадии (а) Примера 18) в толуоле (30 мл), последовательно добавляли уксусную кислоту (0,1 мл) и DMF-DMA (1,7 мл, 12,84 ммоль). Реакционную смесь перемешивали при 105°С в течение 3 часов и обрабатывали метил-4-амино-5-метилтиофен-2-карбоксилатом (1,04 г, 6,116 ммоль; Tsubou, S.; Mimura, S.; Ono, S. I.; Watanabe, K.; Takeda, A. Bull. Chem. Soc. Jpn., 1987, 60, 1807-1812), как описано в Примере 12, с получением продукта в виде твердого вещества желтого цвета, т.пл. 224-226°C. 1H-ЯМР (400 МГц, CDCl3): δ 8,41 (1H, с), 8,08 (1H, с), 6,73 (1H, с, взаимообм. D2O), 4,17 (2H, с), 3,88 (3H, с), 3,31 (2H, т, J=5,6 Гц), 3,08 (2H, т, J=5,4 Гц), 2,40 (3H, с); 13C-ЯМР (100 МГц, CDCl3): δ 171,2, 162,4, 155,8, 152,5, 138,5, 135,1, 133,0, 131,5, 128,1, 125,6, 119,0, 52,1, 47,3, 43,0, 29,4, 13,0; ЖХ-МС (режим отрицательных ионов): m/z 405, 407 (M-H)-.
Стадия (b):
HCl соль: К раствору, содержащему соединение (70 мг) со стадии (а) в диоксане (5 мл), добавляли HCl в диоксане и проводили обработку, как описано а Примере 1, с получением продукта в виде твердого вещества желтого цвета (65 мг, 85%), т.пл. 262-264°С. ЖХ-МС (режим отрицательных ионов): m/z 405, 407 (M-HCl-H)-.
Пример 24
Синтез {4-[3-хлор-4-фторфенил)амино]-5-метилселенофено[2,3-d]пиримидин-6-ил}-N-(2-гидроксиэтил)карбоксамида (соединение № 24)
К раствору, содержащему этиловый эфир 4-[3-хлор-4-фторфенил)амино]-5-метилселенофено[2,3-d]пиримидин-6-карбоксилата (2,0 г, получен на стадии (b) Примера 15) в этаноле (50 мл), добавляли в течение 5 мин этаноламин (20 мл) и перемешивали при комнатной температуре в течение 16 часов. Этанол выпаривали при пониженном давлении, и остаток разбавляли ледяной водой. Раствор экстрагировали этилацетатом (3 × 100 мл). Объединенный органический слой промывали водой, насыщенным солевым раствором и высушивали над сульфатом натрия. Раствор отфильтровали и растворитель выпаривали. Остаток подвергали хроматографии на колонке с силикагелем с использованием в качестве элюента смеси хлороформ-метанол (90:10) с получением продукта в виде твердого вещества не совсем белого цвета (1,2 г, 60%), т.пл. 198-200°С. 1H-ЯМР (400 МГц, DMSO-d6): δ 8,55 (1H, ушир. с), 8,45 (1H, с), 8,32 (1H, ушир. с), 7,88-7,90 (1H, м), 7,60-7,63 (1H, м), 7,44 (1H, т, J=9,0 Гц), 4,77 (1H, м), 3,52-3,55 (2H, м), 3,34-3,36 (2H, м), 2,81 (3H, с); ЖХ-МС (режим отрицательных ионов): m/z 425, 427, 429 (M-H)-.
Пример 25
Синтез N-(2-хлорэтил){4-[3-хлор-4-фторфенил)амино]-5-метилселенофено[2,3-d]пиримидин-6-ил}карбоксамида (соединение № 25)
Стадия (а):
N-(2-хлорэтил){4-[3-хлор-4-фторфенил)амино]-5-метилселенофено[2,3-d]пиримидин-6-ил}карбоксамид: Смесь {4-[3-хлор-4-фторфенил)амино]-5-метилселенофено[2,3-d]пиримидин-6-ил}-N-(2-гидроксиэтил)карбоксамида (1,0 г, из Примера 24) и тионилхлорида (30 мл) нагревали с обратным холодильником в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры, выливали в ледяную воду и перемешивали в течение 10 мин. Выпавший осадок отфильтровывали, промывали водой и высушивали. Сырое твердое вещество подвергали хроматографии на колонке с силикагелем с использованием в качестве элюента смеси хлороформ-метанол (90:10) с получением продукта в виде твердого вещества желтого цвета (600 мг, 57%), т.пл. 178-180°С. ИК (KBr) νмакс 3456, 3239, 2919, 1540, 1612, 1548, 1492, 1458, 1426, 1386, 1266, 1188, 1124, 1052, 976, 879, 807 см-1; 1H-ЯМР (400 МГц, DMSO-d6): δ 8,59-8,62 (1H, м, взаимообм. D2O), 8,57 (1H, с, взаимообм. D2O), 8,45 (1H, с), 7,90 (1H, дд, J=6,8, 2,4 Гц), 7,59-7,64 (1H, м), 7,42 (1H, т, J=9,2 Гц), 3,78 (2H, т, J=6,0 Гц), 3,60 (2H, кв., J=5,9 Гц), 2,83 (3H, с); 13C-ЯМР (100 МГц, DMSO-d6): δ 171,1, 163,9, 157,1, 153,7 (д, J=242,0 Гц), 153,1, 136,1 (д, J=3,0 Гц), 133,4, 132,4, 124,8, 123,7 (д, J=7,0 Гц), 120,7, 118,8 (д, J=19,0 Гц), 116,4 (д, J=22,0 Гц), 43,0, 41,6, 17,4; ЖХ-МС (режим отрицательных ионов): m/z 443, 445, 447 (M-H)-.
Стадия (b):
HCl соль: К раствору, содержащему соединение (70 мг) со стадии (а) в ацетонитриле (5 мл), добавляли HCl в диоксане и проводили обработку, как описано в Примере 1, с получением продукта в виде твердого вещества бледно-желтого цвета (60 мг), т.пл. 226-228°С. ЖХ-МС (режим отрицательных ионов): m/z 443, 445, 447 (M−HCl-H)-.
Пример 26
Синтез 4-[(3-хлор-4-фторфенил)амино]-5,6,8-тригидробензо[2,1-b]пиримидино[5,4-d]селенофен-7-она (соединение № 26)
Стадия (a):
7-аминоспиро[1,3-диоксолан-2,6'-4,5,6,7-тетрагидробензо[2,1-b]селенофен]-8-карбонитрил: К раствору моноэтиленацеталя 1,4-циклогександиона (3 г, 19,23 ммоль, Sigma-Aldrich) в этаноле (30 мл) при комнатной температуре последовательно добавляли малононитрил (1,2 мл, 19,23 ммоль), селен (1,5 г, 19,23 ммоль) в виде порошка и диэтиламин (10 мл, 96,15 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 5 часов и проводили обработку, как описано в Примере 1, с получением продукта в виде твердого вещества не совсем белого цвета, т.пл. 192-194°С. 1H-ЯМР (400 МГц, CDCl3): δ 4,98 (2H, ушир. с), 4,02 (4H, с), 2,82 (2H, с), 2,66-2,70 (2H, м), 1,92 (2H, т, J=6,6 Гц); ЖХ-МС (режим положительных ионов): m/z 283, 285 (M+H)+.
Стадия (b):
(3-хлор-4-фторфенил)спиро[1,3-диоксолан-2,7'-5,6,7,8-тетрагидробензо[2,1-b]пиримидино[5,6-d]селенофен]-9-иламин: К раствору, содержащему соединение (1,2 г, 4,22 ммоль) со стадии (а) в толуоле (20 мл), последовательно добавляли уксусную кислоту (0,2 мл) и DMF-DMA (0,7 мл, 5,08 ммоль). Реакционную смесь перемешивали при 105°С в течение 2 часов и обрабатывали 3-хлор-4-фторанилином (740 мг, 5,08 ммоль), как описано в Примере 12, с получением продукта в виде масла бледно-желтого цвета (1,0 г, 53%). 1H-ЯМР (400 МГц, CDCl3): δ 8,44 (1H, с), 7,77 (1H, дд, J=6,4, 2,4 Гц), 7,39-7,43 (1H, м), 7,14 (1H, т, J=8,8 Гц), 7,07 (1H, с), 4,07 (4H, с), 3,26 (2H, т, J=6,3 Гц), 3,15 (2H, с), 2,12 (2H, т, J=6,3 Гц); ЖХ-МС (режим положительных ионов): m/z 438, 440, 442 (M+H)+.
Стадия (с):
4-[(3-хлор-4-фторфенил)амино]-5,6,8-тригидробензо[2,1-b]пиримидино[5,4-d]селенофен-7-он: К раствору, содержащему соединение (0,8 г) со стадии (b) в THF (10 мл), при комнатной температуре добавляли 30% водный раствор HCl (10 мл) и перемешивали при этой же температуре в течение 16 часов (с отделением твердого вещества). Реакционную смесь выливали в охлажденную льдом воду и перемешивали в течение 30 мин. Раствор подщелачивали водным раствором аммиака и экстрагировали этилацетатом (3 × 200 мл). Объединенный органический слой промывали водой, насыщенным солевым раствором и высушивали над сульфатом натрия. Раствор отфильтровали и растворитель выпаривали. Остаток подвергали хроматографии на колонке с силикагелем с использованием в качестве элюента смеси гексан:этилацетат (70:30) с получением продукта в виде твердого вещества бледно-желтого цвета (500 мг, 70%), т.пл. 228-230°С. ИК (KBr) νмакс 3460, 1713, 1605, 1563, 1497, 1430, 1379, 1305, 1262, 1198, 1127, 1053, 964, 892, 801 см-1; 1H-ЯМР (400 МГц, DMSO-d6): δ 8,46 (1H, ушир. с, взаимообм. D2O), 8,41 (1H, с), 7,86 (1H, дд, J=6,4, 2,4 Гц), 7,56-7,61 (1H, м), 7,41 (1H, т, J=9,0 Гц), 3,83 (2H, с), 3,48 (2H, т, J=6,8 Гц), 2,70 (2H, т, J=6,8 Гц); 13C-ЯМР (100 МГц, DMSO-d6): δ 206,6, 171,8, 155,4, 153,3 (д, J=241 Гц), 151,7, 136,6 (д, J=3,0 Гц), 134,1, 128,5, 123,7, 122,6 (д, J=6,0 Гц), 119,1, 118,8 (д, J=18 Гц), 116,4 (д, J=22 Гц), 42,0, 37,7, 26,0; ЖХ-МС (режим отрицательных ионов): m/z 392, 394, 396 (M−H)−.
Стадия (d):
Соль HCl: Полученное выше свободное основание растворяли в диоксане и обрабатывали раствором HCl в диоксане, как описано в Примере 1, с получением соли, т.пл. 236-240°С. ЖХ-МС (режим отрицательных ионов): m/z 392, 394, 396 (M−HCl-H)−.
Пример 27
Синтез (3-хлор-4-фторфенил)-6,7,8,9-тетрагидробензо[1,2-d]пиримидино[5,6-b]селенофен-4-иламина (соединение № 27)
Стадия (a):
Получение селенида натрия: К раствору гидроксида натрия (4,2 г, 105 ммоль) и формальдегидсульфоксилата натрия (6,93 г, 45 ммоль) в воде (18 мл) добавляли селен (1,5 г, 18,75 ммоль). После перемешивания в течение 1 часа при 50°С, белый осадок отфильтровывали в атмосфере азота и быстро использовали для следующей стадии.
3-амино-4,5,6,7-тетрагидробензо[1,2-b]селенофен-2-карбонитрил: К суспензии селенида натрия (2,35 г, 18,65 ммоль) в DMF (18 мл) при комнатной температуре добавляли в течение 5 мин раствор 2-хлорциклогекс-1-енкарбонитрила (2,63 г, 18,65 ммоль; Gunes, Y.; Polat, M. F.; Sahin, E.; Fleming, F. F.; Altundas, R. J. Org. Chem., 2010, 75, 7092-7098) в DMF (9 мл) и перемешивали смесь при 60°С в течение 45 мин. Затем к реакционной смеси добавляли по каплям хлорацетонитрил (1,18 мл, 18,65 ммоль) и снова перемешивали при 60°С в течение 3 часов. Затем добавляли по каплям раствор метоксида натрия (1,0 г, 18,65 ммоль) в безводном метаноле (18 мл) и перемешивание продолжали в течение 2 часов при той же температуре. Смесь оставляли охлаждаться до комнатной температуры, выливали в холодную воду и перемешивали в течение 30 мин. Выпавшее в осадок твердое вещество отфильтровывали и промывали водой с получением продукта в виде твердого вещества темно-коричневого цвета (2,4 г, 57%), т.пл. 86-88°С.
Стадия (b):
3,6,7,8,9-пентагидробензо[1,2-b]пиримидино[4,5-d]селенофен-4-он: К раствору, содержащему соединение (3,2 г) со стадии (а) в муравьиной кислоте (32 мл), добавляли по каплям в течение 15 минут концентрированную серную кислоту (12 мл). Реакционную смесь перемешивали при 90-100°С в течение 1 часа и давали охладиться до комнатной температуры. Реакционную смесь выливали в охлажденную льдом воду и перемешивали в течение 15 мин. Выпавшее в осадок твердое вещество отфильтровывали, промывали водой и высушивали с получением продукта в виде твердого вещества светло-коричневого цвета (1,8 г, 50%), т.пл. 316-318°С. 1H-ЯМР (400 МГц, DMSO-d6): δ 12,36 (1H, с), 8,14 (1H, с), 2,90 (2H, т, J=6,0 Гц), 2,64 (2H, т, J=6,0 Гц), 1,78-1,86 (4H, м); ЖХ-МС (режим отрицательных ионов): m/z 251, 253 (M-H)-.
Стадия (с):
4-хлор-6,7,8,9-тетрагидробензо[1,2-d]пиримидино[5,4-b]селенофен: Смесь, содержащую соединение (1,1 г) со стадии (b), тионилхлорид (11 мл) и каталитическое количество DMF (1 мл), кипятили с обратным холодильником в течение 1 часа. В результате обработки смеси, как описано в Примере 1, получали продукт в виде твердого вещества светло-желтого цвета (700 мг, 59%), т.пл. 114-116°С. 1H-ЯМР (400 МГц, DMSO-d6): δ 8,98 (1H, с), 3,02-3,05 (2H, м), 2,75-2,78 (2H, м), 1,82-1,94 (4H, м).
Стадия(d):
(3-хлор-4-фторфенил)-6,7,8,9-тетрагидробензо[1,2-d]пиримидино[5,6-b]селенофен-4-иламин: К раствору соединения (700 мг, 2,57 ммоль), полученного на стадии (c), в изопропаноле (15 мл) добавляли при комнатной температуре 3-хлор-4-фторанилин (1,6 г, 11,56 ммоль), и смесь нагревали с обратным холодильником в течение 1,5 часов. В результате обработки этой смеси, как описано в Примере 1, получали продукт в виде твердого вещества не совсем белого цвета, т.пл. 238-240°С. ИК (KBr) νмакс см-1; 1H-ЯМР (400 МГц, CDCl3): δ 8,71 (1H, с), 7,70 (1H, дд, J=6,4, 2,8 Гц), 7,37-7,41 (1H, м), 7,16 (1H, т, J=8,8 Гц), 6,53 (1H, ушир. с, взаимообм. D2O), 2,92 (2H, т, J=6,0 Гц), 2,82 (2H, т, J=6,0 Гц), 1,86-1,99 (4H, м); 13C-ЯМР (100 МГц, DMSO-d6): δ 162,5, 156,2, 153,8, 153,0 (д, J=241 Гц), 148,6, 136,9 (д, J=3,0 Гц), 133,1, 122,7, 121,6 (д, J=7,0 Гц), 118,8 (д, J=19 Гц), 116,5 (д, J=21,0 Гц), 115,6, 27,6, 24,4, 23,5, 21,3; ЖХ-МС (режим отрицательных ионов): m/z 378, 380, 382 (M-H)-.
Стадия (е):
HCl соль: К раствору, содержащему соединение (70 мг) со стадии (d) в диоксане (5 мл), добавляли HCl в диоксане и проводили обработку, как описано в Примере 1, с получением продукта в виде твердого вещества светло-зеленого цвета (70 мг), т.пл. 290-292ºС. ЖХ-МС (режим положительных ионов): m/z 380, 382, 384 (M-HCl+H)+.
Пример 28
Синтез [6-(трет-бутил)селенофено[2,3-e]пиримидин-4-ил](3-хлор-4-фторфенил)амина (соединение № 28)
Стадия (a):
3-амино-5-(трет-бутил)селенофен-2-карбонитрил: К суспензии селенида натрия (3,51 г, 27,87 ммоль) в DMF (28 мл) при комнатной температуре добавляли в течение 5 мин раствор 3-хлор-4,4-диметилпент-2-еннитрила (4,0 г, 27,87 ммоль; Ohta, H.; Ishizaka, T.; Tatsuzuki, M.; Yoshinaga, M.; Iida, I.; Yamaguchi, T.; Tomishima, Y.; Futaki, N.; Toda, Y.; Saito, S. Bioorg. Med. Chem., 2008, 16, 1111-1124) в DMF (10 мл) и смесь перемешивали при 60-70°C течение 2 часов. Затем к реакционной смеси добавляли по каплям хлорацетонитрил (1,76 мл, 27,87 ммоль) и смесь снова перемешивали при 60-70°С в течение 2 часов. Затем добавляли по каплям раствор метоксида натрия (1,5 г, 27,87 ммоль) в безводном метаноле (18 мл) и продолжали перемешивание в течение 1 часа при той же температуре. Смесь оставляли охлаждаться до комнатной температуры, выливали в холодную воду и перемешивали в течение 30 мин. Выпавшее в осадок твердое вещество отфильтровывали и промывали водой. Твердое вещество перекристаллизовывали из смеси хлороформ-гексан с получением продукта в виде твердого вещества коричневого цвета (3,8 г, 60%), т.пл. 110-112°C (Thomae, D.; Kirsch, G.; Seck, P. Synthesis, 2008, 1600-1606). 1H-ЯМР (400 МГц, CDCl3): δ 6,59 (1H, с), 4,46 (2H, ушир. с), 1,33 (9H, с); ЖХ-МС (режим отрицательных ионов): m/z 225, 227 (M-H)-.
Стадия (с):
3-амино-5-(трет-бутил)селенофен-2-карбоксамид: К суспензии 3-амино-5-(трет-бутил)селенофен-2-карбонитрила (2,0 г) в водном растворе гидроксида натрия (50 мл; 10%) добавляли этанол (50 мл), и смесь кипятили с обратным холодильником в течение 1 часа. Этанол отгоняли в вакууме и смесь охлаждали до 5-10°С. Выпавшие кристаллы отфильтровывали, промывали холодной водой и высушивали с получением продукта в виде твердого вещества не совсем белого цвета (1,8 г, 83%), т.пл. 160-162°C (Hesse, S.; Chenet, C.; Thomae, D.; Kirsch, G. Synthesis, 2009, 1204-1208). 1H-ЯМР (400 МГц, CDCl3): δ 6,58 (1H, с), 5,75 (2H, ушир. с), 5,13 (2H, ушир. с), 1,34 (9H, с).
Стадия (d):
6-(трет-бутил)-3-гидроселенофено[3,2-d]пиримидин-4-он: К раствору, содержащему 3-амино-5-(трет-бутил)селенофен-2-карбоксамид (1 г) в муравьиной кислоте (10 мл), при комнатной температуре медленно добавляли в течение 10 мин концентрированную серную кислоту (5 мл). Смесь кипятили с обратным холодильником в течение 1,5 часов и давали охладиться до комнатной температуры. Смесь выливали в ледяную воду и подщелачивали раствором аммиака. Раствор экстрагировали хлороформом (3 × 200 мл) и объединенные хлороформные слои промывали водой, солевым раствором и высушивали над сульфатом натрия. Раствор отфильтровывали и растворитель выпаривали с получением продукта в виде твердого вещества желтого цвета (550 мг, 53%), т.пл. 240-242°С. 1H-ЯМР (400 МГц, CDCl3): δ 12,61 (1H, ушир. с), 8,16 (1H, с), 7,34 (1H, с), 1,46 (9H, с); ЖХ-МС (режим отрицательных ионов): m/z 253, 255 (M-H)-.
Стадия (е):
6-(трет-бутил)-4-хлорселенофено[3,2-d]пиримидин: Смесь 6-(трет-бутил)-3-гидроселенофено[3,2-d]пиримидин-4-она (550 мг), тионилхлорида (6 мл) и каталитического количества DMF (0,5 мл) кипятили с обратным холодильником в течение 2 часов. В результате обработки смеси, как описано в Примере 1, получали продукт в виде твердого вещества светло-желтого цвета (400 мг, 68%), т.пл. 78-80°С. 1H-ЯМР (400 МГц, CDCl3): δ 8,91 (1H, с), 7,51 (1H, с), 1,49 (9H, с).
Стадия (f):
[6-(трет-бутил)селенофено[2,3-e]пиримидин-4-ил](3-хлор-4-фторфенил)амин: К раствору, содержащему 6-(трет-бутил)-4-хлорселенофено[3,2-d]пиримидин (0,4 г, 1,45 ммоль) в изопропаноле (20 мл), при комнатной температуре добавляли 3-хлор-4-фторанилин (0,83 г, 5,8 ммоль) и смесь нагревали с обратным холодильником в течение 2 часов. В результате обработки этой смеси, как описано в Примере 1, получали продукт в виде твердого вещества белого цвета (0,52 г, 94%), т.пл. 204-206°С. ИК (KBr) νмакс 3440, 3270, 3095, 2958, 1621, 1596, 1260, 1207, 1044, 808 см-1; 1H-ЯМР (400 МГц, CDCl3): δ 8,66 (1H, с), 7,68 (1H, дд, J=6,4, 2,8 Гц), 7,35-7,39 (1H, м), 7,34 (1H, с), 7,24 (1H, ушир. с, взаимообм. D2O), 7,16 (1H, т, J=8,8 Гц), 1,42 (9H, с); 13C-ЯМР (100 МГц, CDCl3): δ 172,1, 164,9, 157,1, 155,7 (д, J=246 Гц), 154,8, 134,4 (д, J=3,0 Гц), 126,2, 123,7 (д, J=6,0 Гц), 122,6, 121,3 (д, J=22 Гц), 115,5, 37,2, 32,4; ЖХ-МС (режим отрицательных ионов): m/z 380, 382, 384 (M-H)-.
Стадия (g):
HCl соль: К раствору, содержащему соединение (120 мг) со стадии (f) в диоксане (10 мл), добавляли HCl в диоксане, и в результате обработки, как описано в Примере 1, получали продукт в виде твердого вещества белого цвета (100 мг). ЖХ-МС (режим отрицательных ионов): m/z 380, 382 (M-H-HCl)-.
Пример 29
Синтез (3-хлор-4-фторфенил)(6-фенилселенофено[2,3-e]пиримидин-4-ил)амина (соединение № 29)
Стадия (a):
6-фенил-3-гидроселенофено[3,2-d]пиримидин-4-он: К раствору, содержащему 3-амино-5-фенилселенофен-2-карбоксамид (1,5 г; Hesse, S.; Chenet, C.; Thomae, D.; Kirsch, G. Synthesis, 2009, 1204-1208) в муравьиной кислоте (30 мл), при комнатной температуре медленно добавляли в течение 10 мин концентрированную серную кислоту (10 мл). Смесь кипятили с обратным холодильником в течение 3 часов и оставляли охлаждаться до комнатной температуры. Смесь выливали в ледяную воду и подщелачивали раствором аммиака. Раствор перемешивали в течение 10 минут и выпавшее в осадок твердое вещество отфильтровывали, промывали ледяной водой и высушивали. Затем сырой продукт перекристаллизовывали из смеси метанол-хлороформ-гексан с получением продукта в виде кристаллического твердого вещества белого цвета (1,0 г, 53%), т.пл. 266-268°С. 1H-ЯМР (400 МГц, DMSO-d6): δ 12,50 (1H, ушир. с), 8,19 (1H, с), 8,01 (1H, с), 7,80-7,82 (2H, м), 7,47-7,49 (3H, м); ЖХ-МС (режим положительных ионов): m/z 297, 299 (M+Na)+.
Стадия (b):
(3-хлор-4-фторфенил)(6-фенилселенофено[2,3-e]пиридин-4-ил)амин: Смесь 6-фенил-3-гидроселенофено[3,2-d]пиримидин-4-она (1,0 г), тионилхлорида (20 мл) и небольшого количества DMFA (1,0 мл) кипятили с обратным холодильником в течение 2 часов. Растворители были удалены под вакуумом и смесь разбавляли хлороформом. Растворители снова были удалены под вакуумом, и эту процедуру повторяли дважды (с получением твердого вещества зеленого цвета). Это твердое вещество (1,0 г, 3,395 ммоль) растворяли в изопропаноле (50 мл) при комнатной температуре и добавляли 3-хлор-4-фторанилин (1,97 г, 13,58 ммоль). Смесь кипятили в течение 4 часов и оставляли охлаждаться до комнатной температуры. В результате обработки этой смеси, как описано в Примере 1, получали продукт в виде твердого вещества белого цвета (500 мг, 36%), т.пл. 244-246ºС. ИК (KBr) νмакс 3430, 2928, 1623, 1563, 1482, 1451, 1411, 1384, 1257, 1208, 1033, 870 см-1; 1H-ЯМР (400 МГц, CDCl3 + DMSO-d6): δ 9,10 (1H, с, взаимообм. D2O), 8,65 (1H, с), 7,94 (1H, дд, J=6,8, 2,8 Гц), 7,78 (1H, с), 7,65-7,69 (3H, м), 7,40-7,48 (3H, м), 7,14 (1H, т, J=8,8 Гц); 13C-ЯМР (100 МГц, CDCl3+DMSO-d6): δ 164,2, 156,8, 154,9, 154,7, 154,3 (д, J=244 Гц), 135,9 (д, J=3,0 Гц), 134,9, 129,4, 129,1, 126,7, 124,2, 123,6, 122,1 (д, J=6,0 Гц), 120,2 (д, J=18 Гц), 117,5, 116,1 (д, J=22 Гц); ЖХ-МС (режим положительных ионов): m/z 402, 404, 406 (M+H)+.
Стадия(с):
HCl соль: К раствору, содержащему соединение (150 мг) со стадии (b) в диоксане (10 мл), добавляли HCl в диоксане и проводили обработку, как описано в Примере 1, с получением продукта в виде твердого вещества желтого цвета (130 мг), т.пл. 296-306°C. ЖХ-МС (режим положительных ионов): m/z 402, 404, 406 (M-HCl+H)+.
Пример 30
Синтез бензо[d]пиримидино[5,6-b]селенофен-4-ил(3-хлор-4-фторфенил)амина (соединение № 30)
Стадия (a):
3-аминобензо[d]селенофен-2-карбонитрил: К суспензии селенида натрия (9,14 г, 72,6 ммоль) в DMF (72 мл) при комнатной температуре добавляли в течение 5 мин раствор 2-хлорбензонитрила (10 г, 72,6 ммоль) в DMF (25 мл) и смесь перемешивали при 100-110ºС в течение 24 часов. Затем к реакционной смеси добавляли по каплям хлорацетонитрил (5,48 мл, 72,6 ммоль) и снова перемешивали при 60-70ºС в течение 2 часов. Затем добавляли по каплям раствор метоксида натрия (3,9 г, 72,6 ммоль) в безводном метаноле (24 мл) и перемешивание продолжали в течение 2 часов при той же температуре. Смесь оставляли охлаждаться до комнатной температуры, выливали в холодную воду и перемешивали в течение 30 мин. Выпавший осадок отфильтровывали, промывали водой и сушили с получением продукта в виде твердого вещества не совсем белого цвета (9,5 г, 59%), т.пл. 157-159ºС.
Стадия (b):
Бензо[d]пиримидино[5,6-b]селенофен-4-ил-(3-хлор-4-фторфенил)амин: К раствору, содержащему соединение (2,0 г, 9,0 ммоль) со стадии (a) в толуоле (50 мл), последовательно добавляли уксусную кислоту (0,4 мл) и DMF-DMA (2,72 мл, 18,9 ммоль). Реакционную смесь перемешивали при 105ºС в течение 3 часов и обрабатывали 3-хлор-4-фторанилином (740 мг, 5,08 ммоль), как описано в Примере 12, с получением продукта в виде твердого вещества не совсем белого цвета (1,4 г, 41%), т.пл. 210-212ºС. ИК (KBr) νмакс 3430, 3272, 3123, 1613, 1568, 1494, 1444, 1397, 1264, 1203, 1034, 961, 810, 747 см-1; 1H-ЯМР (400 МГц, DMSO-d6): δ 9,74 (1H, с, взаимообм. D2O), 8,78 (1H, с), 8,39 (1H, д, J=7,6 Гц), 8,28 (1H, д, J=7,6 Гц), 8,14-8,16 (1H, м), 7,77-7,79 (1H, м), 7,59-7,67 (2H, м), 7,45 (1H, т, J=9,2 Гц); 13C-ЯМР (100 МГц, DMSO-d6): δ 159,4, 157,2, 154,5, 153,3 (д, J=241,0 Гц), 140,4, 136,5 (д, J=3,0 Гц), 136,3, 129,9, 126,7, 125,6, 124,7, 123,3, 122,1 (д, J=7,0 Гц), 118,9 (д, J=18,0 Гц), 116,6 (д, J=22,0 Гц), 116,1; ЖХ-МС (режим отрицательных ионов): m/z 374, 376, 378 (M-H)-.
Стадия (с):
HCl соль: К раствору, содержащему соединение (300 мг) со стадии (b) в диоксане (10 мл), добавляли HCl в диоксане и проводили обработку, как описано в Примере 1, с получением продукта в виде твердого вещества светло-желтого цвета (250 мг), т.пл. 278-280°С. ЖХ-МС (режим отрицательных ионов): m/z 374, 376, 378 (M−HCl-H)-.
Пример 31
Синтез (3-хлор-4-фторфенил)пиримидино[4',5'-5,4]селенофено[2,3-b]пиридин-4-иламина (соединение № 31)
Стадия (a):
3-аминоселенофено[2,3-b]пиридин-2-карбонитрил: К суспензии селенида натрия (0,9 г, 7,2 ммоль) в DMF (7 мл) при комнатной температуре добавляли в течение 5 мин раствор 2-хлорпиридин-3-карбонитрила (1 г, 7,2 ммоль) в DMF (3 мл) и смесь перемешивали при 60-70ºС в течение 2 часов. Затем к реакционной смеси добавляли по каплям хлорацетонитрил (0,46 мл, 7,22 ммоль) и снова перемешивали при 60-70ºС в течение 2 часов. Затем добавляли по каплям раствор метоксида натрия (0,39 г, 7,2 ммоль) в метаноле (7 мл) и продолжали перемешивание в течение 1 часа при этой же температуре. Смесь оставляли охлаждаться до комнатной температуры и выливали в холодную воду и перемешивали в течение 15 мин. Осажденное твердое вещество отфильтровывали, промывали водой и высушивали с получением продукта в виде твердого вещества желтого цвета (1,2 г, 75%), т.пл. 208-210ºС.
Стадия (b):
(3-хлор-4-фторфенил)пиримидино[4',5'-5,4]селенофено[2,3-b]пиридин-4-иламин: К раствору, содержащему 3-аминоселенофено[2,3-b]пиридин-2-карбонитрил (0,5 г, 2,24 ммоль) в толуоле (10 мл), последовательно добавляли уксусную кислоту (0,1 мл) и DMF-DMA (0,65 мл, 4,84 ммоль). Реакционную смесь перемешивали при 105°С в течение 3 часов и обрабатывали 3-хлор-4-фторанилином (740 мг, 5,08 ммоль), как описано в Примере 12, с получением продукта в виде твердого вещества не совсем белого цвета, т.пл. 262-266ºС. ИК (KBr) νmax 3436, 3257, 1618, 1571, 1493, 1448, 1389, 1265, 1034, 963, 864, 813, 772 см-1; 1H-ЯМР (400 МГц, DMSO-d6): δ 9,79 (1H, с, взаимообм. D2O), 8,80 (1H, дд, J=4,6, 1,8 Гц), 8,77 (1H, с), 8,61 (1H, дд, J=7,8, 1,8 Гц), 8,14 (1H, дд, J=6,8, 2,4 Гц), 7,73-7,77 (1H, м), 7,64 (1H, дд, J=7,8, 4,6 Гц), 7,43 (1H, т, J=9,2 Гц); 13C-ЯМР (100 МГц, DMSO-d6): δ 163,6, 156,9, 156,8, 154,8, 153,4 (д, J=242 Гц), 151,7, 136,3 (д, J=3,0 Гц), 132,6, 130,7, 123,6, 122,1 (д, J=6,0 Гц), 121,2, 118,9 (д, J=19,0 Гц), 116,6 (д, J=22,0 Гц), 115,8; ЖХ-МС (режим отрицательных ионов): m/z 375, 377, 379 (M-H)-.
Стадия (с):
Соль HCl: К раствору, содержащему соединение (200 мг) со стадии (b) в метаноле (10 мл), добавляли HCl в диоксане (1 мл), до достижения красной окраски бумажного индикатора рН. В результате обработки этой реакционной смеси, как описано в Примере 1, получали продукт в виде твердого вещества не совсем белого цвета, т.пл. 294-298ºС. ЖХ-МС (режим отрицательных ионов): m/z 375, 377, 379 (M−HCl-H)-.
Пример 32
Синтез этил-4-[(3-хлор-4-фторфенил)амино]-5-метилтиоселенофено[3,4-d]пиримидин-7-карбоксилата (соединение № 32)
Стадия (a):
Этил-3-амино-4-циано-5-метилтиоселенофено-2-карбоксилат: К суспензии селенида натрия (4,6 г, 37,5 ммоль) в DMF (37 мл) при комнатной температуре добавляли в течение 5 мин раствор 2-[бис(метилсульфанил)метилен]малононитрила (6,37 г, 37,5 ммоль; Baraldi, P. G.; Fruttarolo, F.; Tabrizi, M. A.; Preti, D.; Romagnoli, R.; El-Kashef, H.; Moorman, A.; Varani, K.; Gessi, S.; Merighi, S.; Borea, P. A. J. Med. Chem., 2003, 46, 1229-1241; Thomae, D.; Perspicace, E.; Henryon, D.; Xu, Z.; Schneider, S.; Hesse, S.; Kirsch, G.; Seck, P. Tetrahedron, 2009, 65, 10453-10458) в DMF (18 мл) и смесь перемешивали при 70-80ºС в течение 2 часов. Затем к реакционной смеси добавляли по каплям этилхлорацетат (6,38 мл, 75 ммоль) и снова перемешивали при 70-80ºС в течение 2 часов. Затем добавляли суспензию метоксида натрия (2,0 г, 37,5 ммоль) в метаноле (37 мл) и перемешивание продолжали в течение 1,5 часов при той же температуре. Смесь оставляли охлаждаться до комнатной температуры, выливали в холодную воду и перемешивали в течение 15 мин. Раствор экстрагировали хлороформом (3 × 100 мл). Объединенные органические слои промывали водой, насыщенным солевым раствором и высушивали над сульфатом натрия. Раствор отфильтровали и растворитель выпаривали. Остаток подвергали хроматографии на колонке с силикагелем с использованием в качестве элюента смеси гексан-этилацетат (90:10) с получением продукта в виде твердого вещества коричневого цвета (2,2 г, 21%), т.пл. 128-130ºС. 1H-ЯМР (400 МГц, CDCl3): δ 5,86 (2H, ушир. с), 4,27 (2H, кв., J=7,06 Гц), 2,67 (3H, с), 1,32 (3H, т, J=7,0 Гц); ЖХ-МС (режим положительных ионов): m/z 289, 291 (M+H)+.
Стадия (b):
Этил-4-[(3-хлор-4-фторфенил)амино]-5-метилтиоселенофено[3,4-d]пиримидин-7-карбоксилат: К раствору, содержащему этил-3-амино-4-циано-5-метилтиоселенофен-2-карбоксилат (1,0 г, 3,45 ммоль) в толуоле (30 мл), последовательно добавляли уксусную кислоту (0,2 мл) и DMF-DMA (1,0 мл, 7,45 ммоль). Реакционную смесь перемешивали при 105°С в течение 3 часов и обрабатывали 3-хлор-4-фторанилином (740 мг, 5,08 ммоль), как описано в Примере 12, с получением продукта в виде твердого вещества светло-розового цвета (1,1 г, 72%), т.пл. 176-178ºС. ИК (KBr) νмакс 3344, 1643, 1609, 1568, 1487, 1425, 1401, 1292, 1259, 1237, 1201, 1099, 1048 см-1; 1H-ЯМР (400 МГц, DMSO-d6): δ 11,34 (1H, с, взаимообм. D2O), 7,74 (1H, д, J=3,6 Гц), 7,26-7,31 (2H, м), 7,03-7,07 (1H, м), 4,32 (2H, кв., J=7,06 Гц), 2,63 (3H, с), 1,32 (3H, т, J=7,0 Гц); ЖХ-МС (режим положительных ионов): m/z 444, 446, 448 (M+H)+.
Стадия (с):
Соль HCl: К раствору, содержащему соединение (100 мг) со стадии (b) в дихлорметане (5 мл), при комнатной температуре добавляли HCl в диоксане (0,5 мл) до достижения красной окраски бумажного индикатора рН. В результате обработки этой смеси, как описано в Примере 1, получали продукт в виде твердого вещества желтого цвета (70 мг), т.пл. 200-202ºС. ЖХ-МС (режим отрицательных ионов): m/z 442, 444, 446 (M−HCl-H)-.
Пример 33
Синтез (4-хлорфенил)метил-5,6,7,8-тетрагидропиримидино[5',6'-5,4]селенофено[2,3-c]пиридин-4-иламина (соединение № 33)
Стадия (a):
(4-хлорфенил)метил-5,6,7,8-тетрагидропиримидино[5',6'-5,4]селенофено[2,3-c]пиридин-4-иламин: К раствору, содержащему N-Boc-2-амино-4,5,6,7-тетрагидроселенофено[2,3-с]пиридин-3-карбонитрил (3,0 г, 9,24 ммоль, со стадии (b) Примера 18) в толуоле (30 мл), последовательно добавляли уксусную кислоту (0,3 мл) и DMF-DMA (2,80 мл, 19,325 ммоль). Реакционную смесь перемешивали при 105°С в течение 3 часов и обрабатывали 4-хлор-N-метиланилином (0,92 мл, 11,04 ммоль), как описано в Примере 12, с получением продукта в виде твердого вещества светло-желтого цвета, т.пл. 186-188°C. 1H-ЯМР (400 МГц, CDCl3): δ 7,92 (1H, с), 7,39 (2H, д, J=8,4 Гц), 7,12 (2H, д, J=8,4 Гц), 3,91 (2H, с), 3,54 (3H, с), 3,16 (2H, т, J=5,7 Гц), 2,62 (2H, т, J=5,7 Гц); 13C-ЯМР (100 МГц, CDCl3): δ 168,6, 152,0, 142,7, 133,2, 131,4, 130,0, 129,8, 122,2, 116,0, 102,8, 46,6, 42,9, 35,5, 27,1; ЖХ-МС (режим положительных ионов): m/z 377, 379, 381 (M+H)+.
Стадия (b):
Соль HCl: К раствору, содержащему соединение (80 мг) со стадии (а) в диоксане (8 мл), при комнатной температуре добавляли HCl в диоксане (0,5 мл), до достижения красной окраски бумажного индикатора рН. В результате обработки этой смеси, как описано в Примере 1, получали продукт в виде твердого вещества желтого цвета (60 мг), т.пл. 274-276ºС. ЖХ-МС (режим положительных ионов): m/z 377, 379, 381 (M-HCl+H)+.
Пример 34
Синтез (3-хлор-4-фторфенил)(2-метил(5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-ил)амина (соединение № 34)
Стадия (a):
2-метил-3,5,6,7,8-пентагидробензо[1,2-b]пиримидино[5,4-d]селенофен-4-он: Сухой газообразный HCl при комнатной температуре пропускали (до тех пор пока раствор оставался прозрачным) через раствор этил-2-амино-4,5,6,7-тетрагидробензо[1,2-b]селенофен-3-карбоксилата (4,0 г, 14,65 ммоль; Aumann, K.M.; Scammells, P. J.; White, J. M.; Schiesser, C. H. Org. Biomol. Chem., 2007, 5, 1276-1281) в ацетонитриле (100 мл) в течение 30 мин. Реакционную смесь нагревали с обратным холодильником в течение 5 часов и оставляли охлаждаться до комнатной температуры. Осажденное твердое вещество отфильтровывали, и твердое вещество растворяли в воде. Раствор нейтрализовали 10%-ым водным раствором NaHCO3 и выпавшее в осадок твердое вещество отфильтровывали, промывали ледяной водой и высушивали с получением продукта в виде твердого вещества не совсем белого цвета (1,4 г, 36%), т.пл. 284-286ºС. 1H-ЯМР (400 МГц, CDCl3): δ 12,36 (1H, ушир. с,-NH), 3,02 (2H, ушир. с, H-8), 2,85 (2H, ушир. с, H-5), 2,50 (3H, с, -CH3), 1,87 (4H, ушир. с, H-6,7); ЖХ-МС (режим отрицательных ионов): m/z 265, 267 (M-H)-.
Стадия (b):
4-хлор-2-метил-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,4-d]селенофен: Смесь 2-метил-3,5,6,7,8-пентагидробензо[1,2-b]пиримидино[5,4-d]селенофен-4-она (1,4 г) и оксихлорида фосфора (15 мл) нагревали с обратным холодильником в течение 2 часов. Реакционную смесь оставляли охлаждаться до комнатной температуры, выливали в ледяную воду и перемешивали в течение 10 мин. Осажденное твердое вещество отфильтровывали, промывали ледяной водой и высушивали с получением продукта в виде твердого вещества коричневого цвета (1,3 г, 87%), т.пл. 106-108ºС. 1H-ЯМР (400 МГц, CDCl3): δ 3,05-3,08 (2H, м, H-8), 2,92-2,93 (2H, м, H-5), 2,73 (3H, с, -CH3), 1,89-1,93 (4H, м, H-6,7).
Стадия (с):
(3-хлор-4-фторфенил)-(2-метил-(5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-ил)амин: К раствору, содержащему 4-хлор-2-метил-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен (500 мг, 3,496 ммоль) в IPA (12 мл), при комнатной температуре добавляли 3-хлор-4-фторанилин (1,5 г, 10,489 ммоль) и смесь нагревали с обратным холодильником в течение 6 часов. Выпавшее в осадок твердое вещество отфильтровывали, промывали водой и очищали, как описано ранее, с получением продукта в виде твердого вещества не совсем белого цвета (450 мг, 65%), 136-138ºС. 1H-ЯМР (400 МГц, CDCl3): δ 7,85-7,86 (1H, м, H-5'), 7,45-7,47 (1H, м, H-2'), 7,09-7,12 (1H, м, H-6'), 7,09 (1H, с, взаимообм. D2O, -NH), 3,00 (2H, ушир. с, H-8), 2,90 (2H, ушир. с, H-5), 2,59 (3H, с, -CH3), 1,97-1,98 (2H, ушир. с, H-6), 1,91-1,92 (2H, ушир. с, H-7); 13C-ЯМР (100 МГц, CDCl3): δ 171,8, 161,3, 154,9, 154,2 (д, J=244,0 Гц), 138,4, 135,6 (д, J=4,0 Гц), 126,4, 122,8, 120,8 (д, J=18,0 Гц), 120,3 (д, J=7,0 Гц), 117,0, 116,4 (д, J=22,0 Гц), 28,3, 27,9, 25,5, 22,8, 22,6; ЖХ-МС (режим положительных ионов): m/z 394, 396, 398 (M+H)+.
Стадия (d):
HCl соль: К раствору, содержащему соединение (100 мг), полученное на стадии (c) в диоксане (5 мл), при комнатной температуре добавляли HCl в диоксане (0,5 мл), до достижения красной окраски бумажного индикатора рН. В результате обработки этой смеси, как описано в Примере 1, получали продукт в виде твердого вещества белого цвета (80 мг), т.пл. 266-268ºС. ЖХ-МС (режим отрицательных ионов): m/z 392, 394, 396 (M-HCl-H)-.
Пример 35
Определение противораковой активности с использованием МТТ-анализа клеточной пролиферации: Анализ пролиферации клеток с включением в них МТТ [3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолийбромида проводили с использованием стандартной процедуры. Цитотоксическая эффективность тестируемых соединений (соединения № 1-34) оценивали в клетках А549 карциномы легкого человека, в клетках НТ29 колоректальной карциномы человека, в клетках DU145 карциномы простаты человека, в клетках MDA-MB-231 карциномы молочной железы человека (отрицательной по рецепторам эстрогена), в клетках HepG2 гепатоцеллюлярной карциномы человека или в клетках HeLa карциномы шейки матки человека, с использованием набора для анализа клеточной пролиферации при воздействии МТТ (Roche Applied Sciences, Германия). Анализ проводили в соответствии с инструкциями, предоставленными поставщиком. Вкратце, одинаковое количество клеток высевали в 96-луночные плоскодонные планшеты и инкубировали в течение трех дней с 4-селенофениламинопиримидиновыми соединениями формулы (I) или с гефитинибом (ирессой), при различных концентрациях. Лунки с культурой, используемые в качестве контроля, обрабатывали только носителем в максимальной концентрации - 0,5% ДМСО. После этого в каждую лунку добавляли 0,5 мг/мл реагента МТТ, и планшеты инкубировали еще в течение 4 ч при 37°С в присутствии 5% СО2. Затем клетки солюбилизировали путем добавления солюбилизирующего раствора и инкубировали при 37°С в течение ночи. После полного растворения кристаллов формазана считывали оптическую плотность (OD) при 540 нм на ридере для микропланшетов (BioRad, USA). Результаты (среднее значение OD ± стандартное отклонение), полученные от четырех одинаковых лунок, использовали для расчетов, чтобы определить ингибирование пролиферации клеток (IC50, 50%-ую ингибирующую концентрацию) под воздействием испытуемых соединений.
Оценка активности соединений по ингибированию клеточной пролиферации была выполнена в два этапа: (1) скрининг и (2) определение полумаксимальной ингибирующей концентрации (IC50). В фазе скрининга, клетки обрабатывали соединениями с различными концентрациями. После этого испытуемые соединения с наилучшими активностями были отобраны для определения величины IC50. Показатели ингибирования клеточной пролиферации для исследуемых соединений (соединения № 1-34) для различных клеточных линий приведены в Таблице 1. Результаты для тестируемых соединений представлены в микромолярных концентрациях. Активности гефитиниба (ирессы) по ингибированию клеточной пролиферации также представлены для сравнения.
Активность соединений № 1-34 по ингибированию пролиферации опухолевых клеток
(карцинома легкого)
(карцинома простаты)
(карцинома толстой кишки)
Затем, основываясь на постоянной и высокой активности соединения № 33 в отношении пролиферации клеток А549, DU145 и НТ-29, оно было дополнительно выбрано для оценки его ингибирующей активности в отношении пролиферации некоторых других раковых клеток человека, таких как клеток MDA-MB-231 карциномы молочной железы (отрицательной по рецепторам эстрогена) или клеток HepG2 гепатокарциномы, или клеток HeLa карциномы шейки матки. Активности гефитиниба (ирессы) по ингибированию клеточной пролиферации также представлены для сравнения (см. Таблицу 2).
Активность соединения № 33 по ингибированию пролиферации опухолевых клеток
(карцинома молочной железы)
(гепатоцеллюлярная карцинома)
(карцинома шейки матки)
| название | год | авторы | номер документа |
|---|---|---|---|
| ЗАМЕЩЕННЫЕ 4-(СЕЛЕНОФЕН-2(ИЛИ 3)-ИЛАМИНО)ПИРИМИДИНОВЫЕ СОЕДИНЕНИЯ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2597609C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2711502C2 |
| Регулятор на основе азотсодержащего гетероциклического производного, способ его получения и его применение | 2020 |
|
RU2829553C2 |
| Новый ингибитор на основе производного хинолина | 2019 |
|
RU2802283C2 |
| ГЕТЕРОАРИЛЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ СПИРОПИПЕРИДИНИЛА И ИХ ФАРМАЦЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2021 |
|
RU2839891C1 |
| ИНГИБИТОРЫ FGFR4 | 2014 |
|
RU2715708C2 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2716136C2 |
| ИНГИБИТОРЫ СЕРИН/ТРЕОНИНОВЫХ КИНАЗ | 2013 |
|
RU2650501C2 |
| ГЕТЕРОАРИЛЬНЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ IRAK II ТИПА И ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2810338C2 |
| НОВЫЕ КОНДЕНСИРОВАННЫЕ ПИРИМИДИНОВЫЕ ПРОИЗВОДНЫЕ ДЛЯ ИНГИБИРОВАНИЯ ТИРОЗИНКИНАЗНОЙ АКТИВНОСТИ | 2011 |
|
RU2585177C2 |
Изобретение относится к селенофеновому соединению формулы (I)
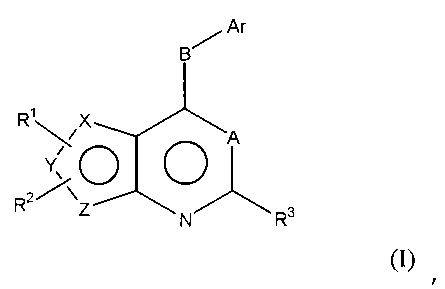
или его фармацевтически приемлемой соли. X представляет собой селен, Y и Z представляют собой атомы углерода; или Y представляет собой селен, X и Z представляют собой атомы углерода; или Z представляет собой селен, X и Y представляют собой атомы углерода; А представляет собой N; В представляет собой NR5, где R5 выбирается из водорода, или алкила; Ar представляет собой арильное или гетероарильное кольцо; арил представляет собой бензольное или нафталиновое кольцо, а гетероарил представляет собой 6-членное ароматическое кольцо, содержащее один, два или три атома азота; или гетероарил представляет собой 5-членное ароматическое кольцо, содержащее один или несколько гетероатомов, выбранных из серы, кислорода и азота, при условии, что присутствует не более чем один атом кислорода или серы; при этом такие кольца включают пиридин, пиридазин, пиразин, пиримидин, тиофен, фуран, пиррол, пиразол, имидазол, оксазол, изоксазол, тиазол и изотиазол; необязательно замещенное одним, двумя или несколькими группами, независимо выбранными из водорода, галогена, тиола, сульфонамида, C1-6алкила, вторичного С1-6алкила, третичного С1-6алкила, С2-6алкинила, С1-4алкоксикарбонила и фенила; R1, R2 и R3 независимо выбираются из водорода, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалометила, С1-6алкила, вторичного С1-6алкила, третичного С1-6алкила, С1-4алкоксикарбонила, аминокарбонила, C1-6алкиламинокарбонила, ди(С1-6алкил)аминокарбонила, и фенила; или R1 и R2 соединены, и вместе с атомами, к которым они присоединены, они образуют 5-7-членное необязательно замещенное карбоциклическое или пергидрогетероциклическое кольцо, указанное в формуле изобретения; или R1 и R2 соединены, и вместе с атомами, к которым они присоединены, образуют необязательно замещенное арильное или незамещенное гетероарильное кольцо, слитое с селенофеном; при этом арил представляет собой бензольное кольцо, и гетероарил представляет собой 6-членное ароматическое кольцо, содержащее один атом азота. Также предложены способы получения селенофенового соединения (варианты), фармацевтическая композиция, способы лечения или ингибирования, или контролирования клеточного пролиферативного нарушения. Изобретение позволяет получить селенофеновое соединение, обладающее противораковой активностью. 8 н. и 21 з.п. ф-лы, 2 табл., 35 пр.
1. Селенофеновое соединение формулы (I)

где
X представляет собой селен, Y и Z представляют собой атомы углерода; или
Y представляет собой селен, X и Z представляют собой атомы углерода; или
Z представляет собой селен, X и Y представляют собой атомы углерода;
А представляет собой N;
В представляет собой NR5, где R5 выбирается из водорода, или алкила;
Ar представляет собой арильное или гетероарильное кольцо; арил представляет собой бензольное или нафталиновое кольцо, а гетероарил представляет собой 6-членное ароматическое кольцо, содержащее один, два или три атома азота; или гетероарил представляет собой 5-членное ароматическое кольцо, содержащее один или несколько гетероатомов, выбранных из серы, кислорода и азота, при условии, что присутствует не более чем один атом кислорода или серы; при этом такие кольца включают пиридин, пиридазин, пиразин, пиримидин, тиофен, фуран, пиррол, пиразол, имидазол, оксазол, изоксазол, тиазол и изотиазол; необязательно замещенное одним, двумя или несколькими группами, независимо выбранными из водорода, галогена, тиола, сульфонамида, C1-6алкила, вторичного С1-6алкила, третичного С1-6алкила, С2-6алкинила, С1-4алкоксикарбонила и фенила;
R1, R2 и R3 независимо выбираются из водорода, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалометила, С1-6алкила, вторичного С1-6алкила, третичного С1-6алкила, С1-4алкоксикарбонила, аминокарбонила, C1-6алкиламинокарбонила, ди(С1-6алкил)аминокарбонила, и фенила;
или
R1 и R2 соединены, и вместе с атомами, к которым они присоединены, они образуют 5-7-членное необязательно замещенное карбоциклическое или пергидрогетероциклическое кольцо, выбранное из соединений формулы:
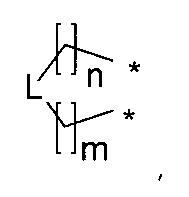
где n представляет собой целое число, выбранное из чисел от 0 до 4; m представляет собой целое число, выбранное из чисел от 0 до 4; * обозначает место присоединения к R1 и R2 в формуле I; L выбирается из СН2 и NR8, где R8 представляет собой водород;
или
R1 и R2 соединены, и вместе с атомами, к которым они присоединены, образуют необязательно замещенное арильное или незамещенное гетероарильное кольцо, слитое с селенофеном; при этом арил представляет собой бензольное кольцо, и гетероарил представляет собой 6-членное ароматическое кольцо, содержащее один атом азота,
или его фармацевтически приемлемая соль.
2. Селенофеновое соединение формулы (I) по п.1, где X представляет собой селен, когда Y и Z являются атомами углерода; или Y представляет собой селен, когда X и Z являются атомами углерода; или Z представляет собой селен, когда X и Y являются атомами углерода; и соединение выбирается из следующих соединений:
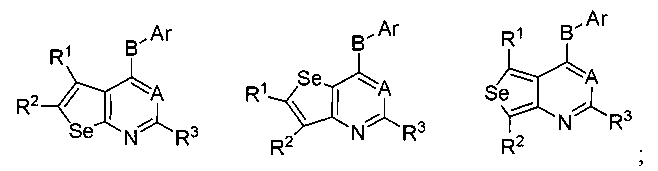
при этом R1, R2 и R3 представляют собой группы, определенные выше.
3. Селенофеновое соединение формулы (I) по п.1, где А представляет собой N; В представляет собой NR5; Ar представляет собой бензол; и соединение выбирается из следующих соединений:
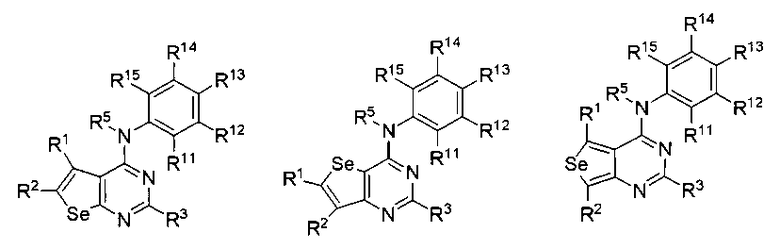
где R11, R12, R13, R14 и R15 независимо выбираются из водорода, галогена, тиола, сульфонамида, С1-6алкила, вторичного C1-6алкила, третичного C1-6алкила, С2-6алкинила, С1-4алкоксикарбонила и фенила;
и где R1, R2, R3 и R5 представляют собой группы, определенные выше.
4. Селенофеновое соединение формулы (I) по п.1, где А представляет собой N; В представляет собой NR5; Ar представляет собой пиридин; и соединение выбирается из следующих соединений:

и где R1, R2, R3, R5, R11, R12, R13 и R14 представляют собой группы, определенные выше.
5. Селенофеновое соединение формулы (I) по п.1, где А представляет собой N; В представляет собой NR5; Ar представляет собой пиридазин; и соединение выбирается из следующих соединений:
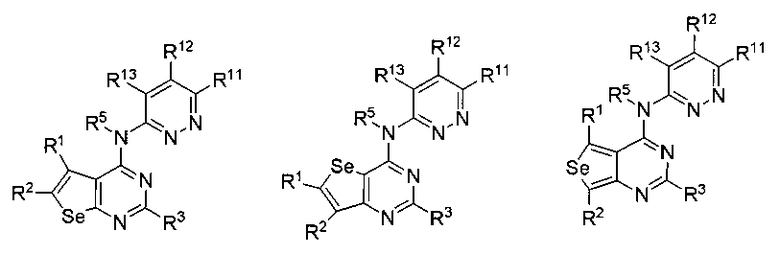
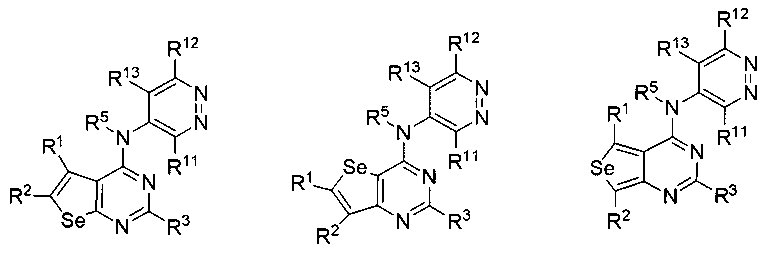
и где R1, R2, R3, R5, R11, R12 и R13 представляют собой группы, определенные выше.
6. Селенофеновое соединение формулы (I) по п.1, где А представляет собой N; В представляет собой NR5; Ar представляет собой пиримидин; и соединение выбирается из следующих соединений:
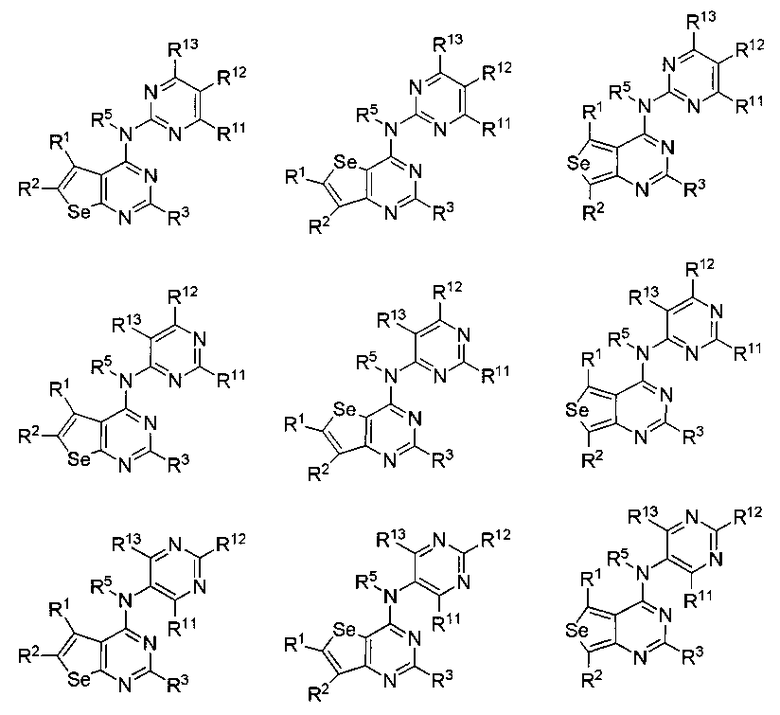
и где R1, R2, R3, R5, R11, R12 и R13 представляют собой группы, определенные выше.
7. Селенофеновое соединение формулы (I) по п.1, где А представляет собой N; В представляет собой NR5; Ar представляет собой пиразин; и соединение выбирается из следующих соединений:
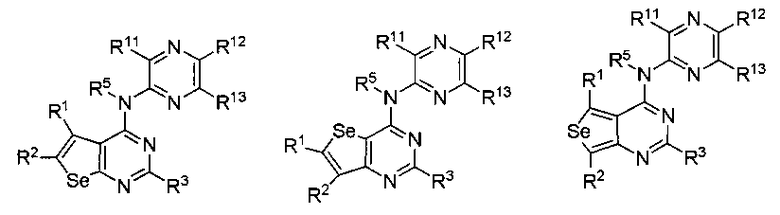
и где R1, R2, R3, R5, R11, R12 и R13 представляют собой группы, определенные выше.
8. Селенофеновое соединение формулы (I) по п.1, где А представляет собой N; В представляет собой NR5; Ar представляет собой тиофен; и соединение выбирается из следующих соединений:
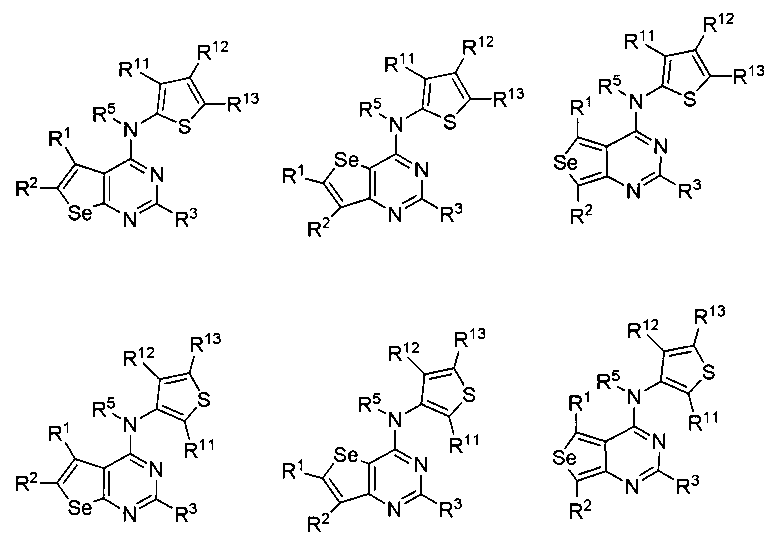
и где R1, R2, R3, R5, R11, R12 и R13 представляют собой группы, определенные выше.
9. Селенофеновое соединение формулы (I) по п.1, где А представляет собой N; В представляет собой NR5; Ar представляет собой фуран; и соединение выбирается из следующих соединений:
и где R1, R2, R3, R5, R11, R12 и R13 представляют собой группы, определенные выше.
10. Селенофеновое соединение формулы (I) по п.1, где А представляет собой N; В представляет собой NR5; Ar представляет собой пиррол; и соединение выбирается из следующих соединений:
и где R1, R2, R3, R5, R11, R12 и R13 представляют собой группы, определенные выше.
11. Селенофеновое соединение формулы (I) по п.1, где А представляет собой N; В представляет собой NR5; Ar представляет собой пиразол; и соединение выбирается из следующих соединений:
и где R1, R2, R3, R5, R11 и R12 представляют собой группы, определенные выше.
12. Селенофеновое соединение формулы (I) по п.1, где А представляет собой N; В представляет собой NR5; Ar представляет собой имидазол; и соединение выбирается из следующих соединений:

и где R1, R2, R3, R5, R11 и R12 представляют собой группы, определенные выше.
13. Селенофеновое соединение формулы (I) по п.1, где А представляет собой N; В представляет собой NR5; Ar представляет собой оксазол; и соединение выбирается из следующих соединений:
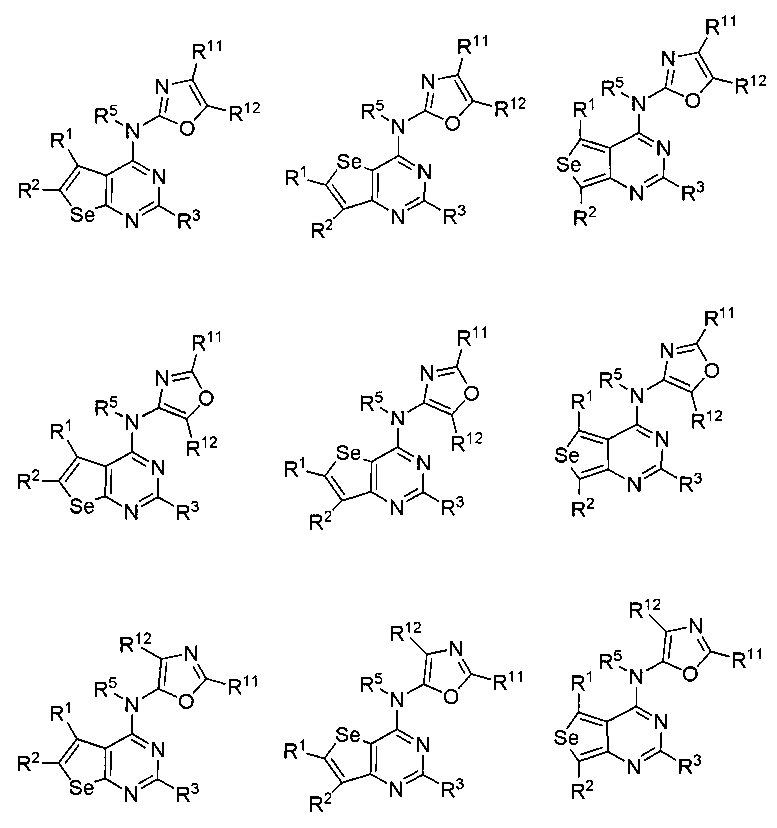
и где R1, R2, R3, R5, R11 и R12 представляют собой группы,
определенные выше.
14. Селенофеновое соединение формулы (I) по п.1, где А представляет собой N; В представляет собой NR5; Ar представляет собой изоксазол; и соединение выбирается из следующих соединений:
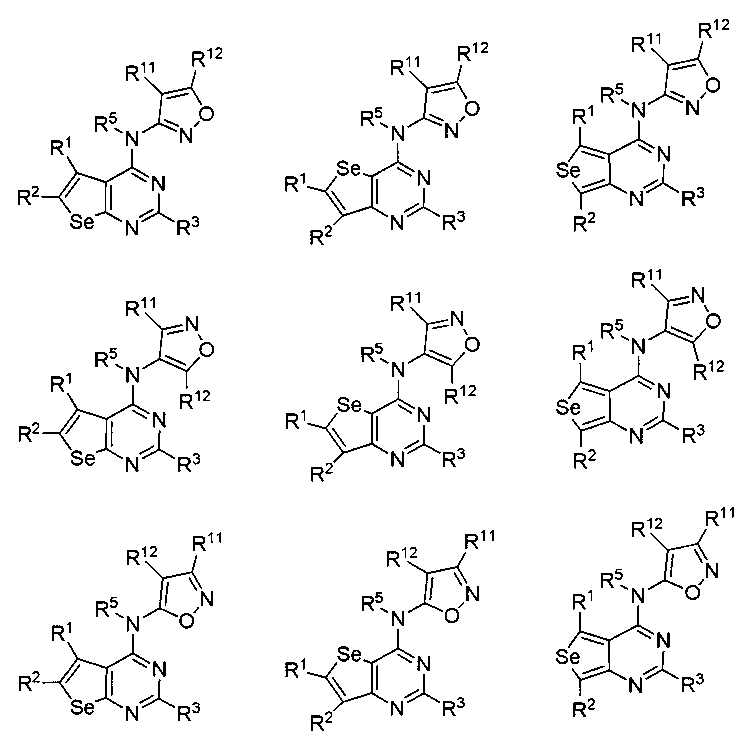
и где R1, R2, R3, R5, R11 и R12 представляют собой группы, определенные выше.
15. Селенофеновое соединение формулы (I) по п.1, где А представляет собой N; В представляет собой NR5; Ar представляет собой тиазол; и соединение выбирается из следующих соединений:
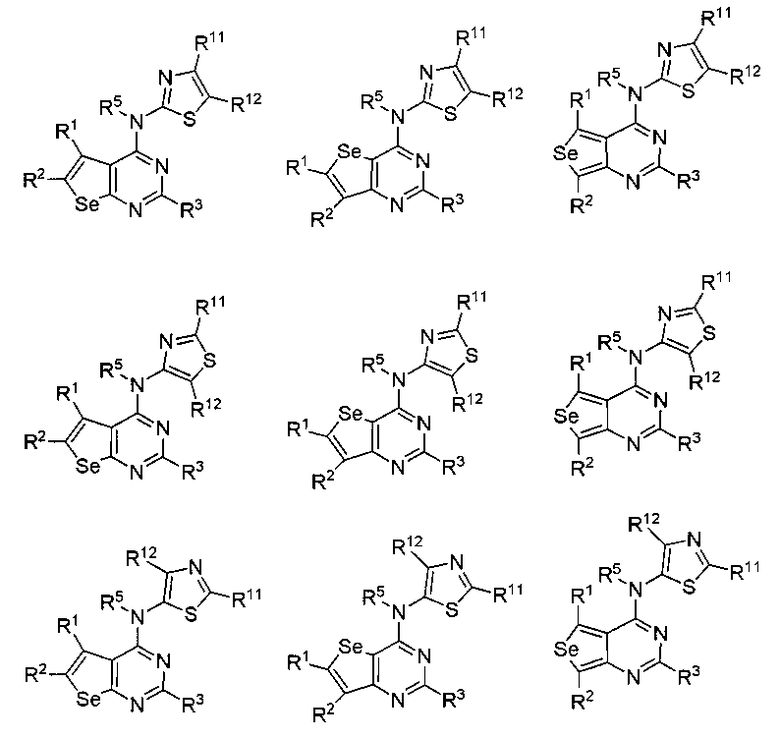
и где R1, R2, R3, R5, R11 и R12 представляют собой группы, определенные выше.
16. Селенофеновое соединение формулы (I) по п.1, где А представляет собой N; В представляет собой NR5; Ar представляет собой изотиазол; и соединение выбирается из следующих соединений:
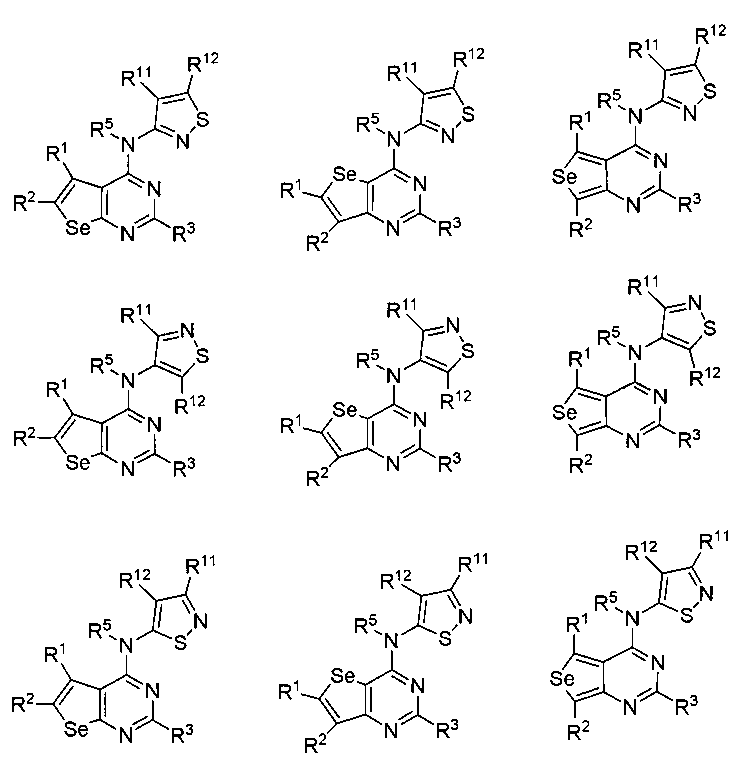
и где R1, R2, R3, R5, R11 и R12 представляют собой группы, определенные выше.
17. Соединение по п.1, где соединение выбирается из группы, состоящей из:
(3-хлор-4-фторфенил)-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламина;
(5-бром(3-пиридил))-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,б-d]селенофен-4-иламина;
(2,6-дихлорпиридин-4-ил)-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламина;
(2,6-дихлорпиримидин-4-ил)-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламина;
пиразин-2-ил-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламина;
(2,5-дибром(3-тиенил)-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламина;
(5-трет-бутил)-3-(5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламино)тиофен-2-карбоксамида;
5-(трет-бутил)-2-(5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламино)фуран-3-карбонитрила;
5-фенил-2-(5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламино)фуран-3-карбонитрила;
2-метилтио-4-(5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламино)-1,3-тиазол-5-карбонитрила;
(2-метилтио-5-нитро(1,3-тиазол-4-ил))-5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламина;
4-(5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-иламино)бензол-сульфонамида;
[5-(трет-бутил)селенофено[3,2-е]пиримидин-4-ил](3-хлор-4-фторфенил)амина;
(3-хлор-4-фторфенил)(5-фенилселенофено[3,2-е]пиримидин-4-ил]амина;
4-[(3-хлор-4-фторфенил)амино]-5-метилселенофено[2,3-d]пиримидин-6-карбоновой кислоты;
[(3-хлор-4-фторфенил)(6-метил-5-фенилселенофено[3,2-e]пиримидин-4-ил]амина;
4-[(3-хлор-4-фторфенил)амино]-5-метилселенофено[2,3-d]пиримидин-6-карбоксамида;
(3-хлор-4-фторфенил)-5,6,7,8-тетрагидропиримидино[5′,6′-5,4]селенофено[2,3-с]пиридин-4-иламина;
4-[(3-хлор-4-фторфенил)амино]-7-(метилсульфонил)-5,6,7,8-тетрагидропиримидино[5′,4′-5,4]селенофено[2,3-с]пиридина;
(3-бромфенил)-5,6,7,8-тетрагидропиримидино[5′,6′-5,4]селенофено[2,3-c]пиридин-4-иламина;
(3-этинилфенил)-5,6,7,8-тетрагидропиримидино[5′,6′-5,4]селенофено[2,3-c]пиридин-4-иламина;
(3,4-дихлорфенил)-5,6,7,8-тетрагидропиримидино[5′,6′-5,4]селенофено[2,3-c]пиридин-4-иламина;
метил-5-метил-4-(5,6,7,8-тетрагидропиримидино[5′,6′-5,4]селенофено[2,3-c]пиридин-4-иламино)тиофен-2-карбоксилата;
{4-[3-хлор-4-фторфенил)амино]-5-метилселенофено[2,3-d]пиримидин-6-ил}-N-(2-гидроксиэтил)карбоксамида;
N-(2-хлорэтил){4-[3-хлор-4-фторфенил)амино]-5-метилселенофено[2,3-d]пиримидин-6-ил}карбоксамида;
4-[(3-хлор-4-фторфенил)амино]-5,6,8-тригидробензо[2,1-b]пиримидино[5,4-d]селенофен-7-она;
(3-хлор-4-фторфенил)-6,7,8,9-тетрагидробензо[1,2-d]пиримидино[5,6-b]селенофен-4-иламина;
[6-(трет-бутил)селенофено[2,3-е]пиримидин-4-ил](3-хлор-4-фторфенил)амина;
(3-хлор-4-фторфенил)(6-фенилселенофено[2,3-е]пиримидин-4-ил)амина;
бензо[d]пиримидино[5,6-b]селенофен-4-ил(3-хлор-4-фторфенил)амина;
(3-хлор-4-фторфенил)пиримидино[4′,5′-5,4]селенофено[2,3-b]пиридин-4-иламина;
этил-4-[(3-хлор-4-фторфенил)амино]-5-метилтиоселенофено[3,4-d]пиримидин-7-карбоксилата;
(4-хлорфенил)метил-5,6,7,8-тетрагидропиримидино[5′,6′-5,4]селенофено[2,3-c]пиридин-4-иламина; и
(3-хлор-4-фторфенил)(2-метил(5,6,7,8-тетрагидробензо[1,2-b]пиримидино[5,6-d]селенофен-4-ил)амина.
18. Способ получения селенофенового соединения формулы (I)
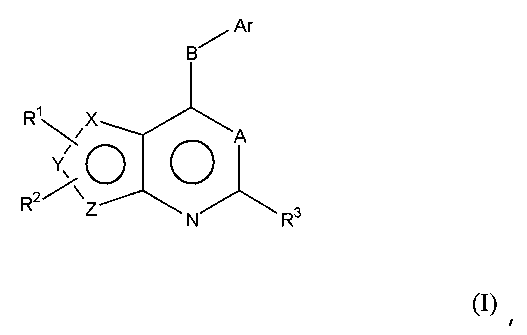
где все группы представляют собой группы, определенные выше, включающий следующие стадии:
- взаимодействие соединения формулы II
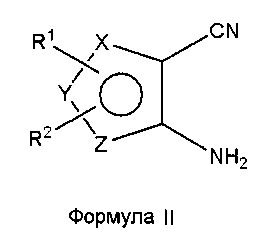
или его производных с муравьиной и серной кислотой с получением соединения формулы III
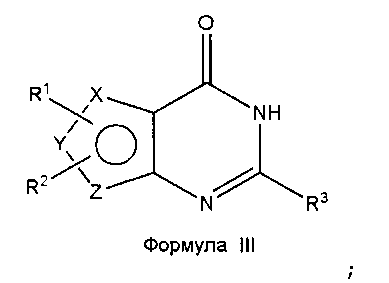
- взаимодействие соединения формулы III с хлорирующими агентами, такими как тионилхлорид или оксихлорид фосфора в присутствии DMF или основания, получая соединение формулы IV
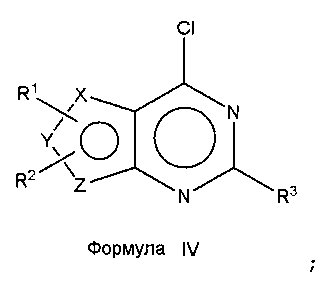
- взаимодействие соединения формулы IV с незамещенными или замещенными ароматическими аминосоединениями в протонном растворителе, таком как изопропиловый спирт, этанол, диметилформамид, и, необязательно, в присутствии основания, с получением соединения формулы I;
где основание может быть органическим или неорганическим, и выбираемым из пиридина, триэтиламина, гидроксида натрия или гидроксида калия.
19. Способ получения селенофенового соединения формулы (I)
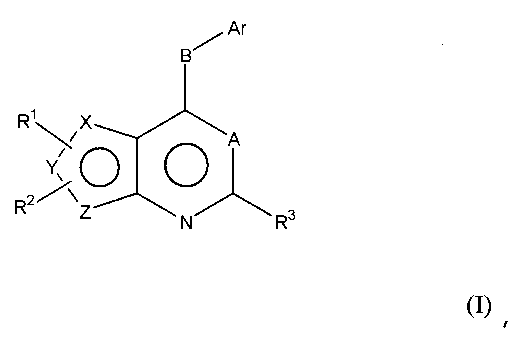
где все группы представляют собой группы, определенные выше, включающий взаимодействие соединения формулы II
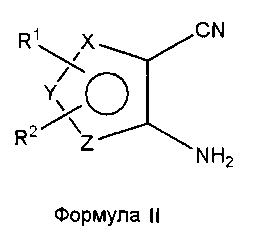
с диметилформамид-диметилацеталем (DMF-DMA) в присутствии растворителя, такого как толуол или ацетонитрил, или уксусная кислота, или их смеси, с получением соединения формулы V

которое затем подвергают взаимодействию с незамещенными или замещенными ароматическими аминосоединениями, с получением соединения формулы I.
20. Способ получения селенофенового соединения формулы (I)
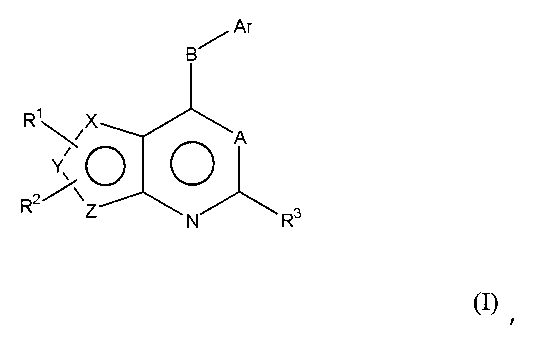
где все группы представляют собой группы, определенные выше, включающий взаимодействие соединения формулы II
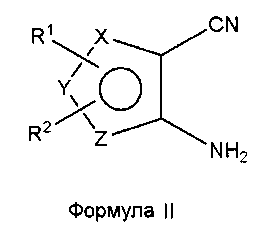
с триэтил/триметил-ортоформиатом с получением соединения формулы VI,
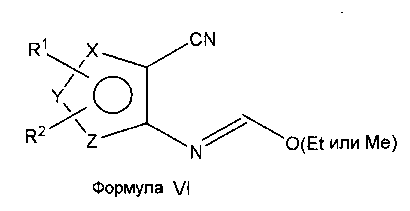
которое затем подвергают взаимодействию с необязательно замещенными ароматическими аминосоединениями в присутствии растворителя, такого как толуол или ацетонитрил, или уксусная кислота, или их смеси, с получением соединения формулы I.
21. Фармацевтическая композиция для лечения или ингибирования, или контролирования клеточного пролиферативного нарушения, содержащая по меньшей мере одно селенофеновое соединение формулы (I)
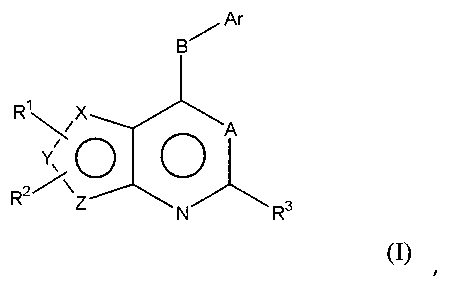
где все группы представляют собой группы, определенные выше,
или его фармацевтически приемлемую соль, и по меньшей мере один ингредиент, выбираемый из фармацевтически приемлемого эксципиента, фармацевтически приемлемого разбавителя и фармацевтически приемлемого носителя.
22. Фармацевтическая композиция по п.21, где указанная композиция дополнительно содержит по меньшей мере один противоопухолевый агент, выбираемый из группы, состоящей из алкилирующих агентов, антиметаболитов, агентов для гормональной терапии, антиангиогенных соединений, антител, ингибиторов VEGF, ингибиторов EGFR (HER1), ингибиторов HER2, ингибиторов CDK, ингибиторов протеасом, ингибиторов серин/треонин-киназы (ингибиторы Raf), ингибиторов тирозинкиназы, антагонистов андрогенных рецепторов и ингибиторов ароматазы.
23. Фармацевтическая композиция по п.21, где эксципиент, разбавитель и носитель выбираются из группы, состоящей из глюкозы, фруктозы, сахарозы, мальтозы, желтого декстрина, белого декстрина, аэросила, микрокристаллической целлюлозы, стеарата кальция, стеарата магния, сорбита, стевиозида, кукурузного сиропа, лактозы, лимонной кислоты, винной кислоты, яблочной кислоты, янтарной кислоты, молочной кислоты, L-аскорбиновой кислоты, dl-альфа-токоферола, глицерина, пропиленгликоля, сложного жирного эфира глицерина, сложного жирного эфира полиглицерина, сложного жирного эфира сахарозы, сложного жирного эфира сорбита, сложного жирного эфира пропиленгликоля, аравийской камеди, каррагенана, казеина, желатина, пектина, агара, витаминов группы В, никотинамида, пантотената кальция, аминокислот, солей кальция, красителей, ароматизаторов, консервантов, дистиллированной воды, физиологического раствора, водного раствора глюкозы, спирта (например, этанола), пропиленгликоля, полиэтиленгликоля, различных масел животного и растительного происхождения, белого мягкого парафина, парафина и воска.
24. Фармацевтическая композиция по п.22, где алкилирующий агент выбирают из N-оксида азотистого иприта, циклофосфамида, ифосфамида, тиотепы, ранимустина, нимустина, темозоломида, алтретамина, апазиквона, бросталлицина, бендамустина, кармустина, эстрамустина, фотемустина, глюфосфамида, мафосфамида, митолактола, цисплатина, карбоплатина, эптаплатина, лобаплатина, недаплатина, оксалиплатина и сатраплатина; антиметаболит выбирают из метотрексата, 6-меркаптопуринрибозида, меркаптопурина, 5-фторурацила, тегафура, доксифлуридина, кармофура, цитарабина, окфосфата цитарабина, эноцитабина, гемцитабина, флударабина, 5-азацитидина, капецитабина, кладрибина, клофарабина, децитабина, эфлорнитина, этинилцитидина, цитозинарабинозида, гидроксимочевины, мельфалана, неларабина, нолатрекседа, окфосфата, динатриевой соли пеметрекседома, пентостатина пелитрексола, ралтитрекседа, триапина, триметрексата, видарабина, винкристина и винорелбина; агенты для гормональной терапии выбирают из экземестана, лупрона, анастрозола, доксеркальциферола, фадрозола, форместана, ацетата абиратерона, финастерида, эпристерида, тамоксифена цитрата, фулвестранта, трелстара, торемифена, ралоксифена, лазофоксифена, летрозола, сагопилона, иксабепилона, эпотилона В, винбластина, винфлунина, доцетаксела и паклитаксела; антиангиогенные соединения выбираются из ацитретина, афлиберцепта, ангиостатина, аплидина, асентара, акситиниба, рецентина, бевацизумаба, бриваниба аланината, циленгитида, комбретастатина, DAST, эндостатина, фенретинида, галофугинона, пазопаниба, ранибизумаба, ребимастата, ремоваба, ревлимида, сорафениба, ваталаниба, скваламина, сунитиниба, телатиниба, талидомида, украина и витаксина; антитела выбираются из трастузумаба, цетуксимаба, бевацизумаба, ритуксимаба, тицилимумаба, ипилимумаба, лумиликсимаба, катумаксомаба, атацицепта, ореговомаба и алемтузумаба; ингибитор VEGF выбирают из сорафениба, DAST, бевацизумаба, сунитиниба, рецентина, акситиниба, афлиберцепта, телатиниба, бриваниба аланината, ваталаниба, пазопаниба и ранибизумаба; ингибитор EGFR (HER1) выбирают из цетуксимаба, панитумумаба, вектибикса, гефитиниба, эрлотиниба и зактима; ингибитор HER2 выбирают из лапатиниба, трастузумаба и пертузумаба; ингибитор CDK выбирают из росковитина и флавопиридола; ингибитор протеасом выбирают из бортезомиба и карфилзомиба; ингибитор серин/треонин-киназы (Raf) представляет собой сорафениб; ингибитор тирозинкиназы выбирают из дазатиниба, нилотиниба, DAST, босутиниба, сорафениба, бевацизумаба, сунитиниба, AZD2171, акситиниба, афлиберцепта, телатиниба, иматиниба мезилата, бриваниба аланината, пазопаниба, ранибизумаба, ваталаниба, цетуксимаба, панитумумаба, вектибикса, гефитиниба, эрлотиниба, лапатиниба, тратузумаба и пертузумаба; антагонист андрогенных рецепторов выбирают из нандролона деканоата, флуоксиместерона, андроида, простатида, андромустина, бикалутамида, флутамида, апо-ципротерона, апофлутамида, хлормадинона ацетата, андрокура, таби, ципротерона ацетата и нилутамида; ингибитор ароматазы выбирают из анастрозола, летрозола, тестолактона экземестана, аминоглютетимида и форместана.
25. Способ лечения или ингибирования, или контролирования клеточного пролиферативного нарушения у теплокровного животного, нуждающегося в этом, где указанный способ включает введение теплокровному животному терапевтически эффективного количества по меньшей мере одного селенофенового соединения формулы (I)
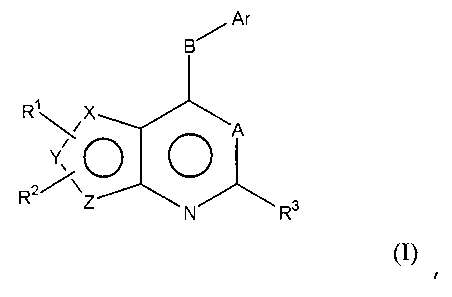
где все группы представляют собой группы, определенные выше, или его фармацевтически приемлемой соли.
26. Способ лечения или ингибирования, или контролирования клеточного пролиферативного нарушения у теплокровного животного, нуждающегося в этом, где указанный способ включает введение теплокровному животному терапевтически эффективного количества по меньшей мере одной композиции по п.22.
27. Способ лечения или ингибирования, или контролирования клеточного пролиферативного нарушения у теплокровного животного, нуждающегося в этом, где указанный способ включает введение теплокровному животному терапевтически эффективного количества по меньшей мере одной композиции по п.23.
28. Способ лечения или ингибирования, или контролирования клеточного пролиферативного нарушения у теплокровного животного, нуждающегося в этом, по п.26, где указанное клеточное пролиферативное нарушение выбирается из псориаза, келоидов и других гиперплазий, влияющих на кожу, эндометриоза, скелетных нарушений, ангиогенных нарушений или пролиферативных нарушений кровеносных сосудов, легочной гипертензии, фиброзных нарушений, пролиферативных нарушений мезангиальных клеток, полипов толстой кишки, поликистоза почек, доброкачественной гиперплазии предстательной железы (ВНР) и солидных опухолей, таких как рак молочной железы, рак дыхательных путей, рак мозга, рак репродуктивных органов, рак желудочно-кишечного тракта, рак мочевого тракта, рак глаз, рак печени, рак кожи, рак головы и шеи, рак щитовидной железы, рак паращитовидных желез, и из лимфом, сарком и лейкемий.
29. Способ лечения или ингибирования, или контролирования клеточного пролиферативного нарушения по п. 26, где указанное введение включает пути введения, выбранные из группы, состоящей из внутрибрюшинного введения (IP), внутривенного введения (IV), орального введения (РО), внутримышечного введения (IM), внутрикожного введения (IC), интрадермального введения (ID), внутриматочного введения, внутриопухолевого введения и интраректального введения.
| US 20090163494 A1, 25.06.2009 | |||
| US 20100004208 A1, 07.01.2010 | |||
| US 20100272678 A1, 28.10.2010 | |||
| WO 2009034571 A2, 19.03.2009 | |||
| RU 2001102777 A, 27.02.2003 |
Авторы
Даты
2015-10-20—Публикация
2011-12-07—Подача