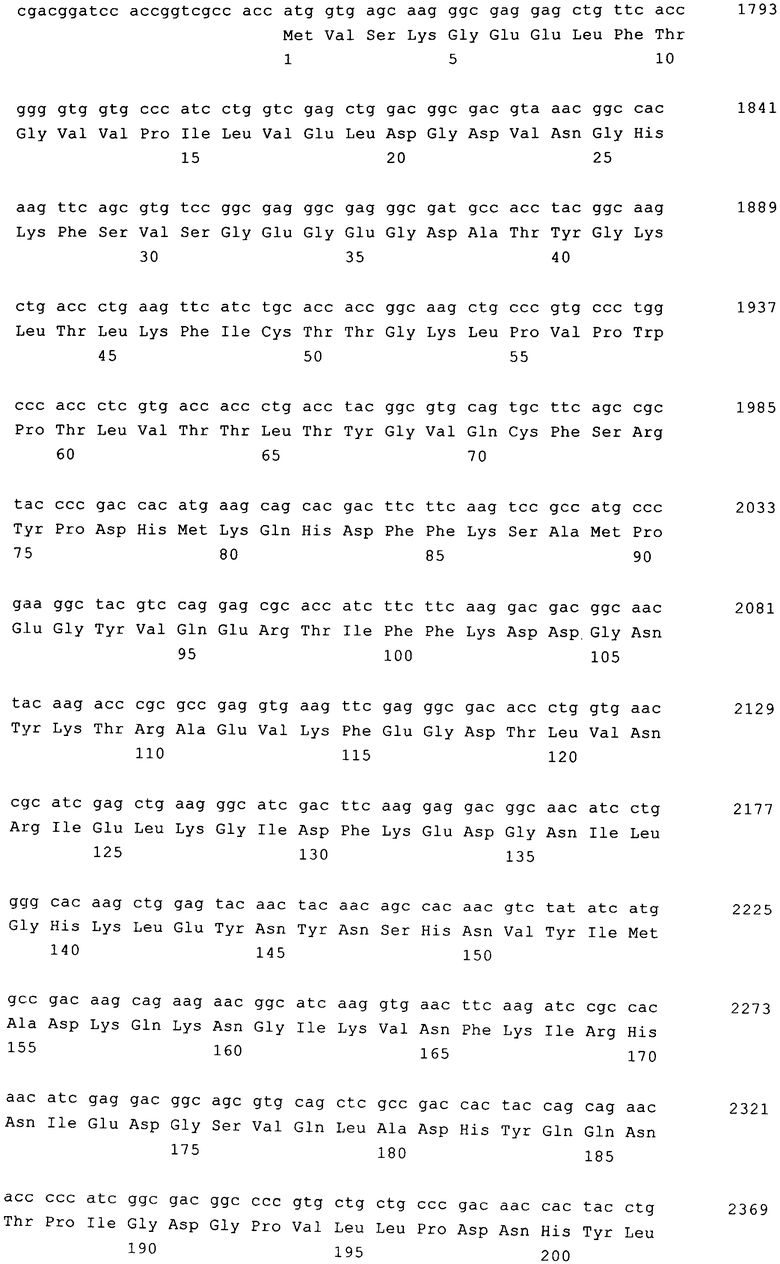
Настоящее изобретение относится к вирусному самоинактивирующемуся (SIN) вектору на основе вируса саркомы и лейкоза птиц (ASLV), вирусным частицам, содержащим вектор, предлагаемый в изобретении, расщепляющей-пакующей системе, которая содержит или состоит из SIN-вектора, первой хелперной плазмиды, которая служит для экспрессии слитого вирусного белка gag-pol, и второй хелперной плазмиды, которая служит для экспрессии оболочечного белка (env) ретровируса, а также к способу получения вирусной частицы с помощью расщепляющей-пакующей системы, прежде всего путем экспрессии в культивируемых человеческих клетках. Кроме того, изобретение относится к вирусной частице, предназначенной для применения в качестве лекарственного средства, прежде всего для переноса трансгена в клетки, а также к применению вирусной частицы для получения лекарственного средства. Первая и вторая хелперные плазмиды, например, входящие в пакующую клеточную линию или применяемые для ее кратковременной трансфекции, служат для создания нереплицирующихся (RCR-некомпетентных) вирусных частиц, которые содержат РНК, имеющую предлагаемый в изобретении SIN-LTR (длинный концевой повтор) на 3'-конце, где РНК может иметь терапевтически эффективный сегмент, который, например, представляет собой трансген. Для этого SIN 3'-LTR характерно наличие обширной делеции в U3-области, которая в процессе обратной транскрипции копируется в 5' LTR.
Для экспрессии трансгена, который, например, в том случае, когда он предназначен для применения в генной терапии, может представлять собой человеческий или гетерологичный ген, вирусный SIN-вектор предпочтительно содержит кассету экспрессии, расположенную 5'-в направлении относительно 3' SIN LTR.
Кроме того, вектор, предлагаемый в изобретении, находящийся в человеческих пакующих клетках, позволяет получать вирусные частицы с высоким титром и отличается тем, что в процессе трансдукции клеток-мишеней, прежде всего человеческих клеток, путем контакта клеток экстракорпорально, т.е. in vitro, или путем введения частицы, адаптированной для этой цели, в клетки пациента, трансдуцированные in vivo, достигают стабильной и отличающейся небольшим снижением экспрессии трансгена соответственно в течение длительного периода времени, при этом частота трансформации клеток-мишеней в результате онко генной активации является низкой. Кассета экспрессии содержит промотор, расположенный в 5'-направлении относительно нуклеотидной последовательности, кодирующей трансген, и посттранскрипционный регуляторный элемент (PRE), прежде всего WPRE (PRE вируса гепатита сурков (WHV)), предпочтительно расположенный в 3'-направлении относительно последовательности, кодирующей трансген.
Известный уровень техники
Hughes (Folia Biologika 50, 2004, сс.107-119) описал серии вирусных векторов на основе вируса птичьего лейкоза (ALV), которые для повышения производства компетентных в отношении репликации ретровирусов (RCR) несли функциональные LTR (RCAS: Replication-Competent ASLV LTR with a Splice Acceptor; компетентные в отношении репликации LTR ASLV с акцепторным сайтом сплайсинга). В этой системе все компоненты, необходимые для производства вируса, находились в одной плазмиде (подобно тому, как это имеет место в полноразмерном вирусе), а возможный трансген встраивали в 3'-нетранслируемую область (UTR).
Ни с соавторами (Molecular Therapy, 2008, сс.1617-1623) продемонстрировали, что ASLV не имеет тенденцию к предпочтительному встраиванию внутрь проонкогенов или в непосредственной близости к ним и что LTR ALSV не имеют тенденцию к активации примыкающих генов и на этой основе сделали заключение о том, что ALSV может представлять собой приемлемую основу для вирусных векторов. Установлено, что путем усовершенствования полиаденилирования можно получать делеции энхансерной области (энхансер) в LTR или ингибировать процесс транскрипции с помощью сигнала терминации.
Ни с соавторами (Human Gene Therapy, 2007, сс.691-700)) и Mitchell с соавторами (Plos Biology, 2004, e234) продемонстрировали, что ALSV не имеет тенденцию к предпочтительному встраиванию внутрь проонкогенов или в непосредственной близости к ним, прежде всего не обладает выраженным предпочтением к областям, расположенным вблизи промотора. Вследствие этого опасность инсерционнного мутагенеза оценивается как более низкая по сравнению с применяемыми в клинических условиях векторными системами на основе вируса мышиного лейкоза (MLV) и вируса иммунодефицита человека (ВИЧ). Установлено, что делеция энхансерной области (энхансер) в LTR или предупреждение процесса транскрипции с помощью сигнала терминации могут рассматриваться как желательные. Из-за архитектуры вектора (1 плазмида, реплицирующаяся) эта система, как правило, является не пригодной для клинических применений.
Ни с соавторами продемонстрировали, что вирусные векторы, полученные из ASLV, которые имеют интактные LTR, не реплицируются в клетках млекопитающих. Точная причина этого явления не установлена.
Благодаря характерной для ретровирусов архитектуре 2 LTR ретровирусов имеют присущие им слабые полиА-сигналы. Для лентивирусных векторов установлено, что процесс транскрибирования с 3'-конца встроенного вирусного вектора может приводить к нежелательной активации гена, что описано, например, у Zaiss с соавторами (Journal of Virology, 2002, сс.7209-7219) и Schambach Baum соавторами (Molecular Therapy, 15(6), 2007, сс.1167-1173). Важным является также то, что U3-область помимо промоторных элементов и энхансерных элементов содержит также энхансеры полиаденилирования, и поэтому для каждого семейства вирусов должны быть вновь валидированы любые делеции с учетом остаточной энхансерной активности и эффективности полиаденилирования.
Для векторов на основе гамма-ретровирусов Kraunus с соавторами (Gene Therapy, 2004, сс.568-1578) предложили удалять целиком область энхансерного элемента и промотора 3" U3-области и оставлять только первые 22 пары оснований (п.о.), расположенных против хода транскрипции относительно энхансера, и последние 14 п.о., расположенных по ходу транскрипции. У ASLV и вируса саркомы Рауса (RSV) LTR-область усложнена наличием очень короткой R-области (короткая повторяющаяся последовательно в каждом конце генома), в результате чего полиА-сигнал (ААТААА) находится в U3-области. Это является очень необычным для ретровирусов (обычно он локализован в R-области) и делает конструирование SIN-вектора очень сложным.
Aubert с соавторами (The J. of Cell Biology, 113, 1991, сс.497-506) и Flamant с соавторами (Journal of General Virology, 74, 1993, сс.39-46) описали делеции в U3-области ALV, затрагивающие положения от -149 до -15 относительно R-области, и от -149 до -15, и от -98 до -59 соответственно, и в этом случае также относительно R-области. Во все эти U3-области все еще входили сохранившиеся энхансерные элементы (Cullen и др., МСВ, 1985, сс.438-447), что создавало проблемы для возможных клинических применений. Это связано с тем, что эти энхансерные элементы могли нарушать регуляцию примыкающих генов (например, онкогенов) путем инсерционного мутагенеза.
Задача изобретения
Таким образом, в основу изобретения была положена задача разработать пригодную для применения в клинических условиях расщепляющую-пакующую систему, включающую вирусный вектор и хелперные плазмиды, которая предназначена для производства в клетках млекопитающих (например, человеческих клетках, например, линии НЕК293Т), с помощью которой вирусный вектор можно получать в виде упакованной вирусной частицы, что минимизирует риск рекомбинации с компетентными в отношении репликации ретровирусами (RCR), а также минимизирует риск того, что инсерция вирусного вектора приведет к активации примыкающих генов в клетке-мишени (инсерционный мутагенез). Предпочтительно вирусный вектор и система, содержащая хелперные плазмиды, соответственно должны позволять также создавать вирусные частицы, имеющие высокие титры, при этом вирусный вектор должен содержать кассету экспрессии, из которой трансген и регуляторные последовательности гена (например, shPHK (короткие (или малые) образующие шпильку РНК), miPHK (микроРНК) и др.) эффективно транскрибируются и/или транслируются. Предпочтительно эти векторы псевдотипированы с приемлемыми для применения в клинических условиях оболочечными белками (например, RD114/TR, env амфотропного MLV, гликопротеин вируса везикулярного стоматита (VSVg)). Все эти критерии следует рассматривать в комбинации, так как они имеют решающее значение для возможных клинических применений.
Подробное описание изобретения
Задача, положенная в основу изобретения, решается с помощью отличительных признаков, которые представлены в формуле изобретения, и прежде всего с помощью вектора, обладающего требуемыми свойствами. Вирусную ДНК можно транскрибировать из плазмиды, которая согласно формуле изобретения представляет собой вирусный вектор на основе ASLV, 3э U3 которого продуцирует или соответственно представляет собой самоинактивирующийся 3э LTR (SIN-LTR), а также вирусную частицу, которая содержит нуклеотидную последовательность, кодирующую вирусный вектор, прежде всего РНК. Кроме того, изобретение относится к системе, содержащей первую хелперную плазмиду, которая кодирует в кассете экспрессии кодирующую последовательность слитого белка gag-pro-pol ASLV, и вторую хелперную плазмиду, которая кодирует в кассете экспрессии оболочечный белок (env), например, ASLV, RD114/TR, амфотропного MLV, VSVg или экотропного MLV.
Когда первая и вторая хелперная плазмиды присутствуют в эукариотической клетке, обозначенной далее как пакующая клетка, то продуцируются вирусные частицы с высоким титром, вирусная РНК которых сама является самоинактивирующейся (SIN) из-за делеций в 5' U3-области, возникающей в клетке-мишени из 3э U3-области в процессе обратной транскрипции в вирусную ДНК, но которые обеспечивают высокий уровень транскрипции и эффективную трансляцию трансгена, который находится в кассете экспрессии, расположенной в 5э-направлении перед 3э SIN-LTR. В такой конфигурации активация примыкающих геномных последовательностей при встраивании вирусного вектора существенно снижается. Снижение активации примыкающих последовательностей продемонстрировано для γ-ретровирусных векторов Zychlinski с соавторами (Mol. Ther., 16, 2008, сс.718-725).
Мутации, известные для вирусных SIN-векторов на основе других ретровирусов, например лентивирусов, которые объединяют свойства высокого титра в пакующих клетках, с одной стороны, отсутствие промоторной активности у LTR, а также эффективную транскрипцию трансгена из кассеты экспрессии с находящимся внутри вектором без процесса транскрипции в геномные последовательности в сайте инсерции, нельзя применять при конструировании SIN-LTR-векторов на основе ASLV. Это связано с устройством функциональных элементов в индивидуальных вирусах и их взаимодействием с клеточными факторами хозяина, которые не являются идентичными друг другу, и не позволяет предсказывать воздействие изменения последовательностей на титр, на предупреждение активации примыкающих геномных последовательностей в сайте инсерции и на транскрипцию трансгена из внутренней кассеты экспрессии.
Вирусный вектор, предлагаемый в изобретении, содержит вместо LTR дикого типа 3'-LTR, в U3-области которого путем делеции удален большой сегмент, в результате чего транскрипциональная активность промоторной и энхансерных областей U3 в значительной степени, предпочтительно полностью, уменьшена или элиминирована соответственно. Элиминацию промоторной и энхансерных областей U3-области, например, в результате делеции или замены нуклеотидов этой области, определяют с помощью оценки активности, когда промоторная активность подвергнутой делеции или замененной U3-области обладающего функциональной активностью расположенного в 3'-направлении репортерного гена находится на уровне фоновой активности лишенного промотора репортерного гена, как, например, в случае полностью удаленной U3-области. В частности, согласно изобретению U3-область ASLV имеет только нуклеотиды 1-27 и нуклеотиды 187-229, предпочтительно только нуклеотиды 1-27 и 207-229 из состоящей из 229 нуклеотидов U3-области дикого типа (SEQ ID NO: 1). Указанная измененная 3'-U3-область вирусного вектора, предлагаемого в изобретении, в которой удалены в результате делеции из U3-области дикого типа нуклеотиды 28-186 и предпочтительно удалены в результате делеции также нуклеотиды 187-202, после обратной транскрипции и интеграции в геном киетки-мишени практически не обладает промоторной активностью и/или энхансерной активностью. Вирусная РНК, которую можно упаковывать, находится под контролем сильного промотора, расположенного 5'-направлении, который утрачивается в процессе обратной транскрипии и не входит в вирусную РНК, образовавшуюся в результате транскрипции соответственно. Это позволяет создавать транскрипт, который в сочетании с первой и второй хелперной плазмидой, можно применять для получения имеющих высокий титр вирусных частиц, которые содержат вирусную РНК.
Удаленные в результате делеции промоторные области и энхансерные области необязательно можно заменять встроенной нуклеотидной последовательностью, которая не обладает ни промоторной активностью, ни энхансерной активностью.
3'-SIN-LTR вектор, предлагаемый в изобретении, может состоять из вышеуказанных сегментов имеющей делецию U3-области дикого типа, R-области дикого типа и U5-области дикого типа. U3-область с делениями, предлагаемыми в изобретении, необязательно может содержать дополнительные нуклеотидные последовательности, которые не обладают промоторной активностью, расположенные между сохранившимися сегментами U3-области дикого типа, которые выбирают, например, из группы, включающей miPHK, shPHK, энхансеры полиаденилирования (USE), распознаваемые рекомбиназами последовательности (например, LoxP, Rox, FRT) и изолирующие элементы (например, cHS4).
Для инсерции нуклеотидных последовательностей, не обладающих промоторной активностью, в предлагаемую в изобретении U3-область эта область предпочтительно должна иметь уникальный сайт рестрикции, распознаваемый рестриктазой, прежде всего, предпочтительно, чтобы нуклеотиды 187-190 согласно нумерации U3-области дикого типа в результате мутации были заменены на последовательность оснований CGTA, что приводит к созданию второго сайта рестрикции SnaBI, который имеет распознаваемую последовательность TACGTA.
В качестве альтернативы делеции нуклеотидов 187-202 можно также изменять путем мутации нуклеотиды 200-206 (ТАТТТАА), например, с получением последовательности TGTCTAA. Вероятно, нуклеотиды 200-206 формируют ТАТА-бокс в U3-области дикого типа, поэтому мутация, которая изменяет этот ТАТА-бокс, снижает или элиминирует часть промоторной активности U3-области, обусловленную этим сегментам.
Имеющая делеции U3-область, предлагаемая в изобретении, содержит также сайт присоединения интегразы (присоединение интегразы), прежде всего на нуклеотидах 1-25, а также полиА-сигнал, например, на нуклеотидах 223-228, в каждом случае нумерация нуклеотидов соответствует нумерации в U3-области дикого типа. Вероятно, сохранение сайта присоединения интегразы и полиА-сигнала является важным для заражения вирусом. При создании изобретения неожиданно было установлено, что вектор, предлагаемый в изобретении, с одной стороны, обеспечивает получение вирусных частиц, имеющих высокий титр в пакующей клетке или линии пакующих клеток, а, с другой стороны, обеспечивает эффективную транскрипцию трансгена из кассеты экспрессии под контролем сильного внутреннего промотора после обратной транскрипции и интеграции в геном клетки-мишени, без транскрипци 3'-SIN-LTR в областях, примыкающих к сайту интеграции, или активации примыкающих геномных последовательностей.
Без осуществления процесса концентрирования титр вирусных частиц, полученных в пакующих клетках, которые содержат вирусную РНК, содержащую 3' SIN-LTR, предлагаемый в изобретении, или 3' U3-область, предлагаемую в изобретении, составляет примерно 1х10 инфекционных частиц/мл. При этом на титр влияет ген, кодирующий слитый белок gag-pro-pol и оболочечный белок соответственно, первой и второй хелперной плазмиды соответственно, и не существенно влияет природа или протяженность делеции U3-области.
При создании изобретения неожиданного было установлено, что экспрессия трансгена из кассеты экспрессии в вирусных векторах, предлагаемых в изобретении, которые имеют SIN-делецию, примерно в 3 раза превышала экспрессию в применяемом для сравнения векторе, в котором 3' LTR включал U3-область, имеющую последовательность дикого типа. Согласно изобретению предпочтительным является также, чтобы кодирующие последовательности первой и/или второй хелперных плазмид включали оптимизированные кодоны, т.е. вирусные кодоны были заменены на кодоны клетки-мишени, прежде всего, заменены на человеческие кодоны, например, с использованием способов получения вирусных частиц и вирусных векторов, предлагаемых в изобретении, которые, например, находят применение в качестве лекарственного средства или для производства фармацевтических композиций. Предпочтительная хелперная плазмида, предлагаемая в изобретении, содержит последовательность, которая кодирует слитый белок gag-pro-pol, в которой вирусные кодоны адаптированы к человеческим наиболее часто встречающимся кодонам.
Для применения в качестве лекарственного средства вирусную частицу, содержащую вирусный вектор, можно приготавливать таким образом, чтобы ее можно было вводить пациенту/человеку или животному кроме человека. В альтернативном варианте вирусная частица и вирусный вектор соответственно можно приводить в контакт с клетками, полученными из организма пациента, т.е. для трансдукции клеток in vitro, которые затем, необязательно после стадии культивирования и/или селекции, приготавливают и применяют соответственно в качестве трансдуцированных клеток, предназначенных для введения пациенту, при этом предпочтительно пациент представляет собой того же пациента, из организма которого получены клетки.
Согласно изобретению в имеющей оптимизированные кодоны кодирующей последовательности слитого белка gag-pro-pol поддерживался начальный сдвиг рамки считывания на -1 (нуклеотид) и транзиция pro в роl относительно ASLV дикого типа.
Установлено, что адаптация наиболее часто встречающихся кодонов ASLV к наиболее часто встречающимся кодонам клетки-мишени, прежде всего к человеческим наиболее часто встречающимся кодонам, в кодирующих областях хелперных плазмид приводит к существенному повышению титра вирусных частиц, так, например, только адаптация наиболее часто встречающихся кодонов слитого белка gag-pro-pol к человеческим наиболее часто встречающимся кодонам сама по себе приводит к повышению примерно в 50 раз титра вирусных частиц в человеческих пакующих клетках.
Для адаптации наиболее часто встречающихся кодонов к человеческим наиболее часто встречающимся кодонам предпочтительно применяют оптимальные (но, не ограничиваясь только ими) пулы тРНК из Homo sapiens; например, кодон глицина GGT с целью адаптации предпочтительно заменяют на GGC. Кроме того, удаляли негативные вызывающие нестабильность РНК мотивы, а также криптические сайты полиаденилирования, а также вторичную структуру РНК, с получением более стабильной мРНК, которая обладала более высокой способностью к трансляции в человеческих клетках. Кроме того, деактивировали в кодирующей последовательности встречающийся в естественных условиях донорный сайт сплайсинга, акцепторный сайт сплайсинга и дополнительные криптические сигналы сплайсинга. Таким образом, предпочтительная хелперная плазмида несет неактивный донорный сайт сплайсинга в гене gag-pol, например, соответствующий нуклеотидам 1501-1502 в SEQ ID NO: 14. Предпочтительно gag кодируется нуклеотидами 1475-3436 SEQ ID NO: 14, a pol кодируется нуклеотидами 3738-6291 SEQ ID NO: 14, поскольку в этих сегментах практически удалены криптические вызывающие нестабильность мотивы РНК и сайты полиаденилирования, а также вторичная структура РНК, то в результате можно получать вирусные частиц, обладающие высокой эффективностью трансдукции, с высоким титром.
И, наконец, согласно изобретению предпочтительно, чтобы вирусный вектор, предпочтительно помимо первой хелперной плазмиды, а также предпочтительно помимо второй хелперной плазмиды, не имел никаких последовательностей, гомологичных последовательностям клетки-мишени, а также предпочтительно также, в частности, не имел перекрывающихся последовательностей, например, не имел сегментов последовательностей, в которых более 5 нуклеотидов были гомологичны друг другу, предпочтительно не имел сегментов последовательностей, в которых более 10-20 нуклеотидов были гомологичны друг другу. Тем самым минимизируется вероятность рекомбинации в пакующей клетке и/или клетке-мишени и минимизируется также вероятность создания RCR.
Таким образом, изобретение относится к вирусной РНК, которая в направлении от 5'- к 3'-концу содержит или состоит из 5' R-области и 5' U5-области, сайта связывания праймера (PBS), сигнала упаковки (40, который в отличие от известных из существующего уровня техники гамма-ретровирусных или лентивирусных векторов действует без ретровирусного донорного сайта сплайсинга, кассеты экспрессии для трансгена или содержащей трансген соответственно и укороченной 3' U3-области (обозначена как Д или d), предлагаемой в изобретении, 3' R-области и выступающего полиА-сегмента (полиА-хвост), а также к вектору, предназначенному для транскрипции вирусной РНК, который в дополнение к нуклеотидной последовательности, кодирующей вирусную РНК, имеет расположенный в 5'-направлении относительно ее 5' R-области, эукариотический или вирусный промотор соответственно, и при этом в векторе нуклеиновая последовательность, кодирующая вирусную РНК, присутствует в форме ДНК, в которой 3' SIN-LTR имеет полиА-сегмент.
Кроме того, изобретение относится к применению вирусной РНК и вирусной частицы, которая содержит вирусную РНК, в качестве лекарственного средства и для приготовления фармацевтической композиции, предназначенной для трансдукции клеток-мишеней, например, человеческих соматических клеток, а также к фармацевтическим композициям, которые содержат вирусную РНК или вирусные частицы, содержащие вирусную РНК, и к применению указанных фармацевтических композиций в качестве лекарственного средства для переноса трансгена в клетку, прежде всего при осуществлении генной терапии.
Кроме того, изобретение относится к клеткам, которые включают интегрированную или неинтегрированную нуклеотидную последовательность, которые получают путем контакта с вирусными частицами, предлагаемыми в изобретении, и которые содержат U3-область, предлагаемую в изобретении, например, ДНК-сегмент, полученный в результате обратной транскрипции из вирусной РНК, предлагаемой в изобретении. Указанные клетки могут представлять собой экстракорпоральные клетки животных или интракорпоральные клетки животных за исключением человеческих гамет.
Кассета экспрессии содержит промотор и по меньшей мере одну транскрибируемую и/или транслируемую последовательность трансгена, которая может представлять собой ген, гомологичный или гетерологичный клетке-мишени, и предпочтительно расположенный против хода транскрипции относительно транскрибируемой последовательности трансгена PRE или других пост-транскрипциональных регуляторных сегментов нуклеиновых кислот или модулей нуклеиновых кислот. Транскрибируемая последовательность может содержать также внутренние сайты связывания рибосом (IRES) в сочетании с кодирующими белок последовательностями, расположенным по ходу транскрипции относительно них, а также другие функциональные сегменты нуклеиновых кислот или кодирующие ферменты сегменты нуклеиновых кислот (например, двунаправленные промоторы, кодирующие последовательности сайтов, расщепляемых 2А-протеазой, или гены 2А-протеазы). Кроме того, необязательно изолирующая последовательность может быть встроена в имеющую делеции 3' U3-область, например, в сайт рестрикции, находящейся в ней, которая ослабляет взаимодействие трансгена с примыкающими геномными последовательностями, или может быть встроена распознаваемая рекомбиназой последовательность, например, распознаваемая последовательность, выбранная из группы, включающей rox, loxP, FRT. После обратной транскрипции и копирования в 5' LTR распознаваемую рекомбиназой последовательность можно активировать путем добавления и экспрессии соответственно рекомбиназы в клетках-мишенях, и, например, сегменты нуклеиновой кислоты в интегрированной ДНК (например, часть кассеты экспрессии), расположенные между распознаваемыми рекомбиназой последовательностями, можно переворачивать или удалять. Другие последовательности, которые можно встраивать в 3' U3-область, содержат, например, последовательности-мишени мякроРНК, короткие (или малые) образующие шпильку РНК или сегменты последовательности, которые облегчают выявление вставки в помощью ПЦР.
Имеющая делеции U3-область в 3' SIN-LTR, предлагаемая в изобретения, в результате делеции энхансерных и промоторных элементов из U3-области дикого типа позволяет создавать вирусные частицы, титры которых превышают титры векторов в пакующих клетках, которые имеют LTR дикого типа, поскольку часто наблюдается резкое снижение вирусных титров, когда не осуществляют делеции в U3-области.
Транскрипция трансгенов, входящих в кассету экспрессии, контролируется промотором кассеты экспрессии, который обозначают также как внутренний промотор. При создании настоящего изобретения высказано предположение о том, что имеющие делеции U3-области, предлагаемые в изобретении, имеют полиА-сигнал, который устраняет процесс транскрипции позади векторной последовательности и обеспечивает правильный полиА-сигнал. Это предположение подтверждается наличием улучшенной в 3 раза экспрессии трансгена, входящего в кассету экспрессии вектора, предлагаемого в изобретении, по сравнению с экспрессией трансгена из вектора, который содержит 3' LTR дикого типа.
Наиболее предпочтительно из нуклеотидной последовательности вирусного вектора, предлагаемого в изобретении, полностью удалены в результате делеции последовательности, кодирующие структурные белки вируса, включая донорный сайт сплайсинга (SD), например, имеет место полная деления последовательностей gag, env, pol и src. Установлено, что в векторах на основе ASLV, у которых удалены в результате делеции последовательности, которые кодируют структурные белки вируса, также отсутствует донорный сайт сплайсинга. При создании изобретения неожиданно было установлено, что указанный вектор на основе ASLV позволяет осуществлять упаковку вирусной РНК в пакующих клетках с помощью расщепляющей-пакующей системы. Это является неожиданным, поскольку, как известно, в ретровирусных векторах области кодирующих вирусных последовательностей требуются для упаковки, поскольку в область этих последовательностей, кодирующих структурные белки вируса, входят сигналы, требующиеся для экспорта РНК, для взаимодействия с нуклеокапсидом вируса и для обратной транскрипции, например, как в случае ВНЧ. Таким образом, вектор, предлагаемый в изобретении, может содержать сигнал упаковки! (У), который входит в SEQ ID NO: 5 (нуклеотиды 1042-1292) без сегментов последовательностей, которые кодируют структурные белки вируса.
Нуклеотидная последовательность вирусного вектора, в которой отсутствует донорный сайт сплайсинга, являющаяся предпочтительным вариантом осуществления изобретения, представляет собой важное отличие от известных лентивирусных или γ-ретровирусных векторов, которые несут встречающийся в естественных условиях вирусный донорный сайт сплайсинга, расположенный против хода транскрипции относительно сайта связывания праймера. В этих известных векторах донорный сайт сплайсинга требуется для получения высоких титров вирусных частиц. При создании изобретения неожиданно было установлено, что вектор, предлагаемый в изобретении, позволяет получать высокие тиры в пакующих клетках даже без его встречающегося в естественных условиях или другого донорного сайта сплайсинга. Поскольку встречающийся в естественных условиях донорный сайт сплайсинга ASLV локализован в гене gag, его полная делеция приводит в результате к удалению донорного сайта сплайсинга. Согласно другому предпочтительному варианту осуществления изобретения в вектор не входит также вирусный акцепторный сайт сплайсинга. Акцепторный сайт сплайсинга ASLV локализован в гене ро1, поэтому его полная делеция приводит в результате также к удалению акцепторного сайта сплайсинга.
Удаление путем делеции донорного сайта сплайсинга и акцепторного сайта сплайсинга в векторе, предлагаемом в изобретении, приводит к оптимизации получения вирусных частиц в пакующих клетках и, кроме того, повышает биологическую безопасность вектора, поскольку рекомбинация с компетентными в отношении репликации ретровирусами становится более трудной. Возможное взаимодействие с клеточными сигналами сплайсинга также является менее вероятным в интрагенных вставках вектора.
Наиболее предпочтительно вектор в 5'-области содержит R-область, U5-область и сигнал упаковки в нуклеотидной последовательности, которая не кодирует структурные белки вируса, и к которой в 3'-направлении присоединена кассета экспрессии трансгена, например, непосредственно, прежде всего после лидерной области. Установлено, что вирусный вектор на своем 5'-конце может содержать R-область, U5-область и сигнал упаковки, который содержит или состоит из нуклеотидов 1042-1292 SEQ ID NO: 5, причем предпочтительно в 3'-направлении к этой последовательности примыкает кассета экспрессии, содержащая трансген.
Для целей изобретения порядок расположения генетических элементов представлен в направлении от 5'- к 3'-концу, если специально не указано иное;
нуклеотидные последовательности представлены в направлении от 5'- к 3'-концу.
Подробное описание изобретения
Ниже изобретение описано более подробно с помощью примеров со ссылкой на чертежи, на которых показано:
на фиг.1 - схематическая структура ASLV дикого типа;
на фиг.2 - схематическая структура SIN-вектора, предлагаемого в изобретении, и плазмиды, содержащей вектор;
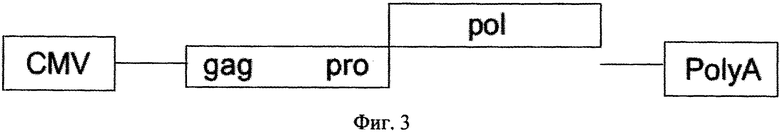
на фиг.3 - схематическая структура первой хелперной плазмиды;
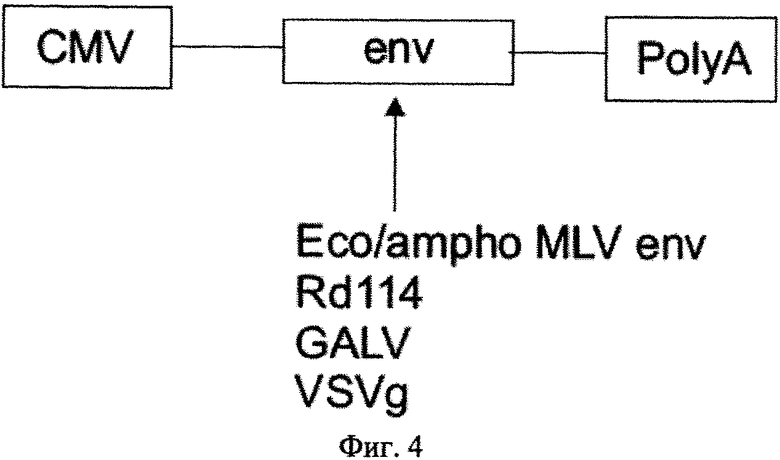
на фиг.4 - схематическая структура второй хелперной плазмиды;
на фиг.5 - сравнение U3-области (U3) дикого типа с имеющей делеции U3-областью (dU3), предлагаемой в изобретении, с имеющей делеции U3-областью, предлагаемой в изобретении, без ТАТА-бокса (dU3 поТАТА) и с имеющей делеции U3-областью, предлагаемой в изобретении, которая содержит мутантный ТАТА-бокс (dU3 TATAmut);
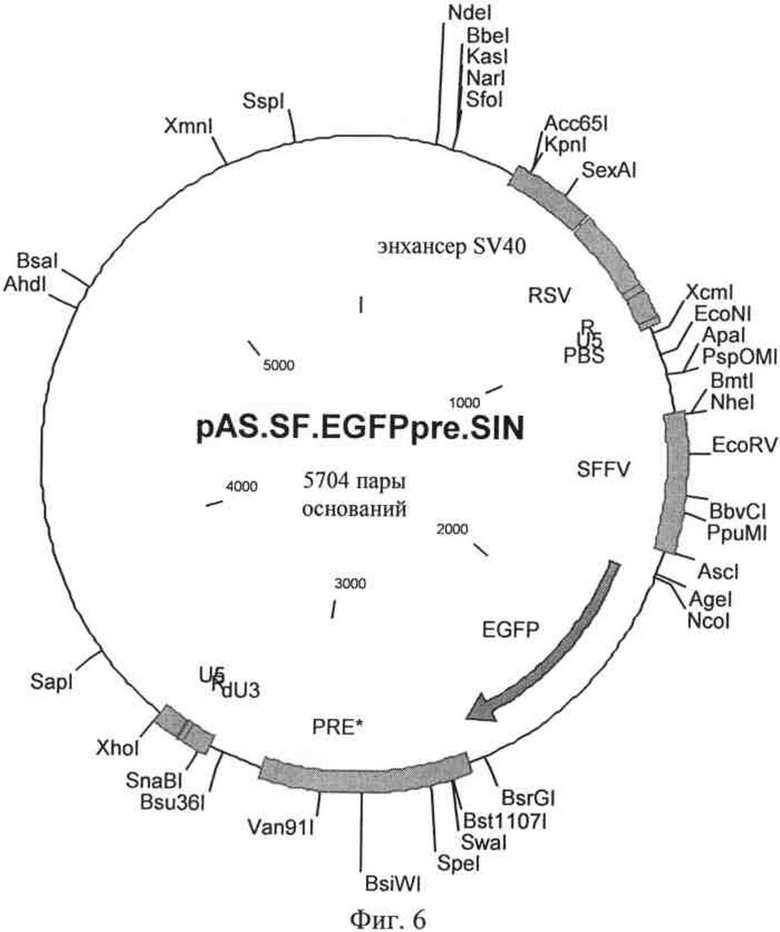
на фиг.6 - плазмидная карта вектора, предлагаемого в изобретении, в котором кассета экспрессии кодирует EGFP (усиленный зеленый флуоресцентный белок) в качестве примера трансгена;
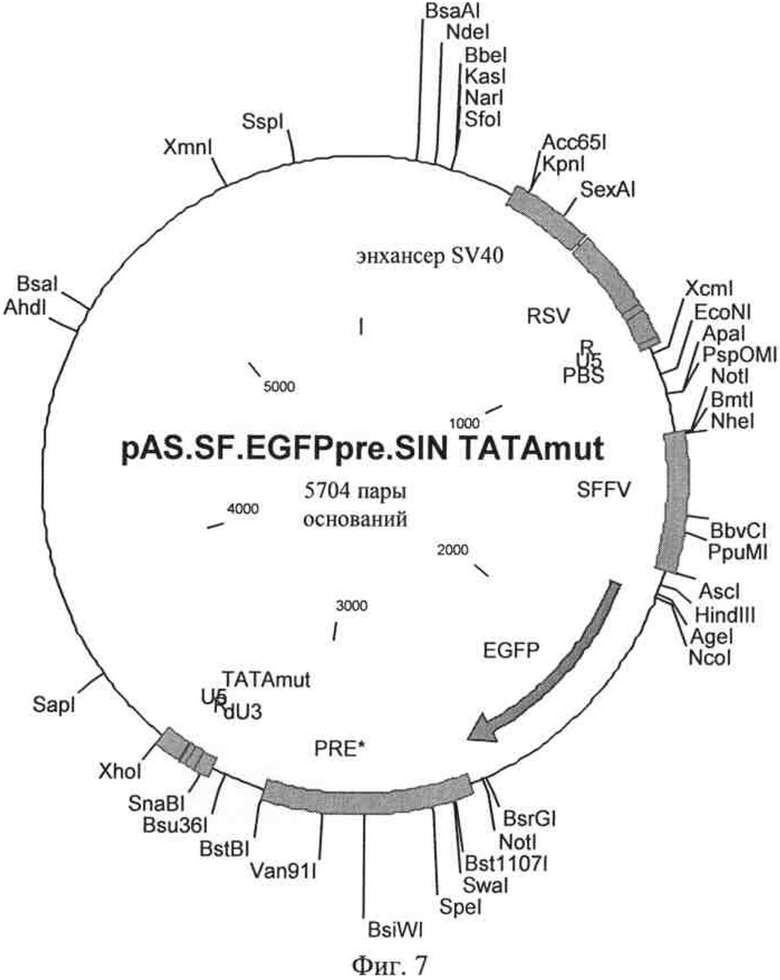
на фиг.7 - карта плазмиды, содержащей вектор, предлагаемый в изобретении, в котором ТАТА-бокс U3-области является мутантным;
на фиг.8 - карта плазмиды, содержащей вектор, предлагаемый в изобретении, в котором из U3-области дополнительно удален ТАТА-бокс;
на фиг.9 - плазмидная карта первой хелперной плазмиды, предназначенной для трансляции слитого белка gag-pol;
на фиг.10 - плазмидная карта первой хелперной плазмиды, в которой в последовательность, кодирующая слитый белок gag-pol, представляет собой последовательность с кодонами, оптимизированными для человеческой пакующей клетки и/или клетки-мишени;
на фиг.11 - график, демонстрирующий уровень экспрессии трансгена (EGFP) из вектора, предлагаемого в изобретении, в сравнении с экспрессией из вирусного вектора, который содержит 3' LTR дикого типа;
на фиг.12 - график, демонстрирующий уровень экспрессии трансгена (EGFP) из SIN-векторов, предлагаемых в изобретении;
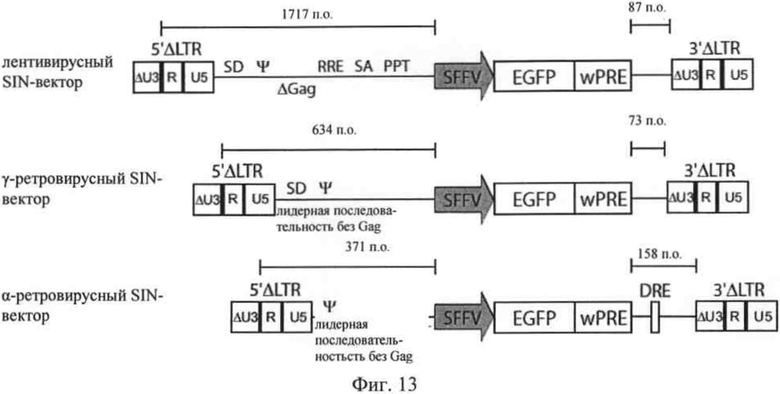
на фиг. 13 - изображение общей структуры вектора, предлагаемого в изобретении, в сравнении со структурой лентивирусного и γ-ретровирусного SIN-вектора соответственно;
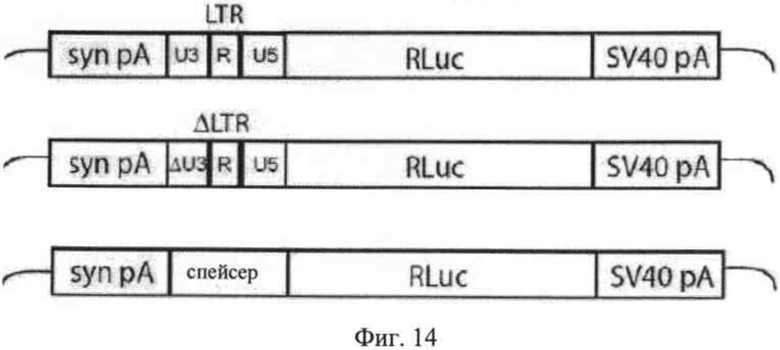
на фиг. 14 сверху - схематическое изображение конструкций нуклеиновых кислот (ДНК-конструкций), предназначенных для транскрипции вирусной РНК, которые содержат кассеты экспрессии, включающий нуклеотидную последовательность, подлежащую тестированию в отношении промоторной активности и энхансерной активности, функционально встроенную в 5′-направлении относительно репортерного гена, и
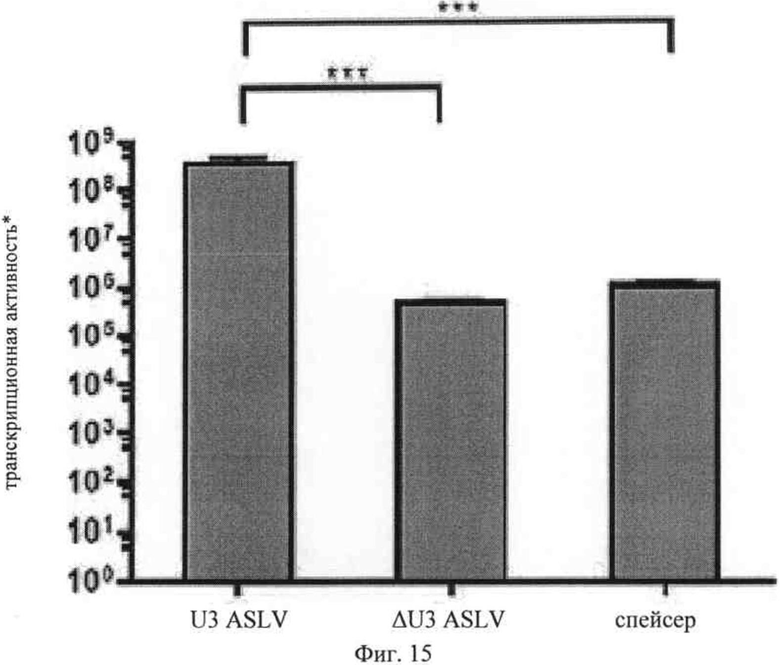
на фиг. 15 - уровень экспрессии репортерного гена в клетках, трансфектированных вирусной РНК, представленной на фиг. 14, и данные об отсутствии промоторной активности/энхансерной активности.
В описании SIN-U3, предлагаемой в изобретении, нумерацию нуклеотидов осуществляли со ссылкой на нуклеотидную последовательность U3 дикого типа ASLV и соответственно делеции и сегменты SIN-U3-области соответственно обозначены согласно нумерации нуклеотидов U3 дикого типа.
На фиг. 1 представлена схематическая структура ASLV дикого типа, в которой LTR содержат U3-область, R-область и U5-область, которые примыкают друг к другу. LTR всегда являются идентичными, поскольку при репликации вируса и U3-область 3′ LTR копируется в 5′-конец и области R и U5 5′ LTR копируются в 3′ LTR. Сайт инициации транскрипции в положении +1 соответствует 5′-концу 5′ R-области.
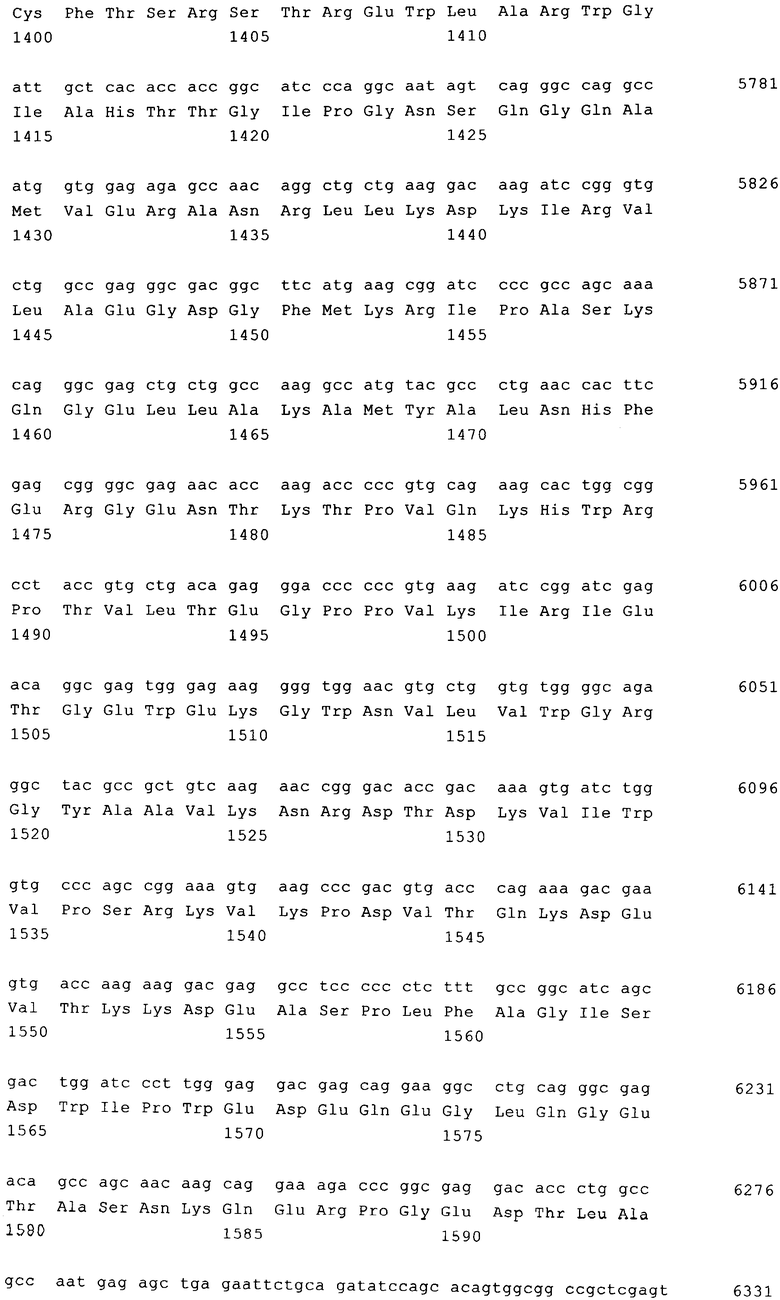
На фиг. 2 представлен вектор, предлагаемый в изобретении, в виде плазмиды, на 5′-конце которой промотор расположен перед R-областью, что позволяет начинать транскрипцию с 5′ R-области. Указанный 5′ промотор 5′ LTR вследствие того, что сайт инициации транскрипции находится в положении +1, которое соответствует первому нуклеотиду 5′ R-области, не входит в вирусную РНК; полученная вирусная РНК состоит из областей, расположенных между нуклеотидом в положении +1 5′ R-области и 3′-концом 3′ R-области плюс полиА-хвост. Соответственно вирусные частицы содержат вирусную РНК, созданную из того сегмента вектора, который содержит 5′ R-область (которая включает нуклеотид +1), простирающуюся вплоть до 3′-конца 3′ R-области с выступающим полиА-хвостом. Промотор вирусного вектора, расположенный против хода транскрипции относительно 5' R-области, показанный на фиг.2, который предпочтительно состоит из энхансера SV40 и из U3-области дикого типа RSV (вирус саркомы Рауса), не становится компонентом вирусной РНК, но контролирует эффективность транскрипции ДНК-последовательности вирусной РНК, представленной на фиг.2. В этом случае вектор представлен на уровне плазмиды в виде ДНК-последовательности, кодирующей вирусную РНК, которая может представлять собой компонент плазмиды, из которой транскрибируется вирусная РНК.
Как показано на фиг.2, вирусный вектор между LTR и соответственно после лидерной области содержит кассету экспрессии, которая содержит по меньшей мере один внутренний промотор, например промотор SFFV (вирус некроза селезенки) и EFS (фактор элонгации, 1α), имеет нуклеотидную последовательность, которая кодирует трансген (ген), предпочтительно имеет PRE, расположенный на 3'-конце.
PRE, предпочтительно представляет собой WPRE кассеты экспрессии, предпочтительно отличается наличием делеции X-ORF и/или мутациями ATG.
Вектор, предлагаемый в изобретении, и вирусная РНК, предлагаемая в изобретении, по меньшей мере в 3' LTR содержат U3-область, которая имеет делеции, инактивирующие любую промоторную активность LTR. В направлении от 5' к 3' SIN LTR и/или внутри 3' U3-области вирусный вектор, предлагаемый в изобретении, может содержать гомологичные и/или гетерологичные генетические элементы, например, последовательности, которые содержат miPHK, shPHK, энхансеры полиаденилирования, распознающие рекомбиназу последовательности, USE и/или изолирующие последовательности.
Между элементами 5' LTR и 3' LTR, предпочтительно между областями 5' LTR и кассетой экспрессии вектор, предлагаемый в изобретении, предпочтительно несет сайт связывания праймера и сигнал упаковки ср).
В отличие от компетентных в отношении репликации ретровирусов вирусный вектор, предлагаемый в изобретении, не имеет последовательностей, которые кодируют gag-pol и/или оболочечные белки.
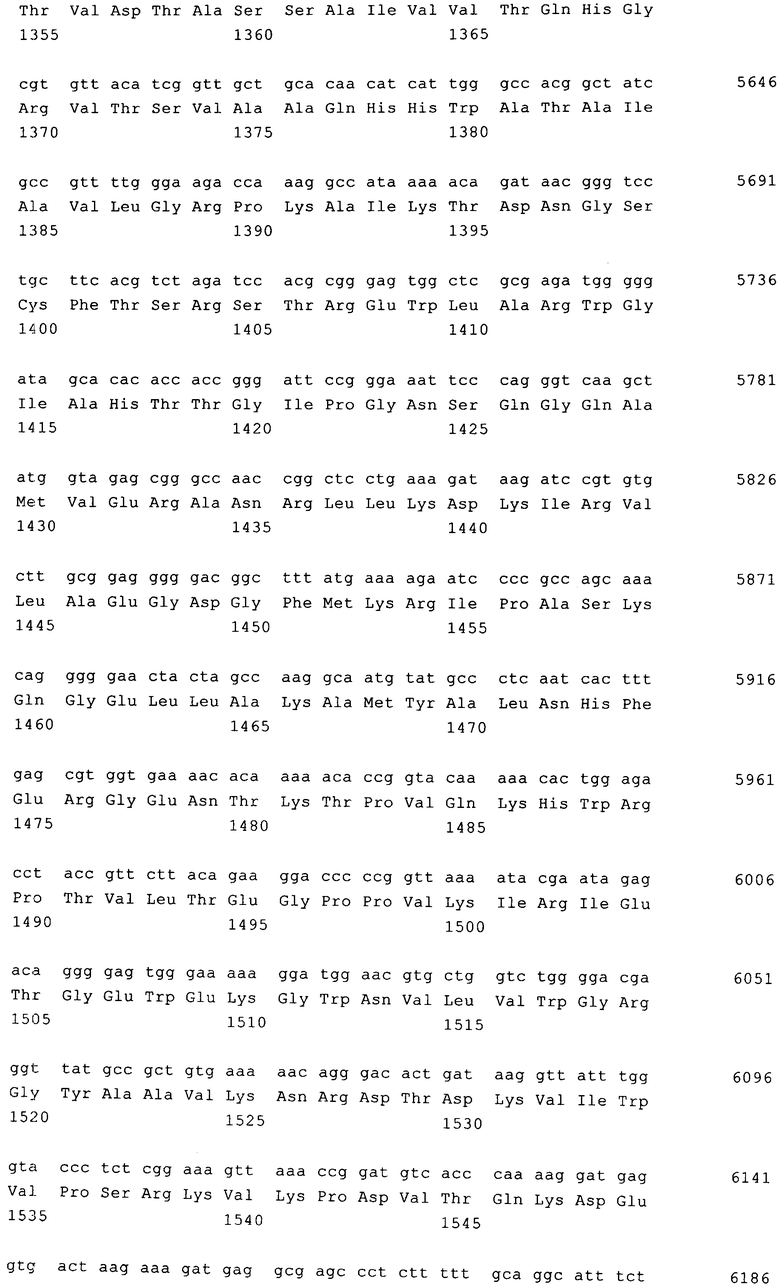
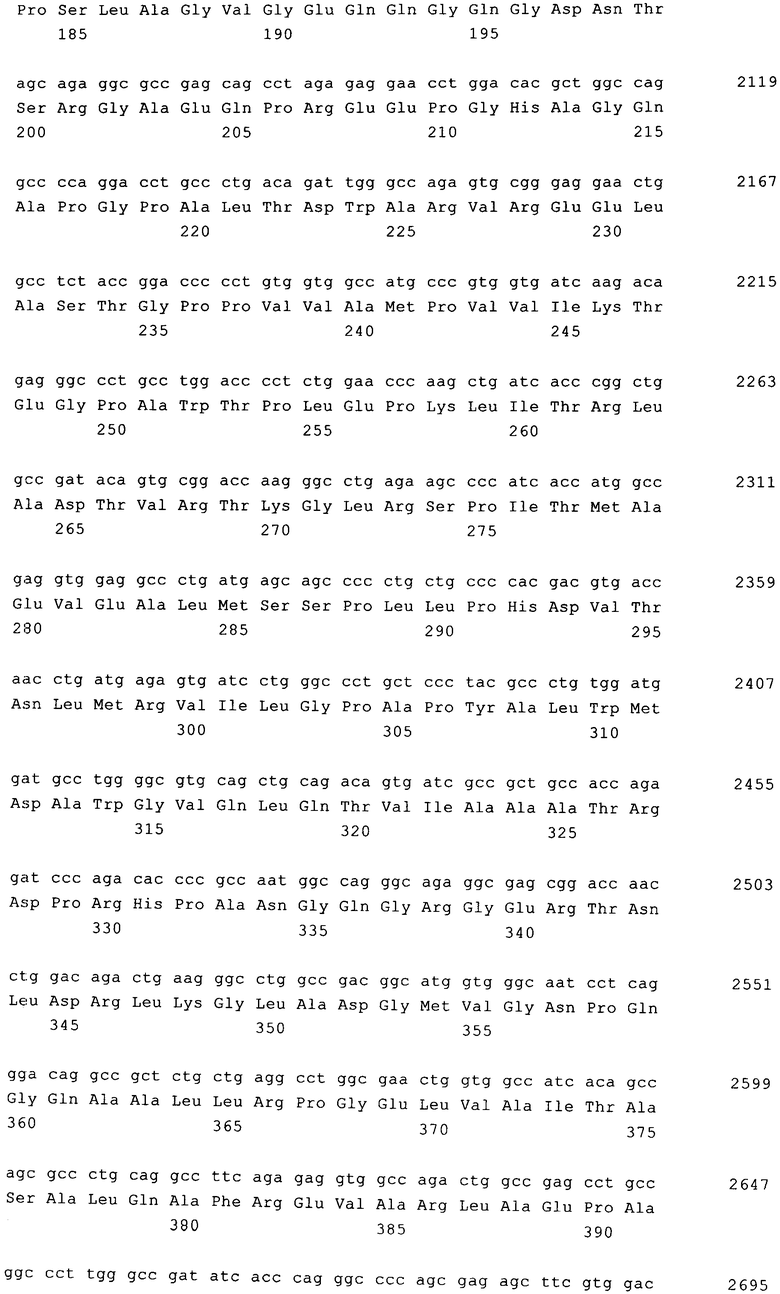
Вирусные белки, которые необходимы для создания вирусной частицы, содержащей вирусную РНК, кодируются отдельными хелперными плазмидами, предпочтительно первой хелперной плазмидой, которая несет кодирующую последовательность слитого белка gag-pro-pol в кассете экспрессии между промотором и последовательностью полиаденилирования, что показано на фиг.3, второй хелперной плазмидой, которая содержит последовательность, кодирующую оболочечный белок (env), в кассете экспрессии, например, как показано на фиг.4, между промотором CMV (цитомегаловирус) и последовательностью полиаденилирования. Для псевдотипификации последовательность, кодирующая оболочечный белок, может состоять из последовательности, кодирующей оболочечный белок экотропного/амфотропного MLV, VSVg, RD114, GALV или их химеры, например. RD114/TR.
В кодирующей последовательности первой хелперной плазмиды предпочтительно присутствует сдвиг рамки считывания на -1 (нуклеотид) между 3'-концом последовательности, кодирующей gag-pro, и 5'-концом последовательности, кодирующей роl, что обозначено на фиг.3 для gag-pro и роl соответственно с помощью выступающих прямоугольников.
Наиболее предпочтительно кодирующие последовательности хелперных плазмид адаптированы к наиболее часто встречающимся кодонам клетки-мишени, т.е. имеют оптимизирвоанные кодоны, поскольку, как было установлено при создании изобретения, указанная оптимизация кодонов для слитого белка gag-pro-pol, предпочтительно также для оболочечного белка env, приводит к повышению титра в хелперных клетках примерно в 50 раз. Таким образом, изобретение относится к способу, позволяющему получать титры и количества вирусных частиц соответственно, которые требуются для клинических применений, путем создания вирусных частиц, содержащих вирусную РНК, предлагаемую в изобретении, с использованием первой хелперной плазмиды и второй хелперной плазмиды, например, путем культивирования пакующей клетки.
На фиг.5 представлен обзор предпочтительных последовательностей 3' U3-области вирусного вектора, предлагаемого в изобретении, в сравнении с последовательностью U3 дикого типа (SEQ ID NO: 1) ASLV. В U3-областях, предлагаемых в изобретении, предпочтительно удалены в результате делеции нуклеотиды 28-186 U3 дикого типа. Вариант осуществления изобретения, представленный в SEQ ID NO: 2, который обозначен как дельта - (d) U3, предпочтительно состоит из нуклеотидов 1-27 и нуклеотидов 187-229 U3 дикого типа, при этом нуклеотиды 187 и 189 дополнительно изменены в результате мутации на С и Т соответственно, что позволяет создавать сайт рестрикции SnaBI (TACGTA). Указанная имеющая делеции U3-область, обозначенная также как SIN-U3, все еще имеет исходный ТАТА-бокс, который идентифицирован как нуклеотиды 200-206 U3 дикого типа.
В предпочтительном варианте осуществления изобретения ТАТА-бокс SIN-U3 также изменен в результате мутации таким образом, что функция ТАТА-бокса аннулирована. Предпочтительный вариант мутантного ТАТА-бокса представлен в SEQ ID NO: 3 (TdU3 TATAmut), в которой нуклеотиды 201-203 изменены в результате мутации таким образом, что нарушается функция ТАТА-бокса.
В предпочтительном варианте осуществления изобретения делеция относительно U3-области дикого типа затрагивает нуклеотиды 28-205 (dU3 noTATA; SEQ ID NO: 4), при этом нуклеотиды 203-204 мутированы для того, чтобы избежать создания ТАТА-бокса примыкающими сегментами, и/или для того, чтобы создать сайт расщепления на примыкающих нуклеотидах 26-27 и 203-206, например, в результате изменения посредством мутации нуклеотидов 203-205 на CGT, для того, чтобы создать уникальный сайт расщепления, распознаваемый рестриктазой SnaBI (TACGTA).
Таким образом, вирусные векторы, предлагаемые в изобретении, включают также варианты, в которых в область делеции нуклеотидов 28-222, предпочтительно в область нуклеотидов 28-190 и 28-206 в SEQ ID NO: 1 соответственно, можно встраивать гетерологичные или гомологичные, например, генетические элементы, геторологичные или гомологичные относительно клетки-мишени, предпочтительно через сайт рестрикции в вышеуказанных сегментах.
Пример 1: Получение вирусных частиц, содержащих SIN-вектор на основе ASLV, предлагаемый в изобретении
В качестве примеров векторов, предлагаемых в изобретении, которые кодируют вирусную РНК, предлагаемую в изобретении, конструировали плазмиды, в которых под контролем промотора энхансерного элемента SV40 (энхансер SV40) и промотора RSV (RSV) в непосредственной близости от промотора находилась R-область, за ней располагалась U5-область, кассета экспрессии для трансгена и 3' SIN-LTR из SIN-U3-области, предлагаемой в изобретении, R-область и U5-область. Кассета экспрессия включала U3-промотор вируса некроза селезенки (SFFV), последовательность, кодирующую EGFP, в качестве примера трансгена и WPRE (PRE).
В векторе, представленном на фиг.6, SIN-U3-область соответствовала SEQ ID NO: 2, в другом варианте в векторе, представленном на фиг.7, она соответствовала SEQ ID NO: 3, и соответственно в векторе, представленном на фиг.8, она соответствовала SEQ ID NO: 4 соответственно.
Последовательность вектора, представленного на фиг.6, обозначена как SEQ ID NO: 5. Таким образом, вектор, предлагаемый в изобретении, и плазмида, кодирующая РНК, предлагаемую в изобретении соответственно, содержат 3' SIN-LTR, который имеет последовательность, соответствующую нуклеотидам 3282-3452 SEQ ID NO: 5. Вирусная РНК, транскрибируемая с него, содержит входящую в нее 3' U3-область, предлагаемую в изобретении.
Последовательность вектора, представленного на фиг.7, обозначена как SEQ ID NO: 9. Таким образом, вектор, предлагаемый в изобретении, с которого транскрибируется вирусная РНК, предлагаемая в изобретении, содержит 3' SIN-LTR, который имеет последовательность, соответствующую нуклеотидам 3282-3452 SEQ ID NO: 9. Вирусная РНК содержит входящую 3' U3-область и R-область, предлагаемую в изобретении, в 3' SIN-LTR, но не содержит U5-область.
Последовательность вектора, представленного на фиг.8, обозначена как SEQ ID NO: 7. Таким образом, вектор, предлагаемый в изобретении, с которого транскрибируется вирусная РНК, предлагаемая в изобретении, содержит 3' SIN-LTR, который имеет последовательность, соответствующую нуклеотидам 3282-3436 SEQ ID NO: 7.
Кроме того, предпочтительно вирусный вектор и вирусная РНК соответственно в форме, в которой нуклеотидная последовательность вирусной РНК находится в плазмиде, содержат R-область дикого типа и U5-область дикого типа в 5' LTR и непосредственно примыкающий к ним в 5'-направлении эукариотический или вирусный промотор, предпочтительно энхансерную последовательность из SV40 в сочетании с промотором из RSV, что соответствует нуклеотидам 452-921 SEQ ID NO: 9.
Последовательность, представленная в SEQ ID NO: 5, кодирует eGFP, который имеет аминокислотную последовательность, представленную в SEQ ID NO: 6, последовательность SEQ ID NO: 7 кодирует eGFP, аминокислотная последовательность которого представлена в SEQ ID NO: 8, и последовательность SEQ ID NO: 9 кодирует eGFP, аминокислотная последовательность которого представлена в SEQ ID NO: 10.
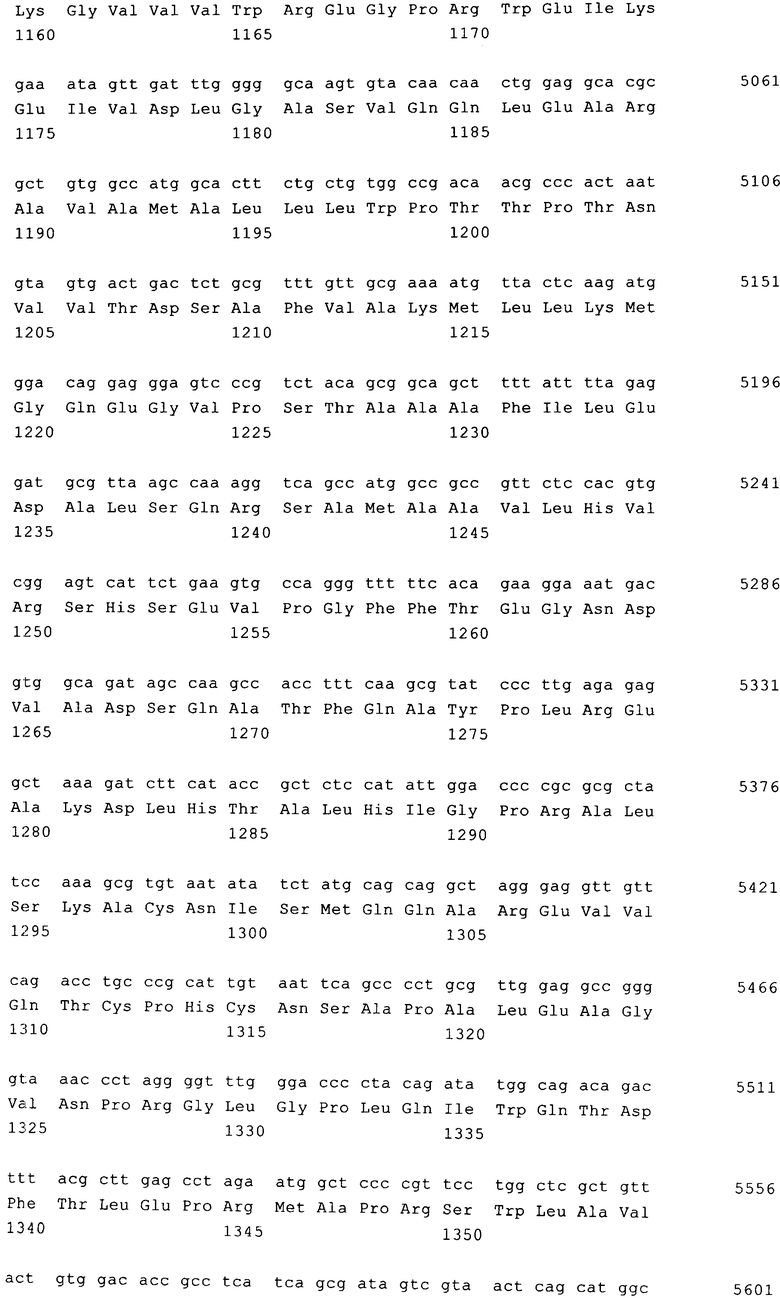
Для создания вирусных частиц плазмиды, которые представлены на фиг.6-8, интродуцировали в клетки линии НЕК293Т, которые содержали также первую хелперную плазмиду, предназначенную для экспрессия слитого белка gag-pol ASLV, путем кратковременной трансфекции или стабильной интеграции. Схематическая плазмидная карта представлена на фиг.9, последовательность обозначена как SEQ ID NO: 11 и содержит кодирующую последовательность слитого белка gag-pol, нуклеотиды 1475-6291. Аминокислотная последовательность gag, кодируемая SEQ ID NO: 11, соответствует SEQ ID NO:
12, аминокислотная последовательность белка pol, кодируемого SEQ ID NO: 11, соответствует SEQ ID NO: 13.
Наиболее предпочтительным вариантом осуществления изобретения является первая хелперная плазмида, несущая кодирующую последовательность слитого белка gag-pol, ко доны которой адаптированы к наиболее часто встречающимся кодонам пакующей клетки, прежде всего клеткам млекопитающим, таким, например, как человеческие клетки. Указанная плазмида схематически представлена на фиг.10; нуклеотидная последовательность обозначена как SEQ ID NO: 14. Таким образом, предпочтительная первая хелперная плазмида и человеческая пакующая клетка соответственно в интегрированной форме содержат кодирующую последовательность с оптимизированными кодонами, которая кодирует белок gag, соответствующую нуклеотидам 1475-3436 SEQ ID NO: 14, аминокислотная последовательность, которого представлена в SEQ ID NO: 15, и/или кодирующую последовательность с оптимизированными кодонами, которая кодирует белок pol, соответствующую нуклеотидам 3738-6291 SEQ ID NO: 14, аминокислотная последовательность которого представлена в SEQ ID NO: 16, предпочтительно кодирующую последовательность с оптимизированными кодонами, которая кодирует слитый белок gag-pol, соответствующую нуклеотидам 1475-6291 SEQ ID NO: 14.
При культивировании пакующей клетки в общепринятых условиях каждый раз получали такие же титры вирусных частиц, предлагаемых в изобретении, которые имели одну из SIN-U3-областей, представленных в векторах, которые имели SEQ ID NO: 7, 9 или 11, что и при использовании применяемой для сравнения конструкции (не представлена), в которой 3' U3-область соответствовала присутствующей в ASLV области дикого типа, а именно титры, составлявшие примерно 1×10 /мл.
Для способа получения вирусных частиц, предлагаемых в изобретении, предпочтительно, чтобы пакующие клетки представляли собой культивируемые человеческие клетки, имеющие нуклеотидную последовательность, которая кодирует вирусные структурные гены, например, gag-pol, имеющую наиболее часто встречающейся человеческие кодоны, причем, эти структурные гены предпочтительно не имеют активного донорного сайта сплайсинга и/или акцепторного сайта сплайсинга, для того, чтобы исключить сплайсинг в кодирующих последовательностях и тем самым достигать высокого уровня экспрессии в пакующих клетках.
Для контроля трансфекции клеток-мишеней вирусной РНК инициировали человеческие фибробласты линии НТ1080. При последующем культивировании после трансфекции экспрессию трансгена (EGFP) определяли с помощью FACS. По сравнению с вирусными частицами, 3' LTR которых представлял собой 3' LTR ASLV дикого типа, в случае вирусных векторов, несущих 3' SIN-LTR, предлагаемый в изобретении, можно было обнаружить в 3 раза более высокий уровень экспрессии трансгена.
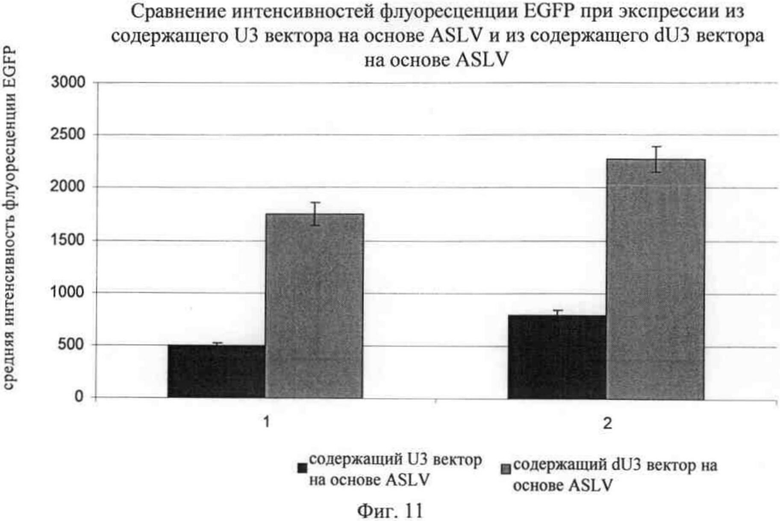
На фиг.11 представлены данные об экспрессии приведенного в качестве примера трансгена EGFP с использованием кассеты экспрессии, представленной на фиг.7, в клетках-мишенях, которые трансдуцировали вирусным вектором. Вирусные частицы получали из супернатанта пакующих клеток (псеводотипированных с помощью VSVg), которые содержали плазмиду, кодирующую вирусную РНК, последовательность которой представлена в SEQ ID NO: 5, предлагаемую в изобретении (ASLV dU3, светлые правые прямоугольники), и вирусную РНК, имеющую 3' U3 дикого типа (ASLV U3, темные левые прямоугольники; U3 дикого типа, см. SEQ ID NO: 1). Для трансдукции вирусные частицы титровали в НТ1080Е-клетках, культивировали в течение 6 дней и затем анализировали с помощью проточной цитометрии. В эксперименте 1 слитый белок gag-pol был дикого типа (нуклеотиды 1475-6291 в SEQ ID NO: 11), в эксперименте 2 кодирующая последовательность имела оптимизированные кодоны (нуклеотиды 1475-6291 в SEQ ID NO: 14). В результате для вирусной частицы, предлагаемой в изобретении, несущей 3' U3-область, предлагаемую в изобретении, был характерен примерно в 3 раза более высокий уровень экспрессии трансгена в клетке-мишени по сравнению с вирусной частицей, имеющей U3-область дикого типа. Это относится как к применению gag/pol дикого типа (эксперимент 1), так и к хелперной плазмиде gag-pol с оптимизированными кодонами (эксперимент 2). В обоих случаях примерно в 3-раза более высокий уровень экспрессии трансгена в клетках-мишенях обнаружен для вирусных частиц, предлагаемых в изобретении (dU3), по сравнению с применяемыми для сравнения частицами дикого типа (U3).
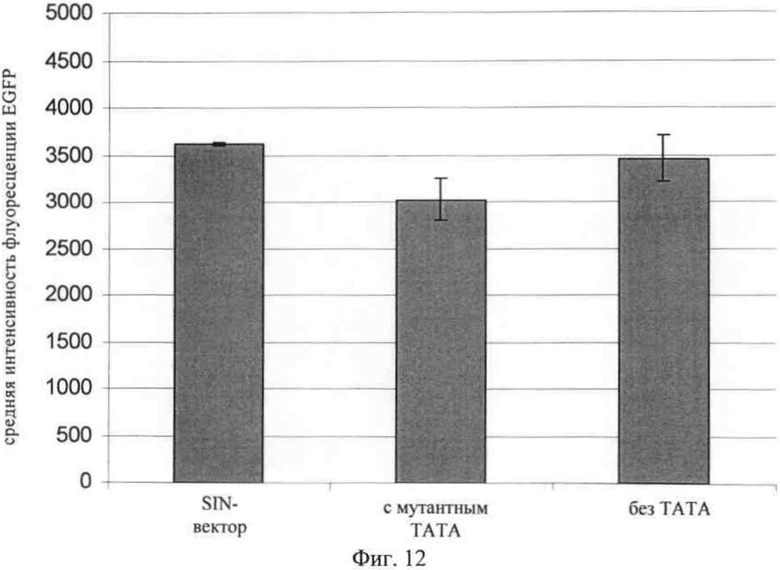
На фиг.12 представлены данные об уровнях экспрессии приведенного в качестве примера трансгена EGFP с использованием кассеты экспрессии, в клетках-мишенях, которые трансдуцировали вирусным вектором, содержащем вирусную РНК, транскрибируемую из плазмиды, последовательность которой представлена в SEQ ID NO: 5 (SIN, предлагаемая в изобретении), SEQ ID NO: 9 (TATAmut) и SEQ ID NO: 7 (noTATA) соответственно. Как описано выше, вирусные частицы создавали в пакующих клетках, которые транслировали с использованием оптимизированных кодонов слитый белок gag-pol и оболочечный белок VSVg. Клетки линии НТ1080 трансдуцировали вирусными частицами, культивировали в течение 6 дней, а затем анализировали с помощью FACS. Из полученных данных очевидно, что 3' U3-область, предлагаемая в изобретении, во всех вирусных РНК и вирусных частицах, предлагаемых в изобретении, соответственно приводила к достижению высокой эффективности экспрессии трансгена в клетках-мишенях. Результаты представлены также в следующей таблице:
В предпочтительном варианте осуществления изобретения в векторе, предлагаемом в изобретении, например, в вирусной РНК, необязательно входящей в вирусные частицы, отсутствуют вирусные кодирующие последовательности, например, отсутствую последовательности, содержащие полностью или частично один из структурных генов gag, env, src или pol. Таким образом, предпочтительно, чтобы вирусная РНК вектора и транскрибируемая нуклеотидная последовательность плазмиды, кодирующей вирусную РНК вектора соответственно, содержащая 5' R-область, 5' U5-область и область, содержащую сигнал упаковки и простирающуюся вплоть до кассеты экспрессии трансгена, состояла из этих трех областей и, например, не содержала донорный сайт сплайсинга. Предпочтительная последовательность 5' R-области, 5' U5-области и области, содержащей сигнал упаковки и простирающейся вплоть до кассеты экспрессии трансгена, содержит нуклеотиды 922-1292 SEQ ID NO: 5 или состоит из указанной нуклеотидной последовательности. Эта нуклеотидная последовательность необязательно может быть укорочена в 3'-области, например, на 140 нуклеотидов, предпочтительно на 10-56 нуклеотидов.
Согласно указанному варианту осуществления изобретения область вирусной РНК, которая на своем 5'-конце и, следовательно, в 5'-направлении непосредственно примыкает к кассете экспрессии трансгена, состоит из нетранслируемых последовательностей, прежде всего R-области, U5-области и сигнала упаковки и поэтому не содержит сегменты gag, env, src или pol.
Указанный вариант осуществления схематически изображен на фиг.13, где продемонстрировано, что указанный 5'-сегмент вектора, который обозначен также как лидер, существенно короче, чем 5'-область лентивирусных или γ-ретровирусных SIN-векторов. В то время как в лентивирусных и во многих версиях γ-ретровирусных SIN-векторов сигнал упаковки У перекрывается вирусными структурными генами, в альфа-ретровирусном векторе, предлагаемом в изобретении, как неожиданно было установлено, сигнал упаковки может присутствовать без сегментов кодирующей последовательности вируса. Таким образом, вектор, предлагаемый в изобретении (альфа-ретровирусный SIN-вектор) обозначают как не содержащий gag лидер. Кроме того, в векторе, предлагаемом в изобретении, вирусный донорный сайт сплайсинга может быть удален или лишен функциональной способности соответственно с помощью мутации. Например, в лентивирусных или γ-ретровирусных векторах это возможно только при снижении титра из-за перекрывания с пакующими функциями. Кроме того, полное удаление сегментов кодирующей последовательности вируса позволяет применять более короткий указанный сегмент векторной последовательности, который расположен в 5'-направлении перед кассетой экспрессии трансгена, например, длиной 371 nt (нуклеотиды, п.о.). Таким образом, по сравнению с лентивирусными и γ-ретровирусными векторами создается существенно большее пространство для включения трансгенных последовательностей. Во всех этих примерах кассета экспрессии состоит из сильного внутреннего промотора SFFV, кодирующей последовательности зеленого флуоресцентного белка (EGFP) в качестве репортерного гена и WPRE.
Пример 2: Длительная экспрессия трансгена в эукариотических клетках-мишенях
Для иллюстрации возможности применения вирусного вектора в качестве лекарственного средства, например, для генной терапии, стволовые клетки крови трансдуцировали вирусными частицами, предлагаемыми в изобретении. Выделенные клетки костного мозга мышей (линии C57BL6) трансдуцировали вирусными частицами, предлагаемыми в изобретении, и для сравнения лентивирусными частицами. В качестве трансгена каждый раз в одну и ту же кассету экспрессии включали EGFP под контролем промотора SFFV. В условиях, обеспечивающих одинаковую эффективность, уровень трансфекции клеток лентивирусньш вектором составлял 39%, что в 1,6 раза выше, чем для вектора, предлагаемого в изобретении (24%). Это может быть связано с тем фактом, что лентивирусные частицы могли трансдуцировать также покоящиеся, не активные с позиций деления клетки, а α-ретровирусные частицы, предлагаемые в изобретении, могли трансдуцировать клетки предпочтительно в процессе деления.
Трансдуцированные стволовые клетки крови трансплантировали 8 мышам одной и той же линии, подвергнутых смертельной дозе облучения. Трансдуцированные клетки идентифицировали в образцах периферической крови с помощью FACS. Через 31 неделю относительное содержание трансдуцированных EGFP-позитивных лейкоцитов при применении лентивирусных векторов составляло 32,9+/-8,9%, что примерно в 2 раза превышало указанное значение, полученное при применении векторов, предлагаемых в изобретении (16,1+/-12%).
Были отобраны образцы костного мозга у животных обеих групп, имеющих наиболее высокие титры EGFP-позитивных клеток, и трансплантированы 5 животным, подвергнутых смертельной дозе облучения, получая вторую группу для каждой из ранее проанализированных групп. Через 6 недель после указанной трансплантации относительное содержание EGFP-позитивных лейкоцитов в случае трансдцированных лентивирусом стволовых клеток составляло 40,6+/-5,9, что все еще примерно на 30% превышало относительное содержание стволовых клеток, трасндуцированных вектором, предлагаемым в изобретении (32,6+/-8,1%). Это свидетельствует о том, что скорость эпигенного «выключения» экспрессии трансгена при применении векторов, предлагаемых в изобретении, не существенно выше, чем при применении лентивирусных векторов.
Пример 3: Демонстрация пониженного риска при использовании подвергнутых инсерционному мутагенезу векторов
С помощью разработанного авторами изобретения анализа in vitro (Mol. Ther., 2009, сс.1919-1928) оценивали риск онкогенной активации при трансдукции и трансфекции соответственно при использовании вирусного вектора. Онкогенная активация, например, при встраивании вирусных последовательностей в близости к геному, приводит к трансформации первичных гематопоэтических клеток. В целом, исследование с применением указанного анализа позволяло установить частоту и степень неопределенности инсерционной активации трансформации, поддерживающей клеточные проонкогены типа Evil. В этом анализе первичные гематопоэтические клетки необработанных мышей, например линии C57BL6, приводили в контакт с вирусными частицами. После этой трансдукции частоту трансформации определяли путем культивирования в условиях, которые вызывают дифференцировку в миелоидном направлении, при этом осуществляли повторный посев с использованием таких клеточных разведении, в которых не происходит пролиферация нетрансформированных клеток из-за ингибирования сохранившейся способности к делению, вызываемому разведением, но только трансформированные клетки обладают способностью к пролиферации. В трансформированных клетках осуществляли, например, повышающую регуляцию экспрессии протоонкогенов с помощью инсерционного мутагенеза. Таким образом, указанный анализ позволяет количественно оценивать частоту трансформации в трансдуцированных клетках. Таким образом, жизнеспособность и стабильность соответственно трансформантов можно определять как результат культивирования трансформированных клеток после повторного посева и повторного культивирования соответственно.
Было установлено, что γ-ретровирусные векторы и лентивирусные векторы обеспечивали частоту трансформации, составлявшую примерно 1×10-5 и 5×10-6 соответственно (Mol. Ther., 2009, сс.1919-1928). В параллельных партиях частота трансформации для векторов, предлагаемых в изобретении, составляла примерно 3,6×10-6, что находилось в пределах значений, установленных для лентивирусных векторов. Помимо частоты трансформации в этом опыте анализировали жизнеспособность и приспособленность к условиям среды культивировании трансформированных клеток соответственно. Уровень приспособленности для 3 из 4 выделенных таким образом клеток, трансформированных вектором, предлагаемым в изобретении, оказался примерно в 10 раз ниже по сравнению со средним уровнем трансформированных лентивирусом клеток. Эти результаты в плане низкой частоты трансформации и низким уровнем приспособленности к условиям среды клеток, трансформированных α-ретровирусным вектором, предлагаемым в изобретении, демонстрируют, что этот вектор обеспечивает повышенную безопасность в отношении онкогенной активации, по сравнению с известными из существующего уровня техники γ-ретровирусными или лентивирусными векторами. Риск, связанный с инсерционной трансформацией, можно дополнительно понижать с помощью выбора приемлемых последовательностей внутренних промоторов.
Пример 4: Определение делений в 3′ U3-области, которые элиминируют ее промоторную и энхансерную активность
Делецию и замену нуклеотидов в U3-области соответственно с целью снижения и элиминации промоторной и энхансерной активности соответственно предпочтительно оценивали с помощью анализа активности, в котором определяли количественно уровень экспрессии функционально активного репортерного гена, который располагали в 3′-направлении относительно имеющей делеции U3-области. Если экспрессия функционального репортерного гена, который расположен в 3′-направлении относительно U3-области, имеющей делеции или замены соответственно, установлена на уровне фоновой активности экспрессируемого без промотора репортерного гена, то это свидетельствует о том, что согласно изобретению промоторная активность элиминирована. Предпочтительно последовательность полиаденилирования располагали в 3′-направлении относительно репортерного гена. В качестве фоновой активности экспрессируемого репортерного гена, например, рассматривали активность, определенную в отсутствии какой-либо U3-области и какого-либо промотора, расположенного в 5′-направлении относительно репортерного гена соответственно.
На фиг. 14 сверху схематическое изображены конструкции нуклеиновых кислот, с помощью которых осуществляли тестирование промоторной и энхансерной активности U3-области, имеющей делеции и замены, предлагаемые в изобретении соответственно. Конструкция, представленная в верхней части на фиг. 13, несет ген люциферазы из Renilla (RLuc) в качестве репортерного гена, фланкированный в 3′-направлении последовательностью сигнала полиаденилирования SV40 (SV40 рА) и в 5′-направлении нуклеотидной последовательностью, подлежащей тестированию в отношении промоторной последовательности и энхансерной последовательности, в данном случае содержащая LTR дикого типа (U3-R-U5) ASLV. Ниже представлена идентичная конструкция, отличающаяся только делецией (ΔLTR), U3-область которой частична удалена в результате делеции (ΔU3). В этой конструкции удалены нуклеотиды 28-186. Еще ниже представлена идентичная конструкция, отличающаяся только тем, что LTR полностью заменен произвольной последовательностью (спейсер, вставка, полученная из прокариотического гена β-лактамазы). Синтетический сигнал полиаденилирования (syn pA) расположен в 5'-направлении относительно сегмента вирусной последовательности.
На фиг.15 представлены данные о люциферазной активности 293Т-клеток, которые трансфектировали конструкцией, представленной на фиг.13, и культивировали в идентичных условиях. Измерение люциферазной активности осуществляли в клеточных гомогенатах, данные представлены в виде относительных величин люминесценции, которые стандартизовали относительно количества общего белка и эффективности трансфекции. Очевидно, что делеция, приводящая к получению ΔU3 (ASLV дельта - U3), предлагаемой в изобретении, вызывает резкое снижение (примерно в 400 раз) промоторной активности по сравнению с LTR дикого типа (ASLV U3). Статистический анализ результатов продемонстрировал их достоверность (**, Р<0,01). Замена LTR на произвольную последовательность (спейсер) привела к аналогичному снижению промоторной активности. Таким образом, согласно изобретению произвольную последовательность, которая, как известно, не обладает промоторными и энхансерными функциями, можно использовать в качестве последовательности, которая обладает фоновой активностью. Вероятно, фоновая активность люциферазы, которую еще можно обнаружить, вызывается другими компонентами плазмиды, в которую входит кассета экспрессии репортерного гена. Предпочтительно репортерный ген адаптирован к наиболее часто встречающимся кодонам трансфектированной клетки.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВИРУСНЫЕ ВЕКТОРЫ С ЗАВИСИМОЙ ОТ УСЛОВИЙ РЕПЛИКАЦИЕЙ И ИХ ПРИМЕНЕНИЕ | 2001 |
|
RU2301260C2 |
| МИКРОВЕЗИКУЛА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2014 |
|
RU2693088C2 |
| РЕТРОВИРУСНЫЙ ВЕКТОР НА ОСНОВЕ ВИРУСА МЫШИНОГО ЛЕЙКОЗА (MLV) (ВАРИАНТЫ) | 1999 |
|
RU2203321C2 |
| БИОПРОИЗВОДСТВО ЛЕНТИВИРУСНЫХ ВЕКТОРОВ | 2016 |
|
RU2729385C2 |
| УСОВЕРШЕНСТВОВАНИЕ ГЕНЕТИЧЕСКИХ КОНСТРУКЦИЙ ДЛЯ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ АНТИВИЧ ТЕРАПИИ | 2013 |
|
RU2533817C1 |
| ВСПОМОГАТЕЛЬНЫЙ ПЛАЗМИДНЫЙ ЛЕНТИВИРУСНЫЙ ЭКСПРЕССИОННЫЙ ВЕКТОР ДЛЯ ПОЛУЧЕНИЯ ВЫСОКИХ ТИТРОВ VPX-СОДЕРЖАЩИХ ЛЕНТИВИРУСНЫХ ЧАСТИЦ, ОБЕСПЕЧИВАЮЩИЙ ЭФФЕКТИВНОЕ ЗАРАЖЕНИЕ МОНОЦИТОВ И ДЕНДРИТНЫХ КЛЕТОК ЧЕЛОВЕКА | 2017 |
|
RU2697781C2 |
| РЕКОМБИНАНТНЫЙ ЛЕНТИВИРУСНЫЙ ВЕКТОР, КЛЕТКА-ХОЗЯИН, ТРАНСДУЦИРОВАННАЯ ЛЕНТИВИРУСНЫМ ВЕКТОРОМ, СПОСОБ ЕЕ ТРАНСДУКЦИИ И ПРИМЕНЕНИЕ | 2002 |
|
RU2305708C2 |
| ГЕНЕТИЧЕСКИЕ КОНСТРУКЦИИ ДЛЯ АНТИВИЧ-ТЕРАПИИ | 2010 |
|
RU2426788C1 |
| УСЛОВНО РЕПЛИЦИРУЮЩИЙСЯ РЕТРОВИРУСНЫЙ ВЕКТОР (ВАРИАНТЫ), СПОСОБ ЕГО ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ (ВАРИАНТЫ), ВЫДЕЛЕННАЯ И ОЧИЩЕННАЯ МОЛЕКУЛА НУКЛЕИНОВОЙ КИСЛОТЫ | 1996 |
|
RU2270250C2 |
| СПОСОБ ВРЕМЕННОЙ ТРАНСФЕКЦИИ ДЛЯ ПРОДУЦИРОВАНИЯ РЕТРОВИРУСА | 2016 |
|
RU2749717C2 |




























































Изобретение относится к области биотехнологии, генной инженерии и вирусологии. Описан вирусный самоинактивирующийся (SIN) вектор на основе вируса саркомы и лейкоза птиц (ASLV) и расщепляющая-пакующая система. Система содержит помимо SIN-вектора первую хелперную плазмиду, предназначенную для экспрессии слитого вирусного белка gag-pol, и вторую хелперную плазмиду, предназначенную для экспрессии оболочечного белка (env) ретровируса. Первая и вторая хелперная плазмиды, содержащиеся в пакующей клеточной линии или применяемые для ее кратковременной трансфекции, служат для создания нереплицирующихся (RCR-некомпетентных) вирусных частиц. Вирусные частицы содержат РНК, содержащую на 3'-конце SIN-LTR, предлагаемый в изобретении, где РНК может иметь терапевтически эффективный сегмент, который, например, представляет собой трансген. Для этого в 3'-SIN-LTR предусмотрена обширная делеция U3-области, которая в процессе обратной транскрипции копируется в 5' LTR. Кроме того, из SIN-вектора удалены все кодирующие области ASLV, а также ретровирусные донорные сайты сплайсинга. Изобретение может быть использовано в генной терапии. 6 н. и 18 з.п. ф-лы, 15 ил., 2 табл., 4 пр.
1. Вирусная РНК, образующая самоинактивирующийся вектор и имеющая 5′-область с R-областью и U5-областью из ASLV и расположенной относительно них в 3′-направлении сайт связывания праймера (PBS), сигнал упаковки (Ψ), кассету экспрессии, 3′ U3-область и R-область, отличающаяся тем, что 3′ U3-область имеет нуклеотидную последовательность, соответствующую SEQ ID NO:1, в которой в результате делеции удалены нуклеотиды с №28 по №186 включительно, что приводит к элиминации промоторной и энхансерной активности 3′ U3-области, причем в ее состав не входят никакие нуклеотидные последовательности, которые частично кодируют вирусные структурные белки или донорный сайт сплайсинга (SD).
2. Вирусная РНК по п. 1, отличающаяся тем, что делетируемые нуклеотиды расположены на 3′ конце последовательности полиаденелирования.
3. Вирусная РНК по п. 1, отличающаяся тем, что 3′ U5-область имеет нуклеотидную последовательность, соответствующую SEQ ID NO:1, и нуклеотиды с №200 по №206 дополнительно изменены в результате мутации с образованием частичной последовательности, в которой отсутствует ТАТА-бокс.
4. Вирусная РНК по п. 3, отличающаяся тем, что нуклеотиды с №200 по №206 изменены в результате мутации с образованием последовательности TGTCTAA.
5. Вирусная РНК по п. 1 или 2, отличающаяся тем, что дополнительно в 3′ U3-области нуклеотид №187 изменен в результате мутации на С и нуклеотид №189 изменен в результате мутации на Т.
6. Вирусная РНК по п. 1 или 2, отличающаяся тем, что 3′ U3-область имеет нуклеотидную последовательность, соответствующую SEQ ID NO:1, из которой в результате делеции дополнительно удалены нуклеотиды с №187 по №. 202.
7. Вирусная РНК по п. 1 или 2, отличающаяся тем, что 3′ U3-область имеет или состоит из последовательности, соответствующей SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:4.
8. Вирусная РНК по п. 1 или 2, отличающаяся тем, что 3′ U3-область, включая 3′ R-область, имеет или состоит из последовательности, соответствующей нуклеотидам с №3282 по №3372 SEQ ID NO:5, последовательности, соответствующей нуклеотидам с №3282 по №3356 SEQ ID NO:7, или последовательности, соответствующей нуклеотидам с №3282 по №3372 SEQ ID NO:9.
9. Вирусная РНК по п. 1 или 2, отличающаяся тем, что удаленная в результате делеции последовательность в 3′ U3-области заменена путем инсерции нуклеотидной последовательностью, которая не имеет ни промоторной, ни энхансерной последовательностей.
10. Вирусная РНК по п. 1 или 2, отличающаяся тем, что 3′ U3-область содержит встроенную нуклеотидную последовательность, которая кодирует miPHK, shPHK, энхансер полиаденилирования, изолятор и/или последовательность, распознаваемую ДНК-рекомбиназой.
11. Вирусная РНК по п. 1 или 2, отличающаяся тем, что кассета экспрессии в направлении от 5′-конца к 3′-концу несет промотор, нуклеотидную последовательность, кодирующую трансген, и PRE.
12. Вирусная РНК по п. 1 или 2, отличающаяся тем, что нуклеотидная последовательность, которая в 5′-направлении примыкает к промотору, в направлении от 5′-к 3′-концу кодирует R-элемент, который примыкает к U5-элементу и сигналу упаковки.
13. Вирусная РНК по п. 1 или 2, отличающаяся тем, что нуклеотидная последовательность, которая расположена в 5′-направлении относительно кассеты экспрессии, содержит или состоит из последовательности нуклеотидов с №922 по №1292 SEQ IDNO:5.
14. Последовательность ДНК, кодирующая вирусную РНК, которая образует самоинактивирующийся вектор, по п. 1 и содержащая промоторный элемент, который является функциональным и расположен в 5′-направлении относительно нуклеотидной последовательности, кодирующей вирусную РНК, отличающаяся тем, что нуклеотидная последовательность, которая кодирует вирусную РНК, имеет последовательность по одному из пп. 1-13.
15. Последовательность ДНК по п. 14, отличающаяся тем, что нуклеотидная последовательность, кодирующая вирусную РНК, имеет 5′ R-область и 5′ U5-область с последовательностью, соответствующей нуклеотидам с №922 по №1022 SEQ ID NO:5, а в 3′-направлении относительно нее 3′ LTR, который имеет последовательность, соответствующую нуклеотидам с №3282 по №3452 SEQ ID NO:5, или имеет последовательность, соответствующую нуклеотидам с №3282 по №3436 SEQ ID NO:7, или имеет последовательность, соответствующую нуклеотидам с 3282 по №3452 SEQ ID NO:9.
16. Вирусная частица для применения в качестве лекарственного средства, содержащая оболочечный белок, отличающаяся тем, что частица содержит вирусную РНК по одному из пп. 1-13.
17. Вирусная частица по п. 16 для применения в качестве фармацевтической композиции.
18. Вирусная частица по п. 17, где фармацевтическая композиция предназначена для применения в качестве лекарственного средства для генетической модификации соматических зрелых клеток, гематопоэтических стволовых клеток или нечеловеческих эмбриональных стволовых клеток.
19. Фармацевтическая композиция, предназначенная для применения в генной терапии, отличающаяся присутствием вирусной частицы по п. 16.
20. Система для создания ретровирусных частиц с последовательностью ДНК, которая кодирует вирусную РНК, имеющая первую хелперную плазмиду, которая кодирует слитый белок gag-pro-pol, и вторую хелперную плазмиду, которая кодирует оболочечный белок, отличающаяся тем, что вирусная РНК имеет нуклеотидную последовательность по одному из пп. 1-13.
21. Система по п. 20, отличающаяся тем, что последовательностью ДНК, кодирующей вирусную РНК, первой хелперной плазмидой и/или второй хелперной плазмидой трансфектируют эукариотическую клетку или их интегрируют в геном эукариотической клетки.
22. Система по одному из пп. 20-21, отличающаяся тем, что первая хелперная плазмида кодирует слитый белок gag-pro-pol и/или вторая хелперная плазмида кодирует вирусный оболочечный белок с использованием кодонов, которые адаптированы к наиболее часто встречающимся кодонам эукариотической клетки, которая их содержит.
23. Система по одному из пп. 20-21, отличающаяся тем, что первая хелперная плазмида кодирует слитый белок gag-pro-pol с помощью нуклеотидной последовательности, которая соответствует нуклеотидам с №1475 по №6291 SEQ ID NO:14.
24. Способ получения вирусных частиц, заключающийся в том, что экспрессируют слитый белок gag-pro-pol и вирусный оболочечный белок в пакующей клетке, отличающийся тем, что вирусная РНК, которая транскрибируется с последовательностью ДНК, имеет нуклеотидную последовательность по одному из пп. 1-15.
| HU JINGQIONG ET AL: "Transduction of rhesus macaque hematopoietic stem and progenitor cells with avian sarcoma and leukosis viral vectors" HUMAN GENE THERAPY, Bd | |||
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| Барботер | 1990 |
|
SU1757703A1 |
| MODLICH U ET AL: "Cell-culture assays reveal the importance of retroviral vector design for insertional | |||
Авторы
Даты
2015-10-27—Публикация
2010-05-17—Подача