Область техники, к которой относится изобретение
Настоящее изобретение относится к способу получения клеток для применения в клеточных лекарственных средствах благодаря быстро дифференцирующимся клеткам, которые должным образом дифференцированы в живом организме. Настоящее изобретение также относится к средству для лечения заболеваний, связанных с клеточными повреждениями, повреждениями тканей или органов. Настоящее изобретение, кроме того, относится к клеточному лекарственному средству, способу получения стволовых клеток, культуральной среде для дифференцирующихся моноцитов, средству, индуцирующему дедифференцирование, набору клеточного лекарственного средства, набору для получения дедифференцированных клеток и фармацевтической композиции, которые эффективно индуцируют клеточную дедифференциацию, и к стволовым клеткам.
Предшествующий уровень техники
Некоторое время тому назад внимание исследователей было привлечено к медицинским процедурам, направленным на содействие регенерации тканей для замещения клеток, утраченных по какой-либо причине, в качестве основного лечения заболеваний. В последние годы дальнейшее развитие получила концепция клеточных лекарственных средств, которые предназначены для регенерации и восстановления тканей в патологическом участке посредством взаимодействия межклеточных биологически активных веществ путем инъекции стволовых клеток или клеток-предшественников клеток ткани.
В связи с этим, было много сообщений о том, что дифференцированные клетки в ткани, например моноциты, происходящие из периферической крови, дифференцируются в стволовые клетки при культивировании в присутствии специфических цитокинов.
Однако, когда стволовые клетки или тканевые клетки-предшественники вводят в живой организм в виде клеточного лекарственного средства, то процентная доля клеток, поступающих в мишеневую поврежденную область, не всегда высока и непостоянна. Для решения этой проблемы требуется получение большого количества клеток. Кроме того, поведение клеток, которые распределяются в областях, отличных от области-мишени, еще не было детально исследовано, и остается вопрос побочных эффектов. Кроме того, хотя для усиленного терапевтического эффекта необходимо введение большого количества клеток, получение аутологичных клеток за короткий период времени представляется затруднительным.
Недавно стало ясно, что происходит феномен, называемый «хомингом». При этом феномене происходит экспрессия SDF1 (происходящий из клеток стромы фактор 1) или VEGF (сосудистый эндотелиальный клеточный фактор роста) поврежденной области в условиях ишемии; как части системы биологической репарации эти факторы служат в качестве индуцируемых молекул; и клетки, экспрессирующие рецепторы, соответствующие этим индуцируемым молекулам, принудительно направляются в поврежденную область. Рецепторами этих факторов являются CXCR4 для SDF1 и VEGFR для VEGF. Например, в непатентном документе 1 сообщается, что рана не заживает, если SDF1 блокируется в ишемической области, или когда клетки, экспрессирующие CXCR4, удаляются из крови.
Fändrich (непатентный документ 2), Huberman (непатентный документ 3) и т.д. сообщают о способах получения плюрипотентных стволовых клеток из моноцитов человека путем индукции дедифференциации. В этих способах для инкубации используются различные цитокины, включая M-CSF (фактор, стимулирующий колонии макрофагов). Каждый способ культивирования показал, что некоторые недифференцированные маркеры становились положительными. Кроме того, Kuwana et al. (непатентный документ 4) сообщают, что мультипотентные стволовые клетки (MOMC) могут быть индуцированы из мононуклеарных клеток человека с использованием культурального планшета, на который наносится фибронектин.
Список ссылок
Непатентный документ 1: Nat. Med. 2004 Aug; 10 (8): 858-64
Непатентный документ 2: Ruhnke M, Fändrich F, "Differentiation of in vitro-modified human peripheral blood monocytes into hepatocyte-like and pancreatic islet-like cells", Gastroenterology, 128 (2005) 1774
Непатентный документ 3: Yong Zhao, Eliezer Huberman, "A human peripheral blood monocyte-derived subset acts as pluripotent stem cells", PNAS 100 (2003) 2426
Непатентный документ 4: Kuwana M. et al., "Human circulating CD14+ monocytes as a source of progenitors that exhibit mesenchymal cell differentiation", J. Leukoc. Biol., 74 (2003) 833
Непатентный документ 5: Folch J., Lees M., Sloane-Stanley G. H., "A simple method for the isolation and purification of total lipids from animal tissues", J. Biol. Chem., 226, 497-509 (1957)
Краткое описание сущности изобретения
Техническая задача
Получение стволовых клеток, которые эффективно поступают в область-мишень, считалось проблематичным в области клеточных лекарственных средств. Целью настоящего изобретения является получение таких стволовых клеток, способ массового получения стволовых клеток за короткий срок и фармацевтическая композиция для индукции стволовых клеток.
Другой целью изобретения является получение средства для лечения заболеваний, связанных с поврежденными клетками, тканями или органами.
Еще одной целью изобретения является получение культуральной среды, индуцирующей дедифференциацию, средства, индуцирующего дедифференциацию, набора клеточного лекарственного средства, набора для получения дедифференцированных клеток и стволовых клеток.
Решение задачи
В качестве решения указанных выше задач, заявители обнаружили, что культивирование моноцитов периферической крови в течение короткого периода времени в присутствии индуцирующего дедифференциацию средства по настоящему изобретению продуцирует большое количество дедифференцированных клеток. Заявители также обнаружили, что непосредственное введение фармацевтической композиции по настоящему изобретению в живой организм значительно эффективно для лечения связанных с повреждением заболеваний. Заявители, кроме того, обнаружили, что введение по меньшей мере одного представителя, выбранного из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта, вызывает дедифференциацию моноцитов в клетки, способные восстанавливать поврежденные ткани или органы, такие как стволовые клетки, возможно, в кооперации с интравитальным M-CSF. Таким образом, настоящее изобретение относится к терапевтическому средству для лечения заболеваний, связанных с поврежденными клетками, тканями или органами.
В частности, настоящее изобретение относится к следующим аспектам.
Пункт 1. Стволовые клетки, полученные культивированием моноцитов в присутствии (i) M-CSF и (ii) по меньшей мере одного представителя, выбранного из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта, посредством этого дедифференцируя моноциты.
Пункт 2. Стволовые клетки по п.1, где активный ингредиент растворимого в воде растительного экстракта представляет собой сахар или содержащий сахар комплекс, причем активный ингредиент дедифференцирует моноциты.
Пункт 3. Стволовые клетки по п.1, где активный ингредиент растворимого в воде растительного экстракта имеет молекулярную массу от 1000 до 500000, причем активный ингредиент дедифференцирует моноциты.
Пункт 4. Стволовые клетки по п.1, где активный ингредиент растворимого в воде растительного экстракта адсорбирован на колонке Con A, причем активный ингредиент дедифференцирует моноциты.
Пункт 5. Стволовые клетки по п.1, где активный ингредиент растворимого в воде растительного экстракта адсорбирован на анионообменной смоле, причем активный ингредиент дедифференцирует моноциты.
Пункт 6. Стволовые клетки по п.1, где активный ингредиент растворимого в воде растительного экстракта представляет собой фракцию водной фазы растительного происхождения, экстрагированную методом Folch, или ее очищенный продукт.
Пункт 7. Стволовые клетки по п.1, где моноциты представляют собой моноциты человека.
Пункт 8. Стволовые клетки по любому из пп.1-7, где экспрессирован по меньшей мере один представитель недифференциированных маркеров Nanog, Nestin, c-Kit, CD9 и Oct3/4, и экспрессия гена CXCR4 является значимой, по сравнению со стволовыми клетками, полученными культивированием моноцитов в присутствии только M-CSF.
Пункт 9. Стволовые клетки, в которых экспрессирован по меньшей мере один представитель недифференцированных маркеров Nanog, Nestin, c-Kit, CD9 и Oct3/4, и экспрессия гена CXCR4 является значимой.
Пункт 10. Способ получения стволовых клеток, включающий культивирование моноцитов в присутствии (i) M-CSF и (ii) по меньшей мере одного представителя, выбранного из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта.
Пункт 11. Способ по п.10, где культивирование выполняется в течение от 7 до 14 дней.
Пункт 12. Культуральная среда для дедифференциации моноцитов, содержащая (i) M-CSF и (ii) по меньшей мере один представитель, выбранный из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта.
Пункт 13. Фармацевтическая композиция, содержащая стволовые клетки по любому из пп.1-9 в качестве активного ингредиента.
Пункт 14. Клеточное лекарственное средство, содержащее стволовые клетки по любому из пп.1-9 в качестве активного ингредиента.
Пункт 15. Вызывающее дедифференциацию средство, содержащее (i) M-CSF и (ii) по меньшей мере один представитель, выбранный из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта, в качестве активных ингредиентов.
Пункт 16. Средство для лечения заболеваний, связанных с поврежденными клетками, тканями или органами, содержащее по меньшей мере один представитель, выбранный из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта, в качестве активного ингредиента.
Пункт 17. Средство для лечения заболеваний, связанных с поврежденными клетками, тканями или органами, по п.16, где заболевания выбраны из группы, состоящей из наружных травм, воспалительных заболеваний, повреждением костей или хрящей, сердечно-сосудистых заболеваний, неврологических расстройств, заболеваний печени, почечных заболеваний, диабета, атопического дерматита и GVHD (болезни трансплантат против хозяина).
Пункт 18. Средство для лечения заболеваний, связанных с поврежденными клетками, тканями или органами, по п.16, где заболевания выбраны из группы, состоящей из наружных травм, панкреатита, лучевого повреждения, дерматомиозита, множественного миозита, некротического фасциита, хронического бронхита, перелома костей, остеопороза, костно-хрящевых переломов, остеохондрита, дилятационной кардиомиопатии, инфаркта миокарда, ишемической кардиомиопатии, сердечной недостаточности, гипертрофии миокарда, застойной сердечной недостаточности, рестеноза, аритмии, атеросклероза, васкулита, периферической нейропатии, нейропатической боли, инсульта, энцефалита, менингита, диабетической нейропатии, расстройства с дефицитом внимания, аутизма, болезни Альцгеймера, болезни Паркинсона, болезни Крейцфелдта-Якоба, внешних повреждений или ишемии мозга или позвоночника, цирроза печени, хронического гепатита, хронической почечной недостаточности, гломерулонефрита, почечной ишемии, диабета, атопического дерматита и GVHD.
Пункт 19. Набор клеточного лекарственного средства, содержащий, по меньшей мере, стволовые клетки по любому из пп.1-9 в качестве существенного ингредиента.
Пункт 20. Набор для получения дедифференцированных клеток, содержащий (i) M-CSF и (ii) по меньшей мере один представитель, выбранный из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта, в качестве существенных ингредиентов.
Пункт 21. Набор по п.20, дополнительно содержащий моноциты в качестве компонента.
Пункт 22. Стволовые клетки, способ получения стволовых клеток, культуральная среда для дедифференциации моноцитов, клеточное лекарственное средство, средство для лечения заболеваний, средство, вызывающее дедифференциацию, набор клеточного лекарственного средства или набор для получения дедифференцированных клеток по пунктам 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или 21, где ганглиозид представляет собой по меньшей мере один представитель, выбранный из группы, состоящей из GD1a, GD1b, GD2, GD3, GM1, GM2, GM3, GT1b и GQ1b.
Преимущества изобретения
Используя моноциты, настоящее изобретение обеспечивает массовое получение за короткий период времени стволовых клеток, поступающих в поврежденные ткани. Настоящее изобретение также относится к средству для индукции стволовых клеток. Таким образом, ожидается, что настоящее изобретение вносит вклад в область создания клеточных лекарственных средств.
Кроме того, было доказано, что ганглиозид и растворимый в воде экстракт растительного происхождения, такой как фракция водной фазы растительного происхождения, экстрагированная методом Folch, или ее очищенный продукт, служат в качестве лекарственного средства для лечения заболеваний, связанных с поврежденными клетками, тканями или органами.
Краткое описание чертежей
На фиг.1 показаны кривые роста стволовых клеток, индуцированных из моноцитов, культивированием в средах 1-5.
На фиг.2 показаны результаты генной экспрессии с использованием RT-PCR (полимеразной цепной реакции с обратной транскрипцией).
На фиг.3 представлены эффекты дедифференциации в стволовые клетки добавлением ганглиозидов.
Фиг.4 иллюстрирует формы клеток после добавления ганглиозидов.
На фиг.5 показана индуцирующая дедифференциацию активность каждой экстрагированной из растения фракции.
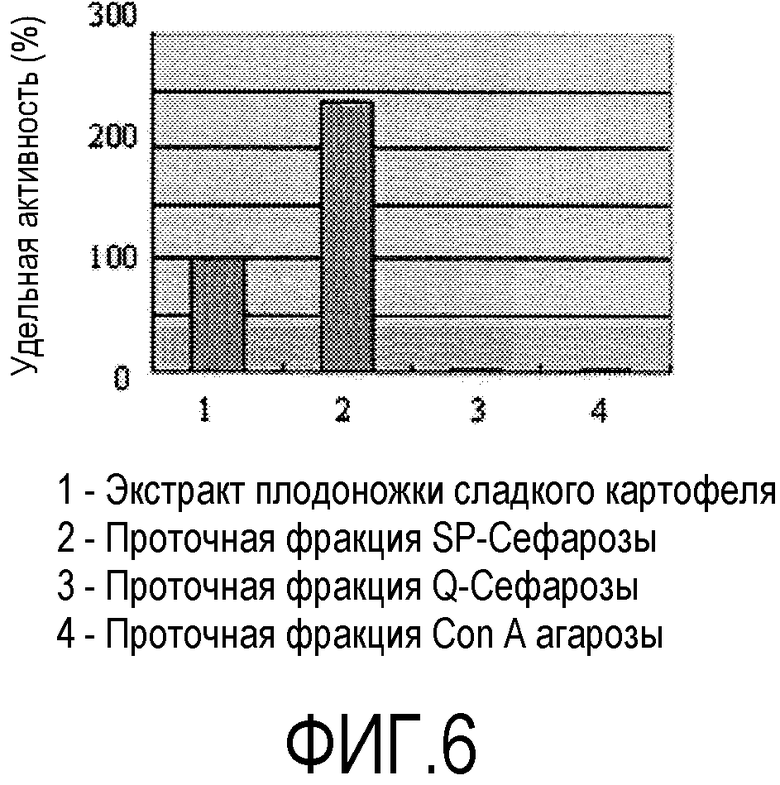
На фиг.6 показаны результаты активности фракций полученного из экстракта плодоножки сладкого картофеля индуцирующего дедифференциацию компонента, полученного хроматографией.
На фиг.7 представлены изображения окрашенных антиколлагеновых антител в мышиной печеночной ткани.
Наилучший способ осуществления изобретения
В настоящем изобретении используются моноциты, такие как моноциты периферической крови, в качестве клеток, подвергаемых дедифференциации.
В настоящем изобретении используются моноциты млекопитающего, полученные у людей, лошадей, коров, обезьян, таких как шимпанзе, свиней, овец, кроликов, мышей, крыс, собак, кошек и подобных млекопитающих. Среди них предпочтительны люди, обезьяны, включая шимпанзе, и тому подобные приматы. Особенно предпочтительны моноциты человека. Моноциты получают из костного мозга или крови. Предпочтительно использование моноцитов, полученных из крови, в частности, моноцитов, полученных из периферической крови.
Способ выделения моноцитов из образца крови или тому подобного материала хорошо известен. Например, существует способ, предусматривающий сначала выделение мононуклеарных клеток из крови с использованием раствора для сепарации клеток крови «LymphoprepTM» (Cosmo Bio Co. Ltd.), а затем обработку полученных мононуклеарных клеток покрытыми антителами магнитными шариками (Miltenyi Biotec), способными распознавать поверхностный антиген CD14, посредством этого отделяя моноциты-мишени. Мононуклеарные клетки могут также непосредственно использоваться в качестве источника для получения моноцитов по настоящему изобретению.
Моноциты человека могут быть выбраны из продуктов, которые являются коммерчески доступными, таких как PT038 (Lonza).
В соответствии с настоящим изобретением, осуществляется дедифференциация моноцитов в стволовые клетки, и полученные клетки пролиферируют перед введением испытуемому индивиду, такому как человек. В этом случае, моноциты получают у пациента, и поэтому необходимо получение как можно большего количества стволовых клеток из минимального количества моноцитов. Настоящее изобретение имеет преимущество дедифференциации стволовых клеток из моноцитов с высокой эффективностью пролиферации, посредством чего продуцируется большое количество стволовых клеток из небольшого количества моноцитов.
Примеры моноцитов включают клетки типа моноцитов (моноциты, мононуклеарные клетки, монобласты), имеющие рецептор M-CSF (c-fms). Поскольку моноциты пролиферируют только если и моноциты, и мононуклеарные клетки используются в одно и то же время, настоящее изобретение относится к возможности использования мононуклеарных клеток в качестве дедифференцированных клеток, в дополнение к моноцитам.
В настоящем описании термин «стволовая клетка» обозначает клетку, экспрессирующую недифференцированный маркер и имеющую ауторепродуктивное свойство. Путем использования моноцитов может быть получено большое количество стволовых клеток по настоящему изобретению. Стволовые клетки по настоящему изобретению могут вызвать дифференциацию и, предпочтительно, имеют свойство плюрипотентной дифференциации. Стволовые клетки, полученные в настоящем изобретении, являются CD14- и CD45-положительными.
Стволовые клетки по настоящему изобретению характеризуются значительной экспрессией генов CXCR4; они также отличаются тем, что экспрессирован по меньшей мере один представитель, предпочтительно, по меньшей мере два представителя, предпочтительнее, по меньшей мере три представителя, еще предпочтительно, по меньшей мере четыре представителя, особенно предпочтительно, экспрессированы все представители Nanog, Nestin, c-Kit, CD9 и Oct3/4.
В предпочтительной форме стволовой клетки по настоящему изобретению, ген CXCR4 значительно сильнее экспрессирован, чем ген в стволовых клетках, полученных культивированием моноцитов в присутствии только M-CSF, и экспрессирован по меньшей мере один представитель, предпочтительно, по меньшей мере два представителя, предпочтительнее, по меньшей мере три представителя, еще предпочтительнее, по меньшей мере четыре представителя, особенно предпочтительно, экспрессированы все пять представителей из Nanog, Nestin, c-Kit, CD9 и Oct3/4.
Ниже представлены признаки стволовых клеток по настоящему изобретению в более предпочтительном варианте осуществления:
(i) ген CXCR4 значительно сильнее экспрессирован, чем в стволовых клетках, полученных культивированием моноцитов в присутствии только M-CSF;
(ii) экспрессирован c-Kit; и
(iii) экспрессирован по меньшей мере один недифференцированный маркер, выбранный из группы, состоящей из Nanog, Nestin, CD9 и Oct3/4.
Признак, который дифференцирует полученные из моноцитов стволовые клетки по настоящему изобретению от других дифференцированных стволовых клеток, представляет собой значительную экспрессию гена CXCR4, который участвует в хоминге клеток. В стволовых клетках по настоящему изобретению, гены CXCR4 значительно сильнее экспрессированы, чем гены CXCR4 в стволовых клетках, полученных культивацией моноцитов в присутствии только M-CSF. Например, в предпочтительном варианте осуществления стволовых клеток по настоящему изобретению, количество экспрессии гена CXCR4, анализируемое RT-PCR или тому подобным способом, более чем в 3 или 4 раза больше, чем количество экспрессии в результате культивации моноцитов в присутствии только M-CSF, или в присутствии M-CSF+IL-3, M-CSF+IL-6&LIF и т.д. Кроме того, в предпочтительном варианте осуществления стволовых клеток по настоящему изобретению, гены CXCR4 значительно сильнее экспрессированы, чем гены CXCR4 в мезенхимальных стволовых клетках, полученных из костного мозга; конкретнее, количество экспрессии гена CXCR4, анализируемое RT-PCR или тому подобным способом, более чем в 2 или 3 раза больше, чем экспрессия гена CXCR4 в костном мозге.
Моноциты, полученные из стволовых клеток по настоящему изобретению, как и другие дедифференцированные стволовые клетки, характеризуются экспрессией c-Kit, который представляет собой маркер стволовых клеток.
Известно, что SDF1, лиганд рецептора CXCR4, экспрессирован в тканях, которые повреждены в результате перелома костей и циркуляторных заболеваний, в поврежденных частях нервной ткани или тому подобных. Поэтому клетки обеспечивают еще лучший эффект хоминга клеток в отношении поврежденных областей, когда он служит в качестве клеточного лекарственного средства.
Стволовые клетки, полученные по настоящему изобретению, могут использоваться для лечения заболеваний путем введения/инъекции их в пораженные области. Перед инъекцией предпочтительно культивирование стволовых клеток в соответствующей культуральной среде для пролиферации клеток. Затем клетки непосредственно вводят/инъецируют в пораженные области. Стволовые клетки можно культивировать в общей среде для клеточной культуры; однако предпочтительно культивировать стволовые клетки в вызывающей дедифференциацию культуральной среде по настоящему изобретению.
В соответствии с одним вариантом осуществления настоящего изобретения, стволовые клетки по настоящему изобретению могут использоваться для лечения внешних травм, воспалительных заболеваний (панкреатита, лучевого повреждения, дерматомиозита, множественного миозита, некротического фасциита, хронического бронхита), повреждения костей или хрящей (перелома костей, остеопороза, костно-хрящевых переломов, остеохондрита), сердечно-сосудистых заболеваний (например, дилятационной кардиомиопатии, инфаркта миокарда, ишемической кардиомиопатии, сердечной недостаточности, гипертрофии миокарда, застойной сердечной недостаточности, рестеноза, аритмии, атеросклероза, васкулита и т.д.), неврологических расстройств (например, периферической нейропатии, нейропатической боли, инсульта, энцефалита, менингита, диабетической нейропатии, расстройства с дефицитом внимания, аутизма, болезни Альцгеймера, болезни Паркинсона, болезни Крейтцфельдта-Якоба, внешних повреждений или ишемии мозга или позвоночника и т.д.), заболеваний печени (цирроза печени, хронического гепатита), почечных заболеваний (хронической почечной недостаточности, гломерулонефрита, почечной ишемии и т.д.), диабета, атопического дерматита, GVHD или тому подобных.
Дедифференцированные стволовые клетки по настоящему изобретению были депонированы в Депозитарии Международной Патентной Организации Национального Института Передовой Науки и Технологии (Central 6, 1-1, Higashi 1-chome Tsukuba-shi, Ibaraki-ken 305-8566 Japan) 30 сентября, 2009 г., под номером доступа ABP-11184.
Как указано выше, моноциты преобразуются в стволовые клетки при культивировании моноцитов в присутствии (i) M-CSF и (ii) по меньшей мере одного представителя, выбранного из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта.
В настоящем описании «растворимый в воде растительный экстракт» обозначает экстракт всего растения или части растения (например, листьев, стеблей/стволов/плодоножек, подземных стеблей, корневищ, клубней, вьющихся растений, корней, цветов, почек, лепестков, завязей, плодов, коробочек, капсул, семян, волокон, семяпочек и т.д.). Примеры экстрагентов включают воду, водный растворитель (например, водный спирт, такой как водный метанол, водный этанол или водный пропанол; водный THF (тетрагидрофуран); водный ацетон) и полярные растворители, такие как DMF (диметилформамид), DMSO (диметилсульфоксид) или диметилацетамид. «Растворимый в воде растительный экстракт» представляет собой вещество, экстрагированное из такого растворителя, т.е. воды, водного растворителя или полярного растворителя, способного растворять полярное вещество в большом количестве. Растворимый в воде растительный экстракт может быть получен следующим образом. Сначала растение экстрагируют с использованием хлорированных углеводородов, таких как хлороформ или метиленхлорид; спиртов, таких как метанол, этанол или пропанол; ароматических углеводородов, таких как бензол или толуол; сложных эфиров, таких как этилацетат; простых эфиров, таких как THF или простой диэтиловый эфир; кетоны, такие как ацетон и метилэтилкетон; алифатические или алициклические углеводороды, такие как гексан или циклогексан. Затем растительный экстракт обрабатывают водой или водным растворителем для получения мишеневого растворимого в воде вещества. Таким образом, растворимое в воде вещество, полученное с использованием воды, водного растворителя или полярного растворителя, может, если требуется, кроме того, быть обработано хлорированными углеводородами, такими как хлороформ или метиленхлорид; ароматическими углеводородами, такими как бензол или толуол; сложными эфирами, такими как этилацетат; простыми эфирами, такими как THF или простой диэтиловый эфир; алифатическими или алициклическими углеводородами, такими как гексан или циклогексан, с тем чтобы отмыть липофильный компонент. Растворимый в воде растительный экстракт представляет собой предпочтительно экстрагированную по Folch из растения фракцию водной фазы или ее очищенный продукт.
Экстракт по Folch обозначает фракцию, остающуюся в водной фазе, в результате процесса экстракции растения с использованием растворителя хлороформ:метанол=2:1 и промывания смешанного растворителя водой. Вместо хлороформа могут использоваться другие хлорированные углеводороды, такие как метиленхлорид, тетрахлорид углерода или 1,2-дихлорэтан. Вместо метанола могут использоваться низшие спирты, такие как этанол, н-пропанол, изопропанол или бутанол. Отношение хлорированного углеводорода к спирту не ограничивается соотношением 2:1. Может использоваться широкий диапазон соотношений. В настоящем описании смешанный растворитель из хлорированного углеводорода и спирта имеет свойство высокого растворения, посредством этого содействуя экстракции. Отношение хлорированного углеводорода к спирту, предпочтительно, устанавливается на величину, которая может обеспечить разделение на водную фазу и органическую фазу при добавлении воды, посредством этого экстрагируя активное вещество в водной фазе. Если фаза не делится добавлением воды, то добавляется органический растворитель для разделения растворителя на два слоя. В настоящем описании, водная фаза, полученная в результате разделения на два слоя добавлением воды, называется «фракций водной фазы, экстрагированной из растения по Folch». Фракция водной фазы, экстрагированная другим способом, также включена в диапазон «фракции водной фазы, экстрагированной из растения по Folch», пока она имеет такое же активное вещество.
Растворимый в воде растительный экстракт по настоящему изобретению содержит подобное гликолипиду вещество (содержащее один или оба из гликолипида и сахара) в качестве активного ингредиента. Поскольку такое подобное гликолипиду вещество имеет низкую растворимость в органическом растворителе, растворимый в воде растительный экстракт предпочтительно выделяют в виде фракции водной фазы. Кроме того, растворимый в воде растительный экстракт может далее быть очищен с использованием различных видов хроматографии, таких как ионообменная хроматография или аффинная хроматография. Очищенный продукт может также использоваться в качестве активного ингредиента.
Активный ингредиент в растворимом в воде растительном экстракте может состоять только из сахара или может содержать и сахар, и другие компоненты (липиды и т.д.). Примеры сахарных компонентов включают глюкозу, арабинозу, ксилозу, рибозу, рамнозу, фукозу, деоксирибозу, маннозу, фруктозу, галактозу, мальтозу, лактозу, целлобиозу, сахарозу, трегалозу, раффинозу, мелибиозу, мальтотриозу, мелезитозу, туранозу, глюкуроновую кислоту, галактуроновую кислоту, маннуроновую кислоту, идуроновую кислоту, глюкозамин, галактозамин, маннозамин, N-ацетилглюкозамин, N-ацетилгалактозамин, N-ацетилманнозамин, нейраминовую кислоту, N-ацетилнейраминовую кислоту и тому подобные. Эти компоненты могут быть сульфатированными. Предпочтительно, они могут присутствовать в форме олигосахаридов, полисахаридов, гликозидов или гликолипидов. Конкретные примеры полисахаридов включают гликозаминогликан, α-глюкан, β-глюкан, леван, фруктан, галактан, маннан, ксилан, арабинан, пектиновую кислоту, альгиновую кислоту, пектиновые вещества, гуаран, сульфатированный полисахарид, полисахарид, в котором один или более видов сахарных остатков связаны, полисахариды, образованные из структурных единиц одного или более членов указанных выше сахарных остатков, и полисахарид, в котором множественные сахарные остатки сложно связаны. Предпочтительно, растворимый в воде растительный экстракт обработан катионообменной смолой после экстрагирования. В одном из вариантов варианте осуществления, растворимый в воде растительный экстракт по настоящему изобретению, предпочтительно, содержит компонент, который адсорбирован на анионообменной смоле (компонент, имеющий анионную группу в воде) в качестве активного ингредиента. В другом варианте осуществления, растворимый в воде растительный экстракт по настоящему изобретению, предпочтительно, содержит компонент, который связывается с агарозой Con A (конкавалин A) в качестве активного ингредиента. В предпочтительном варианте осуществления настоящего изобретения растворимый в воде растительный экстракт адсорбирован на анионообменной смоле и содержит компонент, который связывается с агарозой конкавалина A в качестве активного ингредиента. В качестве активного ингредиента, связывающегося с агарозой конкавалина A, предпочтительны полисахариды или сахара (включая содержащие сахар комплексы, такие как гликолипиды), содержащие остаток глюкозы и/или маннозы, в частности, остаток маннозы. В предпочтительном варианте осуществления растворимый в воде растительный экстракт содержит компонент, имеющий остаток сахара и растворимый в холодной воде или горячей воде (экстрагируемый). Компонент, предпочтительно, представляет собой полисахарид или содержащий сахар комплекс, в котором нижний предел молекулярной массы составляет примерно 500, 1000, 2000, 3000, 4000 или 5000, и выше примерно 500000, 300000, 200000, 100000, 80000, 60000, 50000, 40000, 30000 или 20000.
Индукция до стволовых клеток может выполняться культивированием моноцитов в присутствии по меньшей мере одного представителя, выбранного из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта.
Поскольку M-CSF уже существует в живом организме (например, в организме человека), один представитель, выбранный из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта, может служить в качестве индуктора для вызова превращения из моноцитов в стволовые клетки. Стволовые клетки поступают в пораженную область и, посредством этого, служат в качестве терапевтического средства для лечения различных видов заболеваний. Терапевтическое средство, содержащее в качестве активного ингредиента по меньшей мере один представитель, выбранный из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта, эффективно для лечения внешних травм, воспалительных заболеваний (панкреатита, лучевого повреждения, дерматомиозита, множественного миозита, некротического фасциита, хронического бронхита), повреждения костей или хрящей (перелома костей, остеопороза, костно-хрящевых переломов, остеохондрита), сердечно-сосудистых заболеваний (например, дилятационной кардиомиопатии, инфаркта миокарда, ишемической кардиомиопатии, сердечной недостаточности, гипертрофии миокарда, застойной сердечной недостаточности, рестеноза, аритмии, атеросклероза, васкулита и т.д.), неврологических расстройств (например, периферической нейропатии, нейропатической боли, инсульта, энцефалита, менингита, диабетической нейропатии, расстройства с дефицитом внимания, аутизма, болезни Альцгеймера, болезни Паркинсона, болезни Крейтцфельдта-Якоба, внешних повреждений или ишемии мозга или позвоночника и т.д.), заболеваний печени (цирроза печени, хронического гепатита), почечных заболеваний (хронической почечной недостаточности, гломерулонефрита, почечной ишемии и т.д.), диабета, атопического дерматита, GVHD или тому подобных.
Эффективная доза терапевтического средства, содержащего по меньшей мере один представитель, выбранный из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта в качестве активного ингредиента, зависит, например, от применения, возраста и пола пациента, тяжести заболевания или тому подобных состояний. Обычно, количество используемого активного ингредиента составляет для взрослого примерно от 0,0001 до 100 мг, предпочтительно, примерно от 0,001 до 10 мг, а предпочтительнее, примерно от 0,01 до 5 мг на 1 кг массы тела. Суточная доза терапевтического средства может делиться на 1-4 приема.
«Фракция водной фазы, экстрагированной из растения по Folch» включает широкий диапазон растительных экстрактов, полученных аналогичными способами. Кроме того, активный ингредиент растворимого в воде растительного экстракта, содержащего фракцию водной фазы, экстрагированной из растения по Folch, может комбинироваться с анионообменными смолами и агарозой конкавалина A; и его активность может увеличиваться пропусканием через катионообменную смолу.
При применении в качестве лекарственного препарата терапевтическое средство или фармацевтическая композиция по настоящему изобретению может формироваться в обычную лекарственную форму путем использования фармацевтического носителя вместе с активным ингредиентом, который содержит по меньшей мере один представитель, выбранный из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта и, если требуется, M-CSF. Терапевтический носитель выбирается в зависимости от желательной лекарственной формы, дозировки и способа введения. Примеры терапевтических носителей включают различные разбавители и эксципиенты, такие как наполнители, агенты для увеличения объема, связывающие агенты, смачивающие агенты, разрыхлители, поверхностно-активные вещества, смазывающие вещества и т.д.
Лекарственная форма по настоящему изобретению может быть выбрана из различных форм, в зависимости от цели лечения. Характерные примеры лекарственных форм включают таблетки, пилюли, порошки, жидкости, растворы, суспензии, эмульсии, гранулы, капсулы, суппозитории, инъекционные лекарственные формы (жидкости, суспензии и т.д.), мази и т.д. Лекарственное средство получают в виде соответствующей лекарственной формы обычным способом с использованием подходящего носителя. Таблетка может представлять собой таблетку, имеющую обычное покрытие, такую как таблетки с сахарным покрытием, таблетки, покрытые желатином, таблетки с энтеросолюбильным покрытием, таблетки с пленочным покрытием, двухслойные таблетки или многослойные таблетки и т.д. Когда лекарственные средства по настоящему изобретению получают в виде инъекционных препаратов в форме жидкости, эмульсии или суспензии, то лекарственное средство предпочтительно стерилизуется и является, предпочтительно, изотоничным относительно крови. Поэтому, фармацевтическая композиция по настоящему изобретению может содержать соль, глюкозу или глицерин в количестве, достаточном для получения изотонического раствора. Фармацевтическая композиция по настоящему изобретению может также содержать обычный солюбилизирующий агент, буфер, смягчающий агент и т.д. Кроме того, фармацевтическая композиция по настоящему изобретению может также содержать красящий агент, консервант, ароматизатор, отдушку, подсластитель и т.д., или другие лекарственные средства. При введении и M-CSF, и по меньшей мере одного представителя, выбранного из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта, они могут вводиться одновременно или отдельно.
По меньшей мере один представитель, выбранный из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта, может приниматься внутрь в виде пищевого продукта, например напитков, батончиков (батончиков с пищевой добавкой) и т.д. Такая пищевая композиция может быть получена в соответствии с обычным способом с использованием других целесообразных общеизвестных пищевых материалов (сырьевых материалов), эксципиентов, разбавителей и т.д.
Дедифференцированные стволовые клетки могут быть получены путем индуцирования дедифференциации путем культивирования указанного выше клеточного материала в комбинации (i) M-CSF и (ii) по меньшей мере одного представителя, выбранного из группы, состоящей из ганглиозида и растворимого в воде растительного экстракта, в течение заданного периода.
Существуют связанные с мембраной M-CSF, молекулярная масса которых составляет приблизительно 22000, и секреторные M-CSF, молекулярная масса которых составляет приблизительно 42000. С дисульфидной мостиковой связью их молекулярная масса становится приблизительно 45000 (димер M-CSF с молекулярной массой 22000) и приблизительно 85000 (димер M-CSF с молекулярной массой 42000) соответственно. Существует также тип M-CSF с высокой молекулярной массой, в котором протеогликан, кроме того, связан с M-CSF 85 кДа. Может использоваться любой из этих различных типов M-CSF; однако предпочтительны секреторные M-CSF, молекулярная масса которых составляет приблизительно 42000, и M-CSF, молекулярная масса которых составляет приблизительно 85000 (димер M-CSF с молекулярной массой 42000), тип M-CSF с высокой молекулярной массой, в котором протеогликан, кроме того, связан с M-CSF 85 кДа. M-CSF предпочтительно получен у людей, лошадей, коров, обезьян, в частности шимпанзе, свиней, овец, кроликов, мышей, крыс, собак, кошек и тому подобных млекопитающих. Среди них предпочтительны люди, обезьяны, в частности шимпанзе, и подобные приматы. Особенно предпочтительны человеческие моноциты. M-CSF может быть получен очисткой натурального продукта; однако предпочтителен рекомбинантный M-CSF. Например, предпочтительно использование рекомбинанта, экспрессируемого E. coli, без сахарной цепи, потому что известно, что M-CSF имеет удельную активность, аналогичную натуральному продукту, когда он имеет аминокислоты, по меньшей мере, от N-конца до 153-й аминокислоты.
Ганглиозид конкретно не ограничивается, пока он выбран из следующего списка, включающего GM1, GD1a, GT1b и т.д. Множество из этих ганглиозидов могут комбинироваться. Кроме того, растительный экстракт (подобное гликолипиду вещество растительного происхождения) может также вызывать значительную дедифференциацию. Может также использоваться экстракт, полученный из ткани животного (подобное гликолипиду вещество животного происхождения). Экстракт может быть получен в условиях, обычных для экстрагирования подобного гликолипиду вещества. Активный ингредиент лекарственного средства по настоящему изобретению представляет собой ганглиозид или растворимый в воде экстракт растительного происхождения. Могут использоваться любые экстракты растительного происхождения или экстракты, полученные из ткани животных, содержащие ганглиозид или растворимый в воде экстракт растительного происхождения. Например, ганглиозид в большом количестве содержится в мозге/нервной ткани животного, и экстракты, полученные из мозга и нервных тканей животного, могут использоваться в качестве ганглиозида. Экстрагированный ганглиозид может быть очищен. Поскольку фракция содержит ганглиозид, то степень очистки может варьироваться. Как правило, в качестве компонента экстракции можно использовать фракцию, полученную в условиях, при которых возможна экстракция гликолипид-подобных веществ. Примеры фракций натуральных экстрактов включают экстрагированную по Folch (непатентная литература 5) фракцию водной фазы. Предпочтительные примеры животных включают млекопитающих (коров, свиней, кроликов, овец, лошадей и т.д.), и ганглиозид из мозга или нервных тканей свиней особенно предпочтителен. Может также использоваться ганглиозид, полученный из молока млекопитающих, такого как коровье молоко.
Предпочтительные примеры ганглиозидов или растворимых в воде экстрактов растительного происхождения, подлежащих использованию в качестве материала подобного гликолипиду вещества, включают сладкий картофель вида Ipomea Batatas, ипомею (morning glory), болотную ипомею (swamp morning glory), ипомею плющевидную (Ivy-leaved morning glory), ипомею острозубчатую (fingerleaf morning glory), кардинал вьющийся (cardinal climber), синюю ипомею (blue morning glory), индийскую ипомею, (Ipomoea congesta) и тому подобные вьюнковые (Convolvulaceaes); лотус орехоносный (Nelumbo nucifera) (корень лотоса), лотос желтый (Nelumbo lutea) и подобные лотосы; соланум американский (Solanum americanum), помидорки зубчатики (Solanum lycopersicum), паслен сосочковый (Solanum mammosum), баклажан (Solanum melongena), паслен черный (Solanum nigrum), клубень картофеля (Solanum tuberosum), перец сладкий (Capsicum annuum), перец кайенский (Capsicum frutescens), дурман индийский (Datura metel), дурман метелевидный (Datura meteloides), дурман обыкновенный (Datura stramonium), бругмансию древовидную (Brugmansia arborea), бругмансию с пестрыми лентами (Brugmansia suaveolens), физалис обыкновенный (Physalis alkekengi var. franchetii), подбел широкий (P. japonicum), петунию гибридную (Petunia x hybrida) и подобные Solanaceouses. Кроме приведенных выше примеров, может использоваться широкий диапазон ганглиозидов или растворимых в воде экстрактов растительного происхождения, содержащих гликолипид. Растение может представлять собой листья, стебли, стволы, плодоножки, подземные стебли, корневища, клубни, вьющиеся растения, корни, цветы, почки, лепестки, завязи, плоды, коробочки, капсулы, семена, волокна, семяпочки, травы и т.д. Экстракт может быть получен из любой из этих частей.
Например, может использоваться клубнелуковичная часть картофеля или сладкого картофеля, в дополнение к другим частям картофеля или сладкого картофеля, таким как листья, стебли, стволы, плодоножки, подземные стебли, корневища, клубни, вьющиеся растения, корни, цветы, почки, лепестки, завязи, плоды, коробочки, капсулы, семена, волокна, семяпочки, травы и т.д.
Например, возможно использование трансгенного растения, которое перерабатывается или для введения необходимых генов, или для нокдауна ненужных генов, с тем чтобы увеличить продукцию ганглиозида или подобных гликолипидам веществ.
«Ганглиозид» представляет собой общее название гликофинголипида, имеющего сиаловую кислоту, такого как GD1a, GD1b, GD2, GD3, GM1, GM2, GM3, GT1b или GQ1b.
Ганглиозиды имеют следующие структуры.
GD1a=aNeu5Ac(2-3)bDGalp(1-3)bDGalNAc(1-4)[aNeu5Ac(2-3)]bDGalp(1-4)bDGlcp(1-1)Cer
GD1b=bDGalp(1-3)bDGalNAc(1-4)[aNeu5Ac(2-8)aNeu5Ac(2-3)]bDGalp(1-4)bDGlcp(1-1)Cer
GD2=bDGalpNAc(1-4)[aNeu5Ac(2-8)aNeu5Ac(2-3)]bDGalp(1-4)bDGlcp(1-1)Cer
GD3=aNeu5Ac(2-8)aNeu5Ac(2-3)bDGalp(1-4)bDGlcp(1-1)Cer
GM1=bDGalp(1-3)bDGalNAc[aNeu5Ac(2-3)]bDGalp(1-4)bDGlcp(1-1)Cer
GM2=bDGalpNAc(1-4)[aNeu5Ac(2-3)]bDGalp(1-4)bDGlcp(1-1)Cer
GM3=aNeu5Ac(2-3)bDGalp(1-4)bDGlcp(1-1)Cer
GT1b=aNeu5Ac(2-3)bDGalp(1-3)bDGalNAc(1-4)[aNeu5Ac(2-8)aNeu5Ac(2-3)]bDGalp(1-4)bDGlcp(1-1)Cer
GQ1b=aNeu5Ac(2-8)aNeu5Ac(2-3)bDGalp(1-3)bDGalNAc(1-4)[aNeu5Ac(2-8)aNeu5Ac(2-3)]bDGalp(1-4)bDGlcp(1-1)Cer
aNeu5Ac = 5-ацетил-α-нейраминовая кислота
aNeu5Ac9Ac = 5,9-диацетил-α-нейраминовая кислота
bDGalp = β-D-галактопираноза
bDGalpNAc = N-ацетил-β-D-галактопираноза
bDGlcp = β-D-глюкопираноза
Cer = церамид (общий N-ацилированный сфингоид)
Может использоваться любая культуральная среда для млекопитающих. Например, культивирование может выполняться с использованием среды, такой как RPMI 1640, DMEM, Eagle MEM, αMEM, IMEM или M199, содержащей, например, приблизительно от 1 до 20% сывороточного компонента, такого как FBS, FCS, CS или HS. Культивирование предпочтительно выполняется, без ограничения, в среде DMEM, содержащей приблизительно 10% FBS. Может также использоваться бессывороточная культура, такая как Ultra CULTURETM (среда для типов клеток млекопитающих). Бессывороточная культуральная среда конкретно не ограничивается.
Дедифференцированные стволовые клетки могут быть получены культивированием моноцитов в среде, содержащей (i) M-CSF и (ii) по меньшей мере один представитель, выбранный из группы, состоящей из ганглиозида и растворимого в воде экстракта растительного происхождения, при 37°C в течение примерно от 7 до 14 дней в присутствии 5% CO2. В течение этого периода культивирования происходит дедифференциация и получаются специфические стволовые клетки по настоящему изобретению, экспрессирующие недифференцированный маркер. Кроме того, во время данного периода культивирования, значительно увеличивается экспрессия гена CXCR4, который является признаком стволовых клеток по настоящему изобретению. Даже если период культивирования продлевается, стволовые клетки по настоящему изобретению могут быть получены, пока имеется значимый уровень экспрессии гена CXCR4.
Когда клеточный материал культивируется в таких условиях, конечное число полученных стволовых клеток приблизительно в 5 раз больше их числа, полученного культивированием с использованием только M-CSF или комбинации с другими цитокинами.
Возможно использование комплекса ковалентной связи или нековалентной связи M-CSF и по меньшей мере одного представителя, выбранного из группы, состоящей из ганглиозида и растворимого в воде экстракта растительного происхождения в качестве средства, вызывающего дедифференциацию.
До настоящего времени в некоторых сообщениях было показано получение стволовых клеток путем культивирования моноцитов с использованием только M-CSF. Напротив, настоящее изобретение комбинирует (i) M-CSF и (ii) по меньшей мере один представитель, выбранный из группы, состоящей из ганглиозида и растворимого в воде экстракта растительного происхождения, для получения стволовых клеток, имеющих особенно значительную экспрессию гена CXCR4. Культивирование выполняют с использованием M-CSF в концентрации 5-100 нг/мл, предпочтительнее 25 нг/мл. Ганглиозид может представлять собой смесь экстрактов, полученных из растений или животных, материал, полученный очисткой натурального продукта, содержащего ганглиозид, или химическую композицию.
Гаглиозид может содержаться в культуральной среде в конечной концентрации примерно 1-100 мкг/мл. Растворимый в воде экстракт растительного происхождения может содержаться в культуральной среде в конечной концентрации примерно 0,1-100 мкг/мл.
Конечная концентрация по меньшей мере одного представителя, выбранного из группы, состоящей из ганглиозида и растворимого в воде экстракта растительного происхождения, составляет примерно 1-100 мкг/мл. В настоящем описании, «ганглиозид» обозначает отдельный ганглиозид, такой как GD1a, GD1b, GD2, GD3, GM1, GM2, GM3, GT1b или GQ1b, или смесь этих ганглиозидов. «Содержание ганглиозидов» означает их общее содержание при использовании множественных ганглиозидов.
Набор
Настоящее изобретение также относится к набору клеточного лекарственного средства, который содержит стволовые клетки по настоящему изобретению в качестве существенного ингредиента; и к набору для получения дедифференцированных клеток, который содержит (i) M-CSF и (ii) ганглиозид растворимого в воде экстракта растительного происхождения в качестве основных ингредиентов.
Набор клеточного лекарственного средства содержит стволовые клетки моноцитарного происхождения по настоящему изобретению и, если требуется, культуральную среду, содержащую (i) M-CSF и (ii) по меньшей мере один представитель, выбранный из группы, состоящей из ганглиозида и растворимого в воде экстракта растительного происхождения, контейнер для культуры и т.д. Набор может представлять собой шприц для инъекции, заполненный стволовыми клетками моноцитарного происхождения.
Количество стволовых клеток моноцитарного происхождения в наборе клеточного лекарственного средства составляет, например, примерно от 1×104 до 1×107 на набор.
Набор для получения дедифференцированных клеток по настоящему изобретению содержит (i) M-CSF и (ii) по меньшей мере один представитель, выбранный из группы, состоящей из ганглиозида и растворимого в воде экстракта растительного происхождения; культуральную среду, контейнер для культуры, моноциты и т.д.
Промышленная применимость
Область техники, в которой может применяться изобретение
Настоящее изобретение может применяться во всех областях, в которых применяются стволовые клетки, в частности в области клеточных лекарственных средств, которая привлекает внимание в последние годы. При применении в данной области клетки должны быть получены и предоставлены в пределах кроткого периода времени. Кроме того, с учетом иммунологического отторжения важно получение дедифференцированных стволовых клеток из клеток, взятых из организма пациента, и введение полученных стволовых клеток в организм того же пациента в целях безопасности. Поэтому важно получить определенное количество стволовых клеток в пределах короткого периода времени, после того как клеточный материал взят из организма пациента. Настоящее изобретение значимо в этом отношении.
Один из вариантов осуществления настоящего изобретения представляет собой внутривенное введение дедифференцированных клеток.
Клетки могут быть введены пациенту обычным способом после получения мишеневых клеток путем культивирования. Например, после обработки трипсином клетки собирают центрифугированием и диспергируют в соответствующем изотоническом растворе перед внутривенным введением. Кроме того, возможно добавление соответствующего фармацевтически приемлемого носителя для стабилизации клеток. Когда имеется интервал времени между выделением клеток из культурального раствора и введением культивированных клеток, то клетки могут быть консервированы обычным способом при -80°C или в присутствии жидкого азота. Предпочтительнее клетки собирают для использования с целью лечения через 7-14 дней после начала культивирования для дедифференнциации моноцитов, а затем сразу используют для целевого лечения, потому что в течение этого периода существует вероятность самого высокого уровня экспрессии гена CXCR4. Соответственно, период использования клеток может определяться в зависимости от уровня экспрессии маркерного гена, а не ограничиваться периодом культивирования.
Область техники, в которой может применяться терапевтическое средство/лекарственный компонент
В соответствии с настоящим изобретением производится введение по меньшей мере одного представителя, выбранного из группы, состоящей из ганглиозида и растворимого в воде экстракта растительного происхождения, и, если требуется, M-CSF, млекопитающим, таким как люди, для лечения посредством этого различных заболеваний, таких как внешние травмы, воспалительные заболевания, повреждение костей или хрящей, сердечно-сосудистые заболевания, неврологические расстройства, печеночные заболевания и почечные заболевания, диабет, атопический дерматит или GVHD. По меньшей мере один представитель выбирают из группы, состоящей из ганглиозида и растворимого в воде экстракта растительного происхождения, для дедифференциации моноцитов тестируемого индивида в стволовые клетки, способные излечить заболевания. Стволовые клетки перемещаются в пораженную область и функционируют в качестве терапевтического средства. В другом варианте по меньшей мере один представитель, выбранный из группы, состоящей из ганглиозида и экстрагированной по Folch фракции водной фазы растительного происхождения, может непосредственно или косвенно действовать на клетки, отличные от моноцитов.
Использование набора
Дедифференцированные стволовые клетки, полученные с использованием вызывающего дедифференциацию средства, могут использоваться в виде набора, после того как они подвергаются соответствующей консервирующей обработке.
Аналогичным образом, вызывающее дедифференциацию средство может использоваться в виде набора, который содержит средство в качестве существенного ингредиента.
Ниже описаны примеры настоящего изобретения для более конкретного описания изобретения. Однако настоящее изобретение не ограничивается приведенными примерами.
Примеры
Настоящее изобретение более подробно объяснено ниже на основании примеров. Однако настоящее изобретение не ограничивается данными примерами.
Пример 1
В соответствии с настоящим изобретением, человеческие моноциты (PT038; LONZA) культивировали с добавлением следующих добавок 1-5 к основной культуральной среде (концентрации выражены в виде конечной концентрации, далее именуемой в настоящем описании «FC»). На фиг.1 показаны результаты. По вертикальной оси на фиг.1 указано число жизнеспособных клеток, а по горизонтальной оси показано число дней культивирования. Результаты демонстрируют, что стволовые клетки моноцитарного происхождения по настоящему изобретению имеют очень высокую пролиферативную активность, по сравнению с клетками, полученными способами, описанными Fändrich, Huberman и т.д.
Добавка 1: M-CSF (FC: 25 нг/мл) + ганглиозиды (GD1a коровьего мозга; SIGMA) (FC: 100 мкг/мл)
Добавка 2: M-CSF (FC: 5 нг/мл) + IL-3 (FC: 0,5 нг/мл) (непатентный документ 2)
Добавка 3: M-CSF (FC: 25 нг/мл) + IL-6 (FC: 20 нг/мл) & LIF (FC: 1000 единиц/мл) (не патентный документ 3)
Добавка 4: M-CSF (FC: 25 нг/мл)
Добавка 5: M-CSF (FC: 25 нг/мл) + гликолипид (полученный растворением экстрагированной по Folch фракция водной фазы, полученной из 1 г растения (сладкого картофеля) на основе сухой массы в 500 мл культуральной среды)
Экстрагированную по Folch фракцию водной фазы, использованную в добавке 5, получали следующим образом. Сублимированные клетки (из ткани сладкого картофеля) тщательно гомогенизировали в подходящем количестве физиологического солевого раствора и затем энергично смешивали с эквивалентным количеством раствора хлороформа-метанола (2:1). После разделения смеси центрифугированием на фазу органического растворителя, фазу модифицированного белка и водную фазу, использовали экстракт в растворимой в воде фракции верхнего слоя.
Добавление всех добавок к среде DMEM (20% фетальная телячья сыворотка), культивирование моноцитов человека начинали в концентрации 1,5×105 клеток/мл (200 мкл/лунку, 96-луночный планшет). Количество жизнеспособных клеток определяли с использованием люминесцентного анализа жизнеспособности клеток Promega's CellTiter-GloTM. Конкретнее, лунки промывали физиологическим солевым раствором 3 раза в каждый день культивирования для удаления неприкрепленных клеток, и затем определяли количество прикрепленных и выращенных клеток.
Между тем, уровни генной экспрессии стволовых клеток, полученных способами культивирования в соответствии с настоящим изобретением и предшествующего уровня техники, анализировали RT-PCR. Культивирование моноцитов человека начинали в указанных выше условиях и в концентрации 1,5×105 клеток/мл (6 мл/чашку диаметром 6 см). На 14-й день мРНК собирали с использованием набора Micro Fast Track 2.0 Kit (Invitrogen). В последующем анализ уровня экспрессии выполняли RT-PCR. Ниже следуют параметры и информация о последовательности праймеров:
Структура полосы (величины концентрации выражены в виде конечной концентрации, далее именуемой «FC»)
1: M-CSF (FC: 25 нг/мл) + ганглиозиды (GD1a коровьего мозга; SIGMA) (FC: 100 мкг/мл)
2: M-CSF (FC: 5 нг/мл) + IL-3 (FC: 0,5 нг/мл) (непатентный документ 2)
3: M-CSF (FC: 25 нг/мл) + IL-6 (FC: 20 нг/мл) + LIF (FC: 1000 единиц/мл) (непатентный документ 3)
4: M-CSF (FC: 25 нг/мл)
5: M-CSF (FC: 25 нг/мл) + экстрагированная по Folch фракция водной фазы растительного происхождения
6: Без культуры
7: Без культуры
1-6: Моноциты человека, 7: кДНК костного мозга человека (Human Bone Marrow Marathon-Ready cDNA; Clontech)
Фиг.2 демонстрирует, что стволовые клетки, полученные по настоящему изобретению (полоса 1 или 5), имели очень высокий уровень экспрессии CXCR4.
В последующем проводили сравнение величин индуцирующей стволовые клетки активности различных ганглиозидов.
Конкретнее, ганглиозиды добавляли к культуральной среде в конечной концентрации 100 мкг/мл и культивировали моноциты периферической крови.
К ней добавляли rhM-CSF в конечной концентрации 25 нг/мл. Затем количество жизнеспособных клеток определяли на второй неделе культивирования в виде активности люциферазы с использованием набора CellTiter-Glo (Promega). В результате, все культуры с использованием GM1, GD1a, GT1b и смеси проявили одинаково сильную индуцирующую стволовые клетки активность (фиг.3). Кроме того, не наблюдали различия морфологии клеток (фиг.4; фотографии иллюстрируют клеточную морфологию на второй неделе культивирования).
Ниже на фиг.3 представлены структуры полос (величины концентрации выражены в виде конечной концентрации, далее именуемой «FC»):
1: GM1 (FC: 25 нг/мл)
2: GD1a (FC: 25 нг/мл)
3: GT1b (FC: 25 нг/мл)
4: Смесь равных количеств GM1, GD1a и GT1b (FC: 25 нг/мл (общая концентрация))
5: Только M-CSF
6: Только плазма
Величины индуцирующей стволовые клетки активности различных экстрактов растительного происхождения
Экстракты из стволов корня лотоса и ипомеи плющевидной получали в таких же условиях, как и из плодоножки указанного выше сладкого картофеля. Сравнение величин активности стандартизировали на основании величин сухой массы растений, использованных для экстракции. Удельная активность была основана на активности в отношении пролиферации клеток экстракта плодоножки сладкого картофеля, принятой за 100. Как ясно из фиг.5, аналогичные величины индуцирующей стволовые клетки активности наблюдались у экстрактов из стволов корня лотоса и ипомеи плющевидной.
Одним признаком активного ингредиента растворимого в воде экстракта растительного происхождения является экстракция главным образом в водную фазу способом экстракции по Folch. Растворимый в воде растительный экстракт может быть фракционирован, отделен или очищен пропусканием через различные колонки. Активный ингредиент характеризуется связыванием с анионообменными смолами (Q-Сефарозой, DEAE-Сефарозой и т.д.) и связывающими лектин смолами (Конкавалином A и т.д.) в широком диапазоне pH.
На фиг.6 показаны результаты оценки активности проточной фракции после нанесения экстрактов на смолы, имеющие сродство связывания с активным ингредиентом. Результаты выявили, что проточные фракции утратили активность ввиду связывания активного ингредиента с анионообменной смолой и Con A агарозой. Результаты также свидетельствуют о том, что ингибитор удалялся посредством катионообменной смолы, таким образом, повышая активность.
Расчет был основан на активности экстракта плодоножки сладкого картофеля, принятой за 100. Повышенная активность в проточной фракции в катионообменной смоле указывает на удаление ингибитора. Проточные фракции анионообменной смолы и связывающей лектин Con A смолы утратили активность, свидетельствуя об удерживании активного фактора.
Пример 2
Заживляющий эффект на экспериментальной модели с введением стволовых клеток (пример терапевтического испытания с использованием мышиной модели цирроза печени)
Тетрахлорид углерода (1 мл/кг (массы тела)) вводили лабораторным мышам дважды в неделю в течение 12 последовательных недель для искусственной индукции цирроза печени. Человеческие дедифференцированные стволовые клетки моноцитарного происхождения (hMDDSC) по настоящему изобретению вводили дважды мышам с моделью цирроза печени через хвостовую вену (второе введение проводили через одну неделю после первого введения; 1×105 клеток на индивида). Через одну неделю после второго введения (через 2 недели после первого введения) у всех мышей извлекали печень и выполняли патоморфологический и биохимический анализ срезов ткани. При гепатите, вызванном тетрахлоридом углерода, сообщают о высокой экспрессии SDF1 (фактора-1, происходящего из стромальных клеток) в воспаленной области, как при вирусном гепатите (Jung et al., 2006). Поскольку hMDDSC по настоящему изобретению проявляет высокую экспрессию CXCR4, который является рецептором для SDF1, ожидается, что hMDDSC накапливается в воспаленной области посредством связи между hMDDSC и CXCR4 для оказания заживляющего эффекта на окружающие ткани (Kollet et al., 2003; Nervi et al., 2006).
В отношении функции печени, выявляемой маркерами крови, величины GOT (глутамат-оксалацетат трансаминазы) и GPT (глутамат-пируват трансаминазы) сразу снижались и возвращались к нормальным уровням после завершения введения тетрахлорида углерода. Соответственно, эти величины проявили почти нормальные уровни после двухнедельного курса лечения, и не наблюдались большие различия измеряемых величин среди тестируемых групп. Однако, как показано ниже, 12-недельное медикаментозное лечение вызывало тяжелый фиброз в ткани печени, приводящий к циррозу печени. hMDDSC по настоящему изобретению оказывал выраженный эффект на снижение и удаление фиброзной ткани, разросшейся в печени.
1. Гистопатологический анализ
Залитые в парафин срезы получали из извлеченной и иммобилизованной печени мышей и выявляли коллагеновые волокна, которые представляют собой антитело против коллагена I и основной компонент фиброзной структуры (фиг.7, темно-коричневая окраска). В то же время ядро окрашивалось в синий цвет (окрашивание гематоксилином).
На верхних изображениях показаны три примера контрольной группы, в которой вводили солевой раствор, а hMDDSC не вводился, после индукции цирроза печени, а на нижних изображениях показаны три примера, в которых дважды внутривенно вводили hMDDSC. Введение hMDDSC привело к очевидному удалению толстых пучков волокон (указанных стрелками на верхних изображениях), выявленному антиколлагеновыми антителами.
Кроме того, окрашивание по Azan-Mallory выполняли на тех же срезах печени, и площадь окрашенной в синий цвет фиброзной тканевой части рассчитывали с использованием анализирующего изображение микроскопа (Keyence BZ-9000) (таблица 1).
Результаты анализа изображений фиброзных частей окрашиванием по Azan-Mallory
У группы, получавшей hMDDSC (hMDDSC), проявилась величина, более чем в 5 раз превышающая величину в нормальной контрольной группе (Нормальная), которой не вводили тетрахлорид углерода; однако уменьшение количества фиброзной ткани в группе, которой вводили hMDDSC, достигало 23%, по сравнению с таковым в группе, которой вводили физиологический солевой раствор (Солевой раствор).
2. Биохимический анализ
A) Пептид проколлагена III типа
Уровень пептида проколлагена III типа в крови измеряли в эксперименте по лечению цирроза печени с использованием алогичной мышиной модели. Пептид проколлагена III типа (PIIIP) представляет собой концевой пептид, присутствующий в предшественнике коллагена, и находится в свободной форме в крови и ткани в виде пептида после расщепления во время получения коллагена. Поэтому, PIIIP используется в качестве маркера, отражающего продукцию коллагена (Giannini et al., 2001). Кровь брали из хвостовой вены мышей сразу после эксперимента двухнедельного лечения, и уровень PIIIP в плазме измеряли способом ELISA (CUSABIO CSB-E08095) (таблица 2).
Количество пептида проколлагена III типа в крови
В контрольной группе (Солевой раствор), которой вводили физиологический солевой раствор после индукции цирроза печени, проявилась величина примерно в 5 раз выше, чем в здоровой контрольной группе (Нормальная), хотя количество проколлагена в крови указывало на резкое уменьшение вследствие введения hMDDSC; была получена величина, близкая к величине у здоровой мыши. Ввиду того, что у группы, получавшей физиологический солевой раствор, была получена высокая величина, необычно высокая продукция молекул коллагена, вероятно, продолжалась в течение длительного времени индукции цирроза печени после прекращения стимуляции тетрахлоридом углерода. Однако обнаружено, что необычно высокая продукция коллагена немедленно подавлялась введением hMDDSC, и количество проколлагена в крови снизилось почти до нормальных уровней.
B) Гидроксипролин
С целью определения общего количества волокон в ткани печени непосредственно по ткани измеряли содержание в печеночной ткани гидроксипролина, который является ингредиентом коллагена. Ткань печени, извлеченной у мыши после двухнедельного курса лечения, разрушали и гомогенизировали, и содержащийся белок разрушали обработкой гидроксидом натрия. Концентрацию гидроксипролина измеряли специфичной для гидроксипролина цветной реакцией Хлорамина-T и диметиламинобензальдегида (таблица 3, Reddy et al., 1996).
Количество гидроксипролина в ткани печени
Хотя в группе, получавшей hMDDSC (hMDDSC), еще проявлялось крайне высокая величина, которая была в 3 раза выше, чем величина в нормальной контрольной группе (Нормальная), она проявляла уменьшение, достигающее 22,6%, по сравнению с группой, которой вводили физиологический раствор (Солевой раствор). Другими словами, уменьшение фиброза печени было выявлено в группе, которой вводили hMDDSC.
После введения экстрагированной по Folch фракции водной фазы плодоножки сладкого картофеля указанным выше мышам с циррозом печени через хвостовую вену в количестве 6,6 мг/кг, заявители подтвердили уменьшение цирроза печени.
3. Заключение
Таким образом, модели лечения цирроза печени у мышей с использованием hMDDSC по настоящему изобретению отличаются тем, что продукция волокон значительно подавляется, и фиброзная ткань удаляется или ее количество уменьшается простым и кратковременным лечением (лишь двумя введениями за две недели). В результате, это лечение эффективно для быстрого облегчения течения цирроза печени и для восстановления печеночной ткани до нормального состояния. Таким образом, данное лечение является инновационной терапевтической системой, которая содействует регенерации печеночной ткани.
4. Ссылки
Jung YJ, Ryu KH, Cho SJ, Woo SY, Seoh JY, Chun CH, Yoo K, Moon IH, and Han HS. “Syngenic bone marrow cells restore hepatic function in carbon tetrachloride-induced mouse liver injury”, Stem Cells Dev., 2006, 15, 687-695.
Kollet O, Shivtiel S, Chen YQ, Suriawinata J, Thung SN, Dabeva MD, Kahn J, Spiegel A, Dar A, Samira S, Goichberg P, Kalinkovich A, Arenzana-Seisdedos F, NaglerA, Hardan I, Revel M, Shafritz DA, Lapidot T. “HGF, SDF-1, and MMP-9 are involved in stress-induced human CD34+ stem cell recruitment to the liver”, J Clin Invest. 2003, 112, 160-169.
Nervi B, Link DC, DiPersio JF. “Cytokines and hematopoietic stem cell mobilization. J Cell Biochem”, 2006, 99, 690-705.
Giannini E, Caglieris S, Ceppa P, Risso D, Lantieri PB, Testa R. “Serum pro-collagen III peptide levels are related to lobular necrosis in untreated patients with chronic hepatitis C”, Eur J Gastroenterol Hepatol. 2001, 13, 137-141.
Reddy GK, Enwemeka CS. “A simplified method for the analysis of hydroxyproline in biological tissues”, Clin Biochem. 1996, 29, 225-229.









Изобретение относится к области биотехнологии. Предложены стволовые клетки, полученные культивированием моноцитов человека в присутствии (i) M-CSF с концентрацией от 5 до 100 нг/мл и (ii) по меньшей мере одного представителя, выбранного из группы, состоящей из ганглиозида с концентрацией от 1 до 100 мкг/мл и растворимого в воде растительного экстракта, экстрагированного методом экстракции Folch, с концентрацией от 0,1 до 100 мкг/мл, посредством этого дедифференцируя моноциты, где экспрессия гена CSCR4 указанных стволовых клеток более чем в три или четыре раза больше по сравнению с экспрессией стволовыми клетками, полученными путем культивирования моноцитов человека в присутствии M-CSF и IL-3, и экспрессия гена CSCR4 указанных стволовых клеток более чем в два или три раза больше по сравнению с экспрессией мезенхимальными стволовыми клетками, полученными из костного мозга, для лечения заболеваний, связанных с клеточными повреждениями, повреждениями тканей или органов. 4 н. и 11 з.п. ф-лы, 7 ил., 3 табл., 2 пр.
1. Стволовые клетки, полученные культивированием моноцитов человека в присутствии (i) M-CSF с концентрацией от 5 до 100 нг/мл и (ii) по меньшей мере одного представителя, выбранного из группы, состоящей из ганглиозида с концентрацией от 1 до 100 мкг/мл и растворимого в воде растительного экстракта, экстрагированного методом экстракции Folch, с концентрацией от 0,1 до 100 мкг/мл, посредством этого дедифференцируя моноциты, где экспрессия гена CSCR4 указанных стволовых клеток более чем в три или четыре раза больше по сравнению с экспрессией стволовыми клетками, полученными путем культивирования моноцитов человека в присутствии M-CSF и IL-3, и экспрессия гена CSCR4 указанных стволовых клеток более чем в два или три раза больше по сравнению с экспрессией мезенхимальными стволовыми клетками, полученными из костного мозга,
где растительный экстракт получен по меньшей мере из одного растения, выбранного из группы, состоящей из сладкого картофеля Ipomea Batatas, ипомеи, болотной ипомеи, ипомеи плющевидной, ипомеи острозубчатой, кардинала вьющегося, синей ипомеи, Ipomoea congesta и Convolvulaceaes; Nelumbo nucifera (корень лотоса), Nelumbo lutea и лотосов; Solanum americanum, Solanum lycopersicum, Solanum mammosum, Solanum melongena, Solanum nigrum, Solanum tuberosum, Capsicum annuum, Capsicum frutescens, Datura metel, Datura meteloides, Datura stramonium, Brugmansia arborea, Brugmansia suaveolens, Physalis alkekengi var. franchetii, P. japonicum, Petunia x hybrida и Solanaceouses,
где стволовые клетки предназначены для лечения заболеваний, связанных с клеточными повреждениями, повреждениями тканей или органов.
2. Стволовые клетки по п. 1, где активный ингредиент растворимого в воде растительного экстракта представляет собой сахар или содержащий сахар комплекс, причем активный ингредиент дедифференцирует моноциты.
3. Стволовые клетки по п. 1, где активный ингредиент растворимого в воде растительного экстракта имеет молекулярную массу от 1000 до 500000, причем активный ингредиент дедифференцирует моноциты.
4. Стволовые клетки по п. 1, где активный ингредиент растворимого в воде растительного экстракта адсорбирован на колонке Con А, причем активный ингредиент дедифференцирует моноциты.
5. Стволовые клетки по п. 1, где активный ингредиент растворимого в воде растительного экстракта адсорбирован на анионообменной смоле, причем активный ингредиент дедифференцирует моноциты.
6. Стволовые клетки по п. 1, где активный ингредиент растворимого в воде растительного экстракта представляет собой фракцию водной фазы растительного происхождения, экстрагированную методом Folch, или ее очищенный продукт.
7. Стволовые клетки по п. 1, где моноциты представляют собой моноциты человека.
8. Стволовые клетки по любому из пп. 1-7, где экспрессирован по меньшей мере один представитель недифференцированных маркеров Nanog, Nestin, c-Kit, CD9 и Oct3/4, и экспрессия гена CXCR4 является значимой по сравнению со стволовыми клетками, полученными культивированием моноцитов в присутствии только М-CSF.
9. Способ получения стволовых клеток, включающий культивирование моноцитов человека в присутствии (i) M-CSF с концентрацией от 5 до 100 нг/мл и (ii) по меньшей мере одного представителя, выбранного из группы, состоящей из ганглиозида с концентрацией от 1 до 100 мкг/мл и растворимого в воде растительного экстракта, экстрагированного методом экстракции Folch, с концентрацией от 0,1 до 100 мкг/мл,
где растительный экстракт получен по меньшей мере из одного растения, выбранного из группы, состоящей из сладкого картофеля Ipomea Batatas, ипомеи, болотной ипомеи, ипомеи плющевидной, ипомеи острозубчатой, кардинала вьющегося, синей ипомеи, Ipomoea congesta и Convolvulaceaes; Nelumbo nucifera (корень лотоса), Nelumbo lutea и лотосов; Solanum americanum, Solanum lycopersicum, Solanum mammosum, Solanum melongena, Solanum nigrum, Solanum tuberosum, Capsicum annuum, Capsicum frutescens, Datura metel, Datura meteloides, Datura stramonium, Brugmansia arborea, Brugmansia suaveolens, Physalis alkekengi var. franchetii, P. japonicum, Petunia x hybrida и Solanaceouses.
10. Способ по п. 9, где культивирование выполняется в течение от 7 до 14 дней.
11. Фармацевтическая композиция для лечения заболеваний, связанных с клеточными повреждениями, повреждениями тканей или органов, содержащая стволовые клетки по любому из пп. 1-8 в качестве активного ингредиента.
12. Набор клеточного лекарственного средства для лечения заболеваний, связанных с клеточными повреждениями, повреждениями тканей или органов, содержащий в качестве существенного ингредиента, по меньшей мере, стволовые клетки по любому из пп. 1-8 и (i) M-CSF с концентрацией от 5 до 100 нг/мл и (ii) ганглиозид с концентрацией от 1 до 100 мкг/мл или водорастворимый растительный экстракт с концентрацией от 0,1 до 100 мкг/мл,
где растительный экстракт получен по меньшей мере из одного растения, выбранного из группы, состоящей из сладкого картофеля Ipomea Batatas, ипомеи, болотной ипомеи, ипомеи плющевидной, ипомеи острозубчатой, кардинала вьющегося, синей ипомеи, Ipomoea congesta и Convolvulaceaes; Nelumbo nucifera (корень лотоса), Nelumbo lutea и лотосов; Solanum americanum, Solanum lycopersicum, Solanum mammosum, Solanum melongena, Solanum nigrum, Solanum tuberosum, Capsicum annuum, Capsicum frutescens, Datura metel, Datura meteloides, Datura stramonium, Brugmansia arborea, Brugmansia suaveolens, Physalis alkekengi var. franchetii, P. japonicum, Petunia x hybrida и Solanaceouses.
13. Стволовые клетки по любому из пп. 1-8, где ганглиозидом является по меньшей мере один представитель, выбранный из группы, состоящей из GD1a, GD1b, GD2, GD3, GM1, GM2, GM3, GT1b и GQ1b.
14. Способ получения стволовых клеток по п. 9, где ганглиозидом является по меньшей мере один представитель, выбранный из группы, состоящей из GD1a, GD1b, GD2, GD3, GM1, GM2, GM3, GT1b и GQ1b.
15. Набор клеточного лекарственного средства по п. 12, где ганглиозидом является по меньшей мере один представитель, выбранный из группы, состоящей из GD1a, GD1b, GD2, GD3, GM1, GM2, GM3, GT1b и GQ1b.
| US 20040101962 A1, 27.05.2004 | |||
| ГЕНЕТИЧЕСКИ ИЗМЕНЕННЫЕ КЛЕТКИ И ИХ ПРИМЕНЕНИЕ ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ | 1998 |
|
RU2205029C2 |
| US 20030157113 A1, 21.08.2003 | |||
| САМОУСИЛИВАЮЩИЕСЯ ФАРМАКОЛОГИЧЕСКИ КОНТРОЛИРУЕМЫЕ ЭКСПРЕССИОННЫЕ СИСТЕМЫ | 1997 |
|
RU2197993C2 |
Авторы
Даты
2016-01-27—Публикация
2009-11-19—Подача